Данное изобретение относится к способу кристаллизации производного тетрагидропиридина, к новым кристаллическим формам, полученным данным способом, и к фармацевтической композиции, содержащей указанное производное тетрагидропиридина в данной кристаллической форме в качестве активного ингредиента.
Данное изобретение более конкретно относится к способу кристаллизации гидрохлорида 1-[2-(2-нафтил)этил] -4-(3-трифтор-метилфенил)-1,2,3,6-тетрагидропиридина, к трем кристаллическим формам данного продукта, к определенной смеси двух из трех данных форм и к фармацевтической композиции, содержащей одну из указанных форм или смесь двух из данных форм.
1-[2-(2-Нафтил)этил] -4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридин, далее обозначенный под кодовым номером SR 57746 и его фармацевтически приемлемые соли впервые были описаны в ЕР 0101381 как анорексигенные агенты и впоследствии как антианксиодепрессанты (US 5026716), антиконстипационные агенты (US 5109005), нейротропные агенты (US 5270320), ингибиторы свободных радикалов (US 5292745) и кардиопротекторы (US 5378709).
В ЕР 0101381 описан SR 57746 в виде гидрохлорида, далее обозначенного как SR 57746 А, и эту соль использовали в преклинических и клинических испытаниях на здоровых добровольцах. Согласно указанному документу SR 57746 А выделяли кристаллизацией из этанола, особенно из абсолютного этанола.
В преклинических испытаниях, особенно в фармакологических и токсикологических тестах на животных, SR 57746 А продемонстрировал стабильную активность и поведение. Таким же образом, фармакокинетические исследования на животных дали стабильные и воспроизводимые результаты.
Для сопоставления, в клинических исследованиях, проводимых на здоровых добровольцах (фаза I), обнаружено, что SR 57746 А демонстрировал высокую изменчивость концентрации в плазме и фармакодинамического действия активного ингредиента.
В первых клинических испытаниях, проводимых на пациентах, страдающих очень серьезными заболеваниями, особенно боковым амиотрофическим склерозом, дозу SR 57746 А поддерживали на очень низком уровне, а именно 2 мг/день, в этой дозе данный продукт оказался перспективным (W.G.Bradley, доклад, озаглавленный "New drugs for amyotrophic lateral sclerosis", материалы встречи Американской академии неврологии, 23-30 марта, 1996, страницы 240-23/240-28).
Более того, было обнаружено, что при получении больших количеств SR 57746 А по методике выделения, описанной в ЕР 0101381, невозможно достичь хорошего выхода продукта с постоянными характеристиками, которые делают возможным преодоление недостатков, отмеченных в фазе I клинических исследований.
Более конкретно, было обнаружено, что по методике выделения, описанной в ЕР 0101381, получают SR 57746 А, состоящий из кристаллов, размер которых непостоянен и определенно больше, чем 150 микрометров; более конкретно по крайней мере около 75% кристаллов имеют размер 150-600 микрометров.
Более того, обнаружено, что SR 57746 А, полученный по методике, описанной вЕР 0101381, состоит, как показывает дифференциальная сканирующая калориметрия, из, по крайней мере, 3 различных форм.
В конце концов было обнаружено, что соответствующие соотношения различных форм не постоянны для различных партий SR 57746 А, что затрудняет контроль характеристик исходного материала для получения фармацевтических композиций.
В настоящее время обнаружено, что при проведении кристаллизации SR 57746 А при подходящих и постоянных условиях, которые подразумевают растворитель, скорость смешивания и скорость охлаждения, имеется возможность выделения соединения в трех различных кристаллических формах или в виде смеси двух из этих трех форм с неизменными и воспроизводимыми соотношениями.
Более конкретно, было обнаружено, что
- форму I SR 57746 А получают охлаждением раствора SR 57746 А в смеси этанол/концентрированная хлористоводородная кислота без перемешивания;
- форму II SR 57746 А получают охлаждением раствора SR 57746 А в абсолютном этаноле или в смеси этилацетат/вода при контролируемой скорости охлаждения и скорости перемешивания;
- форму III SR 57746 А получают охлаждением раствора SR 57746 А в диметилсульфоксиде; и
- смесь формы I и формы III, имеющую фиксированный и воспроизводимый состав, получают охлаждением раствора SR 57746 А в смеси этанол/вода.
Также было обнаружено, что эти новые кристаллические формы, как в чистом виде, так и в смесях с фиксированным соотношением двух из указанных форм, абсорбируются одинаково и воспроизводимо и облегчают определение оптимальной дозы активного ингредиента. Даже больше, чем улучшение фармакокинетических и фармакодинамических свойств, возможность контролировать производство композиции SR 57746 А в кристаллической форме является крайне выгодной с точки зрения маркетинга.
Окончательно было обнаружено, что если новые кристаллические формы или смеси двух указанных форм содержат очень мелкие кристаллы, особенно микронизированные кристаллы, активность активного ингредиента значительно повышается и его абсорбция становится одинаковой и постоянной, что дает возможность вводить небольшие дозы при очень хорошем терапевтическим ответе реакции и, в то же время, полного контроля потенциальных побочных эффектов.
На чертежах показаны термограммы, полученные при дифференциальной сканирующей калориметрии формы I, формы II, формы III и смеси форма I/форма III в соотношении 65,7/34,3.
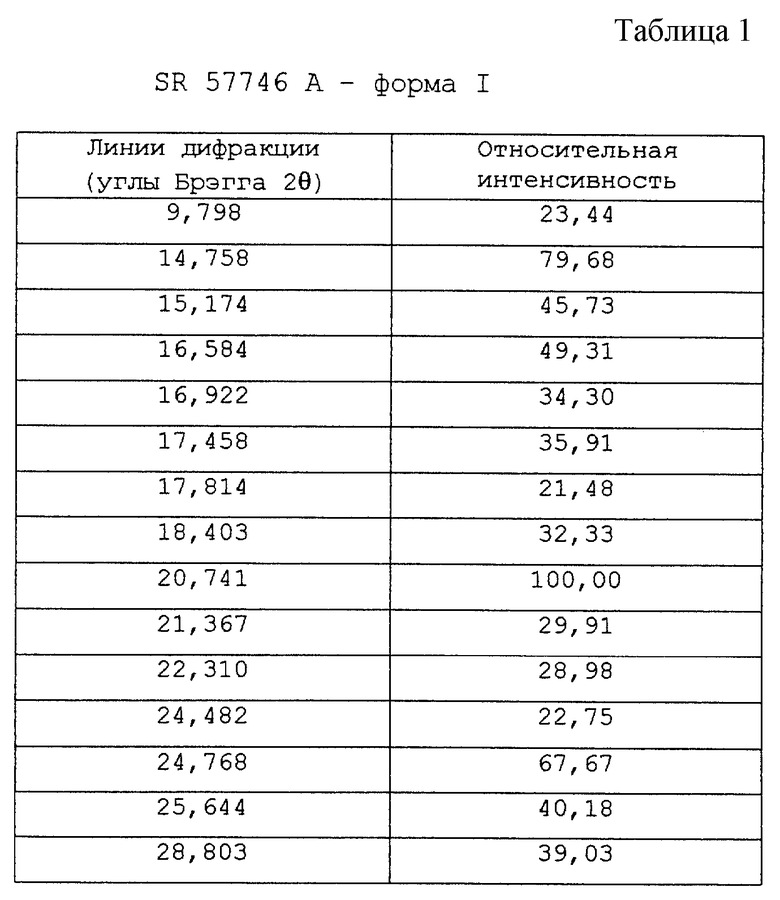
На фиг.1 показана термограмма формы I SR 57746 А, полученной по методике примера 1, указанная термограмма получена при помощи дифференциальной сканирующей калориметрии при температуре от 50oС до 180oС. На данной термограмме значение температуры перехода твердое-твердое составляет 148-149oС.
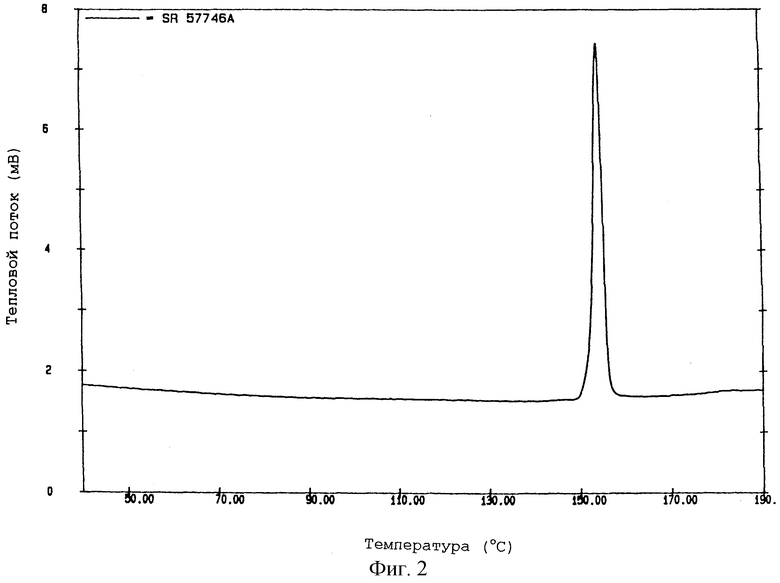
На фиг.2 показана термограмма формы II SR 57746 А, полученной по методике примера 2, указанная термограмма получена при помощи дифференциальной сканирующей калориметрии при температуре от 50oС до 180oС. На данной термограмме значение температуры перехода твердое-твердое составляет 153-155oС.
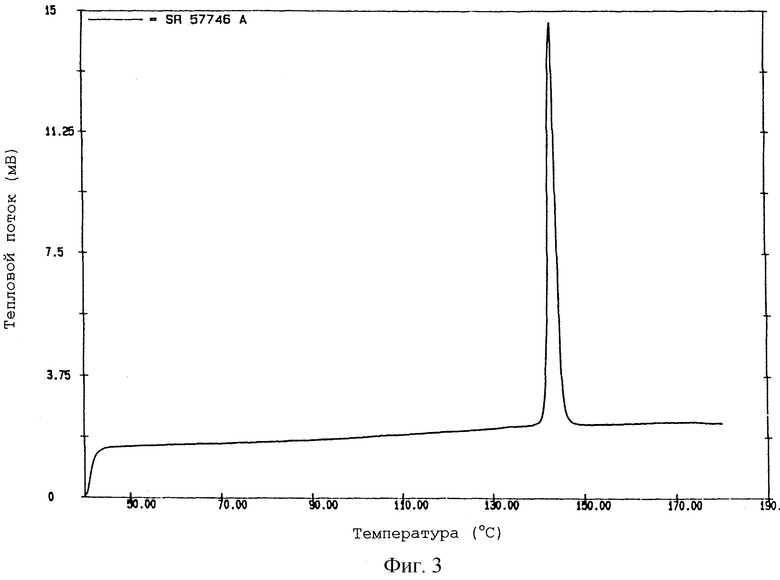
На фиг. 3 показана термограмма формы III SR 57746 А, полученной по методике примера 3, указанная термограмма получена при помощи дифференциальной сканирующей калориметрии при температуре от 50oС до 180oС. На данной термограмме значение температуры перехода твердое-твердое составляет 141-142oС.
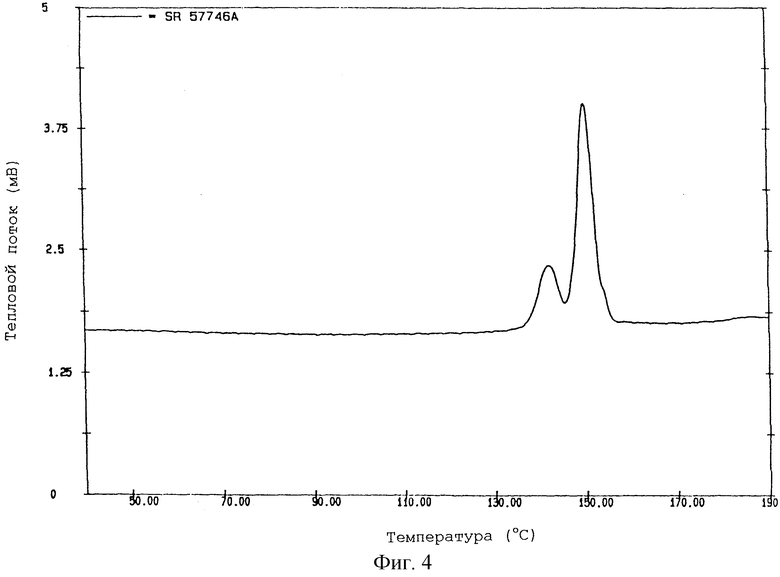
На фиг. 4 показана термограмма смеси форма I/форма III, полученной по методике примера 4, указанная термограмма получена при помощи дифференциальной сканирующей калориметрии при температуре от 50oС до 180oС. На данной термограмме показаны значения температур перехода твердое-твердое двух форм.
Таким образом, согласно одному из аспектов данное изобретение относится к способу кристаллизации гидрохлорида 1-[2-(2-нафтил)этил]-4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина, отличающемуся тем, что
(a) указанное соединение растворяют нагреванием в растворителе, выбранном из алканолов, имеющих от 1 до 3 атомов углерода, кетонов, имеющих от 3 до 6 атомов углерода, диметилсульфоксида и этилацетата, где указанный растворитель необязательно содержит от 5 до 30 об.% воды или водной соляной кислоты;
(b) полученный раствор охлаждают до температуры -10/+10oС со скоростью от 3 до 100oС/час, при перемешивании от 0 до 600 об/мин; и
(c) полученный продукт выделяют и необязательно микронизируют.
Процесс по данному изобретению проводят по обычной методике кристаллизации, однако тип растворителя, скорость охлаждения, присутствие или отсутствие воды и скорость перемешивания являются существенными параметрами для воспроизводимого получения той или иной кристаллической формы или для воспроизводимого получения смеси двух форм с неизменными пропорциями.
На стадии (а) гидрохлорид 1-[2-(2-нафтил)этил] -4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина, например неочищенный продукт, полученный способом, описанным в ЕР 0101381, нагревают, предпочтительно с обратным холодильником, в выбранном растворителе необязательно в присутствии воды.
Вода может использоваться для полного растворения SR 57746 А. Хотя в метаноле и этаноле, например, продукт растворяется полностью до приемлемой концентрации (например, 15-150 г/л), в ацетоне, метилэтилкетоне, изопропаноле или этилацетате при тех же концентрациях продукт полностью не растворяется. В эти растворители достаточно добавить от 5 до 30% воды для практически полного растворения при температуре кипения с обратным холодильником. Однако процент содержания воды не должен быть слишком высоким для избежания избыточной растворимости и потери конечного продукта.
По одной из подходящих методик используют растворитель, выбранный из следующих смесей (об/об): от 100/0 до 70/30 метанол/вода, от 100/0 до 70/30 этанол/вода, от 95/5 до 70/30 ацетон/вода, от 95/5 до 80/20 метилэтилкетон/вода и от 95/5 до 70/30 этилацетат/вода, и диметилсульфоксид.
Как отмечено выше, концентрация SR 57746 А в выбранном растворителе зависит от его растворимости. Она может варьироваться от 15-100 г/л для смесей этилацетат/вода до 150-300 г/л для этанола и смесей этанол/вода.
SR 57746 А преимущественно растворяют до концентрации 5-150 г/л, предпочтительно 100-150 г/л в этаноле, смеси приблизительно 90/10 этанол/вода или метаноле, до концентрации около 60 г/л в смеси приблизительно 90/10 ацетон/вода, до концентрации 100-125 г/л в смеси приблизительно 95/15 метил-этилкетон/вода или до концентрации около 15 г/л в смеси приблизительно 90/10 этилацетат/вода. Растворимость в растворителе при кипячении с обратным холодильником полностью соответствует этим данным.
На стадии (b) полученный раствор охлаждают необязательно при перемешивании; скорость охлаждения контролируют и, если используют мешалку, контролируют скорость перемешивания, так как получение конкретной кристаллической формы в значительной степени зависит от этих двух параметров.
Если кристаллизацию проводят при перемешивании, предпочтительно использовать лопастную мешалку (также обозначенную здесь как крыльчатая мешалка), которая способствует вращению всех жидкостей, причем диаметр вращения данной мешалки составляет от 4/5 до 2/5 от диаметра используемого реактора.
Скорость охлаждения регулируют градиентом температуры, который варьируется от 100 до 3oС в час.
Получение конкретной кристаллической формы, а также смеси двух форм в фиксированных пропорциях зависит одновременно от двух параметров, указанных выше, в данном растворителе, и понятно, что скорость перемешивания обычно изменяется как прямая функция скорости охлаждения.
На стадии (с) кристаллизованный продукт выделяют согласно обычным методикам и необязательно микронизируют.
Выделение продукта может быть достигнуто, например, сушкой полученного соединения; доказано, что стадия сушки, проводимая в печи или в сушилке с перемешиванием, не изменяет кристаллическую структуру, полученную в результате кристаллизации.
В зависимости от выбора подходящих условий для стадий (а) и (b) на стадии (с) могут быть выделены четыре различных вида SR 57746 А, а именно форма I, форма II, форма III и смесь форм I/Ill, причем возможно определение основных характеристик указанных видов при помощи дифференциальной сканирующей калориметрии (ДСК); из термограмм, полученных на калориметре PERKIN-ELMER, при хорошо известных условиях определяют
- температуру перехода твердое-твердое;
- энтальпию, связанную с этим переходом.
Дифференциальную сканирующую калориметрию проводят с использованием аппарата PERKIN-ELMER DSC7, который калибруют относительно эндотерм плавления индия или свинца и циклогексана. Этот анализ проводят, используя от 3 до 6 мг продукта в алюминиевой чашке с гофрированной и проколотой крышкой, при температуре от 50 до 180oС, со скоростью нагревания 10oС/минуту, используя азот в качестве газа для промывания.
Температура перехода твердое-твердое и энтальпия перехода являются основными характеристиками, которые сами по себе являются достаточными для определения каждой кристаллической формы или смесей двух из указанных форм.
Указанные формы могут быть охарактеризованы рентгеновской порошковой дифрактометрией. Картину порошковой дифракции рентгеновских лучей (брэгговская дифракция 20 θ) получают, используя дифрактометр SIEMENS 500 ТТ с генератором на 40 кВ, задним монохроматором, Сu k•1 источником и силиконовым держателем, при сканировании от 4o до 40o со скоростью 1o в минуту.
По одной из предпочтительных методик стадию (а) проводят кипячением с обратным холодильником SR 57746 А в смеси от 95/5 до 70/30 этанол/соляная кислота до завершения растворения и стадию (b) проводят охлаждением полученного раствора до температуры около 4oС при температурном градиенте от 3 до 100oС в час, без перемешивания. Выделенная на стадии (с) этой предпочтительной методики кристаллическая форма SR 57746 А называется "форма I" и имеет следующие характеристики:
- температура перехода твердое-твердое 148,4±1,6oС; и
- энтальпия перехода 26,4±1,1 Дж/г.
Форма I SR 57746 А, имеющая указанные выше характеристики, является дополнительным аспектом данного изобретения.
Эта новая кристаллическая форма также была проанализирована с помощью рентгеновской порошковой дифракции. При количественном изучении образцов дифракции установлено, что форма I имеет характерные линии (2 θ) при
- 9,9±0,3o
- 14,8±0,3o
- 20,8±0,3o (интенсивность 100).
Форму I также получают, если раствор на стадии (b) охлаждают выстаиванием в течение 8-15 часов при температуре 0-5oС, также без перемешивания.
Согласно другой предпочтительной методике стадию (а) проводят кипячением с обратным холодильником в абсолютном этаноле или смеси от 95/5 до 75/15 этилацетат/вода до завершения растворения, причем SR 57746 А присутствует в данном растворе в концентрации 10-80 г/л, предпочтительно 70 г/л, в смеси этилацетат/вода или в концентрации 5-150 г/л в абсолютном этаноле.
Согласно данной предпочтительной методике стадию (b) проводят охлаждением раствора от температуры кипячения с обратным холодильником до температуры 5oС при градиенте температуры от 100 до 30oС в час и скорости перемешивания от 100 до 600 об/минуту.
Другая кристаллическая форма, выделенная на стадии (с), называется в данном описании "форма II" и имеет следующие характеристики:
- температура перехода твердое-твердое 153,9±1,1oС;
- энтальпия перехода 24,1±1,0 Дж/г.
Форма II SR 57746 А, имеющая указанные выше характеристики, составляет дополнительный аспект данного изобретения.
Эта новая кристаллическая форма также была проанализирована при помощи рентгеновской порошковой дифракции. При количественном изучении образцов дифракции установлено, что форма II имеет характерные линии (2 θ) при
- 14,5±0,3o (интенсивность: 100)
- 19,3±0,3o
- 20,4±0,3o.
Согласно другой предпочтительной методике стадию (а) проводят кипячением с обратным холодильником SR 57746 А в диметилсульфоксиде до полного растворения, и стадию (b) проводят охлаждением полученного раствора при температурном градиенте от 3 до 100oС в час и со скоростью перемешивания от 0 до 600 об/минуту.
Другая кристаллическая форма, выделенная на стадии (с), называется в данном описании "форма III" и имеет следующие характеристики:
- температура перехода твердое-твердое 141±2oС;
- энтальпия перехода 17,6±0,5 Дж/г.
Форма III SR 57746 А, имеющая указанные выше характеристики, составляет дополнительный аспект данного изобретения.
Согласно особенно предпочтительной методике стадию (а) проводят нагреванием SR 57746 А в смеси от 95/5 до 70/30, предпочтительно от 90/10 до 85/15 этанол/вода до полного растворения и стадию (b) проводят охлаждением раствора при температурном градиенте от 5 до 30oС в час, преимущественно до 5oС при температурном градиенте от 10 до 20oС в час, предпочтительно 10oС в час, и со скоростью перемешивания от 0 до 600 об/минуту, преимущественно от 200 до 400 об/минуту и предпочтительно 400 об/минуту.
Неожиданно было обнаружено, что смесь форма I/форма III в весовом соотношении от 80/20 до 60/40, преимущественно от 70/30 до 65/35 и предпочтительно около 66/34, как было показано дифференциальной сканирующей калориметрией, воспроизводимым образом выделяют на стадии (с).
Эта смесь состоит из частиц диаметром ниже 150 микрометров.
Формы I, II и III SR 57746 А и смесь форм I и III могут быть микронизированы с получением фармацевтически активного ингредиента с размером частиц меньше 50 микрометров, преимущественно меньше 30 микрометров и предпочтительно для по крайней мере 80% частиц меньше 10 микрометров.
Микронизацию проводят на обычном оборудовании для получения микрокристаллов с размером менее 50 микрометров, например на микронизере ALPINE 200 AS, помещая SR 57746 А в камеру микронизации (диаметр 200 мм) со скоростью от 15 до 50 кг/час и рабочем давлении от 1 до 6,5 бар и собирая продукт в рукавный фильтр.
Микронизированные кристаллические формы I, II и III SR 57746 А и микронизированные смеси форм I и III в соотношениях от 80/20 до 60/40, преимущественно от 70/30 до 65/35 и предпочтительно около 66/34, являются преимущественным аспектом данного изобретения.
Наличие определенных ранее форм SR 57746 А или фиксированной смеси форма I/форма III делает возможным получение фармацевтических композиций, которые имеют постоянную и воспроизводимую композицию.
Более того, получение продукта, имеющего мелкие частицы, например микронизацией, делает возможным для постоянной активности значительно понижать эффективные дозы с получением такого же терапевтического результата.
Более конкретно было показано, что микрокристаллическая форма не только делает возможным снижение дозированного количества активного ингредиента, имеющегося в фармацевтической композиции, но также, в частности, делает возможным достижение равномерной пероральной абсорбции и, таким образом, получение постоянного терапевтического ответа у каждого пациента, независимо от того, вводится ли препарат на пустой желудок пли после еды.
Исследования, относящиеся к определению in vitro абсорбции SR 57746 А в виде микронизированной смеси форм I/Ill проводили с использованием однослойной модели САСО-2. Этот тест, который широко используется в качестве прогнозной модели кишечной эпителиальной абсорбции лекарственного средства (P. Artusson, Crit.Rev.Ther.Drug, 1991, 8: 305-330), дает возможность продемонстрировать значительные различия в сроках растворения и проницаемости между SR 57746 А в виде микронизированной смеси форм I/III и SR 57746 А, полученным согласно ЕР 0101381.
Результаты показали, что в используемой среде (раствор Ханка с добавлением 10% фетальной телячьей сыворотки и таурохолевой кислоты) скорости растворения и степени проницаемости значительно различаются для SR 57746 А в виде микронизированной смеси форм I/III и для SR 57746 А, полученного по методике ЕР 0101381. Более конкретно, было продемонстрировано, что растворение и проницаемость нормализуются, то есть становятся равномерными после микронизации.
Таким образом, согласно другому аспекту данное изобретение относится к фармацевтической композиции, содержащей в качестве активного ингредиента 1-[2-(2-нафтил)этил] -4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина гидрохлорид в необязательно микронизированной кристаллической форме, выбранной из формы I, формы II и формы III, определенных выше, и смесей формы I/формы III в соотношениях от 80/20 до 60/40, преимущественно от 70/30 до 65/35 и предпочтительно около 66/34.
Кристаллические формы данного изобретения могут удобно вводиться перорально, парентерально, подъязычно или чрескожно. Количество вводимого активного ингредиента зависит от природы и тяжести состояния, подлежащего лечению, и от веса пациента. Тем не менее количество активного ингредиента, имеющееся в стандартной дозированной форме, может изменяться от 10 мг (рассчитано для свободного основания) для немикронизированного продукта и может составлять от 0,1 до 5 мг, преимущественно от 0,5 до 3 мг и предпочтительно 2 мг (рассчитано для свободного основания) для микронизированного продукта. Предпочтительные стандартные дозы обычно составляют 0,5; 1; 1,5; 2; 2,5 или 3 мг (рассчитано для свободного основания) микронизированного продукта.
Эти стандартные дозы обычно вводят один или более раз в день, например один или два раза в день, причем общая доза для человека варьируется от 0,5 до 20 мг в день, преимущественно от 1 до 10 мг в день (рассчитано для свободного основания) для немикронизированного продукта, и от 0,2 до 10 мг в день, преимущественно от 1 до 6 мг в день (рассчитано для свободного основания) для микронизированного продукта.
В стандартных дозированных формах фармацевтических композиций данного изобретения активный ингредиент вводят животным и человеку, предпочтительно в смеси с обычными фармацевтическими носителями, для лечения заболеваний, указанных в патентах US 5026716, US 5109005, US 5270320, US 5292745 и US 5378709, и, в частности, для лечения заболеваний нервной системы, особенно для лечения нейродегенарции,
Подходящие стандартные дозированные формы для введения включают формы для перорального введения, такие как таблетки, которые могут быть разделяемыми, желатиновые капсулы, порошки и гранулы и формы для подъязычного и трансбуккального введения, новые кристаллические формы также могут быть использованы для получения форм для чрескожного введения.
При получении твердой композиции в виде таблеток активное соединение смешивают с фармацевтическим носителем, таким как желатин, крахмал, лактоза, стеарат магния, тальк, аравийская камедь и так далее. Таблетки могут быть покрыты сахарозой или другими подходящими веществами, кроме того они могут быть обработаны таким образом, чтобы иметь пролонгированное или замедленное действие и, таким образом, непрерывно высвобождать определенное количество активного ингредиента.
Препаративная форма в виде желатиновых капсул может быть получена смешиванием активного ингредиента с разбавителем и заполнением полученной смесью мягких или твердых желатиновых капсул.
Активный ингредиент может также быть введен в микрокапсулы, необязательно с одним или более носителями и добавками.
В фармацевтических композициях данного изобретения активный ингредиент также может быть в виде комплекса включения в циклодекстрины, их простые и сложные эфиры.
Следующие примеры иллюстрируют данное изобретение.
ПРИМЕР 1.
Смесь 19,5 г неочищенного гидрохлорида 1-[2-(2-нафтил)-этил)-4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина, 95 мл абсолютного этанола и 4,65 мл 37% соляной кислоты кипятят с обратным холодильником при перемешивании до завершения растворения и затем дают смеси охладиться, продолжая перемешивание. Когда начинают образовываться первые кристаллы (при температуре около 63oС) мешалку останавливают и реакционную смесь оставляют при температуре 0-5oС в течение ночи. После фильтрации продукт дважды доводят до пастообразного состояния в 30 мл абсолютного этанола и затем сушат в течение ночи при температуре 40oС в вакууме.
В этих условиях получают 12,8 г гидрохлорида 1-[2-(2-нафтил)этил]-4-(3-трифторметилфенил)-1,2,3,6-тетрагидропири-дина (SR 57746 А - форма I).
По данным дифференциальной сканирующей калориметрии SR 57746 А - форма I, полученная в данном примере, имеет следующие характеристики:
- температура перехода твердое-твердое 148-149oС; и
- энтальпия перехода 26,4 Дж/г.
Соответствующая термограмма показана на фиг.1.
По данным анализа рентгеновской порошковой дифракции, проведенной при помощи дифрактометра SIEMENS 500 ТТ в приведенных выше условиях, SR 57746 А - форма I, полученная в этом примере, имеет характерные линии (брэгговская дифракция 2 θ) при 9,8o, 14,7o и 20,7o (относительная интенсивность: 100).
Картина порошковой дифракции рентгеновских лучей (углы дифракции) SR 57746 А - формы I данного примера дана по значительным линиям, сопоставленным в таблице 1 вместе с относительной интенсивностью и выражена в процентном отношении к наиболее интенсивной линии.
ПРИМЕР 2.
В калориметрическом реакторе METTLER RC1, оборудованном лопастной мешалкой диаметром 8 см, смесь 70 г неочищенного гидрохлорида 1-[2-(2-нафтил)этил] -4-(3-трифторметилфенил)-1,2, 3,6-тетрагидропиридина и 1 л абсолютного этанола кипятят с обратным холодильником до полного растворения продукта. Полученный раствор охлаждают до 10oС со скоростью охлаждения 80oС в час и скоростью перемешивания 500 об/минуту. Полученный осадок фильтруют и сушат в течение ночи при температуре 45oС в вакууме.
В этих условиях получают форму II гидрохлорида 1-[2-(2-нафтил)этил]-4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина (SR 57746 А - форма II).
По данным дифференциальной сканирующей калориметрии SR 57746 А - форма II, полученная в данном примере, имеет следующие характеристики:
- температура перехода твердое-твердое 153-155oС;
- энтальпия перехода 24,1 Дж/г.
Соответствующая термограмма показана на фиг.2.
По данным анализа рентгеновской порошковой дифракции, проведенной при помощи дифрактометра SIEMENS 500 ТТ в приведенных выше условиях, SR 57746 А - форма II, полученная в этом примере, имеет характерные линии (брэгговская дифракция 2 θ) при 14,3o (относительная интенсивность: 100), 19,2o и 20,5o.
Рентгеновский порошковый профиль дифракции (углы дифракции) SR 57746 А - формы II данного примера дан по значительным линиям, сопоставленным в таблице 2 вместе с относительной интенсивностью, и выражен в процентном отношении к наиболее интенсивной линии.
ПРИМЕР 3.
Смесь 2 г неочищенного гидрохлорида 1-[2-(2-нафтил) -этил]-4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина и 50 мл диметилсульфоксида кипятят с обратным холодильником до полного растворения, полученной смеси дают охладиться до 5oC в течение ночи и кристаллический продукт затем отделяют и сушат в вакууме при температуре 45oС в течение ночи.
В этих условиях получают форму III гидрохлорида 1-[2-(2-нафтил)этил]-4-(3-трифторметилфенил)-1,2,3,6-тетрагидро-пиридина (SR 57746 А - форма III).
По данным дифференциальной сканирующей калориметрии SR 57746 А - форма III, полученная в данном примере, имеет следующие характеристики:
- температура перехода твердое-твердое 141-142oС;
- энтальпия перехода 17,6 Дж/г.
Соответствующая термограмма показана на фиг.3.
ПРИМЕР 4.
Смесь 100 г неочищенного гидрохлорида 1-[2-(2-нафтил)-этил]-4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина и 1 л смеси 90/10 этанол/вода кипятят с обратным холодильником при перемешивании до полного растворения продукта. Полученный раствор охлаждают от температуры кипячения с обратным холодильником до температуры 5oС, при лопастном перемешивании со скоростью 400 об/минуту и скоростью охлаждения 10oС/час. Полученный кристаллический продукт отфильтровывают и сушат при температуре 45oС в вакууме в течение ночи.
В этих условиях гидрохлорид 1-[2-(2-нафтил)этил]-4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина получают в виде смеси форма I/форма III в соотношении 65,7/34,3 (SR 57746 А - форма I/III).
По данным дифференциальной сканирующей калориметрии SR 57746 А - форма I/III, полученная в данном примере, имеет термограмму, показанную на фиг.4, которая показывает только два характерных пика, соответствующих формам I и III.
ПРИМЕРЫ 5 и 6.
Используют методику примера 2 и в двух различных экспериментах скорость охлаждения и скорость перемешивания изменяют следующим образом:
- охлаждение при 100oС/час и перемешивание при 600 об/минуту (пример 5);
охлаждение при 30oС/час и перемешивание при 300 об/минуту (пример 6).
В этих условиях получают SR 57746 А - форму II.
Было обнаружено, что при проведении процесса в абсолютном этаноле при концентрации 70 г/л зависимость получения формы II от скорости охлаждения и скорости перемешивания можно выразить в соответствии с линейным уравнением типа у=ах+b.
Для получения формы II в этих условиях уравнение имеет следующий вид:
Rmax=4,23•V+170,51
в котором Rmах равно скорости перемешивания, выраженной в оборотах/минуту и V равно скорости охлаждения, выраженной в oС/час. Следовательно, для получения формы II скорость перемешивания должна быть меньше или равна Rmax для данной скорости охлаждения.
ПРИМЕР 7.
Смесь 15 г неочищенного гидрохлорида 1-[2-(2-нафтил)-этил]-4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина и 1 л смеси 90/10 этилацетат/вода кипятят с обратным холодильником до полного растворения продукта при перемешивании лопастной мешалкой диаметром 8 см. Полученный раствор охлаждают до 5oС со скоростью 60oС в час и скоростью перемешивания 150 об/минуту, и полученный осадок затем отфильтровывают и сушат в вакууме с получением SR 57746 А - формы II, которая идентична продукту, полученному в примере 2.
ПРИМЕРЫ 8-11.
В четырех различных экспериментах неочищенный гидрохлорид 1-[2-(2-нафтил) этил]-4- (3-трифторметилфенил)-1,2,3,6-тетрагидропиридина в концентрации 70 г/л в смеси 92/8 этилацетат/вода (реакционный объем 1,3 л) кипятят с обратным холодильником в реакторе RC1, соединенном со счетчиком частиц PARTEC® 100 от LASENTEC и оборудованном лопастной мешалкой диаметром 8 см. После завершения растворения раствор охлаждают при следующих условиях для четырех экспериментов:
- охлаждение при 100oС/час и перемешивание при 400 об/минуту (пример 8);
- охлаждение при 80oС/час и перемешивание при 300 об/минуту (пример 9);
- охлаждение при 50oС/час и перемешивание при 200 об/минуту (пример 10);
- охлаждение при 30oС/час и перемешивание при 100 об/минуту (пример 11).
В этих условиях получают SR 57746 А - форму II.
Было обнаружено, что при проведении процесса в смеси 92/8 этилацетат/вода при концентрации 70 г/л зависимость получения формы II от скорости охлаждения и скорости перемешивания можно выразить следующим уравнением:
Rmах=4,14•V-18,9
в котором Rmах равно скорости перемешивания, выраженной в оборотах/минуту и V равно скорости охлаждения, выраженной в oС/час.
Для получения формы II скорость перемешивания должна быть меньше или равна Рmах для данной скорости охлаждения.
ПРИМЕР 12.
Неочищенный гидрохлорид 1-[2-(2-нафтил)этил]-4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина в концентрации 60,6 г/л в смеси 90/10 ацетон/вода кипятят с обратным холодильником при перемешивании до полного растворения. Затем используют методику примера 4 с получением SR 57746 А - формы I/III в соотношении 80/20.
ПРИМЕР 13.
Неочищенный гидрохлорид 1-[2-(2-нафтил)этил]-4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина при концентрации 100 г/л в метаноле кипятят с обратным холодильником при перемешивании до полного растворения. Используют методику примера 4 с получением SR 57746 А - формы I/III в соотношении 80/20, который идентичен продукту примера 12.
ПРИМЕР 14.
Неочищенный гидрохлорид 1-[2-(2-нафтил)этил]-4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина при концентрации 100 г/л в смеси 70/30 этанол/вода кипятят с обратным холодильником при перемешивании до полного растворения. Используют методику примера 4 с получением SR 57746 А - формы I/III соотношении 65,7/34,3, которая идентична продукту примера 4.
ПРИМЕР 15.
24 кг SR 57746 А - формы I/III, описанной в примере 4, помещают в камеру для микронизации (диаметр 200 мм) микронизера ALPINE 200 AS со скоростью 25 кг/час и при рабочем давлении 6,5 бар, и затем микронизированный продукт собирают в рукавном фильтре. Этот процесс дает SR 57746 А - форму I/Ill с таким распределением размера частиц, что все частицы имеют размер меньше 20 микрометров и 85% частиц имеют размер менее 10 микрометров.
Дифференциальная сканирующая калориметрия полученного микронизированного продукта показала, что температуры перехода не изменяются после микронизации. Указанный переход является переходом типа твердое-твердое. SR 57746 А разлагается до плавления, которое начинается при 250oС.
ПРИМЕР 16.
Фармацевтическая композиция, содержащая в качестве активного ингредиента SR 57746 А - форму I/III (микронизированный) согласно примеру 15, представленному выше
Активный ингредиент - 2,192 мг
Кукурузный крахмал - 141,218 мг
Безводная коллоидная двуокись кремния - 0,200 мг
Стеарат магния - 0,400 мг
Активный ингредиент просеивают через сито с ячейками 0,2 мм и затем смешивают с наполнителями. Эту смесь просеивают через сито с ячейками 0,315 мм, повторно смешивают и затем просеивают снова через сито с ячейками 0,315 мм. После окончательного смешивания композицию помещают в желатиновые капсулы 3 по 170 мг композиции, содержащей SR 57746 А - форму I/III в количестве, соответствующем 2 мг основания 1-[2-(2-нафтил)этил]-4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина.

Описывается способ кристаллизации гидрохлорида 1-[2-(2-нафтил)этил]-4-(3-трифторметилфенил)-1,2,3,6-тетрагидропиридина (SR 57746A), заключающийся в том, что а) указанное соединение растворяют при нагревании в растворителе, выбранном из алканолов, имеющих 1 - 2 атомов углерода, ацетона, диметилсульфоксида и этилацетата, причем указанный растворитель необязательно содержит 5 - 30% воды или водной хлористоводородной кислоты, б) полученный раствор охлаждают до температуры 0 - 10oС со скоростью 3 - 100oС/ч при перемешивании со скоростью 0 - 600 об/мин, с) полученный продукт выделяют и необязательно микронизируют. Описываются полученные три формы (SR 57746A): форма I, форма II, форма III и смесь формы I и III, а также фармацевтическая композиция для лечения нейродегенерации, содержащая соединение SR 57746A в необязательно микронизированной кристаллической форме, выбранной из формы I, формы II, формы III и смеси формы I/формы III. Технический результат - повышение активности активного ингредиента. 10 с. и 14 з.п. ф-лы, 4 ил., 2 табл.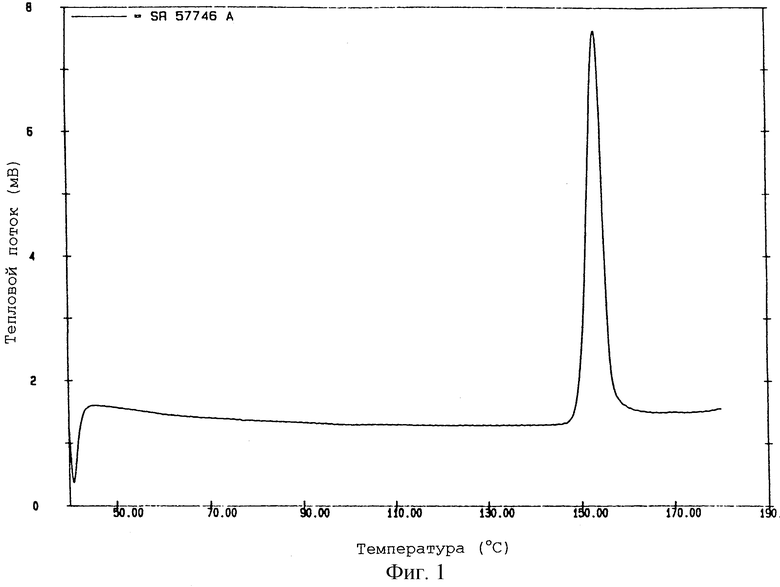
| Стабилизатор напряжения | 1952 |
|
SU101381A2 |
| Тринус Ф.П | |||
| Фармакотерапевтический справочник | |||
| - Киев: Здоровье, 1989, с.320. | |||
Авторы
Даты
2002-11-10—Публикация
1997-12-23—Подача