Изобретение относится к медицинской микробиологии и может быть использовано для селективного выделения бактерий рода Lactobacillus из клинического материала (фекалий, вагинального отделяемого).
Бактерии рода Lactobacillus широко распространены в природе, содержатся во многих пищевых продуктах (молочных, мясных, растительных), являются типичными представителями резидентной микрофлоры организма человека и животных. Известно, что бактерии рода Lactobacillus являются доминирующей флорой влагалища человека. Существует тесная взаимосвязь между состоянием микрофлоры родовых путей беременных и формированием эубиотической микрофлоры кишечника ребенка в неонатальном периоде. При возникновении ряда акушерско-гинекологических заболеваний как инфекционной, так и неинфекционной природы, формируются выраженные нарушения резидентной вагинальной микрофлоры. Бактериальный вагиноз, сопровождающийся резкими изменениями лактофлоры, в настоящее время рассматривается как дисбактериоз влагалища. В диагностике дисбактериоза кишечника и влагалища одним из критериев дисбактериоза служит содержание бактерий рода Lactobacillus. При проведении бактериотерапии дисбактериозов содержание бактерий рода Lactobacillus служит показателем нормализации микрофлоры.
В связи с тем, что перед проведением антибиотикотерапии лечащий врач должен знать, как влияет выбранный для лечения препарат на состояние индигенной лактофлоры пациента, необходимо определение чувствительности к антибиотикам индигенных бактерий рода Lactobacillus, а для этого нужен способ выделения их из клинического материала.
Кроме того, в тех случаях, когда содержание индигенных бактерий рода Lactobacillus у пациента ниже нормы (Дисбактериоз кишечника и методы его лабораторной диагностики. - Метод. рекомендации. - Хабаровск. - 1987), ему проводят заместительную бактериотерапию эубиотическими штаммами бактерий рода Lactobacillus. Однако применение эубиотических штаммов не всегда бывает эффективным. Известно, что экзогенные бактерии рода Lactobacillus не всегда приживаются в организме хозяина. Это связано с тем, что среди бактерий рода Lactobacillus широко распространен межвидовой и даже внутривидовой антагонизм, они могут оказывать повреждающее действие на индигенную микрофлору или, наоборот, аутофлора может подавлять развитие эубиотика, что снижает его лечебный эффект (Коршунов В.М., Смеянов В.В., Ефимов Б.А. Рациональные подходы к проблеме коррекции микрофлоры кишечника // Вестн. Рос. АМН,- 1996.- 2. - С. 60-65). В связи с этим необходимо до начала бактериотерапии определять биосовместимость эубиотических бактерий рода Lactobacillus с аутолактофлорой пациента, а для этого также требуется простой и доступный для осуществления в бактериологических лабораториях способ выделения бактерий рода Lactobacillus из клинического материала.
Выделение чистой культуры бактерий рода Lactobacillus из клинического материала (фекалий, вагинального отделяемого) необходимо и для получения аутоштаммов, на основе которых затем изготавливают аутопробиотик для восстановления индигенной лактофлоры конкретного пациента. Считают, что применение аутоштаммов является наиболее оптимальным способом восстановления индигенной микрофлоры после антибиотикотерапии.
Известен способ выделения бактерий рода Lactobacillus, который предусматривает посев клинического материала на поверхность плотной среды Рогоза следующего состава (в граммах на 1 л): 25,0 дрожжевого аутолизата обыкновенного; 20,0 агар-агара; 10,0 пептона; 20,0 глюкозы; 1,0 Твин-80; 6,0 КН2РO4; 25,0 ацетата натрия; 2,0 цитрата аммония; 0,575 MgSO4; 0,12 MnSO4•2Н2О; 0,034 FeSO4•7Н2О; 1,32 уксусной кислоты ледяной; воды дистиллированной до 1 л; рН среды 5,4±0,1; с последующей инкубацией посевов при температуре 37oС в заполненном углекислым газом анаэростате в течение 4 суток (Ленцнер А. А., Тоом М.А., Воронина М.Н., Микельсаар М.Э. К методике выделения отдельных видов лактобацилл микрофлоры человека // Лабораторное дело. - 1967.- 5.- С. 301-302).
Недостатком этого способа является многокомпонентность состава питательной среды, что делает процесс ее изготовления трудоемким и длительным, а также то, что для создания селективности в отношении бактерий рода Lactobacillus и подавления нежелательной микрофлоры используется ацетат натрия с высокой концентрацией (25 г/л). Вместе с тем, известно, что введение химических селективных факторов, наряду с торможением развития посторонней микрофлоры, может ингибировать рост лактобацилл. Так, при посеве фекалий, желудочного сока и вагинального отделяемого на среду Рогоза было обнаружено, что разные виды лактобацилл обладали различной всхожестью. Это объясняется различной чувствительностью отдельных штаммов лактобацилл к концентрации ацетата натрия (25 г/л) в среде Рогоза. Кроме того, культивирование посевов по этому способу осуществляют в заполненных углекислым газом анаэростатах в отсутствие кислорода, в течение 4-5 суток, затем колонии лактобацилл отсевают на полужидкую среду МРС-2, инкубируют при 37oС в течение 2-4 суток, затем делают высев на плотную среду Рогоза и вновь инкубируют в заполненном углекислым газом анаэростате при 37oС в течение 4-5 суток. Для получения чистых культур выделенные штаммы лактобацилл рассевают на плотную среду Рогоза по меньшей мере 6 раз. К недостатку указанного способа относится еще и длительность процесса выделения чистой культуры бактерий рода Lactobacillus из клинического материала.
Наиболее близким к заявляемому является способ выделения бактерий рода Lactobacillus из клинического материала (фекалий, вагинального отделяемого), заключающийся в приготовлении серии 10-кратных разведений исследуемого материала в жидкой селективной питательной среде обогащения, высеве из разведений на поверхность плотной селективной питательной среды, культивировании посевов в течение 24-48 часов при повышенном содержании углекислого газа (5%) и пониженной концентрации кислорода (16%) в атмосфере культивирования, отличающийся тем, что осуществляют накопление бактерий рода Lactobacillus из клинического материала при 39oС на жидкой селективной питательной среде обогащения при следующем соотношении компонентов среды, г/л:
Гидролизат обезжиренного молока жидкий - 225,0±25,0
Аутолизат дрожжей концентрированный - 110,0±10,0
Агар - 0,8
Вода дистиллированная - До 1 л
Раствор едкого натра 20% до рН среды - 5,4±0,1
а затем проводят выделение лактобацилл на плотной селективной питательной среде при следующем соотношении компонентов среды, г/л:
Гидролизат обезжиренного молока жидкий - 225,0±25,0
Аутолизат дрожжей концентрированный - 110,0±10,0
Агар - 22,5±2,5
Вода дистиллированная - До 1 л
Раствор едкого натра 20% до рН среды - 5,4±0,1
Культивирование посевов осуществляют в течение 24-48 часов при повышенном содержании углекислого газа - 5% и пониженной концентрации кислорода - 16% в атмосфере культивирования при температуре 39oС.
Для приготовления селективной питательной среды обогащения и плотной селективной питательной среды в указанном способе используется гидролизат молока жидкий, который получают из обезжиренного молока и панкреатина.
Недостатком этого способа является трудоемкость приготовления гидролизата молока жидкого в условиях бактериологической лаборатории и высокая себестоимость исходного сырья (молоко сухое обезжиренное ГОСТ 10970-87, 88 рублей за 1 кг; панкреатин, 60 таблеток по 25 ЕД, АО "Акрихин", 59 рублей 65 копеек). Трудоемкость заключается в необходимости корректировки рН не менее шести раз в течение 4 часов при панкреатическом гидролизе молока, а также в необходимости нагревания до кипения гидролизата, содержащего токсичное вещество - хлороформ, что ухудшает условия труда и требует наличия приточно-вытяжной вентиляции (Инструкция по приготовлению кисло-молочного бифилакта на молочных кухнях 11-14/6-33. - Утв. 27.03.87. МЗ СССР. - М., 1987. - C.11).
Задача изобретения - создание более простого способа выделения бактерий рода Lactobacillus, расширение арсенала питательных сред для выделения лактобацилл из клинического материала путем упрощения получения жидкой селективной питательной среды обогащения и плотной селективной питательной среды при сохранении их ростовых и ингибирующих свойств.
Поставленная задача достигается тем, что осуществляют накопление бактерий рода Lactobacillus из клинического материала при 39oС на жидкой селективной питательной среде обогащения следующего состава, г/л:
Аутолизат дрожжей концентрированный (аминный азот 580-600 мг%) - 110,0±10,0
Лактоза - 10,0±2,0
Кислота уксусная ледяная - 3,8±0,4
Агар - 0,9±0,1
Отвар крупы сои (аминный азот 38-40 мг%) - До 1 л
Раствор едкого натра 20% до рН среды - 5,4±0,1
а затем проводят выделение лактобацилл на плотной селективной питательной среде следующего состава, г/л:
Аутолизат дрожжей концентрированный (аминный азот 580-600 мг%) - 110,0±10,0
Лактоза - 10,0±2,0
Кислота уксусная ледяная - 3,8±0,4
Агар - 22,5±2,5
Отвар крупы сои (аминный азот 38-40 мг%) - До 1 л
Раствор едкого натра 20% до рН среды - 5,4±0,1
а культивирование посевов осуществляют в течение 24-48 часов при температуре 39oС, повышенном содержании углекислого газа - 5% и пониженной концентрации кислорода 16% в атмосфере культивирования.
Новизна заявляемого способа состоит в том, что для приготовления питательных сред вместо гидролизата молока жидкого используют отвар крупы сои, лактозу и уксусную кислоту.
Сущность способа заключается в следующем.
Процесс выделения лактобацилл из клинического материала (фекалий, вагинального отделяемого) всегда состоит из двух обязательных взаимосвязанных этапов:
- накопление в жидкой селективной среде обогащения,
- последующий высев на плотную селективную питательную среду для получения изолированных колоний лактобацилл.
Первый этап заключается в приготовлении серии 10-кратных разведений исследуемого материала в жидкой селективной питательной среде обогащения для накопления лактобацилл следующего состава, г/л:
Аутолизат дрожжей концентрированный (аминный азот 580-600 мг%) - 110,0±10,0
Лактоза - 10,0±2,0
Кислота уксусная ледяная - 3,8±0,4
Агар - 0,9±0,1
Отвар крупы сои (аминный азот 38-40 мг%) - До 1 л
Раствор едкого натра 20% до рН среды - 5,4±0,1
Разведения делают в пробирках, содержащих по 4,5 мл жидкой селективной питательной среды обогащения при помощи автоматического дозатора со съемными наконечниками, путем перенесения из пробирки в пробирку по 0,5 мл. Титрование по 0,5 мл производят до 10-8-10-10. После титрования посевы инкубируют в течение 24 часов при повышенном содержании углекислого газа - 5% и пониженной концентрации кислорода - 16% в атмосфере культивирования при температуре 39oС. Результат учитывают визуально, по наличию общего помутнения среды или росту изолированных колоний. Затем из пробирок с наличием роста готовят мазки, окрашивают по Граму. Отмечают последнее разведение, где был обнаружен рост характерных по морфологии грамположительных палочек. Титр лактобацилл (количество бактерий рода Lactobacillus в 1 г клинического материала) определяют по максимальному разведению, в котором обнаружены типичные грамположительные палочки. Отмечают пробирки с разведениями клинического материала, в которых обнаружен обильный рост бактерий рода Lactobacillus.
Затем проводят второй этап - выделение лактобацилл на плотной селективной питательной среде. Для этого из пробирок с разведениями клинического материала, в которых обнаружен обильный рост бактерий рода Lactobacillus, осуществляют посев бактериологической петлей на поверхность плотной селективной питательной среды для получения изолированных колоний. Плотная селективная питательная среда имеет следующий состав, г/л:
Аутолизат дрожжей концентрированный (аминный азот 580-600 мг%) - 110,0±10,0
Лактоза - 10,0±2,0
Кислота уксусная ледяная - 3,8±0,4
Агар - 22,5±2,5
Отвар крупы сои (аминный азот 38-40 мг%) - До 1 л
Раствор едкого натра 20% до рН среды - 5,4±0,1
Культивирование посевов осуществляют при 39oС в атмосфере, содержащей 5% углекислого газа, 16% кислорода, в течение 24-48 часов.
В условиях первого этапа культивирования на жидкой селективной среде происходит накопление бактерий рода Lactobacillus за счет их ускоренного роста и ингибирования роста сопутствующей микрофлоры при культивировании в атмосфере, содержащей 5% углекислого газа и 16% кислорода в течение 24 часов при температуре 39oС. Лактобациллы, обитающие в организме человека в составе индигенной микрофлоры, являются термофильными и хорошо растут при 39oС. Бактерии рода Lactobacillus являются факультативными анаэробами, поэтому растут в атмосфере, содержащей 5% углекислого газа, 16% кислорода. Для получения атмосферы культивирования, содержащей 5% углекислого газа и 16% кислорода, посевы помещают в герметически закрывающуюся емкость (анаэростат, эксикатор), зажигают свечу и плотно закрывают.
Известно, что для приготовления питательных сред в качестве источника белка используют вещества животного и растительного происхождения, например отходы рыбной и мясной промышленности, водоросль хлореллу, горох, сою, плоды тунгового дерева (Орел Л.Л., Дубянская Л.Д. Обзор патентных документов по приготовлению питательных сред для выращивания бактерий. / Журн. микробиол. - 1983. - 12. - С. 22-26.). Как правило, для выращивания микроорганизмов используют ферментативные панкреатические гидролизаты животного (патент 2027754, 6 С 12 N 1/20, заявл. 30.08.91, опубл. 27.01.95, БИ 1995, 3, стр. 158) и растительного (патент 2061037, 6 С 12 N 1/20, заявл. 29.03.94, опубл. 27.05.96, БИ 1996, 15) сырья.
Соя содержит 24-45% белка, 20-32% углеводов, 13-37% жира, витамины D1, В, Е и др. Известно, что белок сои наиболее близок по аминокислотному составу к животному белку (Большая Советская энциклопедия. - 1976. - Т. 24, книга 1. - С. 831). Именно поэтому соя и продукты из нее используются в качестве ингредиентов или полных заменителей молока (Н.И. Смородина. Чудо - соя. Лучшие рецепты соевой кулинарии. - Феникс: Ростов-на-Дону. - 2000. - С. 7).
Известно применение соевого молока вместо коровьего молока в питательной среде для поддержания коллекции молочнокислых микробов; эта среда состоит из 1 л молока и 5% нейтрального аутолизата дрожжей с рН 6,8. (В.Л. Омелянский. Практическое руководство по микробиологии, издание второе / под общ. ред. проф. Б.Л. Исаченко. - 1940. - С. 61.).
Недостатком молочно-дрожжевой среды является то, что она пригодна только для выращивания и хранения чистых культур молочнокислых бактерий и не способна подавлять рост посторонней микрофлоры при посеве клинического материала.
Установлено, что отвар крупы сои (содержание аминного азота 38-40 мг%) в количестве 880,0-900,0 г/л обеспечивает развитие лактобацилл, так как содержит необходимые ростовые факторы. Из литературных источников не найдено использование его в качестве компонента питательных сред.
Введение в состав среды 8-12 г/л лактозы восполняет дефицит этого углевода в отваре крупы сои.
Кислота уксусная ледяная в количестве 3,4-3,8 г/л обеспечивает подавление сопутствующей микрофлоры при посеве клинического материала, причем в таком количестве она в значительно меньшей степени ингибирует рост лактобацилл, по сравнению с известными селективными факторами, например ацетатом натрия в количестве 25 г/л (Ленцнер А.А., Тоом М.А., Воронина М.Н., Микельсаар. М. Э. К методике выделения отдельных видов лактобацилл микрофлоры человека // Лабораторное дело. - 1967. - 5. - С. 301-302).
Таким образом, отвар крупы сои, лактоза и уксусная кислота в указанных количествах позволяют получить новую совокупность существенных признаков, обеспечивающих получение новой питательной среды, обладающей достаточными ростовыми свойствами для лактобацилл и ингибирующими свойствами для посторонней микрофлоры при посеве клинического материала. При этом упрощается технология приготовления питательных сред и за счет этого - сам способ выделения лактобацилл.
Дрожжевой аутолизат концентрированный (содержание аминного азота 580-600 мг%) в количестве 100,0-120,0 г на 1 л среды служит стимулятором роста и источником пластических веществ, способствующих регенерации лактобацилл, поврежденных действием селективных факторов (рН 5,4±0,1, уксусная кислота).
Использование в заявляемом способе 0,8-1,0 г/л агара повышает вязкость среды, что позволяет получить рост изолированных колоний бактерий рода Lactobacillus в столбике среды, а также уменьшает растворимость кислорода в толще среды. В тоже время 0,8-1,0 г/л агара в питательной среде не затрудняет приготовление разведений.
Установление значения рН среды в пределах 5,3-5,5 в сочетании с заявляемым составом обеспечивает подавление сопутствующей микрофлоры, не угнетая при этом роста засеянных лактобацилл. Культивирование посевов при 39oС в атмосфере, содержащей 5% углекислого газа, 16% кислорода обеспечивает ускорение роста колоний лактобацилл, одновременно задерживая рост сопутствующей микрофлоры при исследовании клинического материала. Атмосфера такого газового состава может быть получена при помощи анаэростата и свечи. Сопутствующая индигенная анаэробная микрофлора в таких условиях не растет, из представителей аэробной микрофлоры в указанных условиях возможен рост энтерококков и грибов рода Candida.
Введение в состав среды 20,0-25,0 г агара на 1 л позволяет получить плотную селективную питательную среду для выделения изолированных колоний лактобацилл, что дает возможность выделения чистой культуры бактерий рода Lactobacillus для дальнейшего изучения.
Пример. Выделение бактерий рода Lactobacillus из фекалий с предварительным накоплением на жидкой селективной питательной среде обогащения.
1 кг сухой крупы сои (ГОСТ 17109-88, 1 сорт, 10 рублей за 1 кг) помещают в эмалированную кастрюлю вместимостью 5 л, трижды промывают водой, добавляют 3 л водопроводной воды, оставляют при комнатной температуре для набухания. В процессе выдержки в течение 14-16 часов производят замену воды через каждые 3-4 часа. Воду сливают, набухшее зерно заливают 3 л свежей воды, медленно (в течение 1 часа) нагревают до кипения и варят на медленном огне, не допуская бурного кипения в течение 4 часов. За 30 мин до окончания варки добавляют 10 - 15 г натрия хлорида. Охлаждают до комнатной температуры, отвар сливают. Отвар выдерживают в холодильнике в течение суток, отделяют от осадка декантацией или центрифугированием при 6000 об/мин в течение 15 минут. Выход отвара - 2,5 л. Отвар прозрачный, светло-желтого цвета, содержание аминного азота 38,22 мг%.
В колбу вместимостью 1 л помещают 100,0 г дрожжевого аутолизата концентрированного (содержание аминного азота 583 мг%); уксусной кислоты ледяной 3,4 мл; 0,8 г агара; 10 мл 20%-ного раствора едкого натра; отвара крупы сои (содержание аминного азота 38,22 мг%) до 1 л, нагревают до расплавления агара, контролируют рН при помощи рН-метра (в данном примере рН 5,4), стерилизуют в автоклаве при 0,5 атм в течение 20 минут. Отдельно в колбе готовят 40% (весообъемный процент) раствор лактозы, стерилизуют кипячением на водяной бане в течение 30 минут, охлаждают до комнатной температуры. Затем в асептических условиях к среде добавляют 25 мл 40%-ного раствора лактозы (10,0 г/л), перемешивают. Среду быстро охлаждают, поместив колбу в водяную баню с температурой 15-20oС, периодически перемешивают для ускорения охлаждения и равномерного распределения агара в объеме среды. После стерилизации среду можно хранить в холодильнике до 2-х месяцев.
Жидкую селективную питательную среду обогащения в асептических условиях разливают в пробирки по 4,5 мл. Пробирки можно хранить в холодильнике до 4 недель, поместив в герметичный пластиковый пакет для предотвращения высыхания. Перед использованием пробирки необходимо подогреть в термостате или на водяной бане до 37-39oС.
Из основного разведения фекалий 10-1 (в стерильном физиологическом растворе) при помощи дозатора готовят ряд 10-кратных последовательных разведений в 4,5 мл жидкой селективной питательной среды обогащения (титрование по 0,5 мл, до 10-10). Посевы инкубируют при 39oС в течение 24 часов в атмосфере, содержащей 5% углекислого газа и 16% кислорода. Результат учитывают визуально, по наличию общего помутнения среды или росту изолированных колоний. Затем из пробирок с наличием роста готовят мазки, окрашивают по Граму. Отмечают последнее разведение, где обнаружен рост характерных по морфологии грамположительных палочек. Титр (количество бактерий рода Lactobacillus в 1 г фекалий) определяют по максимальному разведению, в котором обнаружены типичные грамположительные палочки. В посевах фекалий, кроме лактобацилл, в указанных условиях могут расти энтерококки, которые легко отличимы по морфологии в мазках по Граму. Отмечают пробирки с разведениями фекалий, в которых обнаружен обильный рост бактерий рода Lactobacillus без энтерококков или с минимальным присутствием энтерококков, а затем из этих пробирок бактериологической петлей делают высев на поверхность плотной селективной питательной среды для получения изолированных колоний.
Плотную селективную питательную среду готовят следующим образом. В колбу вместимостью 1 л помещают 100,0 г дрожжевого аутолизата концентрированного (содержание аминного азота 583 мг%); 3,4 мл уксусной кислоты ледяной; 20,0 г агара; 10 мл 20%-ного раствора едкого натра; отвара крупы сои (содержание аминного азота 38,22 мг%) до 1 л, нагревают до расплавления агара, контролируют рН (в данном примере рН 5,3), стерилизуют в автоклаве при 0,5 атм в течение 20 минут. Отдельно в колбе готовят 40% (весообъемный процент) раствор лактозы, стерилизуют кипячением на водяной бане в течение 30 минут, охлаждают до комнатной температуры. Затем в асептических условиях к горячей среде после стерилизации добавляют 25 мл 40%-ного раствора лактозы (10,0 г/л), перемешивают, среду охлаждают до температуры 45-50oС, разливают в асептических условиях по 20 мл в стерильные чашки Петри. Перед посевом чашки подсушивают в термостате при 37-39oС до исчезновения капель конденсата на поверхности среды.
Инкубируют посевы на плотной селективной питательной среде в чашках Петри крышкой вниз в атмосфере, содержащей 5% углекислого газа и 16% кислорода, при температуре 39o С в течение 24-48 часов. Колонии бактерий рода Lactobacillus вырастают разной величины, от точечных (росинки) до 2-3 мм в диаметре, чаще плоские, шероховатые, слегка опалесцирующие, прозрачные, иногда с возвышением в центре и валиком по краю, редко белого цвета. В мазке по Граму - грамположительные мелкие или крупные, без капсулы, неспорообразующие палочки, расположенные отдельно или цепочками. При посеве фекалий, наряду с колониями бактерий рода Lactobacillus, обнаруживают колонии энтерококков. Колонии энтерококков белые, круглые, выпуклые, блестящие, гладкие, редко шероховатые. От бактерий рода Lactobacillus их дифференцируют в мазках по Граму.
Для обоснования принадлежности выделенных бактерий к роду Lactobacillus используют следующие признаки. Сам факт развития культуры на селективной питательной среде в атмосфере, содержащей 5% углекислого газа и 16% кислорода, позволяет предположить развитие культуры лактобацилл. Дополнительно проводят морфологические исследования: палочковидная форма и положительная окраска по Граму, а также выявление метахроматических включений при окраске метиленовым синим, отсутствие способности к споро- и капсулообразованию. Подтверждением принадлежности культуры к роду лактобацилл служит отсутствие подвижности (особенно из жидкой среды) при фазово-контрастной микроскопии, неспособность к редукции нитратов и метиленовой сини, отрицательная оксидазная и каталазная пробы, отсутствие пигментообразования. На принадлежность культуры к группе анаэробных и факультативно-анаэробных микроорганизмов указывает неспособность к росту на неселективной плотной среде для культивирования лактобацилл при 39oС в аэробных условиях, отсутствие роста при 39oС на простом агаре в атмосфере, содержащей 5% углекислого газа и 16% кислорода.
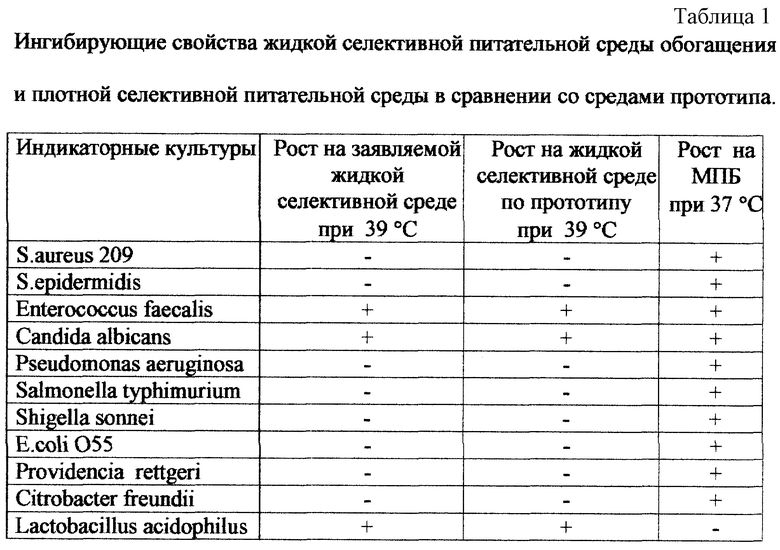
Определение ингибирующих свойств заявляемой жидкой селективной питательной среды обогащения.
В пробирки с заявляемой жидкой селективной питательной средой обогащения, разлитой по 5 мл, засевали по 0,1 мл суточных бульонных культур индикаторных микроорганизмов, выращенных при 37oС. Параллельно произвели посев этих же культур в пробирки с селективной питательной средой обогащения, приготовленной по прототипу, и в пробирки с мясопептонным бульоном (МПБ) для контроля жизнеспособности культур (табл.1). Посевы в селективных средах инкубировали при 39oС, а посевы в МПБ - при 37oС, как наиболее оптимальной температуре для развития индикаторных культур. Предварительный учет результатов проводили через сутки, окончательный - через двое суток инкубирования. Предварительные и окончательные результаты учета роста микроорганизмов совпадают. При 39oС на селективных средах (заявляемой и по способу-прототипу) растут только лактобациллы, энтерококки и грибы рода Candida, а при 37oС в МПБ растут все культуры, за исключением лактобацилл. Это доказывает равноценные ингибирующие свойства заявляемой среды и среды по способу-прототипу.
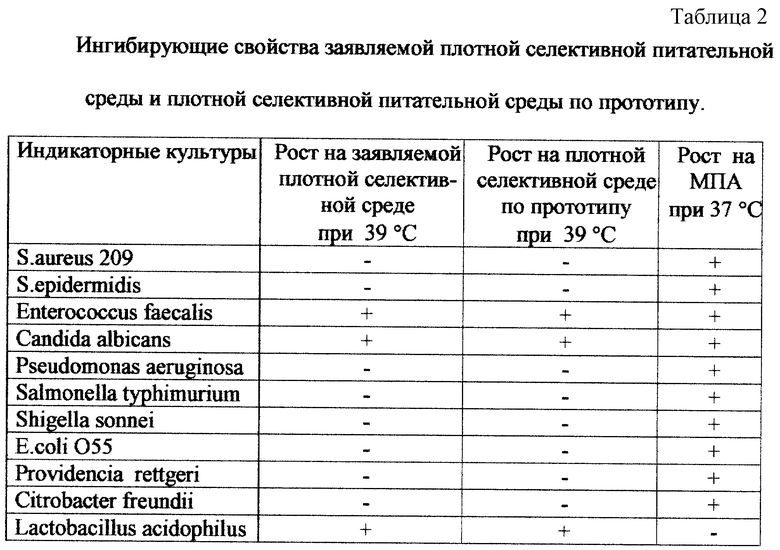
Аналогичные результаты (табл.2) получены при посеве индикаторных культур на поверхность плотных селективных питательных сред (заявляемой и по способу-прототипу) и при посеве на мясопептонный агар (МПА). Дно чашек Петри с плотными питательными средами делили на 6 секторов, на каждую чашку петлей засевали по 5 секторов суточными бульонными культурами индикаторных микроорганизмов, а на шестой сектор - суточную культуру Lactobacillus acidophilus 317/402 в среде накопления. Инкубацию посевов на плотных селективных питательных средах осуществляли в чашках Петри крышкой вниз в атмосфере, содержащей 5% углекислого газа и 16% кислорода, при 39o С в течение 24-48 часов. Посевы на МПА инкубировали в чашках Петри крышкой вниз при 37oС в аэробных условиях.
Таким образом, полученные результаты доказывают, что заявляемый способ выделения бактерий рода Lactobacillus из клинического материала позволяет не только упростить технологию приготовления питательных сред за счет исключения стадии ферментативного гидролиза, но и расширить ассортимент селективных питательных сред, предназначенных для выделения бактерий рода Lactobacillus из клинического материала, значительно снизить материальные затраты, связанные с приготовлением питательных сред.
При этом новая селективная среда обладает достаточными ростовыми свойствами и обладает ингибирующими свойствами для подавления роста посторонней микрофлоры, что особенно важно при посеве клинического материала, содержащего сопутствующую микрофлору.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫДЕЛЕНИЯ БАКТЕРИЙ РОДА LACTOBACILLUS ИЗ КЛИНИЧЕСКОГО МАТЕРИАЛА | 2000 |
|
RU2178171C1 |
| СПОСОБ ВЫДЕЛЕНИЯ БАКТЕРИЙ РОДА LACTOBACILLUS ИЗ КЛИНИЧЕСКОГО МАТЕРИАЛА | 1999 |
|
RU2154822C1 |
| СПОСОБ СЕЛЕКТИВНОГО ВЫДЕЛЕНИЯ АУТОШТАММОВ LACTOBACILLUS SPP. ИЗ КЛИНИЧЕСКОГО МАТЕРИАЛА | 2018 |
|
RU2675315C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ДЕРМАТОФИТОВ ИЗ КЛИНИЧЕСКОГО МАТЕРИАЛА | 2000 |
|
RU2181144C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИДКОГО ЛАКТОБАКТЕРИНА | 2002 |
|
RU2244744C2 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ ЛАКТОБАКТЕРИЙ | 2012 |
|
RU2510416C1 |
| Штамм бактерий Lactobacillus paracasei 1, используемый для приготовления пробиотического препарата | 2015 |
|
RU2608871C1 |
| ШТАММ Lactobacillus fermentum Z, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПРОИЗВОДСТВА ПРОБИОТИЧЕСКИХ МОЛОЧНОКИСЛЫХ ПРОДУКТОВ | 2008 |
|
RU2412239C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРСОНИФИЦИРОВАННОГО АУТОПРОБИОТИЧЕСКОГО ПРОДУКТА И СПОСОБ ЛЕЧЕНИЯ СИНДРОМА РАЗДРАЖЕННОЙ КИШКИ С ИСПОЛЬЗОВАНИЕМ ЭТОГО ПРОДУКТА | 2013 |
|
RU2546253C2 |
| СПОСОБ ЛЕЧЕНИЯ РЕЦИДИВИРУЮЩЕГО УРОГЕНИТАЛЬНОГО КАНДИДОЗА НА ФОНЕ ТРИХОМОНИАЗА | 2001 |
|
RU2212238C2 |
Изобретение относится к медицине, в частности к микробиологии, и может быть использовано для селективного выделения бактерий рода Lactobacillus из клинического материала. Сущностью изобретения является накопление бактерий рода Lactobacillus на жидкой селективной питательной среде обогащения, а затем выделение лактобацилл на плотной селективной питательной среде. Техническим результатом является упрощение получения селективной питательной среды обогащения для выделения бактерий Lactobacillus из клинического материала при сохранении их ростовых свойств, а также расширение арсенала питательных сред. 2 табл.
Способ выделения бактерий рода Lactobacillus из клинического материала, заключающийся в приготовлении серии 10-кратных разведений исследуемого материала в жидкой селективной питательной среде обогащения, высеве из разведений на поверхность плотной селективной питательной среды, культивировании посевов при 39oС в течение 24-48 ч при повышенном содержании углекислого газа - 5% и пониженной концентрации кислорода - 16% в атмосфере культивирования, отличающийся тем, что осуществляют накопление бактерий рода Lactobacillus из клинического материала на жидкой селективной питательной среде обогащения при следующем соотношении компонентов среды, г/л:
Аутолизат дрожжей концентрированный (аминный азот 580-600 мг%) - 110,0±10,0
Лактоза - 10,0±2,0
Кислота уксусная ледяная - 3,8±0,4
Агар - 0,9±0,1
Отвар крупы сои (аминный азот 38-40 мг%) - До 1 л
Раствор едкого натра 20% до рН среды - 5,4±0,1
а затем проводят выделение лактобацилл на плотной селективной питательной среде при следующем соотношении компонентов, г/л:
Аутолизат дрожжей концентрированный (аминный азот 580-600 мг%) - 110,0±10,0
Лактоза - 10,0±2,0
Кислота уксусная ледяная - 3,8±0,4
Агар - 22,5±2,5
Отвар крупы сои (аминный азот 38-40 мг%) - До 1 л
Раствор едкого натра 20% до pH среды - 5,4±0,1
| US 6340585 А, 27.09.2000 | |||
| АБРОСИМОВА Н.А | |||
| и др | |||
| Питательная среда для выделения молочнокислых бактерий | |||
| - Лабораторное дело, 1991, №3, с.78-79 | |||
| КАРКИ Т.В | |||
| и др | |||
| Количественный состав лактофлоры и методика его определения | |||
| - Журнал микробиологии, эпидемиологии и иммунобиологии, 1994, №4, с | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
Авторы
Даты
2002-11-20—Публикация
2001-03-27—Подача