Изобретение относится к производным пиридо-1,2,4-тиадиазина и пиридо-1,4-тиазина, способам их получения, композициям, содержащим данные соединения, использованию этих соединений в качестве лекарственных средств и их применению в терапии, например, при лечении болезней центральной нервной системы, сердечно-сосудистой системы, легочной системы, желудочно-кишечной системы и эндокринной системы.
Известный уровень техники
Калиевые каналы играют важную роль в мембранном потенциале. Среди различных типов калиевых каналов имеются АТФ-чувствительные (катф)-каналы, которые регулируются изменениями во внутриклеточной концентрации аденозинтрифосфата. катф-каналы были обнаружены в клетках из различных тканей, таких как сердечные клетки, панкреатические клетки, скелетные мышцы, гладкие мышцы, центральные нейроны и клетки аденогипофиза. Эти каналы связаны с разнообразными клеточными функциями, например секрецией гормонов (инсулина из панкреатических бета-клеток, гормона роста и пролактина из клеток аденогипофиза), расширением кровеносных сосудов (в клетках гладких мышц), потенциальной продолжительностью сердечной деятельности, выделением нейротрансмиттеров в центральной нервной системе.
Было обнаружено, что модуляторы катф-каналов имеют большое значение при лечении различных болезней. Некоторые сульфонилмочевины, которые были использованы для лечения инсулиннезависимого сахарного диабета, действуют путем стимуляции выделения инсулина посредством ингибирования катф-каналов в панкреатических бета-клетках.
Было обнаружено, что открыватели калиевых каналов, которые включают гетерогенную группу соединений, способны релаксировать гладкие мышцы сосудов, и поэтому их использовали для лечения гипертензии.
Кроме того, открыватели калиевых каналов можно использовать в качестве бронхолитических средств при лечении астмы и различных других болезней.
Более того, было показано, что открыватели калиевых каналов стимулируют рост волос, они были использованы для лечения облысения.
Открыватели калиевых каналов способны также релаксировать гладкие мышцы мочевого пузыря, следовательно, их можно использовать для лечения недержания мочи. Открыватели калиевых каналов, которые релаксируют гладкие мышцы матки, можно использовать для предупреждения преждевременных родов.
Благодаря действию на калиевые каналы центральной нервной системы эти соединения можно использовать для лечения различных неврологических и психиатрических болезней, таких как болезнь Альцгеймера, эпилепсия и церебральная ишемия.
Недавно было показано, что диазоксид (1,1-диоксид 7-хлор-3-метил-2Н-1,2,4-бензотиадиазина) и некоторые производные 1,1-диоксида 3-(алкиламино)-4Н-пиридо[4,3-е]-1,2,4-тиадиазинов ингибируют выделение инсулина путем активации катф-каналов в панкреатических бета-клетках (Pirotte В. et al., Biochem. Pharmacol., 47, 1381-1386 (1994); Pirotte В. et al., J. Med Chem. , 36, 3211-3213 (1993). Кроме того, было показано, что диазоксид замедляет начало диабета у ВВ-крыс (Vlahos W.D. et al., Metabolism 40, 39-46 (1991). Было показано, что у страдающих ожирением крыс-сосунков диазоксид снижает секрецию инсулина и повышает связывание инсулина рецепторами и, следовательно, повышает толерантность к глюкозе и снижает увеличение массы (Alemzadeh R. et al., Endocrinol., 133, 705-712, 1993). Предполагается, что такие соединения можно использовать для лечения болезней, характеризующихся повышенной продукцией инсулина, и для лечения и профилактики диабета.
В Европейском патенте ЕР 618 209 описывается класс производных пиридотиадиазина, имеющих алкил или алкиламиногруппу в положении 3 кольца тиадиазина. Заявлено, что эти соединения являются агонистами АМРА-рецептора глутамата.
В Acta Crystallographica, Section С, 1995, С51(9), 1903-1905, описывается кристаллическая структура 1,1-диоксида 3-бензамидо-4Н-пиридо[4,3-е]-1,2,4-тиадиазина.
Описание изобретения
Настоящее изобретение относится к производным пиридо-1,2,4-тиадиазина и пиридо-1,4-тиазина общей формулы I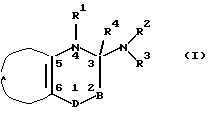
где В представляет >NR5 или >CR5R6, где R5 и R6 независимо могут быть водородом; гидрокси; C1-6-алкокси или C1-6-алкилом, C3-6-циклоалкилом, C2-6-алкенилом или C2-6-алкинилом, необязательно моно- или полизамещенным галогеном, или R5 и R4 вместе представляют одну из связей в двойной связи между атомами 2 и 3 формулы I;
D представляет -S(=O)2- или -S(=O)-, или
D-B представляет -S(= O)(R10)=N-, где R10 представляет C1-6-алкил, или арил, или гетероарил, необязательно моно- или полизамещенный галогеном, гидрокси, C1-6-алкокси, арилокси, арилалкокси, нитро, амино, C1-6-моноалкил- или диалкиламино, циано, ацилом или C1-6-алкоксикарбонилом;
R1 представляет водород; гидрокси; C1-6-алкокси или C1-6-алкил, C3-6-циклоалкил, C2-6-алкенил или C2-6-алкинил, необязательно моно- или полизамещенный галогеном, и R4 представляет водород или R4 вместе с R5 представляют одну из связей в двойной связи между атомами 2 и 3 формулы I, или R1 вместе с R4 представляют одну из связей в двойной связи между атомами 3 и 4 формулы I;
R2 представляет водород; гидрокси; C1-6-алкокси или C1-6-алкил, C3-6-циклоалкил, C2-6-алкенил или C2-6-алкинил, необязательно моно- или полизамещенный галогеном;
R3 представляет R11; -OR11; -C(=X)R11; -NR11R12; бициклоалкил, арил, гетероарил, арилалкил или гетероарилалкил, необязательно моно- или полизамещенный галогеном, гидрокси, C1-6-алкокси, арилокси, арилалкокси, нитро, амино, C1-6-моноалкил- или диалкиламино, циано, оксо, ацилом или C1-6-алкоксикарбонилом, или арил, замещенный C1-6-алкилом;
где R11 представляет водород; C3-6-циклоалкил или (C3-6-циклоалкил)-C1-6-алкил, причем C3-6-циклоалкильная группа, необязательно моно- или полизамещена C1-6-алкилом, галогеном, гидрокси или C1-6-алкокси; 3-6-членная насыщенная циклическая система, содержащая один или несколько атомов азота, кислорода или серы, или неразветвленный или разветвленный C1-18-алкил, необязательно моно- или полизамещенной галогеном, гидрокси, C1-6-алкокси, C1-6-алкилтио, C3-6-циклоалкилом, арилом, арилокси, арилалкокси, нитро, амино, C1-6-моноалкил- или диалкиламино, циано, оксо, формилом, ацилом, карбокси, C1-6-алкоксикарбонилом или карбамоилом;
Х представляет О или S;
R12 представляет водород; C1-6-алкил; C2-6-алкенил; C3-6-циклоалкил, необязательно моно- или полизамещенный C1-6-алкилом, галогеном, гидрокси или C1-6-алкокси, или
R11 и R12 вместе с атомом азота образуют 3-12-членную моно- или бициклическую систему, в которой один или несколько атомов углерода могут быть заменены на азот, кислород или серу, причем каждая из этих циклических систем является необязательно моно- или полизамещенной галогеном, C1-6-алкилом, гидрокси, C1-6-алкокси, C1-6-алкокси-C1-6-алкилом, нитро, амино, циано, трифторметилом, C1-6-моноалкил- или диалкиламино, оксо, или
R3 представляет
где n, m, p независимо равно 0, 1, 2, 3 и R13 представляет водород; гидрокси; C1-6-алкокси; C1-6-циклоалкил, необязательно моно- или полизамещенный C1-6-алкилом, галогеном, гидрокси или C1-6-алкокси; C1-6-алкил, C2-6-алкенил или C2-6-алкинил, необязательно моно- или полизамещенный галогеном,
или R2 и R3 вместе с атомом азота образуют 3-12-членную моно- или бициклическую систему, в которой один или несколько атомов углерода могут быть заменены на азот, кислород или серу, причем каждая из этих циклических систем является необязательно моно- или полизамещенной галогеном, C1-6-алкилом, гидрокси, C1-6-алкокси, C1-6-алкокси-C1-6-алкилом, нитро, амино, циано, трифторметилом, C1-6-моноалкил- или диалкиламино или оксо;
А вместе с 5 и 6-м атомами углерода формулы I образует кольцо пиридина, выбранное из

где R7, R8, R9 независимо представляют водород; галоген; С1-12-алкил; C3-6-циклоалкил; гидрокси; C1-6-алкокси; C1-6-алкокси-C1-6-алкил; нитро; амино; циано; цианометил; пергалогенметил; C1-6-моноалкил- или диалкиламино; сульфамоил; C1-6-алкилтио; C1-6-алкилсульфонил; C1-6-алкилсульфинил; C1-6-алкилкарбониламино; арилтио, арилсульфинил, арилсульфонил, причем арильная группа необязательно моно- или полизамещена C1-6-алкилом, галогеном, гидрокси или C1-6-алкокси; C1-6-алкоксикарбонил; C1-6-алкоксикарбонил-C1-6-алкил; карбамил, карбамилметил; C1-6-моноалкил- или диалкиламинокарбонил; C1-6-моноалкил- или диалкиламинотиокарбонил; уреидо; C1-6-моноалкил- или диалкиламинокарбониламино, тиоуреидо; C1-6-моноалкил- или диалкиламинотиокарбониламино; C1-6-моноалкил- или диалкиламиносульфонил; карбокси; карбокси-C1-6-алкил; ацил; арил, арилалкил, арилокси, причем арильная группа необязательно моно- или полизамещена C1-6-алкилом, галогеном, гидрокси или C1-6-алкокси; (1,2,4-оксадиазол-5-ил) - или (1,2,4-оксадиазол-3-ил)-C1-6-алкил, причем оксадиазолильная группа необязательно замещена C1-6-алкилом или C3-6-циклоалкилом, или 5-6-членное азотсодержащее кольцо, необязательно замещенное фенилом или C1-6-алкилом, при условии, что, когда В представляет NR5, D представляет SO2 и R2 представляет водород, C1-6-алкил или C3-6-циклоалкил, то R3 не может представлять водород, незамещенный C1-6-алкил, C3-6-циклоалкил (C3-6-циклоалкил)-C1-6-алкил, пирролидин, пиперидин, пиперазин, морфолин, тиоморфолин или бензоил,
или их солям с фармацевтически приемлемой кислотой или основанием.
В пределы объема изобретения включаются все оптические изомеры соединений формулы I, некоторые из которых оптически активны, а также их смеси, включая их рацемические смеси.
Объем изобретения включает также все таутомерные формы соединений формулы I.
Соли включают фармацевтически приемлемые кислотно-аддитивные соли, фармацевтически приемлемые соли металлов или необязательно алкилированные аммониевые соли, такие как соли хлористоводородной, бромистоводородной, йодистоводородной, фосфорной, серной, трифторуксусной, трихлоруксусной, щавелевой, малеиновой, пировиноградной, малоновой, янтарной, лимонной, винной, фумаровой, миндальной, бензойной, коричной, метансульфоновой, этансульфоновой, пикриновой кислоты и тому подобное, включая кислоты, имеющие отношение к фармацевтически приемлемым солям, приведенным в Journal of Pharmaceutical Science, 66, 2 (1977), и введенным здесь в качестве ссылки, или соли лития, натрия, калия, магния и тому подобное.
Термин "C1-6-алкокси", используемый здесь, отдельно или в комбинации, относится к неразветвленному или разветвленному одновалентному заместителю, содержащему C1-6-алкильную группу, связанную через кислород простого эфира, имеющему свободную валентную связь от кислорода простой эфирной группы и содержащему от 1 до 6 атомов углерода, например метокси, этокси, пропокси, изопропокси, бутокси, пентокси.
Термин "C1-6-алкилтио", используемый здесь, отдельно или в комбинации, относится к неразветвленному или разветвленному одновалентному заместителю, содержащему низшую алкильную группу, связанную через двухвалентный атом серы, имеющему свободную валентную связь от атома серы и содержащему от 1 до 6 атомов углерода, например метилтио, этилтио, пропилтио, бутилтио, пентилтио.
Термин "C2-6-алкенил", используемый здесь, относится к ненасыщенной углеводородной цепи, содержащей 2-6 атомов углерода и одну двойную связь, такой как винил, 1-пропенил, аллил, изопропенил, н-бутенил, н-пентенил и н-гексенил.
Термин "C3-6-циклоалкил", используемый здесь, относится к радикалу насыщенного циклического углеводорода с указанным числом углеродов, такому как циклопропил, циклобутил, циклопентил или циклогексил.
Термин "С2-6-алкинил", используемый здесь, относится к ненасыщенным углеводородам, которые содержат тройные связи, таким как, например, 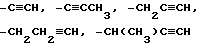
и тому подобное.
Термин "C1-6-алкокси-C1-6-алкил", используемый здесь, относится к группе из 2-12 атомов углерода, прерываемой О, такой как, например, СН2-О-СН3, СН2-О-СН2-СН3, СН2-О-СН(СН3)2 и тому подобное.
Термин "галоген" означает фтор, хлор, бром или йод.
Термин "пергалогенметил" означает трифторметил, трихлорметил, трибромметил или трииодметил.
Термины "C1-6-алкил", "C1-12-алкил" и "C1-18-алкил", используемые здесь, отдельно или в комбинации, относятся в неразветвленной или разветвленной насыщенной углеводородной цепи, имеющей указанное число атомов углерода, такой как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, 2-метилбутил, 3-метилбутил, 4-метилпентил, неопентил, н-гексил, 1,2-диметилпропил, 2,2-диметилпропил, 1,2,2-триметилпропил и тому подобное.
Термин "C1-18-алкил", используемый здесь, включает также вторичный C3-6-алкил и третичный C4-6-алкил.
Термин "C1-6-моноалкиламино", используемый здесь, относится к аминогруппе, где один из атомов водорода замещен неразветвленной или разветвленной насыщенной углеводородной цепью, имеющей указанное число атомов углерода, такой как метиламино, этиламино, пропиламино, н-бутиламино, втор-бутиламино, изобутиламино, трет-бутиламино, н-пентиламино, 2-метилбутиламино, н-гексиламино, 4-метилпентиламино, неопентиламино, н-гексиламино, 2, 2-диметилпропиламино и тому подобное.
Термин "C1-6-диалкиламино", используемый здесь, относится к аминогруппе, где два атома водорода независимо замещены неразветвленной или разветвленной насыщенной углеводородной цепью, имеющей указанное число атомов углерода, такой как диметиламино, N-этил-N-метиламино, диэтиламино, дипропиламино, N-(н-бутил)-N-метиламино, ди(н-пентил)амино и тому подобное.
Термин "ацил", используемый здесь, относится к одновалентному заместителю, содержащему C1-6-алкильную группу, связанную через карбонильную группу, такому как ацетил, пропионил, бутирил, изобутирил, пивалоил, валерил и тому подобное.
Термин "C1-6-алкоксикарбонил", используемый здесь, относится к одновалентному заместителю, содержащему C1-6-алкоксигруппу, связанную через карбонильную группу; такому как, например, метоксикарбонил, карбэтокси, пропоксикарбонил, изопропоксикарбонил, н-бутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, 3-метилбутоксикарбонил, н-гексоксикарбонил и тому подобное.
Термин "3-12-членная моно- или бициклическая система", используемый здесь, относится к одновалентному заместителю формулы -NR2R3 или -NR11R12, где R2 и R3 или R11 и R12 вместе с атомом азота образуют 3-12-членную моно- или бициклическую систему, в которой один или несколько атомов углерода могут быть заменены на азот, кислород или серу, такому как 1-пирролидил, пиперидино, морфолино, тиоморфолино, 4-метилпиперазин-1-ил, 7-азабицикло[2,2,1]гептан-7-ил, тропанил и тому подобное.
Термин "3-6-членная насыщенная циклическая система", используемый здесь, относится к одновалентному заместителю, содержащему моноциклическую насыщенную систему, содержащую один или несколько гетероатомов, выбранных из азота, кислорода и серы, и имеющую 3-6 членов и имеющую свободную валентность у атома углерода, например 2-пирролидил, 4-пиперидил, 3-морфолинил, 1,4-диоксан-2-ил, 5-оксазолидинил, 4-изоксазолидинил или 2-тиоморфолинил.
Термин "бициклоалкил", используемый здесь, относится к одновалентному заместителю, содержащему бициклическую структуру, образованную из 6-12 атомов углерода, такому как, например, 2-норборнил, 7-норборнил, 2-бицикло[2,2,2]октил и 9-бицикло[3,3,1]нонанил.
Термин "арил", используемый здесь, относится к фенилу, 1-нафтилу или 2-нафтилу.
Термин "гетероарил", используемый здесь, отдельно или в комбинации, относится к одновалентному заместителю, содержащему 5-6-членную моноциклическую ароматическую систему или 9-10-членную бициклическую ароматическую систему, содержащую один или несколько гетероатомов, выбранных из азота, кислорода и серы (например, пиррол, имидазол, пиразол, триазол, пиридин, пиразин, пиримидин, пиридазин, изотиазол, изоксазол, оксазол, оксадиазол, тиадиазол, хинолин, изохинолин, хиназолин, хиноксалин, индол, бензимидазол, бензофуран, птеридин и пурин).
Термин "арилалкил", используемый здесь, относится к неразветвленной или разветвленной насыщенной углеродной цепи, содержащей от 1 до 6 атомов углерода и замещенной ароматическим углеводородом, такой как бензил, фенетил, 3-фенилпропил, 1-нафтилметил, 2-(1-нафтил)этил и тому подобное.
Термин "арилокси", используемый здесь, относится к фенокси, 1-нафтилокси или 2-нафтилокси.
Термин "арилалкокси", используемый здесь, относится к C1-6-алкоксигруппе, замещенной ароматическим углеводородом, такой как бензилокси, фенетокси, 3-фенилпропокси, 1-нафтилметокси, 2-(1-нафтил)зтокси и тому подобное.
Термин "гетероарилалкил", используемый здесь, относится к неразветвленной или разветвленной насыщенной углеродной цепи, содержащей от 1 до 6 атомов углерода и замещенной гетероарильной группой, такой как (2-фурил)метил, (3-фурил)метил, (2-тиенил)метил, (3-тиенил)метил, (2-пиридил)метил, 1-метил-1-(2-пиримидил)этил и тому подобное.
Термин "C1-6-алкилсульфонил", используемый здесь, относится к одновалентному заместителю, содержащему C1-6-алкильную группу, связанную через сульфонильную группу, такому как, например, метилсульфонил, этилсульфонил, н-пропилсульфонил, изопропилсульфонил, н-бутилсульфонил, втор-бутилсульфонил, изобутилсульфонил, трет-бутилсульфонил, н-пентилсульфонил, 2-метилбутилсульфонил, 3-метилбутилсульфонил, н-гексилсульфонил, 4-метилпентилсульфонил, неопентилсульфонил, н-гексилсульфонил и 2,2-диметилпропилсульфонил.
Термин "C1-6-моноалкиламиносульфонил", используемый здесь, относится к одновалентному заместителю, содержащему C1-6-моноалкиламиногруппу, связанную через сульфонильную группу, такому как, например, метиламиносульфонил, этиламиносульфонил, н-пропиламиносульфонил, изопропиламиносульфонил, н-бутиламиносульфонил, втор-бутиламиносульфонил, изобутиламиносульфонил, трет-бутиламиносульфонил, н-пентиламиносульфонил, 2-метилбутиламиносульфонил, 3-метилбутиламиносульфонил, н-гексиламиносульфонил, 4-метилпентиламиносульфонил, неопентиламиносульфонил, н-гексиламиносульфонил и 2,2-диметилпропиламиносульфонил.
Термин "C1-6-диалкиламиносульфонил", используемый здесь, относится к одновалентному заместителю, содержащему C1-6-диалкиламиногруппу, связанную через сульфонильную группу, такому как диметиламиносульфонил, N-этил-N-метиламиносульфонил, диэтиламиносульфонил, дипропиламиносульфонил, N-(н-бутил)-N-метиламиносульфонил, ди(н-пентил)аминосульфонил и тому подобное.
Термин "C1-6-алкилсульфинил", используемый здесь, относится к одновалентному заместителю, содержащему неразветвленную или разветвленную C1-6-алкильную группу, связанную через сульфинильную группу (-S(=O)-), такому как, например, метилсульфинил, этилсульфинил, изопропилсульфинил, бутилсульфинил, пентилсульфинил и тому подобное.
Термин "C1-6-алкилкарбониламино", используемый здесь, относится к аминогруппе, где один из атомов водорода замещен ацильной группой, такой как, например, ацетамидо, пропионамидо, изопропилкарбониламино и тому подобное.
Термин "(C3-6-циклоалкил)-C1-6-алкил", используемый здесь, отдельно или в комбинации, относится к неразветвленной или разветвленной насыщенной углеводородной цепи, содержащей от 1 до 6 атомов углерода и монозамещенной C3-6-циклоалкильной группой, причем циклоалкильная группа необязательно моно- или полизамещена C1-6-алкилом, галогеном, гидрокси или C1-6-алкокси, такой как, например, циклопропилметил, (1-метилциклопропил)метил, 1-(циклопропил)этил, циклопентилметил, циклогексилметил и тому подобное.
Термин "арилтио", используемый здесь, отдельно или в комбинации, относится к арильной группе, связанной через двухвалентный атом серы, имеющей свободную валентную связь от атома серы, причем арильная группа необязательно моно- или полизамещена C1-6-алкилом, галогеном, гидрокси или C1-6-алкокси, например фенилтио, (4-метилфенил)тио, (2-хлорфенил)тио и тому подобное.
Термин "арилсульфинил", используемый здесь, относится к арильной группе, связанной через сульфинильную группу (-S(=O)-), причем арильная группа необязательно моно- или полизамещена C1-6-алкилом, галогеном, гидрокси или C1-6-алкокси, такой как, например, фенилсульфинил, (4-хлорфенил)сульфинил и тому подобное.
Термин "арилсульфонил", используемый здесь, относится к арильной группе, связанной через сульфонильную группу, причем арильная группа необязательно моно- или полизамещена C1-6-алкилом, галогеном, гидрокси или C1-6-алкокси, такой как, например, фенилсульфонил, тозил и тому подобное.
Термин "C1-6-моноалкиламинокарбонил", используемый здесь, относится к одновалентному заместителю, содержащему C1-6-моноалкиламиногруппу, связанную через карбонильную группу, такому как, например, метиламинокарбонил, зтиламинокарбонил, н-пропиламинокарбонил, изопропиламинокарбонил, н-бутиламинокарбонил, втор-бутиламинокарбонил, изобутиламинокарбонил, трет-бутиламинокарбонил, н-пентиламинокарбонил, 2-метилбутиламинокарбонил, 3-метилбутиламинокарбонил, 4-метилпентиламинокарбонил, неопентиламинокарбонил, н-гексиламинокарбонил и 2,2-диметилпропиламинокарбонил.
Термин "C1-6-диалкиламинокарбонил", используемый здесь, относится к одновалентному заместителю, содержащему C1-6-диалкиламиногруппу, связанную через карбонильную группу, такому как диметиламинокарбонил, N-этил-N-метиламинокарбонил, диэтиламинокарбонил, дипропиламинокарбонил, N-(н-бутил)-N-метиламинокарбонил, ди(н-пентил)аминокарбонил и тому подобное.
Термин "C1-6-моноалкиламинокарбониламино", используемый здесь, относится к аминогруппе, где один из атомов водорода замещен C1-6-моноалкиламинокарбонильной группой, например метиламинокарбониламино, этиламинокарбониламино, н-пропиламинокарбониламино, изопропиламинокарбониламино, н-бутиламинокарбониламино, втор-бутиламинокарбониламино, изобутиламинокарбониламино, трет-бутиламинокарбониламино и 2-метилбутиламинокарбониламино.
Термин "C1-6-диалкиламинокарбониламино", используемый здесь, относится к аминогруппе, где один из атомов водорода замещен C1-6-диалкиламинокарбонильной группой, такой как диметиламинокарбониламино, N-этил-N-метиламинокарбониламино, диэтиламинокарбониламино, дипропиламинокарбониламино, N-(н-бутил)-N-метиламинокарбониламино, ди-(н-пентил)аминокарбониламино и тому подобное.
Термин "5- или 6-членное азотсодержащее кольцо", используемый здесь, относится к одновалентному заместителю, содержащему моноциклическую ненасыщенную или насыщенную систему, содержащую один или несколько атомов азота и имеющую 5 или 6 членов, например пирролидинил, пирролинил, имидазолидинил, пиразолидинил, пиразолинил, пиперидил, пиперазинил, пирролил, 2Н-пирролил, имидазолил, пиразолил, триазолил, пиридил, пиразинил, пиримидинил, пиридазинил, морфолино, тиоморфолино, изотиазолил, изоксазолил, оксазолил, оксадиазолил, тиадиазолил, 1,3-диоксоланил и 1, 4-диоксоланил.
В объем изобретения включаются все оптические изомеры соединений формулы I, некоторые из которых оптически активны, а также их смеси, включая их рацемические смеси.
В предпочтительном осуществлении изобретения соединения общей формулы I выбирают из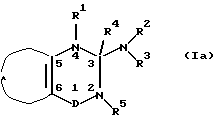
где R1 и R5 независимо представляют водород; гидрокси; C1-6-алкокси или C1-6-алкил, C3-6-циклоалкил, C2-6-алкенил или C2-6-алкинил, необязательно моно- или полизамещенный галогеном, и R4 представляет водород или
R4 вместе с R5 представляют одну из связей в двойной связи между атомами 2 и 3 формулы I и R1 такой, как определено выше, или
R4 вместе с R1 представляют одну из связей в двойной связи между атомами 3 и 4 формулы I и R5 такой, как определено выше;
D представляет -S(=O)2- или -S(=O)-.
В другом предпочтительном осуществлении изобретения соединение общей формулы I выбирают из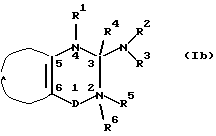
где R1 представляет водород; гидрокси; C1-6-алкокси или C1-6-алкил, C3-6-циклоалкил, C2-6-алкенил или C2-6-алкинил, необязательно моно- или полизамещенный галогеном, и R4 представляет водород или R4 вместе с R1 представляют одну из связей в двойной связи между атомами 3 и 4 формулы I;
D представляет -S(=O)R10=,
где R10 представляет C1-6-алкил; арил или гетероарил, необязательно моно- или полизамещенный галогеном, гидрокси, C1-6-алкокси, арилокси, арилалкокси, нитро, амино, C1-6-моноалкил- или диалкиламино, циано, ацилом или C1-6-алкоксикарбонилом.
В другом предпочтительном осуществлении изобретения с оединение общей формулы I выбирают из
где R1, R5 и R6 независимо представляют водород; гидрокси; C1-6-алкокси или C1-6-алкил, C3-6-циклоалкил, C2-6-алкенил или C2-6-алкинил, необязательно моно- или поли замещенный галогеном, и R4 представляет водород или
R4 вместе с R5 представляют одну из связей в двойной связи между атомами 2 и 3 формулы I и R1 и R6 такие, как определено выше, или
R4 вместе с R1 представляют одну из связей в двойной связи между атомами 3 и 4 формулы I и R5 и R6 такие, как определено выше;
D представляет -S(=O)2- или -S(=O)-.
Предпочтительной общей формулой I является формула (Ia).
В другом предпочтительном осуществлении D представляет -S(=O)2-.
В другом предпочтительном осуществлении изобретения R1 выбирают из группы, включающей водород, C1-6-алкил, C3-6-циклоалкил и C2-6-алкенил. Предпочтительно R1 представляет водород или C1-6-алкил.
В другом предпочтительном осуществлении изобретения R1 вместе с R4 представляют одну из связей в двойной связи между атомами 3 и 4 формулы I.
В другом предпочтительном осуществлении изобретения R4 вместе с R5 представляют одну из связей в двойной связи между атомами 2 и 3 формулы I.
В другом предпочтительном осуществлении изобретения R2 выбирают из группы, включающей водород, гидрокси, C1-6-алкил, C3-6-циклоалкил и C2-6-алкенил.
В другом предпочтительном осуществлении изобретения R3 выбирают из R11, -OR11, -NR11R12 или арила, причем арильная группа необязательно замещена C1-6-алкилом; где R11 представляет водород; C3-6-циклоалкил; (C3-6-циклоалкил)-C1-6-алкил; 3-6-членную насыщенную циклическую систему, содержащую один, два или три атома азота, кислорода или серы, или неразветвленный или разветвленный C1-18-алкил, необязательно замещенный галогеном, гидрокси, C1-6-алкокси, C1-6-алкилтио, C3-6-циклоалкилом или арилом; R12 представляет водород, C1-6-алкил или C3-6-циклоалкил или R11 и R12 вместе с атомом азота образуют 4-6-членное кольцо, предпочтительно 1-пирролидил, пиперидино или морфолино.
Еще в одном предпочтительном осуществлении изобретения R3 выбирают из группы, включающей вторичный C3-6-алкил, третичный C4-6-алкил, C3-6-циклоалкил или (C3-6-циклоалкил)метил, необязательно моно- или полизамещенный C1-6-алкилом, галогеном, гидрокси или C1-6-алкокси. R3 предпочтительно выбирают из группы, включающей изопропил, 1-метилпропил, 2-метилпропил, трет-бутил, 1,1-диметилпропил, 1,2-диметилпропил, 1,2,2-триметилпропил, 2,3-диметилбутил, 1-этилпропил, 1-этил-2-метилпропил, 1-этил-2,2-диметилпропил, 2,3,3-триметилбутил, 2-метилбутил, циклопропил, 1-метилциклопропил, циклобутил, циклопентил, циклогексил, циклопропилметил, 1-(циклопропил)этилциклобутилметил, циклопентилметил иди циклогексилметил.
В дальнейшем предпочтительном осуществлении изобретения R2 и R3 вместе с атомом азота образуют шестичленное кольцо, необязательно замещенное в 2-положении C1-6-алкильной группой, предпочтительно выбранной из метила, этила или изопропила. Предпочтительным шестичленным кольцом является кольцо пиперидина, пиперазина, морфолина или тиоморфолина.
В другом предпочтительном осуществлении изобретения R10 выбирают из C1-6-алкила, фенила или пиридила.
В другом предпочтительном осуществлении изобретения R7, R8, R9 независимо представляют водород; галоген; C1-12-алкил; C3-6-циклоалкил; циано; цианометил; пергалогенметил; сульфамоил; C1-6-алкилтио; C1-6-алкилсульфонил; C1-6-алкилсульфинил; арилтио, арилсульфинил, арилсульфонил, причем арильная группа необязательно моно- или полизамещена C1-6-алкилом, галогеном, гидрокси или C1-6-алкокси; C1-6-алкоксикарбонил-C1-6-алкил; карбамилметил; карбокси-C1-6-алкил; арилокси; (1,2,4-оксадиазол-5-ил)- или (1,2,4-оксадиазол-3-ил) C1-6-алкил, причем оксадиазолильная группа необязательно замещена C1-6-алкилом или C3-6-циклоалкилом; ацил или 5- 6-членное азотсодержащее кольцо, необязательно замещенное фенилом или C1-6-алкилом.
Предпочтительными соединениями являются:
1,1-диоксид 3-гидразино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-бензиламино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(R)-(1-фенилэтиламино)-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(S)-(1-фенилэтиламино)-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-бензиламино-7-хлор-4Н-пиридо[2,3-е]-1,2,4-тиадиазина;
1,1-диоксид 7-хлор-3-(R)-(1-фенилэтиламино)-4Н-пиридо[2,3-е]-1,2,4-тиадиазина;
1,1-диоксид 7-хлор-3-(S)-(1'-фенилэтиламино)-4Н-пиридо[2,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-бензиламино-4Н-пиридо[2,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(R)-(1-фенилэтиламино)-4Н-пиридо[2,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(S)-(1-фенилэтиламино)-4Н-пиридо[2,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-гексиламино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 7-хлор-3-гексиламино-4Н-пиридо[2,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-октиламино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 7-хлор-3-октиламино-4Н-пиридо[2,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-аллиламино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-аллиламино-7-хлор-4Н-пиридо[2,3-е]-1,2,4-тиадиазина;
1,1-диоксид 7-хлор-3-(2-метокси-1-метилэтил)амино-4Н-пиридо[2,3-е] -1,2,4-тиадиазина;
1,1-диоксид 3-(2-метокси-1-метилэтил)амино-4Н-пиридо[4,3-е] -1,2,4-тиадиазина;
1,1-диоксид 3-(2-гидрокси-1-метилэтил)амино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-бензиламино-2-метил-2Н-пиридо[4,3-е]-1,2,4-тиадиазина;
4,4-Диоксид 2-изопропиламино-3,3-диметокси-3Н-пиридо[2,3-b][1,4]тиазина;
1,1-диоксид 3-метоксиамино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-этоксиамино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-циклопропилметоксиамино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-изопропоксиамино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-изобутоксиамино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-бутоксиамино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-циклопентилоксиамино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-аллилоксиамино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-бензилоксиамино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(2-фенилэтокси)амино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(2-метилгидразино)-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(2-этилгидразино)-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(2-изопропилгидразино)-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(2-метил-2-этилгидразино)-4Н-пиридо(4,3-е] -1,2,4-тиадиазина;
1,1-диоксид 3-(2-метил-2-изопропилгидразино)-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(2,2,2-трифторэтил)амино-4Н-пиридо[4,3-е] -1,2,4-тиадиазина;
1,1-диоксид 3-(1,1,1,3,3,3-гексафтор-2-пропил)амино-4Н-пиридо[4,3-е] -1,2,4-тиадиазина;
1,1-диоксид 3-(2-(1,1-бис(трифторметил)пропил))амино-4Н-пиридо-[4,3-е] -1,2,4-тиадиазина;
1,1-диоксид 3-(1-метил-2,2-дифторпропил)амино-4Н-пиридо[4,3-е] -1,2,4-тиадиазина;
1,1-диоксид 3-(1-метил-2,2-дицианоэтил)амино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(2-бицикло[2,2,2] октил)амино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(2-адамантиламино)-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(1-адамантиламино)-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(3-хинуклидинил)амино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(1,5-диметилгексил)амино-4Н-пиридо[4,3-е] -1,2,4-тиадиазина;
1,1-диоксид 3-(3-метилгексил)амино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина;
1,1-диоксид 3-(3-метилбутил)амино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина.
Соединения настоящего изобретения взаимодействуют с калиевыми каналами и поэтому действуют в качестве открывателей или блокаторов АТФ-регулируемых калиевых каналов, что делает их полезными при лечении различных болезней сердечно-сосудистой системы, например церебральной ишемии, гипертензии, ишемических болезней сердца, стенокардии и коронарных болезней сердца, легочной системы; желудочно-кишечной системы; центральной нервной системы и эндокринной системы.
Поскольку некоторые КАТФ-открыватели способны создавать антагонизм вазоспазмам базальных или церебральных артерий, соединения настоящего изобретения можно использовать для лечения вазоспастических нарушений, таких как субарахноидальное кровоизлияние и мигрень.
Открыватели калиевых каналов гиперполяризуют нейроны и ингибируют выделение трансмиттеров, предполагается, что настоящие соединения можно использовать для лечения различных болезней центральной нервной системы, например эпилепсии, ишемии и нейродегенеративных болезней, и для устранения боли.
Благодаря действию на калиевые каналы центральной нервной системы соединения настоящего изобретения можно использовать для лечения различных неврологических и психиатрических болезней, таких как болезнь Альцгеймера, эпилепсия и церебральная ишемия.
Соединения настоящего изобретения можно также использовать для лечения болезней, связанных с пониженным кровотоком в скелетных мышцах, таких как болезнь Reynauds и перемежающаяся хромота.
Кроме того, соединения изобретения можно использовать для лечения хронических болезней дыхательных путей, включая астму, и для лечения нестабильности мускулатуры мочевого пузыря, осуществляющей его опорожнение, побочной к синдрому инфравезикальной обструкции, и, следовательно, для почечных камней путем содействия их прохождению по мочеточнику. Открыватели калиевых каналов также релаксируют гладкие мышцы мочевого пузыря, поэтому соединения настоящего изобретения можно использовать для лечения недержания мочи.
Настоящие соединения можно также использовать для лечения состояний, связанных с расстройством желудочно-кишечной подвижности, таких как синдром раздраженной толстой кишки. Дополнительно эти соединения можно использовать для лечения преждевременных родов и дисменореи.
Кроме того, открыватели калиевых каналов стимулируют рост волос, следовательно, соединения настоящего изобретения можно использовать для лечения облысения.
В болезнях, таких как гиперплазия панкреатических островков и инсулинома, при которых гиперсекреция инсулина вызывает тяжелую гипергликемию, соединения настоящего изобретения можно использовать для снижения секреции инсулина. При ожирении очень часто встречаются гиперинсулинемия и инсулиновая резистентность. Это состояние может привести к развитию инсулиннезависимого диабета (NIDDM). Предполагается, что открыватели калиевых каналов и, следовательно, соединения настоящего изобретения можно использовать для снижения гиперинсулинемии и тем самым для профилактики диабета и снижения ожирения. При явном NIDDM лечение гиперинсулинемии открывателями калиевых каналов и, следовательно, настоящими соединениями может оказать благоприятное воздействие на восстановление глюкозной восприимчивости и нормальной секреции инсулина.
В случаях ранних стадий инсулинзависимого диабета (IDDM) или в преддиабетических случаях открыватели калиевых каналов и, следовательно, настоящие соединения можно использовать для индуцирования покоя бета-клеток, который может предотвратить развитие аутоиммунной болезни.
Соединения настоящего изобретения, которые действуют как блокаторы катф-каналов, можно использовать для лечения NIDDM.
Соединения настоящего изобретения можно использовать предпочтительно для лечения или профилактики болезней эндокринной системы, таких как гиперинсулинемия и диабет.
В соответствии с этим в другом аспекте изобретение относится к соединению общей формулы I или его фармацевтически приемлемой кислотно-аддитивной соли для использования в качестве терапевтически приемлемого вещества, предпочтительно для использования в качестве терапевтически приемлемого вещества для лечения гиперинсулинемии и лечения или профилактики диабета.
Кроме того, изобретение относится также к использованию заявленных соединений формулы I в качестве лекарственных средств, полезных для лечения гиперинсулинемии и лечения или профилактики диабета.
Еще в одном аспекте настоящее изобретение относится к способам получения вышеупомянутых соединений. Способ заключается в:
а) реакции соединения формулы II
где А, В, D, R1 и R4 такие, как определено выше, и Z представляет уходящую группу, такую как имидазол-1-ил, алкокси, алкилтио, галоген, предпочтительно хлор, бром, йод, триметиламино или метилсульфонил,
с соединением формулы III
где R2 и R3 определены выше,
для образования соединения общей формулы I с использованием методик, описанных, например, Т. Н. Cronon et al., J. Med. Chem. 11, 136 (1968); L. Raffa et al. , Farmaco Ed. Sci, 29, 411 (1974); В. Pirotte et al., J. Med. Chem. 36, 3211 (1993).
Другой способ предусматривает:
б) реакцию соединения формулы IV
где R1 представляет водород и А, В, D и Х такие, как определено выше, или В представляет NH и R1, A, D и Х такие, как определено выше,
с соединением формулы III или с его подходящей солью в присутствии P2O5 и высококипящего третичного амина или его подходящей соли с использованием методики, описанной Jensen K.G. and Pedersen E.B., Chem. Scr., 20, 248-250 (1988) and Andersen L., Nielsen F.E. and Pedersen E.B, Chem. Scr., 29, 45-49 (1989), для образования соединения общей формулы I,
в) реакцию соединения формулы IV
где R1 представляет водород и А, В, D и Х такие, как определено выше, или В представляет NH и R1, А, D и Х такие, как определено выше,
с соединением формулы III или с его подходящей солью в присутствии тетрахлорида титана и растворителя, с которым он может образовать комплекс, возможно, например, тетрагидрофурана или смеси толуола и анизола, по методам, описанным в R. I. Fryer, J.V. Earley, G.F. Field, W. Zally and L.H. Stembach, J. Org. Chem., 34, 1143-1145 (1969); J.B. Press et al., J. Med. Chem. 22, 725-731 (1979); G. Roma et al., Eur. J. Med. Chem. 26, 489-496 (1991), для образования соединения общей формулы I,
г) реакцию соединения формулы V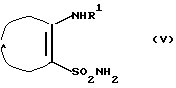
где R1 и А такие, как определено выше,
с соединением формулы VI
R3NCO (VI)
где R3 такой, как определено выше,
с использованием метода, описанного Chern J.W. et al., J. Heterocycl. Chem., 27, 1909-1915 (1990), для образования соединения общей формулы I, где D представляет SO2, В представляет >NR5, R2 представляет Н и R4 и R5 вместе образуют связь,
д) реакцию соединения формулы V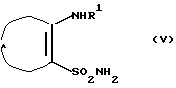
где R1 и А такие, как определено выше,
с соединением формулы VII
R3NHC(=O)Cl (VII)
где R3 такой, как определено выше,
с использованием метода, описанного Chern J.W. et al., J. Heterocycl. Chem., 27, 1909-1915 (1990), для образования соединения общей формулы I, где D представляет SО2, В представляет >NR5, R2 представляет Н и R4 и R5 вместе образуют связь,
е) реакцию соединения формулы V
где R1 и А такие, как определено выше,
с соединением формулы VIII
где Y представляет NH или S,
или с его подходящей солью с использованием методик, описанных Kotovskaya S. K. et al., Khim. - Farm. Zh., 13, 54-57 (русск.) (1979) and Topliss J. G et al., J. Org. Chem, 28, 2313 (1963), для образования соединения общей формулы I, где D представляет SО2, В представляет >NR5, R4 и R5 вместе образуют связь и R2 и R3 представляют Н.
Исходные материалы являются либо известными соединениями, либо соединениями, которые можно получить по аналогии с получением известных соединений или по аналогии с известными методами, как описано, например, Huang B. -S. , et al., J. Med. Chem., 23, 575-7 (1980), Ofitserov V.I. et al., Khim. Geterotsikl. Soedin. , 1119-22 (русск.) (1976), Topliss J. G., U.S. 3641017 (1972), Kotovskaya S.K. et al., Khim.-Farm. Zh., 13, 54-57 (русск.) (1979), Meyer R. F., J. Heterocycl. Chem., 6, 407-408 (1969) and Hattori M., Yoneda M. , and Goto M., Bull Chem. Soc. Jap., 46, 1890-1 (1973), Williams T.R. and Cram D. J., J. Org. Chem., 38, 20-26 (1973), Bames А.С., Kennewell P.D. and Taylor J. B., J. Chem. Soc. Chem. Commun., 1973, 776-777, Stoss and Satzinger, Chem. Ber. , 109, 2097 (1976), Kresze G., Hatjiissaak A., Phosphorus Sulfur, 29, 41-47 (1987), Dillard R.D., Yen T.T., Stark R, Pavey D.E., J. Med. Chem., 23, 717-722 (1980).
Фармакологические способы
Способность соединений взаимодействовать с калиевыми каналами можно определить различными способами. Когда используют методики открытия-закрытия (Hamill О.Р., Marty A., Nefer Е., Sakman В. and Sigworth P.J., Plugers Arch. , 391, 85-100 (1981)), можно зарегистрировать ионный ток через отдельный канал клетки.
Активность соединений в качестве открывателей калиевых каналов можно также измерить методом релаксации колец аорт крыс по следующей методике:
Участок грудной аорты крыс между дугой аорты и диафрагмой рассекают и приготовляют в виде препаратов колец, как описывается Taylor P.D. et al., Brit. J. Pharmacol, 111, 42-48 (1994).
После 45 мин периода равновесия при напряжении 2 г препараты сокращались до величины 80% от максимальной ответной реакции с использованием требуемой концентрации фенилэфрина. Когда ответная реакция на фенилэфрин достигала плато, в ванну в небольших объемах с интервалами 2 мин кумулятивно добавляли потенциальные сосудорасширяющие агенты с использованием половинных логарифмических молярных количеств. Релаксацию выражали как процент сокращенного напряжения. Активность соединения выражали как концентрацию, требуемую для индуцирования 50% релаксации ткани.
В панкреатической /-клетке открытие КАТФ-каналов можно определить путем измерения последующего изменения в концентрации цитоплазматического свободного Сa2+ по способу Arkhammer P. et al., J. Biol. Chem., 262, 5448-5454 (1987).
Вытекание 86Rb+ из β-клеточной линии
Клеточную линию RIN 5F культивировали в среде RPMI 1640 с Glutamax I, дополненной 10% фетальной телячьей сывороткой (от GibcoBRL, Scotland, UK) и выдерживаемой в атмосфере смеси 5% СO2/95% воздуха при 37oС. Клетки отделяли раствором трипсин-ЭДТА (от GibcoBRL, Scotland, UK), ресуспендировали в среде, добавляли 1 мКи/мл 86Rb+ и пересевали в титрационные микропланшеты (кластер с 96 лунками 3596, стерильный, от Costar Corporation, MA, USA) при плотности 50000 клеток/лунку в 100 μл/лунку и культивировали 24 часа до использования в анализе.
Микропланшеты промывали 4 раза буфером Рингера (150 мМ NaCl, 10 мМ HEPES, 3,0 мМ КСl 1,0 мМ CaCl2, 20 мМ сахарозы, рН 7,1). Добавляли восемьдесят мкл буфера Рингера и 1 мкл контрольного или испытуемого соединения, растворенного в ДМСО. После инкубирования 1 ч при комнатной температуре с крышкой 50 мкл супернатанта переносили в Pico Plates (Packard Instrument Company, CT, USA) и добавляли 100 мкл MicroScint 40 (Packard Instrument Company, CT, USA). Обсчет микропланшетов проводили в TopCount (Packard Instrument Company, CT, USA) со скоростью 1 мин/лунку в программе 32Р.
Вычисление ЕС50 и Emax проводили при помощи SlideWrite (программное обеспечение приведенных графиков. Inc., CA, USA) с использованием расчетной кривой с четырьмя параметрами: у=(а-d)/(1+(х/с)b)+d, где а - активность, оцененная при нулевой концентрации, b - фактор наклона, с - концентрация в середине кривой и d - активность, оцененная при бесконечной концентрации. EC50= с и Еmах=d, когда кривая поворачивается при бесконечной концентрации (cм. таблицу).
Измерение выделения инсулина из инкубированных панкреатических островков, выделенных коллагеназным способом из накормленных самок белых крыс Wistar
Группы из 10 островков, каждый из которых получали из одной и той же партии островков, предварительно инкубировали в течение 30 мин при 37oС в 1 мл забуференного бикарбонатом раствора (в мМ: 115 NaCl, 5 KCl, 2,56 СаСl2, 1 MgCl2, 24 NаНСО3), дополненного 2,8 мМ глюкозы, 0,5% (масс./об.) диализованного альбумина (фракция V, Sigma Chemical Co), и уравновешивали относительно смеси О2 (95%) и СO2 (5%). Группы из 10 островков затем инкубировали при 37oС в течение дополнительных 90 мин в 1 мл той же забуференной бикарбонатом среде, содержащей 16,7 мМ глюкозы и, кроме того, выбранные испытуемые соединения.
В этой методике одновременно инкубируют от 6 до 8 серий из 10 лабораторных стаканов. В каждой серии 8 стаканов содержат группы из 10 островков и 2 стакана рассматриваются как контрольные стаканы (обработаны таким же образом, содержат физиологическую среду, но без островков). Чтобы обеспечить гомогенное распределение островков среди различных серий, собранные островки помещают последовательно в один из стаканов каждой серии. Первую и последнюю серии из 10 стаканов (8 стаканов с островками, 2 стакана без островков в каждой серии) инкубируют в присутствии 16,7 мМ глюкозы (без добавленного фармакологического соединения; эти серии рассматривают в качестве контрольных серий). 4-6 других серий из 10 стаканов инкубируют в среде 16,7 мМ глюкозы, обогащенной выбранным фармакологическим соединением (либо различные соединения, либо 1 или 2 соединения, испытываемые при различных концентрациях). После инкубации среду для инкубации удаляют из стакана пипеткой Пастера и хранят при -20oС. Выделение инсулина измеряют радиоиммунологически с использованием инсулина крыс в качестве стандарта. Эксперименты повторяют 2-4 раза, в различные дни (что подразумевает применение 2-4 различных источников панкреатических островков).
Связанные с островками вариации (вариации в абсолютных величинах для секреции инсулина от одного до другого иммуноанализа) приводили нас к выражению скорости секреции относительно контрольной величины (100% = средние абсолютные величины первой и последней серии стаканов в каждом эксперименте: контрольная серия). Таким образом, для каждой экспериментальной серии абсолютные величины выражают в виде % от контрольных условий в том же самом эксперименте.
При концентрации 50 мкМ некоторые соединения сильно ингибируют выделение инсулина:
соединения - % остаточного выделенного инсулина
1 - 75
3 - 17,5
6 - 52,3
Соединения по изобретению эффективны в широком диапазоне доз. В общем, удовлетворительные результаты получают с дозами от около 0,05 до около 1000 мг, предпочтительно от около 0,1 до около 500 мг, в день. Более предпочтительная доза составляет от около 5 мг до около 200 мг в день. Точная доза будет зависеть от способа введения, формы, в которой ее вводят, субъекта, которого нужно лечить, массы тела субъекта, которого нужно лечить, и предпочтительной пользы врача или ветеринара.
Путь введения может быть любым путем, который эффективно переносит активное соединение к подходящему или желаемому месту действия, таким как пероральный или парентеральный, например ректальный, чрескожный, подкожный, внутривенный, внутримышечный или интраназальный, причем предпочтителен пероральный путь.
Типичные композиции включают соединение формулы I или его фармацевтически приемлемую кислотно-аддитивную соль, ассоциированную с фармацевтически приемлемым наполнителем, который может быть носителем или разбавителем, или разбавленную носителем или заключенную в носитель, который может быть в форме капсулы, мешочка, бумаги или другого контейнера. При изготовлении композиций можно использовать общепринятые способы получения фармацевтических композиций. Например, активное соединение обычно будут смешивать с носителем или разбавлять носителем или заключать в носитель, который может быть в форме ампулы, капсулы, мешочка, бумаги или другого контейнера. Когда носитель служит в качестве разбавителя, он может быть твердым, полутвердым или жидким материалом, который действует в качестве переносчика, наполнителя или среды для активного соединения. Активное соединение может быть адсорбировано на гранулированном твердом контейнере, например, в мешочке. Некоторыми примерами подходящих носителей являются вода, солевые растворы, спирты, полиэтиленгликоли, полигидроксиэтилированное касторовое масло, желатин, лактоза, амилоза, стеарат магния, тальк, кремниевая кислота, моноглицериды и диглицериды жирных кислот, эфиры пентаэритрита и жирных кислот, гидроксиметилцеллюлоза и поливинилпирролидон. Готовые препаративные формы могут включать также увлажняющие агенты, эмульгирующие и суспендирующие агенты, консервирующие агенты, подслащивающие вещества или корригенты. Готовые препаративные формы изобретения можно изготовить так, чтобы обеспечить быстрое, длительное или замедленное высвобождение активного ингредиента после введения пациенту, путем использования методов, хорошо известных в данной области.
Фармацевтические препараты можно стерилизовать и, если желательно, смешать с вспомогательными агентами, эмульгаторами, солью для оказания влияния на осмотическое давление, буферами и/или окрашивающими веществами и тому подобное, которые не реагируют с активными соединениями с ухудшением их качества.
Для парентерального применения особенно пригодны инъецируемые растворы или суспензии, предпочтительно водные растворы с активным соединением, растворенным в полигидроксилированном касторовом масле.
Таблетки, драже или капсулы, содержащие тальк и/или углеводный носитель или связующее или тому подобное, особенно пригодны для перорального применения. Предпочтительные носители для таблеток, драже или капсул включают лактозу, кукурузный крахмал и/или картофельный крахмал. Сироп или эликсир можно использовать в случаях, где можно применять подслащенный наполнитель.
Типичную таблетку, подходящую для использования в этом способе, можно получить общепринятыми методами таблетирования, она содержит:
Активное соединение, мг - 5,0
Лактоза, мг Ph. Eur - 67,8 мг
Aвицел®, мг - 31,4
Амберлит® ,мг - 1,0
Стеарат магния, мг Ph. Eur. - 0,25
Вследствие высокой степени их активности, соединения изобретения можно вводить животному, нуждающемуся в таком лечении, профилактике, облегчении или уменьшении интенсивности симптомов различных болезней, упоминаемых выше, и особенно болезней эндокринной системы, таких как гиперинсулинемия и диабет. Такие животные включают как домашних животных, например комнатных животных, так и недомашних животных, таких как дикие животные. Предпочтительным животным является млекопитающее, особенно человек.
ПРИМЕРЫ
Способ получения соединений формулы I и содержащих их препаратов далее иллюстрируется следующими примерами, которые тем не менее не должны истолковываться как ограничение изобретения.
ПРИМЕР 1
Получение промежуточных продуктов
Моногидрат 1,1-диоксида 3-метилсульфанил-4Н-пиридо[4,3-е]-1,2,4-тиадиазина
Соединение I получали по опубликованной методике (В. Pirotte et. al., J. Med. Chem., 1993, 36, 3211-3213).
1,1-диоксид 7-хлор-3-(имидазол-1-ил)-4Н-пиридо[2,3-е]-1,2,4-тиадиазина
Раствор 2-амино-5-хлорпиридин-3-сульфонамида (8,0 г) и тиокарбонилдиимидазола (20,5 г) в диоксане (80 мл) и ДМФ (20 мл) кипятили с обратным холодильником в течение 3 ч. Реакцию контролировали ТСХ. Когда реакция завершалась, растворители удаляли при пониженном давлении. Остаток растворяли в водном растворе NaOH (4 г в 150 мл воды). Раствор быстро превращался в суспензию натриевой соли указанного в заголовке соединения. Соль собирали фильтрованием и промывали небольшим объемом воды. Соль растворяли в воде (200 мл), обрабатывали углем, фильтровали и устанавливали рН фильтрата 5-6 при помощи 1 н. НСl. Осадок собирали фильтрованием, промывали водой и сушили (выход 8,8 г); т.пл. 330-331oС (соединение II).
1,1-Диоксид 3-(имидазол-1-ил)-4Н-пиридо[2,3-е]-1,2,4-тиадиазина
Использовали такую же методику, как описана для соединения II, исходя из 2-амидопиридин-3-сульфонамида (5,0 г) и тиокарбонилдиимидазола (13 г), за исключением того, что натриевая соль не осаждалась после добавления NaOH. Щелочной раствор обрабатывали углем, фильтровали и рН фильтрата устанавливали 5-6 при помощи 1 н. НСl. Осадок собирали фильтрованием, промывали водой и сушили (выход 4,8 г); т.пл. 312-314oС (соединение III).
1,1-Диоксид 2-метил-3-тиоксо-2,3-дигидро-4Н-пиридо[4,3-е]-1,2,4-тиадиазина
Раствор N-метил-4-аминопиридин-3-сульфонамида (de Tullio et al., Tetrahedron 1995, 3221-3234) (5,0 г) и тиокарбонилдиимидазола (7,5 г) в диоксане (30 мл) и ДМФ (15 мл) нагревали при 90oС в течение 2 ч. Растворители удаляли перегонкой при пониженном давлении. Остаток диспергировали в 0,6 н. NaOH (20 мл) и перемешивали в течение 30 мин. Щелочной раствор обрабатывали углем, фильтровали и рН фильтрата устанавливали 4-5. Осадок собирали фильтрованием, промывали водой и сушили (выход 4 г); т.пл. 195-198oС (соединение IV).
1,1-Диоксид 2-метил-3-метилсульфанил-2Н-пиридо[4,3-е]-1,2,4-тиадиазина
Раствор 1,1-диоксида 2-метил-3-тиоксо-2,3-дигидро-4Н-пиридо[4,3-е] -1,2,4-тиадиазина (1,0 г) в ацетонитриле (20 мл) дополняли карбонатом калия (1,0 г), затем метилиодидом (1 мл). После выдерживания 1 час при комнатной температуре растворитель удаляли перегонкой при пониженном давлении. Остаток диспергировали в воде (50 мл) и муравьиной кислотой устанавливали рН суспензии 5. Нерастворимый материал собирали фильтрованием, промывали водой и сушили (выход 0,8 г); т.пл. 135-138oС (соединение V).
1Н-Пиридо[2,3-b][1,4]тиазин-2(3Н)-тион
Тионирование 1H-пиридо[2,3-b] [1,4] тиазин-2(3Н)-она (получен согласно Dunn and Norrie, J. Prakt. Chem. 1990, 332 (4) 444-452) пентасульфидом фосфора в толуоле стандартными методиками (см., например, Н. Tawada et al., Chem. Pharm. Bull. 1990, 38, 1238-1245) давало указанное в заголовке соединение; т.пл. 233-234oС (соединение VI).
2-Изопропиламино-3Н-пиридо[2,3-b][1,4]тиазин
1Н-Пиридо[2,3-b] [1,4] тиазин-2(3Н)-тион (0,5 г) растворяли в 10 мл изопропиламина и оставляли стоять в течение 45 мин при комнатной температуре. Затем избыток амина удаляли в вакууме и твердый остаток растворяли в 25 мл смеси этилацетат/метанол (4:1), обрабатывали углем и фильтровали через подушку диоксида кремния. Фильтр элюировали 2•10 мл смеси этилацетат/метанол (4: 1). Фильтрат выпаривали и медленно кристаллизуемый остаток растирали с 5 мл этилацетата и затем 3 мл диэтилового эфира. Кристаллы отделяли фильтрованием и сушили, получая указанное в заголовке соединение; т.пл. 135-139oС (соединение VII).
ПРИМЕР 2
1,1-диоксид 3-гидразино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина
Моногидрат 1,1-диоксида 3-метилсульфанил-4Н-пиридо[4,3-е]-1,2,4-тиадиазина (1,0 г) добавляли к гидразингидрату (0,8 мл) и смесь нагревали при 70oС в течение 30 мин. После охлаждения реакционную смесь дополняли метанолом (10 мл) и растворители удаляли перегонкой при пониженном давлении. Остаток растворяли в 2М NaOH (20 мл), обрабатывали углем, фильтровали и рН фильтрата устанавливали 6-7 при помощи 1М НСl. Полученный таким образом осадок собирали фильтрованием, промывали водой и сушили (выход 0,8 г); т.пл. 290-292oС (соединение 1).
ПРИМЕР 3
1,1-Диоксид 3-аралкиламино-4Н-1,2,4-пиридотиадиазина
Смесь подходящего предшественника (соединение I, II или III) (0,5 г) и подходящего аралкиламина (2,5 мл) кипятили с обратным холодильником в течение от 30 до 60 мин (до тех пор, пока не завершится реакция; ТСХ). После охлаждения реакционную смесь распределяли между 0,5% водным NaOH (200 мл) и диэтиловым эфиром (100 мл). Водный слой отделяли и обрабатывали углем, затем фильтровали. При помощи муравьиной кислоты устанавливали рН фильтрата 6-7. Получаемый осадок собирали фильтрованием, промывали водой и сушили (выход 70-85%).
Таким путем были получены следующие соединения:
1,1-диоксид 3-бензиламино-4Н-пиридо[4,3-е] -1,2,4-тиадиазина; т. пл. 198-201oС (соединение 2),
1,1-диоксид 3-(R)-(1-фенилэтиламино)-4Н-пиридо[4,3-е]-1,2,4-тиадиазина; т.пл. 236-238oС (соединение 3),
1,1-диоксид 3-(S)-(1-фенилэтиламино)-4Н-пиридо[4,3-е]-1,2,4-тиадиазина; т.пл. 233-235oС (соединение 4),
1,1-диоксид 3-бензиламино-7-хлор-4Н-пиридо[2,3-е] -1,2,4-тиадиазина; т. пл. 244-245oС (соединение 5),
1,1-диоксид 7-хлор-3-(R)-(1-фенилэтиламино)-4Н-пиридо-[2,3-е]-1,2,4-тиадиазина; т.пл. 261-262oС (соединение 6),
1,1-диоксид 7-хлор-3-(S)-(1-фенилэтиламино)-4Н-пиридо-[2,3-е]-1,2,4-тиадиазина; т.пл. 262-265oС (соединение 7),
1,1-диоксид 3-бензиламино-4Н-пиридо[2,3-е] -1,2,4-тиадиазина; т. пл. 232-233oС (соединение 8),
1,1-диоксид 3-(R)-(1-фенилэтиламино)-4Н-пиридо[2,3-е]-1,2,4-тиадиазина; т.пл. 207-210oС (соединение 9),
1,1-диоксид 3-(S)-(1-фенилэтиламино)-4Н-пиридо[2,3-е]-1,2,4-тиадиазина; т.пл. 213-214oС (соединение 10).
ПРИМЕР 4
1,1-Диоксид 3-гексиламино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина
Моногидрат 1,1-диоксида 3-метилсульфанил-4Н-пиридо[4,3-е]-1,2,4-тиадиазина (0,5 г) и гексиламина (5,0 мл) кипятили с обратным холодильником в течение 3-4 ч (до тех пор, пока не завершится реакция; ТСХ) Амин перегоняли при пониженном давлении. Остаток растворяли в 1 н. NaOH (150 мл), обрабатывали углем, фильтровали и муравьиной кислотой устанавливали рН 5-6. Получаемый осадок собирали фильтрованием, промывали водой и сушили (выход 0,38 г), т.пл. 170-171oC (соединение 11).
Подобным же образом было получено следующее соединение: 1,1-диоксид 7-хлор-3-гексиламино-4Н-пиридо[2,3-е] -1,2,4-тиадиазина; т. пл. 176-179oС; из 1,1-диоксида 7-хлор-3-(имидазол-1-ил)-4Н-пиридо[2,3-е] -1,2,4-тиадиазина и гексиламина (Соединение 12).
ПРИМЕР 5
1,1-Ддиоксид 3-октиламино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина
Смесь моногидрата 1,1-диоксида 3-метилсульфанил-4Н-пиридо[4,3-е] -1,2,4-тиадиазина (0,5 г), октиламина (0,5 мл) и м-хлортолуола (3 мл) кипятили с обратным холодильником в течение 2-3 ч (до тех пор, пока не завершится реакция; ТСХ). Большую часть растворителей удаляли перегонкой и остаток диспергировали в смеси воды (30 мл) и метанола (30 мл) и дополняли 10% (масс. /об.) NaOH в воде (2 мл). Смесь обрабатывали углем, фильтровали и при помощи 1 н. НСl устанавливали рН фильтрата 6. Получаемый осадок собирали фильтрованием, промывали водой и сушили (выход 0,29 г); т.пл. 176-179oС (соединение 13).
Подобным же образом было получено следующее соединение: 1,1-диоксид 7-хлор-3-октиламино-4Н-пиридо[2,3-е] -1,2,4-тиадиазина (т. пл. 170-175oС) из 1,1-диоксида 7-хлор-3-(имидазол-1-ил)-4Н-пиридо[2,3-е] -1,2,4-тиадиазина и октиламина (соединение 14).
ПРИМЕР 6
1,1-Диоксид 3-аллиламино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина
Смесь моногидрата 1,1-диоксида 3-метилсульфанил-4Н-пиридо[4,3-е] -1,2,4-тиадиазина (0,5 г) и аллиламина (4 мл) нагревали в герметическом сосуде высокого давления в течение 4-5 ч при 120oС. После охлаждения амин удаляли перегонкой при пониженном давлении. Остаток растворяли в 0,5 н NaOH, обрабатывали углем, фильтровали и при помощи 1 н. НСl устанавливали рН фильтрата 6. Получаемый осадок собирали фильтрованием, промывали водой и сушили, получая указанное в заголовке соединение в виде дигидрата (выход 0,44 г); т.пл. 206-208oС (соединение 15).
Подобным же образом было получено следующее соединение: 1,1-диоксид 3-аллиламино-7-хлор-4Н-пиридо[2,3-е] -1,2,4-тиадиазина (т. пл. 224-227oС) из 1,1-диоксида 7-хлор-3-(имидазол-1-ил)-4Н-пиридо[2,3-е] -1,2,4-тиадиазина и аллиламина (соединение 16).
ПРИМЕР 7
1,1-Диоксид 7-хлор-3-(2-метокси-1-метилэтил)амино-4Н-пиридо-[2,3-е] -1,2,4-тиадиазина
Смесь 7-хлор-3-(имидазол-1-ил)-4Н-пиридо[2,3-е]-1,2,4-тиадиазина (0,5 г) и 2-амино-1-метоксипропана (5 мл) кипятили с обратным холодильником в течение 24 ч. Амин удаляли перегонкой при пониженном давлении. Остаток растворяли в небольшом объеме 0,1 н. NaOH (20 мл), обрабатывали углем, фильтровали и рН фильтрата устанавливали 5-6. Суспензию сохраняли 24 часа при +4oС. Осадок собирали фильтрованием, промывали минимальным количеством воды и сушили (выход 0,25 г); т. пл. 150-156oС (соединение 17).
ПРИМЕР 8
1,1-Диоксид 3-(2-метокси-1-метилэтил)амино-4Н-пиридо-[4,3-е] -1,2,4-тиадиазина
Использовали такую же методику, какая указана выше (за исключением того, что исходным материалом был моногидрат 1,1-диоксида 3-метилсульфанил-4Н-пиридо[4,3-е] -1,2,4-тиадиазина), вплоть до установления рН водного раствора 5-6. Однако в этом случае не происходило осаждения. Затем растворитель удаляли перегонкой при пониженном давлении. Остаток диспергировали в небольшом объеме воды (4 мл). Нерастворимый материал собирали фильтрованием. Твердый продукт диспергировали в ацетоне (30 мл). Нерастворимый материал удаляли фильтрованием. Фильтрат концентрировали при пониженном давлении. Остаток растворяли в небольшом объеме ацетона (3 мл). Через несколько минут появляется мелкозернистый осадок, который собирали фильтрованием, промывали ацетоном и сушили, получая указанное в заголовке соединение в виде моногидрата (выход 0,1 г); т.пл. 174-178oС (соединение 18).
ПРИМЕР 9
1,1-Диоксид 3-(2-гидрокси-1-метилэтил)амино-4Н-пиридо[4,3-е]-1,2,4-тиадиазина
Суспензию моногидрата 1,1-диоксида 3-метилсульфанил-4Н-пиридо[4,3-е]-1,2,4-тиадиазина и 2-амино-1-пропанола (0,75 мл) кипятили с обратным холодильником в течение 90 мин (до завершения реакции; ТСХ). После охлаждения добавление диэтилового эфира (20 мл) вызывало отделение масляного остатка. После декантации эфирного раствора остаток растворяли в метаноле (1 мл) и затем дополняли диэтиловым эфиром (15 мл). Масляный остаток отделялся снова. После декантации супернатанта масляный остаток растворяли в ацетоне (6 мл). Сразу появлялся мелкозернистый осадок. После хранения 3 ч при +4oС получаемый осадок собирали фильтрованием, промывали ацетоном и сушили (выход 0,33 г); т.пл. 213-216oС (соединение 19).
ПРИМЕР 10
1,1-Диоксид 3-бензиламино-2-метил-4Н-пиридо[4,3-е]-1,2,4-тиадиазина
Раствор 1,1-диоксида 2-метил-3-метилсульфанил-4Н-пиридо-[4,3-е]-1,2,4-тиадиазина (0,5 г) и бензиламина (0,5 мл) в диоксане (2,5 мл) кипятили с обратным холодильником до завершения реакции (ТСХ). После охлаждения добавление эфира вызывало осаждение указанного в заголовке соединения. Осадок собирали фильтрованием, промывали эфиром и перекристаллизовали из смеси метанол-эфир (выход 0,4 г); т.пл. 142-146oС (соединение 20).
ПРИМЕР 11
4,4-Диоксид 2-изопропиламино-3,3-диметокси-3Н-пиридо-[2,3-b][1,4]тиазина
К перемешиваемому раствору 2-изопропиламино-3Н-пиридо-[2,3-b][1,4]тиазина (0,10 г) в 2 мл метанола добавляли 2 мл воды. К получаемой мутной смеси в течение 10 минут добавляли оксан (0,59 г) и перемешивание продолжали в течение 1 ч. Затем добавляли 10 мл воды и смесь экстрагировали 3 раза 5 мл дихлорметана. Объединенные экстракты сушили над сульфатом натрия и растворитель удаляли в вакууме. Остаток очищали на колонке с диоксидом кремния с элюированием смесью 9:1 этилацетата и метанола, получая указанное в заголовке соединение; т.пл. 123-126oС; м/е 299 (М+).
1Н ЯМР (СDСl3), δ (м.д.): 7,92 (м, 1Н, 6-Н), 7,39-7,23 (м, 7-Н и остаточный хлороформ), 7,16-7,07 (м, 1Н, 8-Н), 5,79 (шир. д, 1Н, NH), 4,2-4,0 (м, 1Н, СН), 3,66 (с, 3Н, СН3О), 3,57 (с, 3Н, СН3О), 1,35-1,26 (дв. д, 6Н, (СН3)2С) (соединение 21).

Изобретение относится к области органической химии. Описываются производные пиридо-1,2,4-тиадиазина или пиридо-1,4-тиазина общей формулы (I)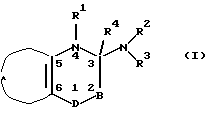
где В представляет >NR5 или >CR5R6, где R5 и R6 независимо могут быть C1-6-алкокси или C1-6-алкилом; D представляет -S(=O)2-; R1 представляет водород и R4 представляет водород или R4 вместе с R5 представляют одну из связей в двойной связи между атомами 2 и 3 формулы I, или R1 вместе с R4 представляют одну из связей в двойной связи между атомами 3 и 4 формулы I, R2 представляет водород; R3 представляет R11, -NR11R12, арилалкил,где R11 представляет водород, неразветвленный или разветвленный C1-18-алкил, возможно моно- или полизамещеный галогеном, гидрокси, C1-6-алкокси или арилом, и R12 представляет водород; А вместе с атомами углерода 5 и 6 тиазина образует кольцо пиридина, выбранное из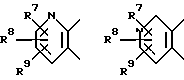

где R7, R8, R9 независимо представляют водород или галоген, при условии, что, когда В представляет NR5, D представляет SO2 и R2 представляет водород, то R3 не может представлять водород или незамещенный C1-6-алкил.Также описывается фармацевтическая композиция, обладающая ингибирующей выделение инсулина активностью, и способ проявления ингибирующей выделение инсулина активности. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами. 4 с. и 13 з.п.ф-лы, 1 табл.

где В представляет >NR5 или >CR5R6, где R5 и R6, независимо, могут быть C1-6-алкокси или C1-6-алкилом;
D представляет -S(= O)2-;
R1 представляет водород и R4 представляет водород или R4 вместе с R5 представляют одну из связей в двойной связи между атомами 2 и 3 формулы I, или R1 вместе с R4 представляют одну из связей в двойной связи между атомами 3 и 4 формулы I;
R2 представляет водород;
R3 представляет R11, -NR11R12, арилалкил, где R11 представляет водород, неразветвленный или разветвленный C1-18-алкил, возможно моно- или полизамещеный галогеном, гидрокси, C1-6-алкокси или арилом; и R12 представляет водород;
А вместе с атомами углерода 5 и 6 тиазина образует кольцо пиридина, выбранное из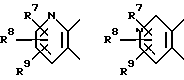
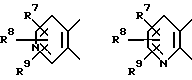
где R7, R8, R9 независимо представляют водород или галоген, при условии, что, когда В представляет NR5, D представляет SO2 и R2 представляет водород, то R3 не может представлять водород или незамещенный C1-6-алкил.
где A, D, R1-R5 такие, как определено выше.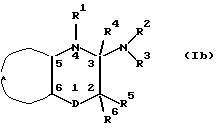
где А, D, R1-R5 такие, как определено выше.
Приоритет по пунктам:
17.01.1996 по пп. 1 и 2, 12-17;
05.03.1996 по пп. 3-17;
16.01.1997 по пп. 11 и 12.
| Сборный инструмент для обработки отверстий | 1976 |
|
SU618209A1 |
| BERNARD PIROTTE et al., "3-(Alkilamino)-4H-pyrido(4,3-e)-1,2,4 - thiadiazine 1,1-dioxides as Powerful Inhibitors of Insulin Release from Ra Pancreatic B-Cells: A new class of Potassium Chamnel Openers" J | |||
| MED | |||
| CHEM., 1993, vol | |||
| Коридорная многокамерная вагонеточная углевыжигательная печь | 1921 |
|
SU36A1 |
| ОТВЕС С ВЫДВИЖНЫМ ЦЕНТРОМ | 1925 |
|
SU3211A1 |
| Устройство для управления преобразователем с многоуровневым выходным напряжением для электропривода | 1986 |
|
SU1368948A1 |
| ПРОИЗВОДНЫЕ БЕНЗАТИАЗИНОВ | 1991 |
|
RU2032679C1 |
Авторы
Даты
2002-11-27—Публикация
1997-01-16—Подача