Изобретение относится к медицине и ветеринарии, в частности к средствам для профилактики и лечения патологических состояний, сопровождающихся токсикозами и снижением общей резистентности организма при вирусных и бактериальных инфекциях, заболеваниях печени, желудочно-кишечного тракта, мочеполовой системы, иммунной системы, стрессах.
Известен иммуномодулятор - метаболик - детоксикант - адаптоген - радиопротектор, представляющий собой экстракт плаценты [1,2].
Иммуномодуляторы - средства для избирательной стимуляции или подавления иммунного ответа, стимуляции естественной резистентности к инфекциям.
Метаболики - вещества, регулирующие углеводный, жировой, белковый, водно-электролитический и другие виды обмена веществ.
Детоксиканты - вещества, обеспечивающие обезвреживание и удаление вредных, токсических и прочих продуктов распада, включая яды, соли тяжелых металлов, радионуклиды и нормализующие нарушенные ими структуры и функции.
Адаптогены - вещества, улучшающие приспособляемость организма к меняющимся внешним условиям и вредным воздействиям среды, помогающие в защите от стрессов.
Радиопротекторы - вещества, обеспечивающие защиту организма от неблагоприятных последствий радиационного поражения, стимулирующие постлучевую выживаемость, обеспечивающие защиту биологических мембран от поражающего действия радиации, стимулирующие восстановление поврежденных облучением структур и функций.
Эти действия известного средства недостаточно выражены, что приводит к снижению эффективности терапии при заболеваниях, сопровождающихся снижением естественной резистентности организма и развитием токсикозов. Коррекция состояний такого рода требует существенного увеличения дозировки исходного препарата и продолжительности лечения.
Технический результат, достигаемый при осуществлении изобретения, заключается в усилении перечисленных свойств лечебного средства.
Указанный технический результат достигается тем, что известный иммуномодулятор - метаболик - детоксикант - адаптоген - радиопротектор, включающий хотя бы один экстракт плаценты, содержит хотя бы одну нуклеиновую кислоту и/или ее производную и дополнительно хотя бы один витамин.
Указанный технический результат достигается также тем, что он содержит хотя бы одну аминокислоту.
Указанный технический результат достигается также тем, что процентное содержание сухого остатка тканевых экстрактов составляет не более 20, нуклеиновых кислот и/или их производных - не более 20, витаминов - не более 5, аминокислот - не более 99,5 массовых процентов.
Указанный технический результат достигается также тем, что в качестве нуклеиновой кислоты или ее производной использованы нуклеинат натрия или ридостин или ларифан или деринат.
Указанный технический результат достигается также тем, что в качестве витамина использованы витамины группы В, и/или витамин С, и/или витамин Е.
Указанный технический результат достигается также тем, что он содержит в качестве источника витаминов и аминокислот среду 199, или среду Игла, или среду RPMI 1640, или другую среду для культивирования животных клеток.
Тканевые экстракты являются стимуляторами метаболизма (обмена веществ). Нуклеиновые кислоты и их производные являются иммуномодуляторами.
Некоторые из них являются также адаптогенами.
Витамины являются регуляторами метаболических процессов.
Аминокислоты являются строительным материалом для белковых молекул. Аминокислоты являются метаболиками.
При композиционировании компонентов их совокупность обеспечивает синергетический эффект, поскольку все упомянутые показатели биологической активности оказываются выше одноименных показателей отдельных ингредиентов.
Этот вывод можно проиллюстрировать следующими примерами.
Пример 1. Иммуностимулирующие (адъювантные) свойства средства.
Использовали метод локального гемолиза в геле [3]. Мышам вводили внутрибрюшинно эритроциты барана (ЭБ) по 5•108 в объеме 0,5 мл). На 5-е сутки после иммунизации у мышей брали селезенки и получали суспензии эритроцитов. Тестируемые клетки (106 в 0,1 мл) вносили в расплавленную агарозу (0,7%) со свежеотмытыми 20%-ными эритроцитами барана, после чего полученную смесь наслаивали на поверхность пластмассовых чашек Петри диаметром 50 мм. После застывания смеси чашки инкубировали при 37oС. Через 1 ч в чашки заливали по 1 мл комплемента морских свинок и инкубировали дополнительно в течение 1 ч при 37oС, после чего комплемент сливали и проводили подсчет зон гемолиза. Расчет числа антителообразующих клеток (АТОК) производили на 1 млн. жизнеспособных спленоцитов.
Исследовали следующие группы мышей (по 10 животных в группе):
1) контрольные - получавшие только ЭБ;
2) мыши, которым одновременно с ЭБ вводили экстракт плаценты (ЭП) в дозе 0,16 мкл/кг (4 мкг/кг по сухому весу);
3) мыши, которым одновременно с ЭБ вводили нуклеинат натрия (Н), относящийся к иммуномодуляторам [3], в дозе 4 мкг/кг, ЭП и смесь витаминов (В) в дозе 0,3 мл/кг (2,85 мкг/кг). Соотношение Н:ЭП:B=36,8%:36,8%:26,4%;
4) мыши, которым одновременно с ЭБ вводили нуклеинат натрия (Н), ЭП и витамин С (ВС) в дозе 0,75 мг/кг. Соотношение Н:ЭП:ВС=0,5%:0,5%:99%;
5) мыши, которым одновременно с ЭБ вводили нуклеинат натрия (Н), ЭП и витамин В1 (ВВ1 в дозе 0,05 мг/кг. Соотношение Н:ЭП:ВВ1=6,9%:6,9%:86,2%;
6) мыши, которым одновременно с ЭБ вводили заявленное средство, содержащее Н, ЭП, В и смесь аминокислот (А) в дозе 0,3 мл/кг (67,8 мкг/кг). Соотношение Н:ЭП:В:А=5,1%:5,1:%:3,6%:86,2%;
7) мыши, которым одновременно с ЭБ вводили заявленное средство, содержащее Н, В и ЭП2 (см. пример 10). Соотношение Н:В:ЭП2=40,6%:28,9%:30,5%;
8) мыши, которым одновременно с ЭБ вводили заявленное средство, содержащее Н, В и ЭП3 (см. пример 10). Соотношение Н:В:ЭП3=26,9%:19,2%:53,9%;
9) мыши, которым одновременно с ЭБ вводили заявленное средство, содержащее Н, ЭП и среду 199 в дозе 0,3 мл/кг (3,5 мкг/кг). Соотношение Н:ЭП:В:А= 2,1%:2,1%:0,16%:95,2%;
10) мыши, которым одновременно с ЭБ вводили заявленное средство, содержащее Н, ЭП и среду RPMI 1640 в дозе 0,3 мл/кг (7,27 мкг/кг). Соотношение Н: ЭП:В:А=1,6%: 1,6%:5,5%:91,3%;
11) мыши, которым одновременно с ЭБ вводили заявленное средство, содержащее ЭП, В и ридостин в дозе 1 мкг/кг. Соотношение ЭП:В:Н=51,0%:36,3%: 12,7%;
12) мыши, которым одновременно с ЭБ вводили заявленное средство, содержащее Н, ЭП, В и серин в дозе 0,05 мг/кг. Соотношение H:ЭП:В:A:=6,6%:6,6%: 4,7%:82,1%.
Результаты, представленные в табл. 1, показывают, что добавление к ЭП иммуномодулятора (Н) и витаминов, и, в еще большей степени, добавление к ЭП нуклеината, витаминов и аминокислот приводит к выраженному адъювантному воздействию.
Пример 2. Влияние препаратов на пролиферативную активность спленоцитов.
Пролиферативную активность оценивали по включению радиоактивной метки в ДНК клеток, культивируемых с препаратом по отношению к включению метки в контрольных культурах (в среде без препарата). Асептически полученную суспензию спленоцитов культивировали в среде следующего состава: среда RPMI 1640 с 5% инактивированной телячьей эмбриональной сыворотки, 2мМ L-глютамина, 10мМ буферного раствора HEPES 50 мкг мл гентамицин-сульфата 5•10-5М 2-меркаптоэтанола. Культивирование проводили в СО2-инкубаторе в атмосфере с 5% СО2 при 37oС в течение 72 ч в 96-луночных плоскодонных планшетах. В каждую лунку вносили по 100 мкл клеточной суспензии (500 000 клеток) и 100 мкл раствора препаратов в концентрации 2 мкл/мл. В контрольные лунки вносили 100 мкл клеток и 100 мкл среды культивирования. В часть лунок препараты вносили совместно с Т-митогеном конканавалином A (Sigma, США), который использовался в конечной концентрации 2 мкг/мл. За 16 ч до окончания культивирования в каждую лунку добавляли 1мкКи 3Н-тимидина с удельной активностью 37 ГБк/ммоль. По окончанию культивирования клетки переносили на стекловолокнистые фильтры (GF/c, Watman, Англия) при помощи харвестера (Flow, Англия). Подсчет радиоактивности производили на сцинцилляционном β-счетчике. Результаты выражали в абсолютных величинах (импульсах в минуту - срm).
Данные, представленные в табл. 2, свидетельствуют о том, что достоверную стимуляцию пролиферации лимфоидных клеток вызывает лишь заявленное средство -смесь ЭП+Н+В+А и его аналоги, содержащие в качестве источника аминокислот и витаминов среду 199 или среду RPMI 1640. Однако ответ на стандартный митогенный препарат, стимулирующий Т-лимфоциты (конканавалин А) усиливался в присутствии смеси ЭП+Н+В, ЭП+Н+ВС и ЭП+Н+ВВ1, что свидетельствует о наличии у указанных препаратов иммуностимулирующей активности. Разные препараты плаценты (ЭП, ЭП1 или ЭП2) действуют практически одинаково.
Пример 3. Активность при радиационном иммунодефиците.
Известно, что ионизирующая радиация в значительных дозах оказывает губительное воздействие на организм, вызывая, в том числе, серьезный вторичный иммунодефицит.
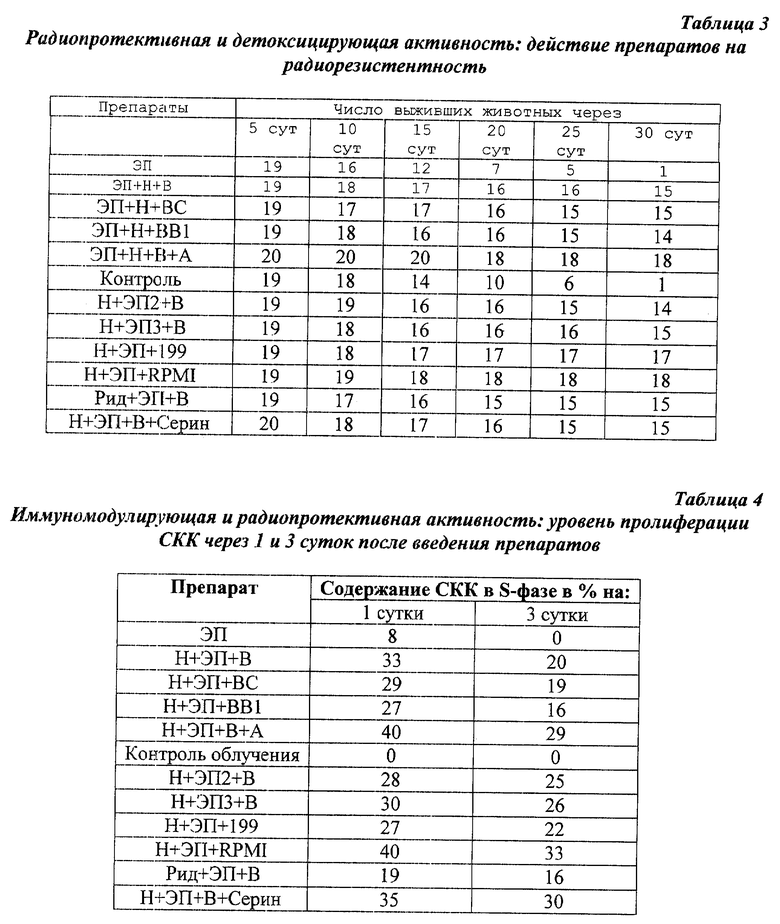
Для исследования влияния препаратов на радиорезистентность их вводили, как в примере 1, внутримышечно мышам-гибридам (CBA•C57B1/6)F1, самцам массой 20 г. В группах было по 20 животных.
Через 1 сут мышей облучали в дозе 900 рад на установке ЭКУ-50, источник Со-60. Радиорезистентность определяли по выживаемости в течение 30 сут после облучения. Положительный результат в этом тесте свидетельствует о приобретении организмом устойчивости к летальному действию смертельной дозы облучения.
Полученные результаты (табл. 3) свидетельствуют о том, что препараты в сочетаниях Н+ЭП+В, Н+ЭП+ВС, Ридостин+ЭП+В, Н+ЭП+ВВ1, Н+ЭП1+ВН+ЭП2+В и заявленное средство смесь Н+ЭП+А+В, Н+ЭП+среда 199, Н+ЭП+среда RPMI 1640, Н+ЭП+В+серин защищают животных от гибели. Механизм защитного воздействия может быть обусловлен несколькими причинами: 1) стимуляцией пролиферации СКК, 2) собственно радиозащитным действием, предохраняющим клеточную мембрану от повреждения, 3) антиоксидантным эффектом, препятствующим губительному воздействию свободных радикалов, 4) стимуляцией продукции ФНО, ИЛ-1 или интерферона.
Для понимания механизма радиозащитного эффекта было изучено влияние препаратов на пролиферацию стволовых кроветворных клеток (СКК) и на продукцию гамма-интерферона.
Пример 4. Пролиферация стволовых кроветворных клеток (СКК).
Для определения пропорции СКК костного мозга, находящихся в S-фазе клеточного цикла, т.е. в фазе синтеза ДНК (пролиферации), использовали метод самоубийства оксимочевиной.
Через 1 и 3 сут после введения препаратов в дозах, указанных в примере 1, у мышей брали костный мозг из бедренных костей, инкубировали клетки в среде RPMI 1640 с добавлением 10% эмбриональной телячьей сыворотки в присутствии оксимочевины (1 мг/мл) или без нее. Через 2 ч инкубации в CO2-инкубаторе клетки отмывали центрифугированием, разводили до концентрации 2250 тыс/мл и вводили внутривенно сингенным мышам-гибридам, облученным в дозе 900 рад. Через 8 сут мышей (по 10 животных в группе) забивали, извлекали селезенки, фиксировали их в растворе Буэна и просчитывали число колоний. После этого определяли содержание СКК в S-фазе как выраженное в процентах отношение (a-b)/b, где а - число колоний без оксимочевины, b - число колоний с оксимочевиной.
Полученные данные (табл.4) свидетельствуют о том, что все предлагаемые композиции стимулируют пролиферацию СКК. Максимальный эффект наблюдается через 1 сут после введения.
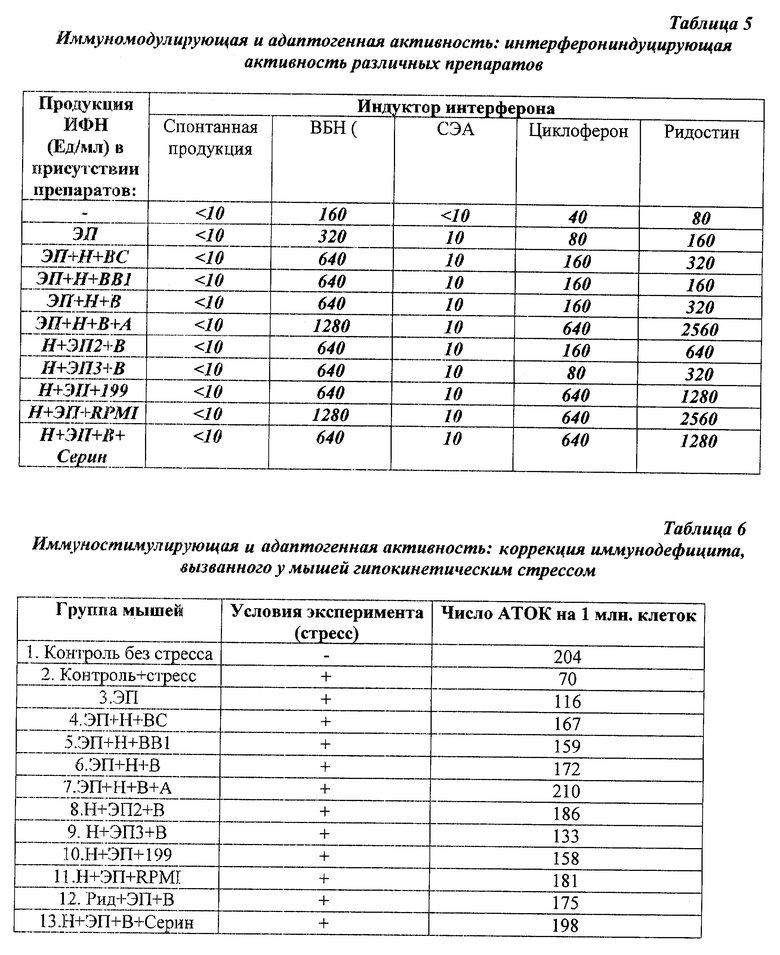
Пример 5. Изучение продукции интерферона.
Самцам мышей линии СВА вводят внутрибрюшинно одновременно со стандартными индукторами интерферона препараты в дозах, указанных в примере 1. Уровень синтеза интерферона в сыворотке крови мышей определяют через 24 ч после введения препарата. Масса мышей - 12-14 г. Титрование интерферона проводят в культуре клеток L-929. В качестве тест-вируса используют 100 ТЦД50 вируса энцефаломиокардита мышей. За единицу интерферона принимают последнее разведение пробы, обеспечивающее 50%-ную защиту клеток при полной деструкции монослоя в контроле. В качестве стандартных индукторов ИФН, вводимых мышам интраперитонеально, использовали: вирус болезни Ньюкасла (ВБН, 108ЦД50/0,2 мл), ридостин (дсРНК дрожжей, 100 мкг/мышь), циклоферон (250 мкг/мышь) и стафилококковый энтеротоксин А (СЭА, 10 мкг/мышь).
Установлено (табл. 5), что ЭП не является индуктором интерферона в сыворотке мышей, однако слабо повышает ИФН-индуцирующую способность индукторов ИФН. Значительно большим стимулирующим действием обладает смесь Н+ЭП+В, Н+ЭП+ВС Н+ЭП+ВВ1 и особенно сильная стимуляция интерферониндуцирующей активности стандартных индукторов интерферона проявляется у заявленного средства смеси Н+ЭП+В+А, Н+ЭП+В+серин, Н+ЭП+среда199, Н+ЭП+среда RРМI 1640.
Пример 6. Коррекция стресс-индуцированного иммунодефицита.
Для индукции стресса экспериментальных мышей содержали в условиях ограничения движений (мышечной депривации). В течение 10 сут мышей помещали по одной в пластмассовые камеры размером 8,5х4,0х2,0 см на 7 ч ежедневно. Контрольных мышей содержали в стандартных клетках по 10 особей (размер стандартной клетки 42х14х11 см). На 10-е сут стрессорного воздействия экспериментальным (и контрольным) животным вводили тест-антиген - эритроциты барана, после чего животных содержали в обычных условиях [4]. Для определения уровня стресса использовали описанный в примере 3 метод локального гемолиза в геле [3].
Исследовали следующие группы мышей (по 10 животных в группе):
1) контрольные - получавшие ЭБ (5%) внутрибрюшинно по 0,5 мл;
2) подвергнутые стрессу - получавшие ЭБ на 7-е сутки стрессорного воздействия;
3) мыши, которым в 1-й день стрессорного воздействия вводили ЭП, а на 7-е сутки - ЭБ;
4) мыши, которым в 1-й день стрессорного воздействия вводили смесь витамина С, ЭП и Н, а на 7-е сутки - ЭБ;
5) мыши, которым в 1-й день стрессорного воздействия вводили смесь витамина В1, ЭП и Н, а на 7-е сутки - ЭБ;
6) мыши, которым в 1-й день стрессорного воздействия вводили смесь витаминов, ЭП и H, а на 7-е сутки - ЭБ;
7) мыши, которым в 1-й день стрессорного воздействия вводили заявленное средство смесь ЭП+Н+В+А, а на 7-е сутки - ЭБ;
8) мыши, которым в 1-й день стрессорного воздействия вводили заявленное средство, содержащее Н, В и ЭП2 (см. пример 10), а на 7-е сутки - ЭБ;
9) мыши, которым в 1-й день стрессорного воздействия вводили заявленное средство, содержащее Н, В и ЭП3 (см. пример 10), а на 7-е сутки - ЭБ;
10) мыши, которым в 1-й день стрессорного воздействия вводили заявленное средство, содержащее Н, ЭП и среду 199 в дозе 0,3 мл/кг, а на 7-е сутки - ЭБ;
11) мыши, которым в 1-й день стрессорного воздействия вводили заявленное средство, содержащее Н, ЭП и среду RPMI 1640, а на 7-е сутки - ЭБ;
12) мыши, которым в 1-й день стрессорного воздействия вводили заявленное средство, содержащее ЭП, В и ридостин, а на 7-е сутки - ЭБ;
13) мыши, которым в 1-й день стрессорного воздействия вводили заявленное средство, содержащее Н, ЭП, В и серин, а на 7-е сутки - ЭБ.
Результаты, представленные в табл. 6, показывают, что стресс, вызванный гипокинезией, индуцирует у мышей значительное подавление первичного иммунного ответа на ЭБ (с 204 до 70 АТОК на 1 млн. спленоцитов). Однократное введение экстракта плаценты способствует некоторому увеличению численности АТОК, тогда как введение заявленного средства смеси ЭП+Н+В+А восстанавливает ответ до нормы, полностью предотвращая развитие стрессиндуцированного иммунодефицита. Чуть меньший эффект достигается при введении других композиций.
Пример 7. Интоксикации различной этиологии.
Заявленное средство смесь ЭП+Н+В+А (препарат гамавит) применяли более чем у 50 животных в период острой и подострой фазы течения заболевания. При применении данного препарата получены убедительные практические данные о более быстром процессе детоксикации, животные гораздо быстрее выходили из токсических состояний.
Пример 8. Анемии.
Заявленное средство смесь ЭП+Н+В+А (препарат гамавит) применяли вместо ферроглюкина для лечения анемий у телят и поросят. При применении данного препарата было продемонстрировано более быстрое восстановление числа эритроцитов и уровня гемоглобина по сравнению с контрольной группой, в которой был использован ферроглюкин.
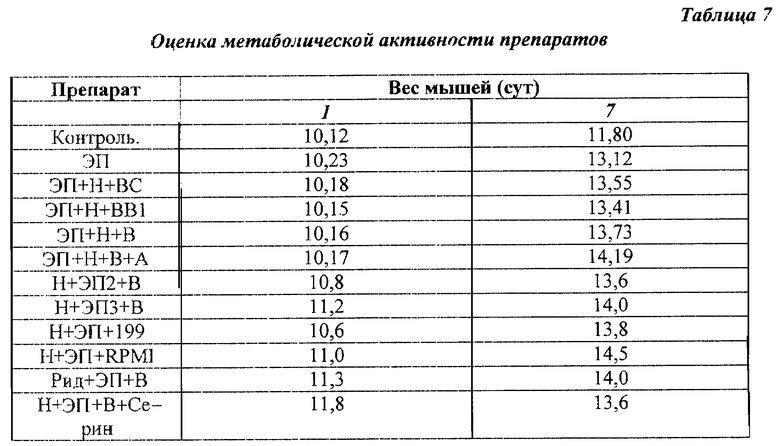
Пример 9. Оценка метаболической активности препарата (по привесу тела мышей).
Использовали самцов мышей линии СВА весом 10 г (предварительно мышей взвешивали и использовали в эксперименте мышей только весом 10 г). Ежедневно, в течение 7 дней мышей взвешивали и затем делали интраперитонеальные инъекции растворов в дозах, указанных в примере 1, на 1, 3 и 5 сут. На 7 сут проводили взвешивание мышей.
Исследовали следующие группы мышей (по 10 животных в группе):
1) контрольные - получавшие интраперитонеально физиологический раствор;
2) мыши, которым вводили ЭП;
3) мыши, которым вводили ЭП+Н+ВС;
4) мыши, которым вводили ЭП+Н+ВВ1;
5) мыши, которым вводили ЭП+Н+В;
6) мыши, которым вводили заявленное средство смесь ЭП+Н+В+А;
7) мыши, которым вводили Н+ЭП2+В;
8) мыши, которым вводили Н+ЭП3+В;
9) мыши, которым вводили Н+ЭП+199;
10) мыши, которым вводили Н+ЭП+RPMI;
11) мыши, которым вводили Рид+ЭП+В;
12) мыши, которым вводили Н+ЭП+В+Серин.
Результаты, представленные в табл. 7, свидетельствуют о достоверном усилении метаболической активности под влиянием большинства использованных смесей, но особенно сильный эффект наблюдался после введения заявленного средства (смеси ЭП+Н+А+В или его аналогов со средами 199, RPMI 1640).
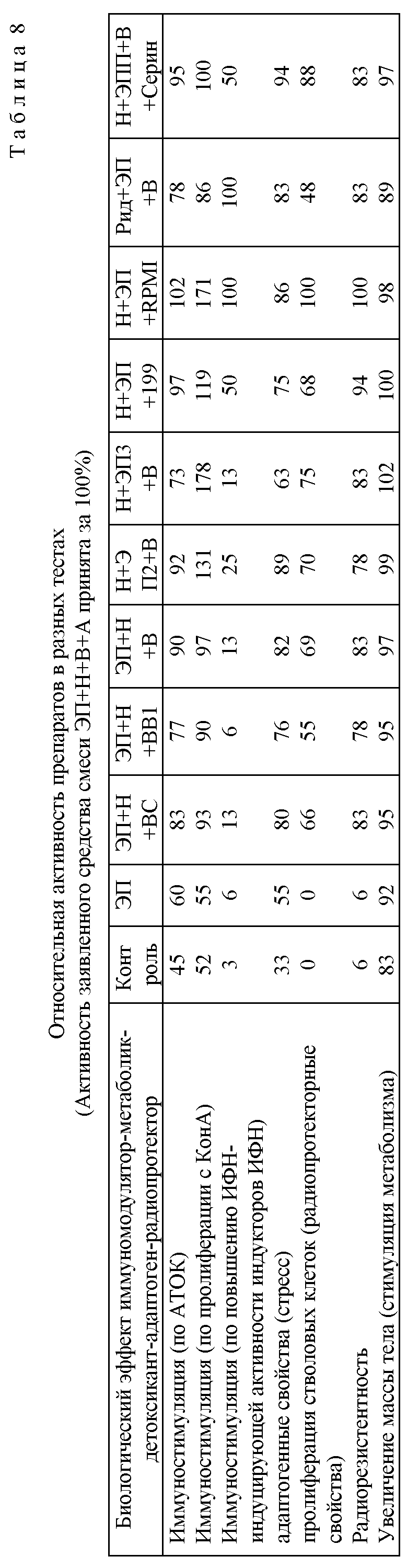
Суммарно имеющиеся данные представлены в табл. 8. Можно видеть, что эффект заявленного средства смеси ЭП+Н+В+А и его аналогов со средами 199 или RPMI 1640 по большинству исследованных параметров существенно превосходит препарат-прототип (ЭП). Несколько ниже суммарный эффект, вызываемый более бедной смесью (ЭП+Н+ВС, ЭП+Н+ВВ1, ЭП+Н+В).
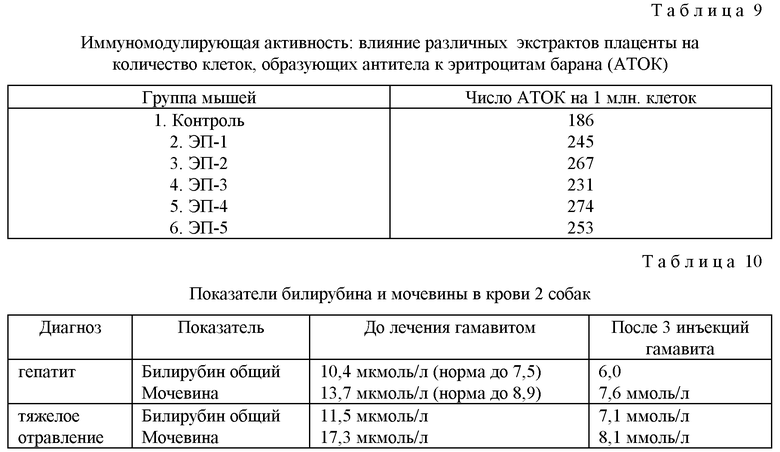
Пример 10. Иммуностимулирующие (адъювантные) свойства различных экстрактов плаценты.
Использовали метод локального гемолиза в геле, описанный в примере 1. Исследовали следующие группы мышей (по 10 животных в группе):
1) контрольные - получавшие только ЭБ;
2) мыши, которым одновременно с ЭБ вводили экстракт плаценты, аналогичный аллогенному препарату плаценты человека, как указано в патенте RU 2137486 (ЭП-1) в дозе 0,16 мкл/кг (4 мкг/кг);
3) мыши, которым одновременно с ЭБ вводили экстракт плаценты, полученной в соответствии с патентом US 4873222 (ЭП-2) в дозе 0,16 мкл/кг (3 мкг/кг);
4) мыши, которым одновременно с ЭБ вводили экстракт плаценты для инъекций - фармпрепарат (см. М.Д. Машковский, Лекарственные средства, М.: Медицина, 1987, т.2, с.154) (ЭП-3) в дозе 0,16 мкл/кг (8 мкг/кг);
5) мыши, которым одновременно с ЭБ вводили взвесь плаценты для инъекций - фармпрепарат (см. М.Д. Машковский, Лекарственные средства, М.: Медицина, 1987, т.2, с.154) (ЭП-4) в дозе 0,16 мкл/кг (4 мкг/кг);
6) мыши, которым одновременно с ЭБ вводили экстракт плаценты - ПАН ветеринарный препарат (ЭП-5) в дозе 0,16 мкл/кг (4 мкг/кг), патент RU 2148408 от 14 сентября 1999 г. - Способ получения биологически активного тканевого препарата.
Результаты, представленные в табл. 9, показывают, что введение ЭП, полученного из разных источников, мышам совместно с ЭБ приводило к образованию примерно одного и того же количества антителообразующих клеток. Полученные данные свидетельствуют об одинаковых иммуностимулирующих свойствах различных экстрактов плаценты, полученных разными способами.
Пример 11. Влияние на катаболизм эндогенных белков у собак.
Уровень билирубина, креатинина и мочевины в сыворотке зависит от функции почек. При почечной недостаточности и при гепатите в сыворотке накапливаются билирубин, мочевина, трансаминазы, креатинин.
В моче билирубин в норме не выявляется. Выведение мочевины прямо пропорционально скорости катаболизма эндогенных белков. Положительный баланс мочевины и билирубина наблюдают в период роста, во время беременности и др. (В. Т. Морозова, И.И. Миронова, Р.Л. Марцишевская. "Исследование мочи", М., 1996).
При хронической почечной недостаточности в крови выявляют повышение уровня билирубина и трансаминаз. В табл. 9 приведены данные по содержанию билирубина и мочевины в крови 2 собак с гепатитом и тяжелым отравлением до и после лечения гамавитом, которые свидетельствуют о влиянии препарата на катаболизм эндогенных белков. Кроме того, в моче обеих собак после терапии гамавитом отмечено появление билирубина (мочевина в моче количественно не определяется), что, наряду с выведением билирубина и мочевины из крови, отражает катаболитическую функцию.
ЛИТЕРАТУРА
1. Машковский М.Д. Лекарственные средства. Вильнюс, 1993, т.2, с. 146.
2. Регистр лекарственных средств России. Энциклопедия лекарств, изд. 8, 2001.
3. Jerne N.K., Nordin A.A., Henry C. The agar plague technique for recognizing antibody-producing cells. In Amos B. and Koprovsky (ed.). Cell bound antibodies. Wistar Press Inst., 1963, p. 109-122.
4. Davis D. E., Cristian J.J. Effect of population size on the adrenal glands and productive organs of male mice in populations of fixed size. Proc. Soc. Exp. Biol. (N.Y.), 1957, V.94, pp. 227-231.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ И КОРРЕКЦИИ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ ЖИВОГО ОРГАНИЗМА | 1998 |
|
RU2177788C2 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ И КОРРЕКЦИИ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ ЖИВОГО ОРГАНИЗМА | 1998 |
|
RU2129867C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ПОЛИПРЕНИЛФОСФАТОВ И БЕТА-СИТОСТЕРИНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2014 |
|
RU2542420C1 |
| СРЕДСТВО ДЛЯ СНИЖЕНИЯ РЕПРОДУКЦИИ ВИРУСА ГЕПАТИТА С | 2013 |
|
RU2526179C1 |
| Средство для стимуляции выработки соматотропного гормона гипофизом и способ его получения | 2016 |
|
RU2665379C2 |
| КОМПЛЕКС 1:2 ГЕРМАНИЯ И 2,6-ПИРИДИНДИКАРБОНОВОЙ КИСЛОТЫ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2171259C2 |
| ПРОТИВОВИРУСНОЕ СРЕДСТВО | 2014 |
|
RU2564919C1 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ОСТРОГО И ХРОНИЧЕСКОГО ПАНКРЕАТИТА | 2010 |
|
RU2425669C1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2427284C1 |
| СРЕДСТВО ДЛЯ КОШЕК, ОБЛАДАЮЩЕЕ РЕГЕНЕРАТИВНОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2646791C1 |

Изобретение относится к фармацевтической промышленности и касается разработки новых лекарственных препаратов для медицины и ветеринарии. Предлагаемый препарат содержит хотя бы один экстракт плаценты, хотя бы одно производное нуклеиновой кислоты и хотя бы один витамин. В качестве производного нуклеиновой кислоты может быть использован нуклеинат натрия или ридостин, в качестве витамина - витамины группы В или витамин С. Препарат может дополнительно содержать хотя бы одну аминокислоту. В качестве источника витаминов и аминокислот в препарате может быть использована среда 199, или среда RPMI 1640, или другая среда для культивирования животных клеток, содержащая витамины и аминокислоты. Технический результат: расширение арсенала лекарственных средств, обладающих широким спектром действия. 5 з.п. ф-лы, 10 табл.
| ПОРОШКООБРАЗНЫЙ БИОГЕННЫЙ ПРЕПАРАТ ИЗ ОКОСТЕНЕЛЫХ ОЛЕНЬИХ РОГОВ И ПИЩЕВАЯ ДОБАВКА НА ЕГО ОСНОВЕ | 1996 |
|
RU2077887C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ И ПОВЫШЕНИЯ РАБОТОСПОСОБНОСТИ СПОРТСМЕНОВ | 1996 |
|
RU2080118C1 |
| RU 2058774 С1, 27.04.1996 | |||
| US 4169139 C1, 25.09.1979 | |||
| US 4054648 C1, 18.10.1977 | |||
| WO 9100098 А, 10.01.1991. | |||
Авторы
Даты
2002-12-20—Публикация
2000-12-27—Подача