Область применения
Изобретение относится к ветеринарии, в частности к ветеринарной терапии, и может быть использовано для стимуляции регенеративных процессов в организме кошки - в послеоперационный период, при дегенеративных заболеваниях органов и систем органов, острых и хронических заболеваниях кожи, улучшает качество жизни стареющих животных.
Уровень техники
Известны синтетические аналоги, обладающие регенеративной активностью, такие как натрия нуклеинат, метилурацил и прочие. Подобные лекарственные средства обладают восстановительными свойствами, улучшают гемапоэз, однако обладают относительно низкой эффективностью и узконаправленностью действия, при этом обладают рядом противопоказаний, связанных с риском угнетения нервной системы, возникновения брадикардии, обострения онкологических патологий системы крови, возникновения аллергических реакций.
Существует регенеративный препарат «Лаураболин 50» (другие названия - ретаболил, нандролона деканоат для кошек), представляющий собой инъекционный анаболический стероид (нандролон лаурат), который применяют в качестве общеукрепляющего средства, при лечении терапевтических и хирургических заболеваний с существенным повреждением тканей. Недостатком данного препарата является его стероидная природа, что в совокупности с длительным курсом лечения может оказать негативное, опасное влияние на весь организм (особенно почки, печень и мозг) и отрицательно сказаться на синтезе собственных гормонов организма животного.
Также известен гомеопатический препарат системного воздействия на организм на растительной основе «Лиарсин», в состав которого входит три компонента - растительное сырье Lycopodium и минеральные соединения - Arsenicum и Phosphorus. Лиарсин используется для восстановления водно-солевого баланса организма кошек после перенесенных кишечных инфекций или воспалительных заболеваний ЖКТ. К недостаткам известного средства можно отнести невысокую биологическую активность препарата и ограниченную сферу применения, так как используется только при заболеваниях ЖКТ.
Прототипом изобретения является препарат «Гамавит» - комплексный препарат, основу которого составляют плацента, денатурированная эмульгированная и нуклеинат натрия. Препарат выпускается в жидкой форме на основе ростовой питательной среды, содержащей сбалансированный раствор солей, аминокислот и витаминов [Патент РФ №2005475 С1 01.10.91]. Для данного прототипа описаны следующие эффекты на организм кошек: нормализует обменные процессы, обладает биостимулирующим, дезинтоксикационным, иммуномодулирующим и адаптогенным действием.
Указанный прототип обладает рядом недостатков. Один из основных компонентов средства - плацента - может нести риск развития аллергической реакции. Указанное сырье, используемое для получения данного препарата, не стандартизировано, поэтому несет опасность развития нежелательной микрофлоры, что влечет угрозу инфицирования животных при применении препарата. Также использование «Гамавита» длительно и требует введения большого количества препарата (при профилактике в дозе 0,1 мл на 1 кг массы тела, в ходе лечения - по 0,3-0,5 мл в течение 2-4 недель). Кроме того, препарат выпускается в жидкой форме, что значительно сокращает срок его хранения.
Стратегия регенеративной медицины, основанная на стимулировании собственного восстановительного потенциала, применяется при создании лекарственных средств для человека, например кондиционная среда, обладающая лечебным эффектом при термических ожогах [патент RU №2292212, 27.01.07], однако не используется в ветеринарии.
Сущность изобретения
Настоящее изобретение ставит перед собой задачу обеспечения стимуляции регенеративных процессов в организме кошки при широком спектре дегенеративных заболеваний и расширения арсенала лекарственных средств, применяемых в восстановительной ветеринарии для кошек.
Технический результат достигается путем разработки ветеринарного препарата для кошек, обладающего регенеративной активностью, а как следствие - терапевтическим эффектом - в отношении широкого спектра заболеваний кошек.
Патогенез дегенеративных заболеваний связан с нарушением способности отдельных тканей организма к восстановлению и компенсации путем реализации собственного регенераторного потенциала. Существующие прототипы обладают фармакологическим действием, на стимуляции либо замещении функций сохранившихся клеточных элементов. Однако концепция компенсации нарушений деятельности и повреждений органов-мишеней за счет указанных приспособительных процессов в значительном числе случаев оказывается несостоятельной.
МСК обладают способностью секретировать широкий спектр хемокинов и ростовых факторов и быстро реагировать на изменение гомеостаза ткани модификацией профиля их секреции. Таким образом, с участием мезенхимальных стволовых клеток осуществляется природный механизм регуляции регенерации тканей. МСК присутствуют во всех органах взрослого организма и могут быть выделены и культивированы in vitro.
Реализация данного подхода может быть обеспечена использованием препарата на основе экстракта и кондиционной среды культуры МСК костного мозга и жировой ткани, регенеративная активность которого обусловлена действием комплекса цитокинов, секретируемых МСК в культуральную среду.
Изобретение представляет собой экстракт и кондиционную среду (КС) культуры мезенхимальных стволовых клеток (МСК) (как выделенных de novo, так и деконсервированных) из костного мозга и/или жировой ткани кошек.
Изготовление заявленного препарата выполняется в следующие этапы:
1. Накопление клеточной массы и формирование кондиционной среды. Для этого выполняют деконсервирование полученных ранее или непосредственное выделение мезенхимальных стволовых клеток из косного мозга либо жировой ткани кошек. МСК кошки культивируют в ростовой среде на основе DMEM с 10% содержанием фетальной бычьей сыворотки (ФБС) до образования кондиционной среды, приемлемость которой оценивается по содержанию интерлейкинов (концентрация ИЛ-1β - не менее 2 пг/мл, ИЛ-2 - не менее 2 пг/мл, ИЛ-6 - не менее 10 пг/мл ИЛ-10 - 2 пг/мл).
2. Приготовление полупродукта на основе кондиционной среды и экстракта МСК. На данном этапе осуществляют сбор кондиционной среды, удовлетворяющей критериям приемлемости по концентрации интерлейкинов, снятие с подложки и диспергирование монослоя мезенхимальных стволовых клеток, получение экстракта клеток путем замораживания-оттаивания клеточной суспензии, объединение экстракта с кондиционной средой, полученной в ходе культивирования МСК кошки.
3. Изготовление конечного продукта. Полученный на предыдущем этапе полупродукт стабилизируют посредством добавления глицина в концентрации 20 мг на 1 мл раствора для лиофилизации, подвергают стерилизующей фильтрации, осуществляют розлив во флаконы в асептических условиях и сублимационную сушку.
Краткое описание иллюстративного материала
Изобретение поясняется, графиками и таблицами:
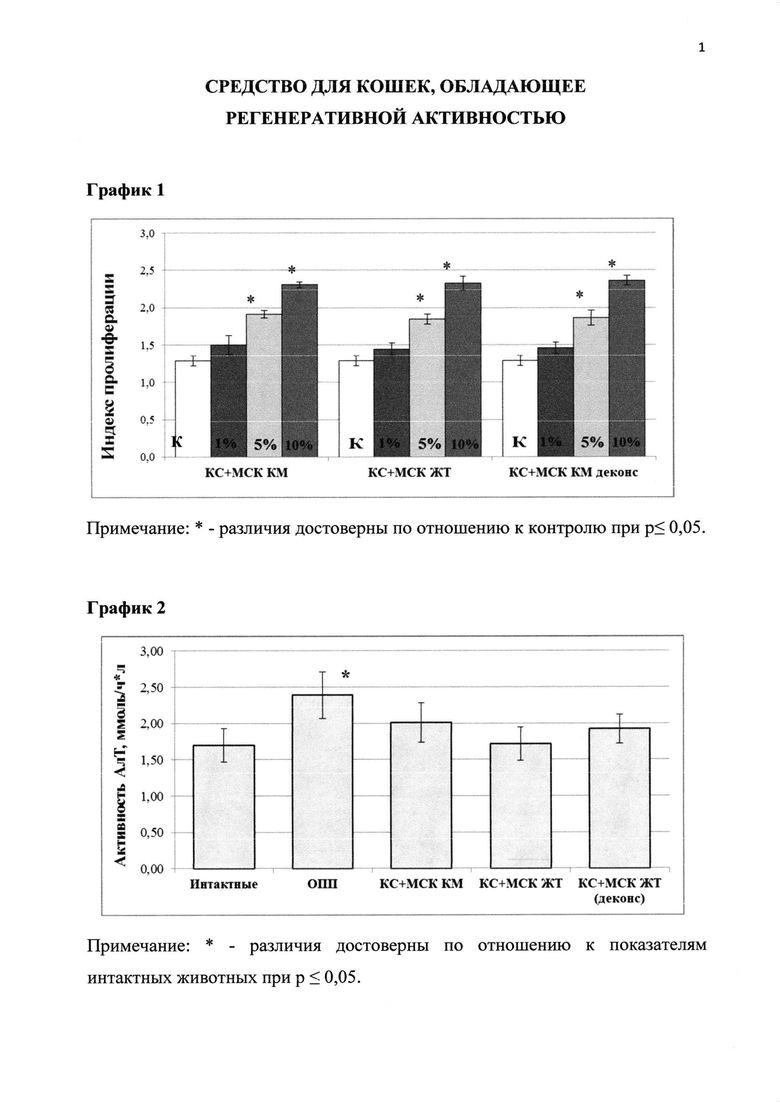
График 1. Влияние препарата на основе экстракта и кондиционной среды мезенхимальных стволовых клеток костного мозга (КС МСК КМ), жировой ткани (КС+МСК ЖТ) и деконсервированных МСК костного мозга (СК+МСК КМ деконс) на пролиферативный индекс культур клеток первичных дермальных фибробластов кошек.
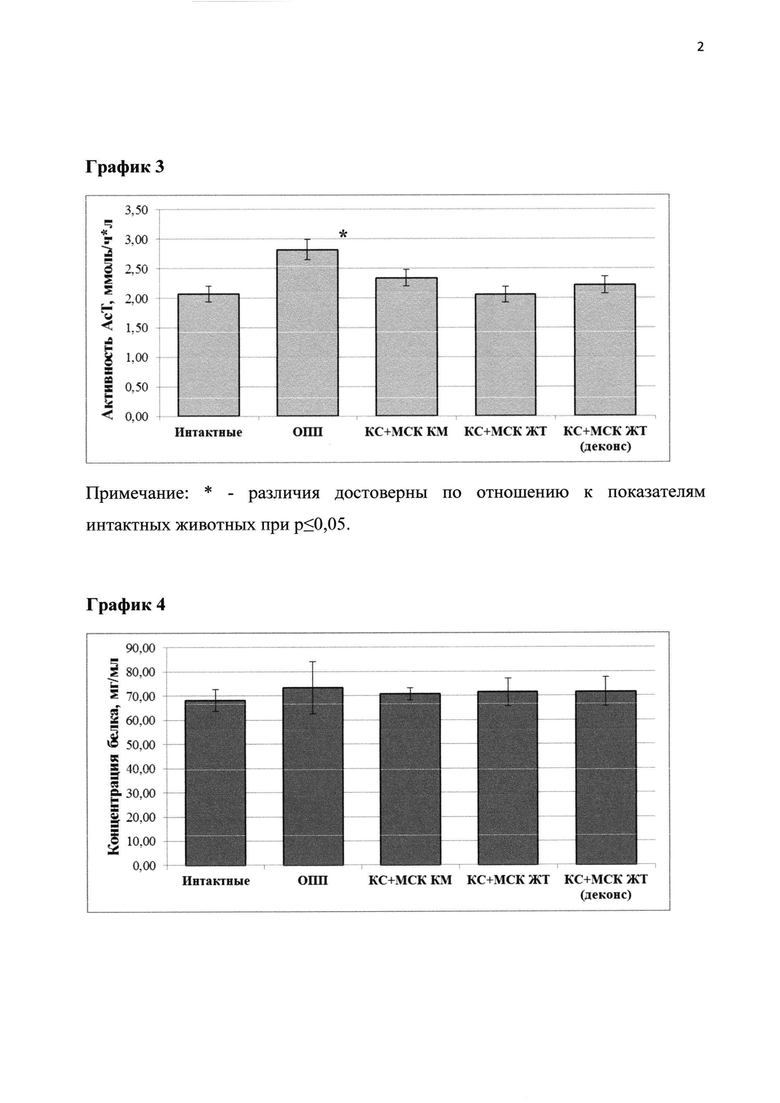
График 2. Влияние препарата на основе экстракта и кондиционной среды мезенхимальных стволовых клеток костного мозга (КС+МСК КМ), жировой ткани (КС+МСК ЖТ) и деконсервированных МСК костного мозга (СК+МСК КМ деконс) на активность АлТ в сыворотке крови крыс при моделировании острой патологии печени (ОПП).
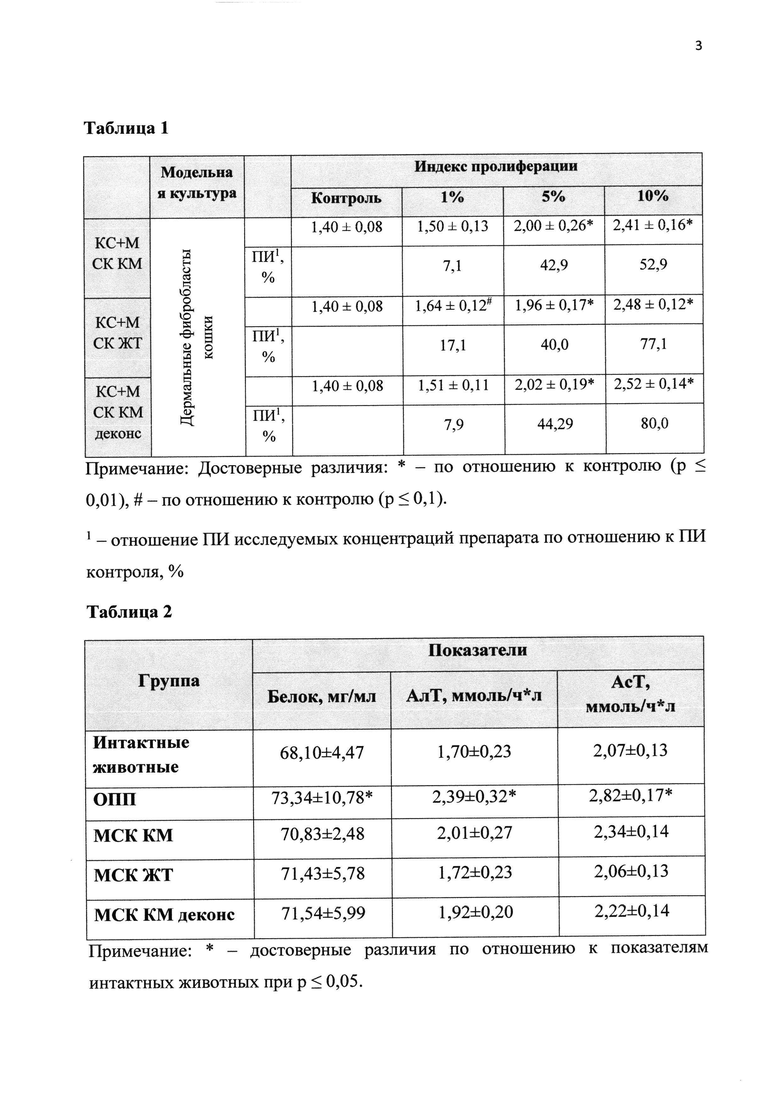
График 3. Влияние препарата на основе экстракта и кондиционной среды мезенхимальных стволовых клеток костного мозга (КС+МСК КМ), жировой ткани (КС+МСК ЖТ) и деконсервированных МСК костного мозга (СК+МСК КМ деконс) на активность АсТ в сыворотке крови крыс при моделировании острой патологии печени (ОНИ).
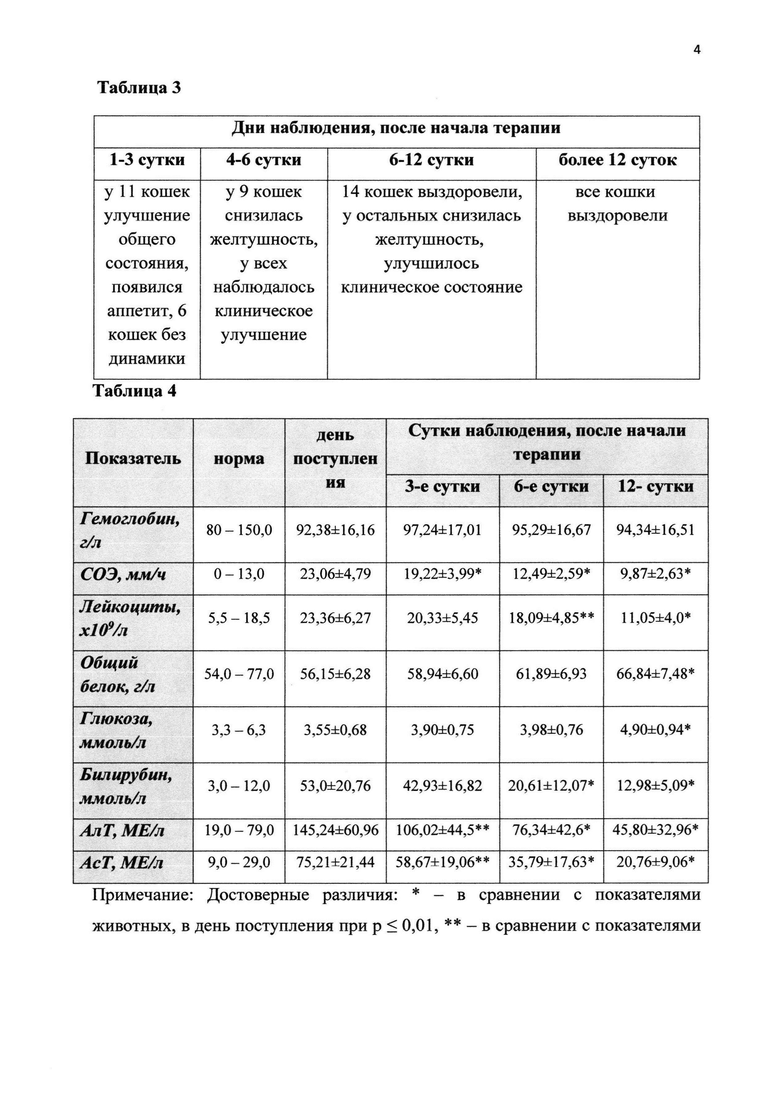
График 4. Влияние препарата на основе экстракта и кондиционной среды мезенхимальных стволовых клеток костного мозга (КС+МСК КМ), жировой ткани (КС+МСК ЖТ) и деконсервированных МСК костного мозга (СК+МСК КМ деконс) на содержание белка в сыворотке крови крыс при моделировании острой патологии печени (ОПП).
Таблица 1. Значение ИП первичной культуры дермальных фибробластов при добавлении разных концентраций регенеративного препарата.
Таблица 2. Биохимические параметры поражения печени в исследуемых группах животных.
Таблица 3. Данные клинических показателей кошек при лечении регенеративным препаратом на основе экстракта и кондиционной среды мезенхимальных стволовых клеток костного мозга (КС+МСК КМ), жировой ткани (КС+МСК ЖТ) и деконсервированных МСК костного мозга (СК+МСК КМ деконс).
Таблица 4. Данные гематологических и биохимических показателей сыворотки крови кошек.
Возможность осуществления изобретения и эффективность его применения поясняются примерами.
Пример 1. Способ получение препарата на основе экстракта и кондиционной среды культуры МСК (как выделенных de novo так и деконсервированных) из костного мозга кошки.
Клеточный материал в виде клеток костного мозга (КМ) был получен при пункции подвздошной кости кошки при использовании местной анестезии 0,5% раствором новокаина строго в стерильных условиях, объемом 0,5 мл. Клетки КМ после выделения помещали в охлажденную среду DMEM/F12 (Biowest, USA), содержащую гентамицин (80 мкг/мл, Биолот, Россия) и амфотерицин Б (0,25 мкг/мл, Biowest, USA), затем дважды отмывали от крови средой DMEM/F12 с антибиотиком и антимикотиком путем центрифугирования при 1200 об/мин в течение 5 мин. Клетки высеивали с концентрацией 1×106 кл/мл и выращивали в пластиковых культуральных флаконах (SPL, Корея) с площадью ростовой поверхности 175 см2 при 37°С в атмосфере с 5%-м содержанием СО2. Клетки выращивали в ростовой среде, в состав которой входит питательная среда DMEM high glucose (Biowest, USA), L-glutamine, 10% фетальной бычьей сыворотки (ФБС, Sigma Aldrich, USA), гентамицин (80 мкг/мл), амфотерицин Б (25 мкг/мл, Biowest, USA).
Для получения кондиционной среды культуру вели в течение 3-4 пассажей, затем выполняли посев в культуральные флаконы из расчета 5-15×103 клеток на 1 см2 площади ростовой поверхности в 90±5 мл ростовой среды и культивировали в описанных выше условиях до достижения необходимой концентрации интерлейкинов в среде.
При достижения необходимой концентрации биологически активных веществ кондиционную среду, содержащую все продукты секреции МСК, собирали в стерильные центрифужные пробирки, очищали путем центрифугирования при 3000 об/мин и температуре 5±1°С в течение 10 минут от клеточного дебриса.
Полученная кондиционная среда может использоваться непосредственно по назначению или храниться в течение продолжительного времени в определенных условиях (до семи суток - при температуре 3±1°С, более длительно хранение требует температуры не выше минус 20°С).
После сбора кондиционной среды получали экстракт МСК КМ: клеточный монослой, при конфлюентности не менее 90%, дезагрегировали указанным выше диспергирующим раствором, добавляли 0,9%-й раствор хлорида натрия (5-10 мл на 1 культуральный флакон), подвергали замораживанию при температуре минус 20±2°С, после чего выполняли оттаивание при комнатной температуре. Полученный экстракт МСК КМ собирали в стерильные центрифужные пробирки, очищали от клеточного дебриса путем центрифугирования при 3000 об/мин и температуре 5±3°С в течение 10 минут.
Для получения регенеративного препарата осадок после центрифугирования, представляющий собой экстракт МСК КМ, объединяли с кондиционной средой, добавляли глицин (до конечной концентрации 20 мг/мл), разливали во флаконы по 1 мл и лиофильно высушивали.
Так, к концу четвертой недели от начала культивирования МСК КМ кошки можно получить до 3000 мл (при посевной концентрации на этапе выделения не менее 1×106 кл/мл) раствора для лиофилизации на основе экстракта и кондиционной среды МСК КМ, который может быть использован для приготовления препарата, стимулирующего регенеративные процессы организма кошки.
Пример 2. Специфическая активность препарата на основе экстракта и кондиционной среды культуры МСК (как выделенных de novo, так и деконсервированных) из костного мозга и/или жировой ткани кошек, на модели in vitro.
Для этого первичные дермальные фибробласты кошек брали на 3 пассаже, высеивали в 12-ти-луночные культуральные планшеты (SPL, Германия) с добавлением в ростовую среду разной концентрации (1%, 5%, 10%) исследуемого регенеративного препарата культивировали в стандартных условиях (инкубировали в течение 3х суток во влажной камере в СО2-инкубаторе при 37°С и 5% СО2) с добавлением 10% ФБС (Sigma-Aldrich, USA) к среде 199 (ГУП ИПВЭ им. М.П. Чумакова, Россия). Посевная концентрация клеток - 8-10×104 кл/мл среды. В качестве контроля использовали клетки, выращенные в ростовой среде без добавления регенеративного препарата.
По окончании инкубации проводили снятие выросших культур с поверхности пластика и определение пролиферативного индекса. Индекс пролиферации (ИП) определяли как отношение количества клеток в 1 мл суспензии, полученной в результате снятия клеток с подложки по достижению конфлюентности монослоя к посевной концентрации клеток (количество клеток в мл раствора при посеве на культуральные планшеты).
Были получены данные (табл. 1 и график 1), которые свидетельствуют о повышении уровня пролиферативных свойств клеток модельной культуры при добавлении в ростовую среду регенеративного препарата на основе экстракта и кондиционной среды МСК (как выделенных de novo, так и деконсервированных) на 7-80% в зависимости от концентрации, в которой исследуемый препарат добавлялся в ростовую среду, по сравнению с контролем, при этом наблюдалась линейная зависимость между концентрацией препарата и значением индекса пролиферации.
Пример 3. Исследование гепатопротекторных свойств препарата на основе экстракта и кондиционной среды культуры МСК (как выделенных de novo, так и деконсервированных) костного мозга и/или жировой ткани кошек.
Регенеративное действие препарата на основе экстракта и кондиционной среды культуры мезенхимальных стволовых клеток костного мозга или жировой ткани было изучено на модели острого поражения печени (МОПП) крыс (in vivo). Модель острого поражения печени была выполнена путем однократного введения крысам в желудок через зонд парацетамола (N-(4-гидроксифенил)ацетамида) в виде суспензии в дозе 700 мг на 1 кг массы тела. Процедура лечения после МОПП заключалась в ежедневном внутримышечном введении 0,5 мл исследуемого препарата животным опытной группы в течение 5 дней. В качестве контроля использовали крыс с МОПП, которые не подвергались терапевтическим воздействиям.
Спустя сутки после окончания курса лечения крыс выводили из эксперимента путем декапитации, предварительно обеспечив наркоз за счет внутрибрюшинного введения хлоралгидрата в дозе 400 мг на 1 кг массы тела животного. В сыворотке крови определили активность ферментов аспартат-(АсТ) и аланинаминотрансферазы (АлТ) с помощью стандартного набора Vital и содержание общего белка - биуретовым методом. Исследованные биохимические параметры отражают функциональное состояние печени. Ферменты АсТ и АлТ присутствуют в значительных количествах в печени и почках, поэтому в норме концентрации АсТ и АлТ в крови невелики. При повреждении гепатоцитов происходит потеря ферментов АсТ и АлТ, и концентрация этих биохимических маркеров в крови возрастает. Изменение уровня общего белка (признак грубой патологии печени) не наблюдалось.
По результатам исследования было показано, что применение регенеративного препарата на основе экстракта и кондиционной среды МСК как костного мозга, так и жировой ткани и деконсервированных в течение пяти дней у животных с ОПП происходило значительное улучшение состояния, судя по исследованным маркерам повреждения печени (показатели уровней АсТ, АлТ) в группе животных, получавших регенеративный препарат, значимо не отличались от показателей в группе интактных крыс (табл. 2 и графики 2-4).
Таким образом, регенеративный препарат на основе экстракта и кондиционной среды МСК обладает выраженным терапевтическим эффектом при остром поражении печени животных. Существенных различий в эффективности препарата на основе кондиционной среды и экстракта мезенхимальных стволовых клеток, полученных из различных источников, также не было выявлено.
Пример 4. Влияние регенеративного препарата на основе экстракта и кондиционированной среды культуры МСК (как выделенных de novo, так и деконсервированных) костного мозга и/или жировой ткани на ранозаживление на модели механической раны у мышей in vivo.
Другая модель, использованная для изучения регенеративной активности препарата in vivo, представляет собой модель глубокой механической раны, края которой для предупреждения стягивания были подшиты к пластиковому кольцу. Препарат вводили на самых ранних этапах раневого процесса (в течение первых пять дней после моделирования раны) в виде подкожных инъекций. Исследование проводили на 30 белых беспородных мышах (15 мышей - группа контроля (без лечения), 15 мышей - опытная группа, которой подкалывали исследуемый препарат).
Спустя пять дней после моделирования ран у животных опытной группы в ране отсутствовал фибрин, экссудация и гиперемия окружающих тканей были слабо выражены, отмечалось набухание краев раны, что свидетельствовало о стихании воспаления. Смещение пика фазы воспаления в опытной группе на более ранний срок наиболее вероятно связано с действием факторов роста и цитокинов, содержащихся в исследуемом препарате. К концу фазы пролиферации на 14 сутки от начала эксперимента в контрольной группе наблюдали продолжающийся процесс эпителизации раневой поверхности, тогда как у животных опытной группы отмечали полное заживление раны и признаки процесса ремоделирования тканей, что указывало на более высокие темпы регенерации при использовании исследуемого препарата.
Пример 5. Исследование аномальной токсичности изобретения.
Испытания на аномальную токсичность исследуемого препарата проводили на белых мышах массой от 19 до 21 г. Препарат, подогретый до 37°С, вводили внутрибрюшинно в количестве 0,5 мл 20-ти мышам. Наблюдение за состоянием здоровья животных осуществляли в течение 7 суток. Считали, что образец выдерживает испытание, если в течение срока наблюдения не погибнет ни одно животное.
Заявленный препарат не вызывал у животных признаков токсичности или других побочных признаков.
Пример 6. Клинические исследования регенеративного препарата на основе экстракта и кондиционной среды культуры мезенхимальных стволовых клеток (как выделенных de novo, так и деконсервированных) из костного мозга и/или жировой ткани кошек при гепатозах.
Согласно предлагаемому изобретению заявляемый препарат вводили 17 кошкам с признаками гепатозов разного возраста и пола, принадлежащим частным лицам.
Заявляемый препарат вводили кошкам по 0,2 мл, предварительно растворив содержимое флакона в 1,0 мл физиологического раствора на 1 кг веса животного внутримышечно ежедневно в течение 5 суток.
За больными животными проводили клиническое наблюдение. Для оценки состояния здоровья брали пробы крови для лабораторных исследований в день поступления, на третьи, шестые и двенадцатые сутки с начала терапии.
При клиническом наблюдении обращали внимание на общее состояние животных, изменение аппетита, наличие рвоты, изменение приема жидкости, состояние кожи и слизистых оболочек (желтушность), проводили макроскопическую оценку физиологических экскрементов.
Улучшение общего состояния животных констатировали при уменьшении или исчезновении желтушной окраски кожи и видимых слизистых оболочек, диспепсических явлений, снижении болезненности при пальпации печени, нормализации общего клинико-физиологического состояния кошек, а также появлении положительной динамики в биохимическом исследовании проб сыворотки крови.
Анализ полученных клинических данных при лечении кошек выявил следующее: к третьим суткам, прошедшим с начала проведения лечения заявляемым препаратом, улучшение общего состояния наступило у одиннадцати животных. Они стали более активными, появился аппетит, исчезла жажда у трех кошек. Особой динамики клинических симптомов не наблюдали.
К шестым суткам общее состояние улучшилось у всех семнадцати животных, у девяти кошек значительно уменьшилась желтушность видимых слизистых оболочек, посветлела моча, кал принял обычную естественную окраску.
К 9-12 суткам четырнадцать кошек выздоровели, у оставшихся животных желтушность уменьшилась. К 12-14 суткам все животные выздоровели. Полученные данные представлены табл. 3.
Из данных, представленных в табл. 4, очевидно, что к шестому дню наблюдения у кошек показатели активности АлТ и АсТ, концентрации билирубина в сыворотке крови нормализовались, что свидетельствует о репаративных процессах в печени данных животных. Нормализация показателей СОЭ и концентрации лейкоцитов у животных свидетельствуют об ослаблении воспалительного процесса в печени к этому дню. К 12 дню заболевания на фоне проводимой терапии у кошек нормализовались все показатели крови. Вместе с тем можно отметить, что к 12 дню показатели глюкозы и общего белка, которые при поступлении животных были на уровне нижней границы нормы (что также свидетельствует о нарушениях в печени), достигли средних значений нормы.
Таким образом, заявляемый препарат показывает терапевтический эффект во всех наблюдаемых случаях применения, обладает выраженными регенеративной, тонизирующей, противовоспалительной, иммуностимулирующей активностью и предназначен для терапии в послеоперационный период, улучшения уровня жизни стареющих животных, а также для лечения дегенеративных заболеваний (цирроз печени, фиброз легких и др.), острых и хронических заболеваний кожи.
Рекомендации по применению предлагаемого препарата
Заявленный препарат рекомендовано применять путем внутримышечных или внутривенных инъекций один раз в день в течение 3-7 дней ежедневно. При необходимости курс повторить через 3-4 дня.
Источники информации
1. Иммуномодулятор-метаболик-детоксикант-адаптоген-радиопротектор. Патент на изобретение N2194502. Приор. 27.12.2000.
2. Дыгай A.M., Зюзьков Г.Н. Клеточная терапия: новые подходы // Наука в России. - Москва: Изд-во «Наука», 2009. - Том. 169. - №1. С. 4-8.
3. Гольдберг Е.Д., Дыгай A.M., Жданов В.В., Зюзьков Г.Н., Мирошниченко Л.А., Симанина Е.В., Ставрова Л.А., Удут Е.В., Фонима Т.Н., Ветошкина Т.В., Хричкова Т.Ю., Ермакова Н.Н., Плотников М.Б., Алиев О.И., Чернышова Г.А. Фармакологические аспекты регенеративной медицины // Бюл. эксперим. биол. и медицины. - 2008. - Приложение 2. - С. 14-21.
4. Патофизиология: Учебник для медицинских ВУЗов. / Под ред. В.В. Новицкого, Е.Д. Гольдберга. - Томск: Изд-во Томского ун-та, 2001. - 681-687.
5. Дыгай А.М., Зюзьков Т.Н., Жданов В.В., Мадонов П.Г., Артамонов А.В., Бекарев А.А., Удут В.В. Иммобилизированный гранулоцитарный колониестимулирующий фактор. Фармакологические свойства и перспективы использования. - Томск: Изд-во: ООО «Печатная мануфактура», 2011. - 149 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ СОБАК, ОБЛАДАЮЩЕЕ РЕГЕНЕРАТИВНОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2646793C1 |
| СРЕДСТВО ДЛЯ ЛОШАДЕЙ, ОБЛАДАЮЩЕЕ РЕГЕНЕРАТИВНОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2646792C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕГЕНЕРАТИВНОГО ВЕТЕРИНАРНОГО ПРЕПАРАТА НА ОСНОВЕ ЭКСТРАКТА МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК И КОНДИЦИОННОЙ СРЕДЫ | 2016 |
|
RU2662172C2 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ПРОТИВОВОСПАЛИТЕЛЬНОЙ, РЕГЕНЕРАТИВНОЙ, ИММУНОМОДУЛИРУЮЩЕЙ, ДЕТОКСИКАЦИОННОЙ, АДАПТОГЕННОЙ АКТИВНОСТЬЮ И СПОСОБНОГО РЕГУЛИРОВАТЬ МЕТАБОЛИЗМ | 2018 |
|
RU2720812C1 |
| СРЕДСТВО ДЛЯ КРУПНОГО РОГАТОГО СКОТА, ОБЛАДАЮЩЕЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ, РЕГЕНЕРАТИВНОЙ, ИММУНОМОДУЛИРУЮЩЕЙ, ДЕТОКСИКАЦИОННОЙ, АДАПТОГЕННОЙ АКТИВНОСТЬЮ И СПОСОБНОЕ РЕГУЛИРОВАТЬ МЕТАБОЛИЗМ | 2018 |
|
RU2720800C1 |
| МАТЕРИАЛ СТВОЛОВЫХ КЛЕТОК И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2785588C2 |
| КОНДИЦИОННАЯ СРЕДА, ОБЛАДАЮЩАЯ ЛЕЧЕБНЫМ ЭФФЕКТОМ | 2005 |
|
RU2292212C1 |
| Способ лечения печеночной недостаточности | 2016 |
|
RU2618989C1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2015 |
|
RU2586952C1 |
| Способ получения препарата на основе стволовых клеток, выделенных из ткани селезенки свиней, для профилактики и лечения инфекционных и незаразных болезней домашних и сельскохозяйственных животных | 2015 |
|
RU2611205C1 |
Изобретение относится к ветеринарии, в частности к ветеринарной терапии, и может быть использовано для стимуляции регенеративных процессов в организме кошки. Средство состоит из экстракта мезенхимальных стволовых клеток (МСК) и кондиционной среды, получаемой в процессе культивирования МСК, при этом средство получено с использованием следующих этапов: выделение de novo или деконсервирование культуры МСК из костного мозга или жировой ткани кошки, культивирование и накопление МСК, получение и сбор кондиционной среды, получение экстракта МСК путем замораживания-оттаивания клеточной суспензии, добавление глицина в концентрации 20 мг/мл к смеси экстракта МСК и кондиционной среды, стерилизация, розлив во флаконы, лиофильная сушка. Изобретение может быть использовано в клинической практике при лечении травм кожи и опорно-двигательного аппарата, при поражениях печени кошки, в послеоперационный период и для улучшения уровня жизни стареющих животных. При этом средство стабильно за счет добавления указанной концентрации глицина, удобно в применении за счет лекарственной формы. 4 ил., 4 табл., 6 пр.
Средство для кошек, обладающее регенеративной активностью, состоящее из экстракта мезенхимальных стволовых клеток (МСК) и кондиционной среды, получаемой в процессе культивирования МСК, при этом средство получено с использованием следующих этапов: выделение de novo или деконсервирование культуры МСК из костного мозга или жировой ткани кошки, культивирование и накопление МСК, получение и сбор кондиционной среды, получение экстракта МСК путем замораживания-оттаивания клеточной суспензии, добавление глицина в концентрации 20 мг/мл к смеси экстракта МСК и кондиционной среды, стерилизация, розлив во флаконы, лиофильная сушка.
| RU 93056731 A, 10.10.1996 | |||
| КОМПОЗИЦИЯ ДЛЯ СТИМУЛИРОВАНИЯ РОСТА И РЕГЕНЕРАЦИИ КЛЕТОК, А ТАКЖЕ СПОСОБЫ ЕЕ ПОЛУЧЕНИЯ | 2006 |
|
RU2341270C2 |
| СПОСОБ СТИМУЛЯЦИИ РОСТА И ПОВЫШЕНИЯ РЕЗИСТЕНТНОСТИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ | 2012 |
|
RU2495565C1 |
| US 20100273141 A1, 28.10.2010 | |||
| КАЛИНОВСКИЙ А.А | |||
| Актуальные проблемы применения мультипотентных мезенхимальных стромальных клеток в современной ветеринарной медицине/ Ветеринария Кубани | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| С | |||
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
Авторы
Даты
2018-03-07—Публикация
2016-12-13—Подача