Область изобретения
Изобретение относится к химическим способам получения соединений, которые пригодны при лечении различных расстройств; такие использования включают, но не ограничиваются ими, использование в качестве антифибриллярных и антиаритмических агентов. Способы этого изобретения пригодны для получения 1,3-дизамещенных 4-оксоциклических мочевин, особенно 1-[[[5-(4-хлорфенил)-2-фуранил] метилен] амино] -3-[4-(4-метил-1-пиперазинил) бутил]-2,4-имидазолидиндиона и его солей.
Предпосылки создания изобретения
Данное изобретение относится к способу получения 1,3-дизамещенных 4-оксоциклических мочевин, особенно 1-[[[5-(4-хлорфенил)-2-фуранил]метилен] амино] -3-[4-(4-метил-1-пиперазинил)бутил] -2,4-имидазолидиндиона или его солей, где конечный продукт получают в чистой форме и с высоким выходом.
Дигидрохлорид 1-[[[5-(4-хлорфенил)-2-фуранил] метилен] амино]-3-[4-(4-метил-1-пиперазинил)бутил] -2,4-имидазолидиндиона (азимилид) описывается в патенте США 5462940 (1995), Norwich Eaton Pharmaceuticals, Ink.; причем указанное описание включается здесь в качестве ссылки. Для этого типа соединения в патенте США 5462940, выданном Yu et al. 31 октября 1995, описываются два общих способа. В каждом из способов описывается ряд реакций, которые включают выделение от трех до пяти промежуточных соединений. Недостатками обоих способов являются использование очень воспламеняемого и чувствительного к воздействию влаги гидрида натрия, потенциально взрывчатых смесей ДМФ/гидрид натрия, избыточных объемов растворителей, иодида натрия и нескольких стадий выделения. Дополнительными недостатками одного способа являются: использование аминозащитной группы и необходимость реакции гидрогенизации для ее удаления.
Из данной области техники известно, что безопасные, дающие более высокие выходы продукта, более экономичные способы получения азимилида должны быть выгодными. Особенно выгодным должно быть уменьшение числа синтетических стадий, повышенная производительность реакции (более высокие концентрации в реакциях), исключение реакции гидрогенизации, элиминирования аминозащитной группы, более высокие общие выходы, возможность проводить реакцию в больших масштабах и лучшие выделения конечного продукта. Неожиданно было установлено, что недостатки описанных синтезов этих соединений можно преодолеть путем проведения последовательности реакций со слабым основанием, таким как карбонат калия для алкилирования, исключения использования иодида натрия для облегчения алкилирования аминогруппы и использования растворителей, таких как метилсульфоксид (ДМСО) и N-метилпирролидон (NMP), чтобы достичь значительно более высоких концентраций в реакциях, повышенного выхода продукта и чистоты.
Предметом данного изобретения является способ получения 1,3-дизамещенных 4-оксоциклических мочевин, посредством которого 1,3-дизамещенные 4-оксоциклические мочевины удобным образом синтезируют с высокими выходами, без выделения промежуточных продуктов, сначала алкилированием соответствующей 1-замещенной 4-оксоциклической мочевины реагентом с углеродной цепью, содержащей до двух уходящих групп, с образованием аддукта, который используют без выделения, для алкилирования амина с образованием 1,3-дизамещенной 4-оксоциклической мочевины, которую, наконец, подвергают реакции с кислотой с образованием целевой соли. Данный способ дает возможность получения 1,3-дизамещенных 4-оксоциклических мочевин в условиях реакции, которые исключают необходимость стадии гидрогенизации и использования аминозащитной группы. Данный способ позволяет достичь повышенных выходов и улучшенной чистоты продукта, более высокой производительности реакции и обеспечивает дополнительную синтетическую простоту получения указанных классов соединений.
В частности, предпочтительные способы данного изобретения обеспечивают новую методологию, которая особенно подходит для масштабирования перехода и производства азимилида.
Краткое изложение сущности изобретения
Данное изобретение предлагает способ получения 1,3-дизамещенных 4-оксоциклических мочевин общей формулы: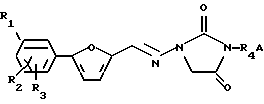
где R1, R2 и R3, независимо, выбирают из группы, состоящей из Н, Cl, F, Br, NH2, NO2, COOH, CH3SO2NH, SО3Н, ОН, алкокси, алкила, алкоксикарбонила, гидроксиалкила, карбоксиалкила и ацилокси;
R4 выбирают из группы, состоящей из замещенного или незамещенного алкила, алкенила, алкинила, алкилацила и гетероалкила; и
А представляет замещенную или незамещенную, насыщенную или ненасыщенную, неразветвленную или разветвленную алкил-или алкениламиногруппу, включающую 1-7 атомов углерода; или А представляет замещенный или незамещенный, насыщенный или ненасыщенный гетероцикл, имеющий 5, 6 или 7 членов, содержащих по крайней мере один азот, и R4 присоединен к данному азоту;
где указанную 1,3-дизамещенную 4-оксоциклическую мочевину получают способом без выделения промежуточных продуктов, включающим стадии:
(Iа) взаимодействия 1-замещенной 4-оксоциклической мочевины с реагентом с углеродной цепью, содержащей по крайней мере две уходящие группы, в присутствии слабого основания и растворителя с образованием аддукта, содержащего по крайней мере одну уходящую группу, и
(Ib) конденсации аддукта с амином с образованием 1,3-дизамещенной 4-оксоциклической мочевины, и
(II) выделения указанной 1,3-дизамещенной 4-оксоциклической мочевины.
Этот способ особенно предпочтителен для получения азимилида. 1-замещенная 4-оксоциклическая мочевина, используемая для получения азимилида, является 1-[[[5-(4-хлорфенил)-2-фуранил]метилен]амино]-2,4-имидазолидиндионом.
Определения и использование терминов
Следующее представляет собой перечень определений для используемых здесь терминов:
Используемая здесь "кислота" означает неорганическую или органическую кислоту. Неорганическая кислота является минеральной кислотой, такой как серная, азотная, хлористоводородная и фосфорная. Органическая кислота представляет собой органическую карбоновую кислоту, такую как муравьиная кислота, уксусная кислота, хлоруксусная кислота, дихлоруксусная кислота, пропионовая кислота, бензойная кислота, малеиновая кислота, фумаровая кислота, янтарная кислота и винная кислота.
Используемый здесь "аддукт" означает промежуточный продукт или продукт химической реакции, содержащий вновь образованную функциональную группу.
Используемый здесь "алкенил" означает углеводородный заместитель с одной или несколькими двойными связями, неразветвленной или разветвленной цепью, незамещенный или замещенный.
Используемый здесь "алкокси" означает заместитель, имеющий структуру Q-O-, где Q представляет алкил или алкенил.
Используемый здесь "алкил" означает насыщенный углеводородный заместитель с неразветвленной или разветвленной цепью, незамещенный или замещенный.
Используемое здесь "основание" означает основный реагент, который добавляют к реакционной смеси, чтобы облегчить алкилирование азота с использованием алкилирующего агента. Основания включают азотистые основания и неорганические основания, такие как N, N-диизопропилэтиламин, триэтиламин, триметиламин, 4-диметиламинопиридин, пиридин, гидрид натрия, гидрид калия, карбонат калия, карбонат натрия, бикарбонат калия и бикарбонат натрия.
Используемый здесь "галоген" означает радикал атома хлора, брома, фтора или иода. Предпочтительными галогенами являются бром и хлор.
Используемое здесь "гетероциклическое кольцо" означает радикал насыщенного, ненасыщенного или ароматического кольца, содержащий атомы углерода и один или несколько гетероатомов в кольце. Гетероциклические кольца являются моноциклическими или конденсированными, мостиковыми или спирополициклическими системами. Моноциклические кольца содержат от 3 до 9 атомов, предпочтительно от 4 до 7 атомов, и наиболее предпочтительно 5 или 6 атомов. Полициклические кольца содержат от 7 до 17 атомов, предпочтительно от 7 до 14 атомов и наиболее предпочтительно 9 или 10 атомов.
Используемый здесь термин "уходящая группа" означает любой замещенный или незамещенный алкил- или арилсульфонат или замещенный или незамещенный алкилгалогенид. Предпочтительными заместителями являются галогены.
Используемый здесь термин "метилен" означает радикал -СН2-.
Используемый здесь "полярный апротонный растворитель" представляет собой растворитель, который обладает свойством высокой полярности, однако не обладает способностью отдавать протон. Предпочтительные полярные апротонные растворители включают N,N-диметилформамид (ДМФ), N,N-диметилацетамид (ДМАЦ), N-метилпирролидон (NMP) и метилсульфоксид (диметилсульфоксид, ДМСО).
Определенные выше и используемые здесь замещающие группы могут сами быть замещены. Такое замещение может быть проведено одним или несколькими заместителями. Такие заместители включают заместители, перечисленные в публикации С. Hansch and A. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology (1979), включенной здесь в качестве ссылки. Предпочтительные заместители включают (например) алкил, алкенил, алкокси, гидрокси, оксо, амино, аминоалкил (например, аминометил и т.д.), циано, галоген, алкокси, алкоксиацил (например, карбоэтокси и т.д.), тиол, арил, циклоалкил, гетероарил, гетероциклоалкил (например, пиперидинил, морфолинил, пирролидинил и т.д), имино, тиоксо, гидроксиалкил, арилокси, арилалкил и их комбинации.
Используемые здесь "объемы" относятся к литрам указанного растворителя на килограмм исходного материала.
Подробное описание изобретения
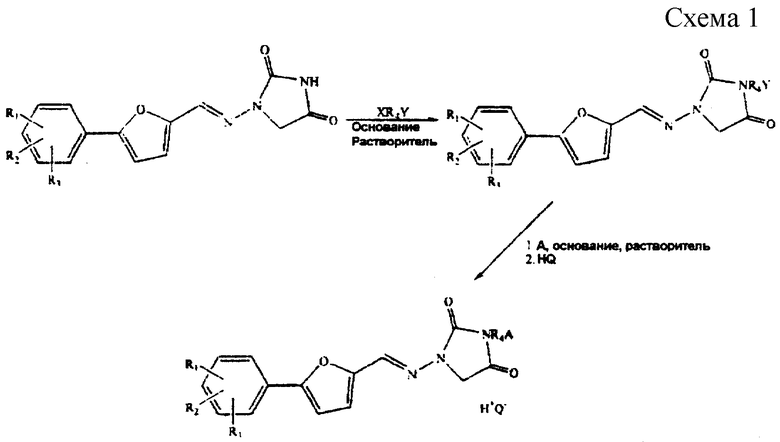
Данное изобретение относится к способу получения 1,3-дизамещенных 4-оксоциклических мочевин, включая, но не ограничиваясь ими, азимилид и другие их фармацевтически приемлемые соли, которые можно получить с высокими выходами, высокой чистотой продукта, высокой производительностью и с синтетической простотой. Данное изобретение включает последовательную процедуру взаимодействия 1-замещенной 4-оксоциклической мочевины с реагентом с углеродной цепью, содержащей две уходящие группы, в полярном апротонном растворителе, в присутствии слабого основания, дальнейшего взаимодействия с амином, осаждения солей сорастворителем, фильтрования и, наконец, добавления кислоты и выделения 1,3-дизамещенной 4-оксоциклической мочевины или ее других солей.
Первое алкилирование происходит при температурах от 40 до 120oС, предпочтительно при температуре примерно от 60 до 75oС. Основание, которое можно использовать, выбирают из оснований, которые образуют легко фильтрующиеся или по другому удаляющиеся соли. Особенно предпочтительные основания включают N, N-диизопропилэтиламин, триэтиламин, триметиламин, 4-диметиламинопиридин, пиридин, гидрид натрия, гидрид калия, карбонат калия, карбонат натрия, бикарбонат калия и бикарбонат натрия. Более предпочтительными основаниями являются карбонат калия, карбонат натрия, бикарбонат калия и бикарбонат натрия. Наиболее предпочтительным основанием является карбонат калия, обычно от 0,8 до 4,0 эквивалентов, предпочтительно от 1,2 до 2 эквивалентов на моль имидазолидиндиона. Предпочтительные реагенты с углеродной цепью выбирают из группы реагентов, содержащих группы галогенов, включая, но ограничиваясь ими, 1-бром-4-хлорбутан, 1,4-дихлор- или 1,4-дибромбутан; более предпочтительным является 1-бром-4-хлорбутан. Специалистам в данной области должно быть известно, что в качестве реагентов с углеродной цепью можно использовать также бутиловые спирты, бутилсульфонилаты и тетрагидрофуран. Обычно используют от 0,8 до 2,5 эквивалента, предпочтительно от 1 до 1,2 эквивалента на моль имидазолидиндиона. Растворителями, которые используют, являются ДМФ, ДМАЦ, ДМСО и NMP, предпочтительно NMP. Обычно используют от 2 до 20 объемов, предпочтительно от 2,5 до 5 объемов NMP.
Предпочтительные 1-замещенные 4-оксоциклические мочевины выбирают из группы, состоящей из: 1-[[[5-(4-хлорфенил)-2-фуранил]метилен]амино]-2,4-имидазолидиндиона; 1-[[[5-(4-метансульфонамидофенил)-2-фуранил]метилен]амино] -2,4-имидазолидиндиона; 1-[[[5-(4-фторфенил)-2-фуранил]метилен]амино]-2,4-имидазолидиндиона; 1-[[[5-(4-нитрофенил)-2-оксазолидинил] метилен] амино]-2,4-имидазолидиндиона; 1-[[[5-(4-метилфенил)-2-фуранил]метилен]амино]-2,4-имидазолидиндиона; 1-[[[5-(3,4-диметоксифенил)-2-фуранил] метилен] амино]-2,4-имидазолидиндиона. При получении азимилида используют 1-замещенную 4-оксоциклическую мочевину, которая представляет собой 1-[[[5-(4-хлорфенил)-2-фуранил]метилен]амино]-2,4-имидазолидиндион.
Второе алкилирование происходит при температурах от 50oС до 120oС, предпочтительно при температурах приблизительно от 75oС до 95oС. Предпочтительные амины для этой стадии выбирают из группы, состоящей из диметиламина; диэтиламина; N, N-бис-(2-гидроксиэтил)амина; изопропиламина; N-бензил-N-метиламина; N-(2-гидроксиэтил)-N-метиламина; N-метилпиперазина; морфолина; 4-гидроксипиперидина; N-метил-N-фениламина. Амином, используемым для получения азимилида, является N-метилпиперазин. Обычно добавляют от 0,8 до 5 эквивалентов, предпочтительно от 1,2 до 3 эквивалентов амина на моль имидазолидиндиона.
После второго алкилирования реакционную смесь охлаждают обычно до температуры от 10o до 50oС, предпочтительно от 5o до 35oС. Сорастворителем, используемым для осаждения солей, является простой эфир, ацетон, метанол, этанол или смеси вышеуказанных сорастворителей, предпочтительно ацетон. Обычно используют от 0 до 20 объемов, предпочтительно от 6 до 10 объемов. Нерастворимые соли собирают фильтрованием и промывают сорастворителем.
Воду добавляют к реакционной смеси для подготовки к образованию соли. Обычно используют от 0 до 5 объемов, предпочтительно от 0,5 до 2,8 объемов воды. Кислотой, которую используют для получения целевой соли, является хлористоводородная кислота.
Обычно рН регулируют в диапазоне рН от 3 до 7, предпочтительно рН от 4,5 до 5, для образования центров кристаллизации с последующим дальнейшим добавлением кислоты до рН 0-3 для осаждения указанного азимилида, который собирают фильтрованием с выходом от 80 до 90%.
Азимилид, полученный по способу данного изобретения, пригоден для лечения различных медицинских расстройств, такие использования включают, но не ограничиваются ими, использования в качестве антифибрилляторных и антиаритмических агентов. Специалистам в данной области должно быть известно, что на конечных стадиях способа для образования различных форм солей, которые могут облегчить выделение и манипулирование, можно добавить различные кислоты. По способу данного изобретения можно получить другие фармацевтически приемлемые соли, такие, как например, сульфат и гидробромид, эти соли включаются в объем данного изобретения.
Данный способ иллюстрируется общей схемой 1 (см. в конце описания), где R1, R2 и R3 независимо выбирают из группы, состоящей из Н, Cl, F, Br, NH2, NO2, СООН, СН3SО2НН, SО3Н, ОН, алкокси, алкила, алкоксикарбонила, гидроксиалкила, карбоксиалкила и ацилокси;
R4 выбирают из группы, состоящей из замещенного или незамещенного алкила, алкенила, алкинила, алкилацила и гетероалкила;
А представляет замещенную или незамещенную, насыщенную или ненасыщенную, неразветвленную или разветвленную алкил- или алкениламиногруппу, включающую 1-7 атомов углерода; или А представляет замещенный или незамещенный, насыщенный или ненасыщенный гетероцикл, имеющий 5, 6 или 7 членов, содержащих по крайней мере один азот, и R4 присоединен к данному азоту;
Х и Y представляют, независимо, уходящую группу, предпочтительно различные уходящие группы;
где указанную 1,3-дизамещенную 4-оксоциклическую мочевину получают способом без выделения промежуточных продуктов, включающим стадии:
(Iа) взаимодействия 1-замещенной 4-оксоциклической мочевины с реагентом с углеродной цепью, содержащей по крайней мере две уходящие группы, в присутствии слабого основания и растворителя с образованием аддукта, содержащего по крайней мере одну уходящую группу, и
(Ib) конденсации аддукта с амином с образованием 1,3-дизамещенной 4-оксоциклической мочевины, и
(II) выделения указанной 1,3-дизамещенной 4-оксоциклической мочевины.
Следующие неограничивающие примеры иллюстрируют способы данного изобретения.
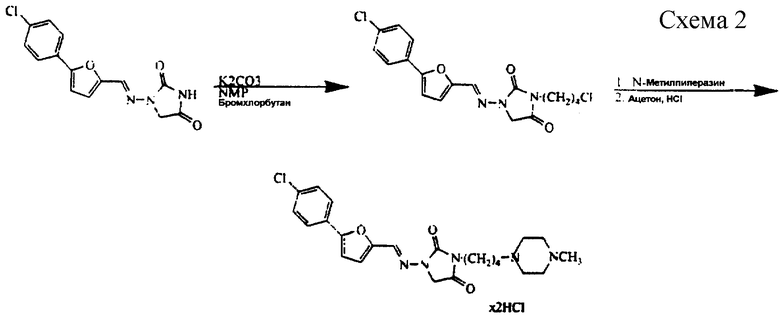
Пример 1. Использование диметилформамида (ДМФ) в качестве растворителя для реакции получения азимилида.
В трехгорлую колбу на 12 л, снабженную термометром, механической мешалкой, нагревательным кожухом, обратным холодильником и капельной воронкой, загружают ДМФ (4,77 л) и нагревают до 50oС. Добавляют 1-[[[5-(4-хлорфенил)-2-фуранил] метилен] амино] -2,4-имидазолидиндион (597 г) и продолжают нагревание. Когда растворение завершается, в колбу загружают карбонат калия (276 г) и нагревание продолжают до 85oС. Через 10 минут добавляют 1-бром-4-хлорбутан (370 г) и нагревание продолжают приблизительно до 100oС. Через 35 минут добавляют N-метилпиперазин (465 г) и смесь оставляют при перемешивании в течение 1 часа при 100oС. Реакционную смесь охлаждают приблизительно до 10oС и фильтруют для удаления нерастворимых материалов. ДМФ удаляют при пониженном давлении при 65-68oС и заменяют абсолютным этанолом (3,6 л). Смесь нагревают для растворения свободного основания и фильтруют для удаления нерастворимых материалов. Продукт осаждают из этанола (всего 6,0 л) добавлением 418 г концентрированной хлористоводородной кислоты и затем фильтруют, получая 680 г этого соединения.
Пример 2. Использование метилсульфоксида (ДМСО) в качестве растворителя для реакции получения азимилида
В трехгорлую колбу на 500 мл, снабженную термометром, механической мешалкой, нагревательным кожухом, обратным холодильником и капельной воронкой, загружают ДМСО (200 мл) и 1-[[[5-(4-хлорфенил)-2-фуранил]метилен]амино]-2,4-имидазолидиндион (20 г). После растворения добавляют карбонат калия (15,5 г) и 1-бром-4-хлорбутан (13,6 г) и смесь нагревают до 70oС на протяжении 30 минут. К смеси на протяжении 15 минут добавляют N-метилпиперазин (19,8 г) при нагревании до 90oС. После, в целом, 2 часов и 15 минут реакционную смесь охлаждают приблизительно до 30oС и добавляют метанол (200 мл). Смесь охлаждают до комнатной температуры и фильтруют для удаления нерастворимых материалов. Фильтрат подкисляют концентрированной хлористоводородной кислотой до рН 1-2. Смесь охлаждают до 15oС и фильтруют, получая 30,4 г данного соединения.
Пример 3. Использование N,N-диметилацетамида (ДМАЦ) в качестве растворителя для реакции получения азимилида
В трехгорлую колбу на 2 л, снабженную термометром, механической мешалкой, нагревательным кожухом, обратным холодильником и капельной воронкой, загружают ДМАЦ (200 мл) и 1-[[[5-(4-хлорфенил)-2-фуранил]метилен]амино]-2,4-имидазолидиндион (100 г), 1-бром-4-хлорбутан (59 г) и карбонат калия (73 г). Смесь перемешивают приблизительно в течение 100 минут при нагревании до 70oС. Добавляют N-метилпиперазин (59,5 г) и смесь перемешивают в течение дополнительных 3 часов с нагреванием до 86oС. Реакционную смесь охлаждают до 20oС и добавляют ацетон (900 мл). Смесь фильтруют для удаления нерастворимых материалов. Фильтрат подкисляют концентрированной хлористоводородной кислотой до рН 1-2, охлаждают до 15oС и фильтруют, получая 122,7 г данного соединения.
Пример 4. Использование N-метилпирролидона (NMP) в качестве растворителя для реакции получения азимилида
В трехгорлую колбу на 5 л, снабженную термометром, механической мешалкой, нагревательным кожухом, обратным холодильником и капельной воронкой, загружают NMP (1,2 л), 1-[[[5-(4-хлорфенил)-2-фуранил]метилен]амино]-2,4-имидазолидиндион (300 г), 1-бром-4-хлорбутан (187 г) и карбонат калия (219 г). Смесь перемешивают в течение приблизительно 1 часа при нагревании до 70oС. Добавляют N-метилпиперазин (149 г) и смесь перемешивают в течение приблизительно 150 минут при нагревании до 90oС. Реакционную смесь охлаждают до 20oС и добавляют ацетон (2,4 л). Смесь фильтруют для удаления нерастворимых материалов. К фильтрату добавляют воду (0,42 л) и смесь нагревают до температуры от 30 до 35oС. Смесь подкисляют концентрированной хлористоводородной кислотой до рН от 4,5 до 5, вносят затравку продукта, перемешивают в течение 1 часа и затем далее подкисляют концентрированной хлористоводородной кислотой до рН от 0 до 3. Смесь охлаждают до 10oС и фильтруют, получая 382,8 г данного соединения (см. схему 2 в конце описания).
Изобретение относится к усовершенствованному способу получения 1,3-дизамещенных 4-оксоциклических мочевин, используемых в качестве антифибриллярных и антиаритмических агентов, общей формулы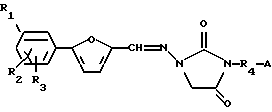
где R1, R2 и R3 независимо выбирают из группы, состоящей из Н, Cl, F, Br, NH2, NO2, COOH, CH3SO2NH, SО3H, ОН, алкокси, алкила, алкоксикарбонила, гидроксиалкила, карбоксиалкила и ацилокси; R4 выбирают из группы, состоящей из замещенного или незамещенного алкила, алкенила, алкинила, алкилацила и гетероалкила; и А представляет замещенную или незамещенную, насыщенную или ненасыщенную, неразветвленную или разветвленную алкил- или алкениламиногруппу, включающую 1-7 атомов углерода; или А представляет замещенный или незамещенный, насыщенный или ненасыщенный гетероцикл, имеющий 5, 6 или 7 членов, содержащий по крайней мере один азот, и R4 присоединен к данному азоту; включающий стадии: а) взаимодействия 1-замещенной 4-оксоциклической мочевины, имеющей формулу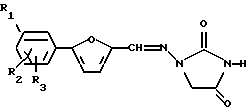
с реагентом с углеродной цепью, выбранным из 1-бром-4-хлорбутана, 1,4-дихлорбутана, 1,4-дибромбутана и их смесей, в присутствии слабого основания, выбранного из группы, включающей карбонат калия, карбонат натрия, бикарбонат калия, бикарбонат натрия и полярного апротонного растворителя с образованием 3-N-алкилированного 2,4-имидазолидиндиона; и b) взаимодействия указанного сырого 3-N-алкилированного 2,4-имидазолидиндиона с амином с образованием 1,3-дизамещенной 4-оксоциклической мочевины. Технический результат - повышение выхода и улучшение чистоты продукта. 10 з.п.ф-лы.
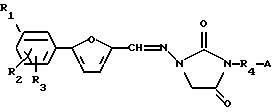
где R1, R2 и R3 независимо выбирают из группы, состоящей из Н, Сl, F, Br, NH2, NO2, COOH, CH3SO2NH, SO3H, ОН, алкокси, алкила, алкоксикарбонила, гидроксиалкила, карбоксиалкила и ацилокси;
R4 выбирают из группы, состоящей из замещенного или незамещенного алкила, алкенила, алкинила, алкилацила и гетероалкила;
А представляет замещенную или незамещенную, насыщенную или ненасыщенную, неразветвленную или разветвленную алкил- или алкениламиногруппу, включающую 1-7 атомов углерода; или А представляет замещенный или незамещенный, насыщенный или ненасыщенный гетероцикл, имеющий 5, 6 или 7 членов, содержащий по крайней мере один азот;
R4 присоединен к данному азоту;
включающий стадии: а) взаимодействия 1-замещенной 4-оксоциклической мочевины, имеющей формулу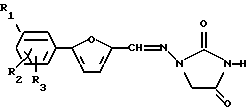
с реагентом с углеродной цепью, выбранным из 1-бром-4-хлорбутана, 1,4-дихлорбутана, 1,4-дибромбутана, в присутствии слабого основания, выбранного из группы, включающей карбонат калия, карбонат натрия, бикарбонат калия, бикарбонат натрия, и полярного апротонного растворителя с образованием 3-N-алкилированного 2,4-имидазолидиндиона; и b) взаимодействия указанного сырого 3-N-алкилированного 2,4-имидазолидиндиона с амином с образованием 1,3-дизамещенной 4-оксоциклической мочевины.
| US 5462940 А, 31.10.1995 | |||
| US 4001222 А, 04.01.1977 | |||
| US 4720580 А, 19.01.1988 | |||
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1994 |
|
RU2126004C1 |
Авторы
Даты
2002-12-20—Публикация
1999-04-27—Подача