ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Эта заявка является частичным продолжением заявки США, сер. 08/352400, поданной 8 декабря 1994 года, содержание которой включено здесь в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к графитовым нанотрубкам, которые включают трубчатые фуллерены (обычно называемые "buckytubes") и фибриллы, которые функционализованы (присоединение функциональных групп) химическим замещением или адсорбцией функциональных частей молекул. Более конкретно данное изобретние относится к графитовым нанотрубкам, которые однородно или неоднородно замещены химическими частями молекул или на которых адсорбированы некоторые циклические соединения, и к комплексным структурам, содержащим такие функционализованные фибриллы, соединенные друг с другом. Данное изобретение относится также к способам введения функциональных групп на поверхность таких структур.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Данное изобретение лежит в области субмикронных графитовых фибрилл, иногда называемых выращенными в парах углеродными волокнами. Углеродные фибриллы представляют собой червеобразные углеродные отложения, имеющие диаметры менее 1,0 мкм, предпочтительно менее 0,5 мкм и, даже более предпочтительно, менее 0,2 мкм. Они существуют в разнообразных формах и были получены каталитическим разложением различных углеродсодержащих газов на металлических поверхностях. Такие червеобразные углеродные отложения наблюдали почти со времени появления электронной микроскопии. Хороший ранний обзор и ссылки можно найти в Baker and Harris, Chemistry and Physics of Carbon, Walker and Thrower ed. , Vol. 14, 1978, p. 83, включено здесь в качестве ссылки. См. также Rodriguez N., J. Mater. Research, Vol. 8, р. 3233 (1993), включено здесь в качестве ссылки.
В 1976 году Endo et а1. (см. Obelin A. and Endo M., J. of Crystal Growth, Vol. 32 (1976), pp. 335-349, включено здесь в качестве ссылки) выяснили основной механизм, по которому происходит рост таких углеродных фибрилл. Было обнаружено, что они происходят из частицы металлического катализатора, который в присутствии содержащего углеводород газа становится пересыщенным по углероду. Экструдируется цилиндрический графитовый сердечник, который немедленно, согласно Endo et аl., становится покрытым наружным слоем пиролитически отлагающегося графита. Эти фибриллы с пиролитическим покрытием, как правило, имеют диаметры более 0,1 мкм, более типично 0,2-0,5 мкм.
В 1983 году Tennent, US Patent No. 4663230, включено здесь в качестве ссылки, удалось вырастить цилиндрические графитовые сердечники, незагрязненные пиролитическим углеродом. Таким образом, изобретение Tennent обеспечило доступность фибрилл меньшего диаметра, как правило, 35-700 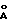 (0,0035-0,07 мкм), и упорядоченной, "как бы выращенной" графитовой поверхности. Фибриллярные углеродные материалы менее совершенной структуры, но без наружного слоя пиролитического углерода также были выращены.
(0,0035-0,07 мкм), и упорядоченной, "как бы выращенной" графитовой поверхности. Фибриллярные углеродные материалы менее совершенной структуры, но без наружного слоя пиролитического углерода также были выращены.
Фибриллы (трубчатые фуллерены) и нановолокна отличаются от непрерывных углеродных волокон, коммерчески доступных в качестве материалов усиливающих волокон. В противоположность фибриллам, которые имеют желательно большие, но неизбежно конечные относительные удлинения, непрерывные углеродные волокна имеют относительные длины (L/D, длина/диаметр) по меньшей мере 104 и часто 106 или более. Диаметр непрерывных волокон также гораздо больше, чем диаметр фибрилл, будучи всегда >1,0 мкм и, как правило, 5-7 мкм.
Непрерывные углеродные волокна производят пиролизом органических предшественников-волокон, обычно гидратцеллюлозного волокна, полиакрилонитрила (PAN) и смолы. Таким образом, они могут содержать гетероатомы в их структурах. Графитовая природа "как бы изготовленных" непрерывных углеродных волокон изменяется, но они могут быть подвергнуты последующей стадии графитизации. Различия в степени графитизации, ориентации и кристалличности графитовых поверхностей, если они присутствуют, потенциальное присутствие гетероатомов и даже абсолютное различие в диаметре субстрата делает опыт работы с непрерывными волокнами малоперспективным для химии нановолокон.
Tennent, US Patent No. 4663230, описывает углеродные фибриллы, которые не имеют непрерывного термического углеродного покрытия и имеют множественные графитовые наружные слои, которые по существу параллельны оси фибриллы. Как таковые, они могут быть охарактеризованы как имеющие с-оси, оси, которые являются перпендикулярными касательным изогнутых слоев графита, по существу перпендикулярными их цилиндрическим осям. Как правило, они имеют диаметры не более 0,1 мкм и отношения длины к диаметру по меньшей мере 5. Желательно, чтобы они были по существу свободны от непрерывного термического углеродного покрытия, т. е. пиролитически отлагающегося углерода, происходящего вследствие термического разрушения подаваемого газа, используемого для их изготовления.
Tennent et al., US Patent No. 5171560, включено здесь в качестве ссылки, описывает углеродные фибриллы, не содержащие термического покрытия и имеющие графитовые слои, по существу параллельные осям фибрилл, так что проекция этих слоев на оси фибрилл простирается на расстояние по меньшей мере двух диаметров фибрилл. Как правило, такие фибриллы являются по существу цилиндрическими, графитовыми нанотрубками по существу постоянного диаметра и содержат цилиндрические графитовые слои, с-оси которых по существу перпендикулярны их цилиндрической оси. Они практически не имеют пиролитически отложенного углерода, имеют диаметр менее 0,1 мкм и отношение длины к диаметру более 5. Эти фибриллы являются фибриллами первостепенного интереса в данном изобретении.
Дальнейшие подробности, касающиеся образования агрегатов углеродных фибрилл, могут быть найдены в описании Snyder et al., US Patent Application Serial No. 149573, поданной 28 января 1988 года, и PCN Application No. US 89/00322, поданной 28 января 1989 года ("Углеродные фибриллы"), WO 89/07163, и Моy et al., US Patent Application Serial No. 413837, поданной 28 сентября 1989 года, и PCN Application No. US 90/05498, поданной 27 сентября 1990 ("Агрегаты фибрилл и способ их приготовления"), WO 91/05089, все переуступленные правопреемнику, являющемуся также правопреемником данного изобретения, и включенные в качестве ссылки.
Моу et al., USSN 07/887307, filed May 22, 1992, включено здесь в качестве ссылки, описывает фибриллы, приготовленные в виде агрегатов, имеющих различные макроскопические морфологии (как определено сканирующим электронным микроскопом), в которых они произвольно спутаны друг с другом с образованием спутанных шариков или фибрилл, напоминающих гнезда птиц ("BN", bird nests), или в виде агрегатов, состоящих из пучков прямых, слегка изогнутых или загнутых углеродных фибрилл, имеющих по существу одну и ту же относительную ориентацию и имеющих вид, например, расчесанной пряжи ("CY", combed yarn), продольная ось каждой фибриллы (несмотря на индивидуальные изгибы или загибы) простирается в том же самом направлении, что и направление окружающих фибрилл в пучках, или в виде агрегатов, состоящих из прямых или слегка согнутых или загнутых фибрилл, которые рыхло спутаны друг с другом с образованием структуры "открытой сетки" ("ON", open net). В структурах открытой сетки степень спутанности фибрилл является большей, чем в агрегатах типа расчесанной пряжи (в которых отдельные фибриллы имеют по существу одну и ту же относительную ориентацию), но меньшей, чем в случае типа птичьих гнезд. CY- и ON-агрегаты более легко диспергируются, чем BN, что делает их применимыми в изготовлении композиционного материала, где желательны однородные свойства по всей структуре.
Когда проекция графитовых слоев на ось фибриллы простирается на расстояние, меньшее, чем два диаметра фибриллы, углеродные плоскости графитового нановолокна, в поперечном сечении, имеют вид скелета селедки. Они названы фибриллами рыбьего скелета. Geus, US Patent No. 4855091, включено здесь в качестве ссылки, обеспечивает процедуру для приготовления фибрилл рыбьего скелета, практически не содержащих пиролитического покрытия. Эти фибриллы применимы также в практике данного изобретения.
Углеродные нанотрубки с морфологией, сходной с каталитически выращенными фибриллами, описанными выше, были выращены в высокотемпературной угольной дуге (Iijima. , Nature, 354, 56, 1991). Сейчас, как правило, признается (Weaver, Science, 265, 1994), что эти выращенные в угольной дуге нановолокна имеют ту же самую морфологию, что и более ранние каталитически выращенные фибриллы Tennent. Выращенные в угольной дуге углеродные нановолокна также применимы в данном изобретении.
McCarthy et al., US Patent Application Serial No. 351967, filed May 15, 1989, включено здесь в качестве ссылки, описывают способы окисления поверхности углеродных фибрилл, которые предусматривают контактирование этих фибрилл с окислителем, который включает серную кислоту (Н2SО4) и хлорат калия (КСlO3), в реакционных условиях (например, времени, температуре и давлении), достаточных для окисления поверхности фибриллы. Фибриллы, окисленные в соответствии с процессами McCarthy et al., являются неоднородно окисленными, т.е. атомы углерода замещены смесью карбоксильных, альдегидных, кетоновых, фенольных и других карбонильных групп.
Фибриллы также неоднородно окислялись обработкой азотной кислотой. International Application PCN/US 94/10168 описывает образование окисленных фибрилл, содержащих смесь функциональных групп. Hoogenvaad M. S. et al. ("Metal Catalysts supported on Novel Carbon Support", Presented at Sixth International Conference on Scientific Basis for the Preparation of Heterogeneous Catalysts, Brussels, Belgium, September 1994) также обнаружили, что удобно при приготовлении удерживаемых на фибриллах благородных металлов предварительно окислять поверхности фибрилл азотной кислотой. Такая предварительная обработка кислотой является стандартной стадией в приготовлении удерживаемых на углеродных носителях катализаторов -благородных металлов, где, при обычных источниках такого углерода, она служит настолько же для очистки поверхности от нежелательных материалов, насколько для функционализации ее.
В опубликованной работе McCarthy and Bening (Polymer Preprints ACS Div. of Polymer Chem., 30 (1) 420 (1990)) производные окисленных фибрилл получают для демонстрации того, что эта поверхность содержит множество окисленных групп. Соединения, которые были получены, фенилгидразоны, галогенароматические сложные эфиры, соли таллия и т.д., были выбраны из-за их аналитической применимости, вследствие, например, их яркой окраски или проявления какого-либо сильного и легко индентифицируемого и дифференцируемого сигнала. Эти соединения не были выделены и, в отличие от производных, описанных здесь, не имеют практического значения.
Хотя были найдены многие возможности использования углеродных фибрилл, описанные в патентах и патентных заявках, которые даны в виде ссылок выше, многочисленные и различные применения могут быть разработаны при функционализации поверхностей фибрилл. Функционализация, однородная или неоднородная, делает возможным взаимодействие функционализованных фибрилл с различными субстратами с образованием уникальных композиций с уникальными свойствами и образование фибриллярных структур на основе связей между функциональными сайтами на поверхности фибрилл.
ОБЪЕКТЫ ИЗОБРЕТЕНИЯ
Таким образом, первым объектом данного изобретения являются функционализованные фибриллы, т.е. фибриллы, поверхности которых однородно или неоднородно модифицированы таким образом, что они имеют связанную с ними функциональную химическую группу.
Следующим и связанным с этим объектом данного изобретения являются фибриллы, поверхности которых функционализованы реакцией в окислительной или других химических средах.
Другим и связанным с этим объектом данного изобретения являются фибриллы, поверхности которых однородно модифицированы либо химической реакцией, либо физической адсорбцией молекул, которые сами обладают химической реакционной способностью.
Следующим объектом данного изобретения являются фибриллы, поверхности которых были модифицированы, например, окислением, которые затем дополнительно модифицированы реакцией с функциональными группами.
Еще одним дополнительным и связанным с этим объектом данного изобретения являются фибриллы, поверхности которых модифицированы спектром функциональных групп, так что эти фибриллы могут химически взаимодействовать или физически связываться с химическими группами в различных субстратах.
Еще одним дополнительным и связанным с этим объектом данного изобретения являются комплексные структуры фибрилл путем связывания функциональных групп на фибриллах друг с другом посредством ряда линкерных химических групп.
Еще одним дополнительным и связанным с этим объектом данного изобретения являются способы химической модификации поверхностей фибрилл и способы физической адсорбции частиц на поверхностях фибрилл для создания таким образом, в каждом случае, функциональной группы, связанной с поверхностью фибриллы.
Дополнительным объектом данного изобретения являются новые композиции на основе функционализованных фибрилл.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фиг.1 является графическим представлением анализа связывания БСА с обыкновенными фибриллами, карбоксифибриллами и модифицированными PEG (ПЭГ) фибриллами.
Фиг.2 является графическим представлением анализа связывания β-лактоглобулина с карбоксифибриллами и модифицированными PEG (ПЭГ) фибриллами, полученными двумя различными способами.
Фиг. 3 является графическим представлением в виде диаграммы профиля элюции бычьего сывороточного альбумина (БСА) на колонке фибрилл, модифицированных третичным амином.
Фиг.4 является графическим представлением в виде диаграммы профиля элюции БСА на колонке фибрилл, модифицированных четвертичным амином.
Фиг.5 представляет последовательность реакций для получения дендримерных фибрилл на основе лизина.
Фиг. 6 является графическим представлением циклических вольтамперограмм, демонстрирующих использование модифицированных железо-фталоцианином фибрилл в проточной ячейке.
Фиг. 7 представляет последовательность реакций для получения бифункциональных фибрилл путем присоединения Nε-(трет-бутоксикарбонил)-L-лизина.
Фиг.8 является графическим представлением результатов синтеза этилбутирата с применением иммобилизованной фибриллами липазы.
Фиг.9 является графическим представлением результатов выделения щелочной фосфатазы (АР) из смеси АР и β-галактозидазы (βG) с использованием модифицированных ингибиторами фибрилл.
Фиг. 10 является графическим представлением результатов выделения βG из смеси АР и βG с применением модифицированных βG фибрилл.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение относится к композициям, которые в общем имеют общую формулу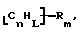
где n обозначает целое число, L обозначает число менее 0,1n, m обозначает число менее 0,5n,
каждый из R является одним и тем же и выбран из SО3Н, СООН, NH2, ОН, R'CHOH, CHO, CN, COCl, галогена, COSH, SH, COOR', SR', SiR'3, 
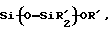 R'', Li, AlR'2, Hg-X, TlZ2 и Мg-Х,
R'', Li, AlR'2, Hg-X, TlZ2 и Мg-Х,
y обозначает целое число, равное или меньше 3,
R' обозначает водород, алкил, арил, циклоалкил или аралкил, циклоарил или поли(алкиловый эфир),
R'' обозначает фторалкил, фторарил, фторциклоалкил, фтораралкил или циклоарил,
Х обозначает галоген и
Z обозначает карбоксилат или трифторацетат.
Атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки по существу постоянного диаметра. Нанотрубки включают трубки, имеющие отношение длины к диаметру более 5 и диаметр менее 0,5 мкм, предпочтительно менее 0,1 мкм. Нанотрубки могут быть также практически цилиндрическими графитовыми нанотрубками, которые по существу не содержат пиролитически отложенного углерода, более предпочтительно нанотрубками, характеризующимися тем, что они имеют проекцию графитовых слоев на ось фибриллы, которая простирается на расстояние по меньшей мере двух диаметров фибриллы, и/или нанотрубками, имеющими цилиндрические графитовые слои, с-оси которых по существу перпендикулярны их цилиндрической оси. Эти композиции являются однородными в том смысле, что каждый из R является одним и тем же.
Также были получены неоднородно замещенные нанотрубки. Они включают композиции формулы
где n, L, m, R и сама нанотрубка аналогичны описанным выше, при условии, что каждый из R не содержит кислорода или, если каждый из R является кислородсодержащей группой, СООН не присутствует.
Функционализованные нанотрубки, имеющие формулу
где n, L, m, R и R' имеют указанные выше значения и атомы углерода являются поверхностными атомами углерода фибриллы типа рыбьего скелета, имеющими отношение длины к диаметру более 5, также включены в данное изобретение. Они могут быть однородно или неоднородно замещенными. Предпочтительно эти нанотрубки не имеют термического покрытия и имеют диаметры менее 0,5 мкм.
В изобретение также включены функционализованные нанотрубки, имеющие формулу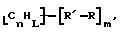
где n, L, m, R' и R имеют указанные выше значения.
Атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки по существу постоянного диаметра. Эти нанотрубки имеют отношение длины к диаметру более 5 и диаметр менее 0,5 мкм, предпочтительно менее 0,1 мкм. Эти нанотрубки могут быть нанотрубками, которые по существу не содержат пиролитически отложенного углерода. Более предпочтительно эти нанотрубки являются нанотрубками, которые имеют проекцию графитовых слоев на оси фибрилл, которая простирается на расстояние по меньшей мере двух диаметров фибриллы, и/или нанотрубками, имеющими цилиндрические графитовые слои, с-оси которых по существу перпендикулярны их цилиндрической оси.
Как в однородно, так и в неоднородно замещенных нанотрубках реагируют поверхностные атомы Сn. Большинство атомов углерода в поверхностном слое графитовой фибриллы, как в графите, являются углеродами базисной плоскости. Углероды базисной плоскости относительно инертны к химической атаке. В дефектных местах, где, например, графитовая плоскость не простирается полностью вокруг фибриллы, имеются атомы углерода, аналогичные краевым атомам углерода графитовой плоскости (см. Urry, Elementary Equilibrium Chemistry of Carbon, Wiley, New York, 1989, в отношении обсуждения концевых углеродов и углеродов базисной плоскости).
В дефектных местах могут быть обнажены краевые углероды или углероды базисной плоскости нижних, внутренних слоев нанотрубки. Термин поверхностный углерод включает все углероды, базисной плоскости и краевые, самого верхнего слоя нанотрубки, а также углероды как базисной плоскости, так и/или краевые более нижних слоев, которые могут быть обнажены в дефектных местах самого верхнего слоя. Краевые углероды являются реакционноспособными и должны содержать какой-либо гетероатом или группу в соответствии с валентностью углерода.
Замещенные нанотрубки, описанные выше, могут быть выгодно функционализованы дополнительно. Такие композиции включают композиции формулы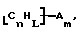
где углероды являются поверхностными углеродами нанотрубки,
n, L и m имеют указанные выше значения,
А выбран из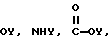
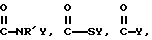 -CR'2-OY, N=Y,
-CR'2-OY, N=Y,
Y обозначает подходящую функциональную группу белка, пептида, аминокислоты, фермента, антитела, нуклеотида, олигонуклеотида, антигена или субстрата фермента, ингибитора фермента или аналога переходного состояния субстрата фермента или выбран из R'-OH, R'-NR'2, R'SH, R'CHO, R'CN, R'X, R'N+(R')3Х-, R'SiR'3, 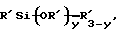
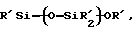 R'-R'', R'-N-CO,
R'-R'', R'-N-CO, 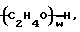
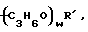
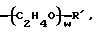 (С3Н6О)w-R',
(С3Н6О)w-R',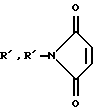
и w обозначает целое число более одного и менее 200.
Атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки по существу постоянного диаметра. Эти нанотрубки включают нанотрубки, имеющие отношение длины к диаметру более 5 и диаметр менее 0,5 мкм, предпочтительно менее 0,1 мкм. Нанотрубки могут быть также по существу цилиндрическими графитовыми нанотрубками, которые по существу не содержат пиролитически отложенного углерода. Более предпочтительно они характеризуются тем, что они имеют проекцию графитовых слоев на оси фибрилл, которая простирается на расстояние по меньшей мере двух диаметров фибриллы, и/или они состоят из цилиндрических графитовых слоев, с-оси которых по существу перпендикулярны их цилиндрическим осям. Предпочтительно эти нанотрубки не содержат термического покрытия и имеют диаметры менее 0,5 мкм.
Функциональные нанотрубки структуры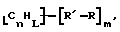
могут быть также функционализованы с образованием композиций, имеющих формулу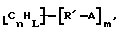
где n, L, m, R' и А имеют указанные выше значения.
Атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки по существу постоянного диаметра. Эти нанотрубки включают нанотрубки, имеющие отношение длины к диаметру более 5 и диаметр менее 0,5 мкм, предпочтительно менее 0,1 мкм. Нанотрубки могут быть также по существу цилиндрическими графитовыми нанотрубками, которые по существу не содержат пиролитически отложенного углерода. Более предпочтительно они характеризуются тем, что они имеют проекцию графитовых слоев на оси фибрилл, которая простирается на расстояние по меньшей мере двух диаметров фибриллы, и/или имеют цилиндрические графитовые слои, с-оси которых по существу перпендикулярны их цилиндрической оси. Предпочтительно эти нанотрубки не имеют термического покрытия и имеют диаметры менее 0,5 мкм.
Композиции по данному изобретению включают также нанотрубки, на которых адсорбированы определенные циклические соединения. Они включают композиции вещества формулы
где n обозначает целое число, L обозначает число менее 0,1n, m является меньше 0,5n, а равно нулю или обозначает число менее 10, Х является полициклической ароматической, полигетероциклической ароматической или металлополигетероциклической ароматической частью молекулы и R имеет указанное выше значение.
Атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки по существу постоянного диаметра. Эти нанотрубки включают нанотрубки, имеющие отношение длины к диаметру более 5 и диаметр менее 0,5 мкм, предпочтительно менее 0,1 мкм. Нанотрубки могут быть также по существу цилиндрическими графитовыми нанотрубками, которые по существу не содержат пиролитически отложенного углерода, и более предпочтительно нанотрубками, характеризующимися тем, что они имеют проекцию графитовых слоев на оси фибрилл, которая простирается на расстояние по меньшей мере двух диаметров фибриллы, и/или нанотрубками, имеющими цилиндрические графитовые слои, с-оси которых по существу перпендикулярны их цилиндрическим осям. Предпочтительно эти нанотрубки не имеют термического покрытия и имеют диаметры менее 0,5 мкм.
Предпочтительные циклические соединения представляют собой плоские макроциклы, описанные на стр. 76 Cotton and Wilkinson, Advanced Organic Chemistry. Более предпочтительными циклическими соединениями для адсорбции являются порфирины и фталоцианины.
Адсорбированные циклические соединения могут быть функционализованы. Такие композиции включают соединения формулы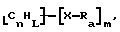
где m, n, L, а, Х и А имеют описанные выше значения и атомы углерода являются поверхностными атомами углерода по существу цилиндрической графитовой нанотрубки, как описано выше.
Углеродные фибриллы, функционализованные, как описано выше, могут быть включены в матрицу. Предпочтительно матрица представляет собой органический полимер (например, термореактивная смола, такая как эпокси-, бисмалеимидная, полиамидная или полиэфирная смола; термопластичная смола; реакционная полученная литьем под давлением смола, или эластомер, такой как природный каучук, бутадиенстирольный каучук, или цис-1,4-полибутадиен); неорганический полимер (например, полимерный неорганический оксид, такой как стекло); металл (например, свинец или медь) или керамический материал (например, клей Портланда). Из матрицы, в которую были включены эти фибриллы, могут быть образованы гранулы. Альтернативно функционализованные фибриллы могут быть присоединены к наружной поверхности функционализованных гранул.
Без связывания с конкретной теорией, функционализованные фибриллы лучше диспергируются в полимерных системах, поскольку свойства их модифицированной поверхности более совместимы с полимером или поскольку модифицированные функциональные группы (в частности, гидроксильные или аминогруппы) связываются непосредственно с полимером при концевых группах. Таким путем полимерные системы, такие как поликарбонаты, полиуретаны, полиэфиры или полиамиды/имиды связываются непосредственно с фибриллами, что позволяет фибриллам легче диспергироваться с улучшенным сцеплением.
Данное изобретение относится также к способам введения функциональных групп на поверхность углеродных фибрилл путем контактирования углеродных фибрилл с сильным окислителем в течение периода времени, достаточного для окисления поверхности этих фибрилл, и дополнительного контактирования этих фибрилл с реагентом, пригодным для присоединения функциональной группы к окисленной поверхности. В предпочтительном варианте данного изобретения окислитель состоит из раствора хлората щелочного металла в сильной кислоте. В других вариантах хлорат щелочного металла представляет собой хлорат натрия или хлорат калия. В предпочтительных вариантах в качестве сильной кислоты используют серную кислоту. Периоды времени, достаточные для окисления, составляют от ~0,5 часа до ~ 24 часов.
В дополнительном предпочтительном варианте композицию, имеющую формулу 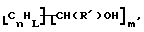 где n, L, R' и m имеют указанные выше значения, образуют реакцией R'CH2OH с поверхностными углеродами нанотрубки в присутствии свободнорадикального инициатора, такого как бензоилпероксид.
где n, L, R' и m имеют указанные выше значения, образуют реакцией R'CH2OH с поверхностными углеродами нанотрубки в присутствии свободнорадикального инициатора, такого как бензоилпероксид.
Данное изобретение относится также к способу присоединения белков к нанотрубкам, модифицированным NHS-эфиром, путем образования ковалентной связи между NHS-эфиром и аминогруппой такого белка.
Данное изобретение относится также к способам получения сетки углеродных фибрилл, предусматривающим контактирование углеродных фибрилл с окислителем в течение периода времени, достаточного для окисления поверхности углеродных фибрилл, контактированием поверхностно-окисленных фибрилл с реагентом, пригодным для присоединения функциональной группы к поверхности углеродных фибрилл, и дополнительным контактированием поверхностно-функционализованных фибрилл со сшивающим агентом, эффективным для образования сетки углеродных фибрилл. Предпочтительным сшивающим агентом является полиол, полиамин или поликарбоновая кислота.
Функционализованные фибриллы могут быть также в форме жестких сеток фибрилл. Хорошо диспергированная трехмерная сетка функционализованных кислотой фибрилл может, например, быть стабилизирована сшиванием кислотных групп (межфибрилльных) с полиолами или полиаминами с образованием жесткой сетки.
Данное изобретение включает также трехмерные сетки, образованные связыванием функционализованных фибрилл данного изобретения. Эти комплексы включают по меньшей мере две функционализованные фибриллы, связанные одним или несколькими линкерами, содержащими прямую связь или химическую часть молекулы. Эти сетки содержат пористые среды с удивительно однородным эквивалентным размером пор.
Хотя промежутки между этими фибриллами являются неправильными как по размеру, так и по форме, их можно считать порами и характеризовать при помощи способов, применяемых для характеристики пористых сред. Размер промежутков в таких сетках может регулироваться концентрацией и уровнем диспергирования фибрилл и концентрацией и длинами цепей сшивающих агентов. Такие материалы могут действовать в качестве структурированных носителей катализаторов и могут быть сконструированы таким образом, что они исключают или включают молекулы определенного размера. Кроме общепринятого промышленного катализа, они могут иметь особое применение в качестве больших пористых носителей для биокатализаторов.
Жесткие сетки могут также служить в качестве каркаса в биомиметических системах для молекулярного узнавания. Такие системы были описаны в US Patent No. 5110833 и International Patent Publication No. W0 93/19844. Подходящий выбор сшивающих агентов и комплексирующих агентов позволяет стабилизировать специфические молекулярные структуры.
СПОСОБЫ ФУНКЦИОНАЛИЗАЦИИ НАНОТРУБОК
Однородно функционализованные фибриллы по данному изобретению могут быть непосредственно получены сульфонированием, электрофильным присоединением к деокисленным поверхностям фибрилл или металлированием. При использовании выращенных в угольной дуге нанофибрилл может быть необходима интенсивная очистка перед функционализацией. Ebbesen et al. (Nature 367 519 (1994)) приводят метод такой очистки.
Предпочтительно, углеродные фибриллы обрабатывают перед контактированием их с функционализирующим агентом. Такая обработка может включать диспергирование фибрилл в растворителе. В некоторых случаях углеродные фибриллы могут быть затем отфильтрованы и высушены перед последующим контактом.
1. СУЛЬФОНИРОВАНИЕ
Известные методы описаны March J.P., Advanced Organic Chemistry, 3rd Ed. Wiley, New York, 1985; House H., Modern Synthetic Reactions, 2nd Ed., Benjamin/Cummings, Menlo Park, CA, 1972.
Активированные С-Н (в том числе ароматические С-Н) связи могут быть сульфонированы при помощи дымящей серной кислоты (олеума), которая представляет собой раствор концентрированной серной кислоты, содержащей до 20% SО3. Общепринятым методом является метод сульфонирования в жидкой фазе при Т~80oС с применением олеума; однако, активированные С-Н связи могут быть также сульфонированы с применением SО3 в инертных апротонных растворителях или SОз в паровой фазе. Реакция представляет собой
-С-Н+SО3 --> -С-SО3Н
Побочная реакция приводит к образованию сульфонов в соответствии с реакцией
2-С-Н+SО3 --> -С-SО2-С-+Н2О
ПРИМЕР 1
Активация связей С-Н с применением серной кислоты.
Реакции проводили в газовой фазе и в растворе без какого-либо значимого различия в результатах. Реакцию в газовой фазе проводили в горизонтальном кварцевом трубчатом реакторе, нагреваемом печью Линдберга. Многогорлую колбу, содержащую 20% SО3 в концентрированной Н2SO4, снабженную трубками входа/выхода, использовали в качестве источника SО3.
Взвешенную пробу фибрилл (BN и СС) в фарфоровой лодочке помещали в однодюймовую трубку, снабженную впускным отверстием для газа; выпускное отверстие соединяли с барботерным улавливателем концентрированной Н2SО4. Аргон продували через реактор в течение 20 минут для удаления всего воздуха и пробу нагревали до 300oС в течение 1 часа для удаления оставшейся влаги. После высушивания температуру доводили до температуры реакции в атмосфере аргона.
Когда устанавливалась желаемая температура, источник SО3 соединяли с реакторной трубкой и ток аргона использовали для введения паров SО3 в кварцевой трубчатый реактор. Реакцию проводили в течение желаемого периода времени при желаемой температуре, после чего реактор охлаждали продуванием аргоном. Затем фибриллы сушили при 90oС при вакууме 5'' рт. ст. с получением прироста сухого веса. Содержание сульфоновой кислоты (-SО3Н) определяли реакцией с 0,100 н. NaOH и обратным титрованием 0,100 н. НСl с применением рН 6,0 в качестве конечной точки.
Реакцию в жидкой фазе проводили в концентрированной серной кислоте, содержащей 20% SО3, в многогорлой колбе на 100 мл, снабженной термометром/терморегулятором и магнитной мешалкой. Суспензию фибрилл в концентрированной Н2SO4 (50) помещали в колбу. Раствор олеума (20 мл) предварительно нагревали до ~ 60oС перед добавлением в реактор. После реакции кислую суспензию выливали на раздробленный лед и разбавляли немедленно 1 л деионизованной (ДИ) воды. Твердые вещества отфильтровывали и промывали интенсивно ДИ-водой до тех пор, пока рН эффлюента не переставал изменяться. Фибриллы сушили при 100oС при вакууме 5'' рт. ст. Вследствие потерь при переносе для фильтрования точные увеличения в весе нельзя было получить. Результаты представлены в таблице I.
Не было значимого различия в содержании сульфоновой кислоты при реакции в паровой фазе или в жидкой фазе. Наблюдали температурный эффект. Более высокая температура реакции (паровая фаза) дает более высокие количества сульфонов. В 118-61В увеличение веса 4,2% согласовалось с содержанием сульфоновой кислоты (теоретическое содержание было 0,51 мэкв/г). Опыты 60А и 61А имели слишком высокое увеличение в весе, чтобы относить его только к содержанию сульфоновой кислоты. Поэтому было сделано предположение, что были образованы также приемлемые количества сульфонов.
2. ПРИСОЕДИНЕНИЯ К НЕСОДЕРЖАЩИМ ОКСИДОВ ПОВЕРХНОСТЯМ ФИБРИЛЛ
Известные методы описаны Urry G., Elementary Equilibrium Chemistry of Carbon, Wiley, New York, 1989.
Поверхностные углероды в фибриллах ведут себя подобно графиту, т.е. они размещены гексагональными слоями, содержащими как углероды базисной плоскости, так и концевые углероды. В то время как углероды базисной плоскости относительно инертны к химической атаке, концевые углероды являются реакционноспособными и должны содержать какой-либо гетероатом или группу в соответствии с валентностью углерода. Фибриллы также имеют дефектные участки поверхности, которые являются в основном краевыми углеродами и содержат гетероатомы или группы.
Наиболее обычными гетероатомами, присоединенными к углеродам поверхности, являются водород, преобладающий газообразный компонент во время изготовления; кислород, вследствие его высокой реакционной способности и вследствие того, что его следов очень трудно избежать, и Н2O, которая всегда присутствует благодаря катализатору. Пиролиз при ~1000oС в вакууме будет деокислять эту поверхность в комплексной реакции с невыясненным механизмом, но с известной стехиометрией. Продуктами являются СО и СO2 в соотношении 2:1. Полученная поверхность фибриллы содержит радикалы в размещении C1-C4, которые очень реакционноспособны в отношении активированных олефинов. Эта поверхность является стабильной в вакууме или в присутствии инертного газа, но сохраняет ее высокую химическую активность, пока она экспонируется с реакционноспособным газом. Таким образом, фибриллы могут быть пиролизованы при ~ 1000oС в вакууме или в инертной атмосфере, охлаждены в тех же самых условиях и могут взаимодействовать с подходящей молекулой при более низкой температуре с образованием стабильной функциональной группы. Типичными примерами являются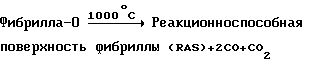
затем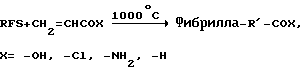
RFS+малеиновый ангидрид-->Фибрилла-R'(COOH)2
RFS+Цианоген-->Фибрилла-CN
RFS+CH2=CH-CH2X-->Фибрилла-R'-СН2Х, X = NH2, -ОН, -галоген
RFS+H2O-->Фибрилла=O (хиноидальная)
RFS+CH2=CHCHO-->Фибрилла-R'CHO (альдегидная)
RFS+CH2=CH-CN-->Фибрилла-R'CN
где R' обозначает углеводородный радикал (алкил, циклоалкил и т.д.)
ПРИМЕР 2
Получение функционализованных фибрилл реакцией акриловой кислоты с не содержащими оксидов поверхностями фибрилл.
1 г фибрилл BN в фарфоровой лодочке помещают в горизонтальную однодюймовую кварцевую трубку, снабженную термопарой, и помещают в трубчатую печь Линдберга. Концы снабжены входным/выходным отверстиями для газа. Трубку продувают сухим деоксигенированным аргоном в течение 10 минут, после чего температуру печи повышают до 300oС и поддерживают в течение 30 минут. После этого при непрерывном токе аргона температуру повышают с приращениями в 100oС до 1000oС и поддерживают на этом уровне в течение 16 часов. В конце этого периода времени трубку охлаждают до комнатной температуры при пропускании аргона. Затем ток аргона шунтируют для прохождения через многогорлую колбу, содержащую неразбавленную очищенную акриловую кислоту при 50oС и снабженную входным/выходным отверстиями для газа. Ток паров акриловой кислоты/аргона продолжают при комнатной температуре в течение 6 часов. В конце этого периода времени оставшуюся непрореагировавшую акриловую кислоту удаляют, сначала выдуванием аргоном, затем сушкой в вакууме при 100oС при вакууме <5'' рт. ст. Содержание карбоновой кислоты определяют реакцией с избытком 0,100 н. NaOH и обратным титрованием 0,100 н. НСl до конечной точки при рН 7,5.
ПРИМЕР 3
Получение функционализованных фибрилл реакцией акриловой кислоты с несодержащими оксидов поверхностями фибрилл.
Способ повторяют аналогично вышеописанному способу за исключением того, что пиролиз и охлаждение проводят при вакууме 10-4 Торр. Очищенные пары акриловой кислоты разбавляют аргоном, как в предыдущей процедуре.
ПРИМЕР 4
Получение функционализованных фибрилл реакцией малеиновой кислоты с несодержащими оксидов поверхностями фибрилл.
Способ повторяют, как в примере 2, за исключением того, что реагентом при комнатной температуре является очищенный малеиновый ангидрид (MAN), который подают в реактор путем прохождения газа аргона через баню с расплавленным MAN при 80oС.
ПРИМЕР 5
Получение функционализованных фибрилл реакцией акрилоилхлорида с несодержащими оксидов поверхностями фибрилл.
Способ повторяют, как в примере 2, за исключением того, что реагентом при комнатной температуре является очищенный акрилоилхлорид, который подают в реактор путем прохождения аргона над неразбавленным акрилхлоридом при 25oС. Содержание галогенангидрида определяют реакцией с избытком 0,100 н. NaOH и обратным титрованием 0,100 н. НСl.
Пиролиз фибрилл в вакууме деокисляет поверхность фибрилл. В аппарате TGA пиролиз при 1000oС либо в вакууме, либо в токе очищенного Аr дает среднюю потерю веса 3% для трех проб фибрилл BN. Анализ газовой хроматографией обнаружил только СО и CO2 в соотношении ~2:1 соответственно. Полученная поверхность является очень реакционноспособной, и активированные олефины, такие как акриловая кислота, акрилоилхлорид, акриламид, акролеин, малеиновый ангидрид, аллиламин, аллиловый спирт или аллилгалогениды, будут реагировать даже при комнатной температуре с образованием чистых продуктов, содержащих только функциональную группу, связанную с активированным олефином. Таким образом, поверхности, содержащие только карбоновые кислоты, доступны с применением реакции с акриловой кислотой или малеиновым ангидридом; поверхности только с галогенангидридом с применением реакции с акрилоилхлоридом; только с альдегидом из акролеина; только с гидроксилом из аллилового спирта; только с амином из аллиламина и только с галогенидом из аллилгалогенида.
3. МЕТАЛЛИРОВАНИЕ
Предыдущие способы представлены в March, Advanced Organic Chemistry, 3rd ed., p. 545.
Ароматические связи С-Н могут быть металлированы разнообразными металлоорганическими реагентами с образованием связей углерод-металл (С-М). М обычно представляет собой Li, Be, Mg, Al или Тl, однако могут быть также использованы другие металлы. Самой простой реакцией является простое замещение водорода в активированных ароматических соединениях.
1. Фибрилла-Н+R-Li-->Фибрилла-Li+RH
Эта реакция может требовать дополнительно сильного основания, такого как трет-бутоксид калия или хелатирующие диамины. Необходимы апротонные растворители (парафины, бензол).
2. Фибрилла-Н+АlR3-->Фибрилла-AlR2+RH
3. 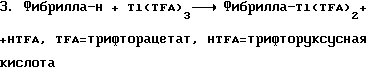
Металлированные производные являются примерами первичных один раз функционализованных фибрилл. Однако они могут взаимодействовать дополнительно с образованием других первичных один раз функционализованных фибрилл. Некоторые реакции могут проводиться последовательно в одном и том же аппарате без выделения промежуточных продуктов.
4. Фибрилла-М+О2-->Фибрилла-ОН+МО, М = Li, Al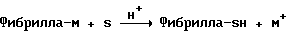
Фибрилла-М+X2-->Фибрилла-Х+MX, Х = галоген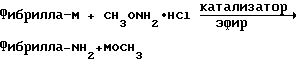
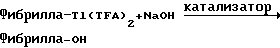
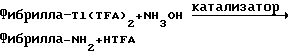
Фибрилла-Tl(TFA)2+вод.KCN-->Фибрилла-CN+TlTFA+KTFA
Фибрилла-CN+H2-->Фибрилла-СН2-NН2
ПРИМЕР 6
Получение фибриллы-Li.
1 г фибрилл СС помещают в фарфоровую лодочку и вставляют в однодюймовый кварцевый трубчатый реактор, который закрывают в трубчатой печи Линдберга. Концы трубки снабжены входным/выходным отверстиями для газа. При непрерывном токе H2 фибриллы нагревают до 700oС в течение 2 часов для превращения любых оксигенатов поверхности в связи С-Н. Затем реактор охлаждают до комнатной температуры при прохождении H2.
Гидрированные фибриллы переносят сухим деокисленным гептаном (с LiAlH4) в однолитровую многогорлую круглодонную колбу, снабженную системой продувания очищенным аргоном, для удаления всего воздуха и поддержания инертной атмосферы, холодильником, магнитной мешалкой и резиновой перегородкой, через которую жидкости могут подаваться при помощи шприца. В атмосфере аргона шприцем добавляют 2% раствор, содержащий бутиллитий в гептане, и суспензию перемешивают при осторожном нагревании с обратным холодильником в течение 4 часов. В конце этого периода времени фибриллы отделяют гравитационным фильтрованием в атмосфере аргона в боксе с перчатками и промывают несколько раз на фильтре сухим деокисленным гептаном. Фибриллы переносят в круглодонную колбу на 50 мл, снабженную запорным краном, и сушат при вакууме 10-4 Торр при 50oС. Концентрацию лития определяют реакцией пробы фибрилл с избытком 0,100 н. НСl в ДИ-воде и обратным титрованием 0,100 н. NaOH до конечной точки при рН 5,0.
ПРИМЕР 7
Получение фибриллы-Тl(TFA)2.
1 г фибрилл СС гидрируют, как в примере 5, и загружают в многогорлую колбу с HTFA, которую дегазируют повторяющимся продуванием сухим аргоном. В колбу через резиновую перегородку добавляют 5% раствор 5 ммоль Tl(TFA)2 в HTFA и суспензию перемешивают при осторожном нагревании с обратным холодильником в течение 6 часов. После реакции фибриллы собирают и сушат, как в получении 1.
ПРИМЕР 8
Получение фибриллы-ОН (окисленного производного, содержащего только функциональную группу ОН).
0,5 г литированных фибрилл, полученных в примере 6, переносят сухим деокисленным гептаном в перчаточном боксе с атмосферой аргона в одногорлую колбу на 50 мл, снабженную запорным краном и стержнем для магнитной мешалки. Колбу вынимают из перчаточного бокса и перемешивают на магнитной мешалке. Затем запорный кран открывают для доступа воздуха и суспензию перемешивают в течение 24 часов. В конце этого периода времени фибриллы отделяют фильтрованием, промывают водным МеОН и сушат при 50oС в вакууме 5'' рт. ст. Концентрацию ОН-групп определяют реакцией со стандартизованным раствором уксусного ангидрида в диоксане (0,252 М) при 80oС для превращения ОН-групп в ацетатные эфиры с высвобождением 1 эквивалента уксусной кислоты на моль прореагировавшего ангидрида. Общее содержание кислоты, свободной уксусной кислоты и непрореагировавшего уксусного ангидрида определяют титрованием 0,100 н. NaOH до конечной точки при рН 7,5.
ПРИМЕР 9
Получение фибриллы-NH2.
1 г таллированных фибрилл получают, как в примере 7. Эти фибриллы суспендируют в диоксане и добавляют 0,5 г трифенилфосфина, растворенного в диоксане. Суспензию перемешивают при 50oС в течение нескольких минут, после чего добавляют при 50oС газообразный аммиак в течение 30 минут. Затем фибриллы отделяют фильтрованием, промывают в диоксане, затем в ДИ-воде и сушат при 80oС при вакууме 5'' рт. ст. Концентрацию амина определяют реакцией с избытком уксусного ангидрида и обратным титрованием свободной уксусной кислоты и непрореагировавшего ангидрида 0,100 н. NaOH.
4. ПРОИЗВОДНЫЕ ПОЛИЦИКЛИЧЕСКИХ АРОМАТИЧЕСКИХ, ПОЛИГЕТЕРОЦИКЛИЧЕСКИХ АРОМАТИЧЕСКИХ И ПЛОСКИХ МАКРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
Графитовые поверхности фибрилл делают возможной физическую адсорбцию ароматических соединений. Притяжение происходит с помощью сил Ван дер Ваальса. Эти силы являются значительными между многокольцевыми гетероциклическими ароматическими соединениями и углеродами базисной плоскости графитовых поверхностей. Десорбция может происходить при условиях, в которых возможна конкурентная поверхностная адсорбция, или когда адсорбат обладает высокой растворимостью. Например, было обнаружено, что фибриллы могут быть функционализованы адсорбцией производных фталоцианинов. Эти фибриллы с производными фталоцианинов могут затем использоваться в качестве твердых носителей для иммобилизации белков. Путем простого выбора различных производных фталоцианина различные химические группы могут быть введены на поверхность фибриллы.
Использование фибрилл с производными фталоцианина для иммобилизации белков имеет значительные преимущества над прежними способами иммобилизации белков. В частности, оно проще, чем ковалентные модификации. Кроме того, фибриллы с производными фталоцианина имеют высокую площадь поверхности и стабильны почти
во всех типах растворителей в широком диапазоне температуры и рН.
ПРИМЕР 10
Адсорбция порфиринов и фталоцианинов на фибриллы.
Предпочтительными соединениями для физической адсорбции на фибриллах являются производные порфиринов или фталоцианинов, которые, как известно, сильно адсорбируются на графитовой или углеродной саже. Некоторые соединения являются доступными, например тетракарбоновая кислота-порфирин, кобальт(II)-фталоцианин или дилитий-фталоцианин. Два последних могут быть превращены в производные в форме карбоновой кислоты.
Дилитийфталоцианин.
Как правило, два иона Li+ замещали из группы фталоцианина (Рс) наибольшими (в частности, многовалентными) комплексами металлов. Таким образом, замещение ионов Li+ ионом металла, связанного с нелабильными лигандами, представляет собой способ помещения стабильных функциональных групп на поверхности фибрилл. Комплексы почти всех металлов переходного ряда будут замещать Li+ из Рс с образованием стабильного, нелабильного хелата. Следующей задачей является связывание этого металла с подходящим лигандом.
Кобальт(II)-фталоцианин.
Комплексы кобальта(II) являются особенно подходящими для этого. Ион Со++ может быть заместителем двух ионов Li+ с образованием очень стабильного хелата. Ион Со++ может затем быть координирован с лигандом, таким как никотиновая кислота, которая содержит кольцо пиридина с боковой карбоксильной группой и которая, как известно, связывается предпочтительно с группой пиридина. В присутствии избытка никотиновой кислоты Со(II)Рс может электрохимически окисляться до Co(III)Pc с образованием нелабильного комплекса с пиридиновой частью никотиновой кислоты. Таким образом, свободная карбоксильная группа никотиновой кислоты прочно присоединяется к поверхности фибриллы.
Другими подходящими лигандами являются аминопиридины или этилендиамин (боковая группа NH2), меркаптопиридин (SH) или другие полифункциональные лиганды, содержащие любую из амино- или пиридильной части молекулы на одном конце и любую желательную функциональную группу на другом конце.
Загрузочная способность для порфиринов или фталоцианинов может быть определена обесцвечиванием растворов при их добавлении с приращениями. Глубокие цвета растворов (темно-розовый для тетракарбоновой кислоты-порфирина в МеОН, темный сине-зеленый для Со(II)- или дилитий-фталоцианина в ацетоне или пиридине) отбрасываются, так как эти молекулы удаляются адсорбцией на черную поверхность фибрилл.
Загрузочные способности оценивали по этому способу и осаждение этих производных рассчитывали из их приблизительных измерений (~140 кв. ангстрем). Для средней площади поверхности для фибрилл 250 м2/г максимальная загрузка будет ~0,3 ммоль/г.
Тетракарбоновую кислоту-порфирин анализировали титрованием. Целостность адсорбции испытывали высвобождением красителя в водных системах при температуре окружающей среды и повышенных температурах.
Суспензии фибрилл сначала смешивали (в смесителе Уоринга) и перемешивали во время загрузки. Часть суспензий обрабатывали ультразвуком, после того как краска больше не выделялась, но безуспешно.
После загрузки (Опыты 169-11, -12, -14 и -19-1, см. таблицу II) промывали в том же самом растворителе для удаления окклюдированного пигмента. Все давали непрерывный слабый оттенок в промывном эффлюенте, так что было трудно точно определить точку насыщения. Опыты 168-18 и -19-2 использовали рассчитанные количества пигмента для загрузки и промывались лишь очень слабо после загрузки.
Тетракарбоновая кислота-порфирин (из ацетона) и Со-фталоцианин (из пиридина) загружались на фибриллы для дальнейшей характеристики (Опыты 169-18 и -19-2 соответственно).
Анализы тетракарбоновой кислоты-порфирина.
Добавление избытка основания (рН 11-12) вызвало немедленное розовое окрашивание в титрующейся суспензии. Хотя это не мешало фильтрованию, это показало, что при высоком рН порфирин десорбируется. Концентрацию карбоновой кислоты определяли обратным титрованием избытка NaOH с рН 7,5 в качестве конечной точки. Титрование давало загрузку 1,10 мэкв/г кислоты, что эквивалентно 0,275 мэкв/г порфирина.
Анализ кобальт- или дилитий-фталоцианина.
Концентрации этих адсорбатов оценивали только на основании экспериментов с обесцвечиванием. Точку, в которой сине-зеленый оттенок не выцветал после 30 минут, брали как точку насыщения.
Ряд замещенных полициклических ароматических или полигетероциклических ароматических соединений адсорбировали на поверхностях фибрилл. Для адгезии число ароматических колец должно было быть большим чем два на кольца/боковую функциональную группу. Таким образом, замещенные антрацены, фенантрены и т. д. , содержащие три конденсированных кольца, или полифункциональные производные, содержащие четыре или более конденсированных колец, могут быть использованы вместо производных порфирина или фталоцианина. Подобно этому могут быть использованы замещенные ароматические гетероциклы, такие как хинолины, или множественно замещенные гетероароматические соединения, содержащие четыре или более колец.
В таблице II суммированы результаты экспериментов по определению загрузки для трех производных порфирина/фталоцианина.
Следующие примеры 11 и 12 иллюстрируют способы адсорбции двух различных производных фталоцианина на углеродных нанотрубках.
ПРИМЕР 11
Фибриллы, функционализованные адсорбцией никель(II)-фталоцианинтетрасульфоновой кислоты.
2 мг никель(II)-фталоцианинтетрасульфоновой кислоты (тетранатриевой соли) смешивали с 4,2 мг простых фибрилл в 1 мл dH2O. Смесь обрабатывали ультразвуком в течение 50 минут и вращали при комнатной температуре в течение ночи.
Эти фибриллы промывали 3 х 1 мл dH2O, 3 х 1 мл МеОН и 3 х 1 мл CH2Cl2 и сушили в вакууме.
Термолизин иммобилизовали на этих модифицированных производным фталоцианина фибриллах адсорбцией. 0,5 мг фибрилл суспендировали в 250 мкл dH2O и обрабатывали ультразвуком в течение 20 минут. Супернатант отбрасывали и фибриллы суспендировали в 250 мкл 0,05 М Трис (рН 8,0) и смешивали с 250 мкл 0,6 мМ раствора термолизина, приготовленного в том же самом буфере. Смесь вращали при комнатной температуре в течение 2 часов и выдерживали при 4oС в течение ночи. Затем фибриллы промывали три раза 1 мл 25 мМ Трис (рН 8) и суспендировали в 250 мкл буфера, содержащего 40 мМ Трис и 10 мМ CaCl2, при рН 7,5.
Количество термолизина на этих фибриллах определяли измерением активности фермента этих фибрил. Термолизин может взаимодействовать с субстратом FAGLA (N-(3-[2-фурил]акрилоил)-glu-leu-амид) и продуцировать соединение, которое вызывает уменьшение поглощения при 345 нм с коэффициентом экстинкции 310 М-1м-1. Для этой реакции использовали тест-буфер 40 мМ Трис, 10 мМ CaCl2 и 1,75 М NaCl при рН 7,5. Реакцию проводили в кювете на 1 мл путем смешивания 5 мкл исходного раствора FAGLA (25,5 мМ в 30% ДМФ в dH2O) и 10 мкг термолизин-фибрилл в 1 мл тест-буфера. Уменьшение поглощения при 345 нм определяли мониторингом на протяжении 10 минут. Затем активность фермента (мкМ/мин) рассчитывали из первоначального наклона кривой с использованием коэффициента экстинкции 310 М-1м-1. Количество активного термолизина на грамм фибрилл было равно 0,61 мкмоль.
ПРИМЕР 12
Фибриллы, функционализованные адсорбцией 1,4,8,11,15,18,22,25-октабутокси-29Н,31Н-фталоцианина.
3 мг 1,4,8,11,15,22,25-октабутокси-29Н,31Н-фталоцианина и 5,3 мг простых фибрилл смешивали в 1 мл СНСl3. Смесь обрабатывали ультразвуком в течение 50 минут и вращали при комнатной температуре в течение ночи.
Фибриллы промывали 3 х 1 мл СН2Сl2 и сушили в вакууме. Термолизин иммобилизовали на фибриллах с производным фталоцианина адсорбцией согласно способу примера 34. Количество активного термолизина на грамм фибрилл было 0,70 мкмоль.
ПРИМЕР 13
Синтез предшественника аспартама с использованием модифицированных производным фталоцианина фибрилл с иммобилизованным на них термолизином.
Фибриллы, модифицированные фталоцианином, на которых был иммобилизован термолизин, могут быть использованы для катализа синтеза предшественника синтетического подслащивающего вещества аспартама. Реакцию проводят путем смешивания 80 мМ L-Z-Asp и 220 мМ L-PheOMe в этилацетате с 10 мкМ иммобилизованным на фибриллах термолизином. Продукт Z-Asp-PheOMe подвергают мониторингу при помощи ВЖХ для определения выхода.
5. ОКИСЛЕНИЕ ХЛОРАТОМ ИЛИ АЗОТНОЙ КИСЛОТОЙ
Литературные источники по окислению графита сильными окислителями, такими как хлорат калия в концентрированной серной кислоте или азотная кислота, включают R. N. Smith, Quarterly Review 13, 287 (1959); M. J. D. Chem. Rev., 60, 267 (1960). Как правило, атакуются концевые углероды (в том числе дефектные участки) с образованием смесей карбоновых кислот, фенолов и других окисленных групп. Этот механизм является сложным, включающим радикальные реакции.
ПРИМЕР 14
Получение функционализованных карбоновой кислотой фибрилл с применением хлората.
Пробу фибрилл СС суспендировали в концентрированной H2SO4 смешиванием шпателем и затем переносили в реакционную колбу, снабженную входным/выходным отверстиями для газа и верхней мешалкой. При перемешивании и при медленном токе аргона загрузку NaClO3 добавляли порциями при комнатной температуре на протяжении опыта. Пары хлора образовывались во время всего хода опыта и выносились из реактора в улавливатель с водным раствором NaOH. В конце опыта суспензию фибрилл выливали на раздробленный лед и фильтровали в вакууме. Фильтровальный осадок переносили затем в камеру Сокслета и промывали в экстракторе Сокслета ДИ-водой со сменой свежей воды каждые несколько часов. Промывание продолжали до тех пор, пока проба фибрилл при добавлении к свежей ДИ-воде не переставала изменять рН воды. Затем фибриллы отделяли фильтрованием и сушили при 100oС при вакууме 52" рт. ст. в течение ночи.
Содержание карбоновой кислоты определяли реакцией пробы с избытком 0,100 н. NaOH и обратным титрованием 0,100 н. НСl до конечной точки, рН 7,5. Результаты представлены в таблице III.
ПРИМЕР 15
Получение функционализованных карбоновой кислотой фибрилл с применением азотной кислоты.
Взвешенную пробу фибрилл суспендировали с азотной кислотой подходящей концентрации в многогорлой индентированной реакционной колбе со связанным дном, снабженной верхней мешалкой и водным холодильником. При постоянном перемешивании температуру доводили до нужного уровня и реакцию проводили в течение указанного времени. Коричневый дым выделялся вскоре после превышения температуры до 70oС независимо от концентрации кислоты. После реакции суспензию выливали на раздробленный лед и разбавляли ДИ-водой. Суспензию фильтровали и избыток кислоты удаляли промыванием в экстракторе Сокслета с заменой воды в резервуаре свежей водой каждые несколько часов, пока суспендированная проба не переставала изменять рН ДИ-воды. Фибриллы сушили при 100oС при вакууме 5'' рт. ст. в течение ночи. Взвешенную порцию фибрилл подвергали взаимодействию со стандартным 0,100 н. NaOH и содержание карбоновой кислоты определяли обратным титрованием 0,100 н. НСl. Содержание поверхностного кислорода определяли с применением XPS. Диспергируемость в воде испытывали при 0,1 мас.% смешиванием в смесителе Уоринга при высокой скорости в течение 2 мин. Результаты суммированы в таблице 1V.
6. АМИНО-ФУНКЦИОНАЛИЗАЦИЯ ФИБРИЛЛ
Аминогруппы могут вводиться непосредственно на графитовые фибриллы обработкой фибрилл азотной кислотой и серной кислотой для получения нитрованных фибрилл, затем восстановлением нитрованной формы восстановителем, таким как дитионит натрия, с получением амино-функционализованных фибрилл согласно следующей формуле:
Полученные фибриллы имеют много применений, в том числе для иммобилизации белков (например, ферментов и антител) и аффинной и ионообменной хроматографии.
ПРИМЕР 16
Получение амино-функционализованных фибрилл с использованием азотной кислоты.
К охлажденной суспензии (0oС) фибрилл (70 мг) в воде (1,6 мл) и уксусной кислоте (0,8 мл) добавляли по каплям азотную кислоту (0,4 мл). Реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Медленно добавляли смесь серной кислоты (0,4 мл) и соляной кислоты (0,4 мл) и перемешивали в течение 1 часа при комнатной температуре. Реакцию останавливали и центрифугировали. Водный слой удаляли и фибриллы промывали водой (х 5). Остаток обрабатывали 10% гидроксидом натрия (х 3) и промывали водой (х 5) с получением нитрованных фибрилл.
К суспензии нитрованных фибрилл в воде (3 мл) и гидроксиде аммония (2 мл) добавляли дитионит натрия (200 мг) в виде трех порций при 0oС. Реакционную смесь перемешивали в течение 5 минут при комнатной температуре и нагревали с обратным холодильником в течение 1 часа при 100oС. Реакцию останавливали, охлаждали до 0oС и рН доводили уксусной кислотой (рН 4). После стояния в течение ночи при комнатной температуре суспензию фильтровали, промывали водой (х 10), метанолом (х 5) и сушили в вакууме с получением амино-фибрилл.
Для испытания амино-функционализованных фибрилл фибриллы связывали с пероксидазой хрена. Затем HRP-связанные аминофибриллы интенсивно диализовали. После диализа фибриллы промывали 15 раз на протяжении следующей недели. Модифицированные ферментом фибриллы тестировали следующим образом: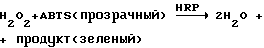
Результаты показали, что HRP, связанная с Фиб-NH2, показала хорошую ферментативную активность, которая сохранялась в течение одной недели.
7. ПРИСОЕДИНЕНИЕ КОНЦЕВЫХ СПИРТОВ С ИСПОЛЬЗОВАНИЕМ СВОБОДНОРАДИКАЛЬНОГО ИНИЦИАТОРА
Высокая степень стабильности углеродных нанотрубок, хотя и позволяющая использовать их в жестких (неблагоприятных) условиях, затрудняет их активацию для дальнейшей модификации. Предшествующие способы включали использование сильных окислителей и кислот. Теперь неожиданно было обнаружено, что к углеродным нанотрубкам могут быть присоединены концевые спирты при помощи свободнорадикального инициатора, такого как пероксид бензоила (ВРО). Углеродные нанотрубки добавляют к спирту, имеющему формулу RCH2OH, где R обозначает водород, алкил, арил, циклоалкил, аралкил, циклоарил или поли(алкиловый эфир), вместе со свободнорадикальным инициатором и нагревают до от около 60oС до около 90oС. Предпочтительные спирты включают этанол и метанол. После прохождении достаточного периода времени для разрушения всего свободнорадикального инициатора реакционную смесь фильтруют и материал углеродных нанотрубок промывают и сушат с получением модифицированных нанотрубок формулы Нанотрубка-СН(R)ОН. Этот способ можно также использовать для связывания бифункциональных спиртов. Это позволяет соединять один конец с углеродной нанотрубкой, а другой использовать для непрямого связывания другого материала с поверхностью.
ПРИМЕР 17
Получение функционализованных спиртом нанотрубок с использованием бензоилпероксида.
0,277 г углеродных нанотрубок диспергировали в МеОН при помощи зондового ультразвукового дезинтегратора. 0,126 граммов ВРО добавляли при комнатной температуре и температуру увеличивали до 60oС и добавляли еще 0,128 г ВРО. Еще после 45 минут при 60oС добавляли конечную загрузку ВРО 0,129 г и смесь выдерживали при 60oС в течение еще 30 минут. Продукт фильтровали на мембрану и промывали несколько раз МеОН и EtOH и сушили в термостате при 90oС. Выход был 0,285 г. ESCA-анализ показал содержание кислорода 2,5 ат.% по сравнению с 0,74% для контрольной пробы, нагреваемой с обратным холодильником в МеОН без ВРО.
ПРИМЕР 18
Модификация углеродных нанотрубок поли(этиленгликолем) с использованием бензоилпероксида.
0,1 г углеродных нанотрубок, 0,5 г ВРО и 10 г поли(этиленгликоля) со ср. мол. массой 1000 (PEG-1000), смешивали вместе при комнатной температуре. Смесь нагревали до 90oС для расплавления PEG и оставляли реагировать при 90oС в течение ночи. Затем всю смесь фильтровали и промывали для удаления избыточного PEG и затем сушили. Полученный продукт можно было использовать в таком виде или его можно было модифицировать дополнительно присоединением представляющих интерес материалов к свободному концу PEG.
ПРИМЕР 19
Применение углеродных нанотрубок, модифицированных PEG, для уменьшения неспецифического связывания.
Неспецифическое связывание с углеродным материалом с высокой площадью поверхности является повсеместным. Было обнаружено, что присоединение гидрофильных олигомеров, таких как PEG, к углеродным нанотрубкам может уменьшать неспецифическое связывание. Кроме того, было обнаружено, что в результате присоединения одного конца подобных цепям молекул, таких как PEG, к поверхности нанотрубок свободный конец может содержать функциональную группу, которая может быть использована для присоединения других представляющих интерес материалов, с сохранением все еще способности слоя PEG (или другого вещества) уменьшать неспецифическое связывание.
Уменьшение неспецифического связывания бычьего сывороточного альбумина модифицированными PEG фибриллами.
Исходные дисперсии немодифицированных фибрилл, окисленных хлоратом фибрилл и фибрилл, модифицированных ПЭГ, при 0,1 мг/мл в 50 мМ калий-фосфатном буфере при рН 7,0 получали диспергированием 1,0 мг каждого из них в 10 мл буфера с обработкой ультразвуком. 2 мл 2-кратных серийных разведении каждой из них помещали в каждую из 9 полипропиленовых пробирок. 100 мкл исходного раствора 0,2 мг/мл бычьего сывороточного альбумина в том же самом буфере добавляли в каждую пробирку и в 3 пробирки слепого контроля (буфер). Также готовили три пробирки с буфером без белка. Все пробирки перемешивали на вортексе и давали им инкубироваться в течение 30 минут при 30-секундном перемешивании вортексом каждые 10 минут. Все пробирки центрифугировали для отделения фибрилл и аликвоты 1 мл супернатанта переносили в новые пробирки и анализировали на содержание общего белка с использованием микротеста на белок БСА (Pierce). Уровень белка, остающегося в супернатанте, был непрямой мерой количества, которое было не специфически связано с фибриллами. Весь БСА оставался в супернатанте для модифицированных PEG фибрилл, в то время как было почти полное связывание с не модифицированными или окисленными хлоратом фибриллами (см. фиг.1).
Сравнение уменьшения неспецифического связывания фибриллами, модифицированными PEG, полученными с использованием бензоилпероксида и путем NHS-эфирного связывания.
Исходные дисперсии окисленных хлоратом фибрилл, фибрилл, модифицированных ПЭГ с использованием бензоилпероксида, и окисленных хлоратом фибрилл, модифицированных PEG путем NHS-эфирного связывания, получали при 0,1 мг/мл в 50 мМ калий-фосфатном буфере при рН 7,0 получали диспергированием 1,0 мг каждого из них в 10 мл буфера с обработкой ультразвуком. 2 мл 3-кратных серийных разведении каждой из них помещали в каждую из 7 полипропиленовых пробирок. 100 мкл исходного раствора 0,2 мг/мл β-лактоглобулина (βLG) в том же самом буфере добавляли в каждую пробирку и в 3 пробирки слепого контроля (буфер). Также готовили три пробирки с буфером без белка. Все пробирки перемешивали на вортексе и давали им инкубироваться в течение 60 минут при 30-секундном перемешивании вортексом каждые 10 минут. Все пробирки центрифугировали для отделения фибрилл и аликвоты 1 мл супернатанта переносили в новые пробирки и анализировали на содержание общего белка с использованием микротеста на белок БСА (Pierce). Уровень белка, остающегося в супернатанте, был непрямой мерой количества, которое было не специфически связано с белком (см. фиг. 2). Для каждой из пробирок βLG оставался в супернатанте для фибрилл, модифицированных PEG с применением NHS-эфира, что демонстрировало отсутствие неспецифического связывания. Фибриллы, модифицированные PEG через путь ВРО, обнаруживали лишь слабое (приблизительно 10%) связывание βLG при наивысшем уровне фибрилл 1,0 мг/мл и отсутствие значимого связывания при более низких уровнях. В противоположность этому было почти полное связывание с окисленными хлоратом фибриллами при уровнях фибрилл 0,1 мг/мл и выше и существенное связывание при уровнях ниже 0,01 мг/мл этих фибрилл.
8. ВТОРИЧНЫЕ ПРОИЗВОДНЫЕ ФУНКЦИОНАЛИЗОВАННЫХ НАНОТРУБОК
Функционализованные карбоновой кислотой нанотрубки.
Число вторичных производных, которые могут быть получены только из карбоновой кислоты, является по существу неограниченным. Спирты или амины легко связываются с кислотой с образованием стабильных эфиров или амидов. Если спирт или амин является частью ди- или полифункциональной молекулы, то связь через O- или NH- оставляет другие функциональности в виде боковых групп. Типичными примерами вторичных реагентов являются реагенты, приведенные в таблице A.
Эти реакции могут проводиться с применением любых способов, разработанных для этерификации или аминирования карбоновых кислот со спиртами или аминами. Из них использовали способы Н. A. Staab, Angew. Chem. Internat. Edit. , (1), 351 (1962), с применением N,N'-карбонилдиимидазола (CDI) в качестве ацилирующего агента для эфиров или амидов и G.W. Anderson et al., J. Amer. Chem. Soc., 86, 1839 (1964), с применением N-гидроксисукцинимида (NHS) для активации карбоновых кислот для амидирования.
ПРИМЕР 20
Получение вторичных производных функционализованных фибрилл N,N'-карбонилдиимидазола.
Для этой процедуры необходимы чистые сухие апротонные растворители (например, толуол или диоксан). Стехиометрические количества реагентов являются достаточными. Для эфиров карбоновую кислоту подвергают взаимодействию в инертной атмосфере (аргон) в толуоле со стехиометрическим количеством CDI, растворенным в толуоле, при комнатной температуре в течение 2 часов. Во время этого времени выделяется CO2. После двух часов добавляют спирт вместе с каталитическими количествами этоксида натрия и реакцию продолжают при 80oС в течение 4 часов. Для нормальных спиртов выходы являются количественными. Реакции представляют собой
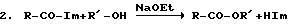
Амидирование аминов происходит без катализа при комнатной температуре. Первая стадия в этой процедуре является той же самой. После выделения CO2 добавляют стехиометрическое количество амина при комнатной температуре и реакцию проводят в течение 1-2 часов. Реакция является количественной. Реакция представляет собой
3. R-CO-Im+R'-NH2-->R-CO-NHR+HIm
Силилирование.
Триалкилсилилхлориды или триалкилсиланолы взаимодействуют непосредственно с кислотным Н в соответствии с
R-COOH+Cl-SiR'3-->R-CO-SiR'3+НСl
Небольшие количества диаза-1,1,1-бициклооктана (DABCO) используют в качестве катализатора. Подходящими растворителями являются диоксан и толуол.
Функционализованные сульфоновой кислотой фибриллы.
Арилсульфоновые кислоты, полученные, как в примере 1, могут взаимодействовать далее с образованием вторичных производных. Сульфоновые кислоты могут быть восстановлены до меркаптанов при помощи LiAlH4 или сочетания трифенилфосфина и иода (March, J.Р., р. 1107). Они могут быть также превращены в сульфонатные эфиры реакцией с диалкиловыми эфирами, т.е.
Фибрилла-SО3Н+R-O-R-->Фибрилла-SO2OR+ROH
N-Гидроксисукцинимид.
Активация карбоновых кислот для амидирования первичными аминами происходит через N-гидроксисукцинамиловый эфир; карбодиимид используют для связывания воды, выделяющейся в виде замещенной мочевины. Затем NHS-эфир превращают при комнатной температуре в амид реакцией с первичным амином. Реакции представляют собой
1. R-COOH+NHS+CDI-->R-CONHS+замещ. мочевина
2. R-CNHS+R'-NH2-->R-CO-NHR'
Этот способ применим, в частности, для ковалентного присоединения белка к графитовым фибриллам через свободную NH2 на боковой цепи белка. Примеры белков, которые могут быть иммобилизованы на фибриллах согласно этому способу, включают трипсин, стрептавидин и авидин. Стрептавидин- (или авидин)-фибриллы обеспечивают твердый носитель для любого биотинилированного вещества.
ПРИМЕР 21
Ковалентное присоединение белков к фибриллам через NHS-эфир.
Для демонстрации того, что белок может быть ковалентно присоединен к фибриллам через NHS-эфир, стрептавидин, авидин и трипсин присоединяли к фибриллам следующим образом.
0,5 мг NHS-эфир-фибрилл промывали 5 мМ натрий-фосфатным буфером (рН 7,1) и супернатант отбрасывали. К этим фибриллам добавляли 200 мкл раствора стрептавидина (1,5 мг в том же самом буфере) и смесь вращали при комнатной температуре в течение 5,5 часов. Затем фибриллы промывали 1 мл следующих буферов в такой последовательности: 5 мМ фосфат натрия (рН 7,1), PBS (0,1 М фосфат натрия, 0,15 М NaCl, рН 7,4), ORIGENТМ тест-буфер (IGEN, Inc., Gaithersburg, MD) и PBS. Стрептавидин-фибриллы хранили в буфере PBS для последующего использования.
2,25 мг соединенных с NHS-эфиром фибрилл обрабатывали ультразвуком в 500 мкл 5 мМ натрий-фосфатного буфера (рН 7,1) в течение 40 минут и супернатант выбрасывали. Фибриллы суспендировали в 500 мкл 5 мМ натрий-фосфатного буфера (рН 7,1) и 300 мкл раствора авидина, приготовленного в том же самом буфере, содержащего 2 мг авидина (Sigma, А-9390). Эту смесь вращали при комнатной температуре еще в течение 1 ч. Фибриллы промывали 1 мл 5 мМ натрий-фосфатного буфера (рН=7,1) четыре раза и PBS-буфером дважды. Авидиновые фибриллы суспендировали в 200 мкл PBS-буфера для хранения.
Трипсин-фибриллы готовили смешиванием 1,1 мг NHS-эфирных фибрилл (обработанных, как в случае авидиновых фибрилл) и 200 мкл 1,06 мМ раствора трипсина, приготовленного в 5 мМ натрий-фосфатном буфере (рН 7,1), и вращением при комнатной температуре в течение 6,5 часов. Затем трипсин-фибриллы промывали 1 мл 5 мМ натрий-фосфатного буфера (рН 7,1) три раза и суспендировали в 400 мкл того же самого буфера для хранения.
ПРИМЕР 22
Измерение ферментативной активности трипсина на фибриллах.
Трипсин может взаимодействовать с субстратом L-BAPNA (Nα-бензоил-L-аргинин-п-нитроанилид) и высвобождать окрашенное соединение, которое поглощает свет при 410 нм. Тест-буфером для этой реакции был 0,05 М Трис, 0,02 М CaCl2, рН 8,2. Реакцию проводили в кювете на 1 мл смешиванием 5 мкл исходного раствора L-BAPNA (50 мМ в 37% ДМСО в H2O) и 10-25 мкг трипсин-фибрилл в 1 мл тест-буфера. Увеличение поглощения при 410 нм подвергали мониторингу на протяжении 10 минут. Затем из начального наклона кривой реакции рассчитывали активность фермента (мкМ/мин).
Для фибрилл с ковалентно связанным трипсином эта активность была 5,24 мкМ/мин на 13 мкг фибрилл. Этот результат может быть преобразован в количество активного трипсина на фибриллах делением на него активности раствора трипсина известной концентрации, который при измерении показал 46 мкМ/мин на 1 мкМ трипсина при тех же самых условиях анализа. Таким образом количество активного трипсина на грамм фибрилл было 8,3 мкмоль (или 195 мг).
ПРИМЕР 23
Углеродные нанотрубки с поверхностными тиолами.
0,112 г амино-углеродных нанотрубок (CN), полученных модификацией этилендиамином, как описано в примере 27 (ниже), суспендировали в 20 мл 0,05 М калий-фосфатного буфера с рН 8,0, содержащего 50 мМ ЭДТА. Эту суспензию обрабатывали ультразвуком при помощи ультразвукового дезинтегратора Branson 450 Watt probe sonicator в течение 5 минут для диспергирования CN. Полученная суспензия была очень густой. Через суспензию барботировали аргон в течение 30 минут при перемешивании. Добавляли 50 мг 2-иминотиолан-НСl и смеси давали реагировать в течение 70 минут при продолжающемся перемешивании в атмосфере аргона. Полученный материал фильтровали на поликарбонатный мембранный фильтр, промывали 2х буфером, 1х ДИ-водой и 2х абсолютным EtOH, все в атмосфере аргона. Модифицированные тиолом CN помещали в вакуумный эксикатор и откачивали в течение ночи. Конечный вес 0,118 г, 55% превращение в расчете на увеличение веса.
Пробу 10 мг тиолированных нанотрубок суспендировали в 10 мл ДИ-воды с обработкой ультразвуком и фильтровали на найлоновую мембрану 0,45 мкм с образованием подобного войлоку мата. Участок мата хранили в вакуумном эксикаторе до анализа при помощи ESCA, который показал 0,46% серы и 1,69% азота, что подтверждало успешное превращение в модифицированные тиолом CN.
ПРИМЕР 24
Присоединение модифицированных тиолом углеродных нанотрубок к золотым поверхностям.
Золотую фольгу (Alfa/Aesar), 2 см х 0,8 см, очищали раствором 1 части 30% Н2O2 и 3 частей концентрированной Н2SO4 в течение 10 минут и споласкивали ДИ-водой. Кусок фольги соединяли с соединительными проводами из Аu и подвергали электрохимическим циклам между -0,35 В против Аg/АgСl и 1,45 В против Ag/AgCl в 1 М H2SO4 при 50 мВ/сек, пока циклические вольтамперограммы не становились неизменяемыми, приблизительно в течение 10 минут. Большой кусок разрезали на 4 полоски (0,5 см х 0,8 см).
10 мл абсолютного EtOH, деокисленного продувкой аргоном в течение 30 минут, помещали в каждый из двух стеклянных флаконов. В одном флаконе суспендировали 16 мг модифицированных тиолом CN (CN/SH) и 2 куска Аu и в другом флаконе 1 кусок Аu и 20 мг модифицированных этилендиамином CN для получения производного тиола. Все манипуляции проводили в заполненном аргоном боксе с перчатками. Флаконы герметизировали в атмосфере аргона и помещали в охлажденную ультразвуковую баню на 1 час. Закрытые флаконы оставляли стоять при комнатной температуре в течение 72 часов. Пробы Аu удаляли из флаконов, промывали 3х EtOH, сушили на воздухе и помещали в предохраняющие флаконы.
Пробы фольги Аu, экспонированные CN/этилендиамину и CN/SH, исследовали сканирующей электронной микроскопией (SEM) для детектирования присутствия или отсутствия CN на этой поверхности. Исследование при увеличении 40000х обнаружило присутствие CN, распределенных по поверхности, экспонированной CN/SH, и отсутствие CN на пробе Аu-фольги, экспонированной CN/этилендиамину.
ПРИМЕР 25
Получение малеимид-фибрилл из амино-фибрилл.
Амино-фибриллы получали в соответствии с примером 13. Затем амино-фибриллы (62,2 мг) обрабатывали ультразвуком в натрий-фосфатном буфере (5 мл, 5 мМ при рН 7,2). К суспензии фибрилл добавляли сульфосукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC; 28,8 мг, 0,66 ммоль; Pierce, Cat. No. 22360). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Фибриллы промывали водой и метанолом и полученные фибриллы сушили под вакуумом. Иммобилизация антител на этом продукте подтвердила присутствие малеимид-фибрилл. Другие малеимиды с различными линкерами (например, сульфо-SМСС, сукцинимидил-4-[п-малеимидофенил]бутират [SMPB], сульфо-SMPB, м-малеимидобензил-N-гидроксисукцинимидный эфир [MBS], сульфо-MBS и т.д.) могут быть получены согласно этому способу.
Полученные малеимид-фибриллы могут быть использованы в качестве твердого носителя для ковалентной иммобилизации белков, например антител и ферментов. Антитела были ковалентно иммобилизованы на активированных малеимидом фибриллах. Емкость для антитела была 1,84 мг на 1 г фибрилл при использовании амино-фибрилл, полученных по способу нитрования/восстановления (пример 13), и 0,875 мг на 1 г фибрилл при использовании амино-фибрилл, произведенных из карбоксил-фибрилл.
ПРИМЕР 26
Получение эфир/спирт-производных из функционализованных карбоновой кислотой фибрилл.
Функционализованные карбоновой кислотой фибриллы получали, как в примере 14. Содержание карбоновой кислоты было 0,75 мэкв/г. Фибриллы взаимодействовали со стехиометрическим количеством CDI в инертной атмосфере с толуолом в качестве растворителя при комнатной температуре до тех пор, пока не прекращалось выделение CO2. После этого суспензия взаимодействовала при 80oС с 10-кратным молярным избытком полиэтиленгликоля (MB 600) и небольшим количеством NaOEt в качестве катализатора. После 2 часов реакции фибриллы отделяли фильтрованием, промывали толуолом и сушили при 100oС.
ПРИМЕР 27
Получение амид/амин-производных из функционализованных карбоновой кислотой фибрилл (177-041-1).
0,242 г окисленных хлоратом фибрилл (0,62 мэкв/г) суспендировали в 20 мл безводного диоксана с перемешиванием в круглодонной колбе на 100 мл с пробкой из серума (составной части латекса). Добавляли 20-кратный молярный избыток N-гидроксисукцинимида (0,299 г) и давали ему раствориться. Затем добавляли 20-кратный избыток 1-этил-3-(3-диметиламинопропил)карбодиимида (EDAC) (0,510 г) и перемешивание продолжали в течение 2 часов при комнатной температуре. В конце этого периода перемешивание останавливали и супернатант отсасывали и твердые вещества промывали безводным диоксаном и МеОН и фильтровали на полисульфоновой мембране 0,45 мкм. Твердые вещества промывали дополнительным количеством МеОН на фильтровальной мембране и сушили в вакууме, пока не переставали наблюдать дальнейшее уменьшение веса. Выход NHS-активированных окисленных фибрилл был 100% в расчете на 6% наблюдаемое увеличение веса.
К 10 мл 0,2 М NаНСО3-буфера добавляли 100 мкл этилендиамина (en). Добавляли эквивалентный объем уксусной кислоты (НОАс) для поддержания рН около 8. NHS-активированные окисленные фибриллы (0,310 г) добавляли при интенсивном перемешивании и проводили реакцию в течение 1 часа. Добавляли дополнительно 300 мкл en и 300 мкл НОАс в течение дополнительных 10 минут. Раствор фильтровали на полисульфоновой мембране 0,45 мкм и промывали последовательно NаНСО3-буфером, 1% НСl, DI-водой и EtOH. Твердые вещества сушили в вакууме в течение ночи. HCl-соль обратно превращали в свободный амин реакцией с NaOH (177-046-1) для последующего анализа и реакций.
Проводили ESCA (ЭСХА) для определения количества N, присутствующего на аминированных фибриллах (GF/NH2). Анализ ESCA 177-046-1 показал 0,90 ат.% N (177-059). Для дальнейшей оценки того, сколько из этого N присутствует как на доступных, так и на реакционноспособных аминогруппах, получали производное реакцией в газовой фазе с пентафторбензальдегидом для образования связей соответствующего основания Шиффа с доступными первичными аминогруппами. Анализ ESCA все еще показывал 0,91 ат.% N, как и ожидалось, и 1,68 ат.% F. Это соответствует 0,34 ат.% N, присутствующего в качестве реакционноспособного первичного амина на аминированной фибрилле (5F на молекулу пентафторбензальдегида). Уровень 0,45 ат.% мог ожидаться при предположении полной реакции со свободными концами каждого N. Наблюдаемый уровень свидетельствует об очень высоком выходе из реакции N с NHS-активированной фибриллой и подтверждает реакционную способность доступных свободных аминных групп.
При уровне 0,34 ат.% N, присутствующего в виде свободного амина, рассчитанном из данных ESCA, должно было бы быть почти полное покрытие фибрилл свободными аминными группами, позволяющее связывание других материалов.
Карбоксил-фибриллы превращали также в амино-фибриллы с использованием монозащищенного 1,6-диаминогексана (шестиуглеродного линкера), а не этилендиамина (двухуглеродного линкера).
ПРИМЕР 28
Получение аминопроизводных из функционализованных карбоновой кислотой фибрилл.
Карбоксильные группы на фибриллах могут быть модифицированы реакцией этих карбоксильных групп с одной аминогруппой соединения, имеющего две или более аминогрупп (по меньшей мере одна из которых является не защищенной такими группами, как t-Boc или CBZ). Полученные таким образом фибриллы являются амидными производными, в которых карбонил амида произведен из карбоксильной группы фибриллы (такой как алкильная группа), содержащими один или более первичных аминов. После этого аминогруппы доступны для использования или дальнейших модификаций.
1 г углеродных фибрилл помещали в сухой стеклянный фильтр (из спекшегося стекла), выход которого плотно закрывали перегородкой из серума (составной части латекса) и добавляли безводный дихлорметан для закрывания. Добавляли N-метилморфолин (758 мкл, 7 ммоль), суспензию смешивали при помощи шпателя. Затем добавляли изобутилхлорформиат (915 мкл, 7 ммоль) и суспензию перемешивали периодически в течение 1 часа. Смесь защищали от атмосферного давления закрыванием Парафильмом настолько, насколько это было практичным.
Между тем гидрохлорид N-boc-1,6-диаминогексана (1,94 г, 7,7 ммоль) распределяли между дихлорметаном (10 мл) и 1 М NaOH (10 мл). Нижнюю, органическую фазу сушили над безводным карбонатом калия и фильтровали через одноразовую пастеровскую пипетку, содержащую ватную пробку, и добавляли N-метилморфолин (758 мкл, 7 ммоль).
Перегородку из серума удаляли из фильтра, реагенты удаляли из фибрилл вакуум-фильтрованием и фибриллы промывали безводным дихлорметаном. Перегородку из серума заменяли и к фибриллам добавляли смесь N-метилморфолина и монозащищенного диаминогексана. Смесь перемешивали периодически в течение 1 часа. Затем реагенты удаляли фильтрованием и фибриллы промывали последовательно дихлорметаном, метанолом, водой, метанолом и дихлорметаном.
50% смесь трифторуксусной кислоты и дихлорметана добавляли к фибриллам и смесь перемешивали периодически в течение 20 минут. Растворители удаляли фильтрованием и фибриллы промывали дихлорметаном, метанолом, водой, 0,1 М NaOH и водой.
Для определения эффективности этого способа небольшую пробу амино-фибрилл подвергали реакции с "активированной" пероксидазой хрена (HRP; 5 мг, Pierce), которая была модифицирована для специфического взаимодействия с аминогруппами. Фибриллы промывали периодически в течение нескольких дней (суспендированием, вращением и центрифугированием в эппендорфовской пробирке) с поддержанием на холоду. После приблизительно двух недель промывания фермент тестировали с H2O2/ABTS в глициновом буфере, рН 4,4. Зеленая окраска появлялась в растворе в пределах 10 минут, указывая на присутствие фермента. Контрольные фибриллы (СООН-фибриллы, обработанные активированной HRP и промытые в течение того же самого периода времени) показали низкую активность или отсутствие каталитической активности.
ПРИМЕР 29
Получение силильного производного из функционализованных карбоновой кислотой фибрилл.
Функционализованные кислотой фибриллы, полученные, как в примере 14, суспендировали в диоксане в инертной атмосфере. При перемешивании добавляли стехиометрическое количество хлортриэтилсилана и реакцию проводили в течение 0,5 часа, после чего добавляли несколько капель 5% раствора DABCO в диоксане. Система реагировала еще в течение 1 часа, после чего фибриллы собирали фильтрованием и промывали в диоксане. Фибриллы сушили при 100oС в вакууме 5'' рт.ст. в течение ночи.
Таблица V суммирует получения вторичных производных. Продукты анализировали ESCA на содержание на поверхности С, О, N, Si и F.
ПРИМЕР 30
Получение силильных производных из функционализованных карбоновой кислотой фибрилл
Функционализованные кислотой фибриллы, полученные, как в примере 14, суспендировали в диоксане в инертной атмосфере. При перемешивании добавляли стехиометрическое количество хлортриэтилсилана и реакцию проводили в течение 0,5 часа, после чего добавляли несколько капель 5% раствора DABCO в диоксане. Система реагировала еще в течение 1 часа, после чего фибриллы собирали фильтрованием и промывали в диоксане. Фибриллы сушили при 100oС в вакууме 5'' рт.ст. в течение ночи.
Таблица VI суммирует получения вторичных производных. Продукты анализировали ESCA. Анализ подтвердил включение желательных боковых групп. Продукты анализировали ESCA на содержание на поверхности С, О, N, Si и F.
ПРИМЕР 31
Получение производных третичных и четвертичных аминов из функционализованных карбоновой кислотой фибрилл.
Функциональные группы третичных и четвертичных аминов могут быть присоединены к поверхности углеродных нанотрубок амидной или эфирной связью через карбоксильную группу на нанотрубке и либо аминогруппу, либо гидроксильную группу на предшественнике третичного или четвертичного амина.
Получение предшественника в виде иодида. триэтилэтаноламина
В круглодонной колбе на 100 мл смешивали 10 г N,N-диэтилэтаноламина (85,3 ммоль) с 10 мл безводного метанола. Затем добавляли по каплям смесь 20 г этилиодида (127,95 ммоль) и 10 мл безводного метанола при помощи пипетки. Реакционную смесь нагревали с обратным холодильником в течение 30 минут. При охлаждении реакционной смеси до комнатной температуры образовался белый кристаллический продукт. Белый кристаллический продукт собирали фильтрованием и промывали безводным метанолом. Продукт затем сушили в течение ночи в эксикаторе под вакуумом. Продукт (10,3 г, 37,7 ммоль) получали с выходом 33%.
Получение функционализованных четвертичным амином графитовых фибрилл.
В высушенном в вакууме одноразовом сцинтилляционном флаконе Wheaton смешивали 100 мг сухих карбоксил-фибрилл (~0,7 ммоль СООН на грамм фибрилл) с 2 мл безводного диметилформамида и смесь обрабатывали ультразвуком в течение 60 секунд. В реакционный флакон добавляли еще 2 мл диметилформамида, 39 мг диметиламинопиридина (0,316 ммоль). Реакционную смесь перемешивали в течение 1 часа при комнатной температуре, затем добавляли 88 мг иодида триэтилэтаноламина и реакции давали протекать в течение ночи. Полученные фибриллы промывали три раза 20 мл диметилформамида, три раза 20 мл метанола и наконец три раза деионизованной водой. Продукт сушили под вакуумом. Результаты элементного анализа азота показали, что ~50% карбоксильных групп на фибрилле прореагировали с первичной аминогруппой в молекуле четвертичного амина.
ПРИМЕР 32
Хроматография бычьего сывороточного альбумина (БСА) на функционализованных третичным амином графитовых трубках.
Водной суспензии, содержащей 60 мг модифицированных 2-диэтиламиноэтиламином карбоксил-фибрилл и 180 мг смолы Sephadex G-25 superfine (Pharmacia, Uppsala, Sweden), давали стоять в течение ночи при комнатной температуре для гарантии полной гидратации твердого носителя. Суспензию упаковывали в колонку 1 см х 3,5 см. Эту колонку уравновешивали 5 мМ натрий-фосфатным буфером (рН 7,3) при скорости тока 0,2 мл/мин. На эту колонку загружали БСА (0,6 мг в 0,1 мл деионизованной воды). Колонку элюировали 5 мМ натрий-фосфатным буфером при скорости тока 0,2 мл/мин и собирали фракции по 0,6 мл. Профиль элюции подвергали мониторингу с использованием детектора УФ-видимого света и этот профиль элюции показан на фиг.3. Как только детектор показывал, что белок больше не элюируется из колонки, связанный БСА элюировали добавлением 1 М КСl в 5 мМ фосфате натрия (рН 7,3). Присутствие белка в каждой фракции идентифицировали БСА-микротестом (Pierce, Rockford, Il).
ПРИМЕР 33
Хроматография бычьего сывороточного альбумина на функционализованных четвертичным амином графитовых фибриллах.
Водной суспензии, содержащей 100 мг модифицированных 2-(2-триэтиламиноэтокси)этанолом карбоксил-фибрилл и 300 мг смолы Sephadex G-25 superfine, давали стоять в течение ночи при комнатной температуре. Полученную суспензию использовали для упаковки колонки с диаметром 1 см. Эту колонку уравновешивали 5 мМ натрий-фосфатным буфером (рН 7,3) при скорости тока 0,1-0,6 мл/мин. На эту колонку загружали БСА (2,7 мг в 0,2 мл деионизованной воды). Колонку элюировали 5 мМ натрий-фосфатным буфером при скорости тока 0,2 мл/мин и собирали фракции по 0,6 мл. Профиль элюции подвергали мониторингу с использованием детектора УФ-видимого света (фиг.4). Как только детектор показывал, что белок больше не элюируется из колонки, связанный БСА элюировали добавлением 1 М КСl в 5 мМ фосфате натрия (рН 7,3). Присутствие белка в каждой фракции идентифицировали БСА-микротестом (Pierce, Rockford, Il).
9. ФЕРМЕНТАТИВНАЯ ФУНКЦИОНАЛИЗАЦИЯ ГРАФИТОВОГО УГЛЕРОДА
Для введения функциональных групп на поверхность графитового углерода, в частности углеродных нанотрубок, могут быть использованы биокатализаторы. До сих пор графитовый углерод модифицировали только химическими способами (см., например, US Application Serial, No. 08/352400, filed December 8, 1994). Эти химические способы имеют следующие недостатки: (1) жесткость условий (использование очень высоких температур, очень высокой кислотности или токсичных химикалиев) и (2) отсутствие специфичности (например, окисление может вводить группы СООН, СОН и СНО). Изготовлены водные суспензии твердого графитового углерода (такого как углеродные фибриллы; Hyperion, Inc.), содержащие один или несколько ферментов, которые способны использовать графитовый углерод в качестве субстрата и выполнять химическую реакцию, приводящую к химически модифицированному графитовому углероду. Водная суспензия поддерживается при условиях, приемлемых для такого фермента (ферментов) для проведения реакции (температуре, рН, концентрации соли и т.д.) в течение времени, достаточного для фермента (ферментов), чтобы каталитически модифицировать поверхность графитового углерода. Во время этой реакции суспензию непрерывно перемешивают для облегчения доступа фермента к поверхности графитового углерода. После времени реакции, достаточного для протекания реакции до удовлетворительной степени, фермент удаляют из угля при помощи промывания при фильтровании.
До настоящего времени использовали два типа ферментов: ферменты цитохрома р450 и пероксидазные ферменты. В обоих случаях типы ферментов были хорошо изученными, они используют субстраты ароматического типа и оптимальные условия реакции для них установлены. Оба типа ферментов вводят гидроксильные группы в их субстраты и могут вводить гидроксильные группы в графитовый уголь. Кроме ферментов, другие биокатализаторы, такие как рибозимы и каталитические антитела или небиологические миметики ферментов, могли бы использоваться для каталитической функционализации углеродных нанотрубок.
ПРИМЕР 34
Ферментативная функционализация с использованием микросом печени крыс.
Считается, что ферменты цитохрома р450 функционируют в печени в качестве агентов детоксикации (F. Peter Guengerich, American Scientist, 81, 440-447, и F. Peter Guengerich, J. Biol. Chem., 266, 10019-10022). Они гидроксилируют чужеродные соединения, такие как полиароматические токсичные соединения. Гидроксилирование позволяет этим соединениям становиться водорастворимыми, так что они могут удаляться из тела через мочу. В печени имеется много различных ферментов цитохрома р450, каждый из которых имеет отличающуюся субстратную специфичность. Считают, что этот широкий диапазон специфичности важен вследствие широкого диапазона токсинов окружающей среды, детоксикация которых требуется. Хотя отдельные цитохромы р450 коммерчески доступны, нет доступной информации в отношении того, могут ли они воспринимать углеродные нанотрубки в качестве субстрата. Вследствие этой неопределенности мы решили первоначально инкубировать углеродные нанотрубки с экстрактом печени крысы, содержащим много различных цитохромов р450.
Двум крысам ("экспериментальным" крысам) вводили фенобарбитал (1 г/л, рН 7,0) в воде для питья в течение одной недели для индукции экспрессии ферментов цитохрома р450. Двум другим крысам ("контрольным" крысам) давали воду без фенобарбитала. Затем крыс умерщвляли и из их печеней стандартными процедурами получали содержащие цитохром р450 микросомы (см., например, Methods in Enzymology, Vol. 206).
Микросомы смешивали с углеродными нанотрубками (фибриллами) для предоставления цитохромам р450 возможности реагировать с графитовым углеродом. В этих экспериментах 5 мг фибрилл (как "обыкновенных" или нефункционализованных, так и "СООН"-фибрилл или окисленных фибрилл) смешивали с микросомами (как с экспериментальными, так и с контрольными микросомами) в забуференном растворе, содержащем 0,1 М Трис, 1,0 мМ НАДФН, 0,01% NaH, 10 мМ глюкозо-6-фосфат, глюкозо-6-фосфатдегидрогеназу (1 ед/мл), рН 7,4. НАДНФ включали в качестве косубстрата для цитохромов р450, а глюкозо-6-фосфат и глюкозо-6-фосфатдегидрогеназу добавляли для регенерации НАДФН из НАДФ+ (если НАДФ+ генерировался цитохромами р450). Смеси вращали при комнатной температуре в течение ~1,5 дней в микроцентрифужных пробирках. После инкубирования фибриллы интенсивно промывали в деионизованной воде, 1 М НСl, 1 М NaOH, 0,05% Тритоне Х-100, 0,05% Твине, метаноле и 1 М NaCl. После промывания микро-БСА-тест для белков (Pierce) показал, что фибриллы, по-видимому, все еще имели связанный с ними белок (хотя в промывном растворе не детектировался белок).
Для определения, были ли введены на поверхности фибрилл гидроксильные группы, фибриллы подвергали реакции с N-FMOC-изолейцином. Различные партии фибрилл (контрольные и экспериментальные) (по 1,5 мг каждая) взаимодействовали с 333 мкл раствора сухого ДМФ, содержащего 4,45 мг/мл FMOC-изолейцина, 1,54 мг/мл диметиламинопиридина (DMAP) и 2,6 мг/мл 1,3-дициклогексилкарбодиимида (DCC). После реакции в течение 2 дней (при непрерывном перемешивании) фибриллы промывали ДМФ, пиперидином, метанолом, водой, ДМФ, метанолом, метиленхлоридом (по 600 мкл каждого). Эту последовательность промывок повторяли три раза. Фибриллы отсылали в лаборатории Galbraith (Knoxville, TN) для аминокислотного анализа на присутствующий изолейцин. Результаты были сомнительными, поскольку, кроме изолейцина, можно было видеть много других аминокислот, что указывало на то, что белки, пептиды и аминокислоты, присутствующие в микросомных экстрактах печени крыс, не вымывались полностью из фибрилл. Таким образом, вследствие технических трудностей в промывании и анализе невозможно было определить, функционализировали цитохромы р450 эти фибриллы.
ПРИМЕР 35
Функционализация фибрилл с использованием коммерчески доступных рекомбинантных ферментов цитохрома р450.
Во избежание примесей, связанных с использованием микросом печени в качестве источника цитохромов р450, были куплены индивидуальные ферменты цитохрома р450 (GENTEST, Woburn, МА). Поскольку ферменты цитохрома р450 активны только в связи с мембранами, эти ферменты предоставляли в виде микросомных препаратов. С применением процедуры реакции, сходной с вышеописанной, мы тестировали следующие цитохромы р450: CYP1A1 (cat. # M111b), CYP1A2 (cat. # М103с), CYP2B6 (cat. # 110a), CYP3A4 (с редуктазой, cat. # 107r). MgCl2 (0,67 мг/мл) также включали в реакционный раствор. В этом эксперименте фибриллы промывали при помощи прибора Сокслета.
Анализ введенных гидроксильных групп проводили реакцией прореагировавших с цитохромом р450 промытых фибрилл с цветным реагентом 3,5-динитробензойной кислотой (DNBA). Связывание проводили, как описано выше для N-FMOC-изолейцина. После реакции с DNBA фибриллы промывали ДМФ и оставшуюся (ковалентно связанную) DNBA гидролизовали либо 6 М НСl, либо 46 ед/мл эстеразы печени свиньи (Sigma). Анализ высвобожденной DNBA проводили при помощи ВЖХ-анализа супернатанта, окружающего фибриллы, после гидролитической обработки. ВЖХ-анализ высвобожденной DNBA проводили в системе ВЖХ Waters, снабженной аналитической колонкой с обращенной фазой Vydac C18 (cat. # 218TP54) и линейным градиентом от деионизованной воды, содержащей 0,1% TFA (растворитель А), до ацетонитрила, содержащего 0,1% TFA (растворитель В).
ПРИМЕР 36
Функционализация фибрилл при помощи пероксидазы.
Описания в литературе субстратной специфичности пероксидазы указывали на то, что углеродные нанотрубки могут быть субстратами для этих ферментов (J. S. Dorick et al., Biochemistry (1986), 25, 2946-2951; D. R. Buhler et al., Arch. Biochem. Biophys. (1961), 92, 424-437; Н. S. Mason, Advances in Enzymology (1957), 19, 79; G.D. Nordblom et al., Arch. Biochem. Biophys. (1976), 175, 524-533). Для определения, может ли пероксидаза (hydrogen peroxidase, Type II, Sigma) вводить гидроксильные группы на поверхность фибрилл, фибриллы (11 мг) смешивали в растворе, содержащем 50 мМ ацетат натрия (1,25 мл, рН 5,0), пероксидазу хрена (200 нМ), и добавляли дигидроксифумаровую кислоту (15 мг) по 5 мг каждый раз в течение первых 3 часов реакции. Реакцию проводили в течение в целом 5 часов при 4oС с периодическим барботированием газообразного кислорода. После реакции фибриллы промывали водой, 1 н. NaOH, метанолом и метиленхлоридом (по 200 мл каждого). Контрольную реакцию проводили с использованием пероксидазы, которая была инактивирована нагреванием (100oС в течение 5 минут).
Для анализа степени катализируемого пероксидазой гидроксилирования фибриллы подвергали реакции с трет-бутилдиметилсилилхлоридом (Aldrich) в сухом ДМФ в присутствии имидазола. После промывания фибрилл их отсылали в Лаборатории Robertson Microlit Laboratories, Inc (Madison, NY) для элементного анализа кремния, включенного в фибриллы. Результаты анализа были сомнительными в отношении присутствия кремния на поверхности фибрилл. Считаем, что кремний из стеклянной посуды, используемой в этом эксперименте, присутствовал в виде небольших крошек в фибриллах, подвергнутых элементному анализу. Это привело к высокому уровню кремния как в экспериментальных, так и в контрольных образцах. Выводом из этого эксперимента является, что пероксидаза может быть вводила гидроксильные группы в фибриллы, но технические трудности помешали нам определить присутствие каких-либо введенных гидроксильных групп.
Фибриллы, функционализованные электрофильным присоединением к не содержащим кислорода поверхностям фибрилл или металлированием.
Первичные продукты, полученные присоединением активированных электрофилов к не содержащим кислорода поверхностям фибрилл, имеют боковые группы -СООН, -СОСl, -CN, -CH2NH2, -CH2OH, -CH2-галоген или НС=O. Они могут быть превращены во вторичные производные следующим образом.
Фибрилла-СООН-->см. выше.
Фибрилла-СОСl (хлорангидрид)+HO-R-Y-->F-COO-R-Y (Sec. 4/5)
Фибрилла-COCl+NH2-R-Y-->F-CONH-R-Y
Фибрилла-CN+H2-->F-CH2-NH2
Фибрилла-CH2NH2+HOOC-R-Y-->F-CH2NHCO-R-Y
Фибрилла-CH2NH2+O=CR-R'Y-->F-CH2N=CR-R'-Y
Фибрилла-СН2ОН+O(COR-Y)2-->F-CH2OCOR-Y
Фибрилла-СН2ОН+HOOC-R-Y-->F-CH2OCROR-Y
Фибрилла-СН2-галоген+Y--->F-CH2-Y+X-Y-=NCO-, -OR-
Фибрилла-С=O+H2N-R-Y-->F-C=N-R-Y
11. ДЕНДРИМЕРНЫЕ НАНОТРУБКИ
Концентрация функциональных групп на поверхности нанотрубок может быть увеличена модификацией нанотрубок рядом генерирований полифункциональным реагентом, что приводит к числу специфических функциональных групп, увеличивающемуся с каждым генерированием, с образованием дендримерподобной структуры. Полученные дендримерные нанотрубки применимы, в частности, в качестве твердого носителя, на котором могут ковалентно иммобилизоваться белки, поскольку они увеличивают плотность белка, иммобилизованного на поверхности нанотрубок. Данное изобретение демонстрирует, что высокие плотности специфической химической функциональной группы могут быть созданы на поверхности углерода с высокой площадью поверхности, что было трудным с прежними углеродами с высокой площадью поверхности.
ПРИМЕР 37
Получение дендримеров на основе лизина.
Последовательность реакций показана на фиг.5. К суспензии амино-фибрилл (90 мг) в бикарбонате натрия (5 мл, 0,2 М, рН 8,6) добавляли раствор N-гидроксисукцинимидного эфира Να,Νε-ди-t-Вoc-L-лизина (120 мг, 0,27 ммоль) в диоксане (5 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Фибриллы с защищенным трет-бутоксикарбонилом лизином тщательно промывали водой, метанолом и метиленхлоридом и сушили под вакуумом. Затем фибриллы с защищенным трет-бутоксикарбонилом лизином обрабатывали трифторуксусной кислотой (5 мл) в метиленхлориде (5 мл) в течение 2 часов при комнатной температуре. Полученные амино-лизин-фибриллы тщательно промывали метиленхлоридом, метанолом и водой и сушили под вакуумом. Получение лизин-фибрилл второго и третьего генерирований выполняли по той же самой процедуре. Результаты аминокислотного анализа показали, что лизин-фибриллы первого генерирования содержали 0,6 мкмоль лизина на грамм фибрилл, лизин-фибриллы второго генерирования содержали 1,8 мкмоль лизина на грамм фибрилл и лизин-фибриллы третьего генерирования имели 3,6 мкмоль лизина на грамм фибрилл.
Углеродные дендримерные фибриллы могут быть получены тем же самым способом с использованием аспарагиновой или глутаминовой кислоты с карбоксил-фибриллами.
ПРИМЕР 38
Получение терминированных карбоксилатом дендримеров.
Терминированные карбоксилатом дендримеры с состоящей из карбоновых нанотрубок (CN) центральной частью получали последовательными связываниями аминобутилнитрилотриуксусной кислоты (NTA), начиная с окисленных хлоратом углеродных нанотрубок, функционализованных NHS-эфиром.
Получение NTA.
NTA получали согласно способу Hochuli (E. Hochuli, Н. Dobeli and A. Schacher, J. Chromatography, 411, 177-184 (1987)), содержание которой включено здесь в качестве ссылки.
Получение CN/NHS.
CN/NHS получали согласно способу примера 20.
Получение CN/NTA.
0,4 г NTA•HCl растворяли в 25 мл 0,2 М NaHCO3, pH 8,1. Добавляли 1 М NaOH для возвращения pH опять до 7,8. Добавляли 0,5 г CN/NHS, смесь обрабатывали ультразвуком для диспергирования CN и полученную суспензию оставляли для прохождения реакции в течение 30 минут при перемешивании. Суспензию фильтровали на найлоновую мембрану 0,45 мкм и промывали 2х карбонатным буфером с pH 8,1 и 2х деионизованной водой на фильтре. Модифицированные CN дважды ресуспендировали в 25 мл МеОН с обработкой ультразвуком, фильтровали с получением твердого фильтровального осадка и наконец сушили в вакуумном эксикаторе.
Получение CN/NTA/NTA.
CN/NTA сначала превращали в NHS активный эфир. 0,396 г CN/NTA сушили в термостате при 90oС в течение 30 минут и затем помещали в круглодонную колбу на 100 мл с 30 мл безводного диоксана и продували аргоном. Добавляли 0,4 г N-гидроксисукцинимида при перемешивании с последующим добавлением 0,67 г EDC с продолжающимся перемешиванием еще в течение часа. CN стремились к агломерации в течение этого периода времени. Диоксан декантировали и твердые вещества промывали 2х20 мл безводного диоксана. Твердые вещества промывали 20 мл безводного МеОН, что разбивало агломераты. Твердые вещества фильтровали на найлоновую мембрану 0,45 мкм, ресуспендировали в МеОН, фильтровали и промывали на фильтре МеОН.
В колбу на 50 мл добавляли 0,2 г NTA и растворяли с 10 каплями 1 М NaOH. Добавляли 20 мл 0,2 М NаНСО3 при рН 8,1 и затем добавляли все CN/NTA/NHS и раствор слегка обрабатывали ультразвуком с применением ультразвукового дезинтегратора (probe sonicator). Смесь оставляли для прохождения реакции на 2,5 часа при комнатной температуре. Модифицированные CN фильтровали на найлоновую мембрану 0,45 мкм, промывали 2х карбонатным буфером, ресуспендировали в ДИ-воде при обработке ультразвуком, фильтровали и промывали ДИ-водой. Затем их помещали в вакуумный эксикатор для высушивания.
Получение CN/NTA/NTA/NTA.
Дополнительный уровень NTA добавляли согласно вышеописанной процедуре.
Получение CN/NTA/NTA/NTA/NTA.
Дополнительный уровень NTA добавляли согласно вышеописанной процедуре.
Пробы (приблизительно 10 мг) каждого из четырех генерирований NTA-присоединения суспендировали в 10 мл ДИ-воды при обработке ультразвуком и фильтровали на найлоновые мембраны 0,45 мкм с получением войлокоподобных матов. Отрезки матов хранили в вакуумном эксикаторе и анализировали при помощи ESCA на азот (N) для получения относительных количеств NTA. Результаты представлены в ниже.
Материал - %N согласно ESCA
CN/NTA - 0
CN/NTA/NTA - 1,45
CN/NTA/NTA/NTA - 1,87
CN/NTA/NTA/NTA/NTA - 2,20
Результаты ESCA подтвердили включение увеличивающихся количеств с каждым последующим генерированием.
ПРИМЕР 39
Углеродные нанотрубки-дендримеры в качестве носителей белка.
Плотность белка, иммобилизованного на углеродных нанотрубках, может быть значительно увеличена с использованием производных фибрилл, несущих дендримеры. Пероксидазу хрена (HRP) иммобилизовали на дендримерных нанотрубках согласно следующему способу.
Простые фибриллы (0,49 мг), амино-фибриллы (0,32 мг), лизин-фибриллы первого генерирования (0,82 мг), лизин-фибриллы второго генерирования и лизин-фибриллы третьего генерирования обрабатывали ультразвуком с натрий-бикарбонатным буфером для конъюгирования (600 мкл, 0,1 М, содержащим 0,9% NaCl) в течение 15 минут при комнатной температуре. Затем их инкубировали с раствором HRP в натрий-бикарбонатном буфере для конъюгирования (490 мл, исходный раствор фермента 5,6 мг/мл) в течение 19 часов при комнатной температуре. Фибриллы с иммобилизованной HRP промывали следующим буфером (1 мл): 10 мМ NаНСО3-буфером, содержащим 0,9% NaCl (1x-промывном буфере), семь раз, 0,1% Тритона Х-100 в 1x-промывном буфере пять раз, 50% этиленгликоле в 1x-промывном буфере три раза. Активность HRP определяли с раствором пероксида водорода (10 мкл, 10 мМ исходный раствор) и диаммониевой соли 2,2-азинобис(3-этилбензотиазолин)-6-сульфоновой кислоты (ABTS, 3 мкл, мМ исходнй раствор) в глициновом тест-буфере (50 мм, рН 4,4) при 414 нм. Результаты представлены ниже:
Фибриллы - нм HRP/г фибрилл
Простые Фиб - 3,82
Фиб-NH2 - 8,58
Фиб-NH-Lys - 28,09
Фиб-NН-Lуs(Lуs)2 - 28,30
Фиб-NН-Lуs(Lуs)4 - 46,28
12. БИФУНКЦИОНАЛЬНЫЕ ФИБРИЛЛЫ
Было обнаружено, что более чем один тип функциональной группы (например, карбоксильная группа и аминогруппа) может быть введен на фибриллу одновременно путем взаимодействия функционализованной нанотрубки, например карбокси-нанотрубки, с аминокислотой. Такие бифункциональные фибриллы могут использоваться для иммобилизации многочисленных молекул, в частности, в стехиометрии 1:1, и в тесной близости.
ПРИМЕР 40
Получение бифункциональных фибрилл путем присоединения лизина.
Синтез бензилового эфира Na-CBZ-L-лизина.
Последовательность реакций показана на фиг.7. Nε-(трет-Бутоксикарбонил)-L-лизин (2 г, 8,12 ммоль) растворяли в метаноле (40 мл) и воде (40 мл) и рН доводили до 8 триэтиламином. К этой смеси добавляли раствор N-(бензилоксикарбонилокси)сукцинимида в диоксане (2,4 г, 9,7 ммоль в 20 мл) и рН поддерживали при 8-9 триэтиламином. Реакционную смесь перемешивали в течение ночи. Растворитель удаляли роторным испарением с получением неочищенного Na-CBZ-Nε-(трет-бутоксикарбонил)-L-лизина. Nε-(трет-Бутоксикарбонил)-L-лизин обрабатывали 0,2 М карбонатом кальция (4 мл) и водный слой удаляли с получением белого твердого вещества. Твердое вещество ресуспендировали в N, N-диметилформамиде (40 мл) и бензилбромиде (1,16 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь обрабатывали этилацетатом и водой и органический слой сушили над сульфатом магния. Растворитель удаляли с получением неочищенного бензилового эфира Nα-CBZ-Nε-(трет-бутоксикарбонил)-L-лизина, который очищали хроматографией на силикагеле с применением 25% гексана в этилацетате в качестве растворителя. К бензиловому эфиру Nα-CBZ-Nε-(трет-бутоксикарбонил)-L-лизина (1 г, 2,2 ммоль) в метиленхлориде (10 мл) добавляли трифторуксусную кислоту при 0oС. Реакционную смесь перемешивали в течение 10 минут при 0oС, затем перемешивали еще в течение 2,5 часа при комнатной температуре. Растворитель удаляли с получением неочищенного продукта. Чистый бензиловый эфир Nα-CBZ-L-лизина получали хроматографией на силикагеле.
Синтез модифицированных бензиловым эфиром Nα-CBZ-L-лизина фибрилл.
К суспензии карбоксил-фибрилл (300 мг) в метиленхлориде (18 мл) добавляли раствор бензилового эфира Nα-CBZ-L-лизина (148 мг, 0,32 ммоль в 20 мл метиленхлорида и 176 мкл триэтиламина). Затем добавляли НОВТ (43,3 мг, 0,32 ммоль) и TDC (61,3 мг, 0,32 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре с получением неочищенного продукта. Полученные фибриллы интенсивно промывали метанолом, метиленхлоридом и водой, затем сушили в вакууме.
Синтез бифункциональных фибрилл Fib-Lys(СООН)NН2.
К модифицированным бензиловым эфиром Nα-CBZ-L-лизина фибриллам (113 мг) в метаноле (4 мл) добавляли гидроксид натрия (1 н., 4 мл) и реакционную смесь перемешивали в течение ночи. Продукт, Nα-CBZ-L-лизин-фибриллы, интенсивно промывали водой и метанолом и эти фибриллы сушили под вакуумом. К суспензии Nα-CBZ-L-лизин-фибрилл (50 мг) в ацетонитриле (4 мл) добавляли триметилсилилиодид (1 мл). Смесь перемешивали в течение 3 часов при 40oС. Конечные бифункциональные фибриллы интенсивно промывали водой, метанолом, 0,5 н. гидроксидом натрия, ацетонитрилом и метиленхлоридом. Аминокислотный анализ показал 0,3 мкмолей лизина на грамм фибрилл.
Гидроксил- и карбоксил- (или амино-) бифункциональные фибриллы могут быть приготовлены способом, аналогичным описанному здесь, с применением серина, треонина или тирозина. Тиолированные и карбоксил- (или амино-) бифункциональные фибриллы могут быть приготовлены с применением цистеина. Карбоксил- и амино-бифункциональные фибриллы могут быть приготовлены с применением аспарагиновой или глутаминовой кислоты.
ПРИМЕНЕНИЯ ФУНКЦИОНАЛИЗОВАННЫХ НАНОТРУБОК
Функционализованные графитовые нанотрубки применимы в качестве твердых носителей во многих биотехнологических приложениях вследствие их высокой пористости, химической стабильности и термостабильности и высокой площади поверхности. Было обнаружено, что они совместимы с жесткими химическими и термическими обработками и очень доступны для химической функционализации.
Например, фермент может быть ковалентно иммобилизован на модифицированной нанотрубке с сохранением его биологической активности. Кроме того, нанотрубки пригодны также для применения в качестве носителей в аффинной хроматографии при разделении биомолекул. Например, ингибиторы ферментов на нанотрубках были получены в многостадийных синтезах, так что эти иммобилизованные ингибиторы были доступны для макромолекул и происходило обратимое специфическое узнавание между белками и модифицированными фибриллами.
Гидрофобность поверхности нанотрубок является недостаточной для иммобилизации высоких плотностей белков адсорбцией. Для увеличения гидрофобности поверхности нанотрубок и для расширения гидрофобного окружения от двух измерений до трех измерений алкильные цепи различной длины были связаны с поверхностью нанотрубок. Белки, которые были иммобилизованы на алкилированных нанотрубках, включают трипсин, щелочную фосфатазу, липазу и авидин. Ферментативные активности этих иммобилизованных белков сравнимы с активностями свободных ферментов, обнаруживаемыми по каталитической эффективности в отношении гидролиза их субстратов в водных растворах.
Кроме того, были получены фенил-алкил-нанотрубки, которые являются алкил-нанотрубками с присоединенной фенильной группой на конце алкильной цепи. Эта модификация ввела ароматическую структуру, которая взаимодействует с аминокислотами - фенилаланином, тирозином и триптофаном в - белках через взаимодействия π-π. Адсорбция щелочной фосфатазы и липазы на фенил-алкил-нанотрубках сравнима с адсорбцией на С8-алкил-нанотрубках.
Было обнаружено также, что функционализованные фибриллы применимы в качестве твердых носителей для синтеза белка.
1. ФУНКЦИОНАЛИЗОВАННЫЕ НАНОТРУБКИ В КАЧЕСТВЕ ТВЕРДЫХ НОСИТЕЛЕЙ ДЛЯ ФЕРМЕНТОВ
ПРИМЕР 41
Получение алкил-фибрилл.
Алкил-фибриллы получали реакцией 10 мг карбоксил-фибрилл, которые содержали приблизительно 0,007 ммолей -СООН-групп (10 мг фибрилл х 0,7 ммоль -СООН/мг фибрилл=0,007 ммоль), с 0,14 ммоль алкиламинов в 1,5 мл ДМФ (N,N-диметилформамиде) с использованием 0,14 ммоль EDC (1-этил-3-(3-диметиламинопропил)карбодиимида) и 0,14 ммоль DMAP (4-диметиламинопиридина). Химическая реакция была следующей:
Фибрилла-СООН+NH2(CH2)nCH2R (R=H или ОН)-->
Фибрилла-CONH(CH2)nCH2R
При помощи этой процедуры получали несколько различных алкил-фибрилл с различной длиной алкильных цепей (n=5, 7, 9, 17; R=OH только для n=5). После перемешивания реакционной смеси при температуре окружающей среды в течение ночи фибриллы интенсивно промывали 3 х 25 мл CH2Cl2, 3 х 25 мл МеОН и 3 х 25 мл dН2О. Элементный анализ содержания азота в фибриллах показал, что выходы реакции были 65-100%.
Адсорбция ферментов.
Ферменты - липаза, трипсин, щелочная фосфатаза и авидин - были иммобилизованы на алкил-фибриллах адсорбцией. Алкил-фибриллы и фермент смешивали при комнатной температуре в течение 3-4 часов с последующим промыванием 2-4 раза 5 мМ фосфатом натрия (рН 7,1). Щелочную фосфатазу иммобилизовали на С8-фибриллах и на С6ОН-фибриллах, трипсин на С6-, С8-, С10- и на C18-фибриллах, липазу на С6ОНО, С8-, С10- и C18-фибриллах и авидин на С8-фибриллах. Результаты представлены в таблице 7.
Было обнаружено, что кинетические свойства иммобилизованных ферментов сравнимы с кинетическими свойствами свободных ферментов, как показано в таблице 8.
ПРИМЕР 42
Этерификация, катализируемая фибриллами с липазой.
Синтез этилбутирата.
Липазу иммобилизовали на С8-алкил-фибриллах согласно процедуре примера 41. Липаза-фибриллы промывали сначала диоксаном, затем смесью диоксана и гептана и наконец гептаном для диспергирования фибрилл в гептане. Для синтеза этилбутирата (пищевой добавки, которая дает ананасно-банановый вкус) этанол (0,4 М) и масляную кислоту (0,25 М) смешивали в гептане с 6,2 мкМ иммобилизованной на фибриллах липазой. Реакционную смесь перемешивали при комнатной температуре. Выход был 60% после 7 часов, его определяли измерением концентрации этанола в реакционной смеси при помощи общепринятого способа. Эта реакция и ее результаты показаны на фиг.8.
ПРИМЕР 43
Иммобилизация щелочной фосфатазы на фенил-алкил-фибриллах.
Получение фенил-алкил-фибрилл.
Фенил-алкил-фибриллы получали двумя различными реакциями. В реакции 1 смешивали 20 мг карбоксил-фибрилл (содержащих приблизительно 0,014 ммоль -СООН-групп) с 0,28 ммоль 4-фенил-бутиламина, 0,28 ммоль EDC и 0,28 ммоль DMAP (4-диметиламинопиридина) в 1,5 мл ДМФ (N,N-диметилформамиде). В реакции 2 смешивали 20 мг карбоксил-фибрилл с 0,28 ммоль 6-фенил-1-гексанола, 0,28 ммоль DCC (1,3-дициклогексилкарбодиимида) и 0,28 ммоль DMAP в 1,5 мл ДМФ. Реакции проводили при комнатной температуре с перемешиванием в течение ночи. Затем фибриллы промывали интенсивно 3 х 25 мл CH2Cl2, 3 х 25 мл МеОН и 3 х 25 мл dH2O.
Получение фибрилл с иммобилизованной щелочной фосфатазой.
0,5 мг фенил-алкил-фибрилл суспендировали в 400 мкл 0,05 М Триса (рН 8,6) и обрабатывали ультразвуком в течение 20 минут. К этим фибриллам добавляли 150 мкл раствора щелочной фосфатазы (1,67 мг/мл в 5 мМ натрий-фосфатном буфере, рН 7,0), смесь вращали при комнатной температуре в течение 2 часов и выдерживали при 4oС в течение ночи. Затем фибриллы промывали 600 мкл 5 мМ натрий-фосфатного буфера (рН 7,1) дважды и суспендировали в 200 мкл того же самого буфера.
Количественное определение специфически иммобилизованной щелочной фосфатазы путем измерения каталитической активности.
Щелочная фосфатаза реагирует с субстратом п-нитрофенилфосфатом и высвобождает цветное соединение, которое поглощает свет при 405 нм с коэффициентом экстинкции 18200 M-1см-1. Для этой реакции использовали в качестве тест-буфера 10 мМ Трис, 1 мМ MgCl2 и 0,1 мМ ZnCl2, рН 8,4. Реакцию проводили в кювете на 1 мл смешиванием 5 мкл исходного раствора п-нитрофенилфосфата (0,5 М в 33% ДМСО в тест-буфере) и 13 мкг фибрилл с иммобилизованной щелочной фосфатазой в 1 мл тест-буфера. Увеличение поглощения при 405 нм подвергали мониторингу с временным сканированием на протяжении 10 минут. Затем рассчитывали ферментативную активность из начального наклона кривой с использованием коэффициента экстинкции 18200 М-1см-1.
Для щелочной фосфатазы, адсорбированной на фенил-фибриллах из реакции 1, активность была 6,95 мкМ/мин на 13 мкг фибрилл. Для щелочной фосфатазы, адсорбированной на фенил-фибриллах из реакции 2, активность была 2,58 мкМ/мин на 13 мкг фибрилл. Эти результаты соответствовали 0,63 мкмоль (или 54 мг) и 0,23 мкмоль (или 20 мг) активной щелочной фосфатазы на грамм фибрилл соответственно, как было рассчитано делением активности раствора щелочной фосфатазы известной концентрации, которая была 879,8 мкМ/мин на 1 мкМ щелочной фофатазы при тех же самых условиях теста.
ПРИМЕР 44
Иммобилизация липазы на фенил-алкил-фибриллах.
Получение фибрилл с иммобилизованной липазой
0,5 мг фенил-алкил-фибрилл суспендировали в 50 мкл 5 мМ натрий-фосфатного буфера (рН 7,1), обрабатывали ультразвуком в течение 20 минут. К этим фибриллам добавляли 350 мкл раствора липазы (0,2 мМ в 5 мМ натрий-фосфатном буфере, рН 7,1), смесь вращали при комнатной температуре в течение 5 часов и выдерживали при 4oС в течение ночи. Затем фибриллы промывали 600 мкл 5 мМ натрий-фосфатного буфера (рН 7,1) дважды и суспендировали в 200 мкл того же самого буфера.
Количественное определение специфически иммобилизованной липазы путем измерения каталитической активности.
Липаза реагирует с субстратом резоруфиновым эфиром 1,2-о-дилаурил-rас-глицеро-3-глутаровой кислоты и высвобождает цветное соединение, которое поглощает свет при 572 нм с коэффициентом экстинкции 60000 М-1см-1. Для этой реакции использовали в качестве тест-буфера 0,1 М КН2РO4, рН 6,8. Реакцию проводили в кювете на 1 мл смешиванием 5 мкл исходного раствора (7,6 мМ в 50% диоксане в Thesit) и 13 мкг фибрилл с иммобилизованной липазой в 1 мл тест-буфера. Увеличение поглощения при 572 нм подвергали мониторингу с временным сканированием на протяжении 10 минут. Затем рассчитывали ферментативную активность (мкМ/мин) из начального наклона кривой с использованием коэффициента экстинкции 60000 М-1см-1.
Для липазы, адсорбированной на фенилалкил-фибриллах из реакции 1 примера 43, активность была 0,078 мкМ/мин на 13 мкг фибрилл. Для липазы, адсорбированной на фенилалкил-фибриллах из реакции 2 примера 43, активность была 0,054 мкМ/мин на 13 мкг фибрилл. Эти результаты соответствовали 4,7 мкмоль (или 564 мг) и 3,3 мкмоль (или 396 мг) активной липазы на грамм фибрилл соответственно, как было рассчитано делением активности раствора липазы известной концентрации, которая была 1,3 мкМ/мин на 1 мкМ щелочной фосфатазы при тех же самых условиях теста.
ПРИМЕР 45
Иммобилизация пероксидазы хрена (HRP) на модифицированных амино-алкилом фибриллах.
Получение функционализованных карбоновой кислотой фибрилл (карбоксил-фибрилл).
Пробу 10,0 г графитовых фибрилл суспендировали в 450 мл концентрированной Н2SO4 смешиванием шпателем и затем переносили в реакторную колбу, снабженную входным/выходным отверстиями и верхней мешалкой. При перемешивании и медленном токе аргона добавляли загрузку 8,68 г NаСlО3 порциями при комнатной температуре на протяжении периода 24 часов. Пары хлора, которые генерировались во время всего протекания этого опыта, выгонялись из реактора в улавливатель с водным раствором NaOH. В конце реакции суспензию фибрилл выливали на раздробленный лед и вакуум-фильтровали. Затем фильтровальный осадок переносили в муфту Сокслета и промывали в экстракторе Сокслета деионизованной водой, с заменой воды свежей деионизованной водой каждые несколько часов. Промывание продолжали, пока проба фибрилл при добавлении свежей деионизованной воды не переставала изменять рН этой воды. Затем карбоксилированные фибриллы извлекали фильтрованием и сушили в течение ночи при 100oС и вакууме 5'' рт. ст. Выход был 10,0 г.
Получение фибрилл с иммобилизованной HRP.
Амино-фибриллы, полученные из 1,6-диаминогексана согласно способу примера 27 (1,2 мг), добавляли к буферу для конъюгирования (0,1 М NаНСО3, 0,9% NaCl, pH 9,5) и суспензию обрабатывали ультразвуком в течение 20 минут. Затем фибриллы промывали дважды буфером для конъюгирования в пробирке Эппендорфа и суспендировали в 430 мкл буфера для конъюгирования. Аликвоту 50 мкл этой суспензии (0,14 мг фибрилл) смешивали с 4,0 мг активированной HRP (Pierce, Rockford, IL), растворенной в 50 мкл деионизованной воды, и полученную суспензию вращали в течение ночи при 4oС. HRP-конъюгированные фибриллы промывали интенсивно в центрифужной пробирке Эппендорфа комбинированием следующих растворов: буфера для конъюгирования, промывного буфера (20 мМ КН2РO4, 0,45% NaCl, pH 6,2), промывного буфера, содержащего 0,03-0,1% Тритон Х-100, и промывного буфера, содержащего 50% этиленгликоль. В качестве контроля идентичные манипуляции проводили с активированной HRP с обычными (немодифицированными) фибриллами, которые показали, что присоединение HRP к амино-фибриллам происходило действительно посредством ковалентного связывания.
Количественное определение специфически иммобилизованной HRP путем измерения каталитической активности.
Интенсивное промывание удаляло большую часть неспецифически связанного фермента. Иммобилизованную активную HRP количественно определяли по превращению субстрата с использованием H2O2 и хромогенного субстрата диаммониевой соли 2,2'-азинобис(3-этилбензтиазолин-6-сульфоновой кислоты) (ABTS). Каталитическую активность HRP подвергали спектрофотометрическому мониторингу при 414 нм с использованием 100 мкМ Н2O2 и 30 мкМ ABTS в качестве субстратов. Общее количество фермента, связанного с амино-фибриллами, в этих предварительных исследованиях было 0,0230 мкмоль HRP/г фибрилл. В сравнении с этим контроль (обычные фибриллы) не специфически связывал 0,0048 мкмоль HRP/г фибрилл. Путем вычитания получали количество ковалентно (специфически) связанной HRP 0,0182 мкмоль/г фибрилл.
ПРИМЕР 46
Разделение аффинной хроматографией щелочной фосфатазы (АР) и β-галактозидазы (βG) на фибриллах, несущих иммобилизованные ингибиторы ферментов.
Получение фибрилл с ингибитором щелочной фосфатазы.
Получение модифицированных АР-ингибитором фибрилл было основано на способе Brenna et al. (1975), Biochem. J., 151:291-296.
Карбоксилированные фибриллы использовали для получения NHS-эфир-фибрилл, как описано в примере 50. NHS-Эфир-фибриллы (114 мг) суспендировали в 4 мл ацетона и добавляли 10 эквивалентов (на основании оценки 0,7 мэкв NHS-эфира на грамм фибрилл) тирамина. Добавляли сухой триэтиламин (10 экв.) и смесь перемешивали в течение 3 часов при комнатной температуре. Тираминилированные фибриллы промывали под вакуумом на стеклянном фильтре (из спекшегося стекла) сначала ацетоном, затем интенсивно деионизованной водой.
4-(п-Аминофенилазо)фениларсоновую кислоту (66 мг) суспендировали в 4 мл 1 н. НСl. Суспензию охлаждали до 4oС и смешивали медленно с 0,36 мл 0,5 М NaNO2. После 15 минут смесь арсоновая кислота/NаNО2 добавляли к тираминилированным фибриллам, которые суспендировали в 10 мл 0,1 М NаСО3 (рН 10,0). Реакционную смесь (рН~10) перемешивали в течение ночи при 4oС. Затем фибриллы обрабатывали последовательными промывками 0,1 М Nа2СО3 (рН 10,0), 8 М гуанидин-HCl, 25 мМ NaOH и водой, пока эффлюент не становился прозрачным. Атомный абсорбционный анализ мышьяка в АР-ингибитор-фибриллах был проведен Galbraith Laboratories (Knoxville, TN). Было обнаружено атомным абсорбционным анализом, что АР-ингибитор-фибриллы имеют содержание мышьяка 0,4%. Это указывает на то, что при грубой оценке 10% оцененных первоначальных групп СООН были превращены в АР-ингибиторы в этом многостадийном синтезе. При расчете на площадь поверхности фибрилл это означает, что одна молекула ингибитора (сайта связывания фермента) приходится на каждые 500 ангстрем площади поверхности.
Получение фибрилл с ингибитором β-галактозидазы.
Модифицированные п-амино-фенил-β-D-тиогалактозидом (TPEG) фибриллы получали на основе способа Ullman (1984), Gene, 29:27-31. К 8 мг карбоксилированных фибрилл в 0,2 мл деионизованной воды добавляли 2,24 мг TPEG. рН суспензии доводили до 4,0 0,1 М НС1 и добавляли 15 мг EDAC. Смесь перемешивали в течение 3 часов при рН 4,0 и при комнатной температуре. Реакцию останавливали быстрым центрифугированием в пробирке Эппендорфа и удалением жидкости, β-галактозидаза-фибриллы промывали пять раз повторяющимся ресуспендированием в деионизованной воде и центрифугированием.
Афинные разделения.
Смеси щелочной фосфатазы (АР) (из E.coli, Type III; Sigma Chemical Co., St. Louis, МО) и β-галактозидазы (βG) (из E.coli; Calbiochem. La Jolla, CA) разделяли сериями на АР-ингибитор-фибриллах или на βG-ингибитор-фибриллах в микроцентрифужных пробирках Эппендорфа. Для аффинных разделений к 0,8-1,0 мг либо АР-, либо βG-ингибитор-фибрилл добавляли 1,0 мл растворов загрузочного буфера (200 мМ Трис, 10 мМ MgCl2, 1,6 М NaCl, 10 мМ цистеин, рН 7,4), содержащих как АР (обычно приблизительно 10 единиц), так и βG (обычно приблизительно 280 единиц). Полученные суспензии осторожно перемешивали на вортексе, затем вращали при комнатной температуре в течение 2 часов. После связывания ферментов фибриллы осаждали непродолжительным центрифугированием в настольной центрифуге и жидкую фазу, содержащую несвязанный фермент, оттягивали и сохраняли для определения активности фермента. Промывки (7 х 1,0 мл) загрузочным буфером проводили путем повторяющегося добавления буфера, осторожного перемешивания на вортексе, 15-минутного вращения, непродолжительного центрифугирования и оттягивания растворителя пастеровской пипеткой. После седьмой промывки те же самые манипуляции повторяемо проводили (5 х 1,0 мл) с соответствующим буфером для элюции либо для βG-ингибитор-фибрилл (100 мМ борат натрия, 10 мМ цистеин, рН 10,0), либо для АР-ингибитор-фибрилл (40 мМ NaHPO4, 10 мМ Трис, 1,0 мМ MgCl2, 0,1 мМ ZnCl2, pH 8,4).
Все фракции (несвязанный фермент, промывки и элюции) оценивали как на АР-, так и на βG-активность. Активность щелочной фосфатазы определяли спектрофотометрическим мониторингом скорости гидролиза 500 мкМ п-нитрофенилфосфата (PNPP) при 410 нм (Δε=18000 М-1см-1). Измерения активности щелочной фосфатазы проводили в 10 мМ Трис, 1,0 мМ MgCl2 и 0,1 мМ ZnCl2 при рН 8,4. β-Галактозидазу тестировали спектрофотометрическим мониторингом способности фермента гидролизовать 2-нитро-галакто-β-D-пиранозид (ONPG). Начальные скорости катализируемого β-галактозидазой гидролиза 5,0 мМ ONPG измеряли при 405 нм (Δε=3500 M-1см-1) в 10 мм Трис, 10 мМ MgCl2, 1,6 М NaCl, 10 мМ цистеине, рН 7,4.
Как для АР-ингибитор-фибрилл, так и для βG-ингибитор-фибрилл добавляли смесь АР и βG. Для облегчения определений способности специфического связывания концентрации добавленных ферментов были в большом избытке относительно концентраций иммобилизованного ингибитора. Для АР-ингибитор-фибрилл было связано 0,550 мкмоль АР/г фибрилл (в противоположность неспецифическому связыванию 0,020 мкмоль βG/г фибрилл). Для βG-ингибитор-фибрилл эта способность была 0,093 мкмоль βG/г фибрилл (в противоположность неспецифическому связыванию 0,012 АР/г фибрилл). Результаты экспериментов с аффинной хроматографией показаны на фиг. 9 и 10. АР-ингибитор-фибриллы не связывали ощутимо βG, но связывали АР, которая специфически элюировалась при добавлении к буферу 40 мМ фосфата, конкурентного ингибитора (фиг.9). Фибриллы, модифицированные βG-ингибитором, не связывали значительных количеств АР, но связывали βG, которая специфически элюировалась при повышении рН для ослабления связи фермент-ингибитор (фиг.10). Эти результаты показывают, что ингибиторы были успешно ковалентно присоединены к этим фибриллам, что иммобилизованные ингибиторы были доступны для больших молекул, что ингибиторы были приемлемы для специфического связывания ферментов и что, при специфическом связывании, ферменты оставались активными. На фиг.10 видно, что, по-видимому, продолжалось вымывание βG из βG-ингибитор-фибрилл. Это может быть скорее результатом природной слабой аффинности фермента-ингибитора, чем дефектом фибрилл, поскольку такое явление не наблюдается на фиг.9 с АР-ингибитор-фибриллами.
2. ФУНКЦИОНАЛИЗОВАННЫЕ НАНОТРУБКИ В КАЧЕСТВЕ ТВЕРДЫХ НОСИТЕЛЕЙ ДЛЯ АНТИТЕЛ
Было обнаружено, что антитела могут быть иммобилизованы на функционализованных нанотрубках и что такие антитела-нанотрубки имеют уникальные преимущества для многих приложений благодаря их высокой площади поверхности на вес, электропроводимости и химической и физической стабильности. Например, антитела-нанотрубки могут использоваться в качестве аффинных реагентов для молекулярных разделений. Антитела-нанотрубки применимы также для аналитических приложений, в том числе для диагностических иммуноанализов, таких как иммуноанализы на основе ECL.
Антитела могут быть иммобилизованы либо ковалентным связыванием, либо нековалентной адсорбцией. Ковалентную иммобилизацию выполняют различными способами, в том числе восстановительным аминированием углеводных групп антител, NHS-эфирной активацией карбоксилированных фибрилл (см. пример 27, выше) и реакцией тиолированных или малеимидо-фибрилл с восстановленными или малеимидо-модифицированными антителами (см. примеры 23 и 25 выше).
Наилучший способ присоединения антител к нанотрубкам будет зависеть от приложения, в котором они должны использоваться. Для разделений предпочтительным способом может быть нековалентная адсорбция, так как способность связывания белка является, по-видимому, наивысшей для этого способа. Для способов с участием ECL, где может быть важной электропроводимость фибрилл, могут быть предпочтительными ковалентные способы (алкильные придатки являются слабыми электрическими проводниками и можно ожидать, что они изолируют фибриллы). Восстановительное аминирование может быть наилучшим способом ковалентного присоединения антител к фибриллам, поскольку при использовании этого способа антитела правильно ориентированы, так что их сайты связывания направлены кнаружи (прочь от фибрилл).
3. ПРИСОЕДИНЕНИЕ НАД+ К ФУНКЦИОНАЛИЗОВАННЫМ НАНОТРУБКАМ
Было обнаружено, что кофакторы, такие как НАД+, могут быть присоединены и использованы в качестве твердого носителя для биоспецифической аффинной хроматографии белков, которые связываются с кофакторами ферментов. Например, НАД+-фибриллы использовали в качестве твердого носителя для очистки дегидрогеназы. Основным преимуществом использования фибрилл является большой размер доступной площади поверхности. Аффинный матрикс с высокой площадью поверхности является желательным вследствие высокой потенциальной емкости. Фибриллы могут быть дисперсией или могут быть фиксированы помещением в колонку или в мат.
ПРИМЕР 47
Аффинно-хроматографическое разделение дегидрогеназ на НАД+-фибриллах.
Получение НАД+-фибрилл.
Фибриллы окисляли для введения карбоксильных групп в соответствии с примерами 14 и 15. К суспензии фибрилл (31 мг) в растворе бикарбоната натрия (3 мл, 0,2 М, рН 8,6) добавляли раствор литиевой соли N6-[аминогексил]карбамоилметил)никотин-амидадениндинуклеотида (25 мг из Sigma в 5 мл раствора бикарбоната натрия). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Полученные фибриллы интенсивно промывали водой, N,N-диметилформамидом и метанолом. Результаты элементного анализа показали, что полученные фибриллы содержали 130 ммолей молекул НАД на грамм фибрилл согласно анализу азота и 147 ммолей молекул НАД на грамм фибрилл согласно анализу фосфора. Другие аналоги НАД+, имеющие линкеры, заканчивающиеся в аминогруппе, могут быть использованы для получения НАД+-фибрилл.
Аффинное разделение.
Фибриллы с иммобилизованным НАД+ (0,26 мг) и простые фибриллы (0,37 мг) обрабатывали ультразвуком с 0,1% полиэтиленгликолем (PEG, мол. масса 1000) в фосфате натрия (1 мл, 0,1 М, при рН 7,1) в течение 30 минут при 40oС, затем инкубировали в течение 30 минут при 40oС. Суспензию фибрилл центрифугировали и супернатант удаляли. Фибриллы инкубировали со смесью L-лактатдегидрогеназы (LDH) в 0,1% PEG (1000)-натрий-фосфатном буфере (250 мкл, отношение раствора LDH и 0,1% PEG-буфера было 1:1) в течение 90 минут при 4oС. Затем эти смеси уравновешивали в течение 30 минут при комнатной температуре. После инкубирования фибрилл с LDH фибриллы промывали 0,1% PEG (1000) в натрий-фосфатном буфере (5 х 1000 мкл) и каждое промывание занимало 15 минут с вращением. LDH элюировали 5 мМ раствором НАДН в 0,1% PEG (1000) в натрий-фосфатном буфере (5 мМ 3 х 100 мкл). Во время каждой элюционной промывки фибриллы вращали в течение 15 минут. LDH-активность в элюентах определяли измерением изменения поглощения при 340 нм во время восстановления пирувата. Тест-смесь содержала 0,1% PEG (1000) в натрий-фосфатном буфере (980 мкл), пируват (3,3 мкл, 100 мМ исходный раствор) и каждую фракцию элюции (16,7 мкл). Эта ферментативная реакция показана ниже
Результаты показали, что емкость (адсорбционная способность) для LDH на фибриллах с иммобилизованным НАД+ была 484 нмолей на грамм фибрилл, а емкость для LDH на простых фибриллах (контроль) была 3,68 нмолей на грамм фибрилл. Неспецифическое связывание LDH составляло 5,6%.
4. ФУНКЦИОНАЛИЗОВАННЫЕ НАНОТРУБКИ В КАЧЕСТВЕ ТВЕРДЫХ НОСИТЕЛЕЙ ДЛЯ СИНТЕЗА БЕЛКА
ПРИМЕР 48
Применение функционализованных фибрилл в качестве твердого носителя для синтеза пептидов.
К смеси амино-фибрилл (400 мг) и суспензии 4-(гидроксиметил)феноксиуксусной кислоты (255 мг, 1,4 ммоль) в метиленхлориде (20 мл) добавляли 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC, 268 мг, 1,40 ммоль) и гидрат 1-гидроксибензотриазола (НОВТ, 189 мг, 1,4 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре в атмосфере аргона. Полученные фибриллы интенсивно промывали метиленхлоридом, метанолом и водой, затем сушили под вакуумом с получением фибрилл. К этой суспензии фибрилл в N,N-диметилформамиде (ДМФ, 2 мл) и метиленхлориде (8 мл) добавляли N-(9-флуоренилметоксикарбонил)-О-бутил-L-серин (215 мг, 0,56 ммоль), 1,3-дициклогексилкарбодиимид (DCC, 115 мг, 0,56 ммоль) и 4-диметиламинопиридин (DMAP, 3,4 мг, 0,028 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре и полученные фибриллы обрабатывали 20% пиперидином в ДМФ (5 х 40 мл, каждый раз с пропитыванием в течение 1 минуты). Затем
полученные фибриллы интенсивно промывали ДМФ, водой, гидроксидом натрия (1 н. ), метанолом и метиленхлоридом. Полученные фибриллы Fib-Handle-Ser (О+)-СООН (нингидриновый тест был положительным) сушили под вакуумом. Для синтеза дипептида ту же самую процедуру использовали для присоединения аргинина. Результаты аминокислотного анализа Fib-Handle-Ser(O+)-Arg(Тε-2,2,5,7,8-пентаметилхроман-6-сульфонил) показывают, что этот продукт содержит 6,5 мкмоль серина на грамм фибрилл и 7,6 ммоль аргинина на грамм фибрилл. Любой другой пептид может быть получен при помощи этого способа.
5. БИОТИНИЛИРОВАННЫЕ ФИБРИЛЛЫ И БИОТИНИЛИРОВАННЫЕ АЛКИЛ-ФИБРИЛЛЫ
Было обнаружено, что поверхности фибрилл могут быть функционализованы биотинилированием или как алкилированием, так и биотинилированием. Затем фибриллы, содержащие такие модификации, могут связывать любые конъюгированные со стрептавидином вещества, такие как стрептавидиновые гранулы и связанные со стрептавидином ферменты.
Фибриллы предоставляют большие преимущества, чем твердые носители, вследствие их высокой площади поверхности. Гранулы, которые могут быть сделаны сильно магнитными, очень применимы в разделительных анализах. Биотинилированные фибриллы, описанные здесь, объединяют преимущества как фибрилл, так и гранул. Биотинилированные алкил-фибриллы являются расширением той же самой идеи, но обнаруживают дополнительное свойство адсорбции белков алкил-фибрилл.
Покрытые стрептавидином и биотином фибриллы могут быть использованы в диагностике и могут быть использованы в качестве улавливающих агентов для электрохемилюминесцентных анализов.
Новым признаком данного изобретения является сочетание двух твердых носителей на одной фибрилле с образованием бифункциональной фибриллы. Кроме того, описанный способ увеличивает площадь поверхности для гранул и значительно увеличивает намагниченность фибрилл.
ПРИМЕР 49
Получение биотинилированных фибрилл.
Биотинилированные фибриллы получали смешиванием 2,4 мг амино-фибрилл, полученных в основном, как описано в примере 16, и 9 мг биотина с длинной NHS-эфирной цепью в буфере 0,2 М NаНСО3 при рН 8,15. Эту смесь вращали при комнатной температуре в течение 4 часов и промывали тем же самым буфером дважды.
ПРИМЕР 50
Получение биотинилированных алкил-фибрилл
Биотинилированные алкил-фибриллы получали в двухстадийной реакции. Сначала смешивали 4,25 мг бифункциональных фибрилл (содержащих как амино, так и карбоксил) и 25 мг биотина с длинной NHS-эфирной цепью. Фибриллы промывали и сушили в вакууме.
Вторую реакцию проводили путем смешивания 4 мг биотинилированных бифункциональных фибрилл с 11 мг EDC (1-этил-3-(3-диметиламинопропил)карбодиимида), 7,5 мг DMAP (4-диметиламинопиридина) и 10 мкл NH2(CH2)7CH3 в 0,5 мл ДМФ. Смесь перемешивали при комнатной температуре в течение ночи. Конечные биотинилированные алкил-фибриллы промывали CH2Cl2, MeOH и dH2O.
ПРИМЕР 51
Биотинилированные фибриллы в качестве твердого носителя в анализах.
Биотинилированные фибриллы могут использоваться в анализах, включающих формы проведения анализов, которые требуют взаимодействий стрептавидин-биотин или авидин-биотин. Биотинилированные фибриллы могли бы быть дополнительно дериватизованы стрептавидином. Биотин, ковалентно связанный с фибриллами (см. пример 50), мог бы образовать сильные нековалентные связывающие взаимодействия со стрептавидином. Поскольку стрептавидин представляет собой тетрамерный белок с четырьмя равноценными сайтами связывания, стрептавидин, связанный с биотинилированными фибриллами, мог бы почти наверняка иметь незанятые сайты связывания, с которыми могли бы связываться дополнительные биотинилированные реагенты. Таким образом, биотинилированные фибриллы могли бы быть превращены в покрытые стрептавидином фибриллы.
Имеется ряд аналитических тестов, которые могли бы выпоняться с такими фибрилла-биотин-стрептавидиновыми (FBS) носителями. Например, биотинилированное антитело против аналита могло бы улавливаться на FBS-носителе (либо перед образованием комплекса антитела с аналитом, либо после этого). Анализы с использованием биотинилированных антител против аналитов хорошо разработаны. Такие анализы включают конкурентные анализы, в которых представляющий интерес аналит конкурирует с меченым аналитом за связывание с антителом против аналита. Свободный (несвязанный) аналит и свободный (несвязанный) меченый аналит можно вымыть из иммобилизованных фибриллой антител. Стадия промывания зависит от фибрилл, физически отделенных от фазы раствора общепринятыми способами, включающими центрифугирование, фильтрование или притягивание к магниту.
Кроме конкурентного анализа, иммуноанализ типа сэндвич-иммуноанализа мог бы проводиться на FBS-носителях. Сэндвич-иммуноанализы хорошо известны в области диагностики. Такие анализы включают связывание аналита одновременно с двумя антителами: первым "первичным" антителом, которое прикреплено на твердом носителе, например, будучи меченным посредством биотина, и "вторичным" антителом, которое не прикреплено к твердой поверхности, но помечено репортерной группой. Такой сэндвич-анализ мог бы проводиться с использованием фибрилл в качестве твердого захватывающего носителя, посредством которого фибриллы улавливаются, как описано в предшествующем параграфе. Следовательно, в таком анализе фибриллы могли бы иметь ковалентно связанный с ними биотин, который мог бы связываться со стрептавидином, который, в свою очередь, связан с биотинилированным первичным антителом, которое могло бы связываться с аналитом (если он присутствует), который мог бы быть связан с меченым вторичным антителом.
Аналогично, анализы с ДНК-зондом могли бы проводиться с использованием FBS-носителей. Биотинилированная одноцепочечная ДНК может быть связана с FBS-носителями и может происходить конкурентная гибридизация между комплементарными одноцепочечными молекулами ДНК (аналитом) и комплементарными мечеными олигонуклеотидами.
Другой тип биотинилированных фибрилл, биотинилированные алкил-фибриллы, могут использоваться в иммуноанализах и анализах с ДНК-зондами. Как описано в примере 51, биотинилированные фибриллы могут быть модифицированы ковалентным присоединением биотина к одному типу функциональной группы, а цепи алкила к другому типу функциональной группы. Полученные алкилированные биотинилированные фибриллы могут быть использованы в специфической ассоциации как со стептавидином, так и с авидином (через биотин), а также для адсорбции белков (через алкильные цепи).
Алкил-фибриллы могли бы использоваться в соединении с другими твердыми носителями, такими как покрытые стрептавидином магнитные гранулы. Одним из преимуществ фибрилл над такими гранулами является то, что они имеют гораздо большую площадь поверхности (на единицу веса). Следовательно, если фибриллы могли бы быть присоединены к наружной поверхности магнитных гранул, это существенно улучшило бы площадь поверхности и, следовательно, связывающую емкость этих гранул. Предполагается, что алкилированные, биотинилированные фибриллы могли бы смешиваться с покрытыми стрептавидином гранулами, приводя к высоким афинным взаимодействиям стрептавидина (гранула)-биотина (фибрилла) и, следовательно, получению покрытых фибриллами гранул с чрезвычайно высокой площадью поверхности. Поскольку алкил-фибриллы могут связывать белки посредством адсорбции, покрытые этими фибриллами гранулы могли бы образовать дальнейшие производные с адсорбированными белками, в том числе со стрептавидином и антителами. Как описано выше, покрытые стрептавидином или антителами фибриллы могут использоваться в иммуноанализах и анализах с ДНК-зондами. Таким образом, покрытые фибриллами гранулы могли бы улучшить свойства этих гранул значительным увеличением площади их поверхности, так что будет требоваться меньшее количество гранул в конкретном анализе для получения того же самого результата.
6. ТРЕХМЕРНЫЕ СТРУКТУРЫ
Окисленные фибриллы более легко диспергируются в водных средах, чем неокисленные фибриллы. Стабильные пористые 3-мерные структуры с мезо- и макропорами (порами >2 нм) очень применимы в качестве катализаторов или хроматографических носителей. Поскольку фибриллы могут быть диспергированы на индивидуализированной основе, хорошо диспергированная проба, которая стабилизирована поперечными (мостиковыми) связями, позволяет сконструировать такой носитель. Фунционализованные фибриллы являются идеальными для такого применения, так как они легко диспергируются в водных и полярных средах и функциональность обеспечивает точки поперечных связей. Кроме того, функциональная группа обеспечивает точки для несения каталитических или хроматографических сайтов. Конечным результатом является жесткая 3-мерная структура с ее доступной общей площадью поверхности с функциональными сайтами, которые могут служить носителем для активного агента.
Типичные применения этих носителей в катализе включают их использование в качестве высокопористого носителя для металлических пропитанных катализаторов, например катализаторов гидрирования из драгоценных металлов. Кроме того, способность анкерных молекулярных катализаторов связываться с носителем через функциональную группу в сочетании с высокой пористостью этой структуры позволяет проводить гомогенные реакции по типу гетерогенных. Такой привязанный молекулярный катализатор по существу болтается в непрерывной жидкой фазе, подобно гомогенному реактору, в котором он может использовать преимущества в селективности и скоростях, которыми отличаются гомогенные реакции. Однако, поскольку он привязан к твердому носителю, он может быть легко отделен и извлечен с получением активного, во многих случаях очень дорогостоящего катализатора.
Эти стабильные жесткие структуры позволяют проводить до сих пор бывшие очень трудными реакции, такие как асимметричные синтезы или аффинную хроматографию, путем присоединения подходящего энантиомерного катализатора или селективного субстрата к такому носителю. Получение производных через Metallo-Pc или металл-порфириновые комплексы также позволяет восстановить лиганд, связанный с ионом металла, и, кроме того, любую молекулу, которая связана с этим лигандом, через вторичные производные. Например, в случае, когда 3-мерной структурой функционализованных фибрилл является электрод или часть электрода, и функционализация произошла в результате адсорбции Со(II)Рс, электрохимическое окисление Со(II) до Со(III) в присутствии никотиновой кислоты будет производить нелабильный Со(III)-пиридильный комплекс с карбоновой кислотой в качестве боковой группы. Присоединение подходящего антигена, антитела, каталитического антитела или другого сайт-специфического улавливающего агента сделает возможным селективное разделение молекул (аффинную хроматографию), которое в ином случае очень трудно получить. После промывания электрода для удаления прилипшего материала комплекс Со(III), содержащий целевую молекулу, может быть электрохимически восстановлен извлечением лабильного комплекса Со(II). Затем лиганд на Со(II), содержащий целевую молекулу, может быть извлечен mass action-замещением лабильного лиганда Со(II) с разделением и извлечением тем самым молекул, которые иным образом очень трудно или дорого разделить и извлечь (например, хиральных лекарственных средств).
Ранее считали, что поры внутри матов из функционализованных углеродных фибрилл являются слишком малыми, чтобы позволить значительное протекание, и, следовательно, не могут быть применимы в качестве проточных электродов. Существовали также проблемы, связанные с использованием материалов из углеродных частиц или других материалов на основе углерода (таких как Reticulated Vitreous Carbon (RVC)) в качестве материалов для электродов. Например, пористые электродные материалы было невозможно образовывать in situ, упаковывать слишком плотно и формовать полости или каналы, они обнаруживали двумерную нестабильность во время изменений условий растворителя и потока и из них нельзя было изготовлять очень тонкие электроды. Использование функционализованных углеродных фибрилл в качестве электродов в проточной ячейке решило эти проблемы.
Функционализованные углеродные фибриллы, используемые в качестве электродов в проточной ячейке, могут быть модифицированы обработкой поверхности электроактивными агентами. Эти фибриллы могут быть также модифицированы неэлектроактивными материалами, которые могут выполнять каталитическую или электрокаталитическую функцию или выполнять ингибирование нежелательных реакций или адсорбции материалов из протекающего потока.
Такие проточные электроды применимы в разделительных способах, таких как электрохроматография, электрохимически модулируемая аффинная хроматография, электросинтез или электрохимически модулируемая ионообменная хроматография. Они могут быть также использованы в диагностических устройствах, разделяющих и/или анализирующих материал, улавливаемый на мате из углеродных фибрилл.
Могут быть использованы также композиционные маты, состоящие из функционализованных углеродных фибрилл и других волокон или состоящих из частиц материалов. Эти волокна или состоящие из частиц материалы могут добавляться к суспензии для изменения конечной пористости или проводимости мата из углеродных частиц.
ПРИМЕР 52
Применение фибрилл, функционализованных железо-фталоцианином, в качестве электродов в проточной ячейке.
Графитовые фибриллы модифицировали адсорбцией железо(III)фталоцианин-бис-пиридина (FePc-2Py) (Aldrich 41,016-0). 0,403 г фибрилл и 0,130 г FePc-2Py добавляли к 150 мл абсолютного EtOH и обрабатывали ультразвуком при помощи ультразвукового дезинтегратора 450 Watt Branson probe sonicator в течение 5 минут. Полученную суспензию фильтровали на найлоновый фильтр MSI 0,45 мкм в вакуум-фильтрующем сборнике с мембраной Millipore 47 мм, промывали водой и сушили в вакуумном термостате в течение ночи при 35oС. Конечный вес был 0,428 г, что свидетельствовало о значительной адсорбции. Спектрофотометрический анализ фильтрата учитывал оставшийся FePc-2Py.
5 мг модифицированных FePc-2Py фибрилл диспергировали в 10 мл ДИ-воды при обработке ультразвуком. Дисперсию помещали на кусочек плетеной сетки из нержавеющей стали (SS) 200 меш, удерживаемый в фильтрующем сборнике с мембраной 25 см, и давали ей высохнуть при комнатной температуре. Диск с диаметром 0,5 дюйма из мата из фибрилл, удерживаемого на SS-сетке, вырезали при помощи пробойника в форме арки.
Электрохимическую проточную ячейку конструировали из пластикового держателя для мембранного фильтра 13 мм типа Swinney путем помещения диска из золотой сетки (400 меш, Ladd Industries) с диаметром 13 мм на верхнюю часть мембранного держателя и образования электрического контакта с этой сеткой при помощи платиновой проволоки, изолированной трубкой с усадкой при нагреве из тефлона (Teflon®), которая проходила через стенку держателя для фильтра для наружного соединения в качестве рабочего электрода стабилизирующей трехэлектродной цепи. Золотую сетку фиксировали на месте минимальным количеством эпоксида вокруг наружного края. Полоску золотой фольги выкраивали в виде кольца и помещали в нижней части, расположенной по потоку секции держателя фильтра, и соединяли с изолированным выводом из Pt-проволоки для соединения в качестве противоэлектрода регулирующей напряжение (стабилизирующей) трехэлектродной цепи. Кольцо с диаметром 0,5 мм из серебряной проволоки, электрохимически окисленной в 1 М НСl, помещали в верхней части держателя фильтра с изолированным выводом для соединения в качестве электрода сравнения.
Диск с диаметром 0,5 дюйма модифицированных FePc-2Py CN помещали в проточную ячейку, которую затем соединяли с подходящими проводами регулятора напряжения (стабилизатора) EG and G PAR 273. Проточную ячейку соединяли с насосом со шприцем (Sаgе), наполненным 0,1 М КСl в 0,1 М калий-фосфатном буфере при рН 7,0. Циклические вольтамперограммы (CV) записывались при отсутствии потока (статические) и при потоке (0,4 мл/мин) при потенциальной скорости сканирования 20 мВ/сек (см.фиг.6). CV были почти одинаковыми с потоком и без потока и показали две стойкие волны обратимого окисления и восстановления, совпадающие с поверхностью, находящейся в пределах FePc-2Py. Устойчивость этих редокс-пиков в условиях тока жидкости демонстрирует, что FePc-2Py сильно связан с углеродными фибриллами и что модифицированные железо-фталоцианином фибриллы функционируют хорошо в качестве материала проточного электрода.
Другим примером 3-мерных структур являются фибрилльно-керамические композиционные материалы.
ПРИМЕР 53
Получение состоящих из модифицированных оксидом алюминия фибрилл (оксид алюминия-фибрилл) композиционных материалов (185-02-01).
Один грамм окисленных азотной кислотой фибрилл (185-01-02) хорошо диспергировали в 100 мл деионизованной воды при помощи дезинтегратора U/S (ультразвукового). Суспензию фибрилл нагревали до 90oС и медленно добавляли раствор 0,04 моль трибутоксида алюминия в 20 мл пропанола. Нагревание с обратным холодильником продолжали в течение 4 часов, после чего холодильник удаляли для удаления спирта. После 30 минут холодильник помещали обратно и суспензию нагревали с обратным холодильником при 100oС в течение ночи. Получали черный коллоидный раствор однородного вида. Этот коллоидный раствор охлаждали до комнатной температуры и после одной недели образовался черный гель с гладкой поверхностью. Гель нагревали при 300oС на воздухе в течение 12 часов.
Оксид алюминия-фибрилльные композиционные материалы испытывали сканирующей электронной микроскопией (SEM). Микрофотографии треснутых поверхностей обнаружили гомогенное диспергирование фибрилл в геле.
ПРИМЕР 54
Получение состоящих из диоксид кремния-фибрилл композиционных материалов (173-85-03).
2 г окисленных азотной кислотой фибрилл (173-83-03) хорошо диспергировали в 200 мл этанола при помощи обработки ультразвуком. К суспензии медленно добавляли раствор 0,1 моль тетраэтоксисилана, растворенного в 50 мл этанола, при комнатной температуре с последующим добавлением 3 мл концентрированной НС1. Смесь нагревали до 85oС и поддерживали при этой температуре, пока объем не уменьшался до 100 мл. Смесь охлаждали и оставляли стоять, пока не образовался черный твердый гель. Этот гель нагревали при 300oС на воздухе.
Состоящие из диоксид кремния-фибрилл композиционные материалы испытывали при помощи SEM. Микрофотографии растреснутых поверхностей обнаружили гомогенное диспергирование фибрилл в этом геле.
Могут быть приготовлены подобные препараты с другими керамиками, такими как диоксид циркония, диоксид титания, оксиды редкоземельных металлов, а также третичные оксиды.
7. ВКЛЮЧЕНИЕ ГРАФИТОВЫХ НАНОТРУБОК НА ПОЛИМЕРНЫЕ ГРАНУЛЫ
Полимерные гранулы, в частности магнитные полимерные гранулы, такие как изготовляемые Dynal и другие, имеют много применений в диагностике. Однако эти гранулы имеют низкую площадь поверхности по сравнению с площадью поверхности, доступной в случае нанотрубок. Функционализованные фибриллы могут быть включены на поверхность гранул, что позволяет использовать композиционный материал полимер/фибрилла в качестве твердых носителей для разделений или аналитического применения (например, для электрохемилюминесцентных анализов, для иммобилизации ферментов).
ПРИМЕР 55
Присоединение функционализованных фибрилл к функционализованным гранулам.
7,5 мг магнитных активированных тозилом гранул (Dynabeads М-450, Dynal, Oslo, Norway) (30 мг/мл) промывали три раза 0,1 М натрий-фосфатным буфером, рН 7,5. Затем к этим гранулам добавляли 0,9 мл 0,1 М натрий-фосфатного буфера, рН 8,4, и добавляли 0,1 мл амино-фибрилл. Смеси давали вращаться в течение 16-24 часов при комнатной температуре.
При наблюдении под микроскопом были видны комки фибрилл с гранулами на поверхности фибрилл.
Как показано предшествующим описанием и примерами, данное изобретение имеет приложение в приготовлении большого разнообразия функционализованных нанотрубок и в способах их применения.
Термины и выражения, которые были применены, используются как термины описания, а не ограничений, и нет намерения использования таких терминов или выражений для исключения каких-либо эквивалентов показанных и описанных признаков в виде их частей, причем признается, что возможны разнообразные модификации в пределах данного изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГРАФИТОВЫЕ НАНОТРУБКИ В ЛЮМИНЕСЦЕНТНЫХ АНАЛИЗАХ И СПОСОБЫ ПРОВЕДЕНИЯ ТАКИХ АНАЛИЗОВ | 1997 |
|
RU2189043C2 |
| Способ приготовления гетерогенного биокатализатора на основе бактериальных клеток, агрегированных с углеродными нанотрубками | 2015 |
|
RU2634414C2 |
| Покрытие для электрода устройства и устройство для количественной оценки содержания мочевины в физиологических жидкостях | 2024 |
|
RU2835673C1 |
| КОМПОЗИЦИОННЫЙ МАТЕРИАЛ И УСТРОЙСТВО ДЛЯ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ СОДЕРЖАНИЯ ЛАКТАТА В ФИЗИОЛОГИЧЕСКИХ ЖИДКОСТЯХ | 2024 |
|
RU2835306C1 |
| Композиционный материал и устройство для количественной оценки содержания крахмала в жидкостях | 2024 |
|
RU2840515C1 |
| Устройство для определения индекса летучих фенолов в воде | 2024 |
|
RU2838656C1 |
| ГИДРОЗОЛЬ ДЛЯ ФОРМИРОВАНИЯ ПОКРЫТИЙ ЭЛЕКТРОХИМИЧЕСКИХ ПЕРОКСИДЧУВСТВИТЕЛЬНЫХ СЕНСОРОВ И БИОСЕНСОРОВ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ЭЛЕКТРОХИМИЧЕСКИЙ СЕНСОР И БИОСЕНСОР, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2010 |
|
RU2419785C1 |
| Устройство для определения летучих алкилфенолов в водных средах | 2023 |
|
RU2816917C1 |
| Биокатализатор, способ его приготовления и способ получения сложных эфиров с использованием этого биокатализатора | 2019 |
|
RU2725474C1 |
| ПОВЕРХНОСТНО-АКТИВНЫЙ ОТБЕЛИВАТЕЛЬ И ДИНАМИЧЕСКИЙ pН | 2007 |
|
RU2431655C2 |

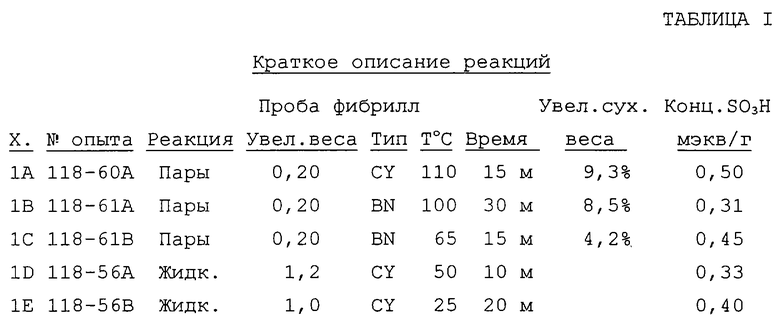
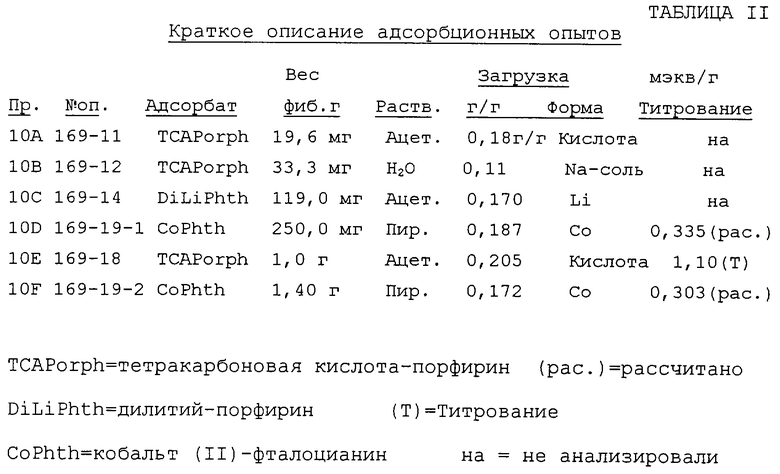

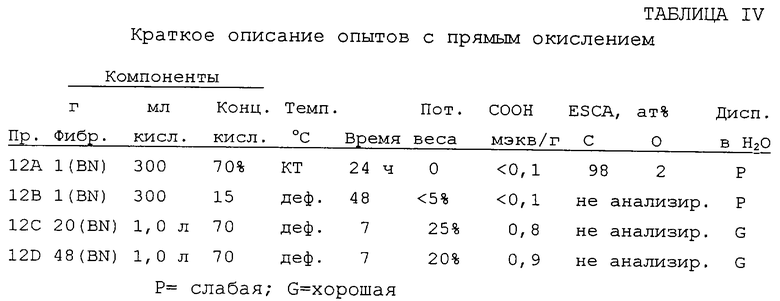


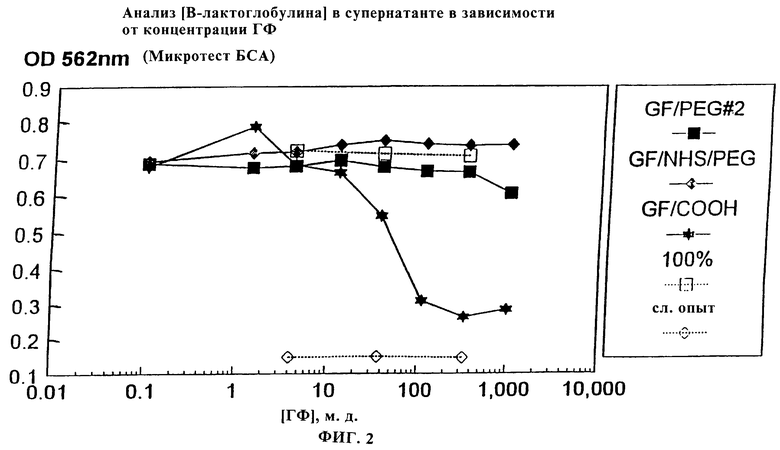

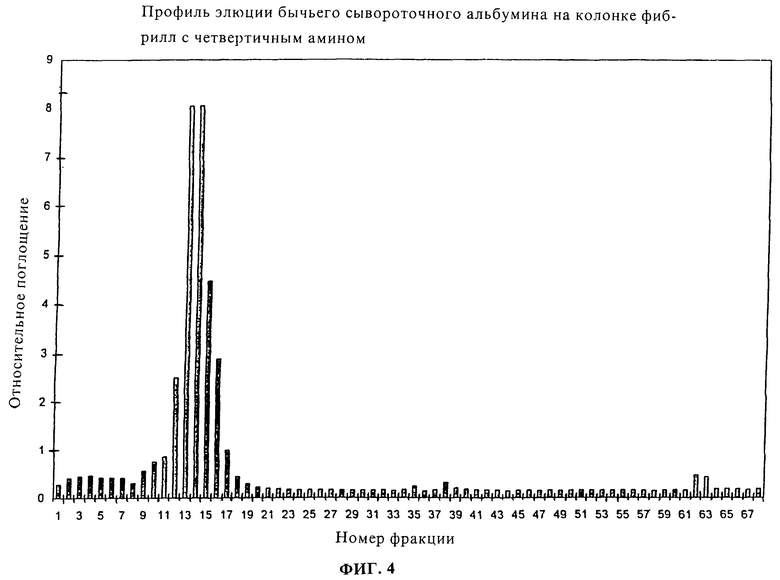


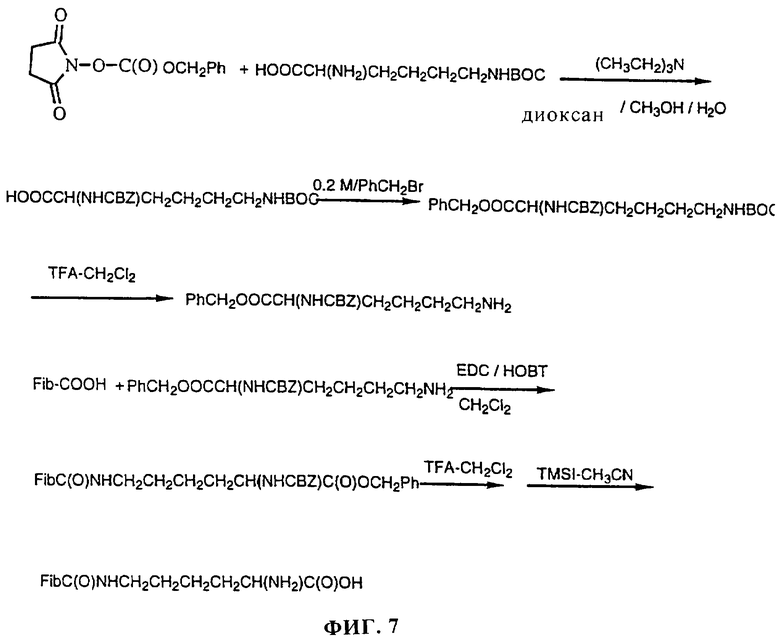
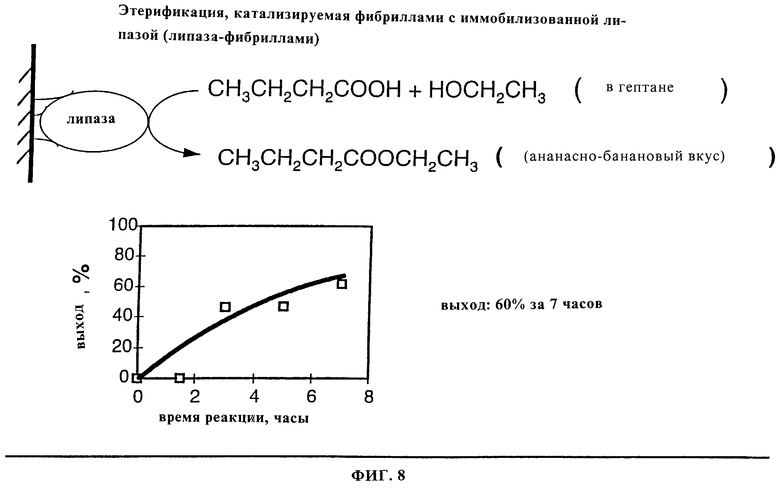
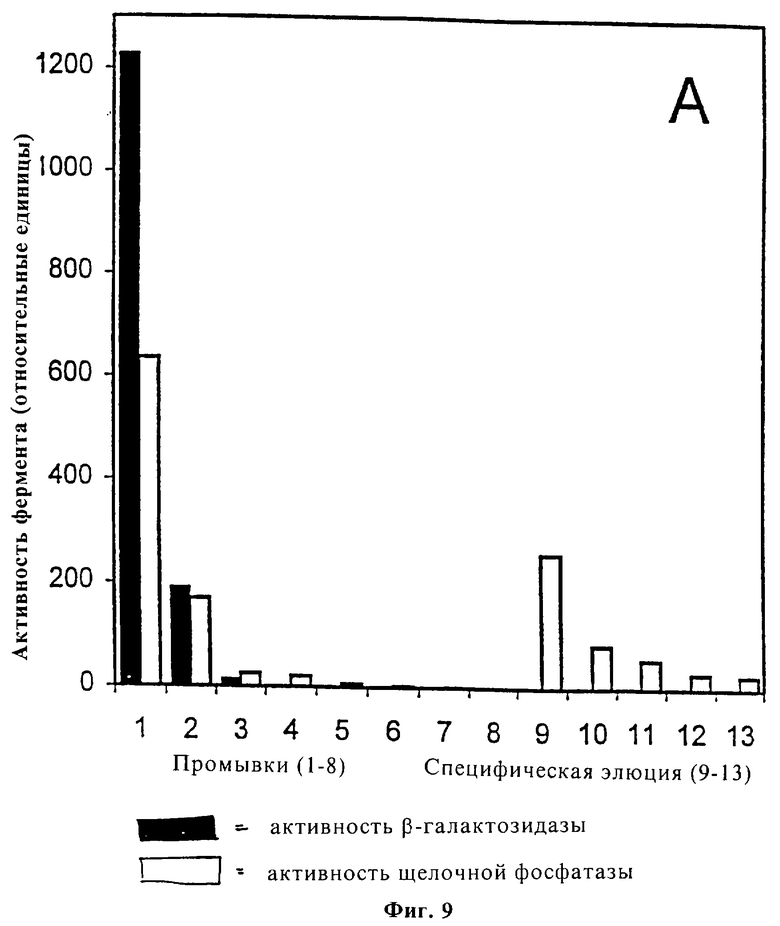

Изобретение относится к молекулярной биологии. Описаны графитовые нанотрубки, которые включают трубчатые фуллерены и фибриллы, которые функционализованы химическим замещением или адсорбцией функциональных частей биологических молекул. Более конкретно данное изобретение относится к графитовым нанотрубкам, которые однородно или неоднородно замещены химическими частями молекул или на которых адсорбированы некоторые циклические соединения, и к комплексным структурам, состоящим из таких функционализованных нанотрубок, соединенных друг с другом. Данное изобретение относится также к способам введения функциональных групп на поверхность таких нанотрубок. Технический результат - расширение арсенала биологически активных средств. 8 с. и 55 з.п. ф-лы, 10 ил., 9 табл.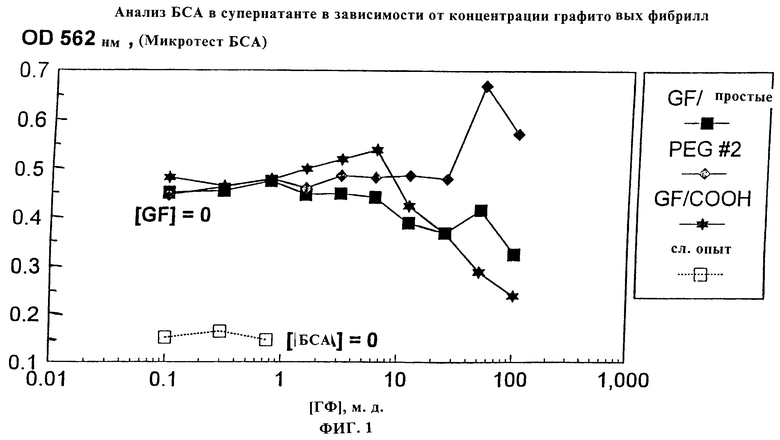
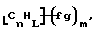
где атомы углерода, Сn, представляют собой поверхностные атомы углерода;
Н обозначает водород;
fg обозначает функциональную группу, представленную R, А, [R'-А] или [Х'-Аа] ;
n обозначает целое число;
L обозначает число меньше 0,1n,
m обозначает число меньше 0,5n,
и а обозначает целое число меньше 10; каждый из R является одним и тем же или различным и выбран из SО3Н, СООН, NH2, ОН, R'CHOH, CHO, CN, COCl, галогена, COSH, SH, COOR', SR', SiR'3, 
 R'', Li, AlR'2, Hg-X, TlZ2, и Mg-X; каждый R' обозначает водород, алкил, арил, циклоалкил, аралкил, циклоарил или поли(алкиловый эфир); А выбран из
R'', Li, AlR'2, Hg-X, TlZ2, и Mg-X; каждый R' обозначает водород, алкил, арил, циклоалкил, аралкил, циклоарил или поли(алкиловый эфир); А выбран из
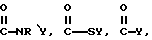
-CR'2-OY, N= Y,
Y обозначает подходящую функциональную группу белка, пептида, аминокислоты, фермента, антитела, нуклеотида, олигонуклеотида, антигена или субстрата фермента, ингибитора фермента или аналога переходного состояния субстрата фермента или выбран из R'-OH, R'-N(R')2, R'SH, R'CHO, R'CN, R'X, R'N+(R')3Х-, R'SiR'3, 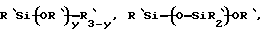 R'-R'', R'-N-CO,
R'-R'', R'-N-CO, 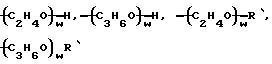
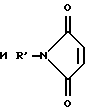
где y обозначает целое число, равное или меньше 3; R'' обозначает фторалкил, фторарил, фторциклоалкил или фтораралкил; Х обозначает галоген; Z обозначает карбоксилат или трифторацетат; и w обозначает целое число больше 1 и меньше 200; X' обозначает полициклическую ароматическую, полигетероциклическую ароматическую или металлополигетероциклическую ароматическую часть молекулы,
при условии, что, если fg не является R, то значение R' - водород исключено.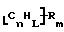
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки, имеющей отношение длины к диаметру больше 5 и диаметр меньше 0,5 мкм и все R одинаковы.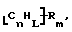
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой фибриллы, которая по существу не содержит пиролитически отложенного углерода, причем проекция графитовых слоев на указанных фибриллах простирается на расстояние по меньшей мере двух диаметров фибриллы, и все R одинаковы.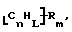
где атомы углерода, Сn, представляют собой поверхностные атомы фибриллы типа рыбьего скелета, и все R одинаковы.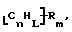
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки, имеющей отношение длины к диаметру больше 5 и диаметр меньше 0,5 мкм, и когда каждый из R представляет собой кислородсодержащую группу, то СООН не присутствует.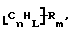
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой фибриллы, которая по существу не содержит пиролитически отложенного углерода, причем проекция графитовых слоев на указанных фибриллах простирается на расстояние по меньшей мере двух диаметров фибриллы, и когда каждый из R представляет собой кислородсодержащую группу, то СООН не присутствует.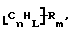
где атомы углерода, Сn, представляют собой поверхностные атомы фибриллы типа рыбьего скелета, и когда каждый из R представляет собой кислородсодержащую группу, то СООН не присутствует.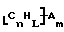
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки, имеющей отношение длины к диаметру больше 5 и диаметр меньше 0,1 мкм.
R' обозначает Н и Y обозначает аминокислоту, выбранную из группы, состоящей из лизина, серина, треонина, тирозина, аспарагиновой кислоты и глутаминовой кислоты.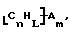
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой фибриллы, которая по существу не содержит пиролитически отложенного углерода, причем проекция графитовых слоев на указанных фибриллах простирается на расстояние по меньшей мере двух диаметров фибриллы.
R' обозначает Н и Y обозначает то же, что и в п. 9.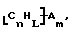
где атомы углерода, Сn, представляют собой поверхностные атомы фибриллы типа рыбьего скелета.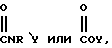
R' обозначает Н и Y обозначает то же, что и в п. 9.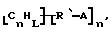
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки, имеющей отношение длины к диаметру больше 5 и диаметр меньше 0,5 мкм.
R' обозначает Н и Y обозначает то же, что и в п. 9.
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки, которая по существу не содержит пиролитически отложенного углерода, причем проекция графитовых слоев на указанных фибриллах простирается на расстояние по меньшей мере двух диаметров фибриллы.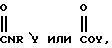
R' обозначает Н и Y обозначает то же, что и в п. 9.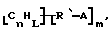
где атомы углерода, Сn, представляют собой поверхностные атомы фибриллы типа рыбьего скелета.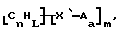
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки, имеющей отношение длины к диаметру больше 5 и диаметр меньше 0,5 мкм.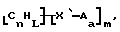
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки, которая по существу не содержит пиролитически отложенного углерода, причем проекция графитовых слоев на указанных фибриллах простирается на расстояние по меньшей мере двух диаметров фибриллы.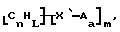
где атомы углерода, Сn, представляют собой поверхностные атомы фибриллы типа рыбьего скелета.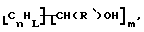
где атомы углерода, Сn, являются поверхностными углеродами по существу цилиндрической графитовой нанотрубки и n, L, m и R' указаны в п. 1, включающий стадию взаимодействия поверхностных углеродов с соединением, имеющим формулу R'CH2OH, в присутствии свободно-радикального инициатора в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу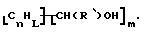
26. Способ по п. 25, где упомянутый свободно-радикальный инициатор представляет собой бензоилпероксид.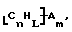
где атомы углерода, Сn, являются поверхностными углеродами по существу цилиндрической графитовой нанотрубки,
и n, L, m и А указаны в п. 1,
включающий стадии:
(а) взаимодействия поверхностных углеродов по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования замещенных нанотрубок, имеющих формулу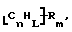
где каждый R выбран из SО3Н, СООН, NH2, ОН, R'CHOH, CHO, CN, COC1, галогена, COSH, SH, COOR', SR', SiR'3, 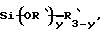
 R'', Li, AlR'2, Hg-X, TlZ2 и Mg-X, и y обозначает целое число, равное или меньше 3; и
R'', Li, AlR'2, Hg-X, TlZ2 и Mg-X, и y обозначает целое число, равное или меньше 3; и
(b) взаимодействия замещенных нанотрубок [СnНL] -Rm, по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу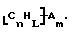
28. Способ по п. 22 получения продукта формулы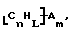
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки, имеющей отношение длины к диаметру больше 5 и диаметр меньше 0,5 мкм;
и n, L, m и А указаны в п. 1,
включающий стадии:
(а) взаимодействия поверхностных углеродов по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования замещенных нанотрубок, имеющих формулу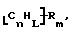
где каждый R обозначает то же, что и в п. 27, и y обозначает целое число, равное или меньше 3; и
(b) взаимодействие замещенных нанотрубок  по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу
по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу 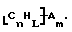
29. Способ по п. 22 получения продукта формулы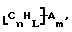
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки, по существу не содержащей пиролитически отложенного углерода,
и n, L, m и А указаны в п. 1,
включающий стадии:
(a) взаимодействия поверхностных углеродов по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования замещенных нанотрубок, имеющих формулу 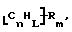 где каждый R обозначает то же, что и в п. 27, и y обозначает целое число, равное или меньше 3; и
где каждый R обозначает то же, что и в п. 27, и y обозначает целое число, равное или меньше 3; и
(b) взаимодействия замещенных нанотрубок  по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу
по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу 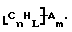
30. Способ по п. 22 получения продукта формулы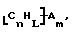
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки,
и n, L, m и А указаны в п. 1,
включающий стадию взаимодействия замещенных нанотрубок 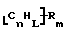 по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу
по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу  где каждый R обозначает то же, что и в п. 27; и y обозначает целое число, равное или меньше 3.
где каждый R обозначает то же, что и в п. 27; и y обозначает целое число, равное или меньше 3.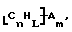
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки, имеющей отношение длины к диаметру больше 5 и диаметр меньше 0,1 мкм;
и n, L, m и А указаны в п. 1,
включающий стадию взаимодействия замещенных нанотрубок  по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу
по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу 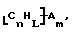 где каждый R обозначает то же, что и в п. 27; и y обозначает целое число, равное или меньше 3.
где каждый R обозначает то же, что и в п. 27; и y обозначает целое число, равное или меньше 3.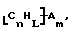
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки, по существу не содержащей пиролитически отложенного углерода,
и n, L, m и А указаны в п. 1,
включающий стадию взаимодействия замещенных нанотрубок 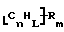 по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу
по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу 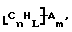 где каждый R обозначает то же, что и в п. 27, и y обозначает целое число, равное или меньше 3.
где каждый R обозначает то же, что и в п. 27, и y обозначает целое число, равное или меньше 3.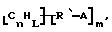
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки,
и n, L, m, R' и А указаны в п. 1,
включающий стадию взаимодействия замещенных нанотрубок  по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу
по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу 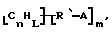 где каждый R обозначает то же, что и в п. 27; и y обозначает целое число, равное или меньше 3.
где каждый R обозначает то же, что и в п. 27; и y обозначает целое число, равное или меньше 3.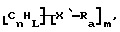
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки,
и n, L, a, m, R и X' указаны в п. 1,
включающий стадию адсорбции по меньшей мере одного подходящего макроциклического соединения на поверхность графитовой нанотрубки в условиях, достаточных для образования функционализованной нанотрубки формулы 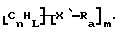
35. Способ по п. 22 получения продукта формулы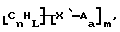
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки;
и n, L, а, m, X' и А указаны в п. 1,
включающий стадии:
(а) адсорбции по меньшей мере одного подходящего макроциклического соединения на поверхность графитовой нанотрубки в условиях, достаточных для образования функционализованной нанотрубки формулы 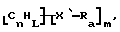 где каждый R обозначает то же, что и в п. 27, и y обозначает целое число, равное или меньше 3; и
где каждый R обозначает то же, что и в п. 27, и y обозначает целое число, равное или меньше 3; и
(b) взаимодействия замещенных нанотрубок 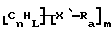 по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованной нанотрубки, имеющей формулу
по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованной нанотрубки, имеющей формулу 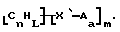
36. Способ по п. 22 получения продукта формулы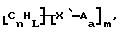
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки;
и n, L, а, m, X' и А указаны в п. 1,
включающий стадию взаимодействия замещенных нанотрубок 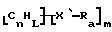 по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованной нанотрубки, имеющей формулу
по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованной нанотрубки, имеющей формулу 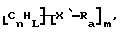 где каждый R обозначает то же, что и в п. 27, и y обозначает целое число, равное или меньше 3.
где каждый R обозначает то же, что и в п. 27, и y обозначает целое число, равное или меньше 3.
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки;
и n, L и m указаны в п. 1,
включающий стадии:
взаимодействия поверхностных атомов углерода по меньшей мере с одним подходящим реагентом в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу 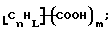 и
и
взаимодействия функционализованных нанотрубок с соединением, имеющим две или больше аминогрупп, в условиях, достаточных для образования функционализованных нанотрубок, имеющих формулу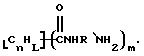
38. Способ по п. 22 получения продукта формулы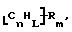
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки;
и n, L, m и R указаны в п. 1,
включающий стадию взаимодействия поверхностных углеродов по меньшей мере с одним ферментом, способным воспринимать нанотрубку в качестве субстрата и осуществлять химическую реакцию, приводящую к образованию композиции 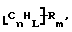 в водной суспензии в условиях, приемлемых для проведения этой реакции по меньшей мере одним ферментом.
в водной суспензии в условиях, приемлемых для проведения этой реакции по меньшей мере одним ферментом.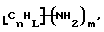
где атомы углерода, Сn, представляют собой поверхностные атомы углерода по существу цилиндрической графитовой нанотрубки,
и n, L и m указаны в п. 1,
включающий стадии:
взаимодействия поверхностных углеродов с азотной кислотой и серной кислотой с образованием нитрованных нанотрубок; и
восстановления нитрованных нанотрубок с образованием 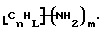
41. Углеродная нанотрубка с модифицированной поверхностью, которая включает цилиндрическую графитовую нанотрубку, имеющую отношение длины к диаметру более 5 и диаметр менее 0,5 мкм, которая содержит на поверхности указанной углеродной нанотрубки функциональные группы, образованные за счет контакта с эффективным количеством реагента для введения функциональной группы на поверхность углеродной нанотрубки.
| US 5098771, 24.03.1992 | |||
| US 5165909, 24.11.1992 | |||
| US 5124075, 23.06.1992. |
Авторы
Даты
2003-03-20—Публикация
1997-03-05—Подача