Изобретение относится к фармацевтическим препаратам вообще и, в частности, к полученному лиофильной сушкой стабилизированному рекомбинантному Фактору VIII (rF VIII), не содержащему альбумина.
Фактор VIII представляет собой хорошо известный белок плазмы, играющий существенную роль в процессе свертывания крови. Хотя Фактор VIII можно получать, и до сего дня получают, из плазмы человека, в последние годы делались попытки получать Фактор VIII методом рекомбинантной ДНК (rF VIII) с целью избежать потенциальных загрязнений, сопутствующих веществам крови. Кроме того, источники рекомбинантного Фактора VIII обеспечивают практически неограниченное количество фактора свертывания крови, что позволяет избежать ограничений в снабжении, связанных с применением плазмы донорской крови в качестве его источника.
Так как одним из преимуществ получаемого рекомбинантного Фактора VIII (rF VIII) является то, что он производится не из плазмы крови человека и, следовательно, свободен от потенциальных примесей (загрязнений) из нее, то целью производства rF VIII являлось получить устойчивый состав rF VIII, который можно описать, как абсолютно свободный от каких-либо загрязнений продуктами жизнедеятельности человека. Однако, к сожалению, Фактор rF VIII является белком и, подобно многим другим белкам, применяемым в терапии, может стать неустойчивым при хранении. Чтобы преодолеть эту неустойчивость, в обычной практике в продукт в качестве стабилизатора добавляют сывороточный альбумин человека. Было найдено, что альбумин является хорошим стабилизатором rF VIII, и его применяют во многих имеющихся в продаже промышленных продуктах. Однако при использовании альбумина человека в качестве стабилизатора rF VIII утрачивается первоначальное преимущество применения продукта рекомбинации (а именно то, что человек не используется в качестве источника вещества).
Недавно описано несколько препаратов Фактора VIII как в среде с низкой, так и средней ионной силой, с применением хлористого натрия, хлористого кальция и гистидина в качестве иона буфера. Кроме того, применялись основные аминокислоты, такие как лизин, и сахара, такие как маннит, сахароза или мальтоза. Для того чтобы повысить стабильность не содержащего альбумин препарата Фактора VIII при сохранении необходимой изотоничности раствора, требуемой для терапевтических целей, в таких не содержащих альбумин препаратах использовали примерно 10% сахара (см., например, патент США 4877608 (состав с низкой ионной силой). Европейский патент 0314095 описывает другой не содержащий альбумина состав с высокой ионной силой и гистидином в качестве буферирующего агента.
Указанный выше патент США 4877608 рассматривает жидкий раствор, а не лиофилизируемый продукт, который должен выдерживать лиофилизационные циклы, необходимые для получения продукта. Применявшийся впервые жидкий состав с относительно высоким содержанием хлористого натрия описан в Европейском патенте 314095.
Другие патенты, касающиеся препаратов Фактора VIII, включают патент США 5399670, который описывает применение аргинина в содержащем альбумин лиофилизированном составе (см. также Международную заявку WO 95/01804), которая описывает препарат, не содержащий сахарозу или глицин, и патенты США 4440679 и 4623717, в которых указано применение, по меньшей мере, 30 вес.% сахаров в комбинации с аминокислотами для стабилизации F VIII в жидком состоянии в условиях пастеризации (60oС, по меньшей мере, 10 часов).
Помимо вышеприведенных препаратов Фактора VIII есть несколько других патентов, касающихся очистки и/или стабилизации Фактора VIII. Таковые включают патент США 5288853, который описывает многостадийный производственный процесс, заключающийся в применении колонки для связывания гепарина с последующим добавлением глицина с целью образования в качестве продукта очищенного Фактора VIII.
Патент США 5399670 описывает процесс получения лиофилизированного препарата Фактора VIII с повышенной стабильностью, который перед лиофилизацией требует добавления аргинина к раствору Фактора VIII.
Патент США 5259951 описывает многостадийный способ очистки Фактора VIII от плазмы с применением колонок для ионообменной хроматографии.
Патент США 4758657 описывает многостадийный процесс отделения Фактора VIII: C от плазмы, при котором, по крайней мере, на одной из стадий необходима адсорбция Фактора VIII:C на гидрофобном носителе.
В дополнение к вышеназванным патентам совсем недавно описан препарат Фактора IX (F IX), который, по-видимому, сходен с препаратом rF VIII, описанным ниже (cм. реферат 244 L. Bush и др., Hemophilia, т. 2, дополнение 1, стр. 64 (июнь 1996)). Фактор F IX представляет собой профермент, который превращается в активный протеолитический энзим. С другой стороны, F VIII представляет собой со-фактор наряду с другими коагулирующими компонентами для того, чтобы осуществить свертывание крови. Молекулярный вес Фактора F VIII составляет около 340.000 дальтон, тогда как Фактор F IX имеет молекулярный вес примерно от 56.000 до 57.000 дальтон. Фактор F VIII очень чувствителен к протеолитическому процессингу, который сопровождается потерей коагулирующей активности. Хорошо известно, что Фактор VIII по своей природе менее устойчив, чем Фактор F IX, и лиофилизированные концентраты каждого фактора показывают заметное различие устойчивости при хранении при различных температурах. В отличие от F VIII Фактор F IX включает уникальное гамма карбоксилирование 12N-концевых остатков глутаминовой кислоты, что и является возможным объяснением различной стабильности. Таким образом рецептура препаратов Фактора F IX не обязательно соответствует рецептуре препаратов Фактора F VIII.
В журнале Pharmaceutical Research, том 12, 6, стр. 31-837, 1995 также описан препарат антагониста рецептора стабилизированного рекомбинантного интерлейкина-1 человека, подобный описанному ниже.
Несмотря на прошлые и настоящие усилия по получению устойчивого препарата rF VIII, который можно было бы успешно лиофилизировать, а позже быстро снова разбавлять водой, до настоящего времени было трудно получить препарат, который не только не содержит продуктов жизнедеятельности человека, таких как альбумин, но также удовлетворяет требованиям правильной лиофилизации и быстрого разбавления, и изотоничности, и в то же время обеспечивает Фактор rF VIII, стабильный в течение длительного времени с фармацевтически приемлемым сроком хранения.
Неожиданно было обнаружено, что такой препарат возможен. В процессе поиска этого препарата оказалось, что гистидин, который, как сообщалось, использовался в предыдущей технике в качестве буферирующего агента, в действительности оказывал дестабилизирующее действие на лиофилизированные, не содержащие альбумин препараты. Было обнаружено, однако, что дестабилизирующее влияние гистидина может быть с успехом преодолено с помощью новой рецептуры, содержащей соли, глицин и сахарозу, сочетание которых, как было найдено, оказывает благотворное действие на стабилизацию Фактора rF VIII. Эта смесь также защищает Фактор rF VIII во время многократных циклов замораживания-размораживания в процессе лиофилизации и обеспечивает быстрое разбавление лиофилизированного продукта водой. Препарат содержит как кристаллические, так и аморфные компоненты, в отличие от большинства известных в технике рецептур, которые, в основном, являются аморфными. Препарат по данному изобретению остается устойчивым в жидком состоянии, по крайней мере, в течение 24 часов при комнатной температуре. Подробно препарат по изобретению и его применение описаны ниже.
Препарат Фактора rFVIII представляет собой фармацевтически приемлемый, не содержащий альбумина лиофилизированный продукт, который может быть легко (в течение 30 секунд) разбавлен водой и применим для лечения гемофилии. Лиофилизированный препарат представляет собой новую смесь солей, аминокислот и сахара. Он устойчив при комнатной температуре и в отличие от препаратов по известному уровню (препаратов, применяемых в технике) имеет относительно низкое содержание сахара.
Препарат после разбавления водой содержит следующие ингредиенты:
глицин - примерно от 65 до 400 мМ, предпочтительно 290 мМ;
гистидин - примерно до 50 мМ, предпочтительно от 1 до 50 мМ, наиболее предпочтительно 20 мМ;
сахароза - примерно от 15 до 60 мМ, предпочтительно 30 мМ;
хлористый натрий - примерно до 50 мМ, предпочтительно от 1 до 50 мМ, наиболее предпочтительно 30 мМ;
хлористый кальций - примерно до 5 мМ, предпочтительно от 0,1 до 5 мМ, наиболее предпочтительно 2,5 мМ;
rF VIII - примерно от 50 до 1500 МЕ/мл.
В предпочтительном лиофилизированном препарате количество остаточной воды должно быть от 1 до 3 вес.%, предпочтительно около 1 вес.%.
На чертеже в виде диаграммы представлено сравнение активности во времени при 40oС препарата по данной заявке с относительно низким содержанием сахара (верхняя кривая) с препаратом, применяемым в технике, с относительно высоким содержанием сахара (нижняя кривая).
Целью данного изобретения была разработка не содержащего альбумин препарата, который обеспечивает устойчивость рекомбинантного Фактора rF VIII (минимальная или менее чем примерно 20% потеря активности) в ходе различных стадий процесса, таких как ультрафильтрация/диафильтрация, хранение замороженной массы, процессы замораживания-размораживания и лиофилизация. Кроме того, желательно было, чтобы быстро растворяющийся продукт был устойчив в разбавленном жидком состоянии. Наконец, желательно было иметь приемлемый лиофилизированный продукт с подходящим сроком хранения, который можно было бы лиофилизировать в течение короткого цикла лиофилизации (замерзания-сушки).
Белки не кристаллизуются во время лиофилизации. Целью процесса сушки было перевести растворенный в воде белок в аморфное состояние для предотвращения его химической и/или конформационной неустойчивости, вызванной кристаллическим состоянием (или полной потерей воды). Так, обычно вводят значительные количества альбумина (до 1%) для создания аморфной фазы (компонента), чтобы стабилизировать белки.
На основании общих соображений был получен состав как с кристаллическим компонентом для обеспечения быстрой лиофилизации, так и с аморфным компонентом для стабилизации рекомбинантного Фактора rF VIII. Используемое ниже выражение "кристаллический с аморфным компонентом" означает, что рецептура содержит две или более различные фазы, причем, по крайней мере, одна из них является кристаллической, и одна является аморфной. Твердые вещества могут существовать в кристаллическом или аморфном состоянии. Кристаллические вещества характеризуются тем, что имеют определенную структуру, стехиометрический состав и температуру плавления. Напротив, аморфные вещества не имеют явно выраженной молекулярной структуры и могут быть охарактеризованы как переохлажденные жидкости с чрезвычайно высокой вязкостью, такие как вязкоэластичная "резина" или более твердое хрупкое стекло. Полагают, что другие сахара, такие как мальтоза, трегалоза и мальтотриоза могут также входить в состав аморфного компонента. Маннит может входить в состав кристаллического компонента рецептуры.
Стратегия, применявшаяся для разработки фармацевтически приемлемого, не содержащего альбумина препарата рекомбинантного Фактора rF VIII, состояла в следующем:
a) Исходный материал представлял собой тщательно очищенный (высокочистый) rF VIII, который чистили с помощью процессов ортогональной хроматографии. Таковые можно определить как хроматографические процессы, которые осуществляются определенными способами, в соответствии с определенными правилами и обычно применяются последовательно. В результате белок можно быстро очистить, применяя различные (наи)более эффективные способы очистки. В итоге получен Фактор VIII, по крайней мере, 90%-ной чистоты (с помощью электрофореза в геле) с удельной активностью более, чем 2000 МЕ/мг белка. Теоретическая чистота rF VIII является дискуссионным вопросом, но, полагают, что она равна, примерно, 3500-5000 МЕ/мг белка.
b) Рецептуру белка разрабатывали, применяя ультрафильтрацию/диафильтрацию (УФ/ДФ), и исследовали регенерацию в ходе УФ/ДФ, чувствительность к замораживанию-размораживанию и устойчивость в жидком состоянии при различных температурах термостатирования.
c) Потенциальные препараты дополнительно были охарактеризованы их отношением к нагреванию с помощью ДСК (дифференциальной сканирующей калориметрии). Определялись температуры стеклования (Тг'), расстекловывания (кристаллизации стекла) (Тк') и эвтектическая температура плавления (Тэ'). С помощью этой информации определяли рецептуру препарата, который можно быстро лиофилизировать и который использовался в дальнейших исследованиях.
d) Препараты с лучшей рецептурой лиофилизировали, применяя быстрый цикл лиофилизации, и анализировали устойчивость при стандартных и повышенных температурах хранения.
e) Устойчивые препараты просто отбирали среди образцов, хранившихся при 40oС, через различные временные интервалы.
При анализе результатов многочисленных исследований, которые привели к рецептуре препарата по данному изобретению, применяли стратегию многомерного (со многими переменными) экспериментального дизайна и программу для поиска группы ингредиентов, которые представляли собой смеси аминокислот, солей и сахаров. Результаты анализировали, применяя сложную программу для того, чтобы учесть все взаимодействия между ингредиентами, и проводили анализ многомерной функции (поверхности) отклика в пространстве данных. Неожиданно было найдено, что гистидин (обычно используемый в технике) в действительности дестабилизирует препараты rF VIII. Это привело к необходимости критически изучить критерии для различных ингредиентов в найденной авторами данного изобретения рецептуре препарата, которая в конечном счете оказалась приемлемой.
Пример 1
Влияние на устойчивость лиофилизированного рекомбинантного Фактора rF VIII изучали титрованием различных количеств гистидина в смеси, содержащей rF VIII, а также содержащей 150 мМ хлористого натрия, 2,5 мМ хлористого кальция и 165 мМ маннита. Результаты представлены в таблице (см. в конце описания).
Из вышеприведенных данных видно, что увеличение количества гистидина приводит к понижению активности разбавленного водой лиофилизированного rF VIII в зависимости от дозы. Этот результат подтверждает, что гастидин не играет роли в стабилизации F VIII в лиофилизированном состоянии.
Пример 2
Устойчивость rF VIII в рецептурах с высоким и низким содержанием сахара.
Были составлены две рецептуры препаратов рекомбинантного Фактора VIII. Нестабильность изучали в условиях хранения при повышенной температуре (40oС).
Препарат с рецептурой с высоким содержанием сахара, подобной рецептуре по известному уровню техники, представлял собой аморфный состав, содержащий, после разбавления в воде, 50 мМ хлористого натрия, 2,5 мМ хлористого кальция, 5 мМ гистидина и 10 вес.% мальтозы.
Препарат с рецептурой с низким содержанием сахара по данному изобретению был кристаллическим, для стабилизации белка содержащим в качестве аморфного компонента 1% сахарозы (30 мМ сахарозы). Этот препарат, после разбавления WFI, содержал 30 мМ хлористого натрия, 2,5 мМ хлористого кальция, 20 мМ гистидина, 290 мМ глицина и примерно 200 МЕ/мл rF VIII. Сравнение данного препарата с препаратом, применяемым в технике (см. чертеж), показывает, что препарат с низким содержанием сахара по данному изобретению является значительно более устойчивым во времени, чем препарат с высоким содержанием сахара, применяемый в технике.
Следует иметь в виду, что различные модификации, известные специалистам в данной области, также относятся к данному изобретению. Следовательно, вышеприведенные примеры служат только для иллюстрации, а объем изобретения определяется только нижеследующей формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЙ СТАБИЛИЗАТОР ДЛЯ ФАРМАЦЕВТИЧЕСКИХ БЕЛКОВ | 2011 |
|
RU2571496C2 |
| НОВЫЙ СТАБИЛИЗАТОР ДЛЯ ФАРМАЦЕВТИЧЕСКИХ БЕЛКОВ | 2011 |
|
RU2707090C2 |
| НОВЫЕ НЕ СОДЕРЖАЩИЕ АЛЬБУМИН СОСТАВЫ ФАКТОРА VIII | 2000 |
|
RU2244556C2 |
| НОВЫЕ ЗАЩИТНЫЕ КОМПОЗИЦИИ ДЛЯ РЕКОМБИНАНТНОГО ФАКТОРА VIII | 2009 |
|
RU2510279C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРЕПАРАТ КОАГУЛЯЦИОННОГО ФАКТОРА VIII, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ПОВЕРХНОСТНО-АКТИВНОГО ВЕЩЕСТВА В КАЧЕСТВЕ СТАБИЛИЗАТОРА | 1993 |
|
RU2136294C1 |
| СОСТАВ ХЛОРИДА НАТРИЯ ДЛЯ ВОССТАНОВЛЕНИЯ ИЛИ РАЗБАВЛЕНИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2006 |
|
RU2432157C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИОФИЛИЗИРОВАННЫХ ПЕЛЛЕТ, СОДЕРЖАЩИХ ФАКТОР VIII | 2016 |
|
RU2735082C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ФАКТОРА VIII | 2004 |
|
RU2253475C1 |
| ЛИОФИЛИЗИРОВАННАЯ КОМПОЗИЦИЯ ДЛЯ ИНДУКЦИИ ИММУННОГО ОТВЕТА НА ФЛАВИВИРУС, КОМПОЗИЦИЯ И СПОСОБ ДЛЯ ЕЕ ПОЛУЧЕНИЯ | 2007 |
|
RU2541784C2 |
| СПОСОБ ПРОИЗВОДСТВА ФАКТОРА VIII, ИМЕЮЩЕГО УЛУЧШЕННОЕ СООТНОШЕНИЕ FVIII:C/FVIII:Ag | 2015 |
|
RU2695428C2 |

Изобретение относится к медицине и касается устойчивого, не содержащего альбумина препарата рекомбинантного Фактора VIII (rFVIII) в лиофилизированной форме, в которой имеются как кристаллические, так и аморфные компоненты, которая после разбавления водой содержит примерно от 65 до 400 мМ глицина, до 50 мМ гистидина, от 15 до 60 мМ сахарозы, от 1 до 50 мМ хлористого натрия, до 5 мМ хлористого кальция и от 50 до 1500 МЕ/мл rFVIII. Наиболее предпочтительная рецептура содержит после разбавления водой около 290 мМ глицина, 20 мМ гистидина, 30 мМ сахарозы, 30 мМ хлористого натрия, 2,5 мМ хлористого кальция и от 50 до 1500 МЕ/мл rFVIII. Содержание остаточной воды в лиофилизированном препарате составляет от 1 до 3 вес.%, предпочтительно около 1 вес.%. Изобретение позволяет повысить сроки хранения. 3 з.п. ф-лы, 1 ил., 1 табл.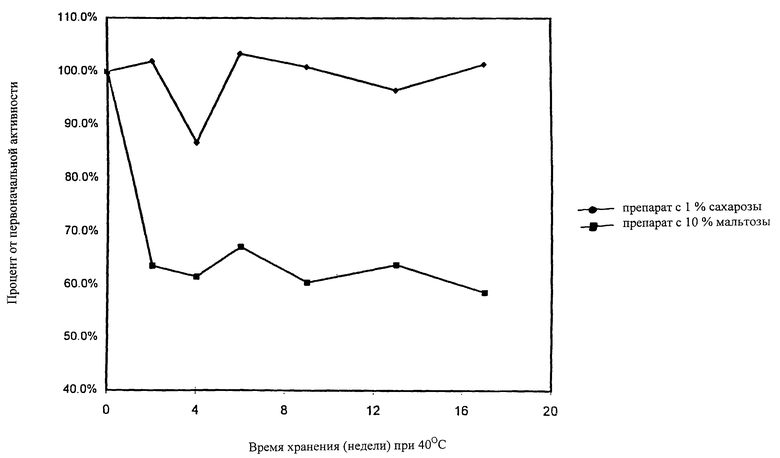
Рекомбинантный фактор коагуляции VIII - Примерно 50-1500 МЕ/мл
Глицин - Примерно 65-400 ммоль
Гистидин - Примерно до 50 ммоль
Хлорид натрия - Примерно 1-50 ммоль
Хлористый кальций - Примерно до 5 ммоль
Сахароза - Примерно 15-60 ммоль
2. Композиция по п. 1, отличающаяся тем, что содержание остаточной воды составляет примерно от 1 до 3 вес. %.
Рекомбинантный фактор коагуляции VIII - Примерно 50-1500 МЕ/мл
Глицин - Примерно 290 ммоль
Хлорид натрия - Примерно 30 ммоль
Хлористый кальций - Примерно 2,5 ммоль
Гистидин - Примерно 20 ммоль
Сахароза - Примерно 30 ммоль
4. Композиция по п. 3, отличающаяся тем, что содержание остаточной воды составляет примерно 1 вес. %.
| СТЕНД ДЛЯ ИССЛЕДОВАНИЯ НАПРЯЖЕННОГО СОСТОЯНИЯ ПОРШНЯ | 0 |
|
SU314095A1 |
| Экономайзер | 0 |
|
SU94A1 |
| Способ получения производных 1-(2- -имидазолинил)-2,2диарилциклопропана | 1973 |
|
SU508194A3 |
Авторы
Даты
2003-03-27—Публикация
1997-07-11—Подача