Изобретение относится к технологии получения неконцентрированной азотной кислоты и может быть использовано также в производствах концентрированной азотной кислоты, нитрит-нитратных солей и калийных удобрений.
Известен способ получения азотной кислоты, включающий каталитическое окисление аммиака кислородом воздуха в оксид азота (II) с образованием нитрозного газа, гомогенное окисление оксида азота (II) в оксид азота (IV) кислородом воздуха, охлаждение нитрозного газа до 160-180oС с достижением степени окисленности (в частях единицы), равной 0,85-0,88, конденсацию реакционной влаги из нитрозного газа с охлаждением газа до 40-50oС, доокисление оксида азота (II) нитрозного газа кислородом дополнительного воздуха с достижением перед абсорбционной колонной содержания оксидов азота (NO2 и NO) в нитрозном газе, равного 6,0-6,5 об.%, и степени окисленности 0,75÷0,78, дальнейшую абсорбцию оксидов азота конденсатом водяного пара в колонне абсорбции с образованием продукционной азотной кислоты, содержащей 56-59 мас.% НNO3 [Бонне M., Заичко Н.Д., Караваев М.М. и др. Производство азотной кислоты в агрегатах большой единичной мощности. М., Химия, 1985, c. 94-104, 136].
Процесс переработки оксида азота (II), полученного окислением аммиака кислородом воздуха, в азотную кислоту представляет собой сложную совокупность параллельно-последовательных физико-химических превращений, являющихся функциями многих технологических параметров, таких как температура, давление, концентрация реагентов, время контактирования.
Известный способ обеспечивает получение целевого продукта - неконцентрированной азотной кислоты, однако характеризуется пониженной концентрацией продукционной азотной кислоты, равной 56-59 мас.%.
Указанный недостаток известного способа получения азотной кислоты обусловлен такими причинами:
- пониженным содержанием оксидов азота (NO и NO2) в нитрозном газе на входе в колонну абсорбции (6,0-6,5 об.%) вследствие интенсивного кислотообразования в процессе выделения реакционной влаги в холодильниках-конденсаторах из переокисленного нитрозного газа, по экзотермическим реакциям
2NO+О2-2NО2+Q1, (1)
3NО2+H2О=2HNО3+NO+Q2; (2)
- пониженной степенью окисленноста нитрозного газа (0,75-0,78) на входе в абсорбционную колонну вследствие образования вторичного оксида азота (II) в процессе кислотообразования по реакции (2), идущей во время конденсации реакционной влаги;
- доокисление нитрозного газа кислородом дополнительного воздуха непосредственно перед колонной абсорбции не обеспечивает требуемую степень окисленноста из-за малого окислительного объема и повышенной температуры нитрозного газа в кубовой части абсорбционной колонны.
Таким образом, пониженное содержание оксидов азота в нитрозном газе на входе в колонну абсорбции, низкая степень окисленноста и повышенная температура нитрозного газа в кубовой части абсорбционной колонны ведут к снижению концентрации продукционной азотной кислоты, снижению степени абсорбции оксидов азота.
Наиболее близким к заявляемому способу по технической сути и достигаемому эффекту является способ получения азотной кислоты, включающий каталитическое окисление аммиака кислородом воздуха с образованием нитрозного газа, каталитическое окисление оксида азота (II) в оксид азота (IV) кислородом воздуха, выделения реакционной влаги из нитрозного газа в присутствии продукционной азотной кислоты после окончания интенсивного выделения реакционной влаги, дальнейшую абсорбцию оксидов азота водой и регенерацию азотной кислоты, используемой в рецикле азотной кислоты. При этом охлажденный до 250oС нитрозный газ направляют в реактор каталитического окисления оксида азота (II), где его пропускают через слой катализатора, доокисляя кислородом воздуха. Окисленный по реакции (1) и охлажденный до 175oС нитрозный газ имеет степень окисленности, равную 0,88-0,90. Выведение реакционной влаги из нитрозного газа осуществляют в барботажном холодильнике-конденсаторе за счет орошения нитрозного газа продукционной азотной кислотой при температуре 45oС. Степень окисленности нитрозного газа на выходе из холодильника-конденсатора уменьшается и равна 0,78-0,80 вследствие процесса кислотообразования по реакции (2).
Доокисление оксида азота (II) нитрозного газа осуществляют кислородом дополнительного воздуха и продукционной азотной кислотой в барботажном окислителе при температуре 60-80oС. При этом за счет протекания жидкостного окисления оксида азота (II) азотной кислотой происходит обогащение нитрозного газа вторичным оксидом азота (IV) и раскисление азотной кислоты по эндотермической реакции
NO+2HNО3=3NО2+Н2О-Q3. (3)
Степень окисленности нитрозного газа перед абсорбционной колонной составляет 0,93-0,95, при этом содержание оксидов азота (NO и NО2) в газе составляет 7,5-8,0 об.% [Авт. свид. СССР 1685866, МПК 5 С 01 В 21/40, 1991].
Повышенное содержание оксидов азота в нитрозном газе и высокая степень окисленности газа перед абсорбционной колонной обеспечивают получение продукционной азотной кислоты концентрацией 50-70 мас.% НNО3.
Достижения этого эффекта обеспечивают подачей продукционной кислоты на орошение барботажного конденсатора в количестве 100-150 кг/т HNO3, что соответствует 10-15% от общего количества продукционной кислоты, а также благодаря доокислению кислородом дополнительного воздуха в присутствии продукционной кислоты в барботажном окислителе. Раскисленный раствор азотной кислоты, содержащий 37-56 мас.% НNO3 и 1,0-1,5 мас.% N2O4, направляют в абсорбционную колонну. Количество азотной кислоты в рецикле, ниже 10%, не обеспечивает протекания процесса совсем, а более 15% - экономически нецелесообразно из-за значительных энергетических затрат на циркуляцию продукционной кислоты по большому контуру.
Указанный способ получения азотной кислоты в сравнении с вышеописанным позволяет повысить содержание оксидов азота в нитрозном газе и степень окисленности его перед абсорбционной колонной, что приводит к повышению степени абсорбции и концентрации продукционной азотной кислоты.
К недостаткам указанного технического решения необходимо отнести:
- значительные энергетические затраты на создание циркуляционного контура продукционной азотной кислоты, который, однако, обеспечивает высокую степень окисленности нитрозного газа и повышенное содержание оксидов азота перед абсорбционной колонной;
- расход готового продукта (продукционной кислоты) в циркуляционном контуре;
- недостаточное использование тепловой энергии нитрозного газа, часть которой теряют, отводя в водооборотный цикл с расходуемой охлаждающей водой.
Кроме того, потенциальной тепловой энергии нитрозного газа с температурой 60-80oС недостаточно для раскисления более чем 100 кг/т моногидрата азотной кислоты по эндотермической реакции (3) и повышения содержания оксидов азота в нитрозном газе более чем на 8 об.%.
Задачей, на решение которой направлено изобретение, является повышение экономичности способа получения азотной кислоты путем осуществления дополнительного жидкостного окисления оксида азота (II) в оксид азота (IV) до начала интенсивного выделения реакционной влаги из нитрозного газа при определенной температуре за счет использования тепловой энергии нитрозного газа и осуществления абсорбции оксидов азота в присутствии десорбированной и раскисленной до 10-30 мас.% азотной кислоты, что дает возможность уменьшить материальные и энергетические затраты производства за счет:
- сокращения количества единиц оборудования в технологической схеме процесса (реактор каталитического окисления оксида азота (II) в оксид азота (IV), насосы для циркуляционного контура продукционной кислоты),
- экономии материалов (катализатор, охлаждающая вода) и эффективного использования низкопотенциальной тепловой энергии нитрозного газа,
- при этом повышают содержание оксидов азота перед абсорбционной колонной и обеспечивают сохранение на известном уровне концентрации продукционной азотной кислоты и содержания оксидов азота в "хвостовых" газах после абсорбционной колонны.
Заявляемый способ имеет следующие существенные признаки:
- дополнительное окисление оксида азота (II) в оксид азота (IV) осуществляют азотной кислотой с одновременным обогащением нитрозного газа оксидом азота (IV) до начала интенсивного выделения реакционной влаги из нитрозного газа;
- жидкостное окисление оксида азота (II) азотной кислотой и ее одновременное раскисление осуществляют при температуре 90-120oС за счет использования тепловой энергии нитрозного газа;
- абсорбцию оксидов азота осуществляют в присутствии десорбированной и раскисленной до 10-30 мас. % азотной кислоты, образующейся после дополнительного окисления;
- дополнительное окисление оксида азота (II) в оксид азота (IV) осуществляют азотной кислотой, образующейся на стадии конденсации реакционной влаги.
Жидкостное окисление оксида азота (II) указанной азотной кислотой в указанных выше условиях (температура 90-120oС) приводит к резкому ускорению реакции (3).
При этом повышается содержание оксидов азота в нитрозном газе перед абсорбционной колонной до 8,5-9,5 об.%, степень окисленности газа 0,93-0,95, а содержание азотной кислоты уменьшается до 10-30 мас.% (она раскисляется).
Жидкостное окисление оксида азота (II) азотной кислотой по реакции (3) осуществляют в предконденсаторе (он же окислитель), обычном насадочном аппарате, при непосредственном контактировании горячего малоокисленного нитрозного газа и раствора 40-50%-ной кислоты, образующейся на стадии конденсации реакционной влаги в холодильнике-конденсаторе.
Совокупность технологических приемов позволяет получить неожиданный эффект - достичь высокой степени обогащения нитрозного газа оксидом азота (IV) при температуре, отвечающей точке росы этого газа - 90-120oС. Дальнейшее выделение реакционной влаги из нитрозного газа, поступающего при температуре 90-120oС на охлаждение в холодильник-конденсатор, осуществляют в условиях скоростной конденсации влаги и пониженной скорости кислотообразования.
Кроме вышеуказанного окисления в предконденсаторе нитрозный газ обогащается оксидами азота (NO и NO2) благодаря их десорбции из 40-50%-ного раствора азотной кислоты от контактирования его с горячим нитрозным газом. Десорбированный и раскисленный раствор азотной кислоты содержит 10-30 мас.% HNО3, его направляют в абсорбционную колонну.
Заявляемый способ обеспечивает:
- получение повышенного содержания оксидов азота в нитрозном газе перед абсорбционной колонной (8,5-9,5%, по прототипу - 7,5-8,0%);
- достижение основных технологических показателей способа на известном уровне: степени окисленности нитрозного газа перед абсорбционной колонной (0,93-0,95), концентрации азотной кислоты до 70 мас.% (по прототипу 50-70 мас. %) и содержания оксидов азота в "хвостовых" газах после абсорбционной колонны до 0,08 об.% при условии одновременного получения азотной кислоты повышенной концентрации. При этом уменьшаются материальные и энергетические затраты производства за счет устранения из технологической схемы циркуляционного контура продукционной азотной кислоты и реактора каталитического окисления оксида азота (II) с катализатором, улучшается экономичность процесса в целом.
Сравнение заявляемого технического решения с прототипом показывает, что предложенный способ отличается новым порядком технологических операций и приемами, позволяющими вести процесс в ином аппарате и в условиях, отличающихся от условий ведения процесса по известному способу. Таким образом, заявляемый способ отвечает критерию "новизна".
Заявляемое техническое решение иллюстрируют принципиальная технологическая схема получения азотной кислоты и пример, подтверждающий промышленную применимость технического решения. На чертеже схематически изображен узел подготовки и переработки нитрозного газа в производстве азотной кислоты в аппаратах:
1 - предконденсатор;
2 - холодильник - конденсатор;
3 - абсорбционная колонна;
4 - продувочная колонна.
Заявляемый способ осуществляют следующим образом (см. чертеж): малоокисленный нитрозный газ (ГН) со степенью окисленности 0,65-0,75 и температурой 160-170oС направляют в нижнюю часть предконденсатора 1, в который сверху самотеком поступает из холодильника-конденсатора 2 раствор Р1, содержащий 40-50 мас. % азотной кислоты. В предконденсаторе 1 осуществляют охлаждение нитрозного газа до точки росы 90-120oС и восстановление азотной кислоты в оксид азота (IV) за счет использования тепловой энергии нитрозного газа при условии прямого контактирования горячего газа с раствором 40-50%-ной азотной кислоты.
Нитрозный газ (ГН) из предконденсатора I с температурой 90-120oС направляют в холодильник-конденсатор 2, где осуществляют его смешивание с дополнительным воздухом 6 и отдутыми оксидами азота из продувочной колонны 4, а остаточное охлаждение нитрозного газа (ГН) до 40-50oС с образованием раствора, содержащего 40-50 мас.% азотной кислоты. Этот раствор после десорбции и раскисления в предконденсаторе 1 направляют в абсорбционную колонну 3. Нитрозный газ (ГН) после холодильника-конденсатора 2, содержащий 8,5-9,5 об.% оксидов азота, с температурой 40-50oС и степенью окисленности 0,93-0,95 тоже направляют в абсорбционную колонну 3.
Вследствие противоточного взаимодействия нитрозного газа (ГН) и абсорбента - конденсата водяного пара (КВП) в присутствии раскисленного и десорбированного водного раствора Р2, содержащего 10 - 30% азотной кислоты, в колонне 3 образуется продукционная азотная кислота концентрацией до 70 мас.%, при этом "хвостовые" газы (ГХ) содержат до 0,08 об.% остаточных оксидов азота. Продукционную азотную кислоту направляют в продувочную колонну 4, где осуществляют десорбцию растворенных в азотной кислоте оксидов азота воздухом, и далее - на склад готовой продукции.
Предложенный способ поясняется примером.
Пример. Нитрозный газ в количестве 3790 м3/т, содержащий 360 м3/т (или 9,5 об. %) оксидов азота со степенью окисленности 0,72 (температура 170oС, давление 0,7 МПа) подают в нижнюю часть предконденсатора 1. В верхнюю его часть подают 400 кг/т азотной кислоты (моногидрата) в виде водного раствора, который содержит 48 мас.% азотной кислоты. Вследствие этого при температуре 105oС, соответствующей точке росы для приведенных параметров нитрозного газа и являющейся саморегулируемой величиной, идет интенсивное окисление азотной кислотой оксида азота (II) в оксид азота (IV) с обогащением нитрозного газа до 460 м3 /т (или 13,5 об.%) оксидов азота, увеличением степени окисленности до 0,94 и раскислением водного раствора азотной кислоты до 25 мас.%. На дальнейшей стадии скоростной конденсации реакционной влаги в холодильнике-конденсаторе 2 с введением дополнительного воздуха в количестве 600 м3/т идет частичная потеря оксида азота (IV) с образующимся раствором, содержащим 48 маc. % азотной кислоты. Нитрозный газ из холодильника-конденсатора 2 поступает в абсорбционную колонну 3 в количестве 3400 м3/т. Он содержит 310 м3/т (или 9,1 об. %) оксидов азота. Раскисленный и десорбированный водный раствор, содержащий 25 мас.% азотной кислоты, из предконденсатора 1 самотеком поступает в куб абсорбционной колонны 3. Нитрозный газ взаимодействует с конденсатом водяного пара в абсорбционной колонне 3 с образованием продукционной азотной кислоты концентрации 70 мас.% и содержанием оксидов азота в "хвостовых" газах после абсорбционной колонны 0,08 об.%.
Как видно из примера, предлагаемый способ получения азотной кислоты обеспечивает увеличение содержания оксидов азота в нитрозном газе перед абсорбционной колонной и сохранение на известном уровне таких технологических показателей, как степень окисленности нитрозного газа перед абсорбционной колонной, концентрации продукционной азотной кислоты и одновременно с этим содержания оксидов азота в "хвостовых" газах после абсорбционной колонны.
Предлагаемый способ применен в условиях опытно-промышленных испытаний на агрегате производства азотной кислоты УКЛ-7. Ожидаемый годовой экономический эффект от внедрения предлагаемого способа на одном агрегате УКЛ составляет 50 тыс. долл. США.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОИЗВОДСТВА НИТРИТА НАТРИЯ | 1993 |
|
RU2069174C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИЛАМИНСУЛЬФАТА И УСТАНОВКА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1991 |
|
RU2045471C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЗОТНОЙ КИСЛОТЫ | 1991 |
|
RU2009996C1 |
| СПОСОБ ПРОИЗВОДСТВА НИТРИТА НАТРИЯ | 1993 |
|
RU2069173C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЦЕНТРИРОВАННОГО ОКСИДА АЗОТА (II) | 2001 |
|
RU2186723C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЦЕНТРИРОВАННОГО МОНООКСИДА АЗОТА | 1997 |
|
RU2121964C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИЛАМИНСУЛЬФАТА | 2002 |
|
RU2241662C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИЛАМИНСУЛЬФАТА | 2003 |
|
RU2259940C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИЛАМИНСУЛЬФАТА | 2003 |
|
RU2257339C1 |
| СПОСОБ УПРАВЛЕНИЯ ПРОЦЕССОМ ПРОИЗВОДСТВА КОНЦЕНТРИРОВАННОГО ОКСИДА АЗОТА (II) | 1996 |
|
RU2127222C1 |
Изобретение относится к области технологии получения неконцентрированной азотной кислоты и может быть использовано в производствах концентрированной азотной кислоты, нитрит-нитратных солей и калийных удобрений. Способ получения азотной кислоты включает стадии окисления аммиака, подготовки и переработки нитрозного газа, в том числе абсорбцию, при этом подготовку и переработку нитрозного газа осуществляют, применяя дополнительное окисление оксида азота (II) в оксид азота (IV) раствором азотной кислоты промежуточной концентрации с одновременным обогащением нитрозного газа оксидом азота (IV) при определенной температуре до выделения реакционной влаги из нитрозного газа и проводя процесс абсорбции в присутствии раствора десорбированной и раскисленной азотной кислоты. Способ позволяет эффективно использовать низкопотенциальную энергию нитрозного газа, повысить содержание оксида азота в нитрозном газе перед абсорбционной колонной, улучшить экономичность процесса в целом при улучшении и сохранении основных технологических показателей процесса на известном уровне. 2 з.п.ф-лы, 1 ил.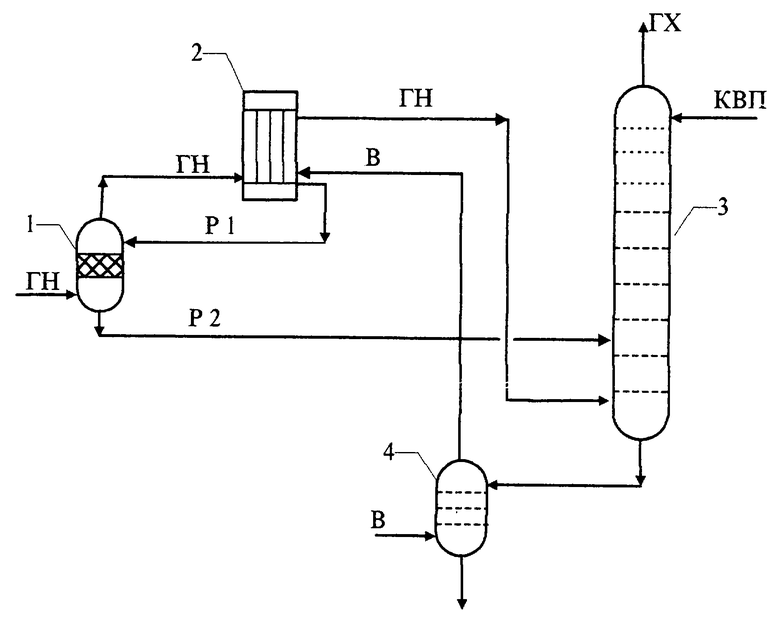
| Способ получения азотной кислоты | 1987 |
|
SU1685866A1 |
| Справочник азотчика | |||
| Изд | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| - М.: Химия, 1987, с | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| СПОСОБ ПОЛУЧЕНИЯ АЗОТНОЙ КИСЛОТЫ | 1991 |
|
RU2009996C1 |
| US 3634031 А, 11.01.1972. | |||
Авторы
Даты
2003-04-10—Публикация
2001-06-27—Подача