Изобретение относится к биологическим средствам для диагностических или терапевтических целей, более конкретно к антителу VFF-18 и его аналогам.
Недавно было показано, что экспрессия вариантов поверхностных гликопротеинов гена CD44 необходима и достаточна, чтобы вызвать так называемое спонтанное метастатическое поведение как в неметастазирующей линии клеток аденокарциномы поджелудочной железы крысы, так и в неметастазирующей линии клеток фибросаркомы крысы (Günthert и др., 1991). В то время, как наименьшая изоформа CD44, стандартная форма CD44s (или CD44std), выражается повсюду в ряду различных тканей, включая эпителиальные клетки, определенные сплайсинговые варианты CD44 (CD44v, CD44var) выражаются только в подгруппе эпителиальных клеток. Варианты CD44 получают путем альтернативного сплайсинга таким образом, что последовательности 10 экзонов (v1-v10) в CD44s полностью вырезаются, однако в большем числе вариантов могут наблюдаться в различных комбинациях (Screaton и др., 1992; Tölg и др., 1993; Hofmann и др., 1991). Варианты отличаются тем, что различные аминокислотные последовательности включаются в определенное положение внеклеточных участков белков. Такие варианты могли быть обнаружены в различных опухолевых клетках человека и опухолевых тканях человека. Так, недавно была исследована экспрессия вариантов CD44 при образовании и развитии колоректального ракового новообразования (Heider и др. , 1993а). Экспрессия вариантов CD44 отсутствует в нормальном эпителии толстой кишки человека, и лишь слабая экспрессия наблюдается в пролиферирующих клетках крипт. На более поздних стадиях прогрессии опухоли, например в случае аденокарцином, выражаются все злокачественные перерожденные варианты CD44. Экспрессия в ткани вариантов CD44 на высоком уровне могла быть также показана в случае агрессивных не-Ходжкинских лимфом (Koopman и др., 1993).
Показано, что важную роль, в особенности при метастатическом развитии, играет экзон v6 (Rudy и др., 1993). На модели животного антитела против специфичных к v6 эпитопов могли препятствовать распространению метастазирующих клеток и росту метастазов (Seiter и др., 1993). При карциномах толстого кишечника экспрессия v6 коррелирует с прогрессией опухоли (Wielenga и др., 1993). При раке желудка экспрессия v6 является важным диагностическим индикатором при дифференцировании опухолей интестинального и рассеянного типа (Heider и др., 1993b). Экспрессия v6 в обеих упомянутых последними работах была измерена с помощью антител против специфичных к v6 эпитопов.
Моноклональные антитела против эпитопа, кодируемые экзоном v6, известны из уровня техники (Hofmann и др., 1991; Wielenga и др., 1993). Из-за высокой потенциальной пользы, которую могут принести подобные антитела для диагностики и терапии, существует высокая потребность в антителах с улучшенными свойствами.
Задачей настоящего изобретения яляется получение антител, которые по сравнению с известными специфичными к v6 антителами проявляет лучшие свойства.
Поставленная задача решается предлагаемым моноклональным антителом к эпитопу с аминокислотной последовательностью, кодируемой вариабельньм экзоном v6 гена CD44, представляющим собой антитело VFF-18, продуцируемое гибродомой DSM АСС 2174, или его фрагмент, причем моноклональное антитело или его фрагмент предназначены для диагностических или терапевтических целей.
Дополнительньм объектом изобретения является линия клеток гибридомы DSM АСС 2174, продуцирующей предлагаемое моноклональное антитело.
Дальнейшим объектом изобретения является антитело к эпитопу с аминокислотной последовательностью, кодируемой вариабельным экзоном v6 гена CD44, полученное рекомбинантной, и/или ферментативной, и/или химической модификацией без изменения аминокислотной последовательности антитела VFF-18 в области места связывания антигена, или его фрагмент.
Еще одним объектом изобретения является рекомбинантное антитело к эпитопу с аминокислотой последовательностью, кодируемой вариабельньм экзоном v6 гена, имеющее идентичную аминокислотную последовательность моноклонального антитела VFF-18 в обасти места связывания антитела, или его фрагмент, причем рекомбинантное антитело или его фрагмент предназначены для диагностических или терапевтических целей.
Признаки, развивающие и уточняющие вышеприведенные объекты изобретения, описаны в нижеследующем.
Из полного иммуноглобулина антитела VFF-18 могут быть, например, получены фрагменты Fab или F(аb')2 или другие фрагменты (Kreitman и др., 1993). Для диагностических способов можно соединять молекулы антитела VFF-18, их фрагменты или рекомбинантные молекулы антитела с одинаковым идиотипом, например с радиоактивными изотопами, как131I, 111In, 99mТc или радиоактивными соединениями (Larson и др., 1991; Thomas и др., 1989; Srivastava, 1988), с ферментами, такими как пероксидаза или щелочная фосфатаза (Catty и Raykundalia, 1989), с флуоресцентными красителями (Johnson, 1989) или с молекулами биотина (Guesdon и др., 1979). Для терапевтического применения можно соединять VFF-18 или производные от VFF-18 молекулы антитела с токсинами (Vitetta и др. , 1991; Vitetta и Thorpe, 1991; Kreitman и др., 1993; Theuer и др., 1993), с цитостатиками (Schrappe и др., 1992), с пролекарствами (Wang и др., 1992; Senter и др., 1989) или с радиоактивными веществами. Антитело далее можно соединить с цитокином или другим иммуномодулирующим полипептидом, например с фактором некроза опухоли или интерлейкином-2.
Далее специалист может получить после анализа аминокислотной последовательности антитела VFF-18 и/или при использовании линии клеток гибридомы, продуцирующей это антитело, и, в частности, содержащейся там генетической информации рекомбинантные молекулы антитела с таким же, как у VFF-18, идиотипом. Соответствующие способы составляют основу этой техники. Такие рекомбинантные молекулы антител могут быть, например, антителами, приближенными к таковым для человека (Shin и др., 1989; Gьssow и Seeman, 1991), биспецифическими антителами (Weiner и др., 1993; Goodwin, 1989), одноцепочечными антителами (scFv, Johnson и Bird, 1991), полными или фрагментарными иммуноглобулинами (Coloma и др., 1992; Nesbit и др., 1992; Barbas и др., 1992) или антителами, полученными путем сцепления цепей (Winter и др., 1994). Антитела, приближающиеся по составу к человеческим, могут, например, быть получены путем CDR-трансплантации (европейский патент 0239400). Также могут быть модифицированы каркасные участки (европейский патент 0519596). Для приближения к человеческим антителам сейчас могут быть использованы такие методы, как полимеразная цепная реакция (см., например, европейские патенты 0368684; 0438310; международная заявка 9207075) или компьютерное моделирование (см., например, международная заявка 9222653). Могут также быть получены составные белки, например составные белки из одноцепочечного антитела и токсина (Chaudhary и др., 1990; Friedman и др., 1993). Такого рода молекулы антитела поэтому также включены в изобретение.
В пределах возможностей среднего специалиста находится также обнаружение точного эпитопа для VFF-18 и, располагая этими данными, получение эквивалентных антител с одинаковой специфичностью связывания. Это может происходить, например, при изучении связывания пептидов, как в примере 2, возможно с помощью разновидности пептида Hul. Поэтому подобные антитела также охватываются изобретением.
Диагностические способы при применении молекул антитела в соответствии с изобретением могут быть такими, как известные способы, например ферментный иммуносорбентный анализ (ELISA) (Catty и Raykundalia, 1989), радиоиммунный анализ (Catty и Murphy, 1989), иммуногистохимические способы (Heider и др., 1993b) или Вестерн-блоты. Подобные способы целесообразно осуществлять с взятыми из тела пробами тканей или с жидкостями тела, например, при биопсии. Исследования могут проводиться качественно, полуколичественно или количественно. При этом могут быть использованы антитело или молекулы антитела, как, например, заложено в основе техники, описанной в международной заявке 9500851 для других специфичных к v6 антител, при этом полезные свойства антитела или молекул антитела согласно изобретению означают важное улучшение подобных способов.
Помимо диагностики in vitro молекулы антитела согласно изобретению годятся также для диагностики in vivo, особенно опухолей. Если молекула антитела имеет какую-нибудь детектируемую метку, можно использовать определение метки для диагностических целей, например для визуального обнаружения опухоли in vivo, или, например, при хирургии с применением радиоактивных элементов. Для использования антител, конъюгированных с радиоактивными изотопами, для иммуно-сцинтиграфии существует, к примеру, ряд протоколов, на основании которых специалист может осуществить изобретение (Siccardi и др., 1989; Keenan и др. , 1987; Perkins и Pimm, 1992; Colcher и др., 1987; Thompson и др., 1984).
Терапевтическое применение можно, например, проводить аналогично применению антитела 1.1 ASML (Seiter и др., 1993). При этом применение осуществляют системно или местно, например, путем внутривенной (разовое или капельное вливание), внутрибрюшинной, внутримышечной, подкожной или других инъекций или вливаний. Можно также осуществлять перфузию в отдельные органы или участки. Представленные протоколы, касающиеся введения конъюгированных или неконъюгированных антител (будь это полные иммуноглобулины, фрагменты, рекомбинантные химерные молекулы и др.), являются уровнем техники (Mulshine и др. , 1991; Larson и др., 1991; Vitetta и Thorpe, 1991; Vitetta и др., 1991; Breitz и др., 1992; Press и др., 1989; Weiner и др., 1989; Chatal и др., 1989; Sears и др., 1982).
Лучшие свойства VFF-18 по сравнению с другими антителами против CD44v6 показаны в примерах 2-4.
Чертежи
Фиг. 1: Схема получения составного белка GST-CD44(v3-vlO). GST означает глутатион-S-трансферазу Schistosoma japonicum. v3-vl0 = варианты вставки цитокератины-СD44. Стрелкой отмечено место расщепления тромбином.
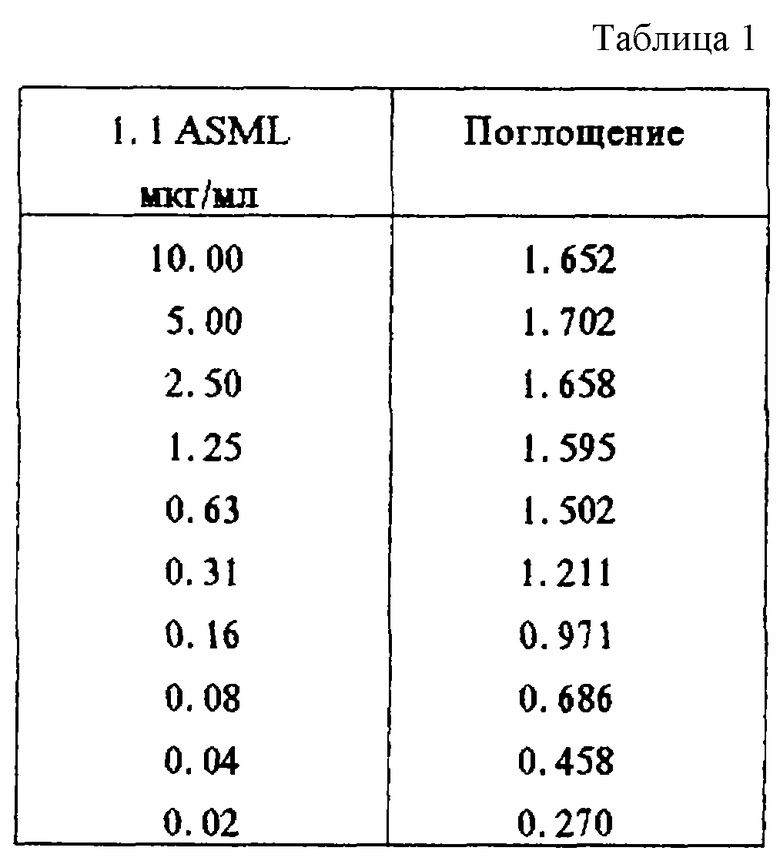
Фиг. 2: Сравнение последовательностей экзона v6 гена CD44 у человека и крысы. Последовательности пептидов Ral и Hul, с которыми связываются антитела 1.1 ASML (против крысиного CD44v6) и VFF-18 (против человеческого CD44v6), выделяются жирно. Идентичные аминокислоты обозначены звездочкой.
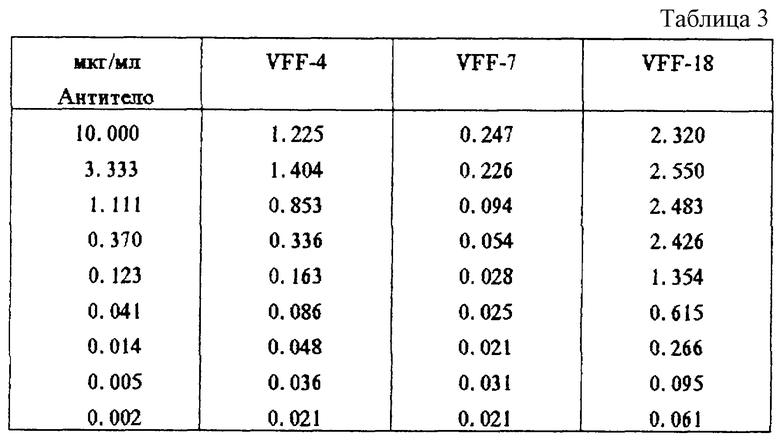
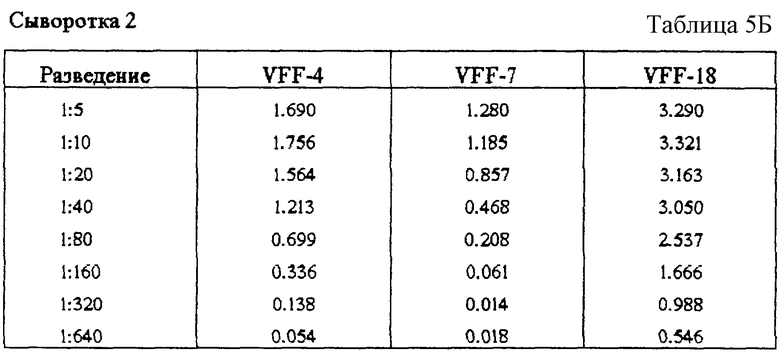
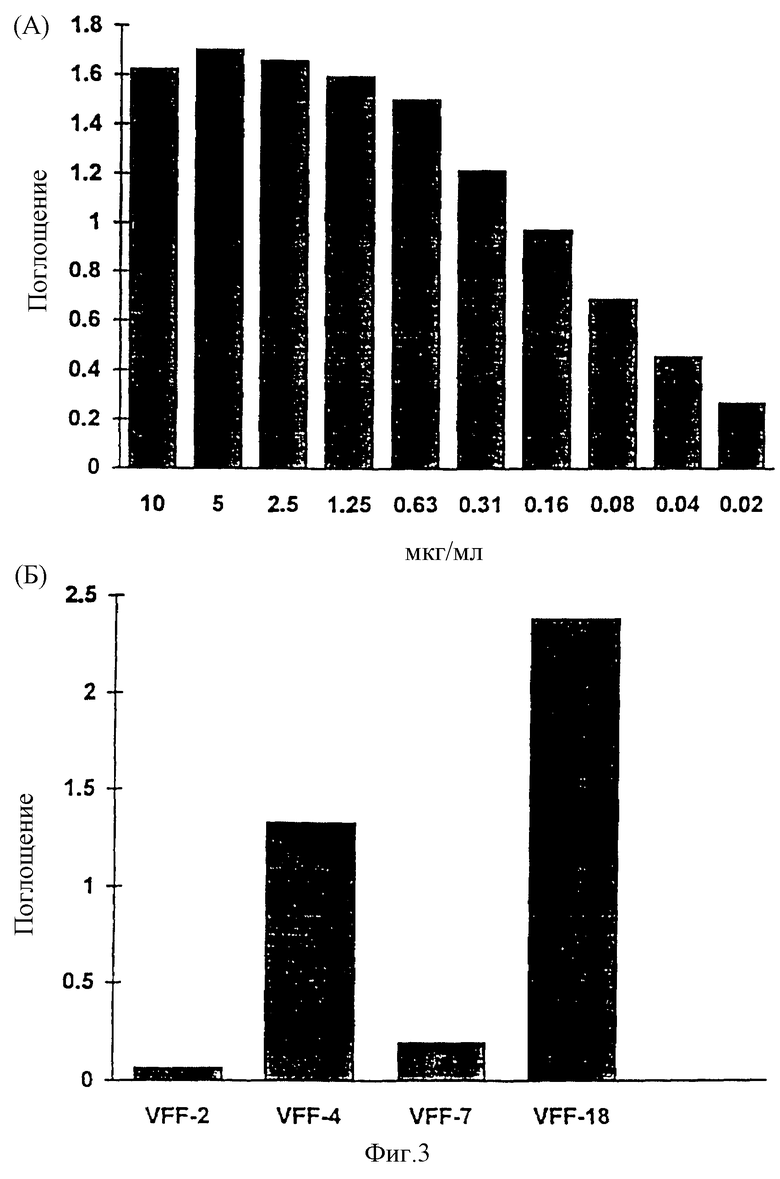
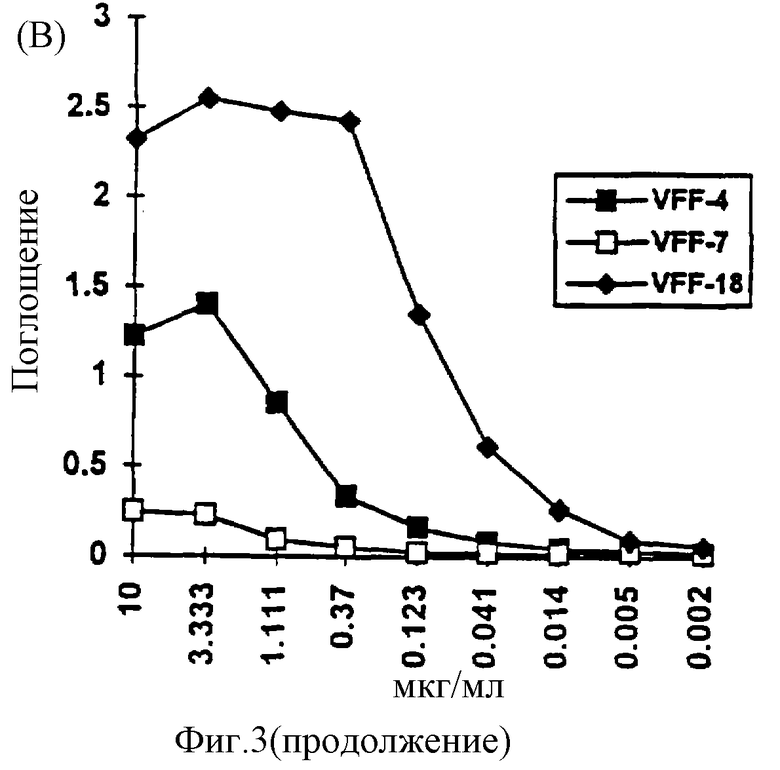
Фиг. 3: Связывание специфичных к CD44v6 антител с синтетическими пептидами. Связывание антител с пептидами определяли с применением ELISA-теста, при котором пептиды подвергали иммобилизации и затем инкубировали с растворами антител. После соответствующих этапов промывания обнаруживали антитело, связанное с конъюгированным с пероксидазой антителом против мышиного IgG. (A): В первом эксперименте было доказано связывание специфичного к CD44v6 крысы антитела 1.1 ASML с пептидом Ral (KWFEN EWQGK NPPT). (Б): В другом эксперименте был синтезирован гомологичный Ral пептид из последовательности человеческого CD44v6. Различные антитела из супернатантов гибридомы, полученной с использованием античеловеческого CD44v6, связывали с этим пептидом Hul (QWFGN RWHEG YRQT). При этом показано, что VFF-18 существенно лучше связывается с пептидом, чем остальные использованные антитела. (В): Для количественной оценки этот эксперимент повторяли с использованием различных концентраций очищенных антител. При этом также было обнаружено, что VFF-18 демонстрирует более высокое сродство к связыванию, чем другие антитела.
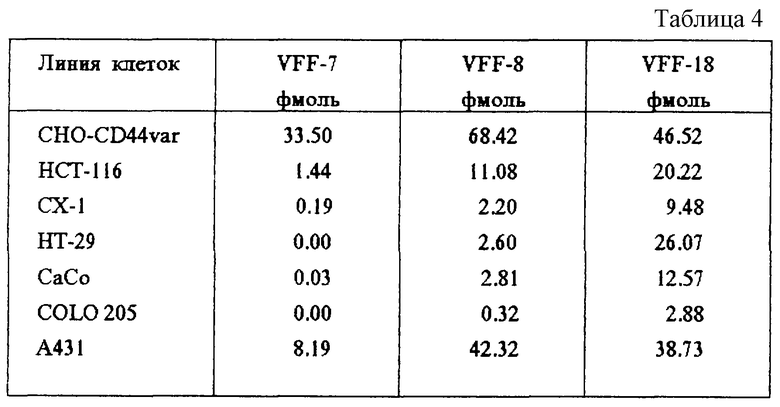
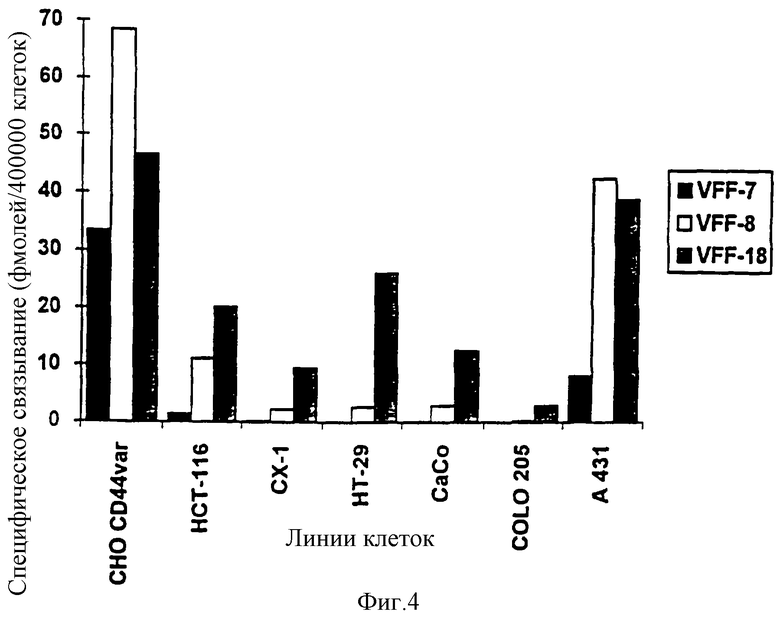
Фиг. 4: Связывание радиоактивно меченных антител с опухолевыми клетками. Три антитела VFF-7 (анти-v6). VFF-8 (анти-v5) и VFF-18 (анти-v6) метили радиоактивным N-гидроксисукцинимидным эфиром [2,3-3H]-пропионовой кислоты и использовали в опытах по связыванию с различными линиями опухолевых клеток. При этом были применены следующие линии клеток: CHO-CD44var: рекомбинантная линия клеток хомячка (яичник китайского хомячка), которая выражает на поверхности вариант человеческого CD44 (экзоны v3-vl0); НСТ-116, СХ-1, НТ-29, СаСо, COLO 205: линии клеток карциномы толстой кишки человека; А431: линия клеток карциномы плоского эпителия человека. Показано специфическое связывание антител с различными линиями клеток. В то время как связывание специфичных к v6 антител VFF-7 и VFF-18 с рекомбинантной линией клеток CHO-CD44var имеет одинаковый порядок величин, антитела ведут себя совершенно по-разному при связывании с линиями опухолевых клеток. В некоторых случаях наблюдается только связывание VFF-18 и в незначительной степени связывание VFF-8 (НТ-29, СаСо, COLO 205), с другими линиями клеток VFF-18 связывается существенно лучше, чем VFF-7.
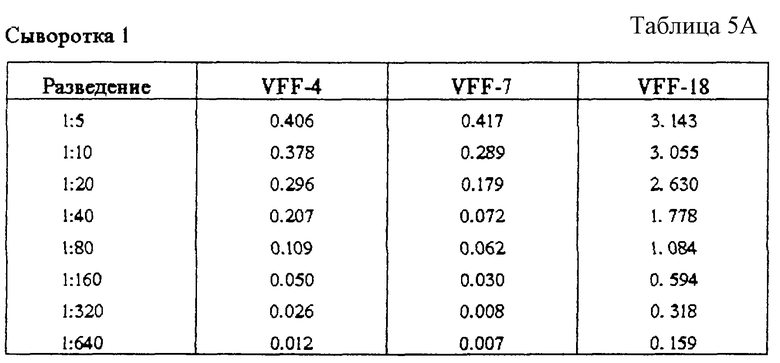
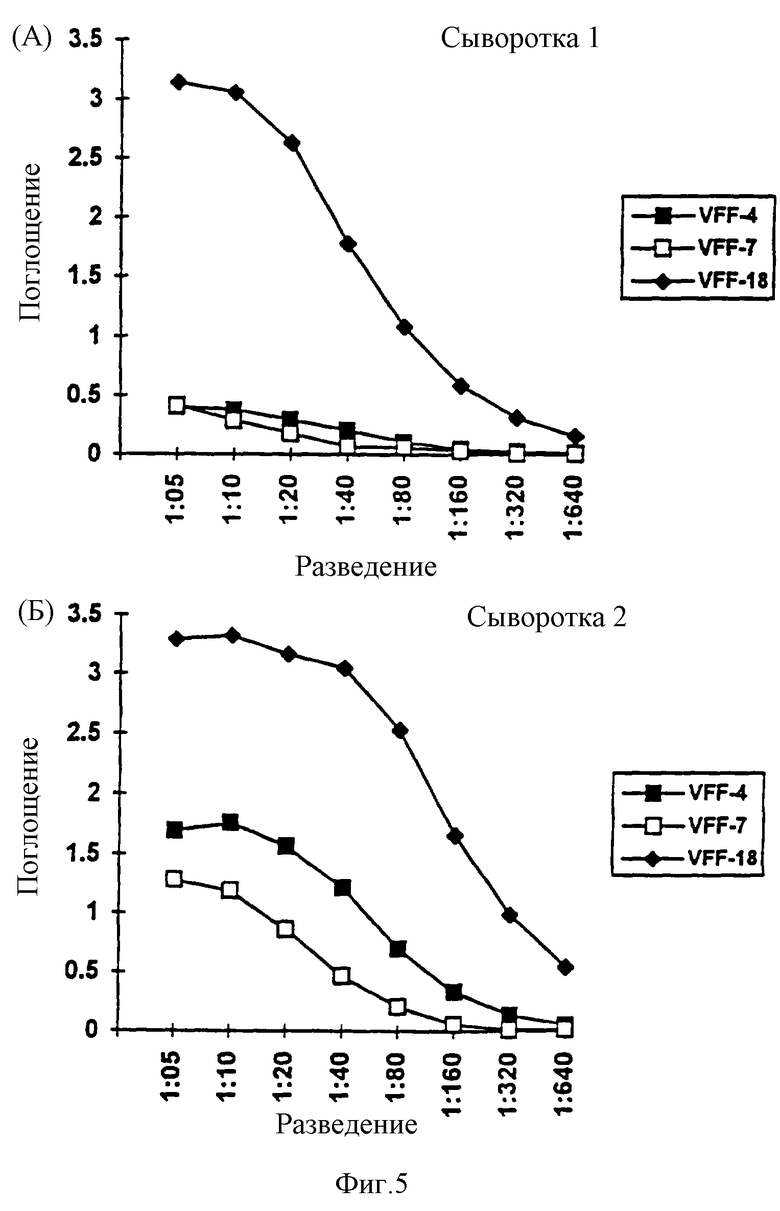
Фиг. 5: Доказательство наличия растворимых вариантов CD44, содержащих экзон v6, в нормальной сыворотке человека. В сэндвич при ЕLISA-тесте помещались в качестве рабочих антител три специфичных к v6 антитела VFF-4, VFF-7 и VFF-18. Во всех трех случаях в качестве антитела-свидетеля использовали конъюгированное с псроксидазой специфичное к CD44std антитело (BU-52, std = стандарт). Обнаруживается сигнал от двух различных нормальных сывороток человека при различных разведениях в этих опытах ((А) и (Б)). В обоих случаях наблюдают существенно более сильный сигнал с VFF-18, чем с двумя другими антителами.
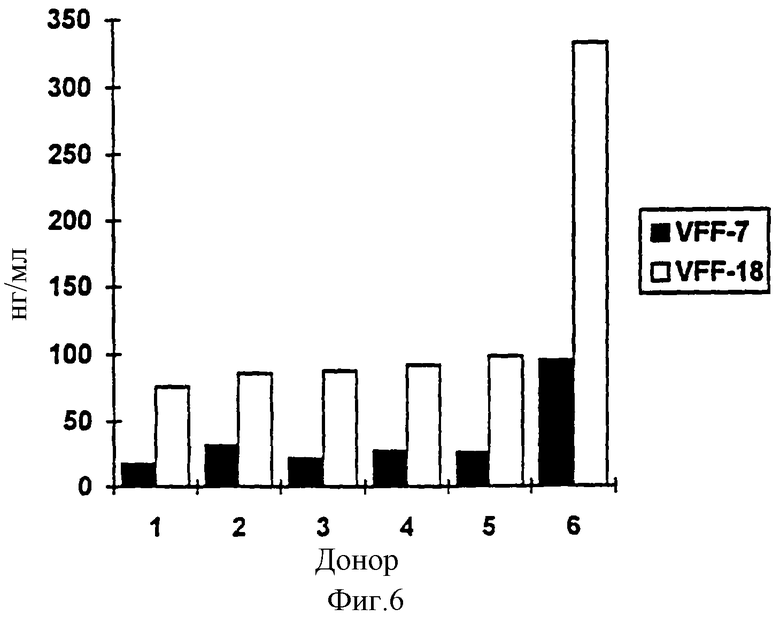
Фиг. 6: Содержание в сыворотке вариантов CD44, содержащих v6. С помощью двух различных иммуноферментных анализов (ELISA-тест) было определено содержание растворимого CD44var в сыворотке 6 здоровых доноров. В одном из опытов в качестве рабочего антитела применяют VFF-7, в другом применяют VFF-18; оба антитела узнают экзон v6. В качестве препарата сравнения в обоих случаях служил получаемый в СНО-клетках рекомбинантный растворимый вариант CD44 (экзон v3-vl0). ELISA-тест при использовании VFF-18 показывает в среднем в 3.5 раза более высокие значения, чем в случае VFF-7. Это означает, что имеющийся в сыворотке растворимый CD44var лучше узнается антителом VFF-18, чем VFF-7.
Примеры
Пример 1: Получение моноклонального антитела VFF-18
Клонирование составных протеинов в pGEX
Общий отличающийся от стандартного участок CD44v типа HPKII (Hofmann и др. , 1991) амплифицировали из человеческих цитокератинов кДНК с помощью полимеразной цепной реакции (ПЦР). Обе ПЦР-затравки 5'-CAGGCTGGGAGCCAAATGAAGAAAATG-3', положения 25-52, и 5'-TGATAAGGAACGATTGACATTAGAGTTGGA-3', положения 1013-984 вариантного участка LCLC97, как описано Ноfmann и др., содержали узнаваемый EcoRI сайт рестрикции, который использовали, чтобы продукт ПЦР непосредственно клонировать в векторе pGEX-2T (Smith и др., 1988). Получающийся в результате продукт (pGEX CD44v HPKII, v3-vl0) кодирует составной белок с массой около 70 кД, состоящий из глутатион-S-трансфсразы Schistosoma japonicum и экзонов v3-vl0 человеческого CD44 (фиг.1; HeiderHnp., 1993а). Составной белок выражался в Е. coli, затем его очищали, используя сродство глутатиона к агарозе (Smith и др., 1988).
Иммунизация и скрининг
Самок мышей линии Balb/c подвергали внутрибрюшинной иммунизации с помощью очищенного при аффинной хроматографии составного белка по следующей схеме:
1. Иммунизация: 90 мкг составного белка в полном адъюванте Фрейнда.
2 и 3. Иммунизация: 50 мкг составного белка в неполном адъюванте Фрейнда.
Иммунизации проводили с промежутками в 4 недели. Через 14 дней после последней иммунизации животных еще в течение трех последующих дней иммунизировали каждый раз 10 мкг составного белка в забуференном фосфатом физиологическом растворе поваренной соли. На следующий день клетки селезенки животного с высоким титром антител подвергали слиянию с миеломными клетками мыши P3.X63-Ag8.653 в полиэтиленгликоле 4000. Гибридомные клетки далее отбирали в планшеты для титрования на среде с гипоксантином, аминоптерином и тимидином (Köhler и Milstem. 1975; Kearne и др., 1979).
Определение титра антител в сыворотке или скрининг гибридомных супернатантов проводили с помощью ELISA-теста. При этом определении планшеты для титрования сначала покрывали составным белком (глутатион-S-трансфераза - CD44v3-10) или только глутатион-S-трансферазой. Затем подвергали инкубированию с серийными разведениями сывороточных проб или гибридомными супернатантами и доказывали наличие специфических антител с конъюгированными с пероксидазой антителами против мышиного иммуноглобулина. Гибридомы, реагировавшие только с глутатион-S-трансферазой, были отвергнуты. Оставшиеся антитела прежде всего охарактеризовывали с помощью ELISA-теста со специфичными к домену составными белками (экзон v3, экзон v5 + v6, экзон v6 + v7, экзон v8 - vl0) (Koopman и др., 1993). Их иммуногистохимическая реакционная способность была испытана на разрезах кожи человека. Антитело VFF-18 было затем идентифицировано по связыванию с синтетическим пептидом Hul (QWFGN RWHEG YRQT). Последовательность Hul является фрагментом экзона v6 человеческого CD44.
Пример 2: Связывание специфичных к CD44v6 антител с синтетическими пептидами
Связывание специфичных к CD44v6 антител с синтетическими пептидаии определяли с применением ELISA-теста.
Растворы:
Рабочий буфер - 0.05 M карбонат натрия, рН 9.6
Буфер для анализа - Забуференный фосфатом физиологический раствор поваренной соли (ЗФР); 0.5% бычий сывороточный альбумин (БСА); 0.05% Твин 20
Раствор субстрата - фирма Киеркегаард & Perry Laboratories, Gaithеrsburg MD, США; 3,3', 5,5'-тетраметилбензидиновый субстрат пероксидазы: псроксидазный раствор Б (Н2О2) 1:1
Пептиды (50 мкг/мл в рабочем буфере) подвергали иммобилизации на иммунопланшетах Максисорп фирмы НУНЦ (1.1 ASML) или планшетах Акти-А фирмы Байо Продактс (антитела VFF) при 4oC в течение ночи. При использовании планшетов Акти-А пептид ковалентно связывается на планшете. Затем промывали ЗФР/0.05% Твином, на свободные адсорбирующие участки на поверхности планшетов наносили буфер для анализа (1 час при комнатной температуре) и снова промывали один раз ЗФР/0.05% Твином 20. Планшеты Акти-А после нанесения буфера восстанавливали 10 мМ боргидридом натрия в 20 мМ бикарбонате натрия, рН 9.0 (встряхивали 1 час при комнатной температуре) и затем трижды промывали ЗФР/0.05% Твином 20. Затем гибридомные супернатанты или растворы антител в буфере для анализа в концентрациях между 0.02 и 10 мкг/мл заливали в ячейки и инкубировали 2 часа при комнатной температуре в установке для встряхивания планшетов. После этого сразу промывали трижды ЗФР/0.05% Твином 20. Затем 100 мкл в ячейке конъюгированного с пероксидазой хрена антитела против мышиного IgG прибавляли в подходящем разведении в буфер дня анализа. После двухчасового инкубирования при комнатной температуре в установке для встряхивания планшетов промывали трижды ЗФР/0.05% Твином 20 и окрашивали раствором субстрата. После обработки в течение 10-15 минут реакцию останавливали 2М серной кислотой и измеряли на фотометре поглощение при 450 им (от фона при 690 нм).
В первом эксперименте было доказано связывание специфичного к крысиному CD44v6 антитела 1.1 ASML с пептидом Ral (KWFEN EWQGK NPPT) (табл.1, фиг.3 (А)).
В другом опыте был синтезирован гомологичный Ral пептид из последовательности человеческого CD44v6 (Hul, QWFGN RWHEG YRQT). Различные антитела против человеческого CD44v6 связывались с Hul. При этом обнаруживается, что VFF-18 проявляет неожиданно более высокое сродство к связыванию, чем все другие добавленные антитела (табл.2, фиг.3 (Б)).
Кроме того, для количественной оценки очищенные антитела против человеческого CD44v6 подвергали связыванию в различных концентрациях с пептидом Hul. При этом также отчетливо обнаруживается лучшее сродство к связыванию для VFF-18 в сравнении с другими антителами (табл.3, фиг.3 (В)).
Пример 3: Связывание радиоактивно меченных специфичных к CD44v6 антител с линиями опухолевых клеток
Введение радиоактивной метки в антитела
N-гидроксисукцинимидный эфир [2,3-3H-пропионовой кислоты с радиоактивностью 1 мКи (Амерсхам, 1 мКи/мл) быстро упаривали досуха в силиконизированном трубчатом пробнике при 0oС в вакууме от водоструйного насоса. К остатку прибавляли 15 мкг антитела (1 мг/мл в ЗФР, рН 7,4) и инкубировали в течение 48 часов при 4oС. Затем избыток N-гидроксисукцинимидного эфира [2,3-3H-пропионовой кислоты удаляли при реакции с 30 мкл 1М глицина в ЗФР (20 минут при комнатной температуре). Отделение меченого антитела от [3Н]-глицина осуществляли на колонке (объем 15 мл) с Сефадексом-G-25-М, при этом в качестве растворителя использовали ЗФР/0.5% БСА. [3Н]-меченое антитело появляется в конечном объеме. Количество антител определяли при использовании ELISA-тест для детектирования мышиного иммуноглобулина и рассчитывали специфическую активность.
Связывание меченых антител с опухолевыми клетками
Три антитела VFF-7 (анти-v6), VFF-8 (анти-v5) и VFF-18 (анти-v6) метили с помощью N-гидроксисукцинимидного эфира [2,3-3H]-пропионовой кислоты и использовали для опытов по связыванию с различными линиями опухолевых клеток. При этом применяли следующие линии клеток: СНО-CD44var: рекомбинантная линия клеток хомячка (яичник китайского хомячка), которая выражает на поверхности вариант человеческого CD44 (экзоны v3-vl0); НСТ-116, СХ-1, НТ-29, СаСо, COLO 205: линии клеток карциномы толстой кишки человека; А431: линия клеток карциномы плоского эпителия человека.
Клетки помещали на планшеты для тканевых культур с 12 отверстиями, проводили инкубирование в течение ночи при 37oС в инкубаторе в углекислом газе, затем один раз промывали с помощью ЗФР и фиксировали спиртом (1 минуту при комнатной температуре). Затем промывали один раз культуральной средой (среда RPMI-1640/10% сыворотка эмбриона теленка) и связывали с радиоактивными антителами (250000 распадов в мин/ячейка в культуральной среде). После инкубации в течение 25 часов при комнатной температуре в устройстве для встряхивания планшетов трижды промывали ЗФР/0.5% БСА, клетки растворяли в 0.1 М едком натре/1% тритоне Х-100 и измеряли радиоактивность сцинтилляционным счетчиком. Неспецифическое связывание определяли в присутствии 100-кратного избытка немеченого антитела. Связывание относили к определенному числу клеток (400000). После определения специфической активности антител количество связанных антител можно выразить в фмолях.
Табл. 4 и фиг. 4 демонстрируют специфическое связывание антител с различными линиями клеток. В то время как связывание специфичных к v6 антител VFF-7 и VFF-18 с рекомбинантной линией клеток CHO-CD44var приблизительно одинаково, антитела ведут себя очень по-разному при связывании с линиями опухолевых клеток. В некоторых случаях наблюдают только связывание VFF-18, а связывание VFF-8 в незначительном объеме (НТ-29, СаСо, COLO 205), в случае других линий клеток VFF-18 связывается значительно лучше, чем VFF-7.
Пример 4: ELISA-тест для определения растворимого CD44v6 в сыворотке
Растворы:
Рабочий буфер - 0.05 М карбонат натрия, рН 9.6
Буфер для анализа - Забуференный фосфатом физиологический раствор поваренной соли (ЗФР); 0.5% бычий сывороточный альбумин (БСА); 0.05% Твин 20
Растворитель для образцов - фирма БендерМедсистемс, Вена, Австрия
Раствор субстрата - фирма Киеркегаард & Perry Laboratories, Gaithеrsburg MD, США; 3,3',5,5'-тетранстилбензидиновый субстрат пероксидазы: пероксидазный раствор Б (Н2О2) 1:1
На планшеты для титрования (фирма Нунц, иммунопланшеты Мажсисорп F96) наносили специфичное к CD44v6 антитело в концентрации 5 мкг/мл (инкубирование при 4oС в течение ночи). Затем промывали ЗФР/0.05% Твином, на свободные адсорбирующие участки на поверхности планшетов наносили буфер для анализа (1 час при комнатной температуре) и снова промывали один раз ЗФР/0.05% Твином 20. Пробы сыворотки затем предварительно разбавляли, по меньшей мере, в соотношении 1:5 растворителем для образцов и далее делали серийные разведения (1: 2) в планшете растворителем для образцов. Затем 50 мкл/ячейка конъюгированного с пероксидазой хрена антитела против CD44std (клон BU-52, Сайт связывания, Бирмингам) прибавляли в подходящем разведении (1:3 000 1:10000) в буфере для анализа. После трехчасового инкубирования при комнатной температуре в устройстве для встряхивания планшетов трижды промывали ЗФР/0.05% Твином 20 и окрашивали раствором субстрата. После обработки в течение 10-15 минут реакцию останавливали с помощью 2 М серной кислоты и измеряли на фотометре поглощение при 450 нм (от фона при 690 нм).
Для количественной оценки делали серийное разведение в буфере для анализа растворимого стандартного препарата CD44 параллельно с пробами сыворотки. Этот препарат был выделен в чистом виде из надосадочной жидкости от рекомбинантных клеток хомячка (СНО), которые выражают растворимый CD44v3-v10. В случае CD44v3-v10 речь идет о человеческом варианте CD44, который содержит кодируемые экзонами от v3 дo v10 пептидные последовательности.
Табл.5 и фиг.5 показывают наличие в нормальной сыворотке человека растворимых вариантов CD44, содержащих экзон v6. При ELISA-тесте с применением техники сэндвича использовали три специфичных к v6 антитела VFF-4, VFF-7 или VFF-18 в качестве рабочих антител. Во всех трех случаях применяли в качестве антитела для идентификации конъюгированное с пероксидазой антитело, специфичное к CD44 - стандарту (BU-52). В этих опытах обнаруживался сигнал от двух разных нормальных сывороток человека при различных разведениях. В обоих случаях ((А) и (Б)) с VFF-18 можно наблюдать существенно более сильный сигнал, чем с двумя другими антителами.
В табл. 6 и на фиг.6 представлены значения концентраций в сыворотке вариантов CD44, содержащих v6. В двух различных опытах с использованием ELISA-теста было определено содержание растворимого CD44var в сыворотках 6 здоровых доноров. В одном опыте использовали VFF-7, в другом использовали VFF-18 в качестве рабочего антитела; оба антитела узнают экзон v6. Препаратом сравнения служил в обоих случаях полученный в СНО-клетках рекомбинантный растворимый вариант CD44 (экзон v3-vl0). ELISA-тсст при использовании VFF-18 показывает в среднем в 3,5 раза более высокие значения, чем аналогичный анализ с VFF-7. Это означает, что встречающийся в сыворотке растворимый CD44var по сравнению с рекомбинантным белком узнается лучше антителом VFF-18, чем антителом VFF-7.
Пример 5
Радиоактивное мечение антител
Мечение антитела 186рением
Конъюгат антитела и 186рения получали с помощью известного многостадийного метода с использованием хелатного S-бензоилмеркаптоацетилтриглицина (S-бензоил-МАГ3) (см. G. W. Visser и др., J. Nucl. Med. 34 (11), 1953-1963 (1993)). Согласно данному методу после твердофазного синтеза для получения конъюгата 186Re-МАГ3 и моноклонального антитела осуществляли этерификацию и конъюгирование. Процесс мечения, который можно приспосабливать к любому количеству 186рения, осуществляли следующим образом. К раствору, содержащему 750 нмоль [186Re] ReО4 -, количество и специфичная активность которого известны в момент калибровки (источник рения получали от фирмы Mallinckrodt Medical, г. Петтен, Нидерланды), добавляли 150 мкл 1-молярного карбоната натрия, 150 мкл (100 мг/мл) сульфата натрия, 1725 нмоль S-бензоил-МАГ3 (1 мг/мл ацетонитрила и воды в соотношении 9:1, полученного от фирмы Mallinckrodt Medical) и 6000 нмоль хлорида олова (II) (1 мг/мл). На данной стадии количество [186Re] ReО- 4 можно варьировать, при условии, что количество МАГ3 и Sn2+ согласовывают соответствующим образом. Мольное соотношение рения и МАГ3 должно равняться 1:2,3, а мольное соотношение рения и Sn2+ - 1:8. Растворитель упаривали досуха при температуре 104oС в атмосфере азота, и реакционную смесь дополнительно нагревали в течение 20 минут. После охлаждения реакционной смеси до 0oС добавляли 500 мкл воды, 480 мкл 1 н. серной кислоты, 200 мкл 2,3,5,6-тетрафторфенола (100 мг на мл ацетонитрила и воды в соотношении 9:1, полученного от фирмы Janssen Chimica, г. Беерсе, Бельгия) и 100 мг 1-этил-3-(3-диметиламинопропил)-карбодиимида и рН доводили до значения, равного 6, путем добавления 1 н. серной кислоты. Реакционную смесь инкубировали при комнатной температуре в течение 30 минут. Сложный тетрафторфеноловый эфир 186Rе-МАГ3 разбавляли водой до объема 8 мл и очищали на двух кондиционированных патронах типа Sep-pak (продукт фирмы Waters, Millipore, штат Массачусетс, США). Для промывки использовали 25 мл инъекционной воды, 30 мл смеси, содержащей 20%-ного по объему этанола и 0,01-молярный фосфат натрия (значение рН 7,0), 5 мл воды и 2 мл диэтилового эфира. Сложный эфир элюировали 3 мл ацетонитрила. Очищенный сложный эфир подвергали сушке при температуре 40oС в потоке азота, затем разбавляли в 500 мкл 0,9%-ного хлористого натрия. Реакцию конъюгирования моноклонального антитела и сложного эфира осуществляли в течение 30-45 минут при комнатной температуре в 0,9%-ном хлористом натрии при значении рН, равном 9,5, которое устанавливали путем добавления 50 ммоль карбоната натрия. Конъюгат очищали на колонне типа PD-10 (продукт фирмы Pharmacia-Biotech, г. Верден, Нидерланды) с использованиемм 0,9%-ного хлористого натрия в качестве элюента. Содержащие конъюгат фракции собирали. После удаления несвязанного 186рения радиохимическая чистота всегда превышала 97%. Очищенный конъюгат пропускали через фильтр величиной пор 0,2 мкм
Контроль качества радиомеченого моноклонального антитела
Для анализа меченного 186рением моноклонального антитела путем высокопроизводительной жидкостной хроматографии использовали насос типа LKB 2150, контроллер типа LKB 2152 LC и колонку размером 10 х 300 мм типа Biotech Superdex 200 HR 10/30 фирмы Pharmacia. Элюент представлял собой смесь 0,05-молярного фосфата натрия, 0,15-молярного хлорида натрия и 0,05% азида натрия (значение рН 6,8), и скорость пропускания через колонку устанавливали при 0,5 мл в минуту. Радиоактивность определяли непрерывно с помощью ультрафиолетового детектора типа LKB VWM 2141 фирмы Pharmacia с использованием моноканального анализатора типа Ortec 406A, связанного с коллектором данных типа Drew 3040 (аппарат фирмы Betron Scientific, г. Роттердам, Нидерланды). Для определения процентной доли связанной метки использовали интегратор типа Merck-Hitachi D2000. Сравнение инъекционного стандарта со всей вытекающей из хроматографической колонки жидкостью во всех случаях показало количественное выделение радиоактивности (95%) из колонки высокопроизводительной жидкостной хроматографии. Время удерживания составляло ± 23 минуты для имунноглобулина и ± 38 минут для несвязанной метки.
Тонкослойную хроматографию меченного 186рением моноклонального антитела осуществляли на пропитанных силикагелем стеклянно-волокнистых пластинках типа ITLC-SG (продукт фирмы Gelman Sciences Inc.) с использованием 0,1-молярного цитрата натрия в качестве элюента. Пробы объемом 1-5 ки разрезали на участки размером 1 см, и радиоактивность определяли в счетчике гамма-излучения типа LKB-Wallac 1282 CompuGamma (прибор фирмы Kabi Pharmacia, г. Верден, Нидерланды). Значение Rf составляло 0,0 для радиомеченого моноклонального антитела и 0,1 для несвязанной метки.
Характеристика связывания in vitro радиомеченого моноклонального антитела определяли путем иммунореакционного анализа, описанного Lindmo и др. (J. Immunol. Methods 72, 77-78, 1984 г.). Для проверки связывания радиомеченого моноклонального антитела использовали клетки UM-SCC-11В в 0,1%-ном глутаральдегиде. Подготовляли шесть серийных разбавлений (от 5 х 106 клеток на трубку до 3,1 х 105 клеток на трубку) с использованием 1%-ного альбумина бычьей сыворотки в буфере PBS. В трубки добавляли иммуноглобулин, меченный 186рением с 10000 импульсами в минуту, и пробы инкубировали при комнатной температуре в течение ночи. Для определения неспецифичного связывания к последней пробе добавляли избыток немеченого моноклонального антитела. Клетки подвергали центрифугированию, радиоактивность в осадке и в надосадочной жидкости определяли с помощью счетчика гамма-излучения и процентную долю связанной и свободной радиоактивности рассчитывали с помощью аппарата типа LRB-Wallac 1282 CompuGamma (прибор фирмы Kabi Pharmacia, г. Верден, Нидерланды). Данные подвергали графическому анализу с использванием модифицированной диаграммы Бурка, причем показывающую иммунную реакцию фракцию определяли путем линейной экстраполяции до условий, представляющих безграничный избыток антигена.
Пример 6
Сочетание антитела с цитотоксичными молекулами
Мечение антитела майтансиноидом (см. R.V.J. Chari и др.. Cancer Reserarch, 1992 г., 52; 127-131)
Для получения конъюгата антитела и майтансиноида антитело модифицировали N-сукцинимидил-3-(2-пирридилдитио)проприонатом для введения дитиопиридиловых групп, или сукцинимидил-4-(Н-малеимидометил)циклогексан-1-карбоксилатом для введения малеимидо-групп. Группы May-SS-Me восстанавливали до May-SH следующим образом. 2-ммолярный раствор May-SS-Me в смеси 0,3 мл этанола и 0,2 мл 50 ммолярного буфера, содержащего фосфат калия (значение рН 7,5) в атмосфере азота обрбатывали 3 ммоль дитиотреитола при температуре 4oС в течение 4 часов. Свежеполученный May-SH очищали путем высокопроизводительной жидкостной хроматографии, и его подвергали высокоразрешающему ядерно-магнитному резонансному анализу. Продукт (1,2 эквивалента на пиридилдитио-группу или малеимидо-группу, введенную в антитело) смешивали с содержащим 2 ммоль ЭДТА раствором модифицированного антитела в 0,1-молярном буфере, содержащем фосфат калия и имеющем значение рН 7,0. За ходом реакции следили путем определения повышения оптической плотности при 343 нм вследствие высвобождения тиопиридиловых групп. После завершения реакции (примерно по истечении 40 минут) конъюгат очищали путем гель-фильтрации на колонке, содержащей сефадекс Г-25. В результате модификации антитела взятым в различных количествах N-сукциними-дил-3-(2-пиридилдитио)пропионатом получали 1-6 дитиопиридиловых групп на молекулу антитела (согласно анализу по высвобождению тиопиридиловой группы с использованием дитиотреитола), а в случае взятого в различных количествах N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилата получали 1-6 малеимидо-групп (определено путем реакции с [14С]цистеином). С помощью данного метода получали конъюгат, содержащий 1-6 молекул майтансиноида на молекулу антитела, что рассчитывали на основе оптической плотности при 252 и 280 нм.
Пример 7
Гуманизация антитела
Гуманизация мышиного моноклонального антитела мыши путем трансплантации гипервариабельных участков
Основные сведения
Моноклональные антитела, полученные из грызунов, имеют антигенное действие в человеке и, таким образом, вызывают нежелательный иммунный ответ, называемый ответом НАМА (Human Anti-Mouse Antibody = человеческое антитело против мыши). Поэтому использование полученных из грызунов антител в качестве терапевтических средств в человеке ограничивается тем, что человеский организм проявляет иммунологический ответ на моноклональное антитело и/или полностью удаляет его, или, по меньшей мере, снижает его эффективность. На практике моноклональные антитела, полученные из грызунов, нельзя использовать в пациентах более чем один или несколько раз, так как скоро развивается ответ НАМА, который приводит к неэффективности моноклонального антитела и к появлению нежелательных реакций. Поэтому был выдвинут ряд предложений для снижения антигенного действия нечеловеческих моноклональных антител в человеке. Такие методы называют методами "гуманизации". Они включают использование применяющей рекомбинантную ДНК технологии для манипулирования последовательностей ДНК, кодирующих полипептидные цепи молекулы антитела.
Согласно одному из методов гуманизации, а именно трансплантации гипервариа-бельных участков, мышиное моноклональное антитело трансплантируют в каркасные области вариабельных доменов человеческого иммуноглобулина путем сайтнаправленного мутагенеза с использованием длинных олигонуклеотидов. В нижеследующем описывается общий протокол трансплантации гипервариабельных участков.
Протокол
1) Секвенирование кДНК, кодирующей имеющие тяжелые и легкие цепи вариабельные области донорного антитела, предназначенное для определения их аминокислотных последовательностей:
Изолировали всю РНК (см. J.M. Chirgwin и др., Biochemistry, 18, 5294-5299, 1979 г. ) из линии клеток гибридомы, продуцирующей мышиное моноклональное антитело. Из совокупности РНК получали поли (А) + РНК (см. Н. Aviv и Р. Leder, Proc. Natl. Acal. Sci., США, 69, 1408-1412, 1972 г.). Осуществляли ПНР при комнатной температуре с использованием специфичных к лидерной последовательности дегенерированных праймеров (см. Т. Jones и M.M. Bendig, 1991 г. . Biotechnology, 9, 579) и праймеров, гомологичных относительно 5'-областей мышиных каппа и гамма константных областей с помощью кита, называемого Perkin Elmer GeneAmp RT-PCR. Продукты ПЦР клонируют в токсин-антитоксин-клонирующий вектор (инвитроген), и с помощью секвенатора с названием "Applied Biosystems Sequencer" секвенировали 10 индивидуальных клонов, имеющих тяжелые и легкие цепи вариабельных областей.
2) Конструкция химерных генов
Для каждого вариабельного участка синтезировали два праймера (переднего и заднего) для осуществления ПЦР. Передний праймер конструировали в соответствии с лидерной последовательностью, определяемой путем секвенирования кДНК на стадии 1. Кроме того, данный праймер имеет сайт клонирования, а именно HindIII. Задние праймеры являются гомологичными к 5'-областям мышиных каппа и гамма константных областей и содержат сайт клонирования, а именно BamHI. ПЦР начинали с использованием 1 нг плазмидной ДНК токсин-антитоксин-клонирующего вектора pCR-2.1, содержащей клонированную кДНК, передние и задные праймеры в конечной концентрации по 1 мкмоль, 1,25 ммоль дезоксинуклеозидтрифосфата, 10 ммоль трис-НСl (значение рН 8,3), 50 ммоль хлористого калия, 1,5 ммоль хлористого магния и 0,01% желатины (соотношение вес/объем). Добавляли ДНК полимеразу Amplitaq (продукт фирмы Perkin Elmer) в количестве 2,5 единицы на пробу. После начального нагрева при температуре 94oС в течение 1,5 минут проводят 25 циклов амплификации при температуре 94oС в течение 1 минуты, при температуре 45oС в течение 1 минуты и при температуре 72oС в течение 3 минут. В заключение осуществляли еще обработку при температуре 72oС в течение 10 минут. Реакционные смеси ПЦР дважды экстрагировали смесью фенола и хлороформа и осаждали этанолом, затем переваривали с использованием HindIII и BamHI. Полученный в результате ПЦР фрагмент, кодирующий область VL или VH, затем клонировали в экспрессионный вектор, содержащий усилитель и промотор человеческого цитомегаловируса, бактериальный неоген, и начало репликации SV40. Фрамент BamHI длиной 2400 п.о. геномной ДНК, кодирующий человеческую гамма-1 константную область и содержащий необходимые сигналы для правильного сплайсинга и сайты поли(А)+(см. N. Takahashi и др., 1982, Cell, 29, 671-679), вставляли с правильной ориентацией на дистальном конце фрагмента области VH (схему плазмиды, см. фиг. 1, С.A. Kettleborough и др., 1991, Protein Engineering, 4, 773-783). Данный вектор позже модифицировали путем удаления сайта BamHI на 3'-конце фрагмента константной области, таким образом обеспечивая возможность непосредственной вставки вариабельных участков в имеющий тяжелые цепи экспрессионный вектор в качестве фрагментов HindIII-BamHI (см. Н. Maeda и др., 1991, Hum. Antibod.Hybridomas, 2, 124-134). Кодирующий область VL фрагмент вводили в похожий экспрессионный вектор человеческого цитомегаловируса, в данном случае содержащего фрагмент BamHI геномной ДНК длиной примерно 2600 п. о., кодирующего человеческую каппа константную область и содержащего акцепторный участок сплайсинга и поли(А)+ сайт (см. Rabbitts и др. , 1984) (схема плазмиды представлена на фиг. 1, Kettleborough и др., 1991).
3) Молекулярное моделирование областей VL и VH мышиного моноклонального антитела.
Молекулярную модель вариабельных областей мышиных моноклональных антител можно сконструировать на основе структуры высокогомологичных антител, например антитела Hy-HEL5 против лизозима (см. Sheriff и др., 1987). Модель можно сконструировать на компьютере с программой Silicon Graphics Iris 4D, функционирующей под системой UNIX, с использованием суб-программы "QUANTA" для моделирования молекул (продукт фирмы Polygon Corp.). Идентичные остатки сохраняли в каркасах; неидентичные остатки заменяли, используя метод максимального перекрытия (см. Snow и Amzel, 1986), включенный также в суб-программу QUANTA для моделирования белков.
4) Конструкция гуманизированных генов антитела
Переформированную человеческую область VL можно получать путем трансплантации гипервариабельных участков, похожей на способ, описанный Рейхманном и др. (см. L. Reichmann и др., 1988, Nature, 322, 21-25) и Ферхееном (см. М. Verhoeyen, С. Milstein и G. Winter, 1988, Science, 239, 18-20). Получали плазмидную ДНК, содержащую VL область человеческого антитела, наиболее гомологичного к мышиному моноклональному антителу. Сконструировали три олигонуклеотида, состоящих из последовательностей ДНК, кодирующих каждую из имеющих легкую цепь гипервариабельных участков мышиного моноклонального антитела, которые на каждом конце содержат по 12 оснований ДНК, комплементарных с последовательностями ДНК, кодирующими смежные человеческие каркасные участки. Все три олигонуклеотида фосфорилировали и использовали одновременно в олигонуклеотид-направленной системе для мутагенеза in vitro, основанной на методах согласно Eckstein и др. (см. также Taylor и др., 1985 a, b; Nakamaye и Eckstein, 1986; Sayers и др., 1988) (систему можно приобрести у фирмы Amersham plc). Стадию переваривания экзонуклеазы III проводили согласно указаниям производителя. Затем реакционную смесь экстрагировали смесью фенола и хлороформа, осаждали этанолом и повторно суспендировали в 100 мкл буфера ТЕ. Партию объемом 10 мкл использовали в качестве матричной ДНК в 100 мкл смеси, содержащей универсальный праймер М13 и праймер обратного секвенирования, причем ПЦР осуществляли до конечной концентрации по 0,2 мкмоль каждого компонента смеси. Использовали вышеуказанные буфер и циклическую термообработку, за исключением того, что температура гибридизации составляла 55oС. Реакционную смесь ПЦР дважды экстрагировали смесью фенола и хлороформа и осаждали этанолом перед перевариванием с использованием HindIII и BamHI и субклонированием в pUC18. Предположительно положительные клоны идентифицировали путем гибридизации с мечеными 32P мутагенными праймерами (см. Р. Carter и др. , 1985, Oligonucleotide site-directed Mutagenesis in M13, An Experimental Approach Manual, Anglian Biotechnology Ltd., Colchester). Тот факт, что клоны являлись положительными, подтверждали путем секвенирования. Область VL, содержащую все три гипервариабельных участка мышиного моноклонального антитела, можно клонировать в качестве фрагмента HindIII-BamHI в имеющий легкую цепь экспрессионный вектор для сконструирования плазмиды человеческого цитомегаловируса с использванием трансплантированной гипервариабельными участками VH-гамма 1 вставки.
Переформированный вариант человеческой VH-области можно получать с помощью метода согласно Камманну и др. (см. Nucleic Acids Res. 17, 1989, 5404). Матричную ДНК родительской человеческой VH-области можно субклонировать в pUC18, и мутагенные праймеры можно использовать в ПЦР для достижения желаемых модификаций. После мутагенеза и секвенирования последовательности, содержащие желаемые модификации, субклонировали в имеющую тяжелую цепь экспрессионную плазмиду для конструирования плазмид человеческого цитомегаловируса с трансплантированной гипервариабельными участками VH-гамма 1 вставки.
5) Трансфекция ДНК в клетки COS
Клетки COS подвергали электропорации с 10 мкг каждого из экспрессионных векторов, имеющих гены, кодирующие тяжелые и легкие цепи. При этом по 10 мкг каждой плазмиды добавляли к аликвотной пробе 1 х 107 клеток на мл суспензии клеток COS в буфере PBS. Для отдачи импульса 1900 В при 25 мкФ использовали аппарат Bio-Rad Gene Pulser. Клеткам давали восстанавливаться при комнатной температуре в течение 10 минут, после чего их подавали в 8 мл среды DMEM, содержащей 10% фетальной телячьей сыворотки. После инкубации в течение 72 часов среду собирали, центрифугировали для удаления клеточных остатков и подвергали ELISA-тесту.
6) Количественный анализ продукции имуноглобулина и детекция антигена
Человеческий имунноглобулин, имеющийся в надосадочных жидкостях клеток COS, обнаруживали путем ELISA-теста. При данном тесте планшеты с 96 углублениями покрывали античеловеческим имунноглобулином козы (целыми молекулами) (продукт фирмы Sigma), и человеческий имунноглобулин в пробах, связывающийся с планшетами, обнаруживали с использованием конъюгата античеловеческого имунноглобулина козы (специфичного к гамма-цепи) с щелочной фозфатазой (продукт фирмы Sigma). В качестве стандарта использовали очищенный человеческий имунноглобулин (продукт фирмы Sigma). Связывание с антигеном, устанавливаемое трансплантированным гипервариабельными участками антителом, определяли путем второго ELISA-теста. Планшеты покрывали препаратом антигенного белка, и антитела, связывающиеся с антигеном, обнаруживали или с использованием конъюгата античеловеческого имунноглобулина (специфичного к гамма-цепи) с пероксидазой (в случае химерных и трансплантированного гипервариабельньми участками человеческого антитела), или конъюгата антимышиного имунноглобулина (целой молекулы) и пероксидазой (в случае мышиного моноклонального антитела) (оба конъюгата являются продуктами фирмы Sigma). В качестве стандарта использовали очищенное мышиное моноклональное антитело.












Моноклональное антитело к эпитопу с аминокислотной последовательностью, кодируемой вариабельным экзоном v6 гена CD44, представляющее собой антитело VFF-18, продуцируемое гибродомой DSM АСС 2174, или его фрагмент, причем моноклональное антитело или его фрагмент предназначены для диагностических или терапевтических целей. Описана гибридома DSM ACC 2174, продуцирующая упомянутое антитело. Изобретение касается также антитела к эпитопу с аминокислотной последовательностью, кодируемой вариабельным экзоном v6 гена CD44, полученного рекомбинантной, и/или ферментативной, и/или химической модификацией без изменения аминокислотной последовательности антитела VFF-18 в области места связывания антигена или его фрагмента. Кроме того, изобретение относится к рекомбинантному антителу к эпитопу с аминокислотной последовательностью, кодируемой вариабельным экзоном v6 гена, имеющему идентичную аминокислотную последовательность моноклонального антитела VFF-18 в области места связывания антитела, или его фрагмент, причем рекомбинантное антитело или его фрагмент предназначены для диагностических или терапевтических целей. Антитела VFF-18 и его аналоги и фрагменты по сравнению с другими специфичными к v6 антителами проявляют улучшенные свойства, что имеет высокую потенциальную пользу для диагностики и терапии опухолей. 4 с. и 13 з.п. ф-лы, 6 табл., 6 ил.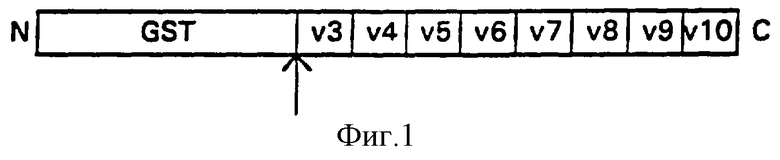
Приоритет по пунктам:
02.09.1994 - по пп. 1-6;
08.06.1994 - по пп. 1-17.
| WO 9412631 A, 09.06.1994. |
Авторы
Даты
2003-05-20—Публикация
1995-06-02—Подача