Изобретение относится к способу выявления веществ с фармакологическим действием путем определения их модулирующего действия на зависимый от рецептора путь в человеческих клетках или клетках животных, более конкретно к способу определения вещества модулирующего действия на зависимый от рецептора интерлейкина-5 путь передачи сигналов в человеческой клетке или клетке животного.
Известен способ определения модулирующего действия вещества на зависимый от рецептора путь передачи сигналов в человеческой клетке или клетке млекопитающего, включающий инкубирование клеток млекопитающего, трансформированных рекомбинантной ДНК, содержащей репортерный ген и регуляторную последовательность, и экспрессирующих функциональный рецептор с исследуемым веществом, определение концентрации продукта репортерного гена и избирательности действия исследуемого вещества (см. заявку WO 92/13063, опуб. 06.08.92, C 12 P 21 C 00).
Известный способ ограничен определением экспрессии генов, регулируемой концентрацией сАМР, представляющего собой переносчик одного из путей передачи связанных с G-белком рецепторов.
Задачей настоящего изобретения является разработка способа, позволяющего определение модулирующего действия вещества на зависимый от рецептора интерлейкина-5 путь передачи сигналов, о механизмах и переносчиках которого очень мало известно. В частности, настоящее изобретение призвано предоставить способ, способный к автоматизации и, таким образом, пригодный для скрининга веществ с высокой производительностью. Кроме того, способ должен обеспечить возможность исследования содержания фармакологически активных веществ в сложных смесях веществ, например экстрактах организмов. Выявление веществ с модулирующим действием на зависимый от рецептора интерлейкина-5 путь передачи сигналов, в частности выявление антагонистов рецептора интерлейкина-5, является исходной точкой разработки лекарств, используемых для терапии заболеваний, в которых участвует модуляция, часто активация, рецептора интерлейкина-5.
Поставленная задача решается предлагаемым способом определения модулирующего действия вещества на зависимый от рецептора передачи сигналов в человеческой клетке или клетке животного, включающим инкубирование клеток, трансформированных рекомбинантной ДНК, содержащей рецепторный ген и регуляторную последовательность, и экспрессирующих функциональный рецептор, с исследуемым веществом с последующим определением концентрации продукта рецепторного гена и избирательности действия исследуемого вещества, за счет того, что определяют модулирующее действие вещества на зависимый от рецептора интерлейкина-5 путь передачи сигналов, при этом рекомбинатная ДНК содержит рецепторный ген и регуляторную последовательность, реагирующие на изменение концентрации одного или нескольких вторичных переносчиков зависимого от рецептора интерлейкина-5 пути передачи сигналов, клетки экспрессируют функциональный рецептор интерлейкина-5, а избирательность действия исследуемого вещества в отношении зависимого от рецептора интерлейкина-5 путем передачи сигналов осуществляют путем инкубирования вещества в идентичных условиях с контрольными клетками млекопитающего, экспрессирующими контрольный рецептор, отличный от рецептора интерлейкина-5, и трансформированными рекомбинантной ДНК, содержащей рецепторный ген и регуляторную последовательность, реагирующую на изменение концентрации вторичного переносчика зависимого от контрольного рецептора пути передачи сигналов, с последующим сравнением концентрации продукта репортерного гена в экспрессирующих рецептор интерлейкина-5 клетках с этой концентрацией в контрольных клетках.
В рамках настоящего изобретения удалось показать, что в клетках, экспрессирующих требуемые для работы рецептора интерлейкина-5 структурные элементы и компоненты зависимого от рецептора интерлейкина-5 пути передачи сигналов, (в нижеследующем эти клетки для простоты называются "клетками, экспрессирующими функциональный рецептор интерлейкина-5'') и трансформированных конструктом репортерного гена, содержащим регулирующие элементы ДНК, конструкт репортерного гена индуцируется путем активации рецептора интерлейкина-5 после связывания его лиганда.
Этот результат был неожиданным из-за небольших знаний о зависимом от рецептора интерлейкина-5 пути передачи сигналов, тем более, что прежде не было возможным делать какие-то предсказания относительно того, реагирует ли один из описанных регулирующих элементов ДНК на вещество-мессенджер начатого рецептором интерлейкина-5 пути передачи сигналов, и какой.
В рамках настоящего изобретения под "зависимым от рецептора интерлейкина-5 путем передачи сигналов" следует понимать также зависимый от рецептора интерлейкина-5 механизм передачи сигналов, в случае необходимости состоящий из некоторых путей передачи сигналов.
Под "компонентом пути передачи сигналов" понимают все механизмы молекул, участвующих в пути передачи сигналов, включая самого рецептора интерлейкина-5 соответственно его субъединиц.
Если желают обнаружить ингибиторы зависимого от рецептора интерлейкина-5 пути передачи сигналов, то определяют антагонистическое действие исследуемых веществ тем, что их подают на клетки вместе с интерлейкином-5, причем в общем интерлейкин-5 подают на клетки одновременно с исследуемым веществом или после него.
Рекомбинантная ДНК, реагирующая на изменение вторичных переносчиков в нижеследующем называют "сенсорной ДНК". Репортерный ген определяется тем, что его экспрессионный продукт поддается обнаружению, и количество данного продукта можно определять путем измерения сигнала, пропорционального его концентрации.
Клетки, трансформированные сенсорной ДНК и экспрессирующие рецептор интерлейкина-5, в нижеследующем называются "исследуемыми клетками".
Под "рецептором интерлейкина-5" в рамках настоящего изобретения понимают функциональный рецептор интерлейкина-5, причем эта дефиниция охватывает также возможно имеющиеся субтипы рецептора интерлейкина-5. "Функциональным рецептором" в рамках настоящего изобретения является с одной стороны естественный рецептор интерлейкина-5, состоящий из α-субъединицы и β-субъединицы той же породы, а также в исследуемых клетках, в частности человеческих клетках, работоспособные комбинации α- и β-субъединиц рецептора интерлеейкина-5 разных пород, например α-субъединицу человеческого рецептора и β-субъединицу мышиного рецептора или наоборот. Далее, функциональный рецептор в рамках настоящего изобретения имеется тогда, когда в клетке, в которой β-субъединица естественно взаимодействует с α-субъединицей другого рецептора, например, рецептора интерлейкина-3 или стимулирующего колонии гранулоцитов и макрофагов фактора, α-субъединицу рецептора интерлейкина-5 вводят в клетку и возбуждают ее к экспрессии, причем в этом случае α-субъединица может происходить от другой породы, если обеспечено функциональное взаимодействие обеих субъединиц для начала пути передачи сигналов.
Рекомбинантная ДНК, содержащая одну или больше кодирующих субъединицу(ы) рецептора интерлейкина-5 последовательность(ей), в нижеследующем называют "рецепторной ДНК".
В качестве исходных клеток для получения исследуемых клеток пригодны клетки, эндогенно уже содержащие полный функциональный рецептор интерлейкина-5, а также клетки, содержащие требуемые для индукции сенсорной ДНК компоненты зависимых от рецептора путей передачи сигналов. Для годности таких клеток не требуется, чтобы они уже экспрессируют полный рецептор интерлейкина-5 или одну из его субъединиц. В случае отсутствия одной или обеих субъединиц клетку можно трансформировать не только сенсорной ДНК, а дополнительно еще кодирующей отсутствующую(ие) субъединицу(ы) рецептора последовательностью.
Согласно одному варианту изобретения исследуемая клетка произведена от клетки, по своей природе экспрессирующей обе субъединицы, требуемые для функционального рецептора интерлейкина-5.
Согласно другому варианту настоящего изобретения исследуемая клетка происходит от клетки, экспрессирующей лишь β- субъединицу. В этом случае клетку трансформируют не только сенсорной ДНК, а также плазмидой, содержащей кодирующую α--субъединицу рецептора интерлейкина-5 последовательность ДНК.
Согласно дальнейшему варианту изобретения исходная клетка для исследуемой клетки первоначально не содержит ни α-субъединицу рецептора интерлейкина-5, ни его β-субъединицу. В этом случае клетку необходимо трансформировать обеими последовательностями ДНК, которые могут иметься вместе на одной плазмиде или же отдельно на разных плазмидах.
Если желают исследовать фармакологическое действие веществ в связи с лечением патологических состояний человека, то ДНК рецептора предпочтительно содержит кодирующую человеческий рецептор интерлейкина-5 последовательность. (Предлагаемый способ предпочтительно служит для обнаружения веществ, пригодных для лечения патологических состояний человека. Однако его можно также применять для скрининга веществ, используемых для лечения животных; в последнем случае используют рецептор интерлейкина-5 подходящего животного).
Предпочтительно клетки для получения исследуемых клеток выбирают в зависимости от того, показывают ли они после стимуляции веществами, в зависимости от рецептора интерлейкина-5 повышающими концентрацию вторичных веществ-мессенджеров, сильную экспрессию репортерного гена. Это целесообразно проверяют путем временной трансформации клеток, экспрессирующих функциональный рецептор интерлейкина-5, сенсорной ДНК с последующим определением концентрации репортерного продукта после стимуляции рецептора интерлейкином-5.
В качестве исходных клеток для получения исследуемых клеток пригодны, в частности, клетки, о которых знают, что они экспрессируют рецептор интерлейкина-5 или рецептор, содержащий β-субъединицу, соответственно клетки, о которых можно полагать из-за их происхождения или функции в организме, что они экспрессируют один из соответствующих рецепторов, в частности кроветворные клетки-предшественники. В случае необходимости экспрессию можно подтвердить путем опытов связывания и/или опытов проливерации, в которых определяют рост клеток в присутствии соответствующих лигандов (интерлейкина-5, интерлейкина-3 или стимулирующего колонии гранулоцитов и макрофагов фактора).
В качестве примеров пригодных исходных клеток можно назвать зависимые от фактора клеточные линии, получаемые из костного мозга мышей; получение таких клеточных линий, экспрессирующих β-субъединицу, широко известно. В рамках настоящего изобретения трансфецировали один представитель такой мышиной клеточной линии α-субъединицей мышиного рецептора интерлейкина-5 и его использовали в качестве исследуемой клетки. Другим примером пригодных исследуемых клеток являются зависимые от интерлейкина-5 кроветворные клетки, например, клеточной линии TF-1.
В клетках, в которых обе субъединицы происходят от мыши, например в клеточной линии 1H3, α-субъединицу и в случае необходимости также β-субъединицу можно дезактивировать, например, путем гомологической рекомбинации и заменять соответствующей человеческой последовательностью.
В качестве исходных клеток принципиально пригодны клетки млекопитающих любой породы, причем предпочтительными являются человеческие клетки. В случае использования не человеческих клеток предпочитают клетки, трансформированные человеческой ДНК рецептора (интерлейкина-5 β- и/или α-субъединицей).
Дальнейшей предпосылкой годности определенной клетки в качестве исследуемой клетки является ее стабильность. Для определения стабильности клеток (их жизнеспособности, стабильной интеграции чужой ДНК в геном) за длительное время в идентичных условиях проводят опыты на исследуемых клетках и измеряют воспроизводимость результатов опытов.
Сенсорная ДНК предпочтительно находится на плазмиде, способной к размножению в организме хозяина, предпочтительно E. coli, с большим количеством копий и после трансфекции в клетки млекопитающего и интеграции в геном хозяина, позволяющий экспрессировать репортерный ген под контролем регулирующих элементов. Предпочтительно имеется шаттл-вектор, содержащий кассету для экспрессии репортерного гена (сенсорную ДНК) и поддающийся селекции маркер клеток млекопитающего, а также по меньшей мере одну область начала репликации и один маркер для размножения и селекции E. coli.
Для получения постоянных клеточных линий, содержащих сенсорную ДНК в стабильно интегрированном в свой геном виде, вектор содержит доминантный селекционный маркер. Использование определенного селекционного маркера не является критическим; пригодными селекционными маркерами являются, например, ген для неомицин-фосфотрансферазы (neo), придающий устойчивость к антибиотику G-418, ген дигидрофолатредуктазы (DHFR) для клеток, имеющих нехваток дигидрофолатредуктазы, ген ксантин-гуанин-фосфорибозилтрансферазы (gpt), придающий устойчивость к микофенольной кислоте, или ген гигромицин-B-фосфотрансферазы (hph). Примерами промоторов, управляющих геном селекционного маркера, являются промотор SV40-Early, промотор цитомегаловируса (промотор CMV), промотор гена тимидин-киназы вируса простого герпеса (промотор TK), длинный концевой повтор (LTR) вируса саркомы Рауса (RSV). Предпочтительно плазмиды строят с обеспечением того, что индивидуальные важные элементы, например репортерный ген, промотор для репортерного гена, регулирующие последовательности для селекционного маркера, можно простым образом заменять или изменять для приспосабливания к возможно изменяющимся требованиям в конкретном случае использования, например при использовании другой клеточной линии. Такие меры заключаются, например, во встроении сайтов многократного клонирования перед промотором(ами) или репортерным геном для создания возможности клонирования регулирующих, модулирующих промотор последовательностей, например, разных репортерных генов.
При выборе пригодного репортерного гена руководствовались намерением предоставить поддающийся автоматизации опыт с высокой чувствительностью, предпочтительно без применения радиоактивности.
В рамках настоящего изобретения принципиально можно использовать все репортерные гены, выполняющие эти требования.
Использование хемилюминесцирующего субстрата позволяет измерять щелочную фосфатазу с большой чувствительностью, однако оно имеет тот недостаток, что многие клетки млекопитающих относительно сильно экспрессируют этот фермент.
Поэтому такой субстрат пригоден в качестве репортерного гена в общем для клеточных линий, не или лишь мало экспрессируюших его.
Продукты экспрессии гена β-галактосидазы и β-глукуронидазы способны к расщеплению соответствующего метилумбелиферил-галактозида соответственно - глукуронида при образовании флуоресцирующих групп. Эти ферментные реакции можно проверять с помощью известных анализов флуоресценции.
Экспрессию хлорамфеникол-ацетилтрансферазы (CAT) можно доказать со сравнительно большой чувствительностью, однако соответствующий анализ имеет, среди прочего, тот недостаток, что при его осуществлении употребляют радиоактиность, и кроме того, его автоматизация сложна.
Предпочтительно в рамках настоящего изобретения в качестве репортерного гена используют ген, кодирующий Phontinus pyralis-люциферазу. Этот фермент имеет те преимущества, что он со своим субстратом люциферин с добавлением ATP отдает большое количество биолюминисценции, которое можно измерять с помощью поддающихся автоматизации методов, и что данный фермент эндогенно не продуцируется клетками млекопитающих. Кроме того, люцифераза имеет сравнительно короткий период полураспада iv vivo и не является токсичной даже при высокой концентрации.
При конструировании сенсорной ДНК репортерный ген ставят под контроль промоторов, содержащих поддающиеся модулированию регулирующие элементы как, например элементы TRE и/или CRE, и/или SRE, и/или GRE. Так как пути передачи сигналов рецептора интерлейкина-5 подробно не известны, наиболее пригодные конструкции сенсорной ДНК определяют эмпирически в предварительных опытах. Для этого клетку, экспрессирующую функциональный рецептор интерлейкина-5, временно трансформируют разными конструктами сенсорной ДНК, причем можно варьировать с одной стороны репортерный ген, с другой стороны контрольные последовательности, и определяют чувствительность продукта репортерного гена путем измерения концентрации продукта репортерного гена после стимуляции рецептора агонистом, предпочтительно интерлейкином-5. В качестве регулирующих последовательностей в сенсорной ДНК пригодны все элементы ДНК, вызывающие активацию промотора, например элементы из группы, включающей TRE, CRE, GRE и SRE, а также комбинации этих элементов. С помощью такой сенсорной ДНК, содержащей один такой элемент или два, или больше разных таких элементов, можно выявить отдельную активацию нескольких путей передачи сигналов или же параллельную активацию некоторых путей передачи сигналов. Сенсорную ДНК для развития исследуемых клеток выбирают с учетом как можно более высокой способности к индуцированию репортерного гена в соответствующей клеточной системе. Регулирующая область ДНК может представлять собой естественную промотерную область, или же ее можно получать синтетически.
В случае необходимости используют весь промотор гена, индуцируемого некоторыми вторичными веществами-мессенджерами, например 5'-регулирующую последовательность гена ICAM-1 (межклеточная адгезионная молекула 1) или гена c-fos. Естественный, реагирующий на активацию рецептора интерлейкина-5 промотор, содержащий много регулирующих элементов, например промотор ICAM-1, содержащий, среди прочего, элементы TRE, NKKB, SPI и AP2 или промотор c-fos, кроме элементов CRE и SRE среди других содержащий регулирующие последовательности, обозначаемые как "элемент SIF-E" и "подобный AP1 элемент", можно исследовать относительно того, какие из его элементов ответственны за активацию. Для этого можно исследовать способность к активации искусственных последовательностей промотора, снабженных разными мутациями и/или делециями по сравнению с естественным промотором. Исходя из результатов таких исследований в случае необходимости промотор можно далее оптимировать, например, путем использования нескольких копий, идентифицированных как решающие элементы.
В случае необходимости известные естественные или синтетические промоторы модифицируют путем их укорочения до минимальной последовательности, достаточной для выполнения функции промотора.
При конструировании сенсорной ДНК, в которой репортерный ген управляется неестественным промотором, целесообразно перед слабыми элементами промотора размещать один или несколько элементов, например регулирующих элементов TRE и/или CRE и/или SRE и/или GRE, модулирующих промотор. Специалисту известны контрольные последовательности, пригодные для экспрессии в определенных клетках млекопитающих; предварительный выбор возможен на основе литературы, а сужение соответственно оптимацию можно осуществлять с помощью широко известных, легко осуществляемых опытов с временной трансфекцией. В качестве примеров пригодных промоторов можно назвать промотор β-глобина и TK-промотор.
При выборе содержащейся в сенсорной ДНК регулирующей последовательности (включая ее фланкирующие последовательности) исходят из известных из литературы элементов TRE или CRE, которые в предварительных опытах исследуют относительно того, обладают ли они легко доказуемой способностью к индуцированию репортерного гена в определенной клеточной системе. Примерами пригодных элементов TRE, включая их фланкирующие последовательности, являются последовательности соматостатина, васоактивный кишечный пептид, усилитель цитомегаловируса, длинный концевой повтор вируса лейкоза крупного рогатого скота (элементы CRE) соответственно ICAM-1, коллагеназа, паращитовидный гормон (элементы TRE). Если содержащиеся в естественных последовательностях мотивы не имеют точно согласованную последовательность, то, если точно согласованная последовательность необходима или желательна, их и в случае необходимости также смежные последовательности можно изменить путем замены одного или нескольких нуклеотидов.
Регуляторные элементы и фланкирующие их последовательности можно получать синтетически, или они могут быть естественного происхождения.
Для усиления модулирующего действия вторичного переносчика на экспрессию репортерного гена в случае необходимости используют конструкт, содержащий несколько гомологических или гетерологических регулирующих последовательностей в тандемном положении друг за другом. При размещении индивидуальных элементов конструкта их расстояние друг за другом выбирают с обеспечением связывания фактора транскрипции с элементами. Оптимальное расстояние регулирующих элементов друг от друга, при определении которого также учитывают стерическое положение, выявляют эмпирически в предварительных опытах. В случае необходимости тем же образом определяют их расстояние от других регуляторных элементов ДНК, влияющих на транскрипцию, например от TATA-блока. В случае наличия многих регуляторных последовательностей элементы и/или фланкирующие последовательности могут быть идентичными или, по меньшей мере частично, различными, причем в случае тандемной конструкции они предпочтительно различны.
В качестве фланкирующих регуляторный элемент последовательностей, относительно которых выявили, что они также влияют на регулирующие свойства элементов, предпочитают последовательности, естественно окружающие соответствующий регуляторный элемент, в частности, если они находятся в их непосредственной близости. Последовательность и ее размещение определяют эмпирически.
В случае необходимости элементы сенсорной ДНК и используемый для селекции ген-маркер находятся на двух разных плазмидах, причем одна плазмида содержит конструкт репортерного гена (включая контролирующую экспрессию последовательность, содержащую регулирующую последовательность), а другая - конструкт гена-маркера для селекции. (Примерами пригодных конструктов гена-маркера для селекции являются плазмиды pRSVneo, pSV2neo, pRSVgpt, pSV2gpt, структура которых описана в соответствующих справочниках, например в "Cloning Vectors"). В случае использования отдельных плазмид клетки со-трансфецируют обеими клетками и избирают на маркер. Из наличия селекционного маркера можно делать вывод, что клетка также содержит конструкт репортерного гена, потому что известно, что со-трансформация двух генов, находящихся на физически не соединенных друг с другом сегментах ДНК, часто приводит к экспрессии обоих сотрансформированных генов.
С учетом используемых для проведения опытов приборов целесообразно оптимировать соотношение максимального изменения с нормальной величиной измеряемого сигнала, предпочтительно путем изменения структуры сенсорной ДНК, например, путем структурного изменения положения промотора. Предпочтительно фоновый сигнал является, с одной стороны, достаточно низким для измерения индукции экспрессии репортерного гена с высокой чувствительностью и, с другой стороны, достаточно высоким для определения предела доказательства отсутствия экспрессии.
Для конструкта рецепторной ДНК принципиально верны те же соображения, что и для конструкта сенсорной ДНК, с той разницей, что последовательность (и) рецептора предпочтительно ставят под контроль сильного промотора. Рецепторную ДНК можно получать с помощью известных методов молекулярной биологии, например, исходя из препарата РНК из клеток, экспрессирующих рецептор интерлейкина-5, путем получения кДНК с помощью цепной реакции полимеразы с участием обратной транскриптазы, причем праймеры конструируют на основе образуемой(ых) последовательности(ей), с последующим клонированием в пригодный вектор кДНК можно также амплифицировать из библиотеки кДНК путем ПЦР.
При необходимости в случае рецепторной ДНК кодирующая субъединицу рецептора последовательность и доминантный селекционный маркер находятся на разных плазмидах, которыми со-трансформированы клетки.
Трансфекция клеток сенсорной соответственно рецепторной ДНК осуществляют с помощью известных методов, причем предпочитают метод электропорации, метод осаждения фосфата кальция или метод липофекции.
Для контроля избирательности исследуемого вещества относительно рецептора интерлейкина-5 для проведения дальнейших контрольных опытов целесообразно получают клетки для разных других рецепторов, и данные клетки обрабатывают веществом. Если вещество должно специфически влиять лишь на рецептор интерлейкина-5, что обычно требуется с учетом специфичности лекарств, то вещество должно модулировать лишь этот единственный рецептор.
В контрольных клетках контрольный рецептор может принципиально иметься или эндогенно, или его можно трансформировать в клетку. Если сенсорная ДНК, используемая для клетки для исследования рецептора интерлейкина-5, в способной к измерению степени индуцируется также путем стимуляции этого рецептора агонистом, например интерлейкином-5, то в качестве контрольной клетки пригодна клетка для исследования рецептора интерлейкина-5, если эндогенно имеется кодирующая контрольный рецептор последовательность, или если эта последовательность дополнительно трансформировали в клетку. (Под контрольными рецепторами понимают также такие рецепторы, которые имеют ту же β-субъединицу, что и рецептор интерлейкина-5, например рецептор интерлейкина-3). Кроме того, в этом случае в качестве контрольных клеток можно использовать клетки, содержащие эту сенсорную ДНК и контрольный рецептор, а не рецептор интерлейкина-5. Однако, если используемая для клетки для исследования рецептора интерлейкина-5 сенсорная ДНК не индуцируется стимуляцией контрольного рецептора, то необходимо эмпирически определять пригодную сенсорную ДНК, причем берут известные элементы, которые в предварительных опытах исследовали относительно их пригодности, что касается чувствительно доказуемой способности к индуцированию репортерного гена в соответствующей клеточной системе. Затем сенсорную ДНК трансформируют в клетку вместе с кодирующей контрольный рецептор последовательностью, если контрольный рецептор не имеется эндогенно.
Избирательность модулирующего действия вещества на зависимый от рецептора интерлейкина-5 путь передачи сигналов предпочтительно определяют путем их нанесения в идентичных условиях на контрольные клетки, экспрессирующие контрольный рецептор и трансформированные сенсорной ДНК, регулирующая последовательность которой реагирует не только на рецептор интерлейкина-5, но и на активацию контрольного рецептора, и сравнения концентрации продукта рецепторного гена в экспрессирующих рецептор интерлейкина-5 клетках с концентрацией в контрольных клетках.
После трансформации клеток рецепторной ДНК исследуют высоту экспрессии рецептора положительных клонов, например, с помощью опытов связывания, в которых используют известные радиоактивно меченные агонисты и антагонисты.
С помощью пятен Скатчарда можно определять количество рецепторов в молекулах на клетку.
Предпочтительно среди стабильных, содержащих рецепторную ДНК трансформандов выбирают клон с числом рецепторов, по возможности соответствующим физиологической концентрации рецептора. (Если количество рецепторов слишком высоко, то может иметь место неполное и, возможно, неспецифическое связывание, или дополнительно к специфическому связыванию может происходить неспецифическое связывание, причем могут дополнительно активироваться другие эффекторные системы. Если количество рецепторов является слишком низким, то и сигнал низок и не охватывается при измерении).
Под "модулирующим" действием понимают агонистическое или антагонистическое действие на зависимый от рецептора интерлейкина-5 путь передачи сигналов.
Вещества, которые в опытах проявили ингибирующее действие на зависимую от рецептора интерлейкина-5 экспрессию репортерного гена, можно в дальнейшем опыте подвергать исследованию их ингибирующего действия на зависимую от интерлейкина-5 пролиферацию клеток. При таком опыте ингибирующее действие вещества на пролиферацию клеток определяют путем инкубации клеток, кроме рецепторов других факторов роста экспрессирующих функциональный рецептор интерлейкина-5 и относительно своего роста зависимых от присутствия интерлейкина-5, по меньшей мере лиганда для одного из этих рецепторов, например интерлейкина-5, лишь с интерлейкином-5 и в дальнейшей культуре вместе с интерлейкином-5 и исследуемым веществом с последующим определением пролиферации в обеих культурах.
Известен большой выбор таких опытов пролиферации. Их можно осуществлять, например, на микротитрационных планшетах, снабженных 96 углублениями, и они легко поддаются автоматизации. Примерами таких опытов являются опыты на основе определения встроения [3H] -тимидина или бромдезоксиуридина (БДУ) (определение встроения БДУ, например, через связывание меченых флуоресценцией антител против БДУ).
Другой принцип опыта пролиферации основан на измерении красителей, образуемых при взаимодействии пригодных субстратов с ферментами клетки. Одним из методов, разработанных на этой основе, является метод с использованием соли тетразолия, согласно которому спектрофотометрически измеряют концентрацию красителя формазан, образованного в результате дегидрогенизации соли тетразолия.
Примерами пригодных к использованию в опыте пролиферации клеток являются зависимые от интерлейкина-5 кроветворные клетки, например, клетки клеточной линии TF-1.
Вещества, возможное фармакологическое действие которых исследуют с помощью предлагаемого способа, представляют собой естественные или синтетические вещества, причем можно использовать чистые вещества или смеси веществ (например растительные экстракты, растворы ферментации и т.п.). В случае чистых веществ интерес представляют собой, в частности, низкомолекулярные синтетические органические соединения. К веществам, подлежащим исследованию с помощью скринига, принципиально относятся вещества, связывающиеся с местом связывания лиганда на рецепторе, вещества с аллостерическим действием и вещества, не-конкурентные в отношении места связывания лиганда. Эти вещества могут или не представлять собой пептиды.
Целесообразно вещества подают на клетки с градиентом разбавления с тем, чтобы исследовать его действие в как можно более широком диапазоне концентрации. Время инкубации определяют эмпирически, например, путем обработки исследуемых клеток известными агонистами рецептора и определением того момента, начиная с которого индукцию экспрессии репортерного гена можно измерять воспроизводимо. Время инкубации обычно регулируют с учетом этого момента; в общем оно составляет по меньшей мере час. Количество клеток зависит прежде всего от предела доказания измеряемого сигнала и от стадии роста, в котором находятся клетки. Кроме того, нижний предел определен также технически обусловленной способностью равномерного распределения на исследуемые порции. В случае использования микротитрационных планшетов с 96 углублениями количество клеток составляет, например, примерно 1000 - 100000 клеток на один тест, однако при соответствующей чувствительности измеряемого сигнала и возможности точного распределения клеток оно может быть более низким. Стадия роста, в котором используют клетки, зависит от специфических свойств клеток и, кроме того, от рецептора (при разных рецепторах та же самая эффекторная система может в разных стадиях роста активироваться по-разному или в разной степени); то есть, стадию роста и количество клеток также определяют эмпирически в предварительных опытах путем исследования кинетики экспрессии репортерного гена в предварительных клетках и клетках разной стадии роста.
В рамках настоящего изобретения удалось показать, что клетки, экспрессирующие рецептор интерлейкина-5 и трансформированные сенсорной ДНК, реагируют на добавление интерлейкина-5) представляющего собой естественный лиганд рецептора интерлейкина-5, путем индуцирования экспрессии репортерного гена. (С одной стороны исследовали мышиные клетки, по своей природе экспрессирующие β-субъединицу и дополнительно трансформированные α-субъединицей, и, с другой стороны, человеческие клетки, по своей природе экспрессирующие обе единицы, необходимые для функционального рецептора интерлейкина-5). Используемая сенсорная ДНК в качестве регулирующего элемента содержала или 5'-регулирующую область человеческого гена ICAM-1 длиной 1300 пар оснований, среди другого включающую элемент TRE, или 5'-регулирующую область человеческого гена c-fos длиной 756 пар оснований, среди другого включающую элементы TRE, CRE и SRE. Когда стимулировали эти клетки, содержащие эндогенные рецепторы интерлейкина-3 и стимулирующего колонии гранулоцитов и макрофагов фактора, интерлейкином-3 и стимулирующим колонии гранулоцитов и макрофагов фактором, тогда также удалось измерять индукцию экспрессии репортерного гена. В контрольных клетках, за исключением отсутствия α- субъединицы рецептора интерлейкина-5 (опосредующей связывание лиганда с рецептором) идентичных с вышеописанными клетками, экспрессию репортерного гена также удалось индуцировать путем обработки интерлейкином-3 и стимулирующим колонии гранулоцитов и макрофагов фактором, а не путем обработки интерлейкином-5.
В рамках настоящего изобретения предлагается чувствительный и универсальный функциональный способ обнаружения веществ, в зависимости от рецептора интерлейкина-5 специфически влияющих на одни или несколько путей передачи сигналов в клетке. Определяемые с помощью предлагаемого способа вещества служат в качестве ориентировочных веществ при разработке лекарств для лечения заболеваний, связанных с нарушением функции рецептора интерлейкина-5 соответственно зависимого от него пути передачи сигналов, и фармакологические свойство этих веществ можно затем более подробно исследовать путем вторичного скрининга, например, в случае антагонистов в опыте пролиферации с использованием клеточных линий или с использованием первичных клеток, а лишь затем в опыте на животных. Таким образом предлагаемый способ позволяет значительно сократить количество требуемых для исследований животных.
Кроме того, предлагаемый способ имеет то преимущество, что он поддается автоматизации, то есть подача клеток в соответствующие сосуды, например микротитрационные планшеты с 96 углублениями, подача растворов исследуемого вещества, приемы инкубации и промывки и измерение, проводимое, например, в случае люциферазы в качестве продукта репортерного гена с помощью люминометра, можно осуществлять с помощью роботеров. Поэтому предлагаемый способ пригоден для программ скрининга с большой производительностью, причем можно исследовать, например, примерно 2000 веществ или смеси веществ в неделю.
Предлагаемый способ позволяет выявить вещества с аллостерическим действием и вещества, неконкурентные относительно места связывания лиганда.
Далее, с помощью предлагаемого способа можно клонировать рецепторы, фармакологическая или биохимическая характеристика и лиганды которых известны. При этом исходят от банков кДНК или генома, пулы из которых трансформируют в соответствующую клеточную линию. Экспрессия рецептора указывается экспрессией репортерного гена после того, как рецептор активировался путем связывания с лигандом.
Перечень фигур.
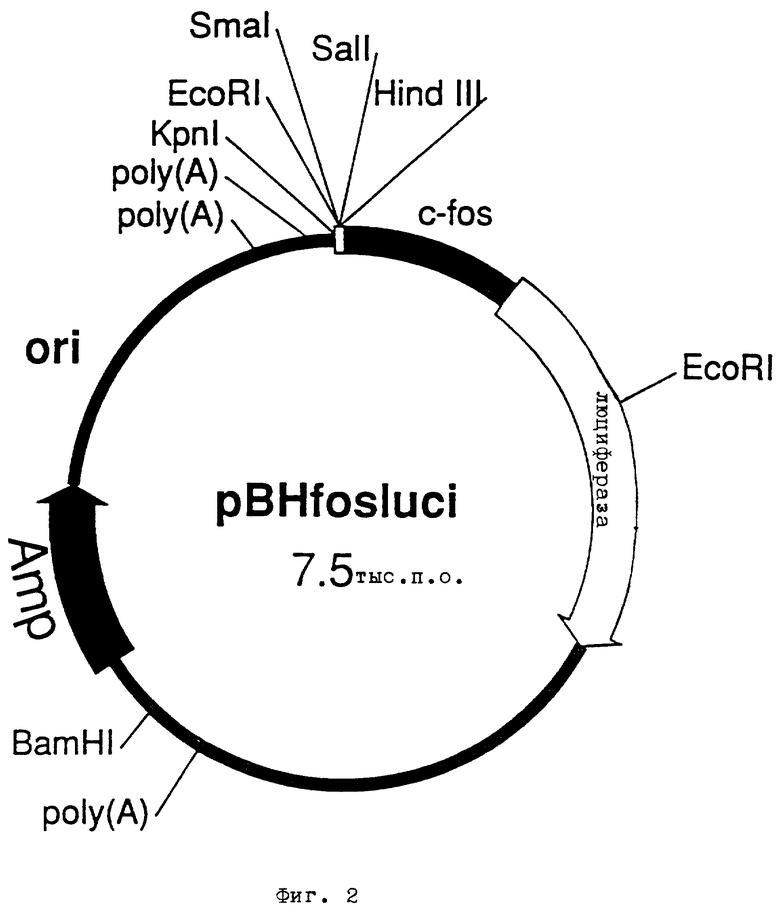
Фиг. 1 - плазмида pBHluc1.3 сенсорной ДНК, содержащая промоторную область гена ICAM-1,
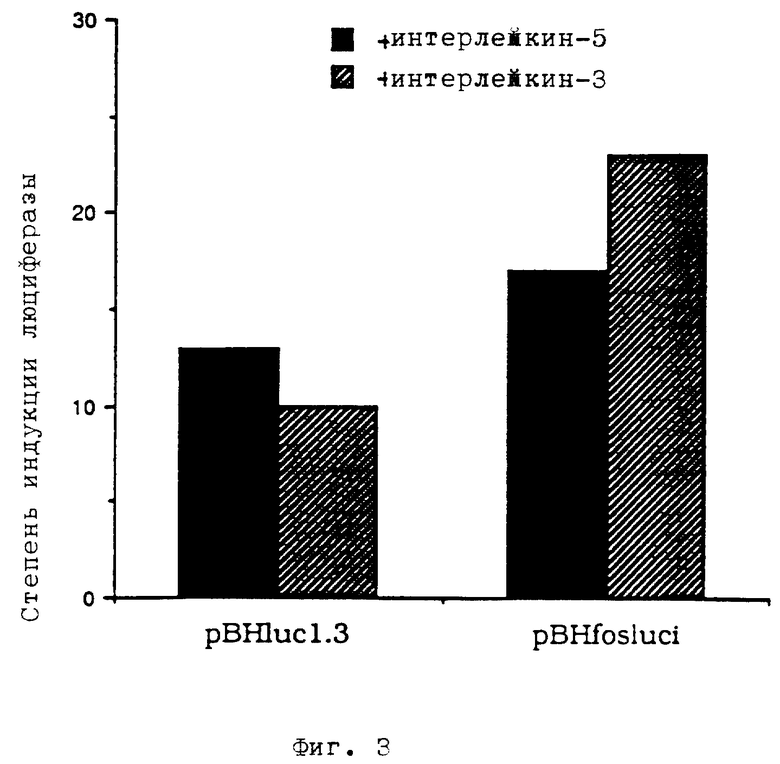
фиг. 2 - плазмида pBHfosluci сенсорной ДНК, содержащая промоторную область гена c-fos,
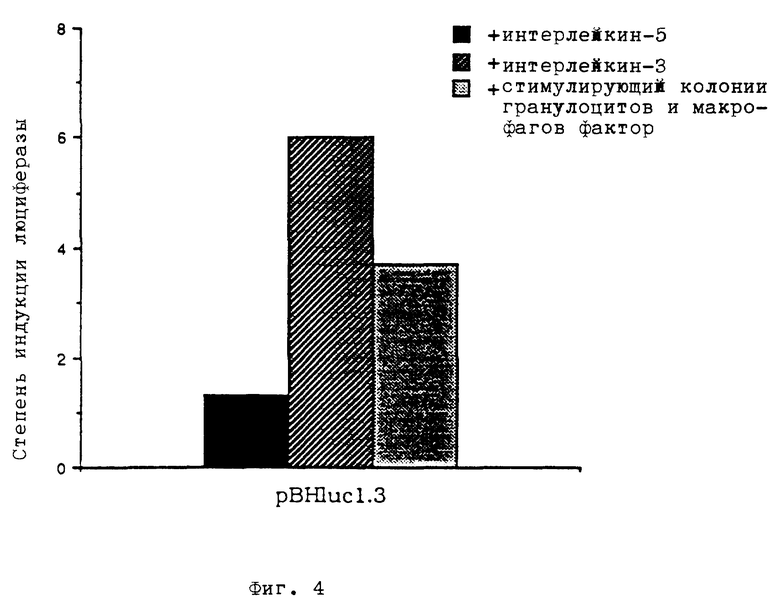
фиг. 3 - индуцирование pBHluc1.3 и pBHfosluci путем стимуляции рецептора в клетках 1H3,
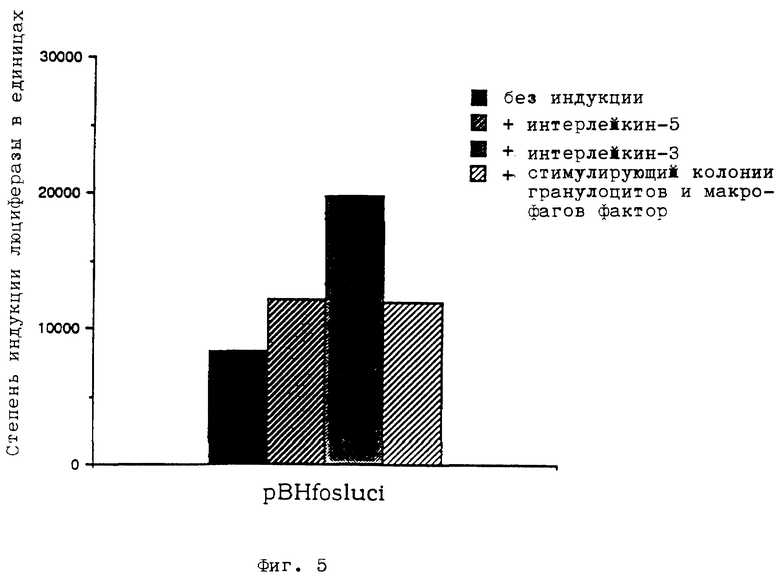
фиг. 4 - индуцирование pBHluc1.3 путем стимуляции рецептора в мышиных клетках FDC-P1,
фиг. 5 - индуцирование pBHfosluci путем стимуляции рецептора в человеческих клетках TF-1,
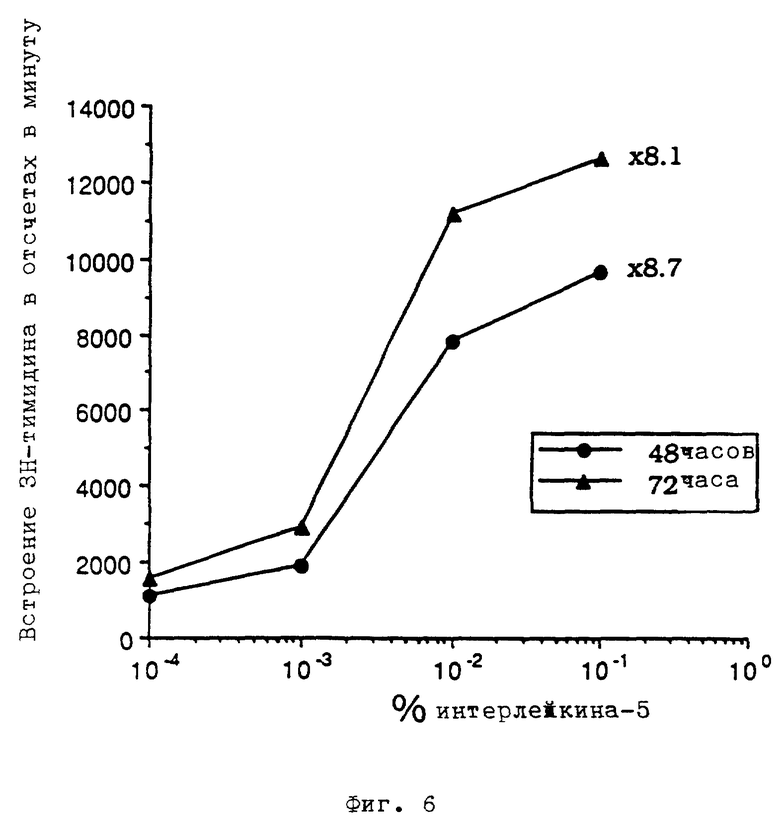
фиг. 6 - индуцирование пролиферации клеток TF-1 путем стимуляции рецептора.
Пример 1
Получение репортерных плазмид, содержащих элементы, регулируемые вторичными вешествами-мессенджерами (сенсорной ДНК)
а) Строение плазмиды pBHluc1.3
В результате клонирования и анализа делеции 1300 пар оснований 5'-фланкирующей области человеческого гена межклеточной адгезионной молекулы ICAM-1 выявилось, что этот фрагмент i) в клеточной линии адеокарциномы легких A549 (Американская коллекция клеточных культур N CCL 185) можно индуцировать тетрадеканоилфорбол-ацетатом (TPA) и ii) содержит реагирующий на TPA элемент (TRE), представляющий собой последовательность ДНК TGATTCA. Плазмида pBHluc1.3 (фиг. 1) содержит регулирующую область гена ICAM-1, имеющую длину 1300 пар оснований и размещенную перед геном люциферазы.
б) Строение плазмиды pBHfosluci
Плазмида pBHfosluci содержит ген люциферазы под контролем промотора человеческого гена c-fos, содержащего разные регулирующие элементы, например, TRE, CRE и SRE. Фрагмент, охватывающий промотор c-fos (положения -711 до +45), изолировали из плазмиды pfosCAT, его временно клонировали в векторе pBluescriptSK (стратагены) и вставили в конструкт pBHluc перед геном люциферазы.
Плазмиду pfosCAT резали XbaI и HindIII. Выделяли фрагмент длиной 756 пар оснований, содержащий промотор c-fos, и его лигировали вектором pBluescriptSK, резанным XbaI и HindIII. Плазмиду, полученную в результате трансформации E. coli, обозначали как pBSfos. Ее резали XbaI, концы ДНК затупили путем добавления фермента Кленова и всех четырех дезоксинуклеозидтрифосфатов, и затем ее резали SalI. Выделяли фрагмент SalII/затупленный конец, содержащий промотор c-fos. Плазмиду pBHluc резали HindIII, концы ДНК затупили, и ее резали SalI. Полученный таким образом вектор лигировали с фрагментом SalI/затупленный конец, содержащим промотор c-fos. Полученную в результате трансформации E.coli плазмиду обозначали как pBHfosluci (фиг. 2).
Пример 2
Опосредованное рецептором индуцирование сенсорной ДНК
Для доказания того, что в клетках, экспрессирующих рецептор интерлейкина-5, сенсорная ДНК индуцируется после стимуляции рецептора веществом с агонистическим действием, клетки мышиной клеточной линии и человеческой клеточной линии временно трансфецировали сенсорной ДНК (pBHluc1.3 или pBHfosluci):
Из клеток FDC-P1, представляющих зависимую от фактора клеточную линию, полученную из клеток костного мозга, путем трансформации α-субъединицей мышиного рецептора интерлейкина-5 получали мышиные клетки 1H3 путем следующего метода: с помощью цепной реакции полимеразы с использованием обратной транскриптазы, с применением РНК из клеточной линии BCL1, клон 5B1b (Американская коллекция клеточных культур N TIB 197) синтетизировали кДНК, кодирующую α-субъединицу мышиного рецептора интерлейкина-5. Для этого использовали праймеры MF71 (последовательность N1) (5'TCGGCTACCATGGTGCCTGTTG3') и MF73 (последовательность N 2) (5'ATGGCAAAATGCCATCAAAACGTG3'); эти праймеры фланикируют область, кодирующую α-субъединицу рецептора. В протоколе последовательностей синтетические олигодезоксирибонуклетиды обозначены как "кДНК"). Продукт цепной реакции полимеразы, имеющий длину 1272 п.о., субклонировали в сайт рестрикции SmaI плазмиды pUC19. Кодирующую последовательность вырезали BamHI и EcoRI, и ее вставили в экспрессионную плазмиду pcDNAI (полученный in vitro ген), которую резали теми же ферментами. 25 мкг линеаризованной плазмиды путем электропорации (при 300 В, 960 мкF, с использованием BioRad Gene Pulser) траснфецировали в 4•107 клеток FDc-P1. Экспрессирующие рецептор интерлейкина-5 клетки селекционировали в среде RPMI-1640, обогащенной мышиным интерлейкином-5. Поэтому в отличие от клеток FDC-P1, которые экспрессируют лишь β-субъединицу рецептора интерлейкина-5, клетки 1H3 экспрессируют функциональный рецептор интерлейкина-5 (α-субъединицу плюс β-субъединицу). Клетки 1H3 и клетки FDC-P1 имеют эндогенные рецепторы интерлейкина-3 и стимулирующего колонии гранулоцитов и макрофагов фактора, β-субъединица рецепторов интерлейкина-5, интерлейкина-3 и стимулирующего колонии гранулоцитов и макрофагов фактора является идентичной.
Человеческую клеточную линию TF-1 получали из клеток костного мозга пациента, больного эритролейкемией. Клетки экспрессируют функциональные рецепторы интерлейкина-5, интерлейкина-3 и стимулирующего колонии гранулоцитов и макрофагов фактора; их пролиферация зависима от присутствия по меньшей мере одного из трех кроветворнных факторов роста.
Через день после трансфекции клеток 1Р3 соответственно TF-1 сенсорной ДНК клетки держали в свободной от фактора среде в течение примерно 12 часов, после чего их обрабатывали специфическим относительно рецептора лигандом интерлейкин-5. В качестве негативного контроля для клеток 1H3 идентичный опыт провели с мышиными клетками FDC-P1, не экспрессирующими функционального рецептора интерлейкина-5. В дальнейших контрольных опытах клетки 1H3, FDC-P1 и TF-1 обрабатывали интерлейкином-3 или стимулирующим колонии гранулоцитов и макрофагов фактором вместо интерлейкина-5.
а) Индуцирование pBHluc1.3 и pBHfosluci путем стимуляции рецептора в клетках 1H3.
Клеточную линию 1H3, экспрессирующую функциональный рецептор интерлейкина-5, инкубировали при температуре 37oC в среде RMPI 1640, содержащей 10% дезактивированной путем воздействия тепла фетальной телячьей сыворотки и 1% добавки, состоящей из 1 м. хлорида натрия, 0,1 м. пирувата натрия и 11,3 м. монотиоглицерина), и дополнительно примерно 500 единиц/мл интерлейкина-5 (рекомбинантного мышиного интерлейкина-5) в присутствии 5% двуокиси углерода. Путем центрифугирования при 1000 оборотах в минуту в течение 5 минут отделяли примерно 3 • 107 клеток, которые повторно суспендировали в 200 мкл среды, содержащей все добавки. После добавления 15 мкг плазмидной ДНК на 107 клеток добавили полную среду до объема 400 мкл. Клетки трансфецировали путем электропорации с использованием прибора Biorad Gene Pulser с токовым импульсом 300 В, 960 мкФ, после чего их инкубировали при температуре 37oC в течение ночи в свежей, полной среде, содержащей интерлейкин-5. В следующий день клетки подвергали центрифугированию при 1000 оборотах в минуту в течение 5 минут и дважды промывали полной средой, свободной от интерлейкина-5. Клетки повторно суспендировали в полной среде, не содержащей интерлейкина-5, и далее инкубировали в течение ночи. Для индуцирования клетки вновь подвергали центрифугированию, после чего их суспендировали в 60 мл свободной от фактора среды и равномерно распределяли на три бутылки для инкубирования. Клетки в одной бутылке не индуцировали и до момента определения активности люциферазы их держали в свободной от фактора среде (отрицательный контроль), а в остальные две бутылки подали примерно 100 единиц на мл интерлейкина-5 соответственно интерлейкина-3. Инкубировали при температуре 37oC в течение 8 часов, затем клетки отделяли центрифугированием, промывали фосфатсодержащим солевым буфером и поглощали в 500 мкл буфера, содержащего 25 ммоль трицина, 0,5 ммоль ЭДТК, 0,54 ммоль триполифосфата натрия, 6,5 ммоль дитиотриетола, 16,3 ммоль сульфата магния в виде гидрата, 0,1% тритона X-100, 1,2 ммоль трифосфата аденозина и 0,05 ммоль люцифенина и имеющего значение pH = 7,8. К 400 мкл этой смеси добавили 20 мкл (1 ммоль) люциферина и подвергали измерению с помощью люминометра марки Lumat 9501. Результат опыта показан на фиг. 3. Видно, что оба сенсорных конструкта, pBHluc1.3 и pBHfosluci, можно индуцираовать интерлейкином-5 более, чем в 10 раз. Стимуляция клеток интерлейкином-3 также приводит к индукцированию обоих сенсорных конструктов через эндогенные рецепторы интерлейкина-3.
б) Индуцирование pBHluc1.3 путем стимуляции рецептора в клетках FDC-P1.
Клеточную линию FDC-P1 инкубировали в среде RMPI 1640 вместе с теми же добавками, что и клетки 1H3 (см. выше "а)"), однако, с добавлением примерно 500 единиц/мл интерлейкина-3 вместо интерлейкина-5. Примерно 4 • 107 клеток трансфецировали описанным под а) методом путем электропорации с использованием 15 мкг ДНК pBHluc1.3 на 107 клеток, инкубировали и хранили в свободной от интерлейкина-3 среде. Клетки равномерно распределяли на четыре бутылки для инкубирования. Клетки в одной бутылке и до момента определения активности люциферазы держали в свободной от фактора среде (отрицательный контроль), а клетки в остальных трех бутылках обрабатывали примерно 1000 единицами на мл интерлейкина-5, интерлейкина-3 соответственно стимулирующим колонии гранулоцитов и макрофагов фактором. После инкубирования в течение 8 часов определяли активность люциферазы вышеописанным методом. Результат опыта показан на фиг. 4. Сенсорная ДНК pBHluc1.3 не индуцируется интерлейкином-5 в клетках FDC-P1, экспрессирующих лишь β-субъединицу рецептора интерлейкина-5, и в которых отсутствует связывающая лиганд α-субъединица. В отличие от этого обработка интерлейкином-3 или стимулирующим колонии гранулоцитов и макрофагов фактором приводит к индукцированию сенсорной ДНК через эндогенные рецепторы интерлейкина-3 и стимулирующего колонии гранулоцитов и макрофагов фактора, имеющегося также как и в клетках 1H3.
в) Индуцирование pBHfosluci путем стимуляции рецептора в клетках TF-1.
Клеточную линию TF-1 инкубировали при температуре 37oC в среде RMPI 1640, содержащей 10% дезактивированной путем воздействия тепла фетальной телячьей сыворотки, в присутствии 1 нг/мл интерлейкина-3 и 5% двуокиси углерода. Путем центрифугирования при 1000 оборотах в минуту в течение 5 минут отделяли примерно 3•107 клеток на каждый прием трансфекции, которые повторно суспендировали в 200 мкл среды, содержащей все добавки. После добавления 15 мкг плазмидной ДНК на 107 клеток добавили полную среду до объема 400 мкл. Клетки трансфецировали путем электропорации с использованием прибора Biorad Gene Pulser с токовым импульсом 280 В, 980 мкФ, после чего их инкубировали при температуре 37oC в течение ночи в свежей, полной среде, содержащей интерлейкин-3. В следующий день клетки подвергали центрифугированию при 1000 оборотах в минуту в течение 5 минут и дважды промывали полной средой, свободной от интерлейкина-3. Клетки повторно суспендировали в полной среде, не содержащей фактора, и продолжали инкубировать в течение ночи. Для индуцирования клетки вновь подвергали центрифугированию, после чего их суспендировали в 60 мл свободной от фактора среды и равномерно распределяли на четыре бутылки для инкубирования. Клетки в одной бутылке не индуцировали и до момента определения активности люциферазы их держали в свободной от фактора среде (отрицательный контроль), а в остальные три бутылки подали примерно 10 нг/мл интерлейкина-5 соответственно 1 нг/мл интерлейкина-3 соответственно 100 нг/мл стимулирующего колонии гранулоцитов и макрофагов фактора. Инкубировали при температуре 37oC в течение 8 часов, затем клетки отделяли центрифугированием, промывали фосфатсодержащим солевым буфером и подали в 500 мкл буфера, содержащего 25 ммоль трицина, 0,5 ммоль ЭДТК, 0,54 ммоль триполифосфата натрия, 6,5 ммоль дитиотриетола, 16,3 ммоль сульфата магния в виде гидрата, 0,1% тритона Х-100, 1,2 ммоль трифосфата аденозина и 0,05 ммоль люцифенина, и имеющего значение pH = 7,8. К 400 мкл этой смеси добавили 20 мкл (1 ммоль) люциферина и подвергали измерению с помощью люминометра марки Lumat 9501. Результат опыта показан на фиг. 5. Видно, что сенсорный конструкт pBHfosluci можно индуцировать интерлейкином-5, а также интерлейкином-3 и стимулирующим колонии гранулоцитов и макрофагов фактором.
г) Индуцирование пролиферации клеток TF-1 путем стимуляции рецептора.
Для доказания того, что клетки TF-1, экспрессирующие рецептор интерлейкина-5, проявляют пролиферацию после стимуляции веществом с агонистическим действием, клетки подали в микротитрационные планшеты, снабженные 96 углублениями, то есть в каждое углубление двух планшетов подали примерно 3•103 клеток в 100 мкл среды RMPI 1640, содержащей 2% фетальной телячьей сыворотки. Три порции клеток на каждом планшете инкубировали без интерлейкина-5 (отрицательный контроль), а к трем порциям подали 0,001% рекомбинантного человеческого интерлейкина-5, к трем порциям - 0,01%, и к дальнейшим трем порциям - 0,1%. К клеткам одного планшета подали 1 мккюри [6-3Н]тимидина на каждое углубление после инкубации в течение 48oC при температуре 37oC, а к клеткам другого планшета - после инкубации в течение 72 часов при температуре 37oC. Затем продолжали инкубировать в течение 12 часов, после чего планшеты хранили при температуре -20oC до измерения встроения тимидина с помощью прибора для сбора клеток марки Packard FilterMate Cell Harvester и сцинтилляционного счетчика TopCount. Результат опыта показан на фиг. 6. При наивысшей концентрации интерлейкина-5 (0,1%) встроение тимидина после инкубации в течение 48 часов в 8,1 раз выше величины, получаемой для контрольных клеток в свободной от интерлейкина-5 среде, а после инкубации в течение 72 часов -в 8,7 раз.
Протокол последовательностей
(1) Общая информация:
(i) Заявитель:
(а) название фирмы: Берингер Ингельхайм Интернациональ ГмбХ
(б) улица: Почтовый ящик 200
(в) город: Ингельхайм ам Райн
(д) страна: Федеративная Республика Германия
(е) почтовый индекс: 55216
(ж) телефон: 06132/772282
(з) телефакс: 06132/774377
(ii) Название изобретения:
Способ скининга веществ с модулирующим действием на зависимый от рецептора интерлейкина-5 путь передачи сигналов в клетках
(iii) Количество последовательностей: 2
(iv) Форма записи для компьютера:
(а) носитель информации: гибкий диск
(б) компьютер: совместимый с персональным компьютером IBM
(в) операционная система: PC-DOS/MS-DOS
(г) программа: Patentin Release No 1.0, версия No 1.25 (EPA)
(2) Информация о последовательности No 1:
(i) Характеристика последовательности:
(а) длина: 21 пара оснований
(б) вид: нуклеиновая кислота
(в) структура: однонитевая
(г) топология: линейная
(ii) Вид молекулы: кДНК
(iii) Антисмысловая: нет
(ix) Признаки:
(а) название/ключ: 5'UTR
(б) положение: 1..21
(xi) Описание последовательности: последовательность No 1:
TCGGCTACCA TGGTGCCTGT G 21
(2) Информация о последовательности No 2:
(i) Характеристика последовательности:
(а) длина: 24 пары оснований
(б) вид: нуклеиновая кислота
(в) структура: однонитевая
(г) топология: линейная
(ii) Вид молекулы: кДНК
(iii) Антисмысловая: нет
(ix) Признаки:
(а) название/ключ: 5'UTR
(б) положение: 1..24
(xi) Описание последовательности: последовательность No 2:
ATGGCAAAAT GCCATCAAAA CGTG 24и
Изобретение относится к биотехнологии и может быть использовано для выявления веществ с фармакологическим действием. Действие вещества на зависимый от рецептора интерлейкина-5 путь передачи сигналов в человеческой клетке или клетке животного определяют путем инкубирования клеток, трансформированных рекомбинантной ДНК, содержащей репортерный ген и регуляторную последовательность, и экспрессирующих функциональный рецептор интерлейкина-5, с исследуемым веществом и последующего определения концентрации продукта репортерного гена. Избирательность действия исследуемого вещества в отношении зависимого от рецептора нитерлейкина-5 пути передачи сигналов определяют путем инкубирования вещества в идентичных условиях с контрольными клетками, экспрессирующими контрольный рецептор, отличный от рецептора интерлейкина-5, и трансформированными рекомбинантной ДНК, содержащей рецепторный ген и регуляторную последовательность, реагирующую на изменение концентрации вторичного переносчика зависимого от контрольного рецептора пути передачи сигналов, и сравнения концентрации продукта репортерного гена в экспрессирующих рецептор интерлейкина-5 клетках с этой концентрацией в контрольных клетках. Способ позволяет выявить вещества с возможным фармакологическим действием, обладающим избирательностью относительно зависимого от рецептора интерлейкина-5 пути передачи сигналов. 16 з.п. ф-лы, 6 ил.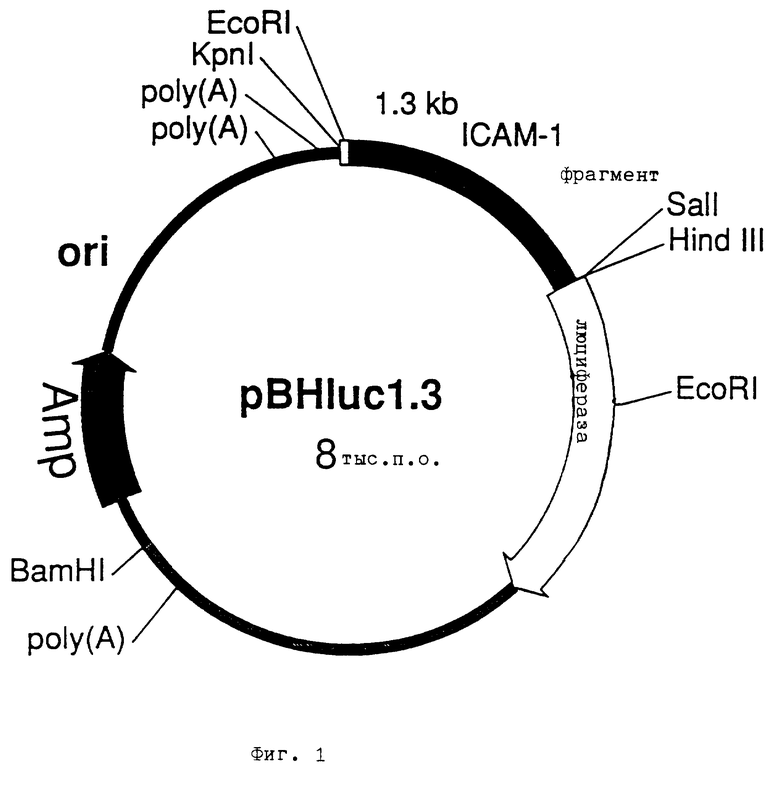
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
Авторы
Даты
1999-10-20—Публикация
1994-05-27—Подача