Настоящее изобретение касается нового способа лечения эндотоксинового шока с применением антиадгезивных антител. Более точно, настоящее изобретение касается способа лечения эндотоксинового шока с использованием анти-CD18 и анти-ICAM-I антител.
Клеточная адгезия является процессом, посредством которого лейкоциты прикрепляются к клеточным субстратам, таким как эндотелиальные клетки, для того, чтобы мигрировать из потока (крови, лимфы и т.п.) к местам возникающего воспаления и соответствующим образом защищать хозяина от чужеродных внедрений, таких как бактерии или вирусы. Прекрасный обзор системы защиты дан Айзеном (см. Eisen H.W. microbiology, 3 rd Eg, Harper L. Row, Philadelpia PA (1980), pp. 290 - 295 и 381 - 418).
Одной из молекул на поверхности эндотелиальных клеток, которая участвует в адгезионном процессе, является молекула межклеточной адгезии ICAM-I./ См. Ротляйн с сотр. Rothlein et. al. I. Immunol, 137; 1270 (1986)/, эта статья включена в настоящее описание посредством ссылки. Было продемонстрировано, что эта молекула является посредником адгезии путем связывания с молекулами семейства CD18 гликопротеинов, которые присутствуют на клеточных поверхностях лейкоцитов (Saneher-madrid et al, J. Exper. med 158 : 1785 (1983): Keiser et al, Eur I. Immunol 15 : 1142 (1985). Это семейство гликопротеинов состоит из гетеродимеров, имеющих одну альфа- и одну бета-цепь. Хотя альфа-цепи каждого из этих протеинов отличаются друг от друга, было обнаружено, что бета-цепь высококонсервирована (Санчес-Мадрид и др., см. выше). Бета-цепь гликопротеинового семейства (иногда называемая "CD18:) имеет, как оказалось, молекулярный вес 95 кД, тогда как молекулярный вес альфа-цепей изменяется от 150 кД до 180 кД (Т. Шпрингер, см. Springer T, Fed Proc 44 : 2660 (1985). Хотя альфа-субъединицы мембранных протеинов не разделяют протяженной гомологии, которой обладают бета-субъединицы, тщательный анализ альфа-субъединиц гликопротеинов обнаружил, что между ними имеется существенное сходство. В семействе CD18 имеется три основных члена: Mac-1, LFA-1 и p150, 95. Mac-1 является гетеродимером, обнаруживаемым на макрофагах, гранулоцитах и больших гранулярных лимфоцитах, LFA-1 является гетеродимером, обнаруживаемым на большинстве лимфоцитов (Шпрингер с сотр., Immunol. Rev. 68: 111 (1982). p150, 95 имеет распределение по тканям подобно Mac-1 и также играет роль в клеточной адгезии (Кайзер с сотр., см. Keiser et al. Eur. I.Immonol 15: 1142 (1985)). Сходства между альфа- и бета-субъединицами LFA-1 - родственных гликопротеинов рассмотрены в работах Санчес-Мадрид с сотр. (см. выше) и Санчес-Мадрид с сотр., F. Exper med 158: 586 (1983).
Анти-CD18 антитела были описаны в качестве полезных при лечении гемморагического шока у кроликов (Веддер с сотр., см. Vedder et al, J Clin Invest 81: 939 (1988)). Было продемонстрировано, что анти-CD18 антитела не повышают восприимчивость к сепсису при применении их для ингибирования нейтрофильной адгезии у кроликов (см. Mileski et al, Surgical Forum, Infection and its mediators p. 107 (1989).
Патент США N 4388318 описывает способ лечения эндотоксинового шока с использованием пиримидо-пиримидинового производного. Патенты США N 4472420 и 4472431 описывают способ обработки (лечения) шока с использованием беноксапрофена и фенопрофена соответственно.
До настоящего изобретения, однако, не был известен способ лечения эндотоксинового шока с использованием анти-ICAM-I антител.
Соответственно, целью настоящего изобретения является обеспечить новый способ лечения эндотоксинового шока с использованием анти-CD18 и анти-ICAM-I антител.
На чертеже представлен график выживаемости кроликов, страдающих септическим (эндотоксиновым) шоком, которые были обработаны или солевым (физиологическим) раствором или моноклональным анти-ICAM-I антителом R6,5.
Настоящее изобретение касается способа лечения эндотоксинового шока у пациента, предусматривающего введение пациенту терапевтически эффективного количества анти-CD18 антитела или анти-ICAM-I антитела, или их фрагментов.
Анти-CD18 и анти-ICAM-I антитела, используемые в настоящем изобретении, могут быть получены с использованием известных процедур, например, посредством иммунной очистки поликлональной сыворотки, гибридомной технологией или технологией рекомбинантной ДНК, См., например, Kohler et al, PNAS USA, 77(4): 2197 (1980) и патент США N 4816397.
Предпочтительно, анти-CD18 антитело и анти-ICAM-I антитело являются моноклональным антителом. Моноклональное анти-CD18 антитело может быть приготовлено следующим образом. Мышей иммунизируют клетками, содержащими CD18. Затем мышей забивают и удаляют селезенку. Клетки селезенки сливают с клетками миеломы с получением гибридом. Эти гибридомы культивируют, и их супернатанты (надосадочную жидкость) исследуют (проводят скрининг) на анти-CD18 активность, например, посредством тестов ELISA или RIA, или посредством агрегационного анализа, как описано в Ротляйна и др. (см. выше). Гибридомы, секретирующие моноклональные антитела с желаемой анти-CD18 активностью, клонируют и культивируют. Моноклональное анти-ICAM-I антитело может быть приготовлено подобным образом посредством предварительного иммунизирования мышей клетками, содержащими ICAM-I, или собственно ICAM-I.
Могут использоваться различные способы введения анти-CD18 антитела или анти-ICAM-I антитела пациента, включая, например, внутрикожный, подкожный, внутримышечный; внутрибрюшинный (интраперитонеальный) и внутривенный пути. Предпочтительно, для введения анти-CD18 или анти-ICAM-I антител используют их подкожную или внутримышечную инъекцию в присутствии различных адъювантов. Количество вводимого анти-CD18 или анти-ICAM-I антитела будет изменяться в зависимости от силы шока, пути введения и т.д., но, в общем, пациенту может вводиться от 0,1 мг/кг до 10 мг/кг или более антитела. Анти-CD18 или анти-ICAM-I антитело может быть внесено в рецептуру с подходящим адъювантом, включая, например, минеральные гели, такие как гидроокись алюминия, поверхностно-активные вещества, такие как лизолецитин; плюроновые полиолы, пептиды или масляные эмульсии.
Анти-CD18 или анти-ICAM-I антитела могут использоваться в качестве целых антител в способе по настоящему изобретению или в виде фрагментов. Фрагменты антител анти-CD18 или анти-ICAM-I должны включать по крайней мере один связывающий сайт анти-CD18 или анти-ICAM-I антитела. Возможные для использования фрагменты анти-CD18 или анти-ICAM-I антител включают фрагменты Fab и Fab/2. Фрагменты антител анти-CD18 или анти-ICAM-I могут быть приготовлены с использованием известных процедур, например, посредством переваривания антитела протеолитическими ферментами или посредством технологии рекомбинантной ДНК.
Следующие примеры иллюстрируют настоящее изобретение.
Пример N 1
A. Приготовление моноклонального антитела анти-CD18 (R15,7)
Моноклональное антитело анти-CD18, R15,7, получают как описано у Энтмана и др. (Entman et al., J. Clin. Invest). 85: 1497 (1990), в статье, которая включена в настоящее описание в качестве ссылки. Вкратце, мышей BALB/c иммунизируют собачьими перитонеальными макрофагами. Клетки селезенки от иммунизированных мышей сливают с миеломными клетками P3x63A g8.653 для создания гибридом. Надосадочные жидкости гибридом подвергают скринингу на ингибирование агрегации TY клеток и SKW3 Клоны, положительные на оба теста, затем скринируют на связывание гибридных клеток мыши/человека, которые экспрессируют мышиный CD11a и человеческий CD18. Был выбран один клон, R15,7. Асцитическую жидкость получают у пристан-примированных BALB/c мышей для клона R15,7, и антитело R15,7 выделяют на белке A.
R15,7 является мышиным IgG1 антителом к собачьему CD18. Хотя и направленное против собачьего CD18, R15,7 дает перекрестную реакцию с человеческим CD18 и кроличьим CD18.
B. Подготовка животных
Белых (NZW) кроликов (Hare Marland, Hewith, NJ), весивших от 2,5 до 4,0 кг, примировали 10 μ г/кг E.Col липополисахаридом (LPS) посредством внутривенной инъекции в краевую вену (правую) уха (примирующая доза). Кроликов обезболивали внутримышечной инъекцией кетамин-HCl и ксилазина, 50 мг/кг и 5,7 мг/кг, соответственно. Системное кровяное давление наблюдали на правой сонной артерии. Через 17,5 часов после примирующей дозы кроликам делали внутривенную инъекцию в правую краевую ушную вену одного из следующих испытываемых соединений:
(1) стерильный солевой раствор
(2) мышиный IgG (1 мг/кг)
(3) R15,7 (1 мг/кг)
Через полчаса после введения испытываемого соединения кроликам затем делают вторую внутривенную LPS инъекцию (100 мг/кг).
Образцы крови берут у кроликов после примирующей дозы: после инъекции стерильного солевого раствора, мышиного IgG или R15,7; после второй инъекции LPS через 1 час после второй инъекции IP; через 2 часа после второй инъекции LPS.
C. Результаты
У всех 5 обработанных солевым раствором кроликов развилась периферийная лейкопения с выраженной нейтропенией и тромбоцитопенией; у четырех возникла резкая гипотония (снижение кровяного давления), исчезнувшая в течение 30 минут (27 ± 3,6 минут) после второй LPS инъекции.
Все три кролика, обработанные мышиным IgG, испытали резкое падение системного кровяного давления, с гематологическими параметрами, подобными таковым у кроликов, обработанных солевым раствором, и все три погибли после второй инъекции LPS/18, 44 и 114 минут соответственно.
Все кролики, обработанные R15,7, прожили 2 часа после второй инъекции LPS. Среднее артериальное давление снизилось лишь ненамного (15,5 - 19,3 мм рт. ст. за 2 часа). Подсчет периферийных нейтрофилов дал результаты, которые оставались существенно ниже (P менее 0,5) в R 15,7 кроликов, чем у кроликов, обработанных солевым раствором или мышиным IgG.
Пример 2
A. Приготовление моноклонального антитела анти-ICAM-I (R6,5)
Моноклональное антитело анти-ICAM-I R6.5 приготавливают как описано в Европейской патентной заявке N 289949, из гибридомной клеточной линии R6'506'E9'B2 (ATCC HB 9580).
B. Подготовка животных
Белым Новозеландским кроликам-самцам (Хэзелтон Рисерч, Денвер, США) весом от 2,0 до 4,0 кг, делали внутривенную инъекцию одного из следующих веществ:
1) стерильный солевой раствор (0,2 мл/кг) или
2) R6.5 (2,0 мг/кг)
R6,5 был растворен в стерильном солевом растворе. Через 0,5 часа кроликов примировали 20 μ г/кг липополисахарида (LPS) (Сигма, E.coli, LPS, серотип 0111: В4, лот 39F4030), посредством внутривенной инъекции в правую краевую ушную вену. Через 18 часов кроликов усыпляли внутримышечной инъекцией кетамина (50 мг/кг) и ксилазина (6 мг/кг) с последующей постоянной инфузией ксилазина (0,32 мг/кг/мин). Системное кровяное давление контролировалось по правой сонной артерии с помощью трансдуктора давления Гуда/Статхэма R23 10. Кролики, получившие вначале стерильный солевой раствор, затем получили вторую внутривенную инъекцию стерильного солевого раствора (0,2 мг/кг) в правую краевую ушную вену. Животным, получившим R6.5 в качестве примирующей дозы, вводили вторую внутривенную инъекцию R6.5 (2,0 мг/кг), разведенного в солевом растворе. Через 0,5 часа кроликам делали дополнительную внутривенную инъекцию LPS (400 мг/кг) и результаты наблюдали в течение 2 часов.
Образцы крови по 1,0 мл брали у кроликов через катетер из сонной артерии перед начальным введением стерильного солевого раствора или R6.5; перед второй инъекцией стерильного солевого раствора или R6.5; перед второй (дополнительной) инъекцией LPS; и через 30 мин, 1 час и 2 часа после второй инъекции LPS.
C. Результаты
Только один из 4 кроликов, обработанных солевым раствором, прожил в течение всей процедуры (см. чертеж). Все обработанные солевым раствором развили воспалительную реакцию (конъюнктивное истечение, слезотечение) после первой инъекции LPS. Два из этих обработанных солевым раствором кроликов погибли до второй инъекции LPS. Другие 2 обработанные солевым раствором кролика испытали сильную гипотонию и один из них погиб через 30 минут после второй инъекции LPS.
Все пять кроликов, обработанные R6.5, выжили до второй инъекции LPS. У обработанных R6.5 кроликов воспалительная реакция была заметно слабее после первоначального введения LPS. Четыре из пяти обработанных R6.5 кроликов выжили в течение всего эксперимента. Один из R6.5 обработанных кроликов издох через 30 минут после второй инъекции LPS. У выживших кроликов, обработанных R6.5, среднее артериальное давление понизилось лишь немного (16 ± 5 мм рт. ст.) в конце эксперимента.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФРАГМЕНТЫ АНТИТЕЛ В ТЕРАПИИ | 1994 |
|
RU2139092C1 |
| ГИБРИДОМА, ОБОЗНАЧЕННАЯ 199М, И МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СЕКРЕТИРОВАННОЕ ЭТОЙ ГИБРИДОМОЙ | 1997 |
|
RU2183671C2 |
| АНТИ-MIF АНТИТЕЛА | 2008 |
|
RU2509777C2 |
| АНТИТЕЛО VFF-18 И ЕГО АНАЛОГИ | 1995 |
|
RU2204606C2 |
| ПРИМЕНЕНИЕ ОДНОКРАТНОЙ ДОЗЫ CD20-СПЕЦИФИЧЕСКИХ СВЯЗЫВАЮЩИХ МОЛЕКУЛ | 2006 |
|
RU2421242C2 |
| ГУМАНИЗИРОВАННЫЙ ИММУНОГЛОБУЛИН, СПЕЦИФИЧНЫЙ ДЛЯ БЕЛКА L-СЕЛЕКТИНА ЧЕЛОВЕКА | 1993 |
|
RU2151612C1 |
| СПОСОБЫ И КОМПОЗИЦИИ, ПРИГОДНЫЕ ДЛЯ ИНГИБИРОВАНИЯ АНГИОГЕНЕЗА | 1995 |
|
RU2162712C2 |
| НОВЫЕ СИНЕРГИЧЕСКИЕ ЭФФЕКТЫ | 2009 |
|
RU2471499C2 |
| ВЫСОКОАФФИННЫЕ ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ АНГИОПОЭТИНУ-2 | 2010 |
|
RU2545399C2 |
| ПРИМЕНЕНИЕ ГЕПАРИНСВЯЗЫВАЮЩИХ АНТАГОНИСТОВ В ИНГИБИРОВАНИИ ВЫСВОБОЖДЕНИЯ БРАДИКИНИНА | 2000 |
|
RU2251433C2 |
Способ предназначен для лечения эндотоксинового шока путем введения терапевтически активного вещества. В качестве активного вещества пациенту вводят антиадгезивное антитело или его фрагмент. Указанное антитело выбирают из группы, состоящей из анти-СД18 антител и анти-ICAM-1 антител. При этом указанное анти-СД18 антитело предпочтительно является моноклональным R 15.7 антителом, а анти-ICAM-1 антитело - моноклональным R 6.5 антителом. Вводят антитело внутривенно в количестве от 0,1 мг/кг до 10 мг/кг. В качестве фрагмента активного вещества может быть использован фрагмент Fab или F(ab)2 антиадгезивного антитела. Способ прост, эффективен. 5 з.п. ф-лы, 1 ил.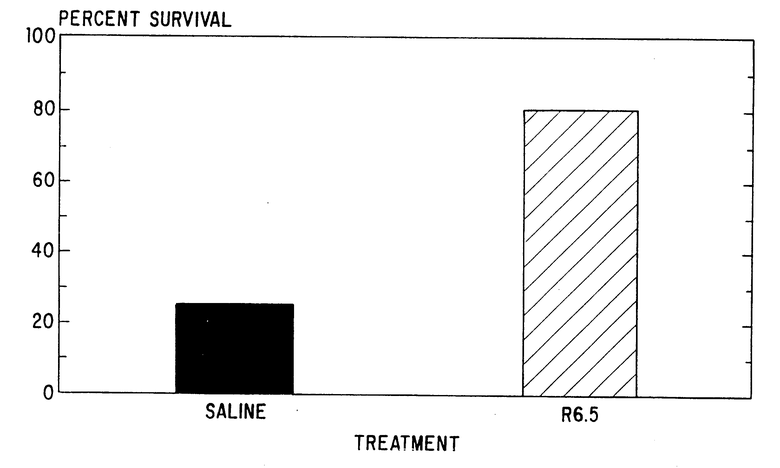
| US 4472420 A 18.09.84 | |||
| US 4388318 A 14.06.83 | |||
| US 4462431 A 18.09.84 | |||
| US 5176908 A 05.01.93 | |||
| US 5124147 A 23.06.92. |
Авторы
Даты
1998-12-27—Публикация
1991-08-30—Подача