Настоящее изобретение касается новых веществ из природных источников, которые полезны в качестве фармацевтических препаратов, ингибируют пролиферацию опухолевых клеток или вирусов и демонстрируют противоопухолевый или противовирусный эффект, способа получения этих соединений, их применений и клеток для продуцирования этих соединений.
Более подробно, настоящее изобретение касается продуктов культивирования клеточной линии, полученной из отпадающей плаценты (placenta deciduae) человека, обычно культивирования СD57-положительных, HLA.DR-сильно положительных природных клеток-супрессоров (NS) человека "клеточной линии СD57+HLА-DRbrightNS (ТТК-1)" (обозначаемая далее как "NS-клетки"), которые затем клонируют из клеток ТТК-1, способа производства продуктов культивирования, их применения и NS-клеток.
В области химиотерапии рака были исследованы клинические применения ряда метаболических продуктов микроорганизмов, таких как блеомицин и адриамицин, и эти продукты применяли практически на клинических стадиях.
Однако эти продукты не всегда удовлетворительно действуют на разные опухоли и клиническая применимость осложнилась, так как клинически были выявлены явления невосприимчивости опухолевых клеток к действию таких фармацевтических препаратов [см. рефераты 47th General Meeting of NIPPON GAN GAKKAI, стр.12-15 (1988)].
С другой стороны, выяснено, что материнская иммунная реакция на плод контролируется, главным образом, отпадающей плацентой (decidua), и большое количество клеточных групп, относящихся к большим гранулярным лимфоцитам (LGL) с NK-клеточным маркером, аккумулируется в слое отпадающей плаценты млекопитающих, включая человека, на начальной стадии беременности [Mori T. и др. , Immunomolecular mechanism in mammalian implantation. Endocrine J., 41 (отправл.):S17].
Признано, что NS-клетка, относящаяся к LGL, является клеточной группой, отличной от иммунной Т-клетки, В-клетки или макрофага, так как она обладает рецептором к WGA-лектину у мышей и маркером сахарной цепи CD57 у человека.
Описано, что NS-клетка обладает также функцией супрессии деления раковых клеток, благодаря своей функции сильно подавлять реакции деления лимфоцитов, такие как реакция деления лимфоцитов под действием МНС-нерестриктивного митогена или реакции смешанной культуры лимфоцитов (MLR) (Tilden и др., J.Immunol., 130, 1171).
Однако, что касается причинного фактора, управляющего иммуносупрессивным влиянием на эффект супрессии пролиферации раковых клеток NS-клеткой, описан белок семейства TGF-β и липидподобное вещество с молекулярной массой ниже 10000 (Clark и др., J.Immunol., 144, 3008, и Mortari и др., J.Immunol., 144, 3037), но точная структура или функция NS-клетки остается неясной до настоящего времени и требует выяснения.
Общеизвестные соединения, имеющие химическую структуру, похожую на соединение согласно изобретению, и оказывающие противоопухолевое и/или противовирусное действие, включают в себя фторурацил (Патенты США 2802005 и 2885396), доксифлуридин (doxifluridine) (Патент США 4071680), Тегафур (Tegafur) (Патент Великобритании 1168391), Зидовудин (Zidovudine), AZT (Патент Германии 3608606), Диданозин (Didanosine; ddl) (Европейская выложенная открытая публикация 206497) и им подобные.
Однако эти противоопухолевые агенты и противовирусные агенты типа нуклеиновых кислот не только эффективны в отношении опухолевых или вирусных клеток ограниченных видов, но также действуют на нормальные клетки человека, поэтому эти агенты обладают высокой токсичностью и становятся объектом беспокойства общественности.
Настоящее изобретение проводилось с учетом разработок подобных проблем в прототипах, и целью настоящего изобретения является поиск среди метаболитов клеток человека вещества, обладающего эффективностью против раковых образований, вирусов и им подобного, по отношению к которым общеизвестные противоопухолевые и противовирусные агенты демонстрируют лишь недостаточные эффекты, и обеспечение материала, который оказывает канцеростатическое действие на различные невосприимчивые раковые образования и противовирусное действие, а также пониженное побочное действие, благодаря чему не наносит вреда нормальным клеткам человека.
Для достижения цели заявители настоящего изобретения провели важнейшие исследования и в результате обнаружили, что NS-клеточная линия индуцирует апоптотическую гибель раковых клеток человека К562, Molt4, U937, BeWo, GCIY; подавляет цитокинез раковых клеток, а также обнаружили вещества типа нуклеиновых кислот (обозначены AIF), которые продуцируются этой клеточной линией и индуцируют смерть раковых клеток вследствие апоптоза, и разделили и очистили эти вещества для определения их структур. Заявители полагают, что эти вещества можно разрабатывать и применять в качестве канцеростатических агентов природного типа и противовирусных агентов, а также в качестве фармацевтического препарата, основанного на совершенно новой идее и имеющего меньшие побочные эффекты.
Заявители настоящего изобретения культивировали NS-клетку, обладающую способностью продуцировать соединение формулы (1) и полученную из отпадающей плаценты человека, собирали соединение формулы (1) из культуральной жидкости (супернатант и клетки, в особенности супернатант), превращали его, если необходимо, в фармацевтически приемлемую соль, получая соединение, представленное формулой (1)
где R1 представляет собой группу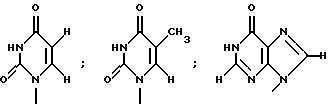
или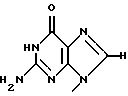
R2 представляет собой атом водорода, гидроксильную группу или метоксигруппу,
или его фармацевтически приемлемую соль, и обнаружили, что соединение формулы (1) или его фармацевтически приемлемая соль индуцирует смерть раковых клеток вследствие апоптоза, подавляет пролиферацию раковых клеток и демонстрирует противоопухолевый или противовирусный эффект. Таким образом, цель настоящего изобретения достигнута.
То есть настоящее изобретение касается противоопухолевого или противовирусного вещества, представленного описанной выше формулой (1), где R1 и R2 имеют такие значения, как определено выше, или его фармацевтически приемлемой соли, способа его получения, фармацевтического препарата, содержащего в качестве эффективного ингредиента противоопухолевое или противовирусное вещество, представленное описанной выше формулой (1), или его фармацевтически приемлемую соль, применения описанного выше соединения с целью приготовления фармацевтического препарата и терапии и СD57-положительной, HLA.DR-сильно положительной NS-клетки, выделенной из отпадающей плаценты человека.
Краткое описание чертежей
На фигуре 1 представлен ЯМР-спектр соединения Р1;
на фигуре 2 представлен ЯМР-спектр соединения Р2;
на фигуре 3 представлен ЯМР-спектр соединения Р3;
на фигуре 4 представлен ЯМР-спектр соединения Р4;
на фигуре 5 представлен ЯМР-спектр соединения Р5;
на фигуре 6 представлен ЯМР-спектр соединения Р6;
на фигуре 7 представлены УФ- и масс-спектры и структурная формула AIF (Р1);
на фигуре 8 представлены УФ- и масс-спектры и структурная формула AIF (P2);
на фигуре 9 представлены УФ- и масс-спектры и структурная формула AIF (Р3);
на фигуре 10 представлены УФ- и масс-спектры и структурная формула AIF (Р4);
на фигуре 11 представлены УФ- и масс-спектры и структурная формула AIF (P5);
на фигуре 12 представлены УФ- и масс-спектры и структурная формула AIF (P6);
на фигуре 13 представлена фазово-контрастная микрофотография NS-клеточной линии настоящего изобретения;
на фигуре 14 (A-G) представлены фотографии, которые показывают результат исследования фрагментации ДНК;
на фигуре 15 представлены графики, которые показывают результат непрямого совместного культивирования NS-клеток и клеток-мишеней;
на фигуре 16 (А, В) представлены графики, которые показывают супрессию включения 3H-тимидина в клетки-мишени посредством AIF из NS (ТТК-1) клеточного супернатанта (sup);
на фигуре 17 (А, В) представлены фотографии, которые показывают результат исследования фрагментации ДНК клеток-мишеней посредством AIF;
на фигуре 18 (А-С) представлены графики высокоэффективной жидкостной хроматографии AIF;
на фигуре 19 представлены графики, которые показывают супрессию включения 3H-тимидина;
на фигуре 20 (А-С) представлены фотографии, которые показывают результат исследования фрагментации ДНК клеток-мишеней посредством AIF;
на фигуре 21 (A-D) представлены фотографии, которые показывают результат исследования фрагментации ДНК клеток-мишеней посредством AIF;
на фигуре 22 представлен график, который демонстрирует эффект супрессии AIF на раковых клетках желудка человека;
на фигуре 23 представлены фотографии, которые показывают действие AIF на диссимиляцию раковой ткани желудка человека (А, В), и фотографии, которые показывают результат исследования фрагментации ДНК (С), и
на фигуре 24 представлен график, который демонстрирует супрессивное действие AIF на клетки Т-клеточного лейкоза человека.
Наилучший способ осуществления изобретения
Далее подробно описано настоящее изобретение. Прежде всего описаны использованные здесь разнообразные термины и определения.
Соединения формулы (1) получают путем физико-химического разделения и очистки апоптоз-индуцирующего фактора (AIF) в супернатанте культуры NS-клеточной линии и представляют формулой (1)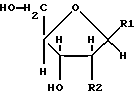
где R1 представляет собой группу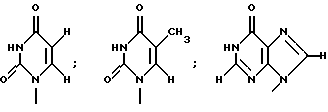
или
R2 представляет собой атом водорода, гидроксильную группу или метоксигруппу, эти соединения обозначают как P1, P2, Р3, Р4, Р5 и Р6, соответственно активным фракциям, полученным способом высокоэффективной жидкостной хроматографии с обращенной фазой.
Термины "Р1, Р2, Р3, Р4, Р5 и Р6" здесь обозначают конкретно 2'-дезоксиуридин, риботимидин, 2'-O-метилуридин, тимидин, 2'-O-метилинозин и 2'-O-метилгуанозин соответственно.
То есть это соединение формулы (1) является Р1, если R1 и R2 представляют собой
и атом водорода соответственно;
является Р2, если R1 и R2 представляют собой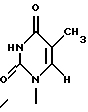
и гидроксил соответственно;
является Р3, если R1 и R2 представляют собой
и метоксигруппу соответственно;
является Р4, если R1 и R2 представляют собой
и атом водорода соответственно;
является Р5, если R1 и R2 представляют собой
и метоксигруппу соответственно, и
является Р6, если R1 и R2 представляют собой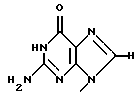
и метоксигруппу соответственно.
Далее перечислены физико-химические характеристики типичных соединений настоящего изобретения.
а) Физико-химические характеристики Р1:
природа - бесцветный кристалл;
молекулярная формула С9Н12N2О5;
т.пл. 165oС;
масс-спектр: FAB-MS (масс-спектрометрия с бомбардировкой быстрыми электронами) высокого разрешения, m/z 229 [М+1];
УФ-спектр: λ [H2O (pH 7,2), max 258,5 нм];
спектр ЯМР 1Н (300 МГц, CDCl3, δ, м.д.): спектр ЯМР для Р1 показан на фигуре 1;
растворимость: растворим в органических растворителях, таких как метанол и диметилсульфоксид, и в воде;
дискриминирование из кислых, нейтральных и основных веществ: основное вещество;
тонкослойная хроматография (Merck, Kieselgel 60F254), значение Rf 0,64 [проявляющий растворитель: смесь хлороформ/метанол/вода=60:40:8];
высокоэффективная жидкостная хроматография:
колонка: TSK gel ODS-80TM, 4,6х150 мм (Tosoh);
подвижная фаза: водная система, содержащая 0,1% трифторуксусной кислоты, с градиентом ацетонитрила, содержащего 0,1% трифторуксусной кислоты, 5%/360 мин;
скорость потока 0,5 мл/мин;
детектирование: УФ 214 нм;
время удерживания 20 мин.
б) Физико-химические характеристики Р2:
природа - бесцветный кристалл;
молекулярная формула С10Н14N2О6;
т.пл. 183-185oС;
масс-спектр: FAB-MS (масс-спектрометрия с бомбардировкой быстрыми электронами) высокого разрешения, m/z 259 [М+1];
УФ-спектр: λ [Н2О (pH 7,2), max 267 нм];
спектр ЯМР 1Н (300 МГц, CDCl3, δ, м.д.): спектр ЯМР для Р2 показан на фигуре 2;
растворимость: растворим в органических растворителях, таких как метанол и диметилсульфоксид, и в воде;
дискриминирование из кислых, нейтральных и основных веществ: основное вещество;
тонкослойная хроматография (Merck, Kieselgel 60F254), значение Rf 0,66 [проявляющий растворитель: смесь хлороформ/метанол/вода=60:40:8];
высокоэффективная жидкостная хроматография:
колонка: TSK gel ODS-80TM, 4,6х150 мм (Toso);
подвижная фаза: водная система, содержащая 0,1% трифторуксусной кислоты, с градиентом ацетонитрила, содержащего 0,1% трифторуксусной кислоты, 5%/360 мин;
скорость потока 0,5 мл/мин;
детектирование: УФ 214 нм;
время удерживания 29 мин.
в) Физико-химические характеристики Р3:
природа - бесцветный кристалл;
молекулярная формула С10Н14N2О6;
т.пл. 159oС;
масс-спектр: FAB-MS (масс-спектрометрия с бомбардировкой быстрыми электронами) высокого разрешения, m/z 259 [М+1];
УФ-спектр: λ [H2O (рН 7,2), max 263 нм];
спектр ЯМР 1Н (300 МГц, CDCl3, δ, м.д.): спектр ЯМР для Р3 показан на фигуре 3;
растворимость: растворим в органических растворителях, таких как метанол и диметилсульфоксид, и в воде;
дискриминирование из кислых, нейтральных и основных веществ: основное вещество;
тонкослойная хроматография (Merck, Kieselgel 60F254), значение Rf 0,72 [проявляющий растворитель: смесь хлороформ/метанол/вода=60:40:8];
высокоэффективная жидкостная хроматография:
колонка: TSK gel ODS-80TM, 4,6х150 мм (Toso);
подвижная фаза: водная система, содержащая 0,1% трифторуксусной кислоты, с градиентом ацетонитрила, содержащего 0,1% трифторуксусной кислоты, 5%/360 мин;
скорость потока 0,5 мл/мин;
детектирование: УФ 214 нм;
время удерживания 40 мин.
г) Физико-химические характеристики Р4:
природа - бесцветный кристалл;
молекулярная формула C10H14N2O5;
т.пл. 185oС;
масс-спектр: FAB-MS (масс-спектрометрия с бомбардировкой быстрыми электронами) высокого разрешения, m/z 243 [М+1];
УФ-спектр: λ [H2O (pH 7,2), max 267 нм];
спектр ЯМР 1Н (300 МГц, СDСl3, δ, м.д.): спектр ЯМР для Р4 показан на фигуре 4;
растворимость: растворим в органических растворителях, таких как метанол и диметилсульфоксид, и в воде;
дискриминирование из кислых, нейтральных и основных веществ: основное вещество;
тонкослойная хроматография (Merck, Kieselgel 60F254), значение Rf 0,69 [проявляющий растворитель: смесь хлороформ/метанол/вода=60:40:8];
высокоэффективная жидкостная хроматография:
колонка: TSK gel ODS-80TM, 4,6х150 мм (Toso);
подвижная фаза: водная система, содержащая 0,1% трифторуксусной кислоты, с градиентом ацетонитрила, содержащего 0,1% трифторуксусной кислоты, 5%/360 мин;
скорость потока 0,5 мл/мин;
детектирование: УФ 214 нм;
время удерживания 50 мин.
д) Физико-химические характеристики Р5:
природа - бесцветный кристалл;
молекулярная формула C11H14N4O5;
т.пл. 210-212oС;
масс-спектр: FAB-MS (масс-спектрометрия с бомбардировкой быстрыми электронами) высокого разрешения, m/z 283 [М+1];
УФ-спектр: λ [Н2О (рН 7,2), max 283 нм];
спектр ЯМР 1Н (300 МГц, CDCl3, δ, м.д.): спектр ЯМР для Р5 показан на фигуре 5;
растворимость: растворим в органических растворителях, таких как метанол и диметилсульфоксид, и в воде;
дискриминирование из кислых, нейтральных и основных веществ: основное вещество;
тонкослойная хроматография (Merck, Kieselgel 60F254), значение Rf 0,67 [проявляющий растворитель: смесь хлороформ/метанол/вода=60:40:8];
высокоэффективная жидкостная хроматография:
колонка: TSK gel ODS-80TM, 4,6•150 мм (Toso);
подвижная фаза: водная система, содержащая 0,1% трифторуксусной кислоты, с градиентом ацетонитрила, содержащего 0,1% трифторуксусной кислоты, 5%/360 мин;
скорость потока 0,5 мл/мин;
детектирование: УФ 214 нм;
время удерживания 64 мин.
е) Физико-химические характеристики Р6:
природа - бесцветный кристалл;
молекулярная формула C11H15N5O5;
т.пл. 218-220oС;
масс-спектр: FAB-MS (масс-спектрометрия с бомбардировкой быстрыми электронами) высокого разрешения, m/z 298 [М+1];
УФ-спектр: λ [Н2О (рН 11, рН 1), max 258 нм при рН 11, 256 нм при рН 1];
спектр ЯМР 1Н (300 МГц, CDCl3, δ, м.д.): спектр ЯМР для Р6 показан на фигуре 6;
растворимость: растворим в органических растворителях, таких как метанол и диметилсульфоксид, и в воде;
дискриминирование из кислых, нейтральных и основных веществ: основное вещество;
тонкослойная хроматография (Merck, Kieselgel 60F254), значение Rf 0,59 [проявляющий растворитель: смесь хлороформ/метанол/вода=60:40:8];
высокоэффективная жидкостная хроматография:
колонка: TSK gel ODS-80TM, 4,6х150 мм (Toso);
подвижная фаза: водная система, содержащая 0,1% трифторуксусной кислоты, с градиентом ацетонитрила, содержащего 0,1% трифторуксусной кислоты, 5%/360 мин;
скорость потока 0,5 мл/мин;
детектирование: УФ 214 нм;
время удерживания 83 мин.
Далее перечислены цитологические свойства клеточной линии настоящего изобретения:
1) морфология клетки: большой гранулярный лимфоцит;
2) происхождение клетки: клетка ткани отпадающей плаценты, производное из плаценты человека при 7-недельной беременности;
3) субкультура: способна к постоянной пролиферации;
4) необходимое условие фактора роста: способен к пролиферации в среде, не имеющей фактора роста нормальных клеток эндометрия человека или гепарина;
5) сохранение клеток, условия пролиферации, зависимость пролиферации: данная клеточная линия обычно сохраняется и удовлетворительно пролиферирует при температуре 36-38oС, предпочтительно при 37oС, и при рН 6,5-7, предпочтительно 7,0;
6) способность пролиферации клетки: если культивируют 2•105/мл данных клеток при описанных выше условиях, через 3 дня плотность клеток достигает, по крайней мере, 5•105/мл;
7) функция: это не интерстициальная клетка отпадающей плаценты, так как отсутствуют рецепторы эстрогена и прогес-терона. Она продуцирует функциональные вещества типа нуклеиновых кислот и подавляет тем самым деление лимфоцитов вследствие реакции смешанной культуры лимфоцитов (MLR) или митогенного раздражения;
8) форма колонии: образует колонию на чашке Петри, но не в мягком агаре;
9) хранение при замораживании: можно хранить очень долго при температуре от -70 до -196oС;
10) природа хромосомы: метацентрическая;
11) конфигурация по данным хромосомного анализа: клетка, производная из ткани человека;
12) число хромосом 99-100, 107-108;
13) клеточный поверхностный маркер: это клетка иммунной системы, так как является СD57-положительной и HLA.DR-сильно положительной;
14) питательная среда для сохранения и пролиферации: удовлетворительно сохраняется и пролиферирует в среде 10% FCS+RPMI-1640 или среде, не содержащей сыворотки, из которой удален тимидин.
Клеточный штамм настоящего изобретения можно получить, применяя, например, следующий способ. То есть клетку отпадающей плаценты человека можно получить, например, способом, описанным в J.Clin.Invest., 52, 2745-2756 (1973). Кратко излагая этот способ, клетку можно получить, беря образец эндометрия или отпадающей плаценты человека, как можно более асептическим способом (можно использовать любую ткань, убедившись, что эта ткань внутриматочная, а образцы отпадающей плаценты человека предпочтительны вследствие их легкой доступности), промывая его перед обработкой трипсином для отделения клеток от соединительной ткани.
Используемая в настоящем изобретении клетка может быть любой клеткой, при гарантии, что она является CD57-положительной, HLA.DR-сильно положительной, происходит из отпадающей плаценты человека и обладает способностью продуцировать вещество формулы (1), но предпочтительно она представляет собой NS-клетку или штамм ее клона, или штамм субклона. Этот клеточный штамм (NS) можно получить обычным способом, путем дериватизации в выбранный клонирующий штамм.
Например, можно получить штамм клона, обладающий более высокой способностью продуцирования вещества формулы (1), контролируя обычным способом количество вещества формулы (1), полученное клонированием NS-клетки. Конкретно, 1•105 клеток ТТК-1 предварительно несколько раз культивируют, применяя для анализа способ ограничительного разбавления (limiting dilution analysis), при 37oС в присутствии 5% газообразного диоксида углерода, так, чтобы число клеток составляло 0-1 на ячейку, и таким образом отбирают клеточный клон, обладающий более высокой способностью продуцирования соединения формулы (1).
В связи с этим клеточная линия настоящего изобретения внесена в National Institute of Bioscience и Human-Technology, Agency of Industrial Science и Technology (1-3, Higashi 1-chome, Tsukuba-Shi, Ibaraki-Ken, Japan) с входящим номером FERM BP6350 (дата первоначального вложения: 19 мая 1997) (перенесено из FERM P-16233 японского вложения (дата переноса: 13 мая 1998)).
На фигуре 13 показана также фазово-контрастная микрофотография (400х) NS-клеточного штамма настоящего изобретения. NS-клеточный штамм прилипает к субстрату культуры посредством самопроизвольно выделяющегося ламинина и образует морфологию LGL-клеточного штамма.
Далее здесь описан способ получения соединений настоящего изобретения.
Соединения настоящего изобретения можно получить, внося клетки, производные из отпадающей плаценты человека (обычно NS-клетки), в питательную среду, содержащую питательное вещество, аэробно культивируя эти клетки в СО2-инкубаторе, собирая соединения настоящего изобретения, представленные формулой (1), из культуральной жидкости (супернатант и клетки, предпочтительно, супернатант) и необязательно превращая эти соединения в фармацевтически приемлемые соли.
Полученные таким образом NS-клетки, производные из отпадающей плаценты человека, обычно можно культивировать в среде, используемой для культивирования животных клеток, содержащей, если необходимо, добавленную туда сыворотку, и, конкретно, в обычной среде для культивирования клеток, содержащей 20% эмбриональной бычьей сыворотки.
В качестве среды для культивирования клеток можно упомянуть любую среду, способную поддерживать клетки в культуре, такую как среда ВМЕ, среда MEM (Earle. Dulbecco, High-GEM), среда Ham (F-10, F-12), среда ISKOF, среда 119, среда L-15, среда МсСоу 5A, среда NCTC135, среда Williams E, среда Waymouth, среди которых особо предпочтительна среда RPMI-1640.
Культивирование можно осуществлять таким же способом, как при производстве метаболита обычной клеточной линии, можно использовать как твердую, так и жидкую культуру. В случае жидкой культуры можно применять любые способы культивирования, включая стационарное культивирование, культивирование с перемешиванием, культивирование с применением встряхивания и культивирование с аэрацией, среди которых предпочтительны культивирование с применением встряхивания и культивирование с глубокой аэрацией-перемешиванием. При культивировании клеток указанная выше среда преимущественно содержит несколько процентов (конкретно около 5%) газообразного диоксида углерода.
Такая среда имеет рН 6-8, подходящими являются значения около нейтрального. Культивирование можно проводить при 30-40oС, предпочтительно около 37oС. Время культивирования зависит от использованной среды, рН, температуры и других условий, но клетки можно субкультивировать, обычно через 4-5 дней культивирования.
Для получения из этой культуры нужного вещества формулы (1) используют подходящим образом способы выделения, используемые обычно для сбора произведенного микроорганизмом метаболита из культуры.
Полученное таким способом соединение формулы (1) можно чистить известными методами разделения-очистки, такими как метод экстракции растворителем, метод с использованием ионообменной смолы, метод абсорбционной или распределительной хроматографии и метод гель-фильтрации, каждый в отдельности или в комбинации.
Для экстракции и очистки можно подходящим образом применять обычные способы разделения, такие как высокоэффективная жидкостная хроматография с обращенной фазой и тонкослойная хроматография. Высокой степени очистки можно достичь, например, посредством колоночной хроматографии на силикагеле, ионообменной хроматографии, аффинной хроматографии и высокоэффективной жидкостной хроматографии с обращенной фазой, особенно в комбинации.
Как описано здесь далее (в параграфе "подтверждение применимости изобретения"), предполагается применять соединения настоящего изобретения в качестве фармацевтических препаратов, таких как терапевтический агент для лечения опухолевых и вирусных заболеваний у млекопитающих, включая человека.
В этой связи фармакологическое действие in vivo могут оказывать соединения настоящего изобретения в фосфорилированной форме, и нет необходимости говорить, что такие фосфорилированные соединения также включены в область данного изобретения.
Подходящие опухоли, на которые, как предполагается, соединения настоящего изобретения оказывают терапевтическое действие, включают в себя, например, не только рак крови у человека, но также и эпителиальный рак, включая раковые заболевания пищеварительной системы, такие как рак желудка или толстой кишки, раковые заболевания дыхательной системы, такие как рак легких или подобное, раковые заболевания половых органов, такие как рак яичников или хориокарцинома.
Подходящие вирусы, на которые, как предполагается, соединения настоящего изобретения оказывают терапевтическое действие, включают в себя, например, такие типы ретровирусов человека, как вирус Т-клеточного лейкоза человека (HTLV), вирус иммунодефицита человека, ВИЧ (HIV) и подобные.
Вещества формулы (1) настоящего изобретения, если они применяются в качестве противоопухолевого или противовирусного агента, можно также применять в виде их фармацевтически приемлемых солей.
Нетоксические соли соединений настоящего изобретения, представленных формулой (1), включают в себя, например, соли с неорганическими кислотами, такими как соляная кислота, азотная кислота, серная кислота или фосфорная кислота, соли с органическими кислотами, такими как уксусная кислота, лимонная кислота или винная кислота, соли с органическими сульфоновыми кислотами, такими как метансульфоновая кислота или пара-толуолсульфоновая кислота, или соли с аминокислотами, такими как аспарагиновая кислота, глутаминовая кислота или лизин.
Фармацевтически приемлемые соли соединений настоящего изобретения можно получить, комбинируя подходящим образом общеизвестные способы, применяемые в практике органической синтетической химии. Конкретно, можно упомянуть способ нейтрализационного титрования раствора свободного соединения настоящего изобретения посредством кислотного раствора.
Если соединения настоящего изобретения применяют как противоопухолевый или противовирусный агент, то в качестве дозированных форм можно выбрать разные формы, которые включают в себя, например, препараты для перорального применения, такие как таблетка, капсула, порошок, гранула и жидкость, и стерильные жидкие препараты для парентерального применения, такие как раствор или суспензия. Препарат настоящего изобретения включает в себя в качестве эффективного ингредиента одно или более соединений настоящего изобретения и, если необходимо, может включать в себя различные общеизвестные добавки, такие как носитель, разбавитель или наполнитель (фармацевтическая композиция).
Твердые препараты можно приготовить непосредственно в виде таблетки, капсулы, гранулы или порошка, а также можно приготовить с использованием подходящих добавок.
Эти добавки включают в себя, например, сахара, такие как лактоза и глюкоза, крахмалы, такие как кукурузный, пшеничный и рисовый крахмал, жирные кислоты, такие как стеариновая кислота, неорганические соли, такие как метасиликат натрия, алюминат магния и безводный фосфат кальция, синтетические полимеры, такие как поливинилпирролидон и полиалкиленгликоль, соли жирных кислот, такие как стеарат кальция и стеарат магния, спирты, такие как стеариловый спирт и бензиловый спирт, синтетические производные целлюлозы, такие как метилцеллюлоза, карбоксиметилцеллюлоза, этилцеллюлоза и гидроксипропилметилцеллюлоза, а также обычные добавки, такие как вода, желатин, тальк, растительные масла, гуммиарабик и им подобное.
Твердые препараты, такие как таблетка, капсула, гранула или порошок, обычно могут содержать эффективный ингредиент в количестве 0,1-100% по весу, предпочтительно 5-100% по весу.
Жидкие препараты можно приготовить в виде суспензии, сиропа, препарата для инъекций или подобного с применением воды, спиртов или обычных добавок, подходящих для жидких препаратов, например масел, производных растительных масел, таких как соевое масло, арахисовое масло или кунжутное масло.
Конкретно, растворители, подходящие для парентеральных дозированных препаратов в виде препарата для внутримышечных, внутривенных, подкожных или внутриопухолевых инъекций, включают в себя, например, дистиллированную воду для инъекций, водный раствор лидокаина гидрохлорида (для внутримышечных инъекций), физиологический раствор, водный раствор глюкозы, этанол, жидкости для внутривенных инъекций, такие как водный раствор лимонной кислоты или цитрата натрия, растворы электролитов, такие как растворы для внутривенных капельниц или внутривенных инъекций или их смешанные растворы.
Такие препараты для инъекций можно также приготовить в виде порошка или препарата, содержащего добавленные к нему подходящие добавки, который образует раствор для такого же применения, как и предварительно растворенные формы. Эти препараты для инъекций обычно могут содержать эффективный ингредиент в количестве 0,1-10% по весу, предпочтительно 1-5% по весу.
Жидкие препараты для перорального применения, такие как суспензия или сироп, могут содержать эффективный ингредиент в количестве 0,5-10% по весу.
Препарат настоящего изобретения может включать в себя один или более соединений настоящего изобретения в качестве эффективных ингредиентов, а примерами эффективных ингредиентов предпочтительно являются типичные соединения настоящего изобретения Р1-Р6, более предпочтительно - комбинации от двух до шести этих соединений.
Практически предпочтительную дозу соединения настоящего изобретения можно менять подходящим образом, в зависимости от типов использованных соединений, типов включенных композиций, частоты приема дозы, подвергающихся лечению нарушений и тяжести состояния пациентов.
Например, доза для взрослого человека составляет 10-500 мг/день в случае перорального приема и 10-100 мг/день в случае парентерального приема, предпочтительно при внутривенной инъекции. В этой связи частота приема дозы меняется, в зависимости от способа введения и состояния, но соединение можно принимать один раз единой дозой или частями, за два-пять приемов.
Подтверждение применимости данного изобретения
[Краткое изложение]
Штамм СD57-положительных, HLA. DR-сильно положительных природных клеток-супрессоров (NS), полученных из ткани отпадающей плаценты (placenta deciduae) человека, вызывает апоптоз раковых клеток человека, таких как К562, Molt4, U937, GCIY и BeWo, и подавляет пролиферацию таких клеток. Фактор, вызывающий апоптоз (AIF), продуцируется и выделяется в супернатант культуры NS-клеточной линии. Таким образом, продуцируемый NS-клетками AIF отделяют и чистят физико-химическими методами. Активность AIF измеряют способностью включения 3H-тимидина в клетки и методом фрагментации ДНК. Прежде всего, супернатант культуры NS-клеточной линии адсорбируют на колонке С18 и элюируют для разделения AIF. Сырой экстракт проявляют на пластине для тонкослойной хроматографии (ТСХ) и активные фракции разделяют и чистят методом высокоэффективной жидкостной хроматографии с обращенной фазой (ВЭЖХ).
Компоненты (Р1-Р6), производные пиков, полученных методом ВЭЖХ, вызывают гибель клеток и подавляют пролиферацию раковых клеток К562, Molt4, U937, GCIY и BeWo, но не наносят вреда нормальным клеткам WI-38, производным легкого плода человека. Физические и химические характеристики этих шести веществ AIF предполагают, что эти шесть AIF являются нуклеиновыми кислотами или их производными. Действительно, структурный анализ этих веществ методом масс-спектрометрии с бомбардировкой быстрыми электронами (FAB-MS) и ЯМР показывает, что Р1 является 2'-дезоксиуридином, Р2 - риботимидином, Р3 - 2'-O-мeтилypидинoм, Р4 - тимидином, Р5 - 2'-O-метилинозином и Р6 - 2'-O-метилгуанозином. Также значительный дегенеративный эффект в отношении опухолей наблюдают в эксперименте на животных, с мышами, имеющими трансплантированную им ткань рака человека, которым вводят эти шесть соединений AIF.
[Подтверждающий тест]
Окончательно разделенные и полученные методом ВЭЖХ соединения AIF добавляют к раковым клеткам-мишеням для проверки in vitro способности индуцировать апоптоз (эксперимент in vitro) и терапевтических эффектов соединений AIF на мышах SCID, имеющих инокулированные им раковые клетки (эксперимент на животных).
[I] Эксперимент in vitro
Далее для иллюстрации применимости настоящего изобретения измеряют взаимодействие между NS-клеточной линией (как типичным представителем настоящего изобретения) и типичной клеткой из различных раковых клеток человека в качестве клетки-мишени, измеряют непосредственно или непрямо при совместном их культивировании. Ниже показаны использованные клетки:
(1) S-клеточная линия (ТТК-1) (клеточная линия, производная из отпадающей плаценты человека), это клетка, образованная как штамм путем культивирования клетки ткани отпадающей плаценты человека при 7-недельной беременности, которая является СD57-положительной, HLA.DR-сильно положительной природной иммуносупрессивной клеткой, производной костно-лимфатической ткани;
(2) Molt4 (клеточная линия лейкоза Т-клеток человека);
(3) К562 (клеточная линия лейкоза эритробластов человека);
(4) U937 (клеточная линия лейкоза гистиоцитов человека);
(5) GCIY (клеточная линия карциномы желудка человека);
(6) BeWo (клеточная линия хориокарциномы человека);
(7) WI-38 (клеточная линия нормальных фибробластов, производных ткани легкого плода человека).
Перечисленные выше клетки представляют собой клетки, полученные при субкультивировании в среде 10% FCS + RPMI-1640 или среде, не содержащей сыворотки, из которой удален тимидин, в инкубаторе при 37oС под 5% СО2.
Экспериментальный пример 1
Исследование прямого совместного культивирования NS-клеточной линии и клеток-мишеней Molt4/K562/U937/GCIY/ BeWo/WI-38 (прямая реакция)
Исследование прямого совместного культивирования: используют NS, Molt4 (клеточную линию лейкоза Т-клеток человека), К562 (клеточную линию лейкоза эритробластов человека), U937 (клеточную линию лейкоза гистиоцитов человека), GCIY (клеточную линию карциномы желудка человека), BeWo (клеточную линию хориокарциномы человека), WI-38 (клеточную линию нормальных фибробластов, производных ткани легкого плода человека), NS (104, 105, 106) и Molt4/K562/U937/GCIY/BeWo/WI-38 (106) клеток совместно культивируют в 2 мл питательной среды в 24-луночном планшете в течение 24-48 часов.
В результате прямого взаимодействия (совместное культивирование) между NS-клеточной линией и клетками-мишенями через 24 часа экстрагируют ДНК клетки и подвергают электрофорезу на 2% агарозном геле.
В итоге, как показано на фигуре 14А, полосы 1, 2 и 3 представляют собой результаты совместного культивирования с 104, 105 и 106 NS-клеток на ячейку соответственно и 106 Molt4 нa ячейку, и степень фрагментации ДНК в клетке-мишени увеличивается, в зависимости от количества инокулированных NS-клеток.
С другой стороны, полоса 4 представляет собой результат культивирования только с 106 NS-клеток на ячейку, а полоса 5 представляет собой результат культивирования только с 106 Molt4 нa ячейку. В этих случаях не наблюдают фрагментации ДНК. Полоса М является маркером, который показывает размеры ДНК.
Как показано на фигуре 14В, полосы 1, 2 и 3 представляют собой результаты совместного культивирования с 104, 105 и 106 NS-клеток на ячейку , соответственно и 106 К562 на ячейку, и степень фрагментации ДНК в клетке-мишени увеличивается, в зависимости от количества инокулированных NS-клеток.
С другой стороны, полоса 4 представляет собой результат культивирования только с 106 К562 на ячейку, а полоса 5 представляет собой результат культивирования только с 106NS-клеток на ячейку. В этих случаях не наблюдают фрагментации ДНК.
Как показано на фигуре 14С, полосы 1, 2 и 3 представляют собой результаты совместного культивирования с 106, 105 и 104 К562-клеток на ячейку и Molt4 соответственно, полоса 4 представляет собой результат культивирования только с 106 Molt на ячейку, а полоса 5 представляет собой результат культивирования только с 106 К562 на ячейку. Ни в одном случае не индуцируется фрагментация ДНК.
Как показано на фигуре 14D, полосы 1, 2 и 3 представляют собой результаты совместного культивирования с 104, 105 и 106 NS-клеток на ячейку соответственно и 106 BeWo на ячейку, и степень фрагментации ДНК в клетке-мишени увеличивается, в зависимости от количества инокулированных NS-клеток. С другой стороны, полоса 4 представляет собой результат культивирования только с 106 NS-клеток на ячейку, а полоса 5 представляет собой результат культивирования только с 106 BeWo на ячейку, полоса 6 представляет собой результат совместного культивирования с 106 BeWo на ячейку и 106 GCIY на ячейку, а полоса 7 представляет собой результат культивирования только с 106 GCIY на ячейку. Ни в одном из случаев не наблюдают фрагментации ДНК.
Как показано на фигуре 14Е, полосы 1, 2, 3 и 4 представляют
собой результаты совместного культивирования с 103, 104, 105 и 106 NS-клеток на ячейку соответственно и 106 U937 на ячейку, и степень фрагментации ДНК в клетке-мишени увеличивается, в зависимости от количества инокулированных NS-клеток.
С другой стороны, полоса 7 представляет собой результат совместного культивирования с 106 Molt4 на ячейку и 106 U937 на ячейку, полоса 8 представляет собой результат культивирования только с 106 Molt4 нa ячейку, полоса 6 - только с 106 U937 на ячейку, а полоса 5 - с 106 NS-клеток на ячейку. Ни в одном из этих случаев не индуцируется фрагментация ДНК.
Как показано на фигуре 14F, полосы 1, 2 и 3 представляют собой результаты совместного культивирования с 104, 105 и 106 NS-клеток на ячейку соответственно и 106 GCIY на ячейку, и степень фрагментации ДНК в клетке-мишени увеличивается, в зависимости от количества инокулированных NS-клеток.
С другой стороны, полоса 4 представляет собой результат культивирования только с 106 GCIY на ячейку, а полоса 5 представляет собой результат культивирования только с 106 NS на ячейку. Ни в одном из этих случаев не наблюдали фрагментации ДНК.
Как показано на фигуре 14G, полосы 1, 2 и 3 представляют собой результат совместного культивирования с 104, 105 и 106 NS-клеток на ячейку соответственно и 106 WI-38 на ячейку, и в клетках-мишенях не наблюдают фрагментации, независимо от увеличения количества NS-клеток. Полоса 4 представляет собой результат культивирования только с 106 WI-38 на ячейку, а полоса 5 представляет собой результат культивирования только с 106 NS на ячейку. Ни в одном из этих случаев не индуцируется фрагментация ДНК.
То есть взаимодействие (совместное культивирование) между NS-клетками и клетками Molt4, К562, BeWo, U937 и GCIY дает фрагментацию ДНК клеток-мишеней через 24 часа, и степень фрагментации ДНК зависит от увеличения количества NS-клеток.
С другой стороны, фрагментация ДНК не индуцируется ни в одном из случаев совместного культивирования клеток К562 и Molt4, клеток Molt4 и U937, клеток BeWo и GCIY. Также не наблюдают фрагментации ДНК при совместном культивировании NS-клеток и нормальных клеток WI-38. Это указывает на то, что NS-клеточная линия не наносит вреда нормальным клеткам человека. Действительно, можно сказать, что NS-клеточная линия вызывает гибель раковых клеток человека вследствие специфического апоптоза (фрагментации ДНК).
Экспериментальный пример 2
Непрямое взаимодействие (непрямое совместное культивирование), в котором NS-клетку и клетки-мишени К562/Molt4 помещают в камеру
Исследование непрямого совместного культивирования. Камеру для культивирования, предназначенную для реакции между клетками и имеющую дно в виде фильтра (диаметр 0,45 мкм), вставляют в ячейку и добавляют клетки Molt4/К562 (104).
После культивирования в течение 3 дней при 37oС под 5% СO2 собирают клетки-мишени и подвергают их радиоизотопному исследованию на включение 3H-тимидина, исследованию с окрашиванием при включении красителя трипанового синего и исследованию методом фрагментации ДНК для определения взаимодействия между клетками.
В этой системе количество раковых клеток-мишеней в камере снижается вместе с увеличением количества NS-клеток через 72 часа (фигура 15).
Этот экспериментальный результат показывает, что NS-клетка продуцирует низкомолекулярное растворимое соединение, которое проникает через мембрану миллипорового фильтра в камеру и вызывает гибель раковых клеток-мишеней.
Экспериментальный пример 3
Исследование, подтверждающее супрессию включения 3H-тимидина в клетку-мишень и фрагментацию ДНК посредством AIF, грубо экстрагированного методом тонкослойной хроматографии (ТСХ)
Образец, лиофилизованный из 50 мл супернатанта культуры NS-клеточной линии, подвергают хроматографированию на колонке C18 (BONDELUTE) и удержанную в колонке фракцию отделяют, элюируют ацетонитрилом и метанолом и концентрируют до сухости посредством выпаривания растворителей при помощи газообразного азота. Удержанная в колонке фракция подавляет пролиферацию клеток K562/Molt4 и индуцирует фрагментацию ДНК.
Далее эту фракцию проявляют методом ТСХ. То есть раствор отделенных на колонке С18 соединений в смеси хлороформ: метанол (1:1) наносят в виде пятна на тонкий слой и проявляют смесью хлороформ:метанол:дистиллированная вода (60: 40: 8). После проявления пластину делят на две фракции: расположенную ниже полосы (Rf 0,5) реагента фенолового красного, содержащегося в среде (Rf<0,5, TCX-A), и расположенную выше этой полосы (Rf>0,5, TCX-B), и гель с каждой из фракций соскребают и экстрагируют смесью хлороформ/метанол, высушивая экстракт при помощи газообразного азота. Во фракции (U), расположенной выше фенолового красного (Rf 0,5), обнаруживают присутствие соединения, которое подавляет пролиферацию клеток K562/Molt4 (фигура 16А-В) и индуцирует фрагментацию ДНК (фигура 17А-В).
В качестве контроля в используемой свежей среде или в супернатанте культуры клеток-мишеней K562/Molt4 не обнаруживают продуцирования соединения, которое подавляет пролиферацию клеток-мишеней или индуцирует фрагментацию ДНК. Таким образом подтверждают, что вещество (AIF), которое индуцирует апоптоз (гибель клеток) раковых клеток человека, продуцируется в супернатанте культуры NS-клеточной линии, и что AIF обнаруживают во фракции, которая движется на ТСХ быстрее, чем феноловый красный (Rf фенолового красного 0,5).
Экспериментальный пример 4
Исследование супрессии включения 3H-тимидина в клетку-мишень Molt4 соединением AIF, окончательно выделенным и очищенным методом высокоэффективной жидкостной хроматографии (ВЭЖХ)
Активную фракцию В на ТСХ отделяют и чистят на колонке ODS-80TM (Tosoh), элюируя ацетонитрилом, содержащим 0,1% трифторуксусной кислоты, с градиентом 0-5%/360 мин при скорости потока 0,5 мл/мин, осуществляя контроль оптической плотности (OD) при 214 нм.
Все образцы, полученные из шести основных пиков (1-6) (фигура 18А, ВЭЖХ-диаграмма), подавляют включение 3H-тими-дина в клетку Molt4. В частности, образцы из пиков 1 и 4 демонстрируют сильную активность и также сильную активность демонстрирует смешанный образец разбавлений 1/10 этих пиков (0,7 мкг/мл) (фигура 19).
Как показано в колонке М, проявляется синергический эффект этих пиков (AIF).
Экспериментальный пример 5
Критическое количество AIF, которое способно индуцировать фрагментацию ДНК клетки Molt4
Как показано на фигурах 20А и 20В, образцы, производные соответствующих активных пиков (1-6), разделенные методом ВЭЖХ (А: 7 мкг/мл, В: 7•3-2 мкг/мл), реагируют с 5•105 клеток Molt4, и ДНК клетки-мишени экстрагируют и подвергают электрофорезу на 2% агарозном геле. При концентрациях 7 мкг/мл и 7•3-2 мкг/мл регистрируют фрагментацию ДНК клетки Molt4, но, как показано на фигуре 20С, эффект исчезает при низкой концентрации 7•3-5 мкг/мл.
Экспериментальный пример 6
Исследование фрагментации ДНК клетки-мишени BeWo посредством AIF, окончательно выделенного методом ВЭЖХ
Как показано на фигуре 21А, образцы, производные из соответствующих пиков (1-6), разделенные методом ВЭЖХ (21 мкг/мл), реагируют с клетками BeWo в течение 48 часов, и ДНК клетки BeWo экстрагируют и подвергают электрофорезу на 2% агарозном геле. Все пики индуцируют фрагментацию ДНК клетки BeWo (фигура 21А).
Экспериментальный пример 7
Исследование фрагментации ДНК клетки-мишени U937 посредством AIF, окончательно выделенного методом ВЭЖХ
Как показано на фигуре 21В, образцы, производные из соответствующих пиков (1-6), разделенные методом ВЭЖХ (21 мкг/мл), реагируют с клетками U937 в течение 48 часов, и ДНК клетки U937 экстрагируют и подвергают электрофорезу на 2% агарозном геле. Все пики индуцируют фрагментацию ДНК клетки U937 (фигура 21В).
Экспериментальный пример 8
Исследование фрагментации ДНК клетки-мишени GCIY посредством AIF, окончательно выделенного методом ВЭЖХ
Как показано на фигуре 21С, образцы, производные из соответствующих пиков (1-6), разделенные методом ВЭЖХ (21 мкг/мл), реагируют с клетками GCIY в течение 48 часов, и ДНК клетки GCIY экстрагируют и подвергают электрофорезу на 2% агарозном геле. Все пики индуцируют фрагментацию ДНК клетки GCIY (фигура 21С).
Экспериментальный пример 9
Исследование фрагментации ДНК нормальной человеческой клетки WI-38 посредством AIF, окончательно выделенного методом ВЭЖХ
Как показано на фигуре 21D, не происходит индуцирования пролиферации клеток или фрагментации ДНК, если в качестве клетки-мишени присутствует нормальная клетка человека WI-38, даже при троекратном количестве (63 мкг/мл) образцов, производных из соответствующих пиков (1-6). Как показано на фигуре 14G, это соответствует результату, что прямая реакция NS-клетки и клетки WI-38 не наносит никакого вреда нормальной клетке.
Экспериментальные результаты этой серии имеют важное значение. То есть эти результаты показывают, что AIF, выделенный и очищенный в соответствии с настоящим изобретением, вызывает специфическую гибель клеток вследствие апоптоза (фрагментации ДНК) раковых клеток, но не наносит вреда нормальным клеткам, другими словами, нормальную клетку можно разрабатывать в качестве идеального противоракового агента, не дающего побочных эффектов при введении раковым больным.
Кроме того, возможно разрабатывать соединение настоящего изобретения в качестве иммуносупрессивного агента, так как иммуносупрессивные агенты прототипов демонстрируют свое действие посредством ингибиторного фармакологического эффекта на деление лимфоцитов.
Если супернатант культуры клетки Molt4 или свежую среду (в качестве конечного контроля) обрабатывают аналогичным образом, как среду культуры NS-клеточной линии, и в заключение подвергают ВЭЖХ, то в ВЭЖХ-диаграмме не наблюдают таких активных пиков (1-6), какие получены из среды культуры NS-клеточной линии (фигура 18В, С).
С другой стороны, такой же образец, как образец супернатанта культуры NS-клеточной линии, наблюдали в диаграмме ВЭЖХ образца, полученного деструкцией самой NS-клеточной линии с последующей экстракцией. Это показывает, что сама NS-клеточная линия содержит те же активные пики (1-6), что и пики в супернатанте культуры.
Результаты описанных выше экспериментов in vitro можно суммировать следующим образом.
1. NS-клеточная линия индуцирует гибель раковых клеток-мишеней вследствие апоптоза.
Установлено, что в результате прямого взаимодействия (совместного культивирования) между NS-клетками и клетками К562, Molt4, BeWo, U937 и GCIY через 24 часа происходит фрагментация ДНК клеток-мишеней (фигуры 14 А, В, С, D, Е, F).
Степень фрагментации ДНК в клетке-мишени увеличивается в зависимости от количества инокулированных NS-клеток. С другой стороны, фрагментация ДНК не индуцируется при совместном культивировании клеток К562 и Molt4 (фигура 14С), клеток Molt4 и U937 или клеток GCIY и BeWo. Также не наблюдают фрагментации ДНК при совместном культивировании NS-клеток и клеток WI-38 (фигура 14G). Этот результат показывает, что NS-клетка не наносит вреда нормальным клеткам человека. Другими словами, можно сказать, что только NS-клетка обладает способностью индуцировать апоптоз специфических раковых клеток человека.
2. NS-клеточная линия выделяет AIF в супернатант культуры.
При непрямом взаимодействии (непрямом совместном культивировании) систему, в которой NS-клетку и клетки-мишени К562/Molt4 помещают в камеру, количество лейкозных клеток-мишеней в камере снижается вместе с увеличением количества NS-клеток через 72 часа (фигура 15). Кроме того, в камере определяют фрагментацию ДНК лейкозных клеток-мишеней. Экспериментальные результаты показывают, что NS-клетка продуцирует низкомолекулярное растворимое соединение, которое проникает через мембрану миллипорового фильтра в камеру и вызывает гибель лейкозных клеток-мишеней.
3. Грубо очищенный методом тонкослойной хроматографии (TCX) AIF подавляет включение 3H-тимидина в клетки-мишени и индуцирует фрагментацию ДНК.
Образец, лиофилизованный примерно из 50 мл супернатанта культуры NS (ТТК-1)-клеточной линии, подвергают хроматографированию на колонке С18, и удержанная в колонке фракция, которую элюируют ацетонитрилом и концентрируют, подавляет пролиферацию клеток K562/Molt4 и индуцирует фрагментацию ДНК.
Далее эту фракцию исследуют методом TCX. Определяют, что вещество, которое подавляет деление клеток K562/Molt4 (фигура 16А, В) и индуцирует фрагментацию ДНК (фигура 17А, В), присутствует в этой фракции, и положение его полосы выше полосы фенолового красного (Rf 0,5) в TCX (Rf>0,5, ТСХ-В).
В качестве контроля в используемой свежей среде, не содержащей сыворотки (SFM), или в супернатанте культуры клеток-мишеней K562/Molt4 не обнаруживают продуцирования соединения, которое индуцирует фрагментацию ДНК.
Таким образом, подтверждают, что соединение (AIF), которое индуцирует апоптоз (гибель клеток) раковых клеток человека, продуцируется в супернатанте культуры NS-клеточной линии, и что AIF обнаруживают во фракции (Rf>0,5), которая движется на TCX быстрее, чем феноловый красный (Rf фенолового красного 0,5).
4. AIF, окончательно выделенный и очищенный методом ВЭЖХ, индуцирует фрагментацию ДНК клеток-мишеней.
Всю активную фракцию (ТСХ-В), грубо выделенную из 500 мл супернатанта культуры NS-клетки способом TCX, делят и чистят способом ВЭЖХ с обращенной фазой на колонке TSK gel ODS-80TM (Tosoh). Получают шесть основных пиков (1-6) (фигура 18А, ВЭЖХ-диаграмма).
Все образцы из соответствующих пиков 1-6 (7 мкг/мл) подавляют включение 3H-тимидина в клетку Molt4, другими словами, эти образцы подавляют деление клетки Molt4. В частности, образцы из пиков 1 и 4 демонстрируют сильную активность, и также сильную активность демонстрирует смешанный образец разбавлений 1/10 этих пиков (0,7 мкг/мл соответственно) (фигура 19). Как показано в колонке М фигуры 19, это дает синергический эффект этих пиков (AIF).
5. Критическое количество AIF, которое способно индуцировать фрагментацию ДНК клетки Molt4".
В соответствии с супрессивным эффектом активных пиков (1-6) на деление клеток Molt4, образцы, производные из соответствующих пиков (1-6) (7 мкг/мл), индуцируют фрагментацию ДНК клетки Molt4 (фигура 20А).
При обработке клетки Molt4 в течение 48 часов каждым образцом (7•3-2 мкг/мл), производным из активных пиков, разделенных способом ВЭЖХ, определяют фрагментацию ДНК клетки-мишени (фигура 20В), но эффект исчезает при низкой концентрации 7•3-5 мкг/мл (фигура 20С).
(6) Если в качестве клетки-мишени используют BeWo, U937 и/или GCIY, то образцы, производные из пиков (1-6) (21 мкг/мл) и разбавленные 1/10 смешанные образцы (2,1 мкг/мл, соответственно) индуцируют фрагментацию ДНК (фигуры 21А, В и С).
Также, если в качестве клетки-мишени используют нормальную клетку человека WI-38, не происходит ни подавления деления клеток, ни фрагментации ДНК, даже если к мишени добавляют образцы, производные из соответствующих пиков (1-6), в количестве, в три раза большем, чем добавляют к раковым клеткам-мишеням (фигура 21D). Это соответствует результату, что прямое взаимодействие NS-клетки и клетки WI-38 не наносит никакого вреда нормальной клетке. То есть результат показывает, что AIF, выделенный и очищенный в соответствии с настоящим изобретением, вызывает специфическую гибель клеток вследствие апоптоза (фрагментации ДНК) раковых клеток, но вряд ли наносит вред нормальным клеткам, другими словами, нормальную клетку можно разрабатывать в качестве идеального противоракового агента, не дающего побочных эффектов при введении раковым больным. Кроме того, если супернатант культуры клетки Molt4 или свежую среду обрабатывают аналогично тому, как обрабатывают культуры NS-клеточной линии, и в заключение подвергают ВЭЖХ, то в ВЭЖХ-диаграммах не наблюдают таких активных пиков (1-6), как полученные из среды культуры ТТК-1 (фигура 18В, С).
С другой стороны, такой же образец, как образец супернатанта культуры NS-клеточной линии, наблюдали в ВЭЖХ-диаграмме образца, полученного деструкцией самой NS-клеточной линии с последующей экстракцией.
Из этих результатов можно сделать вывод, что AIF представляет собой вещество, получаемое только из NS-клеточной линии и выделяемое в питательной среде.
7. Исследование физико-химических характеристик AIF и определение структуры.
Наличие аминокислот или гексозы в окончательно выделенном и очищенном методом ВЭЖХ AIF определяют посредством реакции орсинолсульфата или реакции нингидрина. Кроме того, обнаружено, что AIF представляет собой соединение типа нуклеиновой кислоты, так как максимум поглощения в УФ-спектре наблюдают около 260 нм. Молекулярную массу вычисляют с помощью масс-спектрометрии (FAB-MASS). Окончательно определяют структуру методом ядерного магнитного резонанса на протонах (ЯМР).
Полагают, что соответствующие активные пики (1-6), разделенные методом ВЭЖХ, являются теплостойкими, отрицательными относительно реакции нингидрина и орсинола и, следовательно, содержат небелковые и негексозные соединения.
Обнаружено также, что AIF представляет собой соединение типа нуклеиновой кислоты, так как максимум поглощения в УФ-спектре наблюдают около 260 нм (левые верхние спектры на фигурах 7-12).
На основании структурного анализа было решено, что клетки NS культивировали в большом количестве (около 300 литров) и образцы приготавливали из аликвот каждого из пиков (1-6), окончательно отделены и очищены ВЭЖХ. Структура образцов была окончательно определена при помощи масс-спектрометрии (FAB-MASS) NMR (ЯМР). Активные пики 1-6 AIF: 2'-деоксиуредин для Р1, риботимидин для Р2, 2'-O-мeтилypидин для Р3, тимидин для Р4, 2'-O-метилинозин для Р5, и 2'-O-метилгуанозин для Р6 (правая верхняя панель фигур 7-12).
В этой связи под стрелкой в масс-спектре указана молекулярная масса (+Н) каждого из активных пиков (1-6) AIF (нижние спектры на фигурах 7-12).
[II] Тесты на животных
Использовали типичные клетки рака крови Molt4 и типичные клетки эпителиального рака GCIY, на которых экспериментально in vitro подтвержден эффект AIF.
1. Примерно 108 раковых клеток желудка человека (GCIY) инокулируют 20 мышам SCID и, когда диаметр опухоли достигает 0,5 см (0,25 см2) (примерно через 2 недели), делят этих мышей на 4 группы, начиная терапевтические эксперименты с применением AIF на мышах, имеющих опухоли. Каждая группа включает в себя 5 мышей.
Пример исследования 1
Пяти мышам вводят раствор образца (фракция ТСХ-В), который фракционирован описанным выше методом ТСХ и содержит шесть нуклеозидов (AIF) в фосфатном буфере (PBS). Доза составляет 1 мг (соответственно 90 мкг 2'-дезоксиуридина, 110 мкг риботимидина, 135 мкг 2'-O-метилуридина, 322 мкг тимидина, 226 мкг 2'-O-метилинозина и 117 мкг 2'-O-метилгуанозина) в 0,5 мл PBS, раствор образца вводят внутривенно (через хвостовую вену), всего 18 раз.
В качестве контроля используют образец (фракция ТСХ-А), который фракционирован описанным выше методом ТСХ и содержит фракцию, положение которой в ТСХ ниже положения фенолового красного, то есть не содержит ни одного из шести нуклеозидов. Этот образец вводят внутривенно (через хвостовую вену), также всего 18 раз. Размер опухоли определяют как произведение большего размера на меньший (площадь). Фигура 22 иллюстрирует средний размер опухоли для пяти мышей через 1, 2 и 3 недели соответственно. Как очевидно из графика, обнаружено значительное различие между группой, принимающей AIF, и контрольной группой: группа, принимающая AIF, демонстрирует значительно более сильный супрессивный эффект по сравнению с контрольной группой (t-тест, Р<0,01).
Пример исследования 2
Раствор 1 мг каждой фракции ТСХ-А и В в 0,3 мл PBS вводят тремя порциями (0,1 мл/дозу) прямо в опухоли пяти мышам, имеющим опухоль, в течение 3 дней. Образец, содержащий 6 нуклеозидов (AIF) фракции ТСХ-В (содержащий те же составные части, что и в примере 1), дает в результате полную дегенерацию опухоли. Фракция ТСХ-А, не содержащая AIF как контроль, вообще не вызывает дегенерации опухоли (в качестве типичного примера на фигурах 2ЗА и В показаны контрольная мышь с опухолью и обработанная мышь, 3 мыши, которым вводили AIF и у которых опухоль пропадает, и 3 контрольные мыши). Как очевидно из механизма дегенерации опухоли посредством AIF, показанного на фигуре 23С, AIF индуцирует фрагментацию ДНК, то есть гибель опухоли вследствие апоптоза.
2. Примерно 108 клеток лейкоза Т-клеток человека (Molt4) инокулируют 10 мышам SCID и, когда диаметр опухоли достигает 0,3 см (0,09 см2) (примерно через 2 недели), делят этих мышей на 2 группы, начиная терапевтические эксперименты с применением AIF на мышах, имеющих опухоли.
Каждой из 5 мышей вводят несколько раз (за 18 введений, попеременно внутривенных и прямых внутриопухолевых) раствор образца, содержащего три нуклеозида AIF (по 400 мг 2'-дезоксиуридина, риботимидина и тимидина соответственно, всего 1,2 мг) в 0,5 мл PBS (всего 21,6 мг). Размер опухоли определяют как произведение большего размера на меньший (площадь) и следят за ним в течение 3 недель. Опухоли у трех мышей из пяти полностью деградируют, а у оставшихся двух мышей также деградируют до предельно малого размера. График на фигуре 24 показывает средний размер опухоли для пяти мышей через 1, 2 и 3 недели соответственно. Как очевидно из графика контрольной группы, опухоль становится больше в контрольной группе, которой вводили PBS, и, таким образом, регистрируют существенное различие между группой, принимающей AIF, и контрольной группой (t-тест, р<0,001).
[III] Обсуждение
Материнская иммунная реакция на плод регулируется, в первую очередь, посредством ткани отпадающей плаценты.
В своих исследованиях заявители настоящего изобретения выяснили, что большое количество групп клеток, которые предположительно представляют LGL-клетку, имеющую NK-клеточный маркер, аккумулируется на отпадающей плаценте млекопитающих, включая человека, на начальной стадии беременности. Кроме того, считают, что эти группы NK-клеток играют важную роль в фазе имплантации бластоцита. То есть NK-клетка контролирует образование зародышевой плаценты, непрерывно пролиферируя и, таким образом, переходя к потомству при беременности. Другими словами, природная иммунная реакция против рака осуществляется на стадии беременности.
NS-клеточная линия настоящего изобретения представляет собой CD57-положительную, HLA. DR-сильно положительную человеческую природную клетку-супрессор, которую клонировали и создали из слоя отпадающей плаценты человека при 3-месячной беременности. Эта клеточная линия не имеет рецепторов эстрогена или прогестерона, характерных для интерстициальных клеток отпадающей плаценты, или не выделяет пролактин, поэтому считается, что она представляет собой клеточную линию, флотирующую из костного мозга или лимфатических тканей.
В качестве специфической функции NS-клетки указывают не только супрессию производства антител и деления лимфоцитов в следствие MLR или митогенного раздражения, но также супрессию пролиферации раковых клеток (Sugiura, К., M. Inaba, H. Ogata, R. Yasumuzu, E.E. Sardina, K. Inaba, S. Kuma, R.A. Good и S. Ikehara, 1990, ингибирование пролиферации опухолевых клеток природными клетками-супрессорами, присутствующими в костном мозге мышей, Cancer Res., 50: 2582). В качестве эффекторных соединений NS-клетки, которые опосредуют контроль деления клеток, указывают белок семейства TGF-β (D.A.Clark, K.C. Flanders, D. Banwatt, W. Millar-Book, J. Manuel, J. Stedronska-Clark и B. Rowley, 1990, отпадающая плацента беременных мышей продуцирует уникальную иммуносупрессивную молекулу, имеющую отношение к фактору роста бета-2, J. Immunol. , 144:3008) и липидподобное соединение, имеющее молекулярную массу 10000 или менее (Mortari F. и S.K. Singhal, 1988, получение фактора супрессии, производного костного мозга человека. Влияние на синтез антител и активированную лектином пролиферацию клеток, J. Immunol., 141:3037), но их сущности оставались сомнительными. Также, как указано в предыдущем исследовании авторов иммуносупрессивного механизма NS-клетки (Tatsumi, К., Т., Mori, E. Mori, H. Kanzaki и T. Mori, 1987), иммунорегуляторный фактор, выделенный из клеточной линии, производной из ткани отпадающей плаценты человека, Am. J. Reprod. Immunol. Microbiol., 13:87), белковое соединение подавляет деление Т-клеток через IL-2.
К удивлению, обнаружено, что NS-клеточная линия индуцирует гибель клеток вследствие их апоптоза (фрагментации ДНК) не только раковых клеток крови человека К562, Molt4 и U937, но также раковых клеток желудка человека GCIY и клеток хориокарциномы человека BeWo и подавляет их пролиферацию.
Кроме того, для индуцирования апоптоза раковых клеток эти соединения (AIF) выделяют из супернатанта культуры этой клеточной линии, чистят и определяют их структуру. Этот процесс включает в себя прежде всего элюирование ацетонитрилом соединения, которое лиофилизованный образец супернатанта культуры NS-клеточной линии гидрофобно связывает с колонкой С18. Элюированные активные факторы грубо чистят методом ТСХ. Активная фракция показывает большее значение Rf, чем феноловый красный, и подавляет деление клеток К562 и Molt4, вызывая фрагментацию ДНК. В заключение активные молекулы делят и чистят как шесть основных пиков методом ВЭЖХ на колонке С18 с обращенной фазой. Все полученные из этих шести пиков образцы подавляют пролиферацию раковых клеток-мишеней и вызывают фрагментацию ДНК. Таким образом, успешно подтверждено, что эти образцы представляют собой новые искомые объекты, то есть AIF. Также обнаружено, что эти шесть AIF наиболее эффективны, когда их используют в виде коктейля, смешивая эти факторы (комбинация многих агентов, используемая в настоящее время для химиотерапии рака; в данном случае природная комбинация многих агентов). Кроме того, эти шесть AIF обладают психохимическими свойствами, отрицательно реагируя на реакцию орцинола и реакцию нингидрина, и, следовательно, эти факторы являются небелковыми соединениями, не содержащими гексозы. Оценено, что эти соединения имеют молекулярную массу 100-500, определяемую на основе их прохождения через диализную мембрану с порогом 500 Д и измерений их масс-спектров.
Кроме того, как показано в левых верхних частях фигур 7-12, каждый из активных пиков, фракционированных методом ВЭЖХ, показывает УФ-спектр, имеющий максимум поглощения при 245-265 нм. То есть это строго предполагает, что AIF представляет собой вещество, относящееся к нуклеиновым кислотам или их производным.
Для получения образца в количестве, достаточном для структурного анализа, AIF окончательно делят, чистят от супернатанта большого количества культуры NS-клетки и окончательно определяют его молекулярную массу методом масс-спектрометрии с бомбардировкой быстрыми электронами и структуру методом ЯМР на протонах (фигуры 1-12). Эти шесть AIF принадлежат к нуклеозидам, имеющим уникальную структуру, в которой часть основания или рибоза дезоксигенирована или метилирована.
Насколько знают авторы, впервые в мире обнаружено, что, как представлено в изобретении, NS-клетка человека выделяет вещества типа нуклеиновых кислот и индуцирует апоптоз раковых клеток.
Клинически доступные противораковые и противовирусные агенты типа нуклеиновых кислот, такие как 5-FU, Futraful (FT), Furtulon, AZT, DDI и Ara-c, обладают сильной клеточной токсичностью и, следовательно, при введении в организм человека создают социальную проблему вследствие сильных побочных эффектов, а также их эффективности.
Наблюдения раскрытых заявителями настоящего изобретения AIF представляют исследования in vitro и эксперименты на животных (эти экспериментальные системы являются обычными системами в исследованиях in vitro и на животных, принятыми в практике для оценки применимости человеком противораковых и противовирусных агентов; смотри, например, фигуры 22, 23, 24). Однако в связи с этим были разработаны основания для развития идеальных канцеростатических агентов природного типа, которые вообще не оказывают вредного воздействия на нормальные клетки человека, но вызывают гибель раковых клеток, посредством природного фармакологического механизма, то есть, индуцируя специфический апоптоз (фрагментацию ДНК) раковых клеток, тогда как подразумевается, что при введении в организм человека побочные эффекты будут снижены.
[IV] Дополнительное описание рисунков
На фигуре 14 показан факт, что NS-клеточная линия индуцирует гибель раковой клетки-мишени вследствие апоптоза, но не вызывает апоптоза и, как следствие его, гибели нормальной клетки.
В результате прямого взаимодействия (совместного культивирования) между NS-клеткой и клетками-мишенями, клеточную ДНК экстрагируют и подвергают электрофорезу на 2% агарозном геле.
Как показано на фигуре 14А, полосы 1, 2 и 3 демонстрируют результаты совместного культивирования с 104, 105 и 106 NS-клеток на ячейку соответственно и 106 Molt4 нa ячейку, и степень фрагментации ДНК в клетке-мишени увеличивается, в зависимости от количества инокулированных NS-клеток. С другой стороны, полоса 5 представляет собой результат культивирования только с 106 Molt4 нa ячейку, а полоса 4 представляет собой результат культивирования только с 106 NS-клеток на ячейку. В этих случаях не наблюдают фрагментации ДНК. М является маркером.
Как показано на фигуре 14В, полосы 1, 2 и 3 представляют собой результаты совместного культивирования с 104, 105 и 106 NS-клеток на ячейку соответственно и 106 К562 на ячейку, и степень фрагментации ДНК в клетке-мишени увеличивается, в зависимости от количества инокулированных NS-клеток. С другой стороны, полоса 4 представляет собой результат культивирования только с 106 К562 на ячейку, а полоса 5 представляет собой результат культивирования только с 106 NS-клеток на ячейку. В этих случаях не наблюдают фрагментации ДНК. М представляет собой маркер.
Как показано на фигуре 14С, полосы 1, 2 и 3 представляют собой результаты совместного культирования с 106, 105 и 104 К562-клеток на ячейку и Molt4 соответственно, полоса 4 представляет собой результат культивирования только с 106 Molt4 нa ячейку, а полоса 5 представляет собой результат культивирования только с 106 К562 на ячейку. Ни в одном случае не индуцируется фрагментация ДНК. М представляет собой маркер.
Как показано на фигуре 14D, полосы 1, 2 и 3 представляют собой результаты совместного культивирования с 104, 105 и 106 NS-клеток на ячейку соответственно и 106 BeWo на ячейку, и степень фрагментации ДНК в клетке-мишени увеличивается, в зависимости от количества инокулированных NS-клеток. С другой стороны, полоса 4 представляет собой результат культивирования только с 106 NS-клеток на ячейку, а полоса 5 представляет собой результат культивирования только с 106 BeWo на ячейку, полоса 6 представляет собой результат совместного культивирования с 106 BeWo на ячейку и 106 GCIY на ячейку, а полоса 7 представляет собой результат культивирования только с 106 GCIY на ячейку. Ни в одном из случаев не наблюдают фрагментации ДНК.
Как показано на фигуре 14Е, полосы 1, 2, 3 и 4 представляют собой результаты совместного культивирования с 103, 104, 105 и 106 NS-клеток на ячейку соответственно и 106 U937 на ячейку, и степень фрагментации ДНК в клетке-мишени увеличивается, в зависимости от количества инокулированных NS-клеток. С другой стороны, полоса 7 представляет собой результат совместного культивирования с 106 Molt4 на ячейку и 106 U937 на ячейку, полоса 8 представляет собой результат культивирования только с 106 Molt4 на ячейку, полоса 6 - только с 106 U937 на ячейку, а полоса 5 - с 106 NS на ячейку. Ни в одном из этих случаев не индуцируется фрагментация ДНК. М является маркером.
Как показано на фигуре 14F, полосы 1, 2 и 3 представляют собой результаты совместного культивирования с 104, 105 и 106 NS-клеток на ячейку соответственно и 106 GCIY на ячейку, и степень фрагментации ДНК в клетке-мишени увеличивается, в зависимости от количества инокулированных NS-клеток. С другой стороны, полоса 4 представляет собой результат культивирования только с 106 GCIY на ячейку, а полоса 5 представляет собой результат культивирования только с 106 NS на ячейку. Ни в одном из этих случаев не наблюдали фрагментации ДНК. М является маркером.
Как показано на фигуре 14G, полосы 1, 2 и 3 представляют собой результаты совместного культивирования с 104, 105 и 106 NS-клеток на ячейку соответственно и 106 WI-38 на ячейку, и в клетках-мишенях не наблюдают фрагментации, независимо от увеличения количества NS-клеток. Полоса 4 представляет собой результат культивирования только с 106 WI-38 на ячейку, а полоса 5 представляет собой результат культивирования только с 106 NS на ячейку. Ни в одном из этих случаев не индуцируется фрагментация ДНК. М представляет собой маркер.
На фигуре 15 объясняется, что NS-клеточная линия подавляет пролиферацию клетки-мишени при непрямом совместном культивировании с клетками K562/Molt4.
Как показано на фигуре 15, в системе непрямого взаимодействия (непрямого совместного культивирования), где NS-клетку и клетки K562/Molt4 помещают в камеру, количество раковых клеток-мишеней внутри камеры снижается через 72 часа вместе с увеличением числа NS-клеток.
На фигурах 16-17 объясняется, что AIF, грубо очищенный методом тонкослойной хроматографии (ТСХ), подавляет включение 1H-тимидина в клетку-мишень и индуцирует фрагментацию ДНК.
Фракция, полученная посредством внесения образца, лиофилизованного примерно из 50 мл супернатанта (ТТК-1 Sup) культуры NS-клетки (ТТК-1), в колонку С18, элюирования удержанной фракции ацетонитрилом и концентрирования элюата, подавляет деление клеток K562/Molt4.
Затем эту фракцию используют в ТСХ, как показано на фигуре 16А, для получения фракции (U) с положением на ТСХ выше фенолового красного (Rf 0,5), содержащегося в среде. Установили, что эта фракция (U) подавляет деление клетки К562 по сравнению со средой, не содержащей сыворотки (SFM), контрольной группой (С) и фракцией (L), находящейся на ТСХ ниже фенолового красного.
С другой стороны, эту фракцию используют в ТСХ, как показано на фигуре 16В, для получения фракции (U) с положением на ТСХ выше фенолового красного (Rf 0,5), содержащегося в среде. Установили, что эта фракция (U) значительно подавляет деление клетки Molt4 по сравнению с фракцией (L), находящейся на ТСХ ниже фенолового красного.
В контрольной группе (С) и используемой свежей среде, не содержащей сыворотки (SFM), не происходит подавления пролиферации клеток-мишеней.
Как показано на фигурах 17А и В, фракцию получают посредством внесения образца, лиофилизованного примерно из 50 мл супернатанта NS-клеточной культуры (ТТК-1), в колонку С18, элюирования удержанной фракции ацетонитрилом и концентрирования элюата. Полученную таким образом фракцию используют в ТСХ и делят на фракцию (U, полосы 1 и 3) с положением на ТСХ выше фенолового красного (Rf 0,5), содержащегося в среде, и фракцию (L, полосы 2 и 4) с положением на ТСХ ниже фенолового красного, каждую из этих фракций проверяют на присутствие соединения, которое индуцирует фрагментацию ДНК клеток K562/Molt4. Эти экстракты реагируют с клетками K562/Molt4, и клеточную ДНК экстрагируют через 24 часа (полосы 1 и 2), 48 часов (полосы 3 и 4) и подвергают электрофорезу на 2% агарозном геле. Как показано на этой фигуре, вещество (AIF), которое индуцирует апоптоз (гибель клеток) раковых клеток человека, продуцируется в супернатанте NS-клеточной культуры, и AIF обнаружено во фракции, которая движется на ТСХ более быстро, чем феноловый красный (Rf>0,5).
На фигуре 18 показана ВЭЖХ-диаграмма AIF, окончательно разделенных методом ВЭЖХ.
Как показано на фигуре 18А, всю активную фракцию, грубо очищенную методом ТСХ из 500 мл супернатанта культуры NS-клетки (ТТК-1), отделяют и экстрагируют методом ВЭЖХ с обращенной фазой на TSK gel ODS-80TM (Tosoh). Получают шесть основных пиков (1-6).
Как показано на фигурах 18В и С, когда супернатант (В) культуры клеток Molt4 или свежую среду (С) подвергают такой же обработке, как среду NS-клеточной культуры (ТТК-1), и в заключение используют в методе ВЭЖХ, то в ВЭЖХ-диаграмме не наблюдают активных пиков, полученных из среды NS-клеточной культуры (1-6).
Фигуры 19 и 20 объясняют факт, что AIF, окончательно выделенный методом ВЭЖХ, подавляет включение 3H-тимидина в раковую клетку-мишень и индуцирует фрагментацию ДНК, и определяется критическое количество AIF, которое может индуцировать фрагментацию.
Как показано на фигуре 19, все образцы (7 мкг/мл) из основных пиков (1-6), разделенных методом ВЭЖХ, подавляют включение 3H-тимидина в клетку Molt4. В частности, образцы из пиков 1 и 2 демонстрируют сильную активность, и разбавленный 1/10 смешанный образец этих пиков (соответственно 0,7 мкг/мл) также демонстрирует сильную активность. Как показано в колонке М фигуры 19, это указывает на синергический эффект этих пиков.
Как показано на фигурах 20А, образцы, приготовленные из соответствующих пиков (1-6), реагируют с клеткой Molt4 в течение 48 часов, и затем ДНК клетки Molt4 экстрагируют и подвергают электрофорезу в 2% агарозном геле. Согласно супрессивному эффекту соответствующих пиков (1-6) на деление клеток Molt4, оба образца, производных из соответствующих пиков (1-6), и смесь разбавлении 1/10 соответствующих пиков (1-6) индуцируют фрагментацию ДНК клетки Molt4 (фигура 20А, полосы 1-7).
Как показано на фигурах 20В и С, образцы, производные соответствующих пиков (1-6), разделенные методом ВЭЖХ (В: 7•3-2 мкг/мл. С: 7•3-5 мкг/мл, реагируют с клеткой Molt4 в течение 48 часов, и затем ДНК клетки Molt4 экстрагируют и подвергают электрофорезу в 2% агарозном геле. Как показано на фигуре 20В, в образцах, производных соответствующих пиков (1-6) (7•3-2 мкг/мл), и смеси разбавлений 1/10 соответствующих пиков (1-6) (0,7•3-2 мкг/мл) наблюдают фрагментацию ДНК клетки Molt4, но эффект исчезает при низкой концентрации (7•3-5 мкг/мл) каждого образца в отдельности или смеси разбавлений 1/10 (0,7•3-5 мкг/мл), как показано на фигуре 20С (полосы 1-7).
Фигура 21 объясняет, что AIF, окончательно выделенный методом ВЭЖХ, индуцирует фрагментацию ДНК раковых клеток человека BeWo/U937/GCIY, но не индуцирует фрагментацию ДНК нормальной клетки человека WI-38.
Как показано на фигурах 21А, В и С, образцы, производные соответствующих пиков (1-6) (21 мкг/мл), и смеси разбавлений 1/10 (2,1 мкг/мл) образцов, производных соответствующих пиков (1-6), реагируют с клетками BeWo(A)/U937 (В)/GCIY (С) в течение 48 часов, и затем ДНК каждой клетки-мишени экстрагируют и подвергают электрофорезу в 2% агарозном геле. В соответствии с эффектом супрессии деления клеток-мишеней активные пики (1-6) обоих образцов, полученных из соответствующих пиков (1-6), и смеси разбавлений 1/10 соответствующих пиков (1-6), индуцируют фрагментацию ДНК клеток-мишеней (полосы 1-7).
Как показано на фигуре 21D, образцы, производные из соответствующих пиков (1-6) в 3-кратном количестве (63 мкг/мл) от использованного для раковых клеток-мишеней, реагируют в течение 48 часов с нормальной человеческой клеткой WI-38, и затем ДНК клетки WI-38 экстрагируют и подвергают элекрофорезу в 2% агарозном геле. Ни один из образцов, производных активных пиков, не вызывает супрессии деления нормальной клетки или фрагментации ее ДНК.
На фигурах 7-12 приведены физико-химические характеристики и структурное определение соответствующих активных пиков 1-6 (AIF), разделенных методом ВЭЖХ.
Культивируют в большом количестве NS-клеточную линию (примерно 300 л) и получают образцы, проводят фракционирование соответствующих пиков (1-6), разделение и очистку методом ВЭЖХ.
Как показано на левых верхних спектрах Р1-Р6 на фигурах 7-12 соответственно, из анализа максимального поглощения в УФ-спектре около 260 нм обнаружено, что AIF представляет собой вещество типа нуклеиновой кислоты.
В качестве структурного анализа выбрали УФ-спектральный анализ, молекулярную массу определяли масс-спектрометрически (масс-спектрометрия с бомбардировкой быстрыми электронами) (стрелки на нижних спектрах). Кроме того, окончательно структуру AIF определяли методом ядерного магнитного резонанса (ЯМР), как показано на фигурах 7-12 (вверху справа).
Настоящее изобретение описано далее более подробно со ссылкой на примеры, но не ограничено этими примерами.
Пример 1. Описание культуральной среды и культуральной жидкости.
Супернатант NS-клеточной структуры (500 мл) после культивирования в течение 3 дней в атмосфере 5% СО2 при 37oС лиофилизуют и делят на колонке С18. Так как активные вещества связываются в колонке, то их разделяют и элюируют ацетонитрилом и метанолом. Растворитель выпаривают при помощи газообразного азота и элюат концентрируют до сухости.
Раствор соединения, выделенного на колонке С18, в смеси хлороформ:метанол (1:1) наносят в виде пятна на тонкий слой (Kieselgel) и проявляют смесью хлороформ:метанол:дистиллированная вода (60:40:8). После проявления пластину делят на фракции: ниже полосы реагента фенолового красного (L) и выше этой полосы (U), гель соскребают для восстановления соответствующих фракций путем экстракции смесью хлороформ:метанол (1:1) и сушат экстракт при помощи газообразного азота.
Активную ТСХ-фракцию (U) отделяют и чистят на колонке ODS-80TM (Tosoh), элюируя ацетонитрилом, содержащим 0,1% трифторуксусной кислоты, с градиентом 0-5%/360 мин при скорости потока 0,5 мл/мин, осуществляя контроль оптической плотности при 214 нм и получая шесть основных пиков (1-6) (фигура 18А, ВЭЖХ-диаграмма).
Искомые продукты Р1, Р2, Р3, Р4, Р5 и Р6 получают в количестве 0,014 мг, 0,017 мг, 0,021 мг, 0,050 мг, 0,035 мг и 0,018 мг соответственно.
Ниже описаны примеры препаратов соединений настоящего изобретения, но препараты соединений настоящего изобретения не ограничены этими примерами.
Пример препарата 1, вес.ч.:
Данное соединение (Р1) - 10
Бикарбонат магния - 15
Лактоза - 75
Перечисленные выше ингредиенты смешивают до однородности, получая тонко размолотый или гранулированный порошок, имеющий размер частиц 350 мкм или менее. Этот порошок загружают в контейнер, получая капсулу.
Пример препарата 2, вес.ч.:
Данное соединение (Р2) - 45
Крахмал - 15
Лактоза - 16
Кристаллическая целлюлоза - 21
Поливиниловый спирт - 3
Дистиллированная вода - 30
После смешивания ингредиентов до однородности смесь дробят в гранулы, которые сушат и затем просеивают, получая гранулы с размером частиц 117-1410 мкм.
Пример препарата 3
После получения гранул аналогичным образом, как в примере препарата 2, добавляют 4 части стеарата кальция к 96 частям этих гранул, и из этой смеси прямым прессованием получают таблетки с диаметром 10 мм.
Пример препарата 4
К 90 частям гранул, полученных способом, описанным в примере препарата 2, добавляют 10 частей кристаллической целлюлозы и 3 части стеарата кальция, и из этой смеси прямым прессованием получают таблетки с диаметром 8 мм, к которым добавляют сироп желатина/суспензию осажденного карбоната кальция, получая драже.
Пример препарата 5
Данное соединение (Р3) - 0,6 (частей)
Неионный поверхностно-активный агент - 2,4
Физиологический раствор - 97
После смешивания перечисленных выше ингредиентов при нагревании смесь загружают в ампулу и стерилизуют, получая препарат для инъекций.
Промышленная пригодность
Соединения настоящего изобретения, представленные формулой (1), или их фармацевтически приемлемые соли не наносят вреда нормальным клеткам человека, и ожидается, что при введении в организм человека они лечат его заболевания, такие как карцинома и вирусные состояния, по природному механизму, который специфически действует на раковые клетки, вызывая гибель раковых клеток вследствие апоптоза, при этом подразумевается снижение его побочных эффектов. Таким образом, соединения настоящего изобретения полезны в качестве противоопухолевых или противовирусных агентов в фармацевтических препаратах.
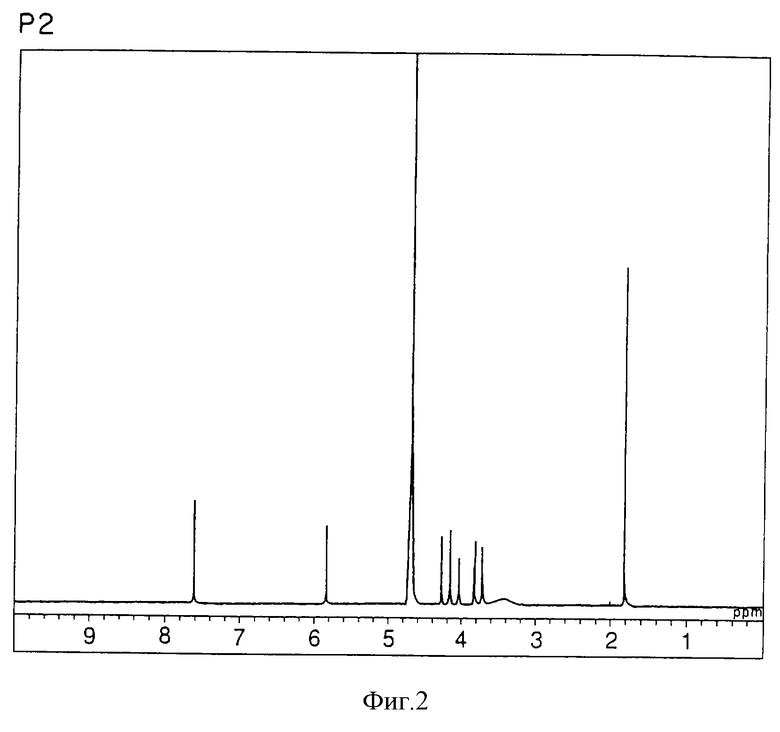
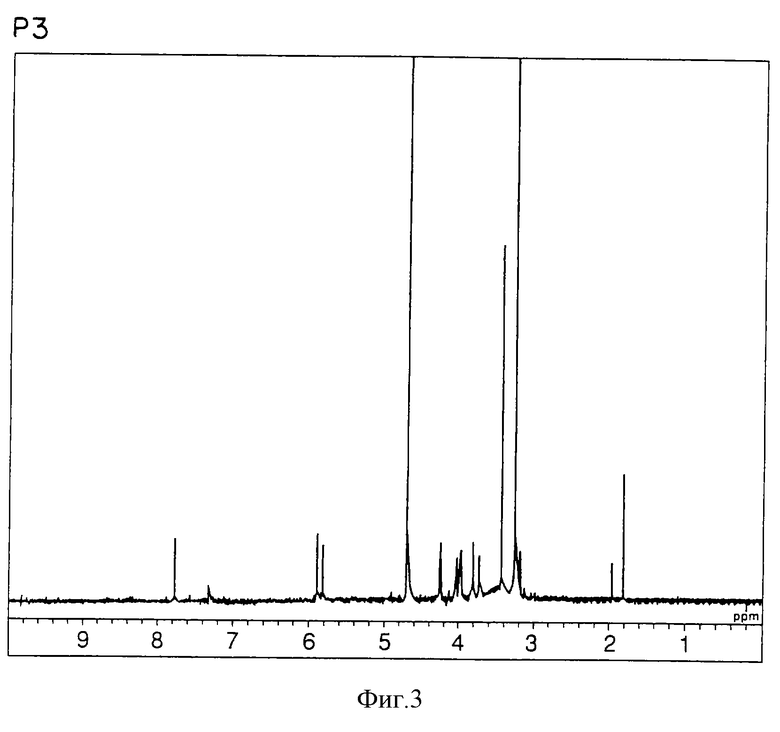



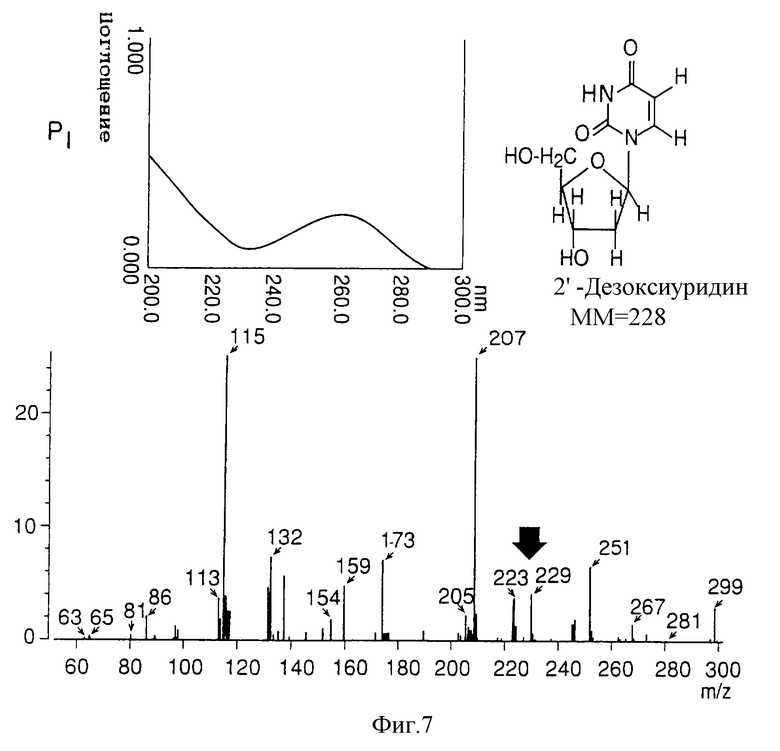

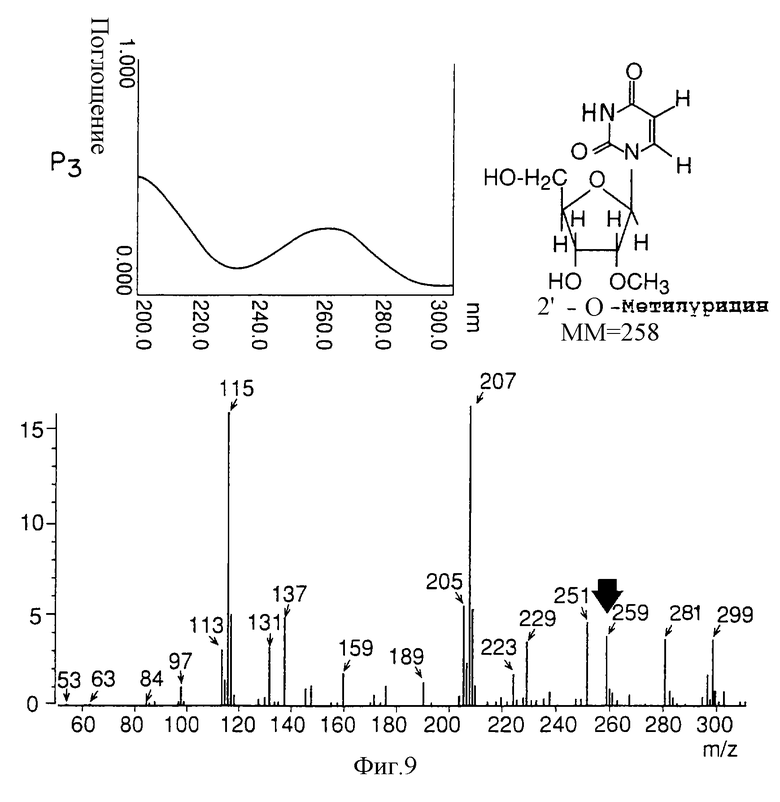


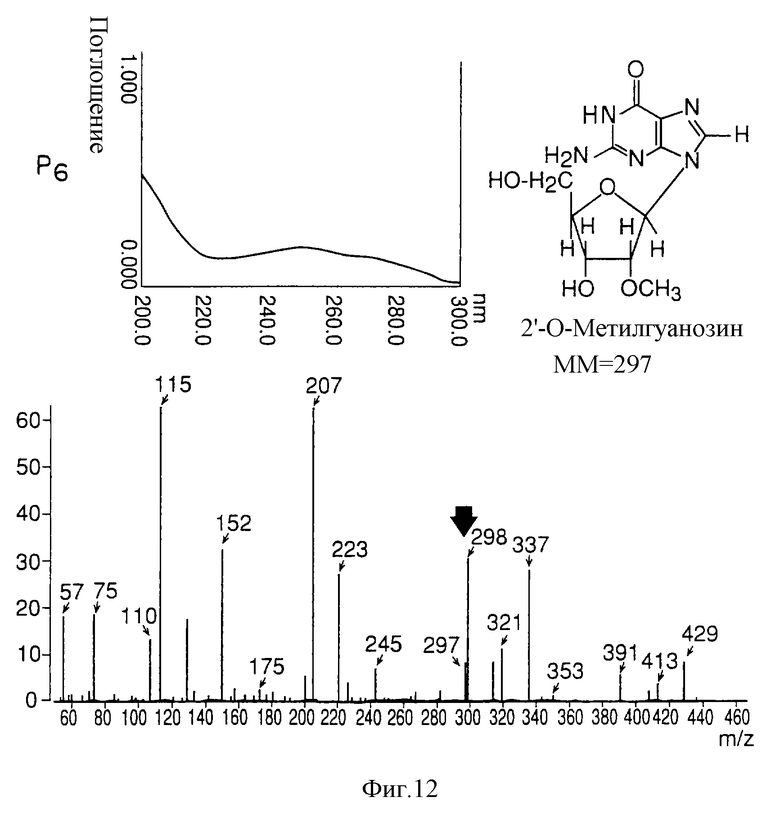

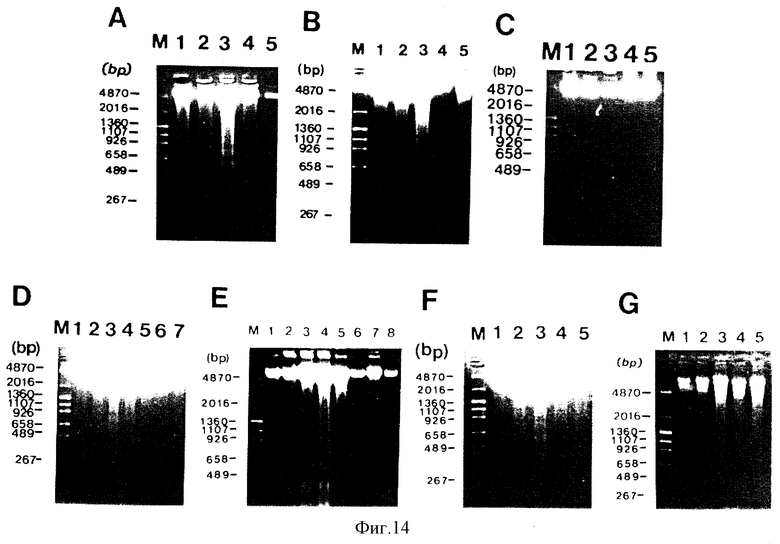
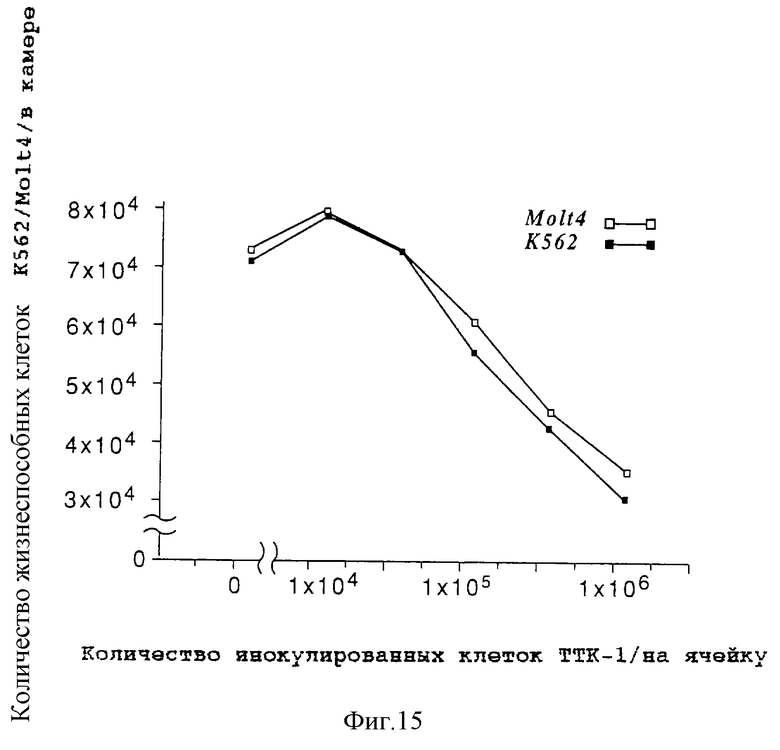


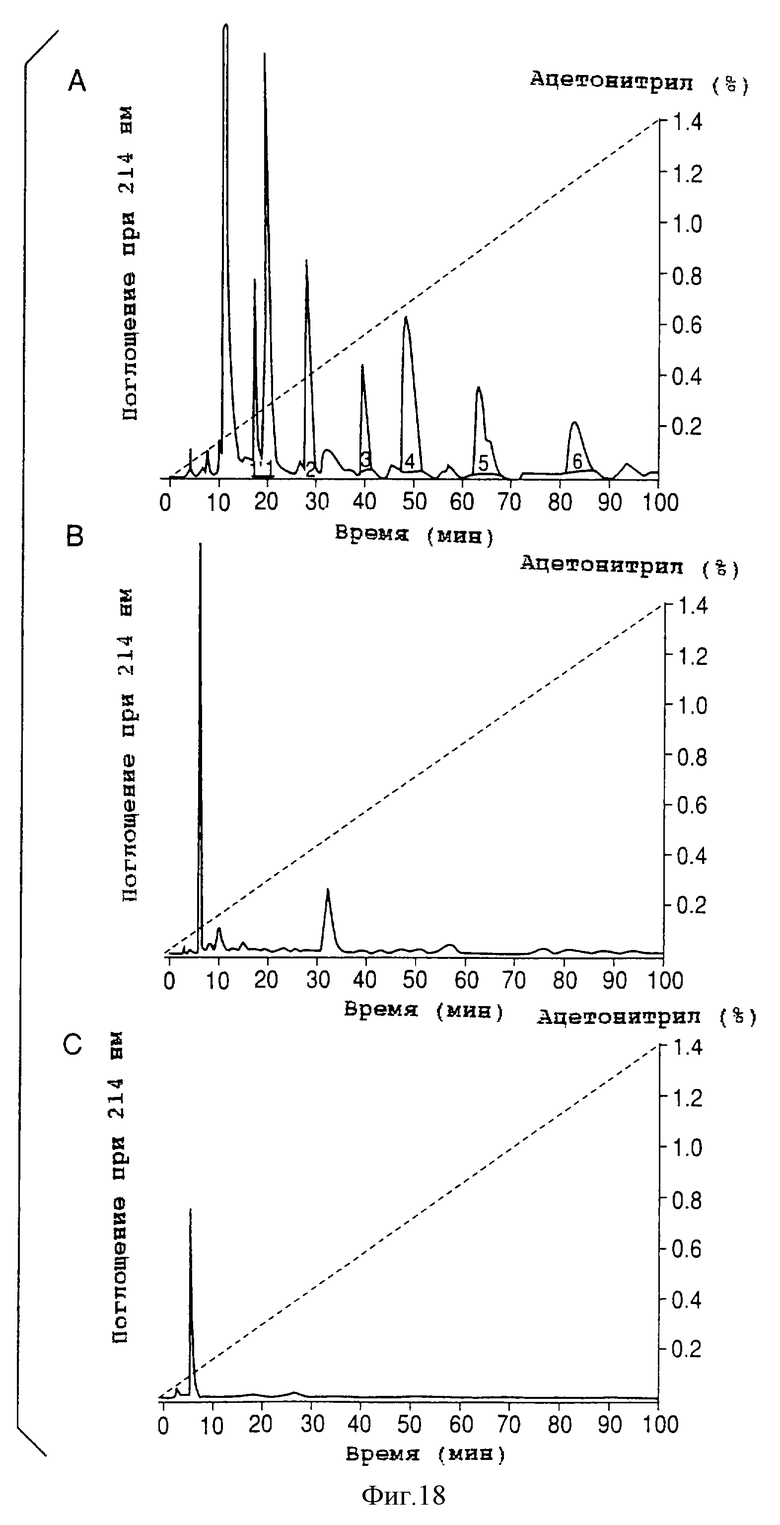
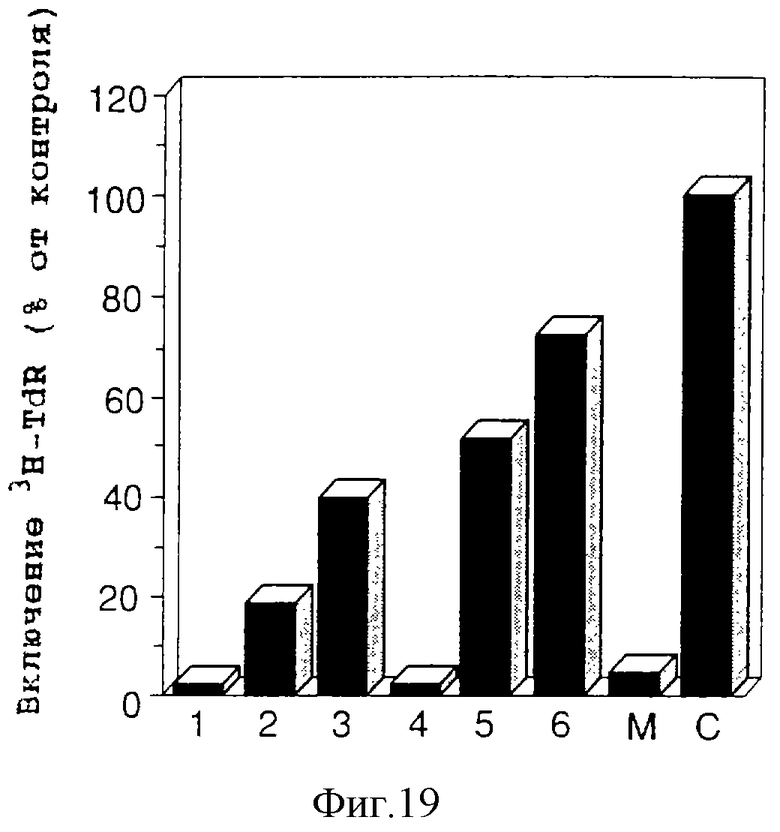

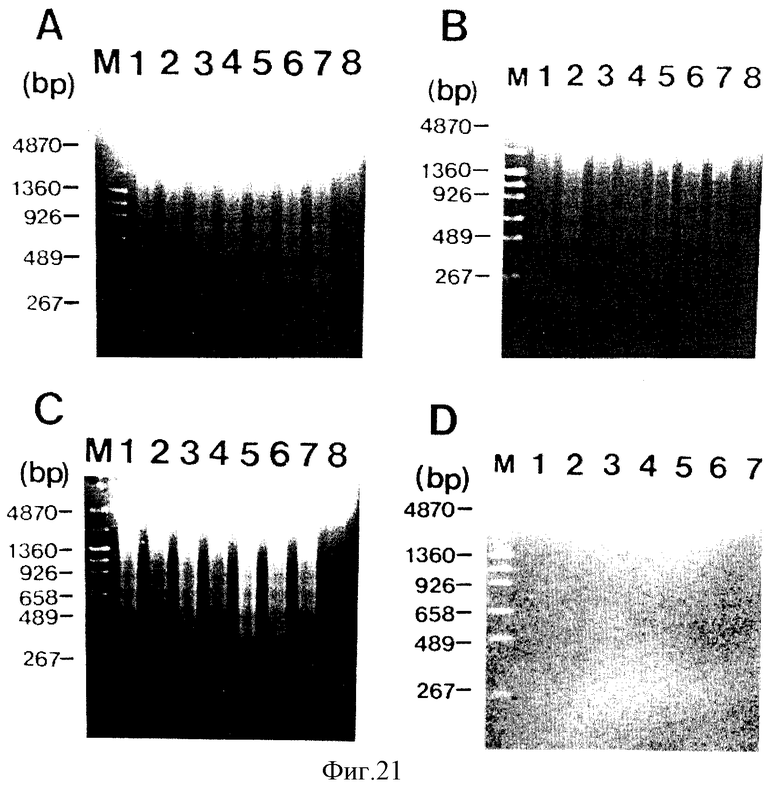
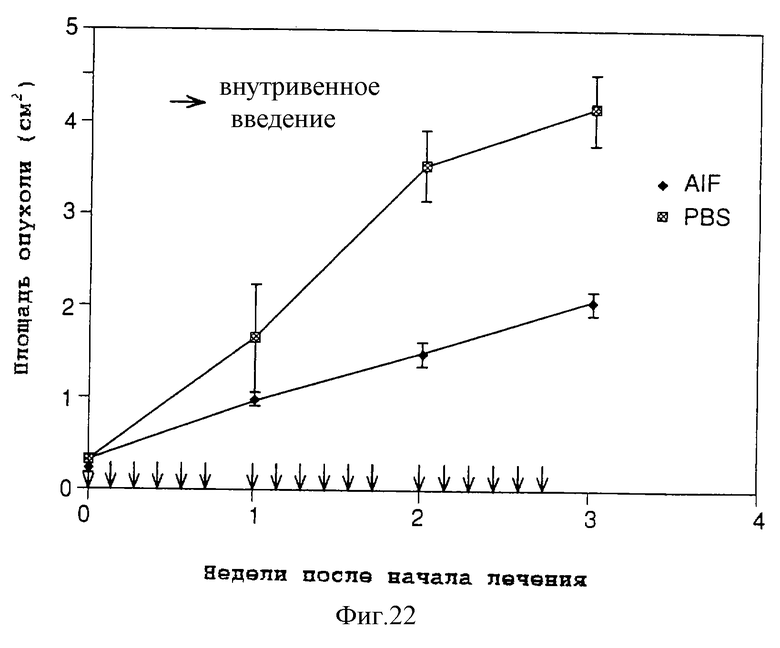


Изобретение относится к медицине и обеспечивает вещества, которые обладают эффективностью против опухолей и вирусов, относительно которых обычные противоопухолевые агенты и противовирусные агенты демонстрируют лишь недостаточные эффекты, и оказывают канцеростатическое действие и противовирусное действие на различные невосприимчивые опухоли. Изобретение касается фармацевтической композиции с противоопухолевым или противовирусным веществом, представленным формулой 1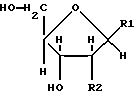
где R1 представляет собой основание нуклеиновой кислоты, представленное определенной формулой, и R2 представляет собой атом водорода, гидроксильную группу или метоксигруппу, или его фармацевтически приемлемой соли. А также касается способа получения вещества, представленного формулой 1, или его фармацевтически приемлемой соли, отличающегося тем, что культивируют NS-клетку, которая обладает способностью продуцировать вещество, представленное формулой 1, собирают вещество, представленное формулой 1, из культуральной жидкости и, если необходимо, превращают это вещество в его фармацевтически приемлемую соль. Кроме того, раскрыты клеточная линия и способ лечения. Изобретение обеспечивает пониженное побочное действие на нормальные клетки организма. 6 с. и 1 з.п.ф-лы, 24 ил.
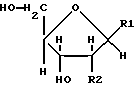
где R1 представляет собой группу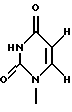


или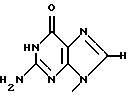
R2 представляет собой атом водорода, гидроксильную группу или метоксигруппу,
или его фармацевтически приемлемую соль и фармацевтически приемлемые добавки.

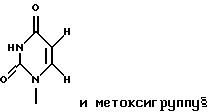
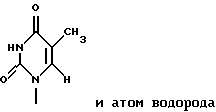
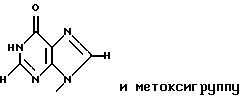
или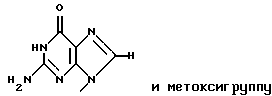
3. Противоопухолевый или противовирусный агент, отличающийся тем, что включает в себя в качестве эффективного ингредиента противоопухолевое или противовирусное вещество, указанное в п. 1 или 2, или его фармацевтически приемлемую соль.
| US 4071680 А, 31.01.1978 | |||
| СПОСОБ ПОЛУЧЕНИЯ ФАКТОРА, ПОДАВЛЯЮЩЕГО МЕТАСТАЗЫ | 1990 |
|
RU2070046C1 |
| US 4916121 A, 10.04.1990 | |||
| US 4726947 A, 23.02.1988 | |||
| US 5470838 А1, 28.11.1995. | |||
Авторы
Даты
2003-05-27—Публикация
1998-06-02—Подача