УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение относится к гибридным клеткам и способам получения гибридных клеток. В частности, изобретение относится к гибридным клеткам, полученным гибридизацией по меньшей мере трех клеток, где по меньшей мере две клетки происходят из различных ростков. Кроме того, изобретение относится к применению гибридных клеток для экспрессии белков, пригодных для ряда диагностических, профилактических, терапевтических и/или исследовательских применений.
УРОВЕНЬ ТЕХНИКИ
Никакое обсуждение уровня техники на протяжении описания не следует считать допущением того, что такой уровень техники широко известен или составляет часть общей информации в данной области.
В настоящее время для экспрессии белков, которые имеют коммерческое значение в ряде диагностических, профилактических, терапевтических и/или исследовательских применений используют различные типы клеток. На сегодняшний день продукцию таких белков обычно проводят в клетках, таких как клетки бактерий, дрожжей, грибов, клетки насекомых и клетки не являющихся человеком млекопитающих.
Клетки часто модифицируют белки путем множества посттрансляционных модификаций, включая, но, не ограничиваясь ими, гликозилирование, ацилирование, фосфорилирование, метилирование, сульфатацию, пренилирование и липидацию. Эти модификации являются видоспецифическими и, по существу, клетки, используемые в настоящее время для продукции имеющих коммерческое значение белков, обладают посттрансляционными модификациями, которые отличаются от посттрансляционных модификаций, наблюдаемых на белках, экспрессируемых из клеток человека или встречающихся в естественных условиях в организме человека. Например, многие типы клеток не млекопитающих, используемых для продукции имеющих коммерческое значение белков, либо лишены способности гликозилировать белки, либо проявляют паттерны гликозилирования, которые отличаются от паттернов гликозилирования, проявляемых белками, экспрессируемыми в клетках человека.
Даже в экспрессирующих системах, не являющихся человеком млекопитающих, таких как клетки яичника китайского хомячка (CHO), выявлены существенные отличия в паттернах гликозилирования от паттернов гликозилирования клеток человека. Например, клеточные линии CHO, используемые для рекомбинантной экспрессии белков, лишены функционального фермента (α 2,6) сиалилтрансферазы для синтеза (α 2,6)-связанных концевых сиаловых кислот, которые присутствуют в клетках человека. Более того, мотивы сиаловых кислот, которые присутствуют на экспрессируемых клетками CHO гликопротеинах, подвержены деградации эндогенной сиалидазой клеток CHO (Gramer et al. Biotechnology 13 (7):692-&, 1995).
В результате отличающихся репертуаров посттрансляционной модификации в экспрессирующих системах, не являющихся человеческими, белки, экспрессируемые из них, могут проявлять физикохимические и фармакологические характеристики, такие как время полужизни, иммуногенность, стабильность и функциональная эффективность, которые отличаются от этих характеристик у белков, происходящих из клеток человека. Это может существенно влиять на клиническую применимость этих белков.
Также накапливаются данные, что в дополнение к их видозависимой природе, посттрансляционные модификации также могут быть тканеспецифичными и даже специфичными к типу клеток в одном и том же виде. Это, в частности, имеет отношение к тканеспецифичной и специфичной к типу клеток экспрессии белков, проявляющих концевое гликозилирование (Feizi Nature 314: 53-54, 1985; Rademacher et al., Annu Rev Biochem 57:785-838, 1988). В частности, было показано, что три сиалилтрансферазы, которые присоединяют концевые сиаловые кислоты к цепям сахаров гликопротеина, проявляют поразительно отличающуюся экспрессию в семи тканях крысы (Paulson et al., J. Biol. Chem. 264:10931-10934, 1989). Это подтверждает тканеспецифичное гликозилирование одного и того же белка. Более того, исследования с двумя изоформами высоко фосфорилированного гликопротеина (остеопонтина мыши), экспрессированного фибробластами мыши и остеобластами мыши из костного мозга, показали значительные отличия в их степени фосфорилирования, которая коррелировала с отличиями в биологической активности. Эти результаты указывают на то, что функция остеопонтина, продуцируемого различными типами клеток, отличается (Christensen et al., J Biol. Chem. 282(27):19463-19472).
Эффективные клеточные системы, пригодные для продукции биологических веществ, проявляющих полностью человеческие характеристики, в идеальном случае должны удовлетворять ряду критериев, включая, но не ограничиваясь ими, следующие:
a) происхождение из ткани человека;
b) рост в культуре с высокой плотностью;
c) проявляют рентабельные выходы белка;
d) позволяют стабильное встраивание чужеродных генов;
e) допускают способы амплификации генов;
f) позволяют применение родительской клетки для продукции моноклональных антител как в гибридомах человек-человек;
g) проявляют стабильную длительную экспрессию белка;
h) способность расти в бессывороточной и не содержащей глутамина среде;
i) лишены активности эндопептидазы, что, таким образом, снижает деградацию белка,
j) свободны от патогенных агентов, включающих вирусную ДНК и микоплазму;
k) продуцируют белки, которые проявляют посттрансляционные модификации, которые функционально сходны с, или являются такими же, как и посттрансляционные модификации, которые встречаются на природных белках, предпочтительно тканеспецифичные и клеточноспецифичные. Эти посттрансляционные модификации могут включать, но не ограничиваться ими, углеводные части на гликопротеинах.
Хотя существует ряд клеток-хозяев человека или гетерогибридом для экспрессии белков человека, ни одна из них не удовлетворяет успешно всем из критериев, приведенных выше. Особенно следует отметить, что попытки экспрессии и выделения белков из существующих клеточных экспрессирующих систем человека с клинически полезными выходами привели к ограниченному успеху.
Экспрессия белка в эукариотических клетках контролируется на различных стадиях, включая: (a) влияние регуляторных факторов на гены в хроматине; (b) регуляцию инициации транскрипции; и (c) посттрансляционную модификацию. Полагают, что эти различные стадии являются специфичными к стадии развития и/или тканеспецифичными. Таким образом, когда в клетку вводят экзогенный ген, кодирующий желаемой белок, экспрессия желаемого белка может быть менее чем оптимальной. В результате этого могут возникнуть проблемы, такие как отсутствие стабильной экспрессии (Li et al., Proc Natl Acad Sci. USA 95:3650-3654, 1998; Miyaji et al., Cytotechnology, 3:133-140, 1990; Miyaji et al., Cytotechnology 4:173-180, 1990; Miyaji et al., Cytotechnology 4:39-43, 1990; Satoh et al., Cytotechnology 13:79-88, 1993), низкие выходы экспрессии (Airoldi et al., Cancer Research 61:1285-1290, 2001; Hosoi et al. Cytotechnology 7:25-32, 1991) и неоптимальные посттрансляционные модификации (Shinkawa et al., J. Biol. Chem. 278:3466-3473, 2003). Все эти факторы могут влиять на потенциальную коммерческую применимость белка.
В качестве одного примера, сублинию клеток Namalwa (B-лимфобластоидные клетки человека, выращенные в суспензионных культурах и адаптированные к бессывороточной и не содержащей альбумина среде), Namalwa KJM-1, использовали для крупномасштабной продукции альфа-интерферона, который представляет собой эндогенный белок для клеток лимфомы Беркитта. Однако, когда в качестве целевого белка для трансфекции путем электропорации использовали белок G-CSF, чужеродный для клеток лимфомы Беркитта, но эндогенный для B-клеток (Airoldi et al., Cancer Research 61:1285-1290, 2001), уровни экспрессии G-CSF варьировали среди множества устойчивых к метотрексату (MTX) клонов, и клон с наиболее высокой продукцией G-CSF имел удельную продуктивность только 2,4 мкг/мл/сутки после адаптации к бессывороточным условиям.
Кроме того, удельная продуктивность снижалась в культуре с высокой плотностью, когда число клеток составляло выше 7×105 клеток/мл (Hosoi et al. Cytotechnology 7:25-32, 1991). Даже несмотря на то, что описанная максимальная концентрация G-CSF была значительно увеличена и достигала 41 мкг/мл, для достижения этого требовалось тщательное и трудоемкое манипулирование условиями культивирования клеток с очень строгим контролем pH. Также было показано, что среда, использованная для оптимального роста, отличалась от среды, которую использовали для оптимальной продукции, что, таким образом, создавало существенное противоречие между желаемой высокой плотностью и высокой скоростью продукции, и приводило к промышленно нецелесообразной системе.
Поскольку экспрессия генов в эукариотах контролируется на нескольких уровнях, которые включают: (a) доступность и достигаемость регулирующих факторов для генов в хроматине; (b) модулирование на доступных промоторах уровня специфической инициации транскрипции; и (c) последующие посттрансляционные события на различных стадиях, присутствие тканеспецифичных и специфичных к стадии развития факторов транскрипции имеет большое влияние на экспрессию генов. Кроме того, регуляция генов конкретного типа клеток требует кооперации нескольких цис-регуляторных последовательностей ДНК, которые представляют собой участки связывания для белков, которые передают молекулярные сигналы генам (Blackwood et al., Science 281:60-63, 1998). Эти последовательности связывают регуляторные белки с образованием комплексов, известных как энхансеосомы (Marika et al., Curr Opin Genet Dev 11(2):205-208, 2001). Таким образом, чем больше отличается клеточное окружение гена-мишени от его обычного клеточного окружения при введении клеток-хозяев человека определенного ростка, тем больше снижается стабильная экспрессия и продукция желаемого белка на высоких уровнях. Когда клетки Namalwa KJM-1 трансфицировали генами чужеродных белков, не являющихся белками, специфичными к ростку лимфобластоидных клеточных линий, таких как бета-интерферон (Miyaji et al., Cytotechnology, 3:133-140, 1990; Miyaji et al., Cytotechnology 4:173-180, 1990) или лимфотоксин человека (Miyaji et al., Cytotechnology 4:39-43, 1990) или проурокиназа (Satoh et al., Cytotechnology 13:79-88, 1993), было выявлено, что скорость трансфекции и продуктивность клеток являются еще более низкими.
Эффективная экспрессия чужеродных генов в специфичных клеточных линиях определенного ростка человека также требует тщательного, и иногда трудоемкого отбора пригодного энхансера/промотора, которые могут содержать участки связывания для ядерных факторов, доступных в человеческих клетках-хозяевах. Нахождение такого энхансера/промотора может, тем не менее, приводить к ограниченной пригодности такого промотора. Например, когда несколько энхансеров/промоторов, таких как ранний промотор генов вируса обезьян 40 (SV40), главный предранний промотор генов цитомегаловируса человека (hCMV), промотор вирус лейкоза мышей Молони (Mo-MuLV), промотор вируса саркомы Рауса (RSV) и промотор β-актина курицы, исследовали в отношении более эффективной экспрессии чужеродного гена в клетках Namalwa KJM-1, было выявлено, что промотор Mo-MuLV является приблизительно в 10 раз более сильным, чем традиционный ранний промотор SV40 и клоны с высокой продуктивностью достигали продуктивности 30-40 мкг/106 клеток/сутки (Satoh et al., Cytotechnology 18:162-172, 1996). Однако проблема применения ретровирусных векторов, таких как Mo-MuLV, состоит в том, что их трудно использовать для трансфекции генов с инвертированными последовательностями (интронами) вследствие их удаления аппаратом ядерного сплайсинга (Li et al., Proc Ntl Acad Sci., USA 95:3650-3654, 1998).
Несоответствие между клеточным и ядерным окружением еще более усиливается в случае белков, кодируемых двумя генами, такими как антитела. Кроме того, хотя клетки Namalwa KJM-1 использовали для получения гибридом человек-человек, выходы антител привели к непригодности этой клеточной линии для промышленной продукции.
В качестве другого примера, было показано, что клеточная линия почки эмбриона человека 293 очень легко трансфицируется генами чужеродного происхождения с высокой степенью стабильности. Однако белки, происходящие из трансфектантов 293, имеют ограниченное применение и обычно пригодны только для целей исследования, поскольку клетки 293 включают ДНК аденовируса Ad5 человека (клетки HEK 293). Однако наибольшее ограничение при использовании клеток 293 в коммерческих условиях состоит в их прикрепляющемся характере. Был предпринят ряд попыток для адаптации клеток 293 к эффективной трансфекции в суспензии с использованием экономически целесообразных носителей, таких как полиэтиленимин (Durocher et al., Nucleic Acids Res 30(2):e9, 2002; Schlaeger et al., Cytotechnology 30:71-83, 1999) или фосфат кальция (Girard et al, Cytotechnology 38:15-21, 2002; Jordan et al., Cytotechnology 26:39-47, 1998; Meissner et al., Biotechnol Bioeng 75(2):197-203, 2001). Однако эти носители приводят только к временной экспрессии рекомбинантных белков, что означает, что трансфекцию необходимо повторять для каждой новой партии посеянной культуры. Для достижения роста в суспензии и высокой экспрессии белка, когда oriP EBV присутствует в остове вектора, клетки 293 необходимо генетически модифицировать для стабильной экспрессии белка EBNA1 вируса Эпштейна-Барр (293E) (Durocher et al., Nucleic Acids Res., 30(2):e9, 2002; Parham et al., Cytotechnology 35:181-187, 2001; Schlaeger et al., Cytotechnology 30:71-83, 1999). Даже после трансфекции посредством EBNA1, клетки 293E, при выращивании в бессывороточной среде (HEK293 EBNA1), (необходимое условие для крупномасштабной продукции) проявляют очень низкую скорость трансфекции, наиболее вероятно, вследствие присутствия полианионов (гепарин, сульфат декстрана), которые добавляют для предупреждения агрегации клеток. Были предприняты попытки решения этой проблемы путем дополнения среды пептонами, полученными ферментативным гидролизом животных источников, таких как мясо, желатин и казеин (Pham et al., Biotechnol Bioeng 84(3):332-42, 2003). Когда клеточную линию HEK293 EBNA1 использовали для продукции Tie-2 (рецепторная тирозинкиназа для ангиопоэтиновых факторов роста) и Нейропилина-1 ED (рецептор, который опосредует регуляцию нейрональных клеток), экспрессия белка была ограничена низкой плотностью клеток полученных культур по сравнению с нетрансфицированными культурами. Также чистота >95% полученного белка пригодна только для продуктов исследовательской категории. Кроме того, клетки HEK293 EBNA1 не пригодны для продукции моноклональных антител (mAb).
Современные стратегии продукции терапевтических mAb включают применение клеточных систем млекопитающих (т.е. трансфектом CHO или NSO) для рекомбинантной продукции mAb, получаемых путем иммунизации трансгенных мышей, несущих гены Ig человека (ксеномыши), гуманизации mAb грызунов или путем скрининга библиотек mAb человека (van Dijk et al., Curr. Opin. Chem. Biol. 5:368-374, 2001). В то время, как с точки зрения их последовательности, недавно терапевтические mAb стали преобразовывать в химерные (вариабельные области грызуна и константные области человека), гуманизированные (последовательность человека, за исключением определяющих комплементарность областей грызунов) и полностью человеческие антитела (Ab человека) для минимизации аллергического ответа, важным аспектом терапевтического mAb является его способность индуцировать иммунные эффекторные функции, такие как антителозависимая клеточная цитотоксичность, которая нарушается, если mAb продуцируется в клетках-хозяевах не млекопитающих, которые изменяют его нативный паттерн гликозилирования (Shinkawa et al., J. Biol. Chem. 278:3466-3473, 2003). В виду этих факторов, идеальный сценарий состоит в том, чтобы терапевтические антитела продуцировались клетками человека. В этом случае, полностью человеческие mAb могут быть способны осуществлять эффекторные функции человека и имеют очень ограниченную иммуногенность, вследствие их нативной для человека структуры.
Описано получение гибридом или трансформированных вирусом Эпштейна-Барр (EBV) лимфобластоидных клеточных линий, происходящих из B-клеток человека (Kirman et al., Hybrid. Hybridomics 21: 405-414, 2002; Boerner et al., J. Immunol. 147:86-95, 1991; Zafiropoulos et al., J. Immunol. Methods 200:181-190, 1997). Однако ограничена информация об охарактеризации этих mAb и клеточных линий в отношении их длительной стабильности и пригодности для процессов производства, особенно в отношении уровней продукции и стабильности секреции Ig на протяжении производства всей партии. Хотя были описаны клеточные линии, продуцирующие mAb человека против GM-CSF человека с совокупным титром 1,2 г/литр в течение 4-суток, эти клеточные линии были получены гибридизацией (слиянием) соматических клеток между первичными B-клетками человека и клетками гетеромиелолимфомы K6H6/B5 (т.е. клеточной линией мыши-человека, полученной гибридизацией B-клеточной лимфомы человека и клетки миеломы мыши (Li et al., Proc Natl Acad Sci USA 103(10):3557-3562, 2006).
В случае трансформации EBV, трудность состояла в установлении полностью иммортализованной B-клеточной линии человека при сохранении стабильной продукции антител. Это является следствием низкой эффективности иммортализации, остановки роста клеток и доминантной иммортализации продуцирующих IgM клеток. Кроме того, в недавних сообщениях было показано, что большинство трансформированных EBV B-клеток имеют укороченные теломеры и ограниченную продолжительность жизни, по большей части на уровнях менее 160 удвоений популяций (Sugimoto et al., J Virol 73:9690-9691, 1999; Toda et al., J Chromatogr B Analyt. Technol. Biomed. Life Sci. 787:197-206, 2003). Для преодоления этой проблемы были предприняты попытки гибридизации (или слияния) трансформированных EBV B-клеток с пригодной клеточной линией-партнером (экспрессирующей системой), однако в действительности эти клеточные линии-партнеры представляли собой различные комбинации гетерогибридов, такие как триома, происходящая из гетерогибридомы мыши-человека с B-клетками человека (Ainai et al., Hum Antibodies 15:139-154, 2006; Kalantarov et al., Hum Antibodies 11:85-96, 2002; Karpas et. al., Proc Natl Acad Sci USA 98:1799-1804, 2001). Когда такую триому подвергали слиянию с первичными трансформированными EBV B-клетками, продуцирующими антитело к столбнячному токсину (TT), это приводило к тетроме, имеющей на одну четверть компонент мыши. Хотя стабильная продукция mAb к TT была возможна после трехкратного последовательного клонирования тетром, такие повторяющиеся стадии клонирования клеток являются трудоемкими и требующими времени. Кроме того, хотя количества mAb, продуцируемых тетромами, были достаточными для экспериментальных целей, уровни были недостаточными для крупномасштабной продукции mAb в качестве фармацевтических средств. Все еще вызывает сомнение, может ли иммортализация в присутствии поликлонального активатора CpG 2006 или лигирования вместе CD19 или BCR приводить к полной системе для эффективной продукции специфических mAb в подходящих объемах для терапевтического применения (Hartman et al., J Immunol 164:944-953, 2000; Hur et al., Cell Prolif 38:35-45, 2005; Traggiai et al., Nat Med 10:871-875, 2004).
Был испробован ряд подходов для применения клеток человека для продукции биологических веществ, таких как факторы роста, антитела и растворимые белки.
Задачей настоящего изобретения является преодоление или уменьшение по меньшей мере одного из недостатков уровня техники, или предоставление пригодной альтернативы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Главным образом, считают, что многократно слитые клетки являются нестабильными, и что чем больше клеток вовлечено в слияние, тем большей является нестабильность полученной гибридной клетки. Неожиданно, в настоящем изобретении гибридные клетки, полученные слиянием нескольких клеток, например трех клеток, проявляют функциональную стабильность. В частности, было открыто, что клетки, происходящие из различных ростков, можно подвергать соматическому слиянию или гибридизовать с образованием по существу стабильных химерных/гибридных клеток. Более конкретно, настоящее изобретение относится к химерным/гибридным клеткам перекрестного происхождения, полученным гибридизацией по меньшей мере трех родительских клеток, приводящей к тройному гибриду, где по меньшей мере две родительские клетки происходят из различных ростков, и где в гибридизацию не включена клетка миеломы.
Также неожиданно было открыто, что стабильные химерные/гибридные клетки по изобретению применимы, например, для продукции белков, которые проявляют желаемые посттрансляционные модификации, такие как, но не ограничиваясь ими, паттерны гликозилирования человека.
Также было неожиданно открыто, что уровни экспрессии желаемого белка из стабильных химерных/гибридных клеток по изобретению могут увеличиваться, когда из химерных/гибридных клеток по изобретению одновременно экспрессируется второй желаемый белок. Более того, уровни экспрессии двух белков-мишеней могут увеличиваться при одновременной экспрессии третьего желаемого белка из химерных/гибридных клеток по изобретению.
Таким образом, настоящее изобретение обеспечивает существенные преимущества над ранее известными системами с точки зрения универсальности и стабильности гибридных клеток. В одном варианте осуществления гибридные клетки по изобретению получают слиянием двух идентичных клеток или двух клеток одного ростка и клетки другого ростка. Такой гибрид склонен к фенотипу, направленному в сторону большинства типов клеток, использованных для гибридизации. Эти гибридные клетки можно использовать, в частности, для экспрессии белков, в которых, как известно, тканеспецифические посттрансляционные модификации являются важными для функциональности белка. Например, цитокин, известный тем, что он имеет определенную функциональную посттрансляционную модификацию при экспрессии из B-клетки, может более эффективно экспрессироваться из гибридной клетки, которая включает по меньшей мере две клетки, происходящие из B-клеточного ростка, таким образом, обеспечивая функциональную посттрансляционную модификацию.
Поскольку посттрансляционная модификация белков может быть тканеспецифичной или специфичной к типу клетки, специалисту в данной области будет очевидно, что гибридные клетки по изобретению также можно обогащать конкретным типом клеток или фенотипом (на что указывает присутствие конкретных CD-маркеров) для обеспечения экспрессии белка, проявляющего желаемую посттрансляционную модификацию или желаемую функциональность, ассоциированную с конкретным типом клеток или фенотипом.
В одном варианте осуществления настоящее изобретение относится к гибридным клеткам, вовлекающим применение по меньшей мере одной иммортализованной клетки. Однако специалисту в данной области будет очевидно, что настоящее изобретение также относится к слиянию неиммортализованных клеток, которые впоследствии могут быть иммортализованы способом трансформации in vitro, таким как встраивание вирусных генов, например, генов вируса Эпштейна-Барр (EBV), гена T-антигена вируса 40 обезьян (SV40), E1A и E1B аденовируса, и E6 и E7 папилломавируса человека (HPV). Альтернативно неиммортализованные клетки можно иммортализовать путем экспрессии белка теломеразной обратной транскриптазы (TERT). Иммортализованные клетки также могут происходить из клеток, в которых модифицирована экспрессия онкогена. Иммортализованные клетки, кроме того, могут быть получены любым действием, которое индуцирует способность к неограниченному росту, включая, но не ограничиваясь ими, воздействие УФ или спонтанную трансформацию, при которой механизм бессмертия неизвестен.
Будет понятно, что настоящее изобретение относится, в одном варианте осуществления, к слиянию трех отдельных клеток. В альтернативном варианте осуществления настоящее изобретение относится к слиянию трех популяций клеток, где каждая популяция включает множество идентичных типов клеток. Специалисту в данной области будет понятно, что слияние популяций клеток можно проводить в смешанных клеточных культурах. Затем желаемые гибридизованные клетки можно идентифицировать, и выделять способами, хорошо известными в данной области, например с помощью селективной среды, такой как среда с гипоксантин-аминоптерин-тимидином (HAT). Альтернативно слитые клетки можно идентифицировать, и выделять путем идентификации конкретных клеточных маркеров, таких как маркеры CD.
Будет очевидно, что выделение клеток на основе экспрессии ими маркеров, таких как маркеры CD, а также обогащение клетки конкретным типом клетки или фенотипом, можно проводить способами, хорошо известными в данной области, такими как, способы активированной флуоресценцией сортировки клеток (FACS).
Также будет очевидно, что клетки по настоящему изобретению можно стабильно или временно трансфицировать ДНК, кодирующей желаемый белок. Эти стабильно или временно трансфицированные клетки можно идентифицировать способами, хорошо известными в данной области, например, путем включения селективного репортерного гена в ДНК, используемую для трансфекции. Такие репортерные гены могут включать гены, которые обеспечивают рост трансфицированных клеток в среде с дефицитом соединения, например ген дигидрофолатредуктазы (dhFr). Репортеры также могут включать гены, которые обеспечивают визуальную идентификацию трансфицированных клеток, например, ген люциферазы или ген зеленого флуоресцентного белка (gfp). Альтернативно репортерный ген может обеспечить устойчивость к конкретному соединению, например G418. Такие репортерные гены хорошо известны в данной области.
В одном предпочтительном варианте осуществления гибридные клетки по изобретению можно использовать для экспрессии моноклональных антител. Традиционно, продукцию моноклональных антител проводят путем слияния клетки миеломы и B-клетки, происходящей из селезенки иммунизированного животного, такого как мышь. Однако нестабильность клеток миеломы и, в частности, геномная нестабильность, может приводить к менее чем, удовлетворительной экспрессии желаемого антитела. Кроме того, поскольку для продукции гибридом используют клетки животных, продуцированные антитела обладают не являющимися человеческими посттрансляционными модификациями. Антитела с не являющимися человеческими посттрансляцинными модификациями могут приводить к существенным проблемам, когда антитела используют в качестве лекарственных средств у человека. Эти проблемы могут включать сниженную эффекторную функцию антитела, а также иммуногенность, приводящие к неудовлетворительному времени полужизни in vivo и, таким образом, сниженной эффективности in vivo. Также существуют данные, указывающие на то, что гибриды не могут успешно продуцироваться в отсутствие миеломной клетки. Гибридные клетки по изобретению неожиданно продемонстрировали, что стабильные гибриды можно продуцировать в отсутствие миеломной клетки. Более того, антитела, экспрессируемые с гибридных клеток по изобретению, решают проблемы, ассоциированные с применением моноклональных антител, продуцируемых гибридомами. Эти антитела проявляют гуманизированные посттрансляцонные модификации и экспрессируются из клеток, которые обладают функциональной стабильностью.
Согласно первому аспекту настоящее изобретение относится гибридной клетке, полученной гибридизацией: первой клетки, где указанная первая клетка представляет собой стволовую клетку или клетку, происходящую из некоммитированной клетки-предшественника; второй клетки, происходящей из общей лимфоидной клетки-предшественника; и третьей клетки, происходящей из общей лимфоидной клетки-предшественника, и где указанная первая клетка не является миеломной клеткой.
В одном варианте осуществления указанная вторая клетка представляет собой клетку, происходящую из B-лимфоидного ростка, и указанная третья клетка представляет собой клетку, происходящую из B-лимфоидного ростка.
В другом варианте осуществления указанная вторая клетка представляет собой клетку, происходящую из T-лимфоидного ростка, и указанная третья клетка происходит из T-лимфоидного ростка.
В другом варианте осуществления указанная вторая клетка представляет собой клетку, происходящую из B-лимфоидного ростка, и указанная третья клетка представляет собой клетку, происходящую из T-лимфоидного ростка.
Предпочтительно, указанная первая клетка представляет собой клетку, происходящую из общей миелоидной клетки-предшественника. По существу, очевидно, что изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки, и двух B-лимфоидных клеток или двух T-лимфоидных клеток. Также изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки и T-лимфоидной клетки.
Предпочтительно, указанная клетка, происходящая из общей миелоидной клетки-предшественника, представляет собой миеломоноцитарного предшественника, моноцит, макрофаг, эозинофил, нейтрофил, дендритную клетку или базофил. По существу, очевидно, что изобретение относится к гибридной клетке, полученной гибридизацией миеломоноцитарного предшественника, моноцита, макрофага, эозинофила, нейтрофила, дендритной клетки или базофила и двух B-лимфоидных клеток или двух T-лимфоидных клеток. Изобретение также относится к гибридной клетке, полученной гибридизацией миеломоноцитарного предшественника, моноцита, макрофага, эозинофила, нейтрофила, дендритной клетки или базофила, B-лимфоидной клетки и T-лимфоидной клетки.
Предпочтительно, указанная клетка, происходящая из общей миелоидной клетки-предшественника, экспонирует по меньшей мере один из следующих антигенов CD: CD16, CD15 или CD14. По существу, очевидно, что изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника, которая экспонирует по меньшей мере один из следующих антигенов CD: CD16, CD15 или CD14, и двух B-лимфоидных клеток или двух T-лимфоидных клеток. Также изобретение относится к гибридной клетке, полученной гибридизацией гибридной клетки, полученной гибридизацией общей миелоидной клетки-предшественника, которая экспонирует по меньшей мере один из следующих антигенов CD: CD16, CD15 или CD14, B-лимфоидной клетки и T-лимфоидной клетки.
В одном варианте осуществления указанная клетка, происходящая из общей миелоидной клетки-предшественника, представляет собой моноцит. По существу, изобретение относится к гибридной клетке, полученной гибридизацией моноцита и двух B-лимфоидных клеток или двух T-лимфоидных клеток. Также изобретение относится к гибридной клетке, полученной гибридизацией моноцита, B-лимфоидной клетки и T-лимфоидной клетки.
В другом варианте осуществления указанная клетка, происходящая из общей миелоидной клетки-предшественника, представляет собой первичного миеломоноцитарного предшественника. По существу, изобретение относится к гибридной клетке, полученной гибридизацией первичного миеломоноцитарного предшественника и двух B-лимфоидных клеток или двух T-лимфоидных клеток. Также изобретение относится к гибридной клетке, полученной гибридизацией первичного миеломоноцитарного предшественника, B-лимфоидной клетки и T-лимфоидной клетки.
В одном варианте осуществления указанная клетка, происходящая из общей миелоидной клетки-предшественника, представляет собой иммортализованную клетку. По существу, очевидно, что изобретение относится к гибридной клетке, полученной путем гибридизации иммортализованной клетки, выбранной из миеломоноцитарного предшественника, моноцита, макрофага, эозинофила, нейтрофила, дендритной клетки или базофила и двух B-лимфоидных клеток или двух T-лимфоидных клеток. Также изобретение относится к гибридной клетке, полученной гибридизацией иммортализованной клетки, выбранной из миеломоноцитарного предшественника, моноцита, макрофага, эозинофила, нейтрофила, дендритной клетки или базофила, B-лимфоидной клетки и T-лимфоидной клетки.
В другом варианте осуществления указанная клетка, происходящая из общей миелоидной клетки-предшественника, происходит из селезенки, периферической крови, пуповинной крови или костного мозга. По существу, очевидно, что изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника, происходящей из селезенки, периферической крови, пуповинной крови или костного мозга, и двух B-лимфоидных клеток или двух T-лимфоидных клеток. Также изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника, происходящей из селезенки, периферической крови, пуповинной крови или костного мозга, B-лимфоидной клетки и T-лимфоидной клетки.
В другом варианте осуществления указанная клетка, происходящая из B-лимфоидного ростка, представляет собой пре-B-клетку, незрелую B-клетку, наивную B-клетку, активированную B-клетку или эффекторную B-клетку. По существу, очевидно, что изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки и двух B-лимфоидных клеток, выбранных из пре-B-клетки, незрелой B-клетки, наивной B-клетки, активированной B-клетки или эффекторной B-клетки. Также изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки, выбранной из пре-B-клетки, незрелой B-клетки, наивной B-клетки, активированной B-клетки или эффекторной B-клетки и T-лимфоидной клетки.
В одном варианте осуществления указанная эффекторная B-клетка представляет собой обученную антигеном B-клетку или плазматическую клетку. По существу, изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки и двух B-лимфоидных клеток, выбранных из обученной антигеном B-клетки или плазматической клетки. Также изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки, обученной антигеном B-клетки или плазматической клетки и T-лимфоидной клетки.
В одном варианте осуществления, указанная клетка, происходящая из B-лимфоидного ростка, экспонирует по меньшей мере один из следующих антигенов CD: CD19, CD20, CD72 или CD5. По существу, изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки и двух B-лимфоидных клеток, которые экспонируют по меньшей мере один из следующих антигенов CD: CD19, CD20, CD72 или CD5. Также изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки, которая экспонирует по меньшей мере один из следующих антигенов CD: CD19, CD20, CD72 или CD5, и T-лимфоидной клетки.
В одном варианте осуществления, указанная клетка, происходящая из T-лимфоидного ростка, представляет собой пре-T-клетку, незрелую T-клетку, наивную T-клетку, активированную T-клетку или эффекторную T-клетку. По существу, изобретение относится к гибридной клетке, получаемой гибридизацией общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки и T-лимфоидной клетки, выбранной из пре-T-клетки, незрелой T-клетки, наивной T-клетки, активированной T-клетки или эффекторной T-клетки. Также изобретение относится к гибридной клетке, получаемой гибридизацией общей миелоидной клетки-предшественника или стволовой клетки и двух T-лимфоидных клеток, выбранных из пре-T-клетки, незрелой T-клетки, наивной T-клетки, активированной T-клетки или эффекторной T-клетки.
В одном варианте осуществления указанная клетка, происходящая из T-лимфоидного ростка, экспонирует по меньшей мере один из следующих антигенов CD: CD3, CD4, CD5 или CD8. По существу, изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки и T-лимфоидной клетки, которая экспонирует по меньшей мере один из следующих антигенов CD: CD3, CD4, CD5 или CD8. Также изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки и двух T-лимфоидных клеток, выбранных из T-клеток, которые экспонируют по меньшей мере один из следующих антигенов CD: CD3, CD4, CD5 или CD8.
В одном варианте осуществления указанная клетка, происходящая из B-лимфоидного ростка, представляет собой иммортализованную клетку. По существу, изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки и двух B-лимфоидных клеток, по меньшей мере одна из которых может быть бессмертной клеткой. Также изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки, бессмертной B-лимфоидной клетки и T-лимфоидной клетки.
В одном варианте осуществления указанная клетка, происходящая из T-лимфоидного ростка, представляет собой иммортализованную клетку. По существу, изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки и бессмертной T-лимфоидной клетки.
В одном варианте осуществления указанная клетка, происходящая из B-лимфоидного ростка, происходит из лимфоидной ткани. По существу, изобретение относится к гибридной клетке, получаемой гибридизацией общей миелоидной клетки-предшественника или стволовой клетки и двух B-лимфоидных клеток, происходящих из лимфоидной ткани. Также изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки, происходящей из лимфоидной ткани, и T-лимфоидной клетки.
В одном варианте осуществления указанная клетка, происходящая из T-лимфоидного ростка, происходит из лимфоидной ткани. По существу, изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки и T-лимфоидной клетки, происходящей из лимфоидной ткани.
Когда B или T-лимфоидные клетки, включенные в гибридные клетки по изобретению, происходят из лимфоидной ткани, указанная лимфоидная ткань предпочтительно выбрана из периферической крови, пуповинной крови, селезенки, костного мозга, тимуса, миндалевидных желез, аденоидов и регионарного лимфатического узла.
В одном варианте осуществления по меньшей мере одна из клеток, вовлеченная в образование гибридной клетки по изобретению, представляет собой клетку человека. Также будет очевидно, что в одном варианте осуществления гибридная клетка по изобретению может включать по меньшей мере одну клетку мыши.
В одном варианте осуществления указанная клетка, происходящая из общей миелоидной клетки-предшественника, представляет собой клетку K562. По существу, будет понятно, что изобретение относится к гибридной клетке, полученной гибридизацией клетки K562 и двух B-лимфоидных клеток. Также изобретение относится к гибридной клетке, полученной гибридизацией клетки K562, бессмертной B-лимфоидной клетки и T-лимфоидной клетки.
В одном варианте осуществления указанная вторая клетка или указанная третья клетка представляет собой клетку WIL2-NS или клетку MOLT4. По существу, будет очевидно, что изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки, клетки WIL2-NS и T-лимфоидной клетки. Также изобретение относится к гибридной клетке, полученной гибридизацией общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки и клетки MOLT4.
В одном варианте осуществления указанная первая клетка представляет собой клетку K562, указанная вторая клетка представляет собой клетку WIL2-NS, и указанная третья клетка представляет собой клетку MOLT4.
В другом варианте осуществления указанная первая клетка представляет собой клетку K562, указанная вторая клетка представляет собой первичную B-клетку, и указанная третья клетка представляет собой первичную T-клетку.
В другом варианте осуществления указанная первая клетка представляет собой первичный моноцит человека, указанная вторая клетка представляет собой клетку WIL2-NS, и указанная третья клетка представляет собой первичную T-клетку.
В другом варианте осуществления указанная первая клетка представляет собой первичного миеломоноцитарного предшественника человека, указанная вторая клетка представляет собой клетку WIL2-NS, и указанная третья клетка представляет собой первичную T-клетку человека.
В другом варианте осуществления указанная первая клетка представляет собой клетку K562, указанная вторая клетка представляет собой клетку WIL2-NS, и указанная третья клетка представляет собой первичную T-клетку.
В другом варианте осуществления указанная первая клетка представляет собой первичный моноцит, указанная вторая клетка представляет собой клетку WIL2-NS, и указанная третья клетка представляет собой клетку WIL2-NS.
В другом варианте осуществления указанная первая клетка представляет собой первичный моноцит мыши, указанная вторая клетка представляет собой клетку SP2, и указанная третья клетка представляет собой первичную T-клетку мыши.
В другом варианте осуществления указанная первая клетка представляет собой первичный моноцит мыши, указанная вторая клетка представляет собой клетку SP2, и указанная третья клетка представляет собой клетку SP2.
В другом варианте осуществления указанная первая клетка представляет собой первичный моноцит человека или мыши, указанная вторая клетка представляет собой клетку WIL2-NS, и указанная третья клетка представляет собой клетку SP2.
В одном варианте осуществления гибридная клетка по изобретению экспрессирует желаемый белок. В другом варианте осуществления гибридная клетка по изобретению экспрессирует более одного желаемого белка. В определенных вариантах осуществления гибридная клетка по изобретению экспрессирует два желаемых белка. В других вариантах осуществления гибридная клетка по изобретению экспрессирует три желаемых белка. В одном варианте осуществления указанный желаемый белок представляет собой эндогенный белок и, где экспрессируется более одного желаемого белка, по меньшей мере один из желаемых белков представляет собой эндогенный белок. В другом варианте осуществления указанный белок представляет собой рекомбинантный белок и, где экспрессируется более одного желаемого белка, по меньшей мере один из желаемых белков представляет собой рекомбинантный белок. Предпочтительно указанный белок представляет собой цитокин, например, колониестимулирующий фактор или интерлейкин. В одном варианте осуществления указанный белок представляет собой GM-CSF. В другом варианте осуществления указанный белок представляет собой интерлейкин 2. В другом варианте осуществления указанный белок представляет собой рецептор или его фрагмент. В одном варианте осуществления указанный белок представляет собой растворимый рецептор. В следующем варианте осуществления указанный белок представляет собой иммуноглобулин.
В одном варианте осуществления указанный белок представляет собой альфа-цепь рецептора IL-4 человека. В другом варианте осуществления указанный белок представляет собой IgM. В другом варианте осуществления указанный белок представляет собой IgG. В следующем варианте осуществления указанный белок представляет собой CD54.
В одном варианте осуществления, где гибридная клетка по изобретению экспрессирует более одного желаемого белка, предпочтительно желаемые белки выбраны из цитокина, колониестимулирующего фактора, интерлейкина или рецептора или его фрагмента. В конкретном варианте осуществления желаемые белки представляют собой иммуноглобулин, такой как IgM и, в частности, растворимый IgM человека; цитокин, например интерлейкин и, в частности, интерлейкин-2 (IL-2) и, более конкретно, IL-2 человека; и/или рецептор, в частности, рецептор интерлейкина и, более конкретно, рецептор интерлейкина человека и, еще более конкретно, рецептор альфа интерлейкина-4 человека (IL-4Ra).
Квалифицированному специалисту будет понятно, что гибридные клетки по изобретению не ограничиваются экспрессией конкретных желаемых белков, а также они не ограничиваются экспрессией определенного количества белков. Более того, квалифицированному специалисту будет очевидно, что одновременная экспрессия желаемых белков с гибридных клеток по изобретению может приводить к увеличению уровней экспрессии желаемого белка.
В одном варианте осуществления указанной гибридизации, используемой для получения гибридной клетки по изобретению, достигают с помощью электрических средств. В другом варианте осуществления указанной гибридизации для получения гибридной клетки по изобретению достигают с помощью химических средств.
В одном варианте осуществления гибридная клетка по изобретению, кроме того, гибридизована с клеткой, которая экспрессирует представляющий интерес белок.
В конкретном варианте осуществления гибридная клетка по изобретению гибридизуется с B-лимфоцитом, который экспонирует антиген CD25.
В особенно предпочтительном варианте осуществления гибридная клетка по изобретению экспонирует антиген CD25 и экспрессирует иммуноглобулин. В следующем варианте осуществления гибридную клетку по изобретению гибридизуют с B-лимфоцитом, который экспонирует антиген CD25, и полученная клетка экспрессирует иммуноглобулин.
В одном варианте осуществления указанную гибридизацию, используемую для получения гибридной клетки по изобретению, проводят гибридизацией трех отдельных клеток.
В другом варианте осуществления указанную гибридизацию, используемую для получения гибридной клетки по изобретению, проводят с использованием трех популяций клеток, где каждая указанная популяция включает множество идентичных типов клеток или фенотипов.
В одном варианте осуществления указанная гибридная клетка по изобретению обогащена конкретным определяющим тип клетки маркером для обеспечения экспрессии белка, проявляющего желаемую посттрансляционную модификацию или желаемую функциональность.
В другом аспекте изобретение относится к способу продукции белка, причем указанный способ включает стадию экспрессии белка в гибридной клетке согласно изобретению.
В другом аспекте изобретение относится к белку, продуцированному в гибридной клетке согласно изобретению.
В другом аспекте изобретение относится к способу получения гибридной клетки согласно изобретению, где указанный способ включает стадию гибридизации: первой клетки, где указанная первая клетка представляет собой стволовую клетку или клетку, происходящую из некоммитированной клетки-предшественника; второй клетки, происходящей из общей лимфоидной клетки-предшественника; и третьей клетки, происходящей из общей лимфоидной клетки-предшественника, и где указанная первая клетка не является клеткой миеломы.
В одном варианте осуществления способа по изобретению указанная вторая клетка представляет собой клетку, происходящую из B-лимфоидного ростка, и указанная третья клетка представляет собой клетку, происходящую из B-лимфоидного ростка.
В другом варианте осуществления способа по изобретению указанная вторая клетка представляет собой клетку, происходящую из T-лимфоидного ростка, и указанная третья клетка происходит из T-лимфоидного ростка.
В другом варианте осуществления способа по изобретению, указанная вторая клетка представляет собой клетку, происходящую из B-лимфоидного ростка, и указанная третья клетка представляет собой клетку, происходящую из T-лимфоидного ростка.
Предпочтительно, указанная первая клетка представляет собой клетку, происходящую из общей миелоидной клетки-предшественника. По существу, очевидно, что изобретение относится к способу получения гибридной клетки гибридизацией общей миелоидной клетки-предшественника или стволовой клетки, и двух B-лимфоидных клеток или двух T-лимфоидных клеток. Также изобретение относится к способу получения гибридной клетки гибридизацией общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки и T-лимфоидной клетки.
Предпочтительно указанная клетка, происходящая из общей миелоидной клетки-предшественника, представляет собой миеломоноцитарного предшественника, моноцит, макрофаг, эозинофил, нейтрофил, дендритную клетку или базофил. По существу, очевидно, что изобретение относится к способу получения гибридной клетки путем гибридизации миеломоноцитарного предшественника, моноцита, макрофага, эозинофила, нейтрофила, дендритной клетки или базофила и двух B-лимфоидных клеток или двух T-лимфоидных клеток. Также изобретение относится к способу получения гибридной клетки гибридизацией миеломоноцитарного предшественника, моноцита, макрофага, эозинофила, нейтрофила, дендритной клетки или базофила, B-лимфоидной клетки и T-лимфоидной клетки.
Предпочтительно указная клетка, происходящая из общей миелоидной клетки-предшественника, экспонирует по меньшей мере один из следующих антигенов CD: CD16, CD15 или CD14. По существу, очевидно, что изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника, которая экспонирует по меньшей мере один из следующих антигенов CD: CD16, CD15 или CD14, и двух B-лимфоидных клеток или двух T-лимфоидных клеток. Также изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника, которая экспонирует по меньшей мере один из следующих антигенов CD: CD16, CD15 или CD14, B-лимфоидной клетки и T-лимфоидной клетки.
В одном варианте осуществления указанная клетка, происходящая из общей миелоидной клетки-предшественника, представляет собой моноцит. По существу, изобретение относится к способу получения гибридной клетки путем гибридизации моноцита и двух B-лимфоидных клеток или двух T-лимфоидных клеток. Также изобретение относится к способу получения гибридной клетки путем гибридизации моноцита, B-лимфоидной клетки и T-лимфоидной клетки.
В другом варианте осуществления указанная клетка, происходящая из общей миелоидной клетки-предшественника, представляет собой первичного миеломоноцитарного предшественника. По существу, изобретение относится к способу получения гибридной клетки путем гибридизации первичного миеломоноцитарного предшественника и двух B-лимфоидных клеток или двух T-лимфоидных клеток. Также изобретение относится к способу получения гибридной клетки путем гибридизации первичного миеломоноцитарного предшественника, B-лимфоидной клетки и T-лимфоидной клетки.
В одном варианте осуществления указанная клетка, происходящая из общей миелоидной клетки-предшественника, представляет собой иммортализованную клетку. По существу, очевидно, что изобретение относится к способу получения гибридной клетки путем гибридизации иммортализованной клетки, выбранной из миеломоноцитарного предшественника, моноцита, макрофага, эозинофила, нейтрофила, дендритной клетки или базофила, и двух B-лимфоидных клеток или двух T-лимфоидных клеток. Также изобретение относится к способу получения гибридной клетки путем гибридизации иммортализованной клетки, выбранной из миеломоноцитарного предшественника, моноцита, макрофага, эозинофила, нейтрофила, дендритной клетки или базофила, B-лимфоидной клетки и T-лимфоидной клетки.
В другом варианте осуществления указанная клетка, происходящая из общей миелоидной клетки-предшественника, происходит из селезенки, периферической крови, пуповинной крови или костного мозга. По существу, очевидно, что изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника, происходящей из селезенки, периферической крови, пуповинной крови или костного мозга, и двух B-лимфоидных клеток или двух T-лимфоидных клеток. Также изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника, происходящей из селезенки, периферической крови, пуповинной крови или костного мозга, B-лимфоидной клетки и T-лимфоидной клетки.
В другом варианте осуществления указанная клетка, происходящая из B-лимфоидного ростка, представляет собой пре-B-клетку, незрелую B-клетку, наивную B-клетку, активированную B-клетку или эффекторную B-клетку. По существу, очевидно, что изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки и двух B-лимфоидных клеток, выбранных из пре-B-клетки, незрелой B-клетки, наивной B-клетки, активированной B-клетки или эффекторной B-клетки. Также изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки, выбранной из пре-B-клетки, незрелой B-клетки, наивной B-клетки, активированной B-клетки или эффекторной B-клетки и T-лимфоидной клетки.
В одном варианте осуществления указанная эффекторная B-клетка представляет собой обученную антигеном B-клетку или плазматическую клетку. По существу, изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки и двух B-лимфоидных клеток, выбранных из обученной антигеном B-клетки или плазматической клетки. Также изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки, обученной антигеном B-клетки или плазматической клетки и T-лимфоидной клетки.
В одном варианте осуществления указанная клетка, происходящая из B-лимфоидного ростка, экспонирует по меньшей мере один из следующих антигенов CD: CD19, CD20, CD72 или CD5. По существу, изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки и двух B-лимфоидных клеток, которые экспонируют по меньшей мере один из следующих антигенов CD: CD 19, CD20, CD72 или CD5. Также изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки, которая экспонирует по меньшей мере один из следующих антигенов CD: CD19, CD20, CD72 или CD5, и T-лимфоидной клетки.
В одном варианте осуществления указанная клетка, происходящая из T-лимфоидного ростка, представляет собой пре-T-клетку, незрелую T-клетку, наивную T-клетку, активированную T-клетку или эффекторную T-клетку. По существу, изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки и T-лимфоидной клетки, выбранной из пре-T-клетки, незрелой T-клетки, наивной T-клетки, активированной T-клетки или эффекторной T-клетки. Также изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки и двух T-лимфоидных клеток, выбранных из пре-T-клетки, незрелой T-клетки, наивной T-клетки, активированной T-клетки или эффекторной T-клетки.
В одном варианте осуществления указанная клетка, происходящая из T-лимфоидного ростка, экспонирует по меньшей мере один из следующих антигенов CD: CD3, CD4, CD5 или CD8. По существу, изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки и T-лимфоидной клетки, которая экспонирует по меньшей мере один из следующих антигенов CD: CD3, CD4, CD5 или CD8. Также изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки и двух T-лимфоидных клеток, выбранных из T-клеток, которые экспонируют по меньшей мере один из следующих антигенов CD: CD3, CD4, CD5 или CD8.
В одном варианте осуществления указанная клетка, происходящая из B-лимфоидного ростка, представляет собой иммортализованную клетку. По существу, изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки и двух B-лимфоидных клеток, по меньшей мере одна из которых может представлять собой бессмертную клетку. Также изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки, бессмертной B-лимфоидной клетки и T-лимфоидной клетки.
В одном варианте осуществления указанная клетка, происходящая из T-лимфоидного ростка, представляет собой иммортализованную клетку. По существу, изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки и бессмертной T-лимфоидной клетки.
В одном варианте осуществления указанная клетка, происходящая из B-лимфоидного ростка, происходит из лимфоидной ткани. По существу, изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки и двух B-лимфоидных клеток, происходящих из лимфоидной ткани. Также изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки, происходящей из лимфоидной ткани, и T-лимфоидной клетки.
В одном варианте осуществления, указанная клетка, происходящая из T-лимфоидного ростка, происходит из лимфоидной ткани. По существу, изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки и T-лимфоидной клетки, происходящих из лимфоидной ткани.
Когда B- или T-лимфоидные клетки, вовлеченные в способ получения гибридной клетки по изобретению, происходят из лимфоидной ткани, указанная лимфоидная ткань предпочтительно выбрана из периферической крови, пуповинной крови, селезенки, костного мозга, тимуса, миндалевидных желез, аденоидов и регионарного лимфатического узла.
В одном варианте осуществления по меньшей мере одна из клеток, вовлеченных в способ получения гибридной клетки по изобретению, представляет собой клетку человека. Также будет очевидно, что, в одном варианте осуществления, способ получения гибридной клетки по изобретению может включать по меньшей мере одну клетку мыши.
В одном варианте осуществления указанная клетка, происходящая из общей миелоидной клетки-предшественника, представляет собой клетку K562. По существу, будет очевидно, что изобретение относится к способу получения гибридной клетки путем гибридизации клетки K562 и двух B-лимфоидных клеток. Также изобретение относится к способу получения гибридной клетки путем гибридизации клетки K562, бессмертной B-лимфоидной клетки и T-лимфоидной клетки.
В одном варианте осуществления указанная вторая клетка или указанная третья клетка представляет собой клетку WIL2-NS или клетку MOLT4. По существу, будет очевидно, что изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки, клетки WIL2-NS и T-лимфоидной клетки. Также изобретение относится к способу получения гибридной клетки путем гибридизации общей миелоидной клетки-предшественника или стволовой клетки, B-лимфоидной клетки и клетки MOLT4.
В одном варианте осуществления указанная первая клетка представляет собой клетку K562, указанная вторая клетка представляет собой клетку WIL2-NS, и указанная третья клетка представляет собой клетку MOLT4.
В другом варианте осуществления способа по изобретению указанная первая клетка представляет собой клетку K562, указанная вторая клетка представляет собой первичную B-клетку, и указанная третья клетка представляет собой первичную T-клетку.
В другом варианте осуществления способа по изобретению указанная первая клетка представляет собой первичный моноцит человека, указанная вторая клетка представляет собой клетку WIL2-NS, и указанная третья клетка представляет собой первичную T-клетку.
В другом варианте осуществления способа по изобретению указанная первая клетка представляет собой первичный миеломоноцитарный предшественник человека, указанная вторая клетка представляет собой клетку WIL2-NS, и указанная третья клетка представляет собой первичную T-клетку человека.
В другом варианте осуществления способа по изобретению указанная первая клетка представляет собой клетку K562, указанная вторая клетка представляет собой клетку WIL2-NS, и указанная третья клетка представляет собой первичную T-клетку.
В другом варианте осуществления способа по изобретению указанная первая клетка представляет собой первичный моноцит, указанная вторая клетка представляет собой клетку WIL2-NS, и указанная третья клетка представляет собой клетку WIL2-NS.
В другом варианте осуществления способа по изобретению указанная первая клетка представляет собой первичный моноцит мыши, указанная вторая клетка представляет собой клетку SP2, и указанная третья клетка представляет собой первичную T-клетку мыши.
В другом варианте осуществления способа по изобретению указанная первая клетка представляет собой первичный моноцит мыши, указанная вторая клетка представляет собой клетку SP2, и указанная третья клетка представляет собой клетку SP2.
В другом варианте осуществления способа по изобретению указанная первая клетка представляет собой первичный моноцит человека или мыши, указанная вторая клетка представляет собой клетку WIL2-NS, и указанная третья клетка представляет собой клетку SP2.
ОПРЕДЕЛЕНИЯ
В контексте настоящего изобретения слова "содержит", "содержащий" и т.п. следует истолковывать в их включающем, а не в их исключающем, значении, т.е. в значении "включая, но не ограничиваясь ими".
Гибридная клетка
Гибридная клетка представляет собой клетку, которая содержит компоненты более чем из одного генома (отличную от зигот и их производных). Она представляет собой клетку, которую конструируют гибридизацией соматических клеток (или гибридизацией целых клеток) например, двух или более биологических клеток (родительских клеток). Родительские клетки можно получать либо из одного и того же ростка (или вида), либо из различных ростков (или видов). Гибридную клетку, полученную из одного ростка и вида, называют аутогибридом, в то время как клетку из различных ростков называют гетерогибридом.
Химерная клетка
Химерная клетка представляет собой искусственно полученную гибридную клетку с геномом, происходящим из двух или более различных видов.
Гибридная клетка перекрестного происхождения
Гибридная клетка перекрестного происхождения представляет собой искусственно полученную гибридную клетку с геномом, происходящим из двух или более клеток, происходящих из различных клеточных ростков. Кроветворные клетки подразделяются на два основных ростка: лимфоидные (T-клетки, B-клетки и NK-клетки) и миелоидные (моноциты и макрофаги, нейтрофилы, базофилы и эозинофилы, эритроциты, мегакариоциты/тромбоциты, дендритные клетки).
Тригибридная клетка
Тригибридная клетка представляет собой искусственно продуцированную гибридную клетку с геномом, происходящим из трех клеток.
Стабильный
При указании на клетку, термин "стабильный" обозначает способность клетки демонстрировать постоянство данного параметра роста или продуктивности, или постоянство характеристик продукта клеточной линии при увеличении номера поколения. При использовании в отношении стабильного трансфектанта, он обозначает клеточную линию, которая экспрессирует трансген на относительно постоянном уровне по существу неограниченно долго.
Гибридизация соматических клеток
В контексте настоящей заявки термин "гибридизация соматических клеток" относится к способу, в котором образуется одна жизнеспособная клетка из двух или более диплоидных (не гаметических) клеток (родительских клеток) таким образом, чтобы индуцировался тесный контакт плазматических мембран клеток, одновременно индуцировалось обратимое разрушение плазматических мембран родительских клеток в точке контакта и структуры или органеллы каждой родительской клетки объединялись в оболочке вновь образованной единичной клетки. Вновь образованную единичную клетку называют гибридизованной клеткой или гибридной клеткой.
Стволовая клетка
Термин "стволовая клетка" относится к неспециализированной клетке со способностью к делению митозом и к развитию в ряд различных типов клеток. Стволовые клетки могут включать эмбриональные стволовые клетки, "взрослые" стволовые клетки, происходящие из пуповинной крови, или стволовые клетки, происходящие от взрослых. Стволовые клетки включают клетки, которые обладают неограниченной способностью к дифференцировке во все типы клеток, т.е. тотипотентные клетки. Стволовые клети также могут включать клетки, которые ограничены по их способности диференцироваться в специализированные клетки, например плюрипотентные, мультипотентные, олигопотентные или унипотентные стволовые клетки.
Иммортализованная клетка
Термин "иммортализованная клетка" относится к клетке, которая обладает способностью к неограниченному росту. Будет очевидно, что иммортализованная клетка может происходить из злокачественной опухоли in vivo или эмбриона. Альтернативно иммортализованная клетка может быть получена путем проведения действия над клеткой, которое индуцирует способность к неограниченному росту. Эти действия могут включать, например, процессы трансформации in vitro, например, введение вирусных генов, таких как гены вируса Эпштейна-Барр (EBV), ген T-антигена вируса обезьян 40 (SV40), E1A и E1B аденовируса, и E6 и E7 папилломавируса человека (HPV). Альтернативно иммортализованная клетка может быть получена из клетки путем экспрессии белка теломеразной обратной транскриптазы (TERT) или другими способами. Иммортализованные клетки также могут происходить из клеток, в которых экспрессия онкогена была модифицирована. Иммортализованные клетки могут быть получены любым действием, которое индуцирует способность к неограниченному росту, включая, но не ограничиваясь ими, воздействие УФ или спонтанную трансформацию, в случае которой механизм бессмертия неизвестен.
Миеломная клетка
Термин "миеломная клетка" относится к злокачественному развитию плазматической клетки.
Гибридома
Термин "гибридома" относится к клетке, которая получена гибридизацией миеломной клетки и B-клетки, происходящей из селезенки иммунизированного животного. Гибридомы представляют собой иммортализованные клетки со способностью продуцировать моноклональные антитела.
Некоммитированная клетка-предшественник
Термин "некоммитированная клетка-предшественник" относится к раннему потомку стволовой клетки, который может дифференцироваться только в ограниченные типы клеток без коммитирования в какой-либо конкретный росток, но более не может самообновляться.
Общая миелоидная клетка-предшественник
Общая миелоидная клетка-предшественник представляет собой потомка гемопоэтической стволовой клетки, ограниченного миелоидным ростком и способного давать начало предшественникам либо мегакариоцитов/эритроцитов, либо гранулоцитов/макрофагов, но не лимфоидных клеток.
Общий лимфоидный предшественник
Общий лимфоидный предшественник представляет собой потомка гемопоэтических стволовых клеток, ограниченного лимфоидным ростком и дающего начало B-, T- и естественным киллерным клеткам, но не миелоидным клеткам.
Клетка, происходящая из B-лимфоидного ростка
Клетка, происходящая из B-лимфоидного ростка, представляет собой клетку, происходящую из общего лимфоидного предшественника после его коммитирования в B-росток для превращения в любой тип B-клеток.
Клетка, происходящая из T-лимфоидного ростка
Клетка, происходящая из T-лимфоидного ростка, представляет собой любую клетку, происходящую из общего лимфоидного предшественника после его коммитирования в T-росток для превращения в любой тип T-клеток.
Гранулоцитарно-макрофагальная клетка-предшественник
Гранулоцитарно-макрофагальная клетка-предшественник представляет собой клетку-предшественника, происходящую из общей миелоидной клетки-предшественника и коммитированную в гранулоцитарный и моноцитарный ростки, но не в мегакариоцитарный и эритроидный ростки.
Мегакариоцитарно-эритроидная клетка-предшественник
Мегакариоцитарно-эритроидная клетка-предшественник представляет собой клетку-предшественника, происходящую из общей миелоидной клетки-предшественника и коммитированную в мегакариоцитарный и эритроидный ростки, но не в гранулоцитарный и моноцитарный ростки.
Пре-B-клетка
Пре-B-клетка представляет собой развивающуюся B-клетку на стадии, когда тяжелая цепь мембраносвязанного IgM экспрессируется с суррогатной легкой цепью.
Незрелая B-клетка
Незрелая B-клетка относится к развивающейся B-клетке в костном мозге, где на стадии рекомбинации локусов антитела происходит реаранжировка VJ на L-цепях и реаранжировка VDJ на H-цепях, и происходит экспрессия рецептора IgM.
Наивная B-клетка
Наивная B-клетка представляет собой зрелую B-клетку, которая дифференцировалась и созрела в костном мозге путем случайной реаранжировки генов ее поверхностного иммуноглобулина, но еще не встретила распознаваемый ею антиген на периферии.
Активированная B-клетка
Тип зрелой B-клетки, которая встретила распознаваемый ею антиген на периферии путем распознавания антигена через BCR, что приводит к комбинации клональной пролиферации и терминальной дифференцировке в плазматические клетки T-зависимым или независимым образом.
Эффекторная B-клетка
Эффекторная B-клетка часто является синонимом секретирующей антитело плазматической клетки - типу короткоживущей B-клетки, которая секретирует антитела, специфичные к конкретному антигену, а также множество цитокинов для привлечения других клеток иммунной системы.
B-клетка памяти
B-клетки памяти представляют собой длительно живущие B-клетки, образованные из активированных B-клеток, которые являются специфичными к антигену, встреченному в ходе первичного иммунного ответа, и способны к быстрому ответу после второго воздействия того же антигена.
Плазматическая клетка
Плазматическая клетка представляет собой конечную постмитотическую короткоживущую клетку иммунной системы, которая дифференцируется из B-клетки при стимуляции CD4+-лимфоцитом (Th-клетки) и секретирует большое количество антител.
Пре-T-клетка
Пре-T-клетка представляет собой развивающуюся T-клетку на стадии, когда VbDbJb является полным и бета-цепь TCR экспрессируется в двойной отрицательной (CD4-CD8-) T-клетке (CD3+).
Незрелая T-клетка
Незрелая T-клетка представляет собой развивающуюся T-клетку, которая мигрировала из костного мозга в тимус, но не завершила реаранжировку ее TCR или селекцию по ее связывающей способности TCR в отношении собственных пептидов, представленных в контексте собственных молекул основного комплекса гистосовместимости (MHC), или претерпела коммитирование в T-киллерные или T-хелперные ростки, которые строго коррелируют со специфичностью TCR клеток в отношении молекул MHC класса I или II, соответственно. Коммитирование ростка фенотипически выражается в утрате экспрессии одной из корецепторных молекул, CD8 или CD4.
Наивная T-клетка
Зрелая T-клетка, которая дифференцировалась в костном мозге, а затем претерпела положительный и отрицательный процессы центральной селекции в тимусе с реаранжировкой ее TCR и утратой одной из корецепторных молекул, но еще не встретила распознаваемый ею антиген на периферии.
Активированная T-клетка
Активированная T-клетка представляет собой T-клетку, которая, путем встречи как TCR, так и CD28, на клеточной поверхности с пептидом основного комплекса гистосовместимости (комплекс пептид: MHC), и представителями семейства B7 на антигенпредставляющих клетках соответственно, становится антигенспецифической эффекторной T-клеткой.
Эффекторная T-клетка
Эффекторная T-клетка представляет собой тип короткоживущего T-лимфоцита, который способен немедленно отвечать при контакте с клетками, несущими соответствующий для этой клетки комплекс пептид: MHC.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Идентификация и очистка сортировкой клеток CD71+ K562.
Фигура 2. Профили FACS для положительных по CD15 и CD71 клеток K562; (a) приблизительно 18% исходной обогащенной по CD71 клеточной популяции K562 были положительными по CD15 (область R1) и (b) повторный анализ положительных по CD15 клеток K562 после двух месяцев в культуре.
Фигура 3. Экспрессия CD15 на мононуклеарных клетках CD34+ AML.
Фигура 4. Профиль FACS CD16 и сортирующие области для различных популяций клеток CD14+, выделенных с помощью магнитных гранул с CD14 (MACS).
Фигура 5. Профиль FACS для мононуклеарных клеток пуповинной крови, окрашенных антителом мыши против CD19 человека и антителом мыши против CD5 человека.
Фигура 6. Профиль FACS для мононуклеарных клеток пуповинной крови, окрашенных антителом мыши против CD3 человека и антителом мыши против CD5 человека.
Фигура 7. Профиль FACS для мононуклеарных клеток костного мозга, окрашенных антителом мыши против CD20 человека и антителом мыши против CD72 человека.
Фигура 8. Типичный профиль FACS для тонзиллярных мононуклеарных клеток в отношении CD3 и CD54.
Фигура 9. Идентификация положительных по IgM и IgG культивируемых лимфоцитов; (A) после культивирования в течение 5 суток 18% CD19+ клеток были положительными по IgM и 1% имел поддающийся детекции IgG на клеточной поверхности и; (B) после 10 суток в культуре процент положительных по IgM лимфоцитов снизился до 2% и процент положительных по IgG клеток увеличился до 15%.
Фигура 10. Профили FACS для экспрессии CD на тригибридных клетках KMW с онкогеном из миелоидного и лимфоидного источников.
Фигура 11. Экспрессия CD4 и CD19 на первичных смешанных популяциях лимфоцитов селезенки, отсортированных по CD4 и CD19, и полученная тригибридная клеточная линия KBT; (a) экспрессия CD4 и CD19 на первичных лимфоцитах селезенки (b) профиль чистоты отсортированных по CD19+ клеток (98,1%); (c) профиль чистоты отсортированных по CD4+ клеток (96,8%); (d) экспрессия вместе CD19 и CD4 на тригибридных клетках. Более 99% популяции тригибридных клеток экспрессируют вместе маркеры как для B-клеток, так и для T-клеток.
Фигура 12. Экспрессия CD19, CD3 и CD5 на тригибриде KBT, происходящем из бессмертных миелоидных и 2 первичных обученных антигеном лимфоидных клеток; (a) экспрессия CD19 и CD5 на поверхности тригибридной клетки KBT, (b) экспрессия CD3 и CD5 на тригибриде KBT.
Фигура 13. Поверхностная экспрессия CD4, CD8, CD72 и CD20 на тригибридных клетках KBT, происходящих из бессмертных миелоидных и 2 первичных лимфоидных клеток, происходящих из костного мозга и тимуса; (a) экспрессия CD4 и CD8, (b) экспрессия CD4 и CD72, (c) экспрессия CD20 и CD8.
Фигура 14. Профили FACS для экспрессии CD на тригибридной линии WTM с онкогеном из лимфоидного источника и CD4 и CD14 из первичных клеток; (a) экспрессия вместе CD19 и CD4 на тригибридных клетках, демонстрирующая одну популяцию клеток CD19 с высоким уровнем экспрессии CD4 (CD19 CD4H) и другую с низким уровнем экспрессии CD4 (CD19 CD4L) и; (b) экспрессия вместе CD4 и CD14 на одной положительной по CD19 тригибридной популяции, демонстрирующая дальнейшую гетерогенность популяции клеток на основе высокой или низкой экспрессии CD14 (CD4HCD14L; CD4HCD14H; CD4LCD14H).
Фигура 15. Типичные профили FACS для экспрессии CD на тригибридных клетках WTM с онкогеном лимфоидного источника WIL2-NS, CD5, происходящего из обученных антигеном T-клеток, и CD14, происходящего из первичных моноцитарных клеток.
Фигура 16. Профили FACS для экспрессии CD на тригибридных клетках WTM с онкогеном лимфоидного источника WIL2NS, CD8, происходящего из цитотоксических T-клеток, и CD14, происходящего из первичных моноцитарных клеток.
Фигура 17. Профиль FACS для коэкспрессии CD4 и CD8 на тригибридах WTM, происходящих из двойных положительных по CD T-клеток.
Фигура 18. Экспрессия CD на поверхности тригибридных клеток WTM, происходящих из миеломоноцитарных клеток-предшественников; (A) трехцветное окрашивание на CD19, CD4 и CD15 и (B) трехцветное окрашивание на CD34 и CD15, происходящие из миеломоноцитарного предшественника, и CD4, происходящий из эффекторных T-клеток.
Фигура 19. Экспрессия специфичных для ростка маркеров тригибридных клеток KWT, происходящих из CD4+ эффекторных T-клеток.
Фигура 20. Экспрессия специфичных для ростка маркеров тригибридных клеток KWT, происходящих из двойных положительных CD4+ CD8+ T-клеток.
Фигура 21. Экспрессия специфичных для ростка маркеров тригибридных клеток KWT, происходящих из CD5+ обученных антигеном T-клеток.
Фигура 22. Типичный профиль экспрессии CD на тригибридных клетках WWM, происходящих из двух клеток, каждая из которых содержит лимфоидный онкоген, и одной первичной моноцитарной клетки; (a) коэкспрессия CD19 и CD14 на тригибридных клетках (область R1), демонстрирующая отдельную популяцию CD19-положительных клеток, которая не экспрессирует CD14 (область R2); (b) экспрессия CD14 на тригибридных клетках, происходящих из отсортированных в область R1 клеток, и размножаемых в культуре в течение 2 месяцев, и; (c) отсутствие поверхностного CD14 на тригибридных клетках, происходящих из отсортированной в область R2 популяции через 2 месяца.
Фигура 23. Типичная ОТ-ПЦР для CD14, полученного из различных субпопуляций тригибридных клеток WWM.
Фигура 24. Кариотипирование отдельного клона клеток K562. Результаты показали, что клеточная линия K562 была триплоидной, имеющей модальное число 69 хромосом. Были выявлены следующие хромосомные нарушения: отсутствие одной X-хромосомы; парацентрическая инверсия длинного плеча хромосомы 2, вовлекающая полосы q33 и q35; отсутствие хромосомы 3, дополнительное производное хромосомы 5 с дополнительным хромосомным материалом неизвестного происхождения, заменившим сегмент из q11.2; дупликация сегмента короткого плеча хромосомы 6 между полосами p21.2 и p23; дополнительная хромосома 7 с парацентрической инверсией короткого плеча хромосомы 7, вовлекающей полосы p13 и p22; отсутствие одной хромосомы 9; концевая делеция короткого плеча хромосомы 9 из полосы p13; производное хромосомы 9 вследствие транслокации, вовлекающей сегменты из двух 9 хромосом; производное хромосомы 10 вследствие транслокации, вовлекающей сегменты из хромосом 3 и 10; отсутствие хромосомы 13; дополнительный хромосомный материал неизвестного происхождения на коротком плече одной хромосомы 13; отсутствие хромосомы 14; дополнительный материал неизвестного происхождения, заменяющий сегмент из p13 на двух 17 хромосомах; производное хромосомы 18 вследствие транслокации, вовлекающей сегменты из хромосом 1 и 18; отсутствие одной хромосомы 20; производное хромосомы 21 вследствие транслокации, вовлекающей сегменты хромосом 1 и 21; отсутствие одной хромосомы 22; пять дополнительных различных маркерных хромосом.
Фигура 25. Кариотипирование одного из пяти клонов клеточной линии WIL2NS. В этом клоне (клон 1), были выявлены следующие нарушения; производное хромосомы 8 вследствие транслокации, вовлекающей сегменты из хромосом 1 и 8; дополнительный гомолог хромосомы 13; производное хромосомы 14 вследствие транслокации, вовлекающей сегменты из хромосом 5 и 14; дупликация хромосомы 17 в сегменте из q22-q23.
Фигура 26. Кариотипирование тригибридной линии KBT-1 (CD19+) и (CD4+), демонстрирующее единичный клон клетки, который является практически триплоидным. Количество хромосом варьировало между 65-66 вследствие случайной потери, однако модальное число хромосом составляло 66. Были выявлены следующие нарушения хромосом: производное X, образованное комплексной транслокацией, вовлекающей короткое плечо X-хромосомы и, возможно, 2 других неидентифицированных хромосомы; отсутствие одной X-хромосомы; парацентрическая инверсия в длинном плече хромосомы 2, вовлекающая полосы q33 и q35; отсутствие хромосомы 3; делеция хромосомы 3p; производное хромосомы 4, вовлекающее сегменты хромосомы 4 и другой неидентифицированной хромосомы; дополнительное производное хромосомы 5 с дополнительным хромосомным материалом неизвестного происхождения, заменяющим сегмент из q11.2; дупликация сегмента короткого плеча хромосомы 6 между полосами p21.2 и p23; дополнительное производное хромосомы 7, вовлекающее длинное плечо хромосомы 7 и длинное плечо маркера 3; отсутствие одной хромосомы 13; дополнительный хромосомный материал неизвестного происхождения на коротком плече одной хромосомы 13; отсутствие одной хромосомы 14; отсутствие одной хромосомы 15; дополнительный материал неизвестного происхождения, заменяющий сегмент из p13 на двух 17 хромосомах; производное хромосомы 18 вследствие транслокации, вовлекающей сегменты из хромосом 1 и 18; отсутствие одной хромосомы 20; производное хромосомы 21 вследствие транслокации, вовлекающей сегменты хромосом 1 и 21; отсутствие хромосомы 22; четыре дополнительных различных маркерных хромосомы.
Фигура 27. Кариотип тригибрида KBT перекрестного происхождения (клетки K562 и CD20+CD72+ и CD4+CD8+) (или KBT-2 перекрестного происхождения), демонстрирующий четыре клона, которые являются практически триплоидными, (A) клон 1 имеет модальное число хромосом 67 и следующие нарушения хромосом: производная X, образованная комплексной транслокацией, вовлекающей короткое плечо X-хромосомы и, возможно, две других неидентифицированных хромосомы; отсутствие одной X-хромосомы; производное хромосомы 1, вовлекающее сегменты из хромосомы 1 и, наиболее вероятно, хромосомы 4; парацентрическая инверсия в длинном плече хромосомы 2, вовлекающая полосы q33 и q35; отсутствие одной хромосомы 3; наиболее вероятно, делетированная хромосома 4, возможно, являющаяся малым производным хромосомы 4; дополнительное производное хромосомы 5 с дополнительным хромосомным материалом неизвестного происхождения, заменяющим сегмент из q11.2; дупликация сегмента короткого плеча хромосомы 6 между полосами p21.2 и p23; дополнительное производное хромосомы 7, вовлекающее длинное плечо хромосомы 7 и длинное плечо маркера 3; отсутствие одной хромосомы 9; концевая делеция короткого плеча хромосомы 9 из полосы p13; производное хромосомы 9 вследствие транслокации, вовлекающей сегменты из двух 9 хромосом; производное хромосомы 10 вследствие транслокации, вовлекающей сегменты из хромосом 3 и 10; отсутствие одной хромосомы 13; дополнительный хромосомный материал неизвестного происхождения на коротком плече одной хромосомы 13; отсутствие одной хромосомы 14; дополнительный материал неизвестного происхождения заменяет сегмент из p13 на двух 17 хромосомах; производное хромосомы 18 вследствие транслокации, вовлекающей сегменты из хромосомы 1 и 18; отсутствие одной хромосомы 20; производное хромосомы 21 вследствие транслокации, вовлекающей сегменты хромосом 1 и 21; отсутствие одной хромосомы 22; четыре дополнительных различных маркерных хромосомы, (B) клон 2 содержит от 65 до 67 хромосом вследствие случайной потери (модальное число хромосом составляет 67) и имеет сходные хромосомные характеристики с клоном 1, за исключением того, что делетированная хромосома 4 клона 1 заменена определенным производным хромосомы 4, вовлекающем сегменты хромосомы 4 и другой неидентифицированной хромосомы, (C) клон 3 является по существу таким же, как и клон 1, но производное хромосомы 1 отсутствует, и имеется другое производное хромосомы 4, происходящее из сегментов хромосом 1 и 4. Он содержит от 67 до 68 хромосом вследствие случайной потери, с модальным числом 67, (D) клон 4 является по существу таким же, как и клон 1, однако отсутствует хромосома 1, и присутствует другое производное хромосомы 1 вследствие транслокации, вовлекающей сегменты хромосом 1 и 4. Присутствует только две нормальных 5 хромосомы, и производное хромосомы 5, которое, по-видимому, является сателлитным 5q.
Фигура 28. Кариотипирование тригибридной линии KWT-1 (тригибрид KWT, происходящий из бессмертных миелоидных и B-лимфоидных клеток, и первичной зрелой CD4+ T-хелперной клетки), демонстрирующее единичный клон, который является практически гексаплоидным с модальным числом от 129 до 140 хромосом и следующими нарушениями хромосом: отсутствие двух X-хромосом; отсутствие одной хромосомы 1; отсутствие одной хромосомы 2; парацентрическая инверсия в длинном плече хромосомы 2, вовлекающая полосы q33 и q35; отсутствие двух 3 хромосом; отсутствие одной хромосомы 4; производное хромосомы 4 с дополнительным хромосомным материалом неизвестного происхождения, заменяющим сегмент из q35; один дополнительный гомолог хромосомы 5; два дополнительных производных хромосомы 5 с дополнительным хромосомным материалом неизвестного происхождения, заменяющим сегмент из q11.2; один дополнительный гомолог хромосомы 6; дополнительная хромосома 6 с дупликацией сегмента короткого плеча хромосомы 6 между полосами p21.2 и p23; один дополнительный гомолог хромосомы 7; две 7 хромосомы с парацентрической инверсией короткого плеча хромосомы 7, вовлекающей полосы p13 и p22; производное хромосомы 8 вследствие транслокации, вовлекающей сегменты из хромосом 1 и 8; отсутствие двух 9 хромосом; концевая делеция короткого плеча хромосомы 9 из полосы p13; два производных 9 хромосом вследствие транслокации, вовлекающей сегменты из двух 9 хромосом; производное хромосомы 10 вследствие транслокации, вовлекающей сегменты из хромосом 3 и 10; отсутствие одной хромосомы 12; одна хромосома 13 с дополнительным хромосомным материалом неизвестного происхождения на коротком плече одной хромосомы 13; отсутствие двух 14 хромосом; производное хромосомы 14 вследствие транслокации, вовлекающей сегменты из хромосом 5 и 14; отсутствие одной хромосомы 15; отсутствие одной хромосомы 17; две 17 хромосомы с дополнительным материалом неизвестного происхождения, заменяющим сегмент из p13 на двух 17 хромосомах; две 17 хромосомы с дупликацией в сегменте из q22-q23; отсутствие двух 18 хромосом; дополнительная хромосома 20; производное хромосомы 21 вследствие транслокации, вовлекающей сегменты хромосом 1 и 21; отсутствие одной хромосомы 22; семь дополнительных маркерных хромосом с двумя копиями маркерной хромосомы 2.
Фигура 29. Кариотипирование KWT-2 (тригибридная линия KWT, происходящая из бессмертных миелоидных и B-лимфоидных клеток и первичной CD3+CD5+ T-клетки памяти), демонстрирующее единичный клон, который является практически гексаплоидным с модальным числом хромосом от 135 до 142 и следующими нарушениями хромосом: отсутствие двух X-хромосом; отсутствие одной хромосомы 1; отсутствие одной хромосомы 2; парацентрическая инверсия в длинном плече хромосомы 2, вовлекающая полосы q33 и q35; отсутствие двух хромосом 3; отсутствие одной хромосомы 4; производное хромосомы 4 с дополнительным хромосомным материалом неизвестного происхождения, заменяющим сегмент из q35; один дополнительный гомолог хромосомы 5; два дополнительных производных хромосомы 5 с дополнительным хромосомным материалом неизвестного происхождения, заменяющим сегмент из q11.2; один дополнительный гомолог хромосомы 6; дополнительная хромосома 6 с дупликацией сегмента короткого плеча хромосомы 6 между полосами p21.2 и p23; две 7 хромосомы с парацентрической инверсией короткого плеча хромосомы 7, вовлекающей полосы p13 и p22; производное хромосомы 8 вследствие транслокации, вовлекающей сегменты из хромосом 1 и 8; отсутствие двух 9 хромосом; концевая делеция короткого плеча хромосомы 9 из полосы p13; два производных хромосомы 9 вследствие транслокации, вовлекающей сегменты из двух 9 хромосом; производное хромосомы 10 вследствие транслокации, вовлекающей сегменты из хромосом 3 и 10; отсутствие одной хромосомы 12; одна хромосома 13 с дополнительным хромосомным материалом неизвестного происхождения на коротком плече одной хромосомы 13; отсутствие двух хромосом 14; производное хромосомы 14 вследствие транслокации, вовлекающей сегменты из хромосом 5 и 14; отсутствие одной хромосомы 15; отсутствие одной хромосомы 17; две 17 хромосомы с дополнительным материалом неизвестного происхождения, заменяющим сегмент из p13 на двух 17 хромосомах; две 17 хромосомы с дупликацией в сегменте из q22-q23; отсутствие двух 18 хромосом; дополнительная хромосома 20; производное хромосомы 21 вследствие транслокации, вовлекающей сегменты хромосом 1 и 21; отсутствие одной хромосомы 22; восемь дополнительных маркерных хромосом с двумя копиями маркерной хромосомы 2.
Фигура 30. Кариотипирование тригибридной линии KWT-3 (тригибрид KWT, происходящий их бессмертных миелоидных и B-лимфоидных клеток, и первичной двойной положительной CD4+CD8+ T-клетки), демонстрирующее три клона, которые являются гиперпентаплоидными с модальным числом хромосом от 124 до 139. (A) Клон 1 имеет следующие нарушения хромосом: три X-хромосомы и одна Y-хромосома; дополнительная хромосома 1; две дополнительных хромосомы 2; парацентрическая инверсия в длинном плече хромосомы 2, вовлекающая полосы q33 и q35; отсутствие одной хромосомы 3; дополнительное производное хромосомы 5 вследствие транслокации, вовлекающей хромосому 5 и хромосому неизвестного происхождения; дополнительная хромосома 6; дупликация сегмента короткого плеча хромосомы 6 между полосами p21.2 и p23; дополнительная парацентрическая инверсия короткого плеча хромосомы 7, вовлекающая полосы p13 и p22; производное хромосомы 8 вследствие транслокации, вовлекающей сегменты из хромосом 1 и 8; концевая делеция короткого плеча хромосомы 9 из полосы p13; производное хромосомы 9 вследствие транслокации, вовлекающей сегменты из двух 9 хромосом; две дополнительных 10 хромосомы; два производных 10 хромосомы вследствие транслокации, вовлекающей сегменты из хромосом 3 и 10; две дополнительных 13 хромосомы; дополнительный хромосомный материал неизвестного происхождения на коротком плече одной хромосомы 13; отсутствие одной хромосомы 14; производное хромосомы 14 вследствие транслокации, вовлекающей сегменты из хромосом 5 и 14; дополнительный материал неизвестного происхождения, заменяющий сегмент из p13 на трех 17 хромосомах; две дупликации хромосомы 17 в сегменте из q22-q23; дополнительная хромосома 18; производное хромосомы 18 вследствие транслокации, вовлекающей сегменты из хромосом 1 и 18; дополнительная хромосома 19; отсутствие одной хромосомы 20; производное хромосомы 21 вследствие транслокации, вовлекающей сегменты хромосом 1 и 21; пять дополнительных маркерных хромосом с двумя копиями каждой маркерной хромосомы 4 и 5. (B) клон 2 имеет сходные нарушения хромосом с клоном 1, за исключением того, что в нем утрачена одна 9 хромосома. (C) клон 3 содержит те же нарушения хромосом, что и клон 2, за исключением того, что парацентрическая инверсия в длинном плече хромосомы 2 заменена изопроизводной хромосомой 2, являющейся следствием образования изохромосомы, вовлекающей производное хромосомы 2, которое получено парацентрической инверсией в длинном плече, вовлекающей полосы q33 и q35.
Фигура 31. Кариотипирование тригибридов WWM (A) и их обогащенной по CD14 сублинии (B), демонстрирующее единичный доминантный клон, присутствие которого увеличено от 55% в исходном тригибриде WWM до 95% в его обогащенной по CD14 сублинии. Каждый из них имеет модальное число хромосом 47 и следующие нарушения хромосом: производное хромосомы 8 вследствие транслокации, вовлекающей сегменты из хромосом 1 и 8; дополнительный гомолог хромосомы 13; производное хромосомы 14 вследствие транслокации, вовлекающей сегменты из хромосом 5 и 14; дупликация хромосомы 17 в сегменте из q22-23; производное хромосомы 21 вследствие транслокации, вовлекающей сегменты из хромосом 3 и 21. Единственное отличие между исходным тригибридом WWM и его обогащенной по CD14+ сублинией состоит в том, что эти нарушения присутствуют только в 55% клеток в исходном WWM и 95% клеток обогащенной по CD14 сублинии. Остальные клетки в тригибриде WWM варьируют от практически триплоидных (со случайной потерей хромосом) до практически тетраплоидных (со случайной потерей хромосом).
Фигура 32. Вестерн-блот супернатантов из культур ProGM. На дорожки 1 и 2 наносили супернатанты неактивированных и активированных 4-суточных культур T-лимфоцитов человека, соответственно. Дорожки 4 и 5 содержали супернатанты культур ProGM, выращенных в отсутствие и в присутствии туникомицина, соответственно. Супернатант не экспрессирующих GM-CSF клеток использовали на дорожке 3. В качестве эталона на дорожке 6, использовали рекомбинантный hGM-CSF (10 нг), происходящий из E. coli.
Фигура 33. Гель-электрофорез GM-CSF человека, продуцированного гибридной линией ProGM. Клеточные супернатанты гибридной линии ProGM, полученной из образцов, которые культивировали с туникамицином (дорожки 3 и 4) и без него (дорожки 1 и 2) подвергали иммунопреципитации с антителом крысы против GM-CSF человека (дорожки 1 и 3) и антителом крысы против GM-CSF мыши (дорожки 2 и 4). Белки визуализировали окрашиванием серебром.
Фигура 34. Экспрессия CD4 и CD54 на поверхности клеточной линии ProCD54 и их обогащенной по CD54 сублинии ProCD54EX; (a) 100% клеток ProCD54 сохраняли экспрессию CD4. Приблизительно 72% популяции клеток также были положительными по CD54 в диапазоне от низких до высоких уровней экспрессии. 42% популяции клеток с характеристиками фенотипа CD4+CD54+ с уровнями экспрессии CD54 от средних до высоких ограничивалось и отсортировывалось, и (b) анализ экспрессии CD4 и CD54 на поверхности отсортированной сублинии CD4+CD54+ исходных ProCD54 демонстрирует, что 98% клеток все еще являются положительными по обоим маркерам после культивирования в течение более чем 6 месяцев.
Фигура 35. Вестерн-блоттинг растворимого CD54 человека, секретируемого клетками ProCD54 и ProCD54EX. Клетки тригибридной клеточной линии-партнера KWT использовали в качестве контроля. Как клетки ProCD54, так и клетки ProCD54EX, утрачивали растворимую форму CD54 массой приблизительно 82 кДа.
Фигура 36. Анализ посредством ОТ-ПЦР экспрессии гена ICAM-I в клетках ProCD54 и ProCd54EX.
Фигура 37. Вестерн-блот-анализ экстрактов клеток из тригибридной клеточной линии KBT, временно трансфицированной цепью hIL4-Rα, через 24, 48 и 72 часа после трансфекции. PBML человека, стимулированные посредством 100 нг/мл hIL4, и нетрансфицированные клетки KBT использовали в качестве положительного и отрицательного контроля для цепи hIL4-Rα, соответственно.
Фигура 38. Продукт ПЦР для детекции мРНК hIL-2 в тригибридных клетках KBT, трансфицированных hIL-2. Уровни экспрессии являются сходными с уровнями, полученными из CD8+ T-лимфоцитов человека и клеток Jurkat. Нетрансфицированные клетки KBT и клетки K562 использовали в качестве отрицательного контроля.
Фигура 39. FACS-анализ внутриклеточного hIL-2 на (a) исходных тригибридных клетках KBT и (b) клетках KBT TR-IL2. Приблизительно 41% клеток KBT были положительными по активирующей молекуле CD69. 92% клеток TR-IL2 KBT окрашивались положительно по внутриклеточному hIL-2 (R1+R2). Отрицательные по hIL-2 клетки были частью положительной по CD69 популяции, в то время как все отрицательные по CD69 клетки были положительными по внутриклеточному hIL2.
Фигура 40. Полученный профиль элюирования после ОФ-ВЭЖХ после аффинной абсорбции по hGM-CSF.
Фигура 41. SDS-PAGE (нижняя паналь) и вестерн-блот (верхняя панель) фракций, собранных после ОФ-ВЭЖХ после аффинной иммуноабсорбации по hGM-CSF. Вестерн-блот выявил изменения в профиле молекулярной массы hGM-CSF, секретируемого Pro-GM-SF, между фракциями. Фракции, элюированные через 24-28 минут, соответствовали первому пику на профиле элюирования ОФ-ВЭЖХ, фракции, собранные через 29-31 минут соответствовали второму пику, в то время как третий пик соответствовал фракциям, собранным через 34-36 минут.
Фигура 42. Выделение клеток CD4+ из культуры активированных PHA лимфоцитов человека: (A) клетки, меченные антителом против CD4-FITC человека ограничивали (R1) и отсортировывали от остальной клеточной популяции. Отсортированные клетки далее анализировали в отношении чистоты; (B) 100% клеток в отсортированной популяции клеток были положительными по CD4.
Фигура 43. Гель-электрофорез дегликозилированного hGM-CSF, происходящего из Pro-GMsf. Очищенный hGM-CSF подвергали расщеплению PHGase F в течение различных периодов времени. Дорожка 1 - 0 мин, дорожка 2- 10 мин, дорожка 3 - 20 мин, дорожка 4 - 40 мин инкубации. Дорожка 5 - рекомбинантный GM-CSF человека, происходящий из E.coli. Белки визуализировали окрашиванием серебром. Указаны маркеры молекулярной массы.
Фигура 44. Идентификация и сортировка клеток TfR+ клеточной линии миеломы мыши Sp2.
Фигура 45. Профили FACS для мононуклеарных клеток мыши из (a) периферической крови и (b) селезенки, окрашенных антителом против CD4 и CD8 мыши. Ограниченные области R1 и R3 соответствуют единичным положительным эффекторным хелперным (CD4+CD8-) и цитотоксическим (CD8+CD4-) T-клеткам, в то время как R2 содержит двойные положительные (CD4+CD8+) T-клетки.
Фигура 46. Профили чистоты моноцитов мыши, выделенных из периферической крови, посредством отрицательной селекции с помощью магнитных гранул. 100% выделенных клеток были положительными по CD11b, и в то же время более чем 98% этих клеток были отрицательными по B220, CD90, CD49b и NK1.1. Приблизительно 38% клеток CD11b+ экспрессировали Ly5G на их поверхности на низких уровнях.
Фигура 47. Профили FACS для экспрессии CD138, CD4 и Cd11b на тригибриде STmMm, происходящем из одной лимфоидной бессмертной клетки Sp2, первичной CD4+ T-клетки мыши и CD11b+ моноцита. Фенотип B-лимфоидного ростка подтверждали экспрессией CD138 на 100% тригибридных клеток, (a) и (b) по меньшей мере 82% популяции клеток экспрессировали все три маркера CD, причем только 5% клеток были положительными по CD138 без коэкспрессии либо CD4, либо CD11b.
Фигура 48. Типичные профили FACS для экспрессии CD138, CD8 и CD11b на тригибриде STmMm, происходящем из одной лимфоидной бессмертной клетки мыши Sp2, первичной цитотоксической CD8+ T-клетки мыши и CD11b+ моноцита мыши. В то время как экспрессия CD138 мыши была подтверждена на 97-100% из тригибридных клеток (a) и (b), коэкспрессия маркеров T-клеток и моноцитов была выявлена на 56% и 57% популяции тригибридных клеток, соответственно. Приблизительно 40% всей тригибридной популяции коэкспрессировали все три маркера (c) и только 14% не экспрессировали ни CD8, ни CD11b, на их поверхности.
Фигура 49. Типичные профили FACS для экспрессии CD138, CD8 и CD11b на тригибридах STmMm, происходящих из одной лимфоидной бессмертной клетки мыши Sp2, одной первичной двойной положительной CD4+CD8+ T-клетки мыши и одного первичного CD11b+ моноцита мыши. 98-100% популяции тригибридных клеток были положительными по CD138, причем 93% популяции также были положительными по CD8 (b). Приблизительно 57-60% всей популяции клеток были одновременно положительными по CD138, CD8 и CD11b.
Фигура 50. Типичный профиль экспрессии CD4 и CD8 на поверхности тригибридов STmMm, происходящих из одной лимфоидной бессмертной клетки мыши Sp2, одной первичной двойной положительной CD4+CD8+ T-клетки мыши и одного первичного моноцита. В то время как 95% клеток были положительными по CD8, только 50% популяции тригибридов экспрессировали вместе CD4 и CD8. Примечательно, что практически вся CD4+ популяция также была положительной по CD8.
Фигура 51. Типичный профиль экспрессии CD138 и CD11b на поверхности тригибридов SSMm, где 93% популяции тригибридов демонстрируют положительное окрашивание по CD138, причем 70% клеток экспрессируют вместе CD11b.
Фигура 52. Типичные профили экспрессии CD71 человека и TfR мыши на поверхности тригибридов SWMm (a) и SWMh (b). Независимо от мыши или человека в качестве источника моноцитов, 100% тригибридов были положительными по рецептору трансферрина как человека, так и мыши.
Фигура 53. Типичные профили экспрессии CD138 мыши на тригибридах SWMm (a) и SWMh (b) и либо CD11b мыши, либо CD14 человека. Экспрессия CD138 мыши, по-видимому, является зависимой от мыши или человека в качестве источника моноцитов. В то время как 84% тригибридов SWMm были положительными по CD138 мыши, только 29% SWMh имели его на их поверхности.
Фигура 54. Профиль FACS для экспрессии CD19 человека и CD14 человека на поверхности химерных тригибридов SWMh демонстрирует, что 96% клеток экспрессируют CD19 человека, причем 66% экспрессируют вместе CD14 человека.
Фигура 55. Система для манипуляции/доставки отдельных клеток.
Фигура 56. Стеклянная микропипетка.
Фигура 57. Микроэлектрод.
Фигура 58. Два параллельных микроэлектрода.
Фигура 59. Два микроэлектрода в лунке планшета для культивирования тканей.
Фигура 60. Вид сверху лунки, содержащей 3 клетки между 2 микроэлектродами.
Фигура 61. Вид сбоку лунки с фигуры 60.
Фигура 62. Экспрессия CD25 и sIgM на поверхности гибридных клеток, полученных гибридизацией одной клетки KBT и одной shIgM+CD25+ B-клетки до (A) и после (B) стабильной трансфекции вторым белком hIL-2.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Предпочтительный вариант осуществления изобретения далее описан с помощью следующих неограничивающих примеров, ссылаясь на прилагаемые фигуры.
Пример 1
1. Селекция клеток, манипулирование с клетками и клонирование единичных клеток
В следующих примерах описано получение клеток, включая селекцию и выделение (или сортировку) клеточных линий млекопитающих и первичных клеток, использованных для создания тригибридов перекрестного происхождения, и для экспрессии желаемых белков. Выбор конкретного способа селекции для получения чистой популяции клеток с конкретными характеристиками или применение конкретного маркера (или маркеров) для выделения клеток с конкретным фенотипом, никоим образом не являются ограничивающими, а скорее показательными. Для обеспечения сходных результатов можно использовать другие клеточные маркеры или способы сортировки.
1.1. Селекция клеток в качестве источника онкогена из клеточных линий млекопитающих
Все бессмертные клеточные линии (см. ниже) выращивали в суспензионной культуре в стандартных (нормальных) условиях в инкубаторе с CO2 при 37°С в увлажненной атмосфере с 5% CO2 с использованием модифицированной RPMI 1640 (среда Roswell Park Memorial Institute) с NaHCO3 (JRH Biosciences), 20 мМ Hepes (Sigma), 4 мМ L-глутамином (Sigma) и дополненной 10% эмбриональной телячьей сывороткой, FCS, (JRH Biosciences). Если нет иных указаний, среда для культивирования тканей (среда TC), описанная в настоящем документе, представляет собой стандартную среду для культивирования всех бессмертных клеточных линий, первичных клеток злокачественной опухоли, первичных культур клеток и установленных тригибридных клеточных линий по настоящему изобретению. Как правило, все клеточные линии, первичные злокачественные клетки и использованные первичные клетки культивировали в среде без антибиотиков. Однако, когда возникало подозрение о высоком риске бактериальной и/или грибковой контаминации, в стандартную среду включали 2% раствор пенициллина (5000 единиц)/стрептомицина (5 мг) (Sigma).
Клеточные линии человека
Клеточные линии человека, которые можно использовать в этом изобретении, являются следующими:
a) Линия общих миелоидных предшественников K562 (клеточная линия, происходящая из хронического миелогенного лейкоза человека),
b) T-лимфоидный росток MOLT4 (T-лимфобласты человека), и
c) B-лимфоидный росток WIL2NS (B-лимфобласты человека).
Не являющаяся человеческой клеточная линия(и)
Не являющаяся человеческой клеточная линия, которую можно использовать по этому изобретению, представляет собой клеточную линию миеломы мыши Sp2 (B-лимфоцитарная плазматическая клетка).
1.1.1. Система для доставки единичных клеток
Выделение или сортировка клеток, манипулирование клетками и клонирование отдельных клеток являются необходимыми процессами для этого изобретения. В этом примере авторы настоящего изобретения описывают систему для доставки единичных клеток, которая была создана для манипулирования и/или клонирования представляющей интерес единичной клетки. Система для доставки клетки (фигура 55) состоит, главным образом, из стеклянной микропипетки, 1-мл шприца и одномерного крупного манипулятора. На фигуре 56 представлена стеклянная L-образная микропипетка, использованная для отбора единичной представляющей интерес клетки. Пипетка была изготовлена из капиллярной трубки для определения гематокрита длиной 75 миллиметров (мм), с наружным и внутренним диаметром 1,5 мм и 1,10 мм, соответственно. С использованием нагревания один конец трубки вытягивали, так чтобы получить конец (1) с внутренним диаметром приблизительно 250-300 микрометров (мкм) и стенкой конца толщиной приблизительно 30 мкм. Другой конец микропипетки оставляли немодифицированным (2). В системе для доставки клеток (фигура 55), шприц (4) помешали на крупный манипулятор, который, в свою очередь, помещали на магнитный штатив (16). Система действует так, чтобы поршень (6) шприца можно было приводить в действие очень медленно, как вперед, так и назад, относительно шприца. Для манипулирования представляющей интерес единичной клеткой, шприц должен быть соединен с немодифицированным концом микропипетки (2), как показано на фигуре, с использованием гибкой трубки медицинской категории (3). Перед любым манипулированием клетками систему для доставки единичной клетки необходимо стерилизовывать путем промывания несколько раз струей 70% спирта и в конце заполнять без пузырьков воздуха соответствующей средой или раствором для культивирования ткани, в зависимости от того, что требуется.
1.1.2. Клонирование единичной клетки
Клоны клеток из каждой клеточной линии получали клонированием единичных клеток. Ниже описан способ клонирования или манипулирования единичной клеткой для любых биологических клеток, например, клеток клеточной линии K562, использованной в этом изобретении.
5 мкл суспензии клеток K562 отбирали из их культуры на log-фазе и помещали в лунку 96-луночного планшета для культивирования тканей (планшет TC, Becton and Dickinson или BD), которая содержала 150 мкл среды TC. Лунка была обозначена как "лунка для хранения клеток". Планшет помещали на XY-предметный столик инвертационного микроскопа (Axiovert 40C, Carl Zeiss). Перед процессом манипулирования/клонирования единичной клетки, микропипетку (фигура 56) полностью заполняли средой TC без пузырей воздуха. Микропипетку, трубки и шприц системы для доставки единичных клеток (фигура 55) помещали на одномерный крупный манипулятор (Narishege). Верхушку микропипетки (1) располагали так, чтобы верхушка была расположена в центре оптического поля зрения микроскопа. Для манипулирования и клонирования единичной клетки K562 микропипетку помещали в лунку для хранения клеток. Путем очень медленного смещения поршня шприца в направлении всасывания, единичную клетку K562 помещали в микропипетку. Микропипетку извлекали из лунки для хранения клеток. Затем путем латерального смещения предметного столика микроскопа от лунки для хранения клеток в соседнюю лунку, обозначенную как "лунка для клонирования", и путем последующего помещения микропипетки в эту лунку для клонирования, единичную клетку в микропипетке осторожно высвобождали из микропипетки. Этого достигали путем очень медленного смещения поршня шприца в направлении высвобождения. Способ извлечения единичной клетки из лунки для хранения клеток и помещения единичной клетки в лунку для клонирования повторяли несколько раз до тех пор, пока не получали 60 клонов единичных клеток на планшет TC. Планшет для клонирования инкубировали в увлажненном инкубаторе (Thermoline Scientific), действующем при 37°C с 5% CO2, в течение 10 суток. Среду в каждой лунке для клонирования регулярно пополняли свежей средой TC в ходе периода инкубации. Пролиферацию клеток каждого клона из каждой лунки для клонирования регистрировали каждые 24 часа. В конце периода инкубации получали ряд клонов клеток K562. Клон с наиболее высокой скоростью пролиферации или наиболее высоким уровнем представляющего интерес маркера, который экспрессировался на клеточной поверхности, например, рецептора трансферрина CD71 на клетках K562, отбирали для продукции тригибрида и дальнейших экспериментов.
1.1.3. Сортировка CD71 + клеток
В качестве примера, представленный ниже способ описывает селекцию и сортировку положительных по CD71 клеток из клеточной линии K562 с использованием сортера для активированной флуоресценцией сортировки клеток (FACS).
1×105 клеток K562, суспендированных в 100 мкл фосфатно-солевого буфера (Dulbeco PBS), содержавшего 2% бычий сывороточный альбумин, BSA, (Sigma) инкубировали в темноте с 20 мкл либо конъюгированного с фикоэритрином (PE) антитела против CD71 (BD Pharmingen), либо конъюгированного с PE изотипического контрольного антитела IgG2a,κ (BD Pharmingen) в течение 30 минут при комнатной температуре. Инкубируемую смесь разбавляли 1 мл PBS, и окрашенные клетки собирали центрифугированием при 300g в течение 10 минут. После дополнительного промывания 1 мл PBS, окрашенные клетки суспендировали в 1 мл PBS и сразу анализировали с использованием FACS (BD FACSCalibur). На фигуре 1 представлены профили CD71+ клеток клеточной линии K562. Положительные по CD71+ клетки ограничивали, и отсортировывали (фигура 1a). Приблизительно 65% исходной популяции K562 были положительными по CD71. Отсортированные клетки центрифугировали при 300g в течение 10 минут и суспендировали в 1 мл PBS для дальнейших экспериментов. 100 мл суспендированных отсортированных по CD71+ клеток собирали для анализа чистоты, как показано на фигуре 1b. Была получена 99% чистота отсортированных по CD71+ клеток. После сортировки клеток CD71+ клетки клеточной линии K562 либо использовали для дальнейших экспериментов, либо помещали в культуру в стандартных условиях культивирования, и обозначали как обогащенные по CD71 клетки K562. Ту же методику использовали для получения обогащенных по CD71 культур WIL2NS и обогащенных по CD71 культур MOLT4.
1.1.3.1. Сортировка CD71 + клеток миеломоноцитарного ростка из культуры K562
Для обеспечения миеломоноцитарного фенотипа клеток в эксперименте по гибридизации клеток, CD71+ клетки K562 далее обогащали CD15+ клетками с использованием анализа FACS и последующей сортировки.
Для этой цели обогащенные по CD71 клетки K562, полученные способом, описанным в разделе 1.1.3, метили конъюгированным с PE антителом против CD71 человека и конъюгированным с FITC антителом против CD15 человека (BD Pharmingen). 1×105 промытых обогащенных по CD71 клеток K562, суспендированных в 100 мкл PBS, содержащем 2% BSA, инкубировали в темноте с 20 мкл либо антитела против CD71-PE человека и антитела против CD15-FITC человека, либо с отрицательными изотипическими контрольными антителами или меченными FITC и PE отрицательными изотипическими контрольными антителами, в течение 30 минут при комнатной температуре. Инкубационную смесь разбавляли 1 мл PBS, и окрашенные клетки собирали центрифугированием при 300g в течение 10 минут. После дополнительного промывания 1 мл PBS окрашенные клетки суспендировали в 1 мл PBS и сразу анализировали с использованием FACSCalibur (BD).
Типичный профиль FACS представлен на фигуре 2a. После культивирования в течение 5 месяцев 99% обогащенных по CD71 клеток K562 оставались положительными по CD71, из которых приблизительно 18% экспрессировали поверхностный CD15. Клетки, положительные как по CD71, так и по CD15, ограничивали (фигура 2a) и отсортировывали. Отсортированные клетки собирали центрифугированием при 300g в течение 10 минут и суспендировали в 1 мл PBS для дальнейших экспериментов. 100 мкл суспендированных CD71+CD15+ отсортированных клеток собирали для анализа чистоты. После культивирования в течение двух месяцев отсортированные клетки повторно анализировали в отношении экспрессии вместе CD71 и CD15 (фигура 2b). Результаты указывают на то, что приблизительно 98% очищенных клеток сохраняли как CD71, так и CD15. Было открыто, что некоторые из клеток, которые ранее экспрессировали как CD71, так и CD15, на поверхности, утратили их экспрессию CD15 (фигура 2b), что указывает на то, что коммитирование в миеломоноцитарный росток в клетках K562 является нестабильным и обратимым.
1.1.4. Селекция положительных по рецептору трансферрина клеток из клеточной линии мыши Sp2
Когда для создания тригибридов использовали клеточную линию миеломы мыши Sp2, популяцию обогащали клетками, экспрессирующими рецептор трансферрина мыши (TfR), аналог CD71 человека.
По существу следовали тому же протоколу, как и в разделе 1.1.3, в котором описано обогащение клеточных линий человека CD71+ клетками, за исключением того, что вместо конъюгированного с PE антитела мыши против CD71 человека использовали конъюгированное с FITC антитело крысы против TfR мыши (Abeam). Изотипические контроли корректировали соответствующим образом.
На фигуре 44 представлен профиль TfR+ клеток клеточной линии Sp2. TfR+-положительные клетки ограничивали, и отсортировывали (фигура 44a). Приблизительно 45% исходной популяции Sp2 были положительными по TfR. Отсортированные клетки центрифугировали при 300g в течение 10 минут и суспендировали в 1 мл PBS для дальнейших экспериментов. 100 мл суспендированных отсортированных по TfR+ клеток собирали для анализа чистоты, как показано на фигуре 44b. Получали 99,5% чистоту отсортированных по TfR+ клеток. После сортировки клеток, TfR+ клетки клеточной линии Sp2 либо использовали для дальнейших экспериментов, либо помещали в культуру в стандартных условиях культивирования, и обозначали как обогащенные по TfR клетки Sp2.
1.2. Селекция клеток в качестве источника онкогена из первичных злокачественных клеток
В качестве примера в способе ниже описана селекция трансформированных клеток миелогенного ростка из образцов костного мозга, полученных от пациентов с острым миелогенным лейкозом (AML). Тот же способ также можно применять для селекции клеток других ростков из образцов костного мозга при соответствующих гематологических злокачественных опухолях.
От пациентов с AML получали материал, собираемый аспирацией костного мозга, после получения информированного согласия. Образцы получали от пациентов, у которых диагноз AML был поставлен до проведения экспериментов. Мононуклеарные клетки AML выделяли с использованием той же процедуры центрифугирования в градиенте плотности, которая описана в разделе 1.3.1, и CD34+ клетки из образцов отсортировывали или выделяли с использованием FACS.
Для окрашивания или мечения мононуклеарных клеток, полученных выше, 10 мкл антитела мыши против CD34-PE человека (BD Pharmingen) или изотипического контрольного антитела-PE (BD Pharmingen) добавляли к 100 мкл данной аликвоты из 1×106 мононуклеарных клеток в среде для окрашивания (PBS+5%BSA). Для данной аликвоты смесь для окрашивания инкубировали в течение 30 минут на льду. К клеточному осадку добавляли 10 мл ледяной среды для окрашивания, и центрифугировали ее в течение 7 мин при 350g и 4°С. Супернатанты аспирировали, а затем клеточный осадок ресуспендировали путем постукивания по пробирке, в которую был добавлен сравнимый объем ледяной среды для окрашивания. Окрашенные клетки центрифугировали, и промывали еще один раз в ледяной среде для окрашивания. Меченые клетки суспендировали в среде для окрашивания и использовали в FACS. После установки соответствующих сортирующих областей для популяции CD34+ клеток, клеточные фракции собирали.
Для обогащения культур, 40×103 клеток обогащенных по CD34+ высевали в 12-луночные планшеты, предварительно покрытые синтетическим внеклеточным матриксом. Клетки размножали в полной среде TC, дополненной 57 мМ β-меркаптоэтанолом (Sigma), 1 мМ гидрокортизоном и 20 нг/мл IL-3 человека и G-CSF человека. После культивирования в течение 48 часов клетки далее отбирали по экспрессии CD15 с использованием FACS.
Для флуоресцентного окрашивания клеток использовали антитело мыши против CD15-FITC человека (BD Pharmingen) и антитело мыши против CD34-PE человека (BD Pharmingen) и также использовали способ окрашивания клеток, сходный со способом, описанным ранее в этом разделе. Окрашенные образцы анализировали с использованием FACS. После установки соответствующих сортирующих областей для положительной по CD34 и CD15 популяции клеток (CD34+CD15+) или для положительной по CD34 и отрицательной по CD15 популяции клеток (CD34+CD15-), фракции собирали.
Профиль экспрессии CD15 на CD34+ клетках AML после культивирования в течение 48 часов представлен на фигуре 3. Приблизительно 54% протестированных мононуклеарных клеток были положительными по CD15 при сохранении их экспрессии CD34, в то время как остальная часть популяции клеток сохраняла ее экспрессию CD34 без коммитирования в миеломоноцитарный росток. CD34+CD15+ клетки использовали в экспериментах для создания тригибридов.
1.3. Первичные клетки
Первичные клетки можно получать из любых лимфоидных тканей, таких как периферическая кровь, пуповинная кровь, селезенка, костный мозг, тимус, миндалевидные железы и регионарные лимфатические узлы. В качестве первой стадии все лимфоидные ткани обрабатывали для выделения мононуклеарных клеток.
1.3.1. Выделение мононуклеарных клеток человека из костного мозга, периферической крови или пуповинной крови
Образцы периферической крови собирали от здоровых индивидуумов после получения информированного согласия. Каждый образец крови собирали в гепаринизированные пробирки (Vacutainer, BD), объединяли, и разбавляли в RPMI 1640.
Материал, собираемый аспирированием костного мозга человека, получали от двух пациентов, которым проводили биопсию костного мозга, и которые имели нормальный костный мозг без каких-либо гематологических нарушений. Образцы разбавляли RPMI 1640 в соотношении 1:3.
Образцы пуповинной крови человека получали после нормальных своевременных вагинальных родов после получения информированного согласия. В каждом случае пуповинную кровь собирали с помощью гепаринизированного 60-мл шприца после рождения младенца и перевязки пуповины, перед изгнанием плаценты. Каждый образец разбавляли в RPMI 1640.
Мононуклеарные клетки периферической крови (PBMC), мононуклеарные клетки костного мозга (BMMC) и мононуклеарные клетки пуповинной крови (UCBMC) получали центрифугированием в градиенте плотности Ficoll-Paque (Amersham Pharmacia). В кратком изложении 10 мл Ficoll-Paque наслаивали под 20 мл суспензии клеток с использованием трубки с канюлей, присоединенной к 20-мл шприцу. Клетки образца центрифугировали при 1700 об/мин (700g) в течение 40 минут при 4°С. Клетки на межфазной границе собирали и промывали в 50 мл RPMI 1640 центрифугированием при 2000 об/мин (1000g) в течение 10 минут. Супернатант удаляли и осажденные клетки ресуспендировали в 40 мл RPMI 1640 и центрифугировали при 1300 об/мин (400g) в течение 10 минут. Эритроциты и тромбоциты удаляли лизисом с помощью 0,83% (масс./об.) NH4Cl, и второго центрифугирования в Ficoll-Paque, разбавленном PBS в соотношении 1:2, соответственно.
Выделенные мононуклеарные клетки использовали для культивирования или анализа и сортировки на определенные клеточные фракции с помощью FACS или системы разделения с магнитными гранулами.
1.3.2. Выделение мононуклеарных клеток человека из твердых лимфоидных тканей
Представленный ниже способ описывает методику, использованную в этом изобретении для выделения мононуклеарных клеток из селезенки, тимуса, миндалевидных желез или регионарных лимфатических узлов. Также приведен способ окрашивания и сортировки клеток.
Образцы селезенки получали от доноров трансплантатов органов согласно национальным этическим нормам. Блоки селезенки, каждый приблизительно 2×2×3 см, держали при 4°C в RPMI 1640 до выделения спленоцитов. Каждый блок нарезали на небольшие фрагменты через решетку стерильного сита с использованием поршня шприца. Затем клетки ферментативно диссоциировали путем расщепления 20 Е/мл коллагеназы типа VII (Sigma) и 20 Е/мл ДНКазы (Sigma) в полной среде в течение 30 минут при комнатной температуре. Клеточные агрегаты далее диссоциировали добавлением ЭДТА до 10 мМ и встряхиванием в течение 5 минут при комнатной температуре. Затем спленоциты промывали два раза полной средой для остановки ферментативного расщепления и ресуспендировали в RPMI 1640. Эти условия не влияли на поверхностную экспрессию молекул по сравнению с неферментативными способами диссоциации (Mcllroy et al 1995). Мононуклеарные клетки селезенки выделяли из этих суспензий спленоцитов центрифугированием в градиенте плотности, как описано в разделе 1.3.1, за исключением удаления эритроцитов. Мононуклеарные клетки селезенки ресуспендировали в RPMI 1640 и концентрацию клеток доводили до 1×106 клеток на мл. Жизнеспособность клеток была выше 98% при определении по исключению трипанового синего.
От детей, подвергнутых кардиологической хирургической операции, получали тимусы после получения информированного согласия их родителей. Тимоциты выделяли из тимусов разрушением ткани тимуса и вымыванием тимоцитов из ткани шприцом, заполненным средой RPMI 1640. Тимоциты очищали центрифугированием в градиенте плотности, как описано выше.
Миндалевидные железы получали от пациентов, подвергнутых тонзилэктомии вследствие воспалительных нарушений, после получения информированного согласия. Образцы тканей хранили на льду в полной среде, и 250 мкг/мл гентамицина и обрабатывали в течение 3 часов. Тонзиллярную ткань нарезали на фрагменты после удаления эпителиального слоя и блоки тканей осторожно аспирировали через обрезанную пипетку для переноса. Затем клетки миндалевидных желез выделяли с использованием того же способа, который описан ранее для выделения мононуклеарных клеток селезенки.
1.3.3. Выделение специфичных для ростка первичных клеток из мононуклеарных клеток, происходящих из различных тканей
Клетки человека B-лимфоидного ростка, T-лимфоидного ростка и миелоидного ростка выделяли стандартными способами с использованием FACS-анализа и сортировки клеток или магнитной сортировки клеток. Ниже приведены неограничивающие примеры окрашивания и сортировки клеток для выделения специфичных для ростка первичных клеток из различных тканей.
1.3.3.1. Выделение B-клеток, хелперных T-клеток и миеломоноцитарных клеток из селезенок и периферической крови человека
Образцы тканей первоначально обрабатывали для экстракции популяции мононуклеарных клеток, как описано в разделе 1.3.1. Затем проводили флуоресцентное окрашивание клеток в пределах 4 часов после выделения популяции мононуклеарных клеток. Клетки суспендировали в полной среде в стандартных условиях культивирования (см. раздел 1.1) до окрашивания.
1.3.3.1.1. Окрашивание и сортировка первичных зрелых B-клеток, эффекторных T-клеток и миеломоноцитарных клеток, происходящих из различных тканей
Ниже приведены примеры окрашивания и сортировки B- и T-клеток из первичных клеток. Обычно селекция B-клеток и хелперных T-клеток была основана на поверхностной экспрессии CD19 и CD4, соответственно, в то время как селекция миеломоноцитарных клеток была основана на поверхностной экспрессии CD14 и/или CD16.
В кратком изложении 10 мкл каждого из антитела мыши против CD19 человека-FITC (BD Pharmingen) и антитела мыши против CD4 человека-PE (BD Pharmingen) или соответствующего изотипического контроля добавляли к 100-мкл аликвоте мононуклеарных клеток в среде для окрашивания (PBS+5%BSA), содержащей 1×105 клеток на аликвоту. Для данной аликвоты популяции мононуклеарных клеток смесь для окрашивания инкубировали в течение 30 минут на льду. К смеси для окрашивания добавляли 10 мл ледяной среды для окрашивания, и ее центрифугировали в течение 7 минут при 350g и 4°С. Супернатант аспирировали, а затем клеточный осадок ресуспендировали путем постукивания по пробирке, в которую был добавлен сравнимый объем ледяной среды для окрашивания. Окрашенные клетки центрифугировали, и промывали еще один раз в ледяной среде для окрашивания. Этот процесс повторяли для других аликвот. Окрашенные клетки анализировали с использованием FACS. Для каждого образца анализировали по меньшей мере 20000 событий ограничения в области. После установки соответствующих сортирующих областей для популяции положительных CD19 B-клеток (CD19+CD4-) или для популяции положительных по CD4 T-клеток (CD4+CD19-), фракции собирали. 1 мл каждой фракции собирали для анализа чистоты и остальную часть фракции ресуспендировали в полной среде для дальнейших экспериментов.
1.3.3.1.2. Выделение и анализ отсортированных популяций клеток
Небольшое количество клеток (≤ 5×105 клеток) отсортировывали непосредственно в микроцентрифужные пробирки с соответствующими адапторами. Перед сортировкой в пробирки для выделения добавляли небольшой объем (от 0,1 до 0,2 мл) дополненной RPMI 1640 для смешивания с сортируемым образцом и увеличения жизнеспособности отсортированных клеток. После сортировки, при условии допустимого количества выделенных клеток, 20 мкл каждого образца отсортированных клеток разбавляли 1:10 средой для окрашивания для повторного анализа в целях проверки их чистоты. Приемлемая чистота составляла ≥95%. Добавляли следующие от 20 до 40 мкл FCS на мл отсортированного образца, а затем проводили центрифугирование в течение 7 мин при 350g, 4°С. Затем клетки ресуспендировали в стандартной среде для культивирования тканей. Если было доступно достаточное количество клеток, их подсчитывали для определения выхода.
Профиль FACS для образцов селезенки, меченных антителом против CD19-FITC человека и антителом против CD4-PE человека, представлен на фигуре 11a, в то время как профили анализа чистоты для отсортированных CD19+ B-клеток и CD4+ T-клеток представлены на фигурах 11b и 11с (см. охарактеризацию гибрида KBT). Чистота клеток во фракциях превышала 98% для CD19+-клеток и 96% для CD4+-клеток.
Профили сортировки и чистоты для клеток CD19+ и CD4+ из периферической крови были по существу сходными с профилями из образцов селезенки, только были получены меньшие количества каждой из клеточных популяций.
Для выделения моноцитов и миеломоноцитарных клеток человека, популяции мононуклеарных клеток сначала истощали в отношении отрицательных по CD14 клеток с использованием магнитных гранул для CD14 человека MACS (Miltenyi Biotec GmbH), согласно инструкциям изготовителя. Затем отобранные положительной селекцией CD14 клетки далее окрашивали или метили антителом мыши против CD16-PE человека (BD Pharmingen) и антителом мыши против CD14-PerCP человека (BD Pharmingen). Способы окрашивания и сортировки клеток и выделения отсортированных клеток описаны выше (см. раздел 1.3.3.1.1 и 1.3.3.1.2).
Окрашенные образцы анализировали с использованием FACS. Анализировали по меньшей мере 20000 событий ограничения в области. Приблизительно 86% всех клеток, отобранных положительной селекцией по CD14 с использованием гранул MACS, были положительными по CD14. CD14+ популяцию дальше разделяли на три группы, исходя из экспрессии CD16: CD14HCD16-, соответствующая большинству CD14+ клеток; меньшая часть популяции в виде клеток CD14HCD16L и CD14HCD16H. Чистота клеток во фракциях превышала 98% для CD14HCD16-, 96% для CD14HCD16L и 92% для CD14HCD16H. После установки соответствующих сортирующих областей, собирали следующие популяции клеток: фракции клеток CD14HCD16-, CD14HCD16L и CD14HCD16H. На фигуре 4 представлен профиль FACS для обогащенных по CD14 образцов, меченных антителом мыши против CD16-PE человека и антителом мыши против CD14-PerCP человека.
Способы сортировки и очистки CD14+ клеток из тканей селезенки были по существу такими же, как способы для образцов периферической крови, за исключением того, что получали меньшие количества каждой из популяций клеток.
1.3.3.2. Выделение положительных по CD5 (обученных антигеном) B-клеток и отрицательных по CD5 (наивных) B-клеток из пуповинной крови человека
Из образцов пуповинной крови получали мононуклеарные клетки, как описано в разделе 1.3.1. Флуоресцентное окрашивание клеток с последующей сортировкой клеток проводили в пределах 4 часов после выделения популяции мононуклеарных клеток. В этом конкретном примере проводили сортировку отрицательных по CD5 (наивных) B-клеток и положительных по CD5 (обученных антигеном) B-клеток из пуповинной крови человека, с использованием антитела мыши против CD5-FITC человека (BD Pharmingen), антитела мыши против CD19-PE человека (BD Pharmingen) или соответствующего изотипического контроля согласно способу, описанному выше (раздел 1.3.3.1.1).
Окрашенные образцы анализировали с использованием FACS. Для каждого образца анализировали по меньшей мере 20000 событий ограничения в области. После установки соответствующих сортирующих областей для популяции отрицательных по CD5 B-клеток (CD19+CD5-) или популяции положительных по CD5 B-клеток (CD19+CD5+), был собран ряд фракций. На фигуре 5 представлен типичный профиль образцов, окрашенных антителом мыши против CD19 человека и антителом мыши против CD5 человека.
Процент B-клеток в образце находился в диапазоне от 4 до 19,2% и процент CD5+ B-клеток находился в диапазоне от 0,8 до 7,2% всех циркулирующих лимфоцитов.
1.3.3.3. Выделение положительных по CD5 (обученных антигеном) T-клеток и отрицательных по CD5 (наивных) T-клеток из пуповинной крови человека
Мононуклеарные клетки экстрагировали из образцов пуповинной крови с использованием способа, сходного со способом, описанным в разделе 1.3.1. Флуоресцентное окрашивание клеток с последующей сортировкой клеток проводили в пределах 4 часов после выделения популяции мононуклеарных клеток. В этом конкретном примере сортировку положительных по CD5 (обученных антигеном) T-клеток и отрицательных по CD5 (наивных) T-клеток из пуповинной крови человека проводили с использованием антитела мыши против CD5-FITC человека (BD Pharmingen), антитела мыши против CD3-PE человека (BD Pharmingen) или соответствующего изотипического контроля согласно способу, описанному ранее (раздел 1.3.3.1.1). Окрашенные клетки анализировали с использованием FACS. Анализировали по меньшей мере 20000 событий ограничения в области. Сортировочные области устанавливали для сбора фракций, содержащих либо отрицательные по CD5 T-клетки (CD3+CD5-), либо положительные по CD5 T-клетки (CD3+CD5+). На фигуре 6 представлен типичный профиль образцов, окрашенных антителом мыши против CD3 человека и антителом мыши против CD5 человека.
Выделение и анализ отсортированных популяций
Фактически использовали тот же способ выделения и анализа отсортированных популяций, который описан в разделе 1.3.3.1.2.
Процент T-клеток в образцах находился в диапазоне от 1,7 до 13,5% и процент CD5+ T-клеток находился в диапазоне от 0,4 до 1,3% от всех циркулирующих лимфоцитов.
1.3.3.4. Выделение ранних B-клеток, активированных и покоящихся B-клеток на основе экспрессии CD20 и CD72 из популяции мононуклеарных клеток костного мозга человека
Мононуклеарные клетки экстрагировали из костного мозга с использованием способа, описанного ранее (раздел 1.3.1). Флуоресцентное окрашивание клеток с последующей сортировкой клеток проводили в пределах 4 часов после выделения популяции мононуклеарных клеток. Окрашивание и сортировка активированных B-клеток описаны ранее в разделе 1.3.3.1.1. Конкретно, использовали 10 мкл антитела мыши против CD72-FITC человека (BD Pharmingen) и 20 мкл антитела мыши против CD20-PE человека (BD Pharmingen) или соответствующего изотипического контроля (антитела мыши IgG2b,κ-PE). Окрашенные клетки анализировали с использованием FACS. Сортирующие области были установлены для сбора фракций, содержащих либо положительную по CD20 популяцию, включающую пре-B-клетки, покоящиеся и активированные B-клетки, фолликулярные дендритные клетки (CD20+CD72-), либо положительную по CD72 популяцию, включающую ранние B-клетки (CD20-CD72+) или активированные B-клетки (CD20+CD72+). На фигуре 7 представлен типичный профиль образцов, окрашенных антителом мыши против CD20 человека и антителом мыши против CD72 человека.
Выделение и анализ отсортированных популяций
Для выделения и анализа отсортированных клеток фактически применяли тот же способ, который описан в разделе 1.3.3.1.2.
Как правило, приблизительно 10-15% популяции мононуклеарных клеток костного мозга были положительными как по CD20, так и по CD72; 9-12% клеток были положительными по CD20, но отрицательными по CD72; и приблизительно 8% были положительными только по CD72.
1.3.3.5. Выделение субпопуляций тимоцитов сортировкой с помощью магнитных гранул
С использованием набора MACS CD4 Multisort kit (Miltenyi Biotec GmbH), клеточные популяции CD4-CD8- двойных отрицательных тимоцитов, CD4+CD8+ двойных положительных тимоцитов и положительных только по CD4+ и CD8+ тимоцитов отсортировывали согласно инструкциям изготовителя. В кратком изложении тимоциты, собранные с использованием способа, сходного со способом, описанным в разделе 1.3.2, инкубировали с CD4-микрогранулами CD4 Multisort в течение 30 минут. После промывания 5 мМ ЭДТА и 0,5% BSA в PBS меченые клетки разделяли на магнитных колонках. Отобранные положительной селекцией тимоциты, которые оставались на магнитной колонке, содержали положительные только по CD4+ и CD4+CD8+ двойные положительные популяции клеток, в то время как истощенная по CD4 популяция клеток, которая проходила через колонку, содержала положительные только по CD8+ и CD4-CD8- двойные отрицательные клетки. Для удаления микрогранул из отобранных положительной селекцией по CD4 клеточных популяций, клетки инкубировали с реагентом для высвобождения MACS Multisort. Через 20 минут расщепление останавливали, и клетки метили в течение 30 минут CD8-микрогранулами. Двойные положительные CD4+CD8+ тимоциты получали положительной селекцией, в то время как в истощенной клеточной популяции были выявлены положительные только по CD4+ клетки. Клеточную популяцию, истощенную по CD4, инкубировали в течение 30 с CD8-микрогранулами. После нанесения меченных клеток на магнитную колонку, положительные только по CD8+ клетки можно было отделить от CD4-CD8- двойных отрицательных тимоцитов. Чистоту четырех различных субпопуляций тимоцитов оценивали проточно-цитометрическим анализом. Принимаемая чистота составляла более 95%.
1.3.3.6. Выделение CD54 + T-клеток из миндалевидных желез человека.
Мононуклеарные клетки экстрагировали из миндалевидных желез человека с использованием способа, описанного в разделе 1.3.2. Флуоресцентное окрашивание клеток с последующей сортировкой клеток проводили в пределах 4 часов после выделения популяции мононуклеарных клеток. CD54+ (внутриклеточная молекула адгезии-1 или ICAM-1) T-клетки экстрагировали из популяции мононуклеарных клеток миндалевидных желез с использованием антитела мыши против CD3 человека-PE (BD Pharmingen) и антитела мыши против CD54 человека-FITC (BD Pharmingen) или соответствующего изотипического контроля, и отбирали с использованием способа окрашивания/сортировки клеток, как описано в разделе 1.3.3.1.1. Окрашенные клетки анализировали с использованием FACS. Сортирующие области были установлены для сбора фракций, содержащих либо CD3+ T-клетки (т.е. CD3+CD54- клетки), либо активированные CD54+ T-клетки (т.е. CD3+CD54+ клетки). На фигуре 8 показан профиль FACS для образцов, окрашенных антителом мыши против CD3 человека и антителом мыши против CD54 человека. Клетки CD3+ использовали для создания тригибрида перекрестного происхождения, в то время как CD54+ активированные T-клетки использовали для экспериментов по экспрессии.
Результаты показали, что хотя T-клетки составляли большинство (82%) мононуклеарных клеток, выделенных из миндалевидных желез, только 9% представляли собой CD54+ T-клетки.
1.3.4 Выделение мононуклеарных клеток мыши
Мышей BALB/c в возрасте 8-12 недель содержали в специальных свободных от патогенов помещениях для животных. Перед экстракцией ткани, мышей умерщвляли воздействием CO2. Периферическую кровь отбирали пункцией подмышечной или бедренной артерии и собирали в покрытые гепарином пробирки. Выделение популяции мононуклеарных клеток проводили с использованием того же протокола, который описан в разделе 1.3.1 для выделения мононуклеарных клеток периферической крови человека. Селезенки мышей механически разрушали, и мононуклеарные клетки выделяли с использованием методики выделения мононуклеарных клеток селезенки мыши, как описано в разделе 1.3.2.
1.3.5. Выделение первичных клеток определенного ростка из мононуклеарных клеток
Клетки мыши T-лимфоидного ростка и миелоидного ростка выделяли стандартными способами с использованием FACS-анализа и сортировки клеток или магнитной сортировки клеток. Неограничивающие примеры окрашивания и сортировки для выделения первичных клеток мыши определенного ростка приведены ниже.
1.3.5.1. Выделение эффекторных T-клеток из селезенок и периферической крови мыши
Селекция различных эффекторных T-клеток была основана на поверхностной экспрессии CD4 и CD8.
10 мкл каждого из антитела мыши против CD4-PE мыши (BD Pharmingen) и антитела крысы против CD8-FITC мыши (BD Pharmingen) или соответствующего изотипического контроля добавляли к 100-мкл аликвотам либо клеток селезенки, либо мононуклеарных клеток периферической крови в среде для окрашивания (PBS+5%BSA), содержащей 1×105 клеток на аликвоту. Для данной аликвоты популяции мононуклеарных клеток, смесь для окрашивания инкубировали в течение 30 минут на льду. К смеси для окрашивания добавляли 10 мл ледяной среды для окрашивания, и центрифугировали в течение 7 минут при 350g и 4°С. Супернатант аспирировали, а затем клеточный осадок ресуспендировали путем постукивания по пробирке, в которую был добавлен сравнимый объем ледяной среды для окрашивания. Окрашенные клетки центрифугировали, и промывали еще один раз в ледяной среде для окрашивания. Этот процесс повторяли для других аликвот. Окрашенные клетки анализировали с использованием FACS. Для каждого образца анализировали по меньшей мере 20000 событий ограничения в области. Типичные профили FACS для окрашивания клеток периферичекой крови мыши и мононуклеарных клеток селезенки представлены на фигуре 45(a) и 45(b), соответственно. Обе лимфоидных ткани содержали единичные положительные по CD4 или по CD8 T-клетки и двойные положительные T-клетки, но варьировали по содержанию клеток. Например, наиболее крупная популяция в периферической крови содержала CD8+CD4- цитотоксические T-клетки (43%), в то время как мононуклеарные клетки селезенки были, главным образом, представлены CD4+CD8- хелперными или регуляторными T-клетками (42%). После установки соответствующих сортирующих областей для положительной по CD4 популяции (область R1), для положительной по CD8 популяции (область R3) или двойной положительной клеточной популяции (область R2), фракции собирали. 1 мл каждой фракции собирали для анализа чистоты, а остальную часть каждой фракции ресуспендировали в полной среде для дальнейших экспериментов. Чистота каждой фракции составляла более 98%.
1.3.5.2. Выделение моноцитов из периферической крови мыши
Моноциты мыши выделяли из популяции мононуклеарных клеток периферической крови с использованием отрицательной селекции с помощью магнитных гранул (Miltenyi Bio tec). Мононуклеарные клетки суспендировали в буфере для магнитной сортировки клеток (PBS, 01% масс./об. BSA, и 0,5 мМ ЭДТА) и инкубировали со смесью MicroBeads с антителами, включающими антитела против T-клеток (CD90), B-клеток (B220) и NK-клеток (CD49b) согласно протоколу изготовителя. Затем клетки прогоняли через LD-отрицательную колонку для селекции. Собирали отрицательную (моноцитарную) фракцию. Для определения чистоты клетки окрашивали конъюгированными с PE антителами к CD11b и конъюгированными с FITC антителами к CD90, B220, CD49b, NK1.1 и Ly6G (BD Pharmingen). Моноциты идентифицировали как CD11b+CD90-B220-CD49b-NK1.1-Ly6G-/(low) и профиль чистоты подтверждали с помощью FACS. Профиль чистоты популяции моноцитов мыши представлен на фигуре 46. 100% клеток были положительными по CD11b, в то время как более чем 98% из них были отрицательными по B220, CD90, CD49b и NK1.1. Приблизительно 38% положительных по CD11b клеток экспрессировали Ly6G на низких уровнях.
Пример 2
2. Получение первичных клеток, секретирующих желаемые белки
В следующих разделах приведены способы, использованные для получения первичных клеток человека, которые секретируют желаемые белки. Эти клетки либо использовали для экспериментов по гибридизации клеток, либо в качестве контролей в аналитических экспериментах, либо в качестве эталона для анализа белков, экспрессируемых в тригибридной экспрессирующей системе.
2.1. Получение лимфоцитов, секретирующих GM-CSF человека
Лимфоциты пуповинной крови сначала разделяли центрифугированием в градиенте плотности, как описано в разделе 1.3.1, а затем активировали в культуре фитогемагглютинином (PHA) с последующим размножением клеток в присутствии IL-2 (1000 Е/мл). Продукцию GM-CSF человека анализировали посредством ELISA. Концентрации продукта находились в диапазоне от 15 до 40 нг/мл/106 клеток.
Всего 300000 активированных PHA лимфоцитов человека инкубировали в темноте с антителом мыши против CD4 человека, конъюгированным с FITC (Sigma), в концентрациях согласно инструкциям изготовителя в течение 30 мин при 4°C. Активированные T-клетки человека анализировали, и подвергали селекции с использованием FACS (FACS VantageSE, BD). На фигуре 42 (a) представлен типичный профиль CD4+ T-клеток в активированных PHA культурах лимфоцитов, где на фигуре 42 (b) представлена 100% чистота для отсортированных CD4+ клеток.
2.2. Получение лимфоцитов человека, секретирующих IgM и IgG
Очищенные B-клетки (см. раздел 1.3.3.1) высевали в количестве 3,75×105 клеток/мл в лунки 96-луночных круглодонных планшетов (Corning), покрытых антителом мыши против CD154 человека (BD Pharmingen). Клетки культивировали в полной среде RPMI 1640, дополненной 10% инактивированной нагреванием FBS со сверхнизким содержанием IgG (Gibco/BRL) и 100 Е/мл интерлейкина 4 (IL-4) (R&D systems) и 50 нг/мл интерлейкина 10 (IL10), добавленного после 3 суток в культуре. Культуры пополняли, заменяя половину культуральной среды каждые от 2 до 3 суток. Жизнеспособность клеток оценивали в трех экземплярах по исключению трипанового синего с использованием гемоцитометра. На 5 сутки и 10 сутки, культивированные лимфоциты собирали, промывали два раза PBS и анализировали посредством FACS с использованием антитела мыши против CD19-PE человека, антитела мыши против IgM-FITC человека или антитела мыши против IgG человека-FITC (все от BD Pharmingen). Все окрашивания проводили с помощью 1 мкг каждого антитела на 1×106 клеток при 4°C. Во всех анализах более 95% клеток были двойными отрицательными с маркерами, установленными согласно окрашиванию совпадающим по изотипу отрицательным контролем. Области, содержащие погибшие клетки и дебрис, исключали из анализа. Все анализы проводили путем ограничения в области от 5000 до 10000 живых клеток.
Типичные профили положительных по IgM и IgG клеток в культивированных лимфоцитах представлены на фигуре 9. После 5 суток в культуре 18% CD19+ клеток были положительными по IgM и только 1% имел поддающийся детекции IgG на поверхности, в то время как после 10 суток процент положительных по IgM лимфоцитов снижался до только 2%, в то время как процент положительных по IgG клеток возрастал до 15%. После установки соответствующих областей положительные по IgM и положительные IgG фракции отсортировывали для экспериментов по экспрессии Ig.
Концентрации IgM и IgG в культуре определяли с помощью стандартного ELISA с использованием 96-луночных планшетов для ELISA и абсорбированных на пластмассу подвергнутых аффинной очистке антител козы к μ- и γ-цепям человека. Связанные антитела выявляли с помощью конъюгированных с HRP антител овцы против Ig человека. Все антитела были от Sigma. В качестве субстрата использовали ABTS, и оптическую плотность измеряли при 405 нм. В таблице 1 обобщенно представлены уровни IgM и IgG, выявленных в культуре B-лимфоцитов через 5 и 10 суток.
Продукция IgM снижалась после 5 суток в культуре, в то время как продукция IgG увеличивалась.
Пример 3
3. Гибридизация соматических клеток
В данной области хорошо известно несколько способов соматической гибридизации клеток. Они включают, но не ограничиваются ими, например, биологический способ с использованием фузагенного вируса, такого как вирус Сендай (Kohler and Milstein, 1975), химический способ с использованием полиэтиленгликоля (PEG) (Wojciezsyn, et al, 1983), и электрический способ с использованием электрических полей (Neil and Zimmermann, 1993). Каждый способ может индуцировать или вызывать обратимую проницаемость плазматических мембран и гибридизацию.
Независимо от способов гибридизации клеток, упомянутых выше, для обеспечения гибридизации клеток требуется, в принципе, две обязательных стадии. Во-первых, плазматические мембраны клеток, подлежащих гибридизации, необходимо привести в плотный контакт клеточных мембран. Во-вторых, можно одновременно индуцировать обратимое разрушение плазматических мембран в точке контакта.
Для электрического способа гибридизации клеток, представляющие интерес клетки можно приводить в тесный контакт клеточных мембран с использованием электрического поля с переменным током (поле AC) с соответствующей частотой поля, а затем индуцировать их гибридизацию при воздействии на них короткого электрического импульса одновременно с полем AC.
В качестве другого выбора, электрическая гибридизация клеток вовлекает следующие физические явления; диэлектрофорез (DEP) и электрическое разрушение плазматических мембран клетки.
Диэлектрофорез (Pohl, 1978) представляет собой явление, которое охарактеризовывает движение диэлектрических частиц, таких как биологические клетки, когда они суспендированы в соответствующем растворе и подвергаются действию неравномерного электрического поля AC с соответствующей частотой. Документировано, что движение клеток может быть описано как (i) перенос или миграция диэлектрических частиц, например, при частотах поля между 0,5-2,0 мегагерц (МГц) для клеток Sp2, суспендированных в 100 мМ сорбите (Mahaworasilpa, 1992) и (ii) вращение диэлектрических частиц (Mahaworasilpa, 1992), например при частотах поля между 2-10 килогерц (кГц) для клеток Sp2, суспендированных в 100 мМ сорбите. Неравномерное поле можно получать путем применения электрического поля между парой электродов, например, электрических цилиндрических проводов, которые могут быть расположены в нескольких конфигурациях. Наиболее широко используемая конфигурация представляет собой параллельную конфигурацию электродов (фигура 58). В присутствии неравномерного поля DEP может вызывать привлечение диэлектрическими частицами (т.е. биологическими клетками) друг друга и одновременную миграцию в направлении областей наиболее интенсивного поля. В результате оно формирует цепь или нить из клеток и, в свою очередь, это индуцирует хороший контакт клеточных мембран. Очевидно, что взаимное привлечение клеток обеспечивается строго, когда клетки суспендируют в растворах с умеренно низкой электрической проводимостью.
Электрическое разрушение мембран клеток можно индуцировать, когда на клетки, суспендированные в пригодном растворе для гибридизации, воздействуют электрическим импульсом с соответствующей амплитудой и длительностью (Zimmermann, 1982). Широко используют диапазон длительностей импульса, например, прямоугольные импульсы от 1 до 200 микросекунд (мкс), в зависимости от типов клеток, подлежащих гибридизации.
3.1. Электрическая система для гибридизации клеток
В определенных вариантах осуществления этого изобретения для создания гибридизованных клеток, таких как тригибриды, можно использовать электрический способ.
3.1.1. Система манипулирования клетками
Для манипулирования отдельными представляющими интерес клетками во всех случаях для этого изобретения перед гибридизацией клеток использовали систему для манипуляции/доставки единичных клеток, описанную выше (раздел 1.1.1).
3.1.2. Микроэлектроды
В этом изобретении использовали два L-образных микроэлектрода. На фигуре 57 представлен микроэлектрод, который был изготовлен из непокрытого никелевого сплава диаметром 128 мкм (7). Стержень микроэлектрода был заключен в капиллярную трубку для определения гематокрита с наружным диаметром 1,5 мм (8). L-образная секция микроэлектрода (9 и 10) имела такую конфигурацию, чтобы обеспечивать постоянную площадь поверхности как горизотальной, так и вертикальной секций электрода, подлежащих воздействию среды или соответствующего раствора (Mahaworasilpa, 1992). Перед процессом гибридизации два микроэлектрода устанавливали на два тонких микроманипулятора, по одному на каждый микроэлектрод. Эти микроэлектроды располагали так, чтобы обеспечить параллельную конфигурацию каждого электрода (фигура 58). Каждый тонкий микроманипулятор имел гидравлический привод и обеспечивал движение с точностью до 0,5 мкм в направлении X, Y или Z.
3.1.3. Клеточная камера и конфигурация
На фигуре 59 представлены два параллельных электрода в лунке стандартного 96-луночного планшета TC, лунка служит в качестве камеры для гибридизации клеток в определенных вариантах осуществления этого изобретения. Для проведения гибридизации клеток микроэлектроды погружали в соответствующую среду (11), содержавшуюся в лунке (12) стандартного 96-луночного планшета для культивирования тканей. На фигуре 60 и фигуре 61 показан вид сверху и вид сбоку параллельной конфигурации электродов, соответственно, где, например, три предварительно отобранных клетки, подлежащих гибридизации, помещены между параллельными электродами таким образом, чтобы можно было индуцировать их выстраивание в линию или образование цепи клеток в присутствии соответствующего электрического поля AC.
Пример 4
4. Примеры установления тригибридов перекрестного происхождения электрическим способом гибридизации клеток
В следующих разделах предоставлены примеры создания тригибридных клеточных линий, получаемых гибридизацей клеток либо из различных ростков или типов клеток, либо из одинаковых ростков/или типов клеток, но различных фенотипов. Каждый стабильный тригибрид подвергали анализу для подтверждения того, что он одновременно обладал фенотипическими характеристиками родительских клеток. Подтверждение было основано на анализе специфичных для ростков клеточных маркеров, внутриклеточной экспрессии специфичных для ростков маркеров, присутствии транскриптов РНК специфичных для ростков маркеров, кариотипировании и/или секреции специфичных для ростка белков. Представленные ниже примеры иллюстрируют наиболее типичные фенотипические характеристики тригибридов перекрестного происхождения. Однако эти примеры никоим образом не ограничиваются конкретным выбранным маркером.
4.1. Получение тригибрида перекрестного происхождения из трех бессмертных клеток, происходящих из миелоидных, T- и B-лимфоидных ростков - KMW.
Этот тип тригибрида перекрестного происхождения получали гибридизацией одной миелоидной клетки K562, одной T-лимфоидной клетки MOLT4 и одной B-лимфоидной клетки WIL2NS. Полученный таким образом, тригибрид перекрестного происхождения обозначали как линия KMW (с последующим серийным номером). Следующие стадии способа получения тригибрида KMW перекрестного происхождения, растворы (среды для гибридизации, культивирования и выделения) и параметры, использованные для этого изобретения, описаны ниже.
4.1.1. Получение клеток для получения тригибрида KMW перекрестного происхождения
Клеточные линии K562, WIL2NS и MOLT4 культивировали в стандартной среде авторов изобретения (см. раздел 1.1). В качестве обычной процедуры, каждую линию пассировали каждые 3 суток. Перед гибридизацией клеток получали стабильный клон каждого типа клеток, который имел наиболее высокую скорость пролиферации, с использованием способа, описанного в разделе 1.1.2. В некоторых экспериментах использовали обогащенные по CD71+ популяции клеток, полученные, как описано в разделе 1.1.3. Также в некоторых случаях использовали CD15+ клетки обогащенной по CD71+ популяции K562 (раздел 1.1.3.1).
4.1.2. Протокол гибридизации клеток для продукции тригибрида KMW перекрестного происхождения
Несколько лунок 96-луночного планшета TC использовали в качестве лунок для гибридизации клеток. Каждую лунку заполняли приблизительно 150 мкл среды для гибридизации, которая состояла из 240 мМ сорбита (Sigma), 2,0 мМ KH2PO4 (Sigma), 0,4 мМ CaCl2 (Sigma), 0,2 мМ Mg(C2H3O2)2 (Sigma) и 0,2 мМ Ca(C2H3O2)2 (Sigma), дополненной 0,2% бычьим сывороточным альбумином, BSA (Sigma). Перед электрической гибридизацией клеток, клетки предварительно отобранного клона каждого типа клеток промывали один раз в среде для гибридизации в течение нескольких минут, и переносили в лунку, содержавшую свежую среду для гибридизации. Лунку обозначали как лунка для предгибридизации. Перед процессом гибридизации клеток единичную и промытую клетку каждого отобранного клона подвергали манипулированию согласно разделу 1.1.1, так чтобы только три клетки, по одной из каждого отобранного клона, были расположены между парой идентичных параллельных электродов, которые были погружены на дно лунки (как показано на фигуре 61). Расстояние между электродами устанавливали на 400 микрометров (т.е. 400 мкм).
Для обеспечения электрической гибридизации клеток, во-первых, применяли поле с переменным током (AC) с частотой 0,8 МГц и силой поля приблизительно 50-60 килоВольт на метр (например 50-60 кВ/м) между электродами в течение нескольких секунд, до тех пор, пока не индуцировалось привлечение трех клеток друг к другу с помощью диэлектрофореза, DEP, и они не образовывали нить из клеток. Этот процесс приводил к тому, что между клетками устанавливался хороший контакт клеточных мембран. Клетки располагали так, чтобы клетка K562 была в середине линии клеток (см. фигуру 60 или 61). Затем применяли два электрических прямоугольных импульса с интервалом 3 секунды между импульсами, одновременно с полем AC. Каждый использованный импульс имел интенсивность приблизительно 170 кВ/м и длительность импульса 75 микросекунд (например, 75 мкс). После окончания второго прямоугольного импульса поле AC поддерживали постоянным в течение других 5 секунд, что приводило к гибридизации клеток в единую тригибридную клетку перекрестного происхождения. Для определенных вариантов осуществления этого изобретения, наблюдали, что гибридизация трех клеток может происходить не одновременно, т.е. часто сначала происходила гибридизация двух из трех клеток с последующей гибридизацией третьей клетки. В некоторых случаях для достижения полной трехклеточной гибридизации требовался дополнительный прямоугольный импульс. Затем вновь полученную тригибридную клетку перекрестного происхождения переносили из лунки для гибридизации в лунку для выделения, которая была расположена в ряду, отличающемся от лунок для гибридизации. Каждая лунка для выделения содержала 150 мкл стандартной среды TC (см. раздел 1.1). Каждую вновь полученную тригибридную клетку перекрестного происхождения инкубировали, по одной тригибридной клетке перекрестного происхождения на лунку для выделения, в инкубаторе с увлажнением, действующем при 37°C и с 5% содержанием CO2 в течение семи суток. Было выявлено, что большинство тригибридов перекрестного происхождения делятся в пределах 36 часов после события гибридизации клеток. В конце периода инкубации, среду в каждой из лунок для выделения соответствующим образом пополняли свежей стандартной средой. Это стимулировало пролиферацию клеток каждого тригибридного клона перекрестного происхождения. Через двое или трое суток делящиеся или выжившие клетки из каждой лунки для выделения идентифицировали и высевали в лунки стандартного 24-луночного планшета TC, что приводило к появлению ряда тригибридных клонов перекрестного происхождения. Каждый тригибридный клон перекрестного происхождения культивировали в 24-луночном планшете в течение другой недели, а затем переносили в 25-см2 колбу TC, содержавшую 10 миллилитров (мл) стандартной культуральной среды авторов изобретения (см. раздел 1.1) и обозначенную соответствующим образом для дальнейшего анализа. Весь процесс электрической гибридизации клеток и выделения тригибрида перекрестного происхождения повторяли несколько раз для получения партии стабильных тригибридных клеток перекрестного происхождения.
4.1.3. Подтверждение статуса тригибрида KMW перекрестного происхождения
Экспрессия маркеров CD
Пример проверки полученной тригибридной клеточной линии KMW перекрестного происхождения приведен ниже.
После получения тригибридной клеточной линии KMW перекрестного происхождения в нормальных условиях культивирования в течение 6 месяцев, популяцию тригибридных клеток перекрестного происхождения анализировали в отношении экспрессии специфичных для ростка маркеров CD.
Использовали трехцветный анализ FACS для проверки коэкспрессии следующих маркеров CD: CD19, происходящий из WIL2NS, CD15, происходящий из K562, и CD4, происходящий из MOLT4.
В кратком изложении 100 мкл тригибридных клеток KMW перекрестного происхождения в концентрации 1×106 клеток/мл в PBS, содержавшем 5% BSA, суспендировали в 100 мкл PBS и инкубировали в течение 30 мин при 4°С с 0,5 мг/100 мл антитела мыши против CD15 человека-PerCP, 0,25 мг/100 мл антитела мыши против CD4-PE человека и 1,0 мг/100 мл антитела мыши против CD19-FITC человека или соответствующего изотипического контроля. Все антитела мыши против антител человека приобретали от BD Pharmingen. После тщательного промывания PBS меченые клетки анализировали с использованием проточного цитометра FACSCalibur и программного обеспечения CellQuest Pro.
На фигуре 10 представлен профиль FACS тригибридной клеточной линии KMW перекрестного происхождения, который указывает на то, что тригибридные клетки KMW перекрестного происхождения, где специфичные для ростка характеристики являются результатом бессмертных фенотипов, содержат гетерогенные популяции клеток смешанных фенотипов, причем миелоидный является преобладающим. Однако 62% клеток KMW обладали миелоидными, и T-лимфоидными фенотипами и 28% KMW клеток проявляли T- и B-лимфоидные фенотипы.
4.2. Получение тригибрида перекрестного происхождения из одной бессмертной миелоидной и двух первичных лимфоидных клеток - KBT
Тригибрид перекрестного происхождения получали гибридизацией соматических клеток: одной миелоидной клетки K562, одной первичной B-клетки человека и одной первичной T-клетки человека. Тригибрид перекрестного происхождения был назван KBT с последующим серийным номером.
4.2.1. Получение клеток для получения тригибрида KBT перекрестного происхождения
Получение клеток K562 перед созданием тригибрида KBT перекрестного происхождения описано выше (раздел 4.1.1). Первичные клетки, использованные для создания тригибридов KBT перекрестного происхождения, включали (i) зрелые B-клетки (CD19+), происходящие из селезенки, периферической крови или пуповинной крови; ранние B-клетки (CD20-CD72+), происходящие из костного мозга; активированные B-клетки (CD20+CD72+), происходящие из костного мозга; обученные антигеном B-клетки (CD19+CD5+), происходящие из пуповинной крови и (ii) хелперные T-клетки (CD4+), происходящие из селезенки, периферической крови, пуповинной крови и тимуса, цитотоксические T-клетки (CD8+), происходящие из селезенки, периферической крови, пуповинной крови и тимуса; обученные антигеном T-клетки (CD3+CD5+), происходящие из пуповинной крови; CD3+ T-клетки из пуповинной крови; двойные отрицательные T-клетки (CD3+CD4-CD8-) происходящие из тимуса, двойные положительные T-клетки (CD3+CD4+CD8+), происходящие из тимуса. Выделение различных лимфоидных клеток из различных лимфоидных тканей описано выше в разделе 1.3.
4.2.2. Протокол гибридизации клеток для получения тригибрида KBT перекрестного происхождения
Протокол гибридизации клеток для получения тригибрида KBT перекрестного происхождения сходен с протоколом, использованным для получения тригибрида KMW перекрестного происхождения (раздел 4.1.2), за исключением того, что среда и электрические поля AC и импульсы отличались.
Среда для гибридизации, использованная в этих экспериментах, состояла из 230 мМ сорбита, 1,8 мМ KH2PO4, 0,5 мМ CaCl2, 0,2 мМ Mg(C2H3O2)2 и 0,3 мМ Ca(C2H3O2)2, дополненных 0,3% BSA. Поле AC с параметрами 0,5 МГц и 65-75 кВ/м применяли одновременно с последовательностью из трех прямоугольных импульсов с интервалом 3 секунды, каждый из которых имел длительность импульса 100 мкс и силу 175-185 кВ/м. Поле AC включали постоянно в течение других 5 с после окончания третьего прямоугольного импульса, что приводило к гибридизации клеток с получением тригибридной клетки перекрестного происхождения. Протоколы для выделения и установления стабильной линии этой вновь полученной тригибридной клетки перекрестного происхождения описаны в разделе 4.1.2.
4.2.3. Подтверждение статуса тригибрида KBT перекрестного происхождения
Экспрессия маркеров CD на клеточной поверхности
Линия тригибридных клеток KBT перекрестного происхождения, полученная из одной бессмертной миелоидной клетки (K562), одной первичной зрелой B-клетки и одной первичной эффекторной T-хелперной клетки
После установления тригибридной клеточной линии перекрестного происхождения, например, в нормальных условиях культивирования в течение нескольких месяцев, клеточную линию анализировали в отношении экспрессии специфичных для ростка маркеров CD. Клетки клеточной линии KBT метили антителами мыши против CD19 и CD4 человека с использованием тех же протоколов, которые описаны для получения клеток перед гибридизацией (раздел 1.3.1.1). На фигуре 11(d) представлены профили FACS (метки CD19 и CD4) для тригибридной клеточной линии KBT перекрестного происхождения, установленной из одной бессмертной миеломоноцитарной клетки и 2 первичных клеток. Как правило, более 95% клеток в таком стабильном тригибриде перекрестного происхождения экспрессировали маркеры CD как для B-клеток, так и для T-клеток с плотностью, сходной с плотностью исходных первичных клеток.
Тригибридная клеточная линия KBT перекрестного происхождения, установленная из одной бессмертной миелоидной клетки (K562) и 2 первичных обученных антигеном лимфоидных клеток (B- и T-клетки)
В другом варианте осуществления была установлена клеточная линия KBT, полученная гибридизацией клетки K562, одной обученной антигеном B-клетки и одной обученной антигеном T-клетки. Клетки анализировали в отношении коэкспрессии CD19, CD3 и CD5 с использованием FACS.
В кратком изложении клетки метили антителом мыши против CD5 человека-FITC и антителом мыши против CD19-PE человека или антителом мыши против CD4-PE человека с использованием того же протокола, что и для получения клеток перед гибридизацией клеток (раздел 1.3.1.1). На фигуре 12 представлены профили FACS для клеток такой тригибридной клеточной линии KBT перекрестного происхождения. Результаты показывают, что 5-10% популяции клеток KBT сохраняли их память о воздействии антигена путем поддержания экспрессии на клеточной поверхности молекулы CD5, оставаясь положительными по CD3 или/и CD19. Также по меньшей мере 83% отрицательной по CD5 популяции клеток коэкспрессировали маркеры как B-ростка (CD19), так и T-ростка (CD3).
Тригибридная клеточная линия KBT перекрестного происхождения, установленная из одной бессмертной миелоидной клетки (K562), активированной B-клетки и одной первичной двойной положительной некоммитированной эффекторной T-клетки
В другом варианте осуществления устанавливали клеточную линию KBT, полученную гибридизацией клеток: одной клетки K562, одной T-клетки (двойная положительная по CD4+ и CD8+), выделенной из тимуса, и одной активированной B-клетки (CD20+ и CD72+) (объяснено в разделе 1.3.34), выделенной из костного мозга. Клетки анализировали в отношении коэкспрессии CD4, CD8, CD20 и CD72 на клеточной поверхности.
В кратком изложении тригибридные клетки KBT перекрестного происхождения метили любой из комбинаций антитела мыши против CD4-PE человека и антитела мыши против CD72-FITC человека или антитела мыши против CD20-PE человека и антитела мыши против CD8-FITC человека или антитела мыши против CD4-PE человека и антитела мыши против CD8-FITC человека с использованием того же протокола, который описан для выделения первичных лимфоцитов (раздел 1.3.3.1.1). На фигуре 13 представлены профили FACS для таких тригибридных клеток перекрестного происхождения.
Результаты (см. фигуру 13) показали, что 99% тригибридных клеток KBT перекрестного происхождения экспрессировали либо CD4, либо CD8, происходящие из двойных положительных T-клеток на их поверхности, где 66-71% клеток были положительными по CD4 и 88-89% клеток были положительными по CD8. В 60% этих клеток экспрессия CD4 и CD8 была одновременной. Являясь положительными по CD4, происходящему из двойных положительных тимоцитов, 61% клеток также были положительными по CD72, происходящему из активированных B-клеток костного мозга. Однако 94% тригибридной популяции перекрестного происхождения экспрессировали CD72 на их поверхности. С другой стороны, 31% положительных по CD8 тригибридных клеток перекрестного происхождения коэкспрессировали CD20. Общее количество положительных по CD20 клеток составляло 39%.
4.3. Получение тригибрида перекрестного происхождения из одной бессмертной лимфоидной клетки, одной первичной лимфоидной клетки и одной первичной миеломоноцитарной клетки - WTM
Далее представлен пример получения тригибридной клеточной линии перекрестного происхождения из одной бессмертной B-лимфоидной клетки человека (WIL2NS), одной первичной T-клетки человека и одного первичного моноцита человека. Тригибридная линия перекрестного происхождения была обозначена как WTM с последующим серийным номером.
4.3.1. Получение клеток для получения тригибрида WTM перекрестного происхождения
Получение клеток WIL2NS, использованных при создании тригибридов WTM перекрестного происхождения, описано выше в разделе 4.1.1. Первичные клетки, использованные для этих экспериментов, включали моноциты CD14+CD16- или CD14+CD16L, происходящие из селезенки и периферической крови; хелперные T-клетки (CD4+), происходящие из селезенки, периферической крови, пуповинной крови и тимуса; цитотоксические T-клетки (CD8+), происходящие из селезенки, периферической крови, пуповинной крови и тимуса; обученные антигеном T-клетки (CD3+CD5+) и CD3+ T-клетки, происходящие из пуповинной крови; двойные отрицательные T-клетки (CD3+CD4-CD8-) и двойные положительные T-клетки (CD3+CD4+CD8+), происходящие из тимуса. Выделение различных первичных лимфоидных клеток из различных лимфоидных тканей описано выше (раздел 1.3.3). В определенных вариантах осуществления вместо положительных по CD14 моноцитов использовали CD34+CD15+ миеломоноцитарные клетки-предшественники, происходящие из костного мозга.
4.3.2. Протокол гибридизации клеток для получения тригибрида WTM перекрестного происхождения
Протокол гибридизации клеток для получения тригибрида WTM перекрестного происхождения был сходен с протоколом, использованным для получения тригибрида KMW перекрестного происхождения (см. раздел 4.1.2), за исключением того, что среда отличалась. Среда для гибридизации, использованная в этих экспериментах состояла из 235 мМ сорбита, 1,8 мМ KH2PO4, 0,5 мМ CaCl2, 0,3 мМ Mg(C2H3O2)2 и 0,25 мМ Ca(C2H3O2)2 (Sigma), дополненных 0,3% BSA. Для получения WTM использовали точный протокол электрической гибридизации, как описано в разделе 4.2.2. Протоколы для выделения и установления стабильной линии этой вновь образованной тригибридной клетки перекрестного происхождения описаны в разделе 4.1.2.
4.3.3. Подтверждение статуса тригибрида WTM перекрестного происхождения
Экспрессия маркеров CD
Тригибридная клеточная линия WTM перекрестного происхождения, установленная из одной бессмертной лимфоидной клетки (WIL2NS), одной первичной T-клетки и одного первичного моноцита
Устанавливали клеточную линию WTM, полученную гибридизацией клеток: одной клетки WIL2NS, одной первичной T-клетки и одного моноцита. После культивирования тригибридной клеточной линии перекрестного происхождения в нормальных условиях (см. раздел 1.1) в течение 6 месяцев, популяцию тригибридных клеток перекрестного происхождения анализировали в отношении экспрессии специфичных для ростка маркеров CD. Для проверки коэкспрессии CD19, происходящего из WIL2NS, CD14, происходящего из первичных моноцитов, и CD4, происходящего из первичных T-клеток, когда эти первичные T-клетки использовали для гибридизации, использовали трехцветный анализ FACS.
В кратком изложении, 100 мл тригибридных клеток WTM перекрестного происхождения в концентрации 1×106 клеток/мл в PBS, содержащем 5% BSA, суспендировали в 100 мкл PBS и инкубировали в течение 30 мин при 4°С с мечеными моноклональными антителами (0,5 мг/100 мл CD14-PerCP, 0,25 мг/100 мл CD4-PE и 1,0 мг/100 мл CD19-FITC, все приобретены от BD Pharmingen) или соответствующим изотипическим контролем. После тщательного промывания PBS, меченые клетки анализировали с использованием проточного цитометра FACSCalibur и программного обеспечения CellQuest Pro.
Профили FACS для тригибридных клеток WTM перекрестного происхождения представлены на фигуре 14. В то время как уровни экспрессии маркера CD19, который происходил из бессмертной клетки, оказались единообразными среди популяции тригибридных клеток перекрестного происхождения, экспрессия маркеров, происходящих из первичных клеток, оказалась отличающейся. В этом конкретном примере популяции клеток можно было подразделить на три подгруппы, основываясь на интенсивности экспрессии CD14 и CD4: (i) CD4HCD14L; (ii) CD4HCD14H; (iii) CD4LCD14H. Затем каждую из этих популяций можно было выделять стандартными способами, такими как FACS, MACS или клонирование единичных клеток и т.д. и размножать в отдельные тригибридные культуры перекрестного происхождения, обладающие фенотипическими характеристиками, отличающимися друг от друга, при сохранении гомогенности внутри культуры.
Тригибридная клеточная линия WTM перекрестного происхождения устанавливленная из одной бессмертной лимфоидной клетки (WIL2NS), одной первичной обученной антигеном T-клетки и одного первичного моноцита
Когда обученные антигеном CD5+ T-клетки использовали для получения тригибридной клетки WTM перекрестного происхождения, экспрессию CD5 одновременно с CD19 и CD14 подтверждали с использованием трехцветного анализа FACS. Протокол был по существу таким же, как описано выше, за исключением того, что вместо антитела мыши против CD19-PE человека и антитела мыши против CD5-FITC человека использовали антитело мыши против CD19-FITC человека и антитело мыши против CD4-PE человека. Профили FACS для этой экспрессии CD на тригибридных клетках перекрестного происхождения представлены на фигуре 15. Анализ показал, что хотя уровень экспрессии CD19, происходящего из бессмертной клетки и ответственного за B-клеточный фенотип, оказался единообразным, составляя приблизительно 91-99% от клеточной популяции, экспрессия CD5, происходящего из обученных антигеном T-клеток, и CD14, происходящего из первичных моноцитов, варьировала среди гибридных клеток WMT. Только 63% положительных по CD19 клеток также были положительными по CD5, и 79% положительных по CD19 клеток были положительными по CD14. Примечательно, что уровень экспрессии CD14 варьировал среди таких тригибридных клеток WMT перекрестного происхождения от низкого до высокого. С другой стороны, популяция клеток отчетливо подразделялась на CD5+ и CD5- тригибридные клетки перекрестного происхождения.
Тригибридная клеточная линия WTM перекрестного происхождения, установленная из одной бессмертной лимфоидной клетки (WIL2NS), одной первичной цитотоксической T-клетки и одного первичного моноцита
Когда цитотоксические положительные по CD8 T-клетки использовали для создания тригибридной линии WTM перекрестного происхождения, анализ FACS для проверки экспрессии вместе CD19, CD8 и CD14 проводили с использованием того же протокола трехцветного мечения, который описан выше в этом разделе. На фигуре 16 представлены профили FACS экспрессии CD19, CD8 и CD14 на клетках этой тригибридной клеточной линии WTM перекрестного происхождения. Экспрессия CD19 и его уровень оставались постоянными среди этих тригибридных клеток WMT перекрестного происхождения, в то время, как только 46% этих клеток экспрессировали вместе CD8, происходящий из первичных цитотоксических T-клеток на низких уровнях, и 41% экспрессировали вместе CD14, происходящий из первичных моноцитов. Примечательно, что уровень экспрессии CD14 среди этих клеток WMT варьировал от низкого до высокого.
Тригибридная клеточная линия WTM перекрестного происхождения из одной бессмертной лимфоидной клетки (WIL2NS), одной первичной двойной положительной T-клетки и одного первичного моноцита
Когда для получения тригибридной клеточной линии WTM перекрестного происхождения использовали двойные положительные по CD T-клетки (CD4+CD8+), происходящие из тимуса, использовали анализ коэкспрессии CD4 и CD8 в дополнение к анализу экспрессии CD19, CD8 и CD14. На фигуре 17 показан профиль FACS для коэкспрессии CD4 и CD8 на клетках тригибридной клеточной линии перекрестного происхождения. В случае, где использовали двойные положительные T-клетки, 96% тригибридных клеток WTM перекрестного происхождения были положительными как по CD4, так и по CD8. Профиль экспрессии CD19 и CD14 на тригибридных клетках WTM перекрестного происхождения, происходящих из положительных по CD4+CD8+ T-клеток, был по существу сходен с профилем экспрессии на тригибридных клетках WTM перекрестного происхождения, происходящих из цитотоксических положительных по CD8 эффекторных T-клеток.
Тригибридная клеточная линия WTM перекрестного происхождения, установленная из одной бессмертной лимфоидной клетки (WIL2NS), одной первичной T-клетки и одной первичной миеломоноцитарной клетки-предшественника
Когда CD34+CD15+ миеломоноцитарные клетки, происходящие из костного мозга, использовали для получения тригибридной клеточной линии WTM перекрестного происхождения, анализировали поверхностные маркеры CD19 (B-росток), CD3 (T-росток), CD15 (миелоидный росток) и CD34 (клетки-предшественники). В кратком изложении, клетки этой тригибридной клеточной линии WMT перекрестного происхождения метили комбинацией антитела мыши против CD19-PE человека, антитела мыши против CD4-FITC человека (BD Pharmingen) и антитела мыши против CD15-PerCP человека или комбинацией антитела мыши против CD34-PE человека, антитела мыши против CD4-FITC человека и антитела мыши против CD15 PerCP человека. Окрашивание клеток проводили согласно протоколам, описанным выше (раздел 1.3.3.1.1). Типичные профили экспрессии тригибридных клеток WTM перекрестного происхождения, происходящих из CD34+CD15+ миеломоноцитарной клетки-предшественника, представлены на фигуре 18. Анализ показал, что приблизительно 81% тригибридных клеток WTM перекрестного происхождения обладают фенотипом B-ростка и миеломоноцитарным фенотипом (CD19+CD15+) и 61% CD19+ клеток также были положительными по CD4, маркеру T-ростка. У 34% CD4+ тригибридных клеток перекрестного происхождения также сохранялся CD34 на их поверхности и 68% CD34+ тригибридных клеток экспрессировали CD15. Интересно, что у 28% CD34+ тригибридных клеток перекрестного происхождения не сохранялась экспрессия CD15, хотя как CD34, так и CD15, происходят из одного источника (миеломоноцитарная клетка-предшественник).
4.4. Получение тригибрида перекрестного происхождения из одной бессмертной миелоидной клетки, одной бессмертной лимфоидной клетки и одной первичной лимфоидной T-клетки - KWT
Этот тип тригибрида перекрестного происхождения получали гибридизаций клеток: одной бессмертной миелоидной клетки (K562), одной бессмертной B-лимфоидной клетки (WIL2NS) и одной первичной T-клетки человека. Тригибрид перекрестного происхождения этого типа обозначили как KWT с последующим серийным номером.
4.4.1. Получение клеток для получения тригибрида KWT перекрестного происхождения
Получение клеток K562 и WIL2NS для этих экспериментов по гибридизации клеток описано в разделах 4.1.1. Перед гибридизацией клеток устанавливали стабильный клон каждого типа клеток, проявляющий наиболее высокую скорость пролиферации, с использованием способа, описанного в разделе 1.1.1. В определенных вариантах осуществления использовали обогащенные по CD71+ популяции клеток, как описано в разделе 1.1.3. В следующих вариантах осуществления использовали CD15+ клетки обогащенной по CD71+ популяции K562, отобранные как описано в разделе 1.1.3.1. Первичные клетки, использованные в этих экспериментах для создания тригибридов KWT перекрестного происхождения, включали хелперные T-клетки (CD4+), происходящие из селезенки, периферической крови, пуповинной крови и тимуса; цитотоксические T-клетки (CD8+), происходящие из селезенки, периферической крови, пуповинной крови и тимуса; обученные антигеном T-клетки (CD3+CD5+) и CD3+ T-клетки, происходящие из пуповинной крови; двойные отрицательные T-клетки (CD3+CD4-CD8-) и двойные положительные T-клетки (CD3+CD4+CD8+), происходящие из тимуса (см. раздел 1.3).
4.4.2. Протокол гибридизации клеток для получения тригибрида KWT перекрестного происхождения
Протокол гибридизации клеток для получения тригибрида KWT перекрестного происхождения был сходен с протоколом, использованным для получения тригибрида KMW перекрестного происхождения (см. раздел 4.1.2).
4.4.3. Подтверждение статуса тригибрида KWT перекрестного происхождения
Экспрессия маркеров CD
Тригибридная клеточная линия KWT перекрестного происхождения, установленная из одной бессмертной миелоидной клетки (K562), одной бессмертной лимфоидной клетки (WIL2NS) и одной первичной T-клетки
Устанавливали клеточную линию KWT, полученную гибридизацией клеток: одной клетки K562, одной клетки WIL2NS и одной первичной T-клетки. После того, как тригибридная клеточная линия перекрестного происхождения была стабильной в нормальных условиях культивирования в течение 6 месяцев, популяцию тригибридных клеток перекрестного происхождения анализировали в отношении экспрессии специфических для ростка маркеров CD. Для идентификации коэкспрессии CD15, происходящего из K562, CD19, происходящего из WIL2NS, и CD4, происходящего из первичной эффекторной T-хелперной клетки, использовали трехцветный анализ FACS. Протокол для окрашивания тригибридных клеток KWT перекрестного происхождения был по существу таким же, как описано для тригибридов KMW перекрестного происхождения (раздел 4.1.3). Профили FACS для тригибридых клеток KWT перекрестного происхождения, происходящих из CD4+ эффекторных T-клеток, представлены на фигуре 19. Большинство тригибридных клеток KWT перекрестного происхождения продемонстрировали смешанные фенотипические характеристики миеломоноцитарного, B- и T-лимфоидного ростков. 100% тригибридных клеток KWT перекрестного происхождения экспрессировали на поверхности CD4, маркера T-лимфоидного ростка, который происходит из первичной эффекторной T-клетки, в то время как 54% из этих клеток одновременно были положительными по маркеру B-ростка CD19, происходящему из линии бессмертных клеток WIL2NS и 24% из этих CD4+CD19+ клеток были положительными по CD15, происходящему из линии бессмертных миеломоноцитарных клеток-предшественников K562.
Тригибридная клеточная линия KWT перекрестного происхождения, установленная из одной бессмертной миелоидной клетки (K562), бессмертной лимфоидной клетки (WIL2NS) и одной двойной положительной T-клетки
Когда двойные положительные T-клетки (CD4+CD8+ клетки) использовали для получения тригибридной линии KWT перекрестного происхождения, также анализировали профиль экспрессии как CD4, так и CD8, происходящих из первичных тимоцитов. Протокол определения профиля CD был по существу таким же, как описано выше для тригибридов KWT перекрестного происхождения, происходящих из CD4+ T-клеток, за исключением того, что вместо антитела мыши против CD18-FITC человека использовали антитело мыши против CD19-FTTC человека. Типичные профили экспрессии CD на тригибридных клетках перекрестного происхождения, происходящих из двойных положительных (CD4+CD8+) T-клеток, представлены на фигуре 20. Результаты показали, что 99% тригибридных клеток KWT перекрестного происхождения были положительными по CD4+ и 69% были положительными по CD8, причем 26% CD4+ клеток были положительными по маркеру CD15 миеломоноцитарных клеток и 23% CD8+ клеток были положительными по CD15, что означает, что клетки CD4+CD8+CD15+ соответствовали приблизительно 23% всей клеточной популяции (поскольку практически 100% клеток являются CD4+, двойная положительная CD8+CD15+ популяция также является положительной по CD4). Как и в тригибриде KWT, происходящем из CD4+ эффекторных T-клеток, CD19+ клетки соответствовали 52% всей популяции клеток, причем 22% из них коэкспрессировали CD15. Таким образом, вся популяция CD15+ клеток коэкспрессировала CD4, CD8 и CD19, составляя 22-23%.
Тригибридная клеточная линия KWT перекрестного происхождения, установленная из бессмертной миелоидной клетки (K562), бессмертной лимфоидной клетки (WIL2NS) и положительной по CD5 обученной антигеном T-клетки
Когда положительные по CD5 обученные антигеном T-клетки использовали для получения тригибридной линии KWT перекрестного происхождения, анализировали экспрессию CD5. Гибридные клетки KWT метили антителом мыши против CD19-FITC человека и антителом мыши против CD5-PE человека с использованием того же протокола, который использовали для анализа тригибридов WTM перекрестного происхождения, за исключением обмена флуоресцентными конъюгатами между антителом мыши против CD19 человека и антителом мыши против CD5 человека (раздел 4.6). Результаты, представленные на фигуре 21, показали, что 90% тригибридных клеток KWT перекрестного происхождения были положительными по CD5, происходящему из обученной антигеном T-клетки и 49% CD5-клеток также были положительными по CD19, происходящему из клеток WIL2NS (B-клетки). Общий процент CD19+-клеток среди тригибридных клеток перекрестного происхождения составлял приблизительно 56%.
4.5. Получение тригибрида перекрестного происхождения из двух бессмертных лимфоидных клеток (WIL2NS) и одного первичного моноцита - WWM
Этот тип тригибрида перекрестного происхождения получали гибридизацией соматических клеток: двух бессмертных лимфоидных клеток (WIL2NS) и одного первичного моноцита человека. Тригибрид перекрестного происхождения обозначили как WWM с последующим серийным номером.
4.5.1. Получение клеток для получения тригибрида WWM перекрестного происхождения
Клеточную линию WIL2NS культивировали тем же способом, как описано в разделе 4.1.1.
В определенных вариантах осуществления использовали обогащенные по CD71+ клеточные популяции, как описано в разделе 1.1.3. Моноциты человека выделяли из смешанных лимфоцитов, происходящих из селезенки, периферической крови или пуповинной крови. Выделение моноцитов было основано на экспрессии маркера CD14 и в некоторых случаях на низких уровнях экспрессии CD16, либо в FACS, либо на магнитных гранулах, как описано выше в разделе 1.3.3.1.1. Оказалось, что отсутствовали различия в параметрах гибридизации или полученных тригибридах перекрестного происхождения, когда использовали моноциты из различных лимфоидных тканей.
4.5.2. Протокол гибридизации клеток для получения тригибрида WWM перекрестного происхождения
Протокол гибридизации клеток для получения тригибрида WWM перекрестного происхождения был сходен с протоколом, использованным для получения тригибрида KBT перекрестного происхождения (см. раздел 4.2.2).
4.5.3. Подтверждение статуса тригибрида WWM перекрестного происхождения
Экспрессия маркеров CD
После того, как тригибридная клеточная линия WWT перекрестного происхождения была стабильной в нормальных условиях культивирования (см. раздел 1.1) в течение 6 месяцев, популяцию тригибридных клеток перекрестного происхождения анализировали в отношении экспрессии специфичных для ростка маркеров CD.
Для определения профиля экспрессии маркеров перекрестного происхождения для полученного тригибрида перекрестного происхождения использовали двойное окрашивание или мечение антителом мыши против CD19-FITC человека и антителом мыши против CD14-PE человека. На фигуре 22a представлен типичный профиль CD таких тригибридных клеток перекрестного происхождения. Экспрессия сцепленного с онкогеном маркера CD19 оказалось постоянной в тригибридных клетках перекрестного происхождения. В то время как некоторая доля клеток (23,5%) экспрессировала CD14 на их поверхности, остальные 72,7% были отрицательными по экспрессии CD14.
4.6. Получение тригибрида перекрестного происхождения с использованием, не являющихся человеческими клеток млекопитающих
Следующий пример указывает на то, что тригибриды перекрестного происхождения можно создавать с использованием клеток млекопитающих, отличных от клеток человека, в частности клеток мыши. Понятно, что тот же принцип можно применять для получения тригибридов перекрестного происхождения из других клеток млекопитающих.
4.6.1. Получение тригибрида перекрестного происхождения из одной бессмертной лимфоидной клетки мыши, одной первичной лимфоидной клетки мыши и одного первичного моноцита мыши
В этом разделе описано получение тригибридной клеточной линии перекрестного происхождения из одной бессмертной B-лимфоидной клетки мыши (Sp2), одной первичной T-клетки мыши и одного первичного моноцита мыши. Тригибридная линия перекрестного происхождения была обозначена как STmMm с последующим серийным номером.
4.6.1.1. Получение клеток для получения тригибрида STmMm перекрестного происхождения
Получение клеток Sp2, использованных для создания тригибридов STmMm перекрестного происхождения описано выше в разделе 1.1.4. В этих экспериментах использовали первичные клетки мыши, включающие моноциты CD11b+CD90-B220-CD49b-NK1.1-Ly6G-/low, происходящие из периферической крови; хелперные T-клетки мыши (CD4+), происходящие из селезенки или периферической крови; цитотоксические T-клетки мыши (CD8+), происходящие из селезенки или периферической крови; и двойные положительные T-клетки (CD4+CD8+), происходящие из селезенки или периферической крови. Выделение различных первичных лимфоидных клеток мыши из селезенки и периферической крови описано выше (раздел 1.3.5).
4.6.1.2. Протокол гибридизации клеток для получения тригибрида STmMm перекрестного происхождения
Протокол гибридизаии клеток для получения тригибрида STmMm перекрестного происхождения был сходен с протоколом, использованным для получения тригибрида WTM перекрестного происхождения (см. раздел 4.3.2), за исключением того, что среда и электрические поля AC отличались. Таким образом, среда для гибридизации, использованная в этих экспериментах, состояла из 265 мМ сорбита, 1,5 мМ KH2PO4, 0,4 мМ CaCl2 и 0,3 мМ Mg(C2H3O2)2 (Sigma), дополненных 0,2% BSA. Поле AC с параметрами 0,5 МГц и 65-75 кВ/м применяли одновременно с последовательностью из трех прямоугольных импульсов с интервалом 3 секунды, каждый из них с длительностью импульса 70 мкс и силой 250-280 кВ/м. Протоколы для выделения и установления стабильной линии этой вновь образованной тригибридной клетки перекрестного происхождения описаны в разделе 4.1.2.
4.6.1.3. Подтверждение статуса тригибрида STmMm перекрестного происхождения
Устанавливали клеточную линию STmMm, полученную гибридизацией клеток: одной клетки Sp2, одной первичной T-клетки мыши и одного моноцита мыши. После культивирования тригибридной клетки перекрестного происхождения в нормальных условиях (см. раздел 1.1) в течение 6 месяцев, популяцию тригибридных клеток перекрестного происхождения анализировали в отношении экспрессии специфичных для ростка маркеров CD. Для подтверждения коэкспрессии CD138, происходящего из клеток Sp2, CD11b, происходящего из первичных моноцитов мыши, и CD4, происходящего из первичных T-клеток мыши, когда эти первичные T-клетки использовали для гибридизации, использовали трехцветный анализ FACS.
В кратком изложении, 100 мкл тригибридных клеток STmMm перекрестного происхождения в концентрации 1×106 клеток/мл в PBS, содержащем 5% BSA, суспендировали в 100 мкл PBS и инкубировали в течение 30 мин при 4°С с мечеными моноклональными антителами крысы против CD138 мыши-PE, CD11b-FITC и CD4-PerCP (BD Pharmingen) или соответствующим изотипическим контролем. После тщательного промывания PBS, меченые клетки анализировали с использованием проточного цитометра FACSCalibur и программного обеспечения CellQuest Pro.
Профили FACS для тригибридных клеток STmMm перекрестного происхождения представлены на фигуре 47. В то время как уровни экспрессии маркера CD138, который происходит из бессмертной клетки B-ростка, оказались единообразными среди популяции тригибридных клеток перекрестного происхождения, экспрессия маркеров, происходящих из первичных клеток, оказалась отличающейся. В этом конкретном примере существовал относительно небольшой процент клеток, которые не коэкспрессировали ни CD4, ни CD11b, с CD138 (см. фигуру 47a и b). Когда клетки STmMm анализировали в отношении коэкспрессии CD4 и CD11b (см. фигуру 47c), приблизительно 82% имели эту коэкспрессию. Фактически, 82% популяции клеток экспрессировали все три маркера CD, причем только 5% клеток были положительными по CD138 без коэкспрессии либо CD4, либо CD11b. Затем каждую из этих различных популяций можно было выделять стандартными способами, такими как FACS, MACS или клонирование единичных клеток и т.д. и размножать в отдельные культуры тригибридов перекрестного происхождения, обладающие фенотипическими характеристиками, отличающимися друг от друга при сохранении гомогенности внутри культуры.
Когда цитотоксические положительные по CD8 лимфоциты использовали при создании тригибридов STmMm, для анализа коэкспрессии CD на полученных тригибридных клетках вместо антител против CD8-PerCp использовали антитела крысы против CD4 мыши-PerCp. Как видно из фигуры 48, от 97 до 100% тригибридных клеток были положительными по CD138 (фигура 48a и b), в то время как 56% или 57% из этих клеток коэкспрессировали CD8 (фигура 48b) или CD11b (фигура 48a). По меньшей мере 40% популяции тригибридных клеток экспрессировали все три маркера CD138, CD8 и CD11b (фигура 48c).
В случае двойных положительных CD4+CD8+ T-клеток, первый анализ проводили аналогично тому, как для цитотоксических T-клеток. На фигуре 49 представлен профиль FACS для экспрессии CD138, CD11b и CD8 на полученном тригибриде. 98-100% тригибридных клеток были положительными по CD138, причем 57-60% популяции были положительными по маркерам всех трех ростков (фигура 49c). Коэкспрессия CD138 и CD8 была выявлена на 93% клеток (фигура 49b). На второй стадии тригибридные клетки проверяли в отношении коэкспрессии CD8 и CD4. Клетки метили антителом крысы против CD8-PE мыши и антителом крысы против CD4-FITC мыши (BD Pharmingen). На фигуре 50 представлен профиль FACS для экспрессии CD8 и CD4. В то время как 95% тригибридных клеток экспрессировали CD8 на поверхности, только 50% клеток в то же время коэкспрессировали CD4. Примечательно, что практически вся положительная по CD4 популяция также была положительной по CD8.
4.6.2. Получение тригибрида перекрестного происхождения из двух бессмертных лимфоидных клеток мыши, и одного первичного моноцита мыши
В этом примере подробно описано создание тригибридной клеточной линии перекрестного происхождения из двух бессмертных B-лимфоидных клеток мыши (Sp2) и одного первичного моноцита мыши. Тригибридная линия перекрестного происхождения была обозначена как SSMm с последующим серийным номером.
4.6.2.1. Получение клеток для получения тригибрида SSMm перекрестного происхождения
Получение клеток Sp2, использованных для создания тригибридов SSMm перекрестного происхождения, описано выше в разделе 1.1.4. В этих экспериментах использовали первичные моноциты мыши CD11b+CD90-B220-CD49b-NK1.1-Ly6G-/low, происходящие из периферической крови. Выделение первичных моноцитов мыши из периферической крови описано выше (раздел 1.3.5).
4.6.2.2. Протокол гибридизации клеток для получения тригибрида SSMm перекрестного происхождения
Протокол гибридизации клеток для получения тригибрида SSMm перекрестного происхождения был таким же, как протокол, использованный для получения тригибрида STmMm перекрестного происхождения (см. раздел 4.6.1.2).
4.6.2.3. Подтверждение статуса тригибрида SSMm перекрестного происхождения
После того, как тригибридная клеточная линия SSMm перекрестного происхождения была стабильной в нормальных условиях культивирования (см. раздел 1.1) в течение 6 месяцев, популяцию тригибридных клеток перекрестного происхождения анализировали в отношении экспрессии специфичных для ростка маркеров CD.
Для определения профиля экспрессии маркеров перекрестного происхождения полученного тригибрида перекрестного происхождения использовали двойное окрашивание или мечение антителом крысы против CD138-PE мыши и антителом крысы против CD11b-FITC мыши (BD Pharmingen). На фигуре 51 представлен типичный профиль CD таких тригибридных клеток перекрестного происхождения. Экспрессия сцепленного с онкогеном маркера CD138 оказалась постоянной в тригибридных клетках перекрестного происхождения, причем только 7% клеток были отрицательными по CD138. Большая часть клеток (70%) также экспрессировали CD11b на их поверхности, в то время как остальные 23% положительных по CD138 клеток были отрицательными по поверхностной экспрессии CD11b.
4.7. Получение химерного тригибрида перекрестного происхождения с использованием клеток человека и не являющихся человекими клеток млекопитающего
В этом примере подробно описано получение химерных тригибридов перекрестного происхождения с использованием клеток человека и не являющихся человекими клеток млекопитающего, особенно мыши. Понятно, что тот же принцип можно применять для получения тригибридов перекрестного происхождения из других клеток млекопитающих.
4.7.1. Получение химерного тригибрида перекрестного происхождения из одной бессмертной лимфоидной клетки, одной лимфоидной клетки человека и одного первичного моноцита либо мыши, либо человека
Получение химерной тригибридной клеточной линии перекрестного происхождения из одной бессмертной B-лимфоидной клетки мыши (Sp2), одной бессмертной B-лимфоидной клетки человека (WIL2NS) и одного первичного моноцита либо мыши, либо человека. Тригибридная линия перекрестного происхождения также была обозначена как SWMm, где использовали моноцит мыши, и SWMh, где использовали моноцит человека. В каждом случае, за сокращенным названием тригибрида следовал серийный номер.
4.7.1.1. Получение клеток для получения химерного тригибрида SWMm и SWMh перекрестного происхождения
Получение клеток Sp2 и WIL2NS, использованных при создании химерных тригибридов SWMm и SWMh перекрестного происхождения, описано выше в разделе 1.1.4 и разделе 1.1.3, соответственно. В этих экспериментах использовали первичные моноциты мыши CD11b+CD90-B220-CD49b-NK1.1-Ly6G-/low, происходящие из периферической крови. Выделение первичных моноцитов мыши из периферической крови описано выше (раздел 1.3.5). Моноциты человека выделяли из смешанных лимфоцитов, происходящих из селезенки, периферической крови или пуповинной крови. Выделение моноцитов было основано на экспрессии маркера CD14 и в некоторых случаях на низких уровнях экспрессии CD16, либо в FACS, либо с помощью магнитных гранул, как описано выше в разделе 1.3.3.1.1. Оказалось, что отсутствовали отличия в параметрах гибридизации или полученных тригибридах перекрестного происхождения, когда использовали моноциты из различных лимфоидных тканей.
4.7.1.2. Протокол гибридизации клеток для получения химерных тригибридов SWMm и SWMh перекрестного происхождения
Протокол гибридизации клеток для получения тригибридов SWMm и SWMh перекрестного происхождения был таким же, как и протокол, использованный для получения тригибрида STmMm перекрестного происхождения (см. раздел 4.6.1.2).
4.7.1.3. Подтверждение статуса химерного тригибрида SWMm и SWMh перекрестного происхождения
После того, как химерные тригибридные клеточные линии SWMm и SWMh перекрестного происхождения были стабильными в нормальных условиях культивирования (см. раздел 1.1) в течение 6 месяцев, популяции химерных тригибридных клеток перекрестного происхождения анализировали в отношении экспрессии специфичных для ростка маркеров CD.
Для установления химерности полученных тригибридов использовали двойное окрашивание в отношении экспрессии CD71 человека и TfR мыши. На фигуре 52 представлены типичные профили FACS такого анализа, причем 100% клеток были положительными по рецепторам трансферрина как человека, так и мыши. Это указывает на надежность тригибрида в отношении контроля деления клеток как мыши, так и человека.
В зависимости от мыши или человека в качестве источника первичных моноцитов, для определения профиля экспрессии маркеров перекрестного происхождения полученных химерных тригибридов перекрестного происхождения применяли двойное окрашивание или мечение антителом крысы против CD138-PE мыши и антителом крысы против CD11b-FITC мыши (BD Pharmingen) или антителом крысы против CD138-PE мыши и антителом крысы против CD14-FITC человека (BD Pharmingen). На фигуре 53 представлены типичные профили CD таких химерных тригибридных клеток перекрестного происхождения. Экспрессия сцепленного с онкогеном маркера CD138, происходящего из клеточной линии мыши Sp2, оказалась зависимой от мыши или человека в качестве источника моноцитов. Процент положительных по CD138 клеток мыши снижался от 84% в тригибридах SWMm до 29% в тригибридах SWMh. Однако 96% химерных тригибридных клеток SWMh были положительными в отношении CD19 человека, происходящего из WIL2NS (см. фигуру 54), в то время как ни одна из клеток в химерном тригибриде SWMm не экспрессировала CD19 человека.
Пример 5
5. Обогащение тригибридов перекрестного происхождения клетками с определенными фенотипами перекрестного происхождения, исходя из распределения маркеров CD
В следующем разделе предоставлен пример установления сублиний тригибридных клеточных линий перекрестного происхождения на основе различных фенотипических характеристик. Этот подход был основан на анализе специфичных для ростка маркеров клеточной поверхности, внутриклеточной экспрессии специфичных для ростка маркеров, присутствии РНК-транскриптов специфичных для ростка маркеров, кариотипировании и/или секреции специфичных для ростка белков. Тригибридные клетки перекрестного происхождения с желаемыми характеристиками выделяли из общей популяции с помощью FACS. Описанный ниже пример основан на тригибриде WWM перекрестного происхождения, который имел две популяции тригибридных клеток на основе экспрессии CD14: положительную и отрицательную. Однако этот пример никоим образом не ограничивается конкретным выбранным тригибридом перекрестного происхождения или маркером.
Тригибридные клетки WWM перекрестного происхождения отсортировывали на положительные по CD14, и отрицательные по CD14 фракции и каждую из фракций размножали, и поддерживали в культуре по отдельности в течение 3 месяцев. На фигуре 22b представлено, что более 95% тригибридных клеток перекрестного происхождения сохраняли экспрессию CD14, в то время как популяция клеток на фигуре 22c продолжала быть отрицательной по CD14. Это демонстрирует, что является возможным выделение и установление различных гомогенных популяций клеток, происходящих из одной тригибридной линии перекрестного происхождения.
Подтверждение тригибрида перекрестного происхождения посредством ОТ-ПЦР
Для подтверждения признаков тригибрида перекрестного происхождения у полученных сублиний, исходные тригибридные клетки перекрестного происхождения, обогащенную по CD19+CD14+ субкультуру и отрицательную по CD14 субкультуру подвергали анализам способом ОТ-ПЦР в отношении CD14. В качестве положительного контроля использовали CD14+ моноциты человека. Контрольные клетки выделяли из периферической крови с использованием FACS, как описано ранее (раздел 1.3.3).
В кратком изложении из культивируемых клеток получали тотальную РНК с использованием набора RNeasy kit (набор RNeasy Mini kit, Qiagen). Синтез кДНК проводили с помощью cDNA-Kit (Amersham Pharmacia) согласно протоколу изготовителя, и ПЦР проводили, по существу как описано Sewing et al. Реакционную смесь для ПЦР анализировали агарозным гель-электрофорезом (2%) и визуализировали окрашиванием бромидом этидия. Олигонуклеотидные пары праймеров имели последовательности 5'-праймера 5'-CACACTCGCCTGCCTTTTCC-3' (SEQ ID NO: 1) и 3'-праймера 5'-GATTCCCGTCCAGTGTCAGG-3' (SEQ ID NO: 2) для амплификации продукта ПЦР размером 450 т.п.н.
Как показано на фигуре 23, ОТ-ПЦР показала присутствие транскриптов мРНК CD14 как в культуре, содержащей исходное клетки WWM, так и в субкультуре с обогащенными по CD14+ клетками исходной культуры WWM. мРНК CD14 также была выявлена в субкультуре WWM, лишенной поверхностного CD14, на уровне, сравнимом с уровнем у CD14+ моноцитов человека.
Пример 6
6. Кариотипирование
Кариотипирование тригибридов перекрестного происхождения проводили для установления цитогенетических характеристик тригибридов перекрестного происхождения, а также для подтверждения их гибридного происхождения.
6.1. Кариотипирование исходных клеточных линий
В качестве примера клетки клеточных линий K562 и WIL2NS кариотипировали на ранних и поздних пассажах для регистрации какой-либо хромосомной нестабильности исходных клеточных линий. Было открыто, что для данной клеточной линии, например линии K562, кариотип свежеразмороженной линии был идентичен кариотипу клеточной линии, которую поддерживали в нормальных условиях культивирования в течение нескольких месяцев.
На фигурах 24 и 25 представлен типичный кариотип клеток K562 и WIL2NS, соответственно. В обоих случаях исследовали всего 20 метафазных клеток с G-полосами при 400 bphs.
Результаты кариотипирования показали, что клеточная линия K562 содержала единичный клон с триплоидными характеристиками, т.е. имеющий модальное число хромосом 69 с различными хромосомными нарушениями. Напротив, клеточная линия WIL2NS содержала пять диплоидных клонов с числом хромосом от 47 до 48 с отчетливо отличающимися нарушениями хромосом по сравнению с клетками K562. Представление клонов в клеточной линии WIL2NS является следующим:
Клон 1 составляет 10%
Клон 2 составляет 55%
Клон 3 составляет 10%
Клон 4 составляет 20%
Клон 5 составляет 5%
В таблице 2 (ниже) обобщенно представлены комплексные кариотипы клеточных линий K562 и WIL2NS. Между двумя клеточными линиями не было общих нарушений. Хромосомные нарушения, присутствующие во всех клонах клеточных линий WIL2NS, выделены синим цветом.

6.2. Кариотипирование тригибридов перекрестного происхождения, использованных для экспрессии белков
Проводили кариотипирование тригибридов перекрестного происхождения, происходящих из различных комбинаций бессмертных и первичных клеток из трех различных ростков и далее использованных для экспрессии желаемых белков. Эти кариотипы также сравнивали с кариотипами исходных бессмертных клеточных линий, которые использовали для получения тригибридов перекрестного происхождения.
6.2.1. Кариотипирование тригибридных линий KBT перекрестного происхождения
Проводили кариотипирование двух тригибридных линий KBT перекрестного происхождения, происходящих из бессмертной миелоидной клеточной линии K562 и первичных B- и T-лимфоцитов. Также для сравнения проводили кариотипирование тригибрида KBT перекрестного происхождения, происходящего из активированных B-клеток (CD20+CD72+), и двойных положительных T-клеток (CD4+CD8+) с различными типами клеток на основе их характеристик экспрессии CD (раздел 4.2.3). На фигурах 26 представлен типичный кариотип тригибридных линий KBT перекрестного происхождения, полученных гибридизацией K562 + B(CD19+) + T(CD4+), обозначенных как линия KBT-1. Он показал, что отдельный клеточный клон KBT-1 был практически триплоидным, имеющим модальное число хромосом 66.
Когда проводили кариотипирование тригибридной линии KBT перекрестного происхождения, полученной гибридизацией клетки K562, B-клетки (CD20+CD72+) и T-клетки (CD4+CD8+), обозначенной как линия KBT-2, было выявлено, что линия KBT-2 (линия, которая показала варьирование экспрессии CD в предыдущем разделе) состояла из четырех клонов, которые были практически триплоидными. Клон 1, клон 2, клон 3 и клон 4 соответствовали 45%, 30%, 15% и 10% клеточной популяции, соответственно. Клон 4 имел модальное число хромосом 66, в то время как все другие клоны имели модальное число хромосом 67. На фигуре 27 представлено кариотипирование одного из клонов линии KBT-2.
Кариотипирование линий KBT-1 и KBT-2 обобщенно представлено в таблице 3. В первом столбце таблице указан номер хромосомы. Некоторые из хромосомных изменений, такие как del(3)(p14), der(4)t(4;?)(q25;?), +der(7)t(7;mar3)(q10;q10) и der(X)t(X;?;?)(q13;?;?) являются общими для всех тригибридов перекрестного происхождения, независимо от подтипа первичных лимфоидных клеток, но не являются общими с клетками K562.
Таблица 3. Обобщение сравнительного анализа KBT-1 и KBT-2, происходящих из различных подтипов первичных лимфоидных клеток и миелоидной клеточной линии K562 в качестве источника онкогена. Хромосомные нарушения линии K562, которые были общими с тригибридными линиями перекрестного происхождения KBT-1 и KBT-2, выделены синим цветом. Хромосомные нарушения, являющиеся общими среди клонов тригибридных линий KBT перекрестного происхождения, но не для исходной клеточной линии K562, выделены красным цветом. Хромосомные нарушения, присутствующие в некоторых из тригибридов KBT перекрестного происхождения и происходящие из линии K562, выделены зеленым цветом.
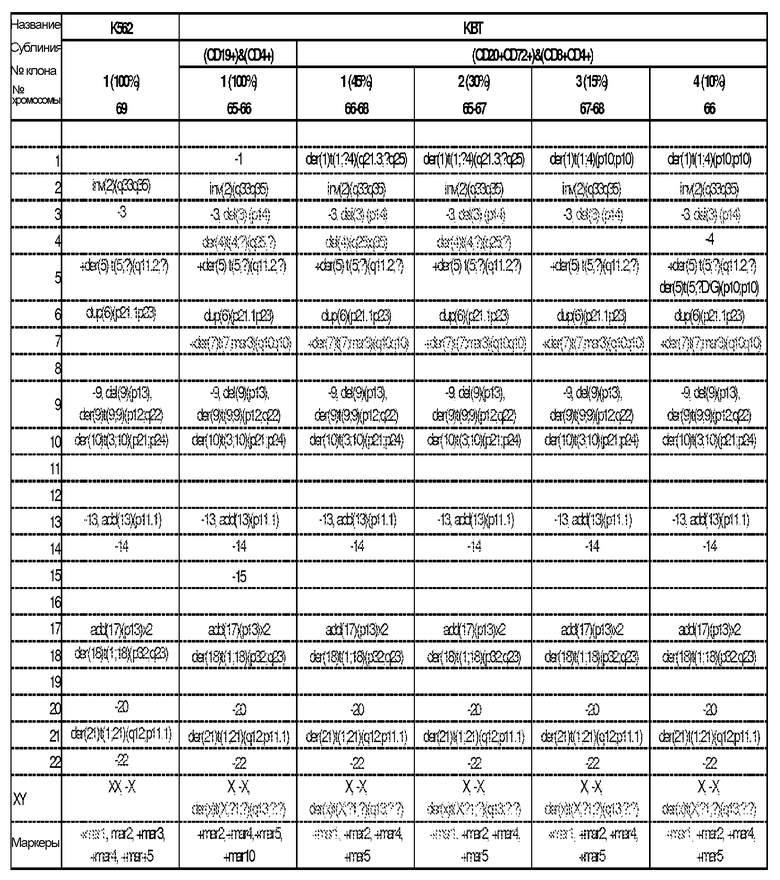
6.2.2. Кариотипирование тригибридных линий KWT перекрестного происхождения
Проводили кариотипирование трех тригибридных линий KWT перекрестного происхождения, происходящих из бессмертной клеточной линии K562, бессмертной линии B-лимфоидных клеток WIL2NS и первичного T-лимфоцита. Также для сравнения проводили кариотипирование тригибрида KWT перекрестного происхождения, происходящего из двойных положительных T-клеток (CD4+CD8+) (обозначенный как KWT-3) с различными типами клеток, исходя из их характеристик экспрессии CD (раздел 4.4.3).
На фигурах 28, 29 и 30 представлены типичные кариотипы тригибридных линий перекрестного происхождения KWT-1, KWT-2 и KWT-3, соответственно. В каждом случае анализировали всего 20 метафазных клеток с G-полосами при 400 bphs. KWT-1 содержала один клон, который был практически гексаплоидным (6n = 138 хромосом). Модальное число хромосом находилось в диапазоне от 129 до 140 хромосом с кариотипической гетерогенностью, т.е. все анализированные клетки обладали некоторыми общими хромосомными нарушениями. KWT-2 содержала один клон, который также был практически гексаплоидным. Модальное число хромосом находилось в диапазоне от 135 до 145 хромосом с кариотипической гетерогенностью. KWT-3 содержала три клона, которые были гиперпентаплоидными (n>115). Клон 1, клоны 2 и 3 соответствуют 55%, 20% и 25% популяции клеток, соответственно. Кариотипы тригибридов KWT перекрестного происхождения подтверждали, что генетические признаки как клеточной линии K562, так и клеточной линии WIL2NS, сохраняются во всех тригибридах KWT перекрестного происхождения, независимо от типа первичной T-клетки, использованной при их создании. В таблице 4 обобщенно представлен сравнительный анализ кариотипов этих тригибридов KWT перекрестного происхождения (т.е. линий KWT-1, KWT-2 и KWT-3).
Таблица 4. Сравнительный анализ тригибридов KWT перекрестного происхождения, происходящих из различных типов первичных T-клеток. Хромосомные изменения в тригибридах KWT перекрестного происхождения, являющиеся общими с клеточной линией K562, выделены красным цветом. Хромосомные изменения, являющиеся общими между тригибридами KWT перекрестного происхождения и клеточной линией WIL2NS, выделены синим цветом. Изменения, которые являются общими между различными субтипами тригибридов перекрестного происхождения, но не являются общими с клеточной линией K562 или клеточной линией WIL2NS, выделены зеленым цветом.

6.2.3. Кариотипирование тригибридных линий WWM перекрестного происхождения
Проводили кариотипирование тригибридной линии WWM перекрестного происхождения, происходящей из двух бессмертных B-лимфоидных клеток (2 линии WIL2NS) и первичного моноцита (CD14+). Также проводили кариотипирование сублинии этого тригибрида перекрестного происхождения, обогащенной CD14+ клетками. На фигурах 31A и 31B представлены кариотипы исходного тригибрида WWM перекрестного происхождения и его обогащенной по CD14+ сублинии, соответственно. В каждом случае анализировали метафазные хромосомы с G-полосами всего 20 клеток при 400 bphs. Исходный тригибрид WWM перекрестного происхождения содержал единичный доминантный клон, который имел модальное число хромосом 47, выявленное в 11 клетках (55%). Однако остальные 9 проанализированных клеток находились в диапазоне от практически триплоидных (со случайной потерей хромосом) до практически тетраплоидных (со случайной потерей хромосом). Не было единообразия между любой из этих клеток. С другой стороны, кариотип обогащенного по CD14+ тригибрида WWM перекрестного происхождения показал нарушение единичного клона, выявленное в 19 клетках. Была выявлена только одна тетраплоидная клетка.
В таблице 5 обобщенно представлен сравнительный анализ кариотипов тригибридных линий WWM перекрестного происхождения. Хромосомные характеристики, являющиеся общими с клетками WIL2NS, выделены синим цветом.
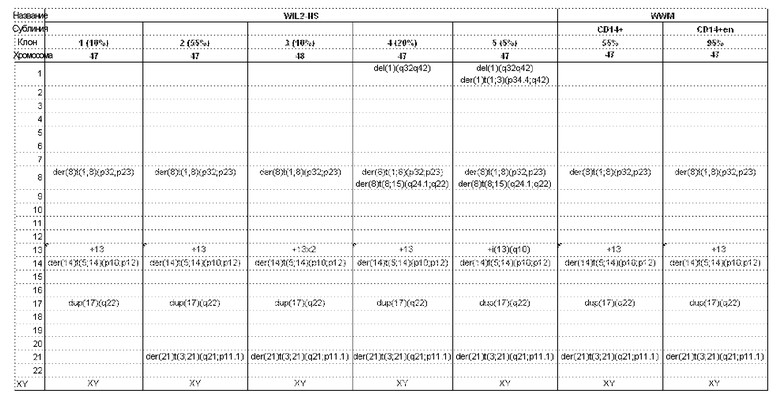
Пример 7
7. Детекция генома EBV способом ПЦР
Для анализов ПЦР для данной тригибридной клеточной линии перекрестного происхождения, геномную ДНК экстрагировали из 5×106 клеток тригибрида перекрестного происхождения. Клетки MOLT-4 использовали в качестве отрицательного контроля, в то время как CO 88BV59-1 использовали в качестве положительного контроля с использованием набора QIAamp DNA Micro kit (Qiagen), согласно инструкциям изготовителя. В количественном анализе ПЦР, область BamHI W генома EBV амплифицировали с помощью специфических праймеров. Последовательности вышележащих и нижележащих праймеров представляли собой 5'-CAAGAACCCAGACGAGTCCGTAGAA-3' (SEQ ID NO: 3) и 5'-AAGAAGCATGTATACTAAGCCTCCC-3', (SEQ ID NO: 4) соответственно (Kimura, et al., 1999). 10 нг экстрагированной ДНК добавляли к реакционной смеси, содержавшей 10 мМ Tris-HCl (pH 8,3), 1,5 мМ MgCl2, 50 мМ KCl, 200 мкМ dNTP, 0,6 мкМ каждого праймера и 0,5 Е Taq-полимеразы (Lomb Life Science). После первоначальной денатурации в течение 2 мин при 95°C выполняли 28 циклов из 15 с при 95°C и 1 мин при 60°С с использованием системы Gene Amp PCR system 9600 (Perkin Elmer). Амплифицированные образцы разделяли на 2% агарозном геле.
Результаты описанных выше анализов показали, что все из установленных тригибридов перекрестного происхождения по этому изобретению являются отрицательными по геному EBV.
Пример 8
8. Тест с Mycoplasma
Тесты с Mycoplasma для любой использованной клеточной линии и тригибридных линий перекрестного происхождения, созданных по этому изобретению, проводили с использованием набора для ПЦР-детекции mycoplasma (Lomb Scientific) согласно инструкциям изготовителя. Результаты теста показали, что все клеточные линии и тригибриды перекрестного происхождения не имели mycoplasma.
Пример 9
9. Экспрессия белков в экспрессирующей системе на основе тригибрида перекрестного происхождения и их охарактеризация
Тригибридную клеточную систему перекрестного происхождения согласно настоящему изобретению можно использовать для получения ряда биологических веществ, включая, но не ограничиваясь ими, биологические молекулы, такие как белки, пептиды, углеводы, липиды, и их химерные молекулы. В частности, биологические молекулы могут включать цитокины, факторы роста, гормоны, рецепторы или химерные молекулы или их фрагменты. Квалифицированному специалисту будет понятно, что желаемая биологическая молекула, такая как белок, экспрессируемый из тригибридной клетки перекрестного происхождения, может быть секретируемой, мембраносвязанной или и секретируемой, и мембраносвязанной. Квалифицированному специалисту, кроме того, будет понятно, что в тригибридной клетке перекрестного происхождения могут коэкспрессироваться различные белковые субъединицы, например, при экспрессии иммуноглобулинов и, более конкретно, продукции моноклонального антитела. Кроме того, квалифицированному специалисту будет понятно, что тригибридную клетку перекрестного происхождения также можно использовать для экспрессии ряда функциональных белковых или пептидных фрагментов, например, в случае иммуноглобулинов, таких фрагментов, как Fab-, Fab'-, F(ab')2- и Fv-фрагменты, включая одноцепочечные Fv-фрагменты.
Экспрессию желаемого белка можно проводить в тригибридной клеточной системе путем гибридизации соматических клеток между тригибридной клеткой и клеткой-партнером, которая экспрессирует желаемый белок (раздел 9.1). Альтернативно тригибридные клетки можно подвергать общепринятым протоколам трансфекции генов для облегчения экспрессии желаемого белка (раздел 9.2.1 и 9.2.2). В следующем варианте осуществления в тригибридных клетках можно экспрессировать множество белков-мишеней одновременно с использованием либо гибридизации соматических клеток, либо общепринятой трансферкции генов, либо обоих этих способов (раздел 9.3).
Следующие примеры иллюстрируют экспрессию ряда различных типов белков в тригибридных клетках перекрестного происхождения. Эти примеры также демонстрируют, что белки, специфичные к конкретному дифференцированному типу клетки, можно экспрессировать в одних и тех же тригибридных клетках перекрестного происхождения (например, иммуноглобулин и CD54).
9.1. Гибридизация тригибридной клетки перекрестного происхождения, экспрессирующей желаемый белок.
9.1.1. Экспрессия GM-CSF человека
Тригибридную линию WWM перекрестного происхождения, обогащенную положительными по CD14 клетками (описанную в разделе 5), использовали в этом конкретном примере в качестве клеточной линии-партнера. Активированные положительные по CD4 лимфоциты человека, выделенные, как описано в разделе 1.3.3.1.1, использовали в качестве источника GM-CSF человека. Способ электрической гибридизации клеток был по существу таким же, как способ, использованный для создания тригибридов WWM перекрестного происхождения, как описано в разделе 4.3.2. После того, как полученный гибрид WWM и CD4+ культивированных T-клеток стал стабильным, его поддерживали в качестве линии, и обозначили как ProGM.
Результаты экспрессии GM-CSF человека
Супернатанты ProGM тестировали в отношении GM-CSF человека с помощью сэндвич-ELISA. 96-луночный планшет для ELISA (Corning) покрывали 50 мкл очищенного поликлонального антитела кролика против GM-CSF в концентрации 10 мкг/мл при 4°C в течение ночи. После удаления раствора антитела оставшиеся участки связывания белка на планшетах блокировали 100 мкл PBS, содержавшего 5% BSA (5% BSA-PBS). Затем в лунки добавляли 50 мкл культурального супернатанта из гибридной клеточной линии ProGM, и инкубировали в течение 2 часов при 37°C. После промывания PBS, содержавшим 0,05% Tween 20 (Tween-PBS) три раза, их инкубировали с 50 мкл антитела кролика против GM-CSF в концентрации 10 мкг/мл при комнатной температуре в течение 1 часа. После промывания 3 раза Tween-PBS, их инкубировали с разбавленным в 200 раз конъюгированным с пероксидазой иммуноглобулином против антител кролика в течение 2 часов при комнатной температуре. После промывания три раза Tween-PBS, конечную реакционную смесь визуализировали путем инкубации с ABTS и 0,01% пероксидом водорода. Измеряли поглощение при 415 нм. В качестве стандарта использовали рекомбинантный GM-CSF человека. Все анализы проводили в двух экземплярах для данного образца. Результаты показали, что ProGM продуцировали GM-CSF человека в диапазоне от 0,7 до 1,1 мкг/мл/106 клеток в неоптимизированных условиях культивирования.
Охарактеризация hGM-CSF, происходящего из гибрида ProGM, вестерн-блоттингом и иммунопреципитацией подтвердила, что гибрид ProGM продуцировал полностью человеческий GM-CSF, имеющий форму гликопротеина, идентичную гликоформам, естественным образом секретируемым лимфоцитами человека. Перед анализом супернатанты, собранные из гибрида ProGM, разбавляли в 100 раз. Для вестерн-блот-анализа (Millipore) использовали мембраны Immunoblot NC и биотинилированное антитело против GM-CSF человека (R&D systems) в концентрации 0,1 мкг/мл. На фигуре 32, вестерн-блоттинг hGM-CSF, секретируемого гибридом ProGM (дорожка 4), продемонстрировал ту же гетерогенность его форм, что и GM-CSF, секретируемый активированной PHA культурой лимфоцитов человека (дорожка 2). Распределение молекулярной массы GM-CSF, экспрессированного в культурах как ProGM, так и лимфоцитов, находилось в диапазоне между 18 кДа и 35 кДа. В присутствии туникамицина, который ингибирует добавление углеводных цепей к остаткам аспарагина, не выявлялись более высокомолекулярные молекулы (т.е. 35 кДа), что указывает на то, что наблюдаемая гетерогенность является следствием различной степени гликозилирования (дорожка 5). Молекулярная масса форм GM-CSF, продуцированных либо активированными PHA лимфоцитами, либо гибридной экспрессирующей системой ProGM, была более высокой, чем у GM-CSF, происходящего из E. coli (дорожка 6).
Супернатанты гибрида ProGM, культивированного с дополнением 10 мкг/мл туникамицина или без него, собирали и инкубировали в течение ночи при 40°С c антителом крысы против GM-CSF человека или антителом кролика против GM-CSF мыши, индуцированным против происходящего из E.coli GM-CSF человека или мыши, соответственно. Добавляли белок A-Sepharose (Invitrogen) и далее инкубировали в течение 3 часов при комнатной температуре. Выделенную смолу тщательно промывали 0,15 M NaCl, 0,5% NP-40, 10 мМ Tris-HCl, pH 8,0. Связанные белки солюбилизировали буфером для образца Laemmli и подвергали SDS-PAGE. Как показано на фигуре 33, молекулярная масса GM-CSF, секретируемого гибридом ProGM, находилась в диапазоне от 18 кДа до 35 кДа, что было сходным со встречающимися в природе формами. Эта гетерогенность является следствием отличающегося гликозилирования на двух участках N-гликозилирования и нескольких участках O-гликозилирования. В присутствии туникамицина более высокомолекулярные полосы не выявлялись, в то время как накапливались белки с более низкой молекулярной массой 18-22 кДа. Эти данные подтверждают, что hGM-CSF, происходящий из гибрида ProGM, секретируется в качестве гликопротеина человека.
9.1.2. Экспрессия иммуноглобулинов человека
Тригибридную линию KWT перекрестного происхождения, происходящую из обученной антигеном T-клетки (CD3+CD5+) (обозначенная как KWT-2) с фенотипическими маркерами, определенными способом FACS (см. раздел 4.4.3 для более подробного описания) и кариотипированную, как описано в разделе 6.2.2, использовали для экспрессии иммуноглобулина человека путем электрической гибридизации клеток. В частности, в этом конкретном примере тригибрид KWT-2 перекрестного происхождения использовали в качестве клеточной линии-партнера. В качестве источника Ig человека использовали первичные CD40-активированные положительные либо по IgM, либо по IgG B-клетки, выделенные, как описано в разделе 1.3.3. Процедура электрической гибридизации клеток была по существу такой же, как процедура, использованная для создания тригибридных линий KWT перекрестного происхождения, как описано в разделе 4.4.2. После того, как полученные гибриды стали стабильными, их поддерживали, и обозначали как клеточные линии ProIM или ProIG (см. раздел 1.1).
Результаты экспрессии иммуноглобулинов человека
Супернатанты из ProIM и ProIG анализировали в отношении присутствия IgM или IgG способом ELISA, описанным ранее (см. раздел 1.3.3). Клетки высевали в круглодонные 96-луночные планшеты в количестве 1×105 клеток на лунку, и культивировали в стандартных условиях в течение 24 часов. Подсчет клеток и определение жизнеспособности проводили с использованием гемоцитометра и исключения трипанового синего. Результаты обобщенно представлены в таблицах 6A и 6B. Каждая величина приведена в качестве среднего значения ± SD для трех независимых измерений.
Рост клеток ProIM и продукция ими IgM
(клеток/мл)
(нг/мл)
(нг/104 клеток/24 часа)
Рост клеток ProIG и продукция ими IgG
(клеток/мл)
(нг/мл)
(нг/104 клеток/24 часа)
Детекцию подклассов IgG и подтипов легких цепей проводили с использованием биотинилированного антитела мыши против IgG1 человека (клон HP6069), IgG2 (клон HP6002), IgG3 (клон HP6047), IgG4 (клон HP6025) (ICN Biomedicals) и биотинилированного антитела козы против каппа-цепи и лямбда-цепи человека (Biosource). Детекцию связанного биотинилированного антитела проводили с помощью конъюгированного с ALP стрептавидина.
Результаты показали, что как IgM, так и IgG, продуцированные клетками ProIM и ProIG, соответственно, имели легкую цепь κ, и IgG был класса IgG2.
9.1.3. Экспрессия CD54 человека
Методика для экспрессии CD54 человека
Тригибрид KWT перекрестного происхождения, происходящий из зрелой T-хелперной клетки (CD4+) (обозначена, как KWT-1) с фенотипическими маркерами при определении способом FACS (см. раздел 4.4.3 для более подробного описания) и кариотипированный, как описано в разделе 6.2.2, далее использовали для экспрессии CD54 человека способом электрической гибридизации клеток. В частности, в этом конкретном примере в качестве клеточной линии-партнера использовали тригибрид KWT перекрестного происхождения. В качестве источника молекулы CD54 человека использовали первичные положительные по CD54 человека T-клетки, выделенные, как описано в разделе 1.3.3. Способ гибридизации был по существу таким же, который использовали для создания тригибридных линий KWT перекрестного происхождения (см. раздел 4.4.2). После того, как полученный гибрид стал стабильным, его поддерживали в качестве клеточной линии в стандартных условиях культивирования (см. раздел 1.1) и обозначили как ProCD54.
Результаты экспрессии hCD54
Экспрессию CD54 на поверхности клеток ProCD54 подтверждали с использованием FACS-анализа. Поскольку 100% исходных тригибридных клеток KWT перекрестного происхождения экспрессировали CD4 на их поверхности (см. фигуру 19), экспрессию CD4 на клеточной поверхности ProCD54 использовали в качестве эталона для стабильности полученной клеточной линии. В кратком изложении 1×105 клеток на аликвоты объемом 100 мкл метили антителом мыши против CD54 человека-FITC и антителом мыши против CD4 человека-PE согласно тому же протоколу, который описан в разделе 1.3.3.1 (выделение CD54+ T-клеток). Типичный профиль экспрессии CD4 и CD54 на поверхности клеток ProCD54 представлен на фигуре 34a. Приблизительно 72% исходных клеток ProCD54 были положительными по CD54, в то время как 100% клеток сохраняли их экспрессию CD4, даже несмотря на то, что уровни экспрессии CD4 оказались, в некоторой степени, более низкими, чем у тригибридных клеток KWT перекрестного происхождения. После установки соответствующих областей, популяцию клеток CD4+CD54+ с уровнями экспрессии CD54 от средних до высоких (приблизительно 42% от всей популяции клеток) ограничивали и отсортировывали (фигура 34a). Отсортированные клетки ресуспендировали в стандартной культуральной среде и поддерживали в культуре в течение нескольких месяцев. Полученную сублинию обозначили как ProCD54EX. Затем эту сублинию анализировали в отношении экспрессии ею CD4 и CD54 с использованием того же протокола, который описан ранее в этом разделе. Типичный профиль экспрессии CD4 и CD54 на поверхности ProCD54EX представлен на фигуре 34b. Как можно видеть из фигуры, по меньшей мере 98% клеток сохраняли экспрессию как CD4, так и CD54, после культивирования в течение 6 месяцев в стандартных условиях. Более того, экспрессия CD54 становилась единообразной на средних уровнях.
ProCD54 и ProCD54EX также анализировали в отношении присутствия растворимого CD54 в супернатантах культур тканей с использованием ELISA для CD54 человека (ICAM-1) (R&D systems) согласно инструкциям изготовителя. Супернатанты собирали в культуре на 7 сутки по меньшей мере 3 раза. Супернатанты тригибридной клеточной линии KWT перекрестного происхождения-партнера использовали в качестве отрицательного контроля. Все измерения проводили для одного и того же образца в двух экземплярах. В кратком изложении, микропланшеты для титрования покрывали моноклональным антителом мыши против растворимого ICAM-1 человека. После инкубации с контролем, образцами или стандартами в соответствующем разведении, добавляли конъюгированные с пероксидазой хрена (HRP) поликлональные антитела к растворимому ICAM-1 человека. После добавления субстрата и стоп-раствора, определяли оптическую плотность каждой лунки в пределах 30 минут, с использованием устройства для считывания микропланшетов, установленного на 450 нм. Результаты обобщенно представлены в таблице 7.
Диапазон концентраций растворимого CD54 (ICAM-1) в тригибридной клеточной линии KWT перекрестного происхождения-партнере, клеточных линиях ProCD54 и ProCD54EX
Молекулярную массу растворимого CD54, слущивающегося с ProCD54 и ProCD54EX, определяли гель-электрофорезом и вестерн-блот анализом. В кратком изложении, концентрацию белка в супернатантах определяли в белковом анализе (R&D systems) и доводили до 1,8 мг/мл. Электрофорез проводили способом SDS-PAGE. Всего 30 мл образца наносили на гель в невосстанавливающем буфере для образца. После электрофореза белки переносили в поливинилидендифторидную мембрану (Bio-Rad). Подвергнутую блоттингу мембрану блокировали обезжиренным сухим молоком (5%) в буфере TBS-Tween (TBST) и встряхивали в течение 2 часов с антителом мыши против ICAM-1 человека (разведение 1:100 в TBST). После промывания образцов посредством TBST, добавляли вторичный реагент, антитело козы против IgG мыши, связанное с HRP (разведение 1:10000). После повторного промывания TBST мембрану промывали водой. Все инкубации проводили при комнатной температуре. На фигуре 35 показано, что sCD54 присутствует в супернатантах как ProCD54, так и ProCD54EX, в качестве одного типа массой приблизительно 82 кДа, что соответствует растворимому CD54, выявленному в сыворотке человека.
Экспрессию мРНК CD54 человека как в клетках ProCD54, так и в клетках ProCD54EX, подтверждали способом ОТ-ПЦР. Тотальную РНК экстрагировали с использованием коммерческого набора и детекцию способом ОТ-ПЦР экспрессии генов проводили, как описано ранее в разделе 5. Набор праймеров для ICAM-1 человека [смысловой 5'-CCGGAAGGTGTATGAACTG-3' (SEQ ID NO: 5); антисмысловой 5'-TCCATGGTGATCTCTCCTC-3' (SEQ ID NO: 6)] использовали в качестве зондов для кДНК, обратно транскрибированной с экспериментального и контрольного образцов РНК. В каждый анализ в качестве внутреннего контроля включали пару праймеров для циклофилина [смысловой 5'-TGTTCTTCGACATTGCCGTCGAC-3' (SEQ ID NO: 7); антисмысловой 5'-GCATTTGCCATGGACAAGATGCCAGGA-3' (SEQ ID NO: 8)]. Продукты реакции ПЦР подвергали электрофорезу в 3% агарозных гелях в Tris-ацетатном буфере, содержащем бромид этидия, и УФ-индуцированные флуоресцентные полосы фотографировали, и оцифровывали. На фигуре 36 показан анализ способом ОТ-ПЦР мРНК для ICAM-1 человека в ProCD54 и ProCD54EX. Тригибридные клетки KWT перекрестного происхождения, которые не экспрессируют CD54 на клеточной поверхности, также демонстрируют очень низкую транскрипцию гена ICAM-1.
9.2. Трансфекция тригибридной клеточной линии перекрстного происхождения геном, кодирующим желаемый белок
Определенные гены можно встраивать в культивируемые клетки рядом общепринятых способов, включающих опосредуемый вектором перенос генов. В одном варианте осуществления настоящего изобретения тригибридные клетки перекрестного происхождения временно трансфицировали геном, кодирующим желаемый белок. Это позволяет получение продуктов генов: либо РНК, либо белка, в пределах часов после захвата ДНК. В альтернативном варианте осуществления настоящего изобретения тригибридную клетку перекрестного происхождения стабильно трансфицировали геном, кодирующим желаемый белок. Это вовлекает встраивание ДНК плазмидного вектора в хроматин клетки-хозяина.
9.2.1. Временная трансфекция
Для экспериментов по трансфекции генов использовали тригибрид перекрестного происхождения KBT, происходящий из зрелой B-клетки (CD19+) и зрелой T-хелперной клетки (CD4+), причем 100% тригибридных клеток перекрестного происхождения имели фенотипические маркеры как B-клеток, так и T-клеток при определении FACS (см. раздел 4.2.3) и кариотипированный, как описано в разделе 6.2.1. В качестве примера временной трансфекции клеток тригибридной линии перекрестного происхождения желаемым белком, клетки тригибрида KBT перекрестного происхождения трансфицировали альфа-цепью рецептора IL-4 человека (hIL4-Rα).
Способ
Получение клеток PBML из образца костного мозга описано в разделе 1.3.1. кДНК hIL4-Rα клонировали всего из 1×106 клеток PBML, инкубированных со 100 нг/мл рекомбинантного IL-4 человека (R&D systems) в течение 24 часов в стандартных условиях культивирования. Тотальную РНК экстрагировали (RNeasy Mini Kit, Qiagen) и синтезировали кДНК с использованием набора для очистки кДНК First Strand cDNA purification kit (Amersham Pharmacia). Для амплификации кДНК hIL4-Rα использовали ПЦР. Амплификацию проводили с помощью смыслового праймера 5'-AGGGGCGCGCAGATAATTAAA-3' (SEQ ID NO: 9) и антисмыслового праймера 5'-AGTGGGGCCAATCACCTTCATA-3' (SEQ ID NO: 10). Для добавления двух участков рестрикции BamHI к фрагменту hIL4-Rα использовали гнездовую ПЦР [смысловой праймер 5'-GGATCCGCGCAGATAATTAAAGA-3' (SEQ ID NO: 11), антисмысловой праймер 5'-GGATCCAAATCACCTTCATACCAT-3' (SEQ ID NO: 12]. Амплифицированную кДНК разбавляли и подвергали первоначальной денатурации в течение 1 мин при 94°С, а затем 31 циклам из 20 секунд при 94°С, 45 секунд при 59°С, 3 минут при 72°С. Фрагмент кДНК IL4R лигировали в клонирующий вектор pGEM-T (Promega) и трансфицировали в компетентные клетки JM109 (Promega). Плазмидную ДНК получали с использованием набора Plasmid Mini Kit (Qiagen).
Для электропорации 7×106 клеток KBT, суспендированных в 350 мкл полной среды TC (см. раздел 1.1) смешивали с 30 мкг кДНК-плазмиды. Трансфекцию проводили с помощью однократного импульса (25 кВ/м, 1050 мкА, длительность импульса 34-37 мc) из Eurogentec Easyject Pulser. Затем клетки инкубировали в планшетах для культивирования тканей, с шестью ячейками в полной среде TC, дополненной 100 нг/мл рекомбинантного hIL4.
Клеточные экстракты получали способом замораживания-размораживания через 24, 48 и 72 часов после трансфекции. Нетрансфицированные клетки KBT и PBML использовали в качестве отрицательного контроля и положительного контроля, соответственно. Общее содержание белка в клеточных экстрактах определяли с использованием анализа белков Bio-Rad (Bio-Rad Laboratories). Равные количества клеточных экстрактов (приблизительно 2 мг) подвергали иммунопреципитации с 3 мкг антитела против α-цепи hIL4-R (BD Pharmingen 551894) с использованием 20 мг белка A с пониженной растворимостью на Sapharose 4B fast flow (Sigma). Иммунопреципитаты промывали два раза буфером для разведения (0,1% Triton X-100 и бычий гемоглобин в растворе TSA, один раз в растворе TSA и другой в растворе 0,05 M TRIS-Cl (pH 6,8)), солюбилизировали буфером Laemmli, кипятили, и разделяли в SDS-PAGE с 4%-12% TRIS-глицином. Раствор TSA содержал 0,01 M TRIS-Cl (pH 8,0), 0,14 M NaCl, и 0,025% азид натрия). В некоторых экспериментах 75 мкг белкового содержимого клеточных экстрактов прямо разделяли посредством SDS-PAGE без предшествующей иммунопреципитации.
Вестерн-блот-анализы проводили путем переноса белков с полиакриламидных гелей на нитроцеллюлозные мембраны Hybond-ECL (Amersham) при 25 В в течение 2 часов в буфере TRIS-глицин, содержавшем 25 мМ TRIS, 192 мМ глицина, 0,1% SDS, 100 мкМ ванадат натрия и 20% метанола. Блоты обрабатывали в течение 1 часа блокирующим буфером (2,5% обезжиренное сухое молоко, 10 мМ TRIS-Cl [pH 7,5], 100 мМ NaCl и 0,1% Tween 20), а затем инкубировали с 2 мкг/мл антитела мыши против hIL4-Rα в блокирующем буфере в течение другого часа. Детекцию связывания антитела проводили путем инкубации блотов в течение 1 часа с иммуноглобулином овцы против антител мыши, конъюгированным с пероксидазой хрена, с последующей инкубацией в течение 1 минут с йодированным субстратом, а затем с усиленной хемилюминесцентной детекцией.
Результаты
На фигуре 37 представлен вестерн-блот-анализ клеточных экстрактов из тригибридной клеточной линии KBT перекрестного происхождения, временно трансфицированной α-цепью hIL4-R через 24, 48 и 72 часов после трансфекции. Детекцию α-цепи hIL4-R проводили в клетках KBT, трансфицированных α-цепью hIL4-R через 24 часа после трансфекции и уровни экспрессии α-цепи hIL4-R постепенно возрастали через 48 и 72 часов после трансфекции. Нетрансфицированные клетки KBT служили в качестве отрицательного контроля для α-цепи hIL4-R. Клеточные экстракты из клеток PBML человека, использованные для получения кДНК hIL4-Rα, служили в качестве положительного контроля для α-цепи hIL4-R.
9.2.2. Стабильная трансфекция
В качестве примера стабильной трансфекции клеток тригибридной клеточной линии перекрестного происхождения желаемым белком, клетки клеточной линии KBT трансфицировали геном интерлейкина 2 человека (hIL-2).
Способ
Для трансфекции использовали экспрессирующий hIL-2 вектор pBC12/RSV/IL2 (IS), который содержит ген препроинсулина II крысы под контролем последовательностей длинных концевых повторов RSV. Включали полную лидерную область инсулина и последовательности инсулина, кодирующие кодон инициации трансляции. Эта химерная мРНК hIL-2 образует значительно большее количество белка hIL2, чем мРНК hIL-2, содержащая природные лидерный и инициирующий кодоны hIL-2 (Cullen, 1988).
Последовательности гена дигидрофолатредуктазы (dhFr) встраивали в вектор pBC12/RSV/IL2 путем лигирования, с фрагментом гена SV40/dhFr (Subramani et al., Mol. Cell. Biol. 1:854, 1981) с получением плазмиды pBC12/RSV/IL-2/dhFr, содержащей целый ген dhFr мыши под контролем ранней промоторной области вируса SV40, и в которой гены hIL-2 и dhFr были расположены в одной и той же ориентации.
Перед трансфекцией культивированные клетки KBT подвергали мутагенезу с 0,1 мМ полициклическим ароматическим углеводородом рацемическим 3a,4b-дигидрокси-1a,2a-эпокси-1,2,3,4-тетрагидробензо[c]фенантреном (B[c]PHDE) в течение 90 минут (Carothers et al., Proc. Natl. Acad. Sci 87:5464-68, 1990). Селекция клонов dhFr- была основана на зависимости от гипоксантина и тимидина и последующем периоде экспрессии в течение 6 суток (Urlaub et al., Proc. Natl. Acad. Sci. 77(7):4216-20, 1980). Полученные клетки KTB с дефицитом dhFr (KBTdhFr-) поддерживали в стандартной среде, дополненной 10-4 M гипоксантина и 10-5 M тимидина.
При трансфекции культивированные клетки KBTdhFr- промывали три раза PBS и ресуспендировали в 0,8 мл PBS. К суспензии клеток добавляли 60 мкг вектора pBC12/RSV/IL2/dhFr и суспензию переносили в пластмассовую кювету для электропорации и инкубировали на льду в течение 10 мин. Электропорацию проводили при 75 кВ/м и 25 мкФ с использованием стандартного протокола электропорации с установкой для электропорации Gene-pulser (Bio-Rad). После подачи импульсов кювету инкубировали на льду в течение 10 мин. Затем клетки переносили в колбы, и культивировали в стандартной среде без гипоксантина и тимидина. Выжившие клетки клонировали с использованием способа клонирования единичных клеток (см. раздел 1.1.2) и установившиеся линии оценивали в отношении секреции hIL-2.
Результаты
Экспрессию мРНК hIL-2 в трансфицированных клетках KBT (KBT TR-IL2) подтверждали способом ПЦР со специфичными к hIL-2 праймерами. В качестве положительного контроля использовали CD8+ T-клетки человека, полученные из PBML способом сортировки с магнитными гранулами (как описано в разделе 1.3.3.5) и клеточную линию Jurkat, клон E6-1. Клетки K562 и нетрансфицированные гибридные клетки KBT использовали в качестве отрицательных контролей. После различных обработок тотальную РНК экстрагировали из трансфицированных клеток KBT с помощью набора RNeasy Mini kit (Qiagen) согласно инструкциям изготовителя. Представленные ниже праймеры представляли собой праймеры для hIL-2, использованные на основе опубликованных последовательностей (Wang et al, 1989):
5'-праймер = 5'-GAATGGAATTAATAATTACAAGAATCCC-3' (SEQ ID NO: 13); 3'-праймер = 5'-TGTTTCAGATCCCTTTAGTTCCAG-3' (SEQ ID NO: 14). Амплификацию проводили на протяжении 35 циклов. Циклы ПЦР состояли из 40 секунд при 94°С, температура отжига для hIL2 составляла 55°С, с последующим удлинением в течение 40 секунд при 72°С. Продукты ПЦР визуализировали в 2% агарозных гелях с бромидом этидия. Результаты приведены на фигуре 38. Уровни экспрессии являются сходными с уровнями, полученными для CD8+ T-лимфоцитов человека и клеток Jurkat. Нетрансфицированные клетки KBT и клетки K562 использовали в качестве отрицательных контролей.
Детекцию внутриклеточного IL-2 проводили с использованием набора для детекции внутриклеточного IL-2 BD FastlmmuneTM CD4 intracellular IL-2 Detection Kit (BD Pharmingen) согласно инструкциям изготовителя. Анализы FACS проводили с использованием BD FACSCalibur. Сначала клетки CD4+ ограничивали на основе рассеяния вперед и порога флуоресценции, а также прямого и бокового рассеяния. За этим следовал анализ ограниченной популяции на основе экспрессии CD69 (активированные CD4+ T-клетки) и внутриклеточной экспрессии IL-2. Профиль FACS для экспрессии IL-2 в клетках KBT TR-IL2 представлен на фигуре 39. Нетрансфицированные клетки KBT использовали в качестве контроля. Приблизительно 41% клеток KBT были положительными по молекуле активации CD69. 92% клеток KBT TR-IL2 положительно окрашивались по внутриклеточному hIL-2 (R1+R2). Отрицательные по hIL-2 клетки были частью положительной по CD69 популяции, в то время как все отрицательные по CD69 клетки были положительными по внутриклеточному hIL2.
Секрецию hIL-2 через тридцать суток и девять суток после трансфекции подтверждали посредством ELISA. В кратком изложении, 1×106 трансфицированных hIL-2 клеток KBT инкубировали в планшете для культивирования тканей с 24-ячейками при 37°C в течение 24 часов. Супернатант собирали и активность hIL-2 измеряли с помощью набора hIL-2 ELISA kit (R&D systems). Супернатанты разбавляли, чтобы они соответствовали диапазону детекции для набора hIL-2 ELISA. Рекомбинантный hIL-2 (R&D systems) использовали в качестве положительного контроля. Анализ ELISA показал уровни секреции hIL-2 в диапазоне от 660 нг/106 клеток/24 часа до 3300 нг/106 клеток/24 часа.
Полученную клеточную линию KBT, стабильно трансфицированную hIL2 и секретирующую hIL2, обозначили как ProL2.
9.3. Одновременная экспрессия белков-мишеней, сочетающая гибридизацию и трансфекцию
В качестве примера одновременной экспрессии белков с использованием тригибридной системы, тригибридные клетки гибридизовывали с sIgM+CD25+ B-лимфоцитами человека для экспрессии hIgM, с последующей стабильной трансфекцией посредством hIL-2. Затем гибридную клеточную систему, которая стабильно экспрессировала как hIgM, так и hIL-2, далее подвергали временной трансфекции hIL-4Rα. В этом примере hIgM представлял собой первый белок, hIL-2 представляет собой второй одновременно экспрессируемый белок, и hIL-4Rα представлял собой третий одновременно экспрессируемый белок. Альтернативно тригибридные клетки стабильно трансфицировали hIL-2 с последующей гибридизацией соматических клеток с shIgM+CD25+ B-клетками человека. После подтверждения того, что как hIL-2, так и hIgM, экспрессировались из гибридной клеточной системы, гибридную клеточную систему далее подвергали временной трансфекции hIL-4Rα. В этом примере hIL-2 представлял собой первый белок, hIgM представлял собой второй одновременно экспрессируемый белок, и hIL-4Rα представлял собой третий одновременно экспрессируемый белок.
9.3.1 Получение клеток
В этих экспериментах использовали тригибрид KBT перекрестного происхождения, происходящий из зрелой B-клетки (CD19+) и зрелой T-хелперной клетки (CD4+) со 100% тригибридных клеток перекрестного происхождения, имеющими фенотипические маркеры как B-клеток, так и T-клеток при определении посредством FACS (см. раздел 4.2.3) и кариотипированный, как описано в разделе 6.2.1. В некоторых случаях в экспериментах использовали клетки KBT с дефицитом dhFr (KBTdhFr-), полученные способом мутагенеза, описанным в разделе 9.2.2 и поддерживаемые в стандартной среде, дополненной 10-4 M гипоксантином и 10-5 M тимидином. Также в некоторых случаях использовали трансфицированную hIL-2 клеточную линию KBT TR-IL2 (см. раздел 9.2.2). В качестве источника B-клеток с sIgM человека для гибридизации использовали первичные CD40-активированные положительные по sIgM B-клетки, выделенные из PBMC, как описано в разделе 1.3.3 и активированные через каскад CD40, как описано в разделе 2.2. Для этих конкретных экспериментов выделение sIgM+ B-клеток также было основано на одновременной поверхностной экспрессии CD25 (рецептор IL-2 человека) с использованием FACS после культивирования в течение 5 суток. CD8+ T-клетки выделяли из тимусов с использованием набора MACS CD4 Multisort kit, как описано в разделе 1.3.3.5.
9.3.2 Гибридизация соматических клеток для продукции первого белка или совместной продукции второго белка
Методика электрической гибридизации клеток между клеткой KBT или клеткой KBTdhFr- или клеткой линии KBT TR-IL2 и shIgM+CD25+ B-клеткой (подгруппа B-клеток памяти) была по существу такой же, как использовали для создания тригибридных линий KBT перекрестного происхождения, как описано в разделе 4.4.2. После того, как полученные гибриды становились стабильными, их поддерживали, как описано в разделе 1.1. Коэкспрессию shIgM и CD25 полученным гибридом подтверждали с помощью анализа FACS (см. фигуру 62) и продукцию hIgM анализировали с помощью ELISA. В случаях, когда клетки KBT TR-IL2 использовали для гибридизации с shIgM+CD25+ B-клеткой, также одновременно с hIgM анализировали продукцию hIL-2.
9.3.3 Стабильная трансфекция вторым белком
Когда гибридизацию соматических клеток проводили перед стабильной трансфекцией системы hIL-2, продуцирующую hIgM систему подвергали трансфекции hIL-2 с использованием методики, описанной в разделе 9.2.2. Одновременную продукцию как hIgM, так и hIL-2, подтверждали способом ELISA.
9.3.4 Временная трансфекция третьим белком
Стабильную гибридную систему, секретирующуюся как hIgM, так и hIL-2, далее временно трансфицировали электропорацией геном hIL-4Ra с использованием того же подхода, который описан в разделе 9.2.1. Совместную продукцию hIgM, hIL-2 и hIL-4Rα подтверждали способом ELISA.
Результаты
Уровни продукции трех белков, одновременно экспрессированных и совместно продуцированных клетками одной системы гибридных клеток, обобщенно представлены в таблице 7a и таблице 7b. Для анализа клетки выращивали в 24-луночных планшетах до плотности 0,5×105 клеток/мл для экспрессии одного белка, 1,2×105 клеток/мл для экспрессии двух белков и 3,2×105 клеток/мл для экспрессии трех белков. Система была не только способна продуцировать три белка одновременно, но также уровень продукции первого белка возрастал после коэкспресии второго белка, и он далее усиливался при экспрессии третьего белка. Аналогично, продукция второго белка усиливалась экспрессией третьего белка.
Типичные уровни продукции белков, одновременно экспрессируемых одной и той же гибридной клеточной системой, где первым способом экспрессии была соматическая гибридизация
нг/мл/24 часа
нг/мл/24 часа
нг/мл/24 часа
Типичные уровни продукции белков, одновременно экспрессируемых одной и той же гибридной клеточной системой, где первым способом экспрессии была стабильная трансфекция
нг/мл/24 часа
нг/мл/24 часа
нг/мл/24 часа
Пример 10
10. Адаптация бессывороточных условий культивирования для продукции гибрида ProGM
Чтобы продемонстрировать надежность гибридных клеток ProGM для коммерческой продукции, объем культуры масштабировали до вращающихся колб с рабочим объемом 1,2 л, и адаптировали к бессывороточным условиям в культуре.
Методика
Клоны гибрида ProGM с наиболее высокой продукцией hGM-CSF адаптировали для выращивания в бессывороточных условиях путем постепенного снижения содержания FCS до 7,5, 5,0, 2,5, 1,0, 0,5 и 0%. Только субкультуры, демонстрирующие наиболее устойчивый клеточный рост и продукцию hGM-CSF, переносили в последующие условия с более низким содержанием сыворотки. Каждую отобранную субкультуру замораживали в стандартной среде авторов изобретения с 5% DMSO для хранения. Для адаптации использовали две бессывороточных культуральных среды. Использовали коммерчески доступную среду с определенным химическим составом, не содержащую сыворотки и белка, Hybri-Max (Sigma) или Excel (JHR) с некоторыми модификациями. Жизнеспособность клеток оценивали по исключению трипанового синего на 7 сутки. Концентрацию hGM-CSF определяли способом ELISA в тот же день.
Результаты
Результаты адаптации к бессывороточным условиям культивирования приведены в таблице 8.
Продукция hGM-CSF из ProGM в бессывороточных условиях
(×106 клеток/мл)
Во всех субкультурах гибрида ProGM продукция hGM-CSF возрастала при снижении содержания сыворотки и белка. Несмотря на низкую плотность клеток в бессывороточных культурах, количество hGM-CSF в бессывороточной среде было приблизительно в 4 раза выше, чем количество, полученное в стандартных условиях культивирования. При нормализации к концентрации клеток, скорость продукции hGM-CSF возрастала в 15 раз.
Пример 11
11.1. Методика продукции во вращающихся колбах
Вращающиеся колбы с рабочим объемом 1,2 л перемешивали при 50 об./мин. Гибридные клетки ProGM, адаптированные для роста в бессывороточной среде (ProGMsf), инокулировали в концентрации 1×105 клеток/мл. Культуру инкубировали при 37°С в увлажненной атмосфере, содержащей 5% CO2. Максимальная достигнутая плотность клеток составляла 5×105 клеток/мл. Жизнеспособность клеток определяли с использованием способа исключения трипанового синего. Изменение среды каждые сутки проводили вплоть до 9 суток. Суспензию клеток (600 мл) центрифугировали при 1000 об./мин. в течение 10 мин, среду удаляли и заменяли свежей средой, и клетки возвращали во вращающуюся колбу. Концентрацию секретированного hGM-CSF определяли способом ELISA. Каждую лунку покрывали 100 мкл антитела крысы против GM-CSF человека (R&D), разбавленного 1:500. После промывания PBS, содержащим 0,05% об./об. Tween 20 (PBS-T), в лунки добавляли 100 мкл стандартного rhGM-CSF (Invitrogen) в PBS-5% об./об. BSA, в диапазоне 0,195-200 нг/мл, или по 100 мкл каждого образца, разбавленного в 100 раз, в двух экземплярах. Все инкубации проводили при 37°C в течение 1 часа, после этого планшеты промывали PBS-T, и добавляли 100 мкл антитела кролика против GM-CSF человека (R&D), разбавленного 1:1000 в PBS-BSA-T и после инкубации и промывания добавляли 100 мкл конъюгат иммуноглобулинов козы против антител кролика с HRP, разбавленный 1:1000 в том же буфере. Планшеты инкубировали и промывали еще один раз и добавляли 100 мкл субстрата. Оптическую плотность измеряли при 450 нм.
Результаты
Относительно низкая плотность клеток, составляющая 5×105 клеток на мл, указывает на субоптимальные условия культивирования для роста клеток ProGMsf. Для получения более высокой плотности (порядка 106 клеток/мл) может потребоваться дальнейшая оптимизация условий культивирования, включая содержание глюкозы и других добавок. Также был оправдан тщательный мониторинг содержания лактата и аммония. Несмотря на субоптимальный рост концентрация hGM-CSF в культуральных супернатантах варьировала от 2,8 до 4,2 мкг на мл. При нормализации к плотности клеток и времени ProGMsf проявляли уровни продукции от 0,6 до 0,9 мкг hGM-CSF на мл на 106 клеток на 24 часа. Для сравнения, продукция 0,3 мкг белка на мл на 106 клеток на 24 часа в CHO считается высокой.
11.2. Очистка GM-CSF человека, продуцированного гибридной клеточной линией
Методика
Супернатант культуры ProGMsf концентрировали приблизительно в 10 раз при 40°С с мембраной PM-10 (Amicon). Концентрат образца наносили на иммуноаффинную колонку, полученную присоединением антитела крысы против происходящего из E. coli GM-CSF человека к Affi-Gel 10 (Bio-Rad) согласно протоколу изготовителя, уравновешенную PBS (137 мМ NaCl, 3 мМ KCl, 8 мМ Na2HPO4, 1,5 мМ KH2PO4), и связанные белки элюировали 0,1 мМ цитратом натрия, pH 2,8. Затем белки, элюированные с аффинной колонки, наносили на колонку для ВЭЖХ RP 300 и элюировали градиентом ацетонитрила 0-60% в течение 60 минут при скорости потока 0,1 мл/мин. Полученный профиль элюирования представлен на фигуре 40. Аликвоты, выделенные путем ОФ-ВЭЖХ, собирали для ELISA, окрашивания серебром и вестерн-блот-анализа.
Результаты
В таблице 9 представлено выделение hGM-CSF путем типичной двухстадийной очистки. Первоначальный выход из аффинной колонки составлял только 59%, и только 2% hGM-CSF было утрачено после ОФ-ВЭЖХ. Имеет ряд возможных объяснений для низкого выхода после аффинной очистки. Связывающая способность аффинной колонки может быть ниже, чем количество hGM-CSF в супернатантах ProGMsf, поскольку 13% hGM-CSF утрачивалось в поток и на стадиях промывания. Низкий выход также может быть следствием низкой аффинности антител крысы, индуцированных против происходящего из E. coli hGM-CSF по сравнению с гликозилированными формами hGM-CSF, продуцированными гибридом ProGMsf. Другое потенциальное улучшение этих конечных выходов может состоять в разработке лучших оптимизированных условиях элюирования. На фигуре 41 (см. раздел 12), вестерн-блоттинг фракций, собранных после ОФ-ВЭЖХ, продемонстрировал, что hGM-CSF элюировался во фракциях 24-36 (элюирование через 24-36 минут). Высокомолекулярные формы (28-32 кДа) элюировались во фракциях 24-27, в то время более низкомолекулярные молекулы (18-22 кДа) элюировались во фракциях 34-36. Эти хроматографиеские условия не полностью разделяли формы hGM-CSF с различной молекулярной массой, особенно во фракциях высокой и средней молекулярной массы.
Профиль, полученный окрашиванием серебром, и профили вестерн-блоттинга были по существу идентичными, указывая на то, что только родственные hGM-CSF белки связывались с аффинной колонкой. Наблюдали несколько типов нативного hGM-CSF по молекулярной массе.
Двухстадийная очистка hGM-CSF, происходящего из ProGMsf
Пример 12
12. Расщепление гликозидазой
Методика
Очищенный GM-CSF человека, происходящий из гибрида ProGMsf, денатурировали нагреванием в течение 3 мин при 100°С в 1% SDS, 1 M P-меркаптоэтаноле, 100 мМ фосфате натрия, pH 7,0, добавляли 0,8 Е PNGase F категории для секвенирования (Sigma) и инкубировали в течение увеличивающихся периодов при 37°С.
Результаты
Как видно на фигуре 43, после N-расщепления, формы hGM-CSF, происходящие из гибрида ProGMsf, мигрировали зависимым от времени образом в положение вблизи hGM-CSF, происходящего из E.coli. Однако ни одна из полос после расщепления не соответствовала негликозилированной форме, продуцированной E.coli. Эти результаты указывают на то, что hGM-CSF, происходящий из гибрида ProGMsf, является гликозилированным по участкам как N-, так и O-гликозилирования, и что распределение молекулярной массы вызывается гетерогенным гликозилированием. Это открытие O-гликозилирования во всех молекулах hGM-CSF является важным с точки зрения иммуногенности незащищенных участков O-гликозилирования; описано, что рекомбинантный GM-CSF человека, лишенный O-гликозилирования, приводил к образованию антител в клинических испытаниях.
Данные указывают на то, что гибридные клетки ProGMsf секретируют три класса hGM-CSF согласно участкам N-гликозилирования: молекулы с обоими гликозилированными участками (25-35 кДа, 2N-тип); молекулы и каким-либо одним гликозилированным участком (20-25 кДа, 1N-тип); и молекулы без гликозилированных участков (18-20 кДа, 0N-тип).
Хотя изобретение описано применительно к конкретным примерам, специалисты в данной области поймут, что изобретение может быть осуществлено во многих других формах, в соответствии с широкими принципами и сущностью изобретения, описанного в настоящем документе.
Ссылки:
Ainai et al.., Hum Antibodies 15:139-154, 2006
Airoldi et al.., Cancer Research 61:1285-1290, 2001
Blackwood et al., Science 281:60-63, 1998
Boerner et al., J. Immunol. 147:86-95, 1991;
Carothers et al., Proc. Natl. Acad. Sci 87:5464-68, 1990
Christensen et al. J Biol. Chem. 282(27):19463-19472
Cullen, B. R., 1988. DNA, 7:645-650
Durocher et al., Nucleic Acids Res 30(2):e9, 2002;
Durocher et al., Nucleic Acids Res 30(2):e9, 2002;
Feizi Nature 314:53-54, 1985;
Girard et al., Cytotechnology 38:15-21, 2002;
Gramer et al., Biotechnology 13 (7):692, 1995
Hartman et al., J Immunol 164:944-953, 2000;
Hosoi et al., Cytotechnology 7:25-32, 1991
Hosoi et al., Cytotechnology 7:25-32, 1991
Hosoi et al., Cytotechnology 7:25-32, 1991
Hur et al., Cell Prolif 38:35-45, 2005;
Jordan et al., Cytotechnology 26:39-47, 1998;
Jordan et al., Cytotechnology 26:39-47, 1998;
Kalantarov et al., Hum Antibodies 11:85-96, 2002;
Karpas et al., Proc Natl Acad Sci USA 98:1799-1804, 2001
Kimura H. et al., 1999. J Clin Microbiol 37:132-136
Kirman et al., Hybrid. Hybridomics 21:405-414, 2002;
Kohler, G and Milstein, C. Nature, 256, 495-497 1975
Li et al., Proc Natl Acad Sci USA 103(10):3557-3562, 2006
Li et al., Proc Ntl Acad Sci USA 95:3650-3654, 1998;
Mahaworasilpa, T. L. (1992). Cell Electro-Dynamics: The mechanics of living cells in intense alternating electric fields. PhD Thesis, University of New South Wales, Sydney, Australia
Marika et al., Curr Opin Genet Dev 11(2):205-208, 2001
McIlroy D, Autran B, Cheynier R, et al.. J Virol.; 69:4737-4745 1995
Meissner et al., Biotechnol Bioeng 75(2):197-203, 2001
Miyaji et al.., Cytotechnology 4:173-180, 1990;
Miyaji et al.., Cytotechnology 4:39-43, 1990;
Miyaji et al., Cytotechnology, 3:133-140, 1990;
Neil, G. A. and Zimmermann, U Electro, Meth. Enzymol 220, 174 1993
Parham et al., Cytotechnology, 35:181-187, 2001
Paulson et al., J. Biol. Chem. 264:10931-10934, 1989
Pham et al., Biotechnol Bioeng 84(3):332-42, 2003
Pohl, H. Dielectrophoresis, Cambridge University Press, London 1978
Rademacher et al., Annu Rev Biochem 57:785-838, 1988
Satoh et al., Cytotechnology 18:162-172, 1996
Satoh et al., Cytotechnology 13:79-88, 1993
Satoh et al., Cytotechnology 13:79-88, 1993
Schlaeger et al., Cytotechnology 30:71-83, 1999
Shinkawa et al., J. Biol. Chem. 278:3466-3473, 2003
Sugimoto et al., J Virol 73:9690-9691, 1999;
Toda et al., J Chromatogr B Analyt. Technol. Biomed. Life Sci. 787:197-206, 2003.
Traggiai et al., Nat Med 10:871-875, 2004
Urlaub et al., Proc. Natl. Acad. Sci. 77(7):4216-20, 1980
van Dijk et al., Curr. Opin. Chem. Biol. 5:368-374, 2001
Wang, A. M., Doyle. M. V., and Mark. D. F. Proc. Nati. Acad. Sci. USA, 86:9717-9721, 1989
Wojciezsyn, J. W. et al., J. Cell. Biol., 96, 151-159, 1983
Zafiropoulos et al., J. Immunol. Methods 200:181-190, 1997
Zimmermann, U. (1982). Biochim. Biophys. Acta. 694, 227-277.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПОЛУЧЕНИЯ КЛЕТОК, ПРОЯВЛЯЮЩИХ ФЕНОТИПИЧЕСКУЮ ПЛАСТИЧНОСТЬ | 2010 |
|
RU2536941C2 |
| РЕКОМБИНАНТНЫЙ ВЕКТОР КЛОНИРОВАНИЯ (ВАРИАНТЫ) | 1991 |
|
RU2116346C1 |
| РАСТВОРИМЫЕ ПОЛИПЕПТИДНЫЕ ФРАКЦИИ ПРОТЕИНА LAG-3, СПОСОБ ПОЛУЧЕНИЯ, ТЕРАПЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, АНТИТЕЛО | 1995 |
|
RU2178306C2 |
| МЕЧЕНЫЕ ХИМЕРНЫЕ ЭФФЕКТОРНЫЕ МОЛЕКУЛЫ И ИХ РЕЦЕПТОРЫ | 2014 |
|
RU2729463C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ БУСТИНГА ЭФФЕКТИВНОСТИ АДОПТИВНОЙ КЛЕТОЧНОЙ ИММУНОТЕРАПИИ | 2015 |
|
RU2716716C2 |
| СПОСОБ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ПЕРСИСТИРУЮЩИХ ИНФЕКЦИЙ | 2006 |
|
RU2434641C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ПЕРСИСТИРУЮЩИХ ИНФЕКЦИЙ | 2016 |
|
RU2746383C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ПЕРСИСТИРУЮЩИХ ИНФЕКЦИЙ | 2006 |
|
RU2596491C2 |
| СПОСОБ ПОЛУЧЕНИЯ НЕДИФФЕРЕНЦИРОВАННОЙ КЛЕТКИ | 1996 |
|
RU2215539C2 |
| ИММУННЫЕ КЛЕТКИ, ДЕФЕКТНЫЕ ПО Suv39h1 | 2018 |
|
RU2784531C2 |






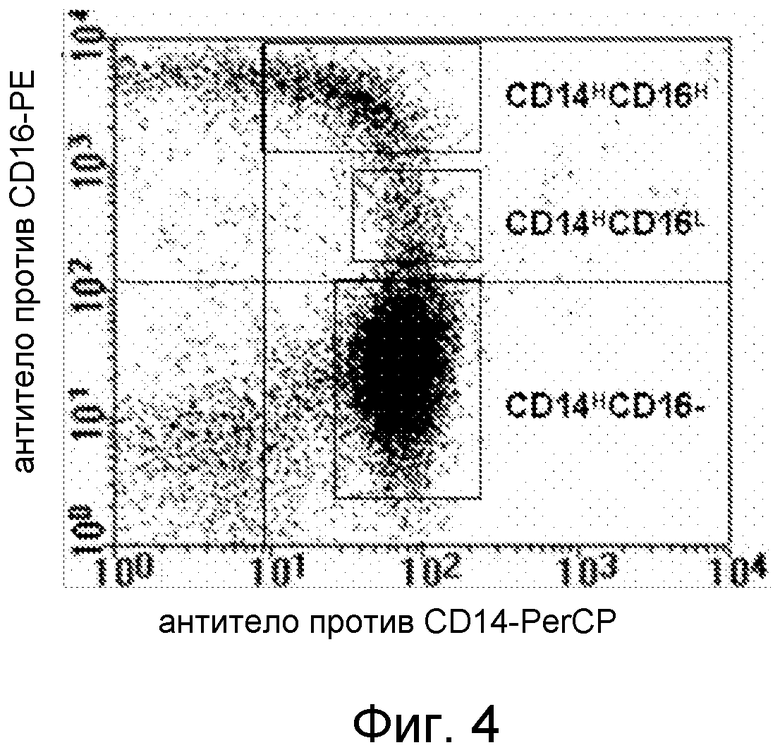




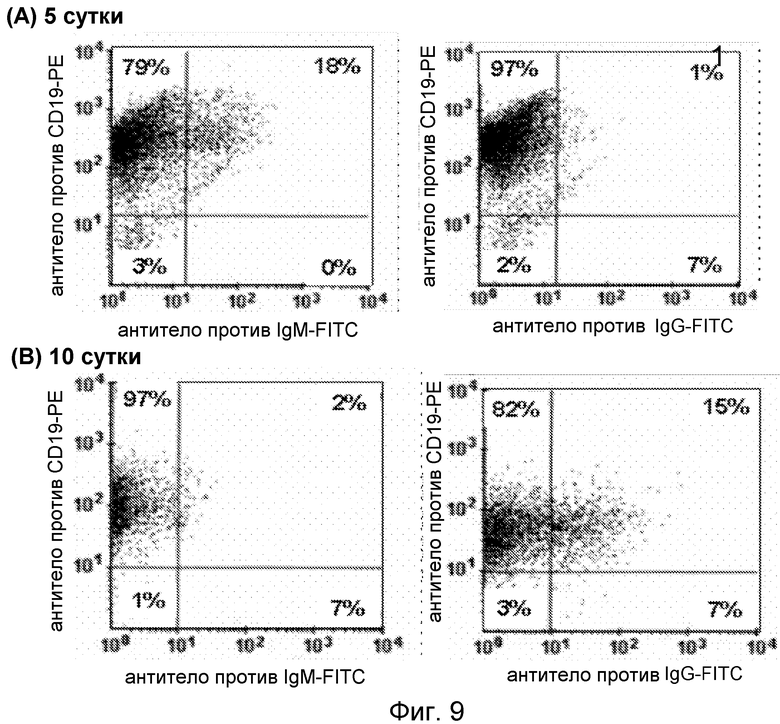
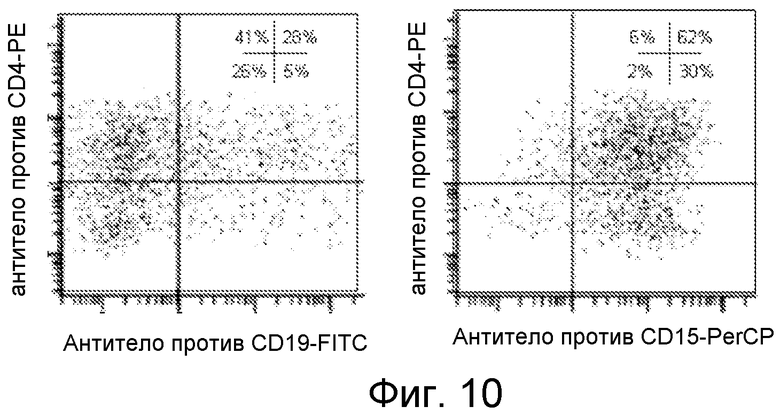

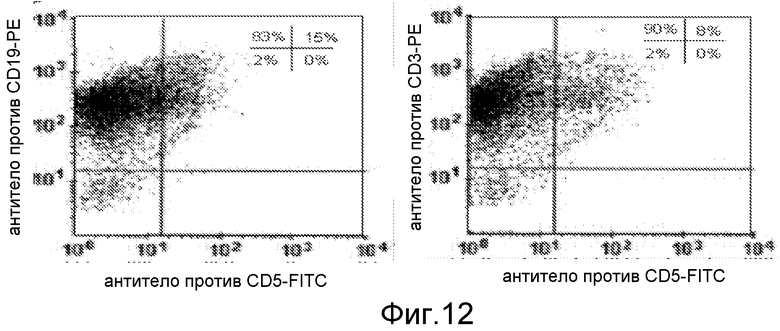





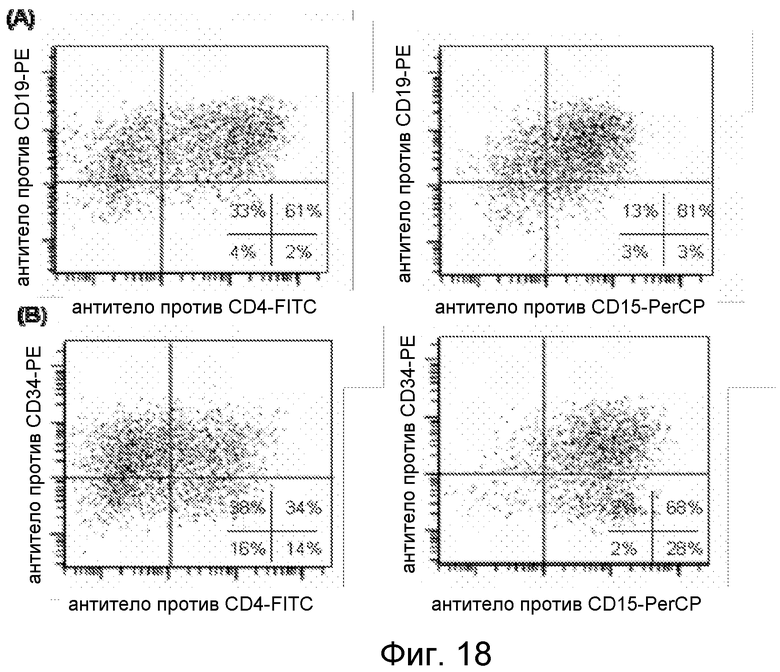
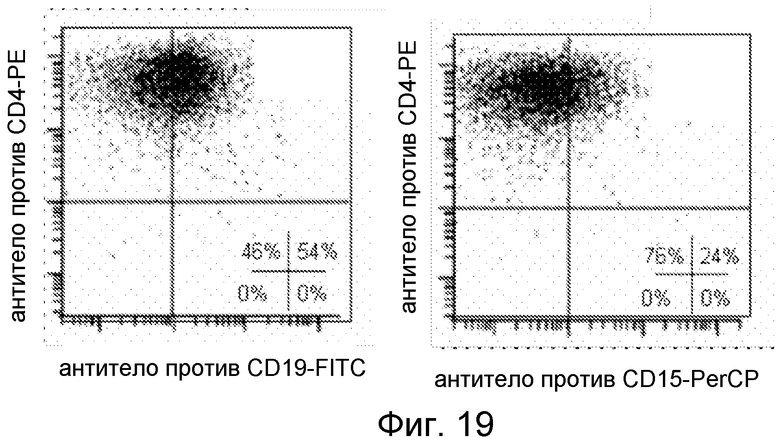






















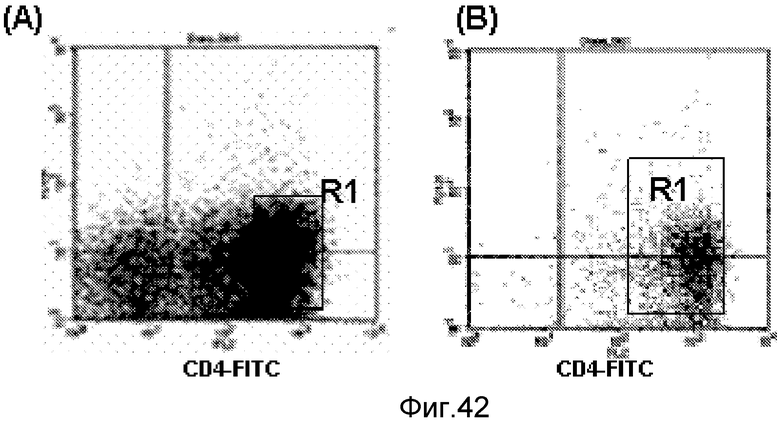

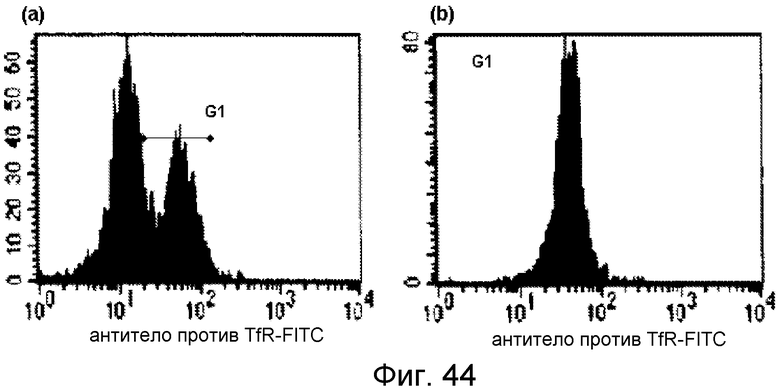


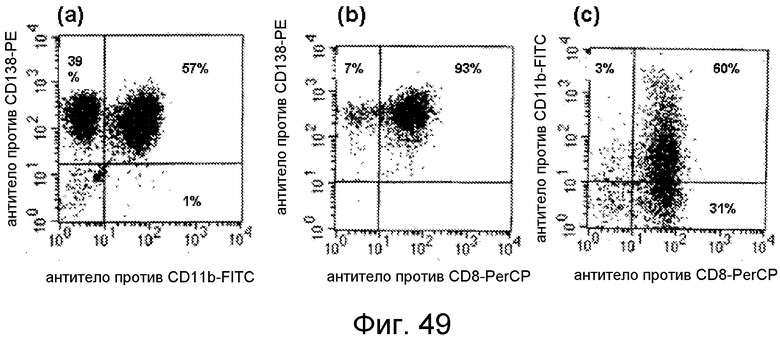












Изобретение относится к области медицины, биотехнологии и генетической инженерии. Предложена тригибридная клетка для экспрессии белков, полученная путем гибридизации первой клетки, представляющей собой стволовую клетку или клетку, происходящую из некоммитированной клетки-предшественника, второй клетки, происходящей из общей лимфоидной клетки-предшественника, и третьей клетки, происходящей из общей лимфоидной клетки-предшественника, где указанная первая клетка не является клеткой миеломы, а также способ её получения и способ получения белков с её использованием. Благодаря увеличению стабильности белков, полученных с помощью данной тригибридной клетки, и увеличению эффективности продукции терапевтических белков изобретение применимо для экспрессии белков, пригодных при ряде диагностических, профилактических, терапевтических и/или исследовательских применений. 3 н. и 61 з.п. ф-лы, 62 ил., 9 табл., 12 пр.
1. Тригибридная клетка, пригодная для экспрессирования белков, полученная путем гибридизации:
первой клетки, где указанная первая клетка представляет собой стволовую клетку или клетку, происходящую из некоммитированной клетки-предшественника;
второй клетки, происходящей из общей лимфоидной клетки-предшественника; и
третьей клетки, происходящей из общей лимфоидной клетки-предшественника,
и где указанная первая клетка не является клеткой миеломы.
2. Тригибридная клетка по п.1, где указанная вторая клетка представляет собой клетку, происходящую из В-лимфоидного ростка, и указанная третья клетка представляет собой клетку, происходящую из В-лимфоидного ростка.
3. Тригибридная клетка по п.1, где указанная вторая клетка представляет собой клетку, происходящую из Т-лимфоидного ростка, и указанная третья клетка представляет собой клетку, происходящую из Т-лимфоидного ростка.
4. Тригибридная клетка по п.1, где указанная вторая клетка представляет собой клетку, происходящую из В-лимфоидного ростка, и указанная третья клетка представляет собой клетку, происходящую из Т-лимфоидного ростка.
5. Тригибридная клетка по любому из пп.1-4, где указанная первая клетка представляет собой клетку, происходящую из общей миелоидной клетки-предшественника.
6. Тригибридная клетка по п.5, где указанная клетка, происходящая из общей миелоидной клетки-предшественника, представляет собой миеломоноцитарного предшественника, моноцит, макрофаг, эозинофил, нейтрофил, дендритную клетку или базофил.
7. Тригибридная клеточная линия по п.5, где указанная клетка, происходящая из общей миелоидной клетки-предшественника, экспонирует по меньшей мере один из следующих антигенов CD: CD16, CD15 или CD14.
8. Тригибридная клетка по п.5, где указанная клетка, происходящая из общей миелоидной клетки-предшественника, представляет собой моноцит.
9. Тригибридная клетка по п.5, где указанная клетка, происходящая из общей миелоидной клетки-предшественника, представляет собой первичный миеломоноцитарный предшественник.
10. Тригибридная клетка по п.5, где указанная клетка, происходящая из общей миелоидной клетки-предшественника, представляет собой иммортализованную клетку.
11. Тригибридная клетка по п.5, где указанная клетка, происходящая из общей миелоидной клетки-предшественника, происходит из селезенки, периферической крови, пуповинной крови или костного мозга.
12. Тригибридная клетка по п.2 или 4, где указанная клетка, происходящая из В-лимфоидного ростка, представляет собой пре-В-клетку, незрелую В-клетку, наивную В-клетку, активированную В-клетку или эффекторную В-клетку.
13. Тригибридная клетка по п.12, где эффекторная В-клетка представляет собой обученную антигеном В-клетку или плазматическую клетку.
14. Тригибридная клетка по п.2 или 4, где указанная клетка, происходящая из В-лимфоидного ростка, экспонирует по меньшей мере один из следующих антигенов CD: CD19, CD20, CD72 или CD 5.
15. Тригибридная клетка по п.3 или 4, где указанная клетка, происходящая из Т-лимфоидного ростка, представляет собой пре-Т-клетку, незрелую Т-клетку, наивную Т-клетку, активированную Т-клетку или эффекторную Т-клетку.
16. Тригибридная клетка по п.3 или 4, где указанная клетка, происходящая из Т-лимфоидного ростка, экспонирует по меньшей мере один из следующих антигенов CD: CD3, CD4, CD5 или CD8.
17. Тригибридная клетка по п.2 или 4, где указанная клетка, происходящая из В-лимфоидного ростка, представляет собой иммортализованную клетку.
18. Тригибридная клетка по п.3 или 4, где указанная клетка, происходящая из Т-лимфоидного ростка, представляет собой иммортализованную клетку.
19. Тригибридная клетка по п.2 или 4, где указанная клетка, происходящая из В-лимфоидного ростка, происходит из лимфоидной ткани.
20. Тригибридная клетка по п.3 или 4, где указанная клетка, происходящая из Т-лимфоидного ростка, происходит из лимфоидной ткани.
21. Тригибридная клетка по п.19, где указанная лимфоидная ткань выбрана из периферической крови, пуповинной крови, селезенки, костного мозга, тимуса, миндалевидных желез, аденоидов и регионарных лимфатических узлов.
22. Тригибридная клетка по п.1, где по меньшей мере одна из клеток представляет собой клетку человека.
23. Тригибридная клетка по п.1, где по меньшей мере одна из клеток представляет собой клетку мыши.
24. Тригибридная клетка по п.5, где указанная клетка, происходящая из общей миелоидной клетки-предшественника, представляет собой клетку К562.
25. Тригибридная клетка по п.1, где указанная вторая клетка или указанная третья клетка представляет собой клетку WIL2-NS или клетку MOLT4.
26. Тригибридная клетка по п.2 или 4, где указанная клетка, происходящая из В-лимфоидного ростка, представляет собой клетку WIL2-NS.
27. Тригибридная клетка по п.3 или 4, где указанная клетка, происходящая из указанного Т-лимфоидного ростка, представляет собой клетку MOLT4.
28. Тригибридная клетка по п.1 или 4, где указанная первая клетка представляет собой клетку К562, указанная вторая клетка представляет собой клетку WIL2-NS и указанная третья клетка представляет собой клетку MOLT4.
29. Тригибридная клетка по п.1 или 4, где указанная первая клетка представляет собой клетку К562, указанная вторая клетка представляет собой первичную В-клетку и указанная третья клетка представляет собой первичную Т-клетку.
30. Тригибридная клетка по п.1 или 4, где указанная первая клетка представляет собой первичный моноцит человека, указанная вторая клетка представляет собой клетку WIL2-NS и указанная третья клетка представляет собой первичную Т-клетку.
31. Тригибридная клетка по п.1 или 4, где указанная первая клетка представляет собой первичный миеломоноцитарный предшественник человека, указанная вторая клетка представляет собой клетку WIL2-NS и указанная третья клетка представляет собой первичную Т-клетку человека.
32. Тригибридная клетка по п.1 или 4, где указанная первая клетка представляет собой клетку К562, указанная вторая клетка представляет собой клетку WIL2-NS, и указанная третья клетка представляет собой первичную Т-клетку.
33. Тригибридная клетка по п.1 или 2, где указанная первая клетка представляет собой первичный моноцит, указанная вторая клетка представляет собой клетку WIL2-NS и указанная третья клетка представляет собой клетку WIL2-NS.
34. Тригибридная клетка по п.1 или 4, где указанная первая клетка представляет собой первичный моноцит мыши, указанная вторая клетка представляет собой клетку SP2 и указанная третья клетка представляет собой первичную Т-клетку мыши.
35. Тригибридная клетка по п.1 или 2, где указанная первая клетка представляет собой первичный моноцит мыши, указанная вторая клетка представляет собой клетку SP2 и указанная третья клетка представляет собой клетку SP2.
36. Тригибридная клетка по п.1 или 2, где указанная первая клетка представляет собой первичный моноцит человека или мыши, указанная вторая клетка представляет собой клетку WIL2-NS и указанная третья клетка представляет собой клетку SP2.
37. Тригибридная клетка по п.1, где указанная тригибридная клетка экспрессирует желаемый белок.
38. Тригибридная клетка по п.1, где указанная тригибридная клетка экспрессирует более одного желаемого белка.
39. Тригибридная клетка по п.38, где указанная тригибридная клетка экспрессирует два желаемых белка.
40. Тригибридная клетка по п.38, где указанная тригибридная клетка экспрессирует три желаемых белка.
41. Тригибридная клетка по п.37, где указанный белок представляет собой эндогенный белок.
42. Тригибридная клетка по п.38, где по меньшей мере один из указанных белков представляет собой эндогенный белок.
43. Тригибридная клетка по п.37, где указанный белок представляет собой рекомбинантный белок.
44. Тригибридная клетка по п.38, где по меньшей мере один из указанных белков представляет собой рекомбинантный белок.
45. Тригибридная клетка по п.37, где указанный белок представляет собой цитокин.
46. Тригибридная клетка по п.37, где указный белок представляет собой колониестимулирующий фактор.
47. Тригибридная клетка по п.37, где указанный белок представляет собой интерлейкин.
48. Тригибридная клетка по п.37, где указанный белок представляет собой GM-CSF.
49. Тригибридная клетка по п.37, где указанный белок представляет собой интерлейкин-2.
50. Тригибридная клетка по п.37, где указанный белок представляет собой рецептор или его фрагмент.
51. Тригибридная клетка по п.37, где указанный белок представляет собой растворимый рецептор.
52. Тригибридная клетка по п.37, где указанный белок представляет собой альфа-цепь рецептора IL-4 человека.
53. Тригибридная клетка по п.37, где указанный белок представляет собой иммуноглобулин.
54. Тригибридная клетка по п.53, где указанный иммуноглобулин представляет собой IgM.
55. Тригибридная клетка по п.53, где указанный иммуноглобулин представляет собой IgG.
56. Тригибридная клетка по п.37, где указанный белок представляет собой CD54.
57. Тригибридная клетка по п.1, где указанной гибридизации достигают электрическими средствами.
58. Тригибридная клетка по п.1, где указанную гибридизацию достигают химическими средствами.
59. Тригибридная клетка по п.1, дополнительно гибридизованная с клеткой, которая экспрессирует представляющий интерес белок.
60. Тригибридная клетка по п.1, где указанную гибридизацию проводят путем гибридизации трех отдельных клеток.
61. Тригибридная клетка по п.1, где указанную гибридизацию проводят с использованием трех популяций клеток, где каждая из указанных популяций включает множество идентичных типов клеток.
62. Тригибридная клетка по п.1, где указанная тригибридная клетка обогащена конкретным определяющим тип клетки маркером для обеспечения экспрессии белка, проявляющего желаемую посттрансляционную модификацию или желаемую функциональность.
63. Способ получения тригибридной клетки по любому из пп.1-62, где указанный способ включает стадию гибридизации;
первой клетки, где указанная первая клетка представляет собой стволовую клетку или клетку, происходящую из некоммитированной клетки-предшественника;
второй клетки, происходящей из общей лимфоидной клетки-предшественника; и
третьей клетки, происходящей из общей лимфоидной клетки-предшественника, и где указанная первая клетка не является клеткой миеломы.
64. Способ продукции белка, причем указанный способ включает стадию экспрессии белка в тригибридной клетке по любому из пп.1-62.
| RU 2001119161 A, 20.06.2003 | |||
| Фотооптический датчик системы автоматического вождения мобильного агрегата | 1986 |
|
SU1423012A1 |
| HERING S | |||
| Регенеративный приемник | 1923 |
|
SU562A1 |
| Механическая топочная решетка с наклонными частью подвижными, частью неподвижными колосниковыми элементами | 1917 |
|
SU1988A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ N-КАРБАМОИЛ-о- ФЕНИЛЕНДИАМИНА | 0 |
|
SU292965A1 |
Авторы
Даты
2014-12-27—Публикация
2010-06-10—Подача