Изобретение относится к области молекулярной биологии и биоорганической химии и касается композиций для иммобилизации олигонуклеотидов, белков, нуклеиновых кислот или любых других биологически значимых молекул в гидрогеле при изготовлении биочипов методом фотоиндуцируемой сополимеризации. Изобретение также относится к технологии изготовления биочипов, находящих применение в молекулярной биологии при секвенировании и картировании ДНК, детектировании мутаций и целого ряда медицинских приложений.
Уровень техники
Известны композиции для иммобилизации олигонуклеотидов и белков в полиакриламидном геле при изготовлении биочипов методом сополимеризации [1, 2].
[1] F.N. Rehman, M. Audeh, E.S. Abrams, P.W. Hammond, M. Kenney and Т.С. Boles, Nucleic Acids Research, 1999, v. 27, 15, p. 649-655.
[2] А.V. Vasiliskov, E.N. Timofeev, S.A. Surzhikov, A.L. Drobyshev, V.V. Shick and A.D. Mirzabekov, BioTechniques, 1999, v. 27, p. 592-606.
В состав композиций, используемых для изготовления указанных биочипов, входят следующие компоненты:
- мономеры, составляющие основу формируемого геля;
- модифицированные олигонуклеотиды и белки, несущие непредельные группы;
- среда проведения фотоиндуцируемой полимеризации.
Известно, что в качестве гелеобразующего компонента используют акриламид, а в качестве сшивающего агента - N,N'-метиленбисакриламид с общим содержанием 10% [1] и 5% [2] и соотношением акриламид: N,N'-метиленбисакриламид, равным 29:1 (С=3,3%) [1] и 19:1 (С=5%) [2].
Известно, что модифицированные олигонуклеотиды и белки несут метакриламидную [1], акриламидную [2] и аллильную [2] группы, обеспечивающие их способность сополимеризоваться с гелеобразующими мономерами.
Известно, что для формирования гидрогеля используют водно-глицериновые растворы с соотношениями вода : глицерин, равными 25:75 [1] и 60:40 [2].
Известны биочипы, в которых макромолекулы, играющие роль молекулярных зондов, иммобилизованы в ячейках гидрогеля, закрепленных на общей подложке и образующих регулярную структуру (матрицу) [1-5].
[3] Khrapko et al., US Patent 5552270;
[4] Ershov et al., US Patent 5770721;
[5] Guschin et al. , Manual manufacturing of Oligonucleotide, DNA and Protein Microchips, Analytical Biochemistry, 1997, v. 250, No. 2, p. 203-211
Известны способы изготовления биочипов на основе гидрогелей, в которых технологический цикл состоит из этапов: (1) подготовки подложки, (2) формирования на ней матрицы ячеек геля, (3) нанесения на ячейки растворов биологических макромолекул в соответствии с заранее составленной схемой биочипа, (4) химической обработки ячеек с целью иммобилизации молекул-зондов, (5) отмывки и просушки полученных биочипов. Для формирования матрицы ячеек геля известен метод лазерной абляции расположенного под сплошным слоем геля специального светопоглощающего слоя с геометрией, дополнительной по отношению к заданной геометрии массива ячеек [4], а также метод фотополимеризации через маску [5].
Известны также способы приготовления биочипов на основе геля, в котором стадии формирования массива ячеек и иммобилизации молекул-зондов объединены в одну за счет использования техники фото- или химически индуцируемой сополимеризации [1, 2]. Суть их состоит в использовании композиций, в состав которых наряду с мономером и сшивающим агентом входят иммобилизуемые макромолекулы, снабженные непредельной группой, обеспечивающей встраивание этих молекул в полимерную сетку гидрогеля.
Известен способ приготовления биочипов [1], согласно которому ячейки биочипа получают полимеризацией композиций в каплях, нанесенных на подложку с помощью микропипетки.
Известен способ приготовления биочипа [2], согласно которому используют специальную тонкослойную (≈5 мкм) камеру с реакционным объемом, ограниченным с одной стороны подложкой будущего биочипа, а с другой - окном, прозрачным в УФ-области. Ячейки биочипа формируют одну за другой путем циклического выполнения следующих операций: (1) заполнения камеры композицией с соответствующим зондом, (2) полимеризации композиции в месте нахождения будущей ячейки под действием УФ-излучения, сфокусированным в квадратное пятно необходимого размера, (3) промывки камеры перед заполнением ее очередным раствором.
Однако известные композиции для иммобилизации биологических макромолекул в гидрогелях при формировании биочипов, биочипы и способы их изготовления имеют ряд недостатков.
Недостатки
1. Использование только акриламида как гелеобразующего компонента и N, N'-метиленбисакриламида как сшивающего агента при изготовлении гелей сильно ограничивает спектр получаемых гидрогелей по структуре и пористости.
2. Модифицированные олигонуклеотиды, используемые для изготовления биочипов, содержат только 5'-концевую метакриламидную группу, связанную с молекулой олигонуклеотида кислотолабильной фосфорамидной связью, или концевую аллильную группу, обладающую низким сродством к акриламиду и N,N'-метиленбисакриламиду в реакции сополимеризации.
3. Модификация белков для последующей иммобилизации осуществляется двустадийным методом, позволяющим вводить непредельную группу только по NH2-группам.
4. Известные биочипы отличаются низкой воспроизводимостью свойств гелевых ячеек и неоднородностью распределения в объеме ячейки иммобилизуемого соединения.
5. Известный способ проведения химической полимеризации компонентов композиции при изготовлении биочипа осуществляют в атмосфере влажного азота, что снижает эффективность полимеризации.
6. Известный способ фотоиндуцируемой полимеризации использует УФ-излучение с длиной волны 254 нм, что приводит к деструкции олигонуклеотидов.
7. Известные способы изготовления биочипов технически сложны и используют процедуры, не обеспечивающие необходимой однородности и воспроизводимости свойств гелевых ячеек и плохо поддающиеся автоматизации.
В основу изобретения положена задача создания биочипа, обеспечивающего оптимальное функционирование иммобилизованных в нем биологически значимых макромолекул.
Поставленная задача решается предлагаемым изобретением.
Сущность изобретения
Предлагается композиция (К) для полимеризационной иммобилизации биологически значимых соединений в гидрогелях при формировании биочипов,
К=аА+bВ+сС+dD+еЕ,
включающая
А - мономер, составляющий основу формируемого геля, представляющий собой производное непредельной карбоновой кислоты;
В - сшивающий агент, представляющий собой водорастворимое производное непредельной карбоновой кислоты;
С - модифицированное биологически значимое соединение, содержащее непредельную группу акриламидного типа, обладающую высоким сродством к мономеру и сшивающему агенту, что позволяет проводить их эффективную сополимеризацию;
D - компоненты среды проведения фотоиндуцируемой полимеризации;
Е - воду,
где a, b, c, d, e - процентное содержание (X) каждого компонента в композиции (X=m/v•100% для твердых веществ и X=v/v•100% для жидких веществ),
включающая
мономер (А), составляющий основу формируемого геля, представляющий собой производное непредельной карбоновой кислоты;
сшивающий агент (В), представляющий собой водорастворимое производное непредельной карбоновой кислоты;
модифицированное биологически значимое соединение (С), содержащее непредельную группу акриламидного типа, обладающую высоким сродством к мономеру и сшивающему агенту, что позволяет проводить их эффективную сополимеризацию;
водную среду для проведения фотоиндуцируемой полимеризации (компоненты D и Е),
причем
в качестве мономеров (А) используют акриламид, метакриламид, N-[тpиc(гидpoкcимeтил)мeтил]aкpилaмид, 2-гидроксиэтилметакрилат по отдельности или в смеси;
в качестве сшивающего агента (В) используют N,N'-метиленбисакриламид, N, N'-этиленбисметакриламид, N,N'-(1,2-дигидроксиэтилен)бисакриламид, полиэтиленгликольдиакрилат по отдельности или в смеси;
общее содержание мономера и сшивающего агента в исходном составе композиции (а+b) лежит в интервале от 3 до 40%, а соотношение мономера и сшивающего агента (а/b) находится в пределах 97:3-60:40 (3<[b/(a+b)]<40%);
использование вышеприведенных мономеров и сшивающих агентов в различных сочетаниях и указанных соотношениях позволяет получать гидрогели с величиной пор, оптимальной для функционирования иммобилизованных биологически значимых макромолекул;
в качестве иммобилизуемого модифицированного биологически значимого соединения (С) с содержанием (с) от 0,0001 до 10% используют
или производные олигонуклеотидов общей формулы I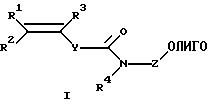
где ОЛИГО - олигонуклеотид;
R1, R2, R3 - Н, алкил C1-C6, Ph, РhСН2-;
Z - (СН2)nСН(СН2OН)СН2OХ, где n=1-6; или (СН2)п-ОХ, где n=2-6;
Х - фосфодиэфирная группа, связывающая непредельный фрагмент с 5'- и/или 3'-концом олигонуклеотида;
R4 - Н, (СН2)nОН, где n=2-6;
Y - (p-С6Н4)n, где n=0-2;
или новые производные ДНК общей формулы II
5'-X-O-ДНК-3'-O-Z (II),
где ДНК - фрагмент ДНК,
Х - Н или Н2РО3, Z - -CO-Y-CR1=CR2R3
или
Х - -CO-Y-CR1=CR2R3, Z - Н или Н2РО3,
R1, R2, R3 - Н, алкил C1-С6, Ph, PhCH2-;
Y - (р-С6H4)п, где n=0-2,
или общей формулы III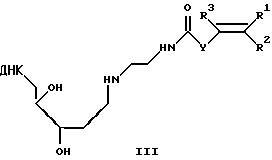
где ДНК - фрагмент ДНК;
R1, R2, R3 - Н, алкил C1-С6, Ph, PhCH2-;
Y - (р-С6Н4)n, где n=0-2,
или общей формулы IV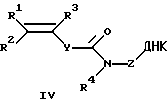
где ДНК - фрагмент ДНК;
R1, R2, R3 - Н, алкил C1-С6, Ph, РhСН2-;
Y - (р-С6Н4)n, где n=0-2;
R4 - Н, (СН2)nОН, где n=2-6;
Z - -(СН2)nСН(СН2OН)СН2OХ, где n=1-6, или -(СH2)nОХ, где n=2-6;
Х - фосфодиэфирная группа, связывающая непредельный фрагмент с 5'- и/или 3'-концом фрагмента ДНК,
или новые производные белка общей формулы V
где R1, R2, R3 - Н, алкил C1-С6, Ph, PhCH2-;
X - NH, О, CH2, S;
Y - (р-С6Н4)n, где n=0-2;
R - (CH2)n, (СН2СН2O)n, n=1-20,
или общей формулы VI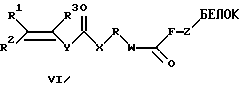
где R1, R2, R3 - Н, алкил C1-С6, Ph, РhСН2-;
Y - (р-С6Н4)n, где n=0-2;
X - NH, O, S, CH2;
R - (CH2)n, (CH2CH2O)n, n=1-20;
W - NH, O, CH2;
F - (CH2)n, n=1, 2;
Z - NH, S,
или общей формулы VII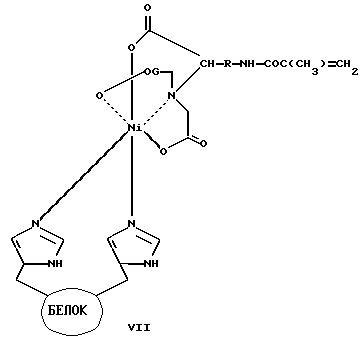
где R - (CH2)n, (CH2CH2O)n, n=1-20,
в качестве компонентов (D) водной среды проведения фотоиндуиируемой полимеризации используют N,N-диметилформамид и диметилсульфоксид как водорастворимые высококипящие органические соединения или глицерин, сахарозу и поливиниловый спирт как водорастворимые полигидроксильные соединения с содержанием вышеуказанных компонентов от 0 до 90%.
Изобретением предлагается носитель на основе пористого стекла (CPG) следующего строения: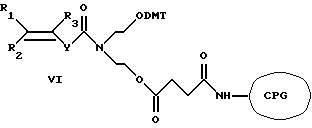
где R1, R2 - Н, алкил C1-С6, Ph, РhСН2-;
R3 - алкил C1-С6;
Y - (p-С6Н4)n, где n=0-2,
способ получения указанного носителя путем ацилирования аминированного пористого стекла
и способ получения модифицированных синтетических олигонуклеотидов формулы I путем введения остатка непредельной кислоты по 3'-концу олигонуклеотида в условиях автоматического твердофазного синтеза с использованием предлагаемого данным изобретением носителя.
Изобретением предлагаются способы получения модифицированных фрагментов ДНК
общей формулы II путем ацилирования фрагментов ДНК ангидридами непредельных кислот;
общей формулы III путем восстановительного аминирования апуринизованной ДНК с последующим ацилированием аминопроизводного активированными эфирами непредельных кислот;
общей формулы IV путем использования в ПЦР-амплификации синтетического праймера, несущего на 5'- или 3'-конце непредельную группу.
Изобретением предлагаются способы получения модифицированных белков общей формулы V путем ацилирования свободных аминогрупп белка активированными эфирами непредельных кислот следующего строения: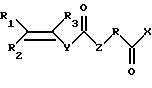
где R1, R2, R3 - Н, алкил C1-С6, Ph, PhCH2-;
Y - (p-С6Н4)n, где n=0-2;
Z - NH, O, CH2, S;
R - (CH2)n, (CH2CH2O)n, где n=1-20;
Х - сукцинимидоокси-, n-нитрофенокси-, пентафторфенокси- или любая другая акцепторная хорошая уходящая группа;
общей формулы VI путем алкилирования сульфгидрильной или аминогруппы белка производными α,β-непредельных и α-галогенкарбонильных соединений следующего строения:
где R1, R2, R3 - Н, алкил C1-С6, Ph, PhCH2-;
Y - (p-С6Н4)n, где n=0-2;
Z - NH, O, S, CH2;
R - (CH2)n, (CH2CH2O)n, где n=1-20;
W - NH, O, CH2;
Z - галогенометил, винил или любой другой фрагмент, содержащий активную кратную связь,
общей формулы VII путем обработки рекомбинантного белка, содержащего концевой His-6 участок, метакриламидными производными нитрилотриуксусной кислоты общей формулы
CH2=C(Me)-CO-NH-R-CH(COOH)-
N(CH2COOH)2,
где R - (CH2)n, (CH2CH2O)n, n=1-20,
в присутствии солей Ni(II).
Изобретение предлагает биочип, включающий подложку, предварительно обработанную кремнийорганическим соединением для ковалентного связывания элементов биочипа с поверхностью, и дискретные гелевые элементы, образующиеся в результате фотоиндуцируемой сополимеризации компонентов композиции, предложенной данным изобретением, причем в качестве кремнийорганического соединения используют 3-триметоксисилилпропилметакрилат, N-(3-триметоксисилилпропил)метакриламид, N-(3-тpимeтoкcиcилилпpoпил)aкpилaмид, 3-глицидилoкcипpoпилтpимeтoкcиcилaн.
Изобретение также предлагает способ изготовления биочипа, заключающийся в том, что предлагаемую данным изобретением композицию наносят в виде микрокапель на подложку, обработанную вышеуказанным кремнийорганическим соединением, выдерживают и полимеризуют в бескислородной инертной атмосфере под действием УФ-излучения (λ≥312 нм), полученный биочип отмывают от компонентов, не принявших участия в полимеризации.
Нанесение композиции на подложку осуществляется при помощи автоматического устройства (робота), снабженного одним или несколькими микродиспенсерами, образующими регулярную структуру.
Одну или несколько подложек с нанесенными на них каплями композиции перед полимеризацией и в процессе полимеризации размещают в герметичном контейнере в атмосфере одного из газов (N2, Аr или СО2) с контролируемой влажностью.
Изобретением также предлагается биочип для проведения полимеразной цепной реакции (ПЦР), в котором в качестве иммобилизованных биологически значимых макромолекул используют синтетические олигонуклеотиды (праймеры).
Изобретение предлагает способ проведения ПЦР на биочипе путем
- инкубации биочипа при постоянной температуре с гибридизационным раствором, содержащим исследуемые образцы нуклеиновых кислот, для их гибридизации с иммобилизованными праймерами,
- инкубации биочипа, содержащего гибридизованные с иммобилизованными праймерами нуклеиновые кислоты, с амплификационным раствором, содержащим прямой (F) и обратный (R) праймеры, при постоянной температуре,
- замены амплификационного раствора вне гелевых элементов биочипа гидрофобной жидкостью (минеральным маслом), которая полностью изолирует ячейки чипа друг от друга, и
- инкубации биочипа в условиях циклических изменений температуры, обеспечивающих осуществление ПЦР-амплификации.
Раскрытие сущности изобретения
Изготовление биочипов с использованием метода фотоиндуцируемой полимеризации на основе предлагаемых композиций включает следующие этапы:
- подготовку композиций и подложек для изготовления микрочипа;
- нанесение микрокапель композиций на подложку;
- выдерживание нанесенных на подложку микрокапель композиции в атмосфере инертного газа;
- полимеризацию в атмосфере инертного газа под действием УФ-излучения;
- отмывку полученного биочипа.
При подготовке композиций для изготовления биочипа все компоненты тщательно смешивают до образования гомогенного раствора, переносят в микротитровальные планшеты для использования далее в качестве источника растворов при нанесении на подложку (подложки) с помощью автоматического устройства (робота), снабженного одним или несколькими микродиспенсерами.
В зависимости от содержания полигидроксильного (или высококипящего) водорастворимого компонента D получают композиции различной вязкости, позволяющие варьировать размер гелевых элементов биочипа при фиксированном диаметре пина робота. Кроме того, соотношение компонентов D композиции может оказывать влияние на сохранение активности иммобилизуемого биологически значимого соединения.
Приготовленные композиции хранятся при -21oС не менее 1 года.
В качестве подложек могут быть использованы стандартные препаратные стекла, а также подложки иных типов, например кварцевые, из оксидированного кремния и т.д.
Подготовка стекла для нанесения композиции для полимеризации включает стадию очистки последовательной обработкой концентрированной щелочью, кислотой и стадию химической модификации с помощью растворов одного из нижеперечисленных кремнийорганических соединений (3-триметоксисилилпропилметакрилата, 3-триметоксисилилпропилметакриламида, 3-триметоксисилилпропилакриламида, 3-глицидилоксипропилтриметоксисилана) в органических растворителях.
Модификация поверхности стекла кремнийорганическими соединениями позволяет получать биочипы, которые можно использовать в интервале рН от 2 до 12 и интервале температур от -10 до +100oС.
Формирование структуры массива ячеек биочипа осуществляют путем нанесения на подготовленную подложку регулярного массива микрокапель полимеризационной композиции. При этом в общем случае каждая микрокапля содержит макромолекулы одного типа. В зависимости от вязкости и других свойств полимеризационных композиций, а также от желаемого размера ячеек биочипа для нанесения используют роботы с микродиспенсерами разных типов. В частности, в случае вязких растворов с содержанием глицерина свыше 40% для этих целей используют робот, снабженный микродиспенсерами стержневого (игольчатого) типа. В зависимости от диаметра стержня диспенсера получают капли (и, следовательно, гелевые ячейки) разного размера.
Затем подложки с нанесенными микрокаллями композиций помещают в герметичный контейнер на срок не менее 2 ч, который затем насыщают осушенным инертным газом (азотом, аргоном, углекислым газом).
Инициирование процесса полимеризации осуществляют УФ-облучением с λ≥312 нм в атмосфере инертного газа. Использование указанной длины волны для проведения полимеризации устраняет деструкцию биологически значимых макромолекул.
Полученные биочипы отмывают сначала в буферных растворах, затем в дистиллированной воде и высушивают на воздухе при 25oС.
Различные сочетания компонентов композиций позволяют получать биочипы, пористость элементов которых может варьироваться в широких пределах и позволяет использовать их для многих приложений, в частности для проведения полимеразной цепной реакции (ПЦР), эффективность осуществления которой на биочипе определяется такими факторами, как пористость геля, обеспечивающая быстроту диффузии фрагментов ДНК и ферментов, стабильность гелевых ячеек в широком диапазоне быстро меняющихся температур, доступность и эффективность участия иммобилизованного олигонуклеотида в гибридизации и аллелеспецифичной полимеразной реакции его удлинения, а также для исследования взаимодействия в системах олигонуклеотид-олигонуклеотид, ДНК-олигонуклеотид, белок-белок, белок-ДНК и др.
Предлагаемый биочип для проведения полимеразной цепной реакции и способ ее реализации позволяют осуществлять ПЦР внутри дискретных гелевых элементов, разделенных гидрофобной жидкостью (минеральным маслом), так что каждый гелевый элемент выступает в роли микропробирки.
Предлагаемое изобретение иллюстрируется следующими примерами и чертежами.
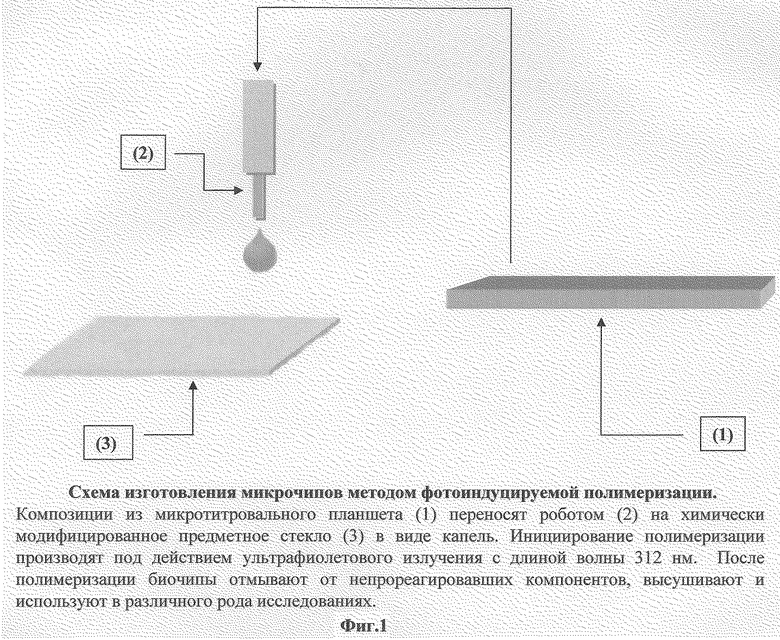
Фиг.1 изображает процесс изготовления биочипа (пример 1).
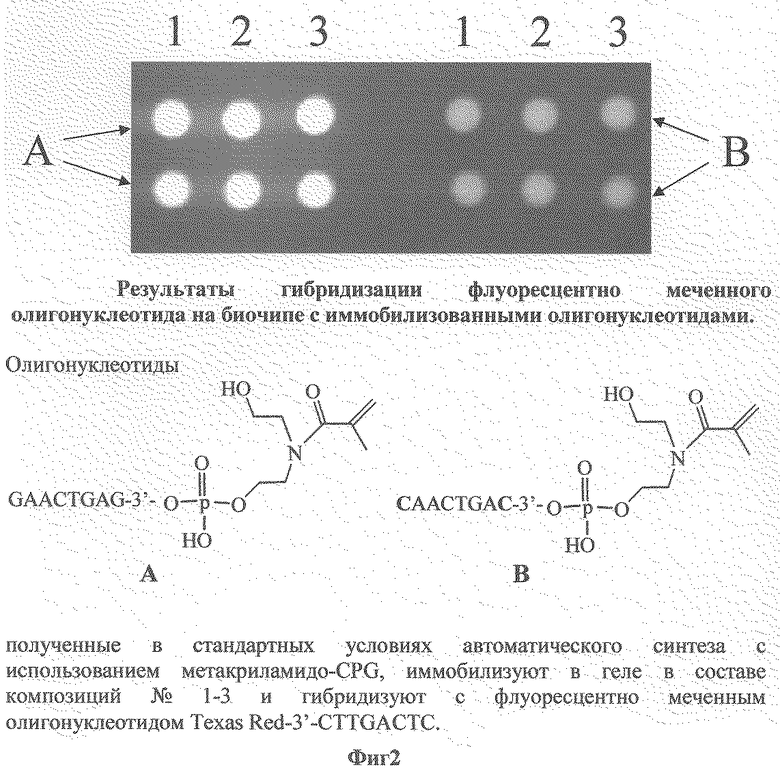
Фиг. 2 представляет результаты гибридизации на биочипе олигонуклеотида, меченного флуоресцентным красителем Texas Red, с иммобилизованными олигонуклеотидами: полностью комплементарным и содержащим две замены, полученными твердофазным синтезом с использованием в качестве носителя модифицированного стекла, приготовленного по методике, приведенной в примере 2. Олигонуклеотиды А и В в составе композиций 1, 2 и 3 нанесены на стекло (по две ячейки каждая) и далее подвергнуты полимеризации. Флуоресценция (светлые пятна) после гибридизации наблюдается в тех ячейках биочипа, которые содержат иммобилизованный олигонуклеотид А, полностью комплементарный флуоресцентно меченному.
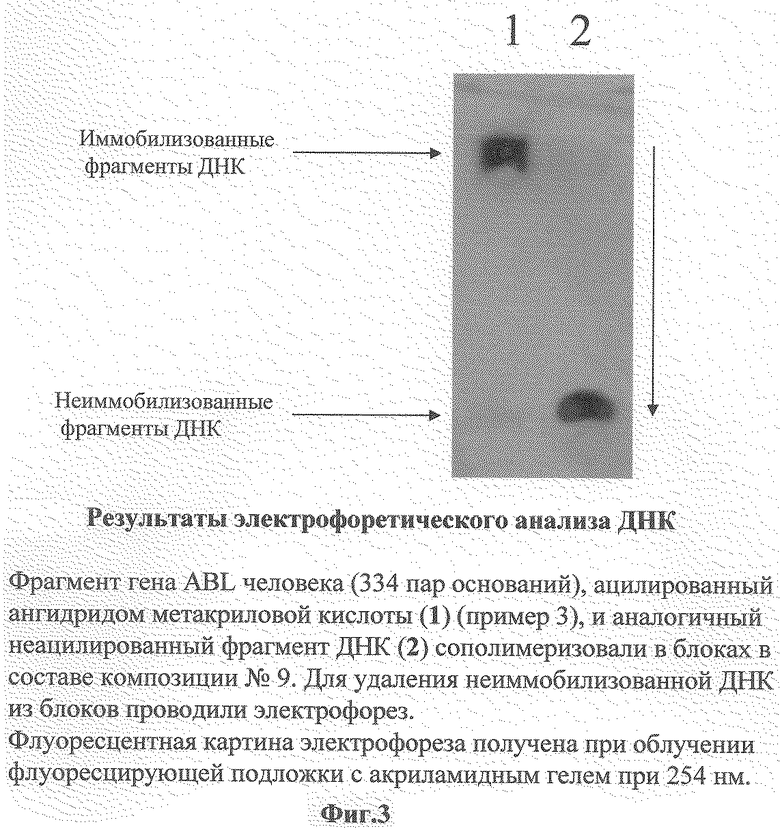
Фиг. 3 показывает результаты электрофоретического анализа ДНК (фрагмент гена ABL человека, 334 пары оснований) после ацилирования метакриловым ангидридом (пример 3) и сополимеризации с акриламидом и N,N'-метиленбисакриламидом (композиция 9) (1) и исходной ДНК (2).
Флуоресцентная картина электрофореза получена при облучении флуоресцирующей подложки с полиакриламидным гелем при 254 нм.
Фиг. 4 показывает результаты гибридизации на биочипе флуоресцентно меченного зонда с фрагментами ДНК, модифицированными по методикам, приведенным в примерах 3-5, и иммобилизованными в геле путем сополимеризации. Ряд 1 служит контролем, ячейки этого ряда не содержат иммобилизованной ДНК, т.к. в состав композиции входит немодифицированный фрагмент ДНК. Ячейки в рядах 2-4 (в каждом ряду по 6 одинаковых ячеек) получены нанесением композиций с модифицированными фрагментами ДНК.
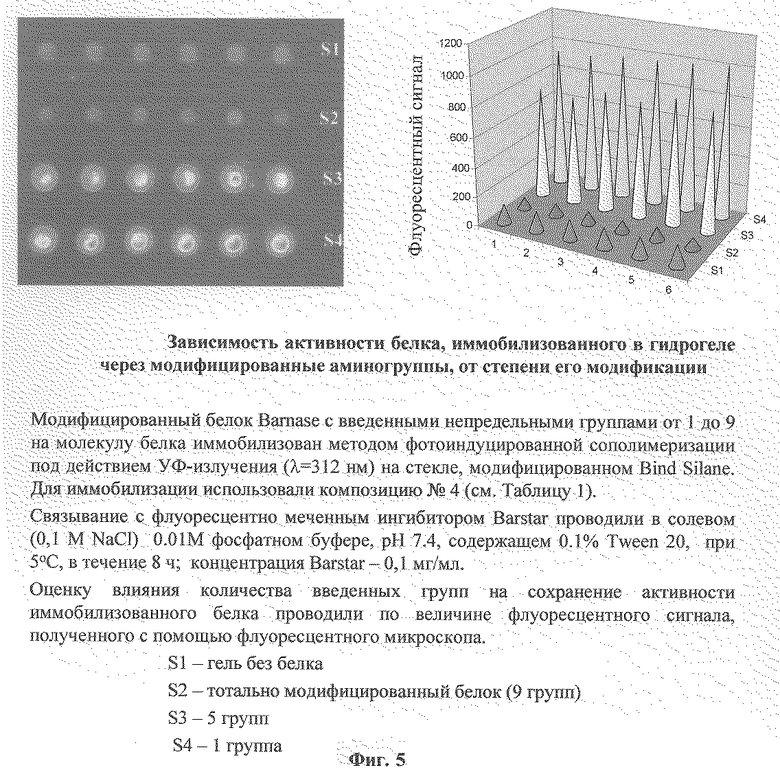
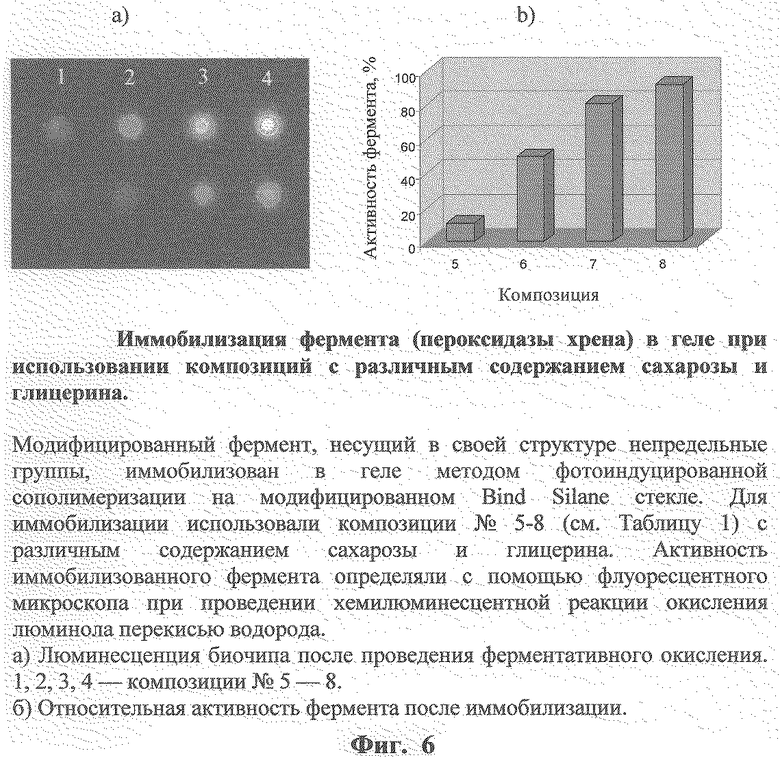
Фиг. 5 иллюстрирует зависимость активности иммобилизованного на биочипе белка Barnase от степени его модификации (пример 6).
Фиг.6 иллюстрирует влияние соотношения компонентов композиции на сохранение ферментативной активности иммобилизуемого белка.
Фиг. 7 иллюстрирует использование ПЦР на биочипе, в котором амплификация происходит как над, так и внутри множества гелевых ячеек микрочипа (пример 10).
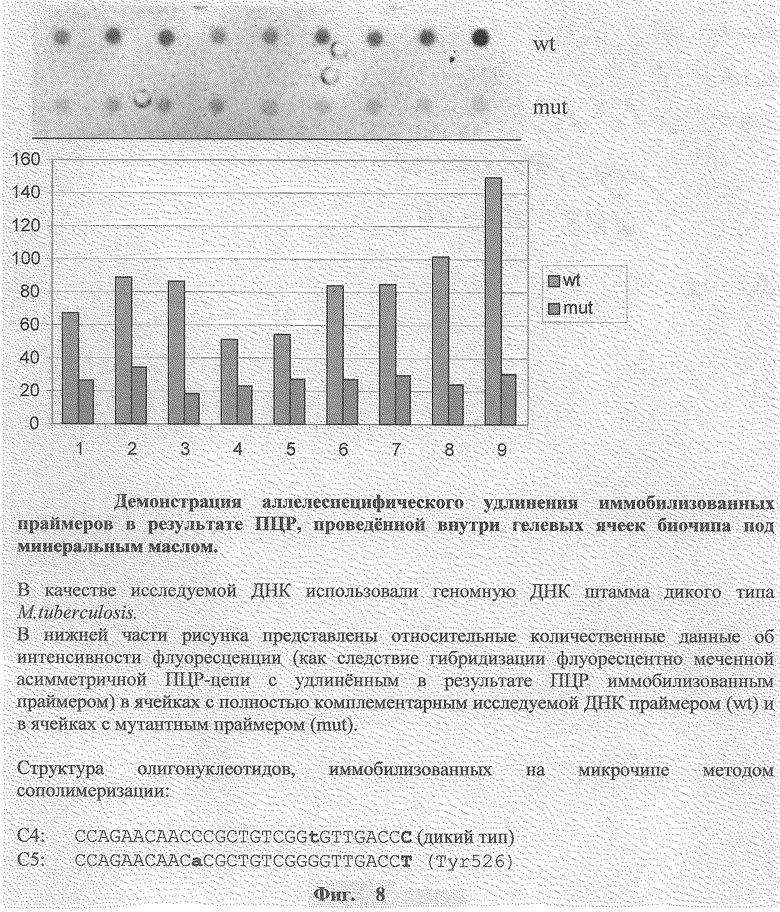
Фиг. 8 иллюстрирует использование ПЦР на биочипе, в котором амплификация происходит внутри множества окруженных гидрофобной жидкостью гелевых ячеек (пример 10).
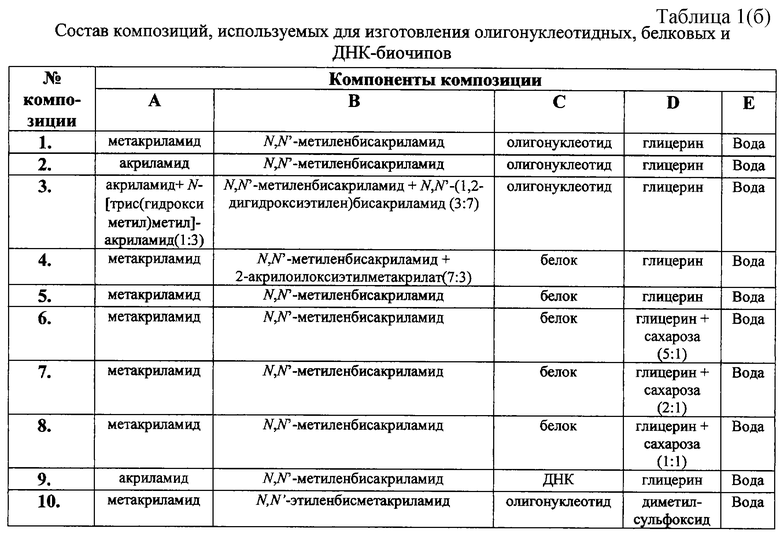
Таблица 1 (а и б) содержит данные о различных по составу композициях.
Примеры
1. Изготовление биочипов (пример 1).
I. Приготовление композиции для гелевых биочипов.
II. Нанесение композиции на подложку и полимеризация.
2. Синтез носителя метакриламидо-CPG (пример 2).
3. Получение ДНК общей формулы II- IV (примеры 3-5).
4. Получение белка общей формулы V-VII (примеры 6-9).
5. Проведение ПЦР на биочипе (пример 10).
Пример 1. Изготовление биочипов.
I. Приготовление композиции для гелевых биочипов.
Для приготовления биочипов используют различные по составу композиции в зависимости от целей эксперимента (таблица 1). В качестве примера приведено приготовление одной из них.
К раствору метакриламида (А) и N,N'-метиленбисакриламида (В) в 0,2 М фосфатном буфере, содержащем 0.15 М NaCl (PBS), рН 7,2 (1.25 мкл, содержание компонентов А и В (а+b)=40% (m/v), соотношение а:b=19:1), прибавляют раствор модифицированного олигонуклеотида или фрагмента ДНК (1-200 пмоль/мкл в PBS, рН 7.2) или модифицированного белка (0.1-10 мг/мл в PBS, рН 7.2) и глицерин (6.45 мкл). Смесь тщательно перемешивают и переносят в микротитровальные планшеты.
II. Нанесение композиции на подложку и полимеризация.
Предметные стекла (Corning 2947 Micro Slides, Corning Glass Works, Corning, NY), используемые для изготовления биочипов, обрабатывают последовательно раствором щелочи, водой, серной кислотой, водой, высушивают, обрабатывают 3-триметоксисилилпропилметакрилатом (Bind Silane), затем отмывают от избытка реагента этанолом, водой и высушивают на воздухе. Композицию наносят с помощью шприца или пина робота Affymetrix 417 Arrayer (Affymetrix, Santa Clara, CA) (фиг.1). Полученный массив капель полимеризуют под действием ультрафиолетового света (λ=312 нм, 40 мин, Т=37oС) в герметичном контейнере в бескислородной, инертной атмосфере с контролируемой влажностью. Затем биочипы отмывают в фосфатном солевом буфере (0.01М, рН 7.0), содержащем 0.1% Tween 20, и в воде и используют для проведения различных типов анализа.
Пример 2. Синтез носителя метакриламидо-CPG.
К раствору N-(2-гидроксиэтил)-N-{2-[ди(4-метоксифенил)фенилметокси]этил} метакриламида (0.143 г, 0.3 ммоль) в сухом пиридине (3 мл) добавляют янтарный ангидрид (0.060 г, 0.3 ммоль) и 4-(N,N-диметиламино)пиридин (DMAP, 0.037 г, 0.3 ммоль). Смесь оставляют на 12 ч при комнатной температуре. К раствору добавляют насыщенный раствор NaHCO3 (2 мл). Растворитель упаривают в вакууме. Осадок растворяют в этилацетате (5 мл) и органический слой последовательно промывают насыщенным раствором NаНСО3, несколько раз водой, сушат безводным Na2SO4 и фильтруют. Растворитель упаривают и остаток (бесцветный сироп) растворяют в сухом пиридине (30 мл). К раствору добавляют 2,2'-дипиридилдисульфид (0.060 г, 0.3 ммоль), трифенилфосфин (0.079 г, 0.3 ммоль) и аминированное пористое стекло LCA CPG (1.00 г). Суспензию концентрируют в вакууме до объема 15 мл и выдерживают 24 ч при комнатной температуре с периодическим встряхиванием. Суспензию фильтруют через стеклянный фильтр и осадок последовательно промывают несколько раз сухим пиридином. К промытому осадку добавляют "кэпирующий" раствор (уксусный ангидрид/DМАР/2,6-лутидин/ацетонитрил) (10 мл) и оставляют на 5 мин. Осадок последовательно промывают несколько раз сухим пиридином, ацетоном и диэтиловым эфиром. Получают модифицированный носитель (метакриламидо-CPG) с концентрацией ненасыщенных групп 33.7 мкмоль/г (тест на тритильную группу).
На фиг. 2 представлены результаты гибридизация на биочипе олигонуклеотида, меченного флуоресцентным красителем Texas Red, с иммобилизованными олигонуклеотидами: полностью комплементарным и содержащим две замены, полученными твердофазным синтезом с использованием в качестве носителя модифицированного стекла, приготовленного по приведенной выше методике.
Пример 3. O-Ацилирование фрагментов ДНК ангидридами непредельных кислот.
Фрагмент ДНК (10 пмоль) растворяют в H2O (50 мкл), охлаждают до 5oС и приливают раствор ангидрида метакриловой кислоты (15 мкл) в N,N-диметилформамиде (DMF, 100 мкл), а затем небольшими порциями добавляют раствор гидроксида натрия, поддерживая рН 7. После 15 мин к реакционной смеси добавляют Н2О (500 мкл) и последовательным добавлением нескольких порций безводного бутанола объем реакционной среды доводят до 50 мкл. Модифицированный фрагмент ДНК высаживают раствором перхлората лития в ацетоне (2%, 1000 мкл) при -21oС, центрифугируют и отмывают ацетоном.
На фиг. 3 представлен результат проведенной сополимеризационной иммобилизации с последующим электрофорезом фрагмента ДНК, полученного по приведенной выше методике. В качестве контроля использован аналогичный неацилированный фрагмент ДНК.
Фрагменты ДНК были иммобилизованы методом сополимеризации в акриламидном геле (композиция 9, таблица 1) в виде прямоугольных блоков. Далее гель с образцами подвергали электрофорезу для удаления неиммобилизованных олигонуклеотидов из гелевых блоков. Из флуоресцентной картины, полученной после проведения электрофореза, видно, что содержащий непредельную группу фрагмент ДНК (1) полностью подвергается сополимеризации, в то время как фрагмент (2) в ней не участвует.
Пример 4. Восстановительное аминирование апуринизованной ДНК с последующим ацилированием активированным эфиром непредельной кислоты.
К раствору олигонуклеотида или фрагмента ДНК (39.3 нмоль) в Н2О (15 мкл) прибавляют муравьиную кислоту (80%, 20 мкл) и выдерживают при комнатной температуре 1 ч. Затем олигонуклеотидный материал высаживают раствором перхлората лития в ацетоне (2%, 1000 мкл), отмывают ацетоном и высушивают. К апуринизованной ДНК приливают раствор 0.5 М гидрохлорида этилендиамина (50 мкл, рН 7.4) и выдерживают 3 ч при 37oС. Затем добавляют свежеприготовленный раствор борогидрида натрия в воде (15 мкл, 0.1 М) и через 30 мин - раствор 20% гидрохлорида этилендиамина (14.75 мкл). Олигонуклеотидный материал высаживают раствором перхлората лития в ацетоне (2%, 1000 мкл), отмывают ацетоном и высушивают. Осадок растворяют в боратном буфере (50 мкл, рН 9.3) и приливают раствор n-нитрофенилового эфира метакриловой кислоты (0.001 г) в DMF (100 мкл). Раствор выдерживают 12 ч при 35oС. Модифицированный фрагмент ДНК очищают гель-фильтрацией.
Пример 5. Получение модифицированных фрагментов ДНК с использованием в ПЦР-амплификации синтетического праймера, несущего на 5'- или 3'-конце ненасыщенную группу.
Фрагмент ДНК (334 пары оснований), содержащий метакриламидную группу (МАА), получают при ПЦР-амплификации кДНК гена ABL человека, клонированного в вектор pGEM-T Easy Vector (Promega, Madison, WI). ПЦР реакцию проводят с использованием Taq ДНК-полимеразы и праймеров 5'-МАА-Аb15 (прямой, F) и А113 (обратный, R). Цикл ПЦР: денатурация (45 сек, 94oС), отжиг (60 сек, 57oС) и удлинение цепи (45 сек, 72oС). Через 35 ПЦР циклов продукты очищают электрофорезом в геле и растворяют в воде.
На фиг. 4 приведены результаты гибридизации на биочипе с иммобилизованными модифицированными фрагментами ДНК, полученными по методикам, приведенным в примерах 3-5. Модифицированные фрагменты ДНК в составе композиции 9 (таблица 1) используют для изготовления биочипа и проводят гибридизацию иммобилизованной ДНК с флуоресцентно меченным олигонуклеотидным зондом. Флуоресценция (светлые пятна) после гибридизации наблюдается в тех ячейках биочипа, которые содержат иммобилизованную ДНК (ряды 2, 3, 4). Ряд 1 содержит служащие контролем гелевые элементы, образовавшиеся в результате полимеризации композиции 9, содержащей тот же фрагмент ДНК, полученный при ПЦР-амплификации с использованием немодифицированных праймеров.
Пример 6. Ацилирование белков по аминогруппам.
В качестве примера приведена методика модификации белка Barnase.
К 100 мкл раствора Bamase (С=1 мг/мл) в 0.01 М боратном буфере (рН 8,3) добавляют 20 мкл раствора эфира 6-метакрилоиламиногексановой кислоты и N-гидроксисукцинимида (С=0,1 мг/мл) в DMF. Реакционную смесь перемешивают 30 мин при комнатной температуре. Затем проводят очистку полученного модифицированного белка от низкомолекулярных продуктов реакции и DMF на микроконцентраторах Nanosep 3K Omega, вымывая белок боратным буфером, рН 8,3. Конечная концентрация очищенного белка в 100 мкл буферного раствора, определенная спектрофотометрически, составляла 0,9 мг/мл. Полученный модифицированный белок по данным MALDI-MS содержал одну введенную 6-метакрилоиламиногексаноильную группу.
Изменение соотношения белок : модифицирующий агент позволяет получать белок различной степени модификации. Фиг.5 иллюстрирует зависимость активности иммобилизованной на биочипе Barnase от степени модификации белка.
Пример 7. Алкилирование белков по SH группам.
В качестве примера приведена методика алкилирования аспартатаминотрансферазы из цитозоля печени кур 2-акрилоилоксиэтилметакрилатом.
К раствору аспартатаминотрансферазы (9 мкл, 3.33 мг/мл) в буфере (25 мМ HEPES, рН 8.0, 30 мМ КСl, 2 мМ MgCl2), охлажденному до 5oС, приливают раствор 2-акрилоилоксиэтилметакрилата (0.012 г, 65.2 мкмоль) в DMF (3 мкл). Гомогенный раствор выдерживают 1 ч, а затем модифицированный белок очищают на мембранных фильтрах. Эффективность модификации белка контролировали электрофоретическим методом (аналогично приведенному на фиг.3). Модифицированный белок используют для изготовления белковых биочипов.
Пример 8. Синтез 2-акрилоилоксиэтилметакрилата
К раствору 2-гидроксиэтилметакрилата (1.070 г, 8.22 ммоль) и триэтиламина (0.832 г, 8.22 ммоль) в тетрагидрофуране (25 мл) добавляют при интенсивном перемешивании акрилоилхлорид (0.744 г, 8.22 ммоль). Смесь перемешивают при комнатной температуре 1 ч, выпавший осадок отфильтровывают и фильтрат концентрируют. К полученному остатку (масло) приливают воду (30 мл) и интенсивно встряхивают. Водный слой отделяют, приливают этилацетат (15 мл), органический слой высушивают сульфатом натрия и растворитель упаривают в вакууме. Выход 81%, масло.
1Н ЯМР (DMSO-d6), δ: 1.87 (с, 3Н, СН3), 3.34 (м, 2Н, O-СН2), 3.37 (м, 2Н, -СН2-O), 5.68 (псевдо-с, 1Н, СН2=); 6.02 (псевдо-с, 1Н, СН2=); 5.96 (дд, J1= 10.26 Гц, J2=1.87 Гц, 1Н, СН2'=); 6.33 (дд, J1=17.13 Гц, J2=1.55 Гц, 1Н, СН2'=); 6.19 (дд, J1=17.13 Гц, J2=10.28 Гц, 1Н, =СН-).
Рассчитано для C9H12O4: С 58.70%; Н 6.52%. Найдено: С 58.63%; Н 6.64%.
Пример 9. Синтез N-(5-метакрилоиламино-1-карбоксипентил)иминодиуксусной кислоты.
К раствору N-(5-амино-1-карбоксипентил)иминодиуксусной кислоты (1.353 г, 5.16 ммоля) в воде (10 мл) добавляют гидрокарбонат натрия (0.563 г, 6.71 ммоля) и раствор 4-нитрофенилметакрилата (1.069 г, 5.16 ммоля) в диметилфорамиде (15 мл). Смесь перемешивают 12 ч при комнатной температуре. К раствору добавляют соляную кислоту небольшими порциями до рН 3, охлаждают до 5oС и выдерживают 1 ч. Выпавший осадок отфильтровывают на холоду, фильтрат упаривают в вакууме. Остаток промывают диэтиловым эфиром (3 x 20 мл) и перекристаллизовывают из этанола. Выход 1.210 г (71%), Тразл~170oС.
1Н ЯМР (ДМСО-d6), δ: 1.40-1.45 (м, 2Н, СН2), 1.54-1.59 (м, 2Н, CH2), 1.84 (с, 3Н, СН3), 1.86-1.90 (м, 2Н, СН2), 3,19 (т, J= 6.40 Гц, 2Н, СН2), 3.73 (с, 4Н, 2СН2), 3.80 (т, J=6.20 Гц, 1Н, СН), 4.84 (с, 4Н, NH, 3ОН), 5.29 (с, 1Н, -СН=); 5.61 (с, 1Н, -СН=).
Рассчитано для C14H22N2O7: С 50.90%; Н 6.71%; N, 8.48%. Найдено: С 50.93%; Н 6.80%; N 9,00%.
Полученное соединение используют для получения модифицированного белка формулы VII путем обработки рекомбинантного белка, содержащего концевой His-6 участок, в присутствии солей Ni(II).
Пример 10. Полимеразная цепная реакция (ПЦР) на биочипе.
Типичный in situ ПЦР-эксперимент проводят на биочипе в микрокамере.
На биочипе методом сополимеризации иммобилизуют в разных ячейках олигонуклеотиды, полностью соответствующие последовательности дикого типа, или олигонуклеотиды, содержащие на 3'-конце нуклеотидную замену. Стандартный ПЦР-раствор (67 мМ Tris-HCl, рН 8.6; 2.5 мМ MgCl2; 16.6 мМ (NH4)2SO4; 0.001% Triton X-100; 1 мг/мл BSA; 0.24 мМ each of dATP, dCTP, dGTP и dTTP; 2.5 U Taq ДНК-полимеразы на 30 мкл) содержит также около 105 копий геномной ДНК Mycobacterium tuberculosis, a также прямой (F) (около 1 пмоль) и меченный Texas Red no 5'-концу обратный (R) (около 10 пмоль) праймеры. Обычно проводят 35 ПЦР-циклов: 40 сек - 95oС, 60 сек - 64oС, 40 сек - 72oС. После окончания ПЦР биочип промывают раствором 0.1-0.3 М NaCl при 80oС, в результате чего только дуплексы с удлиненным в результате реакции праймером сохраняются на чипе и могут быть обнаружены под флуоресцентным микроскопом.
Результат одного из таких экспериментов показан на фиг.7.
ПЦР внутри гелевых элементов под минеральным маслом
Фрагментированную (200-300 нуклеотидов) денатурированную геномную ДНК М. tuberculosis исходно используют для гибридизации с соответствующими олигонуклеотидами на биочипе, описанном выше. Затем, после отмывки ДНК, не вступившей в гибридизацию, биочип инкубируют со стандартным ПЦР-раствором (см. выше) в течение 30 мин при 55oС. Водный раствор вне гелевых элементов замещают минеральным маслом и проводят ПЦР (30 циклов): 40 сек - 72oС, 40 сек - 95oС, 60 сек - 64oС. Вслед за завершающей стадией элонгации (10 мин - 72oС) биочип тщательно отмывают сначала хлороформом, затем раствором 0.1-0.3 М NaCl при 80oС и затем анализируют под флуоресцентным микроскопом.
На фиг.8 показан результат такого эксперимента. Можно видеть, что аллелеспецифическая ПЦР идет и в этом случае достаточно эффективно в ячейках с праймером, полностью комплементарным используемой ДНК (дикого типа, wt, см. ячейки с С4 праймером). Заметно слабее эта реакция прошла в ячейках с праймером, содержащим однонуклеотидную замену на 3'-конце (mut, C5 праймер).



Изобретение относится к композициям (К) для полимеризационной иммобилизации биологических макромолекул в гидрогелях при формировании биочипов К= аА+bВ+сС+dD+еE, включающим А - мономер на основе производных акриловой и метакриловой кислот; В - водорастворимый сшивающий агент; С - модифицированную биологическую макромолекулу, содержащую ненасыщенную группу, D - водорастворимое соединение как компонент среды проведения сополимеризации; Е - воду, где а, b, с, d, е - процентное содержание (Х) каждого компонента в композиции (Х= m/v•100% для твердых веществ и Х=v/v•100% для жидких веществ), в которой общее содержание мономера и сшивающего агента лежит в интервале 3-40% (3≤(а+b)≤(40), соотношение мономера и сшивающего агента находится в пределах 97: 3-60:40, а процентное содержание компонентов С, D и Е находится в пределах 0,0001%≤с≤10%; 0%≤d≤90%; 5%≤е≤95%, способу их приготовления, к модифицированным биологически значимым соединениям ДНК и белкам, биочипу, в котором сформированный на подложке слой ила разделен пустыми промежутками на несколько ячеек, причем каждая из ячеек может содержать либо не содержать иммобилизованные макромолекулы, а макромолекулы, иммобилизованные в разных ячейках, могут различаться по своей природе и свойствам, и двум способам проведения полимеризационно-цепной реакции на биочипе. 11 с. и 23 з.п.ф-лы, 8 ил., 2 табл.
К=аА+bВ+сС+dD+еE,
включающая А - мономер на основе производных акриловой и метакриловой кислот;
В - водорастворимый сшивающий агент;
С - модифицированная биологическая макромолекула, содержащая ненасыщенную группу;
D - водорастворимое соединение как компонент среды проведения сополимеризации;
Е - воду,
где a, b, c, d, e - процентное содержание (X) каждого компонента в композиции (X=m/v•l00% для твердых веществ и X=v/v•l00% для жидких веществ),
в которой общее содержание мономера и сшивающего агента лежит в интервале 3-40% (3≤(а+b)(40), соотношение мономера и сшивающего агента находится в пределах 97:3-60:40, а процентное содержание компонентов С, D и Е находится в пределах 0,0001%≤с≤10%; 0%≤d≤90%; 5%≤е≤95%, используемая для изготовления биочипов.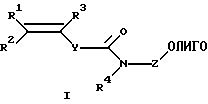
где ОЛИГО - олигонуклеотид;
R1, R2, R3=Н, алкил С1-С6, Ph, PhCН2-;
Z=(СН2)nСН(СН2ОН)СН2ОХ, где n=1-6; или (СН2)n-ОХ, где n=2-6;
Х = фосфодиэфирная группа, связывающая непредельный фрагмент с 5'- и/или 3'-концом олигонуклеотида;
R4=Н, (СН2)nОН, где n=2-6;
Y=(р-С6Н4)n, где n=0-2.
5'-X-O-ДНК-3'-O-Z II
где ДНК = фрагмент ДНК;
Х= Н или Н2РО3, Z=-СО-Y-СR1=СR2R3 или Х=-СО-Y-СR1=СR2R3, Z=Н или Н2РО3, R1, R2, R3=Н, алкил С1-С6, Ph, PhCН2-; Y=(р-С6Н4)n, где n=0-2.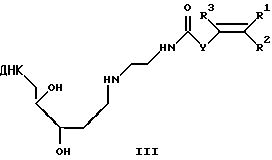
где ДНК = фрагмент ДНК;
R1, R2, R3=Н, алкил С1-С6, Ph, PhCН2-;
Y=(р-С6Н4)n, где n=0-2.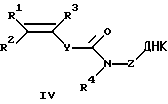
где ДНК = фрагмент ДНК;
R1, R2, R3-Н, алкил С1-С6, Ph, PhCН2-;
Y=(р-С6Н4)n, где n=0-2;
R4=Н, (СН2)nОН, где n=2-6;
Z=-(СН2)nСН(СН2ОН)СН2ОХ, где n=1-6, или -(СН2)nОХ, где n=2-6;
Х - фосфодиэфирная группа, связывающая непредельный фрагмент с 5'- и/или 3'-концом фрагмента ДНК.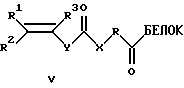
где R1, R2, R3=Н, алкил С1-С6, Ph, PhCН2-;
Х=NH, О, СН2, S;
Y=(р-С6Н4)n, где n=0-2;
R=(СН2)n, (СН2СН2О)n, где n=1-20.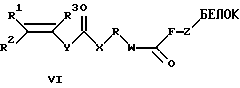
где R1, R2, R3=Н, алкил С1-С6, Ph, PhCН2-;
Y=(р-С6Н4)n, где n=0-2;
Х=NH, О, S, СН2;
R=(СН2)n, (СН2СН2О)n, где n=1-20;
W=NH, О, СН2;
F=(СН2)n, где n=1, 2;
Z=NH, S.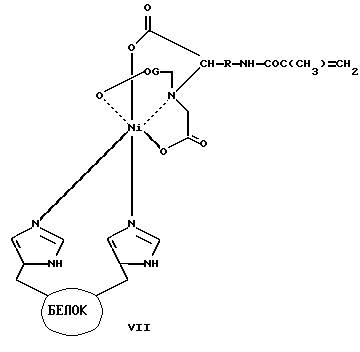
где R=(СН2)n, (СН2СН2О)n, n=1-20.
К=аА+bВ+сС+dD+еE,
включающая А - мономер на основе производных акриловой и метакриловой кислот;
В - водорастворимый сшивающий агент;
С - модифицированная биологическая макромолекула, содержащая ненасыщенную группу;
D - водорастворимое соединение как компонент среды проведения сополимеризации;
Е - воду,
где a, b, c, d, e - процентное содержание (X) каждого компонента в композиции (X=m/v•l00% для твердых веществ и X=v/v•l00% для жидких веществ),
в которой общее содержание мономера и сшивающего агента лежит в интервале 3-40% (3≤(а+b)≤40), соотношение мономера и сшивающего агента находится в пределах 97:3-60:40, а процентное содержание компонентов С, D и Е находится в пределах 0,0001%≤с≤10%; 0%≤d≤90%; 5%≤е≤95%, используемая для изготовления биочипов.
5'-X-O-ДНК-3'-O-Z, II
где ДНК = фрагмент ДНК;
Х= Н или Н2РО3, Z=-СО-Y-СR1=СR2R3, где R1, R2, R3=Н, алкил С1-С6, Ph, PhCH2-; или Х=-СО-Y-СR1=СR2R3, Z=Н или Н2РО3, где R1, R2, R3=Н, алкил С1-С6, Ph, PhCН2-;
Y=(р-С6Н4)n, где n=0-2,
получаемые путем прямого ацилирования фрагментов ДНК ангидридами непредельных кислот,
или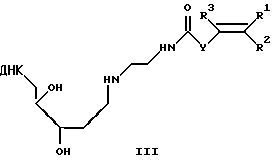
где ДНК = фрагмент ДНК;
R1, R2, R3=Н, алкил С1-С6, Ph, PhCH2-;
Y=(р-С6Н4)n, где n=0-2,
получаемые путем восстановительного аминирования апуринизованной ДНК с последующим ацилированием аминопроизводного активированными эфирами ненасыщенных кислот,
или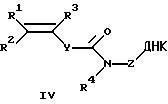
где ДНК = фрагмент ДНК;
R1, R2, R3=Н, алкил С1-С6, Ph, PhCH2-;
Y=(р-С6Н4)n, где n=0-2;
R4=Н, (СН2)nОН, где n=2-6;
Z=-(СН2)nСН(СН2ОН)СН2ОХ, где n=1-6, или (СН2)n-ОХ, где n=2-6;
Х - фосфодиэфирная группа, связывающая непредельный фрагмент с 5'- и/или 3'-концом фрагмента ДНК,
получаемые путем ПЦР-амплификации с использованием синтетического праймера, несущего на 5'- или 3'-конце ненасыщенную группу.
где R1, R2, R3=Н, алкил С1-С6, Ph, PhCH2-;
Х=NH, О, СН2, S;
Y=(р-С6Н4)n, где n=0-2;
R=(СН2)n, (СН2СН2О)n, где n=1-20,
получаемые путем ацилирования свободных аминогрупп белка активированными эфирами непредельных кислот,
или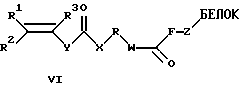
где R1, R2, R3=Н, алкил С1-С6, Ph, PhCH2-;
Y=(р-С6Н4)n, где n=0-2;
Х=NH, O, S, СН2;
R=(СН2)n, (СН2СН2О)n, где n=1-20;
W=NH, О, СН2;
F=(СН2)n, где n=1, 2;
Z=NH, S,
получаемые путем алкилирования сульфгидрильной или аминогруппы белка производными α,β-непредельных и α-галогенкарбонильных соединений,
или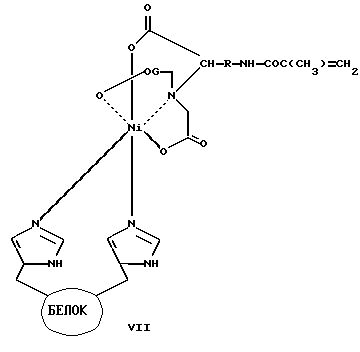
где R=(СН2)n, (СН2СН2О)n, где n=1-20,
путем обработки рекомбинантного белка, содержащего концевой His-6 участок, метакриламидными производными нитрилотриуксусной кислоты в присутствии солей Ni(II).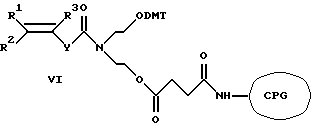
где R1, R2=Н, алкил С1-С6, Ph, PhCH2-;
R3 = алкил С1-С6;
Y=(р-С6Н4)n, где n=0-2,
в качестве носителя для введения остатка непредельной кислоты по 3'-концу олигонуклеотидов формулы I по п.6 в условиях автоматического твердофазного синтеза.
где R1, R2, R3=Н, алкил С1-С6, Ph, PhCH2-;
Y=(р-С6Н4)n, где n=0-2;
Z=NH, О, СН2, S;
R=(СН2)n, (СН2СН2О)n, где n=1-20;
Х = сукцинимидоокси-, п-нитрофенокси-, пентафторфенокси- или любая другая акцепторная хорошая уходящая группа в качестве модифицирующего агента для получения белка формулы V.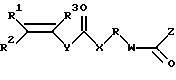
где R1, R2, R3=Н, алкил С1-С6, Ph, PhCH2-;
Y=(р-С6Н4)n, где n=0-2;
Х=NH, О, S, СН2;
R=(СН2)n, (СН2СН2О)n, где n=1-20;
W=NH, О, СН2;
Z = галогенометил, винил или любой другой фрагмент, содержащий активную кратную связь,
в качестве модифицирующего агента для получения белка формулы VI.
СН2=С(Ме)-СО-NH-R-СН(СООН)-N(СН2СООН)2,
где R=(СН2)n, (СН2СН2О)n, где n=1-20,
в качестве модифицирующего агента для получения белка формулы VII.
| СПОСОБ ИЗГОТОВЛЕНИЯ МИКРОЧИПОВ НА ОСНОВЕ ОЛИГОНУКЛЕОТИДОВ | 1999 |
|
RU2157385C1 |
| US 5574142 А1, 12.11.1996 | |||
| US 5981734 А1, 29.11.1999 | |||
| US 5837860 А1, 17.11.1998 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| В.А | |||
| ВАСИЛИСКОВ и др | |||
| Молекулярная биология, 1998, т | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| Устройство для дуплексного телефонирования по проводам и без проводов токами высокой частоты | 1924 |
|
SU923A1 |
Авторы
Даты
2003-06-20—Публикация
2001-07-25—Подача