Изобретение относится к молекулярной биологии и биоорганической химии и рассматривает олигонуклеотиды, модифицированные непредельными группами, способными вступать в реакцию сополимеризации с непредельными мономерами при формировании полимерных гидрогелей, а также способы их синтеза и способ проведения сополимеризации. Изобретение также относится к способу иммобилизации олигонуклеотидов в гидрогелях, получаемых полимеризацией непредельных мономеров акриламида и бис-акриламида, или любых других мономеров на их основе, находящему применение при изготовлении биологических микрочипов, использующихся в молекулярной биологии для секвенирования и картирования ДНК, детектирования мутаций и целого ряда медицинских приложений.
Уровень техники
Известны два способа иммобилизации модифицированных непредельньми группами олигонуклеотидов в гидрогеле.
Первый способ состоит в сополимеризации олигонуклеотида с присоединенным через фосфоамидную связь N-алкилзамещенным метакриламидным остатком (AcryditeТМ) с акриламидом и бисакриламидом. Данный реагент производится фирмой Mosaic Technologies [F. N. Rehman, M. Audeh, E. S. Abrams, P. W. Hammond, M. Kenney and T. C. Boles, Nucleic Acids Research, 1999. V.27, N 15, P. 649-655] и позволяет вводить метакриламидную группу в олигонуклеотид по 5'-концу в автоматическом режиме синтеза.
Данный способ имеет ряд ограничений. Несмотря на то, что метакриламидная группа устойчива как в кислой так и в щелочной областях pH фосфоамидная связь, выбранная авторами для связывания метакриламидного фрагмента с олигонуклеотидом, ограничивает область использования олигонуклеотидов с такого рода модификацией только рамками нейтральной и слабощелочной среды. Известно, что фосфоамидная связь неустойчива в кислой среде [N. N. Preobrazhenskaya, Russ. Chem. Rev., 1972, 41, P.54; Chanley J.D., Feageson E., J.Am. Chem.Soc., 1965, 87, P.3199; Glark V.M., Kirby G.W., Todd A.R., J.Chem.Soc., 1957, P.1497]. Поскольку олигонуклеотиды являются поликислотами, то хранение водных растворов таких олигонуклеотидов приводит, как правило, к отщеплению непредельной группы и как следствие этого к утрате способности вступать в реакцию сополимеризации. В связи с этим фирма изготовитель предлагает хранить олигонуклеотиды в сухом виде при -20oC, что сильно ограничивает рамки использования этих производных. Так, при изготовлении олигонуклеотидных микрочипов неизбежно будет возникать проблема хранения и многократного использования библиотеки олигонуклеотидов.
Таким образом, кислотолабильность фосфоамидной связи в модифицированных олигонуклеотидах выпускаемых под маркой AcryditeТМ резко ограничивает область их применения.
Другим недостатком данного способа является введение непредельной группы только по 5'- концу синтезированного олигонуклеотида.
Второй описанный способ [Vasiliskov A.V., Timofeev E.N., Surzhikov S.A., Drobyshev A. L. , Shick V. V., Mirzabekov A.D., BioTechniques 1999,27, P. 592-606] устраняет некоторые недостатки первого, а именно предлагает использовать аллильные производные олигонуклеотидов, что повышает устойчивость модифицированных олигонуклеотидов к изменениям pH растворов и, тем самым, снимает ограничения, накладываемые на первый способ.
Недостатком данного способа является низкое сродство аллильного фрагмента к акриламиду и бисакриламиду в реакции сополимеризации при иммобилизации олигонуклеотида в акриламидном гидрогеле. Так, например, при изготовлении олигонуклеотидных микрочипов, в сравнении с первым способом требуется огромный избыток олигонуклеотида. Такой способ безусловно является гораздо более дорогостоящим.
Сущность изобретения
Сущность изобретения заключается в том, что олигонуклеотиды модифицируются различными непредельными группами, имеющими высокое сродство с непредельным мономером, составляющим основу формируемого гидрогеля (например, акриламидом, метакриламидом или любым другим мономером на их основе), позволяющими проводить эффективную иммобилизацию полученных модифицированных олигонуклеотидов в гель при непосредственном изготовлении микрочипа.
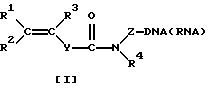
Синтетические олигонуклеотиды общей формулы [1]: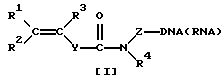
где R1, R2, R3 представляет собой H, алкил С1-C6, Ph, PhCH2-;
Z представляет собой (CH2)nCH(CH2OH)CH2OX, где n=1-6; или (CH2)n-OX, где n= 2-6; и X представляет собой фосфодиэфирную группу, связывающую непредельный фрагмент с 5'- и/или 3'-концом олигонуклеотида;
R4 представляет собой H, (CH2 nОН, где n=2-6;
Y представляет собой (p-C6H4)n, где n= 0-2;
DNA/RNA представляет собой одноцепочечный фрагмент олигонуклеотидов дезокси- и риборяда, полученный на автоматическом синтезаторе по стандартной фосфорамидитной химии; двухцепочечный фрагмент DNA, полученный в условиях полимеразной цепной реакции (PCR) с использованием синтетических праймеров с концевой непредельной группой; одноцепочечный фрагмент DNA, полученный в условиях ассиметрической полимеразной цепной реакции с использованием синтетических праймеров с концевой непредельной группой, получают с помощью соответствующего фосфоамидитного твердофазного синтеза или ацилирования синтезированного олигонуклеотида, содержащего аминолинк, активированным эфиром непредельной кислоты в поставтоматическом режиме. Модифицированные таким образом олигонуклеотиды иммобилизуют в акриламидном геле с помощью реакции радикальной сополимеризации.
Задача настоящего изобретения состоит в разработке способа иммобилизации олигонуклеотидов, содержащих различные непредельные группы, имеющие высокое сродство с непредельным мономером, составляющим основу формируемого гидрогеля (например, акриламидом, метакриламидом или любым другим мономером на их основе) и устойчивых в условиях их использования и хранения.
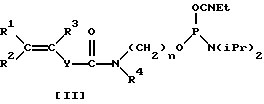
В настоящем изобретении предложено использование ряда алкил(арил) замещенных акриламидных и стирольных фрагментов, имеющих высокое сродство к акриламиду в реакции сополимеризации и способ их введения в олигонуклеотид:
использование в автоматическом режиме синтеза фосфоамидита, отличающегося от коммерческого AcryditeТМ типом связи фосфора с непредельной группой (в данном случае Р-О), что обуславливает значительную устойчивость получаемых продуктов в кислой области pH.
введение способом активированных эфиров непредельнх групп в поставтоматическом режиме.
В автоматическом режиме введение непредельных соединений в синтетический олигонуклеотид осуществляется с помощью соответствующего фосфоамидита [Froehler B.C., Matteucci M.D., Nucleic Acids Res. 1983, 11, P. 8031-8036]. Например, замещенный N-гидроксиалкилметакриламид может быть превращен в соответствующий фосфоамидит в реакции 2-O-цианоэтил-N,N,N',N'- тетраизопропилфосфодиамидитом в ацетонитриле в присутствии тетразола. Полученный реагент в виде 0.1 М раствора в ацетонитриле используют без выделения в стандартных условиях.
В общем случае для модификации олигонуклеотидов может быть использован фосфоамидит (формулы [II]: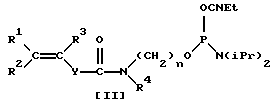
где R1, R2 представляет собой H, алкил С1-С6, Ph-,PhCH2-;
R3 представляет собой алкил С1-С6;
R4 представляет собой H, (CH2)n-ОДМТ, где n=2-6;
Y представляет собой (р-C6H4 n где n=0-2; n=2-6;
с типом связи фосфора с непредельной группой Р-О.
В поставтоматическом режиме введение непредельного остатка в олигонуклеотид осуществляется в результате реакции 4- нитрофенилового эфира соответствующей кислоты с синтезированным олигонуклеотидом, содержащим аминолинк, по 5'- и (или) 3'-концу. 4-Нитрофениловые эфиры непредельных кислот получают в реакции с 4- нитрофенолом в присутствии дициклогексилкарбодиимида.
Способ иммобилизации олигонуклеотидов с непредельными фрагментами реализован в варианте фотополимеризации под действием УФ-излучения. Нанесение полимеризационной смеси проводится капельным способом: капли наносят на предварительно модифицированное стекло и проводят полимеризацию. Нанесение проводят либо с помощью микрошприца, либо с помощью автоматического робота для нанесения микрокапель [Froehler B. C., Matteucci M.D., Nucleic Acids Res. 1983, 11, P. 8031-8036, G.Yershov, V.Barsky, A.Belgovskiy, E.Kirilov, E.Kreindlin, l. lvanov, S.Parinov, D.Guschin, A.Drobishev, S.Dubiley, A.Mirzabekov. Proc.Natl.AcadSci.USA. 1996, V.93, P.4913-4918], позволяющего наносить капли объемом порядка 1 нл.
Заявляемый способ позволяет получать гелевые матрицы, содержащие иммобилизованные олигонуклеотиды с высокой степенью иммобилизации в зависимости от использованной непредельной группы.
Сведения, подтверждающие возможность осуществления изобретения
Приведенные далее примеры являются предпочтительными, предназначены лишь для подтверждения возможности осуществления изобретения и не должны стать основанием для ограничения объема притязаний Заявителя. Специалист в данной области техники без труда найдет возможности иных воплощений изобретения, которые безусловно подпадают под притязания Заявителя, отраженные в формуле изобретения, приводимой ниже.
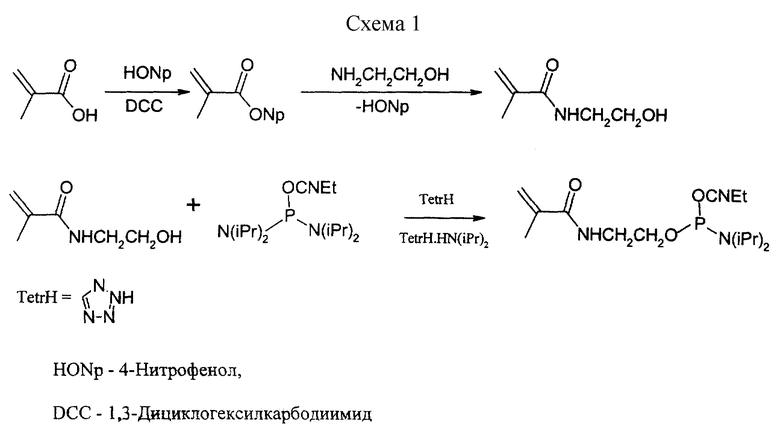
Пример 1. Синтез фосфоамидита, содержащего метакриламидный остаток.
В качестве примера синтеза фосфоамидита, содержащего метакриламидный остаток, приведен синтез N-метакрил-O-(2-O- цианоэтил-N,N'- диизопропиламинофосфит)этаноламина согласно схеме 1. (Приведена в конце описания).
Синтез N-гидроксиэтилметакриламида.
4-Нитрофениловый эфир метакриловой кислоты (0.300 г, 1.45 ммоль) растворяли в ацетонитриле (20 мл). К раствору приливали этаноламин (0.182 г, 2.98 ммоль) и оставляли при комнатной температуре на 12 часов. Выпавший осадок отфильтровывали, фильтрат упаривали. Продукт очищали хроматографией на колонке с силикагелем (элюент: ацетон-петролейный эфир 3:2). Выход 83%. Масло. Rf=0.41 (в системе ацетон-петролейный эфир 3:2).
Синтез N-метакрил-O-(2-O-цианоэтил-N,N-диизопропиламино-фосфит)этаноламина
N-Гидроксиэтилметакриламид (0.013 г, 0.101 ммоль) растворяли в ацетонитриле (0.266 мл). К раствору добавляли 2-цианоэтил-N,N,N',N'-тетраизопропилфосфоамидит (0.030 г, 0.101 ммоль) и 0.4 М раствор тетразола в ацетонитриле (0.255 мл). Раствор перемешивали 30 минут и отфильтровывали. К фильтрату прибавляли ацетонитрил (0.479 мл). Полученный 0.1 М раствор фосфоамидита непосредственно использовали в автоматическом синтезе олигонуклеотидов.
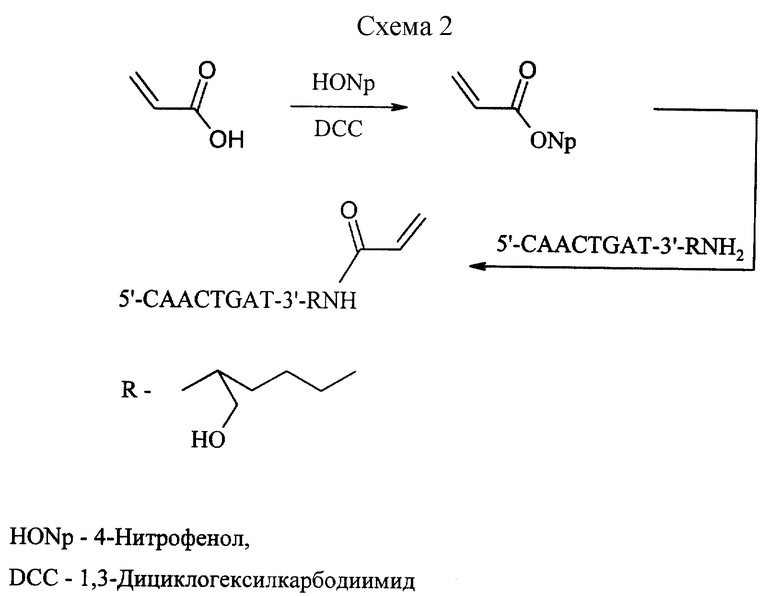
Пример 2. Синтез олигонуклеотида-CAACTGAT с 3'-концевой акриламидной группой.
В качестве примера синтеза олигонуклеотида с 3'-концевой акриламидной группой приведен синтез 5'-СААСТGАТ-3'- (CH2CH(CH2OH)(CH2)3CH2NHC(O)- CH= CH2) согласно схеме 2. (Приведена в конце описания).
Синтез 4-нитрофенилового эфира акриловой кислоты
Акриловую кислоту (0.850 г, 11.79 ммоль) растворяли в этилацетате (7 мл) и при перемешивании приливали раствор 4-нитрофенола (1.804 г, 12.97 ммоль) и дициклогексилкарбодиимида (2.680 г, 12.97 ммоль) в этилацетате (14 мл). Полученный раствор перемешивали при комнатной температуре в течение 12 часов. Осадок дициклогексилмочевины отфильтровывали, фильтрат охлаждали до -70oC и выпавшие кристаллы нитрофенилового эфира отфильтровывали. Фильтрат упаривали вдвое и вновь охлаждали до -70oC. Кристаллы, полученные в двух порциях, высушивали при комнатной температуре и давлении 3 мм рт.ст.
Выход 87%. Тпл=142-143oC.
Синтез 5'-CAACTGAT-3'-(CH2CH(CH2OH(CH2)3CH2NHC(O)-CH=CH2)
К раствору олигонуклеотида 5'-СААСТGАТ-3'-(CH2CH- (CH2OH)(CH2)3CH2NH2 (21.7 нмоль) в боратном буфере (0.050 мл) с pH 9.53 приливали раствор 4-нитрофенилового эфира акриловой кислоты (0.40 мг, 2170 нмоль) в диметилформамиде (0.100 мл). Полученный гомогенный раствор выдерживали при 35oC 12 часов. Затем гель-фильтрацией на сорбенте Sephadex-G25, с использованием в качестве элюента деионизированной воды, отделяли олигонуклеотидную фракцию от низкомолекулярных компонентов.
Олигонуклеотид очищали с помощью ВЭЖX на приборе Gilson (США), колонка Supelco 4,6х250 мм, в системе элюентов: буфер А - 0,05М триэтиламмоний ацетат, буфер Б - 50% ацетонитрила в буфере А, градиент от 0 до 50% буфера Б за 30 мин, детекция при длине волны λ = 260 нм. Время удерживания Rt 19 мин. Выход модифицированного олигонуклеотида составил 72%.
Пример 3. Фотоинициированная сополимеризация модифицированных олигонуклеотидов.
Оценку процента иммобилизации проводили по введенной в олигонуклеотид радиоактивной метке Р32.
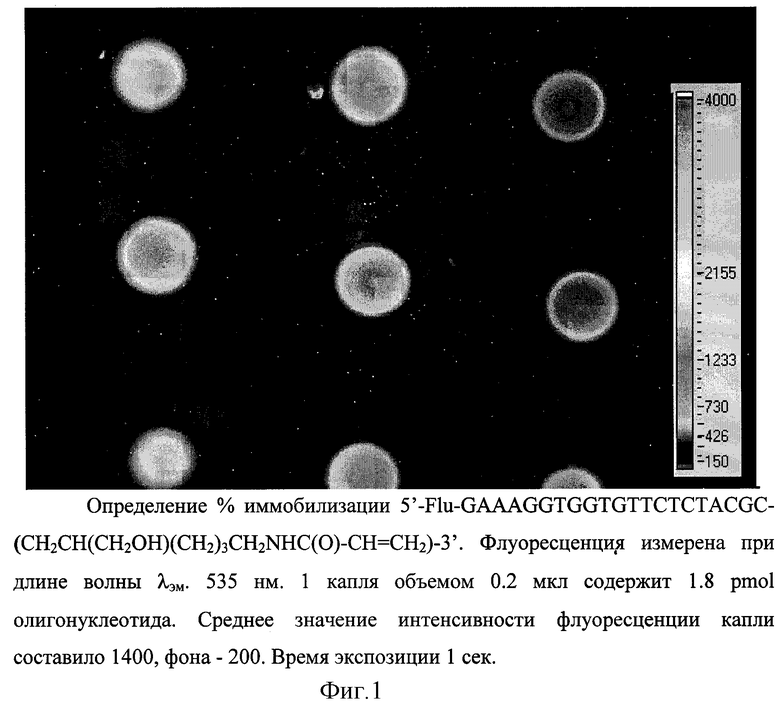
Состав полимеризационной смеси соответствовал 5% полиакриламидному гелю: 5% акриламид-бисакриламид (19:1), 40% глицерин, 2% ацетон, 1,2% ТЕМЕД, 0,1 М натрий фосфатный буфер, pH 7,0. Концентрация меченого Р32 олигонуклеотида, 5'-P32-GAAAGGTGGTGTTCTCTACGC- (CH2CH(CH2OH)(CH2)3CH2NHC(O)- С(CH3)=CH2)-3' составляла 1•10-7M. Капли наносили с помощью микрошприца на стекло, предварительно обработанное Bind-Silan (3-(trimethoxysilyl)-propylmethacrylate). Объем капли 0,2 мкл. Полимеризацию проводили в УФ-печи (Stratolinker 1800-UV). Время экспозиции 20 мин при длине волны 254 нм. После проведения сополимеризации измеряли суммарный радиоактивный фон стекла с нанесенными каплями, который принимали за 100%. Далее проводили серию отмывок в различных условиях до постоянного значения радиоактивного фона и оценивали средний % иммобилизации олигонуклеотида, который составил 65-70%.
Пример 4. Оценка процента иммобилизации по интенсивности флуоресценции флуоресцентной метки, введенной в сополимеризуемый олигонуклеотид.
Для определения % иммобилизации олигонуклеотида был получен 5'-Flu-GAAAGGTGGTGTTCTCTACGC-(CH2CH(CH2OH)(CH2)3CH2NHC(O)-CH= CH2)-3'. Флуоресцеин вводили на 5'-конец последовательной обработкой Т4- полинуклеотидкиназой, ATPγS, 5-IAF (5- йодоацетамидофлуоресцеин), с последующими экстракциями фенол/хлороформом, бутанолом и очисткой HPLC. Полученный гомогенный продукт вводили в сополимеризационную смесь, стандартную для 5% полиакриламидного геля, и проводили полимеризацию в условиях, указанных в примере 3. Оценку % иммобилизации проводили аналогично определению % иммобилизации для меченного по 5'-концу радиоактивным изотопом фосфора (Р32): за 100% принимали среднюю флуоресценцию 1 капли после окончания полимеризации. После отмывки в воде при 60oC, 45 мин повторно измеряли интенсивность флуоресценции и определяли средний % иммобилизации, который составил 60oC. Результаты приведены на фиг. 1.
Пример 5. Влияние введенной в олигонуклеотид непредельной группы на степень сополимеризации.
Оценка степени иммобилизации проводится по связыванию комплиментарных флуоресцентно меченных олигонуклеотидов в результате гибридизации.
Показано, что все модифицированные олигонуклеотиды имеют высокую степень связывания с комплиментарным олигонуклеотидом, меченым Texas Red, при этом однако интенсивность флуоресценции распределена в исследуемом ряду таким образом: акриламидная = метакриламидная > 3-фенилакриламидная > 4-винилбензамидная. Поскольку эксперимент проводили для всех перечисленных соединений в одинаковых условиях, а именно: равные исходные концентрации всех модифицированных олигонуклеотидов в сополимеризационной смеси, одинаковые условия проведения полимеризации и последующих отмывок геля, равная концентрация комплиментарного олигонуклеотида, полученные данные позволяют сделать вывод о реакционной способности перечисленных соединений в условиях проведения сополимеризации.
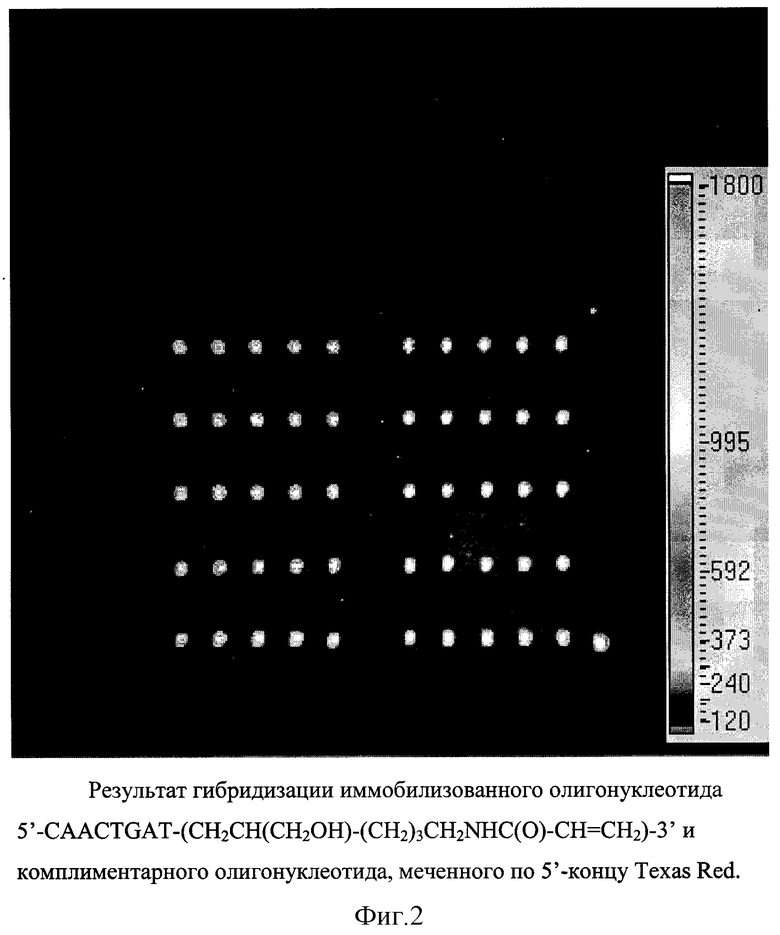
Пример 6. Гибридизация на микрочипе, полученном сополимеризацией модифицированного олигонуклеотида с 5% акриламидным гелем.
Нанесение проводили с помощью автоматического робота для нанесения микрокапель [Froehler B. C. , Matteucci M.D., Nucleic Acids Res. 1983, 11, P. 8031-8036, G. Yershov, V. Barsky, A.Belgovskiy, E.Kirilov, E.Kreindlin, l. lvanov, S.Parinov, D.Guschin, A.Drobishev, S.Dubiley, A.Mirzabekov. Proc.Natl. AcadSci. USA. 1996, V.93, P.4913-4918]. Наносимый объем капли соответствовал 1 нл. Концентрация 5'-CAACTGАТ- (CH2CH(CH2OH)-(CH2)3CH2NHC(O)- CH= CH2)-3' составляла 1•10-6М. Концентрация комплиментарного олигонуклеотида, меченного по 5'-концу Texas Red, составляет 3•10-6М. Результаты приведены на фиг. 2.
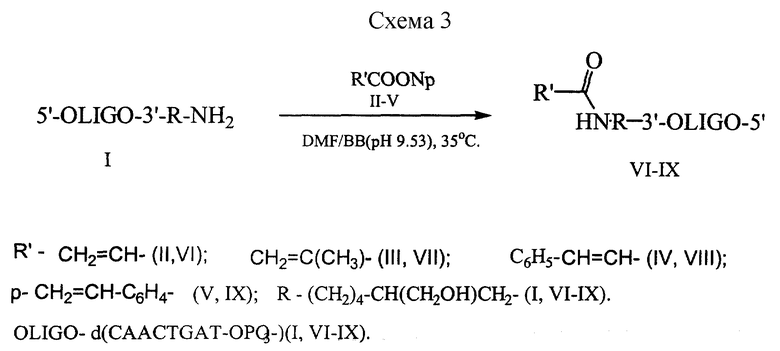
Пример 7. Синтез олигонуклеотидов с 3'- и 5'-концевой ненасыщенной группой.
Синтез олигонуклеотидов с 3'-концевой ненасыщенной группой, проводили согласно схеме 3. (Приведена в конце описания).
Образование целевого продукта в реакции ацилирования контролировали по данным HPLC (Rt), а брутто состав полученных олигонуклеотидов подтверждали методом MALDI-MS. (Таблица 1).
Олигонуклеотиды с 5'-концевой ненасыщенной группой синтезировали при использовании 0.1 М раствора фосфоамидита, полученного по методике,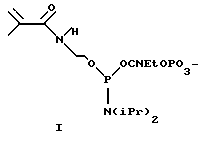
приведенной в примере 1, на синтезаторе Biosystems 394DNA/RNA synthesizer (Applied Biosystems, Foster City) в условиях стандартной фосфорамидитной химии. Образование целевого продукта контролировали по данным HPLC (Rt), а брутто состав полученных олигонуклеотидов подтверждали методом MALDI-MS. (Таблица 2).
Масс-спектры регистрировали на MALDI-MS спектрометре.
Высокоэффективную жидкостную хроматографию (HPLC) проводили на колонке Supeico LC-18(5μm 4.6x250 mm) с использованием элюентной системы: А) 0.05М раствор триэтиламмоний ацетата; В) 0.05М раствор триэтиламмоний ацетата в 50% CH3CH; градиент от 0 до 50% В) за 30 минут.
Эффективность стадии конденсации с использованием фосфоамидита (1) по данным высокоэффективной хроматографии (HPLC) составила более 92%.
Пример 8. Иммобилизация модифицированных непредельной группой олигонуклеотидов в различных гидрогелях на основе акриламида
Олигонуклеотид MAA-5'-GAACTGAG-3'-TexRed получали на автоматическом синтезаторе Biosystems 394DNA/RNA synthesizer (Applied Biosystems, Foster City). Метакриламидную группу
вводили в олигонуклеотид с использованием 0.1М раствора фосфорамидита, полученного по методике, приведенной в примере 1, в условиях стандартной фосфорамидитной химии.
Олигонуклеотид в составе гелей для фотоиндуцируемой полимеризации: (A,B, C, D, E, F,G) наносили с помощью автоматического робота, охарактеризованного выше, на стекло, обработанное BindSilane, облучали УФ с λ= 312 нм и отмывали.
На фиг.3 представлена флуоресцентная картина микрочипа, полученного при иммобилизации в гидрогелях разного состава (A,B,C,D,E,F,G) олигонуклеотида структуры MAA-5'- GAACTGAG-3'-TexRed, с 5'-концевой метакриламидной группой (МАА) и флуоресцентной меткой на 3'-конце (TexRed). Эффективность иммобилизации олигонуклеотида в разных гелях определяли по величине флуоресцентного сигнала. Степень иммобилизации на разных гелях составила 30-60%.
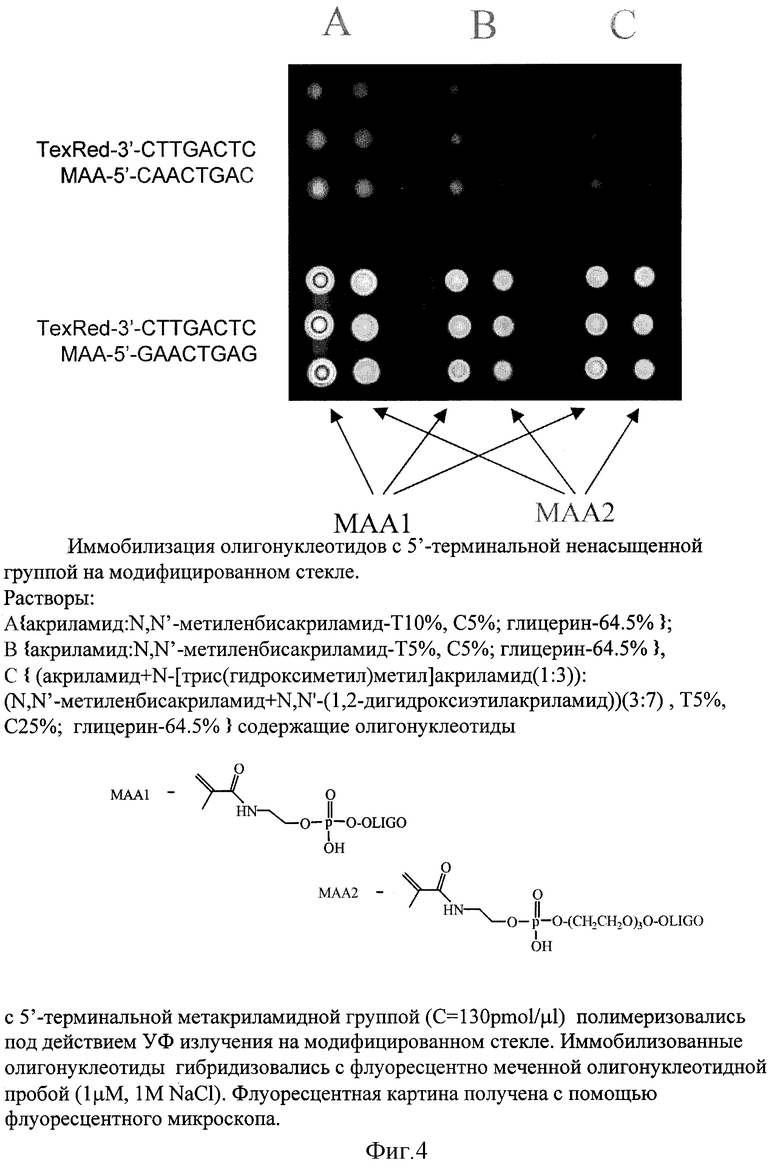
Пример 9. Гибридизация меченых олигонуклеотидов с иммобилизованными в различных гидрогелях модифицированными непредельной группой олигонуклеотидами.
Для изготовления микрочипа синтезировали олигонуклеотиды МАА-GAACTGAG и MAA-CAACTGAC с 5'-концевой метакриламидной группой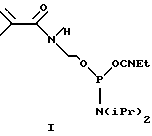
(МАА) при использовании 0.1М раствора фосфоамидита, полученного по методике, приведенной в примере 1, на синтезаторе Biosystems 394DNA/RNA synthesizer (Applied Biosystems, Foster City) в условиях стандартной фосфорамидитной химии. Полученные олигонуклеотиды добавляли в составе гелей для фотоиндуцируемой полимеризации наносили с помощью автоматического робота, охарактеризованного на стр.6, на стекло, обработанное BindSilane, облучали УФ с λ = 312 нм, отмывали и использовали для проведения гибридизационного анализа. Использовали гидрогели следующего состава: А{акриламид:N,N'-метиленбис-акриламид-Т10%, С5%, глицерин-64.5%} ; В {акриламид:N,N'-метиленбисакриламид-Т5%, С5%, глицерин-64.5%}, С {(акриламид+N- [трис(гидроксиметил)метил]акриламид(1:3)}
(N, N'-метиленбисакриламид+N, N'-(1,2-дигидроксиэтил-акриламид))(3: 7), Т5%, С25%; глицерин-64.5%}.
На фиг. 4 представлены результаты гибридизации на олигонуклеотидном микрочипе с использованием иммобилизованных олигонуклеотидов структуры GAACTGAG и CAACTGAC и гибридизуемого олигонуклеотида структуры CTCAGTTC. Полученная гибридизационная картина соответствует теоретическим представлениям. Больший флуоресцентный сигнал наблюдается на иммобилизованном олигонуклеотиде-GAACTGAG, полностью комплиментарном гибридизуемой пробе, независимо от вида используемого геля и линкера, соединяющего метакриламидную группу с олигонуклеотидом. Меньший сигнал наблюдается на ячейках с иммобилизованным олигонуклеотидом CAACTGAC, содержащим концевые замены.
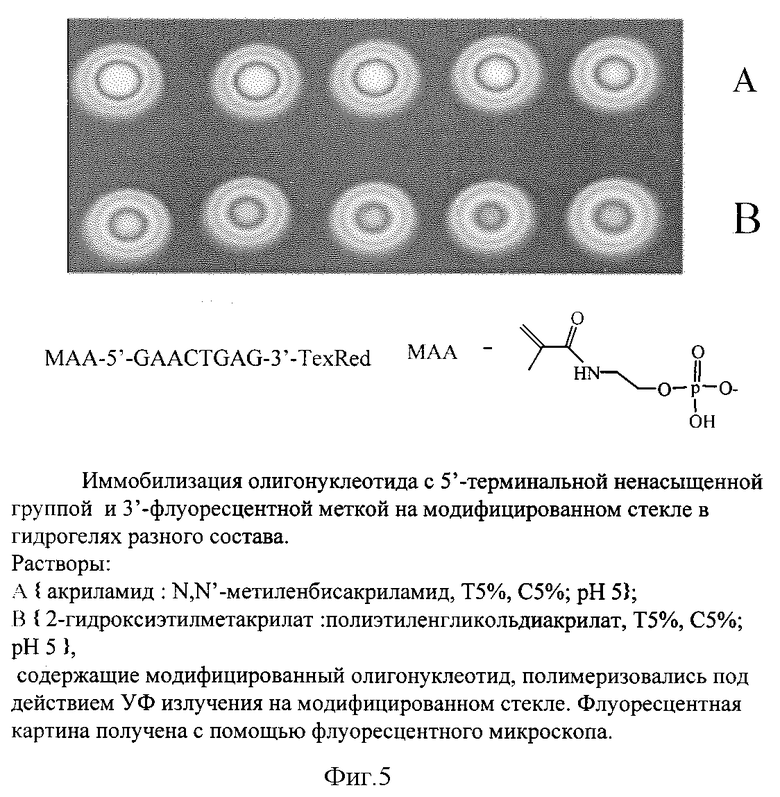
Пример 10. Иммобилизация модифицированных непредельной группой олигонуклеотидов в различных гидрогелях.
Олигонуклеотид в составе гелей для фотоиндуцируемой полимеризации (А,В) наносили с помощью автоматического робота, охарактеризованного выше, на стекло, обработанное BindSilane, облучали УФ с λ = 312 нм и отмывали. Эффективность иммобилизации олигонуклеотида определяли по величине флуоресцентного сигнала на чине до и после отмывки чипа. На фиг. 5 представлена флуоресцентная картина микрочипа, полученного при иммобилизации в гидрогелях разного состава (А, В) олигонуклеотида: МАА-5'- GAACTGAG-3'-TexRed, с 5'-концевой метакриламидной группой (МАА) и флуоресцентной меткой на 3'-конце (TexRed). Процент иммобилизованного олигонуклеотида составил в геле А-75-80%, в В-68-76%.
Данный пример показывает, что олигонуклеотиды с концевой ненасыщенной группой можно эффективно иммобилизовывать не только в гидрогелях на основе акриламида и N,N'-метилен бисакриламида, но и на основе любых других водорастворимых мономеров, способных эффективно сополимеризоваться с концевой ненасыщенной группой олигонуклеотида.



Изобретение относится к способу иммобилизации олигонуклеотидов в полимерных гидрогелях, в том числе в полиакриламидном геле, при котором проводят сополимеризацию олигонуклеотидов, модифицированных непредельными группами, общей формулы I с непредельными мономерами, составляющими основу получаемого гидрогеля. Также изобретение относится к модифицированным олигонуклеотидам формулы I, в которой R1, R2, R3 представляют собой Н, алкил С1-С6, Ph, PhCH2-; Z представляет собой (СН2)nСН(СН2ОН)СН2ОХ, где n=1-6; или (СН2)n-ОХ, где n=2-6; и Х представляет собой фосфодиэфирную группу, связывающую непредельный фрагмент с 5'- и/или 3'-концом олигонуклеотида, R4 представляет собой Н, (СН2)nОН, где n=2-6; Y представляет собой (р-С6Н4)n, где n=0-2. Олигонуклеотиды модифицируют с помощью фосфоамидита общей формулы II, где R1, R2 и Y такие, как в формуле I, R3 представляет собой алкил С1-С6, R4 представляет собой Н, (СН2)n-ОДМТ, где n=2-6; или путем ацилирования олигонуклеотида, содержащего аминолинк, активированным эфиром непредельной кислоты. Технический результат - высокая степень иммобилизации олигонуклеотидов в полимерном гидрогеле при формировании микрочипа. 2 с. и 16 з.п. ф-лы, 5 ил., 2 табл.
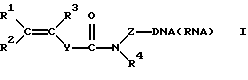
где R1, R2, R3 представляют собой Н, алкил С1-С6, Ph, PhCH2-;
Z представляет собой (СН2)nСН(СН2ОН)СН2ОХ, где n=1-6; или (СН2)n-ОХ, где n= 2-6, и Х представляет собой фосфодиэфирную группу, связывающую непредельный фрагмент с 5'- и/или 3'-концом олигонуклеотида;
R4 представляет собой Н, (СН2)nОН, где n=2-6;
Y представляет собой (р-С6Н4)n, где n=0-2.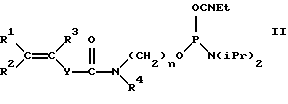
где R1, R2 представляют собой Н, алкил С1-С6, Ph, PhCH2-;
R3 представляет собой алкил С1-С6;
R4 представляет собой Н, (СН2)n-ОДМТ, где n=2-6;
Y представляет собой (р-С6Н4)n, где n=0-2,
n=2-6;
с типом связи фосфора с непредельной группой Р-О.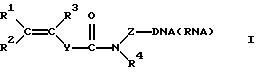
где R1, R2, R3 представляют собой Н, алкил С1-С6, Ph, PhCH2-;
Z представляет собой (СН2)nСН(СН2ОН)СН2ОХ, где n=1-6; или (СН2)n-ОХ, где n= 2-6, и Х представляет собой фосфодиэфирную группу, связывающую непредельный фрагмент с 5'- и/или 3'-концом олигонуклеотида,
R4 представляет собой Н, (СН2)nОН, где n=2-6;
Y представляет собой (р-С6Н4)n, где n=0-2.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| US 5932711 А, 03.08.1999 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| US 5981734 А, 09.11.1999 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| ВАСИЛИСКОВ В В.А | |||
| и др | |||
| Метод получения микрочипов с помощью сополимеризации с акриламидом | |||
| - Молекулярная биология, 1998, т | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| Устройство для дуплексного телефонирования по проводам и без проводов токами высокой частоты | 1924 |
|
SU923A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| СПОСОБ ОЦЕНКИ МЕТАБОЛИЗМА ЖЕЛЧНЫХ КИСЛОТ И ХОЛЕСТЕРИНА | 2004 |
|
RU2260184C1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| КОРШАК В.В | |||
| и др | |||
| Полимеры в процессах иммобилизации и модификации природных соединений | |||
| - М.: Наука, 1984, с.34, 79 - 80, 83. | |||
Авторы
Даты
2001-11-20—Публикация
1999-12-28—Подача