Область техники, к которой относится изобретение
Изобретение относится к молекулярной биологии, биоорганической химии, генетике, геномике и описывает новый подход к анализу нуклеотидных последовательностей в экспериментальном образце с использованием описанного ранее устройства-микрочипа с иммобилизованными на его поверхности в гелевых ячейках олигонуклеотидами.
Уровень техники
Гибридизация ДНК с олигонуклеотидными биочипами - эффективный подход для параллельного анализа большого числа специфических последовательностей (1, 2). Обычно исследуемые последовательности должны быть амплифицированы (размножены) перед гибридизацией путем проведения множественных полимеразных цепных реакций (ПЦР) во многих раздельных пробирках или лунках. Эта процедура довольно дорогая и требует много времени в случае исследования вариаций последовательностей в масштабах геномной ДНК. Например, тысячи независимых ПЦР должны быть проведены в случае исследования полиморфизма в ДНК генома человека. Популярный сегодня метод проведения ПЦР для нескольких различных последовательностей параллельно в одной пробирке ограничен вследствие проблем, возникающих из-за трудно контролируемых взаимодействий между олигонуклеотидами, используемыми в качестве затравки (праймеров) для размножения различных последовательностей путем проведения ПЦР. Осуществление привлекательной идеи проведения ПЦР или иной реакции амплификации (размножения) ДНК прямо на биочипе, интегрирование этой реакции с анализом амплифицируемых последовательностей могло бы быть качественным продвижением и существенным упрощением анализа нуклеотидных последовательностей с использованием биочипов. Недавно был описан метод амплификации па биочипе, в котором оба необходимых для индивидуального ПЦР олигонуклеотида (праймера) были постоянно иммобилизованы в определенном месте (ячейке) биочипа. Этот метод, или "Мост ПЦР" (3), существенно менее эффективен, чем обычный ПЦР в растворе, из-за физических проблем, возникающих при образовании двухцепочечных молекул ДНК, прикрепленных к поверхности биочипа на обоих концах. Высвобождение амплифицированного фрагмента ДНК и одного (или двух) праймера(ов) могло бы существенно повысить эффективность ПЦР.
Другой недавно описанный метод амплификации на биочипе был основан на альтернативной реакции амплификации, "амплификации путем вытеснения цепи" (4). Этот метод амплификации был соединен с технологией микроэлектронного биочипа путем иммобилизации праймеров в определенных местах биочипа, усиленной электрическим полем гибридизации исследуемых молекул ДНК и проведением амплификации на биочипе. Полное замещение цепи одноцепочечного амплифицированного продукта происходило при каждом цикле репликации. Однако, из-за того, что эти одноцепочечные продукты могут диффундировать к другим местам биочипа, специфичность и чувствительность данного метода ограничены.
Недавно был разработан метод прямой ПЦР-амплификации на биочипе, в гибридизационной микрокамере над биочипом и внутри гелевых элементов, интегрированной с аллелеспецифичным удлинением иммобилизованных праймеров (5). Лишь малое число разных последовательностей могут быть взяты одновременно для амплификации и анализа этим способом, так как диффузия амплифицированных ДНК по всей поверхности биочипа и фоновые взаимодействия различных праймеров (в растворе и в геле) между собой и ДНК очевидно ограничивают возможности метода.
Сущность изобретения
Сущность предложенного изобретения состоит в совокупности приемов, позволяющих существенно модифицировать метод амплификации на биочипе, описанный ранее (5). Специально модифицированные олигонуклеотиды, ряд последовательных энзиматических реакций и процедур были использованы для создания нового эффективного метода параллельной амплификации (ПЦР) многих (в перспективе - тысяч) нуклеотидных последовательностей прямо внутри разделенных элементов биочипа и последующего параллельного нуклеотидного анализа амплицифированных последовательностей внутри тех же элементов биочипа.
Используемый биочип (подробно описан ранее - см. ссылку 5) состоит из массива гелевых (модифицированный полиакриламидный гель) ячеек объемом порядка 0,4 нанолитра. Каждая ячейка содержит уникальный специфический набор иммобилизованных праймеров, которые будут последовательно использованы сначала для размножения специфического для данной ячейки фрагмента ДНК, а затем для анализа последовательности этого фрагмента.
Сущностью данного изобретения является способ одновременного, пространственно разделенного, параллельного проведения зависящих от используемой температуры энзиматических или химических реакций, а также комбинации этих реакций в единой многостадийной процедуре, в частности ПЦР-амплификация, для многих различных нуклеотидных последовательностей внутри трехмерных, разделенных с помощью гидрофобной жидкости, элементов биочипа.
Можно выделить три ключевые особенности метода:
1. ДНК, которая должна быть амплифицирована, обогащается в соответствующих гелевых элементах биочипа путем ее гибридизации с комплементарными иммобилизованными олигонуклеотидами.
2. Различные наборы специфических праймеров иммобилизованы внутри различных гелевых ячеек. Амплификационные праймеры непосредственно перед проведением ПЦР энзиматически отделяются от геля и способны свободно перемещаться внутри гелевого элемента во время ПЦР. Гелевый элемент может содержать также дополнительный временно неактивный молчащий праймер, который должен быть активирован, чтобы вести аллелеспецифическую реакцию удлинения праймера для детекции мутации или полиморфного участка в амплифицированной ДНК.
3. Множество параллельных ПЦР (а, возможно, и иных энзиматических реакций) проводятся в ограниченном объеме гелевых ячеек, покрытых и отделенных друг от друга минеральным маслом.
Заключительный анализ локализации специфически удлиненных иммобилизованных праймеров обычно включал их гибридизацию с флуоресцентно мечеными олигонуклеотидными пробами.
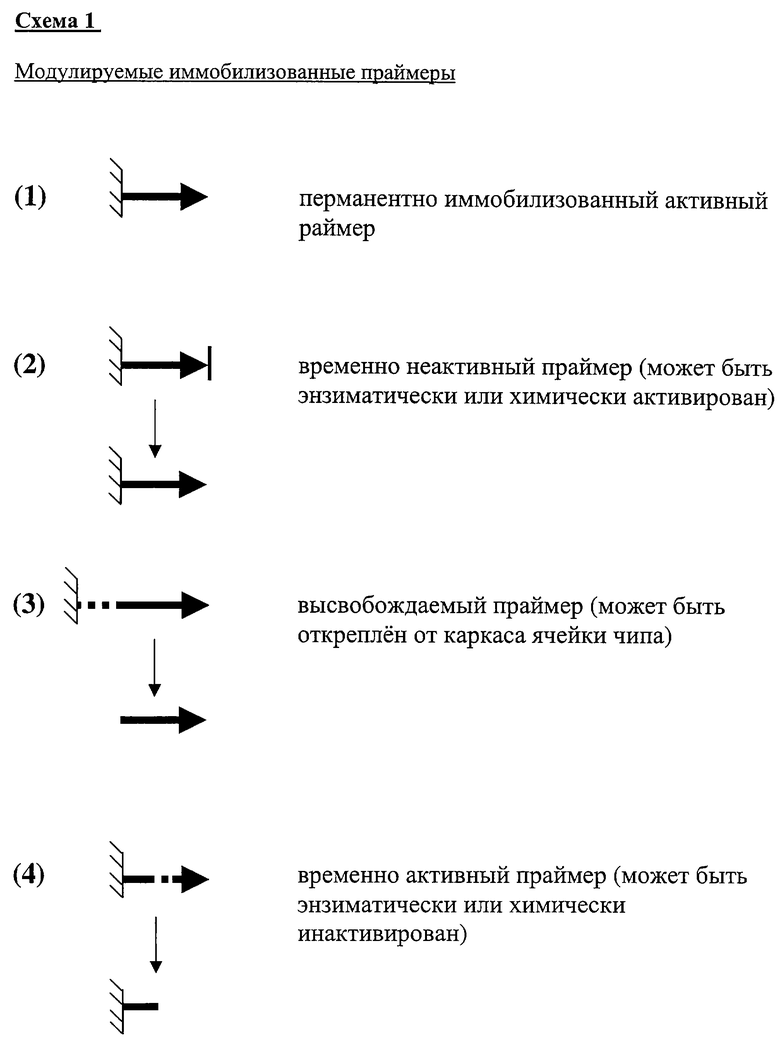
Предложено использование помимо стандартного постоянно иммобилизованного праймера (тип 1) иммобилизованных праймеров трех новых типов:
1) молчащий или активируемый, временно неактивный (тип 2),
2) высвобождаемый или выщепляемый (тип 3),
3) инактивируемый, временно активный (тип 4).
Праймер типа 2, например, может иметь на 3'-конце фосфат вместо гидроксила, что блокирует участие данного олигонуклеотида в затравке полимеразной реакции. Блокирующая группа может быть удалена обработкой щелочной фосфатазой. После такой обработки праймер активируется, то есть становится активным в качестве затравки в полимеразной реакции в составе совершенного дуплекса с комплементарной цепью ДНК, результатом чего является специфическое удлинение данного праймера.
Праймер типа 3, например, может иметь рибонуклеотидный район (--rU-rU-rU- или другой структуры), локализующийся между прикрепленным к гелю 5'-концом и началом специфической последовательности олигонуклеотида (см. табл. 1). Этот район может быть расщеплен при обработке РНКазой А, что ведет к высвобождению олигонуклеотида. Другим примером может служить введение углерод-углеродных -С-С-связей с вицинальными гидроксильными группами (как в случае гликолей) в 5'-область (в состав линкера), высвобождаемого праймера, которая может быть затем в достаточно мягких условиях специфически расщеплена периодатом натрия (реакция Малапрада) (12). Высвобождаемые праймеры позволяют максимально повысить эффективность ПЦР в пористом гелевом элементе. Минеральное масло надежно отделяет места амплификаций различных последовательностей, а также предохраняет реакционные растворы в набухших гелевых элементах от высушивания при высоких температурах ПЦР.
Активируемые праймеры (тип 2) позволяют полностью разделить стадию амплификации ДНК и стадию анализа нуклеотидной последовательности, что способствует увеличению специфичности реакции дискриминации (определению отличий в нуклеотидной последовательности между мутантной ДНК и ДНК дикого типа).
Частным случаем инактивируемого, временно активного праймера (тип 4) может быть как выщепляемый праймер, который вымывают из геля сразу после высвобождения, так и стандартный праймер, который в ходе эксперимента будет инактивирован наподобие временно неактивного праймера путем энзиматического фосфорилирования его 3'-конца. Инактивируемый праймер также может содержать внутреннюю модификацию, например, углерод-углеродную -С-С- связь с вицинальными гидроксильными группами (как в случае α-гликолей) в середине фосфоруглеводной цепи олигонуклеотида. При обработке периодатом натрия (12) такой праймер будет расщеплен пополам и уже не сможет участвовать в ПЦР.
Наборы олигонуклеотидов обоих типов могут быть нанесены с помощью робота и иммобилизованы одновременно в специфических местах на биочипе, и сухие биочипы могут храниться длительное время. Это позволяет стандартизировать процедуру и изготовлять биочипы впрок на длительный срок. Весь последующий анализ проводится полностью прямо на биочипе и состоит из ряда последовательных энзиматических реакций. Каждый гелевый элемент биочипа представляет собой как бы независимую пробирку, где происходит амплификация уникального фрагмента ДНК и затем его идентификация или анализ: выявление точечной мутации или идентификация нуклеотида в определенном положении (полиморфном участке).
Максимально возможное количество различных исследуемых фрагментов или максимальное число исследуемых в ходе одного эксперимента разных полиморфных нуклеотидных участков будет ограничиваться числом отдельных гелевых элементов биочипа. При проведении эксперимента использовался биочип с 676 гелевыми ячейками на 1 квадратном сантиметре стеклянной подложки. Такой биочип в принципе может позволить проводить параллельно до 676 различных ПЦР-анализов. Описываемый способ позволяет модифицировать конкретную последовательность стадий анализа, исходя из конкретной поставленной задачи, путем комбинирования разных стадий (гибридизацию, энзиматические реакции, химические обработки) с активацией, инактивацией или высвобождением специфических праймеров внутри каждой из экспериментальных ячеек биочипа. Все требующиеся праймеры выбирают таким образом, чтобы они могли эффективно работать при одних и тех же реакционных условиях, что необходимо для проведения параллельных независимых анализов ДНК во всех ячейках биочипа с одинаково высокой эффективностью.
Перечень фигур чертежей и иных материалов
Схема 1
Типы олигонуклеотидов (праймеров), используемых в нижеприведенных демонстрационных экспериментах.
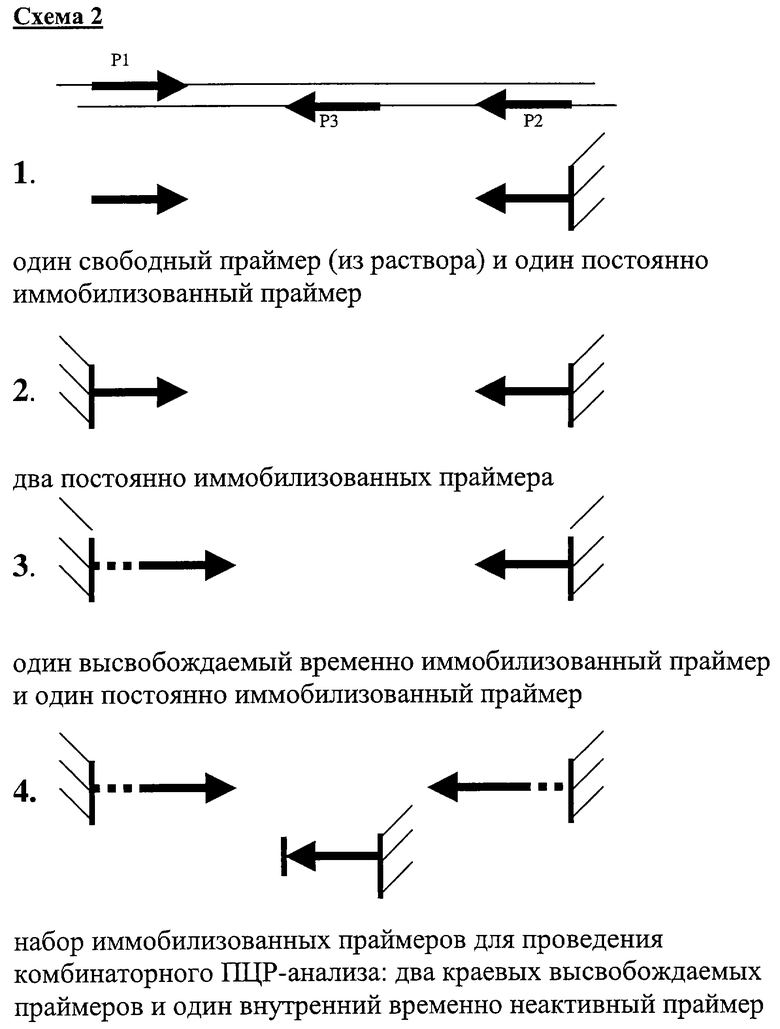
Схема 2
Различные варианты иммобилизации праймеров внутри одной гелевой ячейки для проведения ПЦР-амплификации под маслом.
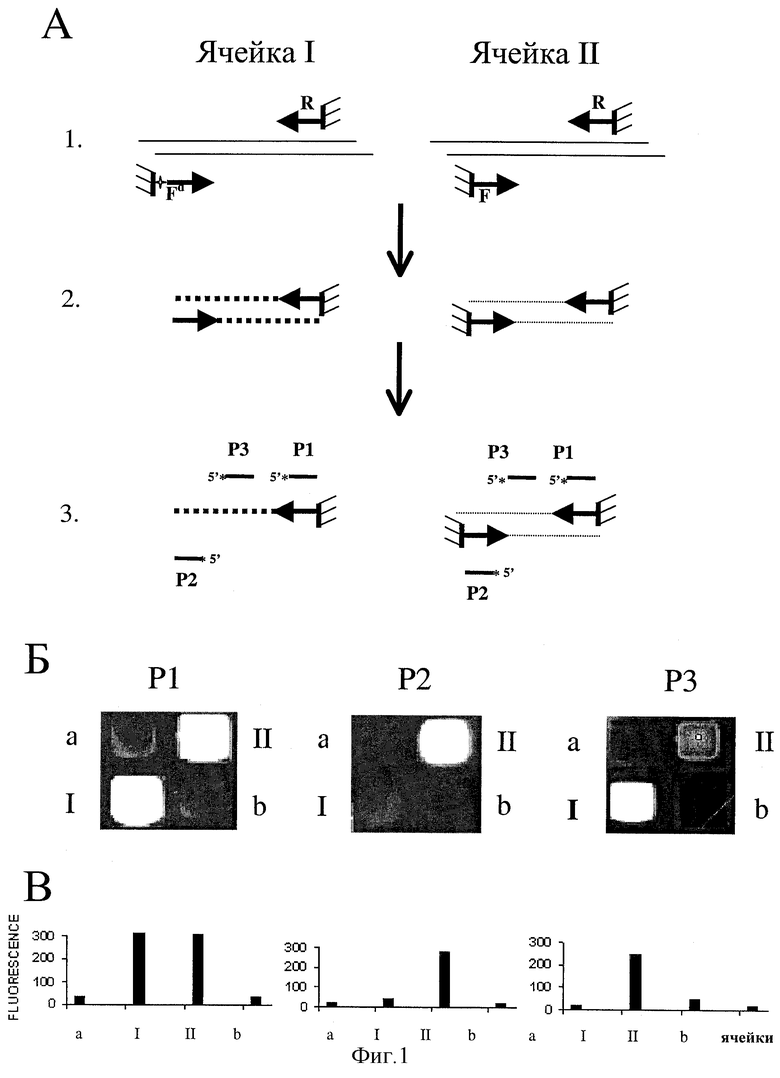
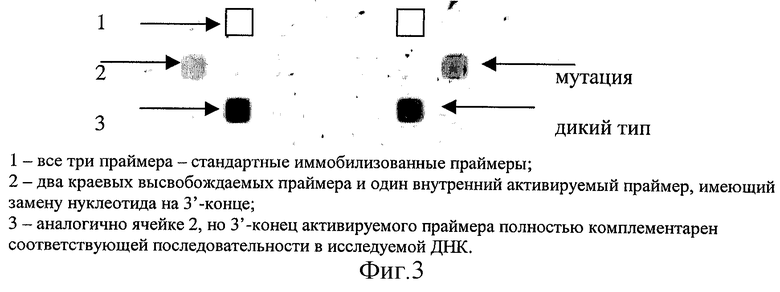
Фиг. 1 - демонстрация значительного повышения эффективности ПЦР-амплификации внутри гелевой ячейки под маслом в результате введения высвобождаемого праймера.
(А) Схема ПЦР-эксперимента на биочипе
1. Высвобождаемый прямой праймер Fd и постоянно иммобилизованный обратный праймер R были иммобилизованы в гелевом элементе I, в то время как в гелевом элементе II были иммобилизованы оба постоянно иммобилизованные прямой F и обратный R праймеры. Пустые гелевые элементы "а" и "b" использовались как внутренние контроли. Фрагментированную денатурированную геномную ДНК М. tuberculosis гибридизовали с иммобилизованными на биочипе праймерами.
2. Высвобождение праймера Fd внутри гелевого элемента I проводили путем обработки с РНКазой А. Эта реакция, как и последующая ПЦР-амплификация, проводилась в индивидуальных элементах (ячейках) биочипа, покрытого минеральным маслом.
3. Амплифицированную ДНК денатурировали и биочип промывали для того, чтобы удалить неприкрепленную ДНК и высвободившиеся праймеры F. Анализ биочипа проводили с помощью последовательных гибридизаций с флуоресцентно мечеными олигонуклеотидными пробами P1, P2 и Р3, комплементарными соответственно праймерам R, F и внутреннему району амплифицированной ДНК.
(B) Три флуоресцентных изображения биочипа после последовательных гибридизаций с флуоресцентно мечеными олигонуклеотидными пробами P1, P2 и Р3.
(C) Интенсивности флуоресценции (в условных единицах) ячеек биочипа.
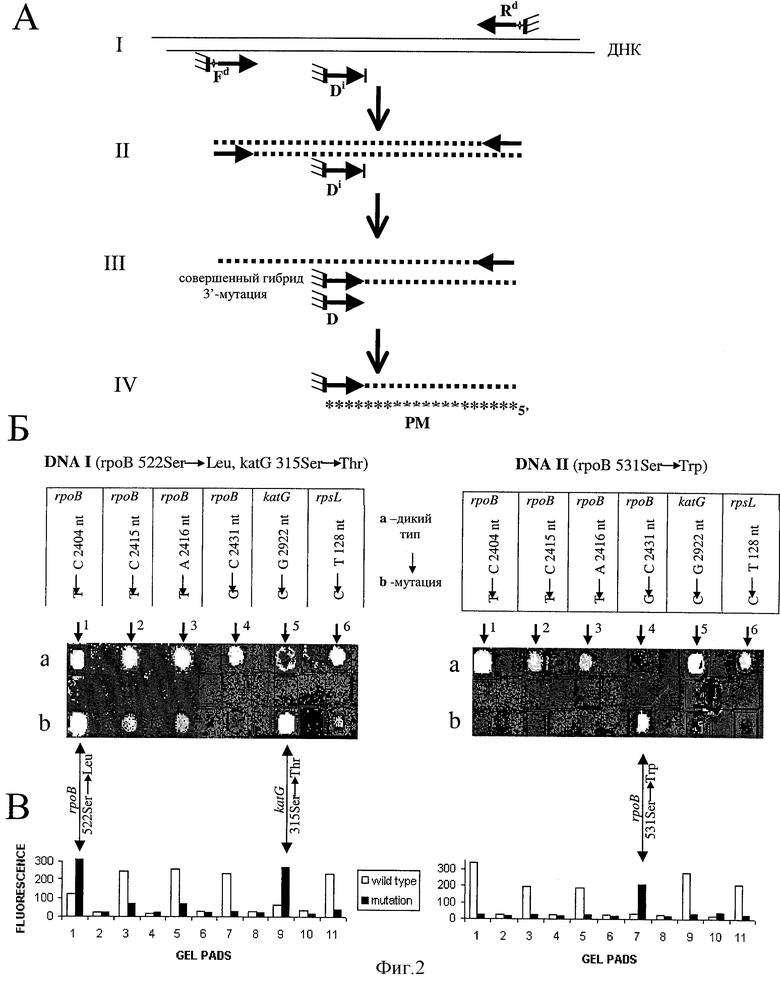
Фиг. 2 - демонстрация одновременной и независимой множественной ПЦР-амплификации на биочипе и последующего параллельного анализа 6 различных мутаций в трех различных генах M.tuberculosis.
(А) Схема эксперимента
I - Наборы из трех праймеров были иммобилизованы в каждом из 6 пар гелевых ячеек биочипа. Каждый набор праймеров включает два высвобождаемых праймера, прямой (Fd) и обратный (Rd), и внутренний "спящий" праймер (Di). 3'-концевой нуклеотид специфического временно неактивного "спящего" праймера (Di) в каждой паре гелевых ячеек соответствует или дикому типу "а", или мутантной "b" последовательности ДНК. Фрагментированную денатурированную геномную ДНК М. tuberculosis гибридизовали с иммобилизованными на биочипе праймерами.
II - биочип покрывали минеральным маслом и два праймера, Fd и Rd, высвобождали с помощью РНКазы А. Затем проводили ПЦР-амплификацию.
III - Амплифицированную ДНК денатурировали и затем гибридизовали с постоянно иммобилизованным внутренним "спящим" праймером (Di). Высвобожденные праймеры и несгибридизовавшуюся ДНК отмывали. "Спящие" праймеры активировали дефосфорилированием и затем проводили второй раунд ПЦР (или реакцию полимеразного удлинения праймера). Праймер D эффективно участвовал в реакции только в том случае, когда его 3'-конец был полностью комплементарен последовательности сгибридизованной с ним ДНК.
IV - Финальный анализ биочипа проводили путем гибридизации удлиненых праймеров D с флуоресцентно мечеными регион-специфичными пробами РМ.
(B) Результаты гибридизации для двух разных ДНК образцов, анализируемых на двух биочипах.
(C) Количественные измерения интенсивностей флуоресценции в гелевых ячейках биочипа.
Фиг. 3 - демонстрация отщепления иммобилизованного олигонуклеотида, содержащего (dU)4-последовательность вблизи места прикрепления к гелевому матриксу (5'-конец) и техасский красный (на 3'-конце), в результате обработки урацил-гликозилазой и последующей инкубации при 95oС в ПЦР-буфере.
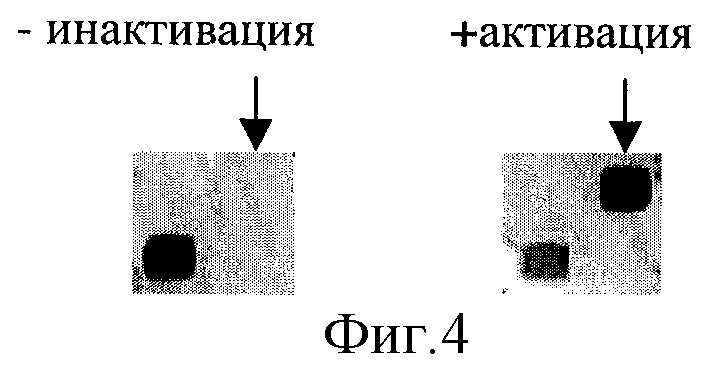
Фиг. 4 - демонстрация значительного повышения эффективности ПЦР-амплификации под маслом внутри гелевой ячейки с тремя праймерами в результате использования двух краевых высвобождаемых праймеров и одного внутреннего постоянно иммобилизованного праймера.
В табл. 1 даны последовательности олигонуклеотидов, используемых для ПЦР-амплификации и детекции мутаций.
Последовательности вариабельных районов генов proB (2336-2472 bp), katG (2873-3002bp) и rpsL (83-192bp) были взяты из файлов Gene Bank с номерами соответственно L27989, X68081 и Х70995.
F, R, Di - прямой, обратный и молчащий (активируемый) праймеры; P - гибридизационная проба; Fd, Rd - отщепляемые праймеры.
5'-NH2-(С6)-аминолинкер (Glen Research Inc., Eugene, OR); p - фосфат.
aФлуоресцентно меченые одноцепочечные продукты асимметричной ПЦР.
Сведения, подтверждающие возможность осуществления изобретения
Далее сущность изобретения раскрывается на отдельных примерах, которые не должны рассматриваться экспертом как ограничивающие притязания патента. Эксперименты проводились на биочипах (MAGIC ChipТМ) с иммобилизованными в гелевых элементах олигонуклеотидами (5-10). Технология создания и использования этих биочипов разрабатывается начиная с конца 80-х годов. Эта технология в силу своих уникальных свойств хорошо подошла для демонстрации возможности осуществления изобретения. Трехмерные гелевые элементы, образуемые на гидрофобной силиконизированной стеклянной поверхности, легко могут быть как одновременно инкубированы в общем растворе (в специальной микрокамере, образуемой на поверхности биочипа при использовании прокладки и покровного стекла, как описано ранее (5) и ниже), так и легко и быстро разделены друг от друга в любой момент даже без предварительного подсушивания. Для этого мы предлагаем использовать гидрофобную жидкость, в демонстрируемых экспериментах мы использовали минеральное масло. Далее, как уже неоднократно указывалось ранее, иммобилизация олигонуклеотидов внутри гелевых пористых трехмерных структур помещает олигонуклеотид в более благоприятные для проведения гибридизации и энзиматических реакций условия, чем иммобилизация на поверхности (6-10). Ниже будут приведены демонстрационные примеры, подтверждающие и раскрывающие возможности применения описываемого изобретения. Специальный раздел (см. ниже) посвящен материалам и методам. Следует отметить, что эксперименты на биочипе проводились с использованием специальной микрокамеры, описанной ранее (5). Простейший вариант ныне используемой нами микрокамеры устроен следующим образом. Овальная двусторонне клейкая прокладка толщиной около 100 мкм помещается на поверхность биочипа таким образом, что она окружает, не касаясь, зону биочипа, где локализуются гелевые элементы. Далее поверх этой прокладки помещается кварцевое стекло толщиной 2-3 мм и размером, несколько превышающим крайние размеры прокладки. Прижиманием и прогреванием при 95oС в течение 10 мин прокладка плотно приклеивается как к поверхности стекла биочипа, так и к покровному стеклу. Объем образующейся полости между двумя стеклянными поверхностями и краями прокладки зависит от толщины прокладки и от размера ограничиваемой ею площади, обычно этот объем порядка 20 микролитров. В покровном кварцевом стекле, как правило, имеются два отверстия диаметром 1-2 мм, расположенные с противоположных краев таким образом, чтобы они были еще внутри площади, окруженной прокладкой, но вне зоны расположения гелевых ячеек (с двух противоположных краев этой зоны). Через эти два отверстия осуществляется добавление и замещение растворов, а также промывка гелевых элементов. Для поддержания определенного температурного режима мы использовали или Master Cycler с in situ ПЦР-насадкой фирмы Eppendorf, или Т-Gradient с in situ ПЦР-блоком фирмы Biometra, или базирующийся на элементе Пелтье термостолик (5).
Фиг. 1 содержит схему, результат и количественный анализ данных эксперимента, в котором демонстрируется возможность и существенное улучшение эффективности ПЦР-амплификации в гелевом элементе под маслом в случае двух исходно иммобилизованных праймеров, когда один из праймеров Fd - высвобождаемый непосредственно перед проведением ПЦР и при этом остающийся в пределах пространства набухшего гелевого элемента, покрытого маслом. Прямой высвобождаемый праймер Fd в гелевом элементе I был исходно ковалентно прикреплен к гелю за 5'-конец. Район праймера между участком прикрепления и началом специфической нуклеотидной последовательности содержал дополнительную тририбонуклеотидную rUrUrC-группу (таблица 1). Расщепление этой группы при обработке рибонуклеазой А приводит к высвобождению праймера в окружающий гелевый матрикс раствор. Прямой праймер F в гелевом элементе II и обратный праймер R в обоих элементах I и II были постоянно прикреплены к гелю. На первом этапе эксперимента образец геномной ДНК был химически фрагментирован до молекул длиной 200-300 нуклеотидов. Денатурированная дробленая ДНК диффундировала в гибридизационном буфере внутрь гелевых элементов и гибридизовалась с иммобилизированными праймерами. После гибридизации несгибридизовавшуюся ДНК отмывали в 0,1-0,3М растворе хлорида натрия. В результате происходило специфическое обогащение комплементарными последовательностями ДНК тех элементов (ячеек) биочипа, где были иммобилизованы соответствующие этим ДНК олигонуклеотиды. Метод применения олигонуклеотидного биочипа для такого гибридизационного обогащения специфическими последовательностями был описан ранее (6). После гибридизации и отмывки биочип инкубировали в ПЦР-растворе (см. материалы и методы) для того, чтобы все необходимые реакционные компоненты, включая температуроустойчивую ДНК полимеразу и дезоксинуклеотидтрифосфаты, продиффундировали внутрь гелевых ячеек биочипа. Затем в течение нескольких секунд биочип инкубировали в том же растворе, дополнительно содержащем рибонуклеазу А (0,2 мг/мл), после чего быстро замещали водный раствор, окружающий и покрывающий гелевые элементы биочипа, минеральным маслом. Минеральное масло при этом окружает каждый гелевый элемент биочипа, предохраняя его водное содержимое (реакционную смесь) от высыхания и от контакта с реакционными смесями других гелевых элементов.
Биочип инкубировали при 37oС для того, чтобы рибонуклеаза переварила олигорибонуклеотидный участок отщепляемого олигонуклеотида (Fd), в результате чего этот олигонуклеотид будет откреплен от геля и будет свободно диффундировать в пределах данного окруженного маслом гелевого элемента. Инкубационную температуру поднимали до 72oС на 2 мин и затем проводили 30 циклов ПЦР (см. материалы и методы). После ПЦР минеральное масло отмывали хлороформом и затем 0,1-0,3М раствором хлорида натрия, денатурировали дуплексы ДНК, повышая температуру до 95oС, тщательно отмывали всю не прикрепленную к гелю ДНК и высвобожденные олигонуклеотиды. Наконец, оставшиеся на биочипе удлиненные и неудлиненные олигонуклеотиды последовательно (с тщательной отмывкой биочипа перед гибридизацией с новой пробой) гибридизовались с тремя олигонуклеотидными пробами, флуоресцентно меченными по 5'-концу техасским красным. Эти пробы - P1, P2 и Р3 (таблица 1) - были соответственно комплементарны праймерам R, F и внутреннему району амплифицированной ДНК. На фиг. 1Б и 1В показано распределение и количественное измерение (с помощью флуоресцентного микроскопа) интенсивностей флуоресценции на биочипе, полученных в результате проведения описанного эксперимента. Гибридизация биочипа с пробой Р1, комплементарной постоянно иммобилизованному обратному праймеру R, дала, как ожидалось, одинаково сильные гибридизационные сигналы в случае обоих рассматриваемых гелевых элементов I и II. Гибридизация с пробой P2, комплементарной праймеру F, дала сильный сигнал в случае гелевого элемента II (в которой этот праймер постоянно иммобилизован) и пренебрежимо малый сигнал в случае гелевого элемента I (где этот праймер был высвобожден в результате РНКазной обработки и затем при финальной отмывке биочипа удален). Этот результат свидетельствует о высокой эффективности высвобождения праймера Fd (более 90%) в результате использованного метода, включающего введение в 5'-концевой район иммобилизуемого олигонуклеотида тририбонуклеотидной последовательности, расщепляемой при обработке рибонуклеазой. Гибридизация с пробой Р3, выявляющей внутренний район новосинтезированного фрагмента ДНК, дала сильный гибридизационный сигнал в случае гелевого элемента I и весьма слабый сигнал в случае элемента II. Соотношение интенсивностей флуоресценции в этих гелевых элементах (I/II) было около 10:1, если вычесть фоновую флуоресценцию контрольных пустых гелевых элементов "а" и "b". Это соотношение указывает на то, что амплификация с использованием обоих постоянно иммобилизованных праймеров, так называемая "bridge PCR amplification" (3), примерно в 10 раз менее эффективна в рассматриваемом случае, чем ПЦР в случае, когда один из праймеров высвобожден в раствор. Эти данные хорошо согласуются с более ранними результатами, указывающими на сравнительно низкую эффективность ПЦР с использованием двух постоянно иммобилизованных праймеров (3, 5). Кривые плавления дуплексов, образованных при гибридизации пробы Р3 с удлиненной (в результате полимеразной реакции) частью иммобилизованного праймера R, анализировались с помощью флуоресцентного микроскопа (5, 9). Характерная для совершенного дуплекса форма кривой плавления и соответствующая для данной нуклеотидной последовательности температура плавления гибрида подтвердили правильность ПЦР реакции.
Более усложненная, но вместе с тем и более универсальная, схема эксперимента рассмотрена ниже. ПЦР-амплификация с двумя высвобождаемыми праймерами и введением дополнительного временно неактивного ("спящего", Di) постоянно иммобилизованного праймера была использована для проведения одновременного анализа нескольких различных последовательностей (фиг. 2). 3'-концевой нуклеотид внутреннего праймера Di фосфорилирован, что делает этот праймер неактивным во время первой амплификационной стадии. Этот спящий праймер Di активировали путем удаления 3'-концевой фосфатной группы в результате обработки щелочной фосфатазой. Аллелеспецифическое удлинение (5) активированного праймера D проводили, чтобы определить, комплементарен ли его 3'-концевой нуклеотид соответствующему нуклеотиду в амплифицированном фрагменте исследуемой ДНК. Схема всего эксперимента, включающего как стадию ПЦР-амплификации, так и стадию детекции точечной нуклеотидной замены, приведена на фиг. 2А. Эта специально разработанная процедура была использована для анализа 6 точечных мутаций в трех генах, rpoB, katG and rpsL, ответственных за резистентность М. tuberculosis соответственно к рифампицину, изониазиду и стрептомицину (фиг. 2Б и табл. 1). На фиг. 2Б и 2В показано распределение и количественное измерение интенсивностей флуоресценции на биочипе, полученных в результате проведения двух таких экспериментов (параллельная множественная ПЦР-амплификация и последующая параллельная детекция мутаций в амплифицированных последовательностях, последовательно проводя ряд процедур на одном и том же биочипе). Соотношение интенсивностей флуоресценции (после гибридизации с новосинтезированными последовательностями аналогично предыдущему примеру) в случае аллелеспецифического удлинения полностью комплементарного праймера по сравнению с сигналом в гелевом элементе, где используемый для детекции праймер содержал 3'-концевой нуклеотид, отличный от соответствующего нуклеотида в исследуемой ДНК, было обычно около 5-10 к 1.
Визуальное и количественное сравнение интенсивностей флуоресценции для каждой пары (или группы) гелевых элементов, анализирующих одну и ту же нуклеотидную позицию и содержащих удлиняемые праймеры (D) для последовательности дикого типа или для соответствующей мутантной последовательности, позволяет однозначно определить присутствие или отсутствие мутации в данном положении исследуемой ДНК. Около 105 молекул геномной ДНК М. tuberculosis воспроизводимо анализировались этим методом, но мы предполагаем, что чувствительность этого метода может быть существенно повышена. Так, включение биотинилированных производных нуклеотидов в реакцию аллелеспецифического удлинения праймера и последующее использование авидина, конъюгированного с техасским красным, для детекции новосинтезированных последовательностей, повышало в несколько раз (по сравнению с описанной выше гибридизационной детекцией) силу специфического флуоресцентного сигнала в предварительных экспериментах.
Описанная комбинированная процедура ДНК-амплификации и анализа непосредственно на биочипе позволит одновременно анализировать мутации и нуклеотидный полиморфизм для многих различных геномных районов, при этом упростит, ускорит и удешевит такой анализ.
Ниже будут коротко упомянуты другие эксперименты, демонстрирующие варианты или отдельные элементы описанной выше многостадийной процедуры.
Иной механизм высвобождения исходно иммобилизованных праймеров был продемонстрирован. Вместо рибонуклеотидного звена в линкерный район праймера был введена олиго-dU последовательность. Были взяты моно-, ди- и тетрамеры (dU)n, и с удлинением этой последовательности повышалась эффективность последующего высвобождения праймера. Механизм высвобождения праймера в этом случае был двухстадийным. Сначала проводили обработку ферментом урацил-гликозилазой, в результате которой происходило отщепление урациловых оснований. Затем, уже во время первичной денатурации в ПЦР-смеси под маслом, проходил гидролиз нуклеотидной цепи в местах отщепления урацила. Иммобилизованный в этом эксперименте олигонуклеотид содержал флуоресцентную метку на 3'- конце, и за ходом реакции следили по уменьшению флуоресценции. Была продемонстрирована (фиг. 3) принципиальная возможность использования этого подхода.
Материалы и методы
Синтез олигонуклеотидов и производство биочипов были описаны ранее (5, 8). Полученные из Московского научного центра по борьбе с туберкулезом образцы, содержащие ДНК М. tuberculosis, были приготовлены из мокроты, как описано (5), и ДНК апуринизировали в 50 мкл 80% муравьиной кислоты при 20oС в течение 15 с. ДНК преципитировали 500 мкл 2% раствором LiClO4 в ацетоне, промывали ацетоном и высушивали. Апуринизированную ДНК инкубировали в 50 мкл 10% раствора пиперидина (Aldrich) при 90oС в течение 40 мин, чтобы фрагментировать ее до фрагментов длиной около 200-300 нуклеотидов, осаждали, промывали ацетоном и затем высушивали.
Все растворы были дегазированы, а минеральное масло было насыщено соответствующим буфером перед тем, как наносить их на биочип в специальной гибридизационной камере (5). Фрагментированную денатурированную ДНК наносили на биочип в 20 мкл гибридизационного буфера (0,5 М NaCl, 0,1 mM EDTA, 10 mM Tris-HCl, pH 7.5) и проводили гибридизацию с иммобилизованными на биочипе праймерами при 55oС в течение примерно 2 ч. Биочип промывали 0,15 М NaCl при 55oС (200 мкл•3 раза по 5 мин). Стандартный ПЦР-раствор (67 mM Tris-HCl, pH 8.6; 2,5 mM MgCl2; 16,6 mM (NH4)2SO4; 0,001% Triton X-100; 1 мг/мл BSA; 0,25 mM каждого из dATP, dCTP, dGTP и dTTP; 2.5 U Taq ДНК полимеразы на 30 мкл) использовали для последующих описанных ниже этапов процедуры. Биочип дважды промывали и затем инкубировали в ПЦР-растворе при 55oС в течение 15 мин, а затем при 72oС в течение 5 мин. Температуру понижали до 37oС. Рибонуклеазу А (концентрированный раствор - 10 мг/мл, Sigma) добавляли к свежей порции ПЦР-раствора до конечной концентрации 0,2 мг/мл. Этот ПЦР-раствор с РНКазой наносили на биочип на несколько секунд и затем быстро замещали его минеральным маслом для ПЦР (Perkin Elmer). Рибонуклеазную обработку под маслом вели в течение 15 мин при 37oС. Затем проводили 35-40 циклов ПЦР на биочипе, покрытом маслом (типичные циклы ПЦР были 40 с при 95oС, 45 с при 66oС, 30 с при 72oС). Гибридизационный анализ проводили, используя короткие флуоресцентно меченные олигонуклеотидные пробы (PI, P2 и Р3), после завершения ПЦР и отмывки неприкрепленной ДНК и высвобожденных праймеров. Гибридизацию проводили, как описано выше.
В случае усложненной процедуры, описанной на фиг. 2, первая часть эксперимента была идентичной описанной выше. После ПЦР-амплификации ДНК денатурировали при 95oС в течение 1 мин и затем гибридизовали с праймером Di при 54oС в течение 20 мин, после чего биочип тщательно отмывали в нескольких сменах 0.15 М NaCl при 55oС. "Спящий" праймер (Di) дефосфорилировали, обрабатывая биочип раствором, содержащим 3 единицы активности щелочной фосфатазы (CIP, Amersham) в 20 мкл 2 mM MgCl2 и 20 mМ Tris-Cl, pH 9,5, в течение 1 часа при 37oС. Фосфатазу затем тщательно отмывали в 0.15 М NaCl. Второй раунд ПЦР-амплификации для аллелеспецифического удлинения иммобилизованного внутреннего праймера проводили так же, как и в первый раунд, но в качестве фермента использовали Taq DNA Polymerase Stoffel fragment (Perkin Elmer) и реакцию вели согласно протоколу компании-изготовителя с добавлением 1 мг/мл BSA. Масло смывали с биочипа хлороформом и большим объемом 0,15 М NaCl. Дуплексы ДНК денатурировали при 95oС в 0.15 М NaCl в течение 5 мин и затем отмывали несколькими сменами того же раствора. Наличие удлиненных праймеров на биочипе анализировали с помощью гибридизации с флуоресцентно меченными одноцепочечными ДНК-пробами (см. таблицу 1). Гибридизацию с длинными пробами (РМ, фиг. 2) проводили в том же буфере, что и с короткими пробами, в течение 2 ч при 65oС, и несгибридизовавшуюся ДНК отмывали при 80oС.
Измерения флуоресценции ячеек биочипа проводили с использованием флуоресцентного микроскопа, оснащенного CCD-камерой и соответствующим программным обеспечением (5, 9).
Источники информации
1. Southern, E. , Mir, К. and Shchepinov, M. (1999) Molecular interactions on microarrays. Nature Genet. 21, 5-9.
2. Gerold, D., Rushmore, T. and Caskey, С. Т. (1999) DNA chips: promising toys have become powerful tools. Trends Biochem. Sci. 24, 168-173.
3. Adams, С. P. and Kron, S. J. (1997) Method for performing amplification of nucleic acid with two primers bound to a single solid support. US PTO. US 5641658.
4. Westin, L., Xu, X., Miller, C., Wang, L., Edman, C. F., and Nerenberg, M. (2000) Anchored multiplex amplification on a microelectronic chip array. Nat. Biotechnol. 18, 199-204.
5. Strizhkov, В. N., Drobyshev, A. L., Mikhailovich, V. M. and Mirzabekov, A. D. (2000) PCR amplification on microarray of gel-immobilized oligonucleotides: detection of bacterial toxin- and drug-resistant genes and their mutations. BioTechniques, 29, 844-857.
6. Dubiley, S., Kirillov, E., Lysov, Y. and Mirzabekov, A. (1997) Fractionation, phosphorylation and ligation on oligonucleotide microchips to enhance sequencing by hybridization. Nucleic Acids Res. 25, 2259-2265.
7. Dubiley, S. , Kirillov, E. and Mirzabekov, A. (1999) Polymorphism analysis and gene detection by minisequencing on an array of gel-immobilized primers. Nucleic Acids Res. 27, e19, i-vi.
8. Yershov, G., Barsky, V., Belgovskiy, A., Kirillov, E., Kreindlin, E., Ivanov, I., Parinov, S., Guschin, D., Drobyshev, A., Dubiley, S. and Mirzabekov, A. (1996) DNA analysis and diagnostics on oligonucleotide microchip. Proc. Natl. Acad. Sci. USA 93, 4913-4918.
9. Fotin, A., Drobyshev, A., Proudnikov, D., Perov, A. and Mirzabekov, A. (1998) Parallel thermodynamic analysis of duplexes on oligonucleotide microchips. Nucleic Acids Res. 26, 1515-1521.
10. Рубина А.Ю., Паньков С.В., Чернов Б.К., Мирзабеков А.Д. Способ иммобилизации олигонуклеотидов, содержащих непредельные группы, в полимерных гидрогелях при формировании биобиочипа. Заявка на патент РФ 99127744, приоритет от 28 декабря 1999 г.
10. Chakravarti, A. (1999) Population genetics-making sence out of sequence. Nat. Genet. (Suppl.) 21, 56-60.
11. Ramaswamy, S. and Musser, J. M. (1998) Tuber. Lung Dis. 79, 3-9.
12. Bentley K. W. in Elucidation of Organic Structures by Physical and Chemical Methods, Pt. 2, Bentley K.W., Kirby G.W., Eds. (Wiley, New York, 2 ed., 1973) p.177-185.


Изобретение относится к области молекулярной биологии и может быть использовано в научно-исследовательской и медицинской практике. Предложен новый подход к анализу любых нуклеотидных последовательностей в экспериментальном образце, нанесенном на микрочип с иммобилизованными в отдельных гелевых ячейках олигонуклеотидами, позволяющий совместить внутри каждого элемента чипа процесс амплификации тестируемых последовательностей с анализом амплифицированных продуктов. Для этого в различных ячейках иммобилизуют специфические наборы праймеров, которые помимо стандартных, постоянно иммобилизованных, праймеров содержат то или иное количество модулируемых праймеров (высвобождаемых, активируемых, инактивируемых), вводимых в действие по мере необходимости и используемых как для размножения, так и для анализа специфического для данной ячейки фрагмента ДНК. Энзиматические реакции проводят параллельно в отдельных гелевых элементах, покрытых и изолированных друг от друга минеральным маслом. Новый способ обеспечивает возможность одновременного анализа множества различных нуклеотидных последовательностей. 33 з.п. ф-лы, 4 ил., 1 табл.
Авторы
Даты
2003-12-10—Публикация
2001-05-04—Подача