Область изобретения
Изобретение относится к амидным соединениям и их солям, которые являются полезными в качестве лекарственных средств.
Предпосылки изобретения
Некоторые аминопиперазиновые производные известны как средства полезные против амнезии и против деменции, например, из международных публикаций РСТ WO 91/01979 и WO 98/35951.
Описание изобретения
Настоящее изобретение относится к амидным соединениям и их солям.
Более конкретно, оно относится к амидным соединениям и их солям, которые оказывают действие по усилению холинергической активности, к способам их получения, к фармацевтической композиции, содержащей такие соединения и к способу лечения и/или предотвращения или профилактики расстройств центральной нервной системы у млекопитающих, и более конкретно, к способу лечения и/или профилактики амнезии, деменции (например, старческой деменции, деменции Альцгеймера, деменции, связанной с различными заболеваниями, такой как церебрально-сосудистая деменция, церебральная пост-травматическая деменция, деменция вследствие опухоли мозга, деменция как следствие хронической субдуральной гематомы, деменция вследствие гидроцефалии с нормальным давлением, деменция после менингита, деменция типа болезни Паркинсона и т.д.), и тому подобное. Кроме того, ожидается, что соединение, являющееся объектом изобретения, будет полезным в качестве терапевтического и/или профилактического лекарственного средства для лечения шизофрении, депрессии, инсульта, раны головы, отказа от курения, травмы позвоночника, беспокойства, поллакиурии, недержания мочи, миотонической дистрофии, расстройства, связанного с недостаточным вниманием при гиперактивности, чрезмерной сонливости в дневное время (нарколепсии), болезни Паркинсона или аутизма.
Одной из целей данного изобретения является предоставление новых и полезных амидных соединений и их солей, которые оказывают действие по усилению холинергической активности.
Еще одной целью изобретения является предоставление способа получения амидных соединений и их солей.
Еще одной целью настоящего изобретения является предоставление фармацевтической композиции, включающей в качестве активного ингредиента указанные амидные соединения и их соли.
И еще одной целью настоящего изобретения является предоставление терапевтического способа для лечения и/или профилактики указанных выше заболеваний у млекопитающих с использованием амидных соединений и их солей.
Амидные соединения данного изобретения могут быть представлены следующей общей формулой [I]: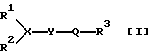
в которой R1 и R2 каждый представляет арил или ар(низший)алкил, или, взятые вместе, образуют низший алкилен или низший алкенилен, каждый из которых может быть замещен арилом или может быть сконденсирован с циклическим углеводородом, необязательно замещенным низшим алкилом, низшим алкокси, арилом, арилокси или галогеном,
R3 представляет низший алкил, низший алкокси, арил, ариламино или арилокси, каждый из которых может быть замещен низшим алкокси или галогеном, пиридил или пиридиламино,
Х представляет СН или N,
Y представляет простую связь или -NH-, и
Q представляет 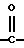
и их солями.
Соединение [I], являющееся объектом настоящего изобретения, или его соль можно получить способом, проиллюстрированным на схемах реакций, представленных в конце описания.
В приведенном выше и в последующем описании настоящего изобретения, подходящие примеры различных определений, включаемых в объем изобретения, подробно объясняются ниже.
Термин "низший" означает группу, имеющую 1-6 атомов углерода, если не указано иное.
Подходящим "низшим алкилом" и низшим алкильным фрагментом в термине "ар(низший)алкил" может быть C1-С6алкил с прямой или разветвленной цепью, такой как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, этилпропил, гексил или аналогичные, из которых предпочтительным является метил.
Подходящим "арилом" и арильным или ар фрагментом в терминах "ар(низший)алкил", "арилокси" и "ариламино" может быть фенил, нафтил, пентил, замещенный низшим алкилом [например, толил, ксилил, мезитил, куменил, ди(трет-бутил)фенил и т.д.] и аналогичные, из которых предпочтительным является фенил.
Подходящим "галогеном" может быть фтор, хлор, бром и йод, из которых предпочтительным является фтор.
Подходящим "ар(низшим)алкилом" может быть бензил, фенетил, фенилпропил, бензгидрил, тритил и аналогичные, из которых предпочтительным является бензил.
Подходящим "низшим алкиленом" может быть C1-C6 алкилен, такой как метилен, этилен, триметилен, пропилен, тетраметилен, пентаметилен, гексаметилен, метилпентаметилен или аналогичные, из которых предпочтительным является тетраметилен или пентаметилен.
Подходящим "низшим алкиленом" может быть C2-C6 алкилен с прямой или разветвленной цепью, такой как винилен, пропенилен, бутенилен, пентенилен, метилпентенилен, гексенилен, пентадиенилен или аналогичные, из которых предпочтительным является бутенилен, пентенилен или метилпентенилен.
Подходящим "низшим алкокси" может быть C1-C6 алкокси с прямой или разветвленной цепью, такой как метокси, этокси, пропокси, изопропокси, метилпропокси, бутокси, изобутокси, трет-бутокси, пентилокси, гексилокси или аналогичные, из которых предпочтительным является метокси.
Подходящим "циклическим углеводородом" может быть насыщенный или ненасыщенный циклический углеводород, такой как циклопентан, циклогексан, бензол, нафталин, индан, инден или аналогичные, из которых предпочтительным является бензол.
Предпочтительным соединением [I] является соединение, в котором R1 представляет арил или ар(низший)алкил, R2 представляет арил или ар(низший)алкил, R3 представляет арил или ариламино, каждый из которых может быть замещен галогеном, Х представляет СН или N, Y означает простую связь или -NH-, и Q означает 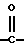 или соединение, в котором R1 и R2, взятые вместе, означают низший алкилен, который может быть замещен арилом или может быть сконденсирован с бензолом, необязательно замещенным низшим алкокси, R3 означает арил или ариламино, каждый из которых может быть замещен галогеном, пиридил или пиридиламино, X означает СН или N, Y означает простую связь или -NH- и Q означает
или соединение, в котором R1 и R2, взятые вместе, означают низший алкилен, который может быть замещен арилом или может быть сконденсирован с бензолом, необязательно замещенным низшим алкокси, R3 означает арил или ариламино, каждый из которых может быть замещен галогеном, пиридил или пиридиламино, X означает СН или N, Y означает простую связь или -NH- и Q означает 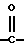
Подходящими солями соединения [I] являются фармацевтически приемлемые общепринятые нетоксичные соли, которые включают кислотно-аддитивные соли, такие как соли присоединения неорганической кислоты [например, гидрохлорид, гидробромид, сульфат, фосфат и т.д.], соли присоединения органической кислоты [например, формиат, ацетат, трифторацетат, малеат, тартрат, метансульфонат, бензолсульфонат, толуолсульфонат и т. д. ], соли с аминокислотами [например, соль аспарагиновой кислоты, глутаминовой кислоты и т.д.], соли металлов, такие как соль щелочного металла [например, натриевая соль, калиевая соль и т.д.] и соль щелочноземельного металла [например, кальциевая, магниевая соль и т.д.] и аналогичные.
Способ получения соединения [I], подробно поясняется ниже.
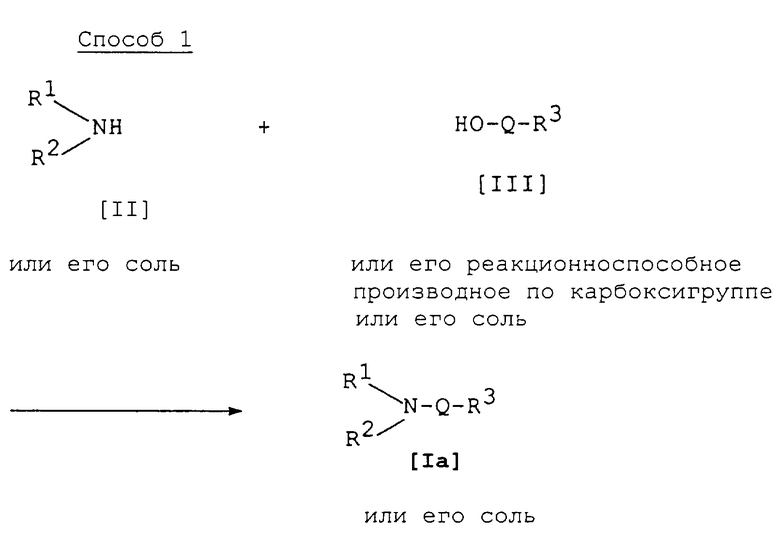
Способ 1
Соединение [Iа] или его соль можно получить взаимодействием соединения [II] или его соли с соединением [III] или его реакционноспособным производным по карбоксигруппе или его солью.
Подходящими солями соединений [Iа] и [II] могут быть такие же соли, которые приводились в качестве примера для соединения [I].
Подходящими солями соединения [III] и его реакционноспособного производного по карбоксигруппе могут быть соли металлов или соли щелочноземельных металлов, примеры которых указаны для соединения [I].
Подходящее реакционноспособное производное по карбоксигруппе или соединение [III] могут включать сложный эфир, галогенангидрид кислоты, ангидрид кислоты и т.п. Подходящими примерами реакционноспособных производных могут быть галогенангидрид кислоты [например, хлорангидрид кислоты, бромангидрид кислоты и т.п.]; симметричный ангидрид кислоты, смешанный ангидрид кислоты с кислотой, такой как алифатическая карбоновая кислота [например, уксусная кислота, пивалиновая кислота и т.д.], замещенная фосфорная кислота [например, диалкилфосфорная кислота, дифенилфосфорная кислота и т.д.]; сложный эфир, такой как замещенный или незамещенный низший алкиловый эфир [например, метиловый эфир, этиловый эфир, пропиловый эфир, гексиловый эфир, трихлорметиловый эфир и т.д.], замещенный или незамещенный ар(низший)алкиловый эфир [например, бензиловый эфир, бензгидриловый эфир, п-хлорбензиловый эфир и т. д.], замещенный или незамещенный ариловый эфир [например, фениловый эфир, толиловый эфир, 4-нитрофениловый эфир, 2,4-динитрофениловый эфир, пентахлорфениловый эфир, нафтиловый эфир и т.д.] или сложный эфир с N, N-диметилгидроксиамином, N-гидроксисукцинимидом, N-гидроксифталимидом или 1-гидроксибензотриазолом, 1-гидрокси-6-хлор-1Н-бензотриазолом или аналогичными. Данные реакционноспособные производные могут быть необязательно выбраны в соответствии с типом используемого соединения [III].
Реакцию обычно осуществляют в обычном растворителе, таком как вода, ацетон, диоксан, хлороформ, метиленхлорид, этилендихлорид, тетрагидрофуран, этилацетат, N, N-диметилформамид, пиридин или любой другой органический растворитель, который не оказывает негативного влияния на реакцию. Среди данных растворителей могут использоваться гидрофильные растворители в смеси с водой.
Реакцию также предпочтительно осуществляют в присутствии обычного основания, такого как триэтиламин, диизопропил-этиламин, пиридин, N,N-диметиламинопиридин и т.д. или их смесь.
Когда соединение [III] используют в реакции в форме свободной кислоты или ее соли, реакцию предпочтительно осуществляют в присутствии обычного конденсирующего агента, такого как N,N'-дициклогексилкарбодиимид, N-циклогексил-N'-морфолиноэтилкарбодиимид, N-этил-N'-(3-диметиламинопропил)-карбодиимид, тионилхлорид, оксалилхлорид, низший алкоксикарбонилгалогенид [например, этилхлорформиат, изобутилхлорформиат и т.д.], 1-(п-хлорбензолсульфонилокси)-6-хлор-1Н-бензотриазол или т.п.
Температура реакции не имеет решающего значения, и реакцию можно осуществлять в условиях от охлаждения до нагревания.
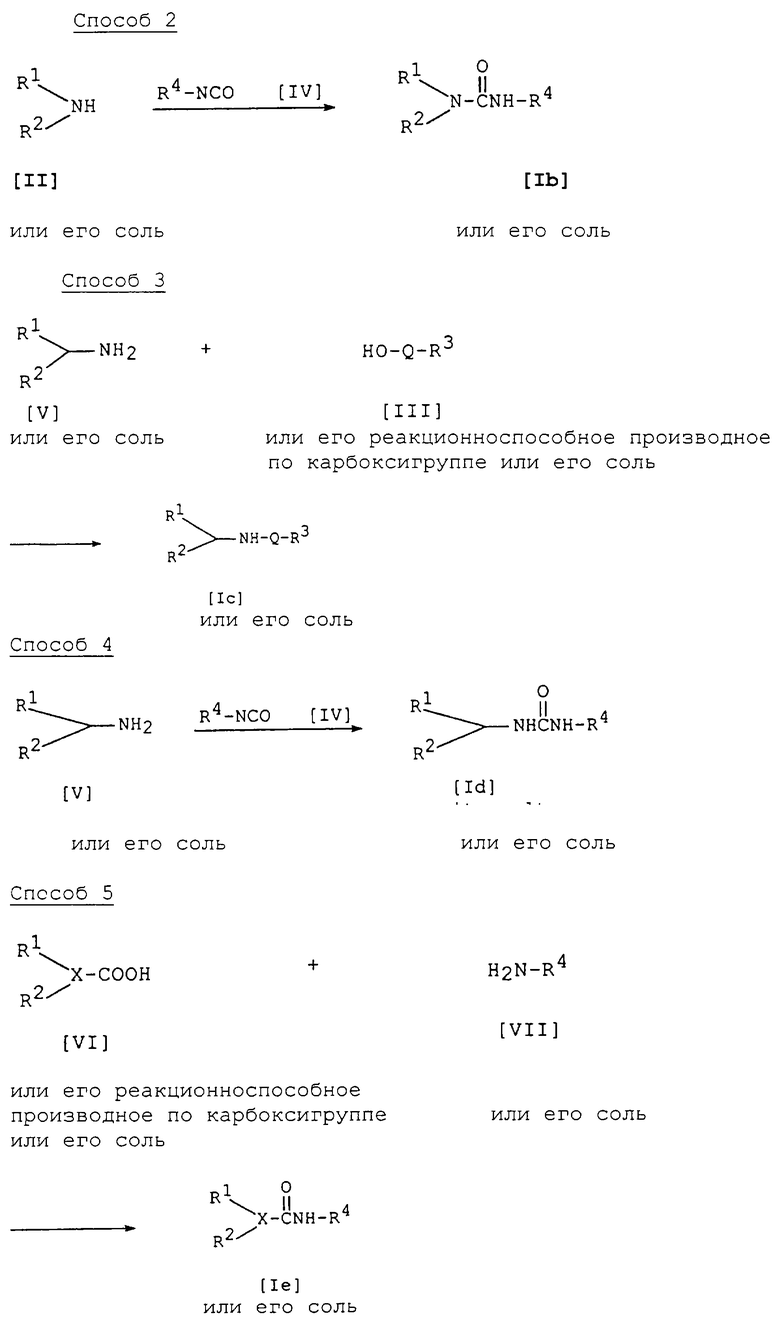
Способ 2
Соединение [Ib] или его соль можно получить по реакции соединения [II] или его соли с соединением [IV]. Подходящими солями соединений [Ib] и [II] могут быть соли, указанные для соединения [I].
Данную реакцию обычно осуществляют в растворителе, таком как диоксан, тетрагидрофуран, бензол, толуол, хлороформ, метиленхлорид или любой другой органический растворитель, который не оказывает отрицательного влияния на реакцию.
Температура реакции не имеет решающего значения, и реакцию можно осуществлять в условиях от охлаждения до нагревания.
Способ 3
Соединение [Iс] или его соль можно получить взаимодействием соединения [V] или его соли с соединением [III] или его реакционноспособным производным по карбоксигруппе или его солью.
Подходящими солями соединений [Iс] и [V] могут быть соли, указанные для соединения [I].
Подходящими солями соединения [III] и его реакционноспособного производного по карбоксигруппе могут быть соли металлов или соли щелочноземельных металлов, указанные для соединения [I].
Данную реакцию осуществляют по существу тем же способом, как способ 1, и поэтому режим и условия реакции [например, растворитель, температура реакции и т.д.] являются такими, как указаны для способа 1.
Способ 4
Соединение [Id] или его соль можно получить взаимодействием соединения [V] или его соли с соединением [IV].
Подходящими солями соединений [Id] и [V] могут быть соли, указанные для соединения [I].
Реакцию осуществляют по существу таким же образом, как способ 2, и поэтому режим и условия реакции [например, растворитель, температура реакции и т.д.] являются такими, как указаны для способа 2.
Способ 5
Соединение [Iе] или его соль можно получить взаимодействием соединения [VI] или его реакционноспособного производного по карбоксигруппе или его соли с соединением [VII] или его солью.
Подходящими солями соединений [Iе] и [VI] могут быть соли, указанные для соединения [I].
Подходящей солью соединения [VII] может быть кислотно-аддитивная соль, примеры которой указаны для соединения [I].
Данную реакцию осуществляют по существу таким же образом, как способ 1, и поэтому режим и условия реакции [например, растворитель, температура реакции и т.д.] являются такими же, как указаны для способа 1.
Соединения, полученные способами, указанными выше, могут быть выделены и очищены обычным способом, таким как распыление, перекристаллизация, колоночная хроматография, повторное осаждение или аналогичные.
Следует заметить, что соединение [I] и другие соединения, вследствие наличия асимметрического(их) атома(ов) углерода и двойной(ых) связи(ей), могут включать один или более стереоизомеров, таких как оптические изомеры или геометрические изомеры, и все из таких изомеров и их смесь охватываются объемом настоящего изобретения.
Кроме того, следует отметить, что любой сольват [например, указанное в скобках соединение (например, гидрат, этанолят и т.д.)] соединения [I] или его соли включены в объем настоящего изобретения.
Целевое соединение [I] и его соли оказывают сильное усиливающее холинергическую активность действие и поэтому они являются полезными для лечения и/или профилактики расстройств центральной нервной системы у млекопитающих, и более конкретно, амнезии, деменции (например, старческой деменции, деменции Альцгеймера, деменции, связанной с различными заболеваниями, такой как церебрально-сосудистая деменция, церебральная посттравматическая деменция, деменция, вследствие опухоли мозга, деменция, вследствие хронической субдуральной гематомы, деменция, вследствие гидроцефалии с нормальным давлением, деменция после менингита, деменция типа болезни Паркинсона и т.д.), и других. Кроме того, ожидается, что соединение, являющееся объектом изобретения, будет полезным в качестве терапевтического и/или профилактического лекарственного средства для лечения шизофрении, депрессии, инсульта, раны головы, отказа от курения, травмы позвоночника, беспокойства, поллакиурии, недержания мочи, миотонической дистрофии, расстройства, связанного с недостаточным вниманием при гиперактивности, чрезмерной сонливости в дневное время (нарколепсии), болезни Паркинсона или аутизма.
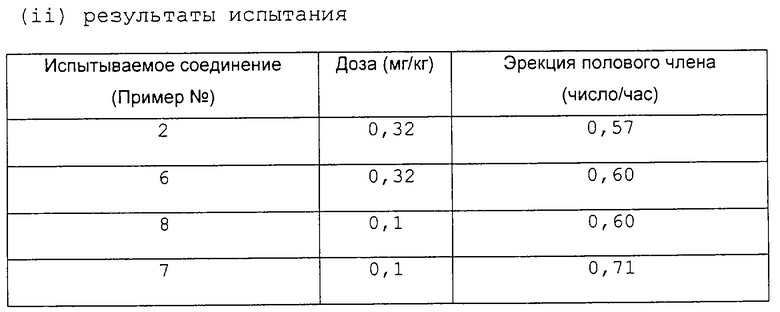
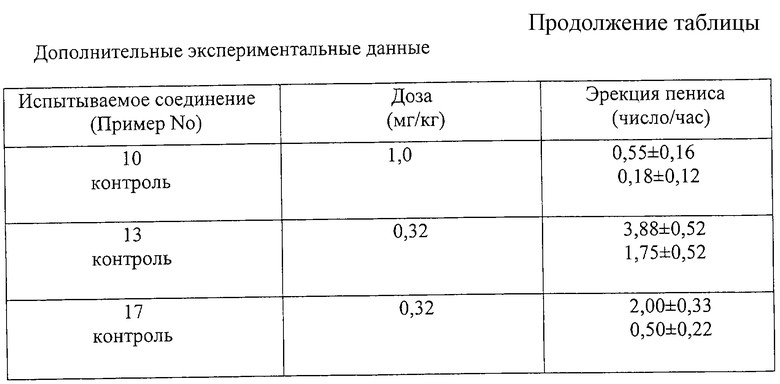
Для иллюстрации полезности соединения [I] ниже приводятся данные фармакологических испытаний соединения [I].
Испытание
Эрекция полового члена у крыс.
(Данное испытание осуществляли по способу, аналогичному описанному в Jpn.J.Pharmacjl., Vol. 64, 147-153 (1994)).
(i) Метод
Использовали самцов крыс Fischer 344, в возрасте 8 недель (n=7). Со всеми крысами производили манипуляции по 3 минуты в день в течение трех дней подряд перед испытаниями. Крыс испытывали в группах по семь особей в каждой, и они получали разные дозы испытываемого соединения в полурэндомизированном порядке. Испытываемые соединения суспендировали в 0,5% метилцеллюлозе непосредственно перед использованием и вводили внутрибрюшинно в объеме 1 мл/кг непосредственно перед началом испытания. Сразу же после инъекции каждую крысу помещали в ящик из "perspex" (25•25•35 см) и наблюдали за ее поведением в течение 60 минут, в течение которых подсчитывали количество эрекций полового члена. За каждым ящиком (камерой) помещали зеркало для облегчения наблюдения за крысой. Данные выражали в виде средних величин. Результаты представлены в таблице.
Как следует из описания в Journal of Pharmacology and Experimental Therapeutics, Vol. 279. 3, 1157-1173 (1996), соединение, обладающее упомянутой выше активностью, способствует уменьшению дефицита памяти (т.е. амнезии, деменции и т. д. Кроме того, на основании некоторых патентных заявок (например, международная публикация РСТ WO 98/27930 и т.п.) можно ожидать, что соединение, обладающее указанной выше активностью, будет полезным в качестве терапевтического и/или профилактического средства при указанных выше заболеваниях.
В терапевтических целях соединение формулы [I] и его фармацевтически приемлемую соль по настоящему изобретению можно использовать в форме фармацевтического препарата, содержащего одно из указанных соединений в качестве активного ингредиента, в смеси с фармацевтически приемлемым носителем, таким как органический или неорганический твердый, полутвердый или жидкий эксципиент, подходящий для перорального или парентерального введения. Фармацевтические препараты представляют собой капсулы, таблетки, драже, гранулы, суппозитории, растворы, суспензии, эмульсии и т.д. При желании, в такие препараты можно включать вспомогательные агенты, стабилизирующие агенты, смачивающие или эмульгирующие агенты, буферы и другие, обычно используемые добавки.
Хотя доза соединения [I] варьирует в зависимости от возраста и состояния пациента, средняя разовая доза, составляющая около 0,1 мг, 1 мг, 10 мг, 50 мг, 100 мг, 250 мг, 500 мг и 1000 мг соединения [I], может быть эффективной для лечения указанных выше заболеваний. Обычно, в сутки может вводиться примерно между 0,1 мг/организм и 1000 мг/организм.
Приводимые ниже препаративные примеры и примеры предназначены для иллюстрации настоящего изобретения.
Препаративный пример 1
К раствору 4-метилциклогекс-3-енкарбонилхлорида (2 мл) в смеси метанола (20 мл) и тетрагидрофурана (20 мл) добавляли водный раствор гидроксида натрия (4N, 20 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 часа и упаривали. Остаток брали в смесь воды и этилацетата и доводили рН смеси до около 1. Органический слой отделяли, промывали насыщенным солевым раствором и сушили над сульфатом магния и упаривали при пониженном давлении с получением 4-метилциклогекс-3-енкарбоновой кислоты, которую использовали без дополнительной очистки.
ЯМР (ДМСО-d6, δ:): 1,60 (3Н, с), 1,35-1, 65 (1H, м), 1,75-2,2 (5Н, м), 2,25-2,45 (1Н, м), 5,25-5,4 (1Н, м), 12,09 (1Н, шир.с)
МС (LD)(m/z): 139,2.
Препаративный пример 2
К раствору 4-метилциклогекс-3-енкарбоновой кислоты (1,7 г) и триэтиламина (1,8 мл) в трет-бутаноле (35 мл) добавляли дифенилфосфорилазид (2,6 мл), и смесь кипятили с обратным холодильником в течение 8 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом, промывали последовательно хлористоводородной кислотой (1N), водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над сульфатом магния. Упаривание при пониженном давлении давало остаток, который хроматографировали на силикагеле (150 мл) с элюированием 1-3% этилацетатом в н-гексане с получением 1-трет-бутоксикарбониламино-4-метилциклогекс-3-ена (0,82 г).
ЯМР (ДМСО-d6, δ): 1,37 (9Н, с), 1,60 (3Н, с), 1,65-2,2 (6Н, м), 3,2-3,4 (1Н, м), 5,2-5,3 (1Н, м), 6,68 (1Н, шир.с)
МС (LD)(m/z): 234,3.
Препаративный пример 3
К раствору 1-трет-бутоксикарбониламино-4-метилциклогекс-3-ена (0,4 г) в смеси анизола (0,4 мл) и дихлорметана (0,8 мл) добавляли трифторуксусную кислоту (1,2 мл) при 0oС, и смеси давали перемешиваться в течение 1 часа. Упаривание давало остаток, который брали в раствор хлористого водорода в диоксане (4N, 2 мл). Упаривание при пониженном давлении и растирание с диизопропиловым эфиром давало гидрохлорид 1-амино-4-метилциклогекс-3-ена, который использовали без дополнительной очистки.
Пример 1
Раствор 1,2,3,6-тетрагидропиридина (0,25 г) и 4-феноксикарбониламинопиридина (0,64 г) в 1,2-дихлорэтане (5 мл) нагревали до 75oС в течение 6 часов. Упаривание растворителя давало остаток, который хроматографировали на силикагеле (50 мл), элюируя 0-5% метанолом в дихлорметане, и брали в раствор хлористого водорода в этилацетате (4N, 2 мл). Упаривание при пониженном давлении и растирание с диизопропиловым эфиром давало гидрохлорид 1-(пиридин-4-илкарбамоил)-1,2,3,6-тетрагидропиридина (0,43 г).
ЯМР (ДМСО-d6, δ): 2,05-2,35 (2Н, м), 3,64 (2Н, т, J=6 Гц), 4,05 (2Н, т, J=2,5 Гц), 5,6-5,8 (1Н, м), 5,8-6,0 (1Н, м), 8,06 (2Н, д, J=7 Гц), 8,55 (2Н, д, J=7 Гц), 10,58 (1Н, с), 14,72 (1Н, шир.с).
МС (LD)(m/z): 204,2.
Пример 2
К перемешиваемому раствору 1,2,3,6-тетрагидропиридина (82 мг) в тетрагидрофуране (2 мл) добавляли 4-фторфенилизоцианат (0,112 мл) при комнатной температуре. После перемешивания при комнатной температуре в течение 10 часов растворитель удаляли выпариванием при пониженном давлении, и остаток растирали с диизопропиловым эфиром с получением 1-(4-фторфенилкарбамоил)-1,2,3,6-тетрагидропридина (117 мг).
ЯМР (ДМСО-d6, δ): 2,0-2,2 (2Н, м), 3,51 (2Н, т, J=5,7 Гц), 3,85-3,95 (2Н, м), 5,65-5,95 (2Н, м), 6,95-7,15 (2Н, м), 7,35-7,55 (2Н, м), 8,47 (1H, с).
МС (LD)(m/z): 243,1.
Пример 3
Следующее соединение получали способом, аналогичным способу Примера 2.
2-(4-Фторфенилкарбамоил)-1,2,3,4-тетрагидроизохинолин.
ЯМР (ДМСО-d6, δ): 2,85 (2Н, т, J=6 Гц), 3,69 (2Н, т, J=6 Гц), 4,63 (2Н, с), 7,07 (2Н, т, J=9 Гц), 7,18 (4Н, с), 7,48 (2Н, дд, J=5,9 Гц), 8,60 (1Н, с).
МС (LD)(m/z): 293,2.
Пример 4
К раствору 1-трет-бутоксикарбониламино-4-метилциклогекс-3-ена (0,18 г) в смеси анизола (0,18 мл) и дихлорметана (0,36 мл) добавляли трифторуксусную кислоту (0,54 мл) при 0oС, и смеси давали перемешиваться в течение 1 часа. Упаривание давало остаток, который брали в 1,2-дихлорэтан (5 мл). К смеси добавляли триэтиламин (0,6 мл) и 4-феноксикарбониламинопиридин (0,183 г), и полученную смесь нагревали при 75oС в течение 6 часов. Упаривание давало остаток, который хроматографировали на силикагеле (50 мл) с элюированием 7% метанолом в дихлорметане, и брали в раствор хлористого водорода в этилацетате (4N, 2 мл). Упаривание при пониженном давлении и растирание с диизопропиловым эфиром давало гидрохлорид N-(4-метилциклогекс-3-ен-1-ил)-N'-(пиридин-4-ил)мочевины (0,144 г).
ЯМР (ДМСО-d6, δ): 1,64 (3Н, с), 1,4-2,4 (6Н, м), 3,6-3,9 (1Н, м), 5,2-5,35 (1Н, м), 7,26 (1Н, д, J=8 Гц), 7,82 (2Н, д, J=7 Гц), 8,51 (2Н, д, J=7 Гц), 10,91 (1Н, с), 14,50 (1Н, шир.с)
МС (LD)(m/z): 232,2.
Пример 5
К суспензии гидрохлорида 1-амино-4-метилциклогекс-3-ена (0,103 г) в дихлорметане (5 мл) добавляли последовательно пиридин (0,14 мл) и 4-фторбензоилхлорид (83 мкл) при 0oС. Смеси давали подогреваться до комнатной температуры и перемешивали в течение 1 часа, затем брали ее в смесь воды и этилацетата. Отделенный органический слой промывали последовательно хлористоводородной кислотой (1N), водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над сульфатом магния. Упаривание при пониженном давлении давало остаток, который хроматографировали на силикагеле (50 мл), элюируя 0-20% этилацетатом в н-гексане с получением 1-(4-фторбензоиламино)-4-метоксициклогекс-3-ена (98 мг).
ЯМР (ДМСО-d6, δ): 1,59 (3Н, с), 1,4-2,3 (6Н, м), 3,8-4,1 (1Н, м), 5,35-5,5 (1Н, м), 7,27 (2Н, т, J=9 Гц), 7,89 (2Н, дд, J=5,9 Гц), 8,25 (1Н, д, J=7 Гц)
МС (LD)(m/z): 234.
Пример 6
Следующее соединение получали способом, аналогичным способу Примера 5.
2-(4-Фторбензоиламино)-1,2,3,4-тетрагидронафталин.
ЯМР (ДМСО-d6, δ): 1,65-1,9 (1Н, м), 1,95-2,25 (1Н, м), 2,7-3,1 (4Н, м), 4,05-4,3 (1Н, м), 7,08 (4Н, с), 7,2-7,4 (2Н, м), 7,85-8,05 (2Н, м), 8,45 (1Н, д J=7,5 Гц).
МС (APCI)(m/z): 270.
Пример 7
К суспензии гидрохлорида 1-амино-4-метилциклогекс-3-ена (0,103 г) в дихлорметане (5 мл) добавляли последовательно пиридин (0,14 мл), гидрохлорид 4-пиридинкарбонилхлорида (0,124 г) и N,N-диметиламинопиридин (0,11 г) при 0oС. Смеси давали подогреваться до комнатной температуры и перемешивали в течение 1 часа. Реакционную смесь брали в смесь воды и этилацетата, и рН доводили до 4,6. Отделенный органический слой промывали последовательно водой и насыщенным солевым раствором и сушили над сульфатом магния. Упаривание при пониженном давлении давало остаток, который растирали с диизопропиловым эфиром с получением 1-(пиридин-4-илкарбониламино)-4-метоксициклогекс-3-ена (46 мг).
ЯМР (ДМСО-d6, δ): 1,64 (3Н, с), 1,45-3,35 (6Н, м), 3,8-4,1 (1Н, м), 5,2-5,45 (1Н, м), 7,74 (2Н, дд, J=1,6, 4,5 Гц), 8,53 (1Н, д, J=7,5 Гц), 8,70 (2Н, дд, J=1,6, 4,5 Гц).
МС (APCI)(m/z): 217.
Пример 8
Следующее соединение получали способом, аналогичным способу Примера 7.
2-(Пиридин-4-илкарбониламино)-1,2,3,4-тетрагидронафталин.
ЯМР (ДМСО-d6, δ): 1,65-1,9 (1Н, м), 1,95-2,15 (1H, м), 2,7-3,15 (4Н, м), 4,05-4,3 (1Н, м), 7,10 (4Н, с), 7,78 (2Н, дд, J=1,6, 4,5 Гц), 8,65-8,8 (3Н, м).
МС (APCI)(m/z): 253.
Пример 9
1) К раствору 1-трет-бутоксикарбониламино-4-метилциклогекс-3-ена (0,18 г) в смеси анизола (0,18 мл) и дихлорметана (0,36 мл) добавляли трифторуксусную кислоту (0,54 мл) при 0oС, и смесь оставляли для перемешивания на 1 час при 0oС. Упаривание давало остаток, содержащий 1-амино-4-метилциклогекс-3-ен.
2) Остаток, содержащий 1-амино-4-метилциклогекс-3-ен, брали в дихлорметан (5 мл). К смеси добавляли триэтиламин (0,6 мл) и 4-фторфенилизоцианат (97 мкл) при 0oС, и полученную смесь оставляли для перемешивания на 30 минут при 0oС. Упаривание при пониженном давлении давало остаток, который брали в смесь воды и этилацетата. Отделенный органический слой промывали насыщенным солевым раствором, упаривали при пониженном давлении и растирали с н-гексаном с получением N-(4-метилциклогекс-3-ен-1-ил)-N'-(4-фторфенил) мочевины (0,206 г).
ЯМР (ДМСО-d6, δ): 1,63 (3Н, с), 1,3-1,9 (3Н, м), 1,9-2,1 (2Н, м), 2,1-2,4 (1Н, м), 3,6-3,85 (1Н, м), 5,25-5,35 (1H, м), 6,07 (1Н, д, J=8 Гц), 7,36 (2Н, дд, J=5, 9 Гц), 8,38 (1Н, с).
МС (LD)(m/z): 271,2.
Пример 10
Следующее соединение получали способом, аналогичным способу Примера 2 с использованием в качестве исходного соединения 2-амино-1,2,3,4-тетрагидронафталина.
N-(4-Фторфенил)-N'-(1,2,3,4-тетрагидронафталин-2-ил)мочевина.
ЯМР (ДМСО-d6, δ): 1,6-1,8 (1Н, м), 1,8-2,05 (1H, м), 2,63 (1Н, дд, J= 8,16 Гц), 2,83 (2Н, т, J=7 Гц), 3,02 (1Н, дд, J=5, 16 Гц), 3,8-4,1 (1Н, м), 6,22 (1Н, д, J=7,5 Гц), 6,95-7,2 (2Н, м), 7,12 (4Н, с), 7,3-7,45 (2Н, м), 8,40 (1Н, с).
МС (APCI)(m/z): 285.
Пример 11
К раствору амидодифенилметана (0,4 г) в дихлорметане (5 мл) добавляли последовательно пиридин (0,21 мл) и 4-фторбензоилхлорид (0,23 мл) при 0oС. Смеси давали подогреваться до комнатной температуры и перемешивали в течение 1 часа. Реакционную смесь брали в смесь воды и этилацетата. Отделенный органический слой промывали последовательно хлористоводородной кислотой (1N), водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над сульфатом магния. Упаривание при пониженном давлении давало остаток, который растирали с диизопропиловым эфиром с получением (4-фторбензоиламино)дифенилметана (0,49 г).
ЯМР (ДМСО-d6, δ): 6,40 (1Н, д, J=9 Гц), 7,2-7,45 (12Н, м), 8,01 (2Н, дд, J=5,9 Гц), 9,30 (1Н, д, J=9 Гц).
МС (APCI)(m/z): 306.
Пример 12
К раствору 4-фторанилина (0,2 г) в дихлорметане (10 мл) добавляли последовательно пиридин (0,19 мл) и дифенилкарбамоилхлорид (0,417 г) при 0oC. Смеси давали подогреваться до комнатной температуры и перемешивали в течение 10 часов, к смеси добавляли N,N-диметиламинопиридин (0,22 г). Реакционную смесь брали в смесь воды и этилацетата. Отделенный органический слой промывали последовательно хлористоводородной кислотой (1N), водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над сульфатом магния. Упаривание при пониженном давлении давало остаток, который растирали с диизопропиловым эфиром с получением N,N-дифенил-N'-4-фторфенилмочевины (0,384 г).
ЯМР (ДМСО-d6, δ): 7,07 (2Н, т, J=9 Гц), 7,15-7,3 (6Н, м), 7,3-7,5 (6Н, м), 8,45 (1Н, с).
МС (APCI)(m/z): 307.
Пример 13
К раствору гидрохлорида (R)-1,2,3,4-тетрагидронафталин-2-иламина (0,9 г) в дихлорметане (15 мл) добавляли последовательно триэтиламин (1,71 мл) и 4-фторбензоилхлорид (0,58 мл) при 0oС. Смеси давали подогреваться до комнатной температуры и перемешивали в течение 1 часа. Реакционную смесь брали в смесь воды и этилацетата. Отделенный органический слой промывали последовательно хлористоводородной кислотой (1N), водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над сульфатом магния. Упаривание при пониженном давлении давало остаток, который растирали с диизопропиловым эфиром с получением (R)-4-фтор-N-(1,2,3,4-тетрагидронафталин-2-ил)бензамида (1,26 г).
ЯМР (ДМСО-d6, δ): 1,60-1,89 (1Н, м), 1,95-2,16 (1H, м), 2,70-3,14 (4Н, м), 4,05-4,30 (1Н, м), 7,09 (4Н, с), 7,30 (2Н, т, J=8,9 Гц), 7,86-8,04 (2Н, м), 8,45 (1Н, д, J=7,6 Гц).
МС (APCI)(m/z): 270,3.
Пример 14
К раствору гидрохлорида (S)-1,2,3,4-тетрагидронафталин-2-иламина (0,9 г) в дихлорметане (15 мл) добавляли последовательно триэтиламин (1,71 мл) и 4-фторбензоилхлорид (0,58 мл) при 0oС. Смеси давали подогреваться до комнатной температуры и перемешивали в течение 1 часа. Реакционную смесь брали в смесь воды и этилацетата. Отделенный органический слой промывали последовательно хлористоводородной кислотой (1N), водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над сульфатом магния. Упаривание при пониженном давлении давало остаток, который растирали с диизопропиловым эфиром с получением (S)-4-фтор-N-(1,2,3,4-тетрагидронафталин-2-ил)бензамида (1,26 г).
ЯМР (ДМСО-d6, δ): 1,60-1,89 (1H, м), 1,95-2,16 (1H, м), 2,70-3,14 (4Н, м), 4,05-4,30 (1Н, м), 7,09 (4Н, с), 7,30 (2Н, т, J=8,9 Гц), 7,86-8,04 (2Н, м), 8,45 (1Н, д, J=7,6 Гц).
МС (APCI)(m/z): 270,3.
Пример 15
К раствору 7-метокси-1,2,3,4-тетрагидронафталин-2-иламина (0,49 г) в дихлорметане (5 мл) добавляли последовательно пиридин (0,29 мл) и 4-фторбензоилхлорид (0,33 мл) при 0oС. Смеси давали подогреваться до комнатной температуры и перемешивали в течение 1 часа. Реакционную смесь брали в смесь воды и этилацетата. Отделенный органический слой промывали последовательно хлористоводородной кислотой (1N), водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над сульфатом магния. Упаривание при пониженном давлении давало остаток, который растирали с диизопропиловым эфиром с получением 4-фтор-N-(7-метокси-1,2,3,4-тетрагидронафталин-2-ил)бензамида (497 мг).
ЯМР (ДМСО-d6, δ): 1,60-1,85 (1Н, м), 1,92-2,13 (1Н, м), 2,63-3,10 (4Н, м), 3,70 (2Н, с), 4,00-4,25 (1H, м), 6,60-6,79 (2Н, м), 7,00 (1Н, д, J=8,2 Гц), 7,30 (2Н, т, J=8,9 Гц), 7,89-8,04 (2Н, м), 8,44 (1Н, д, J=7,6 Гц).
МС (APCI)(m/z): 300.
Пример 16
К раствору 6-метокси-1,2,3,4-тетрагидронафталин-2-иламина (0,57 г) в дихлорметане (5 мл) добавляли последовательно триэтиламин (0,46 мл) и 4-фторбензоилхлорид (0,30 мл) при 0oС. Смеси давали подогреваться до комнатной температуры и перемешивали в течение 1 часа. Реакционную смесь брали в смесь воды и этилацетата. Отделенный органический слой промывали последовательно хлористоводородной кислотой (1N), водным раствором бикарбоната натрия и сушили над сульфатом магния. Упаривание при пониженном давлении давало остаток, который растирали с диизопропиловым эфиром с получением 4-фтор-N-(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)-бензамида (0,59 г).
ЯМР (ДМСО-d6, δ): 1,60-1,85 (1Н, м), 1,92-2,10 (1H, м), 2,60-3,07 (4Н, м), 3,71 (3Н, с), 4,00-4,30 (1H, м), 6,60-6,75 (2Н, м), 6,99 (1Н, д, J=8,2 Гц), 7,30 (2Н, т, J=8,9 Гц), 7,80-8,04 (2Н, м), 8,42 (1Н, д, J=7,6 Гц).
МС (APCI)(m/z): 300.
Пример 17
К раствору индан-2-иламина (0,297 г) в дихлорметане (5 мл) добавляли последовательно пиридин (0,23 мл) и 4-фторбензоилхлорид (0,26 мл) при 0oС. Смеси давали подогреваться до комнатной температуры и перемешивали в течение 1 часа. Реакционную смесь брали в смесь воды и этилацетата. Отделенный органический слой промывали последовательно хлористоводородной кислотой (1N), водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над сульфатом магния. Упаривание при пониженном давлении давало остаток, который растирали с диизопропиловым эфиром с получением 4-фтор-N-(индан-2-ил)бензамида (0,325 г).
ЯМР (ДМСО-d6, δ): 2,94 (2Н, дд, J=6,7, 16,0 Гц), 3,24 (2Н, дд, J=6,7, 16,0 Гц), 4,55-4,80 (1H, м), 7,06-7,40 (6Н, м), 7,83-8,04 (2Н, м), 8,67 (1Н, д, J=6,7 Гц).
МС (APCI)(m/z): 256.
| название | год | авторы | номер документа |
|---|---|---|---|
| АМИДЫ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2000 |
|
RU2208608C2 |
| ПРОИЗВОДНЫЕ НАФТАЛИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2155188C2 |
| ПРОИЗВОДНЫЕ ГУАНИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ ИНГИБИРОВАНИЯ NA/H - ОБМЕНА В КЛЕТКАХ | 1994 |
|
RU2141946C1 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПРЕДУПРЕЖДЕНИЯ И УСТРАНЕНИЯ ТРОМБОЗОВ | 1992 |
|
RU2103276C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТИАЗОЛА ИЛИ ИХ СОЛЕЙ С ГАЛОИДВОДОРОДНОЙ КИСЛОТОЙ | 1990 |
|
RU2010026C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПИРАЗОЛПИРИДИНОВОГО ПРОИЗВОДНОГО ИЛИ ЕГО СОЛИ | 1990 |
|
RU2007403C1 |
| АНТИБИОТИЧЕСКАЯ КОМПОЗИЦИЯ | 1988 |
|
RU2029549C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1994 |
|
RU2176640C2 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1989 |
|
RU2007406C1 |
| ПРОИЗВОДНЫЕ АРОИЛПИПЕРАЗИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 1998 |
|
RU2258702C2 |

Изобретение относится к новым амидам формулы (1) (R1)(R2)-X-Y-Q-R3 (1), где R1 и R2, взятые вместе, образуют бутенилен или пентенилен, каждый из которых может быть конденсирован с бензолом, необязательно замещенным С1-С6алкокси; R3 представляет фенил, замещенный галогеном, Х представляет СН, Y представляет -NH- и Q представляет -С(О)-, при условии, что, когда R1 и R2, взятые вместе, образуют бутенилен, конденсированный с бензолом, тогда индановое кольцо, образованное при взятии вместе R1, R2 и Х, замещено в положении 2 группой - Y-Q-R3, и их солям. Соединения формулы (1) стимулируют холинэргическую активность и могут быть использованы для лечения или профилактики амнезии, шизофрении или деменции. 4 с. и 4 з.п. ф-лы, 1 табл.
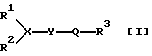
в котором R1 и R2, взятые вместе, образуют бутенилен или пентенилен, каждый из которых может быть конденсирован с бензолом, необязательно замещенным С1-С6алкокси;
R3 представляет фенил, замещенный галогеном;
X представляет СН;
Y представляет -NH-;
Q представляет -С(О)-,
при условии, что когда R1 и R2, взятые вместе, образуют бутенилен, конденсированный с бензолом, тогда индановое кольцо, образованное при взятии вместе R1, R2 и X, замещено в положении 2 группой -Y-Q-R3,
и его соль.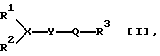
в котором R1, R2, R3, X, Y и Q принимают значения, определенные в п. 1,
или его соли, который включает взаимодействие соединения формулы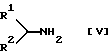
или его соли с соединением формулы
НО-Q-R3 (III)
или его реакционно-способным производным по карбоксигруппе или его солью с получением соединения формулы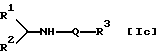
или его соли,
где в вышеуказанных формулах R1, R2, R3 и Q имеют значения, определенные в п. 1.
| 5-ХЛОР-2-ПИРИДИЛАМИД-4-НИТРО-N-(КАРБОКСИМЕТИЛ)АНТРАНИЛОВОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЙ ПРОТИВОВОСПАЛИТЕЛЬНУЮ АКТИВНОСТЬ | 1991 |
|
RU2024507C1 |
| КОМПРЕССИОННЫЙ ВАКУУММЕТР | 0 |
|
SU306375A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| 0 |
|
SU343961A1 | |
| US 4797419 A, 10.01.1989. | |||
Авторы
Даты
2003-08-27—Публикация
2000-02-03—Подача