Область техники
Настоящее изобретение относится к новому и улучшенному способу получения соединения авермектина, формулы (I) из соединения авермектина В2 формулы (II), авермектинового продукта, получаемого ферментацией. Соединение авермектина формулы (I), как известно, является ценным антипаразитическим агентом. Предлагаемый способ дает значительное улучшение общего выхода.
Уровень техники
В соответствии с известным уровнем техники описаны некоторые соединения, которые представляют ценность в качестве антипаразитических агентов. Среди них есть такие авермектиновые соединения, которые описаны и заявлены Bishop Bernard Frank и др. в международной публикации WO 94/15944, а также Ficher, Michael H. и др. в европейской публикации ЕР 0379341 А2. Однако в описанных обычных способах выход конечного продукта реакции не всегда удовлетворителен. Целью настоящего изобретения является превращение авермектинового соединения формулы (II) в авермектиновое соединение формулы (I) с высоким выходом.
Краткое описание изобретения
Настоящее изобретение предлагает способ получения соединения формулы (I):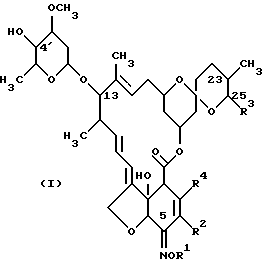
где
R1 представляет собой Н или гидроксииминозащитную группу; R2 представляет собой Н, С1-4-алкил или C1-4-алкоксигруппу; R3 представляет собой C1-8-алкил (предпочтительно C1-4-алкил), С2-8-алкенил (предпочтительно С2-5-алкенил) или С3-8-циклоалкил (предпочтительно циклогексил); и R4 представляет собой Н, атом галогена, C1-4-алкил или C1-4-алкоксигруппу, и этот способ включает стадии:
(а) взаимодействия соединения формулы (II):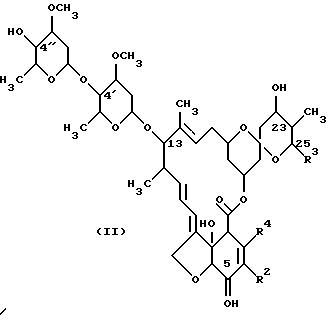
с окисляющим агентом с образованием 5-оксосоединения;
(б) взаимодействия 5-оксосоединения с соединением формулы r1-О-NH2, где R1 представляет собой Н или гидроксиимино-защитную группу, с образованием 5-иминосоединения;
(в) взаимодействия. 5-имино-соединения с агентом тионкарбонизации с образованием 4",23-бистионокарбонильного сложного эфира;
(г) взаимодействия 4", 23-бистионокарбонильного сложного эфира с деоксигенирующим агентом с образованием 4",23-дидеоксисоединения;
и
(д) взаимодействия 4", 23-дидеоксисоединения с кислотой с образованием соединения формулы (I).
Когда R1 представляет собой Н, этот способ дополнительно включает добавление галогентрифенилсилана, трет-бутилдиметилсилана, галогентриметилсилана, галоген(галогенметил)силана, галогеналлилдиметилсилана, галогентриэтилсилана, галогентриизопропилсилана, галоген(3-цианопропил)диметилсилана, галогендиметилоктилсилана, галогентрибензилсилана, галогентригексилсилана или других подобных соединений (предпочтительно галогентрифенилсилана) и триэтиламина, три-н-пропиламина, диизопропилэтиламина, имидазола, пиридина или 4-диметиламинопиридина после стадии (б) для защиты гидроксииминогруппы. Также реакция на стадии (д) (за которой необязательно следует реакция снятия защитной группы) может быть проведена в присутствии палладиевого катализатора, когда R1 представляет собой аллильную группу. Как указывалось выше, конечные продукты, получаемые способом настоящего изобретения, могут быть использованы в качестве антипаразитарных агентов.
Подробное описание изобретения.
В данном описании понятие "C1-8-алкил" означает линейный или разветвленный радикал из 1-8 атомов углерода, включая, но, не ограничиваясь только ими: метил, этил, н-пропил, изопропил, н-бутил, изо-бутил, втор-бутил, трет-бутил, пентил, гексил и т.п.
Понятие "С2-8-алкенил" в данном описании означает линейный или разветвленный ненасыщенный радикал, содержащий 2-8 атома углерода, включая, но, не ограничиваясь только ими, 1-этенил, 1-пропенил, 2-пропенил, 1-бутенил, 2-бутенил, 2-метил-1-пропенил и т.п.
Понятие "С3-8-циклоалкил" в данном описании означает карбоциклический радикал, содержащий от 3 до 8 атомов углерода, в том числе, но, не ограничиваясь только ими, циклопропил, циклобутил, циклопентил, циклогексил и др.
Понятие "галоген" означает атомы фтора, хлора, брома или йода.
Используемое в данном описании понятие "аллильная группа" означает алкильную или замещенную алкильную группу, содержащую углерод-углеродную двойную связь в 2,3-положении, включая, но, не ограничиваясь только ими, аллил, метилаллил, кротил, хлораллил, циннамил и т.п.
Способ настоящего изобретения более подробно описан ниже.
В реакции на стадии (а) соединение формулы (II):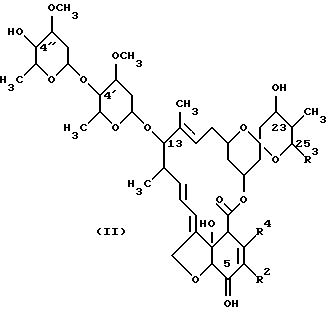
взаимодействует с окислительным агентом с образованием соответствующего 5-оксосоединения. Более конкретно, в этой реакции гидроксильная группа в 5-м положении соединения (II) превращается путем окисления в оксогруппу. Соединение формулы (11) является авермектином В2, который представляет собой полученный путем ферментации авермектиновый продукт. Соединение формулы (II) может быть выделено посредством ферментации авермектин-продуцирующих штаммов Streptomyces avermitilis, таких как АТСС 31267, 31271 или 31272, как это описано в патенте США 5089480. Другим способом получения соединения формулы (II) является выделение из ферментационного бульона Streptomyces avermitilis ATCC 53568, как это описано Dutton и др. в Journal of Antibiotics, 44, 357-65 (1991).
Приемлемыми агентами окисления являются, например, диоксид марганца, пероксид никеля или дихромат пиридиния. Предпочтительным является диоксид марганца с точки зрения селективности окисления α-положения двойной связи. Окислительный агент, используемый на стадии (а), может быть введен в реакцию в количестве от 1 до 200 эквивалентов, предпочтительно в количестве от 10 до 70 эквивалентов, в расчете на соединение формулы (II), которое должно быть обработано. Реакция на стадии (а) может быть проведена при температуре от 0 до 80oС в течение от 10 минут до 10 часов. Реакция может быть проведена в инертном растворителе, выбираемом, но без ограничения ими, из хлороформа, дихлорметана, бензола, толуола, ксилола, тетрагидрофурана, диоксана, диметилформамида, ацетона, ацетонитрила, трет-бутилметилового эфира и их смесей. Предпочтительным является дихлорметан.
В реакции на стадии (б) полученное 5-оксосоединение взаимодействует с соединением формулы R1-О-NН2, где R1 представляет собой Н или гидроксииминозащитную группу, с образованием 5-иминосоединения. Подходящими гидроксииминозащитными группами являются, например, трифенилсилил, трет-бутилдиметилсилил, тетрагидропиранил, метилтиометил, аллил, метилаллил, кротил, хлораллил, циннамил или аллилоксикарбонил (предпочтительно триметилсилил или аллил [СН2= СНСН2-]). Иминирующий агент (агент для введения иминогруппы) на стадии (б) (R1-O-NH2) может быть использован в количестве от 0,5 до 50 эквивалентов, предпочтительно от 1 до 10 эквивалентов, в расчете на 5-оксосоединение, которое необходимо обработать. Реакцию на стадии (б) проводят при температуре от -10 до 80oС в течение от 5 минут до 20 часов. Эта реакция может быть проведете в инертном растворителе, выбираемом, но не ограничиваемом только ими, из хлороформа, дихлорметана, бензола, толуола, ксилола, тетрагидрофурана, диоксана, диметилформамида, метанола, трет-бутилметилового эфира, ацетонитрила, изопропанола, воды и их смесей. Предпочтительна смесь метанола, диоксана и воды.
В реакции на стадии (в) 5-иминосоединение взаимодействует с агентом тиококарбонизации (агентом для введения тиокарбонильной группы) с образованием 4", 23-бистионкарбонильного сложного эфира. Подходящими агентами тионокарбонизации являются, например, R5O-C(S)-галоген или R5S-C(S)-галоген (галоген предпочтительно представляет собой атом хлора), где R5 представляет собой C1-4-алкил, фенил или нафтил, причем фенил или нафтил могут необязательно быть замещены одним или несколькими заместителями, выбираемыми из C1-4-алкила, С1-4-алкоксигруппы, галогензамещенного C1-4-алкила, галогензамещенной C1-4-алкоксигруппы, нитрогруппы, гидроксигруппы, аминогруппы и атома галогена. Предпочтительно используется фенилхлортионоформиат. Агент тионкарбонизации, используемый на стадии (в), может быть введен в реакцию в количестве от 1 до 20 эквивалентов, предпочтительно от 2 до 5 эквивалентов, в расчете на 5-иминосоединение, которое должно быть обработано. Реакцию проводят при температуре от 0 до 130oС в течение от 5 минут до 10 часов в инертном растворителе, выбираемом, но не ограничиваемом только ими, из хлороформа, дихлорметана, бензола, толуола, ксилола, тетрагидрофурана, диоксана, диметилформамида, ацетонитрила, этилацетата и их смесей. Предпочтительным является толуол.
В реакции на стадии (г) 4",23-бистионокарбонильный сложный эфир реагирует с радикальным агентом дезоксигенации с образованием 4",23-дидеоксисоединения. Приемлемыми дезоксигенирующими агентами являются, например, гидрид трибутилолова, трис(триметилсилил)силан, триэтилсилан, трипропилсилан, фенилсилан, дифенилсилан, трифенилсилан, диалкилфосфит или гипофосфористая кислота. Предпочтительным агентом является трис(триметилсилил)силан с инициатором радикалов. Подходящим радикальным инициатором является азобисизобутиронитрил. Радикальный дезоксигенирующий агент, используемый на стадии (г), может быть введен, в реакцию в количестве от 1 до 10 эквивалентов, предпочтительно от 2 до 4 эквивалентов, из расчета на обрабатываемый 4",23-бистионкарбонильный эфир. Реакцию проводят при температуре от 0 до 140oС в течение от 5 минут до 15 часов в инертном растворителе, выбираемом, но не ограничиваемом только ими, из хлороформа, дихлорметана, бензола, толуола, ксилола, тетрагидрофурана, диоксана, диметилформамида и их смеси. Предпочтительным растворителем является толуол.
В реакции на стадии (д) 4",23-дидеоксисоединение взаимодействует с кислотой с образованием соединения формулы (I). Подходящими кислотами являются, например, п-толуолсульфокислота, бензолсульфокислота, HF, HCl, H2SO4, Н3РО4 и НСlО4. Предпочтительной является п-толуолсульфокислота. Кислота, используемая на стадии (д), используется в количестве от 0,01 до 20 эквивалентов, предпочтительно от 0,5 до 5 эквивалентов, в расчете на 4",23-дидеоксисоединение, которое должно быть обработано. Реакцию проводят при температуре от 0 до 100oС в течение от 5 минут до 15 часов, в инертном растворителе, выбираемом, но не ограничиваемом только ими, из хлороформа, дихлорметана, бензола, толуола, ксилола, тетрагидрофурана, диоксана, диметилформамида, метанола, этанола, изопропанола, бутанола, ацетона, этилацетата, воды и их смеси. Предпочтительным растворителем является метанол.
Кроме того, на стадии (д), когда с целью снятия защиты с аллильной группы, реакцию снятия защиты проводят в присутствии палладиевого катализатора, палладиевый катализатор представляет собой палладиевое соединение, способное легко образовывать π-аллильный комплекс при взаимодействии с аллильным соединением. Более приемлемым палладиевым катализатором является, например, катализатор, который имеет лиганд, такой как тетракис (трифенилфосфин)палладий(0), дихлорбис(трифенилфосфин)палладий(II), дихлорбис(ацетонитрил) палладий(II) и дихлорбис(триизо-пропоксифосфин)палладий(II) или диацетат палладия(II) в сочетании с трифенилфосфином или триэтилфосфитом (см. Jiro Tsuji, "Transition metals in organic synthesis", Kagakudojin, 1991). В обычных способах с использованием муравьиной кислоты в качестве снимающего защиту агента реакцию проводят в кипящем диоксане (Yamada Т., et. al. Tetrahedron Lett., 27, 2368 (1986). Однако в способе настоящего изобретения снятие защиты протекает при комнатной температуре, благодаря высокой скорости реакции в присутствии данной реакционной системы.
Катализатор на основе комплекса палладия может быть использован в количестве, достаточном для катализа реакции снятия защиты, обычно в количестве от 0,1 до 50 мольных процентов, предпочтительно от 1 до 10 мольных процентов, в расчете на 4",23-дидеоксисоединение, которое должно быть обработано на стадии (д).
Реакцию снятия защиты проводят в подходящем инертном растворителе. Подходящими растворителями являются растворители, содержащие гидроксильную группу, такие как спирты, например, метанол, этанол и вода; а также растворители, не содержащие гидроксильную группу, например, галогеналкильные соединения, такие как дихлорметан и хлороформ; сложные эфиры, такие как метилацетат и этилацетат; простые эфиры, такие как диэтиловый эфир и тетрагидрофуран; нитрилы, такие как ацетонитрил и пропионитрил; кетоны, такие как ацетон и метилэтилкетон; и ароматические углеводороды, такие как бензол и толуол; а также их смесь.
Реакция снятия защиты может быть проведена, по существу, при нейтральных условиях. Таким образом, способ настоящего изобретения может быть полезен при синтезе с использованием исходных материалов и конечных соединений, которые чувствительны к кислым и щелочным условиям.
Условия проведения реакции снятия защиты могут быть определены в зависимости от типа соединения, которое подвергается обработке, агентов для снятия защиты, катализаторов, используемых растворителей и др. В общем случае реакцию снятия защиты проводят при температуре от -20 до 100oС, предпочтительно от 10 до 40oС, в течение от 1 минуты до 18 часов, предпочтительно от 5 минут до 6 часов.
Соединения формулы (I) могут быть использованы в качестве антипаразитарных агентов и, следовательно, при лечении заражения блохами и глистами у собак и кошек, круглые червями у кошек, или др.
Следующие типичные примеры иллюстрируют изобретение и не предназначены для ограничения его объема.
Примеры
Следующие примеры иллюстрируют настоящее изобретение. Однако следует понимать, что изобретение не ограничивается конкретными деталями настоящих примеров. Масс-спектр на отрицательных ионах при бомбардировке быстрыми атомами (FABMS) записывают на приборе JEOL JMS-700. Спектры поглощения инфракрасных лучей (ИК) записывают на инфракрасном спектрометре Shimadzu (FTIR-8200PC). Спектры ЯМР 1Н и 13С записывают при рабочей частоте 270 МГц и 67,5 МГц соответственно на ЯМР-спектрометре JEOL (JNM-LA270). Химические сдвиги выражены в миллионных долях (δ) относительно тетраметилсилана для 1Н-ЯМР и относительно СНСl3(δ) для 13С-ЯМР.
Пример 1
1-А. 5-Оксо-25-циклогексилавермектин В2
5-Оксо-25-циклогексилавермектин В2 (2,00 г, 2,18 ммоля) растворяют в метиленхлориде (20 мл) и добавляют активированный диоксид марганца (8,0 г). Смесь перемешивают при комнатной температуре в течение 30 минут и затем фильтруют с вспомогательным фильтрующим агентом (3 г). Осадок на фильтре промывают метиленхлоридом (20 мл). Растворы в метиленхлориде объединяют и концентрируют в вакууме, получают названное соединение с количественным выходом в виде смолоподобных желтых кристаллов (1,99 г). Спектр ЯМР (ядерный магнитный резонанс) названного соединения согласуется с характеристическими сигналами 5-оксоавермектина В1а и 5-оксоавермектина В2а, приведенными в J. Agric. Food. Chem., 29, 881 (1981).
Спектр ЯМР 1Н, δ, м. д: 6,60 (с, 1Н, 3Н), 3,42 (с, 2 • 3Н, 4'-ОСН3. 4"-ОСН3).
ИК-спектр (КВr, см-1): 1720, 1680, 1455. 1-Б. 5-(О-Трифенилсилилоксиимино)-25-циклдгексилавермектин
В смеси метанола (9,6 мл) и диоксана (9,6 мл) растворяют 5-оксо-25-циклогексилавермектин В2 (1,92 г, 2,10 ммоля) и добавляют водный раствор (2 мл) гидрохлорида гидроксиламина (451 мг, 6,49 ммоля). Через 2,5 часа добавляют водный раствор (2 мл) гидрохлорида гидроксиламина (500 мг), затем через 3,5 часа добавляют водный раствор (3 мл) гидрохлорида гидроксиламина (1,0 г). Смесь перемешивают при комнатной температуре в течение 5 часов и после добавления воды экстрагируют этилацетатом. Слой этилацетата промывают насыщенным водным раствором соли (NaCl), сушат сульфатом натрия и фильтруют. Фильтрат концентрируют в вакууме, остаток растворяют в метиленхлориде. При добавлении гексана выпадает осадок белого твердого вещества, который отфильтровывают. После сушки в вакууме получают 5-гидроксиимино-25-циклогексилавермектин В2 (1,90 г, выход 97%).
Полученный 5-гидроксиимино-25-циклогексилавермектин В2 (1,00 г, 1,08 ммоля) растворяют в тетрагидрофуране (5,0 мл)
и охлаждают до 3-5oС. Добавляют хлортрифенилсилан (951 мг, 3,23 ммоля) и триэтиламин (0,60 мл, 4,30 ммоля). После нагревания реакционного раствора до комнатной температуры и перемешивания в течение 30 минут реакционную массу экстрагируют этилацетатом, добавляя воду. Фильтрат концентрируют в вакууме, остаток очищают хроматографией на силикагеле (элюент: гексан-этилацетат, 1:1 - 2:3), получают названное соединение в виде белых смолоподобных кристаллов (1,09 г, выход 85%).
Спектр ЯМР 1Н, δ, м. д: 7,75-7,60 (м, 6Н, аром.), 7,48-7,32 (м, 9Н, аром), 3,44 (с, 2•3Н, 4'-ОСН3. 4"-ОСН3).
Масс-спектр (отрицательные ионы, бомбардировка быстрыми атомами): m/е 1187 (М)-.
1-В. 4",23-Бис(фенокситионокарбонил)-5-(О-трифенилсилилоксиимино)-25-циклогексилавермектин В2
В толуоле (11 мл) растворяют 5-(О-трифенилсилилоксиимино)-25-циклогексилавермектин В2 (1,09 г, 0,918 ммоля) и добавляют пиридин (3,3 мл, 40,8 ммоля). Раствор нагревают до 80oС и по каплям добавляют фенилхлортионоформиат (0,635 мл, 4,59 ммоля). Реакционную смесь перемешивают при температуре 80oС в течение 50 минут и охлаждают до 3-5oС. После добавления 0,5 н. водного раствора соляной кислоты (20 мл) смесь экстрагируют толуолом (10 мл). Водный слой экстрагируют толуолом (10 мл). Толуольные экстракты объединяют и промывают насыщенным водным раствором гидрокарбоната натрия (20 мл) и насыщенным водным раствором соли (NaCl, 20 мл). После сушки сульфатом натрия и фильтрования фильтрат концентрируют в вакууме и остаток очищают хроматографией на силикагеле (элюент: гексан/этилацетат, 7:2), получают названное соединение в виде белых смолоподобных кристаллов (1,26 г, выход 94%).
Спектр ЯМР 1Н, δ, м. д: 7,70-7,61 (м, 6Н, аром.), 7,48-7,24 (м, 15Н, аром), 7,15-7,07 (м, 4Н, аром), 3,46 (с, 3Н, -ОСН3), 3,43 (с, 3Н, -ОСН3).
ИК-спектр (КВr, см-1): 3480, 2931, 1716.
Масс-спектр (отрицательные ионы, бомбардировка быстрыми атомами): m/е 1459 (М)-, 1201 (М-Рh3SiН)-.
1-Г. 4"-Дeoкcи-22,23-дигидро-5-(O-трифенилсилилоксиимино-25-циклогексилавермектин В1
В толуоле (12,6 мл) растворяют 4",23-бис(фенокситионокарбонил)-5-(O-трифенилсилилоксиимино)-25-циклогексилавермектин В2 (1,26 г, 0,862 ммоля). Затем добавляют гидрид трибутилолова (0,93 мл, 3,46 ммоля) и азобисизобутиронитрил (142 мг, 0,865 ммоля). Раствор нагревают до 100oС, перемешивают в течение 55 минут и концентрируют в вакууме (3 мл). Полученный таким образом остаток очищают хроматографией на силикагеле (элюент:гексан/этилацетат, 4:1 - 5:2), получают названное соединение в виде белых смолоподобных кристаллов (748 мг, выход 75%).
Спектр ЯМР 1Н, δ, м. д: 7,70-7,60 (м, 6Н), 7,48-7,30 (м, 9Н), 5,99-5,91 (м, 1Н), 5,85-5,69 (М, 2Н), 5,50-5,33 (м, 2Н), 5,00 (д, J=8,8 Гц, 1Н), 4,88 (с, 1Н), 4,81-4,62 (м, 2Н), 4,00-3,52 (м, 6Н), 3,50-3,42 (м, 1Н), 3,42 (с, 3Н), 3,36 (с, 3Н), 3,25 (т, J=8,8 Гц, 1Н), 3,11-3,00 (м, 1Н), 2,58-2,46 (м, 1Н), 2,38-2,12 (м, 3Н), 2,08-1,90 (м, 4Н), 1,85-1,05 (м, 38Н), 0,90-0,70 (м, 4Н).
Спектр ЯМР 13С, δ, м.д: 173,2; 157,8; 155,6; 138,6; 138,2; 135,8; 135,0; 133,3; 132,7; 130,0; 127,6; 125,3; 124,8; 121,2; 118,4; 99,2; 97,4; 94,9; 81,9; 80,2; 79,3; 78,9; 78,5; 72,9, 72,3; 68,7; 68,6; 67,3; 67,1; 64,4; 56,6; 55,2; 46,4; 41,1; 39,9; 39,1; 38,5; 36,9; 36,2; 35,6; 34,6; 34,1; 33,9; 31,2; 30,6; 28,0; 26,9; 26,5; 25,1; 24,7, 23,4; 21,3; 20,1; 18,3; 17,5; 17,4; 15,1.
ИК-спектр (КВr, см-1): 3481, 2929, 2854, 1716.
Масс-спектр (отрицательные ионы, бомбардировка быстрыми атомами): m/е 1155 (М)-, 896 (М-Рh3SiН)-.
1-Д. Моносахарид 22,23-дигидро-5-гидроксиоксиимино-25-циклогексилавермектина В1
В метаноле (22,5 мл) растворяют 4"-деокси-22,23-дигидро-5-(O-трифенилсилилоксиимино)-25-циклогексилавермектин В1 (748 мг, 0,647 ммоля) и добавляют п-толуолсульфокислоту (246 мг, 1,29 ммоля). После перемешивания при комнатной температуре в течение 60 минут добавляют триэтиламин (0,2 мл) и концентрируют в вакууме. Концентрированный остаток очищают хроматографией на силикагеле (элюент:гексан/этилацетат, 1:1), получают названное соединение в виде бесцветных смолоподобных кристаллов (290 мг, выход 58%). Спектр ЯМР (ядерный магнитный резонанс) названного соединения согласуется с характеристическими сигналами моносахарида 22,23-дигидро-5-гидроксиимино-25-циклогексилавермектина В1, синтезированного способом, описанным в международной публикации WO 94/15944
Спектр ЯМР 1Н, δ, м. д: 8,10 (с, 1Н, =N-OH), 3,47 (с, 3Н, 4'-ОСН3), 3,18 (т, J=9,1 Гц, 1Н, 4'-Н).
ИК-спектр (КВr, см-1): 3450, 2920, 1715.
Пример 2
2-А. 5-(O-Аллилоксиимино)-25-циклогексилавермектин В2
В смеси метанола (7,0 мл) и диоксана (7,0 мл) растворяют 5-оксо-25-циклогексилавермектин В2 (993 мг, 1,09 ммоля), который получен согласно Примеру 1-А, и затем добавляют водный раствор гидрохлорида O-аллилгидроксиламина (597 мг, 5,44 ммоля). После перемешивания при комнатной температуре в течение 17 часов добавляют воду (20 мл) и экстрагируют этилацетатом (100 мл). Фазу этилацетата промывают насыщенным водным раствором соли (NaCl), сушат сульфатом магния и фильтруют. Фильтрат концентрируют в вакууме, получают названное соединение в виде светло-желтых смолоподобных кристаллов (992 мг, выход 94%).
Спектр ЯМР 1Н, δ, м. д: 6,10-5,70 (м, 5Н), 5,45-5,20 (м, 4Н), 5,04-4,95 (м, 1Н), 4,80-4,65 (м, 4Н), 4,60 (с, 1Н), 3,95 (с, 1Н), 3,90-3,37 (м, 17Н), 3,25 (т, J=9,1 Гц, 1Н), 3,15 (т, J=9,1 Гц, 1Н), 2,60-2,20 (м, 6Н), 2,03-1,40 (м, 22Н), 1,34-1,15 (м, 12Н), 0,96-0,80 (м, 4Н).
ИК-спектр (КВr, см-1): 3527, 2931, 1735, 1718.
Масс-спектр (отрицательные ионы, бомбардировка быстрыми атомами): m/e 968 (М-Н)-.
2-Б. 5-(O-Аллилоксиимино)-4",23-бис(фенокситионокарбонил)-25-циклогексилавермектин В2
В толуоле (10,7 мл) растворяют 5-(O-аллклоксиимино)-25-циклогексилавермектин В2 (992 мг, 1,02 ммоля) и добавляют пиридин (3,7 мл, 45,7 ммоля). Раствор нагревают до 70oС и по каплям добавляют фенилхлортионоформиат (0,64 мл, 4,62 ммоля). После перемешивания при температуре 80-85oС в течение 90 минут смесь охлаждают до комнатной температуры и осажденное черное масло промывают толуолом (10 мл). Толуольные фракции объединяют и разбавляют этилацетатом (60 мл).
Раствор в этилацетате промывают водой (20 мл), 1 н., водным раствором соляной кислоты (10 мл) и насыщенным водным раствором гидрокарбоната натрия (10 мл). После сушки сульфатом натрия и фильтрования полученный фильтрат концентрируют в вакууме, остаток очищают хроматографией на силикагеле (элюент: гексан/этилацетат 60:16), получают названное соединение в виде светло-красных смолоподобных кристаллов (949 г, выход 75%).
Спектр ЯМР 1Н, δ, м. д: 7,50-7,05 (м, 10Н, аром.), 4,62 (с, 1Н, 6Н), 3,48 (с, 3Н, -ОСН3) 3,43 (с, 3Н, -ОСН3).
Масс-спектр (отрицательные ионы, бомбардировка быстрыми атомами): m/е 1241 (М)-.
2-В. 5-(О-Аллилокси)-4"-деокси-22,23 дигидро-25-циклогексилавермектин В1
В толуоле (25 мл) растворяют 5-(О-аллилокси)-4",23-бис(фенокситионкарбонил)-25-иклогексилавермектин В2 (949 мг, 0,764 ммоля). Затем добавляют трис(триметилсилил)силан (0,71 мл, 2,36 ммоля) и азобисизобутиронитрил (125 мг, 0,761 ммоля). Раствор перемешивают при температуре 80~ 100oС в течение 50 минут и концентрируют в вакууме. Полученный таким образом остаток очищают хроматографией на силикагеле (элюент: гексан/этилацетат/ 4: 1), получают названное соединение в виде светло-желтых смолоподобных кристаллов (356 мг, выход 50%).
Спектр ЯМР 1Н, δ, м. д: 3,42 (с, 3Н, 4'-ОСН3), 3,37 (с, 3Н, 4'-ОСH3).
Все сигналы ароматических протонов исчезают.
ИК-спектр (КВr, см-1): 3481, 2929, 2854, 1716, 1450.
Спектр ЯМР 13С, δ, м. д: 173,3; 150,3; 138,3; 135,0; 134,0; 132,4; 124,8; 124,5; 121,3; 118,4; 117,7; 99,2; 97,5; 94,9; 81,9; 80,3; 79,4; 78,6; 78,5; 75,9; 73,2; 72,4; 68,7; 67,3; 67,1; 64,5; 56,6; 55,2; 46,4; 41,0; 39,9; 39,2; 38,6; 36,9; 36,3; 35,7; 34,6; 34,1; 31,2; 30,6; 28,1; 26,8; 26,6; 24,7; 21,4; 20,1; 18,3; 17,4; 15,2.
Масс-спектр (отрицательные ионы, бомбардировка быстрыми атомами): m/е 937 (М)-.
2-Г. Моносахарид 5-(O-Аллилоксиимино)-22,23-дигидро-25-циклогексилавермектина В1
В метаноле (12 мл) растворяют 5-(O-аллилоксиимино)-4"-деокси-22,23-дигидро-25-циклогексилавермектин В1 (356 мг, 0,379 ммоля) и добавляют п-толуолсульфокислоту (108 мг, 0,568 ммоля). После перемешивания при комнатной температуре в течение 90 минут добавляют насыщенный водный раствор гидрокарбоната натрия (12 мл). Таким образом получают белое твердое вещество, которое отфильтровывают, промывают водой, затем очищают колоночной хроматографией на силикагеле (элюент:гексан/этилацетат, 3:1), получают названное соединение в виде бесцветных смолоподобных кристаллов (218 мг, выход 73%).
Спектр ЯМР 1H, δ, м. д: 6,10-5,90 (м, 2Н), 5,82-5,68 (м, 2Н), 5,50-5,40 (м, 1Н), 5,35-5,18 (м, 2Н), 4,98 (д, J=7,0 Гц, 1Н), 4,82 (д, J=2,9 Гц, 1Н), 4,80-4,62 (м, 4Н), 4,60 (с, 1Н), 4,00-3,80 (м, 4Н), 3,72-3,50 (м, 3Н), 3,47 (с, 3Н, 4'-ОСН3), 3,39 (т, J=2,2 Гц, 1Н), 3,16 (т, J=9, 1 Гц, 1Н), 3,06 (д, J-8,1 Гц, 1Н), 2,62-2,45 (м, 2Н), 2,40-2,18 (м, 3Н), 2,03-1,09 (м, 31Н), 0,91-0,72 (м, 4Н).
Масс-спектр (отрицательные ионы, бомбардировка быстрыми атомами): m/е 809 (М)-.
2-Д. Моносахарид 22,23-дигидро-5-гидроксиимино-25-циклогексилавермектина В1
К хлороформу (2,5 мл) добавляют моносахарид 5-(O-аллилоксиимино)-22,23-дигидро-25-циклогексилавермектина В1 (218 мг, 0,269 ммоля), тетракис(трифенилфосфин)палладий (32 мг, 0,028 ммоля) и бензолсульфиновую кислоту (69 мг, 0,485 ммоля). После перемешивания реакционной смеси при комнатной температуре в течение 1,5 часов добавляют трифенилфосфин (72 мг, 0,274 ммоля) и через 2 часа добавляют тетракис(трифенилфосфин)палладий (52 мг, 0,045 ммоля). После перемешивания в течение 5,5 часов реакционный раствор очищают хроматографией на силикагеле (элюент:гексан-этилацетат, 2:1-1:1), получают названное соединение в виде бесцветных смолоподобных кристаллов (175 мг, выход 85%). Спектр ЯМР (ядерный магнитный резонанс) названного соединения согласуется с характеристическими сигналами моносахарида 22,23-дигидро-5-гидроксиимино-25- циклогексилавермектина В1, синтезированного способом, описанным в международной публикации WO 94/15944.
Спектр ЯМР 1Н, δ, м. д: 8,10 (с, 1Н, =N-OH), 3,47 (с, 3Н, 4'-OCH3), 3,18 (т, J=9,1 Гц, 4'-H).
ИК-спектр (КВr, см-1): 3450, 2920, 1,715.
Изобретение описывает способ получения соединения авермектина формулы (I), где R1 - Н, аллил, метилаллил, кротил, хлораллил, циннамил; R2 - Н, С1-4-алкил или С1-4-алкоксигруппа; R3 - С1-8- алкил, С2-8- алкенил или С3-8-циклоалкил; и R4 - H, галоген, С1-4-алкил или С1-4-алкоксигруппа. Способ включает стадии (а) взаимодействия производного авермектина В2 с агентом окисления с образованием 5-оксосоединения; (б) взаимодействия 5-оксосоединения с соединением формулы R1-O-NH2, где R1 представляет собой Н или гидроксииминозащитную группу, с образованием 5-аминосоединения; (в) взаимодействия 5-аминосоединения с агентом введения тионкарбонильной группы с образованием 4'', 23-бистионокарбонильного сложного эфира; (г) взаимодействия 4'', 23-бистионокарбонильного сложного эфира с дезоксигенирующим агентом с образованием 4'',23-дидеоксисоединения; (д) взаимодействия 4'', 23-дидеоксисоединения с кислотой с образованием соединения формулы (I), и когда R1 - аллил, стадию (д) проводят в присутствии палладиевого катализатора. Способ дает высокий выход I. 10 з.п. ф-лы. 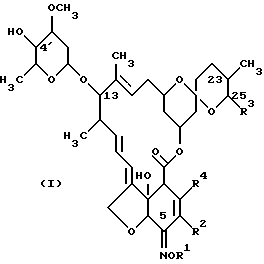
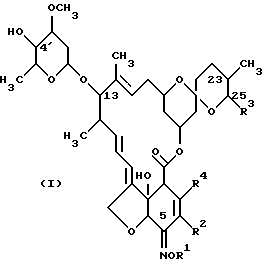
где R1 представляет собой Н или аллил, метилаллил, кротил, хлораллил, циннамил;
R2 представляет собой Н, C1-4-алкил или C1-4-алкокси группу;
R3 представляет собой C1-8-алкил, С2-8-алкенил или С3-8 циклоалкил;
R4 представляет собой Н, атом галогена, C1-4-алкил или C1-4-алкоксигруппу, включающий стадии
(а) взаимодействия соединения формулы (II)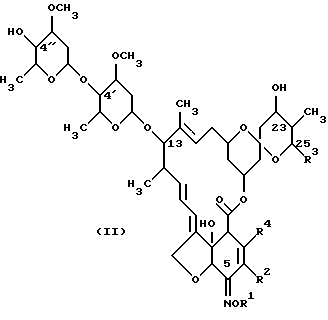
с окислительным агентом с образованием 5-оксосоединения;
(б) взаимодействия полученного 5-оксосоединения с соединением формулы R1'-O-NH2, с образованием 5-имино-соединения, где R1' представляет собой гидроксииминозащитную группу, такую, как трифенилсилил, трет-бутилдиметилсилил, тетрагидропиранил, метилтиометил, аллил, метилаллил, кротил, хлораллил, циннамил или алкоксикарбонил;
(в) взаимодействия полученного 5-иминосоединения с агентом введения тионкарбонильной группы с образованием 4'', 23-бистионокарбонильного сложного эфира;
(г) взаимодействия полученного 4'', 23-бистионокарбонильного сложного эфира с дезоксигенирующим агентом с образованием 4'', 23-дидеоксисоединения,
(д) взаимодействия полученного 4'', 23-дидеоксисоединения с кислотой, и при необходимости получения соединения (I), где R1 представляет собой Н, из соединения (I), где R1 представляет собой аллил, стадию (д) проводят в присутствии палладиевого катализатора.
| RU 94040915, 20.07.1996 | |||
| WO 9415944, 21.07.1994 | |||
| WO 9522552, 24.08.1995 | |||
| УСТРОЙСТВО для ФЛАНКИРОВАНИЯ ЗУБЧАТЫХ КОЛЕС | 0 |
|
SU379341A1 |
Авторы
Даты
2003-08-27—Публикация
1998-06-25—Подача