Область техники.
Изобретение относится к биотехнологии, в частности к способу получения L-аминокислот методом ферментации, и, более конкретно, к генам, полученным из бактерии Escherichia соli. Указанные гены позволяют улучшить продукцию L-аминокислот, например L-треонина и L-валина.
Предшествующий уровень техники
Традиционно L-аминокислоты в промышленном масштабе могут быть получены методом ферментации с использованием штаммов микроорганизмов, полученных из природных источников, или их мутантов, специально модифицированных для того, чтобы увеличить продукцию L-аминокислот.
Описано множество методов увеличения продукции L-аминокислот, например, путем трансформации микроорганизма рекомбинантной ДНК (см., например, патент США 4278765). Указанные методы основаны на повышении активности ферментов, вовлеченных в биосинтез аминокислот, и/или уменьшении чувствительности целевого фермента к обратному ингибированию продуцируемой L-аминокислотой (см. , например, выложенную патентную заявку Японии 56-18596 (1981), WO 95/16042 или патенты США 5661012 и 6040160).
С другой стороны, повышенная экскреция L-аминокислот может увеличить продуктивность штамма, продуцирующего L-аминокислоту. Описан штамм бактерии, принадлежащей к роду Corynebacterium, обладающей повышенной экспрессией гена экскреции L-лизина (ген lysE) (WO 9723597A2). Кроме того, описаны гены, кодирующие белки, способные к секреции L-цистеина, L-цистина, N-ацетилсерина или производных триазолидина (патент США 5972633).
К настоящему времени описаны несколько генов, кодирующих, как предполагается, мембранные белки, которые увеличивают продукцию L-аминокислот. Дополнительная копия гена rhtB делает бактерию более устойчивой к L-гомосерину и увеличивает продукцию L-гомосерина, L-треонина, L-аланина, L-валина и L-изолейцина (Европейская патентная заявка ЕР994190А2). Дополнительная копия гена rhtC делает бактерию более устойчивой к L-гомосерину и L-треонину и увеличивает продукцию L-гомосерина, L-треонина и L-лейцина (Европейская патентная заявка ЕР1013765А1). Дополнительные копии генов yahN, yeaS, yfiK, и yggA увеличивают продукцию L-глутаминовой кислоты, L-треонина, L-аланина, L-гистидина, L-пролина, L-аргинина, L-валина и L-изолейцина (Европейская патентная заявка ЕР1016710А2). И хотя нуклеотидная последовательность всего генома Escherichia coli К-12 описана (Blattner F.R., Plunkett G., Bloch C.A. et al., Science, 227, 1453-1474, 1997; ftp://ftp.genetics.wise. edu/pub/sequence/ecolim52.seq.gz), существует множество открытых рамок считывания, функция которых остается неизвестной.
Описание изобретения
Целью настоящего изобретения является увеличение продуктивности штаммов, продуцирующих L-аминокислоты, и предоставление способа получения L-аминокислот, например L-треонина и L-валина, с использованием указанных штаммов.
Данная цель была достигнута путем идентификации генов, кодирующих белки, которые не вовлечены в пути биосинтеза целевых L-аминокислот, но увеличивают их продукцию. Примером такого белка может являться мембранный белок, обладающий активностью, обеспечивающей экскрецию L-аминокислот. При анализе нуклеотидной последовательности полного генома Escherichia coli были отобраны белки с 4 или более предполагаемыми трансмембранными сегментами (ТМС). В результате тщательного исследования авторы настоящего изобретения идентифицировали среди них два гена, такие как b2682 и b2683, и тщательно изучили их. Гены b2682 и b2683 были известны как предполагаемые кодирующие последовательности, которые могут кодировать белки с неизвестной функцией (номера нуклеотидов с 92 по 829 и с 819 по 1154 в нуклеотидной последовательности под номером АЕ000353 U00096 в Genbank, соответственно). Ген b2683 также известен как ygaH. Также авторы настоящего изобретения установили, что при повышении активности белков, кодируемых генами b2682 и b2683, увеличивается продуктивность штаммов, продуцирующих L-аминокислоты. Таким образом было совершено настоящее изобретение.
Настоящее изобретение включает в себя следующее:
1. Бактерия - продуцент L-аминокислоты, принадлежащая к роду Escherichia, в которой продукция L-аминокислоты упомянутой бактерией увеличена за счет повышения активности белков, описанных в пунктах (А) или (В) и (С) или (D), в клетке упомянутой бактерии:
(A) белок, который представлен аминокислотной последовательностью, приведенной в списке последовательностей под номером 3;
(B) белок, который представлен аминокислотной последовательностью, включающей делеции, замены, вставки или добавление одной или нескольких аминокислот в аминокислотную последовательность, приведенную в списке последовательностей под номером 3, и который обладает активностью, придающей бактерии устойчивость к L-аминокислотам и/или их аналогам;
(C) белок, который представлен аминокислотной последовательностью, приведенной в списке последовательностей под номером 5;
(D) белок, который представлен аминокислотной последовательностью, включающей делеции, замены, вставки или добавление одной или нескольких аминокислот в аминокислотную последовательность, приведенную в списке последовательностей под номером 5, и который обладает активностью, придающей бактерии устойчивость к L-аминокислотам и/или их аналогам;
(здесь и далее, белки, описанные в вышеупомянутых пунктах (А) или (В) и (С) или (D) упоминаются как "белки согласно настоящему изобретению").
2. Бактерия в соответствии с вышеупомянутой бактерией, в которой активности белков, описанных в пунктах (А) или (В) и (С) или (D), повышены путем трансформации бактерии с помощью ДНК, кодирующей белки, описанные в пунктах (А) или (В) и (С) или (D), или путем изменения регуляции экспрессии нуклеотидной последовательности в хромосоме упомянутой бактерии.
3. Бактерия в соответствии с вышеупомянутой бактерией, в которой трансформация осуществляется с использованием многокопийного вектора.
4. Способ получения L-аминокислоты, включающий выращивание бактерии в соответствии с вышеупомянутой бактерией в питательной среде и сбор из культуральной жидкости полученной и накопленной в ней L-аминокислоты.
5. Способ в соответствии с вышеупомянутым способом, в котором L-аминокислотой является L-треонин.
6. Способ в соответствии с вышеупомянутым способом, в котором у указанной бактерии повышена экспрессия треонинового оперона.
7. Способ в соответствии с вышеупомянутым способом, в котором L-аминокислотой является L-валин.
8. Способ в соответствии с вышеупомянутым способом, в котором у указанной бактерии повышена экспрессия ilv оперона.
Способ получения L-аминокислоты включает продукцию L-треонина с использованием бактерии - продуцента L-треонина, в которой повышены активности белков согласно настоящему изобретению, например, представленных аминокислотными последовательностями, приведенными под номерами 3 и 5. Также способ получения L-аминокислоты включает продукцию L-валина с использованием бактерии - продуцента L-валина, в которой повышены активности белков согласно настоящему изобретению, например, представленных аминокислотными последовательностями, приведенными под номерами 3 и 5.
Настоящее изобретение более детально будет описано ниже.
Вышеуказанной бактерией согласно настоящему изобретению является бактерия - продуцент L-аминокислоты, принадлежащая к роду Escherichia, в которой продукция L-аминокислоты указанной бактерией увеличена за счет повышения активностей белков согласно настоящему изобретению в клетке бактерии.
Вышеуказанной бактерией согласно настоящему изобретению является бактерия - продуцент L-аминокислоты, принадлежащая к роду Escherichia и обладающая повышенной активностью белков, которые увеличивают продукцию целевой L-аминокислоты. Конкретно, бактерией согласно настоящему изобретению является бактерия - продуцент L-аминокислоты, принадлежащая к роду Escherichia и обладающая повышенной активностью белков согласно настоящему изобретению. Более конкретно, бактерия согласно настоящему изобретению содержит ДНК, в которой повышена экспрессия генов b2682 и b2683 на хромосоме ДНК или на плазмиде в бактерии, обладает повышенной способностью к продукции L-аминокислоты, например L-треонина и/или L-валина.
К белкам согласно настоящему изобретению относятся белки, описанные в следующих пунктах (А) или (В) и (С) или (D):
(А) белок, который представлен аминокислотной последовательностью, приведенной в списке последовательностей под номером 3;
(B) белок, который представлен аминокислотной последовательностью, включающей делеции, замены, вставки или добавление одной или нескольких аминокислот в аминокислотную последовательность, приведенную в списке последовательностей под номером 3, и который обладает активностью, придающей бактерии устойчивость к L-аминокислотам и/или их аналогам;
(C) белок, который представлен аминокислотной последовательностью, приведенной в списке последовательностей под номером 5;
(D) белок, который представлен аминокислотной последовательностью, включающей делеции, замены, вставки или добавление одной или нескольких аминокислот в аминокислотную последовательность, приведенную в списке последовательностей под номером 5, и который обладает активностью, придающей бактерии устойчивость к L-аминокислотам и/или их аналогам.
Количество "нескольких" аминокислот различается в зависимости от положения и типа аминокислотного остатка в трехмерной структуре белка. Оно может быть от 2 до 24, предпочтительно от 2 до 12, и более предпочтительно от 2 до 5 для белка (А), и от 2 до 11, предпочтительно от 2 до 7, и более предпочтительно от 2 до 5 для белка (С) соответственно.
Устойчивость к L-аминокислотам и/или их аналогам означает способность бактерии к росту на минимальной питательной среде, содержащей L-аминокислоту и/или ее аналог в концентрации, при которой штамм дикого типа или родительский штамм не может расти, или способность бактерии расти с большей скоростью на питательной среде, содержащей L-аминокислоту и/или ее аналог, чем штамм дикого типа или родительский штамм. Примерами аналогов L-аминокислот являются 3,4-дигидропролин, DL-тиаизолейцин, DL-o-метилсерин, 4-азалейцин, норлейцин, L-o-фторфенилаланин и DL-o-фторфенилаланин. Упомянутая выше концентрация L-аминокислоты и ее аналога варьируется значительно (от 0,5 мкг/мл в случае DL-тиаизолейцина до 9600 мкг/мл в случае DL-o-метилсерина) в зависимости от химической структуры используемого соединения. Например, указанная концентрация составляет обычно от 7 до 70 мкг/мл, предпочтительно от 20 до 25 мкг/мл в случае 3,4-дигидропролина; обычно от 0,5 до 5,0 мкг/мл, предпочтительно от 0,9 до 1,1 мкг/мл в случае DL-тиаизолейцина; обычно от 1100 до 9600 мкг/мл, предпочтительно от 3000 до 3500 мкг/мл в случае DL-o-метилсерина; обычно от 15 до 150 мкг/мл, предпочтительно от 40 до 50 мкг/мл в случае 4-азалейцина; обычно от 150 до 1500 мкг/мл, предпочтительно от 450 до 550 мкг/мл в случае норлейцина; обычно от 0,6 до 6,0 мкг/мл, предпочтительно от 1,5 до 2,0 мкг/мл в случае L-o-фторфенилаланина; обычно от 2 до 20 мкг/мл, предпочтительно от 5 до 7 мкг/мл в случае DL-o-фторфенилаланина.
К бактерии согласно настоящему изобретению также относятся бактерии, в которых активности белков согласно настоящему изобретению повышены путем трансформации бактерии с помощью ДНК, кодирующей белки, описанные в пунктах (А) или (В) и (С) или (D), или путем изменения регуляции экспрессии последовательности указанной ДНК в хромосоме упомянутой бактерии.
Упомянутая ДНК, использующаяся для модификации бактерии согласно настоящему изобретению, кодирует, как предполагается, мембранный белок. Конкретно, упомянутая ДНК кодирует белок с 4 или более трансмембранными сегментами. Такая ДНК может кодировать белки, обладающие активностью по экскреции L-аминокислот. Более конкретно, гены b2682 и b2683 являются такой ДНК. Необходимо отметить, что кодирующий участок гена b2682 в области 728-738 и кодирующий участок гена b2683 в области 1-11 перекрываются. Оба гена могут быть получены, например, с помощью ПЦР с использованием затравок с нуклеотидной последовательностью, приведенной под номерами 1 и 2, в виде единственного продукта.
Анализ последовательности полного генома Escherichia coli позволил выбрать гены, кодирующие белки с 4 и более предполагаемыми ТМС. Белки с известной функцией и транспортеры, описанные Paulsen I.T., Sliwinski M.I., Saier M. H. (J. Mol. Biol. , 1998, 277, 573) и Linton K.J., Higgins C.F. (Molecular Microbiology, 1998, 28(1), 5), исключили из группы, подлежащей изучению. В результате тщательного отбора среди оставшихся генов были выбраны несколько генов, кодирующих, как предполагалось, мембранные экспортеры. И было обнаружено, что повышенная экспрессия генов b2682 и b2683 увеличивает продукцию L-аминокислот штаммами - продуцентами L-аминокислот.
К ДНК согласно настоящему изобретению относится ДНК, кодирующая белок, включающий делеции, замены, вставки или добавление одной или нескольких аминокислот в одно или несколько положений белка (А) или (С) при условии, что они не приводят к утрате активности указанного белка. Хотя количество "нескольких" аминокислот различается в зависимости от положения и типа аминокислотного остатка в трехмерной структуре белка, оно может быть от 2 до 24, предпочтительно от 2 до 12, и более предпочтительно от 2 до 5 для белка (А), и от 2 до 11, предпочтительно от 2 до 7, и более предпочтительно от 2 до 5 для белка (С) соответственно. ДНК, кодирующая практически такой же белок, как белок, описанный в пунктах (А) и (С), может быть получена, например, путем модификации нуклеотидной последовательности, кодирующей белки, описанные в пунктах (А) и (С), с использованием сайт-направленного мутагенеза таким образом, что один или несколько аминокислотных остатков будут удалены, заменены, введены или добавлены. Модифицированная подобным образом ДНК может быть получена традиционными методами, использующими обработку химическими реагентами и содержание в условиях, вызывающих мутации. К подобного рода обработкам относятся обработка ДНК, кодирующей белки согласно настоящему изобретению, с помощью гидроксиламина или обработка бактерии, содержащей ДНК, с помощью УФ излучения или химического реагента, такого как N-метил-N'-нитро-N-нитрозогуанидин или азотистая кислота.
К ДНК согласно настоящему изобретению относятся варианты, которые могут быть найдены в различных штаммах или вариантах бактерий, принадлежащих к роду Escherichia, в виду природного разнообразия. ДНК, кодирующая подобные варианты, может быть получена путем выделения ДНК, которая гибридизуется с генами b2682 и b2683 или частью указанных генов в жестких условиях, и которая кодирует белок, увеличивающий продукцию L-аминокислот. Термин "жесткие условия", упомянутый здесь, означает условия, при которых образуются так называемые специфические гибриды, а неспецифические - не образуются. Например, к жестким условиям относятся условия, при которых гибридизуются ДНК, обладающие высокой степенью гомологии, к примеру ДНК, обладающие гомологией не менее 70% друг относительно друга. В качестве варианта, примером жестких условий являются условия, соответствующие условиям отмывки при гибридизации по Саузерну, например, 60oС, 1xSSC, 0,1% SDS, предпочтительно 0,1xSSC, 0,1% SDS. В качестве зонда, для ДНК, кодирующей варианты и гибридизующейся с генами b2682 и b2683, также может быть использована часть нуклеотидной последовательности под номером 3 или номером 5, соответственно. Зонд подобного рода может быть получен в результате ПЦР с использованием в качестве затравок олигонуклеотидов, полученных на основе нуклеотидной последовательности под номером 3 или номером 5, и фрагмента ДНК, содержащего нуклеотидную последовательность под номером 3 или номером 5, в качестве матрицы. В случае, когда в качестве зонда используется фрагмент ДНК длиной около 300 пар оснований, условия отмывки при гибридизации соответствуют, например, 50oС, 2xSSC и 0,1% SDS.
Трансформация бактерии с помощью ДНК, кодирующей белок, означает введение указанной ДНК в клетку бактерии, например, с помощью традиционных методов, для того, чтобы усилить экспрессию генов, кодирующих белок согласно настоящему изобретению, и повысить активность белка в клетке бактерии.
К методам увеличения экспрессии генов относятся методы увеличения числа копий гена. Введение гена в вектор, способный к функционированию в бактерии, принадлежащей к роду Escherichia, увеличивает число копий указанного гена. Для подобных целей могут быть предпочтительно использованы многокопийные векторы. Примерами многокопийных векторов являются pBR322, pMWl19, pUC19, pET22b и подобные им.
Кроме того, усиление экспрессии гена может быть достигнуто путем введения некоторого числа копий гена в бактериальную хромосому, например, методом гомологичной рекомбинации или подобным.
В случае, когда добиваются усиления экспрессии двух или более генов, указанные гены могут быть расположены вместе на одной и той же плазмиде или раздельно на различных плазмидах. Также допустимо, чтобы одни из генов располагались в хромосоме, а другие гены располагались на плазмиде.
С другой стороны, усиление экспрессии генов может быть достигнуто помещением ДНК согласно настоящему изобретению под контроль сильного промотора. Например, в качестве сильных промоторов известны lac промотор, trp промотор, trc промотор, PL и PR промоторы фага лямбда. Использование сильного промотора может быть совмещено с увеличением числа копий гена.
Бактерия согласно настоящему изобретению может быть получена путем введения вышеуказанных ДНК в бактерию, уже обладающую способностью к продукции L-аминокислоты. С другой стороны, бактерия согласно настоящему изобретению может быть получена путем придания бактерии, уже содержащей указанные ДНК, способности к продукции L-аминокислоты. В качестве родительских штаммов, в которых активности белков согласно настоящему изобретению будут повышены, могут быть использованы бактерии - продуценты L-треонина, принадлежащие к роду Escherichia, такие как VL2054 (ВКПМ В-8067), ВНИИГенетика 472Т23 (патент США 5631157), ВКПМ В-3996 (патенты США 5175107 и 5976843), КССМ-10132 (WО009660A1), КССМ-10133 (WО009661A1) или подобные. Также, в качестве родительских штаммов, в которых активности белков согласно настоящему изобретению будут повышены, могут быть использованы бактерии - продуценты L-валина, принадлежащие к роду Escherichia, такие как Н-81 (ВКПМ В-8066), NRRL В-12287 и NRRL В-12288 (патент США 4391907), ВКПМ В-4411 (патент США 5658766), ВКПМ В-7707 (европейская патентная заявка ЕР1016710А2) или подобные.
В бактерии согласно настоящему изобретению в дальнейшем может быть усилена экспрессия одного или нескольких генов, вовлеченных в биосинтез L-аминокислот. Примерами таких генов для бактерии - продуцента L-треонина являются гены треонинового оперона, предпочтительно ген, кодирующий аспартаткиназу-гомосериндегидрогеназу, чувствительность к ингибированию L-треонином по типу обратной связи в которой утрачена (патент Японии 1-29559), для бактерии - продуцента L-валина - гены оперона ilvGMEDA, в котором предпочтительно не экспрессируется треониндезаминаза, и аттенуация которого подавлена (выложенная патентная заявка Японии 8-47397).
К способам согласно настоящему изобретению относится способ продукции L-треонина, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления L-треонина в указанной питательной среде, и сбора L-треонина из культуральной жидкости. Также к способам согласно настоящему изобретению относится способ продукции L-валина, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления L-валина в указанной питательной среде, и сбора L-валина из культуральной жидкости.
Согласно настоящему изобретению выращивание, сбор и очистка L-аминокислоты из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам ферментации, в которых аминокислота продуцируется с использованием микроорганизма. Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, которые требуются микроорганизму для роста. К источникам углерода относятся различные углеводы, такие как глюкоза и сахароза, и различные органические кислоты. В зависимости от степени ассимиляции используемого микроорганизма могут использоваться спирты, такие как этанол и глицерин. В качестве источника азота могут использоваться различные соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов и ферментолизат микроорганизмов. В качестве минеральных добавок используются монофосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные соединения.
Выращивание осуществляется предпочтительно в аэробных условиях, таких как перемешивание, ферментация с аэрацией, при температуре от 20 до 40oС, предпочтительно от 30 до 38oС. рН питательной среды находится в пределах от 5 до 9, предпочтительно от 6,5 до 7,2. рН среды может регулироваться аммиаком, карбонатом кальция, различными кислотами, основаниями и буферами. Обычно выращивание в течение от 1 до 5 дней приводит к накоплению целевой L-аминокислоты в культуральной жидкости.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем целевая L-аминокислота может быть собрана и очищена методами ионообменной хроматографии, концентрирования и кристаллизации.
Краткое описание чертежей
На чертеже показана схема конструирования плазмиды pΔlacZ.
Наилучший способ осуществления изобретения
Настоящее изобретение более детально описано со ссылкой на примеры. В указанных примерах аминокислоты являются аминокислотами L-конфигурации, если не указано иное.
Пример 1. Клонирование генов b2682 и b2683 на плазмиде pΔlacZ.
Для клонирования генов b2682 и b2683 был использован вектор pΔlacZ. Вектор pΔlacZ является производным вектора pET-22b(+) (Novagen, Madison, WI, USA). Вектор pET-22b(+) был обработан рестриктазами BglII и ХbаI и лигирован с фрагментом полимеразной цепной реакции (ПЦР), полученным на плазмиде рМВ9-lас (Fuller F., Gene, 19, 43-54, 1982), обработанным теми же рестриктазами и содержащим промотор PlacUV5. Для амплификации с помощью ПЦР фрагмента с промотором PlacUV5 использовались затравки, приведенные под номерами 7 и 8. В полученную плазмиду была вставлена структурная часть гена lacZ (237 пар оснований без промотора) путем клонирования SalI-BamHI фрагмента плазмиды pJEL250 (Дымакова Е. и др., Генетика, 35, 2, 181-186, 1999). Схема конструкции вектора pΔlacZ показана на чертеже.
Исходным материалом для клонирования предполагаемых рамок считывания b2682 и b2683 из Е.coli (генов b2682 и b2683) был фрагмент ПЦР, полученный с использованием ДНК из штамма Е. coli TG1 в качестве матрицы. Для синтеза этого фрагмента были использованы две затравки, нуклеотидная последовательность которых приведена под номерами 1 и 2. ПЦР осуществлялась на "Perkin Elmer GeneAmp PCR System 2400" в следующих условиях: 40 секунд при 95oС, 40 секунд при 47oС, 40 секунд при 72oС, 30 циклов. Таким образом был получен линейный фрагмент ДНК длиной 1158 пар оснований, содержащий гены b2682 и b2683. Данный фрагмент ПЦР был обработан рестриктазами ХbаI и ВаmHI и введен в многокопийный вектор pΔlacZ, предварительно обработанный теми же рестриктазами.
Полученная плазмида, содержащая фрагмент ПЦР, была названа как pYGAZH и содержала гены b2682 и b2683 под контролем лактозного промотора (PlacUV5).
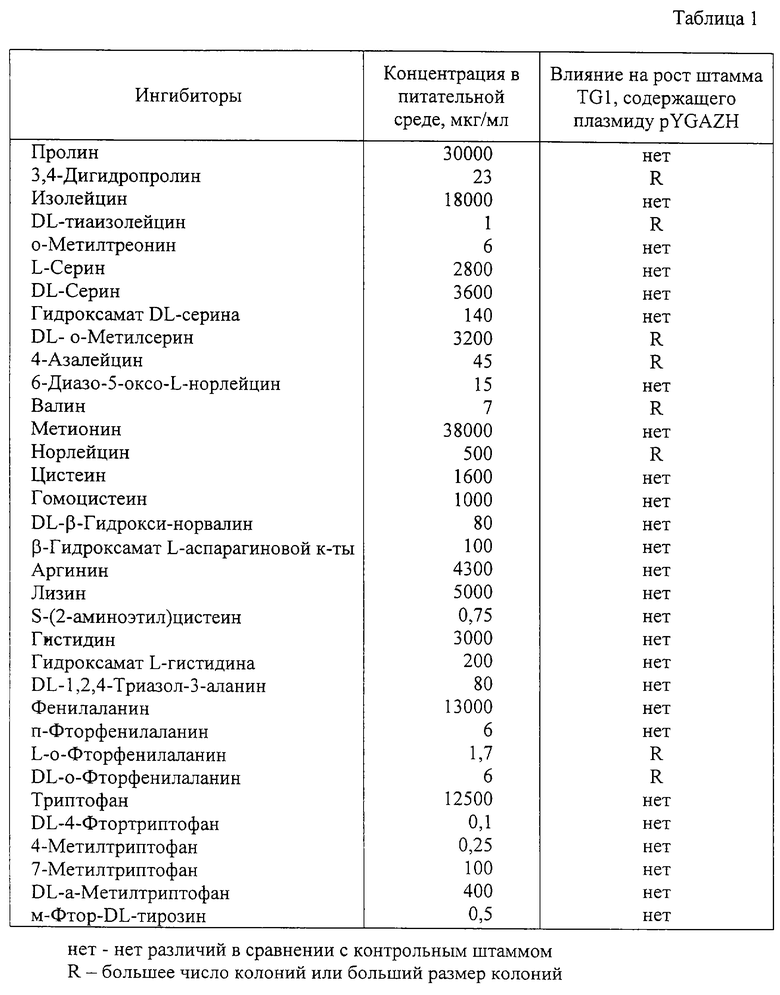
Пример 2. Влияние амплифицированных генов b2682 и b2683 на устойчивость штамма Е.coli TG1 к аминокислотам и их аналогам.
Штамм Е. coli TG1 (pYGAZH) и штамм Е.coli TG1, содержащий вектор без вставки, (контрольный штамм) выращивались в течение ночи в среде LB, содержащей ампициллин (100 мкг/мл). Ночные культуры всех штаммов были разбавлены в 25 раз свежей средой LB, содержащей ампициллин (100 мкг/мл) и ИПТГ (0,5 мМ), и инкубировались в течение 2 ч при 37oС с аэрацией. Культуры в фазе логарифмического роста были разбавлены 0,9% раствором хлорида натрия и около 1000 клеток были высеяны на чашки с твердой питательной средой Адамса, содержащей ампициллин (100 мкг/мл), ИПТГ (0,5 мМ) и аминокислоту или ее аналог. После 2-4 дней инкубации при 37oС определялись различия в размере колоний или их числе между штаммом TG1, содержащим гибридную плазмиду, и контрольным штаммом TG1. Результаты экспериментов представлены в табл. 1.
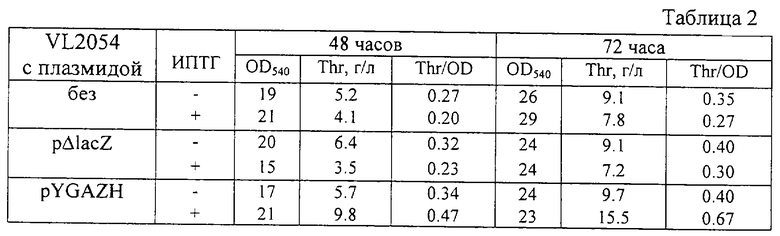
Пример 3. Продукция треонина штаммом, содержащим плазмиду pYGAZH.
Штамм VL2054 - продуцент треонина был трансформирован плазмидой pYGAZH, содержащей гены b2682 и b2683 под контролем промотора PlacUV5. Полученный штамм был назван VL2054(pYGAZH). Штамм VL2054 является производным штамма ВКПМ В-3996 и содержит на хромосоме:
а) интегрированный треониновый оперон под контролем промотора PR;
б) нативный ген rhtA;
в) инактивированный хромосомный ген, кодирующий треониндегидрогеназу (ген tdh}, и инактивированный ген устойчивости к канамицину (ген kan) в Тn5 (tdh::Tn5, Kans);
г) мутацию ilνA442.
Штамм VL2054 был депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (Россия, 113545, Москва, 1-й Дорожный проезд, 1) 30 января 2001 года под инвентарным номером ВКПМ В-8067.
5 колоний каждого из штаммов VL2054, VL2054(pΔlacZ) в качестве контрольного штамма, содержащего плазмиду без вставки, и VL2054(pYGAZH) были суспендированы в 2 мл минимальной питательной среды ((NH4)2SО4 - 11 г/л, NaCl - 0,4 г/л, MgSО4 - 0,4 г/л, К2НРО4 - 1 г/л, FeSО4 - 10 мг/л, MnSО4 - 10 мг/л, тиамин - 0,1 мг/л, дрожжевой экстракт - 0,5 г/л, глюкоза - 40 г/л и ампициллин - 300 мг/л, если необходимо) в 20 мл пробирках и инкубировались в течение ночи с аэрацией при 32oС. 0,2 мл каждой ночной культуры были перенесены в три 20 мл пробирки с 2 мл свежей среды для ферментации с или без ИПТГ и выращивались при 32oС в течение 48 или 72 ч на роторной качалке.
Состав среды для ферментации:
(NH4)2SО4 - 22 г/л
NaCl - 0,8 г/л
MgSО4 - 0,8 г/л
К2НРО4 - 2,0 г/л
FeS04
20 мг/л - MnSО4 - 20 мг/л
Тиамин - 0,2 мг/л
Дрожжевой экстракт - 1,0 г/л
СаСО3 - 30 г/л
Глюкоза - 80 г/л
Ампициллин - 300 мг/л, если необходимо
ИПТГ - 0,5 мМ, если необходимо
После выращивания стабильность плазмиды и оптическая плотность культуральной жидкости при 540 нм были определены традиционными методами. Накопленное в культуральной жидкости количество треонина было определено с помощью тонкослойной хроматографии (ТСХ). Состав подвижной фазы для ТСХ следующий: изопропанол - 50 мл, ацетон - 50 мл, NH4ОH (30%) - 12 мл, H2O - 8 мл. Результаты приведены в табл. 2. Как видно, гибридная плазмида pYGAZH увеличивала накопление треонина штаммом VL2054 - продуцентом треонина.
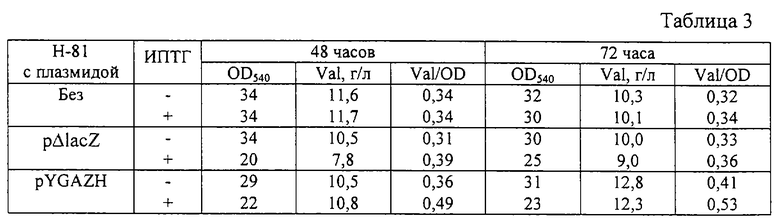
Пример 4. Продукция валина штаммом, содержащим плазмиду pYGAZH.
Штамм Н-81 - продуцент валина был трансформирован плазмидой pYGAZH, содержащей гены b2682 и b2683 под контролем промотора PlacUV5.
Штамм Н-81 был депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (Россия, 113545, Москва, 1-й Дорожный проезд, 1) 30 января 2001 года под инвентарным номером ВКПМ В-8066.
5 колоний каждого из штаммов Н-18, Н-81(рΔ1асZ) в качестве контрольного штамма, содержащего плазмиду без вставки, и H-81(pYGAZH) были суспендированы в 2 мл минимальной питательной среды ((NH4)2SО4 - 18 г/л, K2HPO4 - 1,8 г/л, MgSO4 - 1,2 г/л, тиамин - 0,1 мг/л, дрожжевой экстракт - 0,5 г/л, глюкоза - 60 г/л, ампициллин - 300 мг/л, если необходимо) в 20 мл пробирках и инкубировались в течение ночи с аэрацией при 32oС. 0,2 мл каждой ночной культуры были перенесены в три 20 мл пробирки с 2 мл свежей среды для ферментации с или без ИПТГ, и выращивались при 32oС в течение 48 или 72 ч на роторной качалке.
Состав среды для ферментации:
(NH4)2SО4 - 18 г/л
К2НРO4 - 1,8 г/л
MgSО4 - 1,2 г/л
СаСО3 - 20 г/л
Тиамин - 0,1 мг/л
Глюкоза - 60 г/л
Ампициллин - 300 мг/л, если необходимо
ИПТГ - 0,5 мМ, если необходимо
После выращивания стабильность плазмиды и оптическая плотность культуральной жидкости при 540 нм были определены традиционными методами. Накопленное в культуральной жидкости количество валина было определено с помощью тонкослойной хроматографии (ТСХ). Состав подвижной фазы для ТСХ следующий: изопропанол - 80 мл, этилацетат - 80 мл, NH4OH (30%) - 15 мл, Н2О - 45 мл. Результаты приведены в табл. 3. Как видно, гибридная плазмида pYGAZH увеличивала накопление валина штаммом Н-81 - продуцентом валина.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ, ШТАММ Escherichia coli - ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ (ВАРИАНТЫ) | 2001 |
|
RU2215784C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ, ШТАММ Escherichia coli - ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ (ВАРИАНТЫ) | 2001 |
|
RU2215785C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ, ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ (ВАРИАНТЫ) | 2001 |
|
RU2229513C2 |
| СПОСОБ ПОЛУЧЕНИЯ НЕАРОМАТИЧЕСКОЙ L-АМИНОКИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН kefB | 2006 |
|
RU2333951C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ СЕМЕЙСТВА ГЛУТАМАТА ИЛИ L-ВАЛИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia | 2009 |
|
RU2418064C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА Enterobacteriaceae, ОБЛАДАЮЩЕЙ ПОВЫШЕННОЙ ЭКСПРЕССИЕЙ ГЕНОВ КАСКАДА ОБРАЗОВАНИЯ ФЛАГЕЛЛ И КЛЕТОЧНОЙ ПОДВИЖНОСТИ | 2012 |
|
RU2508404C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, СОДЕРЖАЩЕЙ НЕАКТИВНЫЙ ГЕН gadB | 2003 |
|
RU2264457C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA | 2005 |
|
RU2311454C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН leuO | 2006 |
|
RU2312894C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА ENTEROBACTERIACEAE | 2007 |
|
RU2364628C2 |




Изобретение относится к биотехнологии. L-треонин и L-валин получают культивированием бактерии Escherichia coli. После накопления L-аминокислот их извлекают из культуральной жидкости. В качестве штамма продуцента используют штамм, способность к продукции L-аминокислоты которого дополнительно увеличена за счет повышения активности белка, кодируемого геном b 1242. В качестве штамма - продуцента L-треонина может быть использован штамм Escherichia coli VL2054(pYCHE), а в качестве продуцента L-валина - Escherichia coli H-81(pYCHE). Изобретение позволяет получать L-аминокислоты с высокой степенью эффективности. 3 с. и 4 з.п.ф-лы, 1 ил., 3 табл.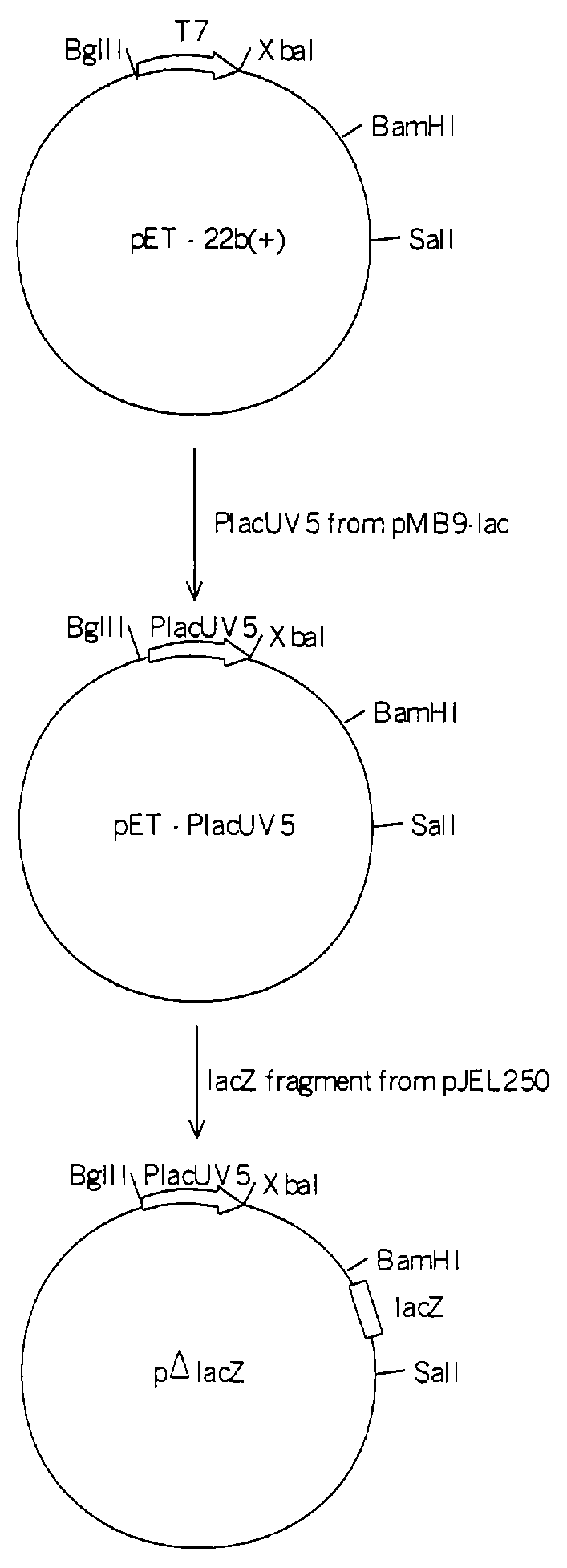
| US 5017483, 21.05.1991 | |||
| US 5705371, 06.01.1998 | |||
| Штамм бактерий ЕSснеRIснIа coLI - продуцент L-треонина | 1987 |
|
SU1694643A1 |
Авторы
Даты
2003-11-10—Публикация
2001-02-26—Подача