Область техники, к которой относится изобретение
Настоящее изобретение относится к биотехнологической промышленности, микробиологическому производству, к генной инженерии микроорганизмов, в частности к способу получения L-аминокислоты методом ферментации с помощью подвижной бактерии семейства Enterobacteriaceae, модифицированной таким образом, что экспрессия гена(ов) каскада образования флагелл и клеточной подвижности изменена; в частности к способу получения L-треонина и L-фенилаланина с помощью указанной бактерии, в которой экспрессия одного или нескольких генов каскада образования флагелл и клеточной подвижности усилена.
Уровень техники
Традиционно L-аминокислоты в промышленном масштабе получают методом ферментации с использованием штаммов микроорганизмов, полученных из природных источников, или их мутантов, специально модифицированных для того, чтобы увеличить продукцию L-аминокислот.
Описано множество методов увеличения продукции L-аминокислот, например, путем трансформации микроорганизма рекомбинантной ДНК (см., например, патент США №4,278,765) и модификации регуляторных последовательностей генов, таких как промотор, лидерная последовательность и/или аттенюатор или других, известных специалисту (патент США №20060216796 и WO 9615246 A1). Другие методы основаны на повышении активности ферментов, вовлеченных в биосинтез L-аминокислот, и/или уменьшении чувствительности целевого фермента к обратному ингибированию (также известному как ингибирование по принципу обратной связи) продуцируемой L-аминокислотой (WO 9516042 A1, ЕР 0685555 А1 или патенты США №4,346,170; 5,661,012 и 6,040,160).
Известны штаммы, используемые для получения L-треонина методом ферментации, включая штаммы, в которых усилена активность ферментов, участвующих в биосинтезе L-треонина (ЕР 0219027А2 или патенты США №5,175,107; 5,661,012; 5,705,371 и 5,939,307); штаммы, обладающие устойчивостью к таким химическим веществам, как L-треонин и его аналоги (WO 0114525A1, ЕР 301572А2, патент США №5,376,538); штаммы, в которых целевые ферменты не чувствительны к ингибированию по типу обратной связи синтезирующимися аминокислотами и побочными продуктами их синтеза (патенты США №5,175,107 и 5,661,012); и штаммы с инактивированными ферментами, катализирующими деградацию L-треонина (патенты США №5,939,307 и 6,297,031).
В литературе описаны подвижные бактерии, такие как Salmonella typhimurium, Escherichia coli, Bacillus subtilis, Yersinia enterocolitica и другие подобные им, которые могут существовать в различных формах и встречаться в природе как в подвижном одноклеточном состоянии (состояние планктона), так и в состоянии оседлых клеток, которые за счет адгезии фимбрий образуют клеточные кластеры и поверхностные биопленки (O'Toole G.A. et al., Annu. Rev. Microbiol., 2000: 54, 49-79). Клетки Е. coli, например, обладают высокой подвижностью в период фазы постэкспоненциального роста (Amsler C.D. et al., J. Bacteriol., 1993: 175, 6238-6244), в то время как при входе в стационарную фазу происходит индукция фимбрий вида «керли» (ворсинки вида «керли»), обладающих адгезивными свойствами, что приводит к агрегации бактерий или их прилипанию к поверхности с образованием пленок (Olsen A. et al., Nature, 1989: 338,652-655).
Известно, что у Escherichia coli (далее Е. coli) образование флагелл и подвижность, а также «керли»-опосредованная адгезия контролируются регуляторными каскадами с прямой связью (каскадами регуляторов), где вершиной каждого каскада является свой мастер-регулятор, который действует как глобальный интегратор сигналов окружающей среды (Pesavento С. et al., Gen. Dev., 2011: 22, 2434-2446). Каскад, контролирующий образование фимбрий вида «керли», является элементом системы общего стрессового ответа, для которого мастер-регулятором является фактор 0s (sigmaS, RpoS) (Hengge-Aronis R. 2000, The general stress response in Е. coli. In Bacterial stress responses (eds. G.Storz and R.Hengge-Aronis), pp.161-178. ASM Press, Washington, DC.). Основным активатором оперона, содержащего структурные гены фимбрий вида «керли», является белок CsgD (csgBAC (Gerstel U. et al., Mol. Microbiol., 2003: 49, 639-654).
Мастер-регулятором каскада образования флагелл и клеточной подвижности является комплекс FlhDC, оперон которого flhDC определен как флагеллярный оперон 1 класса. Флагеллярный мастер-регулятор функционирует как гетероолигомерный комплекс белков FlhD и FlhC (комплекс FlhD4C2), кристаллическая структура которого была охарактеризована применительно к бактерии Е. coli (Wang S. et al., J. Mol. Biol., 2006, 355:798-808). Комплекс FlhDC регулирует в бактерии транскрипцию различных флагеллярных и некоторых нефлагеллярных оперонов, в частности, он активирует экспрессию флагеллярных оперонов 2 класса, ответственных за внутреннюю часть флагеллы и ряд флагеллярных о-факторов (FliA, FlgM) (Pesavento С.et al., Gen. Dev., 2011: 22, 2434-2446). После секреции FlgM происходит высвобождение фактора FliA, который активирует опероны 3 класса, кодирующие субъединицы внешней части флагеллы, дополнительные белки, необходимые для функционирования флагелл и хемотаксиса, а также большое количество белков с неустановленной функцией (Aldrigde P.D. et al., Gen. Dev., 2006: 20, 2315-2326).
Другим ключевым регулятором экспрессии генов, ответственных за клеточную подвижность и образование фимбрий вида «керли», является фосфодиэстераза (ФДЭ), расщепляющая сигнальную молекулу бис-(3',5')-циклодигуанозинмонофосфат (цикло-ди-ГМФ) (Romling U. et al., Mol. Microbiol., 2005: 57, 629-639; Jenal U. and Malone J., Annu. Rev. Genet., 2006: 40, 385-407), например, ФДЭ YhjH и YciR (последняя, наряду с цикло-ди-ГМФ-фосфодиэстеразной активностью, также катализирует обратную реакцию, т.е. обладает дигуанилатциклазной активностью). Было показано, что сверхпродукция цикло-ди-ГМФ ФДЭ влияет на подвижность кишечных бактерий посредством значительной инактивации процесса образования фимбрий вида «керли» и целлюлозных компонентов матрикса биопленок (Romling U. et al., Mol. Microbiol., 2005: 57, 629-639; Jenal U. и Malone J., Annu. Rev. Genet., 2006: 40, 385-407). В частности, было показано, что YhjH положительно влияет на подвижность бактерий (Ko М. и Park С., J. Mol. Biol., 2000: 303, 371-382).
Белок FliZ - продукт гена, расположенного в опероне непосредственно после гена fliA, - является высокоэффективным ингибитором процесса образования фимбрий вида «керли» у Е. coli, что обусловлено воздействием на активность σS-фактора - мастер-регулятора, контролирующего экспрессию генов, ответственных за образование фимбрий вида «керли» (Pesavento С. et al., Gen. Dev., 2011: 22, 2434-2446). Более детально, FliZ временно обеспечивает приоритет подвижности (и, следовательно, приоритет режима питания) над общей стрессовой реакцией микроорганизма, пока поддерживается экспрессия флагеллярных генов.
Бактерия семейства Enterobacteriaceae, модифицированная таким образом, что экспрессия генов оперонов csgBAC и/или csgDEFG ослаблена (патент РФ №2338782), или таким образом, что не происходит образование белка фимбриллярного адгезина 1 типа (ЕР 1838726 А1), была использована для получения L-аминокислот, в частности, L-треонина.
Более того, известно, что микроорганизмы, имеющие флагеллы, в которых один или несколько генов, обусловливающих строение или подвижность флагелл, инактивирован(ы) или удален(ы), могут быть использованы для получения полезных веществ, в частности, L-аминокислот (WO 2002097089 A1).
Однако, в настоящее время нет сообщений о том, что усиление экспрессии бактериальных генов (flhDC, yhjH и fliZ), вовлеченных в каскад образования флагелл и клеточной подвижности, оказывает положительный эффект на продукцию L-аминокислот и, в особенности, L-треонина и L-фенилаланина.
Раскрытие сущности изобретения
Целью настоящего изобретения является предоставление бактерии, принадлежащей к семейству Enterobacteriaceae, в частности, относящейся к роду Escherichia, Enterobacter или Pantoea, модифицированной таким образом, что экспрессия одного или нескольких генов каскада образования флагелл и клеточной подвижности усилена, а также предоставление способа получения L-аминокислоты, в частности, L-треонина и L-фенилаланина с использованием указанной бактерии. Вышеупомянутая цель была достигнута за счет неожиданного обнаружения того факта, что усиление экспрессии гена(ов) каскада образования флагелл и клеточной подвижности, например, генов оперона flhDC у Е. coli, кодирующего парные регуляторы транскрипции FlhD и FlhC, образующие флагеллярный мастер-регулятор FlhD4C2, приводит к повышению продукции L-аминокислот. Авторы настоящего изобретения также неожиданно обнаружили, что использование генов оперона flhDC в комбинации с другими генами каскада образования флагелл и клеточной подвижности, такими как yhjH и fliZ, имеющими повышенный уровень экспрессии, также способствует повышенной продукции L-аминокислоты.
Объектом настоящего изобретения является предоставление способа получения L-аминокислоты, включающего выращивание в питательной среде бактерии, принадлежащей к семейству Enterobacteriaceae и способной производить L-аминокислоту, и выделение указанной L-аминокислоты из культуральной жидкости, отличающегося тем, что указанная бактерия модифицирована таким образом, что экспрессия по крайней мере одного из генов каскада образования флагелл и клеточной подвижности усилена.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что экспрессия гена(ов) каскада образования флагелл и клеточной подвижности усилена путем усиления экспрессии по крайней мере одного из генов, выбранных из группы, состоящей из гена(ов) оперона flhDC, гена yhjH и гена fliZ, или их комбинации.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что экспрессия гена(ов) оперона flhDC усилена путем изменения регуляторной области, контролирующей экспрессию указанного(ых) гена(ов).
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что экспрессия гена(ов) оперона flhDC усилена путем увеличения числа копий гена(ов) оперона flhDC.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что указанная бактерия принадлежит к роду Escherichia.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что указанная бактерия является Escherichia coli.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что указанная бактерия принадлежит к роду Enterobacter.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что указанная бактерия принадлежит к роду Pantoea.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что ген flhD кодирует белок, выбранный из группы, состоящей из:
(А) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO:2;
(B) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO:2, но в которой один или несколько аминокислотных остатков замещен, удален, вставлен, добавлен или инвертирован, причем указанный белок имеет активность ДНК-связывающего парного регулятора транскрипции согласно последовательности SEQ ID NO:2; и
(C) их комбинации.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что renflhC кодирует белок, выбранный из группы, состоящей из:
(D) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO:4;
(Е) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO:4, но в которой один или несколько аминокислотных остатков замещен, удален, вставлен, добавлен или инвертирован, причем указанный белок имеет активность ДНК-связывающий парного регулятора транскрипции согласно последовательности SEQ ID NO:4; и
(F) их комбинации.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что ген yhjH кодирует белок, выбранный из группы, состоящей из:
(G) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO:6;
(Н) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO:6, но в которой один или несколько аминокислотных остатков замещен, удален, вставлен, добавлен или инвертирован, причем указанный белок имеет активность цикло-ди-ГМФ фосфодиэстеразы согласно последовательности SEQ ID NO:6; и
(I) их комбинации.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что ген fliZ кодирует белок, выбранный из группы, состоящей из;
(J) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO:8;
(K) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO:8, но в которой один или несколько аминокислотных остатков замещен, удален, вставлен, добавлен или инвертирован, причем указанный белок имеет активность регулятора согласно последовательности SEQ ID NO:8; и
(L) их комбинации.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что L-аминокислота есть ароматическая L-аминокислота.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что ароматическая L-аминокислота есть L-фенилаланин, L-тирозин и L-триптофан.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что L-аминокислота есть неароматическая L-аминокислота.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что неароматическая L-аминокислота есть L-треонин, L-лизин, L-цистеин, L-метионин, L-лейцин, L-изолейцин, L-валин, L-гистидин, L-серин, L-аланин, L-аспарагин, L-аспарагиновая кислота, L-глутамин, L-глутаминовая кислота, L-пролин, L-аргинин и глицин.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что L-аминокислота есть L-фенилаланин.
Следующим объектом настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что L-аминокислота есть L-треонин.
Настоящее изобретение более подробно будет описано ниже со ссылкой на последующие, но не ограничивающие настоящее изобретение Примеры.
Фигуры и их краткое описание
На Фигуре 1 изображена схема конструирования ДНК-фрагмента kan-Ptac7.
На Фигуре 2 изображена схема конструирования ДНК-фрагмента cat-PyhjH7-yhjH.
На Фигуре 3 изображена схема конструирования ДНК-фрагмента cat-Ptac7.
Наилучший способ осуществления настоящего изобретения
1. Бактерия согласно настоящему изобретению
Используемый в настоящем изобретении термин «бактерия-продуцент L-аминокислоты» может означать бактерию, в том числе и более предпочтительно подвижную бактерию, которая способна продуцировать и вызывать накопление L-аминокислоты в культуральной жидкости, когда указанная бактерия выращивается (культивируется) в питательной среде. Способность бактерии продуцировать L-аминокислоту может означать способность бактерии продуцировать L-аминокислоту в питательной среде или в бактериальных клетках, что приводит к накоплению L-аминокислоты в количествах, достаточных для ее выделения из культуральной жидкости или из бактериальных клеток, когда указанная бактерия выращивается (культивируется) в питательной среде.
Термин «L-аминокислота» обозначает и может включать в себя такие белок-образующие L-аминокислоты, как L-аланин, L-аргинин, L-аспарагин, L-аспарагиновую кислоту, L-цитруллин, L-цистеин, L-глутаминовую кислоту, L-глутамин, глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-орнитин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин и L-валин.
Термин «ароматическая L-аминокислота» может включать в себя L-фенилаланин, L-тирозин и L-триптофан. Термин «неароматическая L-аминокислота» может включать в себя L-треонин, L-лизин, L-цистеин, L-метионин, L-лейцин, L-изолейцин, L-валин, L-гистидин, глицин, L-серин, L-аланин, L-аспарагин, L-аспартат, L-глутамин, L-глутаминовую кислоту, L-пролин, L-цитруллин, L-орнитин и L-аргинин. L-треонин, L-лизин, L-цистеин, L-лейцин, L-гистидин, L- глутаминовую кислоту, L-фенилаланин, L-триптофан, L-пролин и L-аргинин более предпочтительны.
Бактерия может обладать способностью к продукции аминокислот изначально, в соответствии со своими природными характеристиками, или может быть модифицирована с помощью мутаций (мутагенеза) или технологий рекомбинантных ДНК таким образом, чтобы она получила способность продуцировать аминокислоты.
Подвижная бактерия, принадлежащая семейству Enterobacteriaceae, может быть выбрана из бактерий, относящихся к родам, входящим в состав этого семейства, таких как Enterobacter, Envinia, Escherichia, Morganella, Pantoea, Salmonella, Yersinia и т.д., и способных продуцировать L-аминокислоты. Более конкретно, могут быть использованы бактерии, классифицируемые как принадлежащие к семейству Enterobacteriaceae в соответствии с таксономией, используемой в базе данных NCBI (National Center for Biotechnology Information) (http://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi?id=:543). Предпочтительна для модификаций согласно данному изобретению бактерия, относящаяся к роду Escherichia, Enterobacter или Pantoea.
Выбор штаммов бактерий, принадлежащих к роду Escherichia, которые могут быть модифицированы в настоящем изобретении, не ограничен каким-либо образом, однако, в качестве примеров, бактерии рода Escherichia, описанные в книге Neidhardt et al. (Bachmann, B.J., Derivations and genotypes of some mutant derivatives of E. coli K-12, p.2460-2488. In F.C. Neidhardt et al. (ed.), E. coli and Salmonella: cellular and molecular biology, 2nd ed. ASM Press, Washington, D.C., 1996) могут быть включены в число бактерий согласно настоящему изобретению. В качестве конкретного примера могут быть взяты штаммы E. coli., включая E. coli W3110 (АТСС 27325), E. coli MG1655 (АТСС 47076), и т.д., которые происходят из исходного штамма дикого типа, т.е. штамма E. coli K-12. Этот штамм может быть получен, в частности, из Американской коллекции типовых культур «American Type Culture Collection, (АТСС)» (P.O. Box 1549, Manassas, VA 20108, United States of America). Каждому штамму присвоен индивидуальный регистрационный номер, и штаммы могут быть заказаны согласно регистрационному номеру (см. ссылку www.atcc.org). Регистрационные номера штаммов находятся в списке каталога Американской коллекции типовых культур «American Type Culture Collection, АТСС».
Примеры бактерий Enterobacter включают Enterobacter agglomerans, Enterobacter aerogenes, и т.д. Примеры бактерии Pantoea включают Pantoea ananatis, и т.д. Недавно некоторые виды Enterobacter agglomerans были переклассифицированы как Pantoea agglomerans, Pantoea ananatis или Pantoea stewartii на основе анализа нуклеотидной последовательности 16S рРНК и других доказательств. Бактерии, относящиеся к роду Enterobacter или Pantoea, могут быть использованы в соответствии с настоящим изобретением, так как принадлежат семейству Enterobacteriaceae. Полученные с использованием технологий генной инженерии штаммы Pantoea ananatis, такие как штамм Pantoea ananatis AJ 13355 (FERM ВР-6614), штамм AJ 13356 (PERM BP-6615), штамм AJ 13601 (PERM BP-7207) и их производные могут быть использованы по данному изобретению. Эти штаммы были классифицированы как Enterobacter agglomerans при выделении, и они депонированы как Enterobacter agglomerans. Однако позднее они были классифицированы как Pantoea ananatis на основе анализа нуклеотидной последовательности 16S рРНК и других доказательств.
Термин «подвижная бактерия», используемый в настоящем изобретении, может означать бактерию в одноклеточном или планктонном состоянии, проявляющую способность к самопроизвольному движению, но не ограниваясь этим, в подходящих условиях при помощи пропеллерного движения флагеллы или флагелл, причем эта способность проявляется в определенной фазе клеточного роста, например, фазе выраженного роста, постэкспоненциального роста или при вхождении в указанные фазы при культивировании клеток в питательной среде. В частности, может быть использована подвижная бактерия, описанная в «Bergey's Manual of Systematic Bacteriology» (2nd ed., Springer, New York). Термин «подвижная бактерия», используемый в настоящем изобретении, также может означать бактерию, обладающую способностью к поступательному перемещению в культуральной среде и вращению со скоростью, такой же, или более низкой, или более высокой, чем немодифицированная родительская бактерия или бактерия дикого типа.
Настоящее изобретение может быть реализовано путем усиления или повышения экспрессии гена(ов), ассоциированных с каскадом образования флагелл и клеточной подвижности.
Используемый в данном изобретении термин «гены, ассоциированные с каскадом образования флагелл и клеточной подвижности» может означать любой ген или гены каскада образования флагелл и клеточной подвижности, которые кодируют белок или белки, прямо или опосредованно вовлеченный(е) в процессы образования или сборки функциональных флагелл или в процессы стимуляции или поддержания клеточной подвижности различными механизмами. Примером генов, ассоциированных с каскадом образования флагелл и клеточной подвижности, могут являться, не ограничиваясь ими, гены оперона flhDC, кодирующие ключевой регуляторный комплекс FlhD4C2 (мастер-регулятор), который является положительным регулятором образования флагелл. Другими примерами генов, ассоциированных с каскадом образования флагелл и клеточной подвижности, могут являться ген yhjH, кодирующий цикло-ди-ГМФ ФДЭ, снижающий пул сигнальных молекул цикло-ди-ГМФ в бактерии (и являющийся положительным регулятором подвижности), а также ген fliZ, кодирующий регулятор FliZ, влияющий на активность σS-фактора.
Используемый в настоящем изобретении термин «функциональная флагелла» может означать правильно сформированную флагеллу, способную к вращательным и другим формам движения, что позволяет считать бактерию подвижной бактерией.
Термин «бактерия, модифицированная таким образом, что экспрессия по крайней мере одного гена каскада образования флагелл и клеточной подвижности усилена», используемый в данном изобретении, может означать, что количество молекул, кодируемых генами оперона flhDC и/или геном yhjH и/или геном fliZ, содержащихся в бактериальной клетке (количество молекул в пересчете на одну клетку) или активность этих молекул (специфическая активность) в бактериальной клетке увеличены относительно соответствующих показателей для немодифицированного бактериального штамма (дикого или родительского штамма). Бактерия может быть модифицирована таким образом, что активность белков в клетке возрастает до 150% или более, или до 200% или более, или до 300% или более по сравнению с активностью немодифицированного штамма. Примерами немодифицированных штаммов, являющимися референсными для сравнения указанной выше активности, являются, например, дикие штаммы микроорганизма Enterobacteriaceae, такие как штаммы Е. coli MG1655 (АТСС 47076) и W3110 (АТСС 27325) и штамм Pantoea ananatis AJ 13335 (FERM ВР-6614) и т.п.
Методы, которые могут быть использованы для усиления экспрессии отдельных генов или генов оперонов, включают, например, увеличение числа копий генов или оперонов в бактериальной хромосоме и/или вставку генов или оперонов в вектор, способный функционировать в бактерии семейства Enterobacteriaceae, и увеличивать число копий гена. Усиление экспрессии гена может быть достигнуто путем введения множества копий гена в бактериальную хромосому, например, методом гомологичной рекомбинации. Число копий генов может быть увеличено методом лигирования фрагментов ДНК, содержащих целевой ген, в вектор, способный функционировать в бактерии-хозяине, такой как мультикопийный вектор, получить рекомбинантную ДНК, ввести в бактериальную клетку и трансформировать бактерию. Примеры векторов, автономно реплицирующихся в клетках Е. coli, включают, но не ограничиваются ими, pUC19, pUC18, pHSG299, pHSG399, pHSG398, pACYC184 (серии векторов pHSG и pACYC доступны от Takara Bio Inc.), RSF1010, pBR322, pMW219 (pMW219 доступны от Nippon Gene Co., Ltd.), pSTV29 (доступны от Takara Bio Inc.) и т.п.
Усиление экспрессии гена может быть достигнуто также путем введения множества копий гена или оперона в хромосомную ДНК бактерии, например, методом гомологичной рекомбинации. Mu интеграции и т.п. Гомологичная рекомбинация может быть проведена с использованием в качестве целевых последовательностей, присутствующих в хромосоме во множестве копий. Последовательности с множеством копий в хромосомной ДНК включают, но не ограничиваются ими, повторяющиеся ДНК или инвертированные повторы, присутствующие на концах мобильных элементов. Также возможно включить ген или гены оперона в состав транспозона и обеспечить его перенос для введения множества копий гена или оперона в хромосомную ДНК. При использовании Mu интеграции один акт Mu интеграции позволяет ввести в бактериальную хромосому до 3 копий гена.
Усиление экспрессии гена или генов оперона также может быть достигнуто путем подстановки фрагмента ДНК под контроль сильного промотора. Примерами сильных промоторов являются lac промотор, trp промотор, trc промотор, PR или PL промоторы фага λ. Использование сильного промотора, принадлежащего семейству Enterobacteriaceae, может быть использовано в данном изобретении.
С другой стороны, действие промотора может быть усилено, например, введением мутации в промоторный район гена или оперона, ведущей к увеличению уровня транскрипции локализованного за промотором гена или генов оперона. Кроме того, известно, что замена нескольких нуклеотидов в области между сайтом связывания рибосомы (ribosome binding site - RBS) и стартовым кодоном, особенно в последовательности непосредственно перед стартовым кодоном, существенно влияет на трансляционную способность мРНК. Например, обнаружен 20-кратный разброс в уровне экспрессии в зависимости от природы трех нуклеотидов, предшествующих стартовому кодону (Gold L. et al., Annu. Rev. Microbiol., 1981: 35, 365-403; Hui A. et al., EMBO J., 1984: 3, 623-629). Использование сильного промотора можно сочетать с увеличением копий гена.
Методы приготовления плазмидной ДНК, рестрикции и лигирования ДНК, трансформации, выбора нуклеотидов в качестве праймера и т.п. могут быть обычными методами, известными специалисту в этой области. Эти методы описаны, например, в Sambrook J., Fritsch E.F. и Maniatis Т., «Molecular Cloning: A Laboratory Manual, 2nd ed.», Cold Spring Harbor Laboratory Press (1989). Методы молекулярного клонирования и экспрессии гетерологичных генов описаны в Bernard R. Glick, Jack J. Pasternak и Cheryl L. Patten, «Molecular Biotechnology: principles and applications of recombinant DNA», 4th ed., Washington, D.C: ASM Press (2009); Evans Jr., T.C. and Xu M.-Q., «Heterologous gene expression in E. coli», 1st ed., Humana Press (2011).
Уровень экспрессии гена можно определить измерением количества транскрибируемой геном мРНК, используя для этого различные известные методы, включая Нозерн-блоттинг, количественную ОТ-ПЦР (RT-PCR) и т.п. Количество белков, кодируемых геном, можно определить известными методами, включая электрофорез в SDS-ПААГ (SDS-PAGE) с последующим иммуноблоттингом (Вестерн-блоттинг) (Western blotting analysis) и подобными.
Термин «ген(ы) оперона flhDC, ген yhjH и ген fliZ в любой комбинации» применительно к данному изобретению может означать, что в предпочтительном варианте осуществления изобретения в частности, но не ограничиваясь этим, изобретение (результат) достигается за счет использования или одного гена, выбранного из гена(ов) оперона flhDC, гена yhjH и гена fliZ, или двух или более различных генов, выбранных из гена(ов) оперона flhDC и генов yhjH и fliZ в различной комбинации.
Термин «по крайней мере один из генов каскада образования флагелл и клеточной подвижности» может означать один или более генов каскада образования флагелл и клеточной подвижности и может включать, не ограничиваясь этим, ген(ы) оперона flhDC, гены yhjH и fliZ к любой комбинации.
Оперон flhDC состоит из двух генов - flhD и flhC.
Ген flhD кодирует ДНК-связывающий парный регулятор транскрипции FlhD (KEGG, Kyoto Encyclopedia of Genes and Genomes, инвентарный №bl892). Ген flhD (нуклеотиды, комплементарные нуклеотидам в положении с 1,975,871 по 1,976,221; GenBank, инвентарный №NC_000913.2; Gene ID: 945442) расположен между генами flhC и ins В на хромосоме Е. coli K-12. Нуклеотидная последовательность гена flhD и аминокислотная последовательность белка FlhD, кодируемого геном flhD, представлены в SEQ ID NO:1 и SEQ ID NO:2, соответственно.
Ген flhC кодирует ДНК-связывающий парный регулятор транскрипции FlhC (KEGG, инвентарный №Ы891). Ген flhC (нуклеотиды, комплементарные нуклеотидам в положении с 1,975,290 по 1,975,868; GenBank, инвентарный №NC_000913.2; Gene ID: 947280) расположен между генами motA и flhD на хромосоме Е. coli K-12. Нуклеотидная последовательность гена flhC и аминокислотная последовательность белка FlhC, кодируемого геном flhC, представлены в SEQ ID NO:3 и SEQ ID NO:4, соответственно.
Ген yhjH кодирует цикло-ди-ГМФ фосфодиэстеразу YhjH (KEGG, инвентарный №Ь3525). Ген yhjH (нуклеотиды, комплементарные нуклеотидам в положении с 3,676,443 по 3,677,210; GenBank, инвентарный №NC_000913.2; Gene ID: 948042) расположен между генами yhjG и kdgK на хромосоме Е. coli K-12. Нуклеотидная последовательность гена yhjH и аминокислотная последовательность белка YhjH, кодируемого геном yhjH, представлены в SEQ ID NO:5 и SEQ ID NO:6, соответственно.
Ген fliZ кодирует белок FliZ, являющийся антагонистом RpoS и вероятным регулятором активности FliA (KEGG, инвентарный №В 1921). Ген fliZ (нуклеотиды, комплементарные нуклеотидам в положении с 1,998,497 по 1,999,048; GenBank, инвентарный №NC_000913.2; Gene ID: 946833) расположен между генами fliY and fliA на хромосоме Е. coli K-12. Нуклеотидная последовательность гена fliZ и аминокислотная последовательность белка FliZ, кодируемого геном fliZ, представлены в SEQ ID NO:7 и SEQ ID NO:8, соответственно.
Ввиду того, что могут быть некоторые различия в последовательностях ДНК между родами и штаммами бактерий семейства Enterobacteriaceae, гены оперона flhDC и гены yhjH и fliZ не ограничиваются нуклеотидными последовательностями генов, приведенных в SEQ ID NOs:1, 3, 5 и 7, однако могут включать гены, гомологичные нуклеотидным последовательностям SEQ ID NOs:1, 3, 5 и 7, кодирующие варианты белков FlhD, FlhC, YhjH и FliZ.
Термин «вариант белка», используемый в настоящем изобретении, может означать белок, который содержит изменения в последовательности, которыми могут быть делеции, вставки, добавления или замены аминокислотных остатков, при условии, что активность такого белка такая же, как и у белков FlhD, FlhC, YhjH и FliZ, соответственно. Количество изменений в вариантах белков зависит от вида или положения аминокислотного остатка в третичной структуре белка. Оно может быть от 1 до 30, предпочтительно от 1 до 15 и еще более предпочтительно от 1 до 5 в SEQ ID NO:2, 4, 6 и 8.
Консервативными заменами могут быть взаимные замены между Phe, Trp и Tyr, если сайт замещения содержит ароматическую аминокислоту; между Leu, Ile и Val, если сайт замещения содержит гидрофобную аминокислоту; между Gln и Asn, если сайт замещения содержит полярную аминокислоту; между Lys, Arg и His, если сайт замещения содержит основную аминокислоту; между Asp и Glu, если сайт замещения содержит кислую аминокислоту; между Ser и Thr, если сайт замещения содержит аминокислоту, имеющую гидроксильную группу. Специфическими примерами консервативных замен могут быть замены Ser или Thr на Ala; замена Gln, His или Lys на Arg; замена Glu, Gln, Lys, His или Asp на Asn; замена Asn, Glu или Gln на Asp; замена Ser или Ala на Cys; замена Asn, Glu, Lys, His, Asp или Arg на Gln; замена Gly, Asn, Gln, Lys или Asp на Glu; замена Pro на Gly; замена Asn, Lys, Gln, Arg или Tyr на His; замена Leu, Met, Val или Phe на Ile; замена Ile, Met, Val или Phe на Leu; замена Asn, Glu, Gln, His или Arg на Lys; замена Ile, Leu, Val или Phe на Met; замена Trp, Tyr, Met, Ile или Leu на Phe; замена Thr или Ala на Ser; замена Ser или Ala на Thr; замена Phe или Tyr на Tip; замена His, Phe или Trp на Tyr; и замена Met, He или Leu на Val. Описанные выше мутации аминокислотных остатков, такие как делеции, вставки, добавления, замены или подобные также могут включать мутации, происходящие естественным образом ввиду индивидуальных различий видов микроорганизмов, имеющих гены оперона flhDC и гены yhjH и fliZ (мутантные или варианты), и т.п.
В вариантах белков подобные изменения могут быть в областях, не критичных для функции белка, так как некоторые аминокислоты в высокой степени гомологичны другим, и поэтому третичная структура или активность белка не затрагивается ввиду этих изменений. Следовательно, варианты белков, кодируемые генами оперона flhDC и генами yhjH и fliZ, могут иметь гомологию не менее чем 80%, предпочтительно не менее чем 90%, более предпочтительно не менее чем 95% по отношению к полной аминокислотной последовательности, приведенной в SEQ ID NOs:2, 4, 6 и 8, при условии, что активность и/или функция соответствующих белков FlhD и FlhC, а также комплекса FlhD4C2, образуемого белками FlhD и FlhC, а также белков YhjH и FlizH сохранена. Гомология между двумя аминокислотными последовательностями может быть определена с использованием известных методов, например, компьютерной программы BLAST (Basic Local Alignment Search Tool, www.ncbi.nlm.nih.gov/BLAST/), которая считает три параметра: число аминокислотных остатков, идентичность и сходство.
Кроме того, гены оперона flhDC и гены yhjH и fliZ могут быть вариантами, если они гибридизуются в жестких условиях с нуклеотидными последовательностями, комплементарными нуклеотидным последовательностям, приведенным в Перечне последовательностей под номерами SEQ ID NOs:1, 3, 5 и 7, или с зондом, который может быть синтезирован на основе указанных нуклеотидных последовательностей, при условии, что он кодирует функциональные белки FlhD и FlhC, а также комплекс FlhD4C2, образуемый белками FlhD и FlhC, а также белки YhjH и FliZ.
Под «жесткими условиями» понимаются такие условия, в которых образуются специфические гибриды, например, гибриды, имеющие гомологию, не менее чем 80%, или в другом примере не менее чем 90%, или в другом примере не менее чем 95%, или в другом примере не менее чем 97%, или в другом примере не менее чем 99%, и в которых не образуются неспецифические гибриды, например, гибриды, имеющие гомологию меньшую, чем указанно выше. Практическим примером жестких условий является однократная отмывка, предпочтительно двух- или трехкратная, при концентрации солей 1×SSC, 0.1% SDS, или в другом примере 0.1×SSC, 0.1% SDS, при 60°С, или в другом примере при 65°С. Продолжительность отмывки зависит от типа используемой для блоттинга мембраны и, как правило, такова, как рекомендовано производителем. Например, рекомендуемая продолжительность отмывки для положительно заряженной нейлоновой мембраны Hybond™-N+(Amersham) при строгих условиях составляет 15 минут. Предпочтительна двух- или трехкратная отмывка.
Гены, кодирующие белки Е. coli FlhD, FlhC, YhjH и FliZ, известны (см. описание выше), поэтому эти гены и гены, кодирующие варианты указанных выше белков, могут быть получены с использованием метода ПЦР (полимеразная цепная реакция; White T.J. et al., Trends Genet., 1989: 5, 185-189) с использованием праймеров, синтезированных на основе нуклеотидной последовательности генов flhD, flhC, yhjH и fliZ, соответствующих указанным выше белкам. Более конкретно, в качестве зонда может быть использована часть последовательности, комплементарная последовательности, приведенной в SEQ ID NOs:1, 3, 5 и 7. Подобный зонд может быть получен с помощью ПЦР с использованием олигонуклеотидных праймеров, приготовленных на основе последовательностей, приведенных в SEQ ID NOs:1, 3, 5 и 7, и фрагмента ДНК, содержащего нуклеотидную последовательность, в качестве матрицы. Рекомендуемая длина зонда составляет >50 п.н., и она может быть подобрана в зависимости от условий гибридизации, в данном конкретном случае она может быть около 100-1000 п.н. Например, при использовании в качестве зонда фрагмента ДНК длиной около 300 п.н. условия отмывки могут быть как 2×SSC, 0.1% SDS при 50°С, или в другом примере при 60°С, или в другом примере при 65°С.
Методы, которые могут быть использованы для придания бактерии семейства Enterobacteriaceae способности продуцировать L-аминокислоту, такую как L-лизин, L-треонин, L-аспарагиновую кислоту, L-аспарагин, L-метионин, L-аланин и/или L-изолейцин, а также методы повышения способности бактерии семейства Enterobacteriaceae производить эти L-аминокислоты, описаны ниже.
Для получения бактерий рода Escherichia или коринеформных бактерий, способных продуцировать L-аминокислоты (в том числе тех, исходные штаммы которых не обладают такой способностью), могут применяться общепринятые методы («Amino acid fermentation», Gakkai Shuppan Center (Ltd.), pp.77-100, 1st ed., 1986). Эти методы сводятся к получению мутантных штаммов-ауксотрофов; штаммов, устойчивых к аналогам L-аминокислот; штаммов с мутациями, затрагивающими регуляцию метаболизма; или рекомбинантных штаммов, обладающих сверхэкспрессией ферментов биосинтеза L-аминокислот. При получении продуцирующих L-аминокислоты бактерий может достигаться одно или несколько из указанных свойств, таких как ауксотрофия, устойчивость к аналогам L-аминокислот или изменения в регуляции метаболизма с помощью мутагенеза. Экспрессия ферментов биосинтеза L-аминокислот может быть усилена как для одного фермента, так для комбинации двух или более ферментов. Более того, методы приобретения свойств ауксотрофии, устойчивости к аналогам L-аминокислот или мутационные изменения в регуляции метаболизма могут использоваться в комбинации с методами усиления биосинтеза ферментов.
Мутантные штаммы-ауксоторофы, штаммы устойчивые к аналогам L-аминокислот или штаммы с мутациями, затрагивающими регуляцию метаболизма, способные производить L-аминокислоты, могут быть получены с использованием различных методов мутагенеза. Штамм дикого типа или родительский может быть подвергнут обычному мутагенезу, вызванному, например, экспозицией ренгеновскому излучению (X-rays) или облучением УФ-радиацией, обработкой мутагенами, такими как N-метил-N'-нитро-N-нитрозогуанидин (НТГ) или этил-метаносульфонат (ЭМС), после чего производят отбор штаммов, проявляющих заданные свойства в соответствии с излагаемым изобретением, такие как ауксотрофию, аутотрофию, устойчивость к аналогам L-аминокислот или мутациями, затрагивающими регуляцию метаболизма.
Бактерия-продуцент L-треонина
Примеры родительских штаммов, которые могут быть использованы для получения бактерии-продуцента L-треонина, включают, но не ограничиваются ими, штаммы, принадлежащие к роду Escherichia, такие как штамм Е. coli TDH-6/pVIC40 (ВКПМ В-3996) (патенты США №5,175,107 и 5,705,371), штамм Е. coli NRRL-21593 (патент США №5,939,307), штамм Е. coli PERM BP-3756 (патент США №5,474,918), штаммы Е. coli FERM ВР-3519 и FERM ВР-3520 (патент США №5,376,538), штамм Е. coli MG442 (Гусятинер М. и др., Генетика, 1978: 14, 947-956), штаммы Е. coli VL643 и VL2055 (Европейская патентная заявка ЕР1149911А2) и подобные им.
Штамм TDH-6 является дефицитным по гену thrC, способен ассимилировать сахарозу и содержит ген ilvA с мутацией, сохраняющей остаточный уровень экспрессии гена (мутация типа «leaky»). Указанный штамм содержит мутацию в гене rhtA, которая обуславливает устойчивость к высоким концентрациям треонина и гомосерина. Штамм В-3996 содержит плазмиду pVIC40, которая была получена путем введения в вектор, производный от вектора RSF1010, оперона thrA*BC, включающего мутантный ген thrA, кодирующий аспартокиназа-гомосериндегидрогеназу I, у которой существенно снижена чувствительность к ингибированию треонином по типу обратной связи. Штамм В-3996 был депонирован 19 ноября 1987 года во Всесоюзном научном центре антибиотиков (РФ, 117105 Москва, Нагатинская ул., 3-А) с инвентарным номером РИА 1867. Указанный штамм также был депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (РФ, 117545 Москва, 1-й Дорожный проезд, 1) 7 апреля 1987 г. с инвентарным номером В-3996.
В качестве родительского штамма для получения бактерии-продуцента L-треонина также может быть использован штамм Е. coli ВКПМ В-5318 (Европейская патентная заявка ЕР 0593792 В). Штамм В-5318 является прототрофным относительно изолейцина, и чувствительный к температуре С1 репрессор фага λ и PR-промотор замещает регуляторную область в треониновом опероне на плазмиде pVIC40. Штамм ВКПМ В-5318 депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (РФ, 117545 Москва, 1-й Дорожный проезд, 1) 3 мая 1990 г. с инвентарным номером В-5318.
Бактерия может быть дополнительно модифицирована таким образом, чтобы иметь повышенную экспрессию одного или нескольких следующих генов (патент РФ №2275424):
- мутантного гена thrA, кодирующего аспартокиназа-гомосериндегидрогеназу I, устойчивую к ингибированию треонином по типу обратной связи;
- гена thrB, кодирующего гомосеринкиназу;
- гена thrC, кодирующего треонинсинтазу;
- гена rhtA, кодирующего кодирующего внутренний мембранный транспортер системы выброса треонина и гомосерина;
- гена asd, кодирующего аспартат-β-семиальдегиддегидрогеназу; и
- гена aspC, кодирующего аспартатаминотрансферазу.
Нуклеотидная последовательность гена thrA, кодирующего аспартокиназа-гомосериндегидрогеназу I из Е. coli, известна (KEGG, инвентарный №b0002; GenBank, инвентарный №NC_000913.2; номера нуклеотидов с 337 по 2,799; Gene ID; 945803). Ген thrA расположен на хромосоме штамма Е. coli K-12 между генами thrL и thrB.
Нуклеотидная последовательность гена thrB, кодирующего гомосеринкиназу из E. coli, известна (KEGG, инвентарный №ЬОООЗ; GenBank, инвентарный №NC_000913.2; номера нуклеотидов с 2,801 по 3,733; Gene ID: 947498). Ген thrB расположен на хромосоме штамма E. coli K-12 между генами thrA и thrC.
Нуклеотидная последовательность гена thrC, кодирующего треонинсинтазу из E. coli, известна (KEGG, инвентарный №b0004; GenBank, инвентарный №NC_000913.2; номера нуклеотидов с 3,734 по 5,020; Gene ID: 945198). Ген thrC расположен на хромосоме штамма E. coli K-12 между генами thrB и yaaX.
Все три указанных гена функционируют как один треониновый оперон thrABC. Для усиления экспрессии треонинового оперона, из оперона может быть удалена область аттенюатора, который влияет на транскрипцию (заявки РСТ W02005/049808 и W02003/097839). Мутантный ген thrA, кодирующий аспартокиназу-гомосериндегидрогеназу I, устойчивую к ингибированию L-треонином по типу обратной связи, а также гены thrB и thrC могут быть получены в виде единого оперона из хорошо известной плазмиды pVIC40, которая представлена в штамме-продуценте E. coli ВКПМ В-3996. Плазмида pVIC40 подробно описана в патенте США №5,705,371.
Нуклеотидная последовательность гена rhtA, кодирующего внутренний мембранный транспортер системы выброса (efflux system) треонина и гомосерина из E. coli, известна (KEGG, инвентарный №Ь0813; GenBank, инвентарный №NC_000913.2; последовательность нуклеотидов, комплементарных нуклеотидам в положении с 848,433 по 849,320; Gene ID: 947045). Ген rhtA расположен на хромосоме штамма E. coli K-12 между генами dps и ompX вблизи оперона glnHPQ, кодирующего компоненты транспортной системы глутамина. Ген rhtA идентичен гену ybiF (KEGG, инвентарный №В0813).
Нуклеотидная последовательность гена asd, кодирующего аспартат-β-семиальдегиддегидрогеназу из E. coli, известна (KEGG, инвентарный №b3433; GenBank, инвентарный №NC_000913.2; последовательность нуклеотидов, комплементарных нуклеотидам в положении с 3,571,798 по 3,572,901; Gene ID: 947939). Ген asd расположен на хромосоме штамма E. coli K-12 между генами glgB и gntU той же цепи (геном yhgN на комплементарной цепи).
Нуклеотидная последовательность гена aspC, кодирующего аспартатаминотрансферазу из E. coli, известна (KEGG, инвентарный №b0928; GenBank, инвентарный №NC_000913.2; последовательность нуклеотидов, комплементарных нуклеотидам в положении с 983,742 по 984,932; Gene ID: 945553). Ген aspC расположен на хромосоме штамма Е. coli K-12 между геном ompF той же цепи и геном ycbL на комплементарной цепи.
Штамм Е. coli B-3996Δ (ordL-narW) также может быть использован в качестве родительского для получения бактерии, продуцирующей L-треонин. Штамм В-3996Δ (ordL-narW) был назван как AG7843 и депонирован в Российской Национальной Коллекции Промышленных Микроорганизмов (ВКПМ) (Россия, 117545 Москва, 1-й Дорожный проезд, 1) 21 Мая 2010 г. с инвентарным номером ВКПМ В-10647. Затем было произведено международное депонирование этого штамма в ВКПМ согласно условиям Будапештского Договора 19 июля 2012 г. под тем же инвентарным номером.
Бактерия-продуцент L-лизина
Примеры бактерий-продуцентов L-лизина включают штаммы, обладающие устойчивостью к аналогам L-лизина, или штаммы, имеющие мутации, изменяющие регуляцию метаболизма. Аналоги L-лизина ингибируют рост бактерий, принадлежащих к роду Escherichia, но это ингибирование полностью или частично снимается, когда в среде также присутствует L-лизин. Примеры аналогов L-лизина включают, не ограничиваясь этим, оксализин, лизингидроксамат, S-(2-аминоэтил)-L-цистеин (АЭЦ), γ-метиллизн, α-хлорокапролактам и другие. Мутанты, обладающие устойчивостью к указанным аналогам лизина, могут быть получены путем обработки бактерий, принадлежащих к семейству Enterobacteriaceae, соответствующими неприродными мутагенами. Конкретные примеры бактериальных штаммов, используемых для получения L-лизина, включают штамм Е. coli AJ 11442 (FERM BP-1543, NRRL В-12185; заявка Японии 56-18596, патент США №4,346,170) и штамм Е. coli VL611 (заявка Японии 2000-189180) и т.д. В качестве бактерии-продуцента L-лизина может быть также использован штамм Е. coli WC196 (заявка РСТ WO 96/17930).
Кроме того, бактерии-продуценты L-лизина для использования в качестве родительских штаммов могут быть также получены за счет усиления активности ферментов, участвующих в биосинтезе L-лизина. Активность этих ферментов может быть усилена путем увеличения количества копий гена, кодирующего соотвествующий фермент в бактериальной клетке, или путем изменения регуляторных последовательностей, контролирующих экспрессию указанных генов. Указанные модификации могут быть получены с использованием методов, описанных ниже для генов gltP и gltS.
Примеры родительских штаммов, которые могут быть использованы для получения бактерий, продуцирующих L-лизин, также включают штаммы, в которых усилена экспрессия одного или нескольких генов, кодирующих ферменты биосинтеза L-лизина. Примеры генов, кодирующих ферменты биосинтеза L-лизина, включают гены, кодирующие ферменты пути биосинтеза диаминопимелата, такие как ген дигидродипиколинатсинтазы (dapA) ген аспартокиназы (lysC), ген дигидродипиколинатредуктазы (dapB), ген диаминопимелатдекарбоксилазы (lysA), ген диаминопимелатдегидрогеназы (ddh) (WO 96/40934 для всех вышеперечисленных генов), ген фосфоенолпируват карбоксилазы (ррс) (выложенный патент Японии 60-87788), ген аспартат аминотрансферазы (aspC) (японская патентная публикация (Kokoku) 6-102028), ген семиальдегид дегидрогеназы (asd) (WO 00/61723), а также гены, кодирующие ферменты пути биосинтеза аминоадипиновой кислоты, такие как ген гомоаконитат гидратазы (заявка Японии 2000-157276). Кроме того, в качестве родительских могут использоваться бактериальные штаммы с повышенным уровнем экспрессии таких генов, как ген, вовлеченный в процесс дыхания (cyo) (Европейская патентная заявка ЕР 1170376А), ген, кодирующий никотинамиднуклеотидтрансгидрогеназу (pntAB) (патент США №5,830,716), ген, кодирующий белок, обладающий способностью выведения L-лизина (ybjE) (заявка РСТ WO 2005/073390), ген, кодирующий глутамат дегидрогеназу (gdhA) (Valle F. et al., Gene, 1983, 23: 199-209), или повышенным уровнем экспрессии любой произвольной комбинации этих генов. Сокращенные названия генов приведены в скобках. Среди вышеперечисленных генов предпочтительно повышение уровня экспрессии гена ybjE.
Известно, что дигидродипиколинатсинтаза и аспартокиназа из Е. coli дикого типа подвергаются ингибированию по принципу обратной связи L-лизином. Поэтому при использовании генов dapA и lysC необходимо также использовать гены, кодирующие мутантные ферменты, нечувствительные к обратному ингибированию L-лизином. Примером ДНК, кодирующей мутантную дигидродипиколинатсинтазу, нечувствительную к обратному ингибированию L-лизином, является ДНК, кодирующая указанный фермент, в котором остаток гистидина в положении 118 замещен на остаток тирозина. Примером ДНК, кодирующей мутантную аспартокиназу, нечувствительную к обратному ингибированию L-лизином, является ДНК, кодирующая белок AKIII, в котором аминокислотный остаток треонина в положении 352, аминокислотный остаток глицина в положении 323 и аминокислотный остаток метионина в положении 318 замещены на остаток изолейцина, остаток аспарагина и остаток изолейцина соответственно (патенты США №5,661,012 и 6,040,160). Такие мутантные ДНК могут быть получены с помощью сайт-специфического мутагенеза, с применением ПЦР или другими методами.
Известно, что плазмиды-хозяева дикого типа RSFD80, рСАВ1 и pCABD2 содержат мутантный ген dapA, кодирующий мутантную дигидродипиколинатсинтазу, и ген lysC, кодирующий мутантную аспартокиназу (патент США №6,040,160). Штамм Е. coli JM109, трансформированный этими плазмидами, был назван Е. coli AJ 12396 (патент США №6,040,160) и депонирован в Национальном Институте Биологических Наук и Человеческих Технологий, Агентство Промышленной Науки и Технологии, Министерство Международной Торговли и Промышленности (National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology, Ministry of International Trade and Industry) (в настоящее время называющийся Национальный Институт Прогрессивной Промышленной Науки и Технологии, Международный Депозитарий Организмов для Целей Патентования, Централ 6, 1-1, Хигаши 1-Чоме, Тсукуба-ши, Ибараки-кен, 305-8566, Япония - National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary, Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, 305-8566, Japan), 28 октября 1993 г. и получил инвентарный номер FERM Р-13936. Затем было произведено международное депонирование этого штамма, согласно условиям Будапештского Договора, 1 ноября 1994 г., и штамм получил инвентарный номер FERM BP-4859. Штамм RSFD80 был получен из штамма AJ 12396 с использованием соответствующих методов.
Продуцирующие L-аминокислоты бактерии могут иметь пониженную, или вообще не иметь, активность фермента, катализирующего реакцию, которая вызывает ответвление от пути биосинтеза L-аминокислот и приводит к получению других продуктов биосинтеза. Также, бактерия может иметь пониженную, или вообще не иметь, активность ферментов, негативно влияющих на синтез или накопление L-аминокислот. Примеры таких ферментов, вовлеченных в продуцирование L-лизина, включают гомосериновую дегидрогеназу, лизиновую декарбоксилазу (cadA, ldcC), малатдегидрогеназу и другие, а также штаммы, в которых активность этих ферментов уменьшена или удалена (WO 95/23864, WO 96/17930, WO 2005/010175), и т.п.
Экспрессия генов cadA и ldcC, кодирующих лизиндекарбоксилазу, может быть уменьшена с целью уменьшения или удаления лизиндекарбоксилазной активности. Экспрессия обоих этих генов может быть уменьшена, например, методами, описанными в WO 2006/078039.
С целью уменьшения или удаления активности ферментов в гены, кодирующие ферменты, могут быть введены мутации известными методами мутагенеза или с помощью технологий генной рекомбинации таким образом, что внутриклеточная активность ферментов уменьшается или удаляется вовсе. Такое введение мутаций может достигаться, например, за счет рекомбинации, приводящей к удалению генов, кодирующих ферменты, или к модификациям регуляторных последовательностей, контролирующих экспрессию соответствующих генов, таких как промоторная последовательность или последовательность Shine-Dalgamo (SD). Также в гены могут быть введены мутации с целью замены соответствующих аминокислот в кодируемом геном ферменте (missense mutation), введения стоп-кодона (nonsense mutation), делеции или вставки одного или более нуклеотидов для сдвига рамки считывания или частичного или полного удаления генов в геноме (Qiu Z. et al., J. Biol. Chem., 1997, 272: 8611-8617).
Ферментативную активность также можно уменьшить или устранить конструированием гена, кодирующего мутантный фермент, в котором кодирующая область полностью или частично удалена, после чего нативный ген на хромосоме замещают на полученный мутантный ген с помощью гомологичной рекомбинации или подобного метода, или за счет введения в ген транспозона или IS-фактора. Например, следующие методы могут применяться для введения мутаций, которые уменьшают или устраняют активность описанных выше ферментов путем генной рекомбинации. Конструируется мутантный ген, кодирующий мутантный белок со сниженной активностью, или вовсе лишенный ее, и модифицируемая бактерия трансформируется фрагментом ДНК, содержащим мутантный ген. Затем нативный ген на хромосоме замещается с помощью гомологичной рекомбинации мутантным геном, и полученный штамм отбирается. Такое замещение гена с использованием гомологичной рекомбинации может быть проведено с использованием линейной ДНК, например, методом, известным как «Red-зависимая интеграция» или «интеграция посредством Red-системы» (Datsenko K.A. и Wanner B.L., Proc. Natl. Acad. Sci. USA, 2000, 97: 6640-6645), или методом, использующим «интеграцию посредством Red-системы» в комбинации с «excisive system», полученной из фага λ (Cho E.H. et al., J. Bacterial., 2002, 184: 5200-5203) (WO 2005/010175), или методом с использованием плазмиды, репликация которой чувствительна к температуре (патент США №6,303,383, выложенный патент Японии 05-007491), и т.п. Кроме того, такой сайт-специфический мутагенез, основанный на замене генов путем гомологичной рекомбинации, как описано выше, может быть проведен с использованием плазмиды, не способной реплицироваться в клетке-хозяине.
Примеры бактерий, продуцирующих L-лизин, включают штамм Е. coli WC196ΔcadAΔldcC/pCABD2 (WO 2006/078039). Штамм конструируется введением плазмиды, pCABD2, содержащей гены биосинтеза лизина (патент США №6,040,160), в штамм WC196, имеющий нарушения в генах cadA и ldcC, которые кодируют лизиндекарбоксилазу. Штамм WC196 был получен из штамма W3110, родительским штаммом которого был штамм Е. coli K-12, путем замещения нативного гена lysC на хромосоме штамма W3110 на мутантный ген lysC, кодирующий мутантную аспартокиназу III, в которой треонин в положении 352 замещен на изолейцин, что привело к снятию обратного ингибирования L-лизином (патент США №5,661,012), и придает АЕС-устойчивость полученному штамму (патент США №5,827,698). Штамм WC196 был назван Е. coli AJ 13069 и депонирован в Национальном Институте Биологических Наук и Человеческих Технологий, Агентство Промышленной Науки и Технологии, Министерство Международной Торговли и Промышленности (National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology, Ministry of International Trade and Industry) (в настоящее время называющийся Национальный Институт Прогрессивной Промышленной Науки и Технологии, Международный Депозитарий Организмов для Целей Патентования, Централ 6, 1-1, Хигаши 1-Чоме, Тсукуба-ши, Ибараки-кен, 305-8566, Япония - National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary, Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, 305-8566, Japan), 6 декабря 1994 г. и получил инвентарный номер FERM Р-14690. Затем было произведено международное депонирование этого штамма, согласно условиям Будапештского Договора, 29 сентября 1995 г., и штамм получил инвентарный номер FERM BP-5252 (патент США №5,827,698).
Плазмида pCABD2 содержит мутантный ген dapA, полученный из Е. coli, который кодирует дигидродипиколинатсинтазу (ДДПС, DDPS), имеющую мутацию, сообщающую дигидродипиколинатсинтазе нечувствительность к обратному ингибированию L-лизином; мутантный ген lysC, полученный из Е. coli, который кодирует аспартокиназу III, имеющую мутацию, сообщающую нечувствительность к обратному ингибированию L-лизином; ген dapB, полученный из Е. coli, который кодирует дигидропиколинатредуктазу, и ген ddh, полученный из Brevibacterium lactofermentum, который кодирует диаминопимелат дегидрогеназу.
Штамм Е. coli WC196ΔcadAΔldcC также является примером продуцирующей L-лизин бактерии. Штамм WC196ΔcadAΔldcC был назван AJ 110692 и депонирован в Национальном Институте Биологических Наук и Человеческих Технологий, Агентство Промышленной Науки и Технологии, Министерство Международной Торговли и Промышленности (National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology, Ministry of International Trade and Industry) (в настоящее время называющийся Национальный Институт Прогрессивной Промышленной Науки и Технологии, Международный Депозитарий Организмов для Целей Патентования, Централ 6, 1-1, Хигаши 1-Чоме, Тсукуба-ши, Ибараки-кен, 305-8566, Япония - National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary, Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, 305-8566, Japan), 7 октября 2008 г. и получил инвентарный номер FERM Р-14690. Затем было произведено международное депонирование этого штамма, согласно условиям Будапештского Договора, 29 сентября 1995 г., и штамм получил инвентарный номер FERM ВР-11027.
Бактерия-продуцент L-цистеина
Примеры родительских штаммов, которые могут быть использованы для получения бактерии-продуцента L-цистеина, включают, но не ограничиваются ими, штаммы, принадлежащие к роду Escherichia, такие как штамм Е. coli JM15, трансформированный различными аллелями гена cysE, кодирующими устойчивые к ингибированию по типу обратной связи серинацетилтрансферазы (патент США №6,218,168, патентная заявка РФ №2003121601); штамм Е. coli W3110, содержащий сверхэкспрессированные гены, кодирующие белок, способный к секреции соединений, токсичных для клетки (патент США №5,972,663); штаммы Е. coli, содержащие цистеиндесульфогидразу со сниженной активностью (патент Японии JP 11155571 A2); штамм Е. coli W3110 с повышенной активностью позитивного транскрипционного регулятора цистеинового регулона, кодируемого геном cysB (международная заявка РСТ WO 0127307 A1); и подобные им.
Бактерия-продуцент L-лейцина
Примеры родительских штаммов, которые могут быть использованы для получения бактерии-продуцента L-лейцина, включают, но не ограничиваются ими, штаммы, принадлежащие к роду Escherichia, такие как штаммы Е. coli, устойчивые к аналогам лейцина, включающие, например, Р-2-тиенилаланин, 3-гидроксилейцин, 4-азалейцин и 5,5,5-трифлуоролейцин (выложенные патентные заявки Японии 62-34397 и 8-70879); штаммы Е. coli, полученные с помощью генно-инженерных методов и описанные в заявке РСТ 96/06926; штамм Е. coli H-9068 (JP 8-70879 A); и подобные им.
Бактерия может быть улучшена путем усиления экспрессии одного или нескольких генов, вовлеченных в биосинтез L-лейцина. Примеры таких генов включают в себя гены оперона leuABCD, которые могут быть представлены мутантным геном leuA, кодирующим изопропилмалатсинтазу со снятым ингибированием L-лейцином по типу обратной связи (патент США №6,403,342). Кроме того, бактерия согласно настоящему изобретению может быть улучшена путем усиления экспрессии одного или нескольких генов, кодирующих белки, которые экспортируют L-аминокислоту из бактериальной клетки. Примеры таких генов включают в себя гены b2682 и Ь2683 (гены ygaZH) (Европейская патентная заявка ЕР 1239041 А2).
Бактерия-продуцент L-гистидина
Примеры родительских штаммов, которые могут быть использованы для получения бактерии-продуцента L-гистидина, включают, но не ограничиваются ими, штаммы, принадлежащие к роду Escherichia, такие как штамм Е. coli 24 (ВКПМ В-5945, патент РФ №2003677), штамм Е. coli 80 (ВКПМ В-7270, патент РФ №2119536), штаммы Е. coli NRRL В-12116 - В12121 (патент США №4,388,405), штаммы Е. coli H-9342 (FERM ВР-6675) и Н-9343 (FERM ВР-6676) (патент США №6,344,347), штамм Е. coli Н-9341 (FERM ВР-6674) (Европейский патент №1085087), штамм Е. coli AI80/pFM201 (патент США №6,258,554), и подобные им.
Примеры родительских штаммов, которые могут быть использованы для получения бактерий, продуцирующих L-гистидин, также включают штаммы, в которых усилена экспрессия одного или нескольких генов, кодирующих ферменты биосинтеза L-гистидина. Примеры таких генов включают гены, кодирующие АТФ-фосфорибозилтрансферазу (hisG), фосфорибозил-АМФ-циклогидролазу (hisI), фосфорибозил-АТФ-фосфогидролазу (hisIE), фосфорибозилформимино-5-аминоимидазолкарбоксамидриботидизомеразу (hisA), амидотрансферазу (hisH), гистидинолфосфатаминотрансферазу (hisC), гистидинолфосфатазу (hisB), гистидинолдегидрогеназу (hisD) и т.д.
Известно, что гены, кодирующие ферменты биосинтеза L-гистидина (hisG, hisBHAFI), ингибируются L-гистидином, поэтому способность к продукции L-гистидина также может быть значительно усилена введением мутации, придающей устойчивость к ингибированию по типу обратной связи, в ген АТФ-фосфорибозилтрансферазы (hisG) (патенты РФ №2003677 и 2119536).
Специфические примеры штаммов, обладающих способностью к продукции L-гистидина, включают штаммы Е. coli FERM-P 5038 и 5048, в которые был введен вектор, содержащий ДНК, кодирующую фермент биосинтеза L-гистидина (заявка Японии 56-005099 А), штаммы Е. coli, в которые введен ген rht, для экспорта аминокислоты (Европейская патентная заявка ЕР 1016710А), штамм Е. coli 80, которому придана устойчивость к сульфагуанидину, DL-1,2,4-триазол-3-аланину и стрептомицину (ВКПМ В-7270, патент РФ №2119536), и т.д.
Бактерия-продуцент L-глутаминовой кислоты
Примеры родительских штаммов, которые могут быть использованы для получения бактерии-продуцента L-глутаминовой кислоты, включают, но не ограничиваются ими, штаммы, принадлежащие к роду Escherichia, такие как штамм Е. coli VL334 thrC4 (Европейский патент ЕР 1172433). Штамм Е. coli VL334 (ВКПМ В-1641) является ауксотрофом по L-изолейцину и L-треонину с мутациями в генах thrC и ilvA (патент США №4,278,765). В этот штамм был перенесен природный аллель гена thrC методом общей трансдукции с использованием бактериофага Р1, выращенного на клетках природного штамма Е. coli K 12 (ВКПМ В-7). В результате был получен штамм, ауксотроф по L-изолейцину, VL334thrC+ (ВКПМ В-8961), который обладает способностью к продукции L-глутаминовой кислоты.
Примеры родительских штаммов, которые могут быть использованы для получения бактерии-продуцента L-глутаминовой кислоты, включают в себя, но не ограничиваются ими, штаммы, дефектные по активности α-кетоглутаратдегидрогеназы, или штаммы, в которых усилена экспрессия одного или нескольких генов, кодирующих ферменты биосинтеза L-глутаминовой кислоты. Примеры таких ферментов включают глутаматдегидрогеназу (gdh), глутаминсинтетазу (glnA), глутаматсинтетазу (gItAB), изоцитратдегидрогеназу (icdA), аконитатгидратазу (acnA, acnB), цитратсинтазу (gltA), фосфоенолпируваткарбоксилазу (ррс) пируватдегидрогеназу (aceEF, IpdA), пируваткиназу (pykA, pykF), фосфоенолпируватсинтазу (ppsA), енолазу (eno), фосфоглицеромутазу (pgmA, pgmI), фосфоглицераткиназу (pgk), глицеральдегид-3-фосфатдегидрогеназу (gapA), триозофосфатизомеразу (tpiA), фруктозобифосфатальдолазу (fbp), фосфофруктокиназу (pfkA, pfkB) и глюкозофосфатизомеразу (pgi).
Примеры штаммов, модифицированных таким образом, что усилена экспрессия гена цитратсинтетазы, гена фосфоенолпируваткарбоксилазы и/или гена глутаматдегидрогеназы, описанны в европейских заявках ЕР 1078989А, ЕР 955368А и ЕР 952221 А.
Примеры штаммов, модифицированных таким образом, что снижена экспрессия генов цитратсинтетазы и/или фосфоенолпируваткарбоксилазы, и/или дефицитные по активности α-кетоглутаратдегидрогеназы, включают описанные в европейских заявках ЕР 1078989 А, ЕР 955368А и ЕР 952221 А.
Примеры родительских штаммов, которые могут быть использованы для получения продуцирующих L-глутаминовую кислоту бактерий, также включают штаммы, в которых снижена или отсутствует активность ферментов, которые катализируют синтез отличных от L-глутаминовой кислоты соединений, ответвляющихся от основного пути биосинтеза L-глутаминовой кислоты. Примеры таких ферментов включают изоцитратлиазу, α-кетоглутаратдегидрогеназу, фосфотрансацетилазу, ацетаткиназу, синтазу ацетогидроксикислот, ацетолактатсинтазу, форматацетилтрансферазу, лактатдегидрогеназу и глутаматдекарбоксилазу. Бактерии, принадлежащие к роду Escherichia, лишенные активности α-кетоглутаратдегидрогеназы или обладающие сниженной активностью α-кетоглутаратдегидрогеназы и способы их получения описаны в патентах США №5,378,616 и 5,573,945. Конкретно, примеры таких штаммов могут включать в себя следующие штаммы:
E. coli W 3110sucA::KmR
Е. coli AJ 12624 (PERM BP-3853)
Е. coli AJ 12628 (FERM ВР-3854)
Е. coli AJ 12949 (FERM BP-4881)
Е. coli W3110sucA::KmR - это штамм, полученный в результате разрушения гена α-кетоглутаратдегидрогеназы (sucA) в штамме Е. coli W3110. У этого штамма активность α-кетоглутаратдегидрогеназы отсутствует полностью.
Другие примеры бактерии-продуцента L-глутаминовой кислоты включают в себя бактерии, принадлежащие к роду Escherichia и обладающие устойчивостью к антиметаболитам аспарагиновой кислоты и дефицитные по активности α-кетоглутаратдегидрогеназы, например, штамм AJ 13199 (FERM BP-5807) (патент США №5,908,768) или штамм FERM P-12379, дополнительно обладающий низкой активностью по расщеплению L-глутаминовой кислоты (патент США №5,393,671), штамм Е. coli AJ 13138 (FERM ВР-5565) (патент США №6,110,714) и подобные им.
Примеры бактерии-продуцента L-глутаминовой кислоты включают в себя мутантные штаммы, принадлежащие к роду Pantoea, которые лишены активности α-кетоглутаратдегидрогеназы или имеют сниженную активность α-кетоглутаратдегидрогеназы, и могут быть получены описанным выше способом. Примерами таких штаммов являются штамм Pantoea ananatis AJ 13356 (патент США №6,331,419), штамм Pantoea ananatis AJ 13356, депонированный в Национальном Институте Биологических Наук и Человеческих Технологий, Агентство Промышленной Науки и Технологии, Министерство Международной Торговли и Промышленности (National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology, Ministry of International Trade and Industry) (в настоящее время называющийся Национальный Институт Прогрессивной Промышленной Науки и Технологии, Международный Депозитарий Организмов для Целей Патентования, Централ 6, 1-1, Хигаши 1-Чоме, Тсукуба-ши, Ибараки-кен, 305-8566, Япония - National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary, Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, 305-8566, Japan) 19 февраля 1998 г.и получивший инвентарный номер FERM P-16645. Затем было произведено международное депонирование этого штамма, согласно условиям Будапештского Договора, от 11 января 1999 г., и штамм получил инвентарный номер FERM BP-6615. Штамм Pantoea ananatis AJ 13356 не имеет α-кетоглутаратдегидрогеназной активности в результате разрушения α-KGDH-E1 субъединицы (sucA). Вышеупомянутый штамм при выделении был идентифицирован как Enterobacter agglomerans и депонирован как штамм Enterobacter agglomerans AJ 13356. Тем не менее, позднее он был классифицирован как Pantoea ananatis на основе нуклеотидной последовательности 16S рРНК и других доказательств. Несмотря на то, что штамм AJ 13356 был депонирован в указанный выше депозитарий как Enterobacter agglomerans, для целей данного описания он будет упоминаться как Pantoea ananatis.
Бактерия-продуцент L-фенилаланина
Примеры родительских штаммов, которые могут быть использованы для получения бактерии-продуцента L-фенилаланина, включают, но не ограничиваются ими, штаммы, принадлежащие к роду Escherichia, такие как штамм AJ 12739 (tyrA::Tn10, tyrR) (ВКМП В-8197), штамм HW1089 (АТСС-55371), содержащий ген pheA34 (патент США №5354672), мутантный штамм MWEC101-b (KR8903681), штаммы NRRL В-12141, NRRL В-12145, NRRL В-12146 и NRRL B-12147 (патент США №4407952) и пободные им. В качестве родительских штаммов также могут быть использованы бактерии, принадлежащие к роду Escherichia, - продуценты L-фенилаланина, такие как штамм Е. coli K-12[W3110(tyrA)/pPHAB] (FERM ВР-3566), штамм Е. coli K-12[W3110(tyrA)/pPHAD] (FERM ВР-12659), штамм Е. coli K-12[W3110(tyrA)/pPHATerm] (FERM ВР-12662) и штамм Е. coli K-12[W3110(tyrA)/pBR-aroG4, pACMAB], названный как AJ 12604 (FERM BP-3579) (Европейский патент ЕР 488424 В1). Кроме того, также могут быть использованы бактерии-продуценты L-фенилаланина, принадлежащие к роду Escherichia с повышенной активностью белков, кодируемых геном yedA или геном yddG (патентные заявки США №2003/0148473 А1 и 2003/0157667 А1).
Бактерия-продуцент L-триптофана
Примеры родительских штаммов, которые могут быть использованы для получения бактерии-продуцента L-триптофана, включают, но не ограничиваются ими, штаммы, принадлежащие к роду Escherichia, такие как штаммы Е. coli JP4735/pMU3028 (DSM10122) и JP6015/pMU91 (DSM10123), лишенные активности триптофанил-тРНК-синтетазы, кодируемой мутантным геном trpS (патент США №5756345); штамм Е. coli SV164 (pGH5), содержащий аллель serA, кодирующий фосфоглицератдегидрогеназу, не ингибируемую серином по типу обратной связи, и аллель trpE, кодирующий антранилатсинтазу, не ингибируемую триптофаном по типу обратной связи (патент США №6180373); штаммы Е. coli AGX17 (pGX44) (NRRL В-12263) и AGX6(pGX50)aroP (NRRL В-12264), в которых отсутствует активность триптофаназы (патент США №4371614); штамм Е. coli AGX17/pGX50,pACKG4-pps, в котором усилена способность к синтезу фосфоенолпирувата (заявка РСТ W09708333, патент США №6319696); и подобные им. Также могут быть использованы бактерии-продуценты L-триптофана, принадлежащие к роду Escherichia, в которых увеличена активность белка, кодируемого геном yedA или геном yddG (заявки на патент США №2003/0148473 А1 и 2003/0157667 А1).
Примеры родительских штаммов, которые могут быть использованы для получения бактерии-продуцента L-триптофана, согласно настоящему изобретению, также включают в себя штаммы, в которых увеличена активность одного или нескольких ферментов, выбранных из группы, состоящей из антранилатсинтазы, фосфоглицератдегидрогеназы и триптофансинтазы. И антранилатсинтаза, и фосфоглицератдегидрогеназа подвержены ингибированию L-триптофаном и L-серином по типу обратной связи, так что в эти ферменты могут быть введены мутации, снижающие чувствительность к ингибированию по типу обратной связи. Специфические примеры штаммов с такой мутацией включают Е. coli SV164, антранилатсинтаза которой не чувствительна к ингибированию по типу обратной связи, и штамм-трансформант, полученный введением в Е. coli SV164 плазмиды pGH5 (заявка РСТ WO 94/08031), которая содержит мутантный ген serA, кодирующий фосфоглицератдегидрогеназу, не чувствительную к ингибированию по типу обратной связи.
Примеры родительских штаммов, которые могут быть использованы для получения бактерии-продуцента L-триптофана, также включают в себя штаммы, в которые введен триптофановый оперон, содержащий ген, кодирующий антранилатсинтазу, нечувствительную к ингибированию по типу обратной связи (заявки Японии 57-71397 А и 62-244382 А, патент США №4,371,614). Кроме того, способность к продукции L-триптофана может быть придана путем усиления экспрессии гена из триптофанового оперона, кодирующего триптофансинтазу (trpBA). Триптофансинтаза состоит из двух субъединиц α и β, которые кодируются генами trpA и trpB соответственно. Кроме того, способность к продукции L-триптофана может быть увеличена усилением экспрессии оперона изоцитратлиазы-малатсинтазы (заявка РСТ WO 2005/103275).
Бактерия-продуцент L-пролина
Примеры родительских штаммов, которые могут быть использованы для получения бактерий-продуцентов L-пролина, включают в себя, но не ограничиваются ими, штаммы, принадлежащие к роду Escherichia, такие как штамм Е. coli 702ilvA (ВКПМ В-8012), дефицитного по гену ilvA и способного к продукции L-пролина (Европейский патент ЕР 1172433). Бактерия может быть улучшена путем усиления экспрессии одного или нескольких генов, вовлеченных в биосинтез L-пролина. Предпочтительно, примеры таких генов для бактерий-продуцентов L-пролина включают ген proB, кодирующий глутаматкиназу с десенсибилизированной регуляцией L-пролином по типу обратной связи (патент Германии №3127361). Кроме того, бактерия согласно настоящему изобретению может быть улучшена путем усиления экспрессии одного или нескольких генов, кодирующих белки, участвующие в выведении L-аминокислоты из бактериальной клетки. Примерами таких генов являются гены b2682 и b2683 (ygaZH гены) (Европейская патентная заявка ЕР 1239041 А2).
Примеры бактерий, принадлежащих к роду Escherichia и обладающих способностью к продукции L-пролина, включают следующие штаммы Е. coli: NRRL В-12403 и NRRL В-12404 (патент Великобритании GB 2075056), ВКПМ В-8012 (патентная заявка РФ №2000124295), плазмидные мутанты, описанные в патенте Германии DE3127361, плазмидные мутанты, описанные у Bloom F.R. et al (The 15th Miami winter symposium, 1983, p.34), и подобные им.
Бактерия-продуцент L-аргинина
Примеры родительских штаммов, которые могут быть использованы для получения бактерии-продуцента L-аргинина, включают в себя, но не ограничиваются ими, штаммы, принадлежащие к роду Escherichia, такие как штамм Е. coli 237 (ВКПМ В-7925) (патентная заявка США №2002/05 8315А1) и его производные, содержащие мутантную N-ацетилглутаматсинтазу (патентная заявка РФ №2001112869), штамм Е, coli 382 (ВКПМ В-7926) (Европейская патентная заявка ЕР1170358А1), штамм-продуцент L-аргинина, в который введен ген argA, кодирующий N-ацетилглутаматсинтетазу (Европейская патентная заявка ЕР 1170361 А1), и подобные им.
Примеры родительских штаммов, которые могут быть использованы для получения бактерии-продуцента L-аргинина, согласно настоящему изобретению, также включают в себя штаммы, в которых усилена экспрессия одного или нескольких генов, кодирующих ферменты биосинтеза L-аргинина. Примеры ферментов биосинтеза L-аргинина включают N-ацетилглутамилфосфатредуктазу (argC), орнитинацетилтрансферазу (argJ), N-ацетилглутаматкиназу (argB), ацетилорнитинтрансаминазу (argD), орнитинкарбамоилтрансферазу (argF), синтетазу аргининсукциниловой кислоты (argG), лиазу аргининсукциниловой кислоты (argH} и карбамоилфосфатсинтетазу (carAB).
Бактерия-продуцент L-валина
Примеры родительских штаммов, которые могут быть использованы для получения бактерии-продуцента L-валина в соответствии с данным изобретением, включают в себя, но не ограничиваются ими, штаммы, имеющие модификации, приводящий к сверхэкспрессии генов оперона ilvGMEDA (патент США №5,998,178). Желательно удалить фрагмент оперона ilvGMEDA, отвечающий за ослабление экспрессии, с тем, чтобы экспрессия оперона не ослаблялась образующимся L-валином. Далее, в опероне может быть разрушен ген ilvA для того, чтобы снизить активность треониндеаминазы.
Примеры родительских штаммов, которые могут быть использованы для получения бактерии-продуцента L-валина, также включают мутантные штаммы, имеющие мутацию в аминоацил-тРНК-синтетазе (патент США №5,658,766). Например, может использоваться штамм E. coli VL1970, который имеет мутацию в гене ileS, кодирующем изолейцин-тРНК-синтетазу. Штамм E. coli VL1970 депонирован в Российской Национальной Коллекции Промышленных Микроорганизмов (ВКПМ) (Россия, 117545 Москва, 1-й Дорожный проезд, 1) 24 июня 1988 г. с инвентарным номером ВКПМ В-4411. Далее, в качестве родительских штаммов также могут использоваться мутантные штаммы, для роста которых требуется липоевая кислота, и/или с недостаточным количеством H+-АТФазы (WO 96/06926).
Бактерия-продуцент L-изолейцина
Примеры родительских штаммов, которые могут быть использованы для получения бактерии-продуцента L-изолейцина, включают, но не ограничиваются ими, мутантные штаммы с устойчивостью к 6-диметиламинопурину (заявка Японии 5-304969А), мутантные штаммы с устойчивостью к аналогу изолейцина, такому как тиаизолейцин и гидроксамат изолейцина, и мутантные штаммы, дополнительно имеющие устойчивость к DL-этионину и/или гидроксамату аргинина (заявка Японии 5-130882А). Кроме того, в качестве родительских штаммов также могут использоваться рекомбинантные штаммы, трансформированные генами, кодирующими белки, вовлеченные в биосинтез L-изолейцина, такие как треониндеаминаза и ацетогидроксатсинтаза (заявка Японии 2-458А, патент ЕР0356739 и патент США №5,998,178).
2. Способ согласно настоящему изобретению
Способом согласно настоящему изобретению является способ получения L-треонина, включающий стадии выращивания бактерии в питательной среде с целью продукции и накопления L-треонина в питательной среде, и выделения L-треонина из культуральной жидкости.
Выращивание, выделение и очистка L-треонина из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам ферментации, в которых аминокислота продуцируется с использованием бактерии.
Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста микроорганизмов. В качестве источника углерода могут использоваться различные углеводы, такие как глюкоза или сахароза и другие органические кислоты. В зависимости от типа ассимиляции используемого микроорганизма может также использоваться спирт, включая этанол и глицерин. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов, ферментолизат микроорганизмов. В качестве минеральных добавок могут использоваться фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. В качестве витаминов могут использоваться тиамин, дрожжевой экстракт и т.п.
Выращивание может осуществляться в аэробных условиях, таких как перемешивание культуральной жидкости на качалке, взбалтывание с аэрацией, при температуре в пределах от 20 до 40°С или в пределах от 30 до 38°С. Кислотность среды (рН) поддерживают в пределах от 5 до 9, или в пределах от 6,5 до 7,2. рН среды может регулироваться аммиаком, карбонатом кальция, различными кислотами, основаниями и буферными растворами. Обычно, выращивание в течение от 1 до 5 дней приводит к накоплению целевой аминокислоты в культуральной среде.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем L-аминокислота может быть выделена и очищена методами концентрирования, кристаллизации и/или хроматографии.
Полученная после ферментации смесь может содержать в дополнение к целевой L-аминокислоте бактериальные клетки, компоненты среды, воду и побочные метаболиты. Чистота полученной L-аминокислоты может быть, например, 50% и более, 85% и более, 95% и более (патент США №5,431,933, опубликованный патент Японии №1-214636, патенты США №4,956,471, 4,777,051, 4,946,654, 5,840,358, 6,238,714, опубликованная заявка США №2005/0025878).
Более того, если L-аминокислота осаждается в среде, она может быть выделена методом центрифугирования, фильтрации и т.п. Осажденная L-аминокислота может быть выделена вместе с растворенной L-аминокислотой после кристаллизации растворенной L-аминокислоты.
Примеры осуществления изобретения
Пример 1: Конструирование штамма
Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC.
Штамм Е. coli MG1655::Δtdh, rhtA*, Ptac7flhDC получали путем замещения нативной промоторной области оперона flhDC в штамме Е. coli MG1655::Δtdh, rhtA* на промотор Ptac7 (Фиг.1), который, в свою очередь, получали из промотора Ptac путем удаления С-нуклеотида в позиции 23 выше ATG-кодона. Делеция была сделана в области связывания LacI-репрессора с целью исключить LacI-зависимую репрессию.
Для замещения нативной промоторной области оперона flhDC ДНК-фрагмент, содержащий промотор Ptac7 и маркер устойчивости к канамицину (KmR-маркер), кодируемый геном kan, интегрировали вместо нативной промоторной области оперона flhDC на хромосоме штамма Е. coli MG1655::Δtdh, rhtA* с помощью метода, описанного в Datsenko K.A. и Wanner B.L., Proc. Natl. Acad. Sci. USA, 2000, 97:6640-6645, и известного как «Red-зависимая интеграция» или «интеграция посредством Red-системы». Штамм MG1655::Δtdh, rhtA* конструировали так же, как подробно описано в патенте РФ №2364628С2 и международной заявке WO 2009022754 A1. В качестве донора генов фага X, ответственных за Red-зависимую интеграцию, использовали рекомбинантную плазмиду pKD46 (Datsenko K.A. и Wanner B.L., Proc. Natl. Acad. Sci. USA, 2000, 97:6640-6645), репликация которой чувствительна к температуре. Штамм Е. coli BW25113, содержащий рекомбинантную плазмиду pKD46, можно получить в Е. coli Genetic Stock Center, Yale University, New Haven, USA, инвентарный номер CGSC7630. После интеграции плазмиды pKD46 в штамм Е. coli MG1655::Δtdh,rhtA* получили штамм Е. coli MG1655::Δtdh, rhtA*/pKD46.
ДНК-фрагмент, содержащий промотор Ptac7, получали методом полимеразной цепной реакции (ПЦР) с использованием коммерческой плазмиды pKK223-3 («Pharmacia», Литва) в качестве матрицы и праймеров P1 (SEQ ID NO:9) и Р2 (SEQ ID NO:10). Праймер Р1 содержит область длиной 21 нуклеотид, комплементарную 5'-концу гена kan и необходимую для последующего соединения с промотором Ptac7. Праймер Р2 содержит область длиной 40 нуклеотидов, комплементарную 5'-концу гена flhD и необходимую для последующей интеграции в бактериальную хромосому. Также, праймер Р2 содержит делецию С-нуклеотида в позиции 23 выше ATG-кодона в области связывания Lacl-репрессора.
ДНК-фрагмент, содержащий KmR-маркер, кодируемый геном kan, получали методом ПЦР с использованием коммерческой плазмиды pACYC177 (GenBank, инвентарный №Х06402, «Fermentas», Литва) в качестве матрицы и праймеров Р3 (SEQ ID NO:11) и Р4 (SEQ ID NO:12). Праймер Р3 содержит область длиной 41 нуклеотид, комплементарную области, расположенной на 188 нуклеотидов выше стартового кодона renaflhD, и необходимую для последующей интеграции в бактериальную хромосому. Праймер Р4 содержит область длиной 21 нуклеотид, комплементарную 5'-концу промотора Ptac7 и необходимую для последующего соединения с геном kan.
ПЦР проводили с использованием амплификатора «Gene Amp PCR System 2700» (Applied Biosystems). Реакционная смесь для ПЦР общим объемом 50 мкл содержала 5 мкл 10-кратного ПЦР-буфера с 25 мМ MgCl2 («Fermentas», Литва), по 200 мкМ каждого dNTP, по 25 пмоль каждого используемого праймера и 1 ед. акт. Taq-полимеразы («Fermentas», Литва). В качестве матрицы для ПЦР в реакционную смесь добавляли приблизительно 5 нг плазмидной ДНК. Температурные условия были следующие: начальная денатурация ДНК в течение 5 мин при 95°С; затем 25 циклов: денатурация при 95°С в течение 30 сек, отжиг при 54°С в течение 30 сек и элонгация при 72°С в течение 20 сек для промотора Ptac7 или 50 сек для гена kan; конечная элонгация в течение 5 мин при 72°С. Затем амплифицированные ДНК-фрагменты очищали методом электрофореза в агарозном геле, выделяли с использованием «GenElute Spin Columns» («Sigma», США) и осаждали этанолом.
ДНК-фрагмент kan-Ptac7 получали методом ПЦР, позволяющим получать ДНК-фрагменты с перекрывающимися участками (overlapping PCR). Для этого использовали два полученных ранее ДНК-фрагмента и праймеры P1 (SEQ ID NO:9) и Р4 (SEQ ID NO:12). Полученный ДНК-фрагмент kan-Ptac7 очищали методом электрофореза в агарозном геле, выделяли с использованием «GenElute Spin Columns» («Sigma», США) и осаждали этанолом. Полученный ДНК-фрагмент использовали для электропорации и Red-зависимой интеграции в бактериальную хромосому штамма Е. coli MG1655::Δtdh,rhtA*/pKD46.
Электрокомпетентные клетки готовили следующим образом: штамм Е. coli MG1655::Δtdh,rhtA*/pKD46 выращивали в течение ночи при 30°С в жидкой среде LB, содержащей ампициллин (100 мкг/мл), затем клетки разбавляли в соотношении 1:100 средой SOB (дрожжевой экстракт, 5 г/л; NaCl, 0.5 г/л; триптон, 20 г/л; KCl, 2.5 мМ; MgCl2, 10 мМ, рН 7.0) с добавлением ампициллина (100 мкг/мл) и L-арабинозы (10 мМ) (Datsenko K.A. и Wanner B.L., Proc. Natl. Acad. Sci. USA, 2000, 97:6640-6645) и выращивали с аэрацией при 30°С до оптической плотности бактериальной культуры OD600 0.4-0.7. Полученные клетки в объеме питательной среды 10 мл промывали три раза ледяной деионизированной водой и суспендировали в 100 мкл воды. 100 нг ДНК-фрагмента растворяли в 10 мкл деионизированной воды и добавляли к клеточной суспензии. Электропорацию проводили с помощью электропоратора «Bio-Rad» (США) (№165-2098, версия 2-89), придерживаясь инструкции производителя.
С целью отбора KmR-рекомбинантов, клетки после электропорации инкубировали в 1 мл среды SOC (Sambrook et al., «Molecular Cloning: A Laboratory Manual, 2nd ed.». Cold Spring Harbor Laboratory Press, 1989) в течение 2 часов при 37°С при встряхивании, затем пересевали на чашки с L-агаром, содержащим триптон (5 г/л), дрожжевой экстракт (10 г/л), NaCl (5 г/л), агар (20 г/л) и канамицин (50 мкг/мл).
Колонии, выросшие в течение 24 ч, проверяли на наличие KmR-маркера, интегрированного вместо нативной промоторной области оперона flhDC, с помощью ПЦР, используя праймеры Р5 (SEQ ID NO:13) и Р6 (SEQ ID NO:14). С этой целью свежевыделенные колонии суспендировали в 20 мкл воды и отбирали для ПЦР-анализа 1 мкл суспензии. Температурные условия были следующие: начальная денатурация ДНК в течение 10 мин при 95°С; затем 30 циклов: денатурация при 95°С в течение 30 сек, отжиг при 55°С в течение 30 сек и элонгация при 72°С в течение 1,5 мин; конечная элонгация в течение 5 мин при 72°С. Несколько проанализированных KmR-колоний содержали фрагмент длиной 1460 п.н., что подтвердило замену нативной промоторной области оперона flhDC (840 п.н.) на ДНК-фрагмент, содержащий KmR-маркер (kan-Ptac7) (Фиг.1). Один из полученных штаммов излечили от термочувствительной плазмиды pKD46 путем культивирования при 37°С, полученный штамм назвали Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC.
Пример 2:
Продукция L-треонина штаммом Е. coli MG1655::Δtdh,rhtA*, Ptac7flhDC.
Штаммы Е. coli MG1655::Δtdh, rhtA* и MG1655::Δtdh,rhtA*,Ptac7flhDC трансформировали плазмидой pVIC40 (WO 9004636 A1 и патент США №5,705,371). Затем полученные штаммы выращивали при 37°С в течение 18 ч в питательной среде, после чего 0,1 мл каждой культуры переносили в 2 мл питательной среды в пробирках 20×200 мм и выращивали при 37°С в течение 24 и 48 ч на роторной качалке (240 оборотов/мин).
Состав питательной среды (г/л):
Глюкозу и сульфат магния стерилизовали раздельно. СаСО3 стерилизовали сухим жаром при 180°С в течение 2 ч. Кислотность устанавливали до значения рН 7.0. Антибиотик добавляли в среду после стерилизации.
После выращивания количество накопленного в среде L-треонина определяли с помощью бумажной хроматографии, при этом использовали следующий состав подвижной фазы: бутанол:уксусная кислота:вода=4:1:1 (v/v). Раствор нингидрина (2%) в ацетоне использовали для визуализации. Пятно, содержащее L-треонин, вырезали; L-треонин элюировали 0.5% водным раствором CdCl2, после чего количество L-треонина определяли спектрофотометрическим методом при длине волны 540 нм.
Средние результаты двадцати независимых пробирочных ферментации представлены в Таблице 1. Как следует из Таблицы 1, модифицированный штамм Е. coli MG1655::Δtdh,rhtA*, Ptac7flhDC(pVIC40) накапливал большее количество L-треонина, чем исходный штамм Е. coli MG1655::Δtdh,rhtA*(pVIC40).
Пример 3: Конструирование штамма
Е. coli MG1655::Δtdh,rhtA*, ΔintB::yhjH,cat.
Штамм Е. coli MG1655::Δtdh, rhtA*, AintB::yhjH, cat получали путем замещения нативного гена intB штамма Е. coli MG1655::Δtdh, rhtA* на дополнительную копию гена yhjH под контролем собственного промотора PyhjH (Фиг.2).
ДНК-фрагмент, содержащий ген yhjH под контролем собственного промотора, интегрировали вместо нативного гена intB на хромосоме штамма Е. coli MG1655::Δtdh,rhtA* с помощью метода, описанного в Datsenko K.A. и Wanner B.L., Proc. Natl. Acad. Sci. USA, 2000, 97:6640-6645 и известного как «Red-зависимая интеграция» или «интеграция посредством Red-системы». В качестве донора генов фага X, ответственных за Red-зависимую интеграцию, использовали рекомбинантную плазмиду pKD46 (Datsenko K.A. и Wanner B.L., Proc. Natl. Acad. Sci. USA, 2000, 97:6640-6645), репликация которой чувствительна к температуре. Штамм Е. coli BW25113, содержащий рекомбинантную плазмиду pKD46, можно получить в Е. coli Genetic Stock Center, Yale University, New Haven, USA, инвентарный №CGSC7630.
Ген yhjH получали методом ПЦР с использованием хромосомной ДНК штамма Е. coli MG1655 в качестве матрицы и праймеров Р7 (SEQ ID NO:15) и Р8 (SEQ ID NO:16). Праймер Р7 содержит область длиной 21 нуклеотид, комплементарную 5'-концу гена cat, и необходимую для последующего соединения с геном yhjH. Праймер Р8 содержит область длиной 40 нуклеотидов, комплементарную области, расположенной ниже ТАА-кодона гена intB, и необходимую для последующей интеграции в бактериальную хромосому.
ДНК-фрагмент, содержащий маркер устойчивости к хлорамфениколу (CmR-маркер), кодируемый геном cat, получали методом ПЦР с использованием коммерческой плазмиды pACYC177 (GenBank, инвентарный №Х06402, «Fermentas», Литва) в качестве матрицы и праймеров Р9 (SEQ ID NO:17) и PI 0 (SEQ ID NO:18). Праймер Р9 содержит область длиной 41 нуклеотид, гомологичную области, расположенной выше ATG-кодона гена intB, и необходимую для последующей интеграции в бактериальную хромосому. Праймер Р10 содержит область длиной 21 нуклеотид, комплементарную 5'-концу промотора PyhjH, и необходимую для последующего соединения с геном yhjH.
ПЦР проводили с использованием амплификатора «Gene Amp PCR System 2700» (Applied Biosystems). Реакционная смесь для ПЦР общим объемом 50 мкл содержала 5 мкл 10-кратного ПЦР-буфера с 25 мМ MgCl2 («Fermentas», Литва), по 200 мкМ каждого dNTP, по 25 пмоль каждого используемого праймера и 1 ед. акт. Taq-полимеразы («Fermentas», Литва). В качестве матрицы для ПЦР в реакционную смесь добавляли приблизительно 5 нг плазмидной ДНК. Температурные условия были следующие: начальная денатурация ДНК в течение 5 мин при 95°С; затем 25 циклов: денатурация при 95°С в течение 30 сек, отжиг при 54°С в течение 30 сек и элонгация при 72°С в течение 45 сек для гена yhjH или 50 сек для гена cat; конечная элонгация в течение 5 мин при 72°С. Амплифицированные ДНК-фрагменты очищали методом электрофореза в агарозном геле, выделяли с использованием «GenElute Spin Columns» («Sigma», США) и осаждали этанолом.
ДНК-фрагмент cat-PyhjH-yhjH получали методом ПЦР, позволяющим получать ДНК-фрагменты с перекрывающимися участками (overlapping PCR). Для этого использовали два полученных ранее ДНК-фрагмента и праймеры Р8 (SEQ ID NO:16) и Р9 (SEQ ID NO:17). Полученный ДНК-фрагмент cat-PyhjH-yhjH очищали методом электрофореза в агарозном геле, выделяли с использованием «GenElute Spin Columns» («Sigma», США) и осаждали этанолом. Полученный ДНК-фрагмент использовали для электропорации и Red-зависимой интеграции в бактериальную хромосому штамма Е. coli MG1655::Δtdh, rhtA*/pKD46 (см. Пример 1).
Электрокомпетентные клетки штамма MG1655::Δtdh, rhtA*/pKD46 выращивали, разбавляли, выращивали далее и электропорацию проводили так, как описано в Примере 1.
С целью отбора CmR-рекомбинантов, клетки после электропорации инкубировали в 1 мл среды SOC (Sambrook et al., «Molecular Cloning: A Laboratory Manual, 2nd ed.», Cold Spring Harbor Laboratory Press, 1989) в течение 2 часов при 37°С при встряхивании, затем пересевали на чашки с L-агаром, содержащим хлорамфеникол (20 мкг/мл).
Колонии, выросшие в течение 24 ч, проверяли на наличие фрагмента cat-PyhjH-yhjH, интегрированного вместо нативного гена intB, с помощью ПЦР, используя праймеры P11 (SEQ ID NO:19) и P12 (SEQ ID NO:20). С этой целью свежевыделенные колонии суспендировали в 20 мкл воды и отбирали для ПЦР-анализа 1 мкл суспензии. Температурные условия были следующие: начальная денатурация ДНК в течение 10 мин при 95°С; затем 30 циклов: денатурация при 95°С в течение 30 сек, отжиг при 55°С в течение 30 сек и элонгация при 72°С в течение 2 мин; конечная элонгация в течение 5 мин при 72°С. Несколько проанализированных CmR-колоний содержали фрагмент длиной 2215 п.н., что подтверждает замену нативного гена intB (1620 п.н.) на фрагмент cat-PyhjH-yhjH, содержащий CmR-маркер (Фиг.2). Один из полученных штаммов излечивали от термочувствительной плазмиды pKD46 путем культивирования при 37°С, полученный штамм был назван Е. coli MG1655::Δtdh,rhtA*,ΔintB::yhjH,cat.
Пример 4: Конструирование штамма Е. coli MG1655::Δtdh,rhtA*,Ptac7nhDC,ΔintB::yhjH,cat.
Штамм Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC,ΔintB::yhjH,cat получали методом общей трансдукции ДНК-фрагмента, содержащего мутацию ΔintB::yhjH, из штамма MG1655::Δtdh,rhtA*,ΔintB::yhjH,cat в штамм MG1655::Δtdh,rhtA*,Ptac7ilhDC (Miller J.H. (1972) Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, Plainview, NY). Для этого штамм MG1655::Δtdh,rhtA*,Ptac7flhDC инфицировали бактериальным фагом P1vir, выращенным на донорном штамме MG1655::Δtdh,rhtA*,ΔintB::yhjH,cat. Так был получен штамм MG1655::Δtdh,rhtA*,Ptac7flhDC,ΔintB::yhjH,cat.
Пример 5: Продукция L-треонина штаммом
Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC,ΔintB::yhjH,cat.
Штаммы Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC и MG1655::Δtdh,rhtA*,Ptac7flhDC,ΔintB::yhjH,cat трансформировали плазмидой pVIC40 (см. Пример 2). Полученные штаммы выращивали при 37°С в течение 18 ч в питательной среде, после чего 0,1 мл каждой культуры переносили в 2 мл питательной среды в пробирках 20×200 мм и выращивали при 37°С в течение 24 ч на роторной качалке (240 оборотов/мин). Приготовление и состав питательной среды, а также способ определения количества L-треонина описаны в Примере 2.
Средние результаты двадцати независимых пробирочных ферментации представлены в Таблице 2. Как следует из Таблицы 2, модифицированный штамм Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC,ΔintB::yhjH,cat (pVIC40) накапливал большее количество L-треонина, чем исходный штамм Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC(pVIC40).
Пример 6: Конструирование штамма Е. coli MG1655::Δtdh,rhtA*,Ptac7fliZ,cat.
Штамм Е. coli MG1655::Δtdh,rhtA*,Ptac7fliZ,cat получали таким же образом, что и описанный выше штамм Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC в Примере 1 (Таблица 3).
ДНК-фрагмент, содержащий промотор Piac7, получали методом ПЦР с использованием коммерческой плазмиды pKK223-3 («Pharmacia», Литва) в качестве матрицы и праймеров Р13 (SEQ ID NO:21) и Р14 (SEQ ID NO:22). Праймер Р13 содержит область длиной 40 нуклеотидов, комплементарную 5'-концу гена fliZ и необходимую для последующей интеграции в бактериальную хромосому. Также, праймер Р13 содержит делецию С-нуклеотида в позиции 23 выше ATG-кодона в области связывания Lacl-репрессора. Праймер Р14 содержит область длиной 21 нуклеотид, комплементарную 5'-концу гена cat и необходимую для последующего соединения с промотором Ptac7.
ДНК-фрагмент, содержащий маркер устойчивости к хлорамфениколу (CmR-маркер), кодируемый геном cat, получали методом ПЦР с использованием коммерческой плазмиды pACYC184 (GenBank, инвентарный №Х06403, «Fermentas», Литва) в качестве матрицы и праймеров Р15 (SEQ ID NO:23) и Р16 (SEQ ID NO:24). Праймер Р15 содержит область длиной 41 нуклеотид, гомологичную области, расположенной на 9 нуклеотидов выше стартового кодона reuafliZ, и необходимую для последующей интеграции в бактериальную хромосому. Праймер Р16 содержит область длиной 21 нуклеотид, комплементарную 5'-концу промотора Ptac7, и необходимую для последующего соединения с геном cat.
ДНК-фрагмент cat-fliZ получали методом ПЦР, позволяющим получать ДНК-фрагменты с перекрывающимися участками (overlapping PCR). Для этого использовали два полученных ранее ДНК-фрагмента и праймеры Р15 (SEQ ID NO:23) и Р13 (SEQ ID NO:21). Полученный ДНК-фрагмент cat-fliZ очищали методом электрофореза в агарозном геле, выделяли с использованием «GenElute Spin Columns» («Sigma», США) и осаждали этанолом. Полученный фрагмент ДНК использовали для электропорации и Red-зависимой интеграции в бактериальную хромосому штамма Е. coli MG 1655::Δtdh,rhtA*/pKD46.
Колонии, выросшие в течение 24 ч, проверяли на наличие CmR-маркера, интегрированного вместо нативной промоторной области гена fliZ, с помощью ПЦР, используя праймеры Р17 (SEQ ID NO:25) и PI 8 (SEQ ID NO:26), как описано в Примере 3. Несколько CmR-колоний содержали фрагмент длиной 1540 п.н., что подтверждает замену нативной промоторной области гена fliZ (295 п.н.) на ДНК-фрагмент, содержащий CmR-маркер (Фиг.3). Один из полученных штаммов излечивали от термочувствительной плазмиды pKD46 путем культивирования при 37°С. Полученный штамм был назван Е. coli MG1655::Δtdh,rhtA*,Ptac7fliZ,cat.
Пример 7: Конструирование штамма
Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC,Ptac7fHZ,cat.
Штамм Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC,Ptac7fliZ,cat получали методом общей трансдукции ДНК-фрагмента, содержащего мутацию Ptac7fliZ, из штамма Е. coli MG1655::Δtdh,rhtA*,Ptac7fliZ,cat в штамм MG1655::Δtdh,rhtA*,Ptac7flhDC (Miller J.H., Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, Plainview, NY, 1972). Для этого штамм MG1655::Δtdh,rhtA*,Ptac7flhDC инфицировали бактериальным фагом P1vir, выращенным на донорном штамме MG1655::Δtdh,rhtA*,Ptac7fliZ,cat. Так был получен штамм Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC,Ptac7fliZ,cat.
Пример 8: Продукция L-треонина штаммом
Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC,Ptac7fliZ,cat.
Штаммы Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC и MG1655::Δtdh,rhtA*,Ptac7flhDC,Ptac7fliZ,cat трансформировали плазмидой pVIC40 (см. Пример 2). Затем полученные штаммы выращивали при 37°С в течение 18 ч в питательной среде, после чего 0,1 мл каждой культуры переносили в 2 мл питательной среды в пробирках 20×200 мм и выращивали при 37°С в течение 24 ч на роторной качалке (240 оборотов/мин). Приготовление и состав питательной среды, а также способ определения количества L-треонина описаны в Примере 2.
Средние результаты двадцати независимых пробирочных ферментаций представлены в Таблице 3. Как следует из Таблицы 3, модифицированный штамм Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC,Ptac7fliZ,cat(pVIC40) накапливал большее количество L-треонина, чем исходный штамм Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC(pVIC40).
Пример 9: Конструирование штамма
Е. coli AJ 12739::Ptac7flhDC,KmR
Штамм Е. coli AJ 12739::Ptac7flhDC,KmR получали методом общей трансдукции ДНК-фрагмента, содержащего мутацию Ptac7flhDC, из штамма Е. coli MG1655::Δtdh,rhtA*,Ptac7flhDC в штамм-продуцент L-фенилаланина AJ 12739 (tyrA::Tn10, tyrR) (ВКПМ В-8197) (патент США №7,666,655) (Miller J.H, Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, Plainview, NY, 1972). Для этого штамм AJ 12739 инфицировали бактериальным фагом Plyir, выращенным на донорном штамме MG1655::Δtdh,rhtA*,Ptac7flhDC,KmR. Так был получен штамм Е. coli AJ 12739::Ptac7flhDC,KmR.
Пример 10: Продукция L-фенилаланина штаммом
Е. coli AJ 12739::Ptac7flhDC,KmR.
Штамм AJ 12739 и штамм-продуцент L-фенилаланина AJ 12739::Ptac7flhDC,KmR выращивали при 37°С в течение 18 ч в питательной среде, содержащей ампициллин (100 мг/л). Затем 0,3 мл каждой культуры переносили в 3 мл питательной среды, содержащей ампициллин (100 мг/л), в пробирках 20×200 мм и выращивали при 37°С в течение 48 ч на роторной качалке (240 оборотов/мин).
Состав питательной среды (г/л):
Глюкозу и сульфат магния стерилизовали раздельно. СаСО3 стерилизовали сухим жаром при 180°С в течение 2 ч. Кислотность устанавливали до значения рН 7.0. Антибиотик добавляли в среду после стерилизации.
После выращивания накопленный L-фенилаланин измеряли методом тонкослойной хроматографии (ТСХ). Пластинки ТСХ (10×15 см) были покрыты слоем (0.11 мм) силикагеля Sorbfil, содержащим нефлуоресцентный индикатор («Сорбполимер», Краснодар, Российская Федерация). Образцы наносили на пластины с помощью аппликатора Camag Linomat 5. В качестве подвижной фазы использовали смесь пропан-2-ол:этилацетат:25% водный аммиак:вода=40:40:7:16 (v/v). Для визуализации использовали раствор нингидрина (2%) в ацетоне. После прокрашивания пластинки высушивали и сканировали с помощью Camag TLC Scanner 3 в режиме абсорбции с детекцией при 520 нм, данные обрабатывали с помощью программы winCATS (версия 1.4.2).
Средние результаты двадцати независимых пробирочных ферментаций представлены в Таблице 4. Как следует из Таблицы 4, модифицированный штамм Е. coli AJ 12739::Ptac7flhDC,KmR накапливал большее количество L-фенилаланина, чем исходный штамм Е. coli AJ 12739.
Хотя указанное изобретение описано в деталях со ссылкой на наилучшие способы осуществления изобретения, для специалиста в указанной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения. Каждому из упомянутых выше документов соответствует ссылка, и все цитируемые документы являются частью описания настоящего изобретения.
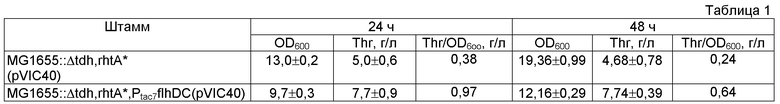
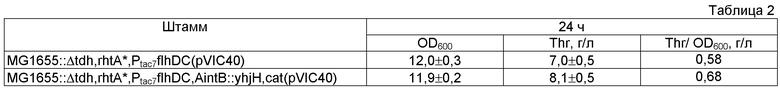
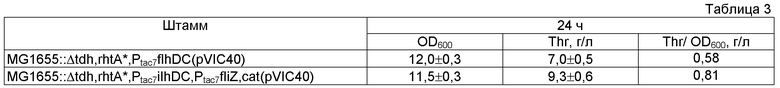
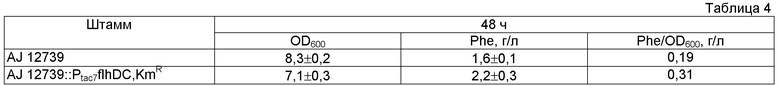
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН yahN | 2007 |
|
RU2392322C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА ENTEROBACTERIACEAE | 2007 |
|
RU2364628C2 |
| МУТАНТНАЯ АДЕНИЛАТЦИКЛАЗА, ДНК, КОДИРУЮЩАЯ ЕЕ, БАКТЕРИЯ СЕМЕЙСТВА ENTEROBACTERIACEAE, СОДЕРЖАЩАЯ УКАЗАННУЮ ДНК, И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ | 2010 |
|
RU2471868C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-треонина С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia | 2006 |
|
RU2351646C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, В КОТОРОЙ ИНАКТИВИРОВАН ОПЕРОН phoBR | 2005 |
|
RU2311452C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА И L-АРГИНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН cpxR | 2005 |
|
RU2320723C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ, ПРИНАДЛЕЖАЩИХ К РОДУ ESCHERICHIA | 2005 |
|
RU2304615C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, В КОТОРОЙ ИНАКТИВИРОВАН ОПЕРОН mazEF | 2005 |
|
RU2313573C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АРГИНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ РОДА Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ОПЕРОН astCADBE | 2010 |
|
RU2482188C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ, ШТАММ ESCHERICHIA COLI TDH7Δ MLC::CAT/PPRT614-ПРОДУЦЕНТ L-ТРЕОНИНА | 2002 |
|
RU2245919C2 |











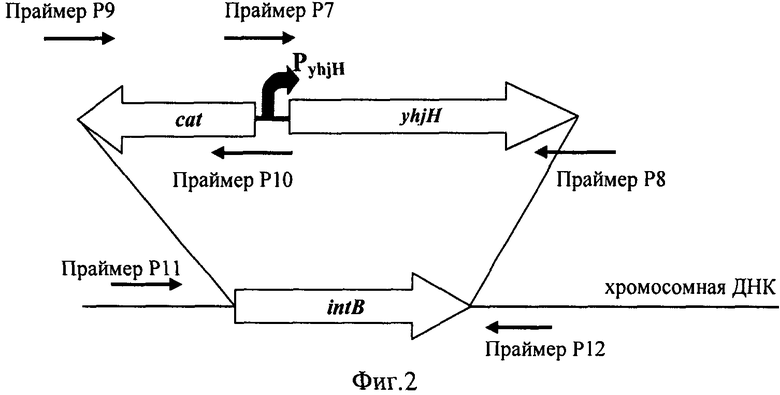
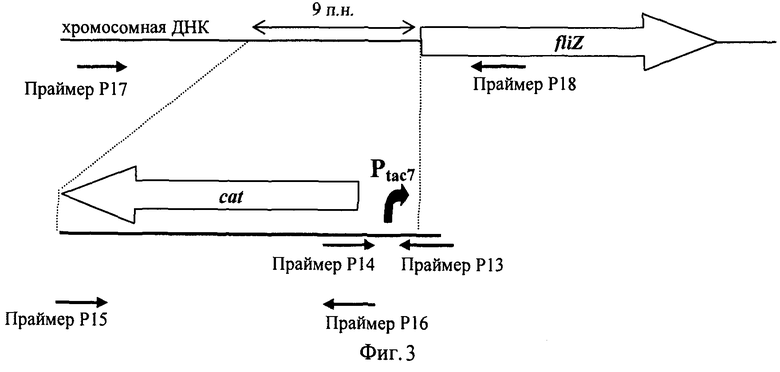
Изобретение относится к биотехнологии и представляет собой способ получения L-аминокислоты с использованием бактерии семейства Enterobacteriaceae, модифицированной таким образом, что экспрессия по крайней мере одного гена каскада образования флагелл и клеточной подвижности усилена. Изобретение позволяет получать L-аминокислоты с высокой степенью эффективности. 17 з.п. ф-лы, 3 ил., 4 табл., 10 пр.
1. Способ получения L-аминокислоты, включающий выращивание в питательной среде бактерии, принадлежащей к семейству Enterobacteriaceae и способной производить L-аминокислоту, и выделение указанной L-аминокислоты из культуральной жидкости, отличающийся тем, что указанная бактерия модифицирована таким образом, что экспрессия по крайней мере одного из генов каскада образования флагелл и клеточной подвижности усилена.
2. Способ по п.1, отличающийся тем, что указанный по крайней мере один из генов выбран из группы, состоящей из гена(ов) оперона flhDC, гена yhjH и гена fliZ, и их комбинации.
3. Способ по п.2, отличающийся тем, что экспрессия указанного(ых) гена(ов) усилена путем изменения регуляторной области, контролирующей экспрессию указанного(ых) гена(ов).
4. Способ по п.2, отличающийся тем, что экспрессия указанного(ых) гена(ов) усилена путем увеличения числа копий указанного(ых) гена(ов).
5. Способ по п.1, отличающийся тем, что указанная бактерия принадлежит к роду Escherichia.
6. Способ по п.5, отличающийся тем, что указанная бактерия является Escherichia coli.
7. Способ по п.1, отличающийся тем, что указанная бактерия принадлежит к роду Enterobacter.
8. Способ по п.1, отличающийся тем, что указанная бактерия принадлежит к роду Pantoea.
9. Способ по п.2, отличающийся тем, что ген flhD кодирует белок, выбранный из группы, состоящей из:
(A) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO: 2;
(B) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO: 2, но в которой один или несколько аминокислотных остатков замещен, удален, вставлен, добавлен или инвертирован, причем указанный белок имеет активность ДНК-связывающего парного регулятора транскрипции согласно последовательности SEQ ID NO: 2; и
(C) их комбинации.
10. Способ по п.2, отличающийся тем, что ген flhC кодирует белок, выбранный из группы, состоящей из:
(D) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO: 4;
(Е) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO: 4, но в которой один или несколько аминокислотных остатков замещен, удален, вставлен, добавлен или инвертирован, причем указанный белок имеет активность ДНК-связывающего парного регулятора транскрипции согласно последовательности SEQ ID NO: 4; и
(F) их комбинации.
11. Способ по п.2, отличающийся тем, что ген yhjH кодирует белок, выбранный из группы, состоящей из:
(G) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO: 6; и
(Н) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO: 6, но в которой один или несколько аминокислотных остатков замещен, удален, вставлен, добавлен или инвертирован, причем указанный белок имеет активность цикло-ди-ГМФ фосфодиэстеразы согласно последовательности SEQ ID NO: 6; и
(I) их комбинации.
12. Способ по п.2, отличающийся тем, что ген fliZ кодирует белок, выбранный из группы, состоящей из:
(J) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO: 8; и
(K) белка, включающего аминокислотную последовательность, представленную как SEQ ID NO: 8, но в которой один или несколько аминокислотных остатков замещен, удален, вставлен, добавлен или инвертирован, причем указанный белок имеет активность регулятора согласно последовательности SEQ ID NO: 8; и
(L) их комбинации.
13. Способ по п.1, отличающийся тем, что L-аминокислота есть ароматическая L-аминокислота.
14. Способ по п.13, отличающийся тем, что ароматическая L-аминокислота есть L-фенилаланин, L-тирозин и L-триптофан.
15. Способ по п.1, отличающийся тем, что L-аминокислота есть неароматическая L-аминокислота.
16. Способ по п.15, отличающийся тем, что неароматическая L-аминокислота есть L-треонин, L-лизин, L-цистеин, L-метионин, L-лейцин, L-изолейцин, L-валин, L-гистидин, L-серин, L-аланин, L-аспарагин, L-аспарагиновая кислота, L-глутамин, L-глутаминовая кислота, L-пролин, L-аргинин и глицин.
17. Способ по п.1 или 13, отличающийся тем, что L-аминокислота есть L-фенилаланин.
18. Способ по п.1 или 15, отличающийся тем, что L-аминокислота есть L-треонин.
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, МОДИФИЦИРОВАННОЙ ТАКИМ ОБРАЗОМ, ЧТО В НЕЙ НАРУШЕНА СПОСОБНОСТЬ К ОБРАЗОВАНИЮ ВОРСИНОК ТИПА "КЕРЛИ" | 2006 |
|
RU2338782C2 |
| WANG S et.al | |||
| Structure of the Escherichia coli FlhDC complex, a prokaryotic heteromeric regulator of transcription | |||
| J Mol Biol | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| KO M et.al | |||
| Two novel flagellar components and H-NS are involved in the motor function of Escherichia coli | |||
| J Mol Biol | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
Авторы
Даты
2014-02-27—Публикация
2012-08-17—Подача