Данное изобретение относится к улучшенному способу хроматографической очистки инсулинов.
Процессы получения инсулина характеризуются наряду с ферментативными и/или генно-инженерными способами в основном хроматографическими способами, чтобы выполнить крайне высокие требования к чистоте.
Под инсулином понимают выделенный из натуральных источников или рекомбинантный (то есть экспрессированный из генетически модифицированных микроорганизмов) инсулин животного или человеческого происхождения (например, свиной инсулин, инсулин крупного рогатого скота или человеческий инсулин), проинсулин (например, форпродукт инсулин, проинсулин) или производные инсулина.
В качестве производных инсулина отмечают ниже производные встречающихся в природе инсулинов, а именно человеческий инсулин или животные инсулины, которые отличаются замещением по меньшей мере одного встречающегося в природе аминокислотного остатка и/или присоединением по крайней мере одного аминокислотного остатка и/или органического остатка соответствующего либо такого же встречающегося в природе инсулина.
Человеческий инсулин представляет собой полипептид, который состоит из 51 аминокислоты. Так называемая А (кислотная) цепь состоит из 21, В (основная) цепь - из 30 аминокислотных остатков. В обеих аминокислотных цепях встречаются 6 цистеиновых остатков, причем каждые два цистеиновых остатка соединены друг с другом одним дисульфидным мостиком (обе цепи связаны друг с другом двумя цистеиновыми мостиками). В биологически активном человеческом инсулине цепи А и В связаны между собой двумя цистеиновыми мостиками, и каждый следующий мостик находится в цепи А. Следующие цистеиновые остатки связаны в (биологически активном) человеческом инсулине друг с другом:
А6-А11
А7-В7
А20-В19
Буквы А или В соответствуют аминокислотной цепи инсулина, цифра относится к положению аминокислотного остатка, которое исчисляется от концевой аминогруппы до концевой карбоксильной группы соответствующей аминокислотной цепи.
Получение рекомбинантного инсулина происходит обычно через стадии ферментации и превращения клеток и сопровождается протеинохимическими и техническими способами, обычно хроматографическими процессами очистки продукта.
Генно-инженерный способ позволяет получать в микроорганизмах человеческий проинсулин или проинсулин (проинсулин производных инсулина), который имеет аминокислотную последовательность и/или длину аминокислотной цепи, отличающуюся от человеческого инсулина. Проинсулины, полученные из генетически измененных клеток Escherichia coli, не имеют корректно соединенных цистеиновых мостиков. Способ получения человеческого инсулина с корректно связанными цистеиновыми мостиками с помощью E. coli известен, например, из европейского патента ЕР 0055945. Улучшенные способы получения человеческого инсулина и производных инсулина с корректно связанными цистеиновыми мостиками описаны в заявках на европейские патенты ЕР 0600372 Al (US 5473049) и ЕР 0668292 А2 (US 5663291).
Проинсулин, полученный из генетически модифицированных микроорганизмов, предшественник инсулина, прежде всего выделяют из клеток, корректно ориентируют и затем ферментативно преобразовывают в человеческий инсулин. Расщепленная смесь, полученная при ферментативном процессе пептизации, содержит кроме нежелательных побочных продуктов как целевое вещество, так и нежелательные инсулиноподобные сопутствующие вещества, которые существенно не отличаются от целевого продукта ни молекулярным весом, ни другими физическими свойствами, что очень затрудняет выделение и очистку, особенно в крупном промышленном масштабе.
Технические способы очистки представляют собой различные, следующие друг за другом хроматографические способы (например, адсорбционная хроматография, ионообменная хроматография, хроматография с обращенными фазами или хроматография высокого давления с обращенными фазами или их комбинации, частично многоступенчатые с различными носителями, частично с последующей кристаллизацией, при этом с помощью хроматографии достигается собственно очистка. При этом на ионообменном носителе или на обращенной фазе кизельгеля происходит отделение инсулиноподобных сопутствующих веществ.
Заключительная стадия (отделение мельчайших примесей как последняя стадия очистки) проводится обычно в области высокого давления с использованием хроматографии с обращенными фазами на кизельгеле (ОФ - ВЭЖХ = высокоэффективная жидкостная хроматография с обращенными фазами.
Под обращенной фазой кизельгеля (или инверсной фазой, так называемой липофильно модифицированной, то есть гидрофобной) понимают материал из диоксида кремния, на который нанесена гидрофобная матрица. Примерами гидрофобной матрицы являются алканы с длиной цепи от 3 до 20 атомов углерода, особенно от 4 до 18 атомов углерода. Размер частиц находится в области от 10 до 50 мкм, ширина пор - от 50 до 300  .
.
Примерами хроматографических способов, которые используют согласно уровню техники ОФ - кизельгель (липофильный модифицированный кизельгель), являются заявки на европейские патенты ЕР 0547544 А2 (US 5621073) или ЕР 0474213 A1 (US 5245008). Согласно известному уровню техники высокие требования к чистоте получаемого инсулина могут быть достигнуты только с помощью применения обращенной фазы кизельгеля.
Обращенная фаза кизельгеля стабильна только в области рН от 2 до 10. При хроматографии продуктов ферментации всегда получают высокомолекулярные побочные продукты, которые устойчиво адсорбируются и не могут быть десорбированы обычным элюированием. Со временем эти побочные продукты накапливаются на ОФ - кизельгеле (это называют старением адсорбента). Регенерация или очищение на месте (CIP) удается в большинстве случаев только путем промывания разбавленным едким натром. Таким образом, при каждом CIP-процессе часть ОФ - кизельгеля разрушается, а его систематическое добавление обходится очень дорого. Кроме того, для инсулина возникает опасность денатуризации на кизельгеле.
Известно много попыток заменить ОФ - кизельгель на основе диоксида кремния. Опыты с ОФ - материалом на основе оксида алюминия или диоксида титана (оба материала не полностью стабильны при изменении рН, но, по крайней мере, более стабильны, чем силикагель) показали, что разделение является недостаточным, и требуемые показатели, в отношении чистоты, не достигаются.
Следующим необходимым свойством материалов для хроматографии является их устойчивость к давлению. Под устойчивыми в отношении давления полимерными хроматографическими материалами понимают частицы органических полимеров (которые могут находиться во всех возможных формах, как, например, в форме палочек, в форме фрагментов или преимущественно в форме шариков и предпочтительно с диаметром от 10 до 35 мкм), деформация которых под действием давления (до 70 бар) лишь незначительна. Материал, находящийся в хроматографической колонке, должен быть так хорошо упакован, чтобы не существовало никакого свободного объема (качество упаковки определяет результат разделения). Для наполнения колонок известны в основном две различные технологии, которые могут применяться также и в комбинации. Существуют методы: сдавливания упаковки с помощью плунжера (приводимого в действие главным образом гидравлически) (ПАС - прямое аксиальное сжатие), или гидродинамического наполнения колонки с помощью насоса высокого давления, то есть наполнения под давлением колонки суспензией жидкости и частиц. В обоих случаях практика показывает, что на поперечное сечение колонки должно действовать давление вплоть до 70 бар, для того чтобы частицы могли быть упакованы как можно плотнее и без образования свободного объема.
Многие частицы органических полимеров неустойчивы к давлению и деформируются под действием давления настолько, что из шариков становятся плоскими шайбами, которые перекрывают друг друга и из-за такого расположения препятствуют протеканию. В противоположность этому обращенная фаза кизельгеля по природе существенно более твердая и едва деформируется под действием названного давления.
Задачей данного изобретения является создание способа хроматографической очистки инсулина на пригодных хроматографических материалах, устойчивых к давлению и используемых во всей области рН от 1 до 14, который приводит к такой высокой степени разделения, что вместо обычно двух или более следующих друг за другом стадий хроматографии, известных из уровня техники, для достижения требуемой очистки инсулина при одновременном повышении выхода этой стадии очистки необходима только одна ступень.
Задача решается с помощью способа хроматографической очистки инсулина, отличающегося тем, что в качестве стационарной фазы применяют устойчивый к давлению, органический полимерный хроматографический материал, а подвижная фаза содержит по крайней мере один смешивающийся с водой органический растворитель и по крайней мере одно буферное вещество и значение рН составляет от 7 до 11.
Неожиданно было обнаружено, что очень хорошее разделение на устойчивых к давлению, органических полимерных хроматографических материалах достигается при хроматографии в области значений рН от 7 до 11, то есть в щелочной области. Предпочтительно значение рН составляет от 9 до 10.
Особенное преимущество способа согласно данному изобретению состоит в том, что в этой щелочной области рН подавляется образование дез-амидо-инсулина, сопутствующего вещества, которое образуется обычно в кислых средах и в соответствии с правилами по изготовлению инсулина должно отделяться до очень незначительных остаточных количеств.
Подвижные фазы, которые используются для элюирования, содержат смешивающийся с водой органический растворитель, например спирты с 1-4 атомами углерода, кетоны, метилацетат или ацетонитрил. Преимущественно это такие спирты как 1- или 2- пропанол (н- или изо-пропанол), метанол или этанол. Концентрация смешивающегося с водой органического растворителя составляет от 1 до 90 об.%, преимущественно от 10 до 50 об.%.
Подвижные фазы содержат, кроме того, буферное вещество для поддержания постоянным значения рН элюэнта. Пригодные буферные вещества представляют собой, например, фосфаты, соли щелочных или щелочноземельных металлов, такие как цитрат натрия или ацетат калия, цитрат-, ацетат-, сульфат- или хлорид аммония.
Регулирование значения рН происходит путем добавления соляной кислоты или едкого натра.
Элюирование может происходить изократно, то есть с постоянной концентрацией буферных веществ и с постоянным содержанием органического растворителя, или предпочтительно с одним линейным градиентом, таким как повышение содержания растворителя.
Средний размер частиц устойчивого к давлению органического полимерного хроматографического материала должен составлять предпочтительно от 5 до 300 мкм, предпочтительно от 10 до 50 мкм. Чем меньше величина частицы, тем тоньше и лучше будет разделение. Кроме того, устойчивость к давлению маленьких частиц меньше.
Инсулин - относительно малый полипептид (молекулярная масса около 6000) и может без проблем диффундировать в поры диаметром от 10 нм (без стерических затруднений). Материалы с маленьким диаметром пор более пригодны, так как их специфическая поверхность и тем самым адсорбционная емкость выше. Средняя величина пор устойчивых к давлению органических полимерных хроматографических материалов составляет чаще всего от 5 до 500 нм, предпочтительно от 10 до 50 нм.
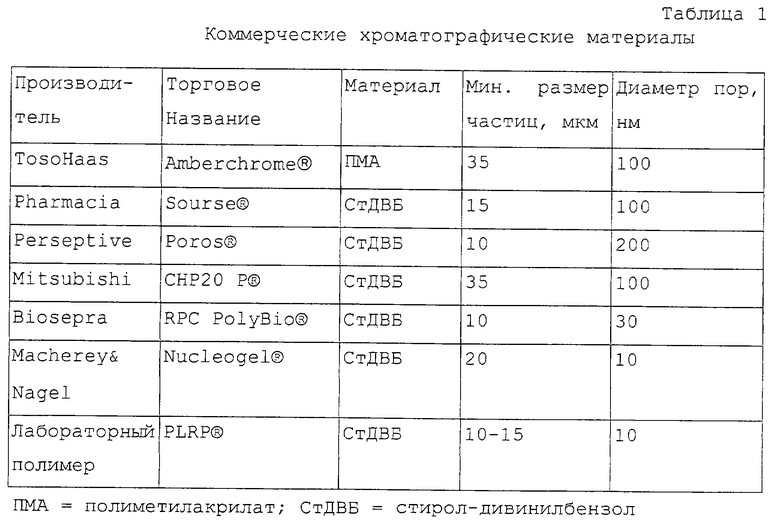
Согласно способу данного изобретения особенно пригодны устойчивые к давлению, органические полимерные хроматографические материалы, которые состоят предпочтительно из полистиролдивинилбензола или из полиметакрилата. Примеры коммерческих, устойчивых к давлению, органических полимерных хроматографических материалов, которые могут быть предпочтительно использованы по способу согласно данному изобретению, представлены в таблице 1 (таблицы 1-5 см. в конце описания).
Способ согласно изобретению пригоден для аналитической, полупрепаративной и особенно для препаративной хроматографии. Под понятием "препаративная хроматография" понимают получение чистых продуктов в техническом масштабе.
Для достижения требуемой чистоты получаемого инсулина необходимо располагать хроматографией с обращенными фазами, например, в соответствии с заявками на европейский патент ЕР 547544 А2 (US 5621073) или ЕР 0474213 A1 (US 5245008), по крайней мере дополнительной хроматографией с обращенными фазами или катионообменной хроматографией и в случае необходимости стадией кристаллизации. В способе согласно изобретению такой же результат достигается одноступенчатой хроматографией на полимерном носителе. Благодаря способу согласно изобретению существенно улучшается общий выход при получении инсулина, так как из-за объединения нескольких стадий процесса в одну стадию сокращаются потери выхода.
Способ согласно данному изобретению пригоден для хроматографической очистки всех инсулинов согласно определению, приведенному ранее, а именно инсулинов, выделенных из натуральных источников или рекомбинированных (т.е. экспрессированных из генетически модифицированных микроорганизмов) инсулинов животного или человеческого происхождения (например, свиной инсулин, инсулин крупного рогатого скота или человеческий инсулин), проинсулинов (например, форпродукт инсулина, проинсулинов) или производных инсулина, причем под производными инсулина понимают производные встречающихся в природе инсулинов, а именно человеческого или животных инсулинов, которые отличаются от соответствующего в остальном такого же, встречающегося в природе инсулина, замещением по крайней мере одного встречающегося в природе аминокислотного остатка и/или присоединением по крайней мере одного аминокислотного остатка и/или органического остатка.
Примерами таких инсулинов являются человеческий инсулин, инсулин крупного рогатого скота, свиной инсулин, инсулины согласно европейскому патенту ЕР 068187 (US 5656722), например Gly(A21), Arg(B31), Arg(В32) - человеческий инсулин, инсулины согласно европейскому патенту ЕР 0 821 006 (ZA 97/6645) или инсулины, описанные в заявках на европейские патенты ЕР 0547544 Al (US 5621073), ЕР 0474213 Al (US 5245008), ЕР 0600372 Al (US 5473049) или в европейском патенте ЕР 0668292 (US 5663291). (Буквы А и В соответствуют аминокислотной цепи инсулина, цифра указывает положение встречающего в природе аминокислотного остатка, который заменен указанным перед скобками аминокислотным остатком.
Пример 1. Варьирование значения рН.
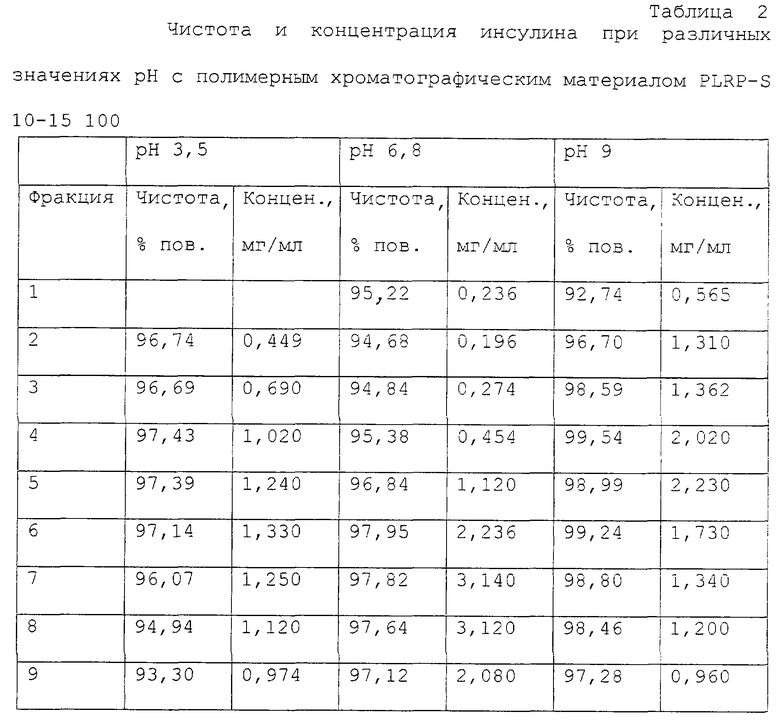
В примере 1 проведены опыты на полупрепаративной колонке размерами 10 мм в диаметре и 120 мм длиной, заполненной носителем PLRP-S размером 10-15 мкм с диаметром пор 100 (лабораторный полимер). Задача состояла в том, чтобы подлежащий очистке инсулин с чистотой 95% поверх. счистить таким образом, чтобы чистота составляла более 98,5% поверх.
(лабораторный полимер). Задача состояла в том, чтобы подлежащий очистке инсулин с чистотой 95% поверх. счистить таким образом, чтобы чистота составляла более 98,5% поверх.
В количественном отношении задача была поставлена так, что заполнение полимерного хроматографического материала составляло от 6 г/л (объема слоя). Буферная система и подвижная фаза - это водно-пропанольные смеси, содержащие 0,05 М ацетата аммония и 0,1 М глицина, которые были доведены до соответствующего значения рН с помощью соляной кислоты или едкого натра. Скорость в пустой трубке составляла 150 см/час. Были установлены три значения рН: 3,5; 6,8; 9. Элюат был собран по фракциям.
Результаты представлены в таблице 2. Только при рН 9 достигается чистота более 98% поверх., и при этом сохраняется специфичность. Определенно следует признать, что очистка инсулина на полимерном хроматографическом материале достигает требуемой эффективности только в щелочной области.
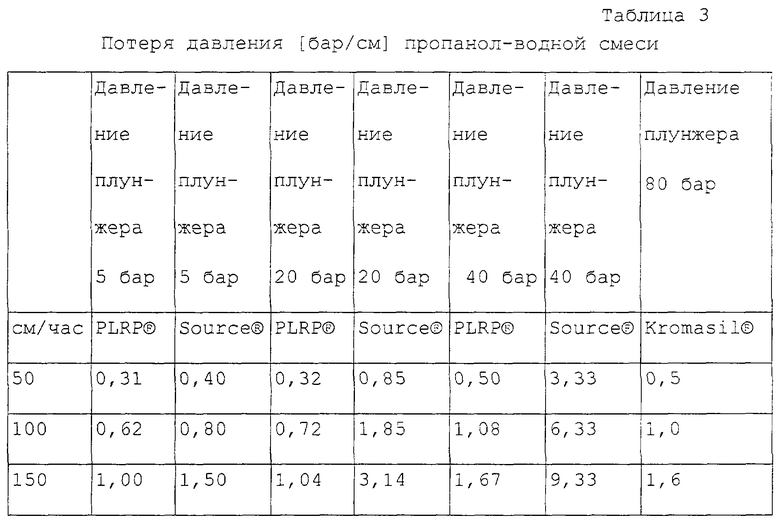
Пример 2. Устойчивость к давлению и заполнение колонки.
Хроматографическая колонка (Prochrom® LS50, диаметр 50 мм) была заполнена с помощью ПАС-техники (прямое аксиальное сжатие). Хроматографический материал (стационарная фаза) был помещен в 100%-ный метанол и затем в колонку. При различных величинах потока была измерена потеря давления 11%-ной н-пропанольной смеси. Давление плунжера хроматографической колонки варьировалось от 5 до 80 бар.
Были исследованы следующие хроматографические материалы:
PLRP-S 10-15 100® (лабораторный полимер),
Source® 15 RPC (Amersham Pharmacia Biotech),
Kromasil® 13-120 (Akzo Nobel).
Материалы имеют примерно одинаковые диаметры частиц (сферические частицы). PLRP® и Source® представляют собой полимеры, Kromasil® - высокопрочный ОФ-кизельгель.
Специфическая потеря давления 1 бар/см означает падение давления 30 бар на 30 см высоты заполнения, что является обычным в технической хроматографии.
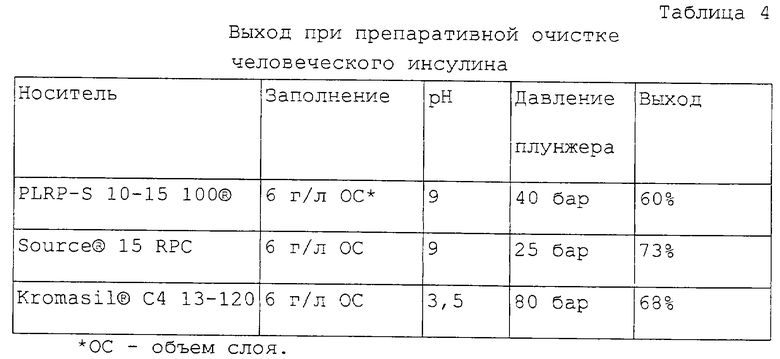
Пример 3. Очистка человеческого инсулина в препаративном масштабе.
Далее описаны три примера, в которых человеческий инсулин очищают в технической колонке, заполненной по ПАС-принципу с помощью перемещаемого плунжера. Использована колонка "Prochrom®",, тип LC50. Во всех опытах заполнение соответствовало одинаковой величине: диаметр 50 мм, длина слоя 110-120 мм.
Человеческий инсулин с чистотой 95% поверх. должен быть очищен до чистоты более 98,5% поверх.
Использованы три хроматографических носителя:
PLRP-S 10-15 100® (лабораторный образец),
Source® 15 RPC (Amersham Pharmacia Biotech),
Kromasil® C4 13-120 (Akzo Nobel).
Как уже описано в примере 2, PLRP и Source® представляют собой полимерные материалы, в то время как Kromasil® - высокопрочный ОФ-кизельгель-носитель.
Введенный буфер и подвижная фаза соответствуют данным примера 1. Заполнение указано в граммах человеческого инсулина на литр объема слоя. Под выходом понимают долю элюата, которая имеет чистоту более 98,5% поверх.
В таблице 4 сопоставлены достигнутые выходы. Значения от 60 до 70% для длины слоя около 12 см являются неожиданно хорошими. Основным отличием между известным уровнем техники (очистка с носителем - кизельгелем, здесь - с Kromasil®)) и хроматографией с помощью полимерного носителя является различие в рН: выходы такого уровня достигаются только при значении рН от 9.
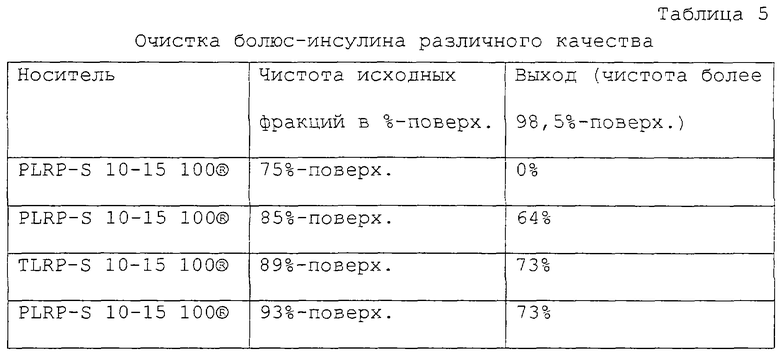
Пример 4. Очистка болюс-инсулина в препаративном масштабе.
В этом примере должен быть очищен болюс-инсулин (инсулин быстрого действия). Кроме того, пример должен демонстрировать, что на этой стадии хроматографии допустимо использовать исходные фракции худшего качества. Согласно уровню техники заключительную очистку инсулина обычно проводят двумя хроматографическими стадиями. Если на заключительной стадии очистки используют непосредственно плохой, т. е. неочищенный продукт, то требуемые чистота и одновременно высокий выход более не могут быть достигнуты.
Неожиданно было показано, что исследуемый полимерный материал обеспечивает эту чистоту на одной хроматографической стадии, что объясняется маленьким диаметром частиц от 10 до 15 мкм и отличными адсорбционными свойствами.
Проведено 4 опыта со следующими исходными фракциями:
Чистота 75% поверх.
Чистота 85% поверх.
Чистота 89% поверх.
Чистота 93% поверх.
В таблице 5 приведены достигнутые выходы (т.е. доля использованного инсулина, которая была элюирована с чистотой более 98,5% поверх.). Если исходная фракция имеет чистоту только 75%поверх., то чистота свыше 98,5% поверх. не может быть достигнута. Чистота составляет лишь 98% поверх.
Однако, если исходные фракции имеют чистоту свыше 85% поверх., тогда достигается требуемая чистота более 98,5% поверх. при выходах между 60 и 80%.
Препаративные условия описаны в примере 1. Все опыты проводили на колонке "Prochrom®" типа LC50 с диаметром 50 мм и высотой заполнения 12 см. Заполнение составляло при необходимости 6 г/л ОС, значение рН 9 и давление плунжера 35 бар.
Из таблицы 5 хорошо видно, как возрастает выход при хроматографии в зависимости от качества исходных фракций. Опытами показано, что чистота несомненно может быть достигнута за одну единственную хроматографическую стадию.
Изобретение относится к способу хроматографической очистки инсулинов, в котором подвижная фаза содержит по крайней мере один смешиваемый с водой органический растворитель и по крайней мере одно буферное вещество и значение рН составляет от 7 до 11, отличающийся тем, что в качестве стационарной фазы используют устойчивый к давлению органический полимерный хроматографический материал, средний размер частиц которого составляет от 10 до 50 мкм. Технический результат: повышение степени разделения инсулина, сокращение стадий очистки. 16 з.п. ф-лы, 5 табл.
| СПОСОБ ОЧИСТКИ ИНСУЛИНА И/ИЛИ ЕГО ПРОИЗВОДНЫХ | 1991 |
|
RU2037500C1 |
| СПОСОБ ОЧИСТКИ РЕКОМБИНАНТНОГО БЕЛКА, СОДЕРЖАЩЕГО ПОСЛЕДОВАТЕЛЬНОСТЬ ПРОИНСУЛИНА | 1990 |
|
SU1839446A1 |
| СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ ИНСУЛИНА ИЛИ ЕГО БИОТЕХНОЛОГИЧЕСКИХ ПРЕДШЕСТВЕННИКОВ | 1994 |
|
RU2081122C1 |
| US 5621073 А, 15.08.1997 | |||
| Способ термической обработки цилиндрических металлических изделий | 1984 |
|
SU1285024A1 |
| Якубке Х.-Д., Ешкайт Х | |||
| Аминокислоты, пептиды, белки | |||
| - М.: Мир, 1985. | |||
Авторы
Даты
2004-01-27—Публикация
1999-08-11—Подача