1.1. Область техники, к которой относится изобретение
Данное изобретение относится к химерному белку, имеющему последовательность, сходную с последовательностью внутримолекулярного "наставника" (IMC), связанную с нацеленным белком. В особенности данное изобретение относится к химерному белку, содержащему IMC-подобную последовательность, связанную с предшественником инсулина. Данное изобретение также относится к способу получения химерного белка с правильной укладкой, содержащего предшественник инсулина, включающий, среди прочего, приведение в контакт химерного белка с неправильной укладкой, имеющего IMC-подобную последовательность, связанную с предшественником инсулина, с, по меньшей мере, одним хаотропным вспомогательным агентом (добавкой). Кроме того, данное изобретение относится к анализу с целью скрининга аминокислотной последовательности на способность усовершенствовать укладкой предшественника инсулина с помощью химерного белка, содержащего IMC-подобную последовательность, связанную с предшественником инсулина.
1.2. Предшествующий уровень техники
1.2.1. Внутримолекулярные "наставники" и укладка белков
Молекулярные "наставники" определяют как класс белков, которые способствуют правильной укладке других полипептидов, но не являются компонентами функциональной собранной структуры (Shinde and Inouye, TIBS, 1993, 18:442-446). Внутримолекулярные "наставники" (IMC) являются частью предшественников нацеленных подлежащих скручиванию белков, и в их отсутствии молекулы нацеленных белков не имеют достаточной информации для соответствующей самоукладки (самоскручивания) (Inouye, Enzyme, 1991, 45:314-321). Уникальные особенности IMC включают: a) IMC и нацеленный белок связаны пептидной связью, образуя отдельный полипептид; Ь) IMC безусловно необходим для образования активной конформации нацеленного белка, но не требуется для функционирования нацеленного белка; с) по завершении укладки (скручивания) белка IMC удаляют либо аутопроцессингом, либо с помощью другой эндопептидазы; d) IMC не функционирует как катализатор, т.е. одна молекула IMC способна раскрутить только одну молекулу нацеленного белка; и е) IMC является в высшей степени специфическим приспособленным полипептидом, который работает только в случае нацеленных белков (Inouye, Enzyme, 1991, 45:314-321).
Было показано, что IMC или пропептид может межмолекулярно помочь нацеленному белку скручиваться, т.е. IMC или полипептид не связан с нацеленным белком пептидной связью, но скорее вводится в реакцию скручивания в виде отдельного пептида (патент США 5719021). Однако следует заметить, что пропептид, используемый в патенте США 5719021, представляет собой природный пропептид нацеленного белка или пропептид полипептида, который имеет ту же функцию, что и нацеленный белок, и полипептид также имеет аминокислотную последовательность, подобную последовательности нацеленного белка. Кроме того, межмолекулярную реакцию, описанную в патенте США 5719021, нужно проводить в забуференной ионной водной среде, более подходящей для гидрофобного взаимодействия.
Примеры IMC включают пропептиды субтилизина, а-литической протеазы, карбоксипептидазы Y и убихитина (Shinde and Inouye, TIBS, 1993, 18:442-446). Некоторые особенности IMC-последовательности субтилизина включают: а) IMC содержит более высокий процент заряженных аминокислотных остатков, чем нацеленный белок; b) распределение этих заряженных остатков внутри IMC чрезвычайно неравномерное, т.е. на N-концевой половине содержится больше положительно заряженных остатков, чем отрицательно заряженных остатков, а на С-концевой половине содержится больше отрицательно заряженных остатков, чем положительно заряженных остатков; с) остатки Ser и Thr в IMC всегда распределены неравномерно; d) IMC содержит реакционноспособно высокую долю ароматических остатков; и е) IMC содержит гидрофобную последовательность из 9 остатков (Inouye, Enzyme, 1991, 45:314-321). Сходная склонность к заряженным остаткам наблюдается также у а-литической протеазы и карбоксипептидазы Y (Inouye, Enzyme, 1991, 45:314-321).
1.2.2. Аминокислотная последовательность зрелого человеческого гормона роста
Аминокислотная последовательность зрелого человеческого гормона роста (hGH) описана в: Ikehara et al., Proc. Natl. Acad. Sci. USA, 1984, 81:5956-5960. В литературе (технике) нет доказательства, что зрелый hGH или его любая часть может функционировать как IMC или пропептид. Действительно, зрелый hGH или его любая часть совсем не могут рассматриваться как пропептид, так как, по определению, любая пре-, про- или препропоследовательность удаляется из зрелой последовательности.
1.2.3. Строение человеческого инсулина
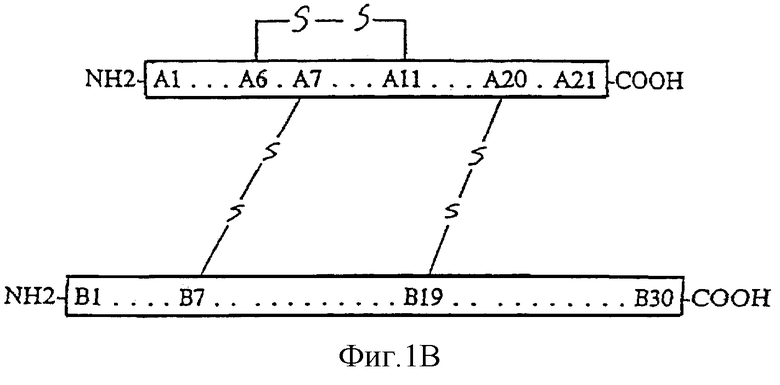
Инсулин является четко определенным белком с известной аминокислотной последовательностью и структурными характеристиками (Watson et al., Recombinant DNA - A Short Course; Scientific American Books, W.H. Freeman Co., New York, 1983, pp. 231-235; Norman and Litwack, In Hormones, Academic Press, New York, 1987, pp. 264-317). Этот гормон состоит из двух отдельных пептидных цепей, представляющих собой А-цепь (21 аминокислота) и В-цепь (30 аминокислот), связанных дисульфидными мостиками, как показано на фиг.1В. Проинсулин является биологическим предшественником инсулина и представляет собой отдельную цепь, образующуюся, когда цепи А и В связываются с помощью С-пептида (фиг.1А).
1.2.4. Человеческий инсулин, получаемый методами рекомбинантной ДНК
Человеческий инсулин был первым животным белком, полученным в бактериях с последовательностью, идентичной последовательности человеческого панкреатического пептида (Watson et al., Recombinant DNA - A Short Course; Scientific American Books, W.H. Freeman Co., New York, 1983, pp. 231-235). О первой успешной экспрессии человеческого инсулина в лаборатории было объявлено в 1978 году, и человеческий инсулин был утвержден как терапевтическое лекарственное средство в 1982 году (Johnson, Science, 1983, 219:632-637).
1.2.4.1. Двухцепочечный метод
Согласно этому методу каждую цепь инсулина получают в виде слитого белка с b-галактозидазой (b-gal) раздельной ферментацией с применением Е. Coli, трансформированных плазмидами, имеющими ДНК-последовательность, кодирующую цепь А или В человеческого инсулина, соответственно. Продукты являются внутриклеточными и видны в заметных цитоплазматических тельцах включения (Williams et al., Science, 1982, 215(5): 687-689). Рекомбинантные белки, продуцируемые в Е. Coli, обычно соответствуют 10-40% тотального белка (Burgess, Protein Engineering; Oxender, D.L., Fox, C.F., Eds.; Alan R Liss, Inc.; New York, 1987; pp.71-82).
После выделения из телец включения, химического расщепления с помощью CNBr по остатку Met между b-галактозидазой и цепью А или В с последующей очисткой получают отдельные А и В-пептиды. Затем пептиды объединяют и инициируют скручивание А-В цепи (S-сульфонатные формы) в соотношении 2:1 в присутствии ограниченного количества меркаптана для получения активного гормона (Chance et al., In Peptides: Synthesis-Structure-Function, Rich D.M., Gross, E., Eds., Pierce Chemical Co., Rockford, II 1981, pp. 721-728; Frank and Chance, In Quo Vadis? Therapeutic Agents Produced by Genetic Engineering, Joyesuk et al., Eds., Sanoff Group, Toulouse-labege, trance, 1985, pp. 137-148). Через 24 часа выход составляет, примерно, 60% в расчете на взятое количество В-цепи (Chance et al., In Insulins, Growth Hormone and Recombinant DNA Technology, Raven Press, New York, 1981, pp. 71-85; Johnson, Fluid Phase Equilib., 1986, 29:109-123). Goeddel et al., Proc. Natl. Acad. Sci. U.S.A., 1979, 76(1): 106-110, получили аналогичные результаты с 20% тотального клеточного белка, экспрессированного в виде слитого белка цепи А или цепи В. Последующее скручивание S-сульфонатных цепей дает 50-80% правильной укладкой.
Большой размер слитого белка b-gal ограничивает выходы, так как слитой белок b-gal (-1000 аминокислот) и цепь А или В инсулина (21 аминокислота или 30 аминокислот, соответственно) стал обособленным от клеточной рибосомы (преждевременная терминация цепи во время трансляции) и, следовательно, дает неполные пептиды инсулина (Burnett, Experimental Manipulation of Gene Expression, Inouye, Ed., Academic Press, New York, 1983, pp. 259-277; Hall, Invisible Frontiers - The Race to Synthesize a Human Gene, Atlantic Monthly Press, New York, 1987). Главным усовершенствованием этого способа является использование триптофан (Тrр)-оперона вместо lac-оперона (система b-gal) для получения меньшего по размеру слитого белка. Тrр-оперон содержит ряд из пяти бактериальных генов, которые последовательно синтезируют ферменты, ответственные за анаболизм триптофана. Один из этих ферментов, Trp E, содержит только 190 аминокислот по сравнению с 1000 аминокислот для b-gal. Trp Е-ген с последующими генами А или В цепей инсулина имеет дополнительные преимущества для повышения продуцирования слитого белка от 5-10% до 20-30% от тотального белка (Hall, Invisible Frontiers - The Race to Synthesize a Human Gene, Atlantic Monthly Press, New York, 1987), так как промотор Trp является сильным промотором в E. Coli. Это в конечном счете приводит к в 10 раз более высокой экспрессии полипептида по сравнению с lac (т.е. b-gal-системой (Burnett, Experimental Manipulation of Gene Expression, Inouye, Ed., Academic Press, New York, 1983, pp. 259-277). Тrр-оперон вводится в действие (включается), когда E. Coli ферментация истощается по триптофану (Hall, Invisible Frontiers - The Race to Sinthesize a Human Gene, Atlantic Monthly Press, New York, 1987; Etienne-Decent, In Genetic Biochemistry: From Gene to Protein, Ellis Horwood Limited, Chichester, U.K., 1988, pp.125-127). Эта особенность полезна в процессе ферментации, так как сначала может быть максимизирована клеточная масса. Затем, когда это нужно, клеточную систему продуцирования инсулина можно включать, позволяя ферментативным средам истощаться по Тrр.
По завершении ферментации клетки регенерируют и измельчают. Клеточный дебрис отделяют затем от телец включения и тельца включения растворяют в растворителе, хотя конкретные подробности неизвестны (Wheelwright, Protein Purification, Oxford University press; New York, 1991, p.217). Тельца включения иногда растворяют в 6 М солянокислом гуанидине и 0.1 мМ дитиотреитоле (Burgess, Protein Engineering; Oxender, D.L., Fox, C.F., Eds.; Alan R Liss, Inc.; New York, 1987; pp.71-82). Далее цепь Trp-LE-Met-A и цепь Trp-LE-Met-В подвергают расщеплению с помощью CNBr с целью выделения цепей А и В инсулина. Дальнейшие модификации А и В цепей включают окислительный сульфитолиз, очистку и соединение (комбинацию) с получением сырого инсулина. Сырой инсулин подвергают ионнообменной, по размеру молекул и обращенно-фазовой высокоэффективной жидкостной хроматографии (RP HPLC, ОФ ВЭЖХ), получая очищенный рекомбинантный человеческий инсулин (Frank and Chance, Munch Med. Wschr, 1983, 125(Suppl. 1):514-520).
1.2.4.2.Проинсулиновый метод (внутриклеточный)
Человеческий инсулин также можно получать с помощью рекомбинированных микроорганизмов, которые продуцируют интактный проинсулин, вместо раздельных цепей А и В (Kroeff et al., J. Chromatogr., 1989, 481:45-61). Сначала мРНК реплицируют в кДНК, а метиониновый кодон синтезируют и присоединяют к 5'-концу кДНК проинсулина. кДНК вставляют в бактериальный ген в плазмидном векторе, который вводится, а затем выращивается в Е. Соli. Проинсулин может быть выделен из фрагмента бактериального фермента (b-gal) (или же, в качестве альтернативы, из проинсулина Trp-LE/Met (Trp проинсулина) при разрушении метионинового линкера. Цепь проинсулина подвергают процессу скручивания с образованием правильных внутримолекулярных дисульфидных мостиков, а С-пептид можно затем расщепить ферментами, получая человеческий инсулин (Frank and Chance, Munch Med. Wschr, 1983, 125 (Suppl.1):514-520). В сравнении с этим методом ранее описанный двухцепочечный метод более сложен.
Dorschung et al. построили рекомбинантную плазмиду, кодирующую слитые белки, содержащие мини-проинсулин (B-Arg-A), экспрессировали слитые белки в Е. Coli (тельце включения) и дрожжах (секретированные), получили правильно скрученный мини-проинсулин BrCN-расщеплением и окислительным сульфитолизом и превратили правильно скрученный мини-проинсулин в человеческий инсулин обработкой трипсином и карбоксипептидазой В (ЕР 0347781 В1; Израильский патент 9562511 В и Австралийский Патент 611303 В2).
Tottrup and Carlsen, Biotechnol. Bioeng., 1990, 35:339-348 использовали систему дрожжей в оптимизированной ферментации с периодической подпиткой; сообщалось, что выходы слитого белка супероксид-дисмутаза-человеческий проинсулин (SOD-PI) составляют 1500 мг/л. SOD-PI предлагается в качестве исходного материала для получения рекомбинантного человеческого инсулина; выходы конечного продукта не сообщались.
Недавно Castellanos-Serra et al., FEBS Letters, 1996, 378:171-176 экспрессировали в Е. Coli слитой белок проинсулина, несущий модифицированный интерлейкин-2 N-концевой пептид (1-22 аминокислотных остатков), связанный с N-концом проинсулина с помощью остатка лизина. Химерный проинсулин был выделен из телец включения, раскручивался окислительным сульфитолизом и затем превращался в инсулин в виде правильно слитых белков продолжительной реакцией с трипсином и карбоксипептидазой В. Слитой белок IL2-проинсулин может быть правильно скручен без предварительного удаления IL2-фрагмента, таким образом исключаются стадии цианогенбромида и связанной с ним очистки. Однако стадии окислительного сульфитолиза и связаной с ним очистки нельзя избежать при использовании слитого белка IL2-проинсулина.
1.2.4.3.Проинсулиновый метод (секретированный проинсулин)
Villa-Komaroff et al., Proc. Natl. Acad. Sci. U.S.A., 1978, 75(8):3727-3731 первыми описали систему секреции человеческого проинсулина в Е. Coli. Thim et al. построили рекомбинантные плазмиды, кодирующие слитые белки, содержащие модифицированную лидерную последовательность фактора al-спаривания дрожжей и предшественника инсулина (Thim et al., Proc. Natl. Acad. Sci. USA, 1986, 83:6766-6770). Лидерная последовательность служит для того, чтобы направлять слитой белок по секреторному пути обмена в дрожжевых клетках и чтобы экспонировать слитой белок с Lys-Arg ферментной системой процессирования. Частичное процессирование (процессинг) также происходило в одной или обеих двухосновных последовательностях между цепями В и А в инсулине и других предшественниках инсулина, содержащих короткий спейсерный пептид (состоящий из 6 или более аминокислотных остатков) вместо С-пептида. Напротив, никакого процессирования не наблюдается в отсутствие спейсерного пептида в молекуле предшественника инсулина, например, В-Arg-Arg-A (где А и В являются А и В цепью человеческого инсулина, соответственно). Этот тип одноцепочечного предшественника инсулина ферментативно можно превратить в инсулин обработкой трипсином и карбоксипептидазой В. Diers et al., Drug Biotechnjlogy Regulation (Scientific Basis and Practices), Chiu and Gueriguan, Eds., Marcel Dekker, Inc., New York, 1991, pp. 167-177, описывают нескрученный пептид как лидерную последовательность или просегмент, далее Lys-Arg последовательность, В цепь (аминокислоты 1-29), короткий пептидный мостик с последующей А цепью (аминокислоты 1-21). У этого предшественника аминокислота 29 цепи В инсулина связана с аминокислотой 1 цепи А коротким связывающим пептидом, содержащим одну основную аминокислоту, соединенную с А цепью. Человеческий инсулин получают транспептидилированием с последующим гидролизом образовавшейся сложноэфирной связи. С целью дополнительной очистки несколько раз хроматографируют.
1.2.5. У кладка предшественников инсулина
Человеческий инсулин представляет собой белок, имеющий две аминокислотных цепи, содержащих в целом 51 аминокислотный остаток. Шесть остатков цистеина присутствуют в двух аминокислотных цепях, причем в каждом случае два цистеиновых остатка связаны друг с другом через дисульфидную связь. Статистически существует 15 возможностей образования дисульфидных мостиков внутри одной молекулы человеческого инсулина. Однако только одна из 15 возможностей реализуется в биологически активном человеческом инсулине со следующими дисульфидными мостиками: 1) А6-А11; 2) А7-В7; и 3) А20-В19.
На образование дисульфидных мостиков, которые имеются в человеческом инсулине, воздействуют с помощью интермедиата, причем остатки цистеина человеческого инсулина обеспечиваются серусодержащей защитной группой, например S-сульфонатной (-S-SO
Цитирование вышеуказанных ссылок не следует интерпретировать как допущение, что эти ссылки представляют состояние уровня предыдущей техники для данного изобретения.
2.СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к химерному белку, включающему от N-конца до С-конца: а) первый пептидный фрагмент, состоящий из аминокислотной последовательности, которая, по меньшей мере, на 40% идентична домену, содержащему, по меньшей мере, 20 N-концевых аминокислот белка человеческого гормона роста (hGH), в котором процент идентичности определяется на протяжении аминокислотной последовательности, идентичной по длине домену hGH; b) остаток Arg, или остаток Lys, или второй пептидный фрагмент, состоящий, по меньшей мере, из 2 аминокислот, причем в этом пептидном фрагменте наибольшим С-концевым аминокислотным остатком является Arg или Lys; и с) третий пептидный фрагмент, состоящий из аминокислотной последовательности, содержащей более двух цистеиновых (Cys) остатков, причем этот пептидный фрагмент не является частью hGH-белка. В особенности изобретение относится к химерному белку, в котором третий пептидный фрагмент является предшественником инсулина.
Изобретение также относится к способу получения первого правильно скрученного химерного белка, содержащего предшественник инсулина, заключающемуся в приведении в контакт неправильно скрученного второго химерного белка, содержащего предшественник инсулина, - причем указанный второй химерный белок, содержащий предшественник инсулина, состоит из подобного внутримолекулярному "наставнику" (IMC-подобного) фрагмента, отделенного от предшественника инсулина одним или более расщепляемым аминокислотным остатком, - с, по меньшей мере, одним хаотропным вспомогательным веществом (добавкой) в водной среде; при этом указанный IMC-подобный пептидный фрагмент: а) содержит примерно от 20 до 200 аминокислотных остатков; b) не является предшественником инсулина или его частью; и с) улучшает скручивание предшественника инсулина таким образом, что выход правильно скрученного первого химерного предшественника инсулина, - в том случае, когда неправильно скрученный второй химерный белок, содержащий предшественник инсулина, контактирует с хаотропной добавкой, - выше, чем выход правильно скрученного предшественника инсулина в том случае, когда неправильно скрученный предшественник инсулина, который не содержит указанный IMC-подобный пептидный фрагмент, контактирует с той же хаотропной добавкой.
Далее, данное изобретение относится к анализу с целью скрининга аминокислотной последовательности на способность улучшать укладку предшественника инсулина, заключающемуся в: а) изменении аминокислотной последовательности первого пептидного фрагмента химерного белка, описанного в главе 4.2, который содержит предшественник инсулина, получении указанного химерного белка с указанными изменениями, приведении в контакт указанного химерного белка с указанными изменениями с, по меньшей мере, одной хаотропной добавкой в водной среде в условиях и в течение времени, достаточных для того, чтобы указанный химерный белок скручивался правильно, и измерении выхода при скручивании указанного химерного белка с указанными изменениями; b) получении химерного белка, используемого на стадии (а), но без каких-либо изменений аминокислотной последовательности, описанных на стадии (а), приведении в контакт химерного белка без каких-либо изменений аминокислотной последовательности, описанных на стадии (а), с теми же хаотропными добавками, используемыми на стадии (а) в водной среде в тех же условиях и в течение того же времени, что и на стадии (а), и измерении выхода при скручивании химерного белка; и с) сравнении выхода при скручивании химерных белков, измеренных на стадии (а) и (b), соответственно, при этом выход на стадии (а), практически равный или более высокий, чем выход на стадии (Ь), указывает, что аминокислотная последовательность улучшает укладку (скручивание) предшественника инсулина.
Фиг.1А и 1В. Структуры проинсулина и зрелого инсулина с правильно образованными дисульфидными мостиками. Фигура 1А изображает структуру проинсулина. Фигура 1В изображает структуру зрелого инсулина с правильно образованными дисульфидными мостиками.
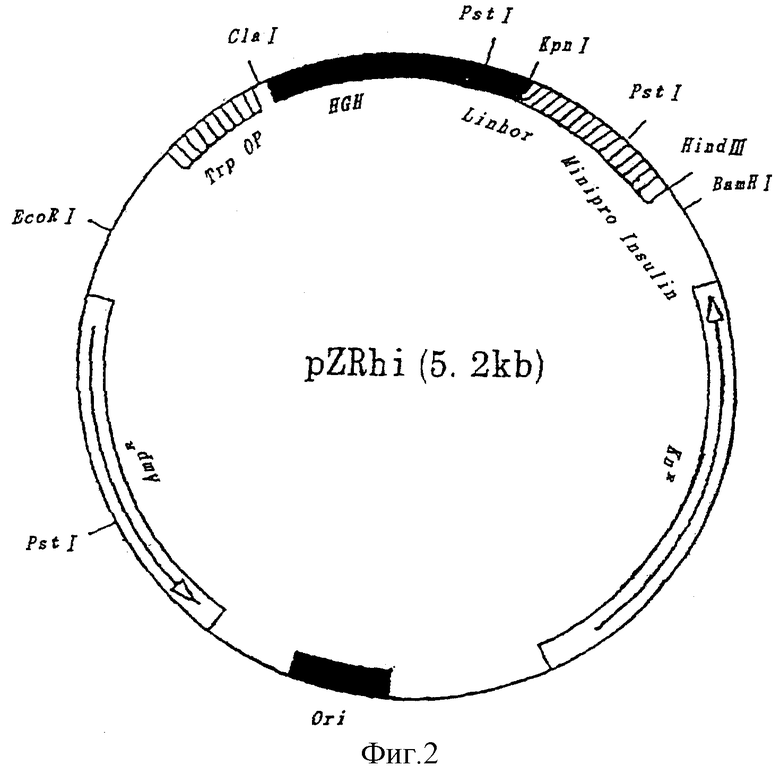
Фигура 2. Карта вектора экспрессии hGH-мини-проинсулина (SEQ ID N0:6) (pZRhi-1).
4. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Методы рекомбинантной ДНК позволяют получать человеческий проинсулин или проинсулин с аминокислотной последовательностью и/или длиной аминокислотной цепи, отличающимися от аминокислотной последовательности и/или длины аминокислотной цепи природного человеческого инсулина в микроорганизмах. Одной основной проблемой при получении человеческого проинсулина или его производных в микроорганизмах, таких как Е. Coli, является внутриклеточное расщепление (Ladisch and Kohlman, Biotechnol. Prog., 1992, 2:469-478). Кроме того, человеческий проинсулин или его производные, получаемые методом рекомбинантной ДНК в микроорганизмах, не содержат правильно связанных цистеиновых мостиков (патент США 5473049).
Процесс получения человеческого инсулина, известный до создания данного изобретения, основан на следующих операциях: 1) ферментация микроорганизмов, трансформированных вектором, экспрессирующим слитой белок, содержащий человеческий проинсулин или его производные; 2) измельчение клеток; 3) выделение слитого белка; 4) расщепление слитого белка цианогенбромидом (бромцианом); 5) выделение продукта расщепления, содержащего последовательность проинсулина; 6) окислительный сульфитолиз; 7) образование правильно связанных цистеиновых мостиков; 8) обессоливание проинсулина; 9) хроматографическая очистка проинсулина с правильно связанными цистеиновыми мостиками; 9) концентрация раствора проинсулина; 10) хроматографическая очистка концентрированного раствора проинсулина; 11) ферментативное расщепление проинсулина с целью получения человеческого инсулина; и 12) хроматографическая очистка полученного человеческого инсулина (ЕР 0055945). К недостаткам этого способа относятся многочисленные стадии и потери на стадиях очистки, что приводит к низкому выходу инсулина. На стадиях выделения слитого белка, расщепления цианогенбромидом, сульфитолиза и очистки проинсулина ожидаются потери проинсулина до 40% (ЕР 0055945). С другой стороны, выход получаемого рекомбинантным методом инсулина или его производных можно значительно увеличить, если резко сократить число необходимых стадий.
Одной целью данного изобретения явилось создание рекомбинантного способа получения человеческого инсулина с правильно связанными цистеиновыми мостиками с меньшим числом стадий и, следовательно, дающего более высокий выход человеческого инсулина. Другой целью данного изобретения было создать химерный белок, содержащий предшественник инсулина, который можно использовать в вышеуказанном способе. Еще одной целью данного изобретения было создать метод скрининга аминокислотной последовательности, которая, будучи связана с предшественником инсулина через пептидную связь, улучшала бы скручивание (укладку) предшественника инсулина.
Заявители изучили пептидные последовательности, которые не только защищают последовательность инсулина от внутримолекулярного разрушения микроорганизмом-хозяином, но также, по сравнению с существующей системой экспрессии человеческого инсулина, обладают следующими преимуществами: будучи связаны с предшественником инсулина через пептидную связь, 1) инициируют скручивание слитого предшественника инсулина; 2) облегчают растворимость слитого белка и уменьшают внутримолекулярные взаимодействия в слитых белках, таким образом позволяя скручивание слитого предшественника инсулина при высокой, имеющей промышленное значение концентрации; 3) исключают стадии расщепления бромцианом, окислительного сульфитолиза и связанные с ними стадии очистки; и 4) исключают применение высокой концентрации меркаптана или гидрофобных абсорбентов-полимеров.
Заявители неожиданно обнаружили, что связывание IMC-подобной последовательности с предшественником инсулина через один или более расщепляемый аминокислотный остаток служит осуществлению задач настоящего изобретения. IMC-подобная последовательность имеет определенные признаки IMC-последовательности, такие как содействие скручиванию нацеленного белка, более высокое процентное содержание заряженных аминокислотных остатков, чем в нацеленном белке, наличие "поляризованного" распределения заряженных аминокислотных остатков и наличие последовательности, которая, по-видимому, приспособлена специально для нацеленного белка. Однако IMC-подобная последовательность, используемая в данном изобретении, отличается от IMC-последовательности в некоторых основных аспектах. Во-первых, IMC-подобная последовательность гетерогенна с нацеленным белком, т.е. не с пропептидом нацеленного белка. Например, если предшественник инсулина является нацеленным белком, который должен скручиваться, IMC-подобная последовательность не является предшественником инсулина или его фрагментом. Кроме того, протяженность IMC-подобной последовательности составляет, примерно, от 20 до 200 аминокислотных остатков.
Далее, в противоположность тому, что утверждается в уровне предыдущей техники (Castellanos-Serra et al., FEBS Letters, 1996, 378:171-176), заявители неожиданно обнаружили, что включение в IMC-подобную последовательность одного или более расщепляемых аминокислотных остатков, идентичных одному или более расщепляемых аминокислотных остатков, которые разделяют IMC-подобную последовательность и предшественник инсулина, позволяет после скручивания удалять IMC-подобную последовательность в виде фрагментов, упрощая таким образом стадии очистки стоков (down-stream).
Для простоты описания описание изобретения разбито на представленные ниже подразделы.
4.1. Нуклеиновые кислоты, кодирующие химерный белок, описанный в Разделе 4.2.
Данное изобретение охватывает выделенную нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую химерный белок, описанный в Разделе 4.2.
В особом варианте данное изобретение предоставляет выделенную нуклеиновую кислоту, имеющую нуклеотидную последовательность, кодирующую химерный белок, имеющий последовательность SEQ ID NО:6.
В другом особом варианте данное изобретение предоставляет выделенную нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую химерный белок, имеющий последовательность SEQ ID NО:7.
В предпочтительном варианте данное изобретение охватывает выделенную ДНК с нуклеотидной последовательностью, кодирующей химерный белок, описанный в Разделе 4.2.
В другом предпочтительном варианте данное изобретение охватывает выделенную нуклеиновую кислоту с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности, кодирующей химерный белок, описанный в Разделе 4.2.
Еще в одном особом варианте данное изобретение охватывает выделенную нуклеиновую кислоту, способную гибридизоваться с нуклеотидной последовательностью, кодирующей первый, второй и третий пептидные фрагменты кодируемого ДНК химерного белка, описанного в Разделе 4.2.
Нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую химерный белок, описанный в Разделе 4.2., или любые его фрагменты, аналоги или производные, может быть получена любым(и) известным(и) в технике способом(ами). Нуклеиновую кислоту можно полностью синтезировать химическим путем. Или же нуклеиновую кислоту, кодирующую каждый фрагмент химерного белка, т.е. первый, второй или третий пептидный фрагмент, можно получать молекулярным клонированием или можно очищать от заданных клеток. Нуклеиновую кислоту, кодирующую каждый фрагмент химерного белка, можно затем химическим или ферментативным способом лигировать вместе с образованием нуклеиновой кислоты с нуклеотидной последовательностью, кодирующей химерный белок, описанный в Разделе 4.2., или его любые фрагменты, аналоги или производные.
Любая человеческая клетка потенциально может служить источником нуклеиновой кислоты для выделения нуклеиновой кислоты, кодирующей hGH. Любая клетка млекопитающего потенциально может служить источником нуклеиновой кислоты для выделения нуклеиновых кислот, кодирующих инсулин. Нуклеотидные последовательности, кодирующие инсулин, можно выделить из млекопитающего, человека, свиньи, коровы, кошачьих, птиц, лошади, псовых, а также из грызунов или приматов и т.д.
ДНК можно получать стандартными методами, известными в технике, из клонированной ДНК (например, библиотека на основе ДНК), химическими синтезами, клонированием кДНК или клонированием геномной ДНК или ее фрагментов, очищенных от заданных клеток (см., например, Sambrook et al., 1989, Molecular Cloning, A Laboratory Manual, 2d Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York; Glover, D.M. (ed), 1985, DNA Cloning: A Practical Approach, MRL Press, Ltd., Oxford, U.K. Vol. I, II). Клоны, полученные из геномной ДНК, могут содержать регуляторные и интронные области ДНК, помимо кодирующих областей; клоны кДНК будут содержать только экзоны. Вне зависимости от источника генов, осуществляют их молекулярное клонирование в соответствующий вектор с целью (размножения) культивирования гена.
При молекулярном клонировании гена из кДНК кДНК получают из тотально (полностью) клеточной РНК или мРНК хорошо известными из уровня техники способами. Гены можно также получать из геномной ДНК, где получают фрагменты ДНК (например, с помощью рестриктаз или гидродинамическим фрагментированием), некоторые из которых кодируют заданный ген. Линейные фрагменты ДНК затем могут быть разделены по размеру стандартными методами, включая, без ограничения, электрофорез на агарозном и полиакриламидном геле и колоночную хроматографию.
Когда нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую химерный белок, описанный в Разделе 4.2., или его любые фрагменты, аналоги или производные, получена, ее идентичность можно подтвердить секвенированием нуклеиновых кислот (любым методом, хорошо известным из уровня техники) и сравнением с известными последовательностями. Анализ последовательности ДНК можно осуществлять любым способом, известным из уровня техники, включая, без ограничения, метод Maxam and Gilbert (Maxam and Gilbert, 1980, Meth. Enzymol., 65:499-560), дидезокси-метод Sanger (Sanger et al., 1977, Proc. Natl. Acad. Sci. U.S.A., 74:5463), применение Т7 ДНК-полимеразы (Tabor and Richardson, Патент США 4795699), применение автоматического ДНК-секвенатора (например, Applied Biosystems, Foster City, CA) или метод, описанный в Международной заявке WO 97/15690.
Нуклеиновые кислоты, гибридизующиеся с нуклеиновой кислотой, содержащей нуклеотидную последовательность, кодирующую химерный белок, описанный в Разделе 4.2., или его любые фрагменты, аналоги или производные, могут быть выделены гибридизацией с нуклеиновой кислотой в расслабленных условиях, в строгих условиях или в условиях умеренной жесткости (см. также Shilo and Weinberg, 1981, Proc. Natl. Acad. Sci. USA, 78:6789-6792).
4.2. Химерный белок
Данное изобретение охватывает химерный белок, содержащий, от N-конца до С-конца: а) первый пептидильный фрагмент, состоящий из аминокислотной последовательности, которая, по меньшей мере, на 40% идентична домену, содержащему, по меньшей мере, 20 N-концевых аминокислот белка человеческого гормона роста (hGH), в котором процент идентичности определяется на протяжении аминокислотной последовательности, идентичной по длине домену hGH; b) остаток Arg, или остаток Lys, или второй пептидильный фрагмент, состоящий, по меньшей мере, из 2 аминокислот, причем в этом пептидильном фрагменте наибольшим С-концевым аминокислотным остатком является Arg или Lys; и с) третий пептидильный фрагмент, состоящий из аминокислотной последовательности, содержащей более двух цистеиновых (Cys) остатков, причем этот пептидильный фрагмент не является частью белка hGH.
В предпочтительном варианте данное изобретение включает химерный белок, описанный выше, в котором первый пептидильный фрагмент состоит из аминокислотной последовательности, по меньшей мере, на 60% идентичной домену hGH-белка.
В другом предпочтительном варианте данное изобретение включает химерный белок, описанный выше, в котором первый пептидильный фрагмент способен связываться с помощью антитела к hGH.
В более предпочтительном варианте данное изобретение предлагает химерный белок, описанный выше, в котором первый пептидильный фрагмент состоит из аминокислотной последовательности SEQ ID NО:l.
В другом, более предпочтительном варианте данное изобретение предлагает химерный белок, описанный выше, в котором первый пептидильный фрагмент состоит из аминокислотной последовательности SEQ ID NО:2.
В предпочтительном варианте данное изобретение включает химерный белок, описанный выше, в котором второй пептидильный фрагмент состоит из аминокислотной последовательности SEQ ID NО:3.
В особом варианте данное изобретение включает химерный белок, описанный выше, в котором третий пептидильный фрагмент является предшественником инсулина, предпочтительно человеческого происхождения.
В более предпочтительном варианте данное изобретение включает химерный белок, описанный выше, в котором предшественник человеческого инсулина способен связываться антителом против человеческого инсулина.
В другом, более предпочтительном варианте данное изобретение охватывает описанный выше химерный белок, в котором предшественник человеческого инсулина имеет аминокислотную последовательность SEQ ID NО:4.
Еще в одном, более предпочтительном варианте данное изобретение охватывает описанный выше химерный белок, в котором в предшественнике человеческого инсулина цепь В и цепь А предшественника человеческого инсулина отделены аминокислотным остатком или пептидильным фрагментом, содержащим от 2 до 34 аминокислотных остатков.
Еще в одном, более предпочтительном варианте данное изобретение охватывает описанный выше химерный белок, в котором предшественник человеческого инсулина имеет аминокислотную последовательность SEQ ID NО:5.
В наиболее предпочтительном варианте данное изобретение включает химерный белок, содержащий аминокислотную последовательность SEQ ID NО:6.
В другом наиболее предпочтительном варианте данное изобретение включает химерный белок, содержащий аминокислотную последовательность SEQ ID NО:7.
4.3. Получение химерного белка, описанного в Разделе 4.2.
Химерные белки, описанные в Разделе 4.2., и их производные, аналоги и фрагменты можно получать любым методом, известным из уровня техники, включая, без ограничения, методы рекомбинантной экспрессии, выделение из природных источников и химический синтез.
Например, химерные белки, описанные в Разделе 4.2., можно получать методом рекомбинантной экспрессии рекомбинантного белка. Для рекомбинантной экспрессии ген или область гена, кодирующую химерные белки, описанные в Разделе 4.2., встраивают в соответствующий клонирующий вектор для экспрессии в определенной клетке-хозяине. Можно использовать большое количество систем вектор-хозяин, известных из уровня техники. Возможные векторы включают, без ограничения, плазмиды или модифицированные вирусы, но векторная система должна быть совместима с используемой клеткой-хозяином. Такие векторы включают, но без ограничения, бактериофаги, такие как лямбда-производные, или плазмиды, такие как производные на основе плазмид pBR322 или pUC или вектор Bluescript (Stratagene). Инсерция в клонирующий вектор может, например, быть выполнена дотированием фрагмента ДНК в клонирующий вектор, который имеет комплементарные "липкие" концы. Однако, если комплементарные сайты рестрикции, используемые для фрагментации ДНК, отсутствуют в клонирующем векторе, концы молекул ДНК могут быть модифицированы ферментативно. Или же любой заданный сайт можно получить, лигируя нуклеотидные последовательности (линкеры) с концами ДНК; эти дотированные линкеры могут представлять собой конкретные химически синтезированные олигонуклеотиды, кодирующие (последовательности) сайты распознавания рестриктаз. Рекомбинантные молекулы можно вводить в клетки-хозяева с помощью трансформации, трансфекции, инфекции, электропорации и т.д., так что образуется много копий последовательности гена.
При альтернативном способе заданный ген можно идентифицировать и выделять после инсерции его в соответствующий клонирующий вектор методом "шотган". Перед инсерцией в клонирующий вектор можно провести обогащение заданным геном, например фракционированием по размеру.
В конкретных вариантах изобретения трансформация клеток-хозяев рекомбинантной ДНК, которая вводит в виде вставки выделенный ген, кодирующий химерные белки, описанные в Разделе 4.2., последовательностью кДНК или синтезированной ДНК делает возможным получение множества копий этого гена. Т.е. ген можно получать в больших количествах, выращивая трансформанты, выделяя рекомбинантную ДНК из трансформантов и, при необходимости, возвращая встроенный ген из выделенной рекомбинантной ДНК.
Нуклеотидная последовательность, кодирующая химерные белки, описанные в Разделе 4.2., и их производные, аналоги и фрагменты, или их функционально активные аналоги, или фрагменты, или другие производные, может вставляться в подходящий вектор экспрессии, т.е. в вектор, который содержит необходимые элементы для транскрипции и трансляции вставленной кодирующей белок последовательности. Ряд систем хозяин-вектор можно использовать для экспрессии последовательности, кодирующей белок. Эти системы включают, без ограничения, системы клеток млекопитающих, инфицированных вирусом (например, вирусом коровьей оспы, аденовирусом и т.д.); системы клеток насекомых, инфицированных вирусом (например, бакуловирусом); микроорганизмы, такие как дрожжи, содержащие дрожжевые векторы, или бактерии, трансформированные бактериофагной ДНК, плазмидной ДНК или космидной ДНК. Экспрессирующие элементы векторов изменяются по силе и специфичности. В зависимости от применяемой системы хозяин-вектор можно использовать любой из подходящих элементов транскрипции и трансляции.
Любой из описанных ранее способов инсерции фрагментов ДНК в вектор можно использовать для конструирования векторов экспрессии, содержащих химерный ген, состоящий из соответствующих последовательностей контролирующих транскрипцию/трансляцию сигнальных и кодирующих белок. Эти способы могут включать in vitro-рекомбинантную ДНК и синтетические методы и in vivo-рекомбинанты (генетическая рекомбинация). Экспрессия нуклеотидной последовательности, кодирующей химерные белки, описанные в Разделе 4.2., и их производные, аналоги и фрагменты, может регулироваться второй нуклеотидной последовательностью, так что химерные белки, описанные в Разделе 4.2., экспрессируют в хозяине, трансформированном рекомбинантной ДНК. Например, экспрессия химерных белков, описанных в Разделе 4.2., может осуществляться под контролем любого промотора/энхансера, известного из уровня техники. Промоторы, которые могут быть использованы для контроля экспрессии химерных белков, описанных в Разделе 4.2., включают, без ограничения, область раннего промотора SV40 (Bernoist and Chambon, 1981, Nature, 290:304-310), промоторы, содержащиеся в 3' длинном концевом повторе вируса саркомы Рауса (Yamamoto, et al., 1980, Cell 22:787-797), промотор герпестимидинкиназы (Wagner et al., Proc. Natl. Acad. Sci. U.S.A., 78:1441-1445), регуляторные последовательности гена металлотионеина (Brinster et al., 1982, Nature, 296:39-42), прокариотические векторы экспрессии, такие как промотор b-лактамазы (Villa-Kamaroff, et al., 1978, Proc, Natl. Acad. Sci. U.S.A., 75:3727-3731), составной промотор (tac) (DeBoer, et al., 1983, Proc. Natl. Acad. Sci. U.S.A., 80:21-25), или промотор Trp E (Hall, Invisible Frontiers-The Race to Synthesize a Human Gene, Atlantic Monthly Press, New York, 1978) см. также "Useful proteins from recombinant bacteria" in Scientific American, 1980, 242:79-94; промоторы на основе дрожжей или других грибов, такие как промотор Gal 4, промотор ADC (алкогольдегидрогеназы), промотор PGK (фосфоглицеринкиназы), промотор щелочной фосфатазы и следующие области, контролирующие транскрипцию у животных, которые проявляют тканеспецифичность и были использованы в трансгенных животных: регуляторная область гена эластазы I, которая активна в панкреатических ацинарных клетках (Swift et al., 1984, Cell 38:639-646; Ornitz et al., 1986, Cold Spring Harbor Symp. Quant. Biol. 50:399-409; MacDonald, 1987, Hepatology 7:425-515), регуляторная область гена инсулина, активная в панкреатических бета-клетках (Hanahan, 1985, Nature 315:115-122). регуляторная область гена иммуноглобулина, активная в лимфоидных клетках (Grosschedl et al., 1984, Cell 38:647-658; Adames et al., 1985, Nature 318:533-538; Alexander et al., Mol. Cell. Biol., 7:1436-1444), регуляторная область вектора на основе вируса опухоли молочной железы, лимфоцитах и тучных клетках (Leder et al., 1986, Cell 45:485-495), регуляторная область гена альбумина, активная в печени (Pinkert et al., 1987, Genes and Devel. 1:268-276), регуляторная область гена альфа-фетопротеина, активная в печени (Krumlauf et al., 1985, Mol. Cell. Biol., 5:1639-1648; Hammer et al., 1987, Science 235:53-58). регуляторная область гена альфа 1-антитрипсина, активная в печени (Kelsey et al., 1987, Genes and Devel. 1:161-171), регуляторная область гена бета-глобина, активная в миелоидных клетках (Mogram et al., 1985, Nature 315:338-340; Kollias et al., 1986, Cell 46:89-94), регуляторная область гена основного миелинового белка, активная в олигодендроцитах мозга (Readhead et al., 1987, Cell 48:703-712), регуляторная область гена легкой цепи-2 миозина, активная в скелетной мышце (Sani, 1985, Nature 314:283-286) и регуляторная область гена гонадотропин-высвобождающего гормона, активная в гипоталамусе (Mason et al., Science 234:1372-1378).
Например, можно использовать вектор, который содержит промотор, функционально связанный с нуклеиновой кислотой, кодирующей химерные белки, описанные в Разделе 4.2., один или более ориджин репликации и, при необходимости, один или более селективный маркер (например, ген устойчивости к антибиотикам). Векторы экспрессии, содержащие генсерции генов, кодирующих химерные белки, описанные в Разделе 4.2., или их фрагменты, аналоги или производные могут идентифицироваться тремя общими способами: (а) нуклеотидной гибридизацией, (b) наличием или отсутствием функции "маркерного" гена, и (с) экспрессией встроенных последовательностей. По первому способу наличие гена, кодирующего химерные белки, описанные в Разделе 4.2., встроенного в экспрессирующий вектор, можно определить гибридизацией нуклеиновых кислот с применением зондов, содержащих последовательности, гомологичные встроенному гену, кодирующему химерные белки, описанные в Разделе 4.2. По второму способу систему рекомбинантный вектор/хозяин можно идентифицировать и можно проводить отбор, основываясь на наличии или отсутствии определенных функций "маркерного" гена (например, активность тимидинкиназы, устойчивость к антибиотикам, фенотип в результате трансформации, образование телец включения в бакуловирусе и т.д.), обусловленных инсерцией гена, кодирующего химерные белки, описанные в Разделе 4.2., в векторе. Например, если ген, кодирующий химерные белки, описанные в Разделе 4.2., вставлен в последовательность "маркерного гена" вектора, рекомбинанты, содержащие инсерт, кодирующий химерные белки, описанные в Разделе 4.2., могут быть идентифицированы по отсутствию функции "маркерного" гена. По третьему способу рекомбинантные экспрессирующие векторы можно идентифицировать, анализируя продукты химерных белков, экспрессируемых рекомбинантом. Такие анализы могут основываться, например, на физических и функциональных свойствах химерных белков, описанных в Разделе 4.2., в in vitro испытуемых системах, например, на связывании с антителом против hGH или против инсулина.
Когда определенная рекомбинантная ДНК идентифицирована и выделена, то в технике известно несколько способов, которые можно использовать для ее культивирования. Когда установлена подходящая система хозяина и условия выращивания, рекомбинантные экспрессирующие векторы можно культивировать и получать количественно. Как объяснялось выше, экспрессирующие векторы, которые можно использовать, включают, без ограничения, следующие векторы или их производные; векторы на основе вирусов животных и человека, таких как вирус коровьей оспы или аденовирус, векторы на основе вирусов насекомых, таких как бакуловирус; дрожжевые векторы, бактериофагальные векторы (например, лямбда) и векторы плазмидной и космидной ДНК (перечислены немногие).
Кроме того, можно выбирать штамм клеток-хозяев, который модулирует экспрессию встроенных последовательностей или модифицирует и процессирует генный продукт специфическим заданным образом. Экспрессия при использовании определенных промоторов может быть повышена в присутствии некоторых индукторов; таким образом, экспрессию полученного методом рекомбинантной ДНК химерного белка, описанного в Разделе 4.2., можно регулировать. Более того, у различных клеток-хозяев имеются характеристические и специфические механизмы трансляционного и посттрансляционного процессирования и модификации (например, гликозилирование, фосфорилирование) белков. Можно выбрать соответствующие клеточные линии или системы хозяев, чтобы гарантировать заданную модификацию и процессирование чужеродного экспрессирующего белка. Например, экспрессию в бактериальной системе можно использовать для получения негликозилированного ядерного белкового продукта. Экспрессия в дрожжах дает гликозилированный продукт. Экспрессию в клетках млекопитающих можно использовать, чтобы гарантировать "нативное" гликозилирование гетерологичного белка. Кроме того, различные системы экспрессии вектор-хозяин могут в разной степени влиять на реакции процессирования.
Можно осуществлять клонирование и экспрессию как ДНК, так и геномных последовательносьей.
Химерный белок, описанный в Разделе 4.2., или его фрагменты, аналоги или производные можно также выделять и очищать стандартными методами, включая хроматографию (например, колоночную, ионообменную, аффинную и хроматографию по размеру молекул), центрифугирование, различную растворимость или другой стандартный способ очистки белков. Функциональные свойства можно определять с помощью любого подходящего метода анализа.
Нуклеотидную последовательность, кодирующую химерный белок, описанный в Разделе 4.2, или его фрагменты, аналоги или производные, можно подвергать мутации in vitro или in vivo, для создания и/или деструкции последовательностей (сайтов) трансляции, инициации или терминации или для изменений в кодирующих областях. Можно использовать любые методы мутагенеза, известные из уровня техники, включая, без ограничения, in vitro сайт-направленный мутагенез (Hutchinson et al., 1978, J. Biol. Chem. 253:6551). использование линкеров TAB (Pharmacia), содержащие мутации PCR-праймеры и т.д.
Экспериментальная работа, связанная с мутагенезом, состоит, во-первых, из сайт-направленного мутагенеза с последующим фенотипическим тестированием измененного генного продукта. Некоторые из самых обычно применяемых протоколов сайт-направленного мутагенеза используют преимущественно векторы, которые могут дать одноцепочечные, а также двухцепочечные ДНК, если это необходимо. Обычно протокол мутагенеза с такими векторами следующий. Синтезируют мутагенный праймер, т.е. праймер, комплементарный изменяемой последовательности, но состоящей из одного или малого числа измененных, введенных или делегированных оснований. Праймер удлиняют in vitro при использовании ДНК-полимеразы, и после нескольких дополнительных манипуляций теперь уже двухцепочечную ДНК трансфицируют в бактериальные клетки. Далее различными методами идентифицируют заданную мутантную ДНК и заданный белок очищают от клона, содержащего мутантную последовательность. Для более протяженных последовательностей часто требуются дополнительные стадии клонирования, потому что в этих векторах протяженные инсерты (более 2 тыс.п.о.) неустойчивы. Протоколы известны специалисту в данной области техники, а наборы для сайт-направленного мутагенеза в больших количествах выпускаются биотехнологическими компаниями - например, Amersham Life Science, Inc. (Arlington Heights, IL) и Stratagene Cloning Systems (LaJolla, CA).
Кроме того, химерный белок, описанный в Разделе 4.2., или его фрагменты, аналоги или производные, можно синтезировать химически (см., например, Clark-Lewis et al., 1991, Biochem. 30:3128-3135 и Merrifield, 1963, J. Amer. Chem. Soc. 85:2149-2156). Например, химерные белки, описанные в Разделе 4.2., или их фрагменты, аналоги или производные можно синтезировать твердофазным методом, отщепить от полимеров и очистить высокоэффективной жидкостной препаративной хроматографией (например, см. Creighton, 1983, Proteins, Structures and Molecular Principles, W.H. Freeman and Co., N. Y., pp.50-60). Химерный белок, описанный в Разделе 4.2., или его фрагменты, аналоги или производные можно также синтезировать, применяя синтезатор пептидов. Строение синтетических пептидов может быть подтверждено анализом аминокислот или секвенированием (например, расщепление по Эдману; см. Creighton, 1983, Proteins, Structures and Molecular Principles, W.H. Freeman and Co., N. Y., pp.34-49).
Химерные белки, описанные в Разделе 4-2., или их фрагменты, аналоги или производные можно синтезировать полностью с помощью секвенциального добавления аминокислотных остатков или же в качестве субкомпонентов фрагментов, которые можно составлять, применяя методы, хорошо известные из уровня техники, такие как, например, конденсация фрагментов (Shin et al., 1992, Biosci. Biotech. Biochem. 56:404-408; Nyfeler et al., 1992, Peptides, Proc. 12th Amer. Per. Soc., Smith and Rivier (eda), Leiden, pp. 661-663; и Nokihara et al., 1990, Protein Research Foundation, Yanaihara (ed), Osaka, pp. 315-320).
В менее предпочтительном варианте изобретения химерные белки, описанные в Разделе 4.2., или их фрагменты, аналоги или производные можно получать протеолизом белка с последующей очисткой с применением стандартных методов, таких, например, как вышеописанные (например, иммуноаффинная очистка).
4.4. Получение правильно скрученного предшественника инсулина
Данное изобретение охватывает способ получения правильно скрученного первого химерного белка, содержащего предшественник инсулина, приведением в контакт неправильно скрученного второго химерного белка, содержащего предшественник инсулина, причем указанный второй химерный белок, содержащий предшественник инсулина, состоит из подобного внутримолекулярному "наставнику" (IMC-подобного) пептидного фрагмента, отделенного от предшественника инсулина одним или более расщепляемым аминокислотным остатком с, по меньшей мере, одной хаотропной добавкой в водной среде; при этом указанный IMC-подобный пептидный фрагмент: а) содержит, примерно, от 20 до 200 аминокислотных остатков; b) не является предшественником инсулина или его фрагментом; и с) улучшает укладку предшественника инсулина, так что выход правильно скрученного первого, содержащего предшественник инсулина, химерного белка в том случае, когда неправильно скрученный второй содержащий предшественник инсулина, химерный белок, контактирует с хаотропной добавкой, выше, чем выход правильно скрученного предшественника инсулина в том случае, когда неправильно скрученный предшественник инсулина, не содержащий IMC-подобного фрагмента, контактирует с той же самой хаотропной добавкой.
Употребляемый в данном описании термин "предшественник человеческого инсулина" относится к молекуле, которая 1) содержит А цепь и В цепь человеческого инсулина или их аналоги, производные и фрагменты, 2) содержит шесть цистеиновых остатков, 3) содержит уходящий связывающий фрагмент, соединенный с А цепью и В цепью инсулина, и 4) способна связываться с антителом против человеческого инсулина. Примеры предшественника человеческого инсулина включают, без ограничения, предшественники инсулина, описанные в Ladisch and Kohlmann, Biotechnol. Prog., 1992, 8:469-478; Thim et al., Proc. Natl. Acad. Sci. USA, 1986, 83:6766-6770; Патент США 5473049; 5457066; и ЕР 0347781 B1.
Термин "правильно скрученный" предшественник человеческого инсулина или химерный белок, содержащий предшественник человеческого инсулина, относится к молекуле, которая у предшественника человеческого инсулина имеет такие конформацию и дисульфидные мостики, которые обнаружены в природном биологически активном человеческом инсулине, т.е. образуются дисульфидные мостики между а) А-6 и А-11, b) А-7 и В-7, с) А-20 и В-19. Термин "неправильно скрученный" предшественник человеческого инсулина или химерный белок, содержащий предшественник инсулина, относится к молекуле, у которой отсутствует конформация, дисульфидные мостики, обнаруженные в природном биологически активном человеческом инсулине, или и то и другое.
В предпочтительном варианте данное изобретение охватывает способ получения правильно скрученного содержащего предшественник инсулина химерного белка, описанного выше, причем предшественник инсулина "человеческого происхождения". Также предпочтительно, когда предшественник человеческого инсулина может связываться с антителом против человеческого инсулина. Еще предпочтительно, когда предшественник человеческого инсулина содержит аминокислотную последовательность SEQ ID NО:4. Также предпочтительным в предшественнике человеческого инсулина является, когда В цепь и А цепь предшественника человеческого инсулина отделены аминокислотным остатком или пептидильным фрагментом, содержащим от 2 до 34 аминокислотных остатков. Более предпочтительно, когда предшественник человеческого инсулина имеет аминокислотную последовательность SEQ ID NО:5.
В предпочтительном варианте данное изобретение включает способ получения правильно скрученного содержащего предшественник инсулина химерного белка, описанного выше, в котором IMC-подобный пептидильный фрагмент имеет более высокое процентное содержание заряженных аминокислотных остатков, чем предшественник инсулина. Также предпочтительно, когда в IMC-подобном пептидильном фрагменте N-концевая половина содержит больше положительно заряженных аминокислотных остатков, чем отрицательно заряженных аминокислотных остатков, а С-концевая половина содержит больше отрицательно заряженных аминокислотных остатков, чем положительно заряженных аминокислотных остатков. Еще предпочтительно, когда IMC-подобный пептидильный фрагмент состоит из аминокислотной последовательности, которая, по меньшей мере, на 40% идентична домену, содержащему, по меньшей мере, первые 20 N-концевых аминокислот белка человеческого гормона роста (hGH), причем процент идентичности в нем определяют на протяжении аминокислотной последовательности, идентичной по длине домену hGH. Также предпочтительно, когда IMC-подобный пептидильный фрагмент состоит из аминокислотной последовательности, по меньшей мере, на 60% идентичной домену, содержащему, по меньшей мере, первые 20 N-концевых аминокислот белка человеческого гормона роста (hGH). Кроме того, предпочтительным является, когда IMC-подобный фрагмент способен связываться антителом против hGH. Более предпочтительно, когда IMC-подобный пептидильный фрагмент имеет последовательность SEQ ID NО:l. Также более предпочтительно, когда IMC-подобный пептидильный фрагмент состоит из аминокислотной последовательности SEQ ID NО:2.
В предпочтительном варианте данное изобретение включает способ получения правильно скрученного содержащего предшественник инсулина химерного белка, описанного выше, в котором расщепляемым аминокислотным остатком является остаток Arg или Lys. Также предпочтительно, когда расщепляемые аминокислотные остатки состоят из аминокислотной последовательности SEQ ID NО:3.
В особом варианте данное изобретение включает способ получения правильно скрученного содержащего предшественник инсулина химерного белка, описанного выше, в котором в неправильно скрученном содержащем предшественник инсулина химерном белке пептидильный фрагмент локализован на N-конце указанного химерного белка. В другом таком особом варианте изобретения IMC-подобный пептидильный фрагмент локализован на С-конце указанного химерного белка. Еще в одном особом варианте изобретения IMC-подобный пептидильный фрагмент локализован между В цепью и А цепью предшественника инсулина.
В предпочтительном варианте данное изобретение охватывает способ получения правильно скрученного содержащего предшественник инсулина химерного белка, описанного выше, в котором IMC-подобный пептидильный фрагмент содержит один или более расщепляемый аминокислотный остаток, идентичный одному или более расщепляемому аминокислотному остатку, который разделяет IMC-подобный пептидильный фрагмент и предшественник инсулина во втором содержащем предшественник инсулина химерном белке. Более предпочтительно, когда расщепляемым аминокислотным остатком является остаток Arg или Lys.
В наиболее предпочтительном варианте данное изобретение включает способ получения правильно скрученного содержащего предшественник инсулина химерного белка, описанного выше, в котором неправильно скрученный содержащий предшественник инсулина химерный белок состоит из аминокислотной последовательности SEQ ID NО:6. Также наиболее предпочтительно, когда неправильно скрученный второй содержащий предшественник инсулина химерный белок состоит из аминокислотной последовательности SEQ ID NО:7.
Хаотропные добавки представляют собой соединения, которые разрывают водородные связи в водных растворах. В конкретном варианте данное изобретение охватывает способ получения правильно скрученного содержащего предшественник инсулина химерного белка, описанного выше, в котором хаотропная добавка выбирается из группы, состоящей из гидрохлорида гуанидина, этиленкарбоната, тиоцианата, диметилсульфоксида и мочевины. Предпочтительным хаотропным агентом является мочевина. Более предпочтительно, когда мочевина присутствует в концентрациях около 2,0-8,0 М. Наиболее предпочтительно, когда мочевина присутствует в концентрациях около 3,0-6,0 М.
В особом варианте данное изобретение включает способ получения правильно скрученного содержащего предшественник инсулина химерного белка, описанного выше, в котором неправильно скрученный второй содержащий предшественник инсулина химерный белок контактирует, по меньшей мере, с одной хаотропной добавкой в водной среде при рН, примерно, от 8,0 до 10,5 и при концентрации неправильно скрученного второго содержащего предшественник инсулина химерного белка, примерно, от 0,05 г до 15,0 г на литр. Предпочтительно, когда рН поддерживается в интервале, примерно, от 9,0 до 10,0. Также предпочтительно, когда неправильно скрученный второй содержащий предшественник инсулина химерный белок присутствует в концентрации, примерно, от 0,5 до 5,0 г на литр. Более предпочтительно, когда концентрация неправильно скрученного второго содержащего предшественник инсулина химерного белка составляет примерно, от 2,0 до 3,0 г на литр.
Меркаптаны представляют собой соединения, растворимые в воде и содержащие, по меньшей мере, одну -SH-группу. Еще в одном конкретном варианте данное изобретение включает способ получения правильно скрученного содержащего предшественник инсулина вышеописанного химерного белка, дополнительно содержащий приведение в контакт неправильно скрученного второго содержащего предшественник инсулина химерного белка, с таким количеством меркаптана, которое дает менее 5-SH-радикалов меркаптана на остаток цистеина неправильно скрученного второго содержащего предшественник инсулина химерного белка. Еще в одном конкретном варианте данного изобретения неправильно скрученный второй содержащий предшественник инсулина химерный белок совместно контактирует с меркаптаном и хаотропной добавкой. Еще в одном конкретном варианте данного изобретения неправильно скрученный второй содержащий предшественник инсулина химерный белок контактирует с меркаптаном и хаотропной добавкой последовательно. Предпочтительно, когда количество меркаптана такое, которое дает примерно от 0,07 до 1,0 -SH-радикала меркаптана на цистеиновый остаток неправильно скрученного второго содержащего предшественник инсулина химерного белка. Также предпочтительно, когда меркаптан выбирают из группы, состоящей из дитиотреитола, дитиоэритрола, 2-меркаптоэтанола, цистеина, метилтиогликолята, 3-меркапто-1,2-пропандиола и 3-меркаптопропионовой кислоты. Более предпочтительно, когда меркаптан представляет собой 2-меркаптоэтанол.
Еще в одном конкретном варианте данное изобретение охватывает способ получения правильно скрученного содержащего предшественник инсулина описанного выше химерного белка, дополнительно включающий отделение правильно скрученного первого содержащего предшественник инсулина химерного белка от неправильно скрученного второго содержащего предшественник инсулина химерного белка. Предпочтительно первый содержащий предшественник инсулина химерный белок отделяют от второго содержащего предшественник инсулина химерного белка ультрафильтрацией. Более предпочтительно, когда ультрафильтрацию проводят при рН, примерно, от 8,0 до 11,0. Наиболее предпочтительно, когда ультрафильтрацию проводят при рН, примерно, от 9,0 до 10,0.
Еще в одном конкретном варианте данное изобретение охватывает правильно скрученный содержащий предшественник инсулина химерный белок, полученный вышеописанным способом.
4.5. Скрининг аминокислотной последовательности, улучшающей укладку предшественника инсулина
Данное изобретение охватывает испытание с целью скрининга аминокислотной последовательности на способность улучшать укладку предшественника инсулина, заключающееся в: (а) изменении аминокислотной последовательности первого пептидильного фрагмента химерного белка, описанного в Разделе 4.2., получении указанного химерного белка с указанными изменениями, приведении в контакт указанного химерного белка с указанными изменениями, по меньшей мере, с одной хаотропной добавкой в водной среде в таких условиях и в течение такого времени, что указанный химерный белок скручивается правильно, и в определении выхода при укладке (скручивания) указанного химерного белка с указанными изменениями; (b) получении того же самого химерного белка, который используется на стадии (а), но без каких-либо изменений аминокислотной последовательности, описанных на стадии (а), контактировании химерного белка, не содержащего каких-либо изменений аминокислотной последовательности, описанных на стадии (а), приведении в контакт химерного белка, не содержащего каких-либо изменений аминокислотной последовательности, описанных на стадии (а), с той(теми) же самой(ыми) хаотропной(ыми) добавкой(ами), применяемой(ыми) на стадии (а), в водной среде в тех же условиях и в течение того же времени, что и на стадии (а), и определении выхода при укладке химерного белка; и (с) сравнении выхода в процессе укладки химерных белков на стадиях (а) и (b), соответственно, при этом выход на стадии (а), практически равный или более высокий, чем выход на стадии (b) указывает, что аминокислотная последовательность улучшает укладку предшественника инсулина.
Аминокислотную последовательность первого пептидильного фрагмента, описанного в Разделе 4.2., можно изменить любым методом, известным для мутагенеза из уровня техники, предпочтительно методами мутагенеза, описанными в Разделе 4.3.
В предпочтительном варианте вышеуказанного теста химерный белок состоит из аминокислотной последовательности SEQ ID NO:7.
В другом предпочтительном варианте вышеуказанного теста химерный белок состоит из аминокислотной последовательности SEQ ID NO: 7.
Еще в одном предпочтительном варианте вышеуказанного теста хаотропной добавкой является мочевина.
Еще в одном предпочтительном варианте вышеуказанного теста тест дополнительно включает приведение в контак химерного белка, на стадии (а) и (b), соответственно, с таким количеством меркаптана, которое дает менее 5 -SH-радикалов меркаптана на цистеиновый остаток химерного белка. Более предпочтительно, когда меркаптаном является 2-меркаптоэтанол.
В особом варианте данное изобретение охватывает продукт вышеописанного испытания.
5. ПРИМЕР
Синтезируют химическим путем фрагмент ДНК, кодирующий hGH-мини-проинсулин, состоящий из аминокислотной последовательности SEQ ID NО:6. Фрагмент ДНК клонируют в бактериальный экспрессирующий вектор под контролем промотора Тrр. Экспрессирующий вектор, содержащий hGH-мини-проинсулин, трансформируют в Е. Coli штамм PR1 и рекомбинантные клетки культивируют в средах М9-СА в присутствии микроэлементов. Слитые белки hGH-мини-проинсулина выделяют из телец включения и скручивание проводят в таких условиях, чтобы в скрученных слитых белках hGH-мини-проинсулина образовывались дисульфидные мостики, как они бы образовывались в правильно скрученном человеческом проинсулине, т.е. дисульфидные мостики А6-А11, А7-В7 и А20-В19. Скрученные слитые белки hGH-мини-проинсулина отделяют от нескрученных белков ультрафильтрацией при 100 кД. Выделенные, правильно скрученные слитые белки hGH-мини-проинсулина подвергают гидролизу трипсином с образованием правильно скрученного Arg(B31)-человеческий инсулина. Arg(B31)-чeлoвeчecкий инсулин очищают с помощью катионообменной хроматографии примерно до 90%-ной чистоты. Очищенный Arg(B31)-человеческий инсулин затем гидролитически расщепляют карбоксипептидазой В с образованием правильно скрученного человеческого инсулина, который затем очищают обращенно-фазовой ВЭЖХ. Полученный таким образом инсулин охарактеризован секвенированием по N-концу, определением молекулярного веса и пептидным картированием.
5.1. Конструкция вектора экспрессии hGH-мини-проинсулина
Фрагмент ДНК, кодирующий hGH-мини-проинсулин, состоящий из аминокислотной последовательности SEQ ID NО:6, синтезируют химическим путем по методике, описанной Gan et al., Gene, 1989, 79:159-166. В синтезированный фрагмент ДНК вводят 5' Cla I-сайт и 3' Hind III-сайт. Короче говоря, фрагмент от 5' Cla I до 3' Крn I, который разрезает нуклеотидную последовательность, кодирующую аминокислтные остатки 51 и 52 последовательности SEQ ID NО:6, и фрагмент от 5' Крn I до 3' Hind III синтезируют химически и субклонируют в вектор pUCIS соответственно. Затем фрагмент ДНК, кодирующий полную аминокислотную последовательность SEQ ID NО:6 пересевают в модифицированный вектор рАТН2 так, чтобы экспрессия hGH-мини-проинсулина была под контролем промотора Тrр и последовательности SD. Образующийся вектор, pZRhi-1 (фиг.2) используют для экспрессии слитого белка hGH-мини-проинсулина.
5.2. Экспрессия слитого белка hGH-мини-проинсулина
Векторы экспрессии слитого белка hGH-мини-проинсулина трансформируют в Е. Coli штамм RR1 К12 W3110. Трансформированные клетки Е. Coli культивируют в средах М9-СА в присутствии микроэлементов. Уровень экспрессии слитых белков hGH-мини-проинсулина определяют как в колбе качалки, так и в ферментере. В обоих случаях наблюдается высокий уровень экспрессии, достигая 20-25% тотальных белков Е. Coli.
5.3. Переукладка слитого белка hGH-мини-проинсулина
Слитые белки hGH-мини-проинсулина экспрессируют в нерастворимой форме, называемой "тельца включения". Для высвобождения телец включения клетки Е. Coli измельчают в гомогенизаторе высокого давления при 800 бар (80000 кПа). Клеточный дебрис и растворимые белки клетки Е. Coli удаляют центрифугированием при 10000 об/мин. Осадок телец включения, содержащий слитые белки hGH-мини-проинсулина промывают 3 раза водой. Образующиеся пеллеты телец включения, в которых слитые белки hGH-мини-проинсулина имеют, примерно, 90%-ную чистоту, используют в качестве исходного материала для скручивания. Тельца включения растворяют в 8 М мочевине, рН 10,4 при концентрации слитого белка hGH-мини-проинсулина 20-30 мг/мл в присутствии от 2 до 6 мМ - меркаптоэтанола. Нерастворимый материал удаляют центрифугированием. Надосадочную жидкость разводят в 10 раз раствором с низкой концентрацией мочевины так, чтобы достичь конечной концентрации мочевины от 3 до 6 М, рН 9-10 и меркаптоэтанола от 0,2 до 0,6 мМ. Стандартную операцию укладки проводят при 4°С при концентрации мочевины 3,2 М, рН 9,3. Процесс укладки (скручивания) контролируют С4 обращенно-фазовой ВЭЖХ в градиенте 30-47% ацетонитрила в 0,1% фосфатном буфере. В таком хроматографическом режиме время удерживания правильно скрученного hGH-мини-проинсулина составляет около 23 мин. Операцию укладки (скручивания) можно завершить за 24 часа. Выход при переукладке около 70%.
Смесь после укладки фракционируют ультрафильтрацией при 100 кД. Правильно скрученные слитые белки hGH-мини-проинсулина, обнаруженные во фракциях фильтрата, концентрируют с помощью 10 кД-ультрафильтрационной системы. Мочевину удаляют водой при рН 3,5. Выход на стадиях ультрафильтрации выше 85%.
5.4 Триптический гидролиз (трипсинолиз) правильно скрученного hGH-мини-проинсулина после переукладки
При проведении триптического гидролиза концентрация правильно скрученного слитого белка hGH-мини-проинсулина составляет около 10-12 мг/мл, предпочтительно 10 мг/мл. Соотношение трипсина и слитого белка hGH-мини-проинсулина находится в интервале, примерно, от 1:60 до 1:250, предпочтительно равно 1:100. Значение рН поддерживается в интервале примерно от 10 до 11, предпочтительно 10,8. Гидролиз проводят при 4°С, примерно, от 1 до 5 часов, предпочтительно в течение 3,5 часов. Расщепление (гидролиз) прекращают, доводя рН до 3,5 с помощью фосфатного буфера. Анализ с помощью обращенно-фазовой ВЭЖХ показывает, что выход на этой стадии расщепления выше 95%. При рН выше 10 трипсин действует на следующие остатки Arg: остаток Arg между цепями В и А человеческого мини-проинсулина, остаток Arg между фрагментом hGH и фрагментом мини-проинсулина, остатки Arg во фрагменте hGH. Гидролиз трипсином дает несколько мелких частей hGH-фрагмента и человеческий инсулин с дополнительным (лишним) Arg на С-конце В цепи, который называют Arg(B31)-человеческий инсулин. Остаток Arg(B22) человеческого инсулина не расщепляется в вышеуказанных условиях, по-видимому, вследствие стерических препятствий, обусловленных (данной) трехмерной структурой.
Arg(B31)-человеческий инсулин очищают катионообменной хроматографией с NaCl в присутствии 10 мМ нитратного буфера в качестве растворителя. Очищенный Arg(B31)-человеческий инсулин имеет чистоту более 90%.
5.5. Превращение Аrg(В31)-человеческого инсулина в человеческий инсулин
Остаток Arg(B31) на С-конце Arg(B31)- человеческого инсулина удаляют с помощью карбоксипептидазы В. При этом концентрация правильно скрученного Arg(B31)-человеческого инсулина составляет около 10 мг/мл. Соотношение карбоксипептидазы В и Arg(B31)- человеческого инсулина поддерживается около 1:1000. Расщепление (гидролиз) протекает при 37°С в течение, примерно, 1 часа в 50 мМ буфере Tris-HCl pH 8,0. Гидролиз прекращают, доводя pH до 3,5 с помощью фосфатного буфера. Выход человеческого инсулина более 99%.
5.6. Очистка человеческого инсулина
Человеческий инсулин, полученный гидролитическим разложением с помощью карбоксипептидазы В, наносят на колонку С8 для обращенно-фазовой ВЭЖХ, которую уравновешивают 0,1% фосфатным буфером, pH 3,0. Человеческий инсулин элюируют ацетонитрилом в градиенте 17-35% в 0,1% фосфатном буфере, pH 3,0. Инсулиновые фракции собирают и добавляют уксусную кислоту до достижения концентрации от 0,125 до 0,2 М, pH 6,0. Полученный таким способом инсулин кристаллизуется при 4°С. Чистота человеческого инсулина превышает 99%.
5.7. Характеристика очищенного человеческого инсулина
Первые 15 N-концевых аминокислот очищенного человеческого инсулина и WHO стандартного человеческого инсулина определяют стандартным расщепление по Эдману. N-концевые последовательности как А, так и В цепи очищенного человеческого инсулина идентичны соответствующим последовательностям WHO стандартного человеческого инсулина.
Молекулярный вес очищенного человеческого инсулина и молекулярный вес WHO стандартного человеческого инсулина определяют масс-спектрометрией на VG Platform. Значение M/Z обоих образцов равно 5807,7.
Как очищенный человеческий инсулин, так и WHO стандартный человеческий инсулин гидролитически расщепляют протеазой V8. Фрагменты, образующиеся при гидролизе, анализируют ClS-обращенно-фазовой ВЭЖХ. Оба образца дают идентичный тип пептидного картирования (см. Thim et al., Genetics and Molecular Biology of Industrial Microorganisms, Hershberger et al., Ed. American Society for Microbiology, 1989, p. 322-328).
Данное изобретение не ограничивается в объеме депонированным микроорганизмом или особыми вариантами, представленными в данном описании. В действительности различные модификации изобретения в дополнение к представленным в данном описании будут очевидны специалистам в данной области техники из предшествующего описания и прилагаемых фигур. Предполагается, что такие модификации входят в объем прилагаемой формулы изобретения.






| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДСТВО БЕЛКОВ | 2005 |
|
RU2429243C2 |
| ПОЛУЧЕНИЕ БИОЛОГИЧЕСКИ АКТИВНЫХ БЕЛКОВ | 2007 |
|
RU2441911C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНСУЛИНА ИЛИ ПРОИЗВОДНЫХ ИНСУЛИНА С ПРАВИЛЬНО СОЕДИНЕННЫМИ ЦИСТИНОВЫМИ МОСТИКАМИ | 2002 |
|
RU2302882C2 |
| УСОВЕРШЕНСТВОВАННЫЙ СПОСОБ ПОЛУЧЕНИЯ ПРЕДШЕСТВЕННИКА ИНСУЛИНА С ПРАВИЛЬНО СОЕДИНЕННЫМИ ЦИСТИНОВЫМИ МОСТИКАМИ | 1998 |
|
RU2205836C2 |
| ПРЕДШЕСТВЕННИК ИНСУЛИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2000 |
|
RU2283846C2 |
| ГИБРИДНЫЙ БЕЛОК, СОДЕРЖАЩИЙ ФРАГМЕНТЫ ФЛУОРЕСЦЕНТНЫХ БЕЛКОВ, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2801248C2 |
| МОДИФИЦИРОВАННЫЙ СИГНАЛЬНЫЙ ПЕПТИД ЭНТЕРОТОКСИНА - II E. COLI И МИКРООРГАНИЗМ, ЭКСПРЕССИРУЮЩИЙ БЕЛОК СЛИЯНИЯ УПОМЯНУТОГО ПЕПТИДА С ГЕТЕРОЛОГИЧНЫМ БЕЛКОМ | 1999 |
|
RU2198179C2 |
| СКОНСТРУИРОВАННЫЕ ПЕСТИЦИДНЫЕ БЕЛКИ И СПОСОБЫ КОНТРОЛЯ ВРЕДИТЕЛЕЙ РАСТЕНИЙ | 2017 |
|
RU2772947C2 |
| СПОСОБ СНИЖЕНИЯ СТЕПЕНИ ГЛИКОЗИЛИРОВАНИЯ БЕЛКОВ, СПОСОБЫ И БЕЛКИ | 2010 |
|
RU2575607C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ СЕКРЕЦИИ ГЕТЕРОЛОГИЧНЫХ ПОЛИПЕПТИДОВ | 2015 |
|
RU2748026C2 |
Изобретение относится к биотехнологии и может быть использовано для получения правильно скрученного, содержащего предшественник инсулина химерного белка. Химерный белок содержит пептидильный фрагмент протяженностью 20-92 аминокислот, который на 60% идентичен первым 20 N-аминокислотным остаткам SEQ ID N:1 или SEQ ID N:2, и пептидильный фрагмент предшественника инсулина, содержащий цепь А и цепь В человеческого инсулина. С-конец первого пептидильного фрагмента связан с N-концом пептидильного фрагмента предшественника инсулина с помощью Arg или Lys. Инсулин получают путем контактирования экспрессированного химерного белка с хаотропным агентом или меркаптаном. Изобретение позволяет получать предшественник инсулина в биоактивной конформации, а также скринировать пептидильный фрагмент, способный улучшать укладку предшественника инсулина. 3 н. и 13 з.п. ф-лы, 3 ил.
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| RU 2062301 С1, 20.06.1996 | |||
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОЛОГИЧНОГО ПОЛИПЕПТИДА В ЭУКАРИОТИЧЕСКИХ МИКРООРГАНИЗМОВ | 1986 |
|
RU2091490C1 |
| US 5422110 А, 06.06.1995. | |||
Авторы
Даты
2004-10-27—Публикация
1998-03-31—Подача