Данное изобретение в основном относится к способу модуляции иммунного ответа на антиген у млекопитающего, основанному на использовании имплантируемого устройства, которое контролируемым образом обеспечивает воздействие клеток иммунной системы на антиген. В результате создания искусственного окружения, имитирующего структуру и функциональную роль лимфатического узла, и благодаря манипулированию биологической доступностью антигена, находящегося внутри устройства, может быть индуцирован сильный ответ, направленный против антигена, или может быть подавлен уже существующий иммунный ответ.
Индукция иммунного ответа на антиген и сила этого ответа зависят от сложного взаимодействия между антигеном, различными типами иммунных клеток и дополнительно стимулирующими молекулами, включая цитокины и хемокины. Продолжительность и степень воздействия антигена на иммунные клетки и дополнительно стимулирующее окружение далее модулируют иммунный ответ. Внутри организма эти различные типы клеток и дополнительные факторы обычно сосредоточены в проксимальной части лимфоидной ткани, а именно в лимфатических узлах. Из множества типов клеток, вовлеченных в этот процесс, антигенпредставляющие клетки, такие как макрофаги и дендритные клетки, транспортируют антиген от периферии к региональной организованной лимфоидной ткани, процессируют антиген и представляют Т-клеткам антигенные пептиды, а также секретируют дополнительно стимулирующие молекулы. Таким образом, если антиген в результате локального распространения достигает лимфоидного органа, при оптимальном градиенте концентраций и при соответствующем окружении, в которое входят дополнительно стимулирующие молекулы, в собирающем лимфатическом узле происходит индукция ответа.
При таком способе воздействия чужеродный антиген, введенный в организм, например, посредством вакцинации, может либо вызывать, либо не вызывать развитие желаемого сильного иммунного ответа. К антигенам, которые используются для вакцинации, относятся аттенюированные или инактивированные бактерии или вирусы и их компоненты. Успех вакцинации отчасти зависит от типа и количества антигена, положения места иммунизации и иммунного статуса в момент вакцинации. Не все антигены одинаково иммуногенны, и для слабо иммуногенных антигенов существует несколько альтернативных возможностей увеличить эффективность иммунизации. Тогда как для экспериментальных животных существует множество приемов усиления развития иммунного ответа, в частности конъюгация антигена с более иммуногенным белком-носителем или биомолекулой (например, гемоцианином моллюска "блюдечко", keyhole limpet) или использование адъювантов, таких как адъювант Фрейнда или квасцы, при вакцинации человека такие способы и адъюванты не пригодны. Таким образом, такие способы не пригодны для пациентов в случаях многочисленных заболеваний, которые могли бы быть предотвращены благодаря проведению вакцинации до воздействия инфекционного агента, или в случае использования вакцины терапевтического назначения, которая может индуцировать развитие эффективного иммунного ответа на уже присутствующий агент, который является причиной заболевания, или на клетки, такие как опухолевые клетки.
Исследования губчатых имплантатов были выполнены на млекопитающих, для того чтобы оценить популяцию иммунных клеток, привлеченных к инородному телу, которые дают так называемый стерильный абсцесс, и эти губки перед имплантацией или после нее насыщали антигеном для дальнейшего изучения популяции привлекаемых клеток. Vallera et al. (1982, Cancer Research 42:397-404) имплантировали губки, содержащие опухолевые клетки мышам, чтобы определить состав клеток, привлекаемых в течение 16-дневного периода, и обнаружили, что на раннем этапе присутствовали предшественники цитотоксических клеток, и пик цитотоксичности наблюдался на 16 день. В случае имплантации губок, содержащих опухолевые клетки, мышам, которые ранее были иммунизированы опухолевыми клетками, было показано более быстрое появление в губке цитотоксических клеток. Ни в одном из случаев клетки селезенки, лимфатических узлов или брюшины не проявляли цитотоксичности, что свидетельствует об узком локальном ответе на антиген в губке.
Jenski et al. (1985, J. Immunol. Methods 85:153-161) использовали сходные условия, чтобы проследить за восстановлением клеточного иммунитета у мышей с синотрансплантатами костного мозга после сублетального облучения путем имплантации губок, наполненных антигеном. Восстановление иммунитета определяли путем измерения активности цитотоксических Т-лимфоцитов, собранных в губке в течение определенного периода времени. Zangemeister-Wittke et al. (1989, J.Immunol. 143:379-385) инъецировали опухолевую вакцину в губки, имплантированные мышам, обладающим противоопухолевым иммунитетом, и следили за возникновением вторичного иммунного ответа в том месте, куда была введена губка. В лимфатических узлах, расположенных вблизи имплантированной губки, не наблюдалось никаких сопутствующих эффектов.
Chen et al. (1994, Cancer Research 54:1065-1070) собирали Т-клетки из губчатых имплантантов, содержащих облученные опухолевые клетки, чтобы показать, что эти Т-клетки могут быть использованы для адаптивной иммунизации с целью переноса антиопухолевой активности. У животных с губчатыми имплантатами, содержащими опухолевые клетки, измеряли частоту встречаемости иммунореактивных цитотоксических по отношению к опухоли Т-клеток в губках, а также в региональных лимфатических узлах и селезенке. Частота встречаемости иммунореактивных цитотоксических по отношению к опухолевым клеткам Т-клеток в губках была в четыре раза выше, чем в лимфатических узлах, и в 50 раз выше, чем в селезенке.
Несмотря на то, что предпринимаются исследования, имеющие большое значение для выяснения недостатков, связанных с эффективностью и пригодностью вакцин, остаются препятствия, связанные с методиками лечения и материалами. Поэтому желательно развитие способов или возможностей, которые позволят преодолеть проблемы, существующие в настоящее время и связанные с современными способами иммунотерапии и схемами лечения, подобными таким как профилактическая и терапевтическая вакцинация, и таким образом способствовать развитию новых эффективных и рациональных стратегий повышения эффективности иммунизации как здоровых представителей млекопитающих, так и тех, кому может быть полезна иммунотерапия. Более того, возможность подавления иммунного ответа на отдельный антиген или серию антигенов является полезной при лечении, например, аллергии и предотвращении отторжения трансплантата. В соответствии с этим задачей данного изобретения является достижение этих и подобных целей.
Согласно данному изобретению обеспечивается способ модуляции иммунного ответа на антиген у млекопитающего путем имплантации в организм млекопитающего устройства, заключающего в себе пористый матрикс, находящийся внутри перфорированного, но изготовленного из непроницаемого материала контейнера. Антиген, к которому нужно выработать иммунный ответ, присутствует в пористом матриксе устройства. Антиген может присутствовать в устройстве перед имплантацией или вводится после имплантации; антиген, который присутствует в матриксе устройства во время имплантации, может быть представлен в биологически недоступной форме, которая становится биодоступной после имплантации. Устройство будет привлекать клетки иммунной системы к контакту с антигеном внутри устройства, и контакт будет модулировать иммунный ответ на антиген. Перфорированный контейнер действует как диффузионный барьер, поддерживая внутри устройства высокий уровень цитокинов и других дополнительно стимулирующих факторов, продуцируемых иммунными клетками внутри устройства, которые при действии на другие иммунные клетки в устройстве усиливают развитие желаемого иммунного ответа. Отверстия обеспечивают свободный вход и выход иммунных клеток. Желаемый иммунный ответ может быть представлен клеточным, местным, обеспечивающим защитные свойства слизистых оболочек, и гуморальным иммунитетом и может касаться как здоровых представителей млекопитающих, так и тех, кому может быть полезна иммунотерапия.
Например, в практике данного изобретения перед имплантацией млекопитающим внутрь устройства, представленного в данном изобретении, помещается небольшое количество антигена. Предпочтительно антиген вводится в пористый матрикс устройства или становится биодоступным внутри матрикса примерно спустя три дня после имплантации в организм млекопитающего. У млекопитающего будет индуцирован сильный иммунный ответ.
Следующей характеристикой конструкции устройства является то, что оно изготовлено из биодеградируемых материалов, которые в конечном итоге разрушаются внутри организма. В альтернативном случае устройство может быть извлечено из организма после достижения желаемого эффекта.
В наиболее широком аспекте данное изобретение распространяется на имплантируемое устройство для иммунизации млекопитающих, имеющее следующие характеристики: пористый матрикс, находящийся внутри перфорированного, но сделанного из непроницаемого материала контейнера, устройство далее включает в себя антиген, который либо присутствует в матриксе в биодоступной форме перед имплантацией, или становится биодоступным внутри матрикса после имплантации, или антиген вводится туда после имплантации. Биодоступность антигена внутри устройства может контролироваться в результате предоставления антигена в биологически недоступной форме, такой как в составе композиции замедленного высвобождения, в частности, представленной в виде микросфер, микрокапсул или липосом, которые при деградации высвобождают антиген в матрикс устройства.
Следующим аспектом способа и устройства согласно данному изобретению является возможность использования для ослабления или подавления иммунного ответа на антиген у млекопитающего с использованием высокой концентрации конкретного антигена внутри устройства, что приводит к супрессии иммунного ответа на конкретный антиген и ингибированию развития иммунного ответа на антиген. Внутри устройства могут быть также предоставлены цитокины или другие дополнительно стимулирующие молекулы.
К дальнейшим случаям использования способов и устройств согласно данному изобретению относится сбор иммунных клеток из устройства для последующего повторного введения в организм в целях предоставления адаптивной иммунотерапии, активной иммунизации и восстановления иммунной системы. К дополнительным случаям использования относится усовершенствование получения поликлональных антител (иммунной сыворотки) и моноклональных антител, включая получение моноклональных антител человека у животных, несущих иммунные клетки человека.
Как будет очевидно из нижеследующего, используя описанное здесь изобретение, в результате создания искусственного окружения, имитирующего строение и функциональную роль лимфатического узла, и путем манипулирования биодоступностью антигена внутри устройства, достигается развитие сильного ответа на антиген. При различных условиях, подбираемых для конкретных антигенов, может быть подавлен существующий иммунный ответ.
Краткое описание чертежей.
На фигуре 1 показана кривая зависимости размера популяции клеток внутри устройства данного изобретения от времени в течение 9-дневного периода после имплантации под кожу млекопитающим.
На фигуре 2 представлен анализ количества и типов клеток, присутствующих в устройстве через четыре дня после имплантации без наличия какого-либо антигена внутри устройства.
На фигуре 3 показано изменение различных типов клеток в популяции внутри устройства на 4, 7 и 10 день после имплантации, в отсутствие какого-либо введенного антигена.
На фигуре 4 показано влияние введения антигена в устройство на количество CD3-позитивных клеток (Т-клетки), CD80-позитивных клеток (В-клетки) и CD14-позитивных клеток (макрофаги как представители антигенпредставляющих клеток) внутри устройства на 3, 7 и 10 день после имплантации. Антиген был введен в устройство на 4 день после имплантации.
На фигуре 5 показан анализ изменения экспрессии CD4 (клетки Т-хелперы) и CD8 (цитотоксические Т-клетки) позитивных клеток в селезенке мышей через десять дней после имплантации устройства, либо не содержащего, либо содержащего различные количества антигена вируса гриппа, или после иммунизации в подушечку лапы антигеном с адъювантом.
На фигуре 6 представлены результаты исследования пролиферативного ответа клеток селезенки на антиген вируса гриппа у мышей, которым либо имплантировали устройство, содержащие антиген с адъювантом или без адъюванта, либо иммунизировали в подушечку лапы антигеном с адъювантом. Пролиферацию Т-клеток селезенки измеряли по продукции гамма-интерферона.
На фигуре 7 показан уровень секреции гамма-интерферона Т-клетками, выделенными из подколенных лимфатических узлов мышей, иммунизированных в подушечку лапы антигеном вируса гриппа с адъювантом.
На фигуре 8 показан пролиферативный ответ Т-клеток селезенки, измеренный по уровню секреции гамма-интерферона у мышей, иммунизированных с помощью устройства данного изобретения антигеном вируса гриппа, с адъювантом или без него.
На фигуре 9 показан уровень активации Т-клеток селезенки, измеренный по уровню секреции гамма-интерферона у мышей, иммунизированных с помощью устройства данного изобретения рядом доз используемого в качестве антигена овальбумина без адъюванта, по сравнению с пролиферативным ответом клеток селезенки животных, иммунизированных в подушечку лапы путем инъекции тех же самых доз антигена с адъювантом.
На фигуре 10 также представлен пролиферативный ответ Т-клеток селезенки, измеренный по уровню секреции гамма-интерферона у мышей, либо не иммунизированных, либо иммунизированных с помощью устройства данного изобретения овальбумином в дозе 50 мкг, 50 нг или 50 пг без адъюванта или с БЦЖ адъювантом, по сравнению с пролиферативным ответом клеток селезенки животных, иммунизированных путем инъекции в подушечку лапы тех же самых доз антигена с адъювантом Райби.
На фигуре 11 показан ответ, заключающийся в продукции специфичных против данного антигена IgG2a антител у животных, которым имплантировали устройство, содержащее различные дозы используемого в качестве антигена пептида gp120 HIV, по сравнению с животными, иммунизированными путем инъекции в подушечку лапы тех же самых доз антигена с адъювантом.
На фигуре 12 показан такой же эксперимент, который описан на фигуре 11, но с последующей бустер-иммунизацией, проведенной тем же путем через три недели после первой иммунизации, причем количество антигена составляло 10% от количества при начальной иммунизации. Антиген повторно вводили в устройства, имплантированные животным.
На фигуре 13 проведено сравнение продукции специфичных IgG2a антител против пептида gp120 HIV, у животных, иммунизированных с помощью устройства данного изобретения в присутствии адъюванта Райби или БЦЖ, или без адъюванта, и у животных, иммунизированных традиционным способом в подушечку лапы с теми же адъювантами.
На фигуре 14 изображен уровень специфических IgG2a антител у животных, иммунизированных различными дозами используемого в качестве антигена цитохрома С либо с помощью устройства данного изобретения без адъюванта, либо традиционным способом иммунизации в подушечку лапы с адъювантом Райби. Уровни циркулирующих IgG2a регистрировали, используя серийные разведения сыворотки мышей.
На фигуре 15 показан общий уровень IgG, специфичного против вируса гриппа, который продуцируется после иммунизации мышей 0,1 мкг или 10 мкг фрагмента белка гемагглютинина вируса гриппа (РГА, расщепленный гемагглютинин) без адъюванта с помощью устройства данного изобретения, по сравнению с иммунизацией такой же дозой антигена в подушечку лапы с адъювантом Райби.
На фигуре 16 представлены результаты исследования активации Т-клеток, при котором в качестве показателя использовался гамма-интерферон. Мыши были иммунизированы антигеном вируса гриппа с помощью устройства данного изобретения без адъюванта, проведено сравнение с результатами, полученными при иммунизации антигеном без адъюванта в подушечку лапы и при иммунизации антигеном, находящимся в имплантированном пористом полимерном матриксе (но матрикс не был помещен в перфорированный контейнер, как это делается в устройстве, представленном в данном изобретении).
На фигуре 17 показаны результаты описанного выше эксперимента при контрольном заражении in vitro неродственным антигеном (ВЭБ, вирус Эпштейн-Барра) клеток селезенки мышей, иммунизированных вирусом гриппа, которые свидетельствуют о специфичности ответа, развивающегося вследствие иммунизации с использованием устройства данного изобретения.
На фигуре 18 представлены результаты тестирования диффузии белка (бычий сывороточный альбумин) из губки, используемой отдельно, по сравнению с губкой, используемой в устройстве данного изобретения.
На фигуре 19 представлены фенотипы клеток, экстрагированных из устройства данного изобретения, не содержащего или содержащего антиген вируса гриппа, на 4 день после введения мышам. Показаны значения, соответствующие таким же типам клеток во фракции лимфоцитов периферической крови мышей, не подвергавшихся воздействию.
На фигуре 20 показаны уровни стимулирующих цитокинов в устройстве данного изобретения в отсутствие антигена, по сравнению с их уровнями в сыворотке.
На фигуре 21 представлен уровень выявления цитотоксических Т-клеток, измеренный на основании лизиса инфицированных вирусом гриппа клеток мишеней, в случае использования имплантированного устройства данного изобретения, содержащего вакцину вируса гриппа, по сравнению с животными, которых подкожно иммунизировали вакциной вируса гриппа вместе с адъювантом.
На фигуре 22 сравнивается гуморальный ответ, измеренный по уровню специфичного против вируса гриппа IgG1 у мышей, иммунизированных с помощью устройства данного изобретения, содержащего вакцину вируса гриппа, и у мышей, иммунизированных подкожно вакциной с адъювантом.
На фигуре 23 показана аффинность при взаимодействии с антигеном специфичного против вируса гриппа IgG1, уровень которого возрастает у животных, иммунизированных с помощью устройства данного изобретения, содержащего вакцину вируса гриппа, по сравнению с животными, иммунизированными подкожно вакциной с адъювантом.
На фигуре 24 представлены данные по выживаемости мышей при контрольном заражении вирусом гриппа после иммунизации с помощью устройства данного изобретения, содержащего вакцину вируса гриппа, по сравнению с мышами, иммунизированными подкожно вакциной с адъювантом.
На фигуре 25 представлен титр IgG антител человека, специфичных против вируса гриппа, который возрастает у мышей SCID, на которых применяли устройство данного изобретения, по сравнению с внутримышечной иммунизацией.
На фигуре 26 показана аффинность к антигену вируса гриппа антител сыворотки (описанных в пояснении к фигуре 25) по сравнению с антителами, уровень которых возрастает при внутримышечной иммунизации антигеном.
На фигуре 27 показана супрессия иммунного ответа высокими количествами антигена, присутствующего в устройстве данного изобретения.
На фигуре 28 демонстрируется пригодность устройства данного изобретения для иммунизации плазмидной ДНК.
На фигурах 29-31 демонстрируется пригодность устройства данного изобретения для индукции иммунного ответа на полисахаридный антиген.
На фигуре 32 показана пригодность устройства данного изобретения для того, чтобы вызвать иммунный ответ на высоко консервативный и поэтому слабо иммуногенный антиген циклофилин.
На фигуре 33 показана пригодность устройства данного изобретения для того, чтобы вызвать иммунный ответ на антигены паразитов в случае использования целых организмов паразитических животных.
В настоящем изобретении представлен способ модуляции иммунного ответа на антиген у млекопитающего с использованием имплантируемого устройства, которое контролируемым способом обеспечивает воздействие клеток иммунной системы на антиген. В результате создания искусственного окружения, имитирующего структуру и функциональную роль лимфатического узла, и благодаря манипулированию биологической доступностью антигена, находящегося внутри устройства, может быть индуцирован сильный ответ, направленный против антигена, или может быть подавлен уже существующий иммунный ответ. Устройство включает в себя пористый матрикс, т.е. материал, похожий на губку, окруженный или находящийся внутри перфорированного, но сделанного из непроницаемого материала покрытия или барьера, именуемого здесь контейнером. Перфорированный контейнер действует как диффузионный барьер, чтобы поддержать высокие концентрации секретируемых иммунными клетками продуктов внутри устройства. Антиген, по отношению к которому усиливается или подавляется иммунный ответ, присутствует внутри пористого матрикса устройства либо уже перед введением устройства по кожу, либо помещается туда после введения устройства. Для индукции сильного иммунного ответа предпочтительно, чтобы антиген стал биологически доступным внутри матрикса устройства примерно через три дня после введения устройства. Это может достигаться путем инъекции антигена в устройство примерно в это время или за счет использования устройства, в котором матрикс включает в себя медленно высвобождаемую форму антигена, которая становится биологически доступной примерно через три дня. Для модуляции по типу обратной связи или супрессии иммунного ответа на конкретный антиген и в зависимости от конкретного антигена предпочтительно, чтобы полностью биологически доступный антиген уже присутствовал в устройстве перед его имплантацией млекопитающему. В случае, когда антиген помещается в устройство после имплантации устройства, антиген может быть введен в устройство трансдермальным путем с помощью шприца и иглы для подкожных инъекций, в результате идентификации положения устройства и введения в устройство иглы. Устройство может быть оставлено на месте или удалено из тела. Оно может быть сделано из биодеградируемых материалов, которые в конечном итоге разрушатся внутри тела, или оно может быть извлечено после достижения желаемого результата. Антиген может быть повторно веден в устройство в более поздний период времени. Антиген может использоваться внутри устройства либо отдельно, либо с адъювантом, или с комбинацией нескольких адъювантов. Предпочтительно, чтобы адъювант не использовался.
В настоящем изобретении предлагаются усовершенствования многих форм иммунотерапии, при которых проявляется или усиливается желаемый иммунный ответ против антигена, и, напротив, при которых уже существующий иммунный ответ или ответ, который может потенциально развиться против конкретного антигена, может быть супрессирован или блокирован соответственно. К таким формам иммунотерапии относится вакцинация, а именно вакцинация здоровых представителей млекопитающих против конкретных антигенов, и процедуры терапевтической вакцинации. Блокирование или супрессия иммунного ответа у млекопитающего может проводиться перед встречей с конкретным антигеном, а именно будущему реципиенту трансплантата, млекопитающему, который предположительно может быть подвергнут воздействию аллергена, или млекопитающему, предрасположенному к развитию иммунного ответа на экзогенный или эндогенный антиген, как, например, в случае аутоиммунных заболеваний. Супрессия иммунного ответа может быть полезна после воздействия антигена, а именно млекопитающему с аллергическим или анафилактическим ответом на антиген, или млекопитающему, у которого происходит отторжение трансплантата. Способы и устройства данного изобретения ориентированы на использование для всех форм иммунитета, включая клеточный, гуморальный и обеспечивающий защитные свойства слизистых оболочек.
Конфигурация устройства и способ его применения имитируют структуру и функции лимфоидной ткани млекопитающих, в частности лимфатического узла. Внедренные в организм чужеродные антигены захватываются и процессируются антигенпредставляющими клетками, макрофагами и дендритными клетками, которые поступают в лимфатические узлы и представляют Т-лимфоцитам иммуногенные пептиды, образованные антигеном в определенной конформации и антигенами главного комплекса гистосовместимости НМС. Специальная популяция Т-клеток (CD4-Th2) предоставляет помощь В-клеткам и поддерживает развитие высоко специфичного гуморального ответа.
В-клетки могут непосредственно контактировать с антигеном (особенно с мультивалентными антигенами, или "воскресшими" антигенами) и дифференцироваться в плазматические клетки, секретирующие специфичные антитела против антигена, которым проводится иммунизация. Кроме того, антигенпредставляющие клетки выделяют цитокины, лимфокины и хемокины, которые принимают участие в развитии иммунного ответа. Та часть устройства, которая представляет собой перфорированный контейнер, обеспечивает диффузионный барьер, который поддерживает внутри устройства и вблизи иммунных клеток, находящихся в устройстве, определенные уровни антигена и продуктов, секретируемых иммунными клетками, таких как цитокины. Отверстия ограничивают диффузию этих молекул из устройства, но обеспечивают свободный вход и выход иммунных и других клеток в устройство и из него. Обнаружено, что очень небольшие количества антигена достаточны для того, чтобы индуцировать сильный иммунный ответ. Таким образом, взаимодействие между антигеном, присутствующим в устройстве, и иммунными клетками, и дополнительно стимулирующими молекулами внутри устройства оптимизировано для того, чтобы усилить развитие иммунного ответа на антиген, а также для того, чтобы обеспечить длительный иммунитет путем продукции популяции клеток памяти.
Имплантация устройства данного изобретения в тело млекопитающих инициирует процесс, который называют стерильным абсцессом, при котором определенные клетки иммунной системы привлекаются к чужеродному телу и входят через ограниченное число отверстий. В первые несколько дней внутри устройства накапливается возрастающая популяция клеток даже в отсутствие какого-либо антигена. При наличии биодоступного антигена в устройстве примерно на третий день и обнаружении антигена клетками иммунной системы, присутствующими в матриксе, антиген захватывается и процессируется антигенпредставляющими клетками и представляется Т-лимфоцитам. Поскольку воздействие окружающей среды на устройство ограничено перфорированным контейнером, иммунные клетки могут войти, но антиген остается внутри устройства, и его концентрация остается высокой, так же, как и концентрация дополнительно стимулирующих факторов, секретируемых популяцией клеток внутри устройства, почти точно так же, как в лимфатическом узле. После примирования и активации Т-лимфоцитов они могут покинуть устройство через ограниченное количество отверстий и вернуться к циркуляции. Таким образом, устройство предоставляет средства контролирования воздействия клеток иммунной системы на антиген и поддержания уровней цитокинов и других факторов, необходимых для развития сильного иммунного ответа. Как будет видно из примеров, приведенных ниже, устройство обеспечивает усиление развития иммунного ответа на конкретный антиген на несколько порядков.
При дальнейшем теоретическом рассмотрении имплантация устройства данного изобретения, содержащего большое количество конкретного антигена, может функционировать противоположным образом по сравнению с функционированием, описанным выше, при этом оно может подавлять или супрессировать существующий или потенциальный иммунный ответ на антиген. Экспозиция Т-клеток с избытком антигена, по-видимому, инициирует апоптоз Т-клеток, специфичных для данного антигена, приводя, таким образом, к элиминации антиген-специфических Т-клеток и предшественников, эффективной супрессии клеточного ответа, а также гуморального ответа, направленного против антигена. Гиперактивация Т-клеток, опосредованная добавлением к антигенному стимулу цитокинов (таких как Ил-2, Ил-4, γ-интерферона, Ил-12) или экспозицией Т-клеток с дополнительным антигенным стимулом в состоянии невосприимчивости (т. е. перед затуханием состояния активации), будет запускать апоптоз клеток и выпадение реактивных клонов (В- и Т-клеток) из антиген-специфичного репертуара клеток. Специалистам в данной области будет известно или будет легко определить, какую подходящую концентрацию конкретного антигена выбрать, чтобы достичь стимуляции или супрессии иммунного ответа с использованием устройства данного изобретения. Иммуногенность конкретного антигена и, следовательно, пределы иммуносупрессирующих или иммуностимулирующих доз конкретного антигена могут быть определены с помощью методов in vitro или in vivo, известных в данной области.
Более того, усиленный иммунный ответ, достигнутый с помощью устройства данного изобретения, превосходит ответ, достигаемый традиционными способами иммунизации, которые в случае с животными обычно включают в себя использование адъювантов. На основании теоретических рассуждений контролируемая экспозиция одного антигена без адъюванта с иммунными клетками и дополнительно стимулирующими их факторами внутри устройства, по-видимому, создает оптимальное окружение для достижения сильного иммунного ответа, который превосходит ответ, достигаемый с помощью адъювантов.
Иммунизация представляет собой эффективный способ профилактики, направленной против большого числа агентов, вызывающих инфекционные заболевания, таких как вирусы, например, гриппа, HIV, папилломы, гепатита, цитомегаловирусы, вирусы полиомиелита и бешенства; бактерии, например, Е. coli, Pseudomonas, Shigella, бактерии, вызывающие сифилис, микобактерии, Chlamydia, риккетсии и Serratia marcescens; грибы, например Aspergillus и Candida, и простейшие и многоклеточные паразиты, например Schistosoma, Plasmodium, Onchocerca и амеба. Иммунизация также обеспечивает возможность использования терапевтических вакцин для лечения пациентов, уже страдающих инфекционными заболеваниями. Более того, благодаря иммунизации может проводиться профилактика или лечение неинфекционных заболеваний, таких как рак. Однако многие антигены слабо иммуногенны, и иммунизация оказывается не подходящей стратегией профилактики или лечения таких заболеваний. Адъюванты, которые обычно используются при иммунизации животных, не пригодны для усиления иммунного ответа. Кроме того, иммунная система какого-либо здорового индивидуума или больного может быть неспособной функционировать оптимально для того, чтобы генерировать иммунный ответ на такой антиген, который в других случаях может вызывать сильный иммунный ответ у здоровых индивидуумов с другой иммунной системой. В таких ситуациях возможно применение устройства данного изобретения для того, чтобы стимулировать сильный иммунный ответ тогда, когда такой ответ невозможен при использовании традиционных процедур иммунизации.
Также может быть желательна супрессия иммунного ответа при лечении определенных состояний, таких как аллергии, или при подготовке пациентов к воздействию чужеродного антигена, такого как трансплантат. Предположительно нарушенный иммунный ответ лежит в основе этиологии большого числа аутоиммунных и других заболеваний, таких как диабет типа I, ревматоидный артрит, рассеянный склероз, увеит, системная красная волчанка, миастения беременных и болезнь Грейвса. Путем имплантации в организм устройства данного изобретения, содержащего предполагаемый антиген, может быть индуцирован вход примированных клеток, узнающих антиген, чтобы подвергнуть их апоптозу и элиминировать из иммунной системы. Элиминирование клеток, предшественников антиген-специфичных клеток, может обеспечить последующую трансплантацию чужеродного антигена без отторжения.
К следующим направлениям применения данного изобретения относятся усовершенствования в получении поликлональных антител (иммунная сыворотка) и моноклональных антител у лабораторных животных и в получении при этом нужных изотипов антител. В одном из вариантов с помощью устройства данного изобретения может быть выполнена процедура получения поликлональных (иммунная сыворотка) и моноклональных антител против антигена, имеющегося в очень малых количествах. В устройство может быть помещено небольшое количество редкого антигена, чтобы иммунизировать животное, после чего могут быть собраны клетки селезенки. Эта процедура обладает преимуществами по сравнению с широко распространенным, трудоемким и непредсказуемым способом введения редкого антигена прямо в селезенку. Более того, необходимость в бустер-иммунизации может отпасть при использовании устройства данного изобретения, и, в дополнение, иммунный ответ будет получен быстрее. Сокращение времени, необходимого для иммунизации животных, позволит в более короткие сроки получать моноклональные антитела. В другом варианте из устройства после иммунизации какого-либо животного антигеном, помещенным внутрь устройства, могут быть собраны иммунные клетки для получения гибридом. Эта процедура может быть также использована для создания моноклональных антител человека путем имплантации устройства данного изобретения в организм индивидуума, заполнения устройства антигеном и затем сбора иммунных клеток из устройства для получения гибридом. Вышеупомянутые поликлональные антитела (иммунная сыворотка) и моноклональные антитела могут использоваться для диагностики, фундаментальных исследований, визуального наблюдения и/или терапии. В другом варианте могут быть получены моноклональные антитела человека с использованием устройства данного изобретения, имплантированного мышам с тяжелым комбинированным иммунодефицитом (SCID), с помощью следующей процедуры. Вначале лимфоциты периферической крови человека путем инъекции вводят в организм мышей SCID, где лимфоциты человека поступают в иммунную систему мышей. Сбор клеток из устройства, проводимый после имплантации устройства данного изобретения, содержащего нужный антиген, который становится биодоступным примерно через три дня после имплантации, позволяет получить В-лимфоциты человека, которые затем могут использоваться для получения гибридом, которые секретируют антитела человека против нужного антигена.
Дальнейшее применение устройства данного изобретения заключается в сборе иммунных клеток из организма млекопитающих для последующего повторного введения млекопитающим. Клетки могут быть извлечены из устройства, например, путем отсасывания из имплантированного устройства или после извлечения устройства из организма, в результате сбора клеток после растворения полимерного матрикса, после этого клетки хранят, например, путем криоконсервации и в последующем повторно вводят млекопитающим. Этот способ может, в частности, использоваться для млекопитающих, подвергнутых радиационной терапии всего тела. Устройство данного изобретения, не содержащее антигена, может быть имплантировано и оставаться в организме от семи до десяти дней, в последующем устройство или его содержимое извлекается, и находящиеся там клетки подвергаются криоконсервированию. После радиотерапии клетки могут быть повторно введены в организм млекопитающих, где эти клетки восстановят иммунную систему. В другом варианте данного применения в устройство могут быть введены дополнительно стимулирующие факторы, такие как цитокины, которые индуцируют пролиферацию иммунных клеток, для того чтобы увеличить сбор клеток в устройстве перед их извлечением. В следующем варианте иммунные клетки, собранные из устройства, содержащего антиген, могут быть использованы для активной иммунизации, при которой клетки могут храниться и затем повторно вводиться млекопитающим, например, после курса химиотерапии или других терапевтических процедур. Еще в одном варианте клетки, собранные из устройства, могут быть подвергнуты криоконсервированию и через некоторое время экспонированы с антигеном (например, антигеном раковой опухоли) для ex-vivo размножения Т-клеток перед введением в организм для адаптивной иммунотерапии.
В другом случае применения данного изобретения устройство может быть использовано для трансфекции иммунных клеток генами внутри устройства. Затем полученные в результате трансфекции иммунные клетки могут примировать иммунные клетки внутри устройства и/или после миграции из устройства могут примировать иммунные клетки в дистальных органах. Например, ДНК, РНК или кДНК, кодирующие специфичный для опухоли антиген или вирусный, бактериальный или паразитический антиген, помещают внутрь устройства в присутствии или без соответствующего белкового антигена. Антигенпредставляющие клетки, поступившие в устройство, могут быть трансфецированы геном, в последующем они могут экспрессировать антигенный белок и мигрировать в периферические отделы тела, где они будут стимулировать иммунные клетки.
Устройство данного изобретения может быть изготовлено способами, известными специалистами в данной области, и размер и форма его может варьировать, но так, чтобы его конфигурация позволяла ему функционировать описанным здесь образом. Как описано выше, устройство создает диффузионный барьер для небольших молекул, таких как антиген, введенный в устройство, цитокины и другие факторы, секретируемые иммунными клетками внутри устройства, но позволяет иммунным клеткам входить в устройство и выходить из него. Таким образом, пассивная диффузия белков и других небольших молекул ограничена, но иммунные клетки активно передвигаются внутрь устройства и выходят из него. В одном из вариантов, если требуется устройство, пригодное для введения в небольшой надрез на коже и последующего извлечения, оно может быть создано из короткого отрезка полой, биологически инертной пластиковой трубки, такой как силиконовая трубка. Пористый полимерный матрикс, т.е. материал, подобный губке, помещается в просвет трубки. Открытые концы трубки либо запаиваются, либо остаются открытыми. Небольшое количество отверстий делается в стенке трубки. Различное количество, форма и размер отверстий могут использоваться в рамках изобретения. Антиген может вводиться в виде раствора или суспензии антигена или в биологически недоступной форме антигена путем введения в матрикс во время изготовления или путем инъекции в матрикс либо через один из концов трубки, либо через стенку самой трубки.
Антиген может прямо вводится в матрикс устройства в так называемой здесь биодоступной или полностью биодоступной форме или может предоставляться в биологически недоступной форме, которая в последующем становится биодоступной. Может быть применено введение антигена в состав композиции, которая благодаря своим характеристикам обеспечивает контролируемое высвобождение, длительное высвобождение или замедленное высвобождение; к таким процессам и композициям могут относиться микроинкапсулирование, липосомы и микросферы. Предпочтительно в целях стимулирования или усиления иммунного ответа на антиген, входящий в состав композиции, антиген становится биодоступным внутри матрикса устройства примерно через три дня после имплантации. Приемлемые композиции, обеспечивающие высвобождение, известны в данной области.
В другом варианте устройство может быть сделано из материала на полимерной основе в форме, которую в конечном итоге желательно придать устройству, и на поверхность его наносится непроницаемое покрытие. Затем могут быть сделаны отверстия. В альтернативном варианте полимерному матриксу с определенной пористой структурой и определенной плотностью сшивания может быть придана желаемая форма путем прессования, и затем внешняя сторона обрабатывается агентом для дальнейшего сшивания полимера с поверхностью устройства для формирования эффективного непроницаемого покрытия или контейнера. Затем покрытие может быть перфорировано и введен антиген. Усиленная полимеризация на поверхности устройства также может быть вызвана облучением поверхности ультрафиолетом, в том случае, если используется полимер, стойкий к ультрафиолетовому излучению. Целью приведенных здесь примеров не является ограничение изобретения, так как специалисты в данной области могут быть свободны в определении целей, для решения которых может быть пригодно устройство с вышеупомянутыми свойствами.
Материалы, из которых состоит устройство, могут быть выбраны из широкого круга приемлемых соединений природного происхождения или синтетических соединений. В одном из вариантов полимерный матрикс может быть представлен биологически совместимым материалом, таким как гидроксилированный поливинилацетат. Другим матриксом является полиуретан, который широко доступен. К другим приемлемым материалам относятся сополимер этилен-винилацетата, полимолочная кислота, полигликолевая кислота, сополимер полилактида-гликолида, коллаген, коллаген, имеющий сшивки, и желатин.
Как описано выше, создание перфорированного, но в остальной части непроницаемого барьера или покрытия, окружающего полимерный матрикс, может быть достигнуто с помощью множества различных способов. В одном варианте кусочек полимерного матрикса помещается в просвет короткого отрезка биологически совместимой пластиковой трубки, такой как силиконовая трубка. В одном из примеров 2,5 см отрезок трубки с внутренним диаметром 0,15 см и наружным диаметром 0,2 см заполняли соответствующим кусочком длиной 2,5 см предварительно смоченного матрикса из гидроксилированного поливинилацетата. В другом примере барьер или покрытие может быть изготовлено из приемлемого материала природного происхождения или синтетического материала, такого как пластик или другой полимер, такой как полиэтилен, коллаген, имеющий сшивки, полиэтилен, силикон, резина из латекса, полистирол, полиакрилат, поливинилпирролидон и комбинация этих материалов. Одним из имеющихся приемлемых коммерческих материалов является силиконовая трубка SILASTIC® от Dow Corning. Эти не ограничивающее изобретение примеры просто являются образцами целого ряда приемлемых структур, которые могут использоваться в данном изобретении.
В качестве не ограничивающего изобретение примера
изготовления устройства данного изобретения, причем такого, при котором сохраняются вышеуказанные желаемые характеристики устройства, которое ограничивает диффузию небольших молекул из устройства, но позволяет входить и выходить иммунным клеткам, может быть изготовление устройства вручную следующим образом. В качестве непроницаемого контейнера устройства данного изобретения может быть использована силиконовая трубка длиной 1,125 дюйма (2,857 см) с наружным диаметром 0,047 дюйма (0,119 см) и радиусом 0,0235 дюйма (0,060 см). Отверстия могут быть пробиты в стенке устройства вручную с помощью иглы для подкожных инъекций калибра 20, которая делает отверстия диаметром приблизительно 1/16 и 1/32 дюйма (0,159 и 0,079 см). В трубке было сделано двадцать отверстий. Эти параметры служат только советом для выбора характеристик устройства, и специалисты в данной области будут иметь представление о других параметрах, которые позволят достичь тех же целей, которые выше были указаны как наиболее важные, таковыми являются предоставление возможности неограниченного входа и выхода клеток, но ограничение диффузии и удерживание в устройстве небольших молекул, таких как цитокины.
Биодеградируемое устройство данного изобретения может включать в себя матрикс и контейнер из материалов, о которых известно, что они медленно деградируют в организме. К таким материалам относятся желатин, коллаген, коллаген, имеющий сшивки, полимолочная кислота, сополимер полилактида-гликолида и другие материалы, известные специалистам в данной области. Таким образом, предпочтительное полностью деградируемое устройство для стимуляции иммунного ответа может включать в себя биодеградируемый контейнер, биодеградируемый матрикс и биодеградируемую композицию замедленного высвобождения антигена, находящуюся в матриксе. Последняя в этом ряду композиция высвобождает антиген примерно на третий день после имплантации; матрикс и контейнер начинают значительно разрушаться после окончания срока жизни устройства, примерно через 10 дней после имплантации.
Отверстия в контейнере устройства могут быть сделаны любым из многочисленных способов, включая ручную и автоматизированную процедуры. Оптимально небольшое количество отверстий, предпочтительно около 10 на сантиметр трубки, хотя это будет зависеть от размера и формы устройства. На основании теоретических рассуждении, приведенных выше, роль отверстий состоит в обеспечении входа клеток иммунной системы в устройство, которые затем контактируют с антигеном и дополнительно стимулирующими молекулами и становятся примированными, и затем отверстия обеспечивают выход примированных клеток. Эти цели могут быть достигнуты при условии, что перфорированное устройство в то же самое время должно содержать и поддерживать внутри устройства желаемые уровни антигена и дополнительно стимулирующих факторов, таких как цитокины, продуцируемые клетками иммунной системы. Приемлемое количество и размер отверстий достигается такими иглами, которые описаны в примерах ниже. В том случае, когда устройство изготовлено из отрезка трубки, концы трубки могут оставаться открытыми и выполнять при этом роль отверстий, а так же служить местом введения иглы или других средств заполнения антигеном либо перед имплантацией, либо после имплантации.
Устройство может быть имплантировано в подходящее место в организме, где простота введения, заполнения антигеном и удаления может сочетаться с минимальным дискомфортом для пациентов. Одним из подходящих мест является середина поверхности плеча. В другом варианте устройство изготавливается из биодеградируемых материалов, и поскольку устройство будет деградировано после окончания срока службы, то нет необходимости в его удалении.
Для стимуляции иммунного ответа биодоступный антиген может присутствовать в устройстве во время имплантации или предпочтительно после этой процедуры. Если после имплантации, то предпочтительным временем является третий день после имплантации. Биологически недоступные композиции антигена с замедленными характеристиками высвобождения могут быть представлены в устройстве во время имплантации, эти композиции высвобождают антиген в матрикс устройства примерно на третий день после имплантации. Примерно через три дня в устройстве присутствует достаточное количество разных типов клеток, способных отвечать на присутствие антигена, вместе с достаточными уровнями цитокинов и других дополнительно стимулирующих молекул, секретируемых этими клетками, которые поддерживаются внутри устройства за счет диффузионного барьера, создаваемого перфорированным контейнером, и последующее введение антигена в устройство инициирует развитие оптимального иммунного ответа.
Если устройство изготовлено не из биодеградируемых материалов, как описано выше, оно может быть удалено с помощью простой хирургической операции, после того как оно выполнит желаемую функцию. В общем, через 10 дней популяция иммунных клеток покидает устройство, и оно становится далее нефункциональным. С другой стороны, устройство может быть позже повторно наполнено антигеном для бустер-иммунизации.
Как описано выше, чтобы достичь желаемой стимуляции или супрессии иммунного ответа, важно регулирование периода времени, в который антиген становится биодоступным внутри матрикса устройства, и этот период зависит от характеристик конкретного антигена. В общем, высокая концентрация полностью биологически доступного антигена, представленная во время имплантации, будет обладать супрессирующим действием на иммунный ответ на антиген. Так же, в общем, небольшое количество полностью биологически доступного антигена примерно через три дня после имплантации устройства будет обладать стимулирующим действием на иммунный ответ. Эти условия можно варьировать, не сокращая применения устройства, в зависимости от характеристик конкретного антигена, используемого в устройстве. Специалисты в данной области смогут оценить иммуногенность конкретного антигена с помощью стандартных методов in vitro и in vivo и определить соответствующую концентрацию антигена, чтобы достичь желаемого действия.
Способ применения устройства данного изобретения для усиления или стимуляции иммунного ответа на антиген направлен на сбор популяции иммунных клеток, Т- и В-лимфоцитов, которые будут повышать эффективный иммунный ответ против антигена, используемого в устройстве.
Другой целью данного изобретения является подавление иммунного ответа против специфического антигена с помощью вышеупомянутого способа и устройства. В результате введения в устройство высоких доз антигена могут быть индуцированы процессы апоптоза иммунных клеток, которые вошли в устройство и столкнулись с антигеном. Такие состояния, как отторжение пересаженной ткани и трансплантата, могут быть предотвращены или излечены в том случае, если реципиенту перед введением или после введения трансплантата ввели устройство данного изобретения, содержащее антиген донора. К общем состояниям, при которых иммунный ответ поддается подавлению, относятся трансплантация, при которой желательно сделать реципиента толерантным к клеткам крови донора, чтобы подавить иммунный ответ реципиента на пересаженную ткань донора; аутоиммунные заболевания, при которых желательно выработать толерантность к аутоантигенам, чтобы подавить патогенные Т-клетки и уменьшить интенсивность формирования иммунных комплексов с эндогенными антигенами, такими как коллаген при ревматоидном артрите; диабет, при котором желательно выработать толерантность пациентов, больных диабетом, к инсулину или GAD; миастения беременных, при которой у пациентов может быть выработана толерантность, чтобы избежать развития иммунного ответа против рецептора ацетилхолина. Более того, иммунный ответ, характерный для аллергии и аллергических реакций, может быть исправлен путем развития толерантности к аллергену или десенсибилизации пациентов путем индукции апоптоза иммунных клеток, ответственных за иммунный ответ. Примерами аллергии и антигенов, которые могут использоваться в устройстве данного изобретения, чтобы супрессировать иммунный ответ, относятся аллерген DERP-1, который вызывает аллергию на кошек, и аллергии на ядовитые вещества плюща/дуба, вызываемые урушиол-модифицированными пептидами.
Следующие примеры представлены для того, чтобы более полно проиллюстрировать предпочтительные варианты изобретения. Однако их не следует толковать как ограничения широких рамок применения изобретения.
Пример 1.
Примерное устройство данного изобретения было изготовлено с использованием силиконовой трубки длиной 2,5 см, имеющей внутренний диаметр 0,15 см и наружный диаметр 0,2 см, заполненной кусочком губки из гидроксилированного поливинилацетата длиной 2,5 см. Устройство погружали в контейнер, содержащий фосфатно-солевой буфер, и автоклавировали для стерилизации. Самок мышей BALB/c (6-8-недельного возраста) анестезировали с помощью авертина (Avertin). Устройство вводили в 1 день через надрез по средней линии спины размером 0,5 см. Некоторым животным на 2 день после имплантации вводили в устройство 50 мкл раствора, содержащего 1 мг/мл антигена вируса гриппа (вакцина вируса гриппа FLUSHIELD®, тривалент, типы А и В, полученные от Henry Schein®, Melville NY), прокалывая кожу иглой для подкожных инъекций вблизи имплантированного устройства и затем направляя иглу, нащупывая один из концов устройства.
С помощью иглы для подкожных инъекций отсасывали жидкость из имплантированных устройств каждого из пяти животных на 2, 4, 7 и 9 день после имплантации, затем клетки, находящиеся в жидкости, объединяли, промывали и подсчитывали. Как показано на фигуре 1, у животных, которым имплантировали устройство, не содержащее антигена, популяция клеток начинала расти на 4 день, и достигала пика на 7 день. Уменьшение количества клеток в устройстве на 9 день свидетельствует о том, что клетки, которые ранее мигрировали внутрь устройства, затем мигрировали из устройства на периферию. В том случае, когда в устройство был введен антиген вируса гриппа на 2 день после имплантации, количество клеток, присутствующих в устройстве на 4 день после имплантации, было в несколько раз выше, 225 000, тогда как без антигена в устройстве эта величина составляла 60 000. Таким образом, присутствие антигена внутри устройства усиливает привлечение клеток в устройство и/или инициирует пролиферацию клеток внутри устройства.
Пример 2.
В этом эксперименте были определены количества и фенотипы клеток, присутствующих в устройстве без добавления антигена, при этом использовали мышей BALB/c. На четвертый день после имплантации устройства, проведенного, как описано в примере 1, клетки от каждого из пяти животных отсасывали из устройства, объединяли, промывали и разделяли в несколько пробирок. Были добавлены меченные флуоресцинизотиоцианатом или фикоэритрином моноклональные антитела, специфичные к следующим маркерам (CD14, CD45/B220, CD11b, CD40, CD11c, CD80, CD86, CD62P, CD62E, CD3 и I-Ad), после инкубации в течение 30-45 минут при 4oС клетки были промыты и определено среднее геометрическое флуоресценции с помощью проточной цитометрии. Для сравнения определяли флуоресценцию лимфоцитов периферической крови интактных, сингенных мышей с использованием такого же набора специфических антител, и результаты, полученные для каждого антигена, выражали в процентах увеличения флуоресценции клеток, выделенных из устройства, по сравнению с флуоресценцией лимфоцитов периферической крови.
На фигуре 2 представлены фенотипы клеток, выделенных из устройства на 4 день после имплантации. Очевидно, что происходила миграция и накопление в устройстве при высокой плотности Т-клеток (CD3, CD40), макрофагов (CD14, CD11b, MHC класса II, СВ80), дендритных клеток (CD40, CD11c, MHC класса II, CD80) и В-клеток (MHC класса II, CD45/B220, CD11b).
Пример 3.
Изменения популяции клеток внутри устройства, описанного в примере 1, в течение времени оценивали, собирая клетки из устройства на 3, 7 и 10 день после имплантации. В первом эксперименте в устройство не вводили антиген. Клетки, выделенные в каждой указанной точке времени путем отсасывания из устройств, имплантированных пяти мышам, объединяли, и определяли плотность клеток, несущих маркеры CD3, CD8, CD80, CD44, CD11c, CD45R/B220 и CD14, следуя той же самой процедуре, которая описана в примере 2, выражая значения в виде процента увеличения по сравнению с лимфоцитами периферической крови интактных мышей.
На фигуре 3 показана плотность пронумерованных фенотипов клеток на 3, 7 и 10 день после имплантации. Было очевидно, что устройство на 3 и 7 день обогащается всеми типами клеток, несущих указанные маркеры, и на 10 день популяция мигрирует из устройства.
Пример 4.
Во втором эксперименте, проведенном точно так же, как описано выше, в устройство на 2 день после имплантации вводили антиген вируса гриппа. Как показано на фигуре 4, плотность Т-клеток и антигенпредставляющих клеток (CD3, CD80 или CD14) еще больше возрастает в присутствии антигена в устройстве, и, более того, сохраняется высокой для всех этих трех типов клеток на 10 день. Добавление антигена может задерживать уход иммунных клеток из устройства.
Пример 5.
Дистальное действие имплантации устройства, снабженного антигеном вируса гриппа, оценивали путем измерения изменения в экспрессии CD4 и CD8 Т-клеток в селезенке животных, которым была проведена имплантация. При этом следовали способам, описанным выше, и фенотипы Т-клеток определяли способом, описанным в примере 2. В устройство вводили 0, 5, 10 или 50 мкг вакцины вируса гриппа на 2 день после имплантации и собирали селезенки животных на 10 день после имплантации (12 день после имплантации). Клетки селезенки выделяли мягким растиранием селезенки между необработанными сторонами предметных стекол. Клетки промывали ФСБ и от эритроцитов избавлялись благодаря 5-минутной инкубации в буфере для лизиса эритроцитов Red Cell Lysis Buffer (Sigma). Флуоресценцию CD4 и CD8 определяли с помощью проточной цитометрии, как описано выше. В качестве контроля использовали традиционный стандартный протокол иммунизации, согласно которому мышам инъецировали те же самые количества антигена вируса гриппа в подушечку лапы, вместе с адъювантом Райби R-700, эмульсией, содержащей монофосфорил липид А и синтетический трегалоза дикриномиколат (МФЛА + ТДМ), изготовленный Ribi ImmunoChem Research, Inc. У контрольных мышей отбирали образцы крови также на 10 день после иммунизации.
Как показано на фигуре 5, для Т-клеток, выделенных из клеток селезенки мышей, которым имплантировали устройство, была характерна повышенная плотность CD4 и CD8 молекул, после того как устройство наполняли антигеном вируса гриппа. Уровень цитотоксических Т-клеток (CD8) в селезенке животных, иммунизированных традиционными способами 50 мкг антигена плюс адъювант, был равен уровню, индуцированному 10 мкг антигена, находящегося в устройстве данного изобретения. Более того, устройство без антигена также вызывало увеличение количества клеток CD8 в селезенке в результате асептического воспаления, индуцированного устройством. Заслуживает внимания тот факт, что у животных, которым имплантировали устройство данного изобретения, содержащее 50 мкг антигена (такое же количество, которое прививали контрольным животным через подушечку лапы с адъювантом), отсутствовала экспрессия клеток CD8 в селезенке. Одним из объяснений является то, что введение высокой дозы антигена в устройство приводит к апоптозу антиген-специфических клеток. Использование чрезвычайно сильных стимулов может приводить к инициации эффекта перевозбуждения, и его конечным результатом была элиминация всех CD4+CD8+ Т-клеток из селезенки обработанных мышей. Это может иметь применение для желаемого подавления иммунного ответа в тех случаях, когда иммунный ответ опасен, например, при отторжении трансплантата.
Предположительным объяснением повышенной эффективности иммунизации с использованием устройства данного изобретения является то, что количество антигена, которое фактически достигает лимфатического узла у животных после инъекции антигена в периферическую часть тела, на несколько логарифмических порядков меньше, чем дается при иммунизации. Таким образом, оптимальная доза для иммунизации с помощью устройства данного изобретения для того, чтобы вызвать позитивный иммунный ответ, предположительно должна быть существенно меньше (т. е. на несколько логарифмических порядков меньше), чем доза, используемая при традиционной иммунизации.
Пример 6.
Силу иммунного ответа на антиген вируса гриппа, помещенного в устройство данного изобретения, оценивали, используя в качестве маркера секрецию гамма-интерферона Т-клетками селезенки. Секреция гамма-интерферона является одним из основных показателей ответа клеток типа Th-1 и CD8 цитотоксических Т-клеток, который известен как защитное оружие против внутриклеточных патогенов и опухоли. Мышам имплантировали устройство, как описано выше, и 5 мкг вакцины вируса гриппа вводили на 3 день после имплантации. Контрольную группу иммунизировали в подушечку лапы 50 мкг антигена с адъювантом Райби. Через десять дней после иммунизации выделяли клетки селезенки, как в предыдущем примере, высевали на планшеты, и продукцию гамма-интерферона измеряли с помощью набора для твердофазного иммуноферментного анализа ELISA (Endogen) после стимуляции в присутствии разных уровней антигена (от 1,4 до 180 мг/мл).
На фигуре 6 показано, что иммунизация животных 5 мкг антигена, находящегося в устройстве данного изобретения, вызывает активацию Т-клеток на том же уровне, как и при иммунизации 50 мкг с адъювантом в подушечку лапы. Таким образом, при использовании устройства данного изобретения, может быть достигнут сильный иммунный ответ, причем без помощи адъюванта и при использовании значительно меньших количеств антигена.
Секрецию гамма-интерферона Т-клетками, полученными из подколенного лимфатического узла тех же животных, оценивали после экспозиции выделенных Т-клеток в присутствии сходных концентраций антигена. Как показано на фигуре 7, секреция гамма-интерферона Т-клетками животных, иммунизированных антигеном с адъювантом в подушечку лапы, была не такой интенсивной, как секреция селезеночными Т-клетками животных, иммунизированных с помощью устройства данного изобретения (сравните с фигурой 6). Поскольку подколенные лимфатические узлы является центральным собирающим узлом области, в которую входит подушечка лапы, и, таким образом, можно предполагать, что клетки узла примируются в присутствии антигена, полученный результат свидетельствует о возможной эффективности применения устройства данного изобретения для получения сильного иммунного ответа без необходимости использования адъюванта. При дальнейшем анализе популяцию клеток, оставшихся в устройстве (которое заполняли антигеном на 3 день) на 10 день после имплантации, оценивали на основании секреции гамма-интерферона в ответ на экспозицию с антигеном. На фигуре 8 показано, что в ответ на контрольное заражение in vitro антигеном вируса гриппа секретируется очень низкий уровень гамма-интерферона по сравнению с уровнем ответа, который регистрируется для клеток селезенки. На основании полученного результата можно предполагать, что эффекторные клетки, примированные путем иммунизации внутри устройства, мигрировали наружу и на 10 день (в это время отсасывали клетки из устройства) резко уменьшилась популяция эффекторных клеток. Показанное на фигурах 1 и 3 отсутствие в устройстве на 9 и 10 день клеток В и Т-клеточных фенотипов подтверждает возможность выхода этих клеток к периферическим органам.
Пример 7.
В ходе следующего эксперимента, целью которого, в частности, была оценка силы иммунного ответа на антиген, индуцированного с помощью устройства данного изобретения, после имплантации и заполнения устройства антигеном проводили исследование пролиферации клеток селезенки. При этом следовали протоколу, который описан в предыдущих примерах. В качестве антигена в этом эксперименте использовали овальбумин; в устройство вводили различные количества овальбумина в пределах от 10 пг до 50 мкг; контрольных животных иммунизировали путем инъекции в подушечку лапы тех же количеств антигена с добавлением адъюванта Райби.
Через 10 дней после имплантации мышей умерщвляли и извлекали селезенки. Исследование пролиферации проводили на 96-луночных планшетах. Вносили по двести тысяч клеток в лунку и экспонировали в присутствии 180 мкг/мл антигена в течение 72 часов при 37oС; в качестве контроля использовали такую же дозу вируса Эпштейн-Барра. После воздействия антигена или используемого для контроля вируса клетки импульсно метили 3H-тимидином в течение 6 часов, измеряли включение метки и полученные данные выражали в виде индекса стимуляции.
На фигуре 9 показано, что иммунизация мышей с помощью устройства, содержащего овальбумин, приводила к сильному антиген-специфичному пролиферативному ответу клеток селезенки. Ответ наблюдался уже при иммунизации животным низкими, измеряемыми пикограммами, количествами антигена. Пролиферативный ответ Т-клеток селезенки животных, иммунизированных традиционными способами с адъювантом, наблюдался только при концентрациях антигена, которые были выше на 5-7 логарифмических порядков. Незначительные уровни стимуляции контрольным (вирус Эпштейн-Барра) антигеном (данные не показаны) свидетельствует о том, что вызванный иммунный ответ на овальбумин высоко специфичен.
В следующем эксперименте с использованием овальбумина в качестве антигена мышей иммунизировали с помощью устройства данного изобретения или в подушечку лапы 50 мкг, 50 нг или 50 пг овальбумина, либо только одним овальбумином в устройстве, либо с адъювантом БЦЖ в устройстве, либо в подушечку лапы с адъювантом Райби. Адъювант БЦЖ (бацилла Кальметт-Герена, Bacille Calmette Guerin), используемый в этих экспериментах, TheraCys(R), высушенная вымораживанием суспензия аттенуированного штамма Mycobacterium bovis, получены Connaught Laboratories Limited для лечения in situ карциномы мочевого пузыря. Через десять дней после иммунизации собирали клетки селезенки и экспонировали в условиях in vitro с различными концентрациями антигена (от 1,4 до 180 мкг/мл) или с такими же концентрациями контрольного антигена, в качестве которого использовали вирус Эпштейн-Барра. После 72-часовой инкубации клетки импульсно метили 3H-тимидином в течение 6 часов и включение метки выражали в виде индекса стимуляции и использовали в качестве показателя стимуляции и пролиферации Т-клеток.
На фигуре 10 показано, что в результате применения устройства данного изобретения может быть достигнут сильный антиген-специфичный Т-клеточный ответ на низкие дозы антигена. После экспозиции клеток селезенки с контрольным антигеном были выявлены очень незначительные уровни стимуляции, из чего следует, что был индуцирован специфичный ответ на иммуноген.
Пример 8.
Антиген-специфичный гуморальный ответ против используемого в качестве антигена пептида gp120 HIV (остатки 315-322, RIQRGPGRAFVTIGK) оценивали после внесения очень низких доз антигена в устройство данного изобретения. Мышей BALB/c иммунизировали различными дозами пептида HIV либо с помощью устройства, либо в подушечку лапы с адъювантом Райби. Через 10 дней после иммунизации собирали образцы крови и определяли титр антител против пептида. Спустя четыре дня проводили бустер-иммунизацию, используя иммуноген в количестве, равном 10% количества иммуногена при первой иммунизации, второй отбор проб крови проводили спустя 10 дней для определения титра антител.
Метод ELISA использовали для измерения уровня антиген-специфичных антител субкласса IgG2a, который выполняли в соответствии со стандартной методикой. Коротко, в титрационные микропланшеты наслаивали фосфатно-солевой буфер, содержащий антиген (1 мкг/мл) в течение 16 час при 4oС. Планшеты промывали (50 мМ трис + 0,2% твин-20 в ФСБ, рН 7-7,5) и блокировали блокирующим буфером (5% раствор БСА + 0,1% твин-20 в ФСБ, рН 7,2-7,4) при 4oС в течение 16 час. Планшеты промывали и в лунки добавляли образцы сыворотки объемом 100 мкл, начиная с разведения 1:50 и далее делая каждый раз 3-кратное разведение. Образцы тестировали в двух повторах. После инкубации в течение 1 час при комнатной температуре планшеты промывали, как описано выше, и в лунки добавляли раствор, содержащий биотинилированные IgG2a антитела мыши (1 мкг/мл). После 1-часовой инкубации и интенсивного промывания, как описано выше, в лунки добавляли конъюгированную со стрептавидином пероксидазу хрена, разведенную до 1: 4000 в блокирующем буфере. Через 30 минут инкубации при комнатной температуре добавляли субстрат (100 мкл/лунку тетраметилбензидина). Планшеты инкубировали в течение 30 минут. Реакцию останавливали добавлением 100 мкл/лунку 2 н. H2SO4. Планшеты анализировали с помощью анализатора ELISA Plate Reader при длине волны 450 нм.
На фигуре 11 показан уровень специфических IgG2a против пептида gp120 HIV и показано, что вследствие однократной иммунизации с применением устройства данного изобретения можно добиться сильного антиген-специфичного гуморального ответа (IgG2a), в то время как при однократной иммунизации в подушечку лапы, выполненной в соответствии со стандартным протоколом, ответ не проявлялся. Вследствие повторной иммунизации (бустер-иммунизации) в подушечку лапы у животных, иммунизированных традиционным способом, возникал гуморальный ответ, но у животных, первично иммунизированных с помощью устройства данного изобретения и затем вторично иммунизированных (10% первоначальной дозы, введенной в устройство), был выявлен повышенный уровень IgG2a и еще значительно более сильный ответ на низкие уровни антигена (фигура 12).
Пример 9.
Оценивали влияние различных адъювантов на конечные иммунные ответы, возникающие при иммунизации с помощью устройства данного изобретения по сравнению с традиционной иммунизацией в подушечку лапы. Мышей BALB/c иммунизировали либо с помощью устройства, либо в подушечку лапы различными дозами пептида gp120 HIV (предыдущий пример), причем либо одним антигеном, либо с адъювантами Райби или БЦЖ, как описано выше. Устройство снабжали иммуногеном через три дня после имплантации, и определяли титр антител через 10 дней после иммунизации. ELISA для выявления IgG2a антител, специфичных против антигена пептида gp120, выполняли, как описано в предыдущем примере. Традиционная иммунизация с адъювантами Райби или БЦЖ вызывала низкий уровень продукции специфичных для пептида IgG2a (фигура 13). Напротив, иммунизация с помощью устройства данного изобретения без адъюванта (50 нг пептида) вызывала заметно более высокий уровень продукции специфичных против пептида IgG2a. Пептид в комбинации с каким-либо адъювантом (Райби или БЦЖ) индуцировал слабый ответ. Эти данные означают, что добавление адъюванта к уже сильному антигенному стимулу приводит к депрессии иммунного ответа. Возможно, что для того чтобы продемонстрировать дополнительное действие или синергизм адъюванта и антигена, процедуру иммунизации следует выполнять при более низких значениях дозы антигена (ниже, чем дозы, измеряемые фемтограммами), а также при более низких концентрациях адъювантов.
Сходные результаты были получены в случае тестирования 15-мерного пептида гликопротеина В вируса простого герпеса
(остатки 497-507: TSSIEFARLQF).
Пример 10.
В следующем тесте для определения силы гуморального иммунного ответа, индуцированного антигеном, присутствующим в устройстве данного изобретения, мышам BALB/c имплантировали устройства, в которые спустя три дня вводили различные дозы цитохрома С. В качестве контроля различные дозы этого же антигена вводили через подушечку лапы в комбинации с адъювантом Райби. Через десять дней после имплантации или через десять дней после инокуляции в подушечку лапы у животных брали кровь и методом ELISA проводили исследование сыворотки на наличие IgG2a, которые специфично узнают антиген. Процедуры проводили сходным образом, как описано в предыдущем примере, за исключением того, что для ELISA использовали серийные разведения сыворотки от 1:50 до 1: 6400.
На фигуре 14 показано, что очень сильный специфический гуморальный иммунный ответ на антиген достигается при очень низких дозах антигена, используемых в устройстве данного изобретения. Такая низкая доза антигена в устройстве как 50 фемтограмм вызывает гуморальный ответ, сходный с ответом, который достигается традиционной иммунизацией в подушечку лапы с добавлением адъюванта и использованием 5 нг антигена, увеличение ответа на 4 порядка.
Пример 11.
Развитие гуморального ответа далее оценивали, используя в качестве антигена белок гемагглютинин, который расщепляли и очищали из вируса гриппа А (антиген, представляющий собой расщепленный гемагглютинин, РГА). Мышей BALB/c иммунизировали с помощью устройства данного изобретения, используя дозы 0,1 и 10 мкг, введенные в устройство на 3 день после имплантации. Контрольных мышей иммунизировали теми же количествами антигена с адъювантом Райби подкожно в основание хвоста. Образцы крови у мышей брали на 7, 14, 21 и 28 дни после иммунизации и анализировали сыворотку методом ELISA на наличие общей фракции IgG антител, специфичных против антигена.
Как показано на фигуре 15, получен сильный гуморальный ответ при использовании 0,1 мкг антигена, высокая концентрация ГА-специфичных антител достигалась уже через 2 недели после иммунизации. У мышей, иммунизированных в соответствии с традиционным протоколом с адъювантом, выявляли низкий уровень антиген-специфического гуморального ответа на второй неделе, этот уровень возрастал на 3 и 4 неделе после иммунизации. Уровень РГА-специфичных антител в сыворотке мышей, иммунизированных с помощью устройства, был на 75-80% выше, чем уровень, достигнутый вследствие традиционной иммунизации высокими дозами антигена и в присутствии адъюванта. В этом эксперименте низкие дозы иммуногена в устройстве вызывают более сильный гуморальный ответ, чем достигался с высокими дозами. Как видно из предыдущих экспериментов, дозы выше чем 5 мкг могут вызвать супрессию иммунного ответа, возможно вследствие побуждения к апоптозу как реакции на сверхстимуляцию.
Пример 12.
Значение перфорированного, но сделанного из непроницаемого материала и биологически инертного покрытия или контейнера, который окружает губчатый матрикс устройства данного изобретения, оценивали путем иммунизации мышей антигеном вируса гриппа либо с использованием устройства, описанного выше, в неизменном виде, либо используя только один губчатый матрикс, имплантированный рядом с отрезком перфорированной трубки. Были определены значения доз антигена (0, 50 пг, 500 пг, 5 мкг и 50 мкг) и введены в устройства или в отдельно используемые губки через три дня после имплантации. В качестве контроля иммунизировали мышей в подушечку лапы с использованием таких же доз антигена вместе с адъювантом Райби. Через 10 дней после имплантации или иммунизации в подушечку лапы у животных собирали селезенки и проводили исследование пролиферации Т-клеток, как описано выше, используя пределы уровней антигена от 0,1 до 180 мкг/мл. В качестве контроля на специфичность in vitro использовали вирус Эпштейн-Барр. Включение 3H-тимидина выражали в виде индекса стимуляции, чтобы представить стимуляцию и пролиферацию Т-клеток.
Как показано на фигуре 16, активация Т-клеток, выявляемая у животных, иммунизированных интактным устройством, свидетельствует о существенно более сильном ответе, чем в том случае, когда антиген присутствует в губках, которые не помещены в перфорированный, но сделанный из непроницаемого материала контейнер. Ответ на неродственный антиген был минимальным, фигура 18.
Пример 13.
Значение перфорированного, но изготовленного из непроницаемого материала и биологически инертного покрытия или контейнера, который окружает пористый матрикс устройства данного изобретения, оценивали с помощью теста на диффузию. 200 мкг бычьего сывороточного альбумина (БСА) инъецировали в устройство или в губку. Устройство и губку помещали в пробирки, содержащие 1,5 мл ФСБ. Образцы отбирали в разные периоды времени и измеряли концентрацию БСА.
Как показано на фигуре 18, все содержимое полностью высвобождалось из губки в течение 5 минут инкубации. Устройство данного изобретения контролировало высвобождение антигена и более 65% антигена оставалось в течение 960 мин. Поддержание диффузионного барьера, чтобы сохранить высокие уровни антигена, цитокинов, хемокинов и других дополнительно стимулирующих молекул внутри устройства для обеспечения контакта с иммунными клетками, несомненно, выдвигается как один из важнейших механизмов, обеспечивающих существенные преимущества устройства перед традиционными процедурами иммунизации для стимуляции сильного иммунного ответа.
Таким образом, примеры, представленные выше, демонстрируют способность устройства данного изобретения стимулировать более сильный Т-клеточный и гуморальный ответ на многие антигены, по сравнению с традиционной иммунизацией в подушечку лапы и по сравнению с простым заполнением антигеном имплантируемого губчатого матрикса.
Пример 14.
Были определены фенотипы клеток, присутствующих после имплантации в устройстве данного изобретения без добавления антигена. Клетки, выделенные из устройства данного изобретения через 4 дня после имплантации, собирали, промывали и окрашивали с помощью меченных флуоресцинизотиоцианатом или фикоэритрином моноклональных антител, специфичных по отношению к следующим маркерам: CD14, CD45/B220, CD11b, CD40, CD11c, CD80, CD86, CDS и I-Ad (PharMingen, CA). С помощью проточной цитометрии определяли средние геометрические значения флуоресценции. Для сравнения определяли флуоресценцию лимфоцитов периферической крови (ЛПК) интактных, сингенных мышей, используя тот же набор специфических антител, и результаты, полученные для каждого из антител, выражали в виде среднего значения интенсивности флюоресценции (СИФ).
На фигуре 19 представлены фенотипы клеток, выделенных из устройства на 4 день после его введения. Очевидно, что происходила миграция и накопление в устройстве при высокой плотности Т-клеток (CD3, CD40), макрофагов (CD14, CD11b, MHC класса II, CD80), дендритных клеток (CD40, CDllc, MHC класса II, CD80) и В-клеток (MHC класса II, CD45/B220, CD11b). Таким образом, в устройстве присутствуют иммунные клетки, имеющие важное значение для развития иммунного ответа. Экспрессия дополнительно стимулирующих (CD80 и CD86) и адгезионных (CD44) молекул существенно выше в иммунных клетках, выделенных из устройства данного изобретения, по сравнению с ЛПК (данные не показаны). Интересно, что электронно-микроскопический анализ среза устройства данного изобретения показал присутствие макрофагов с большим количеством лизосом, что свидетельствует о повышенной степени активации клеток.
Пример 15.
Сравнивали концентрацию цитокинов в устройстве данного изобретения после имплантации в отсутствие антигена с концентрацией цитокинов в сыворотке интактных мышей. Как показано на фигуре 20, устройство содержало более высокие уровни стимулирующих цитокинов Ил-2, Ил-4 и TNF-α и приблизительно одну седьмую часть концентрации ингибирующего цитокина TGF-β (данные не показаны). Таким образом, устройство данного изобретения представляет собой высоко насыщенное окружение, имеющее все необходимые компоненты для вспышки иммунного ответа, "подожженного" однажды антигеном.
Пример 16.
Реакции цитотоксических Т-лимфоцитов (ЦТЛ) предположительно являются наиболее важными для развития иммунитета на вирус гриппа. Чтобы оценить способность устройства данного изобретения вызывать появление антиген-специфических ЦТЛ, мышей иммунизировали 500 пг вакцины вируса гриппа, помещенной в устройство данного изобретения. В качестве контроля мышей иммунизировали подкожно 500 пг вакцины с адъювантом Райби. Получали лимфоциты иммунизированных животных и определяли их специфичность по отношению к вирусу гриппа путем лизиса инфицированных вирусом гриппа клеток мишеней. ЦТЛ получали следующим образом. Мышей умерщвляли и извлекали селезенки. Получали суспензию, состоящую из одних клеток, и клетки промывали ФСБ. От эритроцитов избавлялись с помощью лизирующего буфера Red Cell Lysis Buffer (Sigma, МО). Клетки селезенки (5 х 106) культивировали in vitro совместно с 5 х 106 инфицированных вирусом (100 HAU(гемагглютинирующих единиц)/107 клеток/мл в течение 60 минут при 37oС) и облученных (3000 рад) сингенных клеток селезенки и инкубировали в течение 5 дней при 37oС, 5% СО2.
Инфицированные PR8 (500 HAU/106 клеток) клетки P1.HTR и неинфицированные клетки P1. HTR использовали в качестве мишеней для определения цитотоксичности. Клетки метили 100 мКи Na2 51CrO4 в течение 90 минут и затем три раза промывали. Клетки мишени (104/мл) в 100 мл среды RPMI 1640 с 5% фетальной телячьей сыворотки добавляли к эффекторным клеткам в различных концентрациях, начиная с соотношения 100:1 (эффекторные клетки: клетки мишени) и титруя с двукратным разведением в 96-луночные титрационные микропланшеты, в которых лунки имеют округлое дно. После инкубации в течение 5 часов собирали надосадочную жидкость. Результаты выражали в процентах специфического высвобождения 51Сr по формуле:
[(экспериментальное высвобождение) - (спонтанное высвобождение)] х 100/[(максимальное высвобождение) - (спонтанное высвобождение)].
Как показано на фигуре 21, иммунизация 500 пг вакцины вируса гриппа с помощью устройства данного изобретения инициировала мощные специфичные против вируса гриппа реакции ЦТЛ, которые значительно эффективнее лизировали инфицированные вирусом гриппа клетки мишени, по сравнению с ЦТЛ, полученными в ответ на традиционную подкожную иммунизацию с адъювантом Райби. Появившиеся ЦТЛ не убивали неинфицированные клетки in vitro, что свидетельствует о специфичности вызванного ответа. При более высоких дозах антигена в устройстве данного изобретения стимуляция не наблюдалась.
Пример 17.
Для того чтобы определить, можно ли с помощью иммунизации устройством данного изобретения также модулировать гуморальный иммунный ответ, мышей иммунизировали несколькими разными дозами вакцины вируса гриппа, либо вводя вакцину в устройство данного изобретения, либо инъецируя подкожно с адъювантом Райби. В сыворотке мышей после иммунизации устройством данного изобретения, содержащим низкие дозы вакцины, были выявлены высокие по сравнению с подкожной иммунизацией в комбинации с адъювантом Райби уровни специфичных против вируса гриппа антител IgM, IgG1 и IgG2a (данные не показаны). При анализе специфичных против вируса антител IgG1 обнаружена высокая степень связывания, которая была измерена благодаря регистрации оптической плотности при возрастающих разведениях сыворотки (фигура 22). Сходные результаты наблюдались для IgG2a антител.
Пример 18.
Чтобы определить относительное сродство антител к антигену вируса гриппа, сравнивали антитела, продуцируемые в сыворотке при иммунизации с помощью устройства данного изобретения, и антитела, полученные при традиционной процедуре с адъювантом, при этом антитела подвергали воздействию возрастающего градиента молярной концентрации KSCN (тиоцианат калия), используемого для того, чтобы элюировать антиген-специфические антитела из комплексов, связанных с покрытыми антигеном микропланшетами для титрования. Использовали стандартный формат ELISA на основе микропланшетов для титрования, как описано выше. Перед добавлением биотинилированных анти-IgG мышей, планшеты промывали и в лунки добавляли различные концентрации KSCN. Планшеты инкубировали при комнатной температуре в течение 30 минут. После промывания в лунки добавляли раствор биотинилированных антител анти-IgG мышей (0,5 мкг/мл). Чтобы разорвать комплекс, возникающий в результате связывания высоко аффинных антител с антигеном, необходимы повышенные концентрации KSCN. Как показано на фигуре 23, образующиеся антитела обладали высоким сродством к вирусным антигенам. Таким образом, в случае использования устройства данного изобретения, для того чтобы стимулировать сильный иммунный ответ, достаточны очень малые дозы вакцины.
Пример 19.
Возможность обеспечить защиту млекопитающих от инфекционных заболеваний при иммунизации с помощью устройства данного изобретения тестировали на модели гриппа мышей. Чтобы иммунизировать мышей либо с помощью устройства данного изобретения, либо подкожным введением в комбинации с адъювантом Райби использовали две дозы вакцины вируса гриппа (5 пг и 500 пг). Примерно через 12 недель после вакцинации проводили контрольное заражение животных летальной дозой вируса гриппа. Как показано на фигуре 24, вакцинация с помощью устройства данного изобретения при обеих дозах вакцины вируса гриппа 5 и 500 пг обеспечивала полную защиту, тогда как выживало только 60% мышей, иммунизированных подкожно 500 пг вакцины вируса гриппа с адъювантом Райби. Все животные, иммунизированные дозой 5 пг с адъювантом, погибали в результате заболевания на 14 день. Примечательно, что не только проведенная таким образом иммунизация с помощью устройства данного изобретения обеспечивала полную защиту, но такой же результат достигался при использовании одной сотой этого количества антигена и без адъюванта. Кроме того, мыши, иммунизированные устройством данного изобретения, не изменялись в весе после контрольного заражения вирусом, что свидетельствует о развитии легкой формы заболевания, что коррелирует с их относительной резистентностью к острой инфекции.
Пример 20.
Путем имплантации устройства, содержащего вакцину вируса гриппа, оценивали возможность применения устройства данного изобретения для продукции специфического IgG человека у мышей с тяжелым комбинированным иммунодефицитом (SCID), которым вводили иммунные клетки человека. Мышам SCID Beige CD17 (самки 6-8 недельного возраста) проводили инфузию (внутрибрюшинно) 20 х 106 мононуклеаров периферической крови человека, полученной от здоровых доноров. Через три дня мышей иммунизировали либо внутримышечно, либо имплантируя устройство данного изобретения, в которое предварительно впрыскивали 50 пг вакцины вируса гриппа. Через три недели после иммунизации у мышей брали образцы крови и тестировали сыворотку на наличие специфичной против вируса гриппа гуморальной реакции, используя традиционный метод ELISA. Как
показано на фигуре 25, иммунизация вакциной приводила к продукции специфичного против вируса гриппа IgG человека. Более того, как показано в результате измерения относительного сродства антител сыворотки к антигену вируса гриппа с использованием растворов KSCN возрастающей молярности (как описано выше в примере 18), устройство данного изобретения способствует продукции более высокого титра специфичных против вируса гриппа антител человека, чем тот, который достигается при традиционной внутримышечной иммунизации (фигура 26). Этот способ может быть также использован для создания гибридом человека, способных продуцировать моноклональные антитела человека.
Пример 21.
Большие количества антигена, введенные в устройство данного изобретения, могут вызывать супрессию иммунного ответа. Мышам Balb/c имплантировали устройство, наполненное вакциной вируса гриппа от 5 до 50 мкг, или мышей иммунизировали в подушечку лапы смесью антигена с адъювантом Райби. Мышей забивали на 10 день после иммунизации и выделяли клетки селезенки, которые помещали в 96-луночные планшеты (2 х 105 клеток/лунку). Клетки подвергали воздействию антигена вируса гриппа в течение 72 часов при 37oС. После стимуляции антигеном надосадочную жидкость удаляли из культур и измеряли продукцию гамма-интерферона с помощью набора для ELISA (Endogen). Как показано на фигуре 27, мыши, иммунизированные комбинацией антигена и адъюванта Райби, давали иммунный ответ, который возрастал в прямой зависимости от дозы антигена. Напротив, у мышей, иммунизированных антигеном, находящимся внутри устройства, наблюдалась стимуляция иммунного ответа при низких дозах антигена (как показано в предыдущих приведенных здесь примерах), но ослабление иммунного ответа при высоких дозах антигена. Таким образом, присутствие больших количеств антигена в имплантируемом устройстве данного изобретения приводит к подавлению иммунного ответа. Этот способ может быть применен в методиках лечения, когда необходима специфическая иммуносупрессия, например при трансплантации, аллергии и т.д.
Пример 22.
Кроме того, устройство данного изобретения может быть использовано для возбуждения иммунного ответа на полисахаридный антиген. Однократная иммунизация с помощью устройства, наполненного пневмококковой вакциной (Pneumovax-23), вызывала специфический иммунный ответ. Pneumovax представляет собой поливалентную пневмококковую вакцину, состоящую из высоко очищенных капсульных полисахаридов 23 наиболее распространенных или инвазивных вариантов пневмококка. Мышей иммунизировали 5 мкг или 40 пг вакцины Pneumovax, которую вводили либо в устройство, имплантируемое подкожно, как описано выше, либо инъецировали в подушечку лапы, смешивая с адъювантом Райби. У всех мышей на 10 день брали образцы крови и исследовали методом ELISA для оценки гуморального ответа по уровню суммарного IgG (фигура 29), IgG1 (фигура 30) и IgG2a (фигура 31). Эти результаты показывают, что с помощью устройства данного изобретения может быть достигнут иммунный ответ на полисахаридные антигены.
Пример 23.
Устройство данного изобретения может применяться для возбуждения иммунного ответа на высоко консервативный антиген. В качестве модельного белка для такого эксперимента был выбран циклофилин, так как развитие иммунного ответа на циклофилин достигается с трудом, потому что этот белок высоко консервативен у всех видов млекопитающих. Мышей иммунизировали 5 мкг, 50 пг ил 0,5 нг циклофилина человека либо вводя в устройство данного изобретения и имплантируя подкожно, либо смешивая с адъювантом Райби и инъецируя подкожно. У мышей брали образцы крови и тестировали сыворотку на наличие реакции IgG2a с циклофилином человека методом ELISA. Как показано на фигуре 32, мыши, иммунизированные двумя меньшими дозами антигена с помощью устройства данного изобретения, проявляли более сильный ответ на антиген по сравнению с мышами, иммунизированными подкожно циклофилином с адъювантом Райби. Этот результат демонстрирует способность устройства индуцировать иммунный ответ на высоко консервативные антигены, которые в других случаях не иммуногенны. С помощью иммунизации высокой дозой антигена, введенного в устройство данного изобретения, не удавалось индуцировать иммунный ответ.
Пример 24.
Устройство данного изобретения может применяться для возбуждения иммунного ответа на целые живые организмы. В этом эксперименте мышей иммунизировали живыми личинками анкилостомы, используя либо 5 личинок, помещенных внутрь подкожно имплантированного устройства данного изобретения, либо 1000 живых личинок, инъецированных подкожно с интервалом в 2 недели. Как показано на фигуре 33, при использовании этих двух протоколов происходила индукция L3-специфичного суммарного IgG, как было измерено методом ELISA. Существует возможность иммунизировать против ряда паразитических организмов, включая анкилостому и малярийного паразита, используя облученные личинки и спорозоиты соответственно; проведенные здесь исследования свидетельствуют о том, что иммунизация с помощью устройства данного изобретения может быть достигнута при использовании меньшего количества организмов.
Это изобретения может быть реализовано в других формах или выполняться другими способами без отступления от его сути или основных характеристик. Поэтому данную заявку следует считать поясненной во всех отношениях и не ограниченной, сфера применения изобретения указана в прилагаемой формуле изобретения, и имеется в виду, что она охватывает все изменения, которые подпадают под содержание и круг эквивалентных вариантов.
Здесь цитируются различные публикации, представленные в них материалы включены здесь благодаря ссылке во всей их полноте.
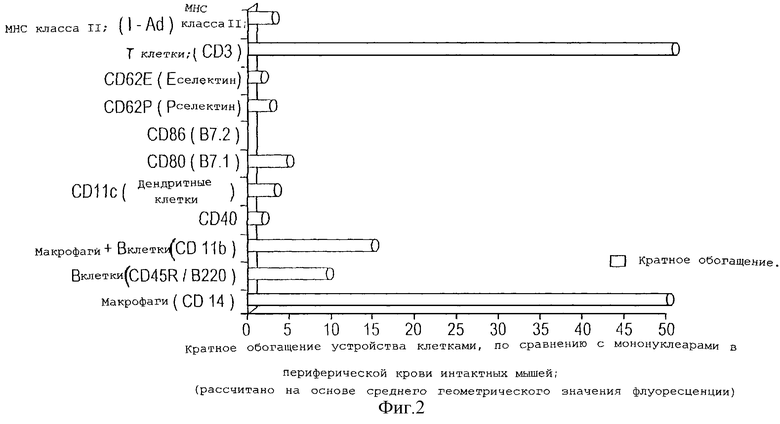
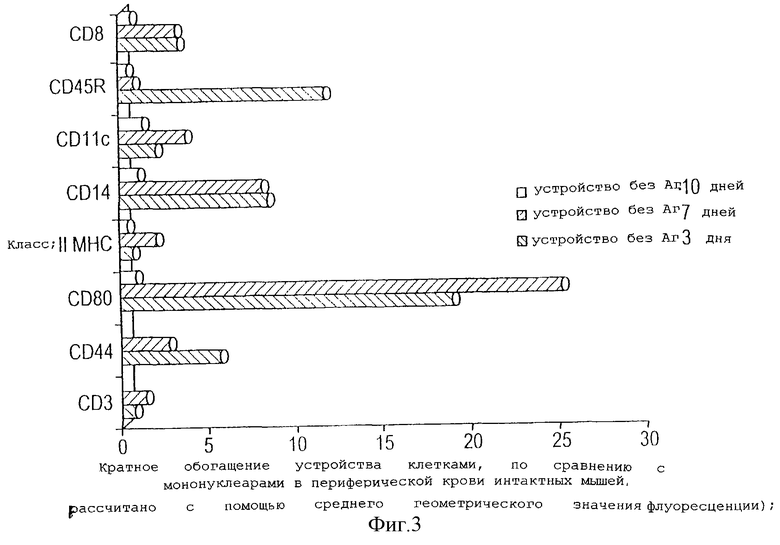

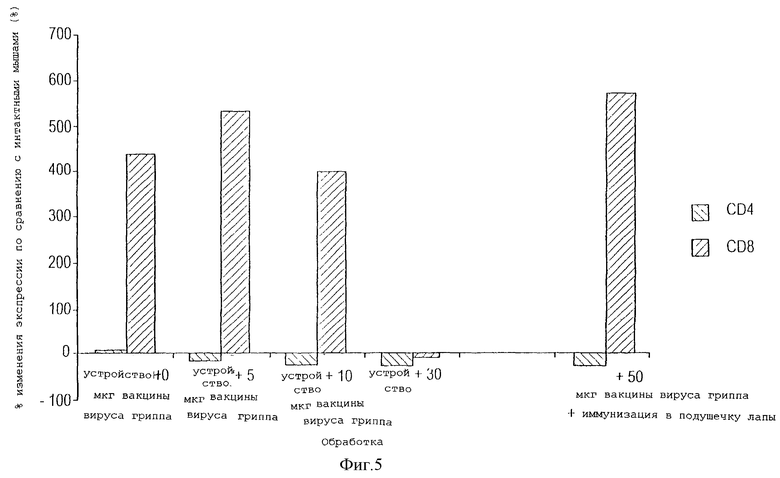



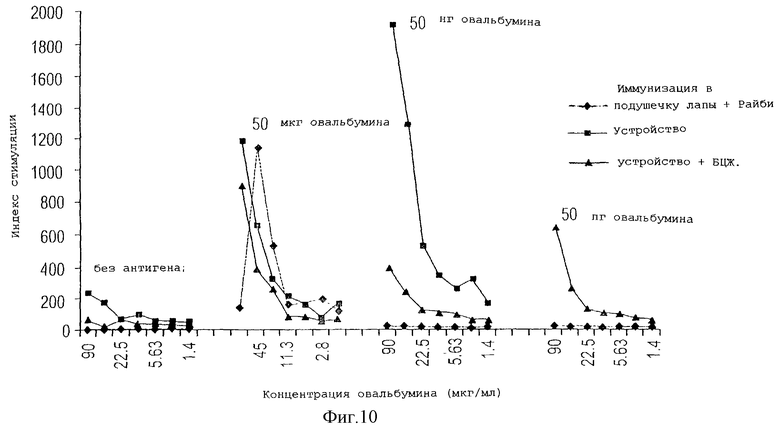
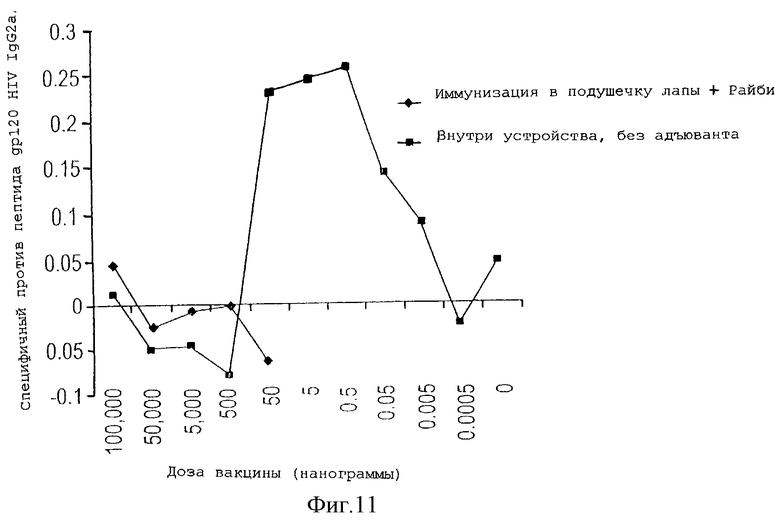

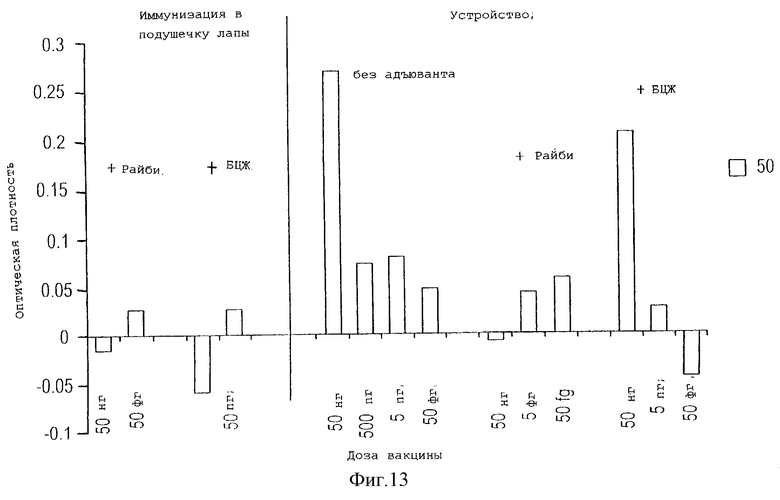
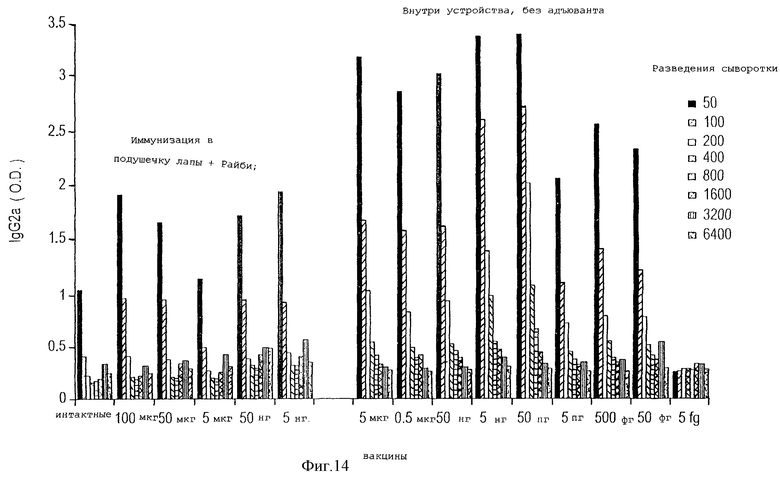
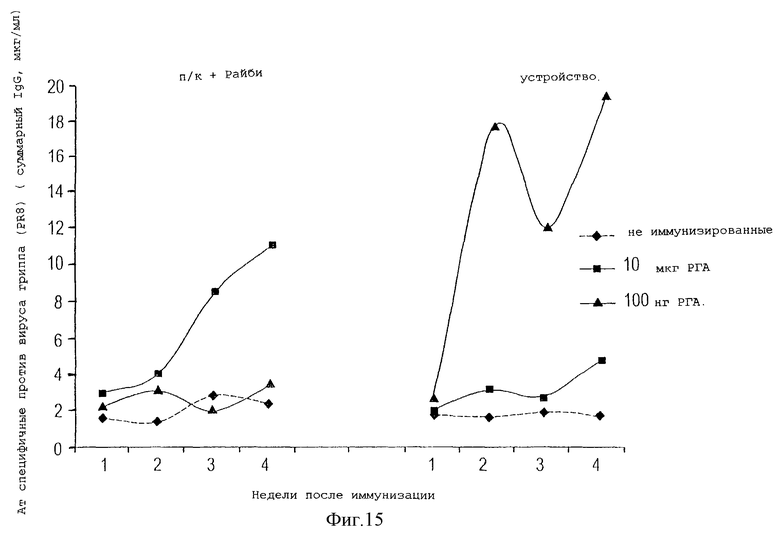
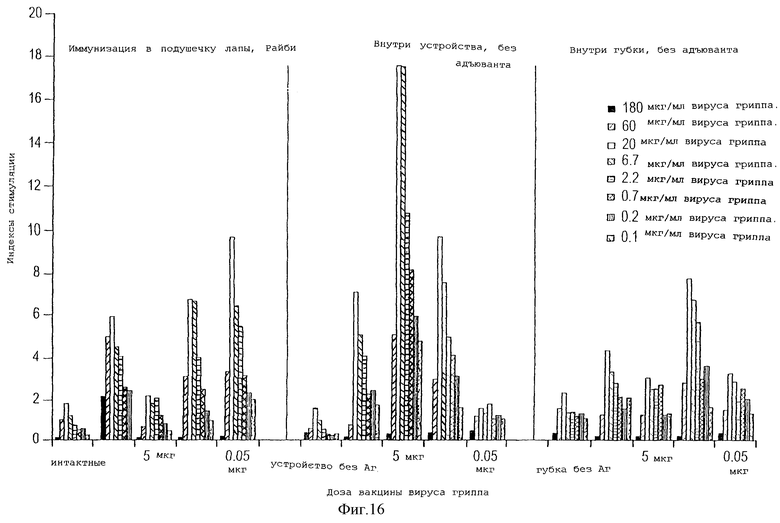





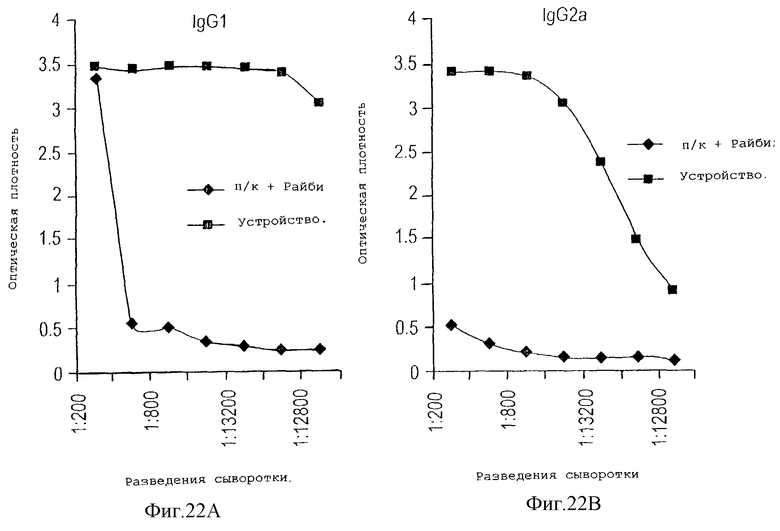
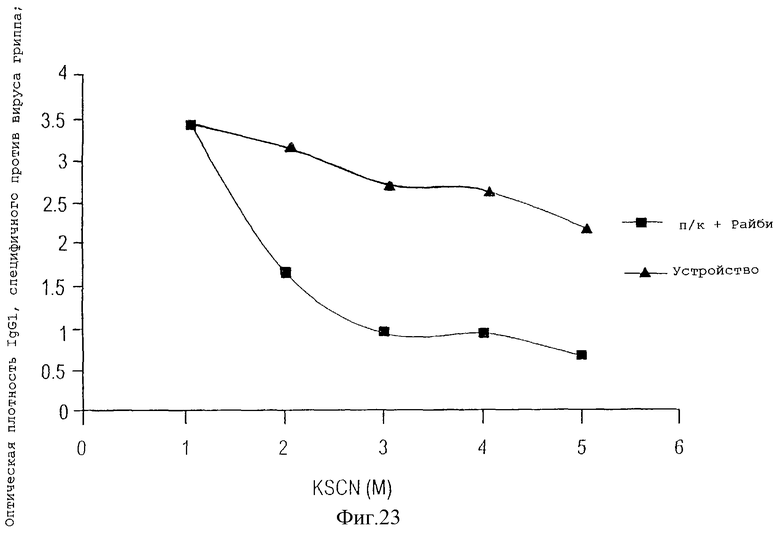
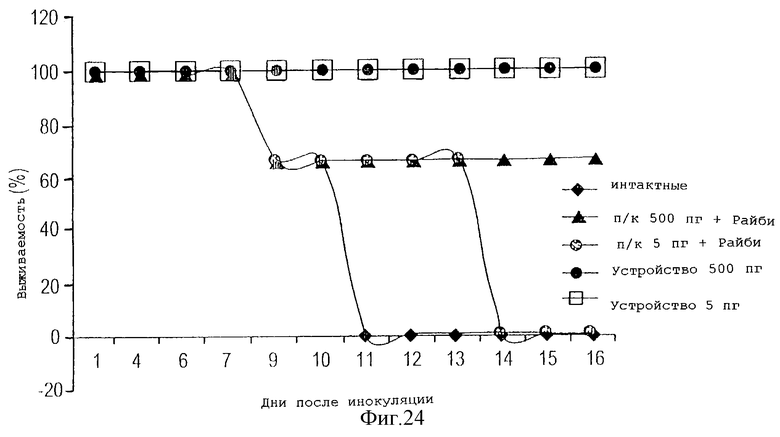
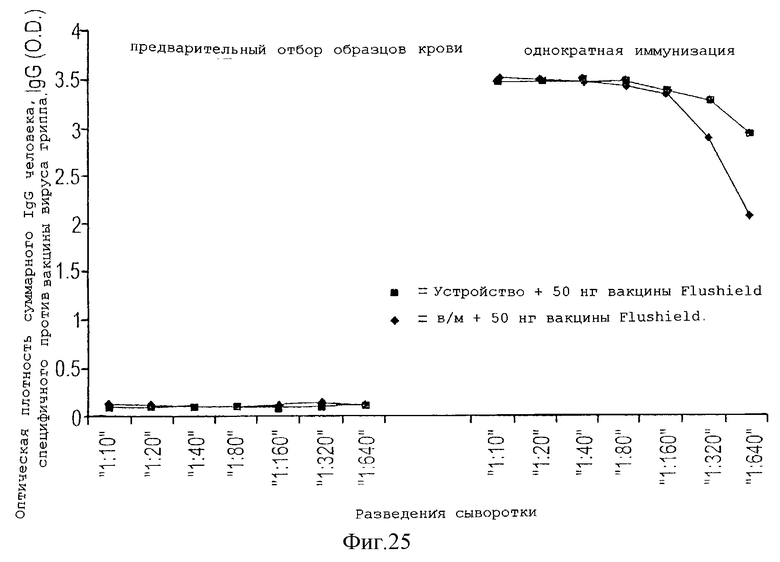

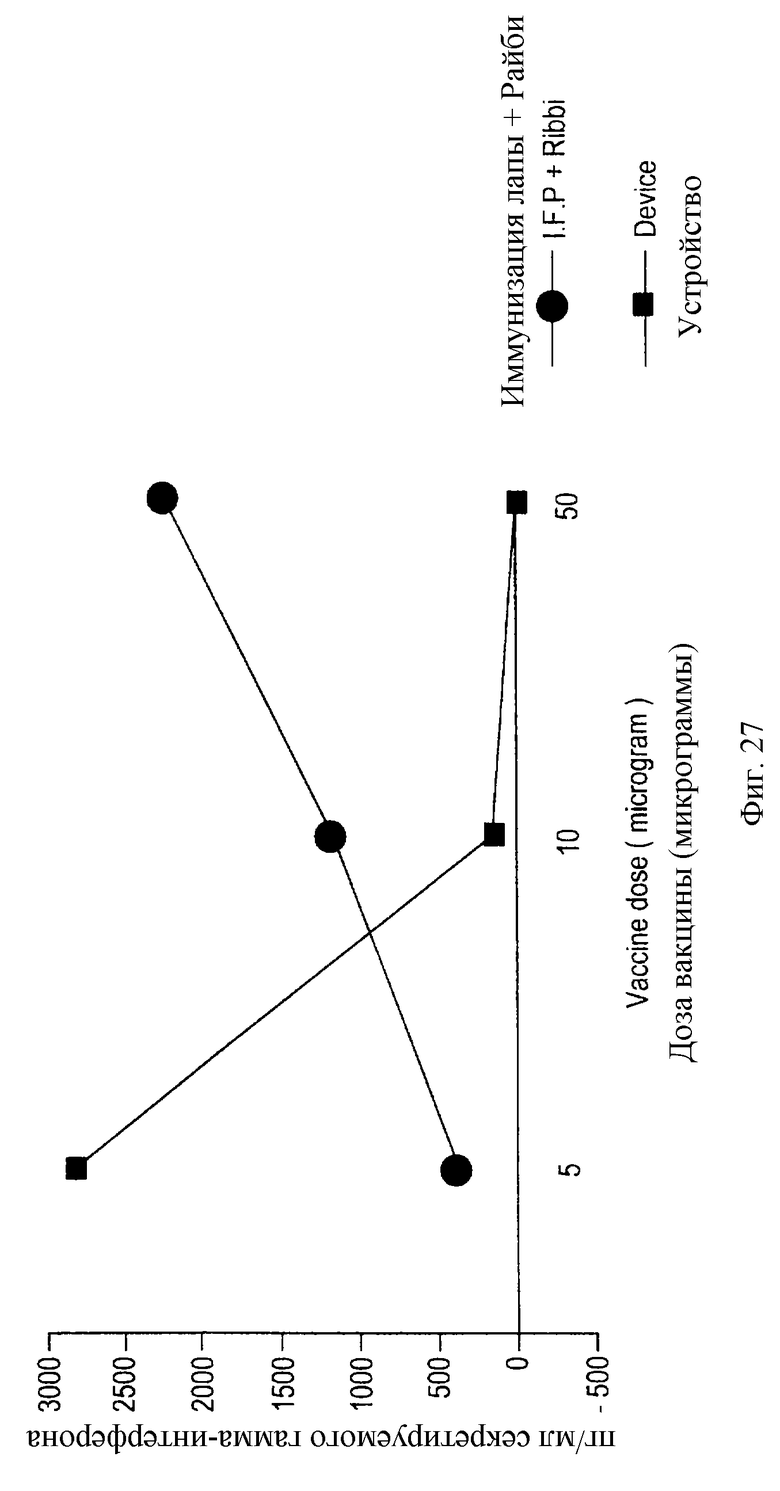
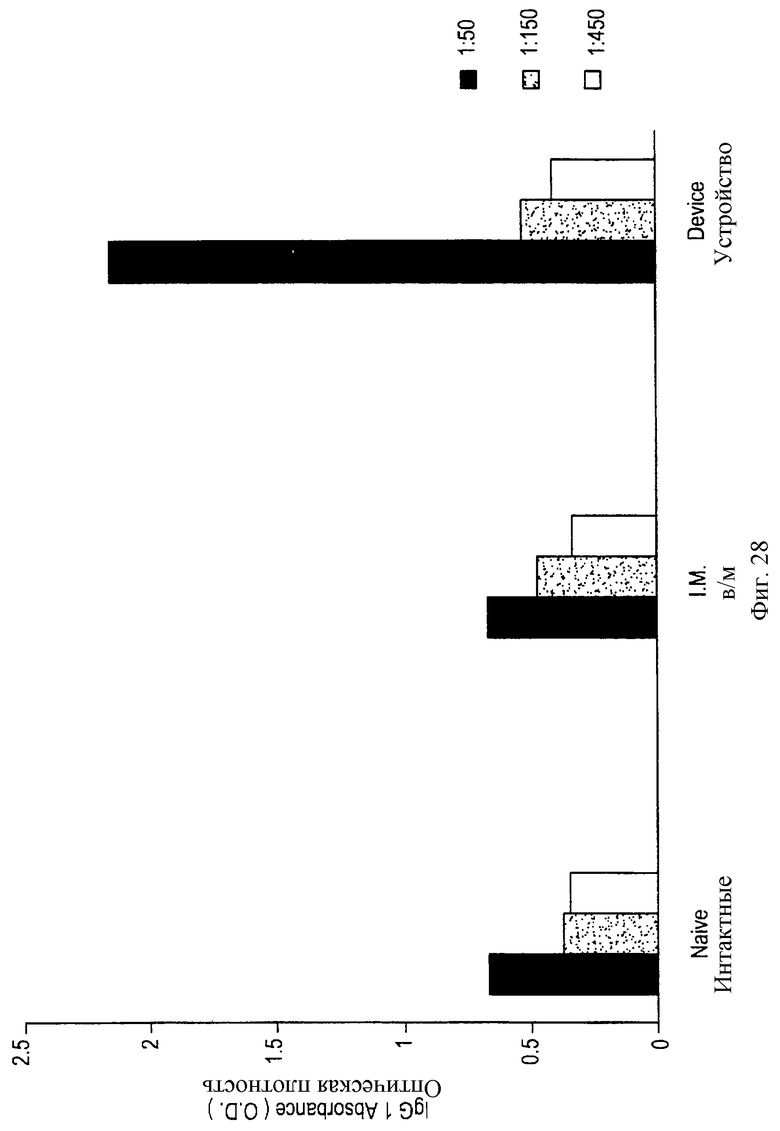
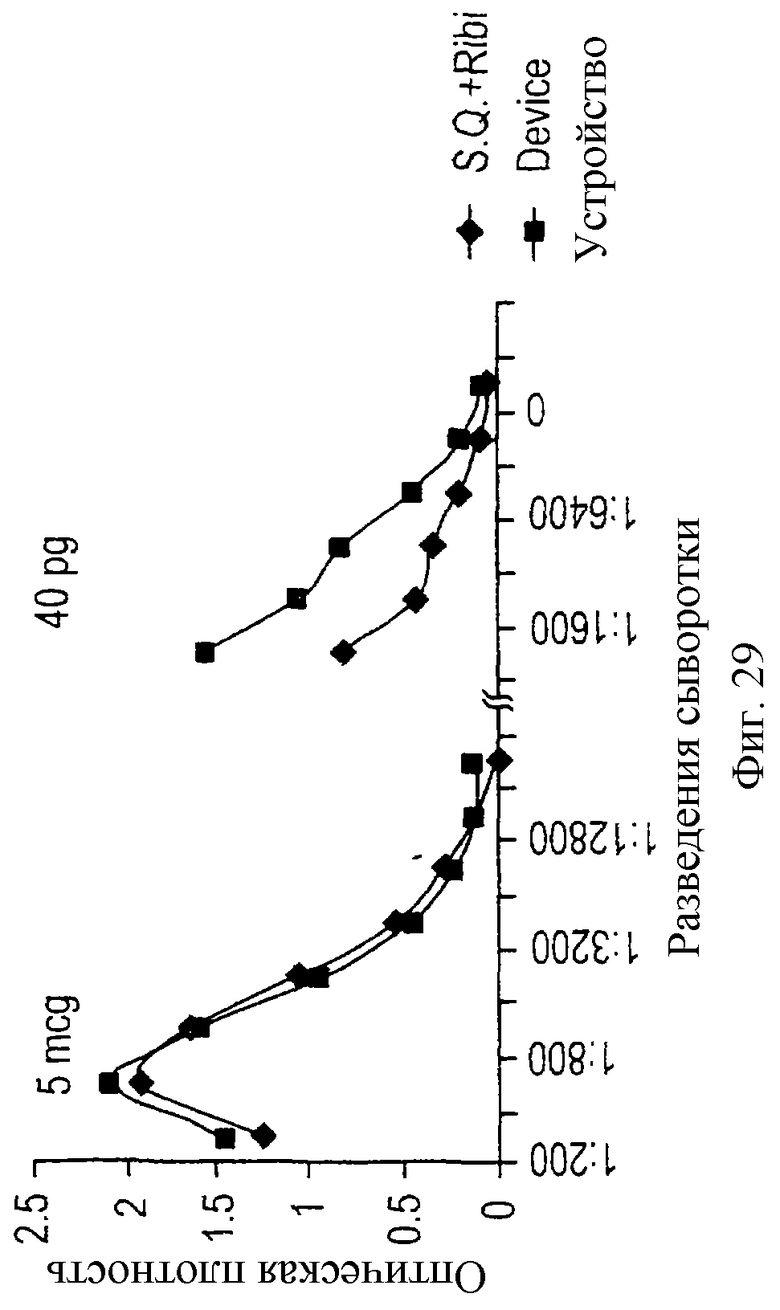




Изобретение относится к области иммунологии, а именно представлены способы и устройства для индукции, стимуляции, блокирования и ослабления иммунного ответа на антиген у млекопитающих. Сущность изобретения: с помощью имплантируемого устройства обеспечивается воздействие клеток иммунной системы на антиген. Устройство включает в себя пористый матрикс, находящийся внутри перфорированного, но изготовленного из непроницаемого материала контейнера. Благодаря манипулированию биологической доступностью антигена внутри устройства и регулированию периода времени введения антигена в устройство относительно времени имплантации устройства млекопитающему может быть индуцирован сильный и пролонгированный ответ, направленный против антигена, или может быть подавлен или блокирован уже существующий или потенциальный иммунный ответ. Способы и устройства могут применяться для терапевтической вакцинации и для профилактической вакцинации млекопитающих, которые не подвергались воздействию антигена. Иммунитет может быть клеточным, гуморальным или местным, основанным на защитных свойствах слизистых оболочек. Технический результат - расширение арсенала средств для лечения или профилактики таких состояний, как аллергия, аутоиммунные заболевания, и для выработки толерантности у млекопитающих супрессии иммунного ответа на антигены трансплантата. 9 с. и 48 з.п. ф-лы, 33 ил.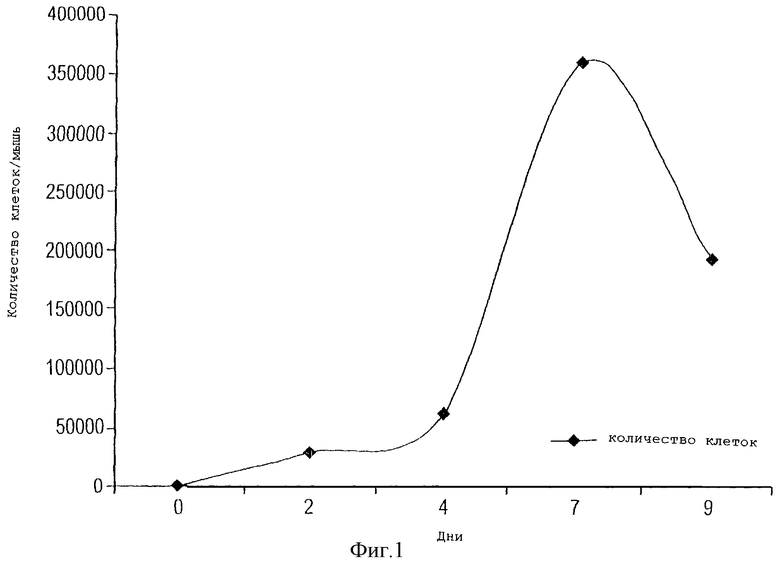
Приоритет по пунктам и признакам:
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| US 4919929 А, 24.04.1990 | |||
| Клиническая иммунология и аллергология | |||
| /Под | |||
| ред | |||
| Л.Йегера | |||
| - М.: Медицина, 1990, с | |||
| Способ отковки в штампах заготовок для спиральных сверл | 1921 |
|
SU367A1 |
Авторы
Даты
2004-03-10—Публикация
1999-03-02—Подача