Изобретение относится к новому биологически активному химическому соединению, конкретно к гидрохлориду N-(β-гидроксиэтил)цитизину (I), формулы

проявляющему антиаритмическую активность. Указанное соединение и его свойства в литературе не описаны.
В настоящее время в медицинской практике при лечении различных нарушений ритма сердца широкое применение находят такие препараты, как хинидин, новокаинамид, аймалин, ритмилен, лидокаин, этмозин и др. Однако указанные средства характеризуются рядом недостатков, а именно: невысокой антиаритмической активностью при различных формах аритмии, относительно высокой токсичностью, наличием гипотензивного и отрицательного инотропного действия, непродолжительностью антиаритмического эффекта [1]. Наиболее важным для препарата, обладающего антиаритмической активностью, является широта его терапевтического действия, высокая эффективность, хорошая переносимость и длительность действия. Большинство применяемых антиаритмических средств имеют серьезные недостатки. Поэтому поиск антиаритмиков остается актуальной задачей.
Наиболее близким по свойствам к заявляемому соединению является аллапинин, клиническое изучение которого показало, что он является высокоэффективным антиаритмическим средством при различных формах нарушений ритма сердца и особенно эффективен при различных формах желудочковых аритмий, пароксимальной мерцательной аритмии и при хронической монофокусной предсердной тахикардии [2-4].
Однако, несмотря на высокий антиаритмический индекс аллапинина, действующим веществом которого является дитерпеновый алкалоид лаппаконитин, его высокая токсичность не позволяет в клинике проявить все его преимущества перед существующими препаратами аналогичного типа действия.
Задача, на решение которой направлено заявленное техническое решение, заключается в поиске новых соединений, обладающих высокой антиаритмической активностью при различных формах аритмии.
В заявленном техническом решении синтезировано новое химическое соединение гидрохлорид N-(β-гидроксиэтил)цитизина (I), проявляющий антиаритмическую активность.
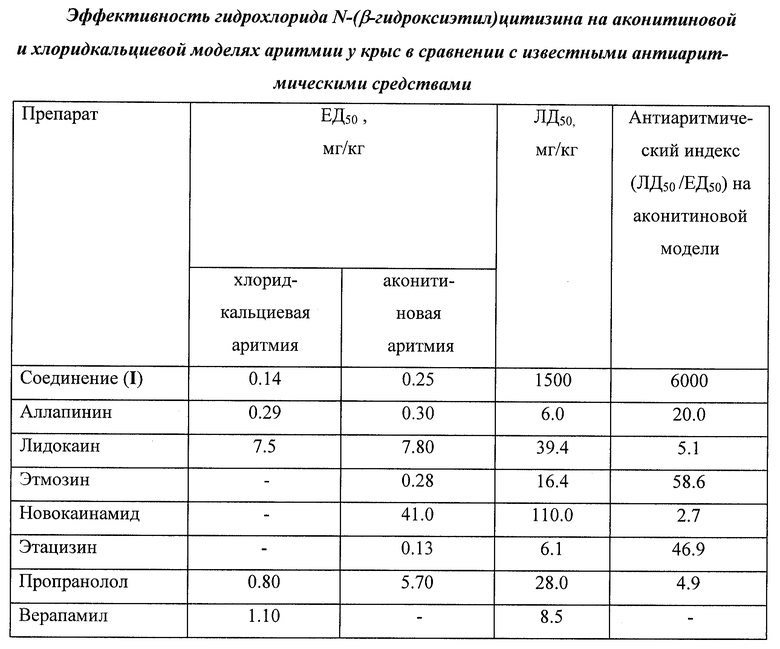
Острая токсичность соединения (I) определялась на белых беспородных крысах массой 150-160 г при внутривенном введении по методу Литчфилда-Уилкоксона. Установлено, что соединение (I) является малотоксичным веществом. Результаты исследований приведены в таблице.
Антиаритмические свойства соединения (I) изучали на аконитиновой и хлорид-кальциевой моделях аритмии сердца. В качестве препаратов сравнения использовали аллапинин и ряд известных антиаритмических средств. Проведенные исследования показали, что соединение (I) обладает высокой антиаритмической активностью на моделях, воспроизводящих различные нарушения ритма сердца, включая наиболее опасную для жизни - фибрилляцию. Результаты исследований приведены в таблице. Соединение (I) проявляет выраженную эффективность на обеих моделях аритмии и имеет наибольший антиаритмический индекс среди известных антиаритмических средств (отношение летальной дозы к эффективной ЛД50/ЕД50). Гидрохлорид N-(β-гидроксиэтил)цитизина (I) по интенсивности антиаритмического действия и хорошей переносимости превосходит большинство известных антиаритмических средств, в 250 раз менее токсичен, чем аллапинин (см. таблицу).
Соединение (I) получали обработкой 5%-ным водным раствором соляной кислоты N-(β-гидроксиэтил)цитизина, полученного взаимодействием цитизина с окисью этилена.
Таким образом, предложено новое малотоксичное соединение - гидрохлорид N-(β-гидроксиэтил)цитизина (I), обладающий высокой антиаритмической активностью при лечении различных форм нарушений ритма сердца.
Сущность изобретения поясняется следующими примерами.
Пример 1. Синтез соединения (I)
1a. Синтез N-(β-гидроксиэтил)цитизина. К раствору 1,0 г (5,3 ммоль) цитизина в 10 мл метанола прилили 0,3 г (8 ммоль) окиси этилена. Реакционную массу выдерживали в течение 3 сут при температуре 0-5°С. Растворитель отогнали под вакуумом, а остаток перекристаллизовывали из метанола. Получили 1,2 г (96%) N-(β-гидроксиэтил)цитизина, т.пл. 76°С. Найдено (%): С, 66,71; Н, 7,65; N, 11,83; C13H18N2O2. Вычислено (%): С, 66,64; Н 7,74; N, 11,96. Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1,25 с (ОН); 1,82 д и 1,94 д (2На-С(11) и С(13), J=12,85 Гц); 2,40-2,60 м (1Н-С(9), 2Н-С(8), 2Нэ-С(11) и С(13)); 3,00 т (2H-NH2, J=9,77 Гц); 3,50 т (2Н-СН2O, J=5,34 Гц); 3,87-3,93 д.д (1Нэ-С(10), J=8,30 и 7,44 Гц); 4,10 д (1Ha-C(10), J=15,51 Гц); 6,00 д (1Н-С(5), J=6,75 Гц); 6,45 д (1H-C(3), J=9,07 Гц); 7,25 и 7,30 д.д (1H-C(4), J=7,37-9,08 Гц). Спектр ЯМР 13С (δ, м.д.): 25,40 т (С(8)); 28,56 д (С(9)); 34,97 д (С(7)); 49,63 т (С(10)); 57,67 т (С(15)); 58,76 т (С(11)); 59,76 т (С(14)); 59,64 т (С(13)); 104,67 д (С(3)); 138,57 д (С(4)); 150,87 с (С(6)); 163,12 с (С(2)).
1б. Синтез гидрохлорида N-(β-гидроксиэтил)цитизина. К раствору 1,0 г (4,3 ммоля) N-(β-гидроксиэтил)цитизина в 10 мл метанола прикапали до кислой реакции 5%-ный водный раствор НСl. Растворители отогнали в вакууме, остаток перекристаллизовали из ацетона, получили 1,1 г (96%) соединения (I). Найдено (%): С, 57,60; Н, 7,05; N, 10,37; C1, 13,10. C13H19N2O2Cl. Вычислено (%): С, 57,67; Н 7,07; N, 10,35; Cl 13,09. ИК-спектр, ν/см-1: 3600 (ОН); 1644 (С-O); 636 (СН=СН). Спектр ЯМР 1Н (D2O, δ, м.д.): 1,90 (уш.с., 1 Н, Н2С(8)); 2,41-2,62 (м, 5 Н, НС(9), Н2С(11), Н2С(13)); 3,02 (т, 2 Н, Н2С(14), J=13,5); 3,22 (уш.с., 1 Н, НС(7)); 3,63 (т, 2 Н, Н2С-ОН, J=6,0); 3,90-4,05 (м, 2 Н, Н2С(10); 6,45-6,57 (м, 2 Н, НС(3), НС(5)); 7,61 (т, НС(4), J=7,9). Спектр ЯМР 13С (δ, м.д.): 26,61 т (С(8)); 29,16 д (С(9)); 37,07 д (С(7)); 52,60 т (С(10)); 60,14 т (С(15)); 61,38 т (С(11)); 62,19 т (С(14)); 62,20 т (С(13)); 111,02 д (С(3)); 143,25 д (С(4)); 154,36 с (С(6)); 166,94 с (С(2)).
Пример 2. Определение острой токсичности
Острую токсичность гидрохлорида N-(δ-гидроксиэтил)цитизина определяли на наркотизированных крысах массой 150-160 г по Литчфилду-Уилкоксону при внутривенном введении бодрствующим животным [5]. За поведением и состоянием животных наблюдали в течение 24 ч после введения препарата. Летальная доза (ЛД50) данного соединения составляет 1500 мг/кг. Исследования показали, что изучаемое соединение (I) является малотоксичным веществом.
Пример 3. Изучение антиаритмической активности гидрохлорида N-(β-гидроксиэтил)цитизина на аконитиновой модели аритмии
Аконитиновая модель аритмии позволяет изучить влияние соединения на смешанную форму нарушений сердечного ритма предсердно-желудочкового типа. Аконитиновую аритмию вызывали введением аконитина в хвостовую вену в дозе 50 мкг/кг наркотизированным крысам массой 150-160 г. Под влиянием аконитина через 1-3 мин возникает политопная экстрасистолия, желудочковая тахикардия и фибрилляция, которую можно сопоставить с аритмией, наблюдающейся в клинических условиях. Регистрировали нарушения ритма предсердно-желудочкового типа Соединение (I) вводили профилактически за 1-2 мин до введения аконитина. Электрокардиограмму (ЭКГ) регистрировали во II стандартном отведении на 3, 5, 10, 15, 20 и т.д. минутах в течение 2 ч. Активность соединения оценивали по его способности предотвращать развитие нарушений сердечного ритма под влиянием аконитина.
Соединение (I) способствовало более быстрому восстановлению аритмии смешанного типа при введении аконитина, уменьшая продолжительность аритмии на 30±4,2 мин по сравнению с контролем. Эффективную дозу (ЕД50) соединения (I) при внутривенном введении на аконитиновой модели аритмии равна 0,25 мг/кг. Результаты исследований приведены в таблице.
Пример 4. Изучение антиаритмической активности гидрохлорид N-(β-гидроксиэтил)цитизина на хлоридкальциевой модели аритмии
Хлоридкальциевую (желудочковую) аритмию вызывали у нелинейных наркотизированных крыс массой 150-160 г введением в хвостовую вену 250 мг/кг хлорида кальция в виде 10% раствора. В большинстве случаев высокие дозы хлорида кальция вызывают летальную фибрилляцию желудочков на 1-2 мин. У некоторых животных желудочковые экстрасистолы в сочетании с синусовой брадикардией и блоком атривентрикулярного проведения сменялось появлением коротких периодов желудочковой тахикардии. Исследуемое соединение (I) вводили внутривенно за 2 мин до введения аритмогена. Электрокардиограмму (ЭКГ) регистрировали во II стандартном отведении. За критерий антиаритмического эффекта принимали уменьшение в процентах случаев летальной фибрилляции и процент предотвращения изучаемым соединением гибели животных. Эффективную дозу соединения (I) (ЕД50) определяли по Литчфилду-Уилкоксону.
На хлоридкальциевой аритмии изучаемое соединение (I) в дозе 0,14 мг/кг полностью предотвращало гибель животных. Данное вещество способствовало уменьшению случаев фибрилляции, вызванной введением летальной дозы СаСl2. Результаты исследований приведены в таблице.
Соединение (I) способствовало более быстрому восстановлению аритмии смешанного типа при введении аконитина, уменьшению случаев летальной фибрилляции, вызванной введением высокой дозы кальция хлорида. Таким образом, гидрохлорид N-(β-гидроксиэтил)цитизина обладает выраженным антиаритмическим действием, превосходящим аллапинин.
Источники информации
1. Машковский М.Д. Лекарственные средства. - М.: Медицина.-1986.
2. Курбанов Р.Д., Абдуллаев Т.А. Фармакодинамика и эффективность аллапинина у больных с нарушением ритма сердца // Клиническая медицина, 1988.- Т.66.- №10.- С.52-55.
3. Сметнев А.С., Голицын С.П., Левин Э.3. Изучение сравнительной антиаритмической эффективности аллапинина, этацизина и мекситила у больных с желудочковыми нарушениями ритма сердца // Тер. арх.-1988.- Т.60.- №8.- С.34-38.
4. Гасилин В.С., Дорофеев Е.В., Розова Н.И. Опыт длительного применения аллапинина в поликлинической практике // Кардиология, 1990.- Т.30.- №9.- С.30-32.
5. Беленький М.Л. Элементы количественной оценки фармакологического эффекта. Л., Медгиз.-1963.-С.152.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГИДРОХЛОРИД 3-(2-ГИДРОКСИЭТИЛ)-1,5-ДИНИТРО-3-АЗАБИЦИКЛО[3.3.1]НОН-6-ЕНА, ПРОЯВЛЯЮЩИЙ АНТИАРИТМИЧЕСКУЮ АКТИВНОСТЬ | 2002 |
|
RU2228334C2 |
| 5-АМИНО-ЭКЗО-3-АЗАТРИЦИКЛО[5.2.1.0]ДЕКАН-4-ОН, ПРОЯВЛЯЮЩИЙ АНТИАРИТМИЧЕСКУЮ, ПРОТИВОВОСПАЛИТЕЛЬНУЮ, АНАЛЬГЕТИЧЕСКУЮ И НООТРОПНУЮ АКТИВНОСТЬ | 2005 |
|
RU2281938C1 |
| ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ РАЗЛИЧНЫХ ФОРМ НАРУШЕНИЯ РИТМА СЕРДЦА | 2000 |
|
RU2180583C1 |
| АНТИАРИТМИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2017 |
|
RU2664668C1 |
| Средство, обладающее антиаритмическим действием | 2016 |
|
RU2630967C1 |
| ПРОИЗВОДНЫЕ 2-МЕРКАПТОБЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ ПРОТИВОИШЕМИЧЕСКОЙ, АНТИАРИТМИЧЕСКОЙ И ПРОТИВОФИБРИЛЛЯТОРНОЙ АКТИВНОСТЬЮ | 1995 |
|
RU2136667C1 |
| КОМПОЗИЦИЯ АМИНОКИСЛОТ С МИКРОЭЛЕМЕНТАМИ, ОБЛАДАЮЩАЯ ПРОТИВОАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ | 1999 |
|
RU2173553C2 |
| N-бензил-N-(2-((2,3,4-триметоксибензил)амино)этан-1,2-диамины, обладающие кардиотропной активностью | 2023 |
|
RU2834294C1 |
| ДИЦИКЛОГЕКСИЛАМИДЫ N-ЗАМЕЩЕННЫХ α-АМИНОКАРБОНОВЫХ КИСЛОТ, ОБЛАДАЮЩИЕ АНТИАРИТМИЧЕСКОЙ И АНТИФИБРИЛЛЯТОРНОЙ АКТИВНОСТЬЮ | 1994 |
|
RU2114821C1 |
| ФУНКЦИОНАЛЬНО ЗАМЕЩЕННЫЕ 1-ФЕНИЛОЛИГООКСИЭТИЛАМИНЫ, ПРОЯВЛЯЮЩИЕ АНТИАРИТМИЧЕСКУЮ АКТИВНОСТЬ | 1997 |
|
RU2141941C1 |
Изобретение относится к химико-фармацевтической промышленности и касается нового соединения, гидрохлорида N-(β-гидроксиэтил)цитизина формулы (I), проявляющего повышенную антиаритмическую активность и обладающего низкой токсичностью. 1 табл.
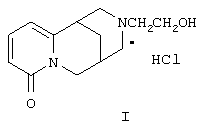
Гидрохлорид N-(β-гидроксиэтил)цитизина формулы

проявляющий антиаритмическую активность.
| Приспособление для разматывания лент с семенами при укладке их в почву | 1922 |
|
SU56A1 |
| Synthesis and preliminary pharmacological evaluation of some cytisine derivatives., Farmaco, 1999, Jul 30, vol | |||
| Видоизменение прибора для получения стереоскопических впечатлений от двух изображений различного масштаба | 1919 |
|
SU54A1 |
| Nicolotti O., Canu Boido С., Sparatore F., Carotti A | |||
| Cytisine derivatives as high affinity nAChR ligands: synthesis and comparative molecular field analysis., Farmaco., 2002, Jun, vol, 57, № 6, p.469-478 | |||
| Butt C.M., Pauly J.R., Debski E.A | |||
| Distribution and development of nicotinic acetylcholine receptor subtypes in the optic tectum of Rana pipiens., J | |||
| Comp | |||
| Neurol., 2000, Aug, 7, № 423, № 4, р.603-618. | |||
Авторы
Даты
2004-05-10—Публикация
2002-07-22—Подача