Изобретение относится к сельскому хозяйству и биотехнологии и может быть использовано в селекции сорго при создании новых сортов и гибридов с помощью генной инженерии, в работах по инсерционному мутагенезу, выделению и клонированию генов сорго.
Известен способ получения трансгенных растений сорго с помощью баллистической трансформации (Casas A.M., Kononovich A.K., Zehr U.B. et al. Trans genie sorghum plants via microprojectile bombardment // Proc. Natl. Acad. Sci. USA, 1993, v. 90, pp. 11212-11216), по которому незрелые зародыши культивируют в течение 24-72 часов на питательной среде, содержащей минеральные соли по Мурасиге и Скугу (MS), витамины по прописи среды В5, L-аспарагин (150 мг/л), сахарозу (30 г/л), кокосовую воду (20 мл/л); 2,4-D (1.5 мг/л) и агар, после чего их подвергают бомбардировке микрочастицами золота или платины с нанесенными на них плазмидными молекулами ДНК, переносят на полужидкую среду исходного состава и культивируют в течение 2 недель. Полученный эмбриогенный каллус пересаживают на среду для субкультивирования, отличающуюся от исходной среды добавкой кинетина (0.5 мг/л), содержащую селективный агент биалофос (3 мг/л). Отбирают устойчивый к селективному агенту эмбриогенный каллус и культивируют его на этой среде в течение 3 месяцев с регулярными пересадками через каждые 2 недели. Затем эмбриогенный каллус пересаживают на среду для регенерации, отличающуюся от среды для субкультивирования заменой 2,4-D на ИУК (1.0 мг/л) и сниженной до 20 г/л концентрацией сахарозы, содержащую биалофос (3 мг/л), и культивируют 2-3 месяца. Затем регенерированные побеги пересаживают на среду для укоренения, отличающуюся от последней сниженной концентрацией минеральных солей (1/2 MS) и биалофоса (1 мг/л), отсутствием кинетина, L-аспарагина и витаминов, но с добавкой НУК (0.5 мг/л). Полученные растения переносят в почву, проверяют на устойчивость к биалофосу и с помощью молекулярно-генетических методов подтверждают наличие встройки плазмидной ДНК.
Недостатками данного способа (аналога) являются значительная дороговизна оборудования, используемого для введения чужеродной ДНК в клетки сорго, низкая частота стабильной трансформации (0.3% зародышей, подвергшихся бомбардировке, дали устойчивый к биалофосу каллус; из 8 испытанных сортов только у одного были регенерированы устойчивые растения), а также длительный и трудоемкий процесс получения трансгенных растений. Кроме того, применение метода баллистической трансформации может привести к попаданию нескольких копий генов в одну клетку, либо вызвать разрыв генетической конструкции, используемой в опыте, что может затруднить экспрессию вводимых генов и/или отбор трансформированных клеток.
Наиболее близким к предлагаемому является способ получения трансгенных растений сорго на основе агробактериальной трансформации незрелых зародышей сорго в культуре in vitro (Zhao Z.Y., Cat Т., Tagliani L. et al. Agrobacterium-mediated sorghum transformation // Plant Mol. Biol., 2000, v.44, pp. 789-798), в соответствии с которым незрелые зародыши сорго помещают на 5 мин в суспензию клеток Agrobacterium tumefaciens (плотность 0.5-1.0×109 кл/мл) в среде для инокуляции, содержащей минеральные соли и витамины по MS, гидролизат казеина (1.0 г/л), 2,4-D (1.5 мг/л), глюкозу (36 г/л), сахарозу (68.5 г/л) с добавкой ацетосирингона (100 μМ) для активации vir-генов, после чего их переносят на 3 дня на среду для сокультивирования, отличающуюся от исходной увеличенной до 2.0 мг/л концентрацией 2,4-D, сниженными до 20 и 10 г/л соответственно концентрациями сахарозы и глюкозы, добавкой L-пролина (0.7 г/л), аскорбиновой кислоты (10 мг/л), MES (0.5 г/л) и агара (8 г/л). Затем зародыши переносят на 4 дня на среду без ацетосирингона, но с добавкой антибиотика карбенициллина (100 мг/л) для подавления роста агробактерий. Затем для индукции эмбриогенного каллуса зародыши переносят на среду, отличающуюся от предыдущей отсутствием глюкозы и сниженной концентрацией 2,4-D (до 1.5 мг/л) и добавкой селективного агента фосфинотрицина (5 мг/л), ген устойчивости к которому (bar) присутствовал в Т-ДНК использованного агробактериального штамма, и культивируют в течение 2 недель. Переносят выживший (устойчивый) каллус на среду того же состава с повышенным уровнем фосфинотрицина (10 мг/л) и пересаживают каждые 2 недели. Для развития эмбриоидов каллус пересаживают на среду, отличающуюся от предыдущей добавкой кинетина (0.5 мг/л) и затем - на среду для побегообразования, отличающуюся от предыдущей отсутствием 2,4-D, увеличенной до 60 г/л концентрацией сахарозы, заменой кинетина на зеатин (0.5 мг/л), добавкой ИУК (1 мг/л), АБК (0.1 μМ) и тидиазурона (0.1 мг/л). Побеги переносят на среду для укоренения - 1/2 MS, НУК (0.5 мг/л), ИБК (0.5 мг/л), сахароза (20 г/л), агар (7 г/л), а затем - на среду того же состава, но без НУК и ИБК. У полученных растений с помощью методов молекулярной генетики анализируют наличие в их геноме встройки фрагмента чужеродной ДНК (Т-ДНК агробактерии).
Данный способ (прототип) позволяет достигать частоты стабильной трансформации до 10.1% в расчете на количество инокулированных зародышей.
Недостатками данного способа (прототипа) является высокая трудоемкость, сложность и длительность процесса получения трансгенных растений. Кроме того, использование системы культуры in vitro, во-первых, может привести к получению сомаклональных вариантов среди растений-трансформантов, во-вторых, ограничивает применение данного способа, поскольку не все образцы сорго (селекционно-ценные линии и гибриды) дают хорошо растущий эмбриогенный каллус с высокой регенерационной способностью, либо же их экспланты, продуцирующие эмбриогенный каллус, некротизируют в результате сокультивирования с агробактериальными клетками.
Цель предлагаемого изобретения - повышение частоты при упрощении и сокращении длительности и трудоемкости процесса получения трансгенных растений сорго.
Поставленная цель достигается тем, что, по предлагаемому способу получения трансгенных растений сорго, включающему обработку сорго суспензией клеток Agrobacterium tumefaciens с активированными vir-генами и отбор трансгенных растений, для получения трансгенных растений используют цветущие метелки сорго, лишенные собственной фертильной пыльцы, которые опыляют пыльцой фертильных растений сорго и до начала завязывания семян на рыльца цветков наносят суспензию клеток Agrobacterium tumefaciens, причем процесс трансформации осуществляют в температурных условиях, способствующих завязыванию семян при сохранении функциональной активности vir-генов, при этом трансгенные растения отбирают среди проростков, выросших из семян, завязавшихся на этих метелках.
Предлагаемое изобретение иллюстрируется чертежом, на котором показаны результаты анализа ДНК некоторых канамицин-устойчивых растений сорго, полученных с использованием предлагаемого изобретения, с помощью метода ПЦР (полимеразной цепной реакции), где 1 - маркер молекулярной массы фрагментов ДНК; 2, 6-8, 10-12 - ДНК трансгенных растений, несущих маркерный ген nptII: 2 - из опыта с использованием плазмиды pAS47, 6-8 - из опыта с использованием плазмиды pTd33 в 2000 г., 10-12 с использованием pTd33 в 2001 г.; 3-5, 9 - ДНК растений, проявивших устойчивость к канамицину, но не являющихся трансгенными; 13 - ДНК растений исходной линии сорго (А2 КВВ-181); 14 - дорожка без ДНК; 15 - ген nptII. На дорожках 2, 6-8, 10-12 отчетливо виден фрагмент ДНК размером 250 п.н., присутствующий на дорожке 15.
Предлагаемый способ получения трансгенных растений сорго осуществляют следующим образом.
Метелки растений сорго изолируют пергаментными изоляторами до начала цветения. Мужски-стерильные растения (несущие мутации цитоплазматической или генной мужской стерильности) используют без кастрации; мужски-фертильные растения перед изоляцией кастрируют. На выброшенные рыльца неопыленных метелок наносят пыльцу фертильных аналогов или растений той же линии. Затем, до начала завязывания семян, например, через 4-7 часов после опыления, на рыльца цветков наносят суспензию клеток штамма Agrobacterium tumefaciens, несущего генетическую конструкцию с функциональными и маркерными генами, подлежащую введению в геном сорго. Используют суспензию в экспоненциальной фазе роста с плотностью клеток, например, 1×106-1×109 кл/мл. В клетках суспензии активируют vir-гены, для чего в суспензию добавляют, например, аце-тосирингон, например, в концентрации 20-200 μM. Нанесение агробактериальной суспензии проводят в температурных условиях, способствующих завязыванию семян при сохранении функциональной активности vir-генов, например, при температуре воздуха 23-25°С. С обработанных растений собирают семена, проращивают их и отбирают проростки, содержащие генетическую конструкцию, подлежащую введению в геном сорго, несущую функциональные и маркерные гены. У таких проростков берут фрагмент ткани, например лист, и с помощью метода ПЦР (полимеразной цепной реакции) проверяют наличие последовательности ДНК функционального или маркерного гена, подлежащего введению в растения сорго. Отбирают проростки, несущие последовательность ДНК данного гена (ПЦР+ проростки), которые являются трансгенными растениями.
Пример конкретного осуществления предлагаемого способа получения трансгенных растений сорго.
Для осуществления предлагаемого способа использовали растения стабильной ЦМС-линии сорго [Sorghum bicolor (L.) Moench] A2 KBB-181, которые выращивали в теплице НИИСХ Юго-Востока (г. Саратов) в 2000-2001 г.г. В качестве доноров пыльцы использовали растения фертильного аналога линии KBB-181, которые выращивали в соседних сосудах.
Трансгеноз осуществляли с помощью Agrobacterium tumefaciens, при этом использовали штаммы GV3101 и LBA4404, которые несли плазмиды соответственно pTd33 и pAS47. В обеих плазмидах присутствовал селективный маркерный ген nptII, обусловливавший устойчивость к канамицину. Суспензию клеток использованных агробактериальных штаммов выращивали на качалке на питательной среде Лурия-Бертани (LB) до плотности 1×106 кл/мл при температуре 28°С. По достижении необходимой плотности в суспензию добавляли ацетосирингон (200 μМ).
До начала цветения метелки сорго тщательно изолировали пергаментными изоляторами. После выбрасывания цветочных рылец метелки опыляли пыльцой фертильного аналога и через 4-7 часов после цветения на рыльца кисточкой наносили суспензию агробактериальных клеток. Нанесение агробактериальной суспензии осуществляли при 23-25°С.
Для выявления трансгенных растений семена, собранные с метелок, обработанных агробактериальной суспензией, и необработанных (контрольных) метелок растений исходной линии, стерилизовали 5%-ным раствором хлорамина (15 мин), интенсивно промывали в проточной воде, замачивали в дистиллированной воде (24 час), повторно стерилизовали в ламинар-боксе 5%-ным раствором хлорамина и без промывки сажали на агаровую среду (1/2 MS), содержащую канамицин (200 мг/л), и выращивали на свету (фотопериод 16 ч/8 ч) (I способ отбора трансгенных растений). По другому способу отбора трансгенных растений зерновки, собранные с обработанных и необработанных метелок, раскалывали пополам; сколы с зародышами стерилизовали согласно вышеописанному способу, замачивали в растворе канамицина (200 мг/л) и после повторной стерилизации в ламинар-боксе без промывки сажали на агаровую среду (1/2 MS), не содержащую канамицина (II способ отбора трансгенных растений). Выявляли устойчивые к канамицину зеленые проростки, пересаживали их в вегетационные сосуды и выращивали в теплице.
Подтверждение трансгенной природы полученных зеленых растений проводили с помощью метода ПЦР. При этом из листьев отобранных растений выделяли ДНК согласно общепринятым методам (Маниатис Т., Фриш. К., Сэмбрук Дж. Молекулярное клонирование. Лабораторное руководство. М.: Мир, 1984. - 453 с.). Реакцию ПЦР проводили с олигонуклеотидными праймерами, специфичными к фрагменту гена nptII размером 250 п.н.: ACAGACAATCGGCTGCTCTGATG и GGCAGGAGCAAGGTGAGATGACA. Циклы выполнялись по схеме: 94°С - 30 с, 60°С - 30 с, 72°С - 1 мин; общее количество циклов 40. Продукты реакции разделяли электрофорезом в агарозном геле. В качестве контроля использовали ген nptII, который несла плазмида pTd33. Для проверки соответствия амплифицированного участка гену nptII проводили рестриктный анализ продуктов реакции с помощью рестриктазы PstI, имевшей рестриктный сайт внутри данного участка гена и разрезавшей его на два фрагмента длиной 100 и 150 п.н.
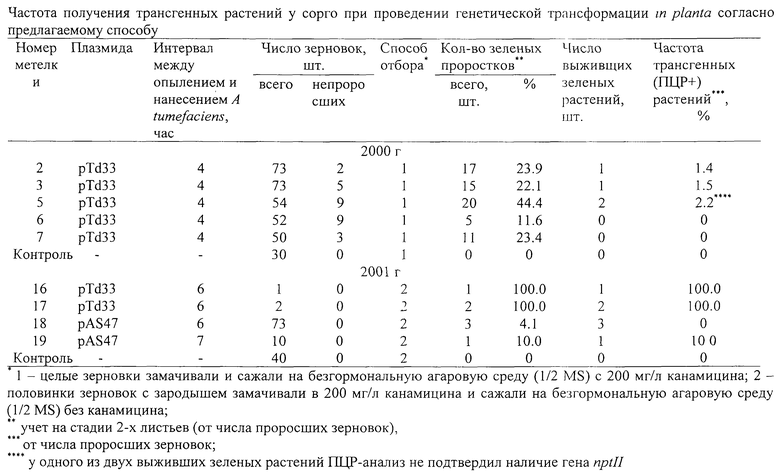
На метелках линии А2 КВВ-181, выращенных в 2000 г., опыленных пыльцой фертильного аналога и обработанных через 6 ч после опыления суспензией клеток агробактериального штамма GV3101 (pTd33), наблюдали хорошую завязываемость семян (80-100%). Потомство, выросшее из этих семян, обладало значительно более высокой устойчивостью к канамицину по сравнению с контролем (исходной линией А2 КВВ-181). Так, в контроле до 100% проростков погибало на стадии развертывания второго листа, тогда как среди проростков, выросших из семян с обработанных метелок, 11-44% оставались зелеными на этой стадии развития (см. табл.). Большинство этих проростков, однако, погибало на последующих стадиях развития, особенно при пересадке в почву. Тем не менее, четыре растения удалось дорастить до взрослого состояния. Результат анализа ДНК показал, что в трех из них присутствует последовательность, соответствующая по своим размерам и сайту рестрикции гену nptII, но отсутствующая у контрольных растений исходной линии (А2 КВВ-181) (см. чертеж). В расчете на число проросших зерновок частота полученных из них взрослых генетически трансформированных растений составила 1.4-2.2%.
При проведении аналогичных экспериментов на этой же линии сорго при выращивании ее в 2001 г. наблюдали значительно более низкий уровень завязываемости семян, нежели в 2000 г. Тем не менее, все зерновки, завязавшиеся на двух метелках, обработанных штаммом A. tumefaciens GV3101 (pTd33), несли только трансгенные проростки, обладавшие нормальной жизнеспособностью (см. табл.). В результате частота генетической трансформации составила 100%. В потомстве одной из двух метелок, обработанных штаммом LBA4404 (pAS47), также присутствовало трансгенное растение (частота трансформации 10%).
Необходимо отметить, что согласно предлагаемому способу нанесение агробактериальной суспензии необходимо проводить именно в течение интервала времени между опылением и началом завязывания семян, в процессе которого происходит рост пыльцевых трубок, их проникновение в зародышевый мешок и оплодотворение. При одновременном опылении и нанесении агробактериальной суспензии завязываемость семян полностью отсутствовала, что делало невозможным получение трансгенных растений по предлагаемому способу. Нанесение суспензии после начала завязывания семян нецелесообразно, так как к этому моменту начинается дегенерация пыльцевой трубки, являющейся, по-видимому, вектором для переноса генетической информации от агробактерии (Т-ДНК) в формирующийся зародыш; кроме того, при генетической трансформации на ранних стадиях эмбриогенеза возрастает вероятность возникновения химерного зародыша, содержащего генетически трансформированные и нетрансформированные клетки.
Необходимо отметить, что согласно предлагаемому способу генетическую трансформацию необходимо осуществлять при температурных условиях, способствующих одновременно как завязыванию семян (росту пыльцевых трубок, двойному оплодотворению), так и агробактериальной трансформации (переносу Т-ДНК, для которого необходимо функционирование vir-генов), поскольку температурный фактор является важнейшим в данных процессах. У теплолюбивой культуры сорго оптимальный температурный интервал для опыления, роста пыльцевых трубок и оплодотворения лежит в диапазоне 25-30°С. В то же время для агробактериальной трансформации температура выше 25°С является критической, и оптимальный интервал этого процесса лежит в диапазоне 22-25°С (Salas M.G., Park S.H., Srivatanakul M., Smith R.H. Temperature influence on stable integration of T-DNA in plant cell // Plant Cell Repts.. 2001. V.20. P. 701-705). В этой связи при использовании данного способа процесс генетической трансформации необходимо проводить в температурном диапазоне, не превышающем 25°С, но максимально приближенном к этой точке.
Таким образом, предлагаемый нами способ позволяет с высокой частотой получать трансгенные растения сорго. При этом выход таких растений может достигать 100%, что на порядок превышает частоту выхода трансгенных растений в прототипе. Предлагаемый способ позволяет получать трансгенные растения при использовании разных агробактериальных штаммов, несущих разные генетические конструкции. Кроме того, необходимо отметить значительно меньшую трудоемкость, простоту и дешевизну предлагаемого нами способа, в сравнении с прототипом, предусматривающим использование серии из шести питательных сред для получения каллусных культур и последующей регенерации растений, среди которых только некоторые оказываются трансгенными, а также в сравнении с аналогом, в котором для получения трансгенных растений необходимо использовать дорогостоящее оборудование для баллистической трансформации. Для получения и отбора трансгенных растений по предлагаемому способу требуется 1-2 месяца (период, необходимый для формирования семян и их проращивания), тогда как по прототипу 5-6 месяцев (получение каллуса, отбор трансформированных клеточных линий, регенерация из них растений и их повторный отбор). Предлагаемый способ позволяет получать трансгенные растения, минуя систему культуры in vitro, и, следовательно, (1) не несет угрозы возникновения сомаклональной изменчивости; (2) позволяет избежать химерности трансформантов, проистекающей из-за развития их из многоклеточных меристем, содержащих как генетически трансформированные, так и нетрансформированные клетки; (3) его использование не ограничено генотипами, способными к образованию хорошо растущего эмбриогенного каллуса. Предлагаемый способ может быть использован для получения трансгенных растений не только у ЦМС-линий, но и у фертильных линий сорго после их предварительной кастрации, поскольку зарегистрированные нами частоты выхода трансгенных растений позволяют использовать даже ручную кастрацию для его осуществления.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ ОДНОДОЛЬНЫХ РАСТЕНИЙ | 2007 |
|
RU2351121C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ КУКУРУЗЫ | 2007 |
|
RU2351120C1 |
| Способ получения безмаркерных трансгенных растений каланхоэ перистого, экспрессирующих ген цекропина Р1 | 2015 |
|
RU2624042C2 |
| Способ получения безмаркерных трансгенных растений каланхоэ перистого, экспрессирующих ген цекропина Р1 | 2015 |
|
RU2631929C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ МОРКОВИ, ПРОДУЦИРУЮЩИХ ИНТЕРЛЕЙКИН-10 ЧЕЛОВЕКА | 2007 |
|
RU2374321C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pBM И СПОСОБ ПОЛУЧЕНИЯ С ЕЕ ИСПОЛЬЗОВАНИЕМ БЕЗМАРКЕРНЫХ ТРАНСГЕННЫХ РАСТЕНИЙ, СИНТЕЗИРУЮЩИХ ЦЕЛЕВЫЕ ПРОДУКТЫ | 2009 |
|
RU2410433C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫХ РАСТЕНИЙ КАЛАНХОЭ, ЭКСПРЕССИРУЮЩИХ ГЕН ЦЕКРОПИНА P1 | 2010 |
|
RU2445768C1 |
| СПОСОБ УЛУЧШЕННОЙ ТРАНСФОРМАЦИИ С ИСПОЛЬЗОВАНИЕМ АГРОБАКТЕРИИ | 2012 |
|
RU2620975C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫХ РАСТЕНИЙ САХАРНОЙ СВЕКЛЫ С ИСПОЛЬЗОВАНИЕМ AGROBACTERIUM TUMEFACIENS | 2004 |
|
RU2278162C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PGII, ОПРЕДЕЛЯЮЩАЯ СИНТЕЗ БЕТА-ИНТЕРФЕРОНА ЧЕЛОВЕКА В ТРАНСГЕННЫХ РАСТЕНИЯХ, И СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ, УСТОЙЧИВЫХ К ВИРУСНОЙ ИНФЕКЦИИ | 1994 |
|
RU2103361C1 |
Изобретение относится к сельскому хозяйству, в частности может быть использовано в селекции сорго для создания новых сортов и гибридов. Проводят опыление цветущих метелок сорго, лишенных собственной фертильной пыльцы. До начала завязывания семян на рыльца цветков наносят суспензию клеток Agrobacterium tumefaciens при температурных условиях, способствующих завязыванию семян и сохранению функциональной активности vir-генов. Проводят отбор трансгенных растений среди проростков, выросших из семян, завязавшихся на обработанных метелках. Изобретение позволяет получать трансгенные растения, минуя систему культуры in vitro, что существенно снижает производственные и временные затраты. 1табл., 1 ил.

Способ получения трансгенных растений сорго, включающий обработку сорго суспензией клеток Agrobacterium tumefaciens с активированными vir-генами и отбор трансгенных растений, отличающийся тем, что в качестве объекта генетической трансформации используют цветущие метелки сорго, лишенные собственной фертильной пыльцы, которые опыляют пыльцой фертильных растений и до начала завязывания семян на рыльца цветков наносят суспензию клеток Agrobacterium tumefaciens, причем процесс трансформации осуществляют в температурных условиях, способствующих завязыванию семян при сохранении функциональной активности vir-генов, при этом трансгенные растения отбирают среди проростков, выросших из семян, завязавшихся на этих метелках.
| Быстродействующий поляризованный выключатель | 1957 |
|
SU112828A1 |
| WO 9849332, 05.11.1998 | |||
| СПОСОБ ТРАНСФОРМАЦИИ РАЗМНОЖАЮЩИХСЯ ПУТЕМ ОПЫЛЕНИЯ РАСТЕНИЙ | 1988 |
|
RU2054482C1 |
| US 6455761, 24.09.2002. | |||
Авторы
Даты
2004-06-10—Публикация
2002-11-06—Подача