Изобретение относится к медицинской промышленности, а именно производству лекарственных средств, содержащих дротаверина гидрохлорид и применяемых для купирования спазма гладкой мускулатуры.
Спазмолитическое действие, т.е. понижение тонуса и снятие спазмов гладкой мускулатуры внутренних органов и кровеносных сосудов может быть достигнуто при помощи различных веществ, в частности производных пурина (теобромин, теофиллин), бензилбензимидазола (дибазол), изохинолина (папаверин, дротаверин) [1].
Известно, что дротаверина гидрохлорид легко окисляется в водной среде с образованием окрашенных продуктов распада. Для предотвращения разрушения дротаверина предложены ряд составов и способов, отличающиеся тем, что в составе лекарственных средств и технологии производства исключена стадия увлажнения дротаверина гидрохлорида. Процесс реализуют путем инкапсулирования лекарственного вещества в системе нерастворимых в воде полимеров [2-5], сополимеров винилпирролидона [6], модифицированого крахмала [7] или экструдированием расплава [8].
Перечисленные составы и способы производства позволяют получать устойчивые при хранении лекарственные формы (таблетки, гранулы) дротаверина, но требуют применения дорогостоящего оборудования и сложной технологической схемы.
Наиболее близким по составу и последовательности технологических операций является лекарственное средство [9] (прототип), содержащее, парацетамол, дротаверина гидрохлорид, кодеина фосфат, вспомогательные вещества, отличающееся тем, что дополнительно в качестве стабилизатора содержит одну или смесь органических кисадяг, или натрия сорбат в качестве стабилизатора.
Указанное лекарственное средство приставляет собой таблетки, содержащие 500 мг парацетамола, 40 мг дротаверина и 8 мг кодеина фосфата, распадающиеся в воде за 15 минут.
Недостатком данного спазмолитического средства является недостаточная стабильность дротаверина при хранении. Процесс инактивации дротаверина гидрохлорида начинается с отщепления от молекулы действующего вещества молекулы соляной кислоты. В результате образуется основание дротаверина, которое легко окисляется кислородом воздуха с образованием окрашенных продуктов распада. Поэтому при хранении таблетки изменяют цвет, наблюдается появление желто-коричневых пятен.
Целью настоящего изобретения является разработка состава таблеток дротаверина в задаче повышения стабильности препарата при хранении при условии полного соответствия требованиям фармакопеи [10] и фармакопейной статьи на таблетки дротаверина 0,04 г [11]:
- внешний вид (таблетки круглой формы с плоскими поверхностями, цельными краями однородной светло-желто-зеленой окраски с координатами цвета R>253, G>246, 175<В<185),
- прочность на истираемость (не менее 97 %),
- отклонение в массе отдельных таблеток (не более ±5%),
- распадаемость, не более 15 минут,
- стабильность при хранении в течение двух лет.
Поставленная цель достигается тем, что разработано спазмолитическое лекарственное средство в виде таблеток массой 0,065-0,26 г, содержащих дротаверина гидрохлорид, инертный фармацевтический наполнитель, связующее, стеариновую кислоту и/или ее соли, отличающееся тем, что дополнительно содержит (0,004-1,4) мас.% неорганической кислоты, при следующем соотношении компонентов, мас.%: дротаверина гидрохлорид 15,0-62,5, инертный фармацевтический наполнитель 28,1-84,696, связующее 0,1-7,0, стеариновая кислота и/или ее соль 0,2-1,0.
При этом заявленное лекарственное средство содержит в качестве:
- неорганической кислоты фосфорную или соляную кислоту,
- инертного фармацевтического наполнителя соединения класса углеводов пищевого или медицинского достоинства, в частности, глюкозу, лактозу, сахарозу, фруктозу, крахмал или/и их смеси.
- связующего - поливинилпирролидон, полиэтиленгликоль, крахмал и/или их смесь. Таким образом, сущностью изобретения является то, что:
- в составе заявленного лекарственного средства, по сравнению с известным содержится неорганическая кислота, что препятствует превращению дротаверина из формы соли в основание в процессе влажного гранулирования и сушки и при хранении в течение срока годности, в том числе при температуре выше 20°С. Заявленное изменение состава таблетки позволяет исключить происходящую в нейтральной и щелочной среде реакцию отщепления от молекулы дротаверина гидрохлорида соляной кислоты с образованием свободного основания дротаверина.
- использовано новое соотношение ингредиентов, позволяющее изменять скорость растворения таблеток от 40 секунд до 15 минут и, следовательно, фармако-кинетические параметры эффективности таблеток
Предлагаемые соотношения действующих и вспомогательных веществ являются оптимальными и позволяют получать таблетки, распадающиеся в течение 15 минут, соответствующие требованиям фармакопеи по всем показателям, стабильные при производстве и хранении в течение двух лет и при повышенной температуре.
Уменьшение или увеличение параметров ведения процесса в сторону от заявленных пределов приводит к снижению качества получаемых таблеток или затрудняет таблетирование.
Спазмолитическое лекарственное средство получают следующим образом.
В смеситель загружают дротаверина гидрохлорид, инертный фармацевтический наполнитель класса углеводов пищевого и медицинского достоинства, в частности смесь крахмала и лактозы, кальция стеарат, предпочтительно, в соотношении 1: 1,4: 1,12: 0,05 перемешивают. Данное соотношение необходимо для обеспечения распадаемости таблеток, не более 15 минут, при номинальной их прочности (см. пример 4).
Массу в смесителе перемешивают, затем добавляют 3-25% раствор ПВП, содержащий кислоту, в количестве, рассчитанном на получение ее концентрации в высушенной таблеточной массе от 0,004 до 1,4%.
Концентрационный предел 0,004-1,4% кислоты в составе таблеточной массы необходим для устойчивого предотвращения перехода дротаверина гидрохлорида из формы соли в основание. В опытах установлен устойчивый переход цвета таблеток в светло-желто-зеленый (значение “В” координаты цвета более 175-185 Ед.) при концентрации соляной кислоты в составе таблеток более 0,004% (см. пример 1, табл. 1, oп. №2). Увеличение концентрации фосфорной кислоты более 1,4% нецелесообразно, т.к. приводит к изменению цвета таблеток (см. пример 1, табл. 2, oп. №5).
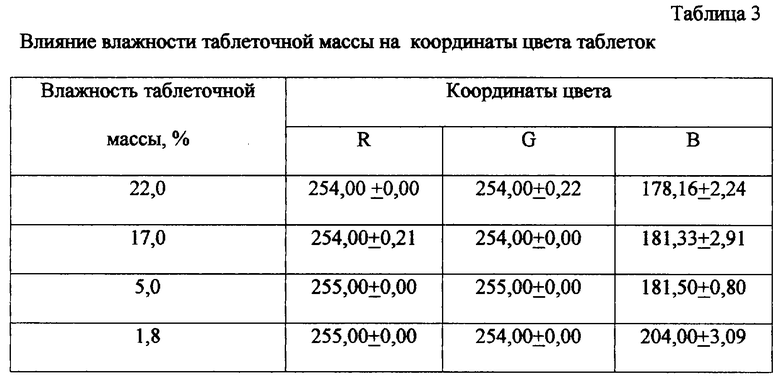
Смесь перемешивают до равномерного увлажнения, а затем сушат до влажности 1,9-5,0%. Выбор данного интервала основан на данных (см. пример 2), в соответствии с которыми установлено, что при влажности массы для таблетирования менее 1,9% наблюдается деколоризация полученного гранулята. Прессование гранулята с влажностью более 5,0% затрудняется налипанием таблеточной массы на поверхность пресс инструмента в процессе таблетирования.
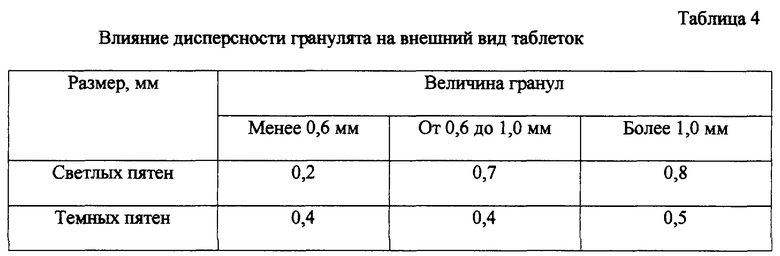
Высушенную массу подвергают сухой грануляции через сетку с отверстиями 1,0 мм. Увеличение размера гранул более 1,0 мм приводит к неоднородной окраске таблеток (см. пример 3). Предпочтительно использовать гранулят, проходящий через сито с отверстиями 0,4 мм.
Полученный гранулят таблетируют пуансонами диаметром 6-10 мм таблетпресса РТМ-41. Масса таблетки от 0,065 до 0,26 г. Таблетки массой более 0,26 г не удовлетворяют требованиям фармакопеи по показателю “прочность”. Нижний предел выбран из расчета выпускаемого промышленностью минимального диаметра пуансонов.
Как видно из вышеизложенного, только предложенные интервалы соотношений ингредиентов являются оптимальными и позволяют получить более эффективное лекарственное средство в виде таблеток, соответствующих требованиям научно-технической документации [10, 11] по всем показателям и стабильных при хранении.
Пример 1.
В ступку загружали 10 г дротаверина гидрохлорида, 14 г крахмала картофельного, 11,25 г лактозы, 0,5 г кальция стеарата, тщательно растирали компоненты. Смесь увлажняли раствором 0,75 г ПВП в 12 г воды. В опытах варьировали количество соляной или фосфорной кислоты, которые вводили в растворе увлажнителя. Увлажненные массы гранулировали через сетку с отверстиями 0,8 мм и сушили до влажности 2,2-2,8%.
Контролем в опытах служили варианты, полученные в полном соответствии со способом, принятым в прототипе (см. табл. 1 и 2 oп. №1). 10 г дротаверина гидрохлорида смешивали с 13 г лактозы, 8,75 г крахмала, 0,35 г смеси стеарата магния и стеариновой кислоты 1:1, увлажняли раствором 0,24 г лимонной кислоты и 1,5 г ПВП в 5,64 г воды. Сушили при 60°С до влажности 2,2%, гранулировали через сито с отверстиями 1,0 мм [2].
Опытные и контрольные массы таблетировали пуансонами диаметром 7 мм. Масса таблеток 0,15 г.
Полученные опытные и контрольные образцы таблеток помещали в сканер HP scanjet-4470с сканировали. Анализ цвета проводили при обработке полученных графических файлов программными средствами Corel 7 Photo-Paint в “RGB” координатах цвета.
Результат измерения колористических характеристик таблеток дротаверина представлен в таблицах 1-2.
Критерием оптимальности было получение таблеток светло-желто-зеленого цвета с координатами цвета R>253, G>246,175<B<185.
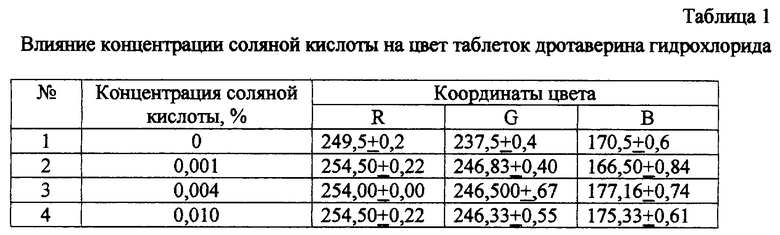

Из таблиц 1 и 2 видно, что введение в состав таблеточной массы 0,004-0,10 соляной кислоты или 0,35-1,4% фосфорной кислоты стабилизирует качество таблеток в процессе влажной грануляции, сушки и таблетирования (в опыте без кислоты координата цвета составила 170,5 Ед, в сравнении со значением 176-181 Ед в опытах с 0,35-1,4% кислоты). Увеличение кислоты более 1,4% приводит к изменению цвета таблеток в светлую сторону (“В” координата цвета увеличивается на 10-15 единиц в сравнении с другими опытами). Изучение динамики изменения цвета подтвердило гипотезу о благоприятном влиянии кислоты на стабильность дротаверина гидрохлорида (см. чертеж) при переработке. Координаты цвета опытных вариантов и прототипа находятся на уровне 180-185 Ед., в сравнении с цветом таблеток без кислоты 170 Ед. (см. значения при продолжительности хранения 0 суток).
Изучение динамики изменения цвета таблеток при хранении при повышенной температуре у всех вариантов наблюдается изменение цвета (см. чертеж), о чем свидетельствует изменение “В” координаты цвета с 180 до 160-150 Ед. Однако при введении в состав таблеток неорганической кислоты гидролиз дротаверина гидрохлорида замедляется. При этом скорость изменения цвета препарата с введением неорганических кислот (см. чертеж кривые соляная и фосфорная кислоты) находится на уровне прототипа (с введением 0,7% лимонной кислоты) и процесс происходит значительно медленнее, чем в опытах без кислоты (см. чертеж кривая “Без кислоты”).
Таким образом, условию оптимальности (R>254, G>246, 175<B>185) соответствуют варианты, содержащие от 0,004% соляной кислоты до 1,4% фосфорной кислоты.
Дальнейшее увеличение концентрации кислоты нецелесообразно, т.к. не приводит к улучшению характеристик цвета таблеток.
Пример 2
Для определения оптимальной влажности таблеточной массы в ступку загружали 10 г дротаверина гидрохлорида, 14 г крахмала картофельного, 11,25 г лактозы, 0,5 г кальция стеарата, тщательно растирали компоненты. Смесь увлажняли раствором 0,75 г ПВП, 0,26 г фосфорной кислоты в 12 г воды. Увлажненную массу гранулировали через сетку с отверстиями 0,8 мм и сушили при температуре 60°С. В процессе сушки отбирали пробы с различной влажностью, которые таблетировали пуансонами 7 мм. Координаты цвета таблеток представлены в табл.4.
В опытах с влажностью гранулята 22 и 17% получить качественные таблетки не удалось вследствие налипания т/массы на поверхность пуансонов. Удовлетворительные результаты таблетирования получены в опытах 5% и 1,8%. Однако в опыте 1,8% наблюдалось изменение цвета таблетки. В результате предложен оптимальный интервал влажности т/массы 1,9-5,0%.
Пример 3
Для определения оптимального фазово-дисперсного состава гранулята в ступку загружали 10 г дротаверина гидрохлорида, 14 г крахмала картофельного, 11,25 г лактозы, 0,5 г кальция стеарата, тщательно растирали компоненты. Смесь увлажняли раствором 0,75 г ПВП, 0,26 г фосфорной кислоты в 12 г воды. Увлажненную массу гранулировали через сетку с отверстиями 1,0 мм и сушили при температуре 60° С до влажности 2,5%. Полученную т/массу просевали через сита с отверстиями, отбирая фракции с гранулами более 1 мм, от 1,0 до 0,6 мм, менее 0,6 мм. Фракции таблетировали пуансонами 7 мм. В полученном в результате сканирования изображении измеряли координаты цвета таблеток и размер темных и светлых пятен на поверхности таблеток при увеличении 100·1 (программно).
Представленные данные позволяют определить оптимальный размер гранул таблеточной массы менее 1,0 мм, при котором наблюдается однородная окраска таблеток.
Пример 4.
Получали 140 г смеси дротаверина гидрохлорида, наполнителя (смесь крахмала и лактозы 1/1), стеарата магния перемешивали и увлажняли 20 мл раствора связующего (ПВП). Увлажненную массу сушили при температуре 50°С до влажности 2,0%. Гранулировали через сетку с отверстиями 1,0 мм. Таблетировали пуансонами 6-10 мм. Масса таблеток 0,065-0,26 г. Определяли распадаемость и цвет таблеток.
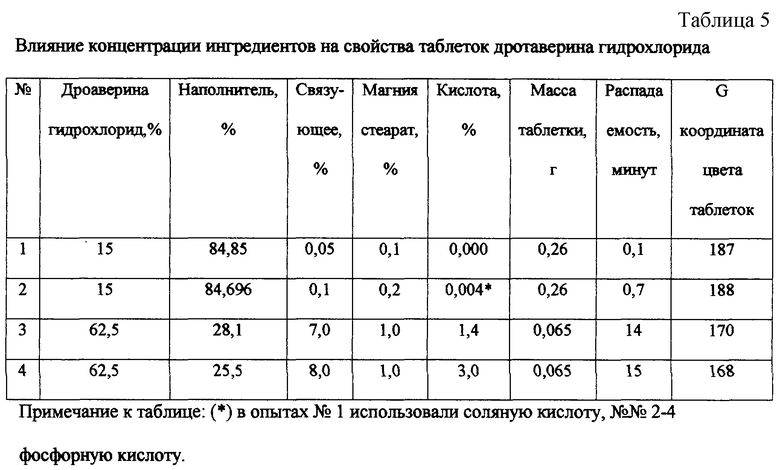
Из таблицы 5 видно, что ведение процесса за рамками заявленных пределов не позволяет получить таблетки, соответствующие заданным параметрам.
Литература
1. Машковский М.Д. Лекарственные средства: - Мн.: Беларусь, 1987, ч.1. с.393.
2. Grabowski, et al., Slow-release тора, matrix pellets and the production thereof United States Patent 6290990, September 18, 2001.
3. Amey, et al., Process for encapsulation of caplets in a capsule and solid dosage forms obtainable by such process. United States Patent 6245350, June 12,2001.
4. Van Lengerich, Embedding and encapsulation of controlled release particles. United States Patent 6190591, February 20, 2001
5. Amey, et al., Process for encapsulation of caplets in a capsule and solid dosage forms obtainable by such process. United States Patent 6080426, June 27, 2000.
6. Goertz, et al., Preparation of solid pharmaceutical forms. United States Patent 4801460, January 31, 1989.
7. Breitenbach, et al., Storage-stable drug form. United States Patent 5945127, August 31, 1999.
8. Klimesch, et al., Continuous preparation of solid pharmaceutical forms. United States Patent 5073379, December 17, 1991.
9. Международная заявка WО 01/07024 PHAKMACEUTICAL COMPOSITION AND PREPARATION THEREOF KALMANNE MATHE IRMA; VITANYINE MORVAI MAGDOLNA; JAKAB BOGLARKA; KOVACS PETERNE, VEGELI ERZSEBET. 2001-02-01. МКИ А 61 К 31/00. Прототип.
10. Государственная фармакопея СССР, вып. 2. Общие методы анализа. Лекарственное и растительное сырье/ МЗ СССР. - 11-е изд., доп. - М.: Медицина, 1989. - Т.2. - С.154-159.
11. ВФС 42-3107-98. Таблетки дротаверина гидрохлорида 0,04 г.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СПАЗМОЛИТИЧЕСКОГО ЛЕКАРСТВЕННОГО СРЕДСТВА | 2003 |
|
RU2252024C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОТИВОМИКРОБНОГО ЛЕКАРСТВЕННОГО СРЕДСТВА | 2002 |
|
RU2224517C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СПАЗМОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2001 |
|
RU2183119C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ БОЛЕУТОЛЯЮЩИМ, ПРОТИВОВОСПАЛИТЕЛЬНЫМ, АНТИПИРЕТИЧЕСКИМ И СПАЗМОЛИТИЧЕСКИМ ДЕЙСТВИЕМ | 2001 |
|
RU2183116C1 |
| Лекарственная форма для высвобождения дротаверина в полости рта | 2019 |
|
RU2729659C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИАНГИНАЛЬНОГО ЛЕКАРСТВЕННОГО СРЕДСТВА | 2000 |
|
RU2195932C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ МОЧЕИСПУСКАНИЯ | 2012 |
|
RU2497504C1 |
| КОМПОЗИЦИЯ - ЛЕКАРСТВЕННАЯ ФОРМА ПРОТИВОАРТРОЗНОГО СРЕДСТВА ГЛЮКОЗАМИНА ГИДРОХЛОРИДА ДЛЯ ВНУТРЕННЕГО ПРИМЕНЕНИЯ | 1996 |
|
RU2130310C1 |
| Витаминно-пребиотическое иммуностимулирующее средство | 2020 |
|
RU2747780C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТВЕРДОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ, СОДЕРЖАЩЕЙ ГЛЮКОЗАМИНА ГИДРОХЛОРИД | 2003 |
|
RU2247563C1 |
Изобретение относится к медицинской промышленности, а именно к спазмолитическому лекарственному средству, содержащему дротаверина гидрохлорид, применяемому для купирования спазма гладкой мускулатуры. Средство содержит, мас.%: дротаверина гидрохлорид 15,0-62,5, инертный фармацевтический наполнитель 28,1-84,696, связующее 0,1-7,0, стеариновую кислоту и/или ее соль 0,2-1,0, неорганическую кислоту 0,004-1,4. В качестве неорганической кислоты средство содержит фосфорную или соляную кислоту. Средство выполнено в форме таблетки массой от 0,065 до 0,26 г. Таблетки дротаверина гидрохлорида стабильны в процессе производства и при хранении в течение двух лет. Качество таблеток соответствует требованиям фармакопеи. 5 з.п. ф-лы, 1 ил., 5 табл.

Дротаверина гидрохлорид 15,0-62,5
Инертный фармацевтический
наполнитель 28,1-84,696
Связующее 0,1-7,0
Стеариновая кислота и/или
ее соль 0,2-1,0
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СПАЗМОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2001 |
|
RU2183119C1 |
| US 5556862 A, 17.09.1996 | |||
| Дистанционный электрический тахометр | 1945 |
|
SU67711A1 |
Авторы
Даты
2004-07-10—Публикация
2002-10-09—Подача