Настоящее изобретение касается антигенов бактерий рода Neisseria.
Предпосылки для изобретения
Бактерии Neisseria meningitidis и Neisseria gonorrhoeae являются неподвижными грамотрицательными бактериями-диплококками, проявляющими патогенность в отношении человека. N.meningitidis образуют колонии в глоточном отделе и вызывают менингит (а также, в отдельных случаях, септицемию без менингита); N.gonorrhoeae образуют колонии в половых путях, вызывая гоноррею. Несмотря на то, что они образуют колонии в разных частях тела и вызывают совершенно разные заболевания, эти два патогена очень близки друг к другу, хотя имеется и отчетливое различие между менингококком и гонококком, связанное с наличием полисахаридной капсулы, которая имеется у всех патогенных менингококков.
Гонококк N.gonorrhoeae обусловливает приблизительно 800 тысяч заболеваний в год за период 1983-90 гг. только в США (глава, написанная Meitzner & Cohen, 1997, "Vaccines Against Gonococcal Infection", In "New Generation Vaccines", 2d ed., ed. Levine, Woodrow, Kaper & Gobon, Marcel Dekker, NY, pp.817-842). Это заболевание имеет широкую распространенность, хотя смертность от него низка. Очень желательной является вакцинация против возбудителя гонорреи, однако многочисленные такие попытки были безуспешными. Основными "антигенами-кандидатами" для создания таких вакцин являются расположенные на поверхности белки, такие как пили, порины, ассоциированные с помутнением белки (Opas) и другие поверхностные белки, такие как Lip, Laz, IgAl-протеаза и трансферрин-связывающие белки. Также в качестве вакцины предлагалось использовать липополисахарид (LOS) (Meitzner & Cohen, цит. выше).
Менингококк N.meningitidis обусловливает и эндемическую, и эпидемическую форму заболевания. В США уровень заболеваемости составляет 0,6-1 на 100 тысяч человек в год, и этот показатель может повышаться в условиях вспышки заболевания (см. Lieberman et al., 1996, "Safety and Immunogenicity of a Serogroups A/C Neisseria meningitidis Oligosaccharide-Protein Conjugate Vaccine in Young Children", JAMA, 275 [19], 1499-1503; Schuchat et al., 1997, "Bacterial Meningitis in the United States in 1995", New England J. Med., 337 [14], 970-976). В развивающихся странах частота эндемических случаев заболевания существенно выше и при возникновении эпидемий этот показатель может достигать 500 случаев на 100 тысяч человек в год. Уровень смертности очень высок - примерно 10-20% в США и еще выше в развивающихся странах. После внедрения комбинированной вакцины против Haemophilus influenzae менингококк N.meningitidis становится основным возбудителем бактериальных форм менингита во всех возрастных группах в США (Schuchat et al., 1997, цит. выше).
Исходя из параметров составляющих капсулу менингококка полисахаридов было идентифицировано 12 серогрупп N.meningitidis. Группа А включает патоген, который в основном связан с эпидемиологическими формами заболевания в присахарских областях Африки. Серогруппы В и С связаны с подавляющим большинством случаев менингита в США и большинстве развитых стран. Серогруппы W135 и Y связаны с остальными случаями в США и развитых странах. Применяемая в настоящее время менингококковая вакцина является тетравалентной полисахаридной вакциной, содержащей факторы серогрупп А, С, Y и W135. Будучи эффективной в приложении к подросткам и взрослым, эта вакцина обусловливает слабый иммунный ответ и кратковременную защиту, а также не может быть применена для маленьких детей (см., например, еженедельный доклад "Morbidity and Mortality weekly report., Vol.46, N RR-5, 1997). Это обусловливается тем, что полисахариды являются независимыми от Т-клеток антигенами, которые обусловливают весьма слабый иммунный ответ, который не может быть усилен (подвергнут "бустингу") путем повторной иммунизации. Достигнув успеха в вакцинации против Н.influenzae, были разработаны комбинированные вакцины против серогрупп А и С - в настоящее время заканчиваются их клинические испытания (W.D.Zollinger, "New and Improved Vaccines Against Meningococcal Disease", In "New Generation Vaccines", supra, pp. 469-488; Lieberman et al., 1996, цит. выше; Constantino et al., 1992, "Development and phase I clinical testing of a conjugate vaccine against meningococcus A and C", Vaccine, 10, 691-698).
Однако проблемным остается серотип В менингококка. В настоящее время этот серотип обусловливает примерно 50% общего количества случаев менингита в США, Европе и Южной Америке. "Полисахаридный подход" не может быть использован, потому что капсулярный полисахарид menB является полимером связанных по α(2-8) N-ацетилнейраминовых кислот, которые также присутствуют в тканях млекопитающих. Это обусловливает толерантность к данному антигену: действительно, если предположить проявление иммунного ответа, то он будет направлен и на собственный организм - т.е. такой ответ является нежелательным. С целью исключения индукции аутоиммунного ответа и индукции защитного иммунного ответа входящий в состав капсулы полисахарид был, например, химически модифицирован путем замещения N-ацетильных групп на N-пропионильные группы, вследствие чего специфичная антигенность остается неизмененной (Romero & Outschoorn, 1994, "Current Status of Meningococcal group В vaccine candidates: capsular or non-capsular?", Clin. Microbiol. Rev., 7 [4], 559-575).
В альтернативных подходах к созданию вакцин против менингита-В использовали комплексные смеси белков внешней мембраны (ОМР), включая сами по себе белки ОМР или ОМР, обогащенные поринами, или делетированные варианты ОМР 4-го класса, которые, как считается, индуцируют выработку антител, блокирующих бактерицидную активность. В этом подходе получают вакцины, полной характеристики которых пока не получено. Эти вакцины способны обеспечивать защиту от гомологичного штамма, но при этом оказываются по сути неэффективными в тех случаях, когда имеются многочисленные антигенные варианты белков внешней мембраны. Для преодоления фактора антигенной изменчивости были получены мультивалентные вакцины, содержащие вплоть до 9 различных поринов (см., например, J.T.Poolman, 1992, "Development of a meningococcal vaccine", Infect. Agents Dis., 4, 13-28). Другими белками, которые используются при создании "внешнемембранных вакцин", являются белки ора и орс - однако ни один из применяемых подходов не обеспечивает преодоления фактора антигенной изменчивости (см., например, Ala'Aldeen & Borriello, 1996, "The meningococcal transferrinbinding proteins 1 and 2 are both surface exposed and generate bactericidal antibodies capable of killing homologous and heterologous strains", Vaccine, 14, 49-53).
Доступными являются некоторые данные по последовательностям менингококковых и гонококковых генов и белков (например, по патентным заявкам ЕР А-0467714 и WO 96/29412), однако, безусловно, они неполны. Получение дополнительных данных по последовательностям предоставит хорошие перспективы для идентификации секретируемых или располагающихся на поверхности клеток белков, которые являются перспективными мишенями для иммунной системы и которые не характеризуются антигенной изменчивостью. Например, некоторые из идентифицированных белков могли бы быть компонентами эффективных вакцин против менингококка-В, некоторые из них могли бы быть компонентами вакцин против всех менингококковых серотипов и другие могли бы быть компонентами вакцин против всех патогенных форм рода Neisseria.
Изобретение
Настоящее изобретение представляет белки, включающие аминокислотные последовательности, принадлежащие нейссериям, описанные в нижеследующих примерах. Эти последовательности относятся к N.meningitidis или N.gonorrhoeae.
Также представляются белки, включающие последовательности, гомологичные (т.е. характеризующиеся идентичностью последовательностей) аминокислотным последовательностям нейссерий, показанных в примерах. В зависимости от конкретной последовательности, уровень идентичности предпочтительно превышает 50% (например, 65, 80, 90% или больше). Эти гомологичные белки включают мутантные и аллельные варианты последовательностей, описанных в примерах. Обычно 50%-ная или более высокая идентичность двух белков рассматривается как свидетельство функциональной эквивалентности. Уровень идентичности двух белков предпочтительно определяют по методу Смита-Уотермана, алгоритм которого заложен в компьютерную программу MPSRCH (Oxford Molecular): используется поиск "аффинных гэпов" (т.е. не совпадающих в двух последовательностях участков) с установлением параметров "gap open penalty=12" и "gap extension penalty=1".
Далее настоящее изобретение представляет белки, включающие фрагменты аминокислотных последовательностей нейссерий, описанных в нижеследующих примерах. Эти фрагменты должны включать по крайней мере n непрерывных аминокислот из базовой последовательности, а, в зависимости от конкретной последовательности, n равно 7 и больше (например, 8, 10, 12, 14, 16, 18, 20 или больше). Предпочтительно такие фрагменты включают эпитоп из последовательности.
Белки по настоящему изобретению могут быть получены, конечно, с использованием различных подходов (например, методами рекомбинантной экспрессии, очистки из клеточных культур, химического синтеза и т.п.) и в различных формах (например, нативной, химерной и т.п.). Предпочтительно их получают в существенно чистой или выделенной форме (т.е. в существенной степени свободной от других белков нейссерий или клеточных белков организма-хозяина).
В соответствии со следующим аспектом настоящего изобретения представляются антитела, которые связываются с такими белками. Это могут быть поликлональные или моноклональные антитела, которые могут быть получены с применением подходящих способов.
В соответствии со следующим аспектом настоящего изобретения представляются нуклеиновые кислоты, включающие нуклеотидные последовательности нейссерий, описанные в примеpaх.
Кроме того, настоящее изобретение представляет нуклеиновые кислоты, включающие гомологичные последовательности (т.е. характеризующиеся идентичностью последовательностей) по отношению к нуклеотидным последовательностям нейссерий, описанным в примерах.
Далее, настоящее изобретение представляет нуклеиновые кислоты, которые могут гибридизовать с нуклеиновыми кислотами нейссерий, описанными в примерах, причем предпочтительно в жестких условиях гибридизации (например, при 65°С в растворе 0,1×SSC, 0,5% SDS).
Также представляются нуклеиновые кислоты, включающие фрагменты таких последовательностей. Они должны включать по крайней мере n расположенных подряд нуклеотидов из состава последовательностей нейссерий, а, в зависимости от конкретной последовательности, n равно 10 или больше (например, 12, 14, 15, 18, 20, 25, 30, 35, 40 или больше).
В соответствии со следующим аспектом настоящее изобретение представляет нуклеиновые кислоты, кодирующие белки и фрагменты белков по настоящему изобретению.
Также должно быть понятно, что настоящее изобретение представляет нуклеиновые кислоты, включающие последовательности, комплементарные тем последовательностям, которые были описаны выше (например, для целей получения антисмысловых последовательностей или зондов).
Нуклеиновые кислоты в соответствии с настоящим изобретением могут быть, конечно, получены многими способами (например, с помощью химического синтеза, из библиотек геномной ДНК или кДНК, непосредственно из организма и т.п.) и могут принимать различные формы (например, одноцепочечную, двухцепочечную, векторную формы, форму зондов и т.п.).
Дополнительно следует сказать, что термин "нуклеиновая кислота" включает ДНК и РНК, а также их аналоги, такие как те, которые включают модифицированные молекулярные скелеты, а также нуклеопротеины (PNA) и т.п.
В соответствии со следующим аспектом настоящего изобретения представляются векторы, включающие нуклеотидные последовательности по настоящему изобретению (например, экспрессирующие векторы) и клетки-хозяева, трансформированные такими векторами.
В соответствии со следующим аспектом настоящего изобретения представляются композиции, содержащие белок, антитело и (или) нуклеиновую кислоту в соответствии с настоящим изобретением. Эти композиции могут быть использованы в качестве, например, вакцин или в качестве диагностических реагентов, или в качестве иммуногенных композиций.
Настоящее изобретение также представляет нуклеиновую кислоту, белок или антитело, соответствующие настоящему изобретению, для использования в качестве лекарственных средств (например, в качестве вакцин) или в качестве диагностических реагентов. Также представляется использование нуклеиновой кислоты, белка или антител в соответствии с настоящим изобретением в производстве: (1) лекарственного средства, предназначенного для лечения или профилактики инфицирования бактериями рода Neisseria; (2) диагностического реагента, предназначенного для детекции присутствия бактерий Neisseria или антител, специфичных в их отношении; и (или) (3) реагента, который может обусловливать выработку антител против нейссерий. Упомянутые бактерии рода Neisseria могут быть представлены любым видом или штаммом (таким как N.gonorrhoeae или любой штамм N.meningitidis, такие как штамм А, штамм В или штамм С).
Также настоящее изобретение представляет способ лечения пациента, включающий введение этому пациенту терапевтически эффективного количества нуклеиновой кислоты, белка и (или) антитела, соответствующих настоящему изобретению.
В соответствии с другими аспектами настоящего изобретения представляются различные способы.
Представляется способ получения белков по настоящему изобретению, включающий этап культивирования клетки-хозяина в соответствии с настоящим изобретением в условиях, которые стимулируют экспрессию белка.
Представляется способ получения белка или нуклеиновой кислоты по настоящему изобретению, при том, что такой белок или такая нуклеиновая кислота синтезируются полностью или частично с использованием химических методик.
Представляется способ детекции полинуклеотидов по настоящему изобретению, включающий следующие этапы: (1) контакт нуклеотидного зонда по настоящему изобретению с биологическим образцом в условиях, пригодных для молекулярной гибридизации с образованием дуплексов; и (2) детекция упомянутых дуплексов.
Представляется способ детекции белков по настоящему изобретению, включающий следующие этапы: (1) контакт антитела по настоящему изобретению с биологическим образцом в условиях, пригодных для образования комплекса "антиген-антитело"; и (2) детекция упомянутых комплексов.
Далее следует обзор стандартных методологий и процедур, которые могут быть использованы с целью осуществления настоящего изобретения (например, с целью использования заявляемых последовательностей для вакцинации или в диагностических целях). Этот обзор не является ограничением для настоящего изобретения, но при этом является примером такого его осуществления, которое не является строго обязательным.
Общие положения
Практическая реализация настоящего изобретения основывается, за исключением отдельно оговариваемых случаев, на стандартных методиках молекулярной биологии, микробиологии, рекомбинантной ДНК и иммунологии, которые известны специалистам в данной области техники. Такие методики подробно описаны в научной литературе: например, Sambrook, 1989, "Molecular Cloning: A Laboratory Manual", 2d Ed.; "DNA Cloning", Vol.I & II, ed. D.N. Glover, 1985; "Oligonucleotide Synthesis", ed. M.J.Gait, 1984; "Nucleic Acid Hybridization", eds. B.D.Hames & S.J.Higgins, 1984; "Transcription and Translation", eds. B.D.Hames & S.J.Higgins, 1984; "Animal Cell Culture", ed. R.I.Freshney, 1986; "Immobilized Cells and Enzymes", IRL Press, 1986; B.Perbal, 1984, "A Practical Guide to Molecular Cloning"; серия руководств "Methods in Enzymology" (издано Academic Press Inc.), особенно тома 154 и 155; "Gene Transfer Vectors for Mammalian Cells", eds. J.H.Miller & M.P.Calos, Cold Spring Harbor Lab., 1987; "Immunochemical Methods in Cell and Molecular Biology", eds. Mayer & Walker, Acad. Press, London, 1987; Scopes, 1987, "Protein Purification: Principles and Practice", 2d ed., Springer-Verlag, NY; и "Handbook of Experimantal Immunology", Vol.I-IV, eds. D.M.Weir & C.C.Blackwell, 1986).
В настоящем описании используются стандартные аббревиатуры для обозначения аминокислот и нуклеотидов.
Все публикации, патенты и патентные заявки, цитируемые в данном тексте, включены в полном своем объеме в виде библиографических ссылок. В частности, в данный текст включены для сведения британские патентные заявки №№9723516.2, 9724190.5, 9724386.9, 9725158.1, 9726147.3, 9800759.4 и 9819016.8.
Определения
Композиция, содержащая X, "в существенной степени свободна от Y" тогда, когда по крайней мере 85% по весу от суммы X+Y приходится на долю компонента X. Предпочтительно Х составляет по крайней мере примерно 90% по весу от общего количества X+Y в данной композиции, более предпочтительно по крайней мере примерно 95% или даже 99% по весу.
Термин "включающий" означает "состоящий", равно как и "содержащий": например, композиция, "включающая" X, может состоять исключительно из компонента Х или может включать нечто дополнительное к X, например, сочетание X+Y.
Термин "гетерологичный" относится к двум биологическим компонентам, которые не встречаются вместе в природе. Такими компонентами могут быть клетки-хозяева, гены или регуляторные сегменты, такие как промоторы. Хотя гетерологичные компоненты в природе вместе не обнаруживаются, они могут обладать совместной функциональностью, например, когда промотор, гетерологичный по отношению к гену, функционально с ним соединен. Другим примером является такая ситуация, в которой последовательность нейссерии является гетерологичной в отношении мышиной клетки-хозяина. Дополнительными примерами могут быть два эпитопа из состава одного и того же или разных белков, которые компонуются в едином белке в таком сочетании, которое никогда не обнаруживается в природе.
"Точка начала репликации" обозначает полинуклеотидную последовательность, которая инициирует и регулирует репликацию полинуклеотидов, таких как экспрессирующий вектор. Точка (или сайт) начала репликации ведет себя как автономная единица полинуклеотидной репликации в клетке, обеспечивая способность к репликации под ее контролем. Присутствие точки начала репликации может быть необходимым для обеспечения репликации вектора в конкретной клетке-хозяине. При наличии нескольких точек начала репликации экспрессирующий вектор может воспроизводиться в большом числе копий в присутствии подходящих белков внутри клетки. Примерами точек начала репликации являются автономно реплицирующиеся последовательности, которые эффективны в клетках дрожжей, а также вирусные Т-антигены, эффективные в клетках линии COS-7.
Термин "мутантная последовательность" определяет ДНК, РНК или аминокислотную последовательность, отличающуюся от нативной или заявленной последовательности, но при этом имеющую сходство с ней. В зависимости от конкретной последовательности уровень идентичности последовательностей при сравнении нативной или заявленной последовательности и мутантной последовательности предпочтительно превышает 50% (составляя, например, 60, 70, 80, 90, 95, 99% и больше: расчет проводится с помощью алгоритма Смита-Уотермана, описанного выше). По использованию в данном тексте термин "аллельный вариант" молекулы нуклеиновой кислоты или участка, для которого представляется нуклеотидная последовательность, является молекулой нуклеиновой кислоты или сегментом, который по сути находится в том же локусе конкретного генома другого или второго изолята, при том, что, ввиду естественной изменчивости, обусловливаемой, например, мутационным или рекомбинационным процессами, характеризуется сходной, но не идентичной нуклеотидной последовательностью. Кодирующий сегмент аллельного варианта обычно кодирует белок, обладающий сходным уровнем активности по сравнению с таковым у белка, кодируемого тем геном, с которым проводится данное сравнение. Аллельный вариант также может включать чередование 5'- или 3'-нетранслируемых участков конкретного гена, таких как регуляторные контрольные сегменты (см., например, патент США №5753235).
Экспрессионные системы
Нуклеотидные последовательности нейссерий могут быть экспрессированы с использованием различных экспрессионных систем: например, для этой цели используются клетки млекопитающих, бакуловирусы, растения, бактерии и дрожжи.
I. Системы млекопитающих
Экспрессионные системы млекопитающих известны в данной области техники. Промотором млекопитающих может являться любая последовательность ДНК, способная связывать РНК-полимеразу млекопитающих, инициируя тем самым транскрипцию нижерасположенной (т.е. по 3'-сторону) кодирующей последовательности (например, структурного гена) с образованием мРНК. Промотор должен включать сайт инициации транскрипции, который обычно располагается проксимально по отношению к 5'-концу кодирующей последовательности, а также бокс ТАТА, обычно расположенный в 25-30 нуклеотидах выше сайта инициации транскрипции. Считается, что бокс ТАТА обеспечивает контролируемое РНК-полимеразой II начало синтеза РНК в правильном сайте. Промотор млекопитающих также должен включать расположенный выше промоторный элемент, обычно находящийся в 100-200 нуклеотидах выше бокса ТАТА. Верхний промоторный элемент определяет скорость, с которой инициируется транскрипция, и может быть активен в любой ориентации (Sambrook et al., 1989, "Expression of Cloned Genes in Mammalian Cells", In "Molecular Cloning: A Laboratory Manual", 2d ed.).
Гены вирусов млекопитающих обычно характеризуются интенсивной экспрессируемостыо и характеризуются широким кругом хозяев: следовательно, последовательности, кодирующие гены вирусов млекопитающих, являются особенно перспективными для применения в качестве промоторных последовательностей. Примерами являются промотор ранних генов вируса SV40, промотор LTR вируса опухоли молочной железы мыши, промотор главного позднего гена аденовируса (AdMLP) и промотор простого герпес-вируса. Кроме того, последовательности, производные от невирусных генов, таких как ген металлотионеина мыши, также представляют применимые промоторные последовательности. Экспрессия может быть как конститутивной, так и регулируемой (индуцибельной), что зависит от возможности индукции промотора глюкокортикоидами в клетках, контролируемых такими гормонами.
Присутствие энхансерного элемента (энхансера) совместно с промоторными элементами, описанными выше, обычно приводит к усилению уровней экспрессии. Энхансер - это регуляторная последовательность ДНК, которая способна стимулировать транскрипцию до тысячекратного уровня в случае ее связывания с гомологичными или гетерологичными промоторами, при том, что синтез начинается в нормальном инициирующем сайте РНК. Энхансеры также активны тогда, когда они помещаются или выше, или ниже сайта инициации транскрипции, как в нормальной, так и в инвертированной по механизму переключения фаз ориентации, или на расстоянии даже больше 1000 нуклеотидов от промотора (Maniatis et al., 1987, Science, 236, 1237; Alberts et al., 1989, "Molecular Biology of the Cell", 2d ed.). В частности, могут быть использованы энхансерные элементы, происходящие от вирусных геномов, поскольку они обычно характеризуются широким кругом потенциальных хозяев. Примерами являются энхансер раннего гена вируса SV40 (Dijkema et al., 1985, EMBO J., 4, 761) и энхансер + промотор, производные от участка длинных концевых повторов (LTR) вируса саркомы Рауса (Gorman et al., 1982b, Proc. Natl. Acad. Sci. USA, 79, 6777) и цитомегаловируса человека (Boshart et al., 1985, Cell, 41, 521). Кроме того, некоторые энхансеры являются регулируемыми и становятся активными только в присутствии индуктора, такого как гормон или ион металла (Sassone-Corsi & Borelli, 1986, Trends Genet., 2, 215; Maniatis et al., 1987, Science, 236, 1237).
Молекула ДНК может быть экспрессирована внутри клеток млекопитающих. Промоторная последовательность может быть напрямую присоединена к молекуле ДНК с учетом того, что первая с N-конца аминокислота в составе рекомбинантного белка всегда должна быть метионином, который кодируется старт-кодоном ATG. Если желательно, N-концевая часть может быть отщеплена от белка путем инкубации in vitro с цианогенбромидом.
С другой стороны, чужеродные белки также могут секретироваться из клетки непосредственно в питательную среду в результате создания химерных молекул ДНК, которые бы кодировали химерный белок, включающий лидерную последовательность сегмента, обеспечивающего секрецию чужеродного белка в клетках млекопитающих. Предпочтительным является наличие сайтов процессинга, кодируемых между лидерным сегментом и чужеродным геном, который бы мог быть расщеплен либо in vivo, либо in vitro. Лидерный сегмент обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот, которые обеспечивают секрецию белка из клетки. Аденовирусный трипартитный лидерный сегмент является примером лидерной последовательности, обеспечивающей секрецию чужеродного белка клетками млекопитающих.
Обычно терминация транскрипции и полиадениловые последовательности, распознаваемые клетками млекопитающих, являются регуляторными сегментами, расположенными с 3'-стороны от стоп-кодона: т.е., вместе с промоторными элементами, они являются мотивами, фланкирующими кодирующую последовательность. 3'-конец зрелой мРНК образуется в результате сайт-специфичного посттранскрипционного расщепления и полиаденилирования (Birnstiel et al., 1985, Cell, 41, 349; Proudfoot & Whitelaw, 1988, "Termination and 3' end processing of eukaryotic RNA", In "Transcription and splicing", ed; B.D.Hames & D.M.Glover; Proudfoot, 1989, Trends Bio-chem. Sci., 14, 105). Эти последовательности обеспечивают транскрипцию мРНК, которая затем может быть транслирована в полипептид, кодируемый исходной ДНК. Примерами сигналов терминации транскрипции и полиаденилирования являются те мотивы, которые происходят из генома вируса SV40 (Sambrook et al., 1989, "Expression of cloned genes in cultured mammalian cells". In "Molecular Cloning: A Laboratory Manual").
Обычно описанные выше компоненты, включая промотор, полиадениловый сигнал и сайт терминации транскрипции, включают одновременно в состав экспрессирующих конструкций. Энхансеры, интроны, включающие функциональные донорные и акцепторные сайты сплайсинга, и лидерные последовательности могут быть также включены в экспрессирующую конструкцию, если это является желательным. Экспрессирующие конструкции часто поддерживаются в виде репликона, такого как внехромосомный элемент (например, плазмиды), способный стабильно сохраняться в организме хозяина, таком как клетка млекопитающего или бактерия. Репликационные системы млекопитающих включают те системы, которые являются производными от вирусов животных, для реплицирования которых необходимо участие трансрегулирующих факторов. Например, плазмиды, включающие репликационные системы паповавирусов, таких как вирус обезьян SV40 (Gluzman, 1981, Cell, 23, 175), или полиомавирусов, реплицируются в исключительно большом числе копий в присутствии подходящего вирусного Т-антигена. Дополнительными примерами репликонов для клеток млекопитающих являются те, которые происходят от бычьего папилломавируса и вируса Эпштейна-Барр. Кроме того, такой репликон может нести две репликационные системы, что тем самым обеспечивает возможность поддержания их, например, в клетках млекопитающих с целью экспрессии и в прокариотических клетках с целью клонирования и амплифицирования. Примеры таких бифункциональных векторов для млекопитающих/бактерий включают конструкции рМТ2 (Kaufman et al., 1989, Mol. Cell. Biol., 9, 946) и рНЕВО (Shimizu et al., 1986, Mol. Cell. Biol., 6, 1074).
Выбор используемых процедур трансформации зависит от вида организма-хозяина, который будет трансформироваться. Способы внесения гетерологичных полинуклеотидов в клетки млекопитающих хорошо известны в данной области техники: они включают опосредуемую декстраном трансфекцию, преципитацию фосфатом кальция, опосредуемую полибреном трансфекцию, слияние протопластов, электропорацию, инкапсуляцию полинуклеотида(ов) в липосомы и прямое микроинъецирование ДНК в ядра клеток-мишеней.
Линии клеток млекопитающих, пригодные в качестве хозяев для целей экспрессии, хорошо известны и включают большое число иммортализованных клеточных линий, доступных из Американской коллекции типовых культур (АТСС), включая, но тем самым не исчерпываясь, клетки яичника китайского хомячка (СНО), клетки HeLa человека, клетки почек новорожденных хомячков (ВНК), клетки почки зеленой мартышки (COS), клетки гепатоклеточной карциномы человека (например, HepG2) и множество других клеточных линий.
2. Бакуловирусные системы
Полинуклеотид, кодирующий белок, также может быть встроен в подходящий экспрессирующий вектор для клеток насекомых: его функциональным образом соединяют с регуляторными элементами в составе такого вектора. При конструировании вектора используются методики, хорошо известные в данной области техники. В целом, компоненты экспрессионной системы включают собственно вектор для переноса, обычно являющийся бактериальной плазмидой, который включает и фрагмент бакуловирусного генома, и стандартный рестрикционный сайт, предназначенный для встраивания гетерологичного гена или генов, которые будут экспрессироваться; бакуловирус дикого типа, характеризующийся сходством последовательности с бакуловирусо-специфичным фрагментом вектора для переноса (это обеспечивает гомологичную рекомбинацию гетерологичного гена в бакуловирусном геноме); и подходящие клетки-хозяева насекомого и культуральную среду.
После внесения последовательности ДНК, кодирующей конкретный белок, в состав вектора для переноса, этот вектор и вирусный геном дикого типа используют для трансфекции в клетку-хозяин насекомого, в которой вектор и вирусный геном могут рекомбинировать. Упакованный рекомбинантный вирус экспрессируется, а рекомбинантные бляшки могут быть идентифицированы и очищены. Материалы и методы формирования экспрессионных систем "бакуловирус/клетки насекомых" доступны в виде специальных наборов на коммерческой основе, например, помимо прочего, от фирмы Invitrogen (Сан-Диего, США): набор реактивов "МахВас". Эти методики в целом известны специалистам в данной области техники и полно охарактеризованы в руководстве Саммерса и Смита (Summers & Smith, 1987, Texas Agricult. Exper. Stat. Bull., N 1555) (здесь и далее цитируется как "Summers & Smith").
Перед встраиванием последовательности ДНК, кодирующей белок, в состав бакуловирусного генома, описанные выше компоненты, включая промотор, лидерный сегмент (если он является желательным), представляющую интерес кодирующую последовательность и сайт терминации транскрипции, обычно компонуют в промежуточную конструкцию (вектор для переноса). Такая конструкция может включать в своем составе единственный ген и функционально присоединенные к нему регуляторные элементы; или множественные гены, каждый из которых имеет "собственный" набор функционально присоединенных регуляторных элементов; или множественные гены, находящиеся под контролем одних и тех же регуляторных элементов. Промежуточные перемежающиеся конструкции часто поддерживаются в виде репликона, такого как внехромосомный элемент (например, плазмида), способного стабильно сохраняться в организме-хозяине, таком как бактерия. Такой репликон должен включать репликационную систему, что тем самым обеспечит поддержание в подходящем организме-хозяине с целью клонирования и амплифицирования.
В настоящее время наиболее распространенным вектором для переноса с целью внесения чужеродных генов в AcNPV является рАс373. Также могут быть сформированы и многие другие векторы, известные специалистам в данной области техники. Они включают, например, pVL985 (в котором изменяется старт-кодон гена полигедрина с ATG на АТТ и который вносит клонирующий BamHI-сайт в 32 парах нуклеотидов ниже кодона АТТ: см. Luckow & Summers, 1989, Virology, 17, 31.
Обычно используемая плазмида также включает сигнал полиаденилирования гена полигедрина (Miller et al., 1988, Ann. Rev. Microbiol., 42, 177) и прокариотический ген резистентности к ампициллину (аmр) и точку начала репликации, необходимые для отбора и воспроизведения в клетках E.coli.
Бакуловирусные трансфекционные векторы обычно включают бакуловирусный промотор. Бакуловирусный промотор - это любая последовательность ДНК, способная связываться с бакуловирусной РНК-полимеразой и инициировать транскрипцию кодирующей последовательности (например, структурного гена) в направлении 5'- 3' с образованием мРНК. Промотор должен включать сайт инициации транскрипции, который обычно помещают проксимально по отношению к 5'-концу кодирующей последовательности.
Этот участок инициации транскрипции обычно включает сайт связывания РНК-полимеразы и собственно сайт инициации транскрипции. Бакуловирусный трансфекционный вектор также может включать второй домен, определяемый как "энхансер", который, если присутствует, обычно находится дистальнее структурного гена. Экспрессия может быть либо индуцибельной, либо конститутивной.
Структурные гены, интенсивно транскрибируемые на поздних этапах вирусного инфекционного цикла, позволяют выделить конкретно применимые промоторные последовательности. Примерами являются последовательности, производные от гена, кодирующего вирусный белок - полигедрин (Friesen et al., 1986, "The Regulation of Baculovirus Gene Expression", In "The Molecular Biology of Baculoviruses", ed. W.Doerfler; европейские патентные публикации №№127839 и 155476), и гена, кодирующего белок р10 (Vlak et al., 1988, J. Gen. Virol., 69, 765).
ДНК, кодирующая подходящие сигнальные последовательности, может быть производной от генов, кодирующих секретируемые белки насекомых или бакуловирусов, такие как ген полигедрина бакуловируса (Carbonell et al., 1988, Gene, 73, 409). С другой стороны, при том, что сигналы посттрансляционных модификаций в клетках млекопитающих (таких как отщепление сигнального сегмента, протеолитическое расщепление и фосфорилирование), по-видимому, распознаются и клетками насекомых, а сигналы, необходимые для секреции и ядерной аккумуляции, также, по-видимому, консервативны в клетках позвоночных и беспозвоночных животных, для обеспечения секреции у насекомых также могут быть использованы лидерные сегменты, не связанные происхождением с насекомыми, такие как те, которые являются производными от генов, кодирующих α-интерферон человека (Maeda et al., 1985, Nature, 315, 592), рилизинг-фактор гастрина человека (Lebacq-Verheyden et al., 1988, Mol. Cell. Biol., 8, 3129), интерлейкин-2 человека (Smith et al., 1985, Proc. Natl. Acad. Sci. USA, 82, 8404), интерлейкин-3 мыши (Miyajima et al., 1987, Gene, 58, 273).
Рекомбинантный полипептид или полипротеин может быть экспрессирован внутриклеточно или, если он экспрессируется с участием специальных регуляторных последовательностей, он может секретироваться. Эффективная внутриклеточная экспрессия нехимерных углеродных белков обычно требует наличия гетерологичных генов, которые в идеале включают короткую лидерную последовательность, включающую подходящие сигналы инициации трансляции, предшествующие старт-кодону ATG. Если желательно, остаток метионина с N-конца может быть отщеплен от зрелого белка путем инкубации in vitro с цианогенбромидом.
С другой стороны, рекомбинантные полипротеины или белки, которые нативно не являются секретируемыми, могут быть секретированы из клеток насекомых путем создания химерных молекул ДНК, которые бы кодировали химерный белок, включающий лидерный сегмент, который обеспечивает секрецию белка, чужеродного для насекомых. Сегмент лидерной последовательности обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот, который контролируют перемещение белка в эндоплазматический ретикулюм.
После встраивания последовательности ДНК и (или) гена, кодирующего экспрессионный продукт, являющийся предшественником конкретного белка, клетку-хозяина насекомого одновременно трансформируют гетерологичной ДНК вектора для переноса и геномной ДНК бакуловируса дикого типа - обычно применяются котрансфекционные методы. Промотор и последовательность терминации транскрипции данной конструкции обычно должны включать сегмент бакуловирусного генома длиной 2-5 тысяч пар нуклеотидов. Способы внесения гетерологичной ДНК по желаемому сайту в состав бакуловируса известны в данной области техники (см. Summers & Smith, цит. выше; Ju et al., 1987; Smith et al., 1983, Mol. Cell. Biol., 3, 2156; Luckow & Summers, 1989). Например, встраивание может быть произведено внутрь гена, такого как ген полигедрина, для чего используется гомологичная двойная рекомбинация; также встраивание может быть осуществлено по рестрикционному ферментному сайту, искусственно созданному в пределах желательного бакуловирусного гена (Miller et al., 1989, BioEssays, 4, 91). Последовательность ДНК, в случае, когда она клонируется в участок гена полигедрина экспрессирующего вектора, фланкируется с обеих сторон (5' и 3') последовательностями, характерными для гена полигедрина и помещается ниже полигедринового промотора.
Заново сформированный бакуловирусный экспрессирующий вектор последовательно упаковывается в инфекционный рекомбинантный бакуловирус. Гомологичная рекомбинация происходит с низкой частотой (от примерно 1% до примерно 5%): следовательно, подавляющее большинство продуцируемых котрансгрануляцией вирусов представляет вирус дикого типа. Это означает, что необходим специальный подход для идентификации рекомбинантных вирусов. Преимуществом данной экспрессирующей системы является возможность визуального скрининга, позволяющего выявлять рекомбинантные вирусы. Белок полигедрин, характерный для природных вирусов, вырабатывается в очень большом количестве в ядрах инфицированных клеток на поздних этапах цикла вирусной инфекции. Накапливаемый белок полигедрин образует включенные тельца, которые также содержат встроенные в них частицы. Эти включенные тельца размером до 15 мкм обусловливают значительное преломление света: это придает им яркое свечение, которое может быть легко визуализовано в обычном световом микроскопе. В клетках, инфицированных рекомбинантным вирусом, включенные тельца отсутствуют. Для выявления рекомбинантных вирусов и вирусов дикого типа трансфекционный надосадочный слой вносят на монослойную культуру клеток насекомых с применением методик, хорошо известных специалистам в данной области техники. А именно бляшки подвергают анализу под световым микроскопом с целью выявления присутствия (как признака вируса дикого типа) или отсутствия (как признака рекомбинантного вируса) включенных телец ("Current Protocols in Microbiology", Vol.2, eds. Ausubel et al., раздел 16.8 (Supp.10, 1990); Summers & Smith, цит. выше; Miller et al., 1989).
Рекомбинантные бакуловирусные экспрессирующие векторы были сконструированы с целью инфицирования в различные типы клеток насекомых. Например, помимо прочего, рекомбинантные бакуловирусы были сформированы для: комара Aedes aegypti, совки Autographa californica, тутового шелкопряда Bombyx mori, дрозофилы Drosophila melanogaster, Spodoptera frugiperda и совки Trichoplusia ni (патентная заявка WO 89/046699; Carbonell et al., 1985, J. Virol., 56, 153; Wright, 1986, Nature, 321, 718; Smith et al., 1983, Mol. Cell. Biol., 3, 2156; как обзор см. Fraser et al., 1989, In Vitro Cell. Develop. Biol., 25, 225).
Клетки и культуральные среды доступны на коммерческой основе как для прямой, так и химерной экспрессии гетерологичных полипептидов в бакуловирусной экспрессирующей системе; технология культивирования клеток в целом хорошо известна специалистам в данной области техники (см., например, Summers & Smith, цит. выше).
Модифицированные клетки насекомых затем могут быть выращены в подходящей питательной среде, которая обеспечит стабильное поддержание плазмиды, присутствующей в модифицированном насекомом-хозяине. В случае, когда экспрессирующий продукт находится под контролем индуцибельных регуляторов, организм-хозяин может быть выращен при очень высоких плотностях с индукцией экспрессии. С другой стороны, когда экспрессия является конститутивной, искомый продукт будет постоянно экспрессироваться в культуральную среду, а питательная среда при этом может непрерывно циркулировать - это позволяет выделять искомый представляющий интерес продукт и пополнять истощаемую питательную среду. Этот продукт может быть очищен с помощью таких методик, как хроматография, например, ВЭЖХ, аффинная хроматография, ион-обменная хроматография и т.п.; электрофорез; центрифугирование в градиенте плотности; экстракция из раствора; или подобное. Если необходимо, этот продукт может быть подвергнут дополнительной очистке, чтобы обеспечить существенное удаление любых белков насекомого, которые также являются секретируемыми в культуральную среду или образуются в результате лизиса клеток насекомого, в результате чего обеспечивается получение продукта, который по сути является свободным от дебриса хозяев, например, белков, липидов и полисахаридов.
С целью обеспечения экспрессии белка рекомбинантные клетки-хозяева, производные от полученных трансформантов, инкубируют в условиях, которые обеспечивают экспрессию последовательности, кодирующей рекомбинантный белок. Эти условия могут варьироваться в зависимости от выбранной клетки-хозяина. Однако такие условия легко могут быть подобраны специалистом в данной области техники на основе известных научных данных.
3. Растительные системы
В данной области техники известны многочисленные генетические экспрессионные системы, основанные на растительных клетках и цельных растениях. Примеры таких генетических экспрессионных растительных систем можно найти в патентах США №№5693506, 5659122 и 5608143. Дополнительные примеры генетической экспрессии в культивируемых растительных клетках описаны Ценком (Zenk, 1991, Phytochemistry, 30, 3861-3863). Описания сигнальных пептидов растительных белков можно найти, в дополнение к указанным выше источникам, в работах Vaulcombe et al., 1987, Mol. Gen. Genet., 209, 33-40; Chandler et al., 1984, Plant Mol. Biol., 3, 407-418; Rogers et al., 1985, J. Biol. Chem., 260, 3731-3738; Rothstein et al., 1987, Gene, 55, 353-356; Whittier et al., 1987, Nucl. Acids Res., 15, 2515-2535; Wirsel et al., 1989, Mol. Microbiol., 3, 3-14; Yu et al., 1992, Gene, 112, 247-253. Описание параметров регуляции экспрессии растительных генов с участием фитогормонов, гибберелловой кислоты и секретируемых ферментов, индуцируемых гибберелловой кислотой, можно найти в монографии R.L.Jones & J.MacMillin, 1984, "Gibberellins", In "Advanced Plant Physiology", ed. M.B. Wilkins, Pitman Publ. Ltd, London, pp.21-52. Материалы, описывающие другие гены, регулируемые с участием метаболических механизмов: Sheen, 1990, Plant Cell, 2, 1027-1038; Maas et al., 1990, EMBO J., 9, 3447-3452; Benkel & Hickey, 1987, Proc. Natl. Acad. Sci. USA, 84, 1337-1339.
Обычно с использованием методологий, известных в данной области техники, желательная полинуклеотидная последовательность встраивается в состав экспрессионной кассеты, включающей генетические регуляторные элементы, сконструированные для функционирования в растениях. Экспрессионную кассету встраивали в желательный экспрессирующий вектор вместе с последовательностями, расположенными выше и ниже экспрессионной кассеты подходящими для экспрессии в растении-хозяине. Сопутствующие последовательности могут иметь плазмидное или вирусное происхождение и обеспечивать необходимые характеристики вектору, которые обеспечат векторам способность переносить ДНК из исходного организма-хозяина, используемого для клонирования, такого как бактерия, в желательное растение-хозяин. Базовая бифункциональная ("бактериально-растительная") векторная конструкция предпочтительно должна обеспечивать широкий круг хозяев, включать прокариотическую точку начала репликации, прокариотический селективный маркер и, в варианте с трансформацией бактерий Agrobacterium, последовательности Т-ДНК, что позволит осуществлять перенос генов на основе трансформации с помощью Agrobacterium. Когда идентификация гетерологичного гена затруднена, данная конструкция должна предпочтительно также включать селективный маркер, пригодный для выявления того, была ли трансформирована растительная клетка. Обзор по селективным маркерам, например, членам семейства grass, можно найти в статье Wilmink & Dons, 1993, Plant Mol. Biol. Reptr., 11(2):165-185.
Последовательности, пригодные для обеспечения интеграции гетерологичной последовательности в геном растения, также рекомендованы. Они могут включать транспозонные последовательности и подобное, которые связаны с процессами гомологичной рекомбинации, равно как и Ti-последовательности, которые обусловливают случайное встраивание гетерологичной экспрессионной кассеты в растительный геном. Подходящие прокариотические селективные маркеры включают признаки резистентности к антибиотикам, таким как ампициллин или тетрациклин. Другие последовательности ДНК, кодирующие дополнительные функции, также могут входить в состав вектора, будучи известными в данной области техники.
Молекулы нуклеиновых кислот по настоящему изобретению могут быть включены в состав экспрессионной кассеты, предназначенной для обеспечения экспрессии представляющего интерес белка (белков). Обычно используется единственная экспрессионная кассета, хотя возможно использование двух или большего числа таких кассет. Рекомбинантная экспрессионная кассета должна включать в дополнение к последовательности, кодирующей гетерологичный белок, следующие элементы: промоторный сегмент, 5'-нетранслируемые последовательности растительного генома, инициирующий кодон, присутствие или отсутствие которого зависит от того, имеется ли он в составе анализируемого структурного гена, и сайты терминации транскрипции и трансляции. Уникальные сайты узнавания рестриктазами по 5'- и 3'-концам данной кассеты обеспечивают удобное встраивание в состав предварительно действующего вектора.
Гетерологичная кодирующая последовательность может быть связана с любым белком по настоящему изобретению. Последовательность, кодирующая интересующий белок, будет кодировать сигнальный сегмент, который обеспечит процессинг и перемещение белка, если это необходимо, и, как правило, должна быть лишена любой последовательности, которая могла бы обусловливать связывание желательного белка по настоящему изобретению с мембраной. При том, что в большинстве случаев участок инициации транскрипции будет предназначен для гена, который экспрессируется и транслоцируется в процессе прорастания, путем использования сигнального сегмента, обеспечивающего перемещение, можно также обеспечить перемещение желательного белка. В этом случае представляющий интерес белок (белки) будет перенесен из клеток, в которых он был экспрессирован: следовательно, он может быть эффективно собран. Обычно секреция в семенах обеспечивается из алейроновой области или щиткового эпителия в эндосперм семени. Хотя нет конкретной необходимости в секреции белка из клеток, в которых он вырабатывался, такой подход облегчает выделение и очистку рекомбинантного белка.
Поскольку окончательная экспрессия желательного генного продукта должна происходить в эукариотической клетке, желательным является определить, не содержит ли любой из участков клонированного гена последовательности, которые могли быть утрачены в виде интронов под действием механизма сплайсинга, свойственного организму-хозяину. Если они есть, то с применением метода направленного (сайт-специфичного) мутагенеза такой "интронный" участок может быть изменен таким образом, чтобы исключить утрату части генетического материала из-за наличия ложно-интронных сигналов (Reed & Maniatis, 1985, Cell, 41, 95-105).
Вектор может быть микроинъецирован в клетки растений с использованием микропипеток, что обеспечит механический перенос рекомбинантной ДНК (Crossway, 1985, Mol. Gen. Genet., 202, 179-185). Генетический материал может быть также перенесен в растительные клетки с использованием полиэтиленгликоля (Krens et al., 1982, Nature, 296, 72-74). Другим способом внесения сегментов нуклеиновых кислот является высокоскоростное баллистическое внесение мелких частиц ("снарядов"), внутри которых или на поверхности которых находится нуклеиновая кислота (Klein et al., 1987, Nature, 327, 70-73; Knudsen & Muller, 1991, Planta, 185, 330-336 - в этих работах описывается применение метода бомбардировки частицами эндосперма ячменя с целью получения трансгенных растений ячменя). Еще одним способом внесения может быть слияние протопластов с другими компонентами, такими как миниклетки, клетки, лизосомы или иные способные участвовать в слиянии с протопластами тельца, имеющие липидную поверхность (Fraley et al., 1982, Proc. Natl. Acad. Sci. USA, 79, 1859-1863).
Вектор также может быть внесен в растительные клетки с применением электропорации (Fromm et al., 1985, Proc. Natl. Acad. Sci. USA, 82, 5824). В этой методике протопласты растений подвергают электропорации в присутствии плазмид, включающих генную конструкцию. Электрические импульсы, характеризующиеся высоким значением напряженности электрического поля, обратимо "продырявливают" биологические мембраны, обеспечивая тем самым проникновение плазмид внутрь. Электропорированные растительные протопласты восстанавливают свою клеточную стенку, делятся и образуют каллюсы.
Все растения, из которых могут быть выделены протопласты с последующим культивированием и получением цельных регенерированных растений, могут быть трансформированы в соответствии с настоящим изобретением таким образом, чтобы были получены цельные растения, несущие перенесенный ген. Известно, что практически все растения могут быть регенерированы из культивируемых клеток или тканей, включая, но тем самым не ограничиваясь, все основные виды сахарного тростника, сахарной свеклы, хлопчатника, фруктовых и других деревьев, бобовых растений и овощных культур. Некоторыми подходящими растениями, например, являются виды родов Fragaria (земляника), Lotus (лядвенец), Medicago (люцерна), Onobrychis (эспарцет), Trifolium (клевер), Trigonella (пажитник), Vigna (вигна), Citrus (цитрусы), Linum (лен), Geranium (герань), Manihot (маниок), Daucus (морковь), Arabidopsis (резуховидка), Brassica (капуста, брюква, репа), Raphanus (редька), Sinapis (горчица), Atropa (красавка-беладонна), Capsicum (овощной перец), Datura (дурман), Hyoscyamus (белена), Lycopersion (помидор), Nicotiana (табак), Solanum (паслен), Petunia (петуния), Digitalis (росичка), Majorana (майоран), Cichorium (цикорий), Helianthus (подсолнечник), Lactuca (латук), Вrоmus (костер), Asparagus (спаржа), Antirrhinum (львиный зев), Hererocallis, Nemesia, Pelargonium (пеларгония), Panicum (просо), Pennisetum (американское просо), Ranunculus (лютик), Senecio (крестовник), Salpiglossis, Cucumis (огурец, дыня), Browaalia, Glycine (соя), Lolium (плевел), Zea (кукуруза), Triticum (пшеница), Sorghum (сорго) и Datura.
Способы регенерации варьируются в зависимости от вида растения, но в целом всегда вначале получают суспензию трансформированных протопластов, несущих копии гетерологичного гена. Потом формируют каллюсные ткани, в которых побеги могут быть индуцированы с последующим формированием корешков. С другой стороны, в суспензии протопластов может быть индуцировано образование эмбрионов. Эти эмбрионы прорастают как и обычные эмбрионы, образуя растения. Культуральные среды обычно должны содержать различные аминокислоты и гормоны, такие как ауксин и цитокины. Также предпочтительным является добавление глутаминовой кислоты и пролина в культуральную среду, особенно для таких видов, как кукуруза и люцерна. Побеги и корешки в норме развиваются одновременно. Эффективность регенерации будет зависеть от культуральной среды, генотипа растения и от параметров конкретной культуры. Если эти три переменных находятся под контролем, то регенерация оказывается воспроизводимой и повторяемой.
В некоторых системах культивирования растительных клеток желательный белок по настоящему изобретению может выделяться сам или, с другой стороны, такой белок может быть экстрагирован из цельного растения. В тех случаях, когда желательный белок по настоящему изобретению секретируется в культуральную среду, он может быть собран. С другой стороны, эмбрионы и "полусемена" с удаленной эмбриональной частью или другие растительные ткани могут быть механически измельчены с целью выделения секретируемого белка из клеток и тканей. Полученная смесь может быть суспендирована в буферном растворе с целью повторного выделения растворимых белков. Стандартные методы выделения и очистки белков могут быть использованы для очистки рекомбинантного белка. Параметры времени, температуры, рН, содержания кислорода и объема могут быть доведены с помощью рутинных процедур с целью оптимизации экспрессии и выделения гетерологичного белка.
4. Бактериальные системы
Методики экспрессии в бактериальных клетках хорошо известны. Бактериальным промотором является любая последовательность. ДНК, способная обеспечивать связывание бактериальной РНК-полимеразы и инициирование транскрипции нижерасположенной (в направлении 3') кодирующей последовательности (например, структурного гена) с образованием мРНК. В промоторе должен присутствовать сайт инициации транскрипции, который обычно располагают проксимально по отношению к 5'-концу кодирующей последовательности. Этот сайт инициации транскрипции обычно включает сайт связывания РНК-полимеразы и собственно сайт инициации транскрипции. Бактериальный промотор также может включать второй домен, называемый "оператором", который может перекрываться с соседним сайтом связывания РНК-полимеразы, с которого начинается синтез РНК. Оператор обеспечивает негативно регулируемую (т.е. индуцибельную) транскрипцию: ген-репрессорный белок может связываться на этом операторе, тем самым подавляя транскрипцию конкретного гена. Конститутивная экспрессия может иметь место в отсутствие негативных регуляторных элементов, таких как оператор. Кроме того, позитивная регуляция может обеспечиваться последовательностью связывания ген-активирующего белка, который: если присутствует, находится проксимально (с 5'-стороны) по отношению к сайту связывания РНК-полимеразы. Примером ген-активирующего белка является катаболический активатор (CAP), который является помощником инициации транскрипции lac-оперона в геноме кишечной палочки Escherichia coli (E.coli) (Raibaud et al., 1984, Annu. Rev. Genet., 18, 173). Таким образом, регуляция экспрессии может быть негативной или позитивной, тем самым усиливия или ослабляя транскрипцию.
Последовательности, кодирующие ферменты метаболического пути, представляют конкретно применимые промоторные последовательности. Примерами являются промоторные последовательности, производные от генов, кодирующих ферменты, участвующие в метаболизме сахаров, таких как галактоза, лактоза (lac) (Chang et al., 1977, Nature 198, 1056) и мальтоза. Дополнительными примерами являются промоторные последовательности, производные от биосинтетических ферментов, таких как ферменты биосинтеза триптофана (trp) (Goeddel et al., 1980, Nucl. Acids Res., 8, 4057; Yelverton et al., 1981, Nucl. Acids Res., 9, 731; патент США №4738921; европейские патентные заявки ЕР А-0036776 и ЕР А-0121775). Промоторная система g-лаотамазы (blа) (Weissmann, 1981, "The cloning of interferon and other mistakes". In "Interferon 3", ed. I.Gresser) и промоторные системы PL λ-бактериофага (Shimatake et al., 1981, Nature, 292,128) и фага Т5 (патент США №4689406) также могут использоваться в качестве промоторных последовательностей.
Кроме того, синтетические промоторы, которые не встречаются в природе, также могут функционировать в качестве бактериальных промоторов. Например, последовательности активации транскрипции одного из бактериальных или бактериофаговых промоторов могут быть соединены с оперонными последовательностями другого бактериального или бактериофагового промотора, в результате чего образуется синтетический гибридный промотор (патент США №4551433). Например, промотор tac является гибридным промотором trp-lac, состоящий из последовательностей промотора trp и промотора lac, которые находятся под контролем репрессора lac (Amann et al., 1983, Gene, 25, 167; de Boer et al., 1983, Proc. Natl. Acad. Sci. USA, 80, 21).
Далее, бактериальный промотор может включать естественно встречающиеся промоторы небактериального происхождения, которые обладают способностью связывать бактериальную РНК-полимеразу и инициировать транскрипцию. Естественно встречающийся промотор небактериального происхождения также может быть соединен с совместимой РНК-полимеразой с обеспечением высокого уровня экспрессии некоторых генов в прокариотических клетках. Система "РНК-полимераза/промотор" бактериофага Т7 является примером объединенной промоторной системы (Studier et al., 1986, J. Mol. Biol., 189, 113; Tabor et al., 1985, Proc. Natl. Acad. Sci. USA, 82, 1074). Кроме того, гибридный промотор также может состоять из бактериофагового промотора и операторного сегмента E.coli (ЕРО-А-0267851).
В дополнение к функциональной промоторной последовательности сайт эффективного связывания на рибосоме также применим для обеспечения экспрессии чужеродных генов в прокариотических клетках. У E.coli сайт связывания на рибосоме называют последовательностью Шайна-Дальгарно (SD): она включает старт-кодон ATG и последовательность из 3-9 нуклеотидов, расположенную в 3-11 нуклеотидах выше от старт-кодона (Shine et al., 1975, Nature, 254, 34). Последовательность SD, как считается, способствует связыванию мРНК на рибосоме за счет спаривания оснований в составе последовательности SD и 3'-конце 163-рРНК E.coli (Steitz et al., 1979, "Genetic signals and nucleotide sequences in messenger RNA", In "Biological Regulation and Development: Gene Expression", ed. R.F.Goldberger). Для экспрессии эукариотических генов и прокариотических генов используется "слабый" сайт связывания на рибосоме (Sambrook et al., 1989, "Expression of cloned genes in Escherichia coli". In "Molecular Cloning: A Laboratory Manual").
Молекула ДНК может быть экспрессирована внутриклеточно. Промоторная последовательность может быть напрямую присоединена к этой молекуле ДНК: в этом случае первая аминокислота с N-конца всегда должна быть метионином, который кодируется старт-кодоном ATG. Если желательно, метионин с N-конца может быть отщеплен от белка путем инкубации in vitro с цианогенбромидом или путем инкубации in vivo или in vitro с бактериальным ферментом - N-терминальной метионинпептидазой (европейская патентная заявка ЕРО-А-0219237).
Химерные белки являются альтернативным способом контроля экспрессии. Обычно последовательность ДНК, кодирующая N-концевой участок эндогенного бактериального белка или другого стабильного белка, сливают с 5'-концом гетерологичных кодирующих последовательностей. В результате экспрессии такая конструкция приводит к образованию химеры (гибрида) двух аминокислотных последовательностей. Например, клеточный ген бактериофага λ может быть соединен по своему 5'-концу с чужеродным геном с последующей экспрессией в бактериях. Получаемый в результате химерный белок предпочтительно сохраняет в своем составе сайт для процессинга с участием фермента (фактор Ха), в результате чего происходит отщепление фагового белка от продукта чужеродного гена (Nagai et al., 1984, Nature, 309, 810). Химерные белки также могут быть сформированы с использованием последовательностей генов lacZ (Jia et al., 1987, Gene, 60, 197), trpE (Allen et al., 1987, J. Biotechnol., 5, 93; Makoff et al., 1989, J. Gen. Microbiol., 135, 11) и Chey (европейская патентная заявка ЕР-А-0324647). Последовательность ДНК в районе соединения двух аминокислотных последовательностей может кодировать сайт расщепления, а может и не кодировать его. Другим примером является химерный белок убихитин. Такой химерный белок формируется таким образом, что в пределах собственно убихитинового сегмента предпочтительно сохранялся сайт-мишень для фермента процессинга (например, специфичной по процессингу убихитина протеазы), необходимая для отщепления убихитина от чужеродного белка. С применением такого подхода могут быть выделены нативные чужеродные белки (Miller et al., 1989, Bio/Technol., 7, 698).
С другой стороны, чужеродные белки также могут быть секретированы клетками вследствие создания химерных молекул ДНК, которые бы кодировали химерный белок, включающий пептидный фрагмент сигнальной последовательности, обеспечивающий секрецию чужеродного белка бактериальными клетками (патент США №4336336). Фрагмент сигнальной последовательности обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот, которые обеспечивают секрецию белка из клетки. Этот белок секретируется либо в культуральную среду (в вариантах с грамположительными бактериями), либо в периплазматическое пространство, расположенное между внутренней и внешней мембранами клетки (грамотрицательной бактерии). Предпочтительно присутствуют сайты процессинга, которые могут быть расщеплены либо in vivo, либо in vitro на участке между фрагментом сигнального пептида и продукта чужеродного гена.
ДНК, кодирующая подходящие сигнальные последовательности, может являться производной от генов, кодирующих секретируемые бактериальные белки, таких как ген белка внешней мембраны E.coli (ompA) (Masui et al., 1983, In "Experimental Manipulation of Gene Expression"; Ghrayeb et al., 1984, EMBO J., 3, 2437) и сигнальная последовательность гена phoA, кодирующего щелочную фосфатазу E.coli (Oka et al., 1985, Proc. Natl. Acad. Sci. USA, 82, 7212). В качестве дополнительного примера можно привести сигнальную последовательность гена α-амилазы различных штаммов палочек рода Bacillus, которая может быть использована для обеспечения секреции гетерологичных белков из клеток сенной палочки B.subtilis (Palva et al., 1982, Proc. Natl. Acad. Sci. USA, 79, 5582; европейская патентная заявка ЕР-А-0244042).
Обычно последовательности терминации транскрипции, распознаваемые бактериями, представлены регуляторными сегментами, находящимися с 3'-стороны от стоп-кодона: соответственно, наряду с промотором они фланкируют конкретную кодирующую последовательность. Эти последовательности обеспечивают транскрипцию мРНК, которая затем может быть транслирована в полипептид, кодируемый этим участком ДНК. Последовательности терминации транскрипции нередко включают последовательности ДНК, состоящие примерно из 50 нуклеотидов, способных образовывать выпетленные структуры, которые и обеспечивают терминацию транскрипции. Примерами являются последовательности терминации транскрипции, производные от генов, имеющих сильные промоторы, таких как ген trp E.coli, равно как и другие биосинтетические гены.
Обычно описанные выше компоненты, включая промотор, сигнальную последовательность (при желании), рассматриваемая кодирующая последовательность и последовательность терминации транскрипции встраиваются вместе в экспрессирующие конструкции. Экспрессирующие конструкции часто поддерживаются в составе репликона, такого как внехромосомный элемент (например, плазмида), способного стабильно сохраняться в организме-хозяине, таком как бактерия. Такой репликон должен включать репликационную систему, которая бы обеспечивала ему способность сохраняться в прокариотическом организме, предназначенном либо для экспрессии, либо для клонирования и амплификации. Кроме того, репликон может быть либо высококопийной, либо низкокопийной плазмидой. Высококопийная плазмида должна в принципе характеризоваться числом копий от примерно 5 до примерно 200, а обычно от примерно 10 до примерно 150. Организм-хозяин, несущий высококопийную плазмиду, предпочтительно должен нести по крайней мере примерно 10 плазмид, а более предпочтительно - по крайней мере примерно 20 плазмид. И высококопийные, и низкокопийные плазмиды могут быть отобраны на основе того влияния, которое оказывает вектор и чужеродный белок на организм-хозяин.
С другой стороны, экспрессирующие конструкции могут быть интегрированы в состав бактериального генома с использованием интеграционного вектора. Интеграционные векторы обычно включают в своем составе по крайней мере одну последовательность, являющуюся гомологичной участку бактериальной хромосомы: это обеспечивает вектору возможность интегрироваться. Как считается, интеграция обусловливается рекомбинацией между гомологичными ДНК в составе вектора и бактериальной хромосомы. Например, интеграционные векторы, сконструированные на основе ДНК различных штаммов Bacillus, интегрируются в. хромосому Bacillus (европейская патентная заявка ЕР-А-0127328). Интеграционные векторы также могут включать фаговые или транспозонные последовательности.
Обычно внехромосомные и интеграционные экспрессирующие конструкции могут включать в себя селективные маркеры, обеспечивающие отбор трансформированных бактериальных штаммов. Селективные маркеры могут быть экспрессированы в бактериальном организме-хозяине и могут включать гены, которые делают бактерии резистентными к лекарственным препаратам, таким как ампициллин, хлорамфеникол, эритромицин, канамицин (неомицин) и тетрациклин (Davies et al., 1978, Annu. Rev. Microbiol., 32, 469). Селективные маркеры также могут включать биосинтетические гены, такие как гены ферментов, вовлеченных в биосинтез гистидина, триптофана и лейцина.
С другой стороны, некоторые из описанных выше компонентов могут быть включены вместе друг с другом в трансформационные векторы. Трансформационные векторы обычно включают селективный маркер, который либо сохраняется в репликоне, либо преобразуются в интегрирующий вектор в соответствии с описанным выше.
Экспрессирующие и трансформирующие векторы (либо внехромосомные или интегрирующие векторы) были сконструированы с целью трансформации многих видов бактерий. Например, экспрессирующие векторы были созданы, помимо прочего, для следующих видов бактерий: сенная палочка Bacillus subtilis (Palva et al., 1982, Proc. Natl. Acad. Sci. USA, 79, 5582; европейские патентные заявки ЕР-А-0036259 и ЕР-А-0063953; международная патентная заявка WO 84/04541), кишечная палочка Escherichia coli (Shimatake et al., 1981, Nature, 292, 128; Amann et al., 1985, Gene, 40, 183; Studier et al., 1986, J. Mol. Biol., 189, 113; европейские патентные заявки ЕР-А-0036776, ЕР-А-0136829 и ЕР-А-0136907), стрептококки Streptococcus cremoris (Powell et al., 1988, Appl. Environ. Microbiol., 54, 655), Streptococcus lividans (Powell et al., 1988, Appl. Environ. Microbiol., 54, 655), стрептомицет Streptomyces lividans (патент США №4745056).
Способы внесения экзогенной ДНК в бактериальные организмы-хозяева хорошо известны в науке и обычно включают либо трансформацию бактерий, обработанных хлористым кальцием или другими агентами, такими как двухвалентные катионы и диметилсульфоксид. ДНК также может быть внесена в бактериальные клетки методом электропорации. Трансформационные процедуры обычно варьируются в зависимости от вида бактерии, который предстоит трансформировать: см., например, Masson et al., 1989, FEMS Microbiol. Lett., 60, 273; Palva et al., 1982, Proc. Natl. Acad. Sci. USA, 79, 5582; европейские патентные заявки ЕР-А-0036259 и ЕР-А-0063953; международная патентная заявка WO 84/04541 (бактерии рода Bacillus), Miller et al., 1988, Proc. Natl. Acad. Sci. USA, 85, 856; Wang et al., 1990, J. Bacteriol., 172, 949 (бактерии рода Campylobacter), Cohen et al., 1973, Proc. Natl. Acad. Sci. USA, 69, 2110; Dower et al., 1988, Nucl. Acids Res., 16, 6127; Kushner, 1978, "An improved method for transformation of Escherichia coli with ColEl-derived plasmids". In "Genetic Engineering: Proc. Intern. Symp. Genet. on Engineering", eds. H.W.Boyer & S.Nicosia; Mandel et al., 1970, J. Mol. Biol., 53, 159; Taketo, 1988, Biochim. Biophys. Acta, 949, 318 (Escherichia), Chassy et al., 1987, FEMS Microbiol. Lett., 44, 173 (молочные бактерии рода Lactobacillus), Fiedler et al., 1988, Anal. Biochem., 170, 38 (псевдомонады рода Pseudomonas), Augustin et al., 1990, FEMS Microbiol. Lett., 66, 203 (бактерии рода Staphylococcus), Barany et al., 1980, J. Bacteriol., 144, 698; Harlander, 1987, "Transformation of Streptococcus lactis by electroporation", In "Streptococcal Genetics", eds. J.Ferretti & R.Curtiss III; Perry et al., 1981, Infect. Immunol., 32, 1295; Powell et al., 1988, Appl. Environ. Microbiol., 54, 655; Somkuti et al., 1987, Proc. 4th European Congr. Biotechnol., 1, 412 (бактерии рода Streptococcus).
5. Экспрессия в дрожжах
Дрожжевые экспрессирующие системы также хорошо известны специалистам в данной области техники. Дрожжевым промотором является любая последовательность ДНК, способная связывать дрожжевую РНК-полимеразу и инициировать транскрипцию нижерасположенного (в 3'-сторону) кодирующей последовательности (например, структурного гена) с образованием мРНК. Промотор должен включать участок инициации транскрипции, который обычно помещают проксимально по отношению к 5'-концу кодирующей последовательности. Этот участок инициации транскрипции обычно включает сайт связывания РНК-полимеразы (т.е. "бокс ТАТА") и собственно сайт инициации транскрипции. Дрожжевой промотор также может включать второй домен, называемый "верхней активаторной последовательностью" (UAS), которая, когда присутствует, обычно располагается дистально по отношению к структурному гену. Сегмент UAS обеспечивает регулируемую (индуцибельную) экспрессию. Конститутивная экспрессия имеет место в случае отсутствия сегмента UAS. Регулируемая экспрессия может быть либо позитивной, либо негативной, что тем самым либо усиливает, либо ослабляет транскрипцию.
Дрожжи - это организм-ферментер, характеризующийся активным метаболизмом: поэтому последовательности, кодирующие ферменты метаболических путей, представляют собой особенно перспективные промоторные последовательности. Примерами являются алкогольдегидрогеназа (ADH) (европейская патентная заявка ЕР-А-0284044), енолаза, глюкокиназа, глюкозо-6-фосфатизомераза, глицеральдегид-3-фосфатдегидрогеназа (GAP или GAPDH), гексокиназа, фосфофруктокиназа, 3-фосфоглицератмутаза и пируваткиназа (РУК) (европейская патентная ЕРО-А-0329203). Дрожжевой ген РНО5, кодирующий кислую фосфатазу, также представляет применимые промоторные последовательности (Myanohara et al., 1983, Proc. Natl. Acad. Sci. USA, 80, 1).
Кроме того, синтетические промоторы, которые не встречаются в природе, также могут функционировать в качестве дрожжевых промоторов. Например, последовательности UAS одного дрожжевого промотора могут быть соединены с участком активации транскрипции другого дрожжевого промотора, в результате чего получают синтетический гибридный промотор.
Примерами таких гибридных промоторов являются регуляторная последовательность гена ADH, соединенная с участком активации транскрипции гена GAP (патенты США №№4876197 и 4880734). Другие примеры гибридных промоторов включают промоторы, которые включают регуляторные последовательности из состава генов ADH2, GAL4, GAL10 или ОRРНО5, сочетанные с участками активации транскрипции генов, кодирующих гликолитические ферменты, такие как гены GAP или РуК (европейская патентная заявка ЕР-А-0164556). Далее, дрожжевой промотор может включать естественно встречающиеся промоторы недрожжевого происхождения, характеризующиеся способностью связывать дрожжевую РНК-полимеразу и инициировать транскрипцию. Примерами таких промоторов являются, помимо прочего, элементы, описанные у Cohen et al., 1980, Proc. Natl. Acad. Sci., USA, 77, 1078; Henikoff et al., 1981, Nature, 283, 835; Hollenberg et al., 1981, Curr. Topics Microbiol. Immunol., 96, 119; Hollenberg et al., 1979, "The Expression of Bacterial Antibiotic Resistance Genes in the Yeast Saccharomyces cerevisiae", In "Plasmids of Medical, Environmental and Commercial Importance", eds. K.N.Timmis & A.Punler; Mercerau-Puigalon et al., 1980, Gene, 11, 163; Panthier et al., 1980, Curr. Genet., 2, 109).
Молекула ДНК может быть экспрессирована внутри клеток дрожжей. Промоторная последовательность может быть напрямую присоединена к молекуле ДНК: в этом случае первая аминокислота с N-конца рекомбинантного белка всегда должна быть метионином, который кодируется старт-кодоном ATG. Если желательно, метионин с N-конца белка может быть отщеплен in vitro путем инкубации с цианогенбромидом.
Химерные белки представляют альтернативный подход для дрожжевых экспрессирующих систем в той же степени, что и для экспрессионных систем клеток млекопитающих, бакуловирусов и бактерий. Обычно последовательность ДНК, кодирующая N-концевую часть эндогенного дрожжевого белка или другого стабильного белка, сливают с 5'-концом гетерологичной кодирующей последовательности. После экспрессии такая конструкция будет обусловливать образование химеры (гибрида) двух аминокислотных последовательностей. Например, гены дрожжевой или человеческой супероксиддисмутазы (SOD) могут быть соединены с 5'-концом чужеродного гена с последующей экспрессией в дрожжах. Последовательность ДНК в области соединения двух аминокислотных последовательностей может кодировать расщепляемый сайт, а может и не кодировать его: см., например, европейскую патентную заявку ЕР А-0196056. Другим примером является химерный убихитиновый белок. Такой химерный белок конструируют таким образом, чтобы предпочтительно убихитиновый сегмент сохранял сайт-мишень для фермента процессинга (например, специфичной для процессинга убихитина протеазы), обусловливающего отщепление убихитина от чужеродного белка. С применением данного метода, следовательно, могут быть выделены нативные чужеродные белки (см., например, международную патентную заявку WO 88/024066).
С другой стороны, чужеродные белки могут также быть секретированы из клетки в питательную среду путем создания химерных молекул ДНК, которые бы кодировали химерный белок, включающий последовательность лидерного сегмента, который обеспечивает секрецию чужеродного белка из дрожжевой клетки. Предпочтительно должны присутствовать кодируемые сайты процессинга, расположенные между лидерным сегментом и чужеродным геном, которые бы могли быть расщеплены in vivo или in vitro последовательность. Лидерный сегмент обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот, который обеспечивает секрецию данного белка из клетки.
ДНК, кодирующие подходящие сигнальные последовательности, могут быть производными от генов, кодирующих секретируемые дрожжевые белки, таких как ген инвертазы дрожжей (европейская патентная заявка ЕР-А-0012873; JPO 62096086) и ген А-фактора (патент США №4588684). С другой стороны, существуют лидерные сегменты недрожжевого происхождения, такие как лидерный сегмент гена интерферона, которые также обеспечивают секрецию в дрожжах (европейская патентная заявка ЕР-А-0060057).
Предпочтительным классом обеспечивающих секрецию лидерных сегментов являются те лидеры, которые используют фрагменты гена α-фактора, в составе которого имеется и "пре" сигнальная последовательность и "про" сегмент. Такие варианты фрагментов α-фактора, которые могут быть использованы, являются полноразмерным препролидером α-фактора (примерно 83 аминокислотных остатка), равно как и укороченные варианты сигнальных сегментов α-фактора (обычно от примерно 25 до примерно 50 аминокислотных остатков) (патенты США №№4546083 и 4870008; европейская патентная заявка ЕР- А-0324274). Дополнительными лидерными сегментами, основывающимися на лидере α-фактора, которые обеспечивают секрецию, являются гибридные α-факторные лидерные сегменты, собранные таким образом, что препоследовательности происходят от первого дрожжевого α-фактора, а пропоследовательности - от второго дрожжевого α-фактора (см., например, международную патентную заявку WO 89/02463).
Обычно последовательности терминации транскрипции, распознаваемые дрожжами, представлены регуляторными сегментами, расположенными с 3'-стороны по отношению к трансляционному стоп-кодону: т.е. они наряду с промотором фланкируют кодирующую последовательность. Эти последовательности обеспечивают транскрипцию мРНК, которая может быть затем транслирована в полипептид, кодируемый данной ДНК. Примерами последовательности терминации транскрипции и других распознаваемых дрожжами терминирующих последовательностей являются те элементы, которые входят в состав генов, кодирующих гликолитические ферменты.
Обычно описанные выше компоненты, включая промотор, лидер (если он желателен), интересующую кодирующую последовательность и последовательность терминации транскрипции, вносят друг с другом в экспрессирующие конструкции. Экспрессирующие конструкции часто поддерживаются в виде репликона, такого как внехромосомный элемент (например, плазмида), способный стабильно существовать в организме-хозяине, таком как дрожжи или бактерия. Такой репликон может включать две репликационные системы: это обеспечит поддержание, например, в дрожжах с целью экспрессии и в прокариотическом хозяине с целью клонирования и амплификации. Примерами таких бифункциональных бактериально-дрожжевых векторов являются YEp24 (Botstein et al., 1979, Gene 8, 17-24), pCl/1 (Brake et al., 1984, Proc. Natl. Acad. Sci. USA, 81, 4642-4646) и YRpl7 (Stinchcomb et al., 1982, J. Mol. Biol., 158, 157). Кроме того, репликон может являться либо высококопийной, либо низкокопийной плазмидой. Высокопийная плазмида в принципе будет характеризоваться наличием числа копий от примерно 5 до примерно 200, а обычно от примерно 10 до примерно 150. Клетка-хозяин, несущая высококопийную плазмиду, предпочтительно должна нести по крайней мере примерно 10 и более предпочтительно по крайней мере примерно 20 копий. Присутствие высококопийного или низкокопийного вектора может быть отселектировано исходя из того влияния, которое оказывает такой вектор и чужеродный белок на организм-хозяин (см., например. Brake et al., цит. выше).
С другой стороны, экспрессирующие конструкции могут быть интегрированы в состав дрожжевого генома с использованием интегрирующего вектора. Обычно интегрирующие векторы включают по крайней мере одну последовательность, гомологичную участку дрожжевой хромосомы, который и обеспечивает интеграцию этого вектора, а предпочтительно включает две гомологичные последовательности, фланкирующие экспрессирующую конструкцию. Предположительно интеграция является следствием рекомбинации между гомологичными ДНК вектора и дрожжевой хромосомы (Orr-Weaver et al., 1983, Meth. Enzymol., 101, 228-245). Интегрирующий вектор может быть направлен в конкретный локус дрожжей путем выбора соответствующей гомологичной последовательности, включаемой в состав этого вектора (см. Orr-Weaver et al., цит. выше). Одна или большее число экспрессирующих конструкций могут интегрироваться так, что, возможно, обусловят снижение уровня выработки рекомбинантного белка (Rine et al., 1983, Proc. Natl. Acad. Sci. USA, 80, 6750). Хромосомные последовательности, включаемые в состав данного вектора, могут находиться в нем либо в виде единственного сегмента вектора, который обусловливает интеграцию всего вектора, или в виде двух сегментов, которые гомологичны соседним сегментам хромосомы и фланкируют экспрессирующую конструкцию вектора, приводя к стабильной интеграции только экспрессирующей конструкции.
Обычно внехромосомные и интегрирующие экспрессирующие конструкции могут нести селективные маркеры, обеспечивающие отбор дрожжевых штаммов, которые были трансформированы. Селективными маркерами могут являться биосинтетические гены, которые будут экспрессироваться в клетках-хозяевах дрожжей, такие как ADE2, HIS4, LEU2, TRP1, а также гены резистентности ALG7 и G418, которые обеспечивают резистентность клеток дрожжей, соответственно, к туникамицину и G418. Кроме того, подходящий селективный маркер также может придавать дрожжам способность расти в присутствии токсичных веществ, таких как ионы металлов. Например, присутствии гена CUP1 обеспечивает дрожжам рост в присутствии ионов меди (Butt et al., 1987, Microbiol. Rev., 51, 351).
С другой стороны, некоторые из описанных выше компонентов могут быть включены вместе друг с другом в состав трансформирующих векторов. Трансформирующие векторы обычно включают селективный маркер, который либо поддерживается в виде репликона, либо преобразуется в интегрирующий вектор в соответствии с описанным выше.
Экспрессирующие и трансформирующие векторы (в виде либо внехромосомных репликонов, либо интегрирующих векторов) были сконструированы для трансформации многих видов дрожжей. Например, экспрессирующие векторы были сконструированы, помимо прочего, для следующих видов дрожжей: Candida albicans (Kurtz et al., 1986, Mol. Cell. Biol., 6, 142), Candida maltosa (Kunze et al., 1985, J. Basic Microbiol., 25, 141), Hansenula polymorpha (Gleeson et al., 1986, J. Gen. Microbiol., 132, 3459; Roggenkamp et al., 1986, Mol. Gen. Genet., 202, 302), Kluyveromyces fragilis (Das et al., 1984, J. Bacteriol., 158, 1165), Kluyveromyces lactis (De Louvencourt et al., 1983, J. Bacteriol., 154, 737; Van den Berg et al., 1990, Bio/Technol., 8, 135), Pichia guillerimondii (Kunze et al., 1985, J. Basic Microbiol., 25, 141), Pichia pastoris (Cregg et al., 1985, Mol. Cell. Biol., 5, 3376; патенты США №№4837148 и 4929555), Saccharomyces cerevisiae (Hinnen et al., 1978, Proc. Natl. Acad. Sci. USA, 75, 1929; Ito et al., 1983, J. Bacteriol., 153, 163), Schizosaccharomyces pombe (Beach & Nurse, 1981, Nature, 300, 706) и Yarrowia lipolytica (Davidow et al., 1985, Curr. Genet., 10, 39; Gaillardin et al., 1985, Curr. Genet., 10, 49).
Способы внесения экзогенной ДНК в дрожжевые клетки-хозяева хорошо известны в науке и обычно включают трансформацию либо сферопластов, либо интактных дрожжевых клеток, обработанных щелочными катионами. Процедуры трансформации обычно варьируются в зависимости от вида дрожжей, трансформация которого осуществляется: см., например, Kurtz et al., 1986, Mol. Cell. Biol., 6, 142; Kunze et al., 1985, J. Basic Microbiol., 25, 141 (Candida); Gleeson et al., 1986, J. Gen. Microbiol., 132, 3459; Roggenkamp et al., 1986, Mol. Gen. Genet., 202, 302 (Hansenula); Das et al., 1984, J. Bacteriol., 158, 1165; De Louvencourt et al., 1983, J. Bacteriol., 154, 1165; Van den Berg et al., 1990, Bio/Technol., 8, 135 (Kluyveromyces); Cregg et al., 1985, Mol. Cell. Biol., 5, 3376; Kunze et al., 1985, J. Basic Microbiol., 25, 141; патенты США №№4837148 и 4929555 (Pichia); Hinnen et al., 1978, Proc. Natl. Acad. Sci. USA, 75, 1929; Ito et al., 1983, J. Bacteriol., 153, 163 (Saccharomyces); Beach & Nurse, 1981, Nature, 300, 706 (Schizosaccharomyces); Davidow et al., 1985, Curr. Genet., 10, 39; Gaillardin et al., 1985, Curr. Genet., 10, 49 (Yarrowia).
Антитела
По использованию в данном тексте термин "антитело" обозначает полипептид или группу полипептидов, включающие по крайней мере один антиген-связывающий сайт. Понятие "антиген-связывающий сайт" обозначает пространственную структуру, параметры поверхности и распределение заряда у которой комплементарны параметрам эпитопа антигена: это обеспечивает процесс связывания антитела с соответствующим антигеном. Под понятием "антитело" понимаются, например, антитела позвоночных животных, химерные антитела, гибридные антитела, гуманизованные антитела, измененные антитела, моновалентные антитела, белки Fab и монодоменные антитела.
Антитела, специфичные в отношении белков по настоящему изобретению, используются для проведения аффинной хроматографии, иммунологических тестов и выявления и идентификации белков нейссерий.
Антитела, специфичные в отношении белков по настоящему изобретению, как поликлональные, так и моноклональные, могут быть получены с применением стандартных методов. В целом, белок, во-первых, используется для иммунизации подходящего животного, предпочтительно мыши, крысы, кролика или козы. Кролики и козы являются предпочтительными объектами для получения поликлональных сывороток благодаря получаемому значительному объему сыворотки крови, а также доступности антикроличьих и антикозьих антител. Иммунизацию обычно проводят путем перемешивания или эмульгирования конкретного белка в солевом (физиологическом) растворе, предпочтительно с адъювантом, таким как полный адъювант Фройнда, с последующим инъецированием полученной смеси или эмульсии парентеральным путем (обычно путем подкожной или внутримышечной инъекции). Обычно достаточными дозами являются по 50-200 мкг за одну инъекцию. Иммунизацию обычно бустируют (т.е. повторяют) через 2-6 недель путем одной или нескольких дополнительных инъекций белка в солевом растворе, предпочтительно с включением неполного адъюванта Фройнда. Также антитела могут быть получены альтернативным путем с помощью иммунизации in vitro с применением известных в данной области техники методов, которые с точки зрения целей настоящего изобретения могут быть эквивалентными методам иммунизации in vivo. Поликлональные антисыворотки получают путем отбора крови у иммунизованных животных в стеклянную или пластиковую емкость с последующей инкубацией крови при 25°С в течение 1 часа и затем инкубацией при 4°С в течение 2-18 часов. Сыворотку затем выделяют центрифугированием (например, при 1000 g в течение 10 минут). У кроликов за один отбор проб может быть взято 20-50 кубиков крови.
Моноклональные антитела получают с использованием стандартного метода Колера-Мильштейна (Kohler & Milstein, 1975, Nature, 256, 495-496) или его модификаций. Обычно в соответствии с описанным выше иммунизуют мышей или крыс.
Однако, в отличие от отбора крови у животных с целью получения сыворотки, удаляют селезенку (и, необязательно, несколько крупных лимфатических узлов) и растворяют до единой клетки. Если это является желательным, клетки селезенки могут быть подвергнуты скринингу (после удаления неспецифических адгезивных клеток) путем нанесения клеточной суспензии на планшет или в отдельную планшетную лунку, покрытые белком-антигеном. В-лимфоциты, экспрессирующие связанный с мембраной иммуноглобулин, специфичный в отношении тестируемого антигена, связывается на планшете таким образом, что с остатком суспензии не смывается с планшета. Затем проводят слияние полученных в результате В-лимфоцитов или же всех растворенных спленоцитов с миеломными клетками, в результате чего образуются гибридомы, которые затем культивируют в селективной среде (например, в среде HAT, содержащей гипоксантин, аминоптерин и тимидин). Полученные в результате гибридомы высевают в ограниченном разведении и тестируют на выработку антител, которые специфическим образом связываются с использовавшимся для иммунизации антигеном (и которые не связываются с посторонними антигенами). Отобранные гибридомы, секретирующие моноклональные антитела (mAb), затем культивируют либо in vitro (например, в ферментерах для полых волокон или стеклянных емкостей для тканевых культур), либо in vivo (в асцитной жидкости у мышей).
Если желательно, антитела (как поликлональные, так и моноклональные) могут быть помечены с применением стандартных методов. Подходящими метками являются флуорофоры, хромофоры, радиоактивные атомы (в частности, 32P и 125I), электронно-плотные реагенты, ферменты и лиганды, для которых известны партнеры по связыванию. Ферменты обычно выявляют по их каталитической активности. Например, пероксидазу хрена обычно выявляют по ее способности превращать 3,3',5,5'-тетраметилбензидин в синий пигмент, количественно оцениваемый на спектрофотометре. Термин "специфичные партнеры по связыванию" обозначает белок, способный связывать молекулу-лиганд, проявляя при этом высокий уровень специфичности, как, например, в случае с антигеном и специфичным в отношении него моноклональным антителом. Другими примерами специфичных партнеров по связыванию являются биотин и авидин (или стрептавидин), иммуноглобулин-G и А-белок, а также многочисленные пары рецепторов и их лигандов, известных в данной области техники. Должно быть понятно, что приведенное выше описание не претендует на классификацию различных маркеров с разделением их на какие-либо классы, поскольку одна и та же метка может быть использована в различных режимах. Например, изотоп 125I может служить в качестве радиоактивной метки или в качестве электронно-плотного агента. Пероксидаза хрена может являться и ферментом, или антигеном для моноклонального антитела. Кроме того, можно для достижения желаемого эффекта сочетать различные метки. Например, mAb и авидин в одинаковой степени нуждаются в мечении в связи с настоящим изобретением: следовательно, можно пометить mAb биотином и выявлять его присутствие с использованием авидина, помеченного, в свою очередь, изотопом 125I или с помощью антиавидинового моноклонального антитела, помеченного пероксидазой хрена. Другие варианты и возможности будут очевидны специалистам в данной области техники и в масштабе настоящего изобретения рассматриваются как эквивалентные.
Фармацевтические композиции
Фармацевтические композиции могут содержать полипептиды, антитела или нуклеиновые кислоты по настоящему изобретению. Эти фармацевтические композиции должны содержать терапевтически эффективное количество полипептидов, антител или полинуклеотидов, заявленных настоящим изобретением.
Термин "терапевтически эффективное количество" по использованию в данном тексте обозначает количество терапевтического средства, предназначенного для лечения, облегчения симптомов или профилактики конкретного заболевания или состояния или обеспечения проявления выявляемого лечебного или профилактического эффекта. Такой эффект может быть выявлен, например, по уровням химических маркеров или антигенов. Лечебные эффекты также включают снижение физических симптомов, таких как понижение температуры тела. Точное эффективное количество в отношении конкретного индивидуума будет зависеть от веса тела и состояния здоровья, от природы и степени выраженности болезненного состояния, а также от типов лекарственных средств или их сочетаний, выбранных для лечения. Следовательно, отсутствует необходимость в изначальном точном определении эффективного количества. Однако эффективное количество для конкретной ситуации может быть определено с помощью рутинных экспериментов: такой подход находится в области компетенции лечащего врача.
Для целей настоящего изобретения эффективная доза должна находиться в пределах от примерно 0,01 мг/кг до 50 мг/кг или от 0,05 мг/кг до примерно 10 мг/кг конструкции ДНК в приложении к конкретному индивидууму, которому она будет введена.
Фармацевтическая композиция также может содержать фармацевтически приемлемый носитель. Термин "фармацевтически приемлемый носитель" обозначает носитель, используемый для введения лекарственного средства, такого как антитела или полипептид, гены или другие лекарственные средства. Данный термин обозначает любой фармацевтический носитель, который сам по себе не индуцирует выработки антител, опасных для индивидуума, получающего фармацевтическую композицию, т.е. который может быть введен без обусловливания токсичности. Подходящими носителями могут быть крупные, медленно метаболизируемые макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, аминокислотные сополимеры и инактивированные вирусные частицы. Такие носители хорошо известны специалистам в данной области техники.
Могут быть использованы фармацевтически приемлемые соли: например, соли неорганических кислот, такие как гидрохлориды, гидробромиды, фосфаты, сульфаты и подобное, или соли органических кислот, такие как ацетаты, пропионаты, малонаты, бензоаты и подобное. Детальное обсуждение фармацевтически приемлемых наполнителей доступно в справочнике Remington's Pharmaceutical Sciences (Mack Publ. Co., NJ, 1991).
Фармацевтически приемлемые носители в составе терапевтических композиций могут содержать жидкости, такие как вода, солевой раствор, глицерин и этиловый спирт. Кроме того, в таких составах могут присутствовать вспомогательные наполнители, такие как смачивающие или эмульгирующие агенты, буферные компоненты, используемые для регуляции рН, и подобное. Обычно терапевтические композиции приготавливают в виде составов для инъекций в виде либо растворов, либо суспензий; твердые формы, пригодные для растворения или суспендирования с получением жидких наполнителей перед проведением инъекций, также могут быть приготовлены. Также в определение фармацевтически приемлемого носителя включается липосома.
Способы доставки
После приготовления фармацевтических композиций по настоящему изобретению они могут быть введены напрямую пациенту. Пациентами, лечение которых проводится, могут быть животные; в частности, лечение может проводиться в отношении человека.
Прямая доставка композиций в принципе должна осуществляться с помощью инъекций - подкожных, внутрибрюшинных, внутривенных или внутримышечных, - или путем доставки во внутритканевые области. Также композиции могут быть введены через повреждение (рану). Другие пути введения включают пероральное и внутрилегочное, в виде суппозиториев и трансдермальное или чрезкожное введение (см., например, международную патентную заявку WO 98/20734), с помощью игл, "генных ружей" или гипоспрэев. Дозировки могут включать в себя введения однократными или многократными дозами.
Вакцины
Вакцины в соответствии с настоящим изобретением могут быть либо профилактическими (т.е. для предотвращения заражения), либо лечебными (т.е. лечить уже имеющее место заболевание).
Такие вакцины включают иммунизующий антиген (антигены), иммуноген (иммуногены), полипептид (полипептиды), белок (белки) или нуклеиновую кислоту, обычно в сочетании с "фармацевтически приемлемыми носителями", которыми являются любые носители, которые сами по себе не индуцируют выработку антител, опасных для индивидуума, получающего данную композицию. Подходящими носителями обычно являются крупные, медленно метаболизируемые макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, аминокислотные сополимеры, липидные агрегации (такие как масляные капли или липосомы) и инактивированные вирусные частицы. Такие носители хорошо известны специалистам в данной области техники. Кроме того, эти носители могут функционировать в качестве иммуностимуляторов ("адъювантов"). Более того, антиген или иммуноген может быть соединен с бактериальным анатоксином, таким как дифтерийный анатоксин, столбнячный анатоксин, холерный анатоксин, анатоксин Н.pylori и других патогенов.
Предпочтительными адъювантами, предназначенными для усиления эффективности конкретной композиции, являются, тем самым не ограничиваясь: (1) соли алюминия, такие как гидрооксид алюминия, фосфат алюминия, сульфат алюминия и т.п.; (2) эмульсионные водомасляные препараты (вместе с другими специфичными иммуностимуляторами, такими как мурамиловые пептиды [см. ниже], или компоненты бактериальных клеточных стенок, или без них), такие как, например, (а) препарат MF59™ (заявка WO 90/14837; глава 10 в книге "Vaccine design: the subunit and adjuvant approach", eds. Powell & Newman, Plenum Press, 1995), содержащий 5% сквалена, 0,5% Твин-80 и 0,5% Span-85 (необязательно включающие различные количества МТР-РЕ [см. ниже], хотя это и не является необходимым), приготавливаемый в виде субмикронных частиц с использованием микродиспергатора, такого как микродиспергатор модели 110Y (Microfluidics, Newton, MA); (b) препарат SAF, содержащий 10% сквалана, 0,4% Твин-80, 5% заблокированного полимера L121 и треонил-MDP (см. ниже) либо микродиспергированный в субмикронную эмульсию, либо перемешанный с получением эмульсии с более крупными частицами, и (с) адъювантная система Ribi™ (Ribi Immunochem, Hamilton, MT), содержащая 2% сквалена, 0,2% Твин-80 и один или более компонентов бактериальных клеточных стенок, представленных группой, включающей монофосфориллипид-А (MPL), димиколаттрегалозу (TDM) и препарат скелета клеточных стенок (CWS), предпочтительно MPL+CWS (Detox™); (3) сапониновые адъюванты, такие как Stimulon™ (Cambridge Bioscience, Worcester, MA) могут быть использованы, равно как и сформированные на их основе частицы, такие как ISCOM (иммуностимулирующие комплексы); (4) полный адъювант Фройнда (CFA) и неполный адъювант Фройнда (IFA); (5) цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 и др.), интерфероны (например, γ-интерферон), колониестимулирующий фактор макрофагов (M-CSF), фактор некроза опухолей TNF) и др.; и (6) другие вещества и соединения, которые действуют как иммуностимуляторы, обеспечивающие усиление эффективности данной композиции. Предпочтительными являются соли алюминия и препарат MF59™.
Как указывалось выше, мурамиловые пептиды включают, тем самым не исчерпываясь, N-ацетилмурамил-L-треонил-D-изоглутамин (треонил-MDP), N-ацетилнормурамил-L-аланил-D-изоглутамин (нор-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (МТР-РЕ) и т.п.
Иммуногенные композиции (например, иммунизующий антиген, или иммуноген, или полипептид, или белок, или нуклеиновая кислота вместе с фармацевтически приемлемым носителем и адъювантом) обычно должны содержать растворители, такие как вода, солевой раствор, глицерин, этанол и т.п. Кроме того, в такие наполнители могут включаться вспомогательные компоненты, такие как смачивающие или эмульгирующие компоненты, буферные компоненты, используемые для контроля рН, и подобное.
Обычно иммуногенные композиции приготавливают в виде препаратов для инъекций, либо в виде жидких растворов или суспензий; также могут быть приготовлены твердые формы, или суспензий в жидких наполнителях непосредственно перед проведением инъекций. Также препарат может быть эмульгирован или инкапсулирован в липосомах с целью усиления адъювантного эффекта, что обсуждалось выше при рассмотрении фармацевтически приемлемых носителей.
Иммуногенные композиции, используемые в качестве вакцины, содержат иммунологически эффективное количество антигенных или иммуногенных полипептидов, равно как и любые другие из отмечавшихся выше компонентов, если в этом есть необходимость. Под "иммунологически эффективным количеством" понимается введение такого количества субъекту либо в виде единственной дозы, либо в виде серии доз, чем достигается эффективное лечение или профилактика. Это количество варьируется в зависимости от здоровья и физического состояния конкретного субъекта, лечение которого проводится, таксономической группы, к которой субъект относится (например, нечеловекообразные обезьяны, приматы в целом и т.п.), способности индивидуальной иммунной системы синтезировать антитела, желательный уровень защиты, состав вакцины, оценки конкретной ситуации лечащим врачом и других связанных факторов. Предполагается, что анализируемое количество должно попадать в достаточно широкий диапазон, который может быть количественно определен с помощью рутинных способов.
Иммуногенные композиции стандартно вводятся по парентеральному пути, например, с помощью инъекций - подкожных, внутримышечных или трансдермальных ("через кожу") (например, международная патентная заявка WO 98/20734). Дополнительные препараты, пригодные для других путей введения, представляют препараты для перорального и внутрилегочного введения, суппозитории и трансдермальные препараты. Дозировки могут быть составлены одинарными дозами или множественными дозами. Вакцина может быть введена вместе с другими иммунорегуляторными агентами.
В качестве альтернативы вакцине, основанной на белковом компоненте, может быть применена ДНК-вакцинация (см., например, Robinson & Torres, 1997, Seminars in Immunol., 9, 271-283; Donnelly et al., 1997, Annu. Rev. Immunol., 15, 617-648; см. ниже в данном тексте).
Приспособления для доставки генов
Генотерапевтические приспособления, предназначенные для доставки конструкций, несущих кодирующую последовательность терапевтического значения по настоящему изобретению, которая предназначена для доставки млекопитающему, в организме которого должна происходить ее экспрессия, могут быть введены либо локально, либо системно. Эти конструкции могут основываться на вирусных или невирусных векторных подходах, осуществляемых в моделях in vivo или ex vivo. Экспрессия такой кодирующей последовательности может быть индуцирована с использованием эндогенных промоторов млекопитающих или гетерологичных промоторов. Экспрессия кодирующей последовательности in vivo может носить как конститутивный, так и индуцибельный (регулируемый) характер.
Настоящее изобретение включает ген-доставочные системы, способные экспрессировать представляемые нуклеотидные последовательности. Такая ген-доставочная система предпочтительно основывается на вирусном векторе и, что более предпочтительно, на ретровирусном, аденовирусном, аденородственном (AAV) вирусном, герпесвирусном и альфавирусном векторе. Вирусный вектор также может быть астровирусом, корона-вирусом, ортомиксовирусом, паповавирусом, парамиксовирусом, парвовирусом, пикорнавирусом, поксвирусом или тогавирусом: как обзоры, см. Jolly, 1994, Cancer Gene Therapy, 1, 51-64; Kimura, 1994, Hum. Gene Therapy, 5, 845-852; Connelly, 1995, Hum. Gene Therapy, 6, 185-193; Kaplitt, 1994, Nature Genet., 6, 148-153.
Ретровирусные векторы хорошо известны в данной области техники, и заявители считают, что любой ретровирусный генотерапевтический вектор применим в связи с настоящим изобретением, включая ретровирусы типов В, С и D, ксенотропные ретровирусы (например, штаммы NZB-X1, NZB-X2 и NZB9-1 [см. (О'Neill, 1985, J. Virol., 53, 160]), политропные ретровирусы, например, MCF и MCF-MLV (см. Kelly, 1983, J. Virol., 45, 291), спумавирусы и лентивирусы; см. "RNA Tumor Viruses", 2d ed., Cold Spring Harbor Lab., 1985.
Фрагменты ретровирусного генотерапевтического вектора могут происходить от различных ретровирусов. Например, входящие в состав ретровирусного вектора длинные концевые повторы (LTR) могут происходить от вируса саркомы мышей, сайт связывания тРНК - от вируса саркомы Рауса, "упаковочный сигнал" - от вируса лейкоза мышей, а сайт начала репликации второй цепи - от вируса лейкоза птиц.
Эти рекомбинантные ретровирусные векторы могут быть использованы для создания компетентных по трансдукции ретровирусных векторных частиц, что достигается путем внесения их в подходящую "упаковочную клеточную линию" (см. патент США №5591624). Ретровирусные векторы могут быть сконструированы с целью обеспечения сайт-специфичной интеграции в пределах ДНК клетки-хозяина, что достигается включением химерного интегразного фермента в состав вирусной частицы (см. международную патентную заявку WO 96/37626). Предпочтительно, чтобы такой рекомбинантный вирусный вектор являлся рекомбинантным вирусом, дефектным по репликации.
"Упаковочные клеточные линии", пригодные для использования для описанных выше ретровирусных векторов, хорошо известны в данной области техники, они могут быть легко созданы (см. международные патентные заявки WO 95/30763 и WO 92/05266) и могут быть использованы для создания продукционных клеточных линий (также называемых "векторными клеточными линиями", или "VCL"), необходимых для выработки рекомбинантных векторных частиц. Предпочтительно упаковочные клеточные линии формируют из родительских человеческих клеток (например, клеток линии НТ1080) или родительских клеточных линий норки, в которых исключена инактивация сыворотки человека.
Предпочтительными ретровирусами, пригодными для конструирования ретровирусных генотерапевтических векторов, являются вирус лейкоза птиц, вирус лейкоза крупного рогатого скота, вирус лейкоза мышей, вирус индукции фокусов в клетках норки, вирус саркомы мыши, вирус ретикулоэндотелиоза и вирус саркомы Рауса. Конкретно предпочтительными вирусами лейкоза мышей являются штаммы 4070А и 1504А (Hartley & Rowe, 1976, J. Virol., 19, 19-25), вирус саркомы Абельсона (АТСС №VR-999), вирус саркомы Фройнда (АТСС №VR-245), вирусы сарком Грэффи и Гросса (АТСС №VR-590), вирусы сарком Кирстена, Харви и Раушера (АТСС №VR-998) и вирус лейкоза мышей Молони (АТСС №VR-190). Эти ретровирусы могут быть получены из депозитарных коллекций, таких как Американская коллекция типовых культур ("АТСС"), находящаяся в Роквилле (штат Мэриленд), или выделены из известных источников с применением стандартных методик.
Примерами известных ретровирусных генотерапевтических векторов, применимыми в объеме настоящего изобретения, являются те векторы, которые описаны в патентных заявках - британской GB 2200651, европейских ЕР 0415731, ЕР 0345242, ЕР 0334301, международных WO 89/02468, WO 89/05349, WO 89/09271, WO 90/02806, WO 90/07936, WO 94/03622, WO 93/25698, WO 93/25234, WO 93/11230, WO 93/10218, WO 91/02805, WO 91/02825, WO 95/07994, патентах США №№5219740, 4405712, 4861719, 4980289, 4777127, 5591624; см. также Vile, 1993, Cancer Res., 53, 3860-3864; Vile, 1993, Cancer Res., 53, 962-967; Ram, 1993, Cancer Res., 53, 83-88; Takamiya, 1992, J.Neurosci. Res., 33, 493-503; Baba, 1993, J.Neurosurgery, 79, 729-735; Mann, 1983, Cell, 33, 153; Cane, 1984, Proc. Natl. Acad. Sci. USA, 81, 6349; Milter, 1990, Hum. Gene Therapy, 1.
Вирусы для генотерапии, основанные на аденовирусах человека, также хорошо известны в науке и применимы в связи с настоящим изобретением: см., например, Berkner, 1988, Biotechniques, 6, 616 и Rosenfeld, 1991, Science, 252, 431, а также международные патентные заявки WO 93/07283, WO 93/06223 и WO 93/07282. Примерами известных аденовирусных генотерапевтических векторов, применимых для целей осуществления настоящего изобретения, являются те векторы, которые описаны в цитировавшихся выше источниках и в международных патентных заявках WO 94/12649, WO 93/03769, WO 93/19191, WO 94/28938, WO 95/11984, WO 95/00655, WO 95/27071, WO 95/29993, WO 95/34671, WO 96/05320, WO 94/08026, WO 94/11506, WO 93/06223, WO 94/24299, WO 95/14102, WO 95/24297, WO 95/02697, WO 94/28152, WO 94/24299, WO 95/09241, WO 95/25807, WO 95/05835, WO 94/18922 и WO 95/09654. С другой стороны, может быть применено внесение ДНК, соединенной с убитым аденовирусом, описанное у Curiel, 1992, Hum. Gene Therapy, 3, 147-154. Ген-доставочные системы по настоящему изобретению также могут основываться на адено-ассоциированных вирусах (AAV). Предпочтительными примерами таких векторов в связи с их использованием по настоящему изобретению являются векторы, основанные на штамме AAV-2, заявленные Сриваставой (Srivastava) в международной патентной заявке WO 93/09239. Наиболее предпочтительные AAV-векторы включают два инвертированных концевых повтора из генома AAV, в которых нативные D-последовательности модифицированы путем нуклеотидных замен таким образом, чтобы по крайней мере пять нативных нуклеотидов и вплоть до 18 нативных нуклеотидов, а предпочтительно по крайней мере 10 нативных нуклеотидов и вплоть до 18 нативных нуклеотидов, а наиболее предпочтительно 10 нативных нуклеотидов сохраняются, а остальные нуклеотиды из состава D-последовательности делегируют или заменяют на ненативные нуклеотиды.
Нативные D-последовательности из состава инвертированных концевых повторов AAV являются 20-нуклеотидными мотивами, имеющимися в каждом терминальном концевом повторе AAV (т.е. имеется один такой мотив в каждом концевом участке), которые не участвуют в образовании HP. Ненативный заменяющий нуклеотид может быть любым нуклеотидом, помимо нуклеотида, имеющегося в составе нативной D-последовательности в том же положении. Другими применимыми примерами векторов на основе вирусов AAV являются штаммы pWP-19 и pWN-1: оба они описаны у Nahreini, 1993, Gene, 124, 257-262. Другим примером такого AAV-вектора является вектор psub201 (см. Samulski, 1987, J. Virol., 61, 3096). Другим примером AAV-вектора является вектор Double-D-ITR. Конструирование вектора Double-D-ITR описано в патенте США №5478745. Другими векторами являются векторы, заявленные Carter в патенте США №4797368 и Muzyczka в патенте США №5139941, а также Chartejee в патенте США №5474935 и Kotin в международной заявке WO 94/288157. Еще одним примером AAV-вектора, применимого в связи с настоящим изобретением, является конструкция SSV9AFABTKneo: она включает энхансер AFP и промотор гена альбумина и обеспечивает экспрессию преимущественно в печени. Ее структура и конструирование описаны у Su, 1996, Hum. Gene Therapy, 7, 463-470. Еще ряд AAV-векторов для генотерапии описан в патентах США №№5354678, 5173414, 5139941 и 5252479.
Векторы для генотерапии в соответствии с настоящим изобретением также включают векторы на основе герпесвируса. Наиболее приемлемыми и предпочтительными примерами являются векторы на основе простого герпесвируса, включающие последовательность, которая кодирует полипептид тимидинкиназу, такие как те векторы, которые описаны в патенте США №5288641 и европейской заявке ЕР 0176170 (Roizman). Дополнительными примерами векторов на основе простого герпесвируса являются HFEM/ICP6-LacZ, раскрытые в WO 95/04139 (Wistar Institute), pHSVlac, описанный у Geller, 1988, Science, 241, 1667-1669 и в международных патентных завяках WO 90/09441 и WO 92/07945; вектор HSV Us3::pgC-lacZ, описанный у Fink, 1992, Hum. Gene Therapy, 3, 11-19, и вектор HSV 7134, 2-RH-105 и GAL4, описанные в европейской заявке ЕР 0453242 (Breakefield), а также те, которые внесены в коллекцию АТСС под депозитарными №№АТСС VR-977 и АТСС VR-260.
Также представляются генотерапевтические векторы на основе альфавирусов, которые могут быть использованы в связи с настоящим изобретением. Предпочтительными являются векторы на основе альфавируса Sindbis. Тогавирусы, вирус Semliki Forest (АТСС VR-67; АТСС VR-1247), вирус Миддлберга (АТСС VR-370), вирус реки росс (АТСС VR-373; АТСС VR-1246), вирус венесуэльского энцефалита лошадей (АТСС VR-923; АТСС VR-1250; АТСС VR-1249; АТСС VR-532) и те тогавирусы, которые описаны в патентах США №№5091309 и 5217879 и в международной патентной заявке WO 92/10578. Более конкретно, применимы альфавирусные векторы, которые описаны в заявке на патент США №08/405627 от 15 марта 1995 г., в международных патентных заявках WO 94/21792, WO 92/10578 и WO 95/07994 и в патентах США №№5217879 и 5091309. Такие альфавирусы могут быть доступны из депозитариев и коллекций, таких как коллекция АТСС, находящаяся в Роквилле (штат Мэриленд), или выделены из известных источников с применением стандартных методов. Предпочтительно должны использоваться альфавирусные векторы, характеризующиеся пониженной цитотоксичностью (см. USSN №08/679640).
ДНК-векторные системы, такие как эукариотические экспрессионные системы, также могут быть использованы для экспрессии нуклеиновых кислот по настоящему изобретению: см. международную патентную заявку WO 95/07994, в которой имеется подробное описание эукариотических экспрессионных систем. Предпочтительно эукариотические экспрессионные системы по настоящему изобретению основываются на альфавирусных векторах, а наиболее предпочтительно - на векторе, в основе которого находится геном вируса Sindbis.
Другие вирусные векторы, пригодные для использования с точки зрения практики настоящего изобретения, включают те векторы, которые являются производными от полиовирусов, например, АТСС VR-58 и тех, которые описаны у Evans, 1989, Nature, 385 и Sabin, 1973, J. Biol. Standart., 1, 115; от риновирусов, например, АТСС VR-1110 и тех, которые описаны у Arnold, 1990, J. Cell. Biochem., L401; от поксвирусов, таких как канареечный поксивирус и вирус коровьей оспы, например, ATCC VR-111 и АТСС VR-2010 и те, которые описаны у Fisher-Hoch, 1989, Proc. Natl. Acad. Sci. USA, 86, 317; Flexner, 1989, Ann. N.Y.Acad. Sci., 569, 86; Flexner, 1990, Vaccine, 8, 17; в патентах США №№4603112 и 4769330 и международной патентной заявке WO 89/01973; от вируса обезьян SV40, например, АТСС VR-305 и те, которые описаны у Mulligan, 1979, Nature, 277, 108 и Madzak, 1992, J. Gen. Virol., 73, 1533; от вируса гриппа, например, АТСС VR-797 и рекомбинантных вирусов гриппа, которые использовались в методиках обратной генетики в соответствии с описанием патента США №5166057 и у Enami, 1990, Proc. Natl. Acad. Sci. USA, 87, 3802-3805; Enami & Palese, 1991, J. Virol., 65, 2711-2713 и Luytjes, 1989, Cell, 59, 110 (см. также McMichael, 1983, New England J. Med., 309, 13 и Yap, 1978, Nature, 273, 238 и Nature, 1979, 277, 108); от вируса иммунодефицита человека в соответствии с описанным в ЕР 0386882 и у Buchschacher, 1992, J. Virol., 66, 2731; от вируса кори, например, АТСС VR-67 и АТСС VR-1247 и тех, которые описаны в ЕР 0440219; от ауравирусов, например, АТСС VR-368; от вируса Bebaru, например, АТСС VR-600 и АТСС VR-1240; от вируса Cabassou, например, АТСС VR-922; от вируса Chikungunya, например, АТСС VR-64 и АТСС VR-1241; от вируса Форт-Морган, например, АТСС VR-924; от вируса Getah, например АТСС VR-369 и АТСС VR-1243; от кызылгачского вируса, например, АТСС VR-927; от вируса Мауаrо, например, АТСС VR-66; от вируса Mucambo, например, АТСС VR-580 и АТСС VR-1244; от вируса Ndumu, например АТСС VR-371; от вируса Pixuna, например, АТСС VR-372 и АТСС VR-1245; от вируса Tonate, например, АТСС VR-925; от вируса Triniti, например, АТСС VR-469; от вируса Una, например, АТСС VR-374; от вируса Whataroa, например, АТСС VR-926; от вируса Y-62-33, например, АТСС VR-375; от вируса O'Nyong (вируса восточного энцефалита), например, АТСС VR-65 и АТСС VR-1242; от вируса западного энцефалита, например, АТСС VR-70, АТСС VR-1251, АТСС VR-622 и АТСС VR-1252; и от коронавирусов, например АТСС VR-740 и тех, которые описаны у Hamre, 1966, Proc. Soc. Exp. Biol. Med., 121, 190.
Доставка композиций по настоящему изобретению в клетки не ограничивается использованием описанных выше вирусных векторов. Могут быть также применены и другие доставочные методы и среды, такие как, например, нуклеотидные экспрессирующие векторы с поликатионно-упакованной ДНК, соединенные или не соединенные с убитым аденовирусом: см., например, заявку на патент США №08/366787, поданную 30 декабря 1994 года и Curiel, 1992, Hum. Gene Therapy, 3, 147-154; ДНК, соединенная с лигандом: см., например, Wu, 1989, J. Biol. Chem., 264, 16985-16987; доставочные системы-клетки для эукариотических клеток: см., например, патентную заявку США №08/240030, поданную 9 мая 1994 года, и патентную заявку США №08/404796; депонирования светополимеризующегося гидрогелевого материала; применение "ручного генного ружья" в соответствии с описанным в патенте США №5149655; использование ионизирующих излучений в соответствии с описанным в патенте США №5206152 и международной патентной заявке WO 92/11033; применение "нейтрализации заряда нуклеотида" или слияния с клеточной мембраной. Кроме того, подобные подходы описаны у Philip, 1994, Mol. Cell. Biol., 14, 2411-2418 и у Woffendin, 1994, Proc. Natt. Acad. Sci. USA, 91, 1581-1585.
Может быть применен метод доставки генов частицами: см., например, заявку на патент США №60/023867. Вкратце, последовательность может быть встроена в состав стандартных векторов, в составе которых имеются обычные регуляторные последовательности, обеспечивающие высокоинтенсивную экспрессию; затем проводят инкубацию с синтетической ген-доставочной молекулой, такой как полимерные ДНК-связывающие катионы, например, полилизин, протамин и альбумин, связанные с лигандами, маркирующими клетки, такие как асиалооросомукоид, в соответствии с описанным у Wu & Wu, 1987, J. Biol. Chem., 262, 4429-4432, или инсулин в соответствии с описанным у Hucked, 1990, Biochem. Pharmacol., 40, 253-263, или галактоза в соответствии с описанным у Plank, 1992, Bioconjugate Chem., 3, 533-539, или лактоза, или трансферрин.
Также может быть использована открытая ("голая") ДНК. Примерами методов внесения открытой ДНК являются те приемы, которые описаны в международной патентной заявке WO 90/11092 и в патенте США №5580859. Эффективность поглощения может быть повышена с использованием шариков из латекса, которые разрушаются в биологической среде. ДНК, загруженная в шарики из латекса, эффективно доставляются в клетки в результате эндоцитоза, который инициируется этими шариками. Данный способ может быть улучшен путем обработки шариков с целью повышения гидрофобности, что тем самым облегчает разрушение эндосомы и выход данной ДНК в цитоплазму.
Липосомы, которые могут быть использованы в качестве ген-доставочных систем, описаны в патенте США №5422120, в международных патентных заявках WO 95/13796, WO 94/23697 и WO 91/14445 и ЕР 524968. В соответствии с описанным в американской патентной заявке №60/023867 невирусным способом доставки, нуклеотидные последовательности, кодирующие полипептид, могут быть встроены в стандартные векторы, которые включают обычные регуляторные последовательности, обеспечивающие интенсивную экспрессию, с последующей инкубацией с синтетической ген-доставочной молекулой, такой как полимерные ДНК-связывающие катионы, например, полилизин, протамин и альбумин, связанные с лигандами, маркирующими клетки, такие как асиалооросомукоид, инсулин, галактоза, лактоза или трансферрин. В других доставочных системах липосомы используются с целью инкапсуляции ДНК, несущей конкретный ген под контролем тканеспецифичных или убихитозно активных (т.е. не зависящих от типа ткани) промоторов. Другими невирусными доствочными системами являются механические доставочные системы, такие как те, которые используются в способе, описанном у Woffendin et al., 1994, Proc. Natl. Acad. Sci. USA, 91, 11581-11585. Более того, кодирующая последовательность и продукт ее экспрессии могут быть доставлены путем депонирования светополимеризующихся гидрогелевых материалов. Могут быть использованы другие стандартные способы доставки генов, включающих кодирующие последовательности, например, которые основываются на применении "ручного генного ружья" в соответствии с описанным в патенте США №5149655, на применении ионизирующих излучений, обеспечивающих активацию переносимых генов, в соответствии с описанным в патенте США №5206152 и международной патентной заявке WO 92/11033.
Примерами липосомных и поликатионных ген-доставочных систем являются те системы, которые описаны в патентах США №№5422120 и 4762915, в международных патентных заявках WO 95/13796, WO 94/23697 и WO 91/14445, в ЕР 0524968 и у Stryer, 1975, "Biochemistry", ed. W.H.Freeman, San Francisco, pp. 236-240; Szoka, 1980, Biochem. Biophys. Acta, 600, 1; Bayer, 1979, Biochem. Biophys. Acta, 550, 464; Rivnay, 1987, Meth. Enzymol., 149, 116; Wang, 1987, Proc. Natl. Acad. Sci. USA, 84, 7851; Plant, 1989, Anal. Biochem., 176, 420.
Полинуклеотидная композиция может включать терапевтически эффективное количество генотерапевтической системы в соответствии с термином, определенным выше. Для целей настоящего изобретения эффективная доза должна находиться в пределах от примерно 0,01 мг/кг до 50 мг/кг или от 0,05 мг/кг до примерно 10 мг/кг ДНК-конструкций в приложении к индивидууму, которому они вводятся.
Способы доставки
После включения в фармацевтическую композицию такие полинуклеотидные композиции по настоящему изобретению могут быть (1) напрямую введены пациенту; (2) доставлены ex vivo в клетки, производные от этого пациента; или (3) использованы для экспрессии рекомбинантных белков in vitro. Субъектами, которым будут вводиться такие композиции, могут быть млекопитающие или птицы. Также лечение может быть проведено в отношении людей.
Прямое введение композиций в принципе должно осуществляться путем инъекций - подкожных, внутрибрюшинных, внутривенных или внутримышечных, - или же они должны вводиться во внутритканевые пространства. Также эти композиции могут быть введены в повреждения (раны). Другими путями введения являются пероральное и внутрилегочное введение, использование суппозиториев, а также трансдермальное введение и введение "через кожу" (см., например, международную патентную заявку WO 98/20734), или введение с использованием игл, "генных ружей" или гипоспрэев. Дозировки могут быть составлены однократными или многократными дозами.
Способы введения ех vivo с последующей реимплантацией трансформированных клеток субъекту хорошо известны в данной области техники и описаны, например, в международной патентной заявке WO 93/14778. Примерами клеток, применимых для введения в варианте ex vivo, являются, например, стволовые клетки, в частности, кроветворные клетки, лимфатические клетки, макрофаги, дендритные клетки или опухолевые клетки.
В целом, доставка нуклеиновых кислот в вариантах применения ех vivo и in vitro может быть осуществлена с помощью, например, таких процедур: трансфекция, опосредуемая декстраном, преципитация с фосфатом кальция, трансфекция с полибреном, слияние протопластов, электропорация, инкапсуляция полинуклеотида (полинуклеотидов) в липосомы и прямое микроинъецирование ДНК в ядра - все эти способы хорошо известны в науке.
Фармацевтические композиции, содержащие полинуклеотиды и полипептиды
В дополнение к фармацевтически приемлемым носителям и солям, которые были описаны выше, могут быть использованы следующие вспомогательные компоненты, включаемые в композиции, содержащие полинуклеотид и (или) полипептид.
А. Полипептиды
Одним из примеров являются полипептиды, которые, тем самым не ограничиваясь, включают: асиалооросомукоид (ASOR); трансферрин; асиалогликопротеины; антитела; фрагменты антител; ферритин; интерлейкины; интерфероны; колониестимулирующий фактор гранулоцитов и макрофагов (GM-CSF), колониестимулирующий фактор гранулоцитов (G-CSF), колоние-стимулирующий фактор макрофагов (M-CSF), фактор стволовых клеток и эритропоэтин. Также могут быть использованы вирусные антигены, такие как оболочечные белки. Также могут быть использованы белки других патогенных организмов, такие как 17-аминокислотный пептид малярийного плазмодия стадии круглого спорозоита, известный в качестве RII.
В. Гормоны, витамины и т.п.
Другие группы соединений, которые могут быть включены в состав, включают, например, гормоны, стероиды, андрогены, эстрогены, тироидный гормон или витамины, например, фолиевую кислоту.
С. Полиалкилены, полисахариды и т.п.
Также полиалкиленгликоль может быть включен вместе с желаемыми полинуклеотидами или полипептидами. В предпочтительном варианте полиалкиленгликолем является полиэтиленгликоль. Кроме того, в состав могут быть включены моно-, ди- или полисахариды. В предпочтительном варианте этого аспекта полисахаридом является декстран или DEAE-декстран. Также могут быть использованы хитозан и поли(лактид-когликолид).
D. Липиды и липосомы
Желательные полинуклеотиды или полипептиды могут быть инкапсулированы в липиды или запакованы в липосомы перед доставкой их субъекту или производные от него клетки.
Липидную инкапсуляцию обычно осуществляют с использованием липосом, которые способны стабильно связывать или включать внутрь себя нуклеиновую кислоту. Соотношение упакованного полинуклеотида и липидного материала может варьироваться, но в принципе близко к 1:1 (мг ДНК к мкмоль липида), или же количество липида несколько выше. По использованию липосом для целей доставки нуклеиновых кислот в качестве обзора см. Hug & Sleight, 1991, Biochim. Biophys. Acta, 1097, 1-17; Straubinger, 1983, Meth. Enzymol., 101, 512-527.
Липосомные препараты для применения по настоящему изобретению включают катионные (т.е. положительно заряженные), анионные (т.е. отрицательно заряженные) и нейтральные препараты. Катионные липосомы, как было показано, обеспечивают внутриклеточную доставку плазмидной ДНК (Felgner, 1987, Proc. Nati. Acad. Sci. USA, 84, 7413-7416), мРНК (Malone, 1989, Proc. Natl. Acad. Sci. USA, 86, 6077-6081) и очищенные транскрипционные факторы (Debs, 1990, J. Biol. Chem., 265, 10189-10192), сохраняющие свою функиональность.
Катионные липосомы являются легкодоступными. Например, N-[1,2,3-диолеилокси)пропил]-N,N,N-триэтиламмонийные (DOTMA) липосомы доступны под торговой маркой "Липофектин" от фирмы Gibco BRL (Grand Island, NY) (см. также Felgner, цит. выше). Другими доступными на коммерческой основе липосомами являются трансфектаты (DDAB/DOPE) и DOTAP/DOPE (Boehringer). Другие катионные липосомы могут быть приготовлены из легкодоступных материалов с использованием методик, хорошо известных в данной области техники: см., например, Szoka, 1978, Proc. Natl. Acad. Sci. USA, 75, 4194-4198; а синтез ДОТАР (1,2-бис(олеоилокси)-3-(триметиламмоний)пропановых) липосом описан в международной патентной заявке WO 90/11092.
Сходным образом легкодоступными являются анионные и нейтральные липосомы, такие как получаемые от фирмы Avanti Polar Lipids (Birmingham, AL), или могут быть легко получены с использованием легкодоступных материалов. Такие материалы включают, помимо прочего, фосфатидилхолин, холестерин, фосфатидилэтаноламин, диолеилфосфатидилхолин (DOPC), диолеил-фосфатидилглицерин (DOPG), диолеилфосфатидилэтаноламин (DOPE). Эти материалы также могут быть смешаны с исходными материалами DOTMA и DOTAP в подходящих отношениях. Способы приготовления липосом с использованием этих материалов хорошо известны в науке.
Липосомы могут включать многослойные пузырьки (MLV), маленькие однослойные пузырьки (SUV) или крупные однослойные пузырьки (LUV). Различные комплексы липосом и нуклеиновых кислот формируют с применением методов, хорошо известных в данной области техники: см., например, Straubinger, 1983, Meth. Immunol., 101, 512-527; Szoka, 1978, Proc. Natl. Acad. Sci. USA, 75, 4194-4198; Papahadjopoulos, 1975, Biochim. Biophys. Acta, 394, 483; Wilson, 1979, Cell, 17, 77; Deamer & Bangham, 1976, Biochim. Biophys. Acta, 443, 629; Ostro, 1977, Biochem. Biophys. Res. Commun., 76, 836; Fraley, 1979, Proc. Natl. Acad. Sci. USA, 76, 3348; Enoch & Strittmatter, 1979, Proc. Natl. Acad. Sci. USA, 76, 145; Fraley, 1980, J. Biol. Chem., 255, 10431; Szoka & Papahadjopoulos, 1978, Proc. Natl. Acad. Sci. USA, 75, 145; Schaefer-Ridder, 1982, Science, 215, 166.
Е. Липопротеины
Кроме того, липопротеины могут быть сочетаны с полинуклеотидом или полипептидом, предназначенным к доставке. Примерами липопротеинов, которые могут быть использованы, являются: хиломикроны, HDL, IDL, LDL и VLDL. Также могут быть использованы мутанты, фрагменты и химеры этих белков. Также могут быть использованы модификации встречающихся в природе липопротеинов, такие как ацетилированные LDL. Эти липопротеины могут обеспечивать доставку полинуклеотидов к конкретным клеткам, экспрессирующим рецепторы липопротеинов. Предпочтительно, чтобы в случае включения в композицию липопротеинов наряду с предназначенным для доставки полинуклеотидом, другие лиганды, обеспечивающие направленную доставку к мишеням, не включались в состав такой композиции.
Встречающиеся в природе липопротеины состоят из липидной и белковой составляющих. Белковый компонент известен под названием "апопротеина". В настоящее время были выделены и идентифицированы апопротеины А, В, С, D и Е. По крайней мере в двух из этих классов имеются по несколько белков, которые обозначаются римскими цифрами: AI, AII, AIV; CI, СII, CIII.
В составе липопротеина может присутствовать более одного апопротеина. Например, встречающиеся в естественных условиях хиломикроны включают апопротеины А, В, С и Е, причем с течением времени они утрачивают апопротеин-А и приобретают апопротеины С и Е. В состав VLDL входят апопротеины А, В, С и Е, в состав LDL - апопротеин-В, а в состав HDL входят апопротеины А, С и Е.
Аминокислотный состав этих апопротеинов известен и описан, например, у Breslow, 1985, Annu. Rev. Biochem., 54, 699; Law, 1986, Adv. Exp. Med. Biol., 151, 162; Chen, 1986, J. Biol. Chem., 261, 12918; Kane, 1980, Proc. Natl. Acad. Sci. USA, 77, 2465; Utermann, 1984, Hum. Genet., 65, 232.
В состав липопротеинов входят различные липиды, включая триглицериды, холестерин (свободный или в виде эфиров) и фосфолипиды. Состав липидов варьируется во встречающихся в естественных условиях липопротеинах. Например, хиломикроны в основном включают триглицериды. Более подробное описание липидного состава встречающихся в естественных условиях липопротеинов можно найти, например, в 128-м томе журнала "Methods in Enzymology" (1986). Состав липидов подбирается таким образом, чтобы соответствовать конформации апопротеину, обеспечивая тем самым активность по связыванию на соответствующем рецепторе. Состав липидов также может быть подобран так, чтобы облегчить гидрофобное взаимодействие и связывание с молекулой, связывающей полинуклеотид.
Встречающиеся в естественных условиях липопротеины могут, например, быть выделены из сыворотки крови путем ультрацентрифугирования. Некоторые способы описаны в "Меthods in Enzymology (цит. выше) и у Pitas, 1980, J. Biochem., 255, 5454-5460 и Mahey, 1979, J. Clin. Invest., 64, 743-750. Липопротеины также могут быть получены in vitro или с помощью рекомбинантных технологий путем экспрессии генов апопротеинов в желательной клетке-хозяине: см., например, Atkinson, 1986, Annu. Rev. Biophys. Chem., 15, 403 и Radding, 1958, Biochim. Biophys. Acta, 30, 443. Также липопротеины могут быть приобретены у коммерческих дистрибьюторов, таких как Biomedical Technologies Inc. (Stoughton, MA, США). Дополнительное описание липопротеинов может быть найдено у Zuckermann et al. в заявке PCT/US 97/14465.
F. Поликатионные компоненты
В состав композиции, включающей желательный полинуклеотид или полипептид, доставка которого предполагается, могут быть включены поликатионные агенты с липопротеином или без него.
Обычно поликатионные компоненты характеризуются общим положительным зарядом при физиологических значениях рН и способны нейтрализовывать электрический заряд нуклеиновых кислот, что должно облегчить доставку к желательному месту. Эти компоненты могут применяться как in vitro и ex vivo, так и in vivo. Поликатионные компоненты могут быть использованы для доставки нуклеиновых кислот прижизненно пациентам путем внутримышечного, подкожного введения и т.п.
Следующие полипептиды являются примерами применимых поликатионных компонентов: полилизин, полиаргинин, полиорнитин и протамин. Другими примерами являются гистоны, протамины, сывороточный человеческий альбумин, ДНК-связывающие белки, негистоновые хромосомные белки, капсидные белки ДНК-вирусов, таких как вирус Х174; транскрипционные факторы также включают участки связывания ДНК и поэтому они также могут быть использованы в качестве агентов, конденсирующих нуклеиновую кислоту. Вкратце, базовый домен, на котором связывается ДНК, входит в состав таких транскрипционных факторов, как С/СЕВР, c-jun, c-fos, АР-1, АР-2, АР-3, CPF, Prot-1, Sp-1, Oct-1, Oct-2, CREP и TFIID.
Органическими поликатионными компонентами являются спермин, спермидин и путресцин.
Размеры и физические свойства поликатионного компонента могут быть экстраполированы, исходя из приведенного выше перечня с целью конструирования других поликатионных компонентов полипептидной природы или с целью создания синтетических поликатионных компонентов.
Синтетические поликатионные компоненты, которые являются применимыми, включают, например, DEAE-декстран и полибрен. Липофектин™ и липофектамин™ являются мономерами, которые образуют поликатионные комплексы в случае их комбинирования с полинуклеотидами/полипептидами.
Иммунологические диагностические тесты
Антигены нейссерий по настоящему изобретению могут быть использованы в иммунологических тестах, нацеленных на определение уровней антител (или, с другой стороны, антитела к антигенам нейссерий могут быть использованы для определения уровней антигенов). Иммунологические тесты, базирующиеся на точно определенных рекомбинантных антигенах, могут быть разработаны с целью замены инвазивных диагностических тестов. Антитела к белкам нейссерий могут быть выявлены в составе биологических образцов, таких как, например, кровь или сыворотка крови. Разработка подобных иммунологических тестов является объектом многочисленных модификаций, и широкий их круг известен в данной области техники. Прописи этих иммунологических тестов могут быть основаны, например, на тестах с конкурентным связыванием или прямой реакции, или принципе "сэндвича". В этих протоколах также, например, могут быть использованы твердые подложки или иммунопреципитация. Во многих тестах используются меченые антитело или полипептид; метки могут быть, например, флуоресцентными, хемилюминесцентными, радиоактивными молекулами или молекулами красителя. Также известны тесты, в которых применяется амплификация сигналов на основе соответствующего зонда: примерами в этом случае являются тесты, в которых используются биотин и авидин, а также ферментно-меченные и опосредованные иммунологические тесты, такие как ТИФА (твердофазный иммуноферментный анализ).
Наборы реактивов, применимые для иммунодиагностики, включающие подходящие помеченные реагенты, формируют путем упаковки подходящих материалов, включая композиции по настоящему изобретению, в пригодные контейнеры, наряду с другими материалами и реагентами (например, подходящими буферами, растворами солей и т.п.), необходимыми для проведения конкурентного теста, равно как и необходимый набор информативных инструкций.
Гибридизация нуклеиновых кислот
Термин "гибридизация" обозначает связывание двух нуклеотидных последовательностей друг с другом с помощью водородных связей. Обычно одну из этих последовательностей фиксируют на твердой подложке, а другая находится в растворе в свободном состоянии. Затем обеспечивают контакт между этими двумя последовательностями в таких условиях, которые благоприятствуют образованию водородных связей. Факторами, которые влияют на образование таких связей, являются: тип и количество растворителя; температура реакции; продолжительность гибридизации; перемешивание; присутствие компонентов, которые бы предотвращали неспецифическое связывание находящейся в жидкой фазе последовательности с твердой подложкой (раствор Денхардта или реактив BLOTTO); концентрация последовательностей; применение соединений, которые способны увеличивать скорость связывания последовательностей (декстрансульфат или полиэтиленгликоль); и жесткость условий промывки после гибридизации (см. Sambrook et al., цит. выше, том 2, глава 9, стр.9.47-9.57).
Под "жесткостью" понимаются условия проведения гибридизации, которые благоприятствуют связыванию очень сходных последовательностей в отличие от различающихся последовательностей.
Например, сочетание температуры и концентрации солей должно выбираться таким образом, чтобы оно было на 120-200°С ниже рассчетной температуры диссоциации (Тm) анализируемого гибрида. Параметры температуры и концентрации солей могут быть, как правило, определены эмпирическим путем в предварительных экспериментах, в которых образцы геномной ДНК, иммобилизованной на фильтрах, гибридизуют с анализируемой последовательностью и затем промывают в условиях различной степени жесткости (см. Sambrook et al., стр.9.50).
Переменные, которые необходимо учитывать при осуществлении, например, Саузерн-блоттинга, это: (1) сложность структуры ДНК, которая будет подвергнута блоттингу, и (2) уровень гомологии зонда и выявляемых последовательностей. Общее количество исследуемого фрагмента (фрагментов) может варьироваться на порядок - от 0,1 до 1 мкг для плазмиды или фага или от 10-9 до 10-8 г для однокопийного гена из состава сложноорганизованного эукариотического генома. Для менее сложных полинуклеотидов могут быть использованы существенно менее продолжительные периоды времени блоттинга, гибридизации и экспозиции, меньшие количества исходных полинуклеотидов и меньшие специфические активности зондов. Например, однокопийный дрожжевой ген может быть выявлен при времени экспозиции всего 1 час при количестве исходной дрожжевой ДНК 1 мкг, блоттинге в течение 2 часов и гибридизации в течение 4-8 часов с зондом, имеющим активность 100 млн. имп./мин на 1 мкг. Для однокопийного гена млекопитающего консервативный подход будет начинаться с 10 мкг ДНК, блоттинга в течение ночи и гибридизации в течение ночи в присутствии 10% декстрансульфата с использованием зонда со специфической активностью свыше 100 млн. имп./мин на 1 мкг, в результате чего время экспозиции составит примерно 24 часа.
Некоторые факторы могут влиять на температуру плавления (Тm) гибрида ДНК/ДНК, образующегося между зондом и анализируемым фрагментом, а следовательно, и на подходящие условия проведения гибридизации и промывки. Во многих случаях зонд не является на 100% гомологичным данному фрагменту. Другие обычно учитываемые переменные - это длина и общее содержание пары GC в гибридизующих последовательностях, а также ионная сила и содержание формамида в гибридизационном буфере. Влияние всех этих факторов может быть учтено с помощью единственного уравнения:
Тm=81+16,6·(log10Ci)+0,4·(% пары GC)-0,6·(% формамида)-600/n-1,5·(% ошибок),
где Ci - концентрация солей (одновалентных ионов), а n - длина данного гибрида, выраженная в числе пар нуклеотидов (формула незначительно модифицирована по сравнению с опубликованным у Meinkoth & Wahl, 1984, Anal. Biochem., 138, 267-284).
При конструировании схемы гибридизационного эксперимента стандартным образом могут быть изменены некоторые факторы, влияющие на гибридизацию нуклеиновых кислот. Наиболее просты с точки зрения доведения до оптимума температура гибридизации и промывки и концентрация солей, используемая при промывке. При увеличении температуры, при которой проводится реакция гибридизация (т.е. жесткость реакции), становится менее вероятным то, что гибридизация произойдет между нуклеотидными цепями, которые негомолгичны, приводя к снижению фонового "шума". Если радиоактивно помеченный зонд не является полностью гомологичным иммобилизованному фрагменту (ситуация, обычная в анализе генных семейств и проведении экспериментов по межвидовой гибридизации), то температура гибридизации должна быть снижена - тогда фоновый "шум" возрастет. Температура промывки сходным образом влияет на интенсивность гибридизационного бэнда и уровень фона. Жесткость условий промывки также возрастает при снижении концентраций солей.
В целом, стандартными температурами гибридизации в присутствии 50% формамида являются 42°С для зонда, гомологичного фрагменту-мишени на 95-100%, 37°С при гомологии на уровне 90-95% и 32°С при уровне гомологии 85-90%. Для более низких уровней гомологии содержание формамида должно быть снижено с последующим соответствующим доведением температуры на основе вышеприведенного уравнения. Если уровень гомологии между зондом и фрагментом-мишенью неизвестен, то наиболее простым подходом является проведение эксперимента изначально с нежесткими условиями гибридизации и промывки.
Если после авторадиографического анализа оказываются интенсивными бэнды неспецифического связывания и уровень фонового "шума", то фильтр может быть промыт при высоком уровне жесткости и протестирован повторно. Если время, необходимое для экспозиции, делает данный подход непрактичным, то по несколько вариантов жесткости гибридизации и (или) промывки могут быть протестированы одновременно ("параллельно").
Тесты с нуклеотидными зондами
В таких методах, как ПЦР, анализ с разветвленными ДНК-зондами и методики блоттинга, основанных на использовании нуклеотидных зондов в соответствии с настоящим изобретением, можно выявить кДНК или мРНК. Говорят, что зонд "гибридизует" с последовательностью по настоящему изобретению тогда, когда он образует дуплекс или двухцепочечный комплекс, который достаточно стабилен для того, чтобы быть выявленным.
Соответствующие нуклеотидные зонды должны гибридизовать и нуклеотидными последовательностями нейссерий по настоящему изобретению (включая и смысловую и несмысловую цепи). Хотя конкретную аминокислотную последовательность может кодировать множество различных нуклеотидных последовательностей, нативные последовательности нейссерий являются предпочтительными потому, что именно они действительно присутствуют в клетках этих организмов. мРНК представляет кодирующую последовательность, поэтому зонд должен быть комплементарен соответствующей кодирующей последовательности; одноцепочечная кДНК комплементарна мРНК, поэтому кДНК-зонд должен быть комплементарен некодирующей последовательности.
Нет необходимости в том, чтобы нуклеотидная последовательность зонда была идентична последовательности нейссерии (или ее комплементу) - некоторый уровень изменчивости последовательности и длины нуклеотидной последовательности может обусловить повышение чувствительности теста тогда, когда нуклеотидный зонд может образовывать дуплекс с нуклеотидами-мишенями, который может быть выявлен. Также нуклеотидный зонд может включать дополнительные нуклеотиды, которые призваны стабилизировать образующийся дуплекс. Дополнительная последовательность нейссерии может также выполнять вспомогательную роль метки, необходимой для выявления образовавшегося дуплекса. Например, некомплементарная нуклеотидная последовательность может быть присоединена к 5'-концу зонда, при том, что остальная последовательность данного зонда комплементарна последовательности нейссерии. С другой стороны, некомплементарные нуклеотиды или удлиняющие последовательности могут быть диспергированы по длине этого зонда с учетом того, что нуклеотидная последовательность данного зонда характеризуется существенным уровнем комплементарности по отношению к последовательности нейссерии, в результате чего будут обеспечены их гибридизация и образование ими дуплекса, который может быть выявлен.
Точные длина и нуклеотидная последовательность зонда будут зависеть от условий проведения гибридизации, таких как температура, солевые условия и подобное. Например, для диагностического применения, в зависимости от сложности анализируемой нуклеотидной последовательности, нуклеотидный зонд обычно состоит по крайней мере из 10-20 нуклеотидов, предпочтительно из 15-25, а наиболее предпочтительно - по крайней мере из 30 нуклеотидов, хотя он может быть короче. Короткие затравки, как правило, требуют более низких температур для образования достаточно стабильных гибридных комплексов с матрицей.
Зонды могут быть сформированы с помощью процедур синтеза, например, с помощью триэфирного метода Маттеуччи с соавт. (Matteucci et al., 1981, J. Amer. Chem. Soc., 103, 3185) или в соответствии с Urdea et al., 1983, Proc. Natl. Acad. Sci. USA, 80, 7461, или с использованием доступных на коммерческой основе автоматических синтезаторов олигонуклеотидов.
Химическая природа зонда может быть выбрана исходя из конкретных предпочтений. Для некоторых путей применения предпочтительными являются ДНК или РНК. Для других вариантов применения могут быть внесены различные модификации: например, модификации осевой структуры, такие как фосфотиоаты или метилфосфонаты, могут быть использованы для увеличения времени полужизни in vivo, изменения уровня аффинности РНК, повышения резистентности к действию нуклеаз и т.п. (см., например, Agrawal & Iyer, 1995, Curr. Opinion Biotechnol., 6, 12-19; Agrawal, 1996, TIBTECH, 14, 376-387); также могут быть использованы такие аналоги, как пептиды нуклеиновых кислот (см., например, Соrey, 1997, TIBTECH, 15, 224-229; Buchardt et al., 1993, TIBTECH, 11, 384-386).
С другой стороны, полимеразная цепная реакция (ПЦР) являются другим хорошо известным способом выявления небольших количеств нуклеиновых кислот-мишеней. Этот тест описан Муллисом с соавт. (Mullis et al., 1987, Meth. Enzymol., 155, 335-350) и в патентах США №№4683195 и 4683202. Два нуклеотида-"затравки" гибридизуют с нуклеиновыми кислотами-мишенями и используют для затравки реакции. Такие затравки могут включать последовательность, которая не гибридизует с последовательностью, предназначенной к амплификации мишени (или ее комплемента) с целью придания стабильности дуплексу или, например, с целью внесения стандартного рестрикционного сайта. Обычно такая последовательность должна фланкировать желаемую последовательность нейссерии.
Термостабильная полимераза создает копии нуклеотидных кислот-мишеней с затравок, используя при этом исходные нуклеиновые кислоты-мишени в качестве матрицы. После того, как такая полимераза обеспечивает появление некоего порогового количества нуклеиновых кислот-мишеней, они могут быть выявлены с применением более традиционных методов, таких как Саузерн-блоттинг. При использовании метода Саузерн-блоттинга помеченный зонд должен гибридизовать с последовательностью нейссерии (или с ее комплементом).
Также мРНК или кДНК могут быть выявлены с помощью традиционных методик блоттинга, описанных у Sambrook et al. (цит. выше). мРНК или кДНК, сформированные на матрице мРНК с помощью фермента полимеразы, могут быть очищены и разделены с помощью метода гель-электрофореза. Нуклеиновые кислоты в геле затем подвергают блоттингу на твердой подложке, такой как нитроцеллюлоза. Твердую подложку обрабатывают помеченным зондом и затем промывают с целью удаления любых негибридизовавших зондов. Далее выявляют полученные дуплексы, включающие помеченный зонд. Обычно такой зонд помечают с использованием радиоактивной составляющей.
Краткое описание фигур
На фиг.1-20 показаны данные биохимического анализа, полученные в нижеследующих примерах, а также данные секвенирования для кодирующих рамок ORF 37, 5, 2, 15, 22, 28, 32, 4, 61, 76, 89, 97, 106, 138, 23, 25, 27, 79, 85 и 132. M1 и М2 соответствуют маркерам молекулярной массы. Стрелки указывают на положение основного рекомбинантного продукта или (в методе Вестерн-блоттинга) положение основного иммунореактивного бэнда N.meningitidis. TP обозначает общий белковый экстракт N.meningitidis; OMV обозначает препарат внешней мембраны пузырька N.meningitidis. В описании теста на бактерицидность: знак ромба (◆) показывает преиммунные данные; знак треугольника ( ) обозначает контрольные данные GST; кружок (•) показывает данные, полученные с рекомбинантным белком N.meningitidis. Компьютерный анализ показывает кривую гидрофильности (вверху), кривую антигенного индекса (в середине) и данные анализа AMPHI (внизу).
) обозначает контрольные данные GST; кружок (•) показывает данные, полученные с рекомбинантным белком N.meningitidis. Компьютерный анализ показывает кривую гидрофильности (вверху), кривую антигенного индекса (в середине) и данные анализа AMPHI (внизу).
Компьютерная программа АМРНI используется для предсказания расположения Т-клеточных эпитопов (Gao et al., 1989, J. Immunol., 143, 3007; Roberts et al., 1996, AIDS Res. Hum. Retroviruses, 12, 593; Quakyi et al., 1992, Scand. J. Immunol., suppl. 11, 9) и она доступна из пакета программ Protean фирмы DNASTAR Inc. (1228 S, Park str., Madison, WI 53715, США).
Примеры
Нижеследующие примеры описывают нуклеотидные последовательности, которые были идентифицированы у N.meningitidis параллельно с предположительно кодируемыми ими продуктами трансляции, а также такие же последовательности N.gonorrhoeae. He все из приведенных нуклеотидных последовательностей являются полными: т.е. они кодируют меньше, чем полноразмерный белок дикого типа.
Приведенные примеры в целом сформированы таким образом:
- нуклеотидная последовательность, которая была идентифицирована у N.meningitidis (штамм В);
- продукт, предсказательно транслируемый с этой нуклеотидной последовательности;
- данные компьютерного анализа продукта трансляции на основе сравнения имеющихся баз данных;
- указания на соответствующие генные и белковые последовательности, идентифицированные у N.meningtidis (штамм А) и у N.gonorrhoeae;
- описание характеристик белков, которые указывают на то, что они могут обладать пригодной антигенностью;
- результаты биохимического анализа (экспрессия, очистка, ТИФА, FACS и т.п.).
Примеры обычно включают подробности, описывающие уровень идентичности между видами и штаммами. Белки, сходные по своей аминокислотной последовательности, сходны и по своим структуре и функциям, т.е. идентичность последовательностей зачастую указывает на единство происхождения в филогенезе. Сравнение аминокислотных последовательностей белков с известной функцией широко используется в качестве способа оценки предполагаемых функций белков с новой последовательностью, а также, как было подтверждено, оказывалось применимым для анализа полных геномов.
Сравнение последовательностей проводили в системе NCBI (http://www.ncbi.nlm.nih.gov) с использованием алгоритмов BLAST, BLAST2, BLASTn, BLASTp, tBLASTn, BLASTx & tBLASTx (также см., например, Altschul et al., 1997, "Gapped BLAST and PSI-BLAST: a new generation of protein database search programs", Nucl. Acids Res., 25, 2289-3402). Поиски проводились по следующим программам полипептидных баз данных: неизбыточные последовательности GenBank+EMBL+DDBJ+PDB и GenBank+трансляции CDS+PDB+SwissProt+SPupdate+PIR.
Для сравнения последовательностей менингококка и гонококка использовали алгоритм tBLASTx, http://www.genome.ou.edu/gono_blast.html. Также алгоритм FASTA использовали для сравнения открытых кодирующих рамок ORF (из GCG Wisconsin Package, версия 9.0).
Пометки точками в составе нуклеотидных последовательностях (например, в положении 495 в последовательности SEQ ID NO 11) определяют нуклеотиды, которые были случайным образом внесены с целью поддержания кодирующей рамки. Таким же образом двойное подчеркивание соответствует удаленным нуклеотидам. Строчные буквы (например, в 496-м положении в SEQ ID NO 11) соответствуют неопределенностям, которые возникают при сопоставлении независимо проведенных реакций секвенирования (некоторые из нуклеотидных последовательностей в нижеследующих примерах являются результатом обобщения двух или большего числа экспериментов).
Нуклеотидные последовательности были просканированы во всех шести кодирующих рамках с целью предсказания присутствия гидрофобных доменов, для чего использовали алгоритм, основывающийся на статистических подходах Esposti et al., 1990, "Critical evaluation of the hydropathy of membrane proteins", Eur. J. Biochem., 190, 207-219). Эти домены представляют потенциальные трансмембранные участки или гидрофобные сигнальные (лидерные) сегменты.
Открытые кодирующие рамки были предсказаны исходя из фрагментированных нуклеотидных последовательностей, для чего использовали программу ORFFINDER (NCBI).
Подчеркивание аминокислотных последовательностей указывает на наличие вероятных трансмембранных доменов или сигнальных сегментов в составе кодирующей рамки ORF в соответствии с предсказаниями программы PSORT (http://www. psort.nibb.ac.jp). Функциональные домены также были предсказаны с помощью программы MOTIFS (GCG Wisconsin & PROSITE).
Различные тесты были использованы для оценки in vivo иммуногенности белков, идентифицированных в примерах. Например, белки могут быть экспрессированы рекомбинантным путем и затем использованы для скрининга сыворотки пациента методом иммуноблоттинга. Наличие позитивной реакции между белком и сывороткой пациента указывает на то, что у этого пациента ранее уже формировался иммунный ответ на анализируемый белок, т.е. данный белок является иммуногеном. Данный способ может быть использован для идентификации иммунодоминантных белков.
Рекомбинантный белок также может быть стандартным образом использован для приготовления антител, например, у мышей. Они могут быть использованы для прямого подтверждения того, что белок локализован на поверхности клеток. Помеченное антитело (например, помеченное флуоресцентной меткой для использования в методе FACS) может быть проинкубировано с интактными бактериями - при этом присутствие метки на поверхности бактериальных клеток подтверждает такую локализацию соответствующего белка.
В частности, следующие методы (от А до S) были использованы для экспрессии, очистки и биохимического анализа белков по настоящему изобретению.
A) Получение хромосомной ДНК
Менингококков N.meningitidis штамма 2996 выращивали до экспоненциальной стадии роста в 100 мл культуральной среды GC, собирали с помощью центрифугирования и ресуспендировали в 5 мл буфера (20% сахарозы, 50 мМ Трис-HCl, 50 мМ EDTA - рН 8). Через 10 минут инкубации на льду бактерий лизировали добавлением 10 мл лизирующего раствора (50 мМ NaCl, 2% саркозила натрия, 50 мкг/мл протеиназы-К) и полученную суспензию инкубировали при 37°С в течение 2 часов. Проводили двукратную экстракцию фенолом (при уравновешивании в рН 8) и однократную экстракцию смесью хлороформа и изоамилового спирта (24:1). ДНК осаждали добавлением 0,3 М ацетата натрия и 2 объемов этилового спирта и затем собирали центрифугированием. Полученный сгусток промывали один раз 70%-ным этанолом и вновь растворяли в 4 мл буфера (10 мМ Трис-HCl, 1 мМ EDTA, рН 8). Концентрацию полученного препарата ДНК определяли по оптической плотности при 260 нм.
B) Конструирование олигонуклеотида
Синтетические олигонуклеотидные затравки были сконструированы на основе кодирующей последовательности каждой кодирующей рамки ORF с использованием (а) В-последовательности менингококка (если она доступна) или (b) A-последовательности гонококка/менингококка, адаптированной к предпочтению кодонов у менингококка (если это являлось необходимым). Любые предполагаемые сигнальные сегменты отбрасывались, для чего формируемые 5'-концевые амплификационные затравки соответствовали участку, расположенному сразу вслед за предполагаемым лидерным сегментом.
Для большинства рамок ORF прямые затравки (5') включали два сайта узнавания рестриктазами (BamHI/NdeI, BamHI/NheI или EcoRI/NheI, в зависимости от собственных рестрикционных параметров конкретного гена); обратные (3') затравки включали рестрикционный XhoI-сайт. Эта процедура была предпринята с целью направления клонирования каждого амплификационного продукта (соответствующего каждой кодирующей рамке ORF) в двух различных экспрессионных системах: pGEX-KG (с использованием рестрикционных сайтов либо BamHI/XhoI, либо EcoRI/XhoI) и рЕТ21b+ (с использованием рестрикционных сайтов либо NdeI/XhoI, либо NheI/XhoI).

Для рамок ORF 5, 15, 17, 19, 20, 22, 27, 28, 65 и 89 были проведены по две независимые реакции амплификации с целью клонирования каждой из ORF в каждой из двух экспрессионных систем. По две различные 5'-концевые затравки были использованы для каждой ORF, при том, что обратной затравкой была та же 3'-затравка, которая названа выше:

Кодирующая рамка 76 была клонирована с использованием экспрессирующего вектора pTRC и экспрессирована в виде химеры с присоединенным по N-концу полигистидиновым "хвостом". В этом конкретном случае предполагаемый сигнальный сегмент включался в состав конечного продукта. Рестрикционные сайты NheI/BamHI были внесены с использованием таких затравок:

Равно как включаются последовательности, узнаваемые рестриктазами, в состав затравок включаются и нуклеотиды, которые гибридизуют с последовательностью, которая должна быть амплифицирована. Число гибридизующих нуклеотидов зависело от температуры плавления полной затравки и определялось для каждой затравки с использованием таких формул:
Tm=4·(G+C)+2 (А+Т) (хвостовой сегмент исключен),
Тm=64,9+0,41·(% GC)-600/N (полная затравка).
Средняя температура плавления выбранных олигонуклеотидов составляла 65-70°С для полных олигонуклеотидов и 50-55°С для отдельных участков гибридизации.
В таблице 1 показаны прямые и обратные затравки, использовавшиеся для каждой реакции амплификации. В некоторых случаях необходимо отметить, что последовательность конкретной затравки не соответствует полностью последовательности кодирующей рамки. Когда проводили исходные реакции амплификации, полные 5'- и (или) 3'-последовательности не были известны для некоторых менингококковых ORF, хотя соответствующие последовательности были идентифицированы у гонококка. Для амплификации последовательности гонококков могли, следовательно, быть использованы в качестве основы для конструирования затравок, проводя в последовательности изменения, исходя из параметров предпочтения кодонов. В частности, были проведены такие изменения кодонов: АТА→АТТ; TCG→ТСТ; CAG→САА; AAG→ААА; GAG→GAA; CGA→CGC; CGG→CGC; GGG→GGC. Такие изменения отражены в табл. 1 путем выделения нуклеотидов курсивом. Должно быть понятно, что как только полная последовательность идентифицирована, данный описанный подход становится далее не нужным.
Олигонуклеотиды были синтезированы с использованием синтезатора ДНК/РНК модели 394 фирмы Perkin-Elmer, элюированы из колонок в 2 мл NH4OH и освобождены от защиты путем 5-часовой инкубации при 56°С. Эти олигонуклеотиды осаждали добавлением 0,3 М ацетата натрия и 2 объемов этанола. Образцы затем центрифугировали и сгустки ресуспендировали либо в 100 мкл, либо в 1 мл воды. Определяли оптическую плотность OD260 с использованием спектрофотометра Laiabda-Bio (Perkin-Elmer), оценивая тем самым концентрацию, которую затем доводили до 2-10 пкмоль/мкл.
С) Амплификация
Стандартный протокол ПЦР был следующим: 50-200 нг геномной ДНК использовали в качестве матрицы в присутствии 20-40 мкМ каждого олигонуклеотида, 400-800 мкМ раствора смеси дезоксирибонуклеотидов (dNTP), 1 × ПЦР-буфера (включая 1,5 мМ MgCl2), 2,5 ед. ДНК-полимеразы TaqI (с использованием амплификатора AmpliTaQ Perkin-Elmer, Gibco Platinum; ДНК-полимеразы Pwo или Taq-полимеразы Tahara Shuzo).
В некоторых случаях параметры ПЦР оптимизировали добавлением 10 мкл ДМСО или 50 мкл 2 М бетаина.
После "горячего старта" (добавление полимеразы в смесь, преинкубируемую в течение 3 минут при температуре 95°С) каждый образец подвергался 2-этапной амплификации: первые 5 циклов проводили с использованием температуры гибридизации, определенной для олигонуклеотидов с исключенным из расчета "хвостом с рестрикционными сайтами", с последующими 30 циклами, проводившимися при температуре гибридизации, определенной для полноразмерных олигонуклеотидов. Все циклы завершали конечным 10-минутным этапом достройки цепи при 72°С.
Стандартные циклы были следующими:
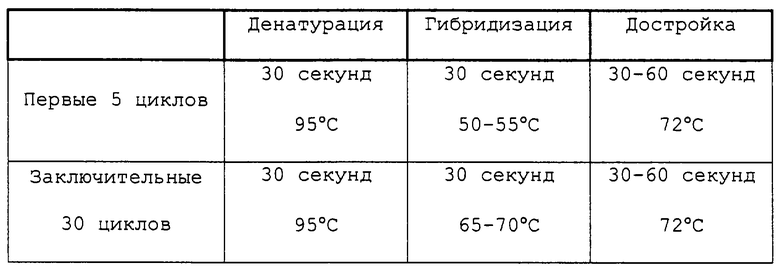
Продолжительность этапа достройки варьировалась в зависимости от длины кодирующей рамки ORF, амплификация которой осуществляется.
Реакции амплификации проводили с использованием ген-амплификатора моделей 9600 либо 2400 (Perkin-Elmer). Для проверки результатов десятую часть амплификационного объема загружали в 1-1,5%-ный агарозный гель и размер каждого из продуктов амплификации сравнивали с молекулярной массой ДНК-маркера.
Амплифицированную ДНК либо загружали напрямую в 1%-ный гель, либо сначала осаждали этиловым спиртом и ресуспендировали в подходящем объеме, который должен быть загружен в 1%-ный гель. Фрагмент ДНК, соответствующий правильному размеру бэнда, затем элюировали и очищали из геля с использованием набора реактивов Qiagen Gel Extraction Kit в соответствии с инструкциями производителя. Конечный объем фрагмента ДНК составлял 30 мкл или 50 мкл в воде или 10 мМ Трис, рН 8,5.
D) Расщепление ПЦР-фрагментов
Очищенную ДНК, соответствующую амплифицированному фрагменту, разделяли на две аликвоты и подвергали двойному расщеплению рестриктазами:
- NdeI/XhoI или NheI/XhoI для клонирования в состав рЕТ21b+ и дальнейшей экспрессии белка в виде С-концевой части химеры, включающей полигистидиновый "хвост";
- BamHI/XhoI или EcoRI/XhoI для клонирования в состав pGEX-KG и дальнейшей экспрессии белка в виде N-концевой части химеры GST;
- в варианте с кодирующей рамкой ORF76 NheI/BamHI для клонирования в состав вектора pTRC-HisA и дальнейшей экспрессии белка в виде N-концевой части химеры, включающей полигистидиновый "хвост";
- EcoRI/PstI, EcoRI/SalI, SalI/PstI для клонирования в состав pGex-His и дальнейшей экспрессии белка в виде N-концевой части химеры, включающей полигистидиновый "хвост".
Каждый очищенный ДНК-фрагмент инкубировали (при 37°С в течение 3 часов или в течение ночи) с 20 ед. каждой из рестриктаз (производства New England Biolabs) при конечном объеме либо 30 мкл, либо 40 мкл в присутствии подходящего буфера. Расщепленный продукт затем очищали с использованием набора реактивов QIAquick PCR purification kit в соответствии с инструкциями производителя и элюировали в конечный объем 30 мкл или 50 мкл либо в воде, либо в 10 мМ Трис-НСl (рН 8,5). Окончательная концентрация ДНК была определена с помощью электрофореза в 1%-ном агарозном геле в присутствии титрированного маркера молекулярной массы.
Е) Обработка клонирующих векторов (рЕТ22В, pGEX-KG, pTRC-HisA, pGex-His)
Двойной рестрикции подвергали 10 мкг плазмиды, используя по 50 ед. каждой рестриктазы в 200 мкл реакционного объема в присутствии подходящего буфера в течение ночи при инкубации при 37°С. После полной загрузки обработанного объема в 1%-ный агарозный гель бэнд, соответствующий расщепленному рестриктазами вектору, очищали из геля с использованием набора реактивов QIAquick Gel Extraction kit (Qiagen) и ДНК элюировали в 50 мкл в 10 мМ Трис-НСl (рН 8,5). Концентрацию ДНК оценивали путем измерения ОD260 каждого образца и доводили ее до 50 мкг/мл. По 1 мкл каждой плазмиды использовали в каждой процедуре клонирования.
Вектор pGEX-His является модифицированным вектором pGEX-2T, несущим участок, который кодирует шесть остатков гистидина, расположенный выше тромбинового сайта расщепления, и включающий множественные сайты клонирования из состава вектора pTRC99 (Pharmacia).
F) Клонирование
Фрагменты, соответствующие каждой кодирующей рамке, предварительно обработанные рестриктазами и очищенные, были лигированы и в состав рЕТ22b, и в состав pGEX-KG. При конечном объеме 20 мкл молярное отношение 3:1 фрагмента и вектора лигировали с использованием 0,5 мкл NEB ДНК-лигазы фага Т4 (400 ед./мкл) в присутствии буфера, предлагаемого производителем. Реакционную смесь инкубировали при комнатной температуре в течение 3 часов. В некоторых экспериментах лигирование осуществляли с использованием набора реактивов Rapid Ligation kit (Boehringer) в соответствии с инструкциями производителя.
С целью внесения рекомбинантной плазмиды в подходящий штамм, 100 мкл компетентных клеток E.coli (штамм DH5) инкубировали с лигазной реакцией в течение 40 минут на льду, затем при 37°С в течение 3 минут, затем, после добавления 800 мкл бульона LB, снова инкубировали при 37°С в течение 20 минут. Клетки затем центрифугировали при максимальной скорости вращения эппендорфовской микроцентрифуги и ресуспендировали приблизительно в 200 мкл надосадочной фракции. Полученную суспензию затем высевали на среду LB, содержащую ампициллин (100 мг/мл).
Скрининг рекомбинантных колоний осуществляли путем выращивания пяти случайным образом отобранных колоний в течение ночи при 37°С либо в 2 мл (клоны pGEX или рТС), либо 5 мл (клоны рЕТ) бульона LB+100 мкг/мл ампициллина. Клетки затем пеллетировали и ДНК экстрагировали с использованием набора реактивов QIAprep Spin Miniprep kit (Qiagen) в соответствии с инструкциями производителя до конечного объема 30 мкл. По 5 мкл каждого отдельного минипрепарата (приблизительно 1 г) обрабатывали рестриктазами либо NdeI/XhoI, либо BamHI/XhoI и полный обработанный объем загружали в 1-1,5%-ный агарозный гель (в зависимости от ожидаемого размера вставки) наряду с маркером молекулярной массы (1Kb DNA Ladder, Gibco). Скрининг позитивных клонов был осуществлен по параметрам правильного размера искомой вставки.
Для клонирования кодирующих рамок ORF 110, 111, 113, 115, 119, 122, 125 и 130 дважды обработанные рестриктазами ПЦР-продукт лигировали в состав дважды обработанного рестриктазами вектора с использованием клонирующих EcoRI/PstI-сайтов, в случае с рамками ORF 115 и 127 - EcoRI/SalI-сайтов, а в случае с рамкой 122 - SalI/PstI-сайтов. После клонирования рекомбинантные плазмиды были внесены в клетки E.coli штамма W3110. Отдельные клоны культивировали в течение ночи при 37°С в L-бульоне с добавлением 50 мкл/мл ампициллина.
G) Экспрессия
Каждую кодирующую рамку ORF, клонированную в состав экспрессирующего вектора, использовали для трансформации штамма, пригодного для экспрессии рекомбинантного белкового продукта. По 1 мкл каждой конструкции использовали для трансформации 30 мкл E.coli штамма BL21 (вектор pGEX), E.coli штамма ТОР10 (вектор pTRC) или E.coli штамма BL21-DE3 (вектор рЕТ) в соответствии с описанным выше. В случае с вектором pGEX-His тот же штамм кишечной палочки E.coli (W3110) использовали для исходного клонирования и экспрессии. Отдельные рекомбинантные колонии высевали в 2 мл культурального бульона LB с ампициллином (100 мкг/мл), инкубировали в течение ночи при 37°С, затем разводили в соотношении 1:30 в 20 мл LB с ампициллином (100 мкг/мл) в 100-мл колбах, проверяя при этом оптическую плотность OD600, которая должна составлять 0,1-0,15. Эти колбы инкубировали при 30°С в ротационном шейкере с водяной баней до тех пор, когда параметр оптической плотности укажет на выход культуры на экспоненциальную стадию роста, пригодную для индукции экспрессии (0,4-0,8 OD для векторов рЕТ и pTRC; 0,8-1 OD для векторов pGEX и pGEX-His). Для векторов рЕТ, pTRC и pGEX-His экспрессию белка индуцировали добавлением 1 мМ IPTG, в то время как в случае с вектором pGEX конечная концентрация IPTG составляла 0,2 мМ. Через 3 часа инкубации при 30°С конечную концентрацию образца проверяли по величине OD. С целью контроля экспрессии по 1 мл каждого образца удаляли, центрифугировали в микроцентрифуге, полученный сгусток ресуспендировали в фосфатно-солевом буфере (ФСБ) и анализировали методом SDS-электрофореза в 12%-ном ПААГ с окрашиванием кумасси голубым. Полный объем образца центрифугировали при 6000 g и полученный сгусток ресуспендировали в ФСБ для дальнейшего использования.
Н) Крупномасштабная очистка химерных GST-белков
Отдельную колонию культивировали в течение ночи при 37°С в среде LB с ампициллином на агаровой пластине. Бактерии высевали в 20 мл LD с ампициллином в жидкой культуре в шейкере, содержащем водяную баню, и культивировали в течение ночи. Бактерий разводили 1:30 в объем 600 мл (свежая культуральная среда) и оставляли расти при оптимальной температуре (20-37°С) до достижения оптической плотности OD550 0,8-1. Экспрессию белка индуцировали добавлением 0,2 мМ IPTG с последующей 3-часовой инкубацией. Культуру центрифугировали при 8000 об/мин при 4°С. Надосадочную фракцию удаляли и сгусток бактериальных клеток ресуспендировали в 7,5 мл холодного фосфатно-солевого буфера. Клетки разрушали ультразвуком на льду в течение 30 секунд при мощности 40 Вт с использованием аппарата В-15 (Branson), дважды замораживали и растаивали и снова центрифугировали. Надосадочную фракцию собирали и перемешивали в 150 мкл глутатион-сефарозной-4В смолы (Pharmacia) (предварительно промытой в ФСБ) и инкубировали при комнатной температуре в течение 30 минут. Образец центрифугировали при 700 g в течение 5 минут при 4°С. Смолу промывали 2 раза в 10 мл холодного ФСБ в течение 10 минут, ресуспендировали в 1 мл холодного ФСБ и загружали на свободную колонку. Смолу промывали дважды в 2 мл холодного ФСБ до тех пор, как проточный материал достигал оптической плотности OD280 0,02-0,06. Химерный GST-белок элюировали добавлением 700 мкл холодного глутатион-элюционного буфера (10 мМ восстановленного глутатиона, 50 мМ Трис-НСl) и фракции собирали до достижения OD280 величины 0,1. По 21 мкл каждой фракции загружали в 12%-ный SDS-гель с использованием либо молекулярных стандартов для SDS-ПААГ от Biorad (M1) (200, 116,25, 97,4, 66,2, 45, 31, 21,5, 14,4, 6,5 кД), либо набора стандартов от Amersham (M2) (220, 66, 46, 30, 21,5, 14,3 кД). При том, что молекулярная масса GST составляет 26 кД, это значение следует прибавлять к значению молекулярной массы, определяемой для каждого химерного GST-включающего белка.
I) Анализ растворимости His-химер (кодирующие рамки 111-129)
Для анализа растворимости His-химерных продуктов экспрессии сгустки 3-мл культур ресуспендировали в буфере Ml (500 мкл ФСБ - рН 7,2). Добавляли 25 мкл лизоцима и бактерии инкубировали в течение 15 минут при 4°С. Полученные сгустки облучали ультразвуком в течение 30 секунд при мощности 40 Вт с использованием ультразвуковой установки Branson В-15, дважды замораживали и растаивали и затем вновь разделяли на сгусток и надосадочную фракцию с помощью центрифугирования. Надосадочную фракцию отбирали и оставшийся сгусток ресуспендировали в буфере М2 (8 М мочевины, 0,5 М NaCl, 20 мМ имидазола и 0,1 М NаН2РO4) и инкубировали в течение 3-4 часов при 4°С. После центрифугирования надосадочную фракцию отбирали и сгусток ресуспендировали в буфере М3 (6 М гуанидин-HCl, 0,5 М NaCl, 20 мМ имидазола и 0,1 М NaH2PO4) в течение ночи при 4°С. Надосадочные фракции на каждом из этих этапов анализировали методом электрофореза в SDS-ПААГ.
Белки, экспрессируемые рамками ORF 113, 119 и 120, как было установлено, растворимы в фосфатно-солевом буфере, в то время как продукты рамок ORF 111, 122, 126 и 129 требуют для растворения мочевину, а продукты рамок ORF 125 и 127-гуанидинхлорида.
J) Крупномасштабная очистка His-химер
Отдельную колонию культивировали на протяжении ночи при 37°С в среде LB с ампициллином на агаровой пластине. Бактерии высевали в жидкую культуру по 20 мл в среде LB с ампициллином и инкубировали в течение ночи в шейкере с водяной баней. Бактерии разводили 1:30 в 600 мл свежей среды и оставляли расти при оптимальной температуре (20-37°С) до плотности QD550 0,6-0,8. Экспрессию белка индуцировали добавлением 1 мМ IPTG и культуру далее инкубировали в течение трех часов. Затем культуру центрифугировали при 8000 об/мин при 4°С, удаляли надосадочный слой и бактериальный сгусток ресуспендировали в 7,5 мл либо (1) холодного буфера А (300 мМ NaCl, 50 мМ фосфатного буфера, 10 мМ имидазола - рН 8) для растворимых белков, либо (2) буфера В (8 М мочевины, 10 мМ Трис-HCl, 100 мМ фосфатного буфера - рН 8,8) для нерастворимых белков.
Клетки разрушали ультразвуком на льду в течение 30 секунд при мощности 40 Вт с использованием ультразвуковой установки Branson В-15, дважды замораживали, растаивали и вновь центрифугировали.
В случае с нерастворимыми белками надосадочный слой хранили при -20°С, в то время как сгустки ресуспендировали в 2 мл буфера С (6 М гуанидингидрохлорида, 100 мМ фосфатного буфера, 10 мМ Трис-НСl - рН 7,5) и обрабатывали в гомогенизаторе в течение 10 циклов. Полученный продукт центрифугировали при 13000 об/мин в течение 40 минут.
Надосадочные фракции отбирали и смешивали с 150 мкл никель-содержащей (Ni2+) смолы (Pharmacia) (предварительно промытой буфером А или буфером В) и инкубировали при комнатной температуре при тщательном перемешивании в течение 30 минут. Образец центрифугировали при 700 g в течение 5 минут при 4°С. Смолу дважды промывали в 10 мл буфера А или В в течение 10 минут, ресуспендировали в 1 мл буфера А или В и загружали на свободную колонку. Смолу промывали либо (1) в 2 мл холодного буфера А при 4°С, либо (2) при комнатной температуре в 2 мл буфера В до тех пор, пока протекающий материал не достигнет оптической плотности OD280 0,02-0,06.
Смолу промывали либо в (1) 2 мл холодного буфера с 20 мМ имидазола (300 мМ NaCl, 50 мМ фосфатного буфера, 20 мМ имидазола - рН 8), либо в (2) буфере D (8 М мочевины, 10 мМ Трис-HCl, 100 мМ фосфатного буфера - рН 6,3) до тех пор, пока протекающий материал не достигнет оптической плотности OD280 0,02-0,06. Химерный His-белок элюировали добавлением 700 мкл либо (1) холодного элюционного буфера А (300 мМ NaCl, 50 мМ фосфатного буфера, 250 мМ имидазола - рН 8), либо (2) элюционного буфера В (8 М мочевины, 10 мМ Трис-HCl, 100 мМ фосфатного буфера - рН 4,5) и полученные фракции отбирали до плотности OD280=0,1. По 21 мкл каждой фракции загружали в 12%-ный SDS-гель.
К) Ренатурация His-химерных белков
К денатурированными белкам добавляли 10% глицерина. Белки затем разбавляли до концентрации 20 мкг/мл с использованием диализного буфера I (10% глицерина, 0,5 М аргинина, 50 мМ фосфатного буфера, 5 мМ восстановленного глутатиона, 0,5 мМ окисленного глутатиона, 2 М мочевины - рН 8,8) и диализовали против того же самого буфера при 4°С в течение 12-14 часов. Далее этот белок диализовали против диализного буфера II (10% глицерина, 0,5 М аргинина, 50 мМ фосфатного буфера, 5 мМ восстановленного глутатиона, 0,5 мМ окисленного глутатиона - рН 8,8) в течение 12-14 часов при 4°С. Концентрацию белка определяли с использованием следующей формулой:
Белок (мг/мл)=(1,55×OD280)-(0,76×OD260).
L) Крупномасштабная очистка His-химеры (кодирующие рамки ORF 111-129)
По 500 мл бактериальных культур инкубировали и химерные белки получали растворимыми в буферах M1, M2 или М3, для чего использовали описанные выше протоколы. Неочищенный экстракт бактерий загружали на суперскоростную колонку Ni-NTA (Quiagen), уравновешенную буфером M1, M2 или М3, в зависимости от того, в каком из этих буферов растворяется химерный белок. Несвязанный материал элюировали промывкой колонки тем же самым буфером. Конкретный белок элюировали с использованием соответствующего буфера, содержащего 500 мМ имидазола, и диализовали против соответствующего буфера, в котором отсутствовал имидазол. После каждого протока колонки восстанавливали промывкой по крайней мере двумя объемами колонки 0,5 М едкого натра и повторным уравновешиванием перед следующим использованием.
М) Иммунизация мышей
Для иммунизации мышей путем внутрибрюшинных инъекций использовали по 20 мкг каждого из очищенных белков. В случаях кодирующих рамок ORF 2, 4, 15, 22, 27, 28, 37, 76, 89 и 97, при иммунизации мышей линии BALB/c на 1-й, 21-й и 42-й дни в качестве адъюванта использовали гидрооксид алюминия, а иммунный ответ контролировали в образцах на 56-й день. В случае с кодирующими рамками ORF 44, 106 и 132 мышей линии CD1 иммунизовали в таком же протоколе. В случае с кодирующими рамками ORF 25 и 40 мышей CD1 иммунизовали в том же протоколе, заменив в качестве адъюванта гидрооксид алюминия на адъювант Фройнда; также отличием было то, что иммунный ответ контролировали на 42-й, а не на 56-й день. Сходным образом, в случаях кодирующих рамок ORF 23, 32, 38 и 79 мышей линии CD1 иммунизовали с адъювантом Фройнда, но иммунный ответ определяли на 49-й день.
N) Тест ТИФА (анализ сыворотки)
Декапсулированный штамм MenB M7 высевали на шоколадно-агаровые пластины и инкубировали в течение ночи при 37°С. Бактериальные колонии отбирали с агаровых пластин с использованием стерильной щетки и высевали в 7 мл культурального бульона Mueller-Hinton (Difco), содержащего 0,25 глюкозы.
Рост бактерий контролировали каждые 30 минут по величине OD620. Бактерии оставляли расти до достижения оптической плотности OD 0,3-0,4. Культуры центрифугировали в течение 10 минут при 10000 об/мин. Надосадочную фракцию удаляли и бактерий промывали один раз фосфатно-солевым буфером, ресуспендировали в ФСБ, содержащем 0,025% формальдегида, и инкубировали в течение 2 часов при комнатной температуре и затем, помешивая, в течение ночи при 4°С. По 100 мкл бактериальных клеток добавляли в каждую лунку 96-луночного грейнерского планшета и инкубировали в течение ночи при 4°С. Затем лунки трижды промывали промывочным фосфатным Твин-буфером (0,1% Твин-20 в фосфатно-солевом буфере). В каждую лунку добавляли по 200 мкл насыщающего буфера (2,7% поливинилпирролидона-10 в воде) и планшеты инкубировали в течение 2 часов при 37°С. Лунки промывали три раза в ФСБ. В каждую лунку добавляли по 200 мкл разведенной сыворотки (дилюционный буфер: 1% бычьего сывороточного альбумина, 0,1% Твин-20, 0,1% NaN в ФСБ) и планшеты инкубировали в течение 90 минут при 37°С. Затем лунки трижды промывали в ФСБ. В каждую лунку добавляли по 100 мкл конъюгированной с пероксидазой хрена кроличьей антимышиной сыворотки (Dako), разведенной 1:2000 в дилюционном буфере, и планшеты инкубировали в течение 90 минут при 37°С. В каждую лунку добавляли по 100 мкл субстратного для пероксидазы хрена буфера (25 мл цитратного буфера - рН 5; 10 мг O-фенилдиамина и 10 мкл воды) и планшеты оставляли при комнатной температуре на 20 минут. В каждую лунку добавляли по 100 мкл серной кислоты и определяли OD490. Тест ТИФА оказывался позитивным тогда, когда величина OD490 в 2,5 раза превышала соответствующий параметр преиммунной сыворотки.
О) Процедура теста FACScan на связывание бактерий
Декапсулированный штамм MenB M7 высевали на шоколадно-агаровые пластины и инкубировали в течение ночи при 37°С. Бактериальные колонии собирали с агаровых пластин с помощью стерильной щетки и высевали в 4 пробирки, содержащие каждая по 8 мл культурального бульона Mueller-Hinton (Difco), содержащего 0,25% глюкозы. Рост бактерий контролировали каждые 30 минут по OD620. Бактерий оставляли расти до достижения оптической плотности величины 0,35-0,5. Культуры центрифугировали в течение 10 минут при 4000 об/мин. Надосадочную фракцию удаляли и сгусток ресуспендировали в блокировочном буфере (1% бычьего сывороточного альбумина, 0,4% NаN3) и центрифугировали в течение 5 минут при 4000 об/мин. Клетки ресуспендировали в блокировочном буфере до достижения ОD620 величины 0,07. В каждую лунку 96-луночного планшета Costar добавляли по 100 мкл бактериальных клеток. В каждую лунку добавляли по 100 мкл разведенной (1:200) сыворотки (в блокирующем буфере) и планшеты инкубировали в течение 2 часов при 4°С. Клетки центрифугировали в течение 5 минут при 4000 об/мин, отсасывали надосадочный слой и клетки промывали добавлением в каждую лунку по 200 мкл блокирующего буфера. В каждую лунку добавляли по 100 мкл козьего антимышиного антитела F(ab)2, конъюгированного с R-фикоэритрином и разведенного 1:100, и планшеты инкубировали в течение 1 часа при 4°С. Клетки осаждали центрифугированием при 4000 об/мин в течение 5 минут и промывали добавлением в каждую лунку по 200 мкл блокирующего буфера. Отсасывали надосадочный слой и клетки ресуспендировали в 200 мкл ФСБ на каждую лунку + 0,25% формальдегида. Образцы переносили в пробирки для FACS (сортировка клеток с возбуждаемой флуоресценцией) и считывали их. Условия проведения FACS-сканирования были следующими: FL1 - включен; FL2 и FL3 - выключены; FSC-H - пороговое значение 92; FSC РМТ - вольтаж Е-02; SSC РМТ - 474; прирост амплитуды - 7,1; FL-2 РМТ - 539; компенсационное значение - 0.
Р) Получение OMV
Бактерии культивировали в течение ночи на пяти пластинах GC, собирали петлей и ресуспендировали в 10 мл 20 мМ Трис-НСl. Инактивацию нагреванием проводили в течение получаса при 56°С и бактериальные клетки разрушали ультразвуком в течение 10 минут на льду (50% нагрузки в цикле облучения, 50% выходной мощности). Неразрушенные клетки удаляли центрифугированием при 5000 g в течение 10 минут и полную фракцию клеточных оболочек выделяли центрифугированием при 50000 g в течение 75 минут при 4°С. Для экстрагирования цитоплазматических мембранных белков из неочищенной фракции внешних мембран полную фракцию ресуспендировали в 2%-ном саркозиле (Sigma) и инкубировали при комнатной температуре в течение 20 минут. Суспензию центрифугировали при 10000 g в течение 10 минут с целью удаления агрегатов, и надосадочную фракцию далее подвергали ультрацентрифугированию при 50000 g в течение 75 минут с получением сгустка внешних мембран. Внешние мембраны ресуспендировали в 10 мМ Трис-НСl (рН 8) и концентрацию белка определяли в тесте Bio-Rad Protein с использованием в качестве стандарта бычьего сывороточного альбумина.
Q) Получение полных экстрактов
Бактерии культивировали в течение ночи на пластинке GC, собирали петлей и ресуспендировали в 1 мл 20 мМ Трис-НСl. Инактивацию нагреванием осуществляли в течение 30 минут при 56°С.
R) Вестерн-блоттинг
Очищенные белки (500 нг на дорожку), пузырьки внешней мембраны (5 мкг) и общие клеточные экстракты (25 мкг), производные от клеток штамма МеnВ-2996, загружали в 15%-ный полиакриламидный гель для SDS-электрофореза и переносили на нитроцеллюлозную мембрану. Перенос осуществляли в течение 2 часов при 150 мА при 4°С в специальном буфере (0,3% основного Трис, 1,44% глицина, 20% метанола). Мембраны насыщали путем инкубации в течение ночи при 4°С в насыщающем буфере (10% снятого молока, 0,1% Тритон Х-100 в ФСБ). Мембраны промывали дважды в промывочном буфере (3% снятого молока, 0,1% Тритон Х-100 в ФСБ) и инкубировали в течение 2 часов при 37°С с мышиной сывороткой, разведенной до 1:200 промывочным буфером. Мембраны промывали дважды и инкубировали в течение 90 минут с помеченным пероксидазой хрена антимышиным иммуноглобулином, разведенным до 1:2000. Мембраны промывали дважды 0,1% Тритона Х-100 в ФСБ и обрабатывали с использованием субстрата из набора реактивов Opti-4CN Substrate Kit (Bio-Rad). Реакцию останавливали добавлением воды.
S) Тест на бактерицидность
Клетки штамма МС58 культивировали в течение ночи при 37°С на шоколадно-агаровых пластинах. По 5-7 колоний отбирали и использовали для высева в культуральный бульон Mueller-Hinton (7 мл). Суспензии инкубировали при 37°С в нутаторе и оставляли культивироваться до достижения OD620 величины 0,5-0,8. Каждую культуру разделяли на аликвоты в стерильных 1,5-мл эппендорфовских пробирках и центрифугировали в течение 20 минут при максимальной скорости микроцентрифуги. Полученный сгусток промывали один раз в буфере Гея (Gibco) и ресуспендировали в том же самом буфере до величины OD620 0,5, разводили в буфере Гея до 1:20000 и хранили при 25°С.
В каждую лунку 96-луночного планшета для культур тканей добавляли по 50 мкл буфера Гея в + 1% бычьего сывороточного альбумина. В каждую лунку добавляли по 25 мкл разведенной мышиной сыворотки (1:100 буфера Гея + 0,2% бычьего сывороточного альбумина) и планшет инкубировали при 4°С. В каждую лунку добавляли по 25 мкл охарактеризованной выше суспензии бактериальных клеток. В каждую лунку добавляли по 25 мкл либо инактивированного нагреванием (до 56°С на водяной бане в течение 30 минут), либо нормального комплемента крольчат. Немедленно вслед за добавлением комплемента крольчат по 22 мкл каждого образца (лунки) высевали на агаровые пластины Meuller-Hinton (время 0). 96-луночные планшеты инкубировали в течение 1 часа при 37°С при вращении и затем по 22 мкл каждого образца (лунки) высевали на агаровые пластины Mueller-Hinton (время 1). После инкубации в течение ночи подсчитывали колонии, соответствующие отрезкам времени 0 и 1 (часов).
В таблице 2 обобщены данные по клонированию, экспрессии и очистке.
Примеры 1-104 приведены в конце текста.
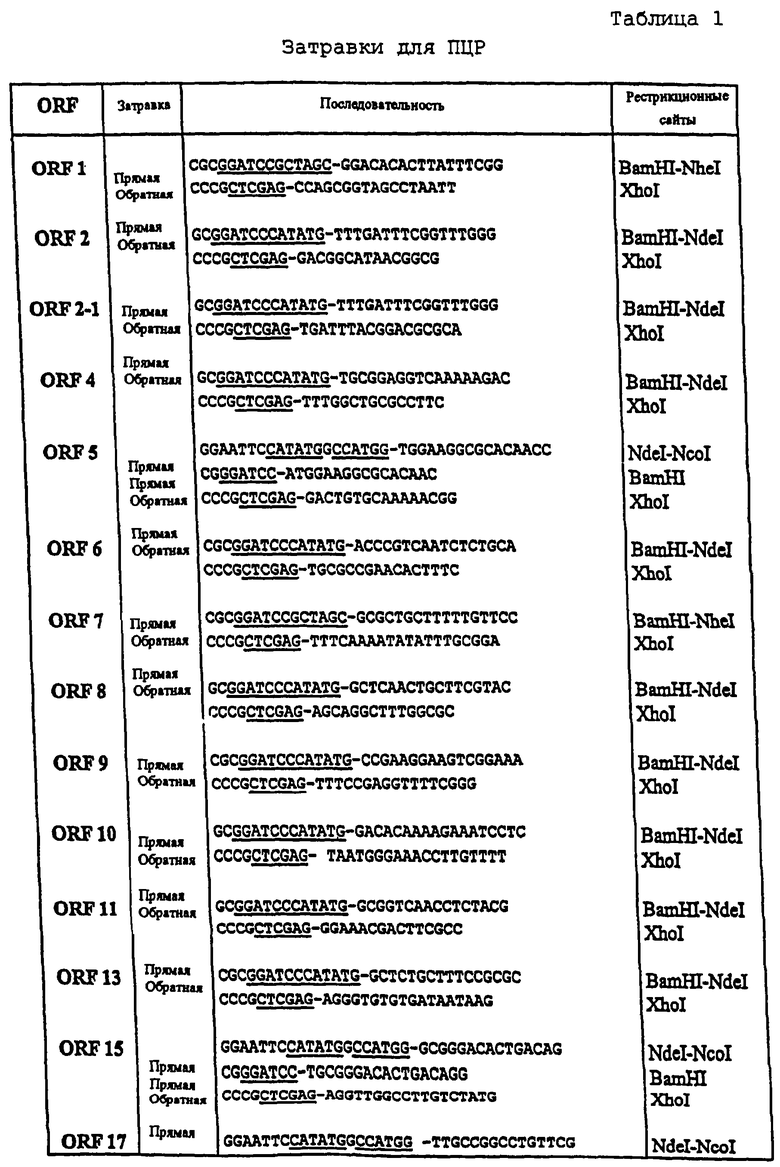


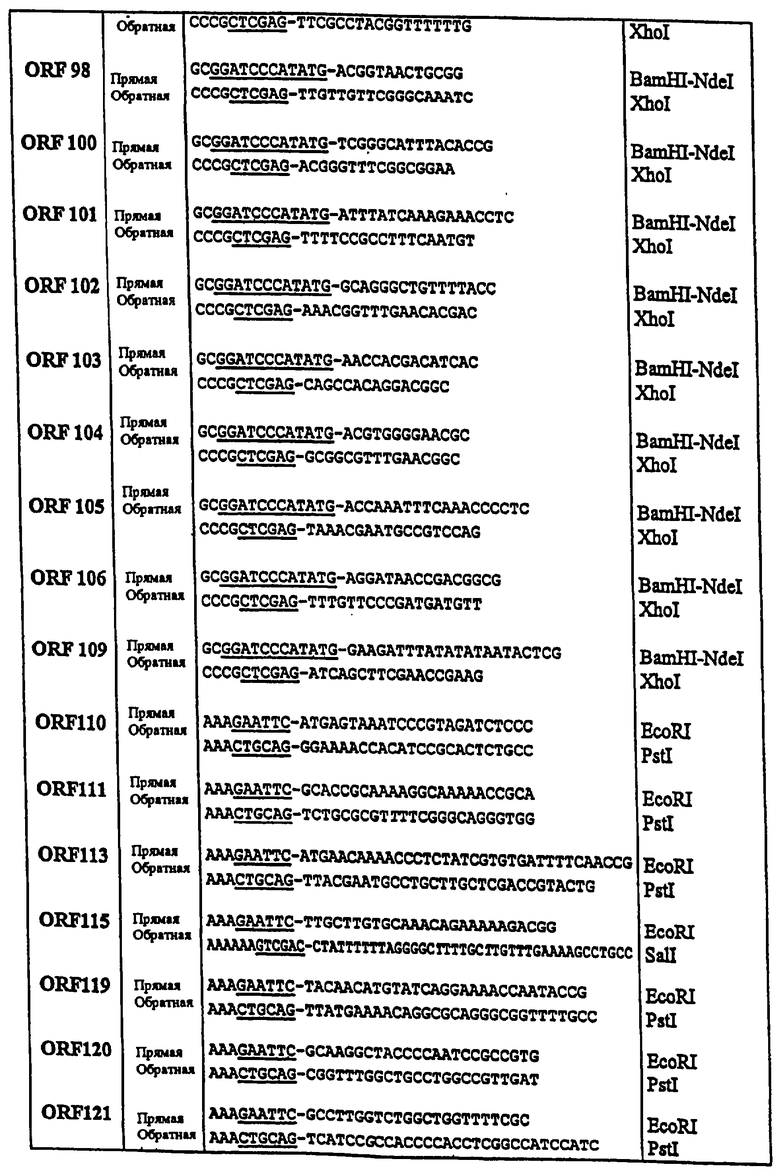
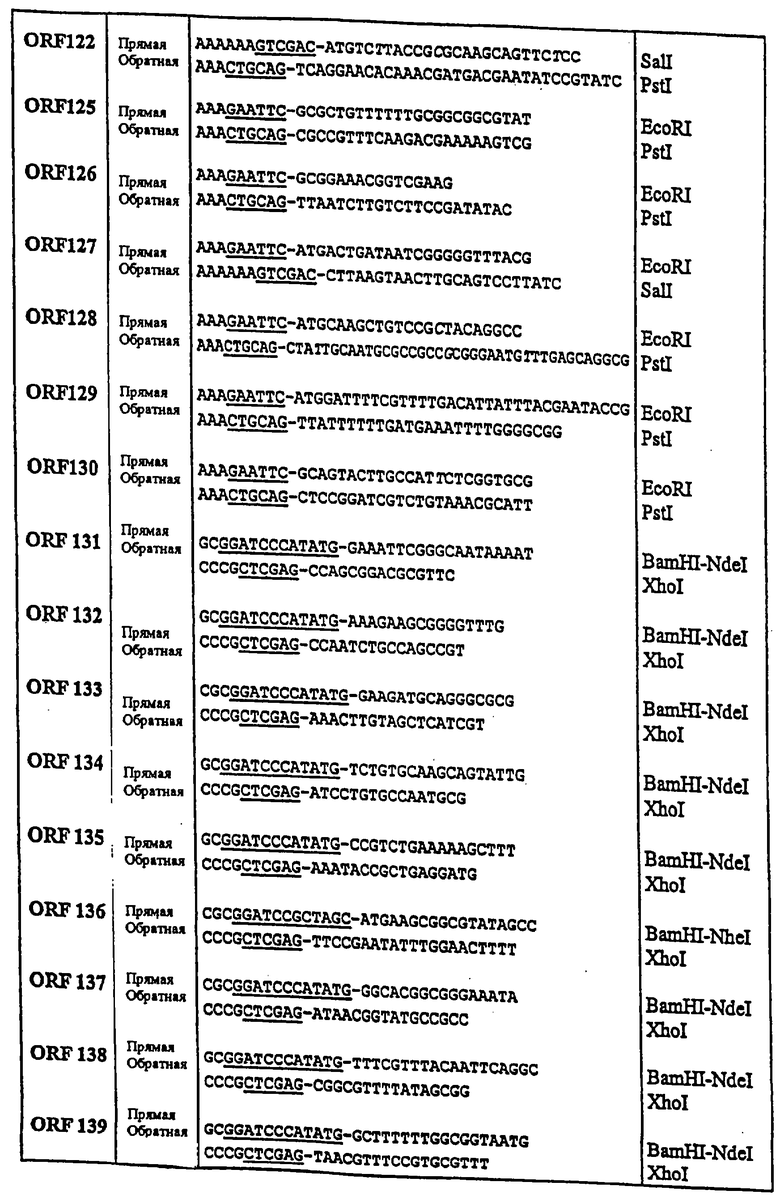

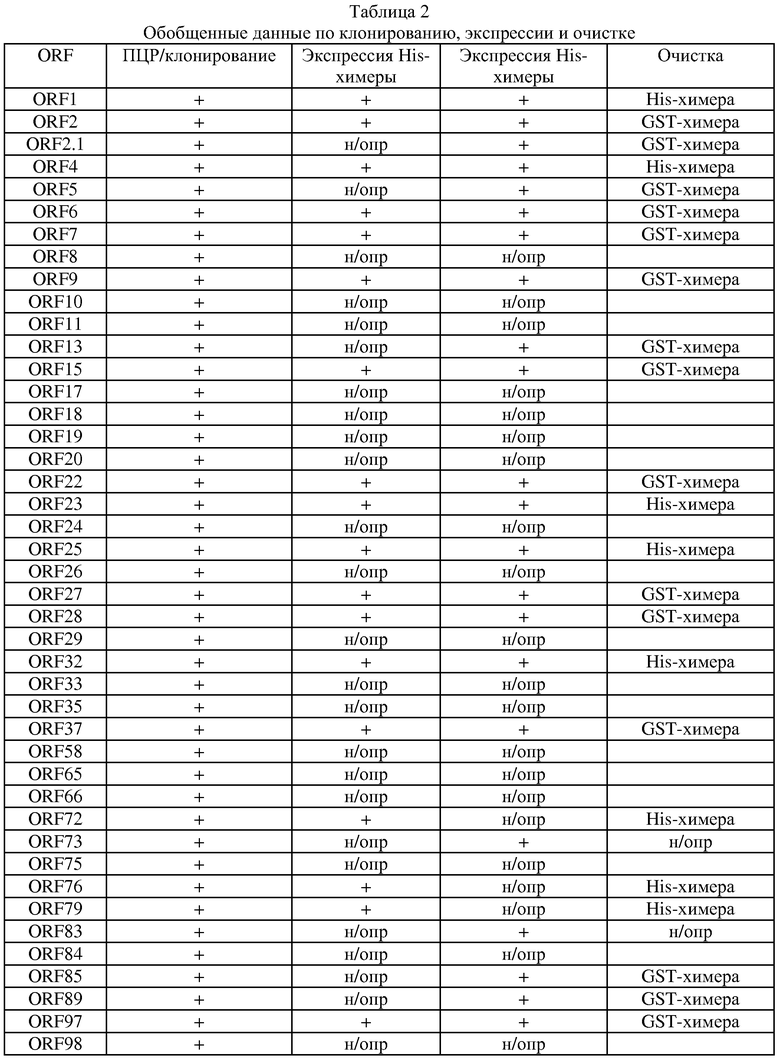
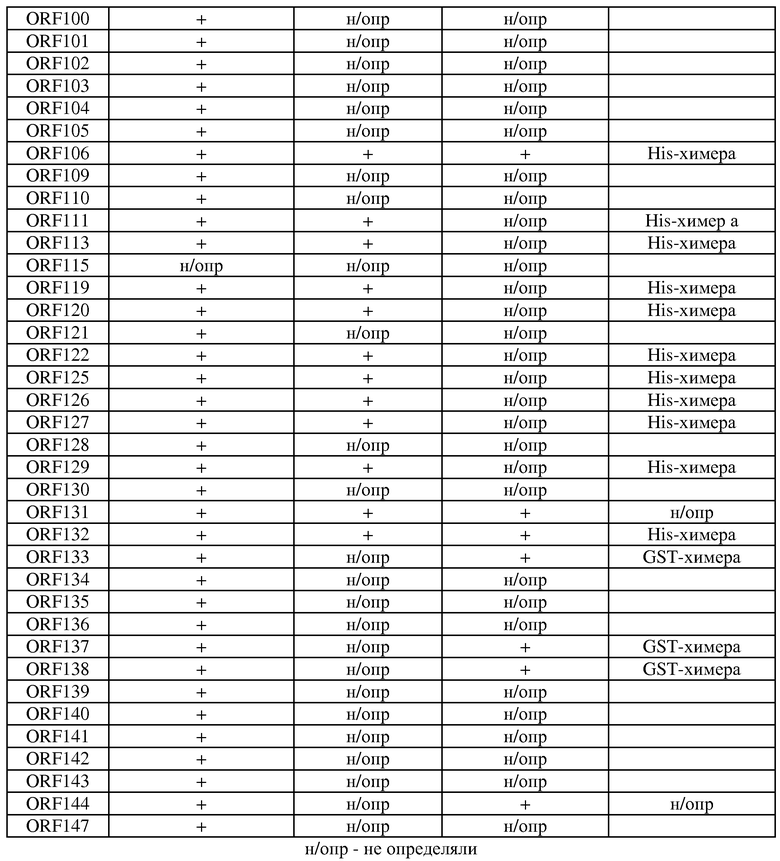
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕЛОК, ПОЛУЧЕННЫЙ ИЗ NEISSERIA MENINGITIDIS, ПРОЯВЛЯЮЩИЙ СВОЙСТВА АНТИГЕНА, АНТИТЕЛО, ФРАГМЕНТ НУКЛЕИНОВОЙ КИСЛОТЫ (ВАРИАНТЫ) И СОДЕРЖАЩАЯ ИХ КОМПОЗИЦИЯ | 1999 |
|
RU2233331C2 |
| БЕЛОК, ПОЛУЧЕННЫЙ ИЗ NEISSERIA MENINGITIDIS, ПРОЯВЛЯЮЩИЙ СВОЙСТВА АНТИГЕНА, АНТИТЕЛО, НУКЛЕИНОВАЯ КИСЛОТА (ВАРИАНТЫ) И СОДЕРЖАЩАЯ ИХ КОМПОЗИЦИЯ | 2000 |
|
RU2233328C2 |
| АНТИГЕНЫ NEISSERIA MENINGITIDIS | 1999 |
|
RU2343159C2 |
| АНТИГЕН NEISSERIA, КОДИРУЮЩАЯ ЕГО НУКЛЕИНОВАЯ КИСЛОТА, ИХ ИСПОЛЬЗОВАНИЕ | 2000 |
|
RU2245366C2 |
| АНТИГЕНЫ НЕЙССЕРИЙ | 1998 |
|
RU2347813C2 |
| АНТИГЕННЫЕ МЕНИНГОКОККОВЫЕ ПЕПТИДЫ (ВАРИАНТЫ) | 2000 |
|
RU2253678C2 |
| АНТИГЕННЫЕ ПЕПТИДЫ NEISSERIA | 2000 |
|
RU2284332C2 |
| АНТИГЕННЫЕ ПЕПТИДЫ NEISSERIA | 2000 |
|
RU2281956C2 |
| ИММУНИЗАЦИЯ ПРОТИВ CHLAMYDIA TRACHOMATIS | 2002 |
|
RU2331435C2 |
| ВАКЦИНА ВЕЗИКУЛ НАРУЖНЫХ МЕМБРАН (OMV), СОДЕРЖАЩАЯ БЕЛКИ НАРУЖНОЙ МЕБРАНЫ N.Meningitidis СЕРОЛОГИЧЕСКОЙ ГРУППЫ В | 2001 |
|
RU2279889C2 |





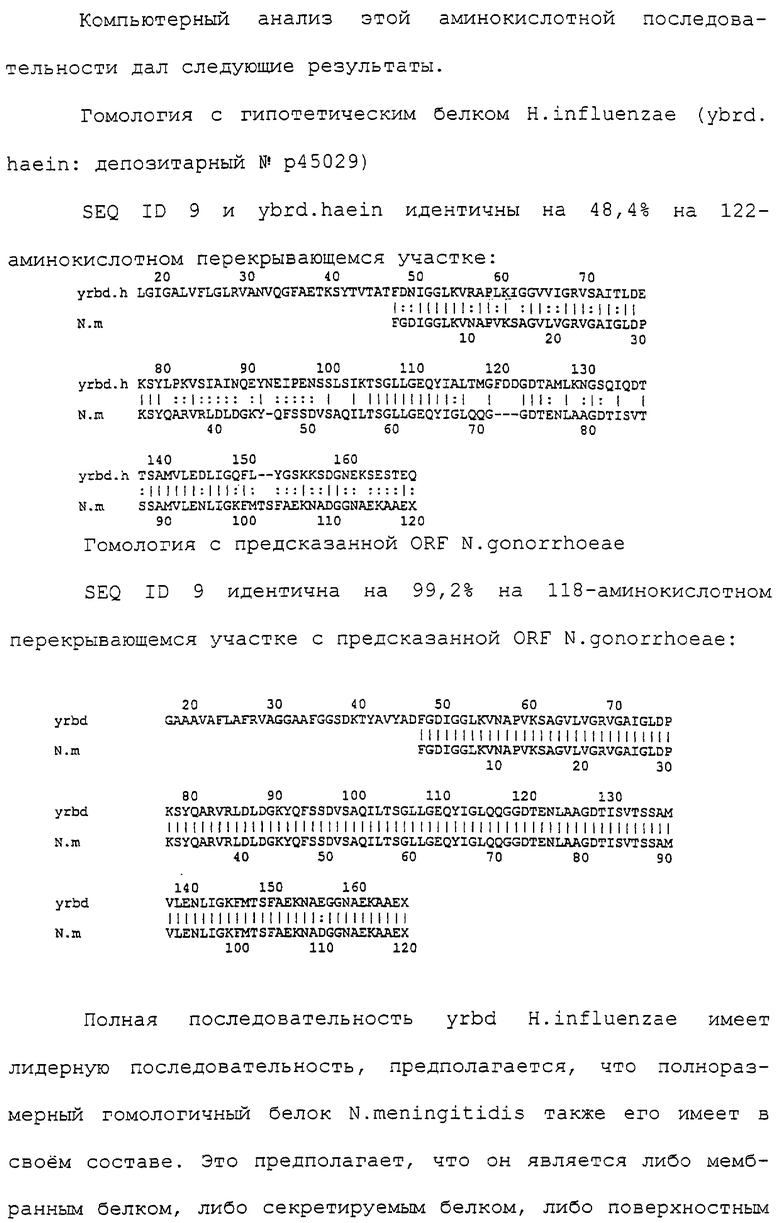









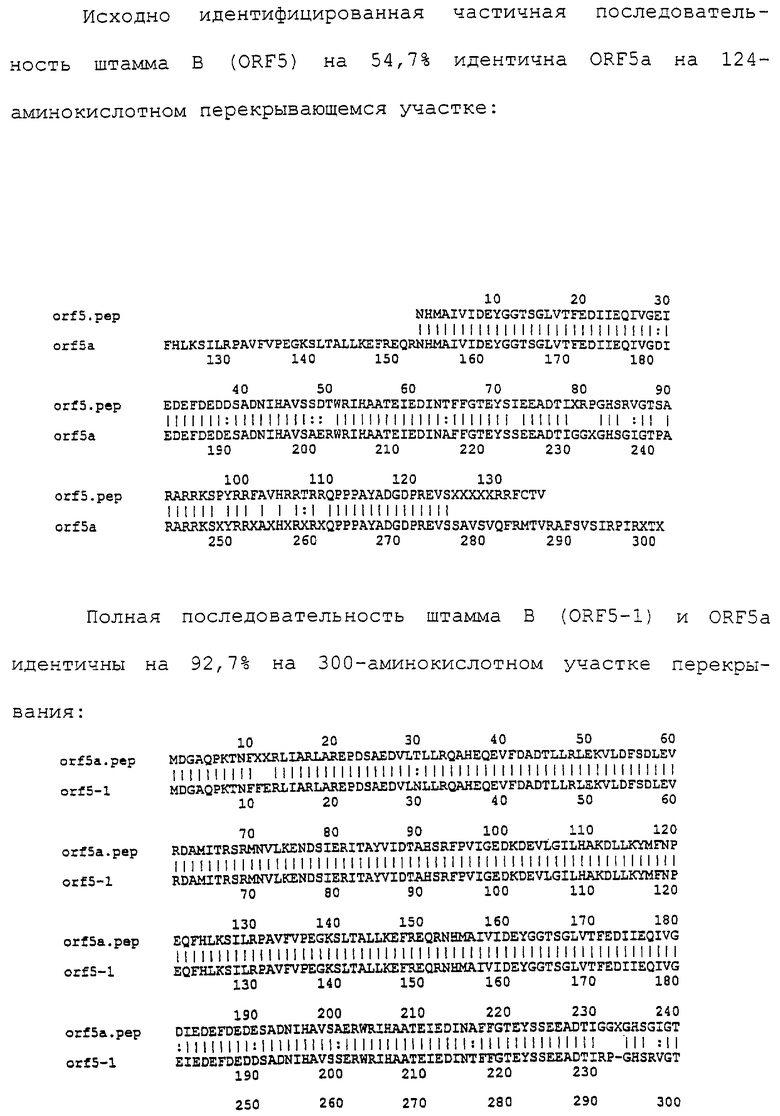


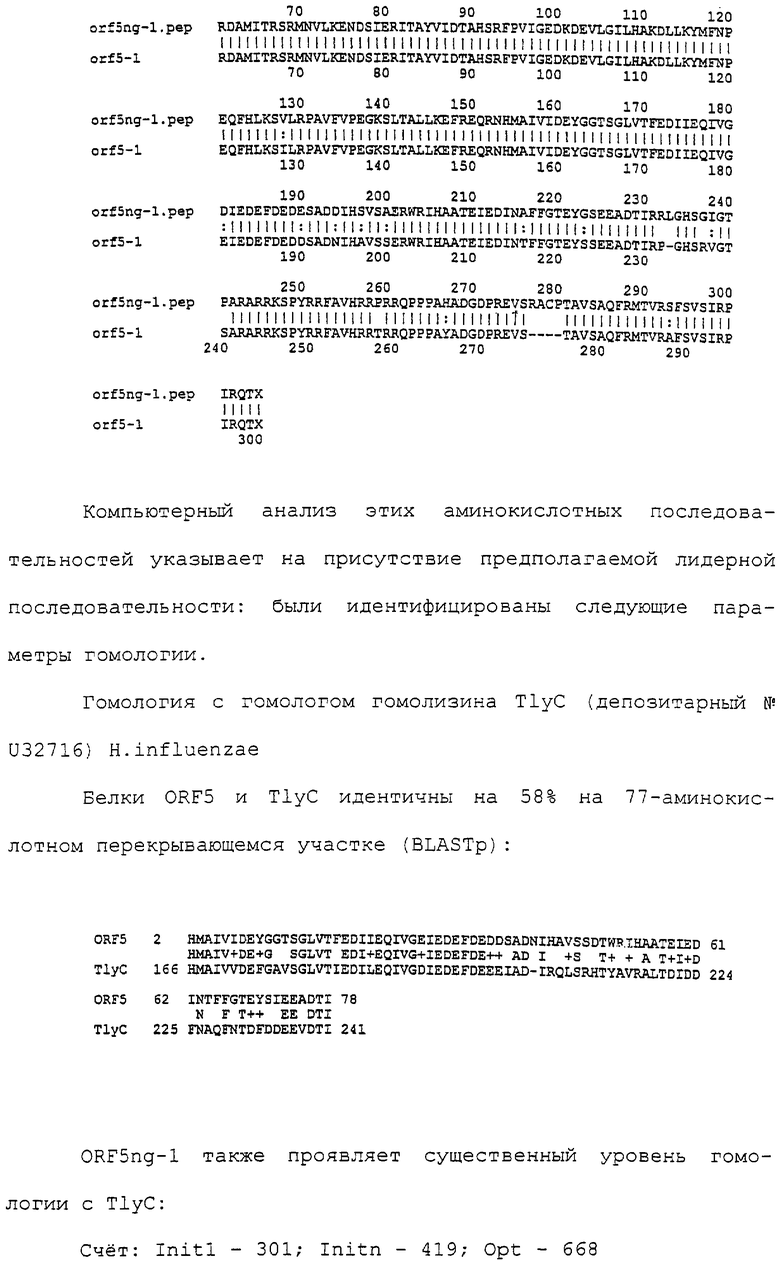




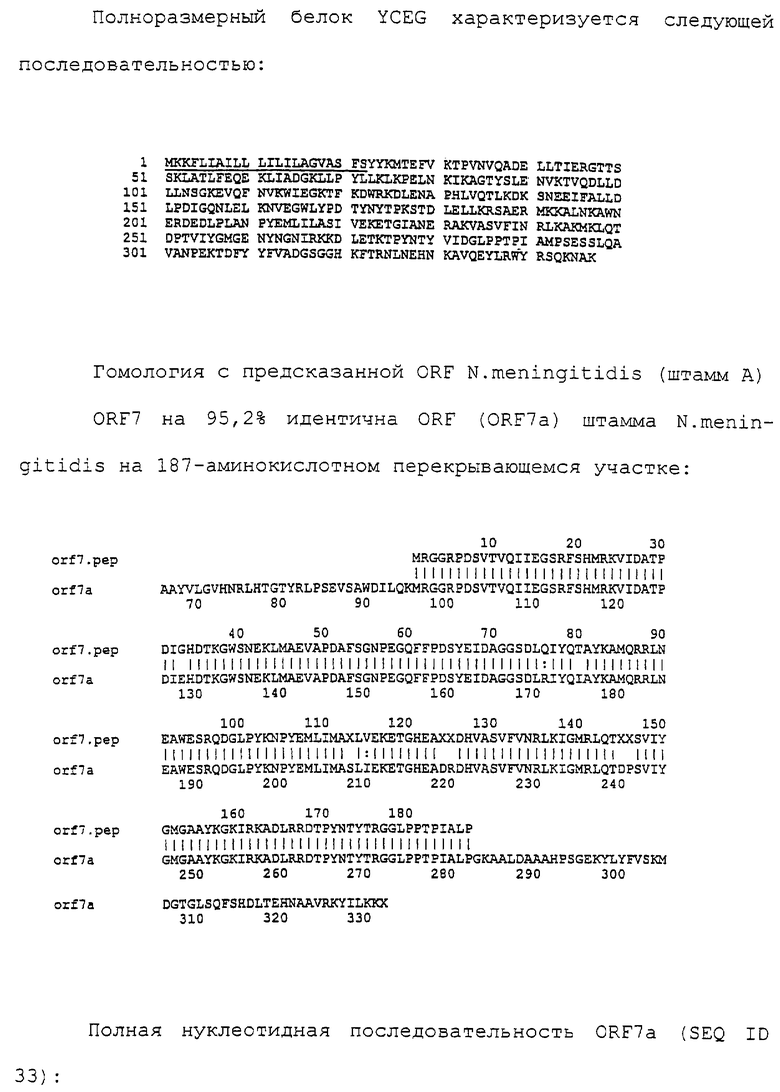

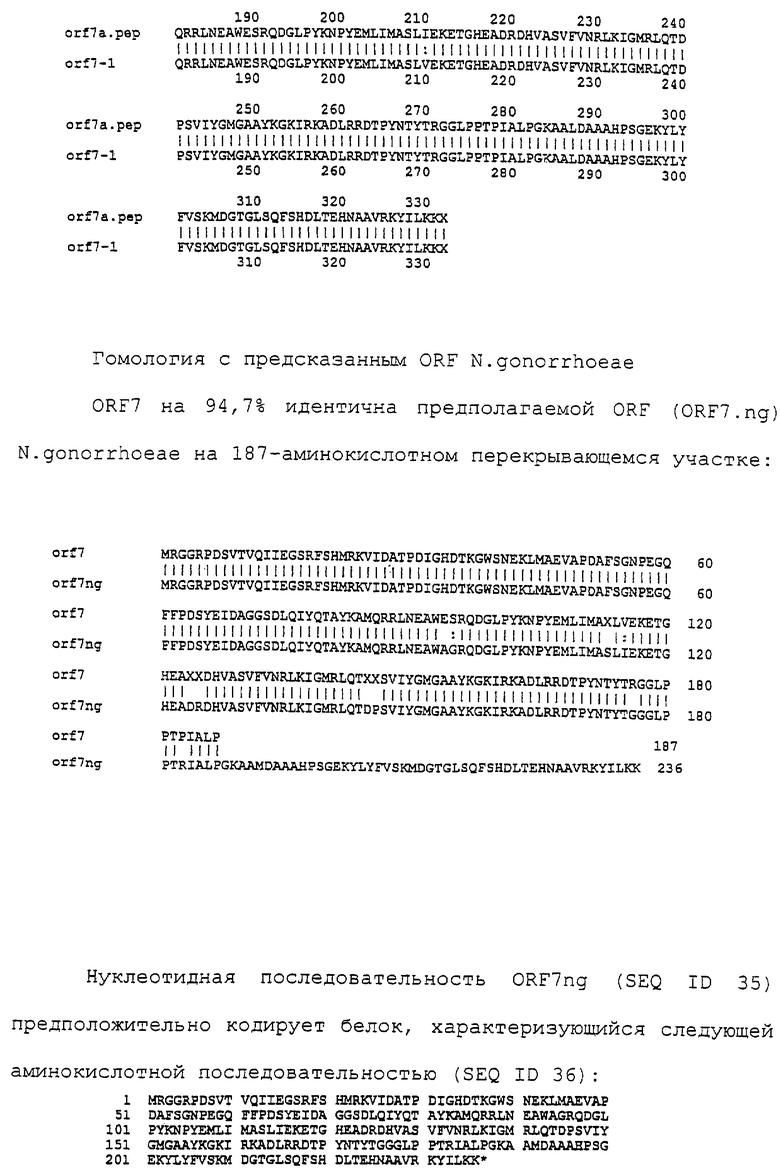







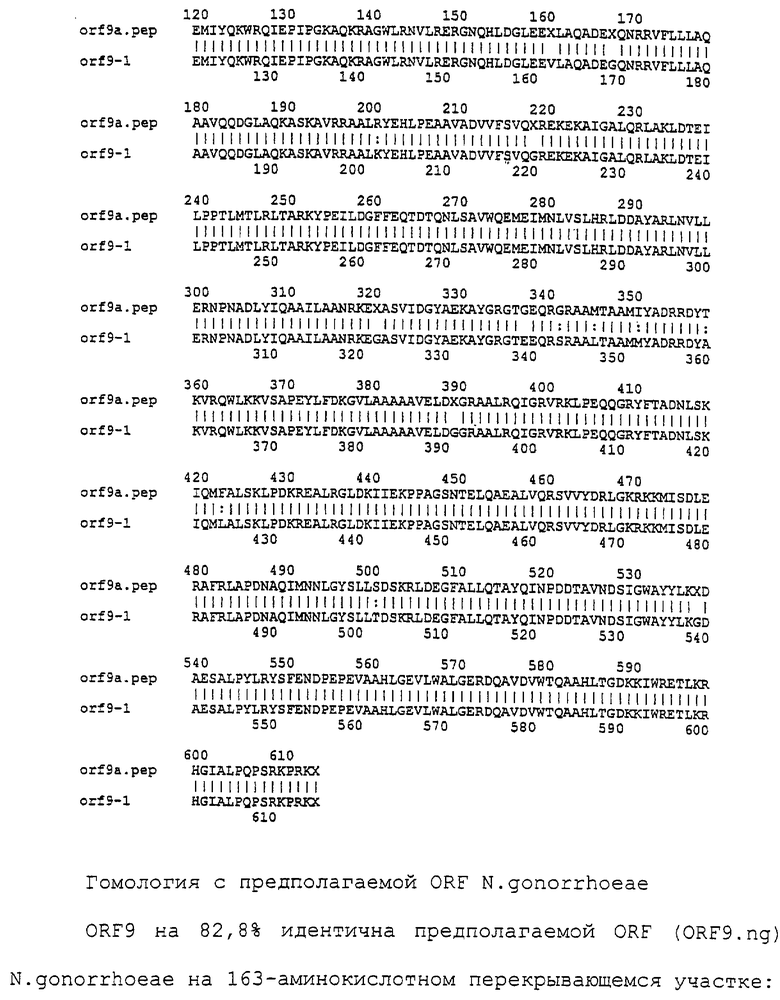
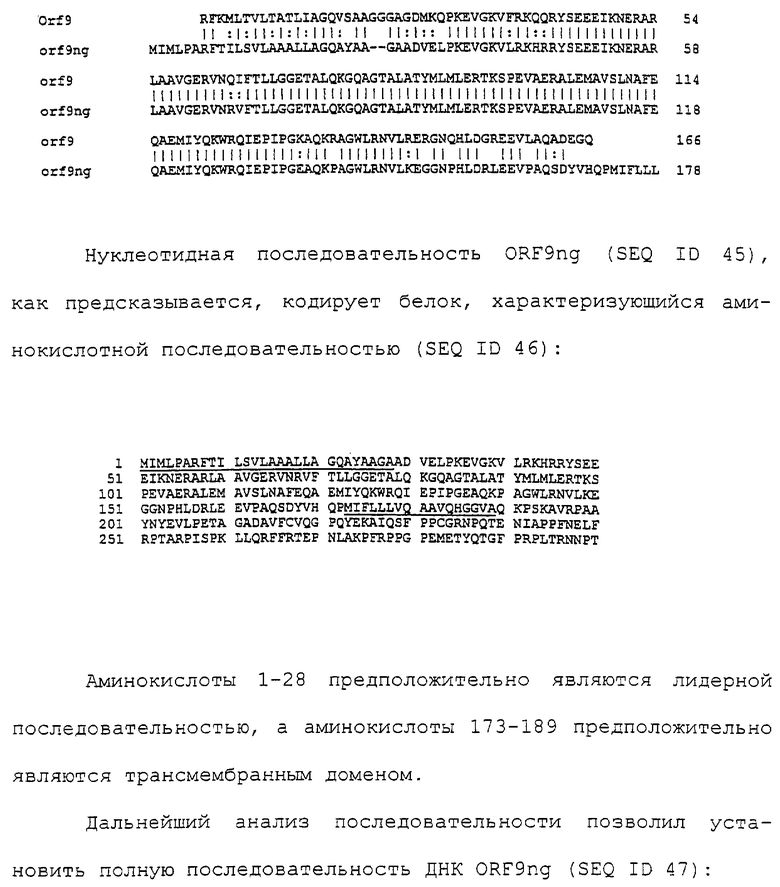

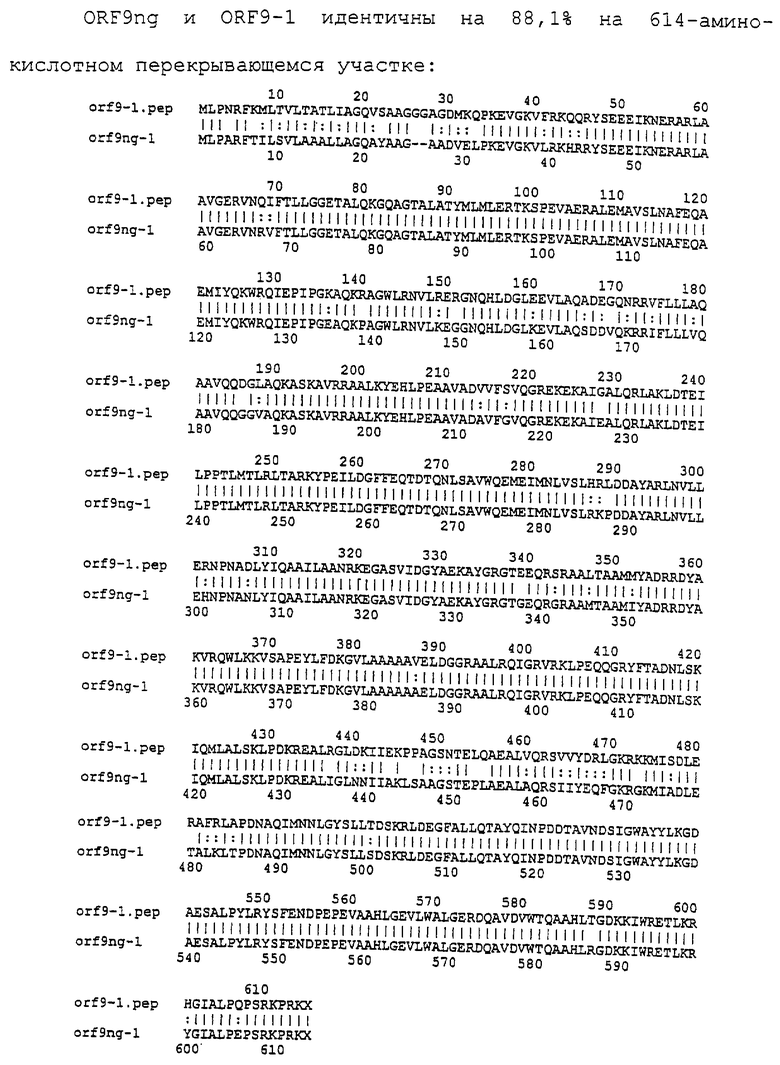




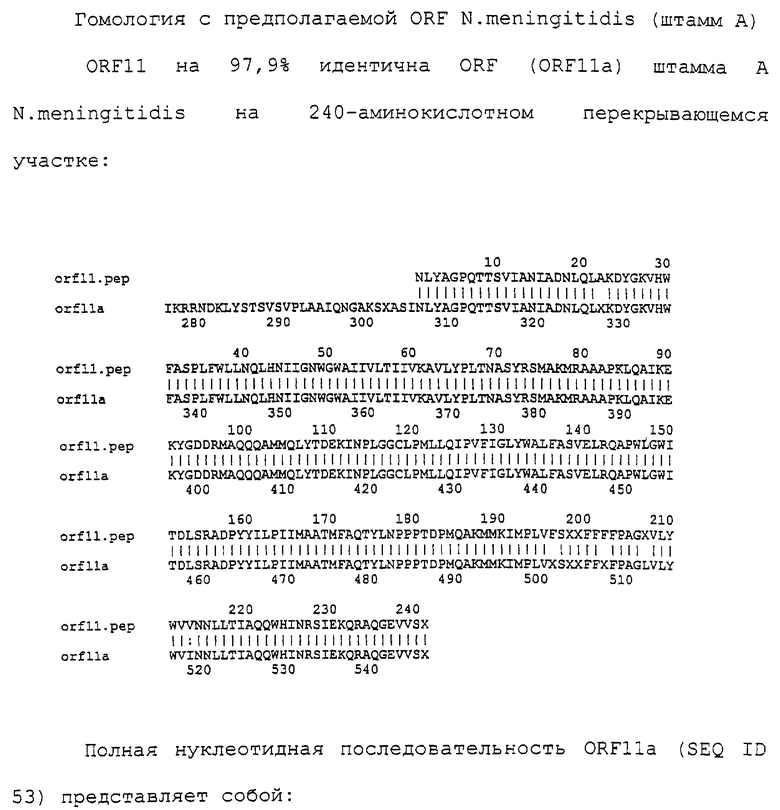

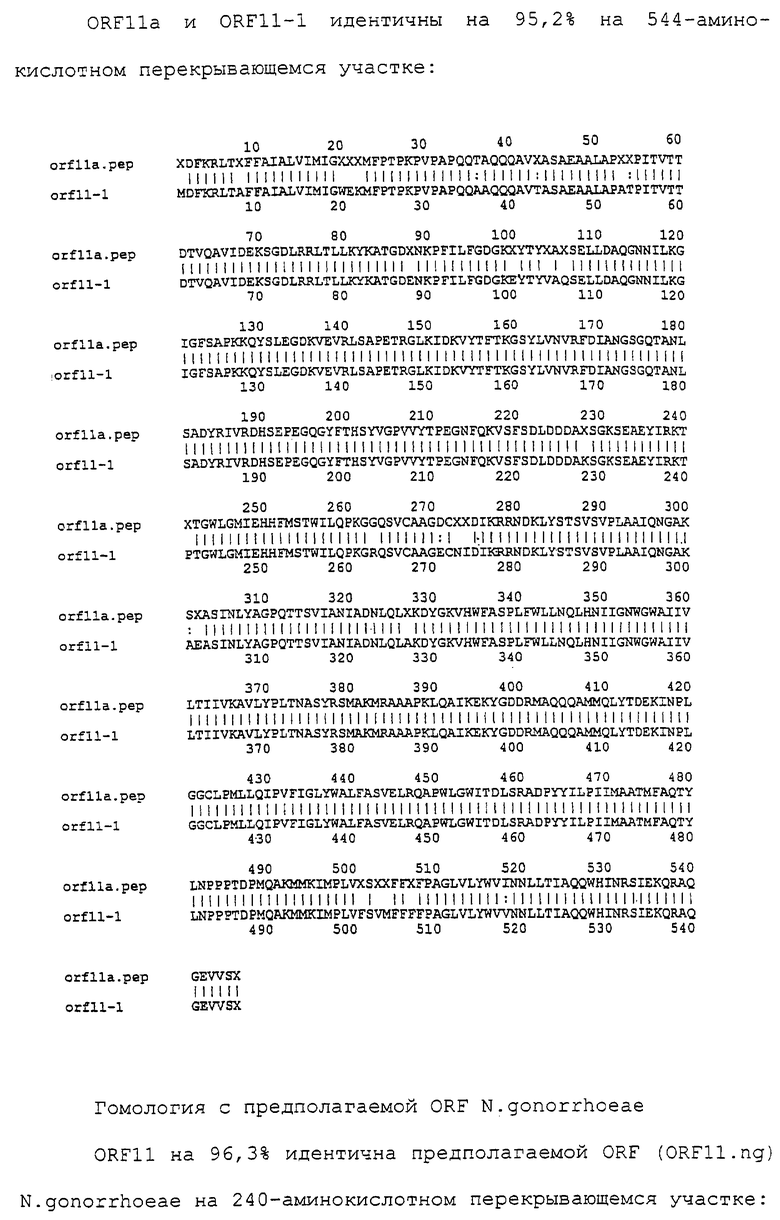

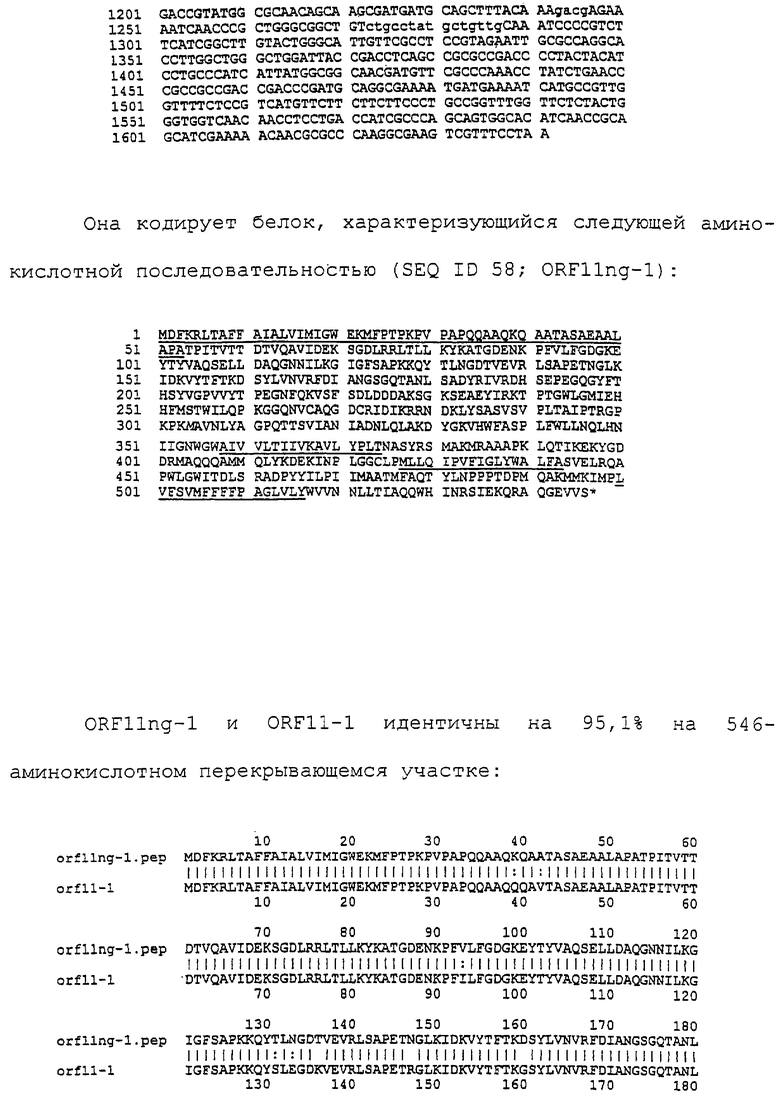




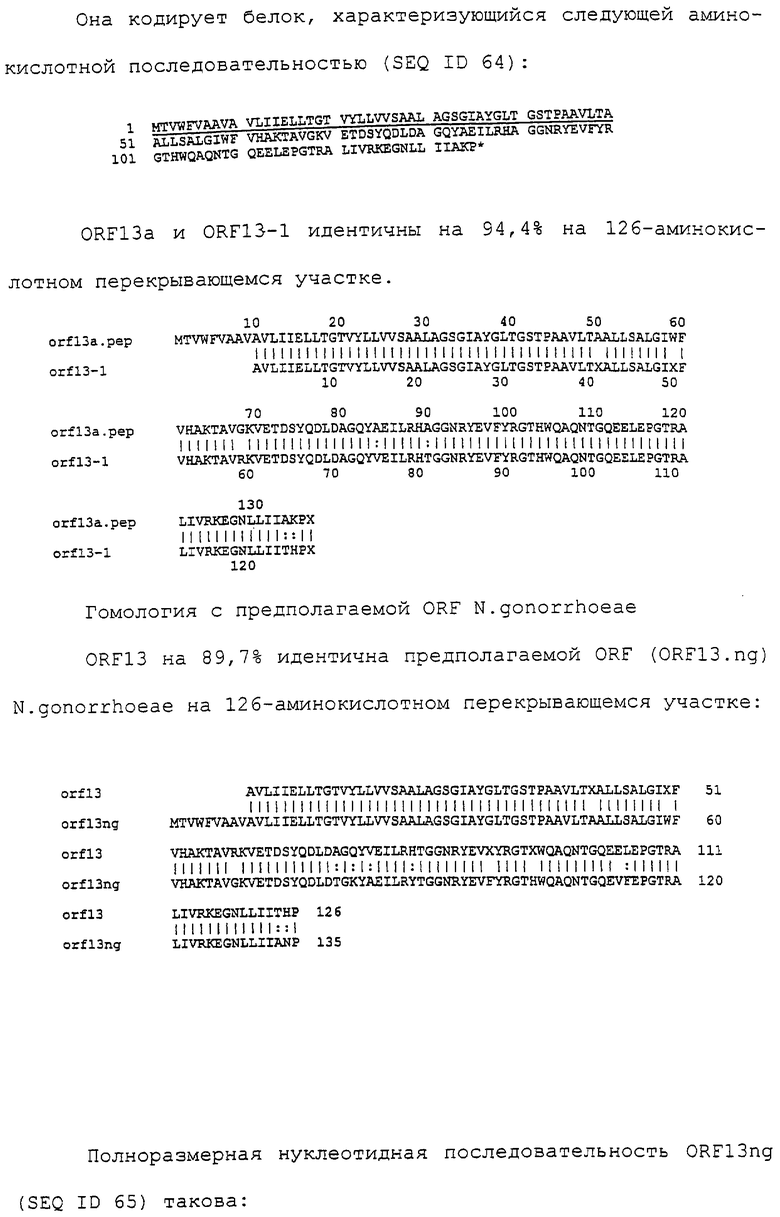









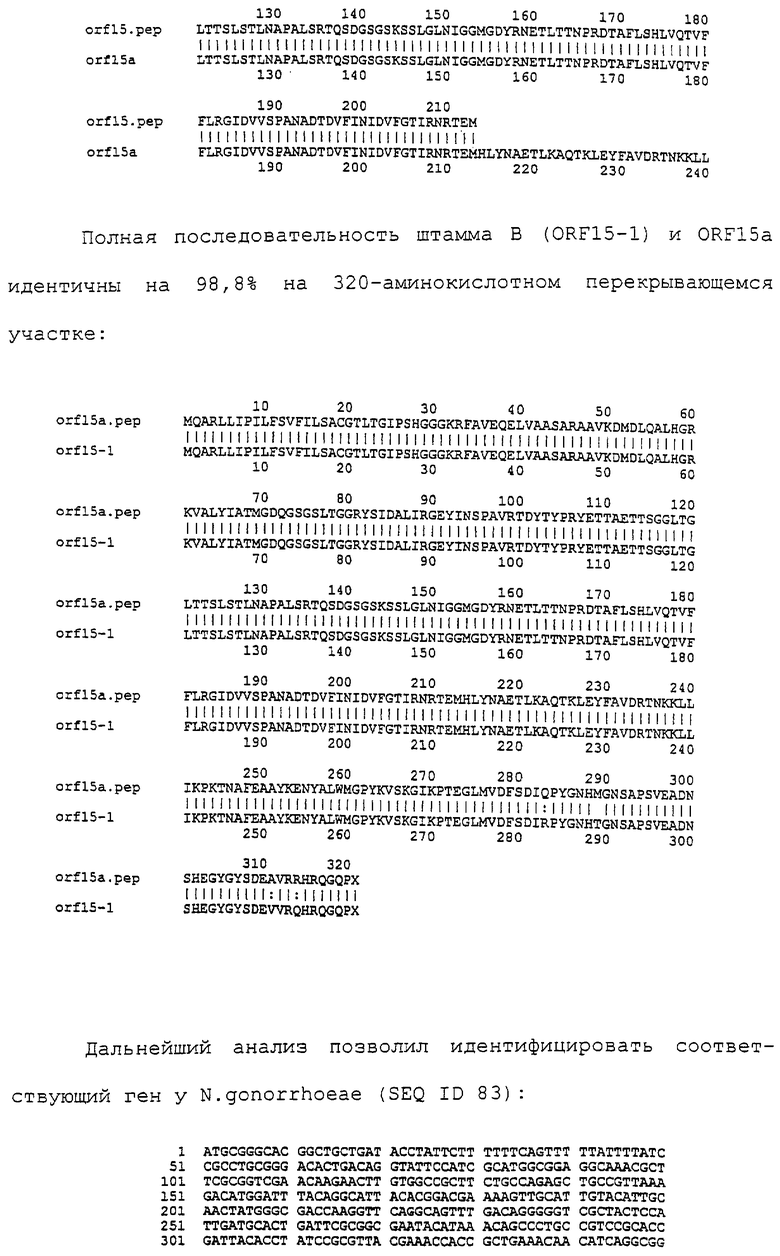
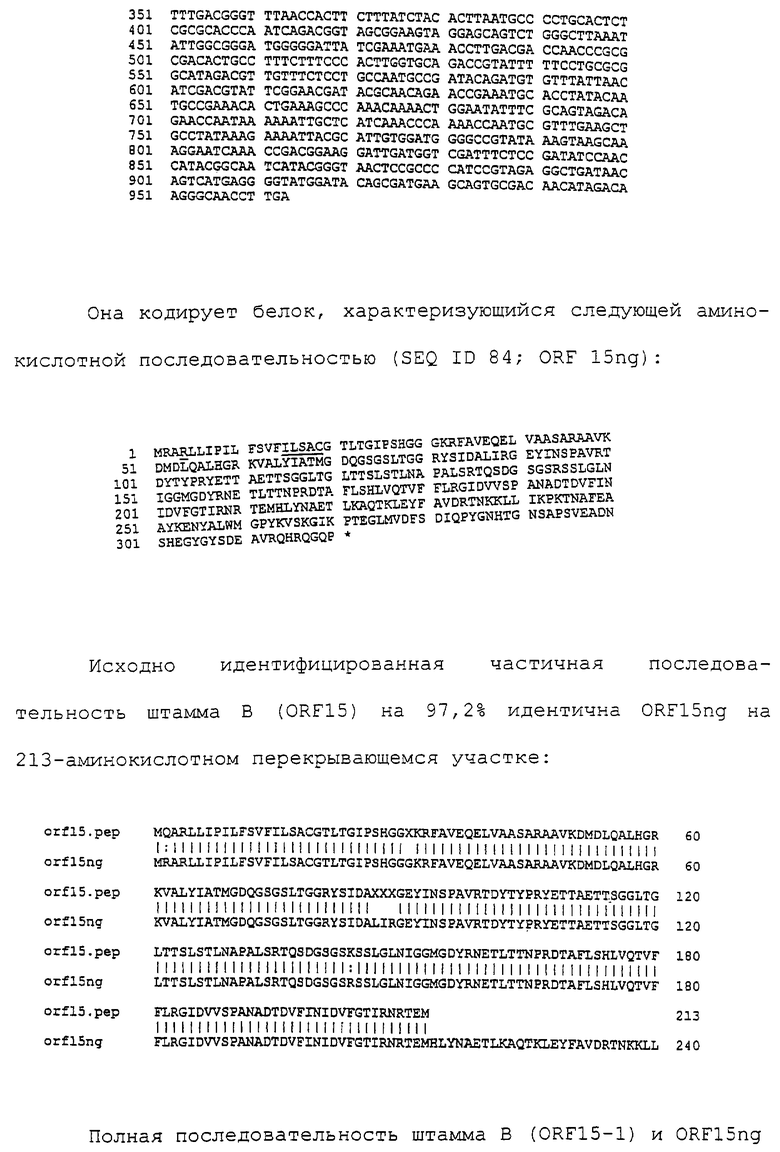





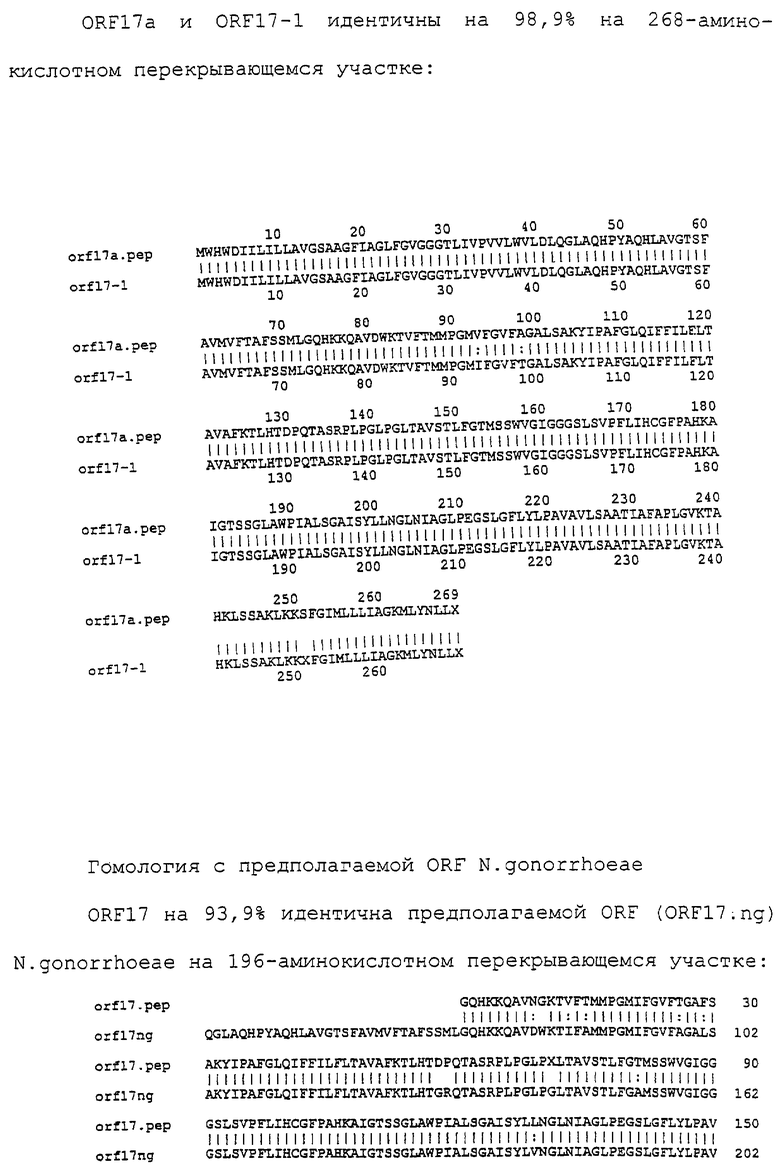












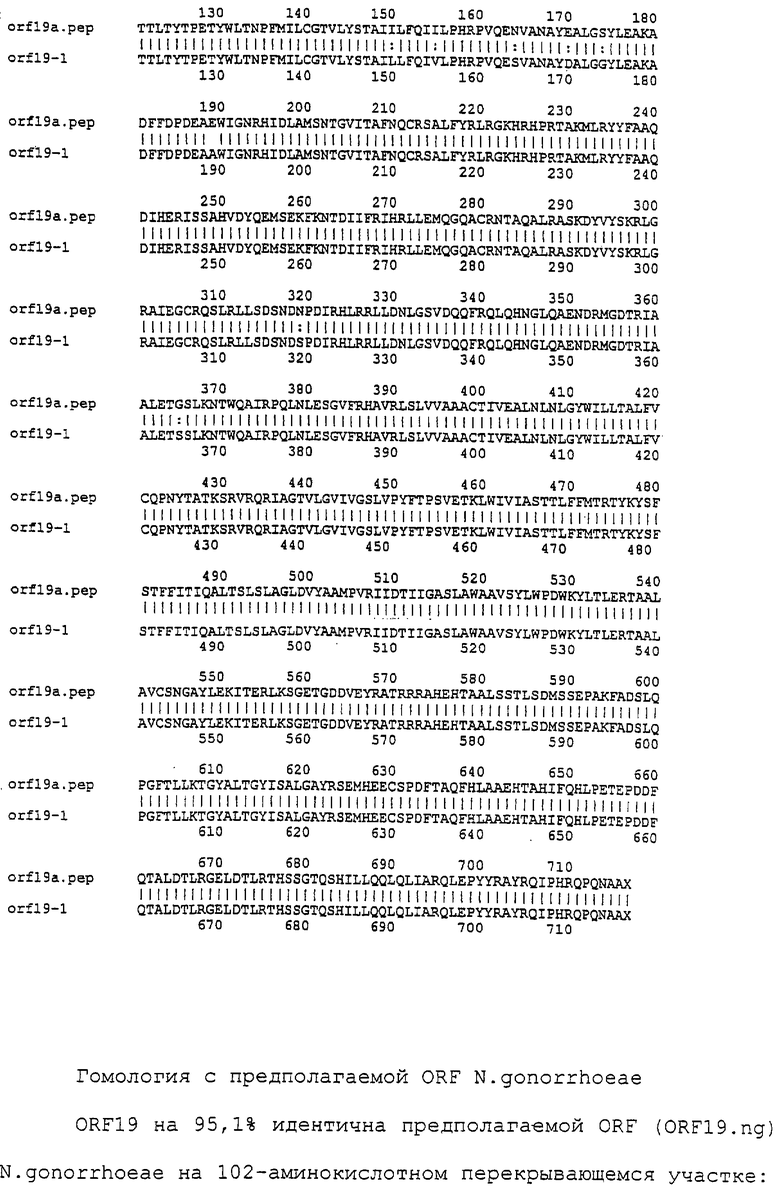







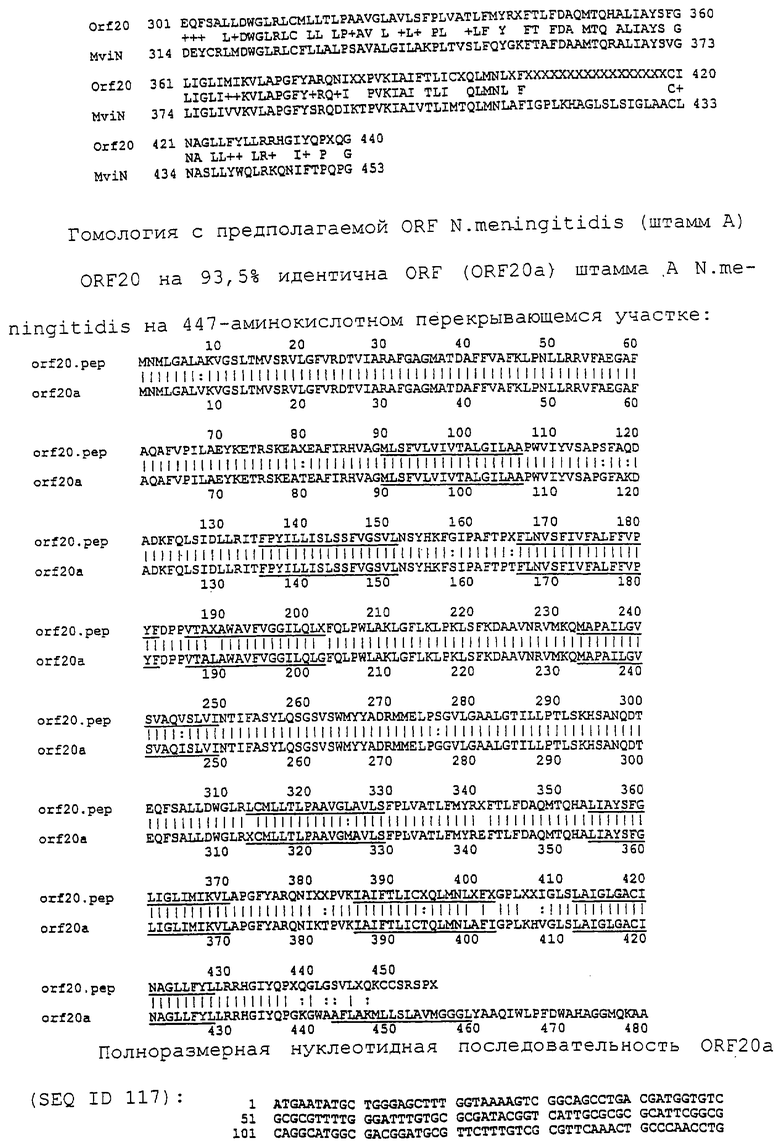




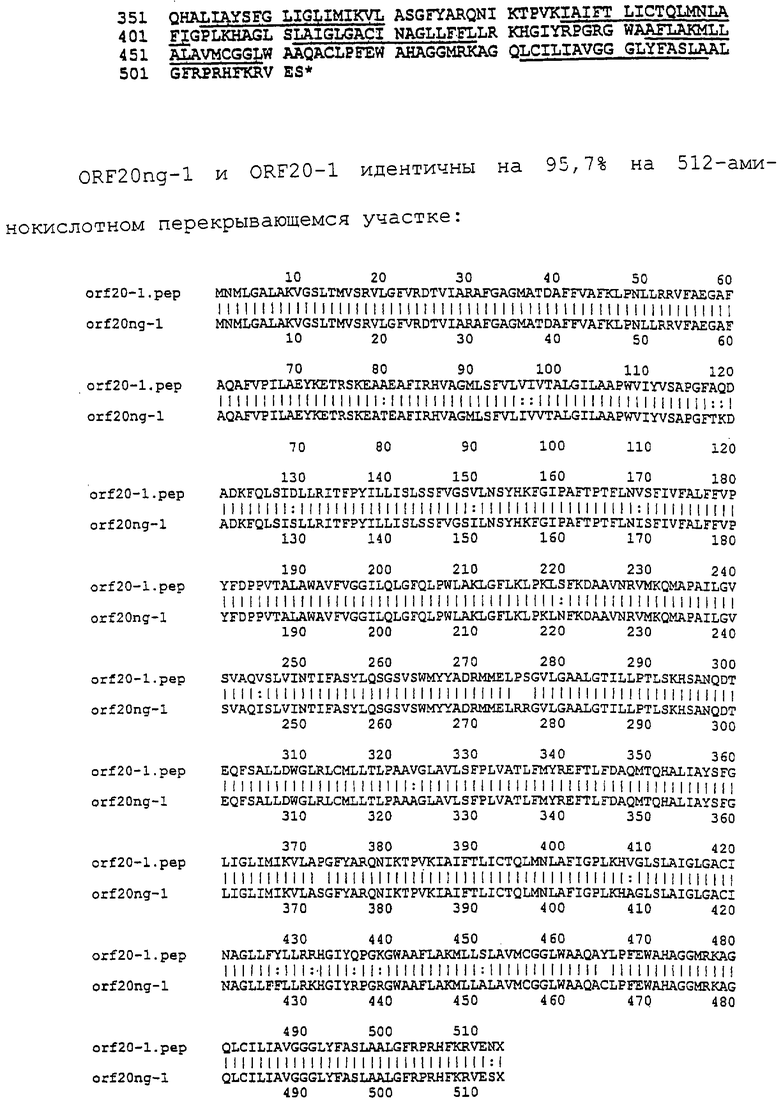




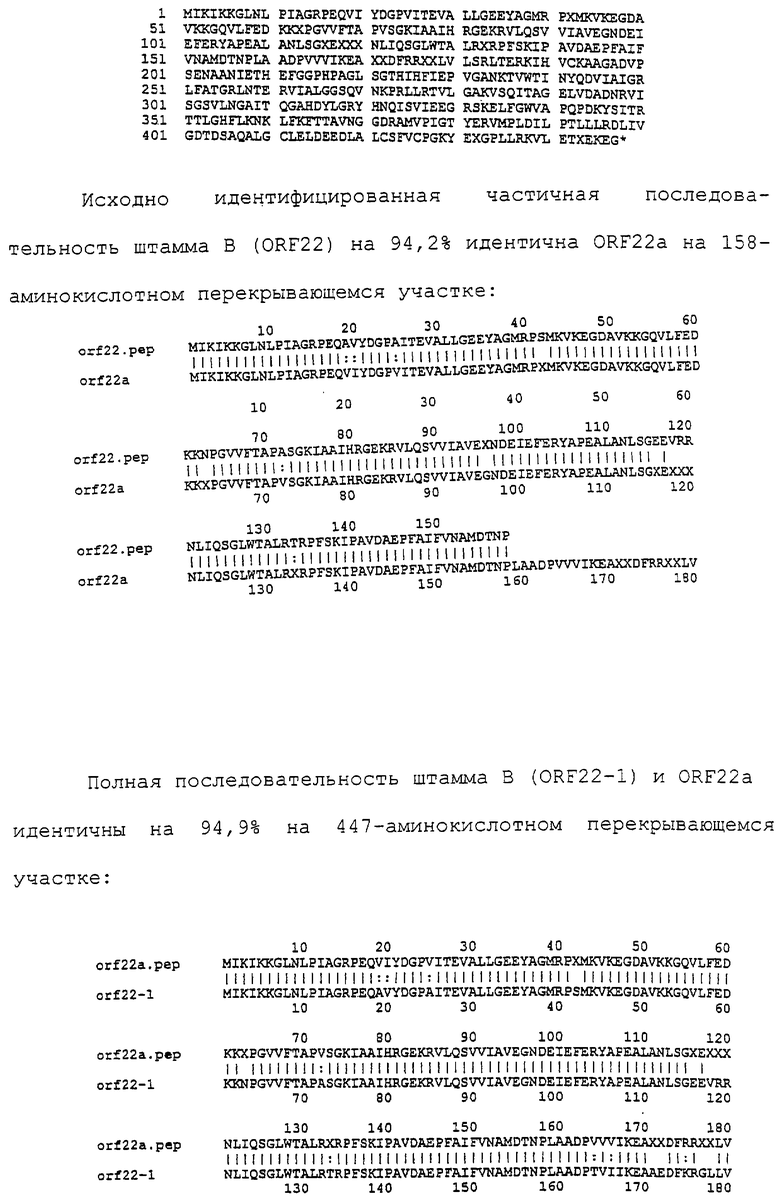
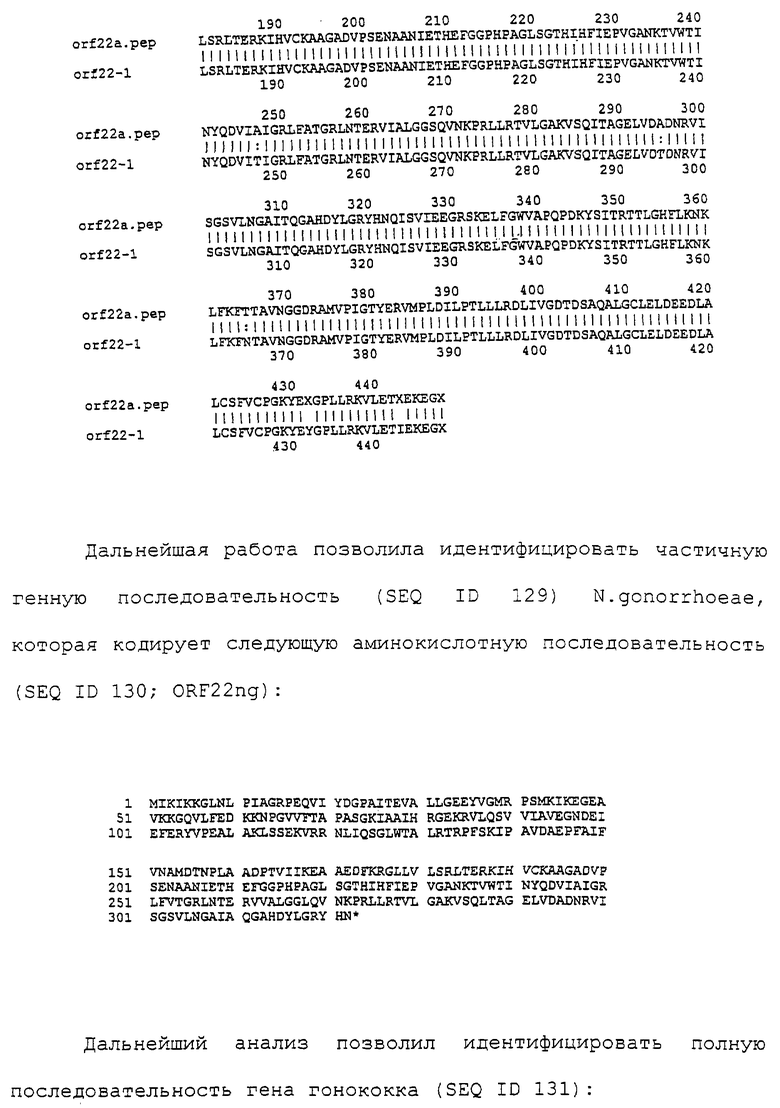

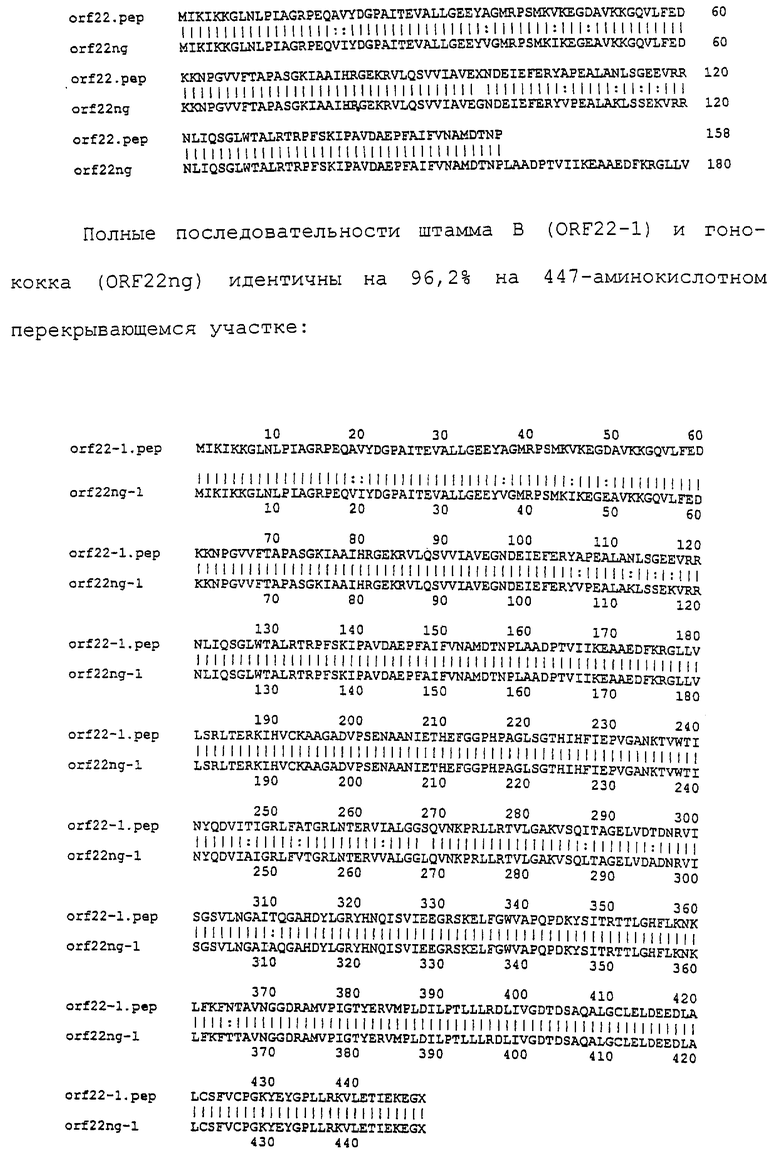







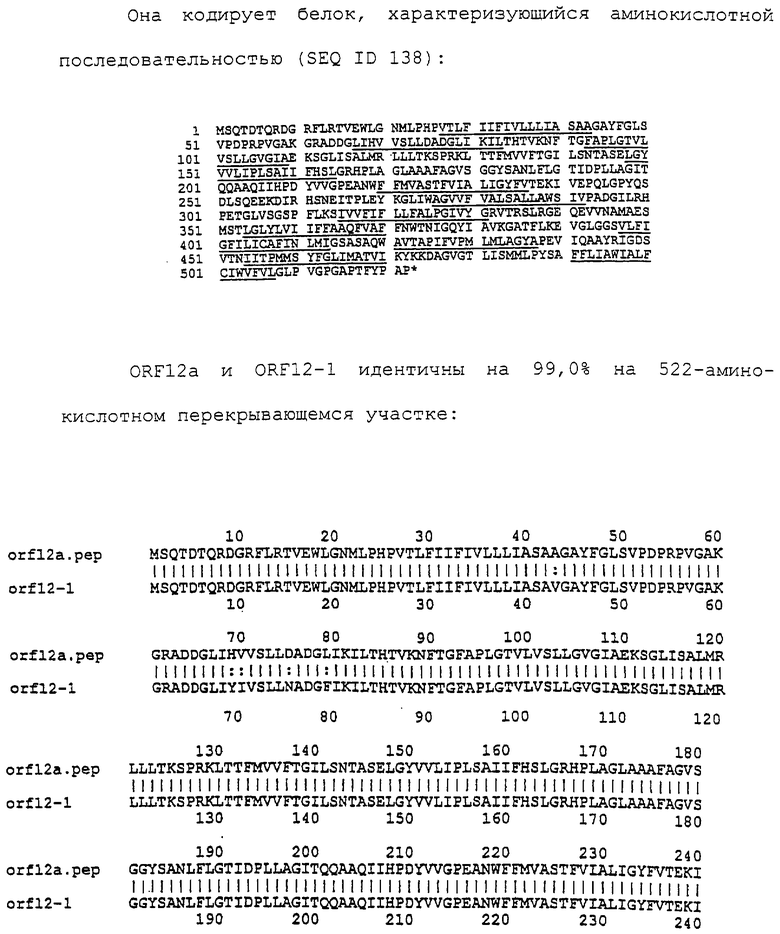
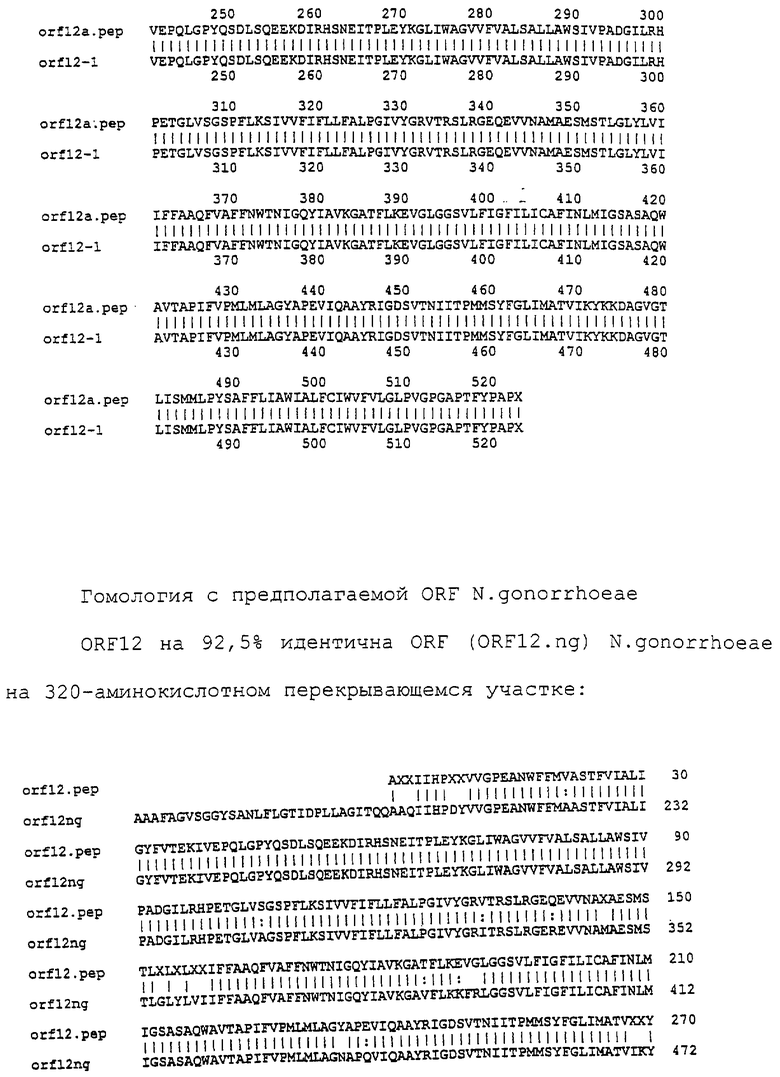






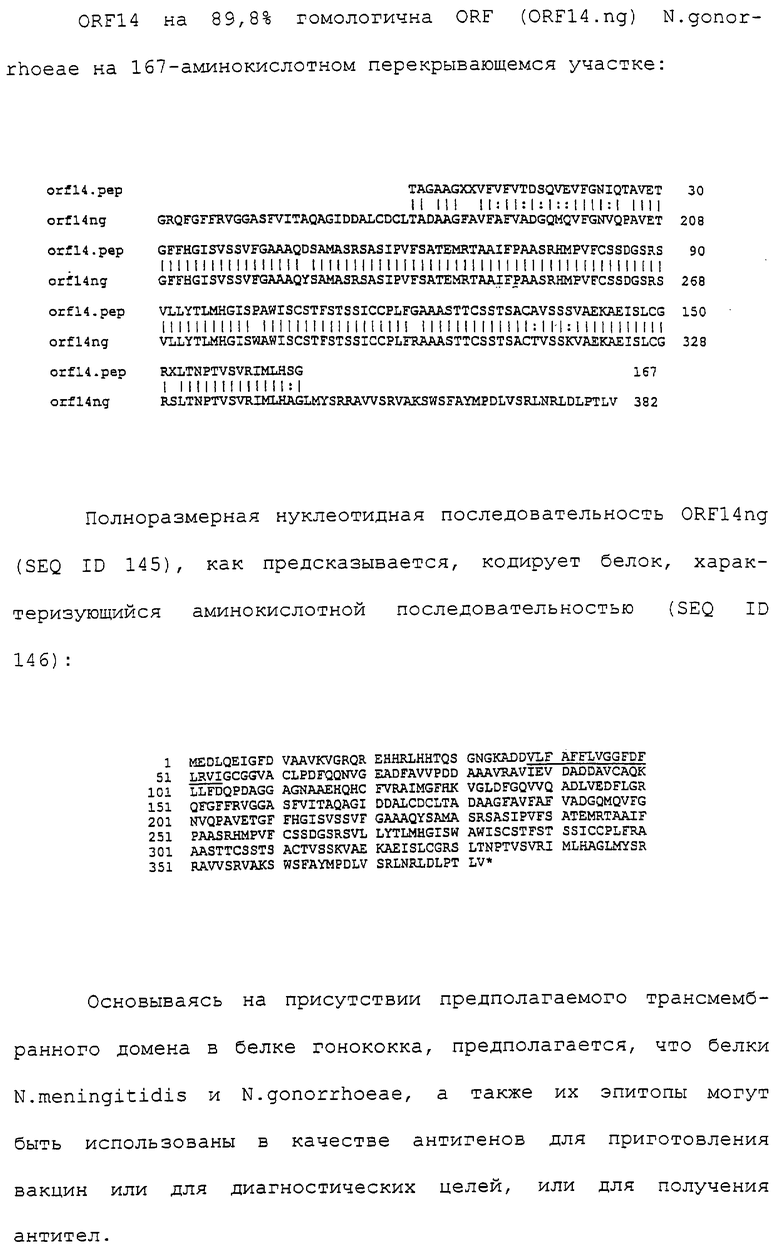




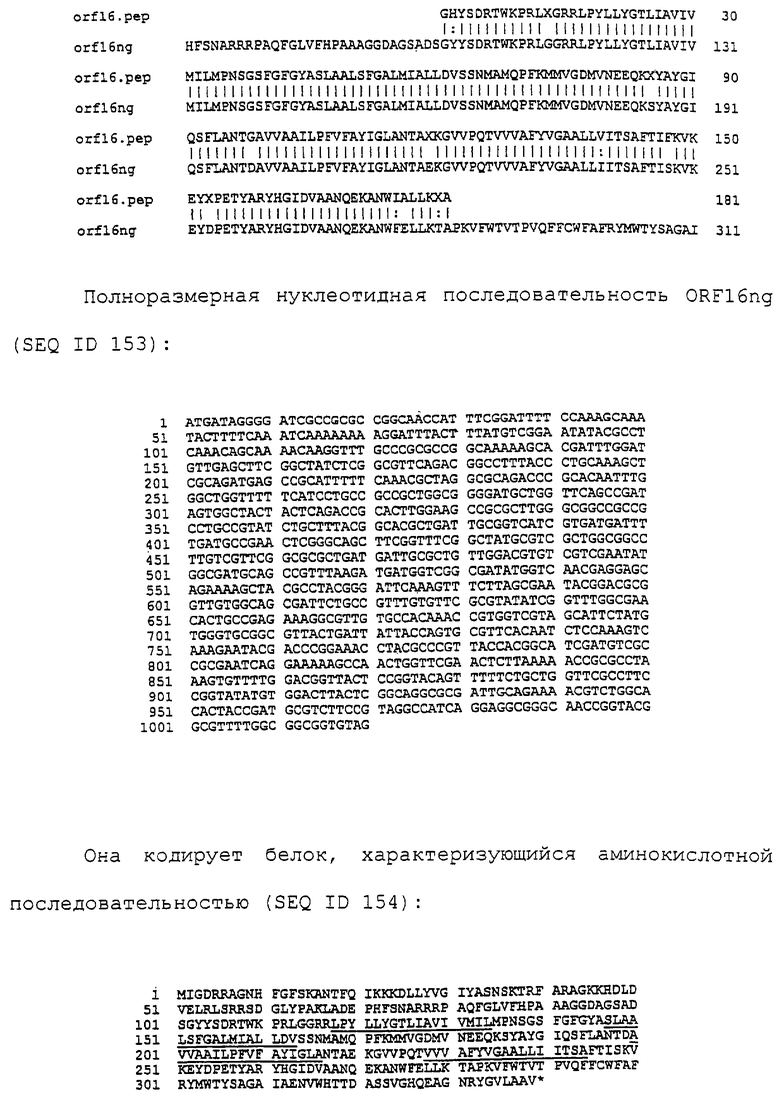




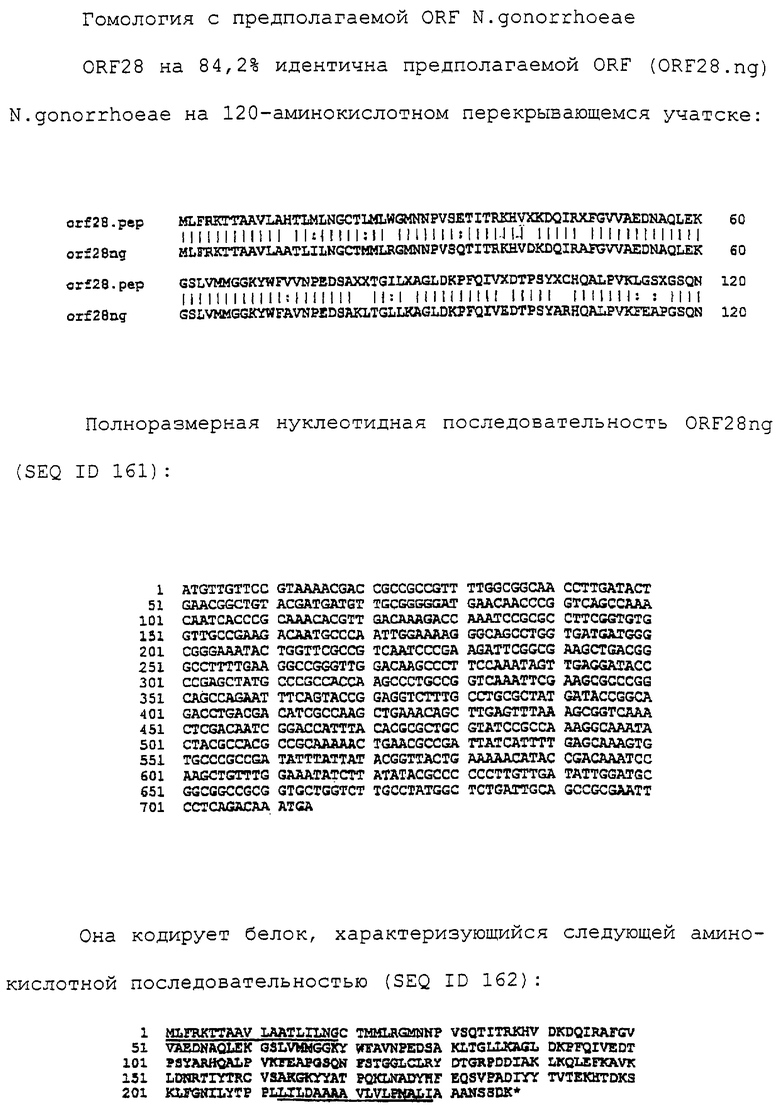



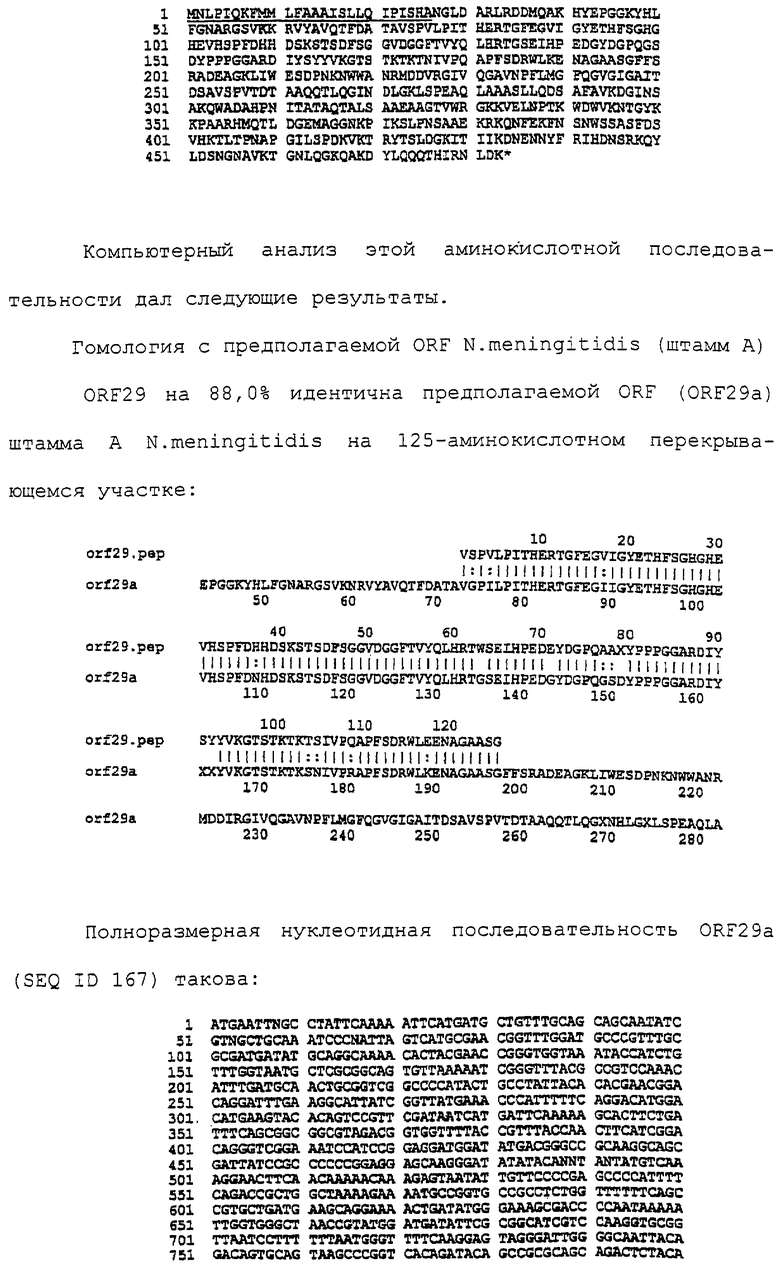
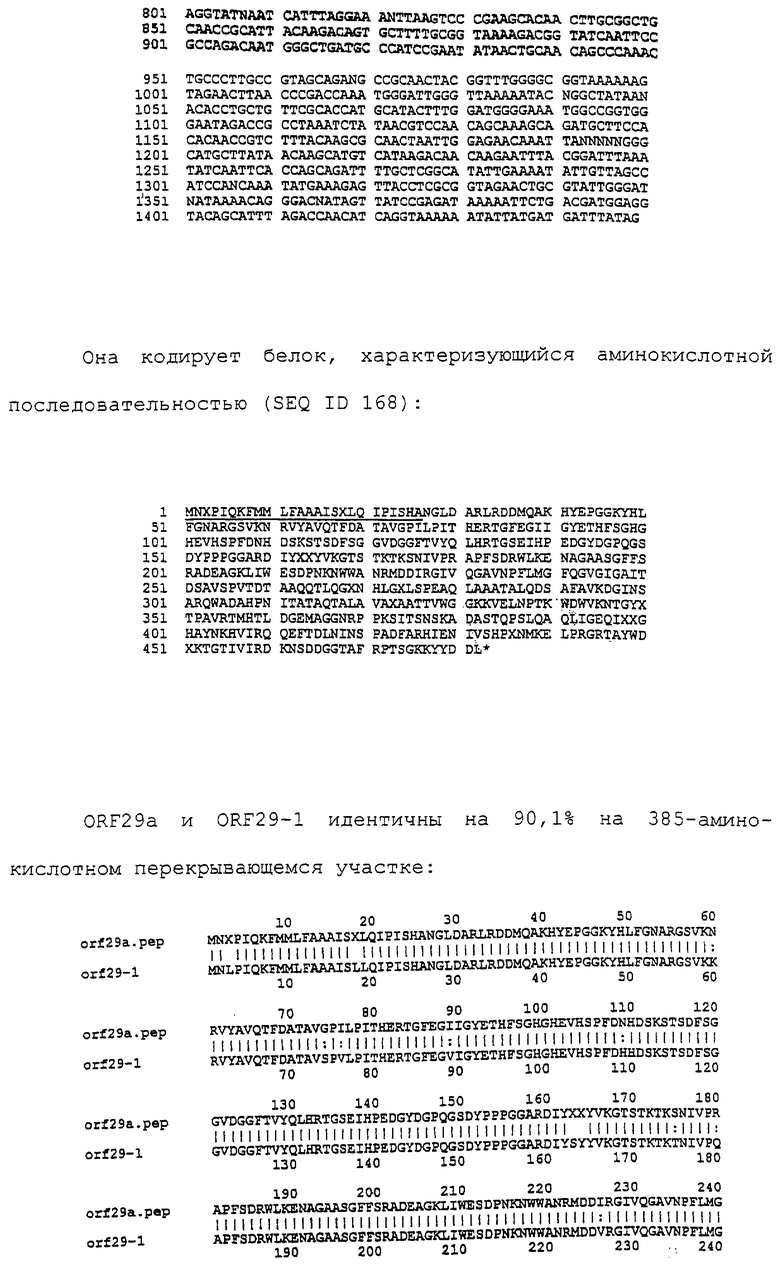


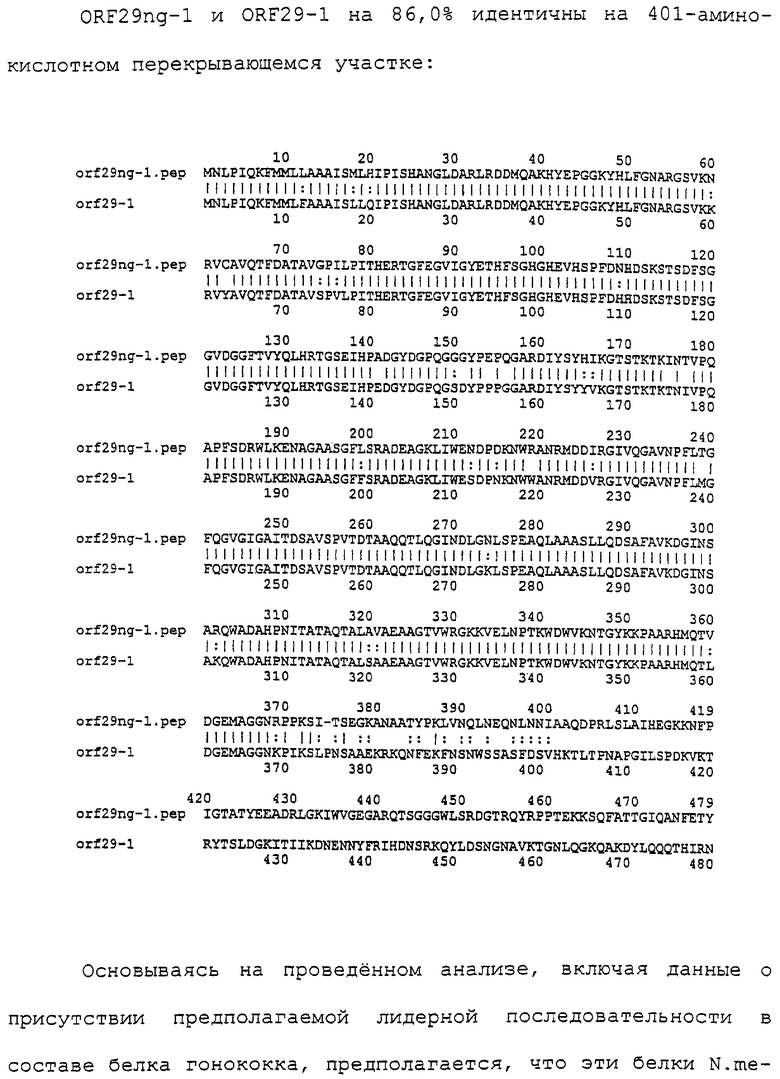

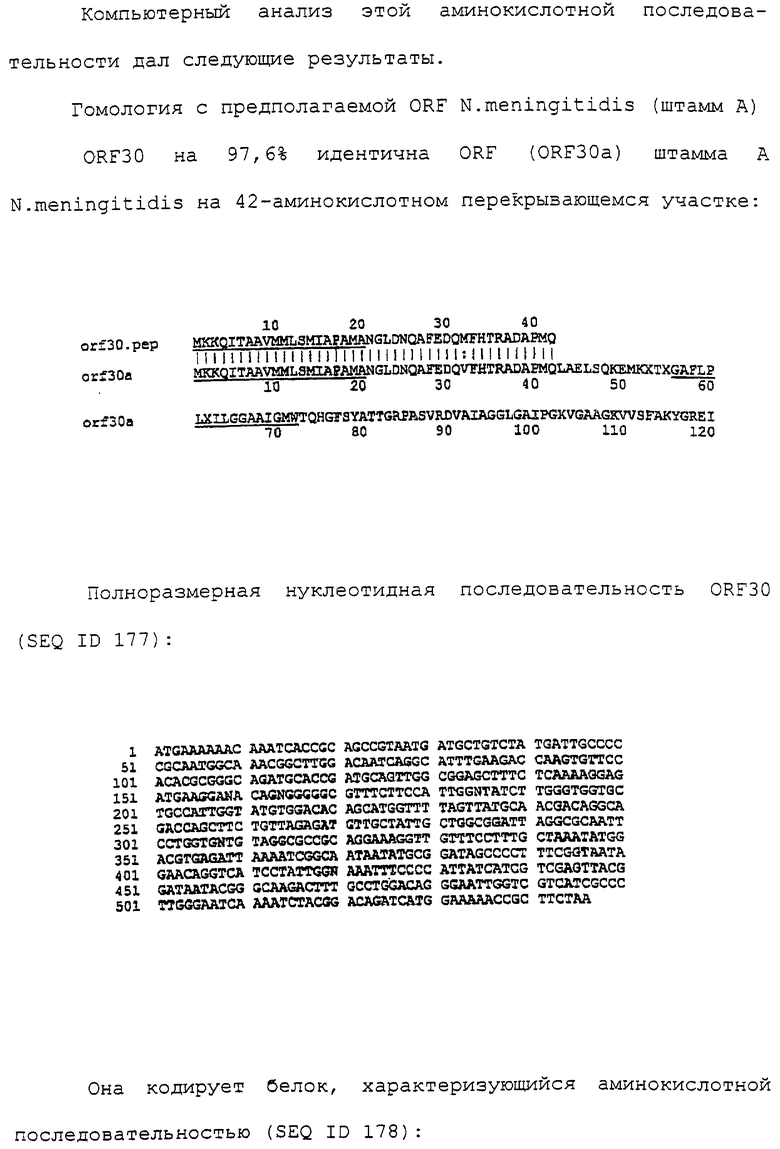

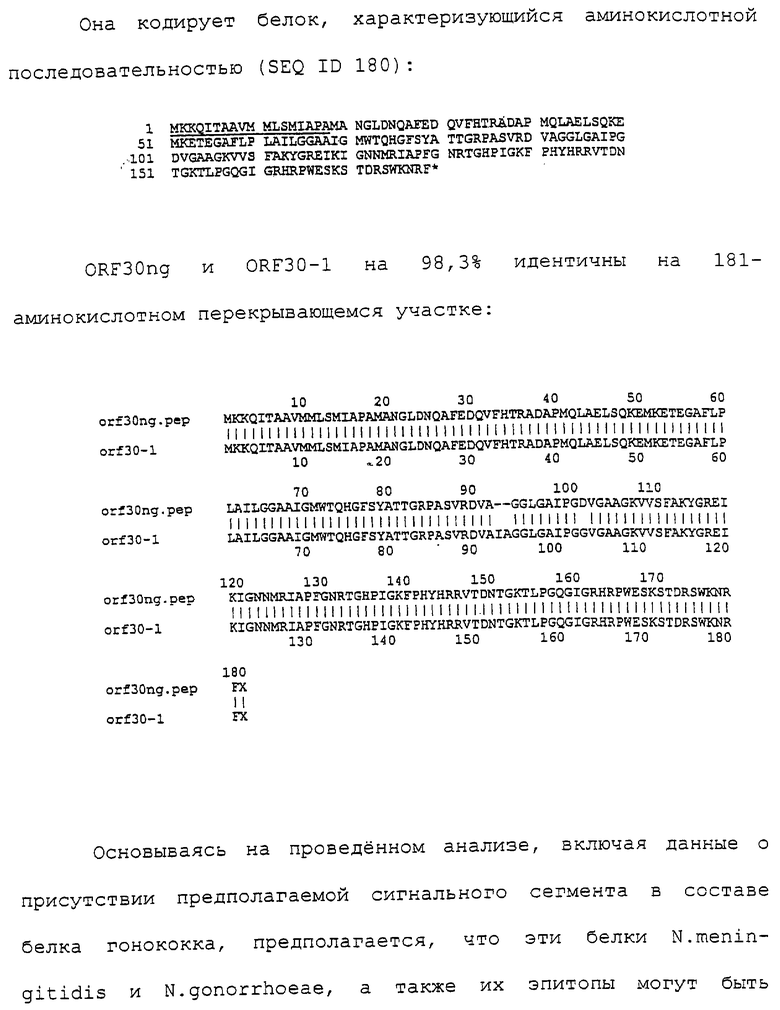




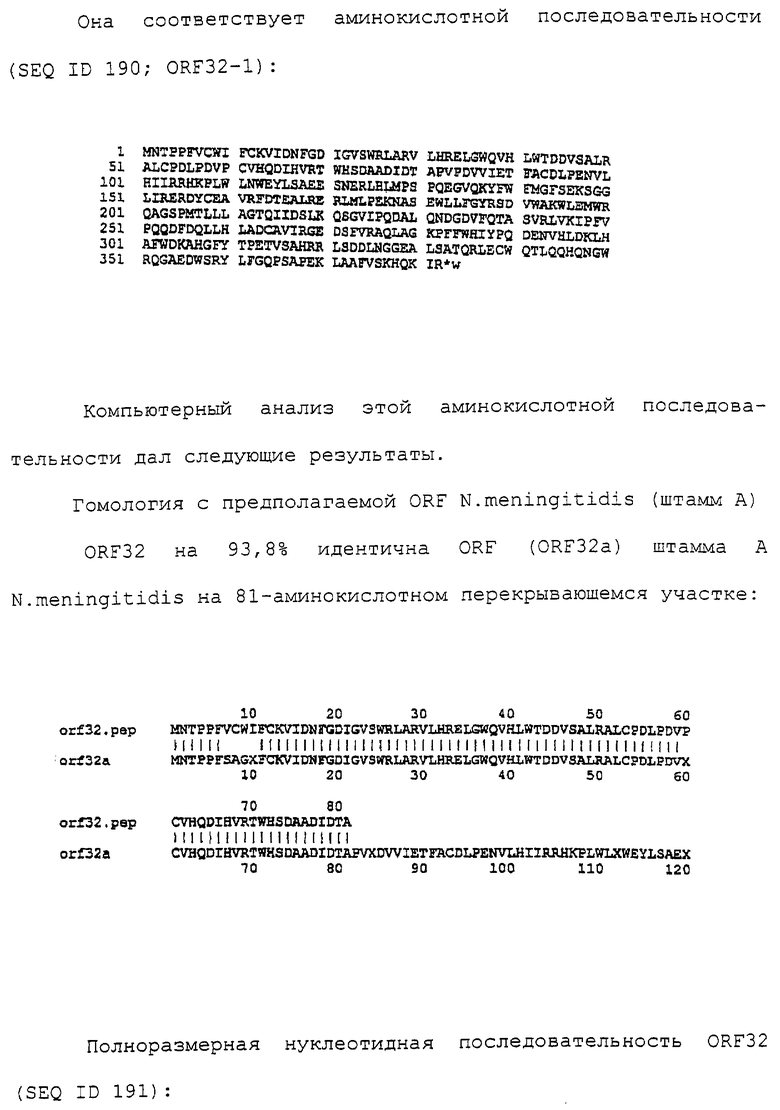

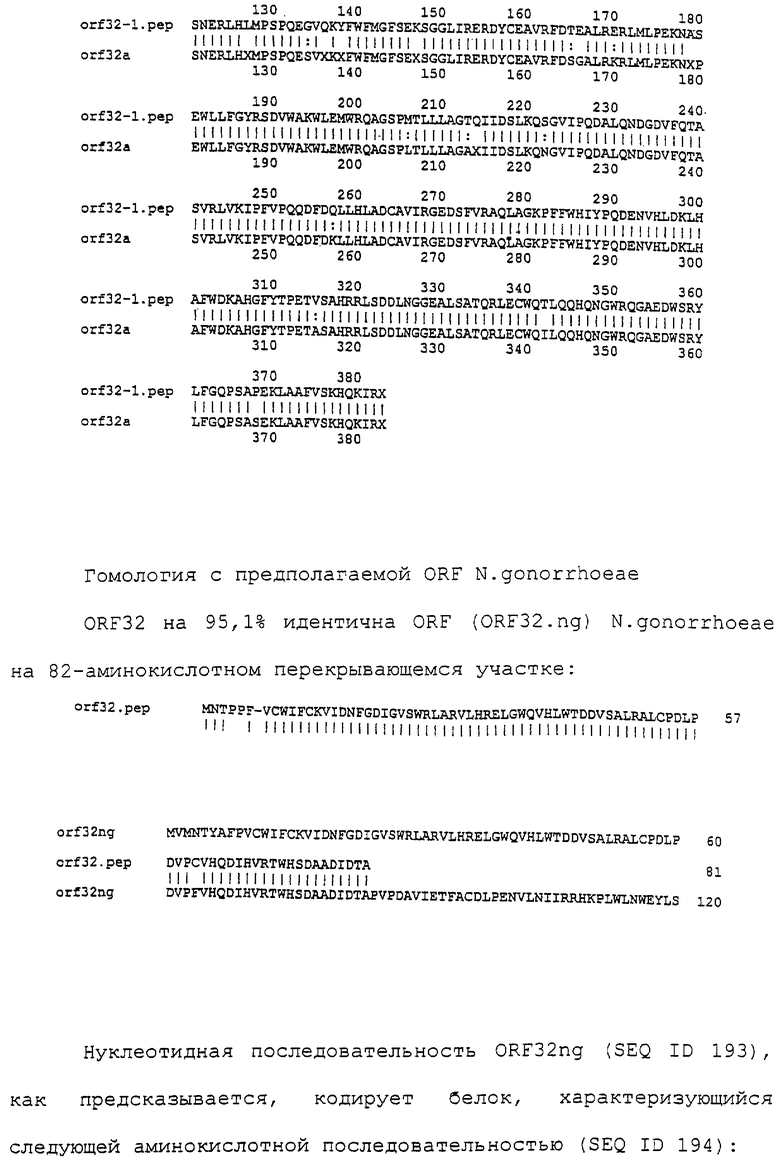





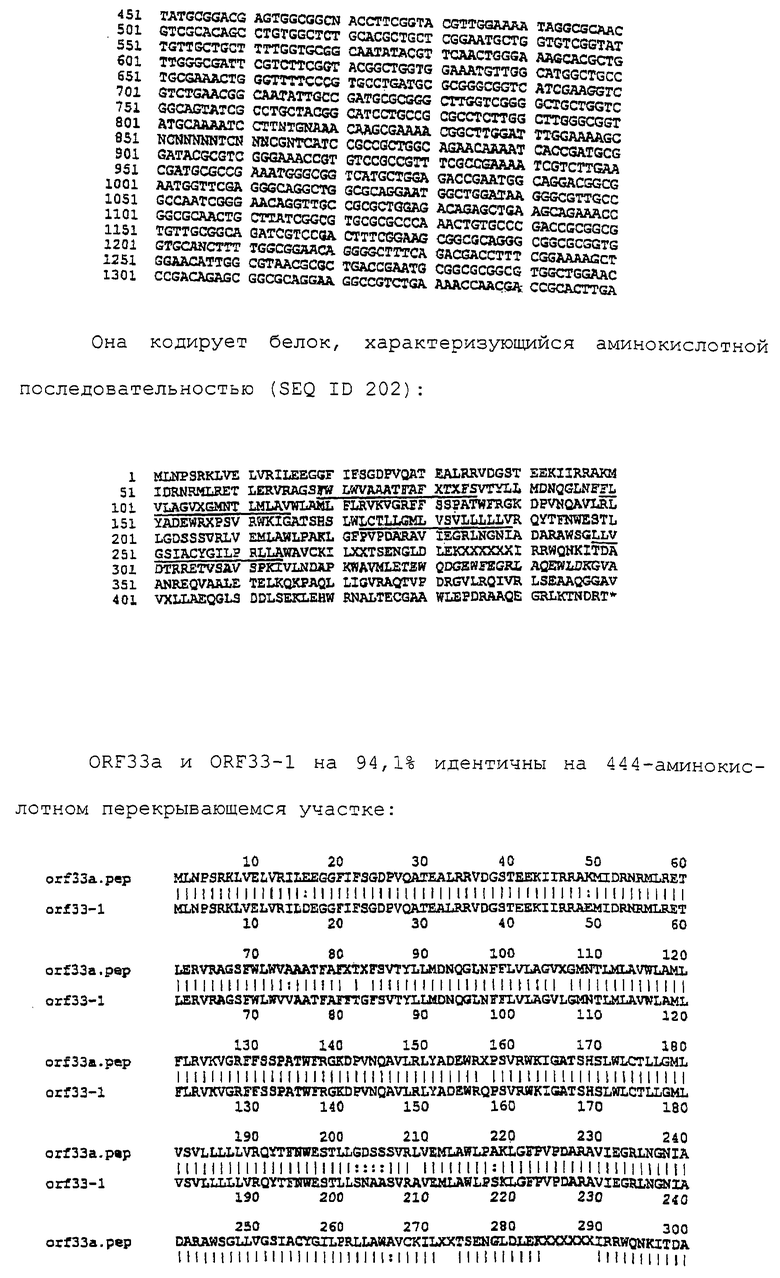


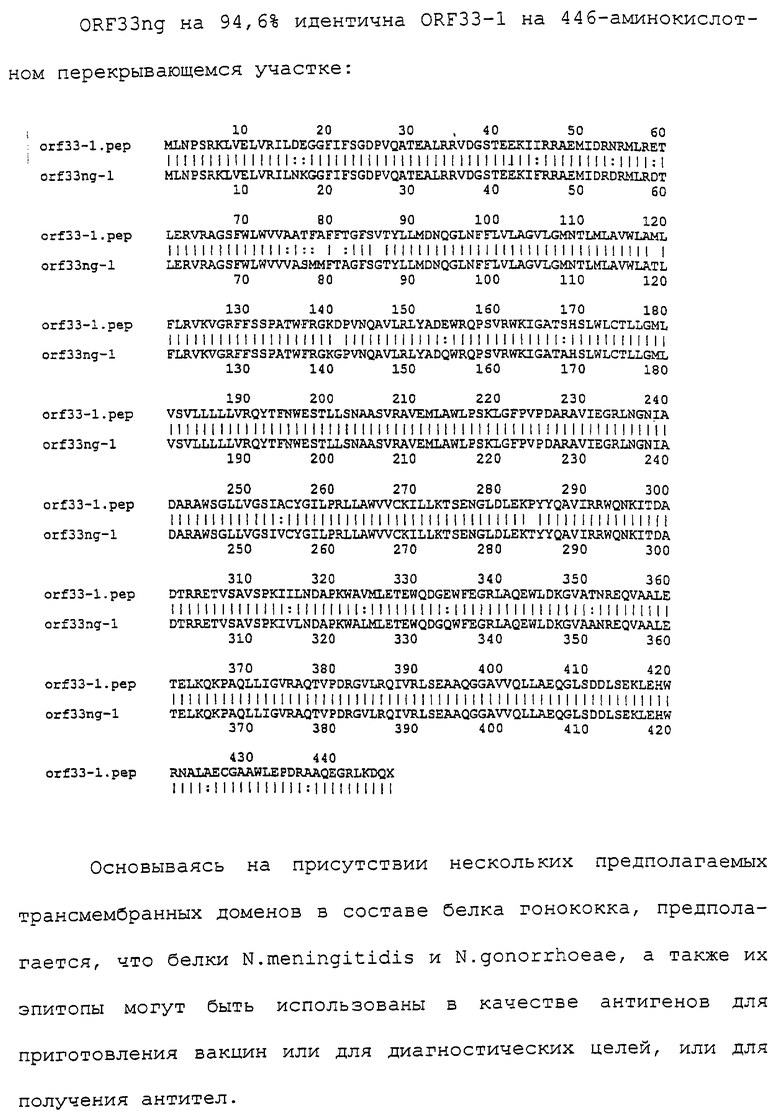



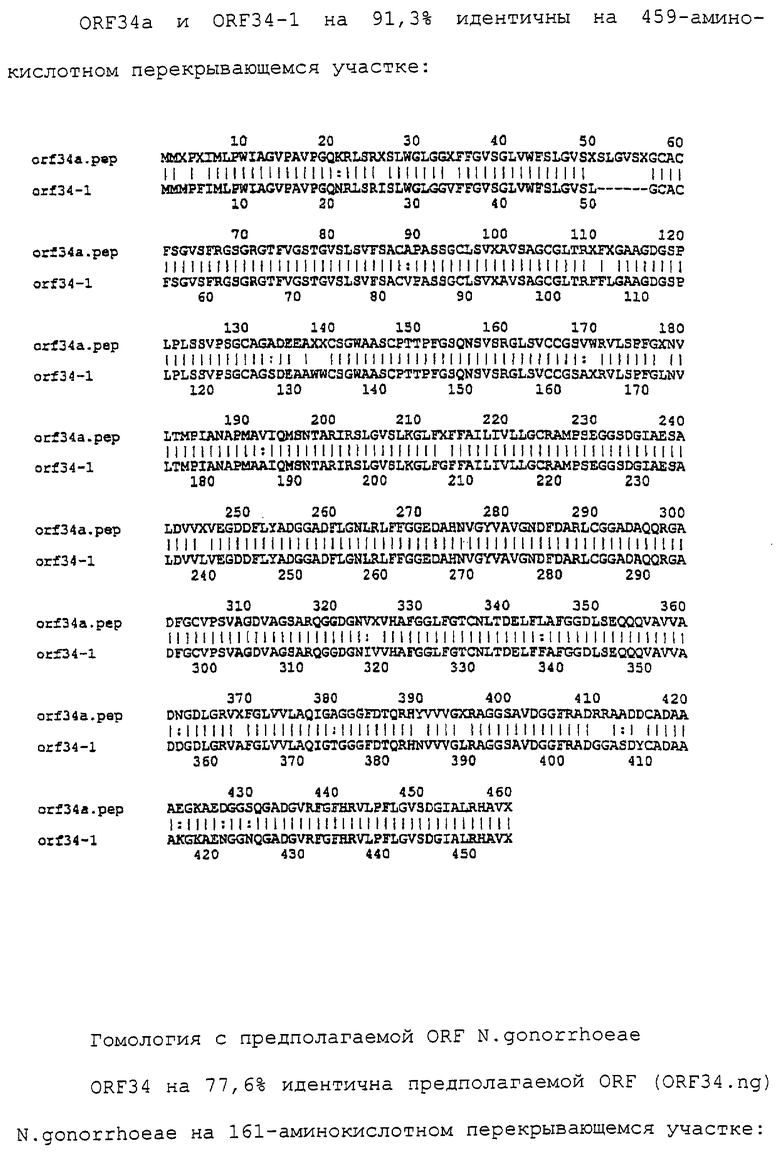

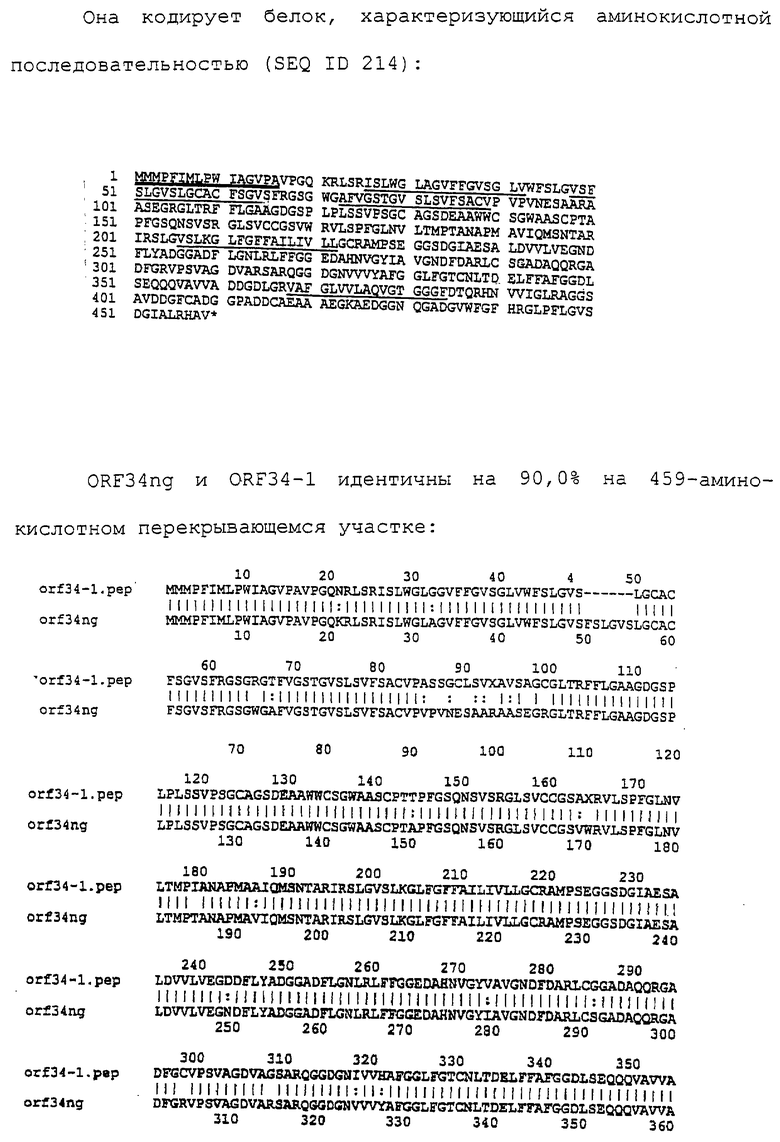
















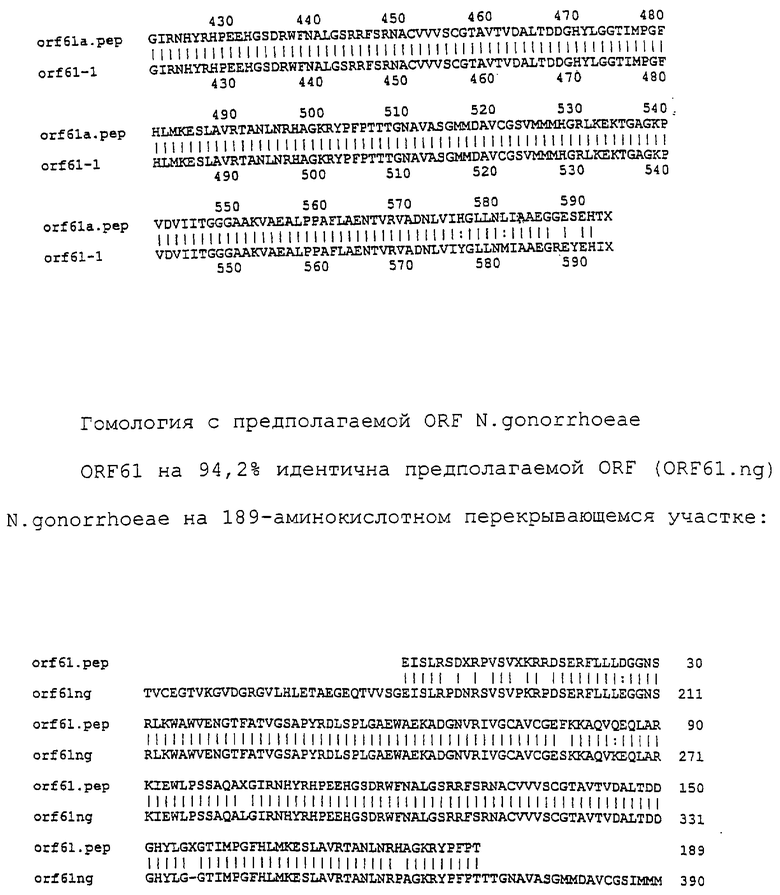




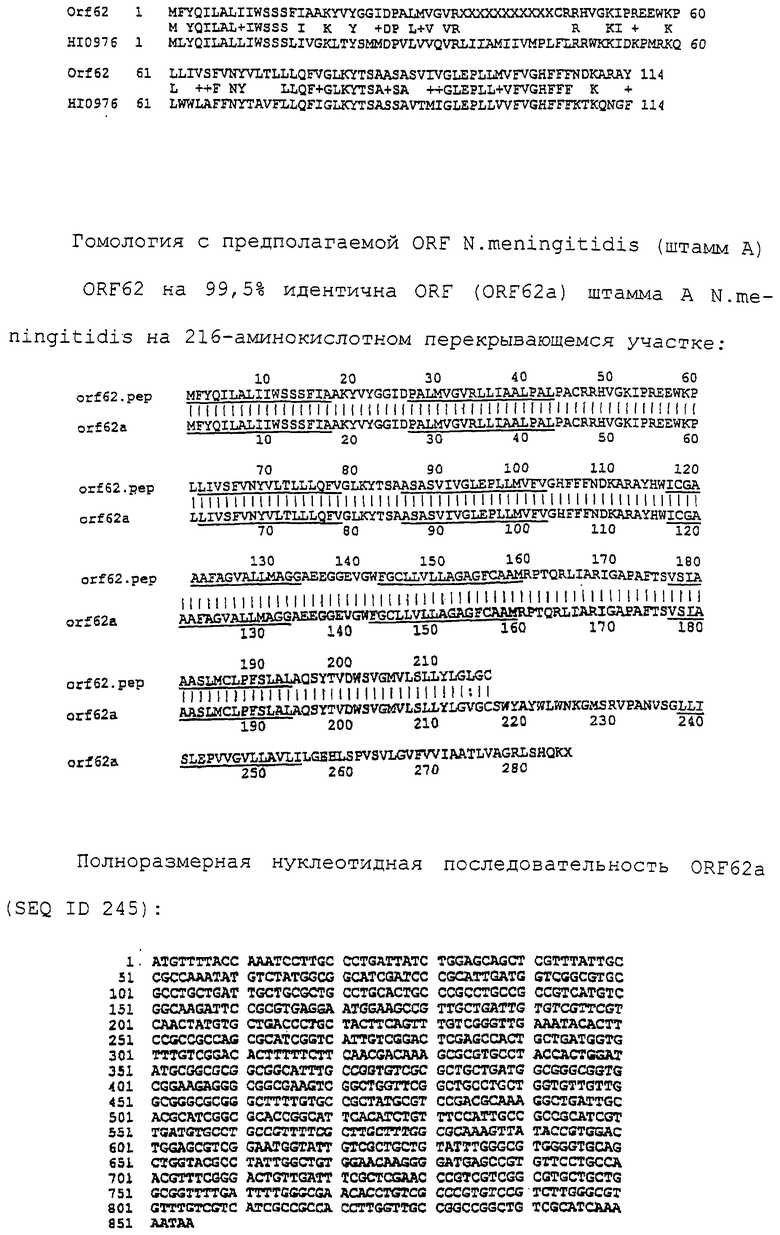
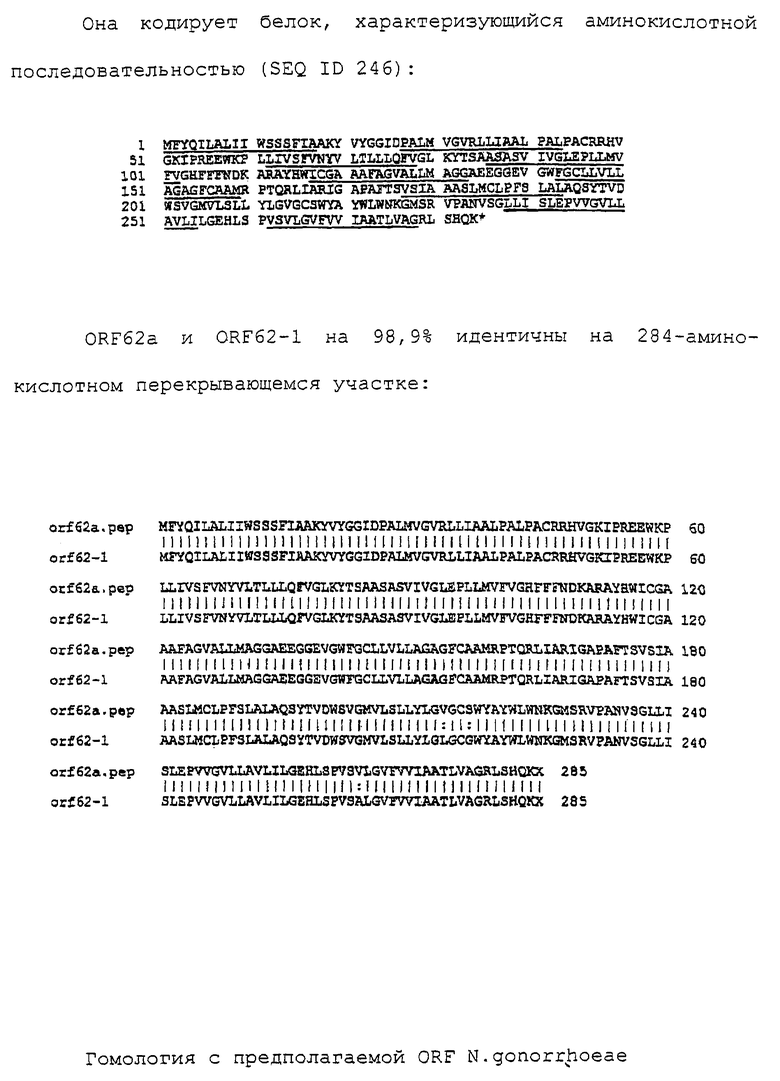
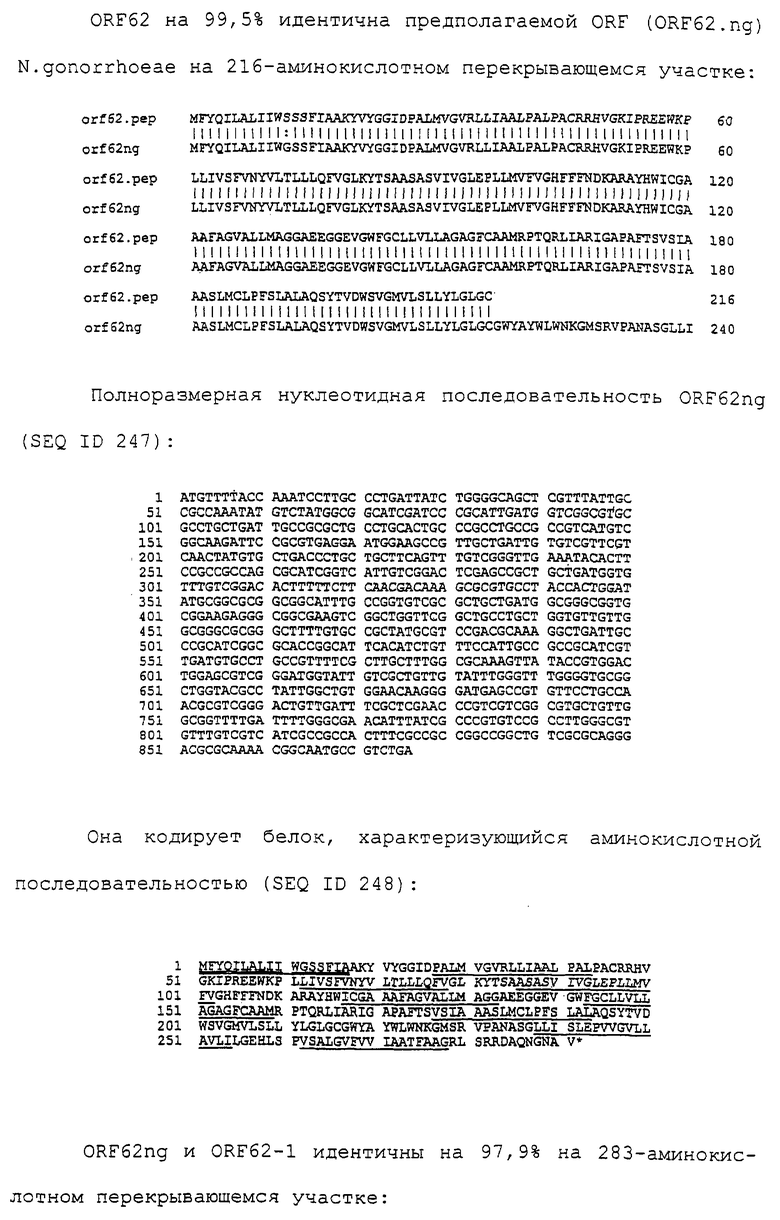




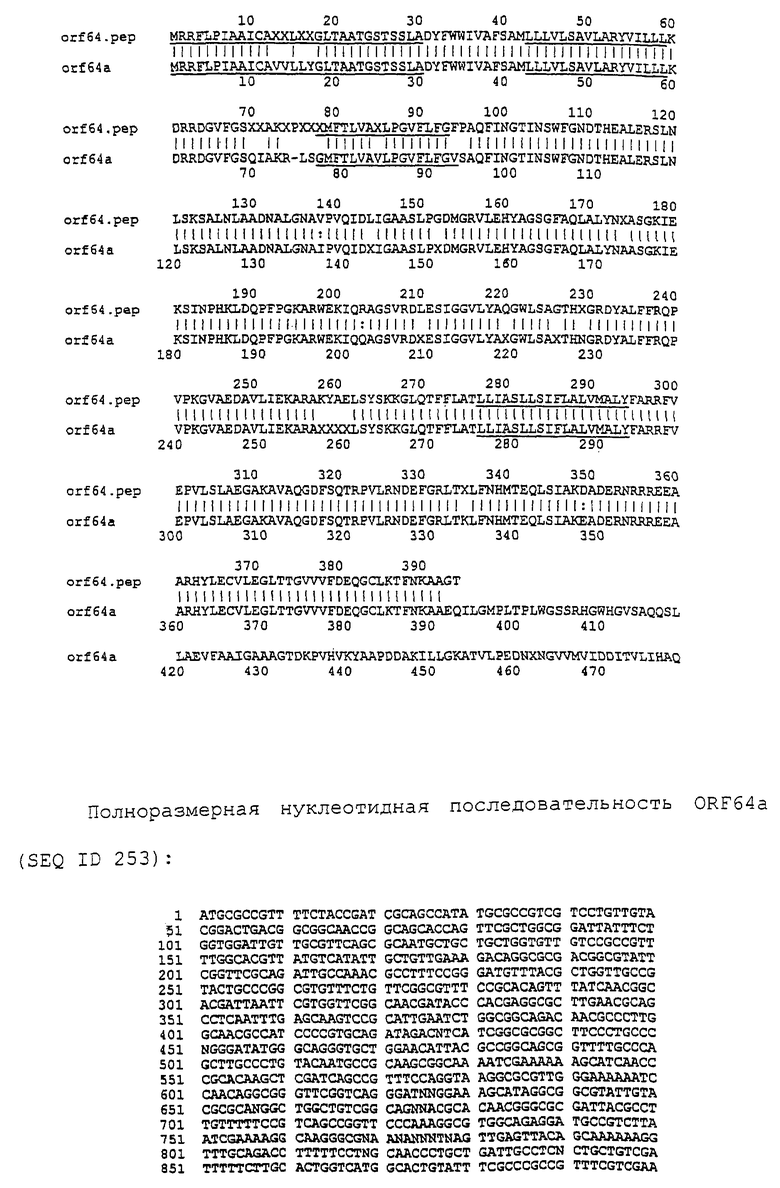
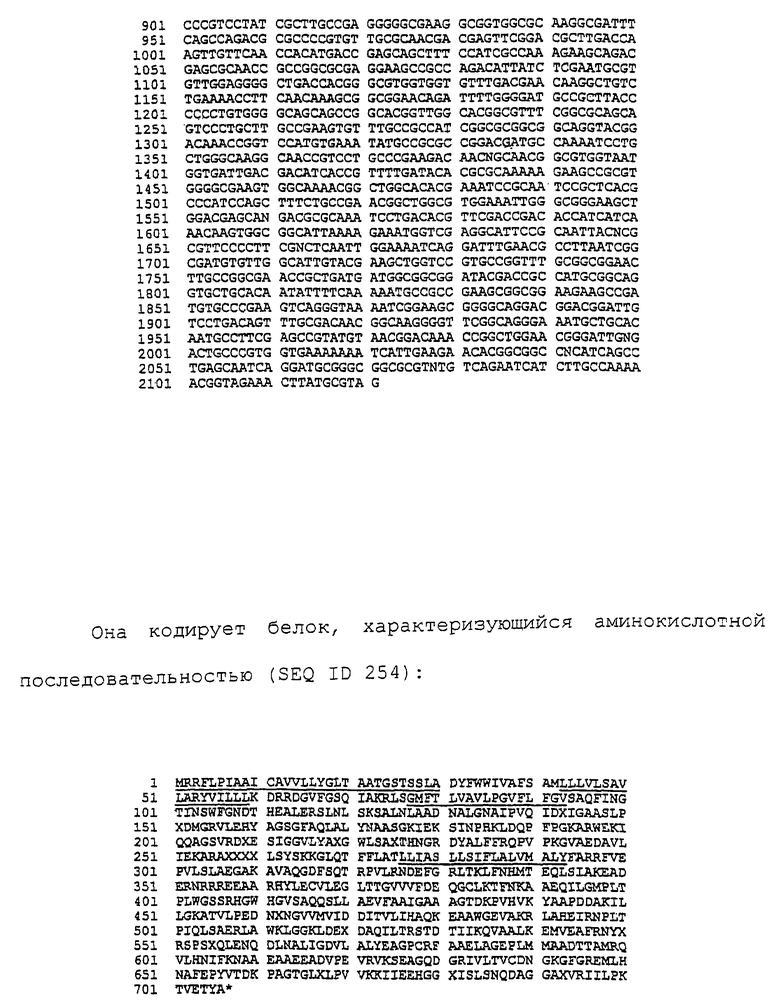









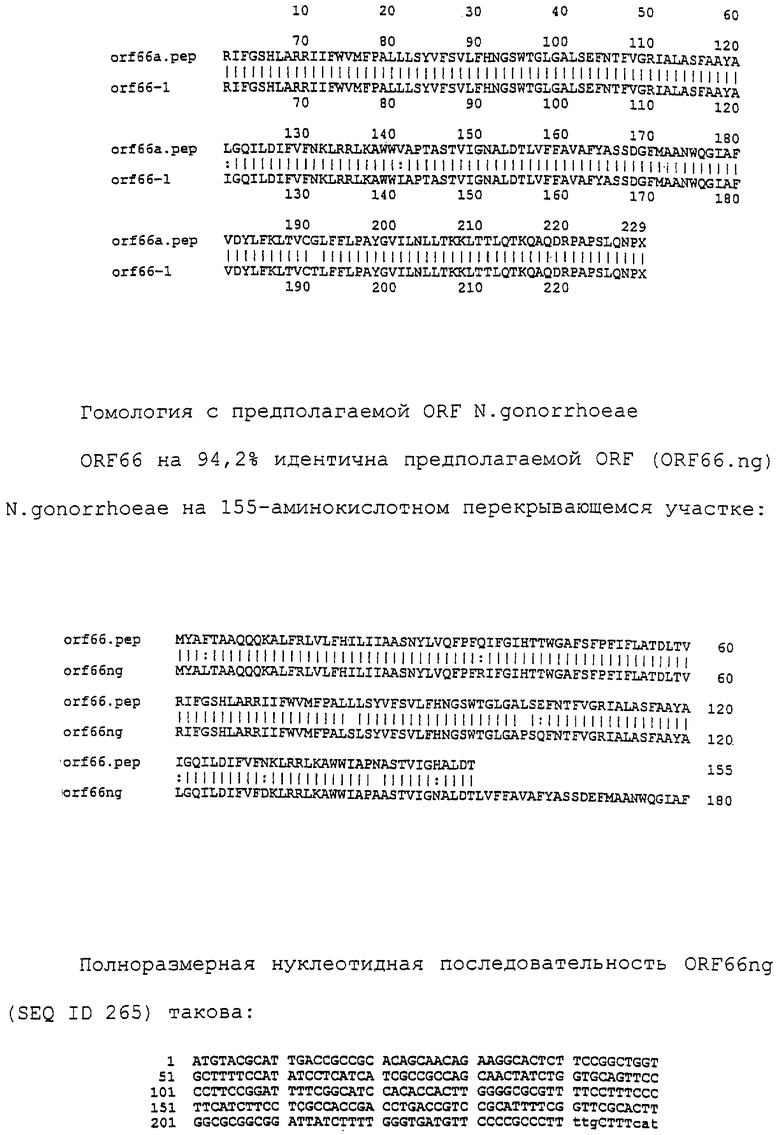








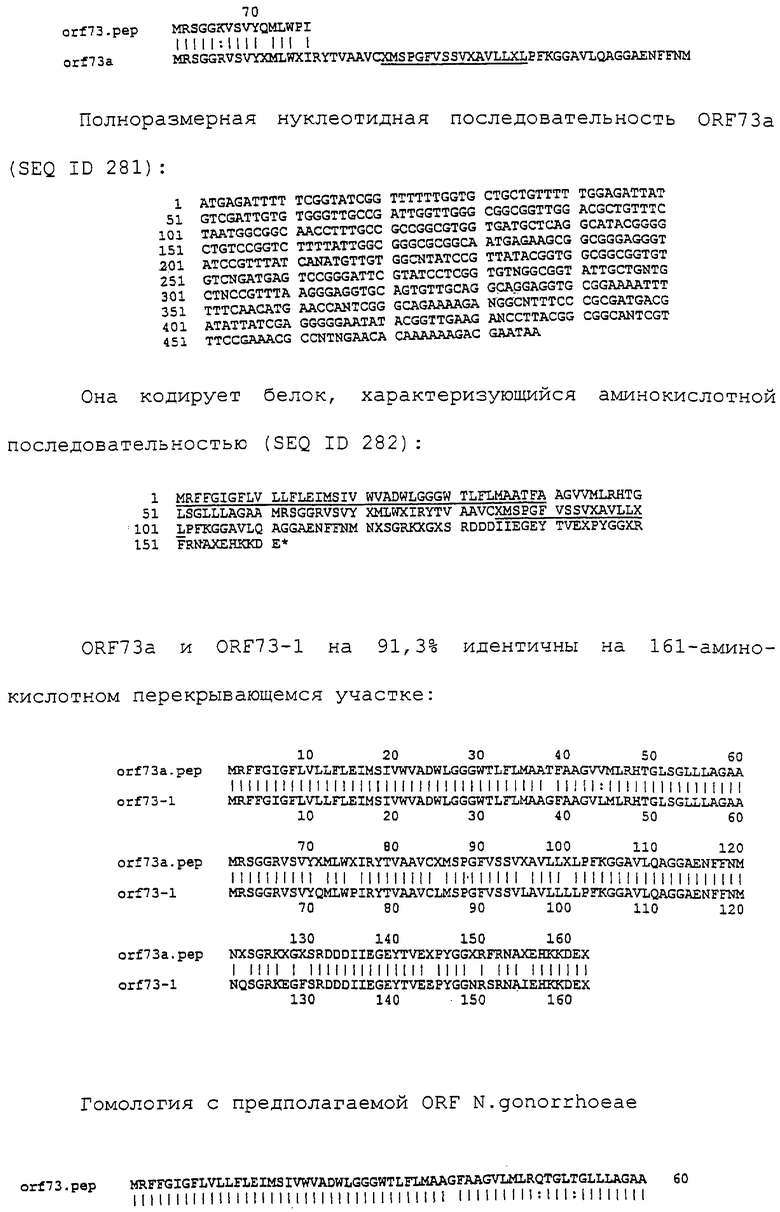


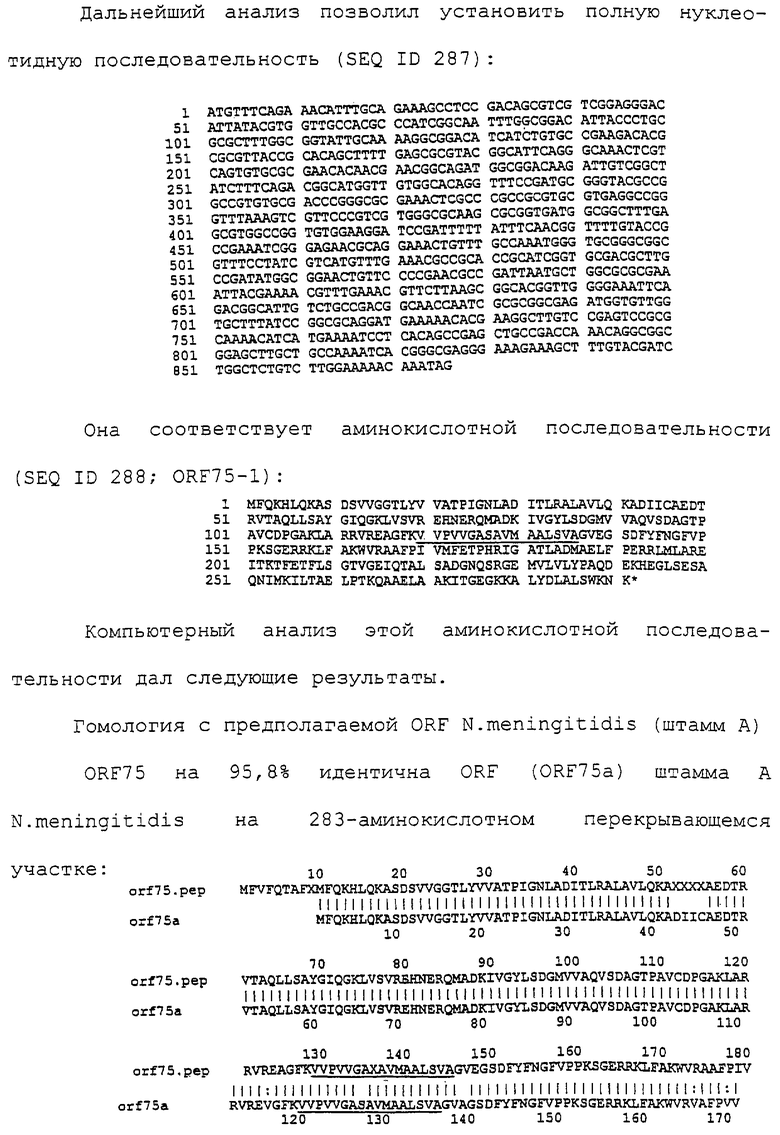

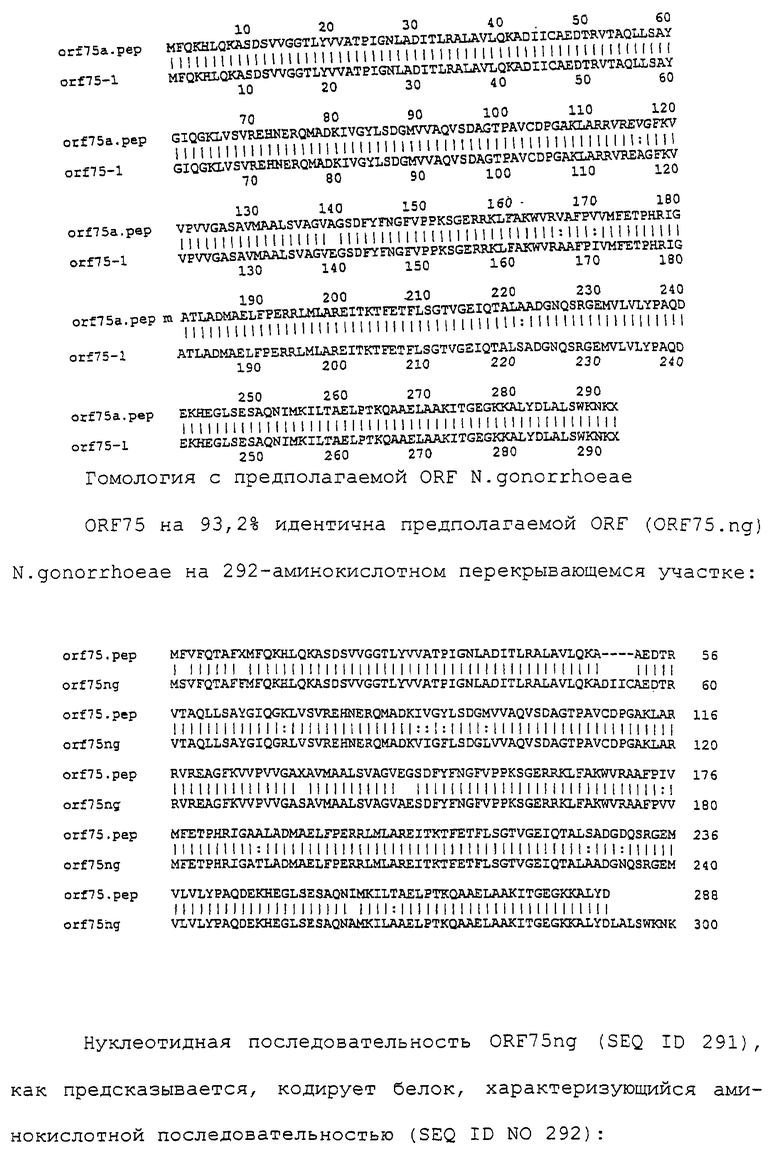




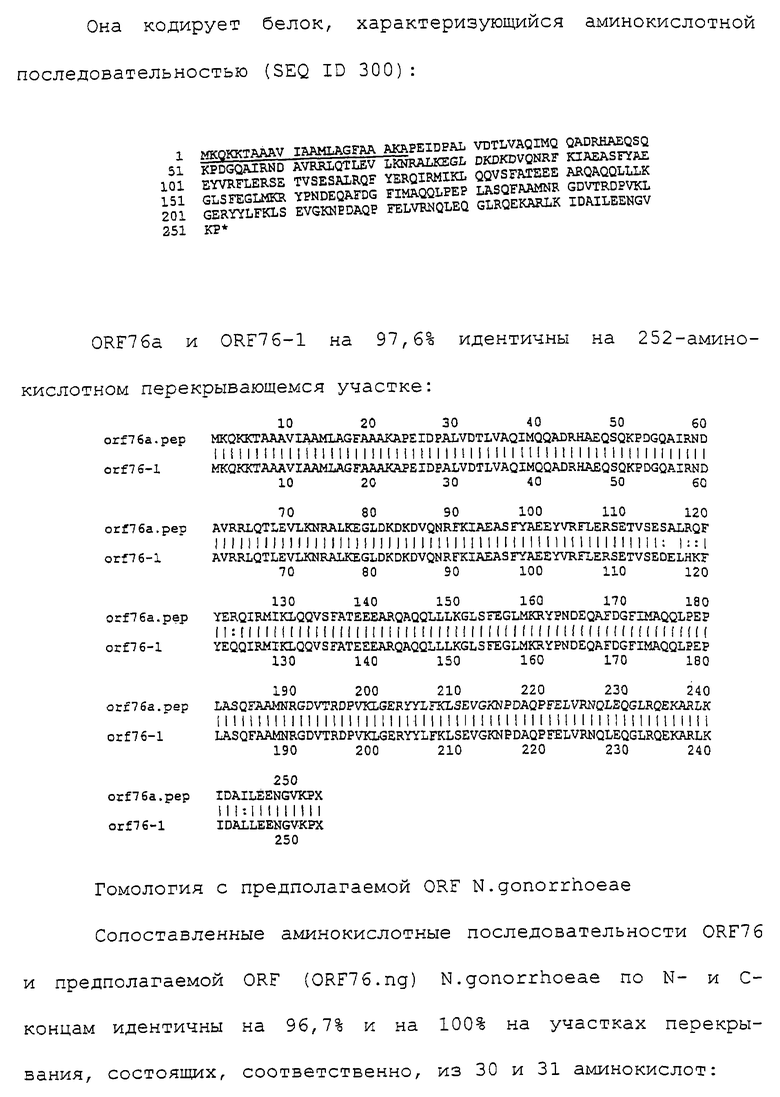





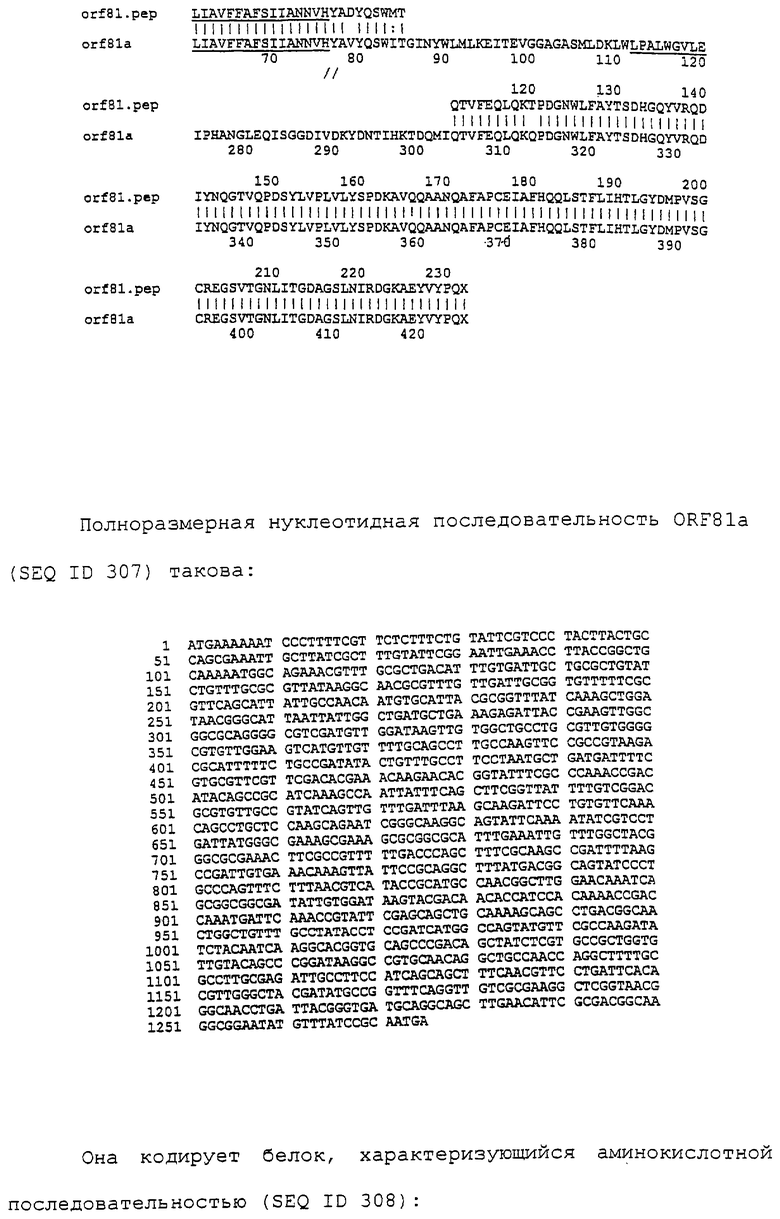

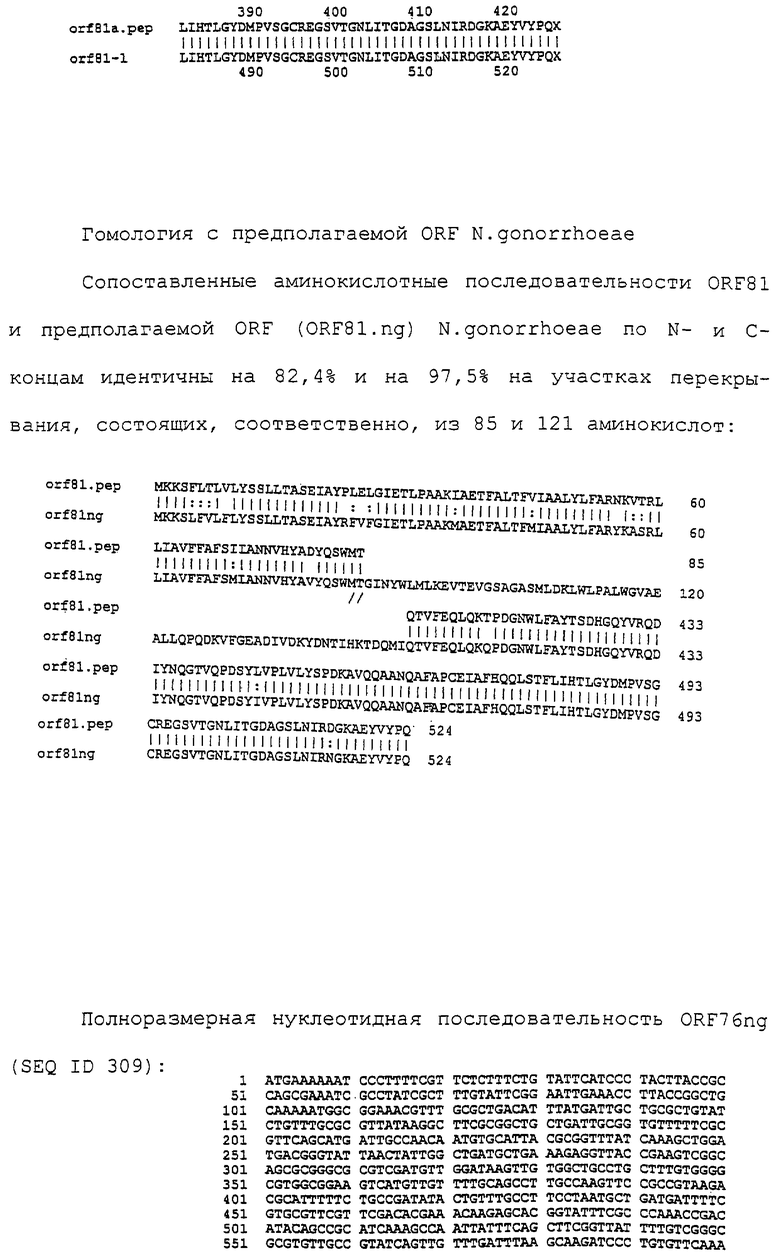
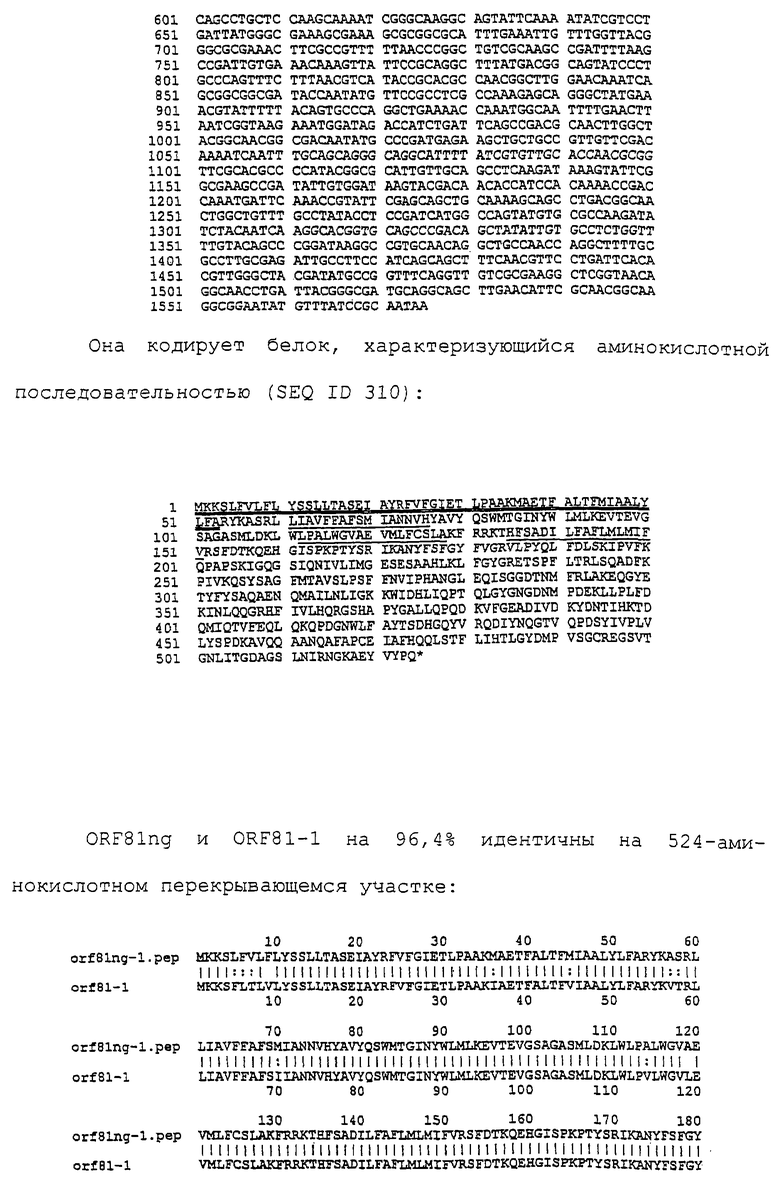





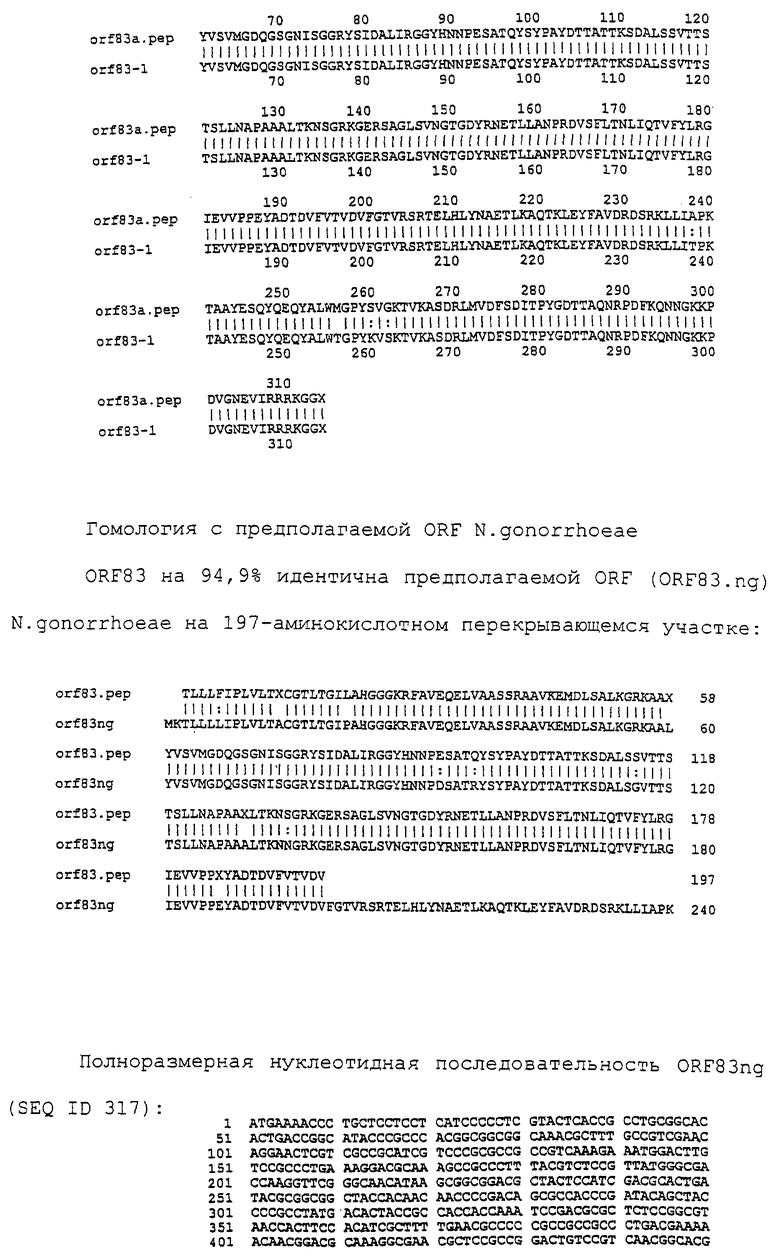











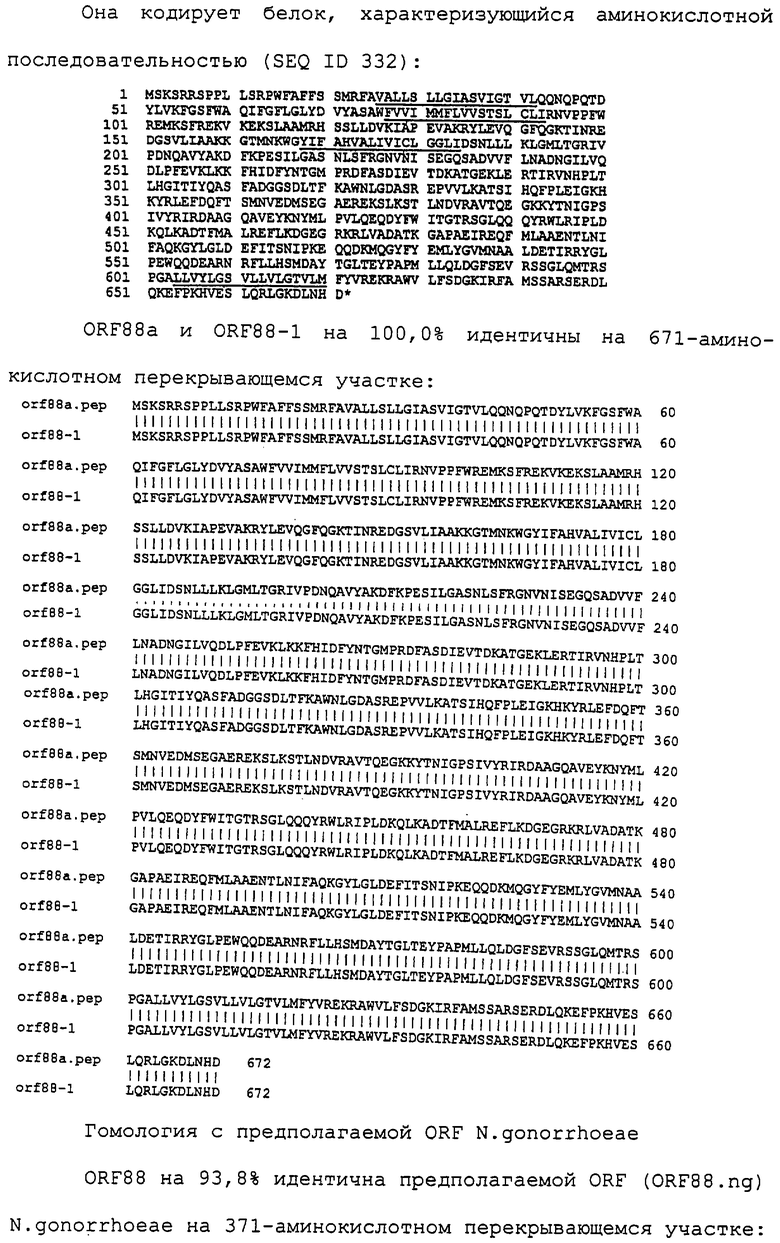





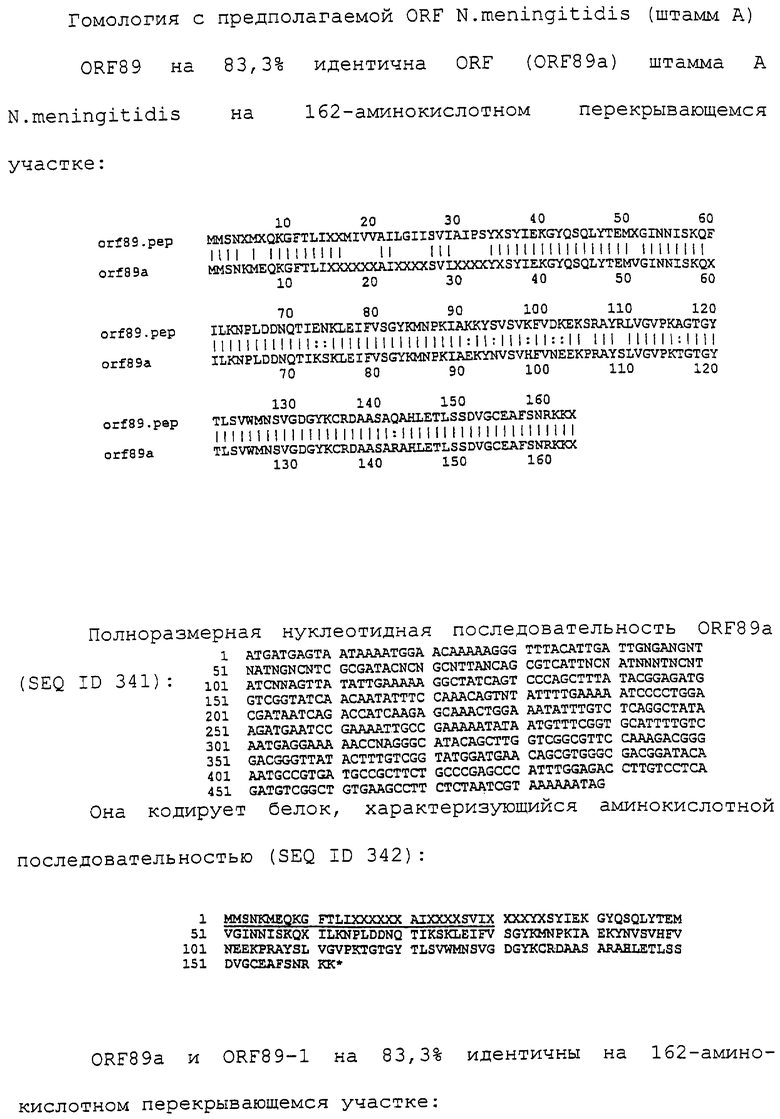




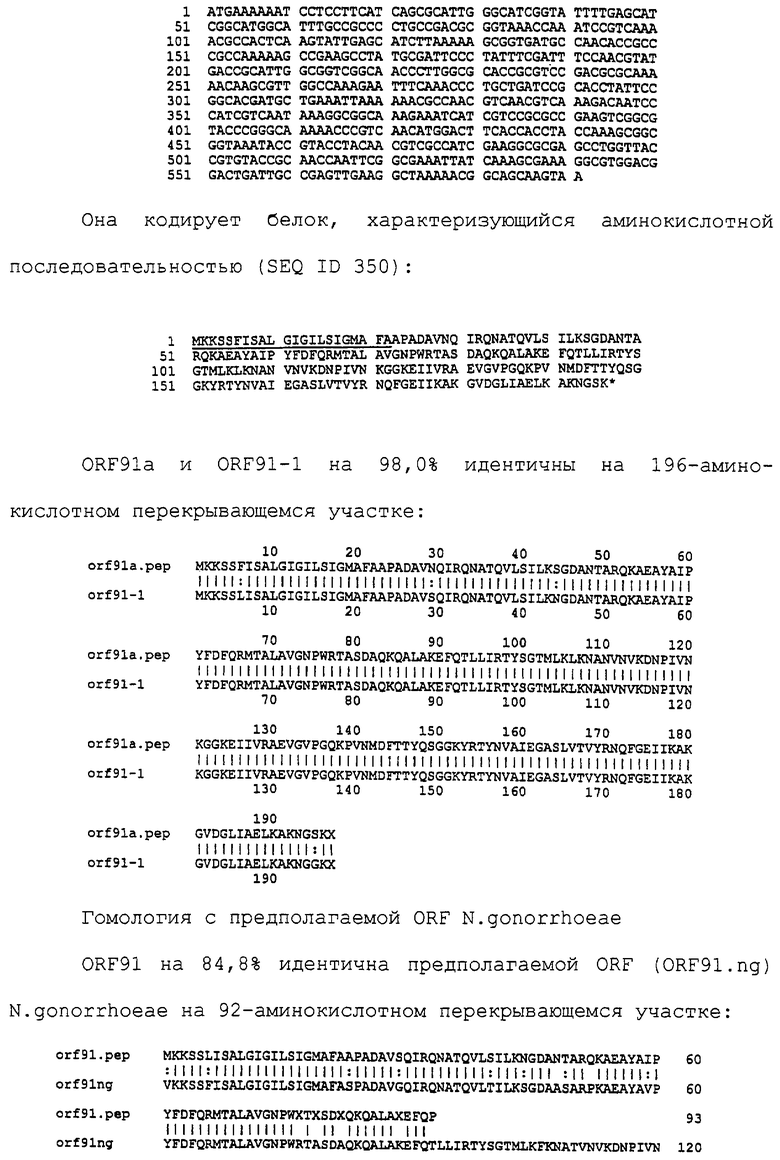



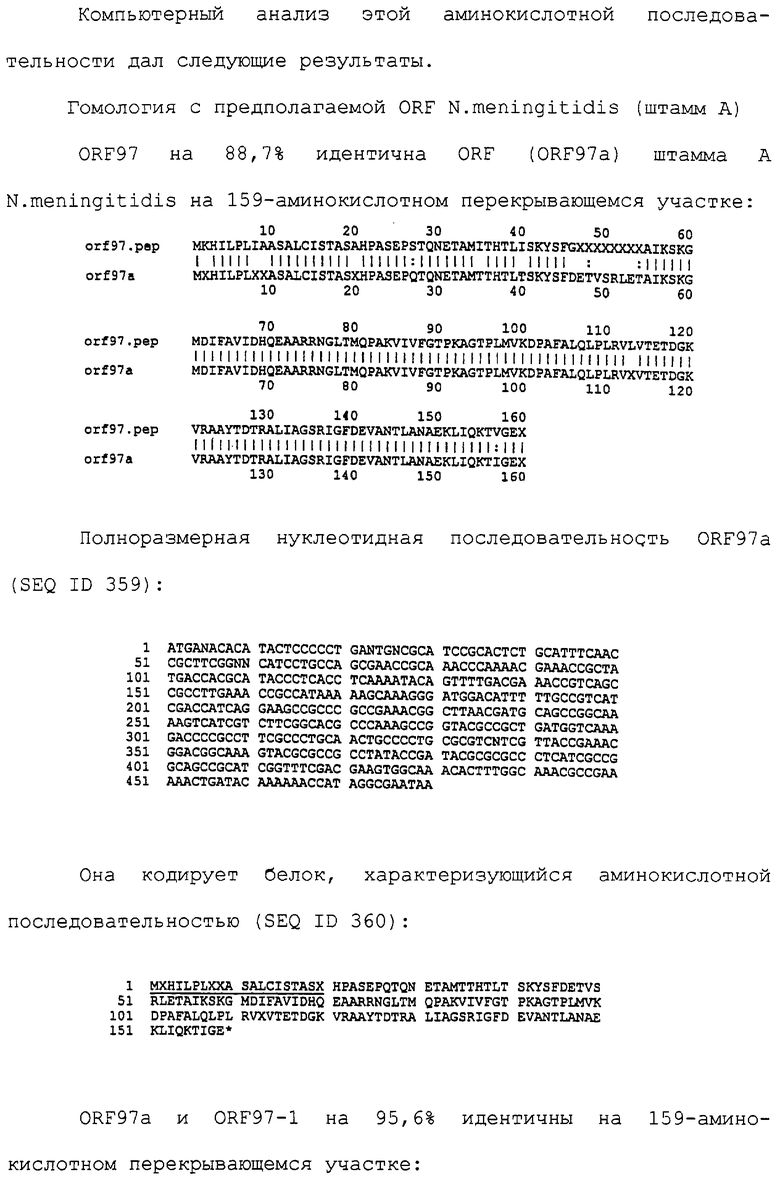
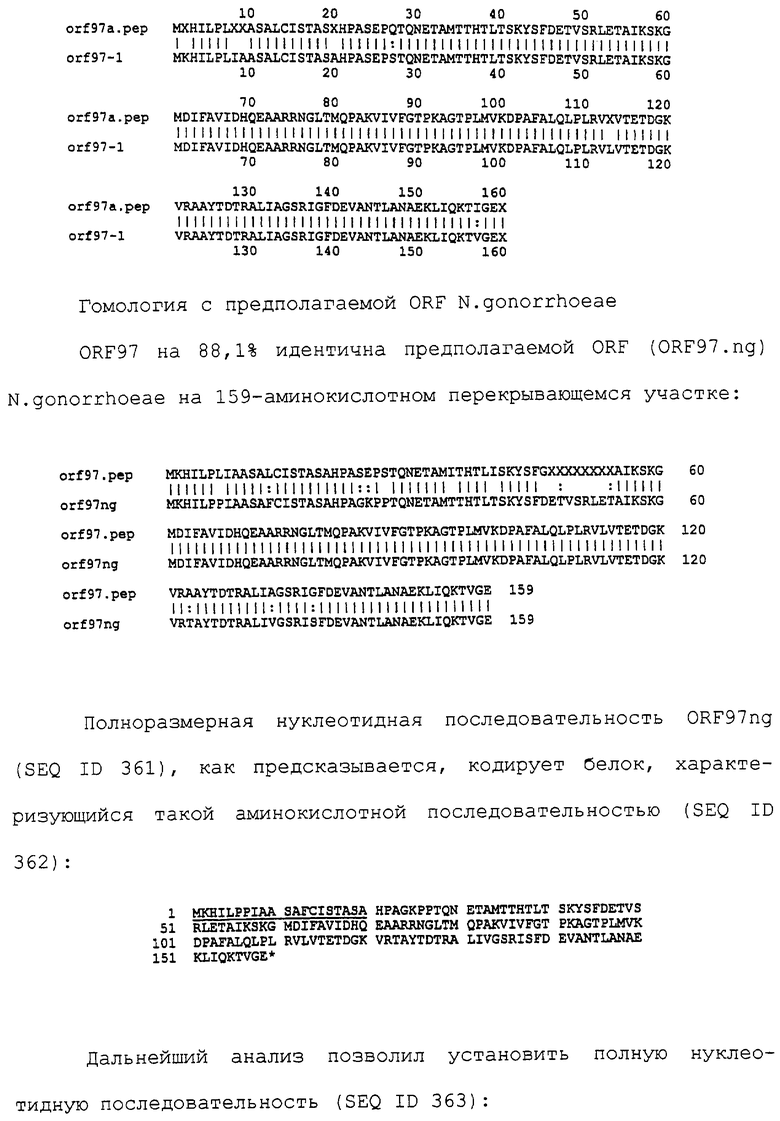
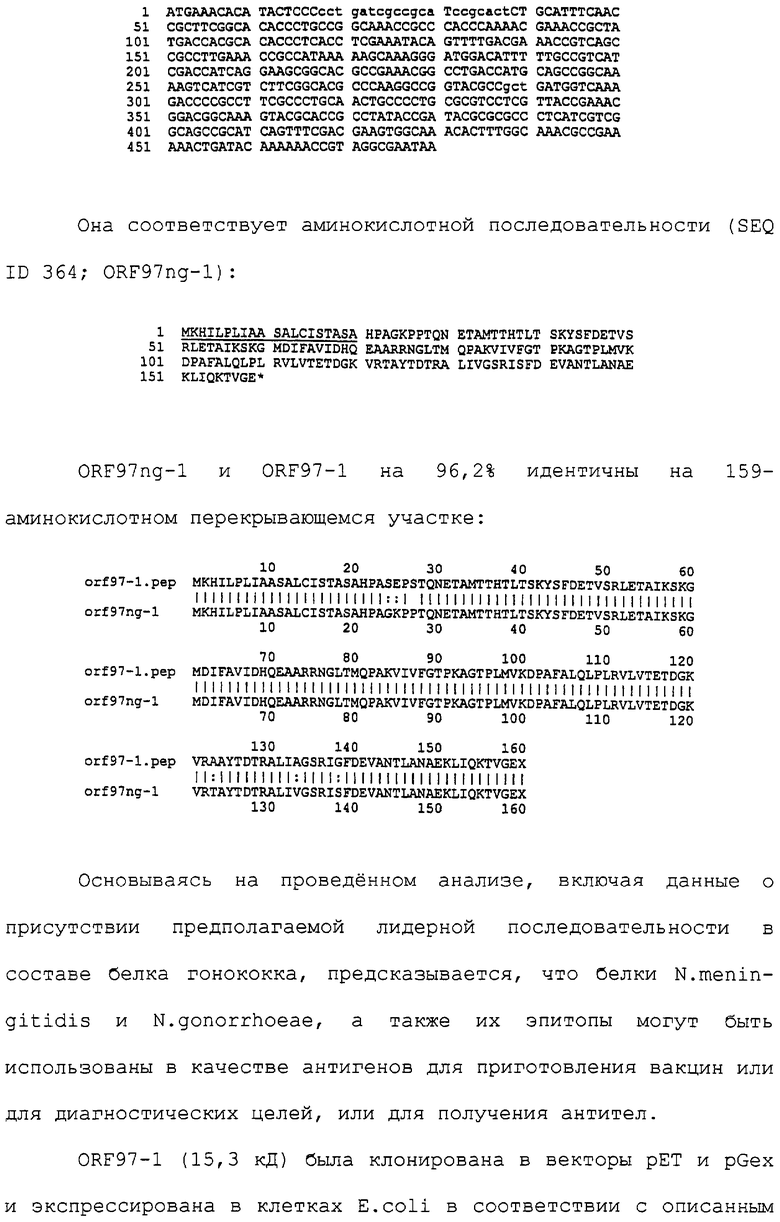








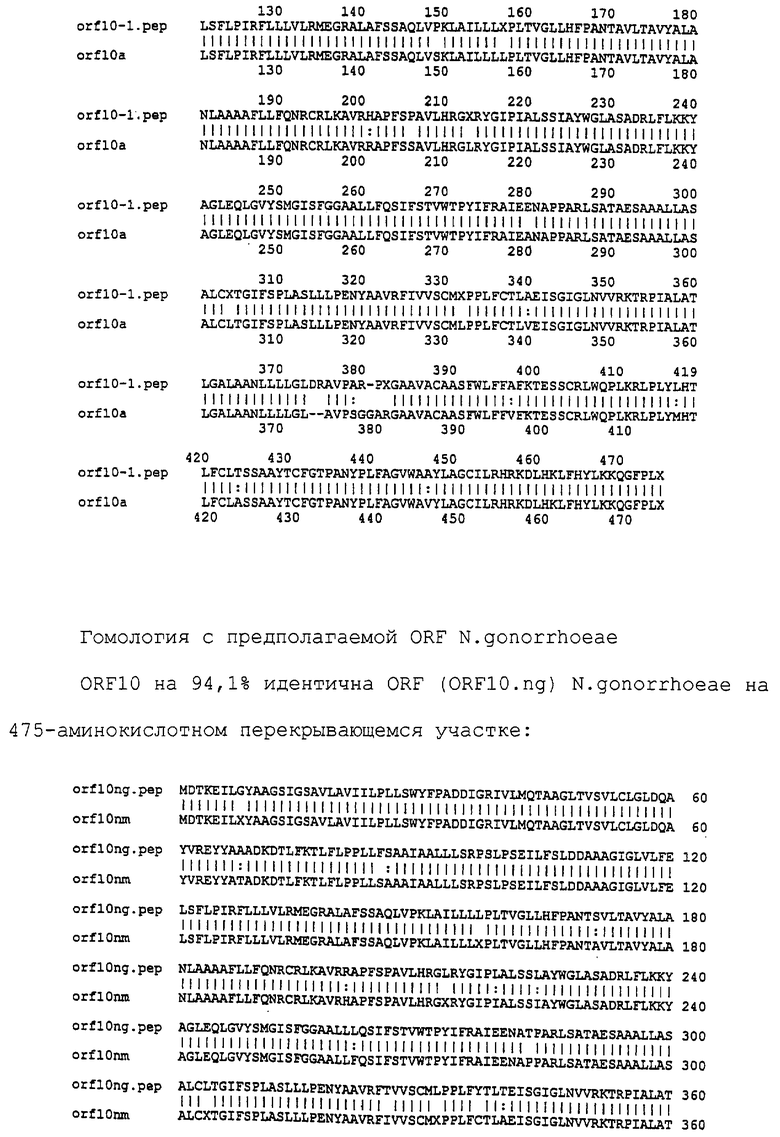





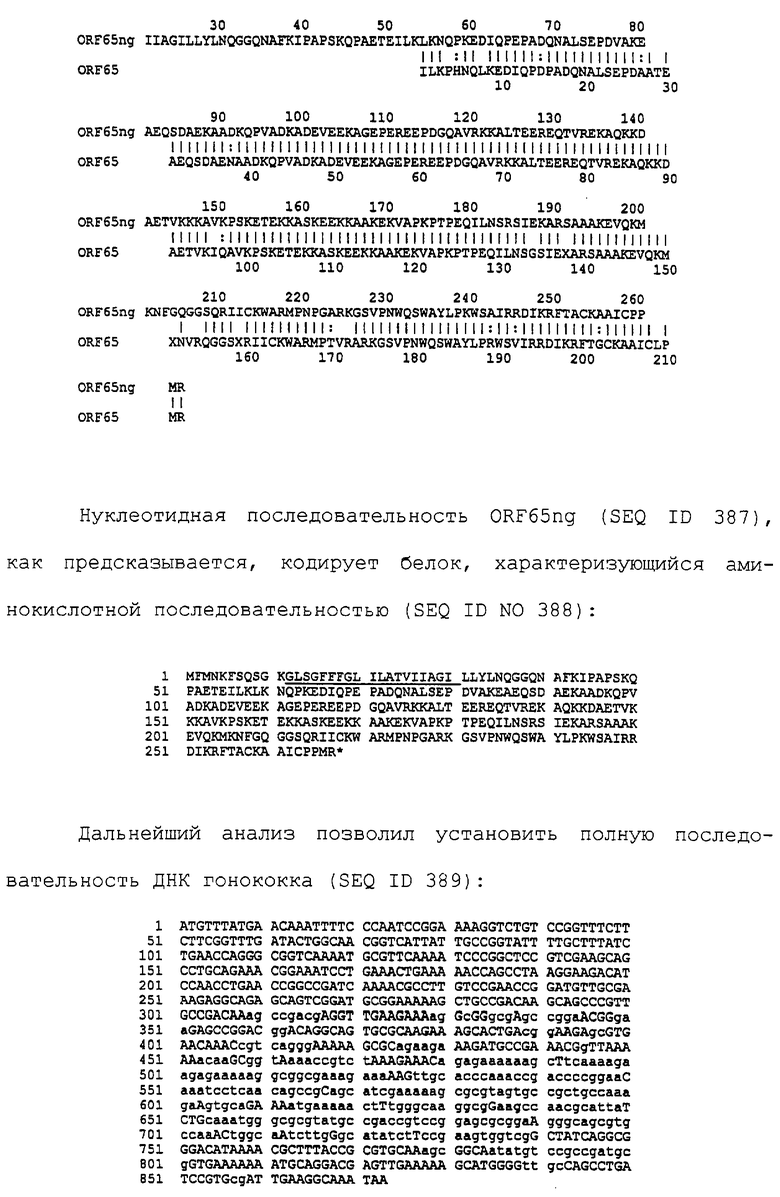


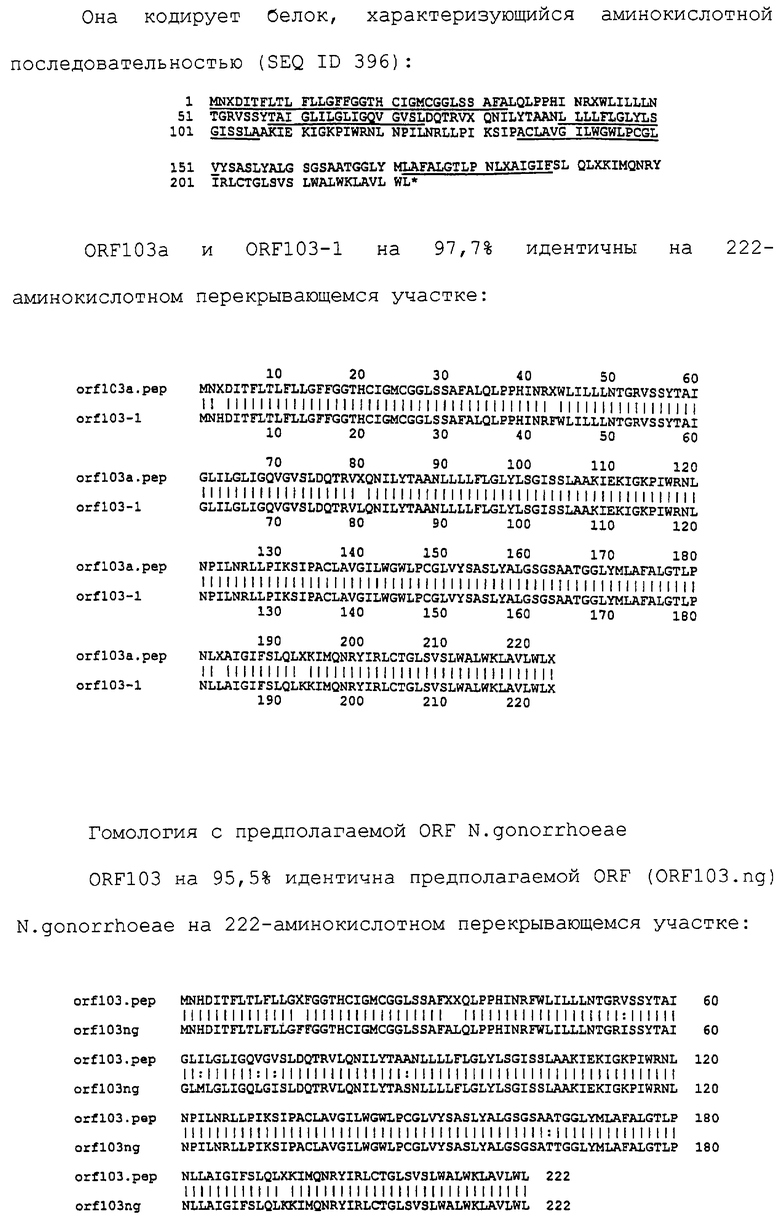



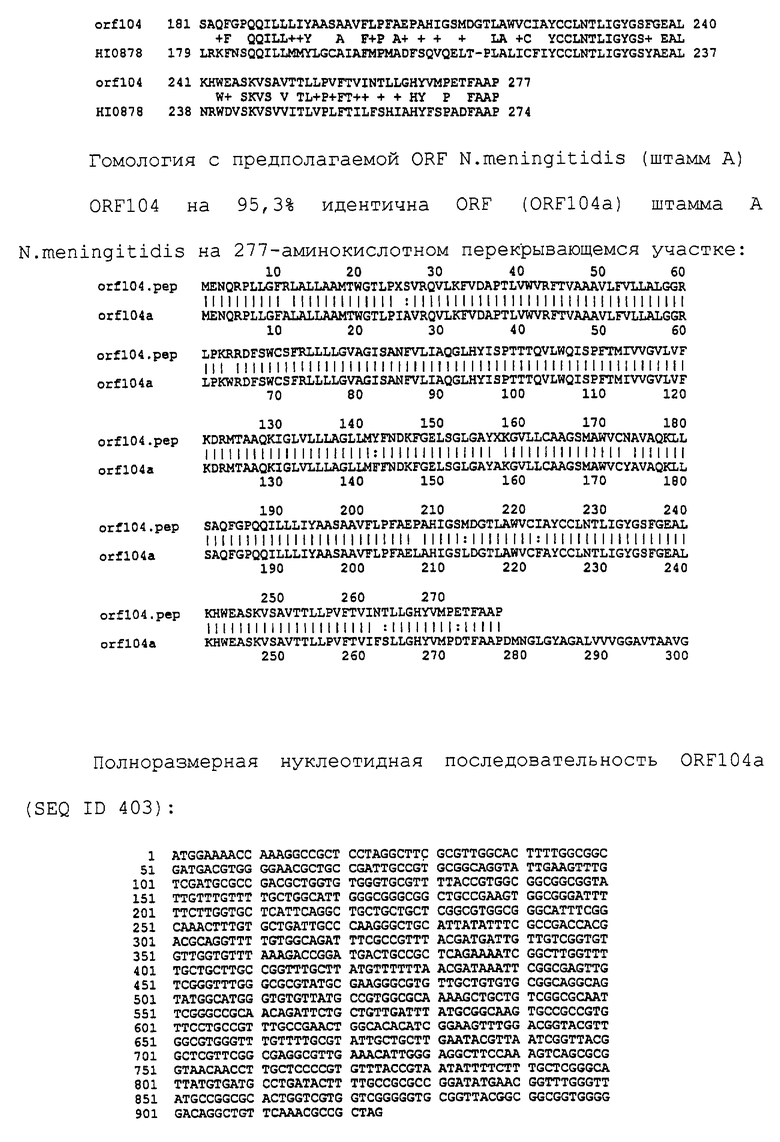
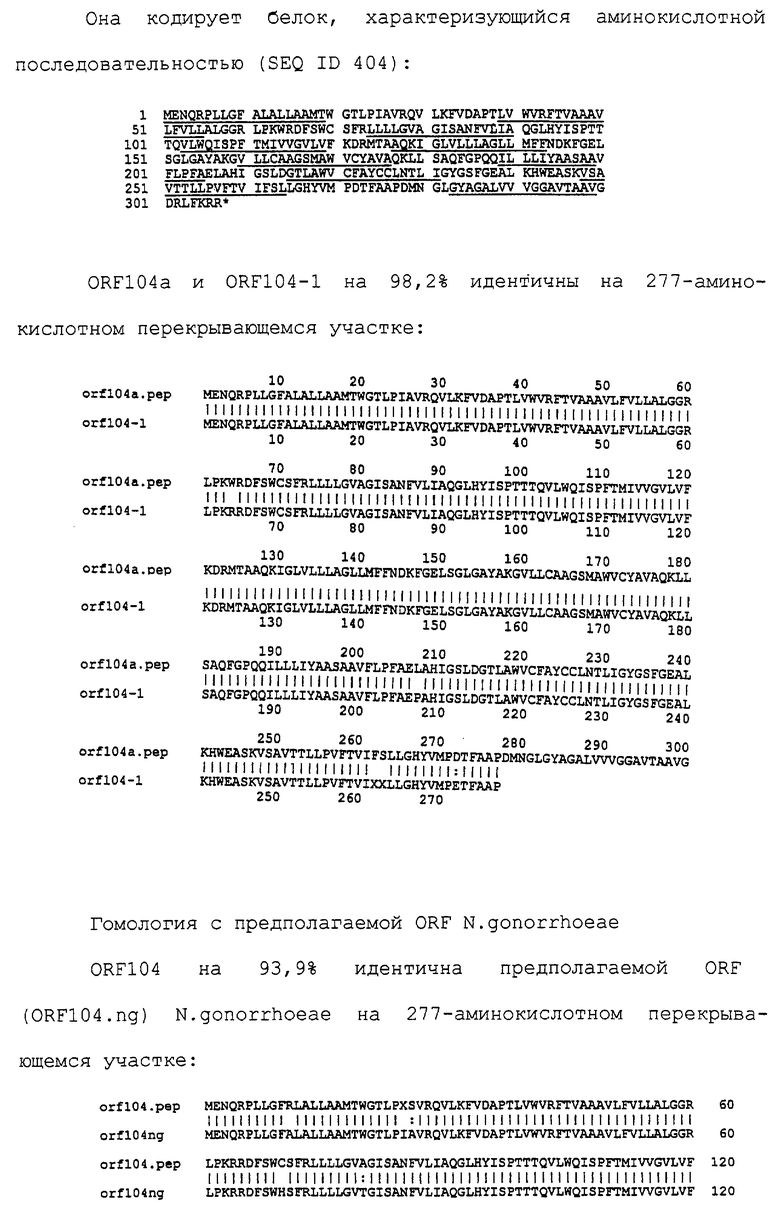

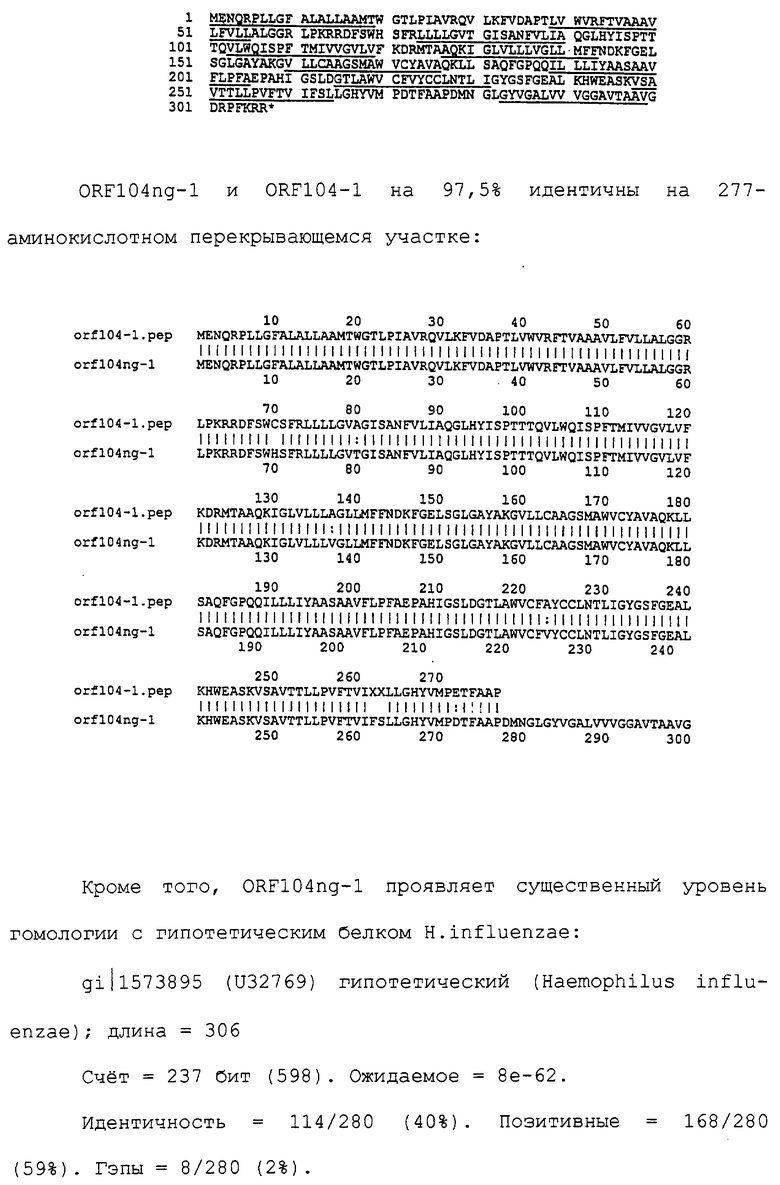


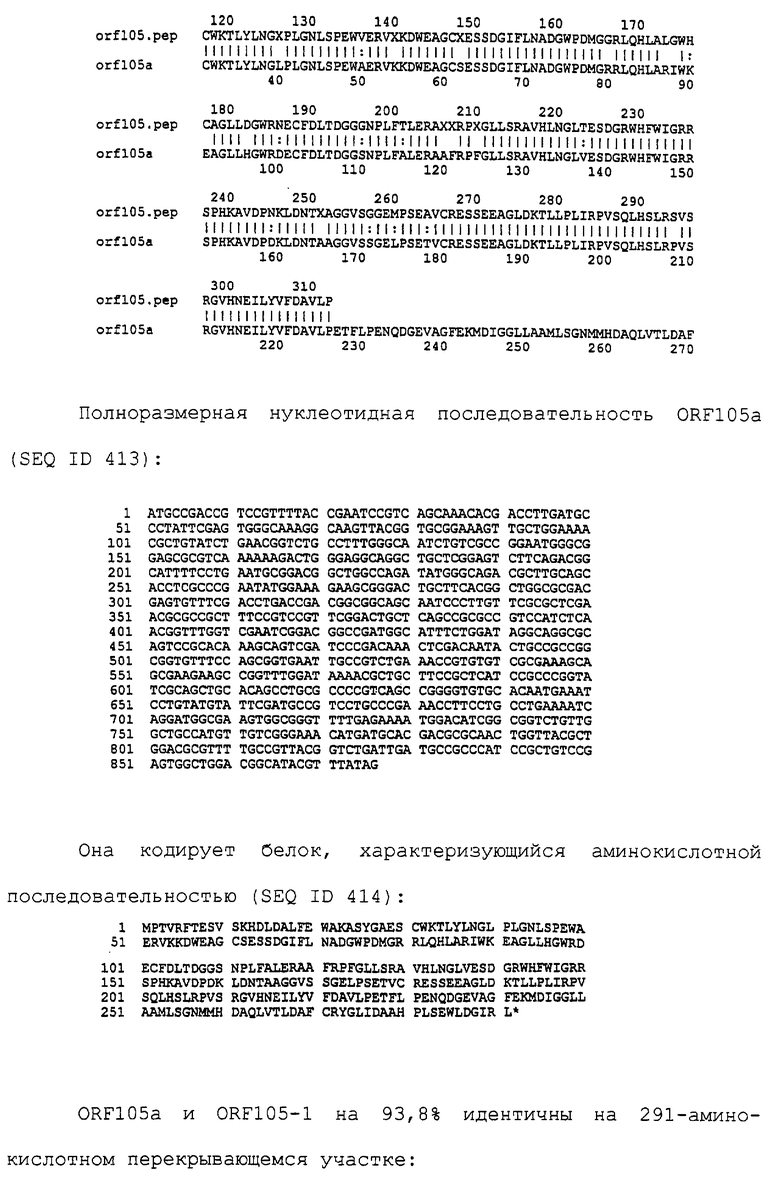




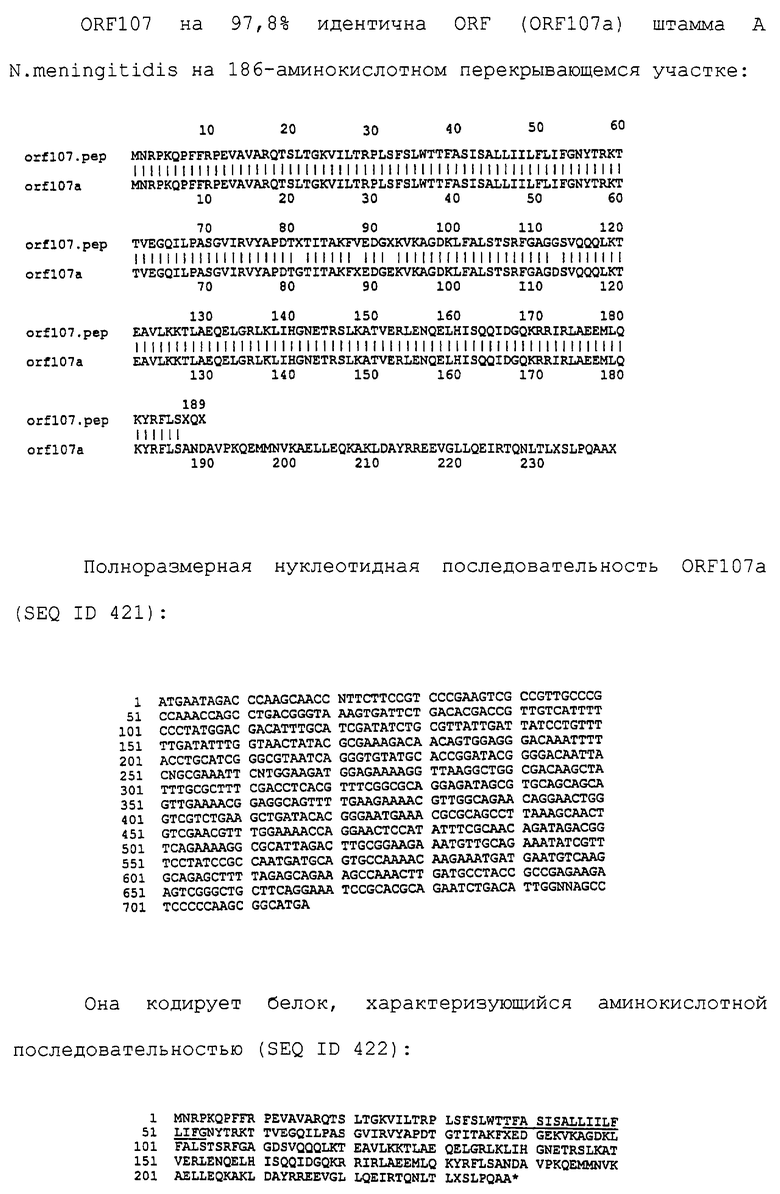







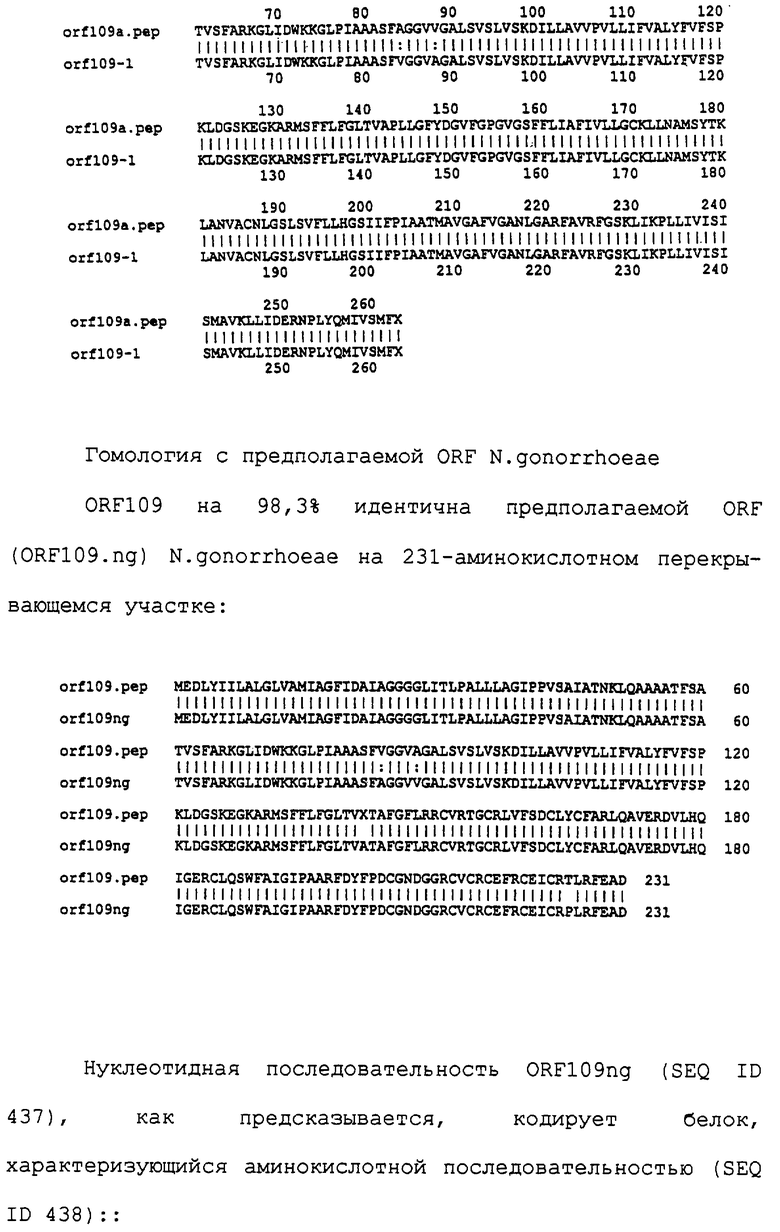






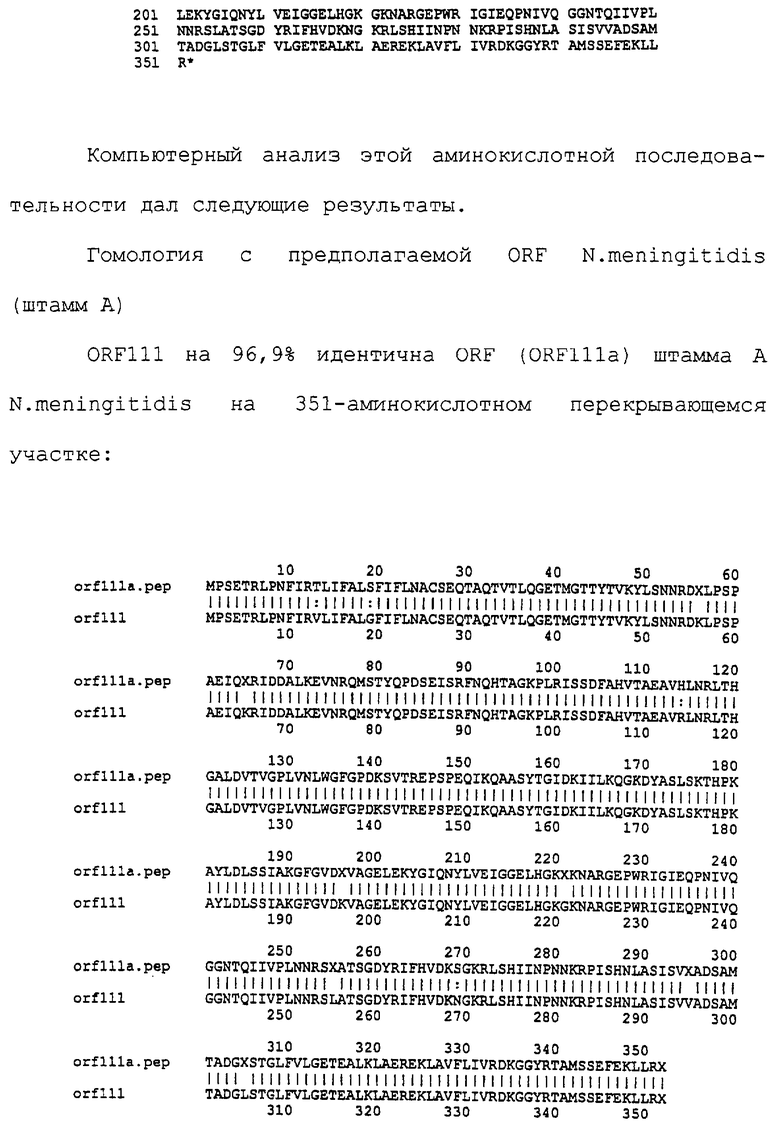











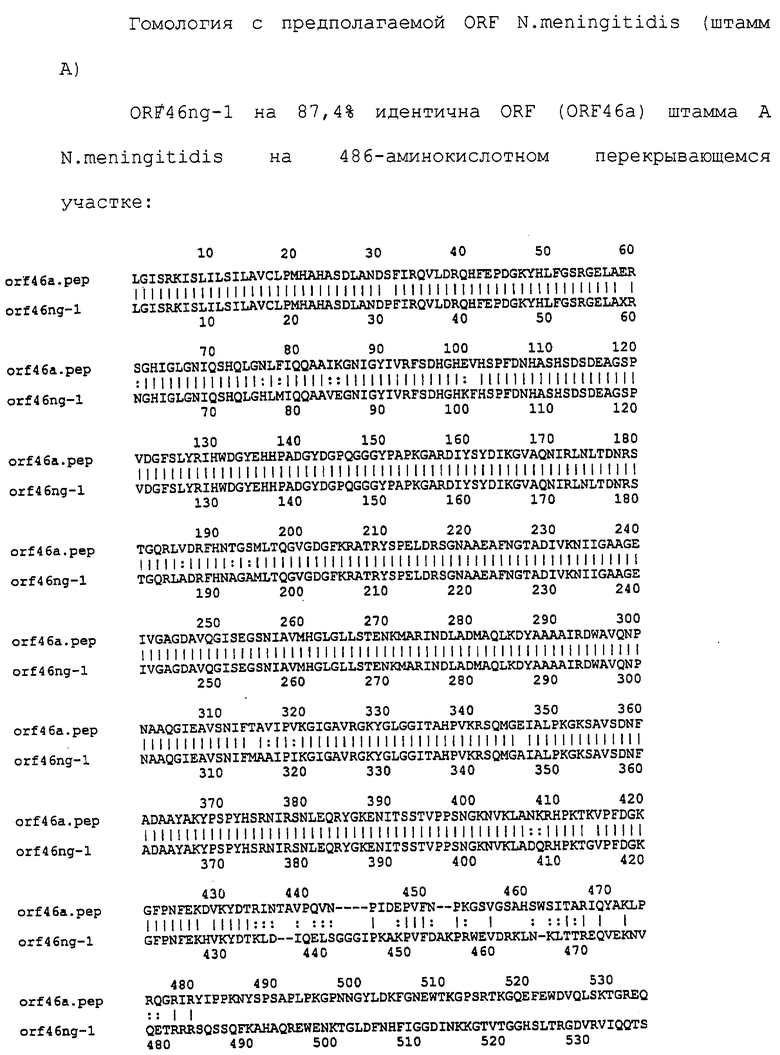



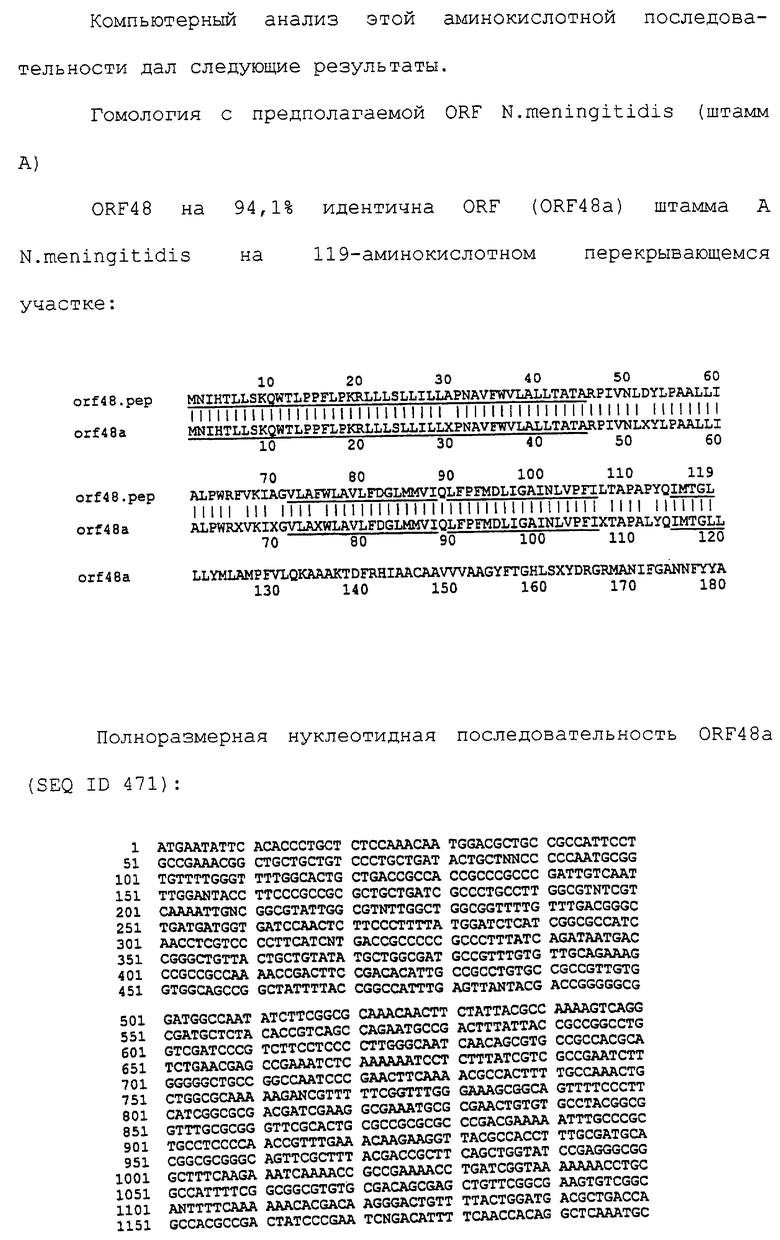

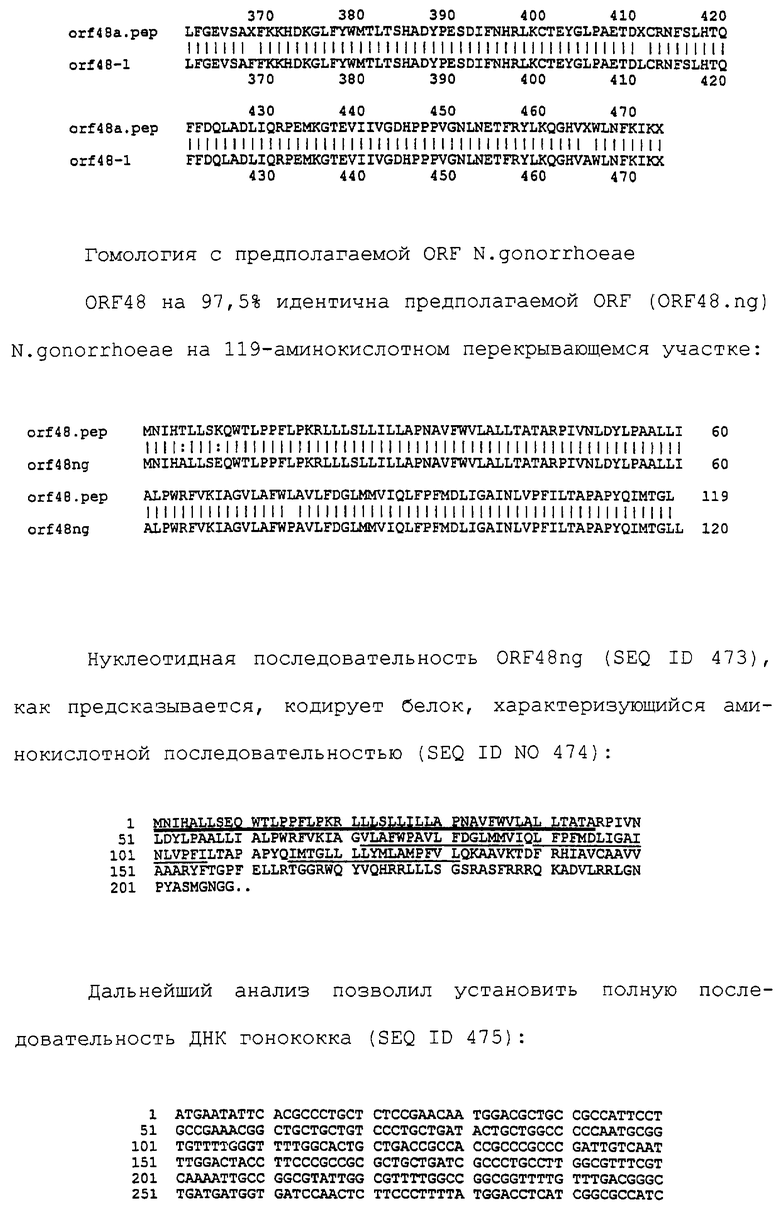



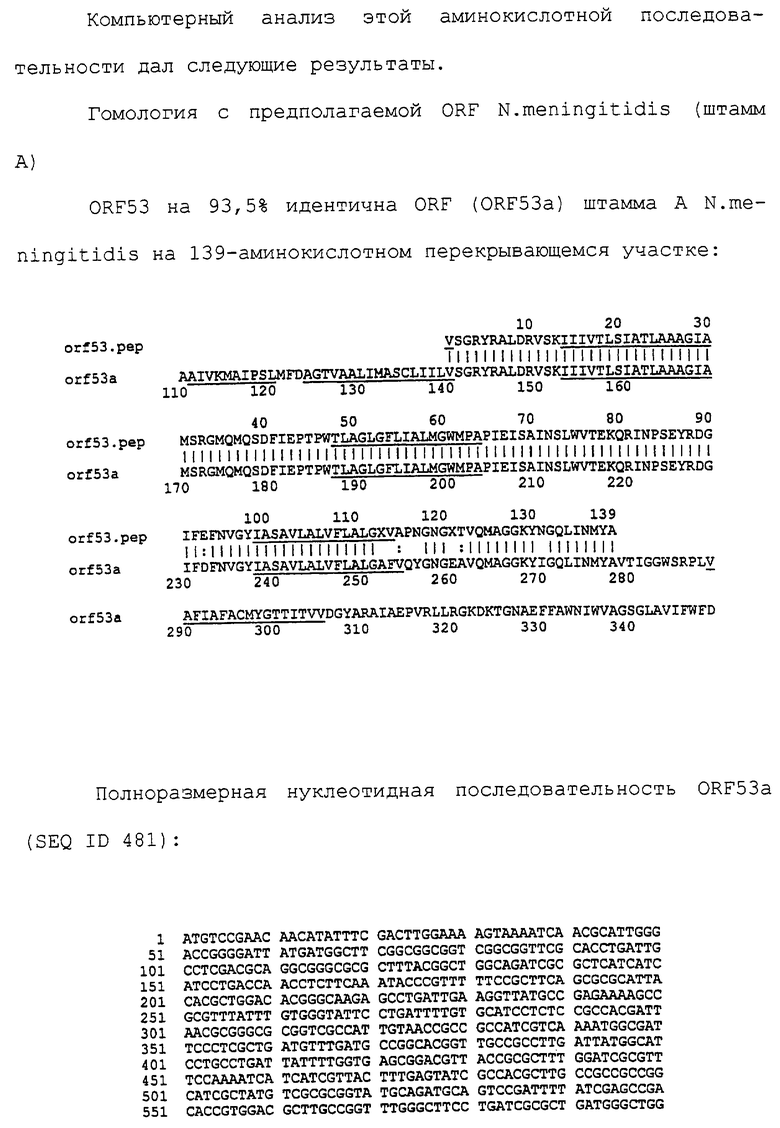

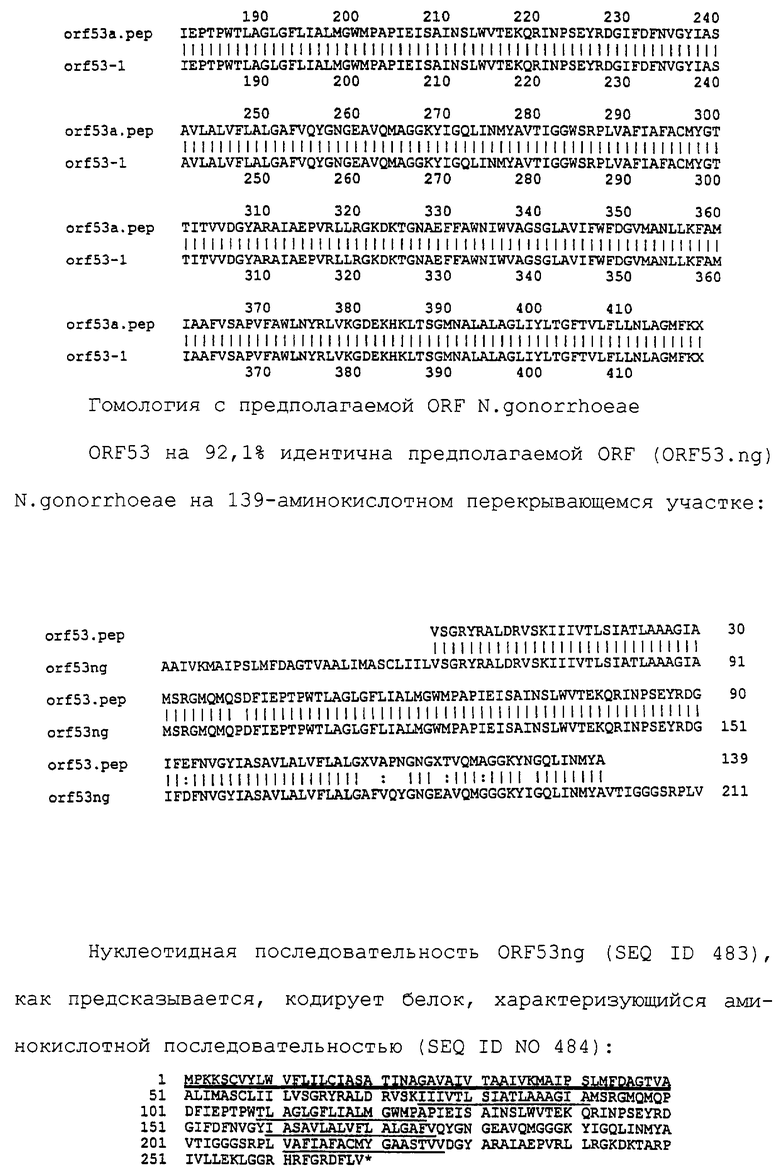





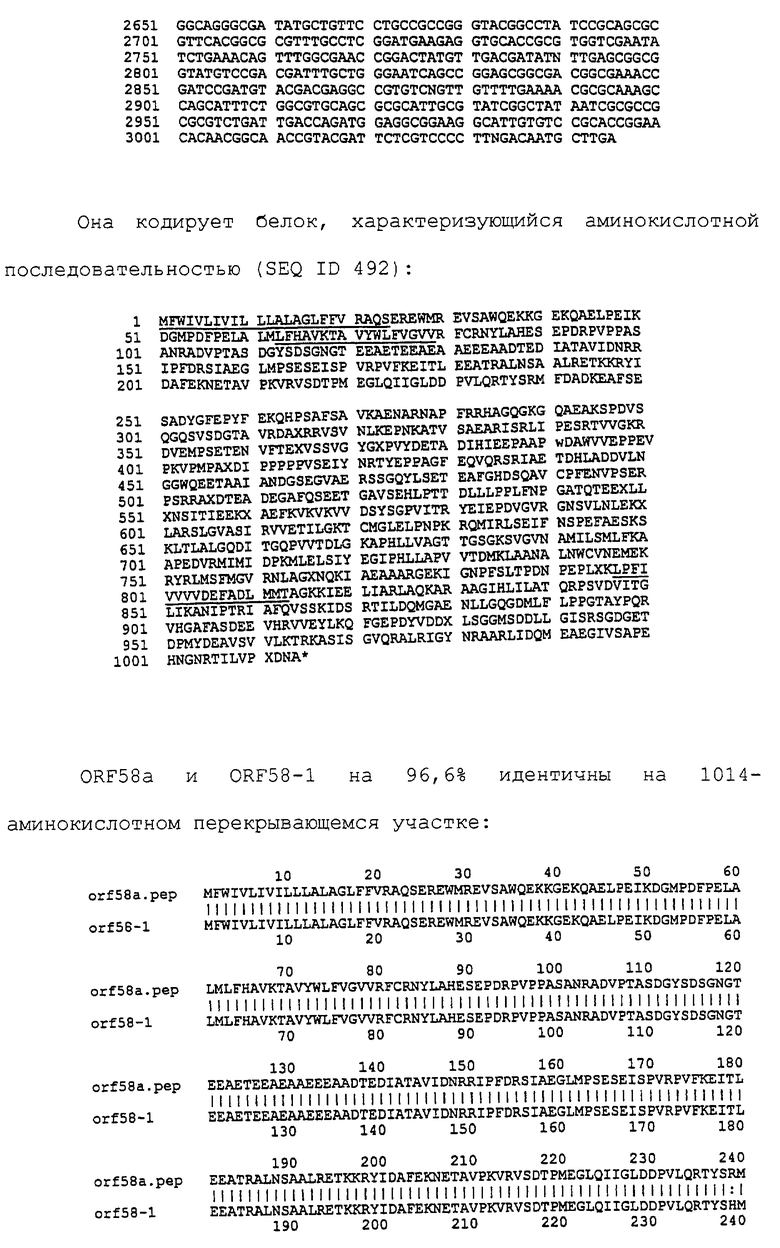
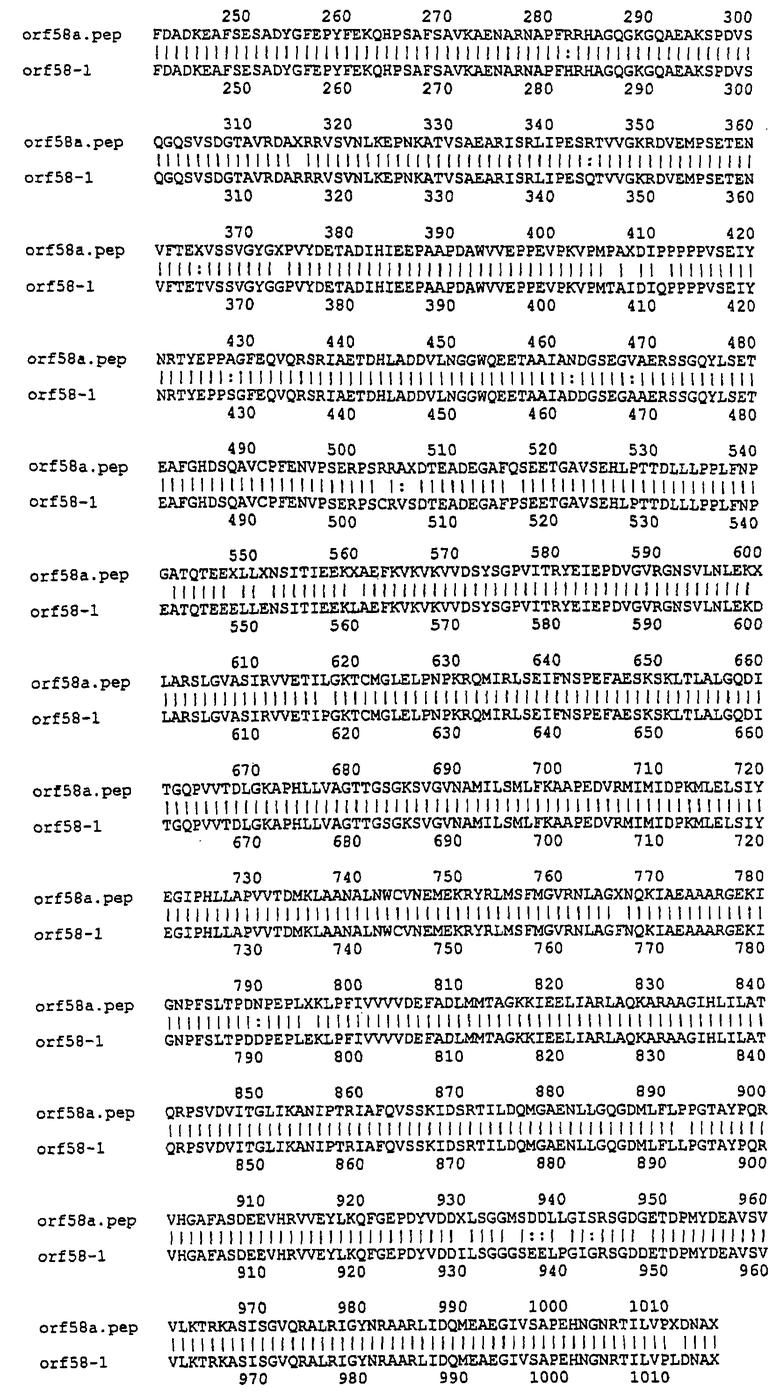


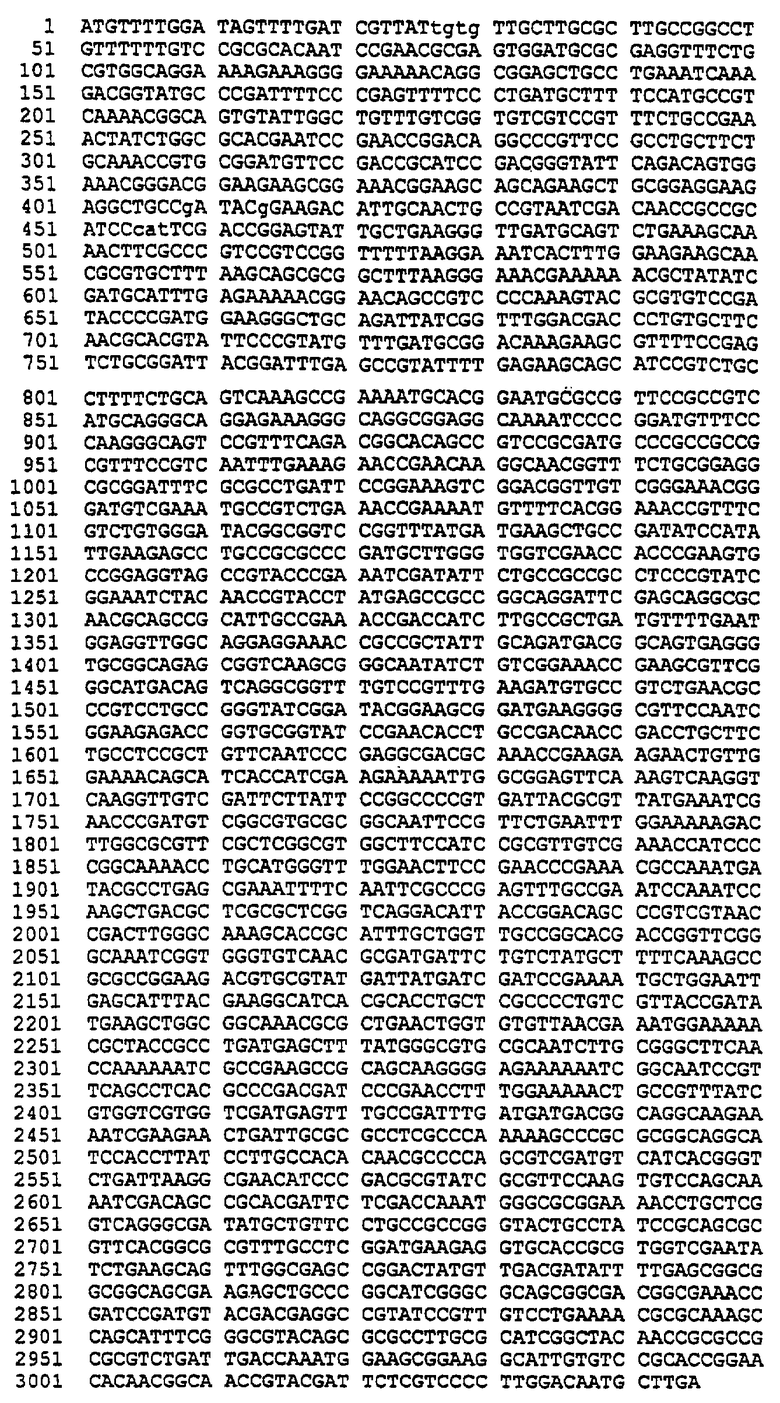
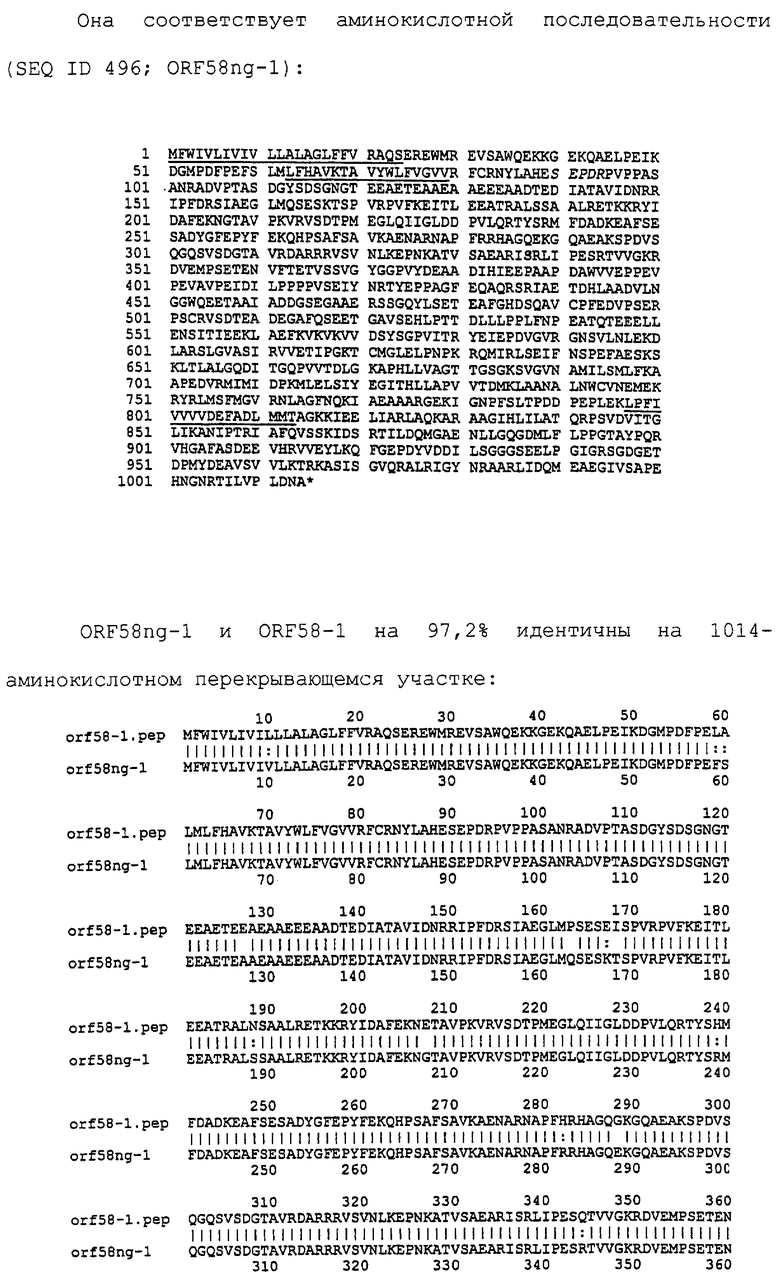
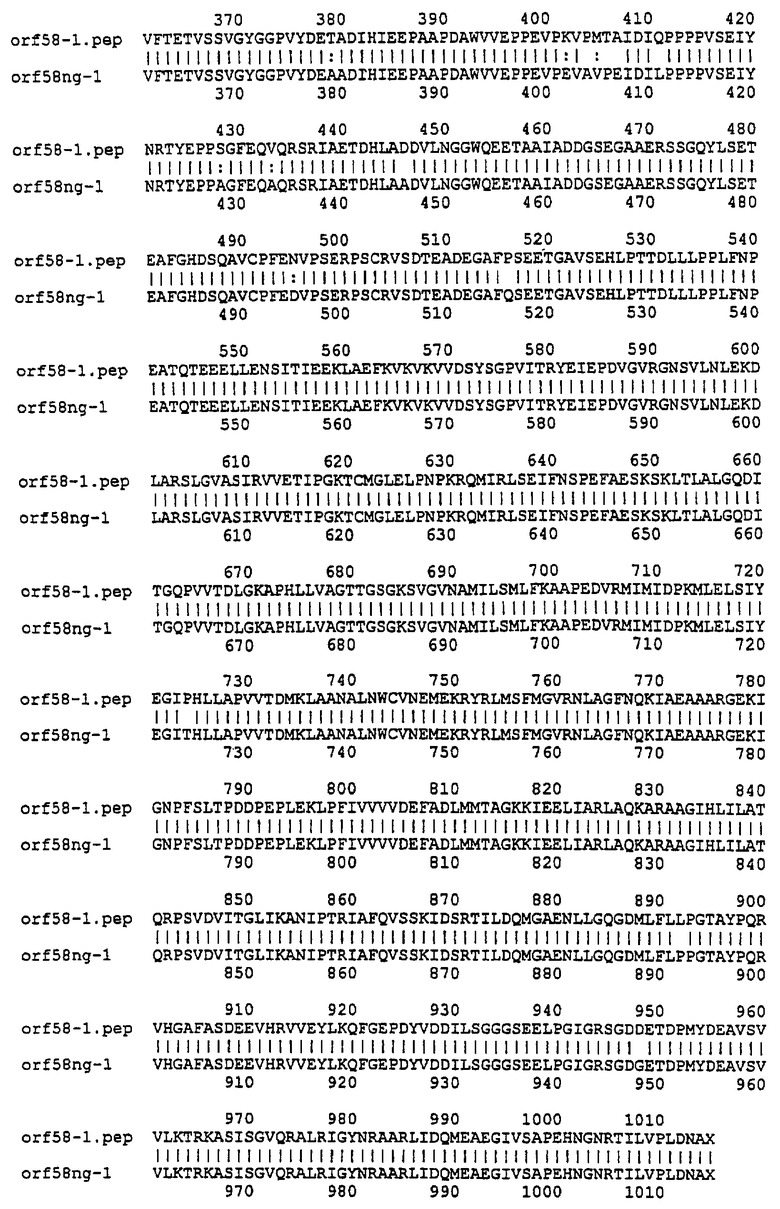
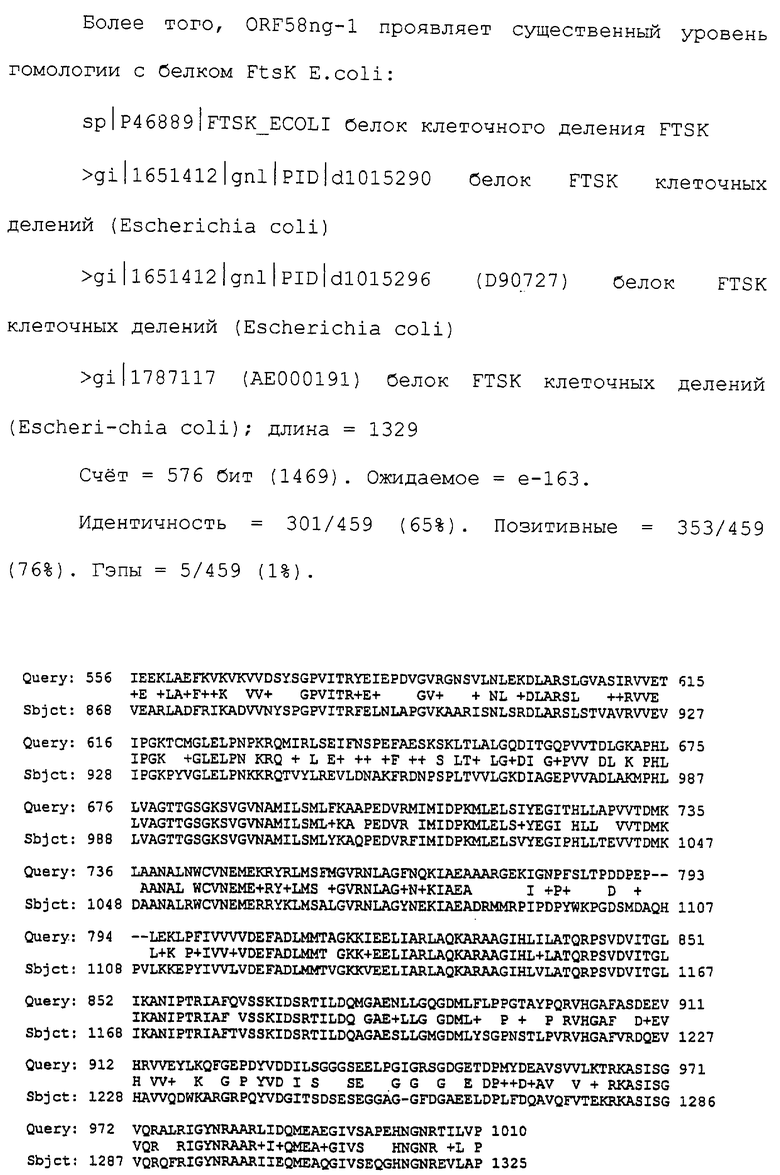



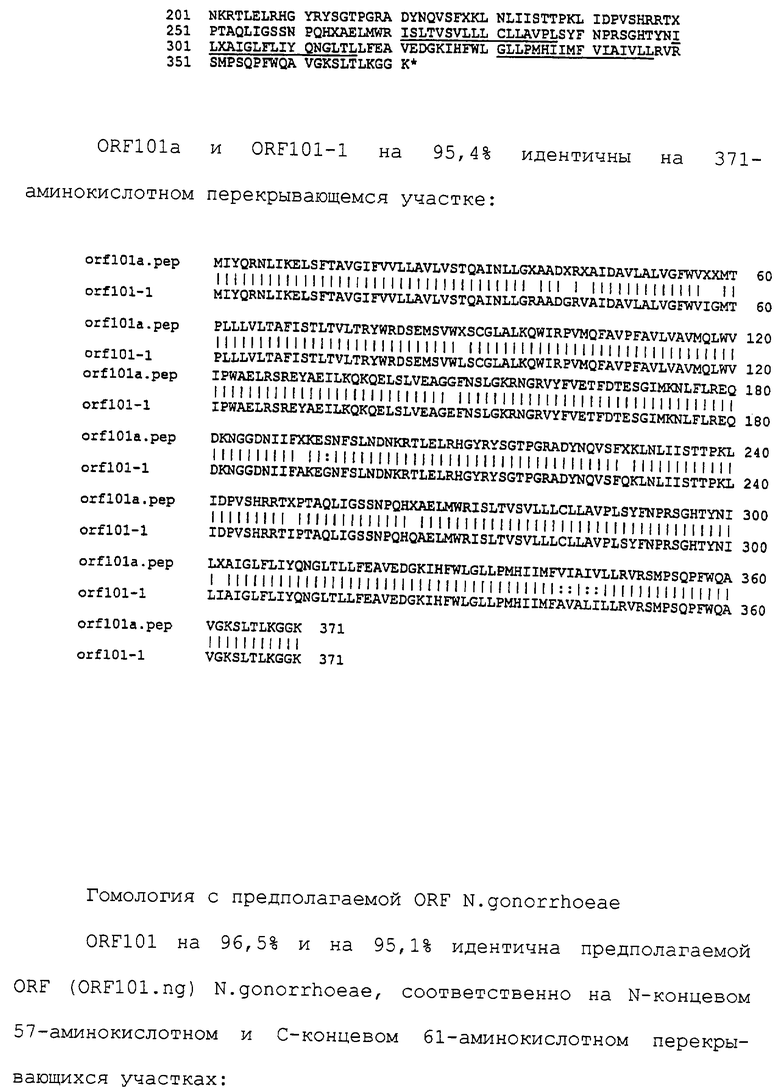






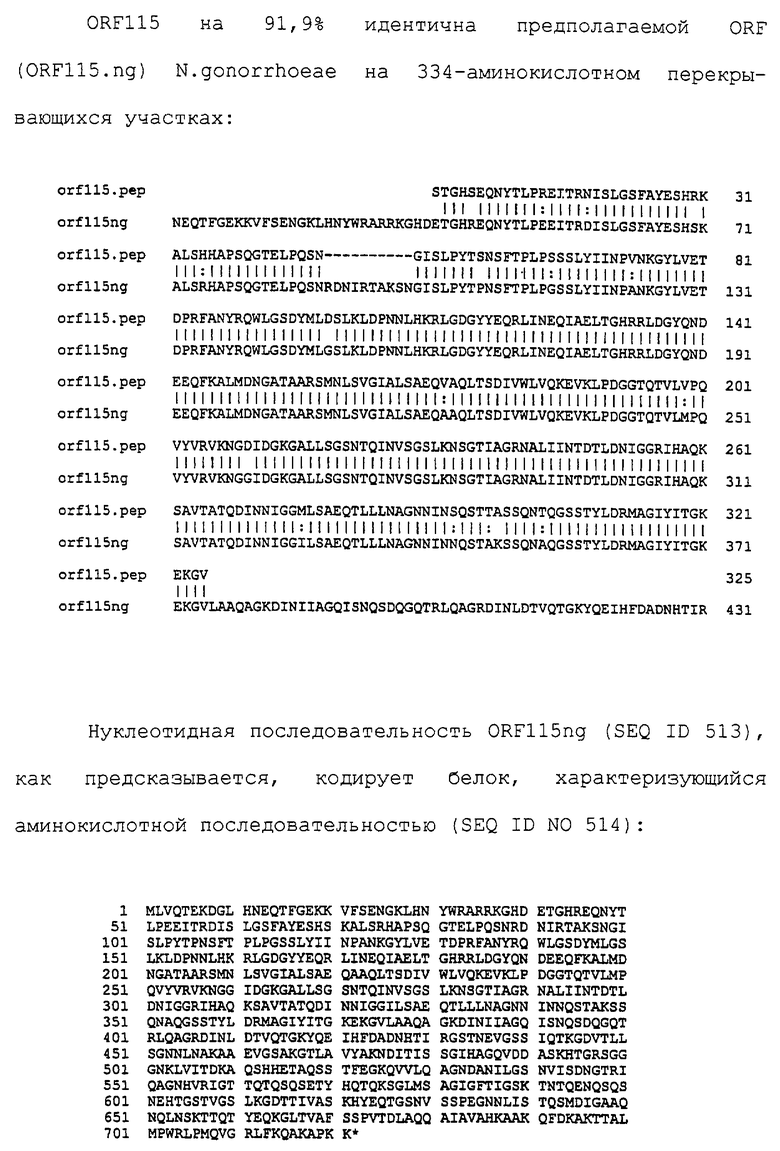













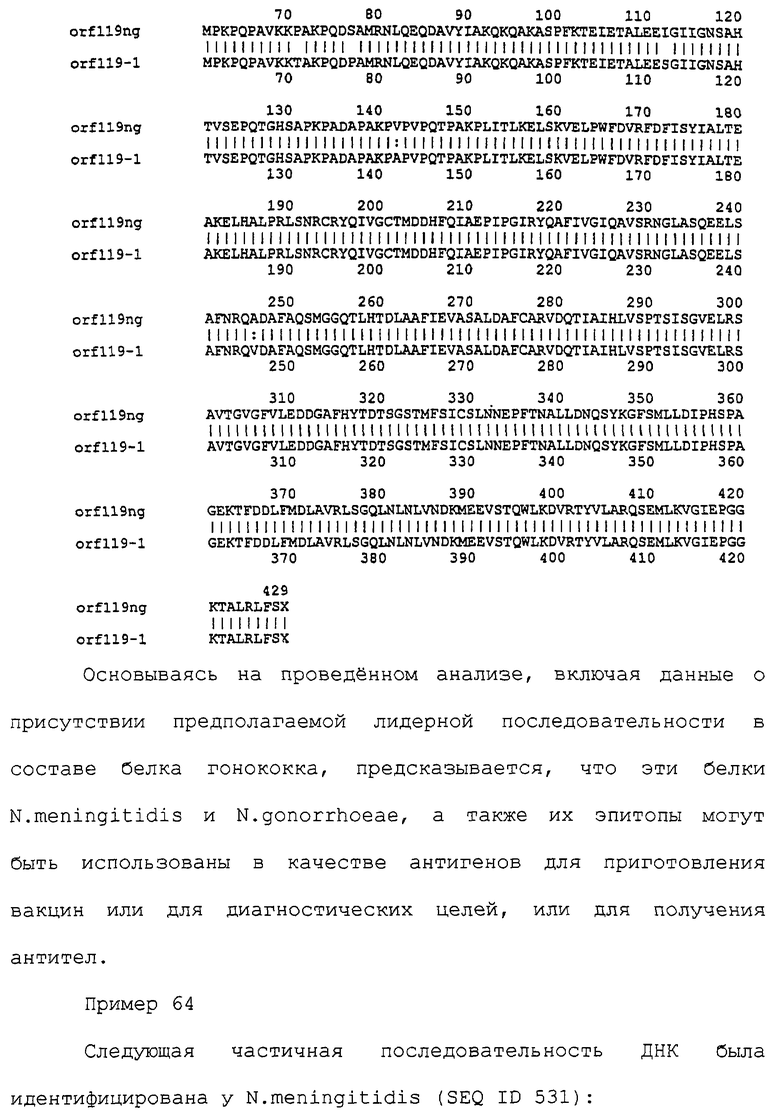


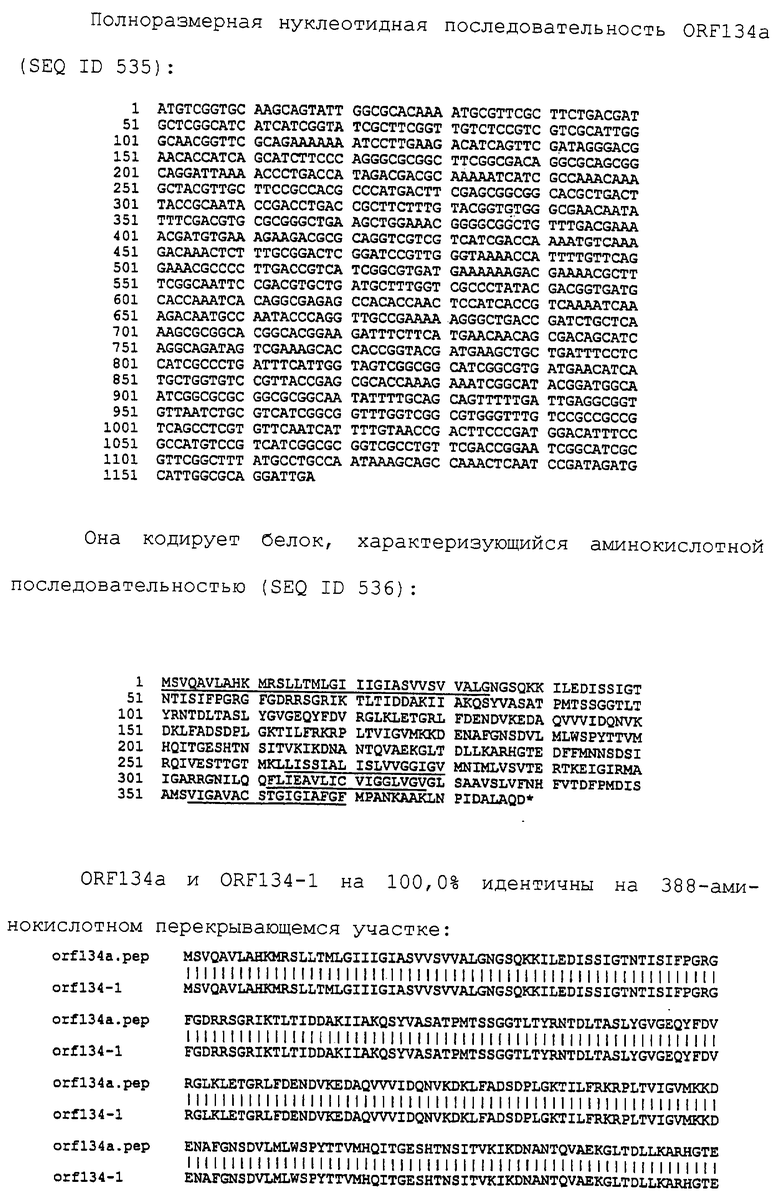

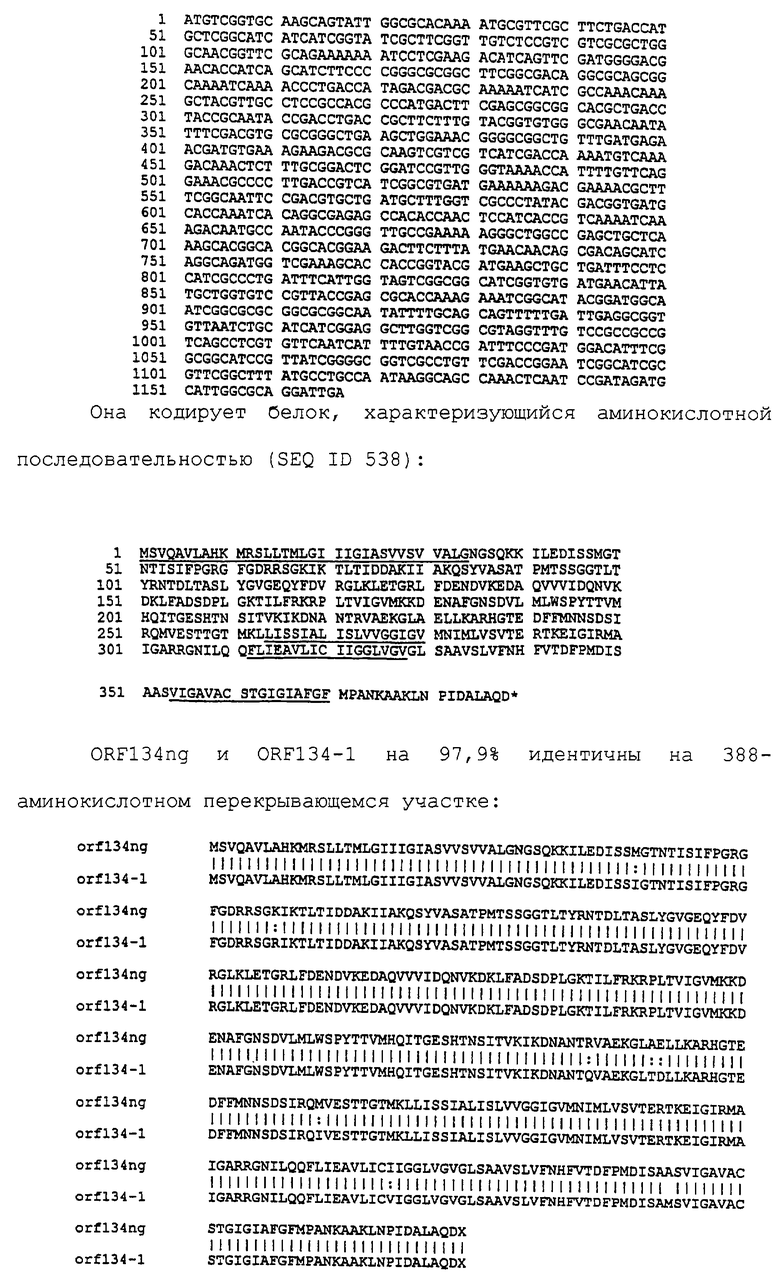



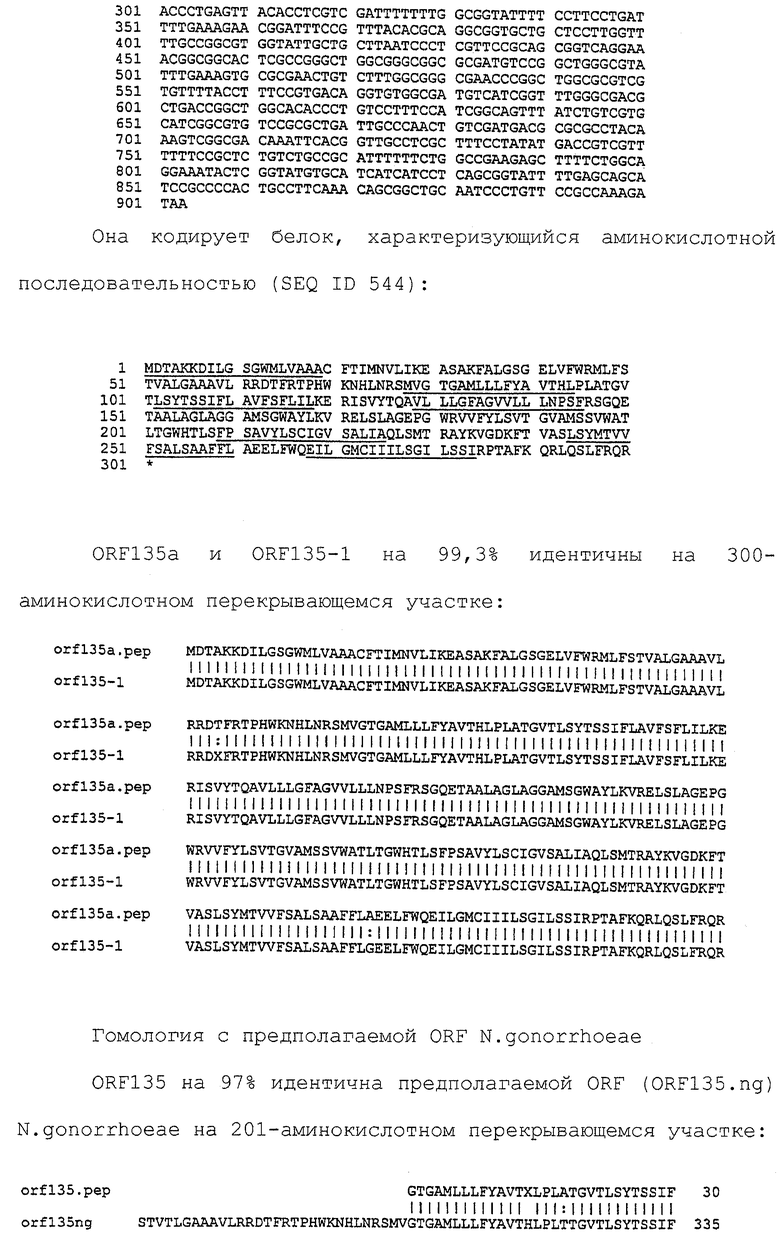



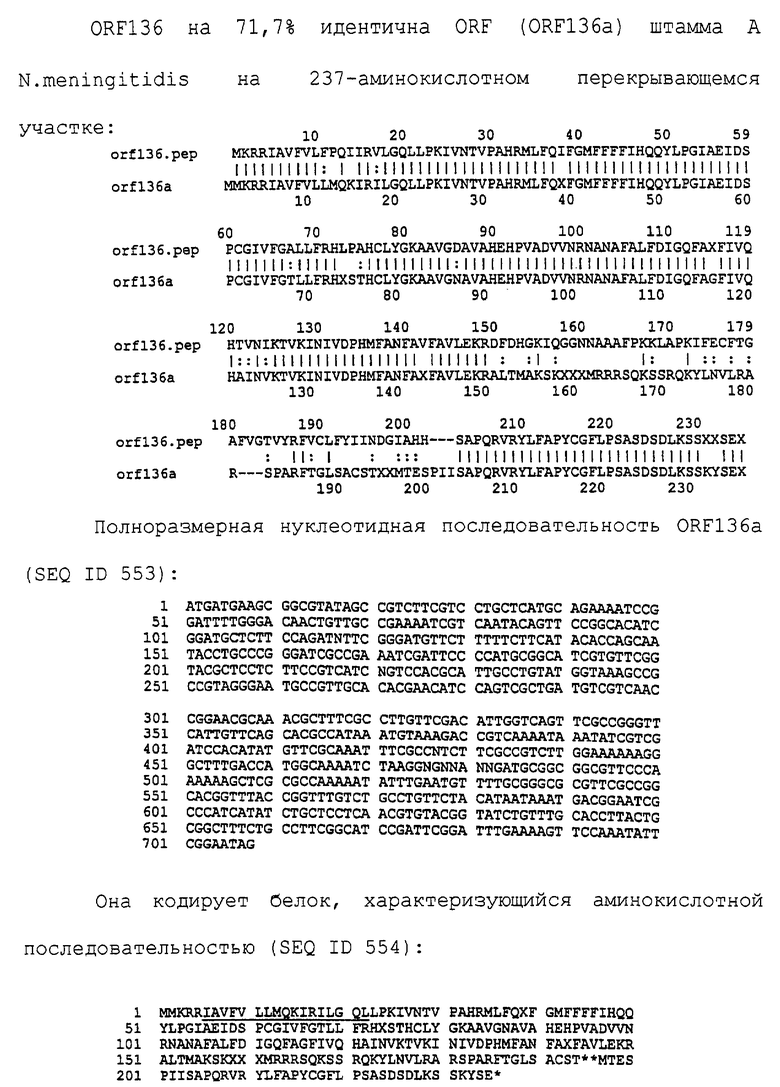
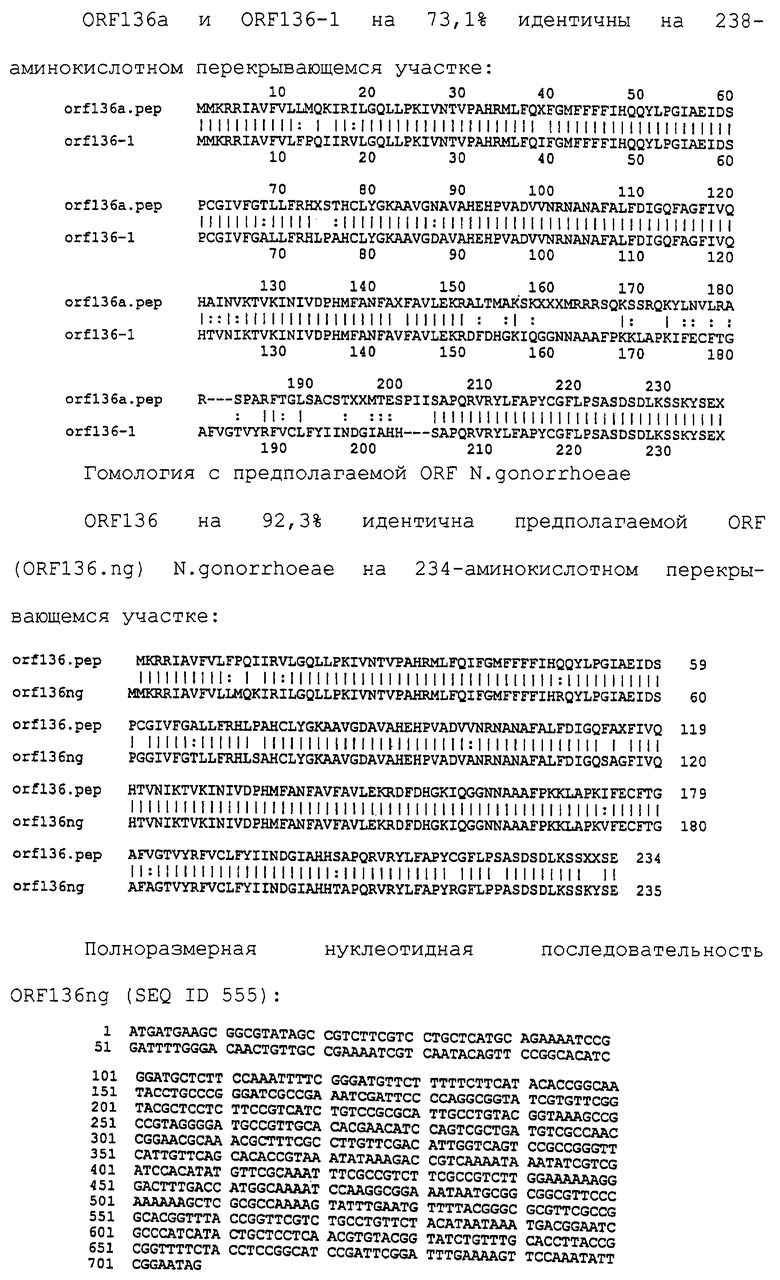


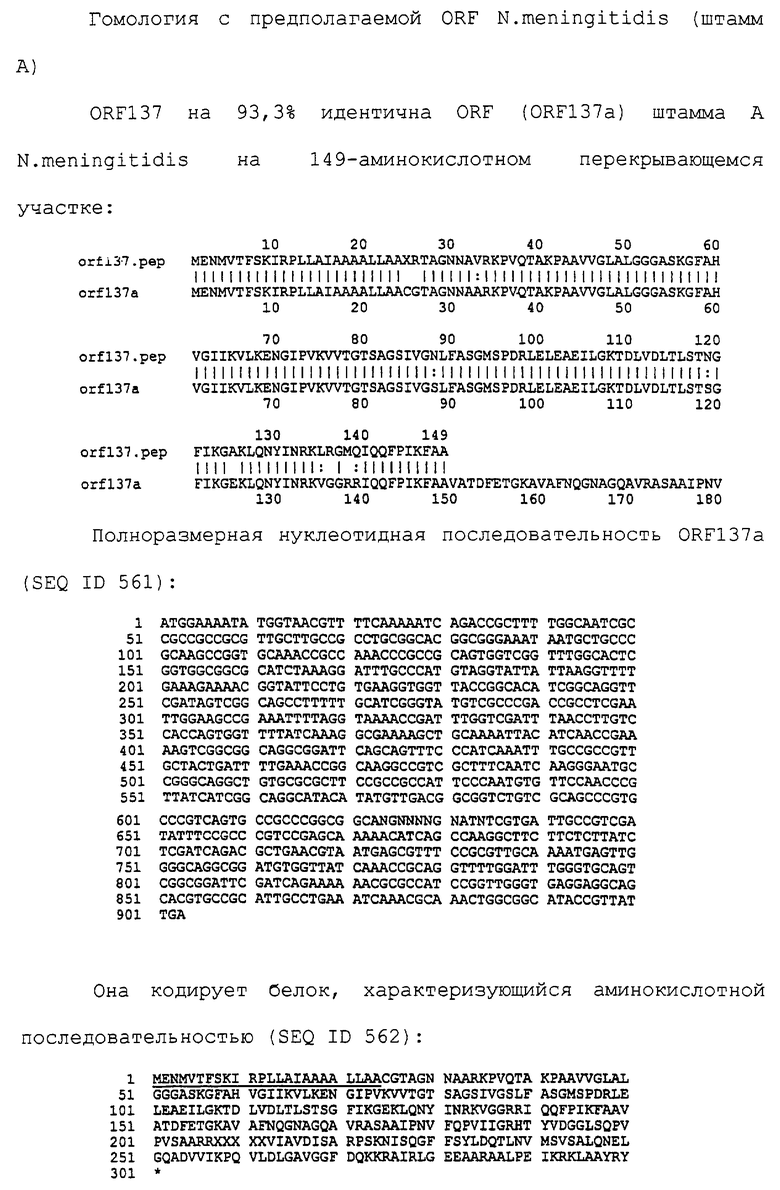
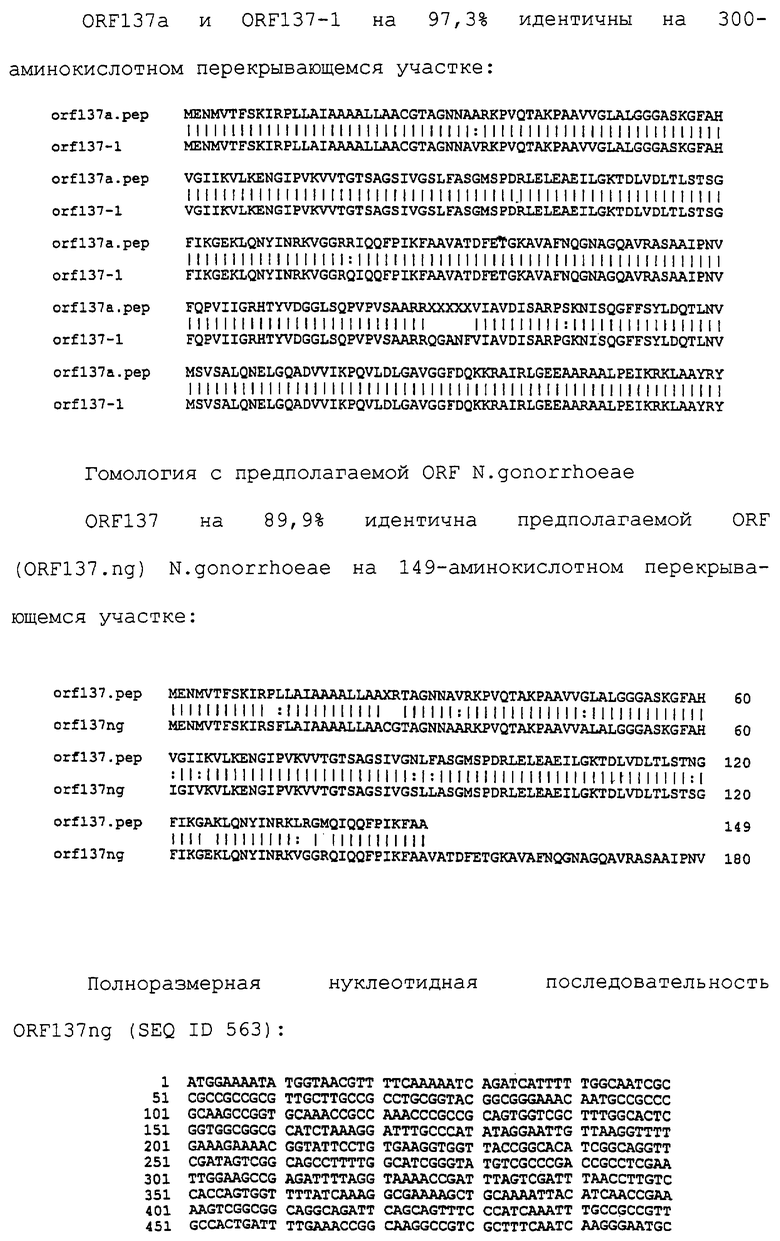
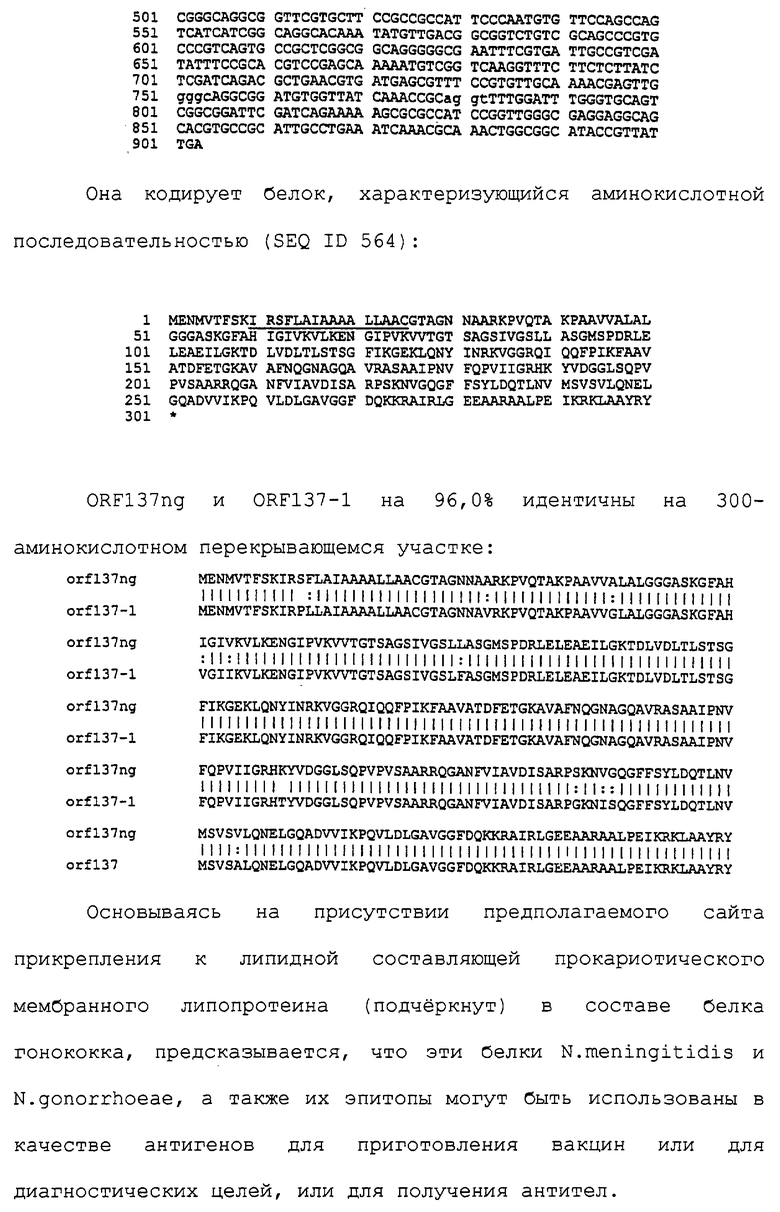

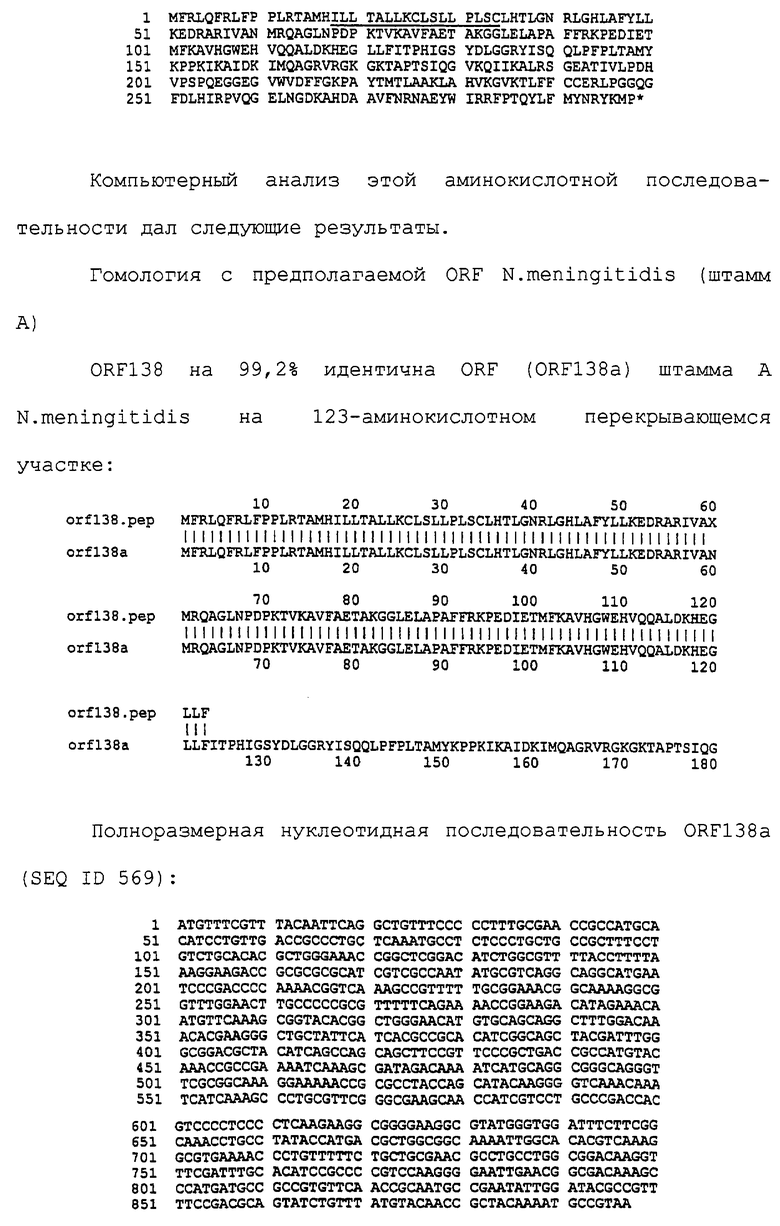
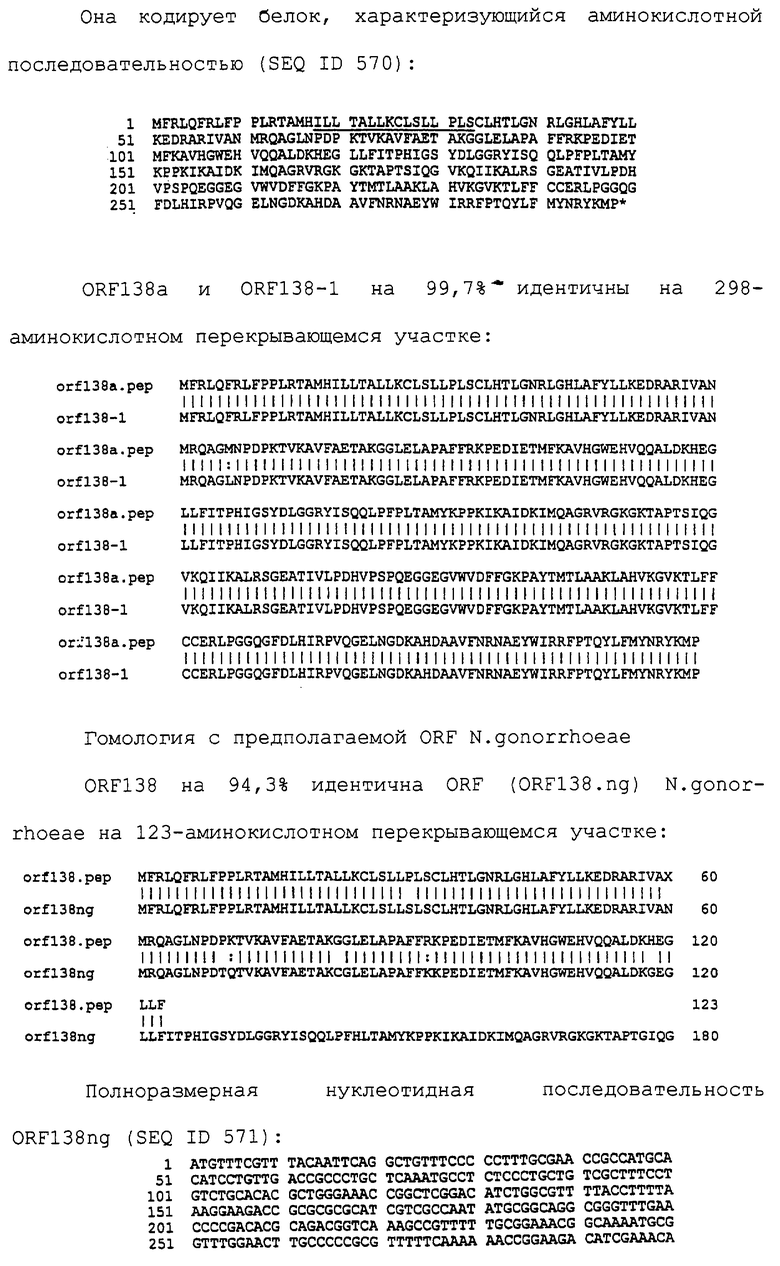
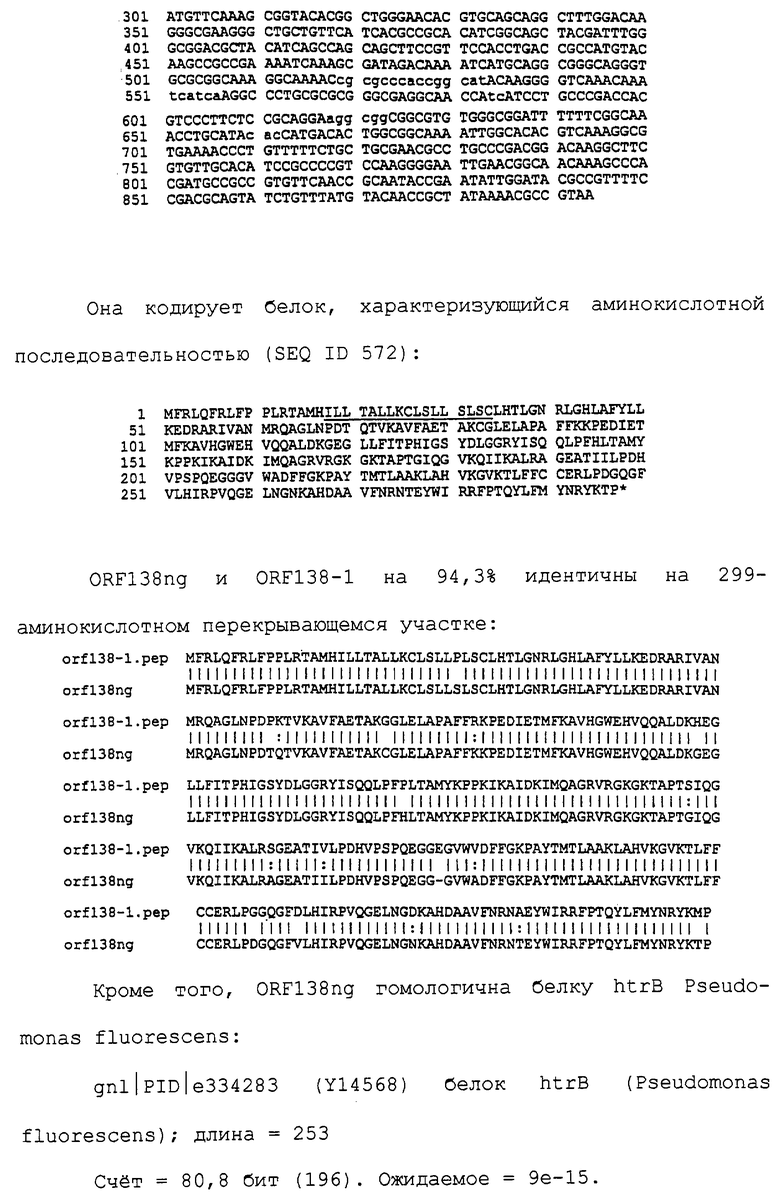

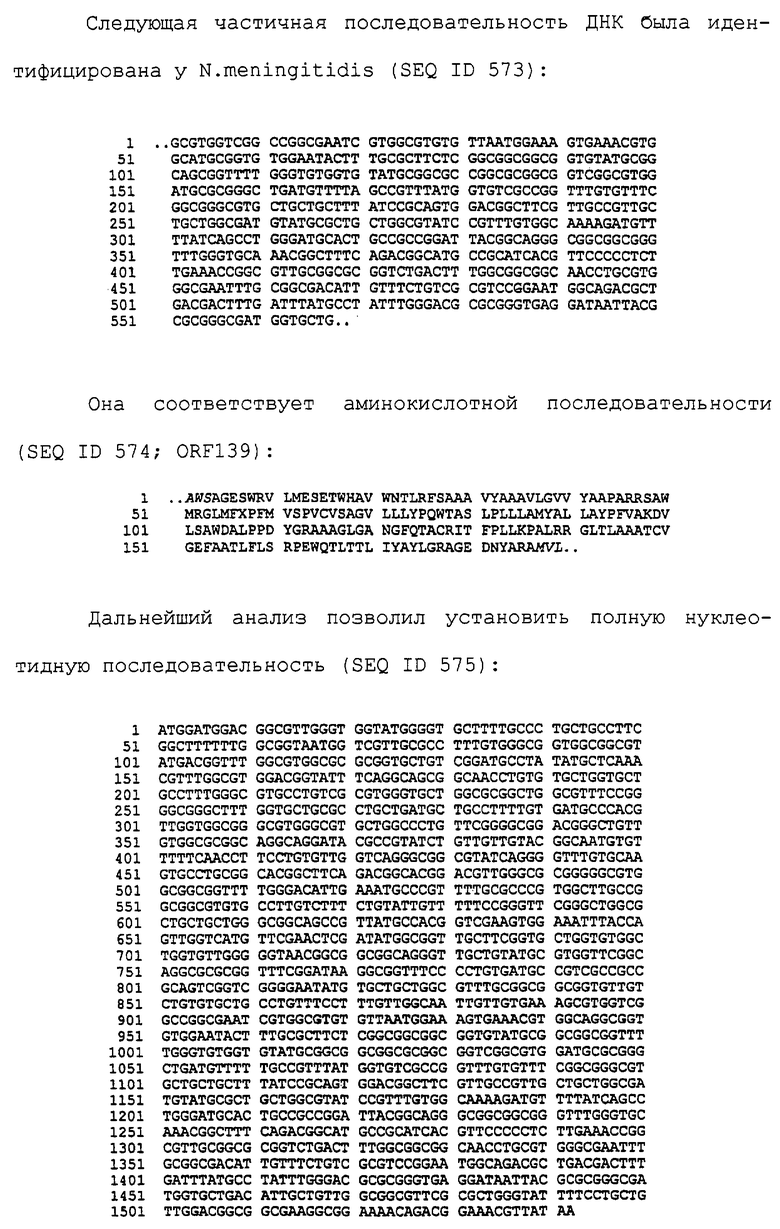


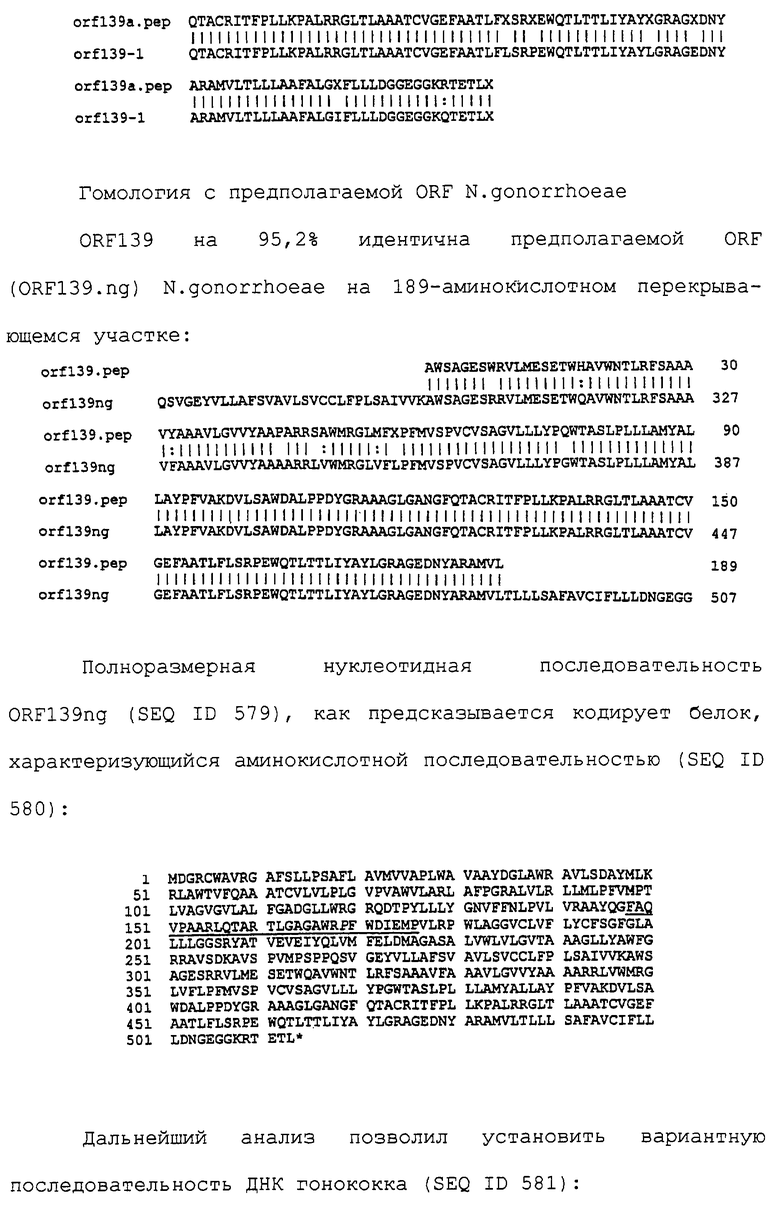



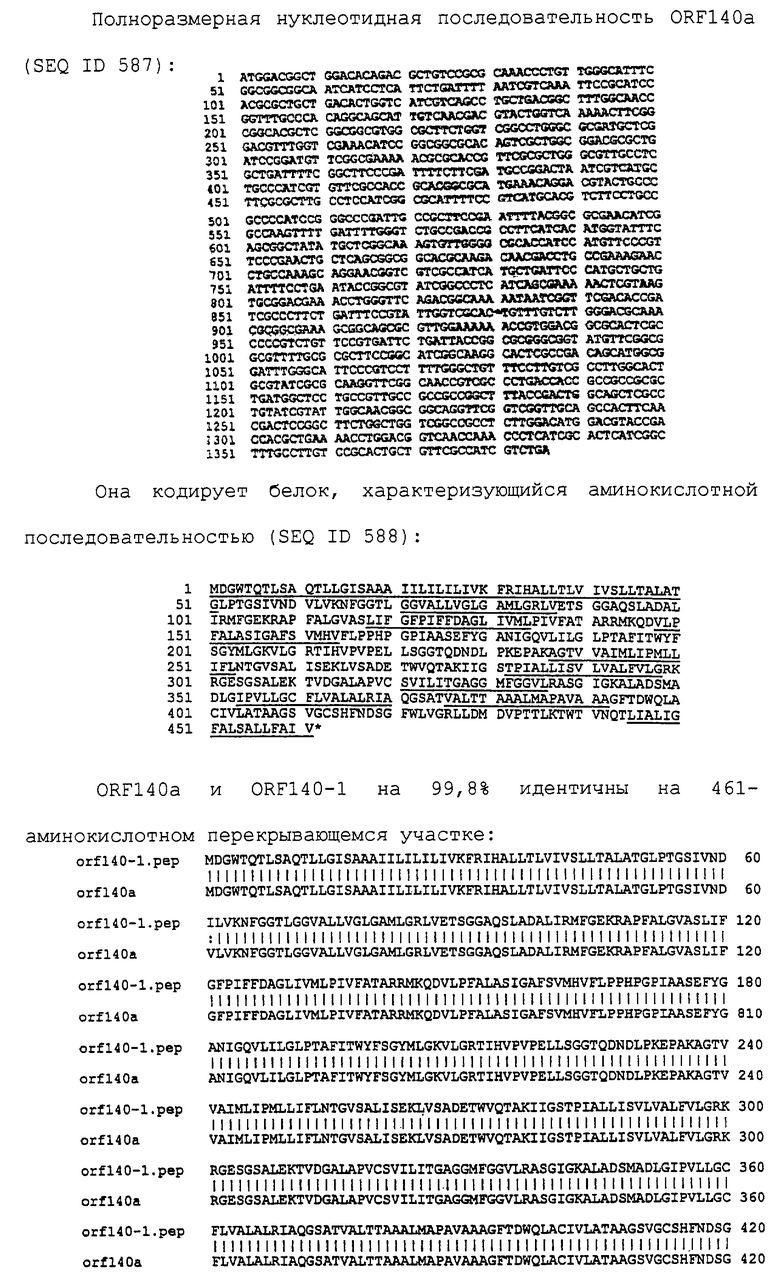

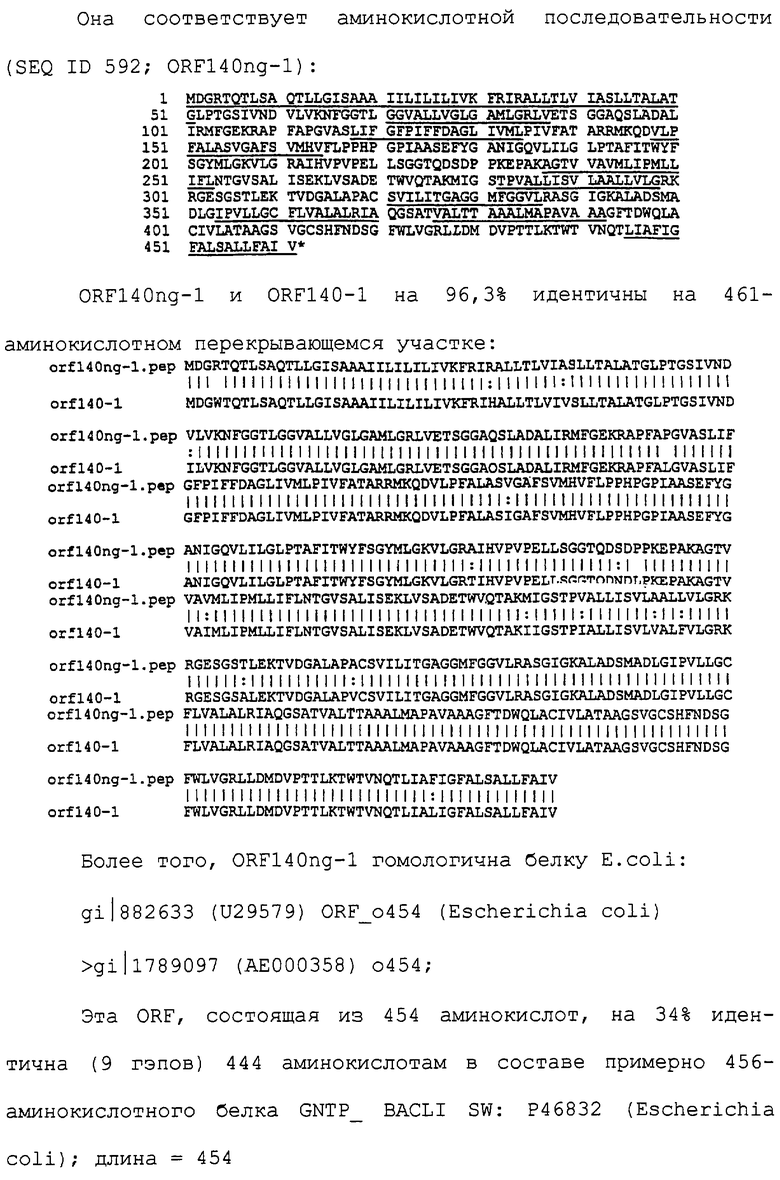


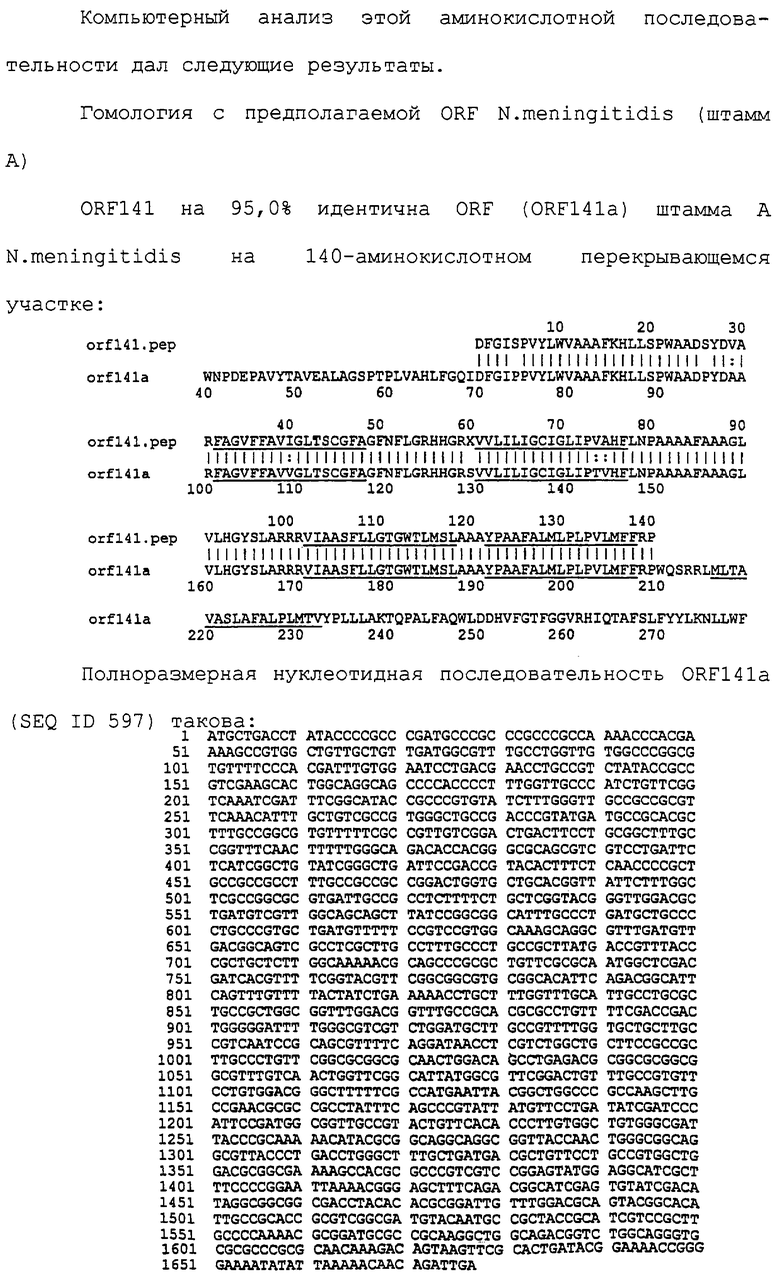
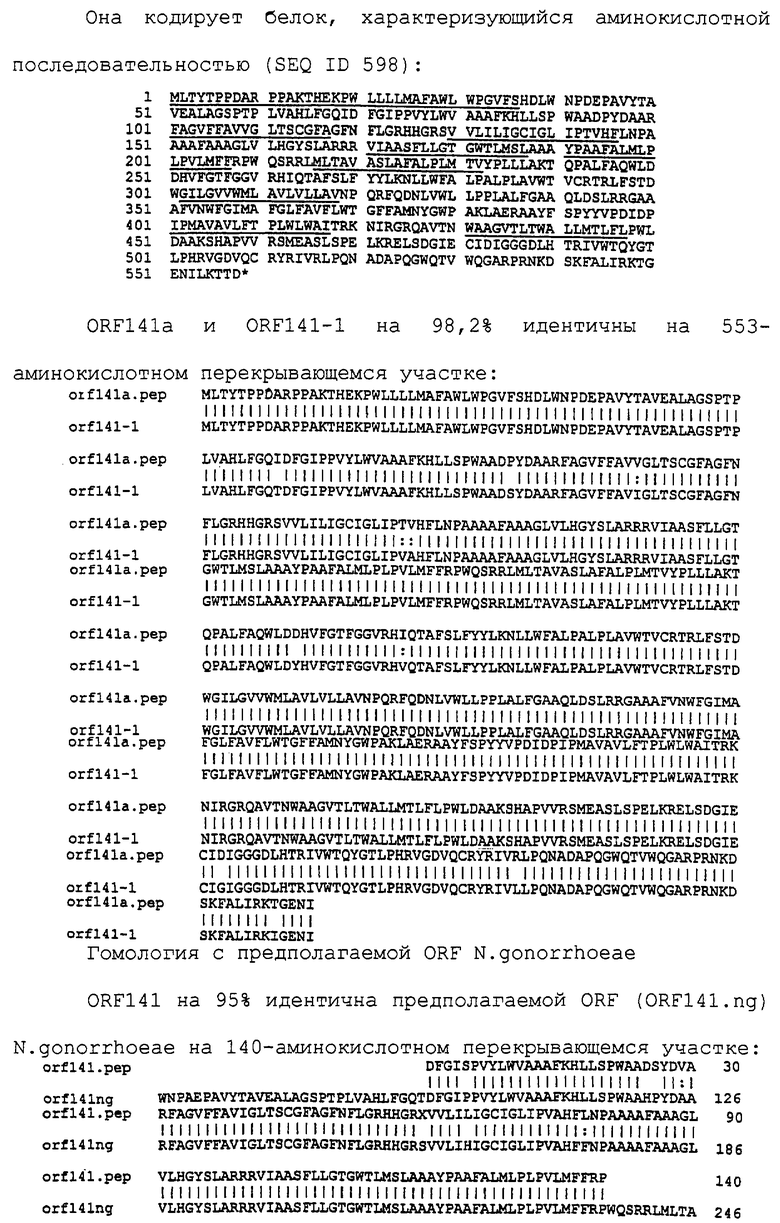








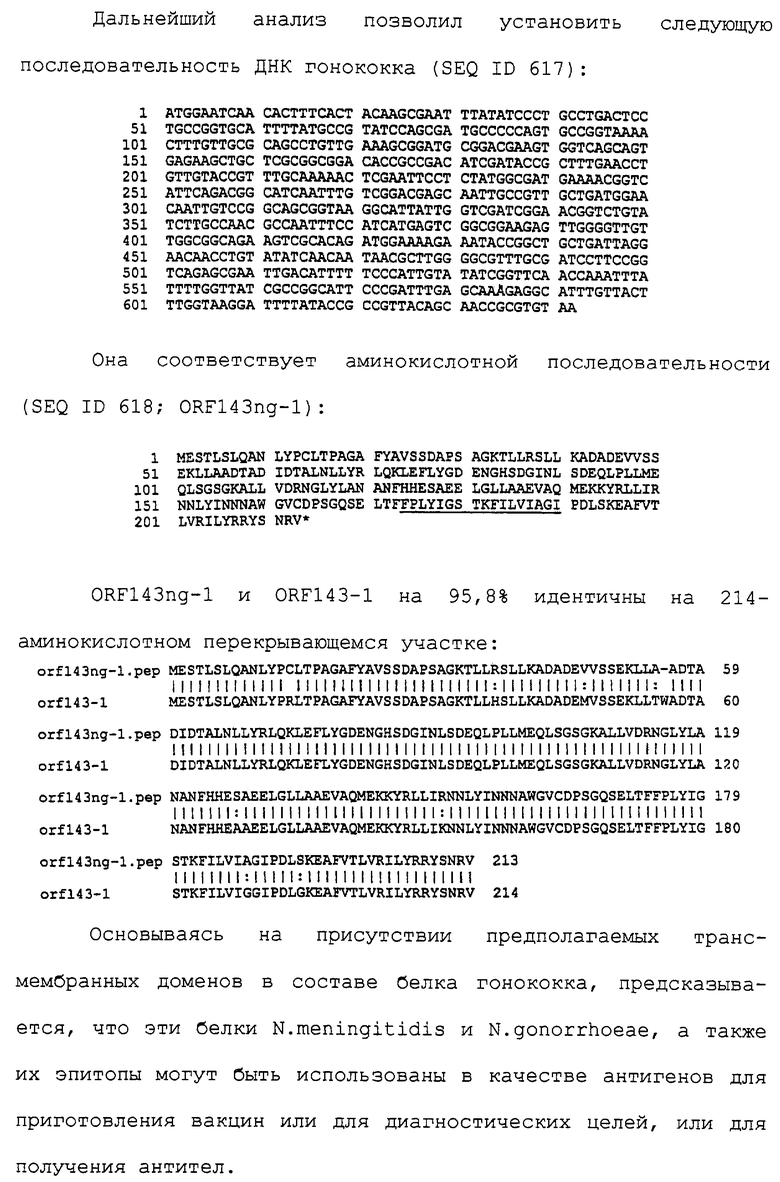

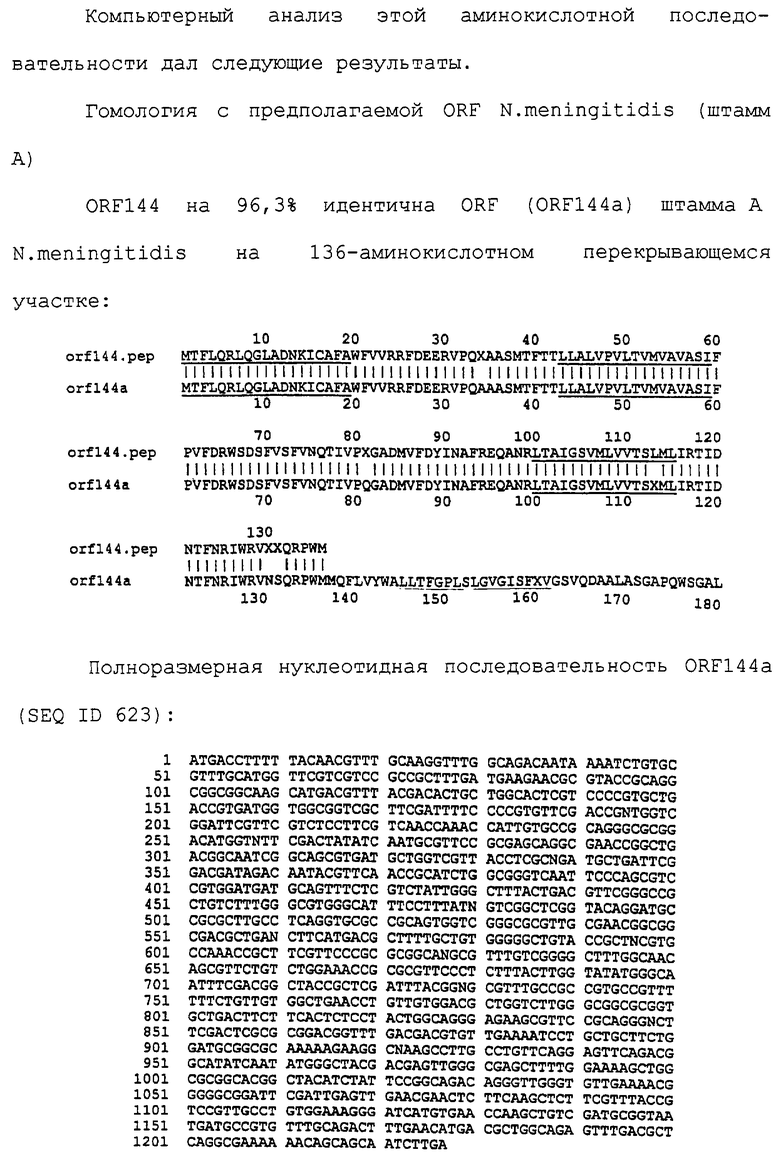




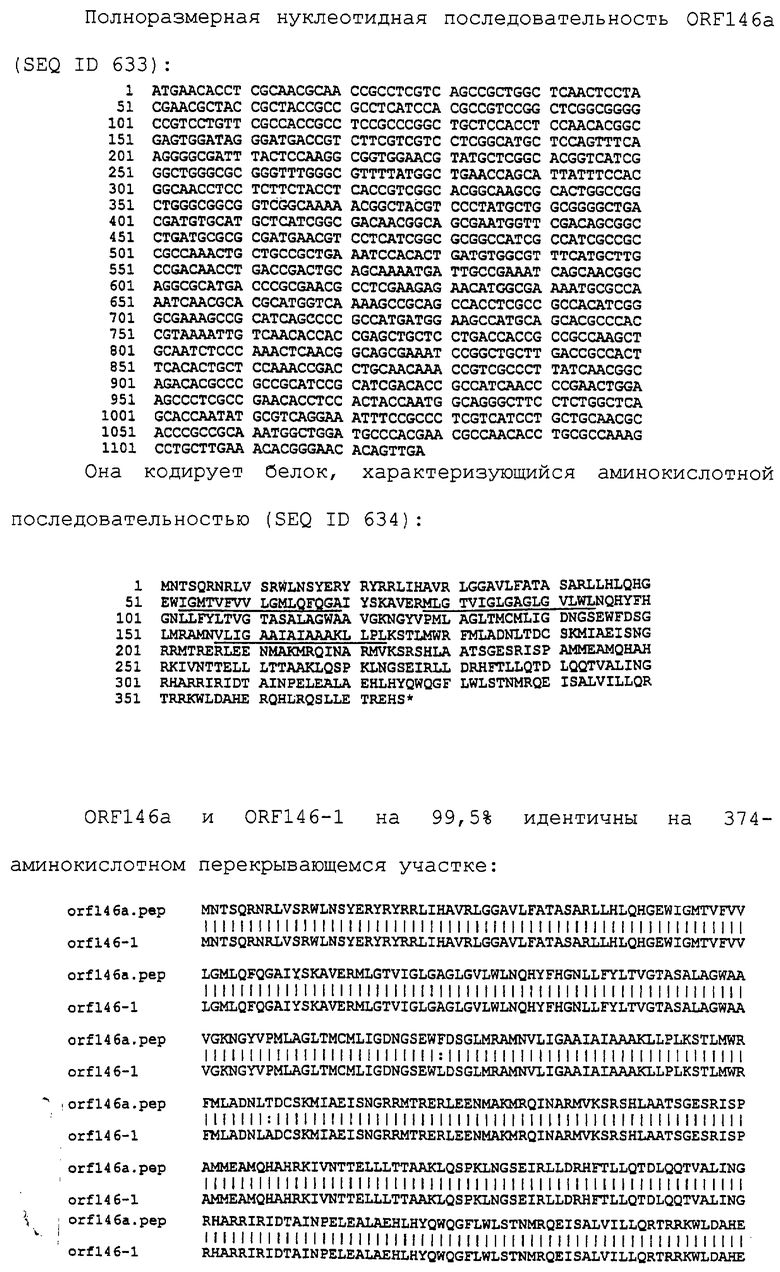




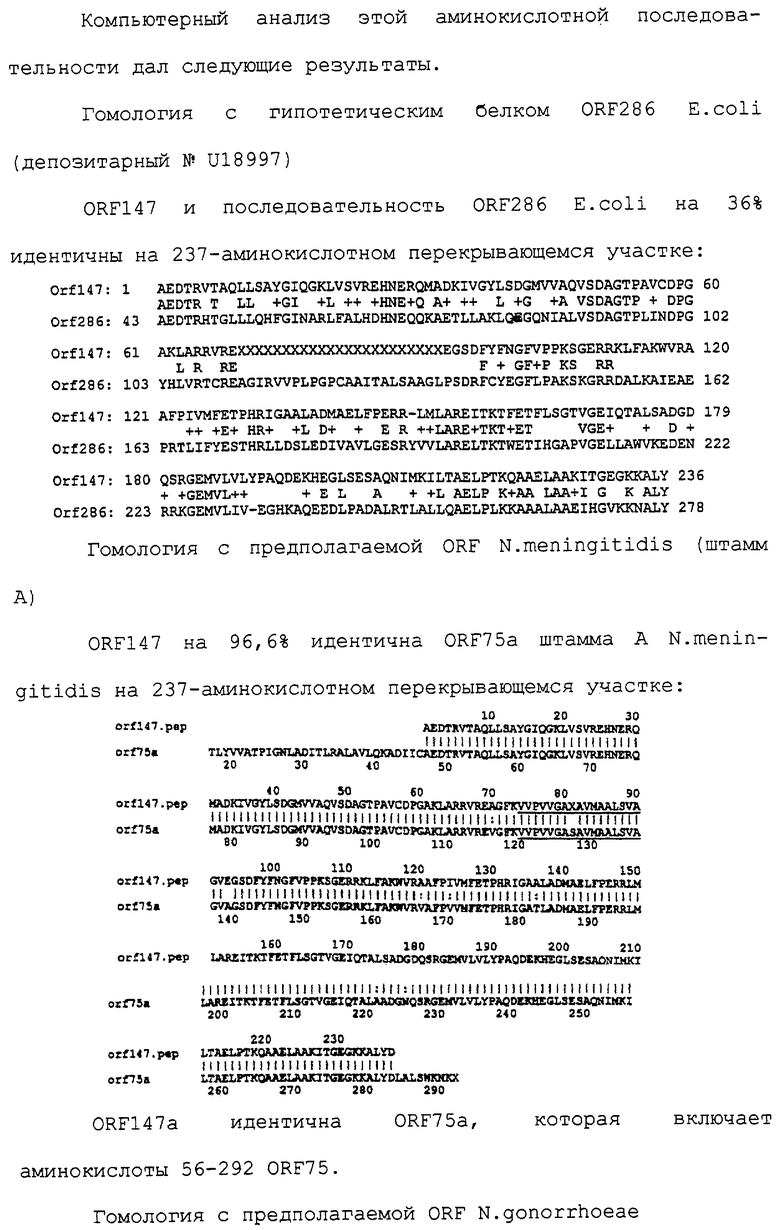





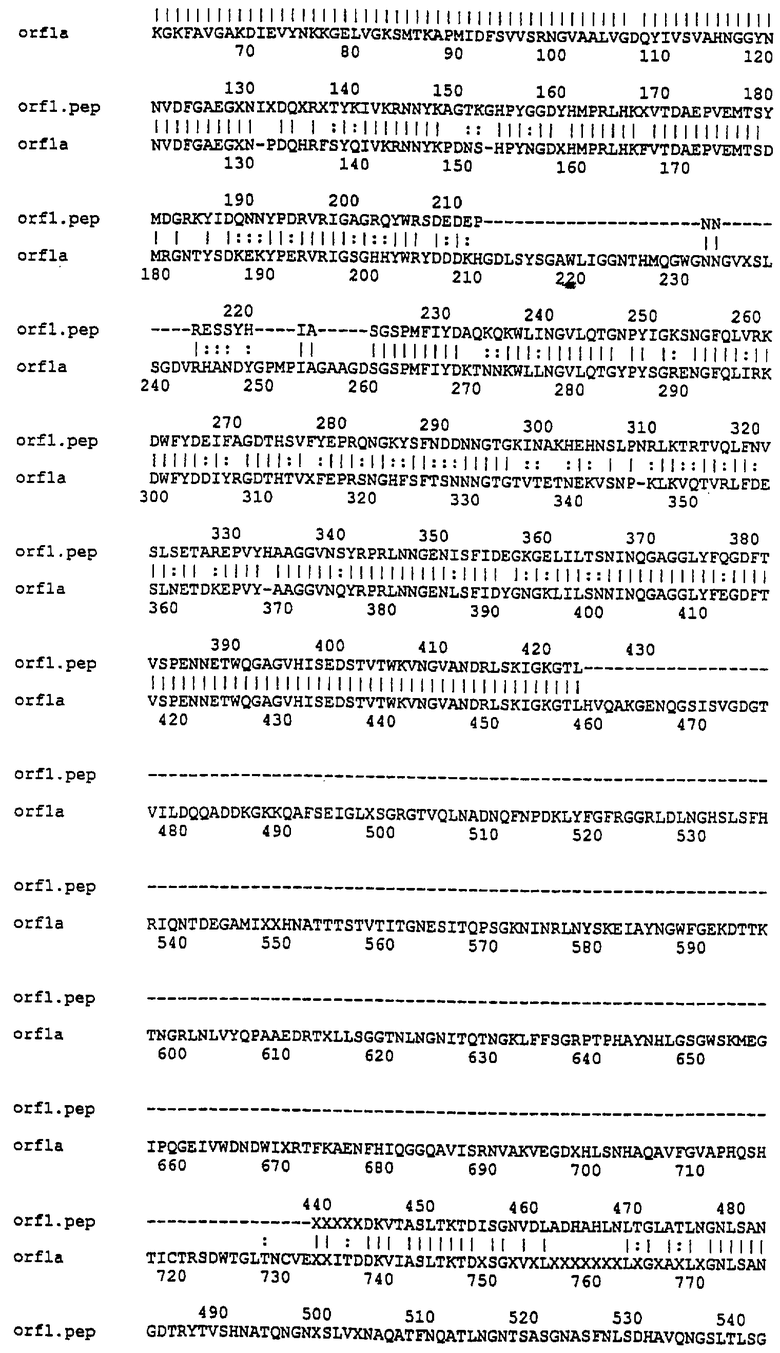






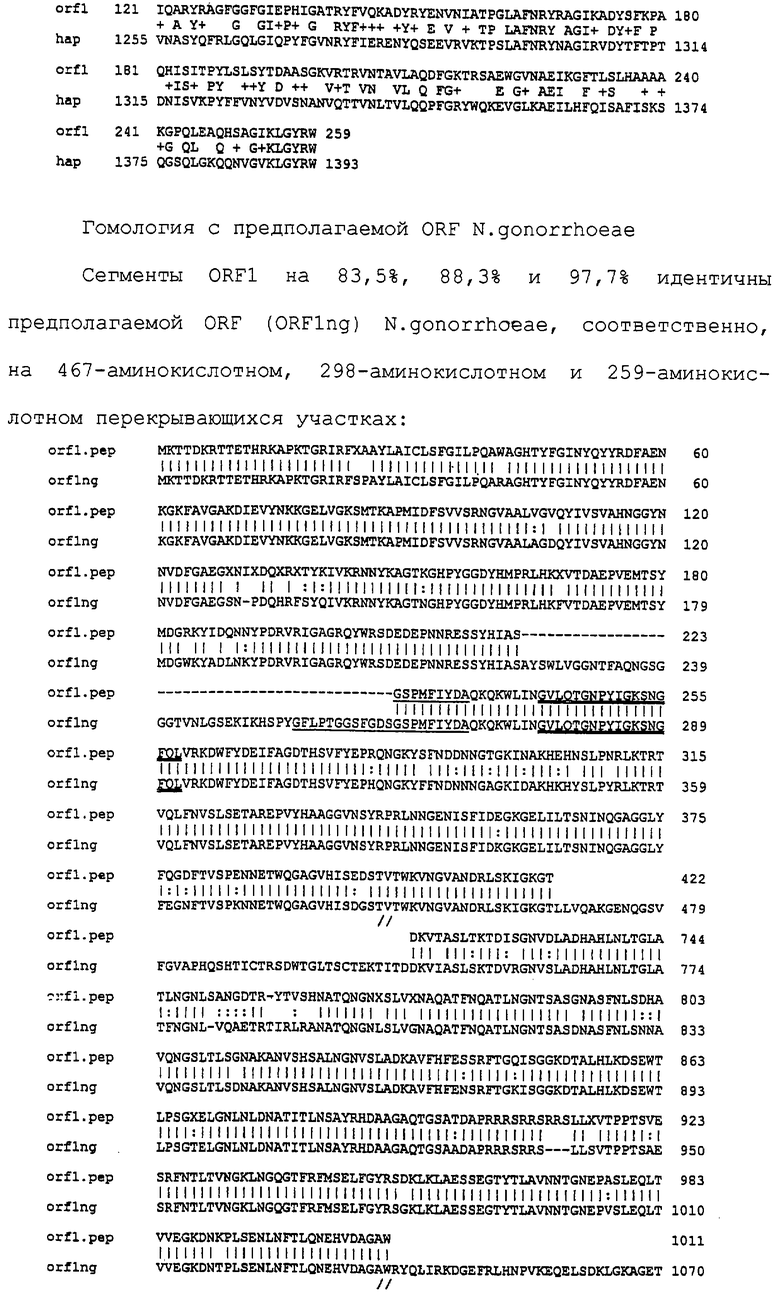


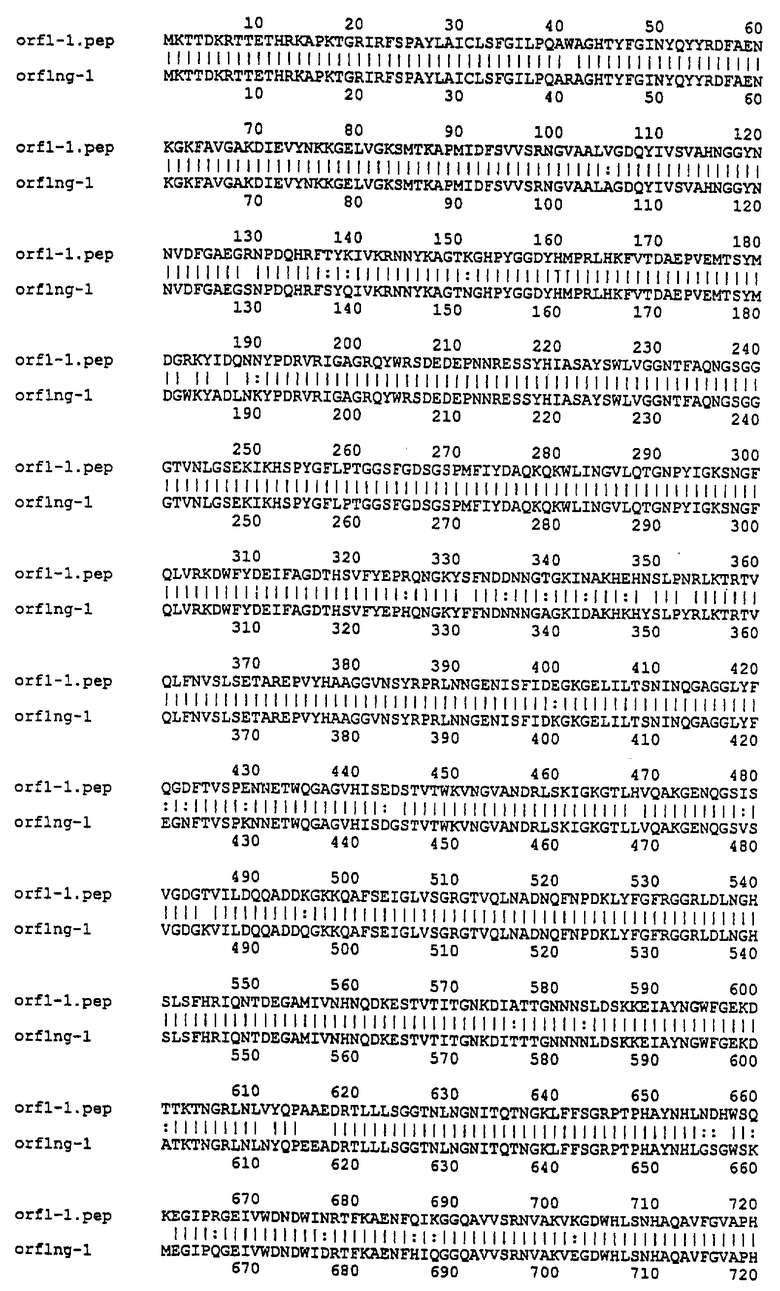
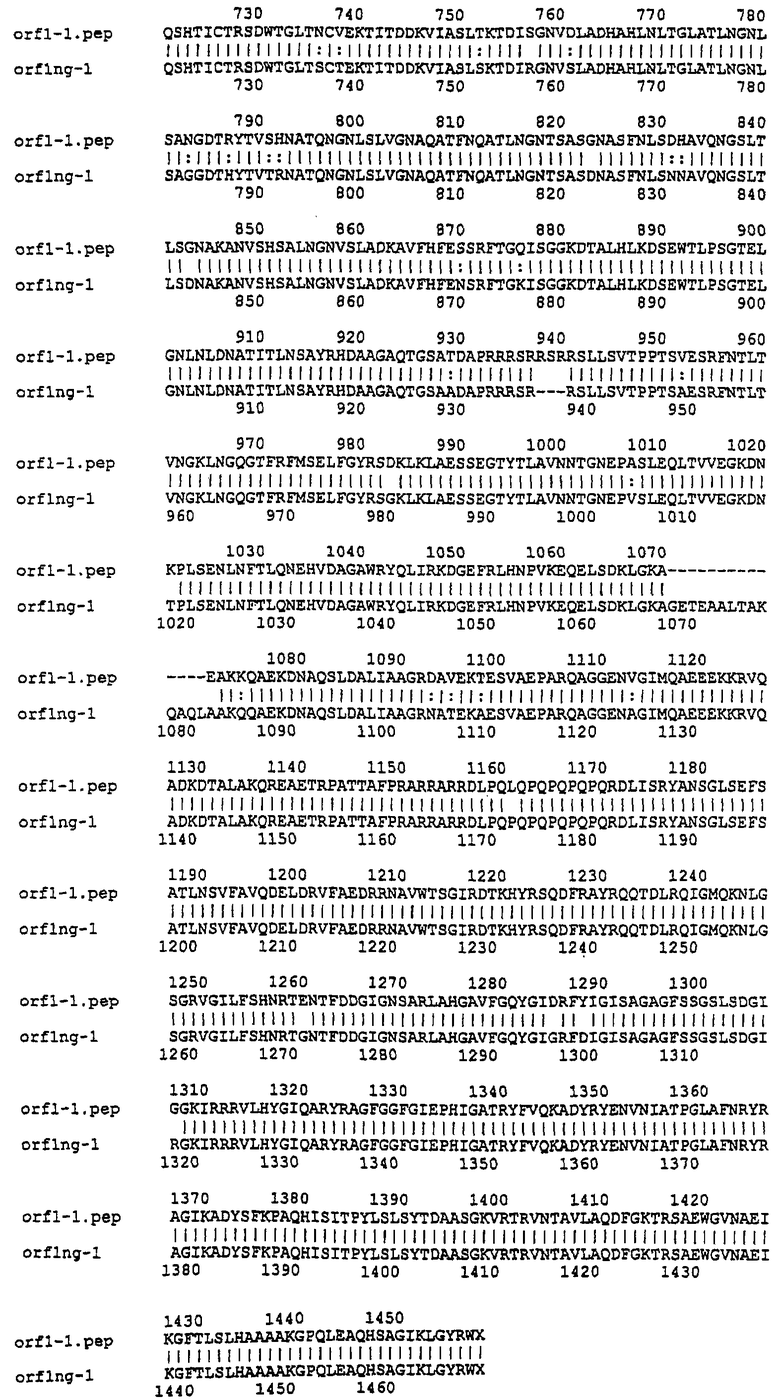




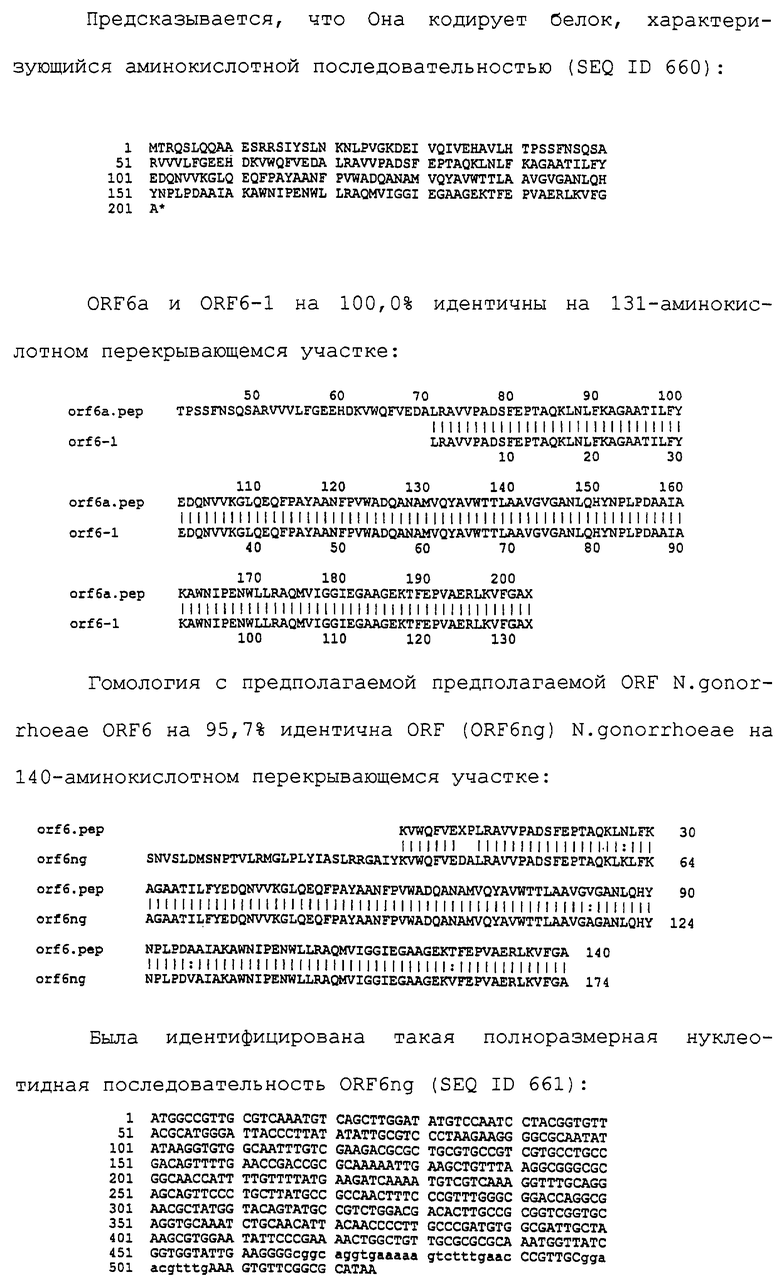











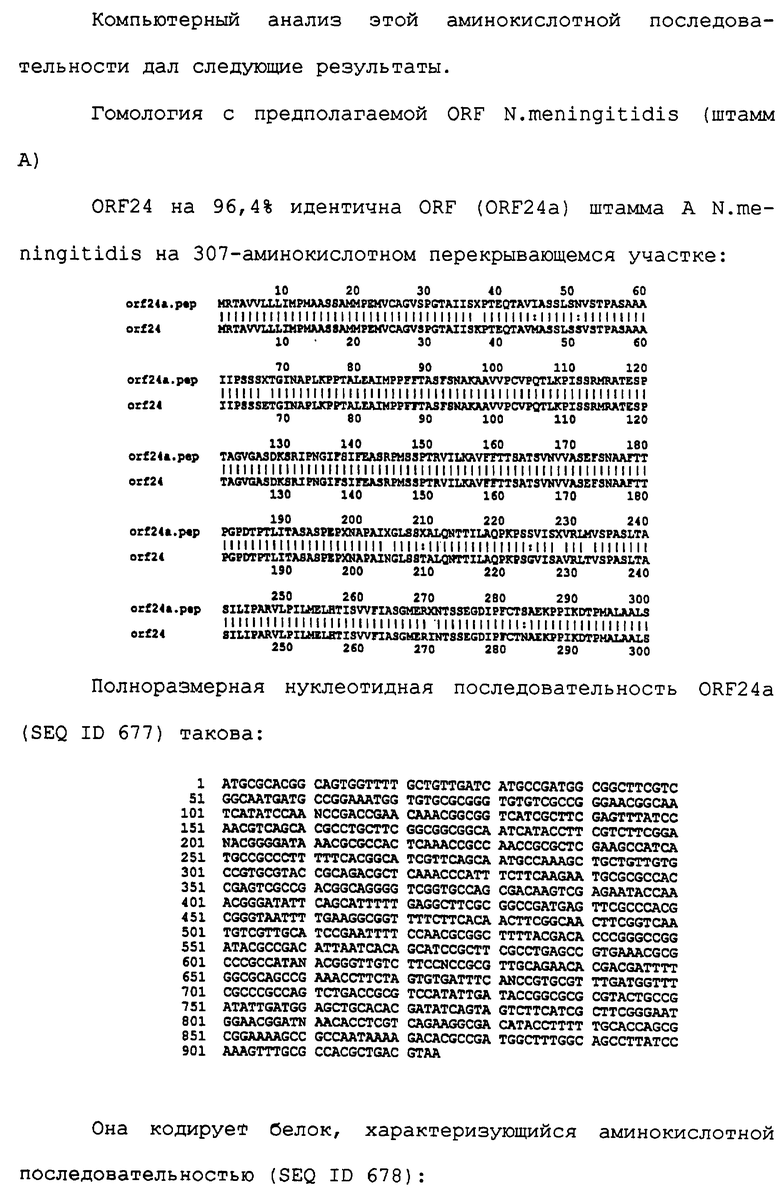

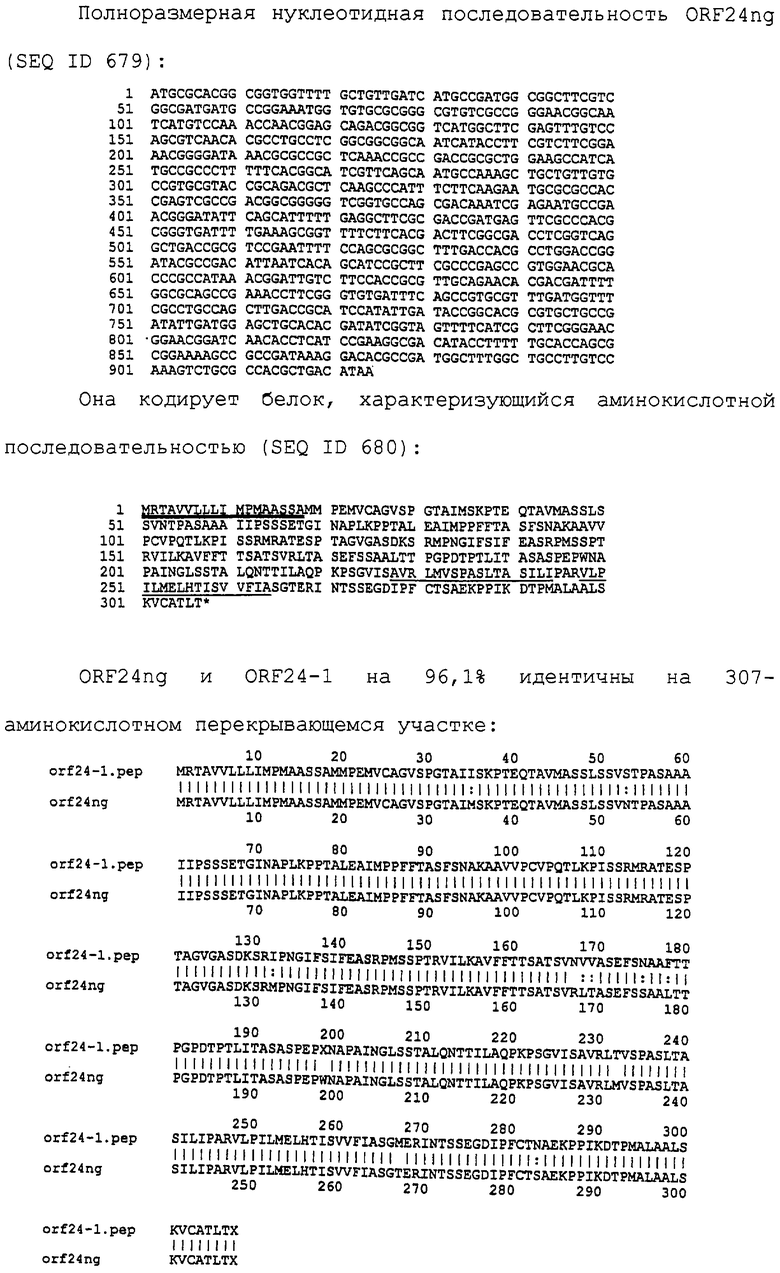


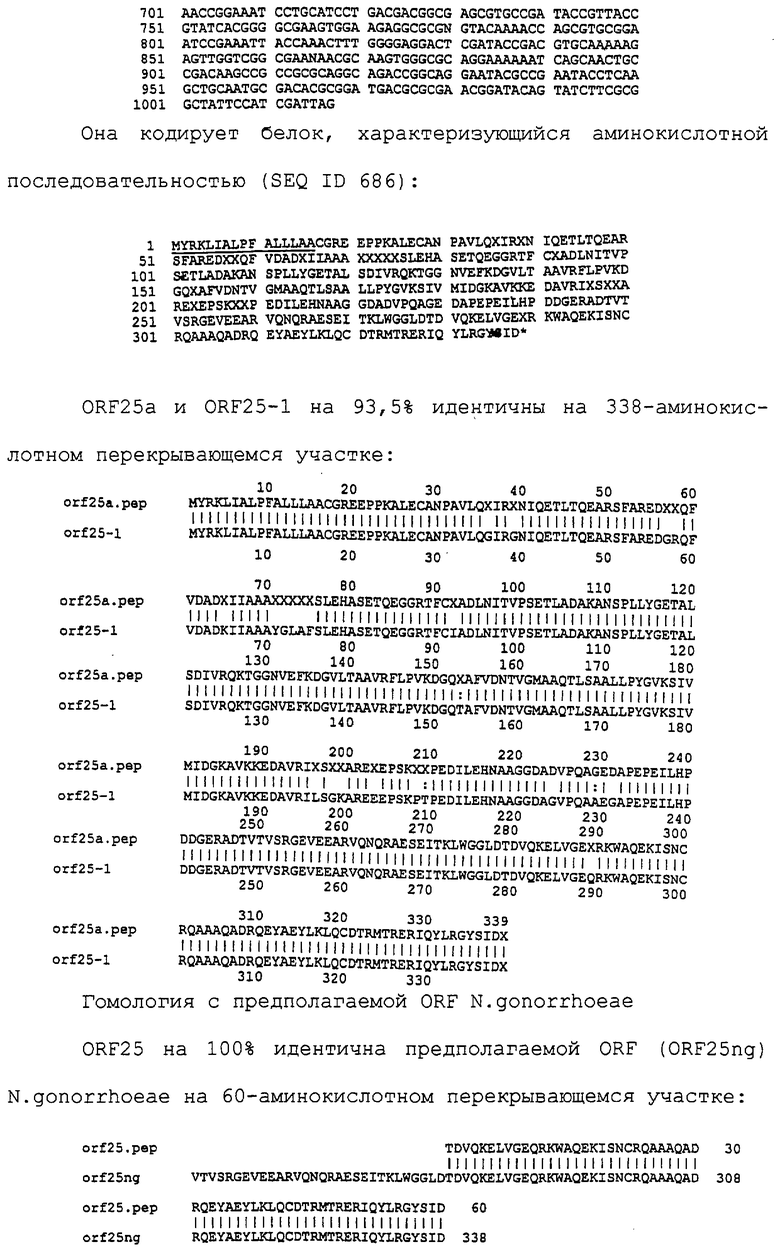
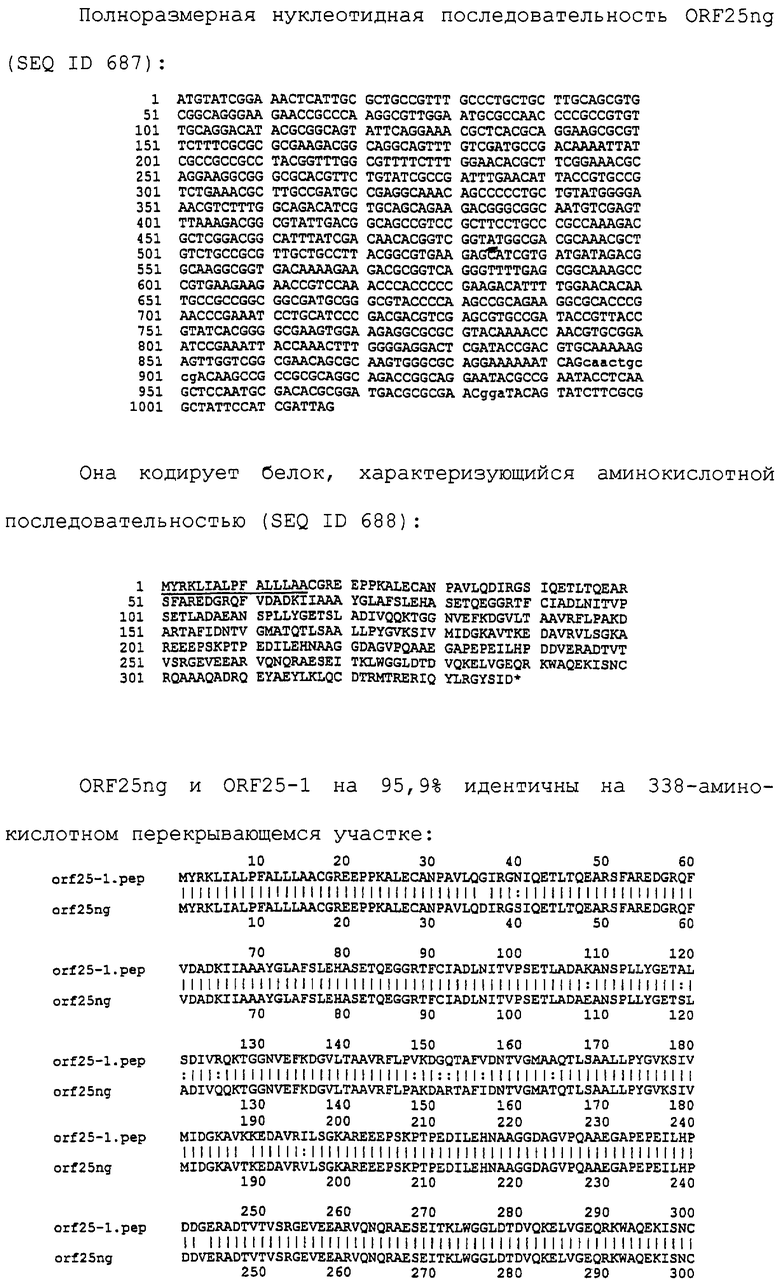




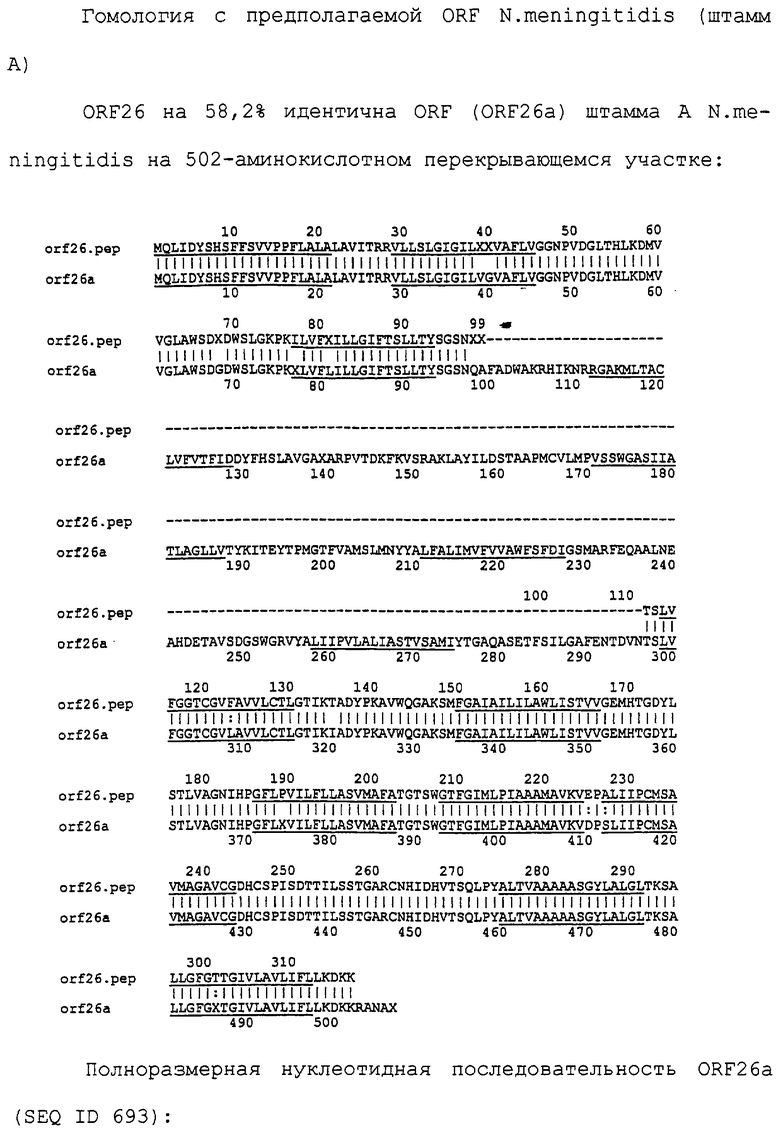

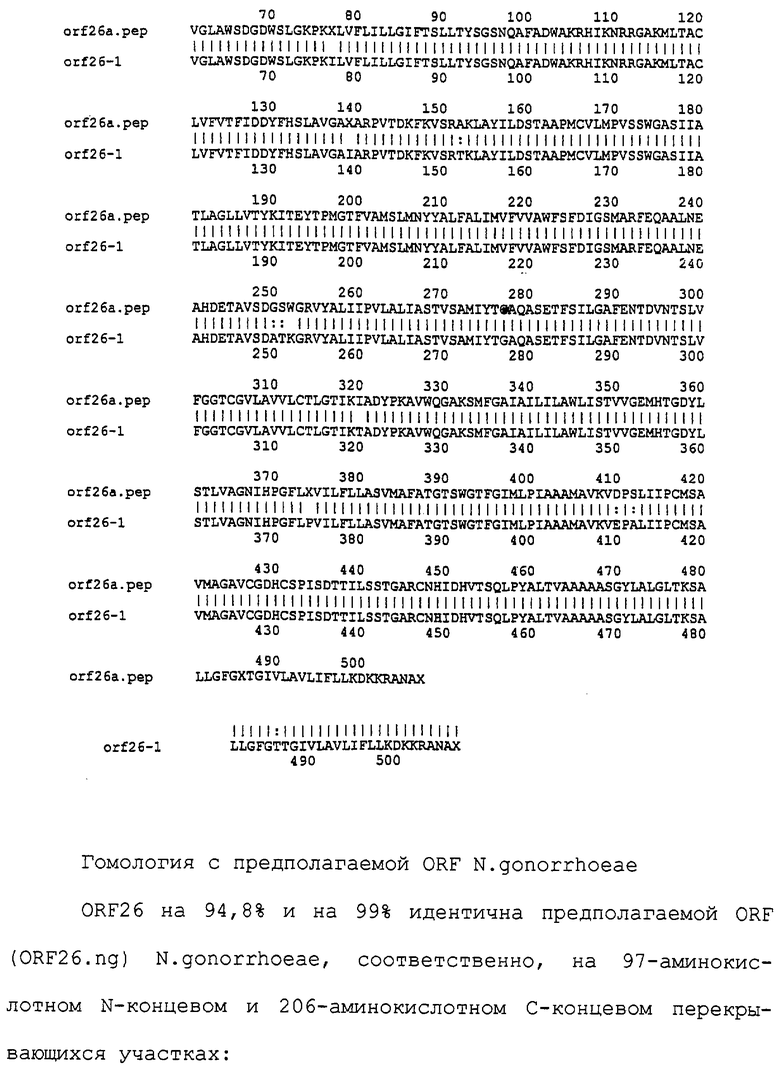
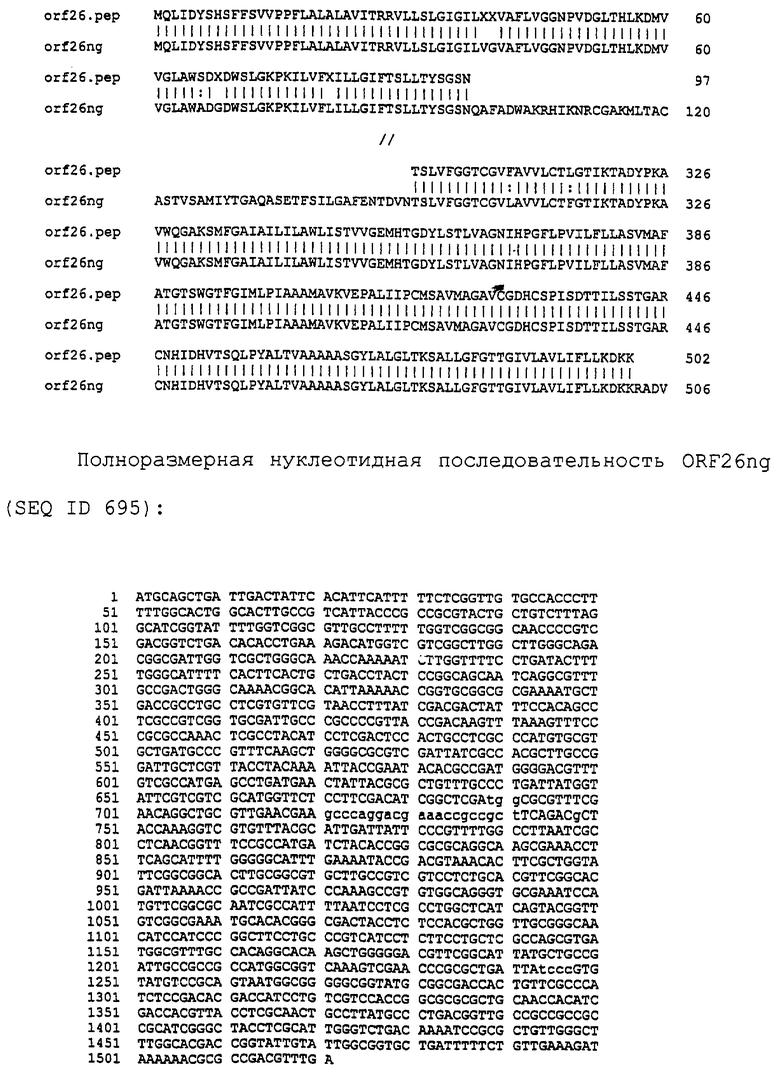





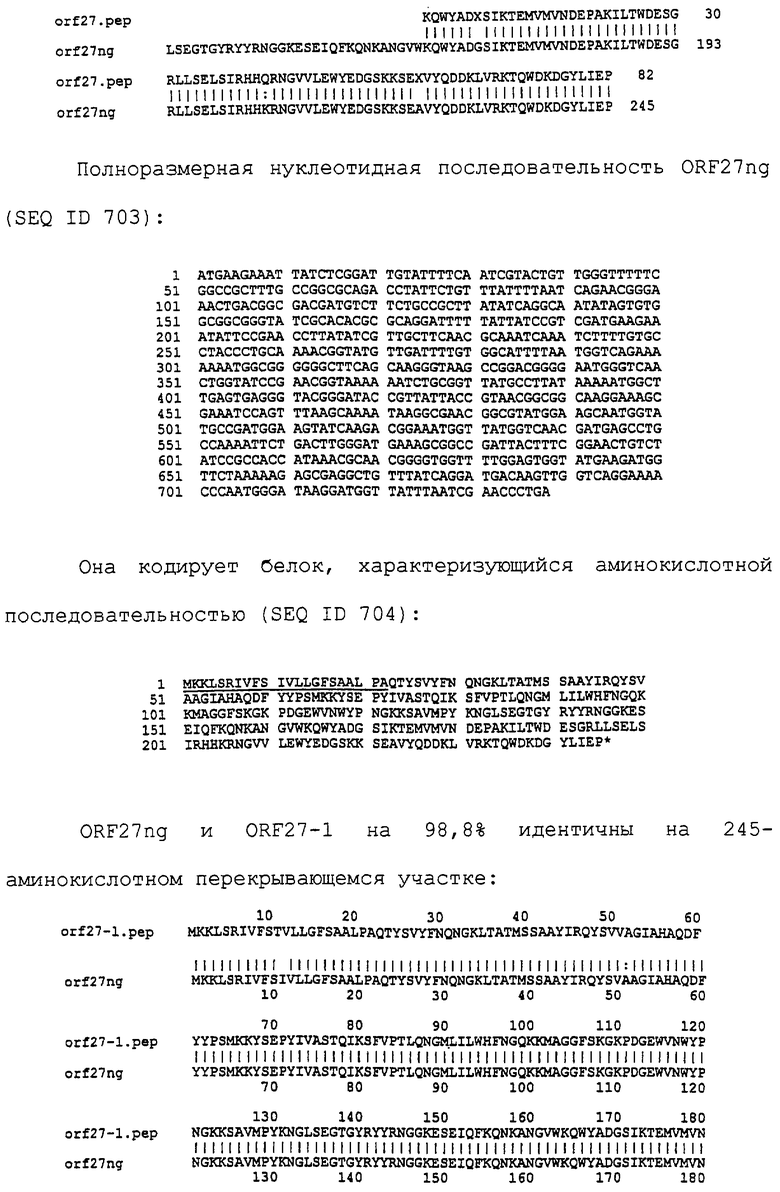




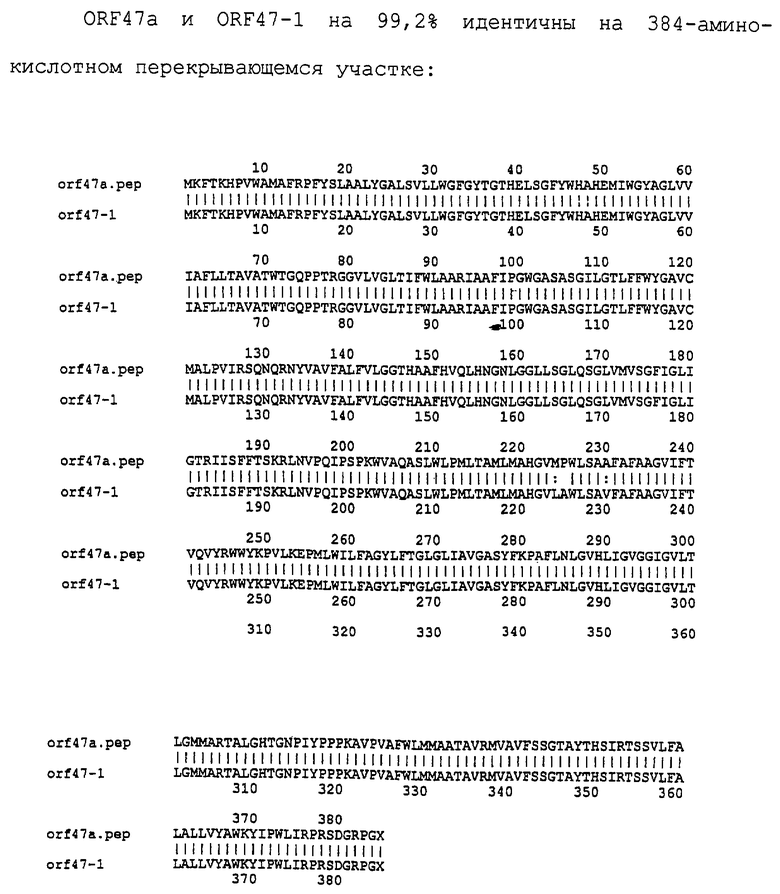
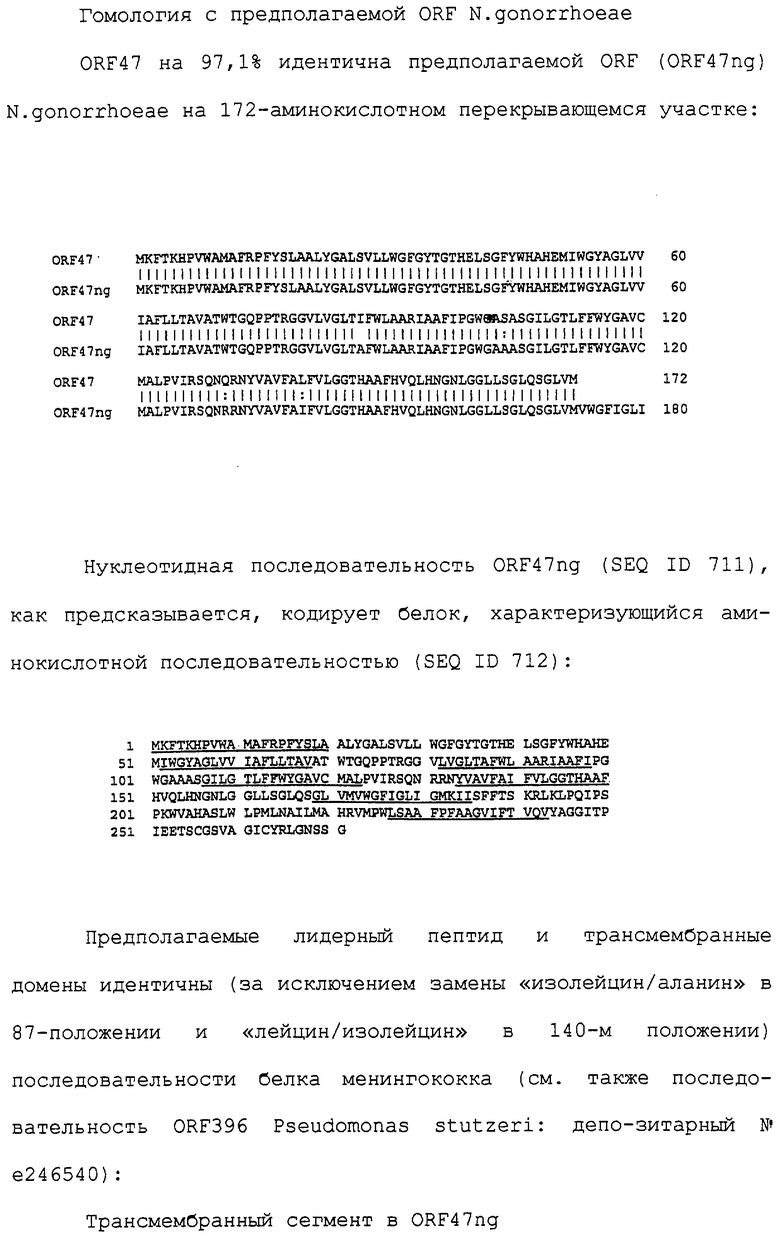



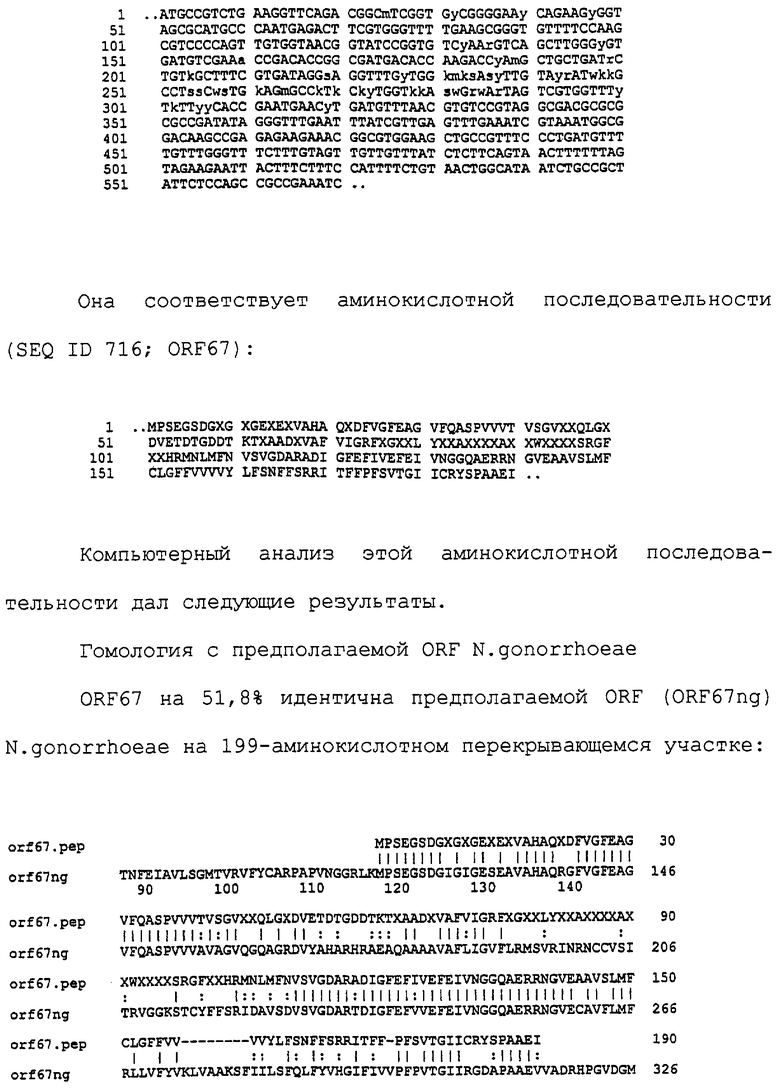



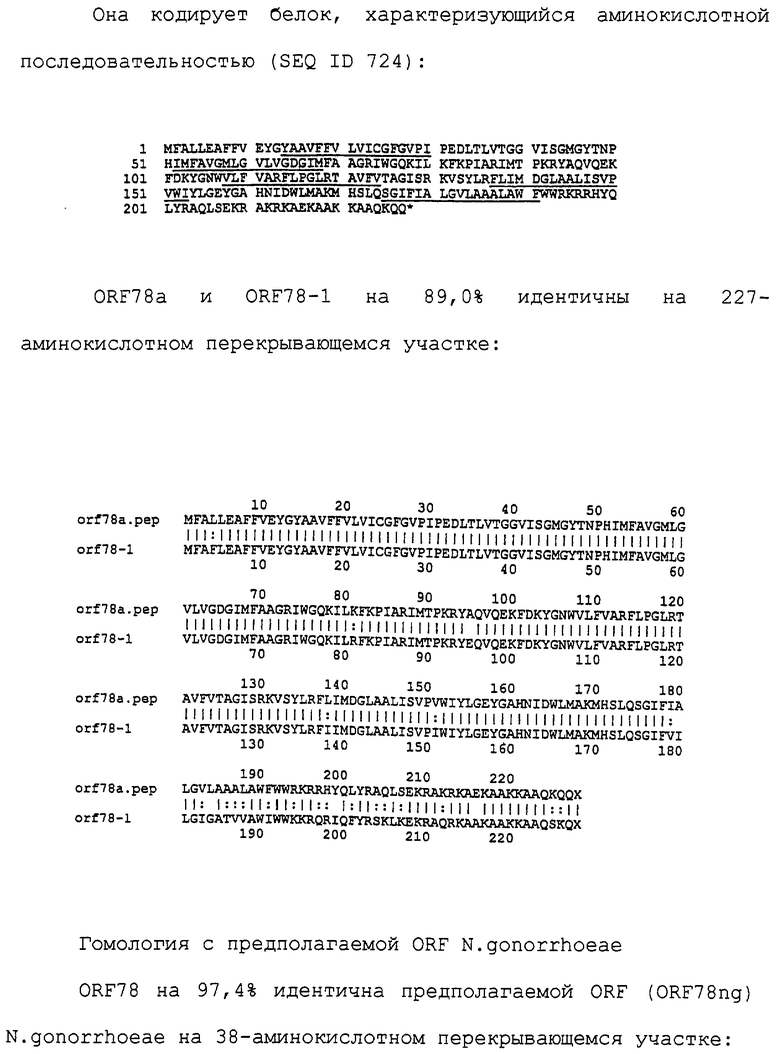






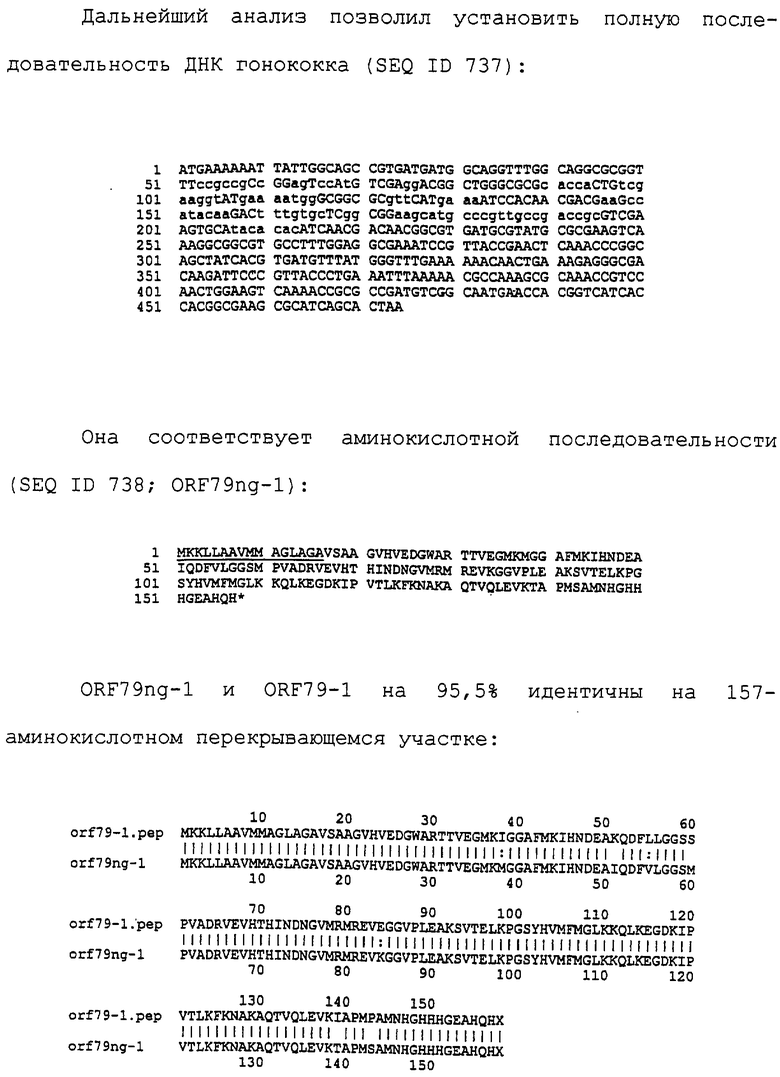




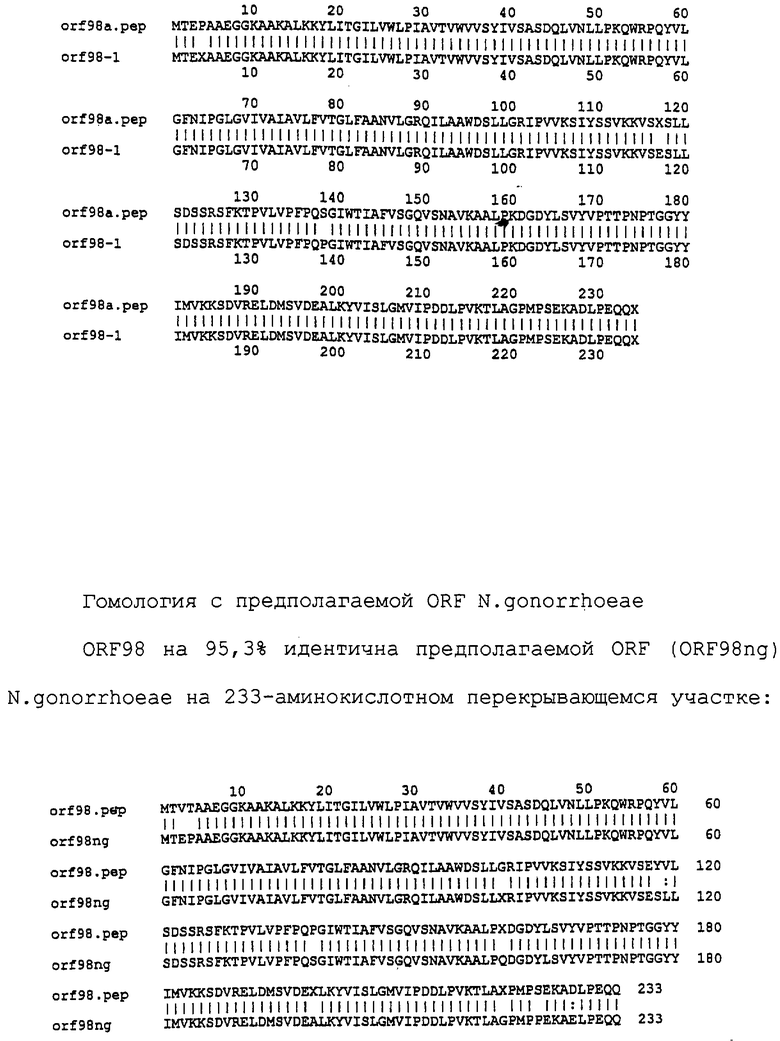

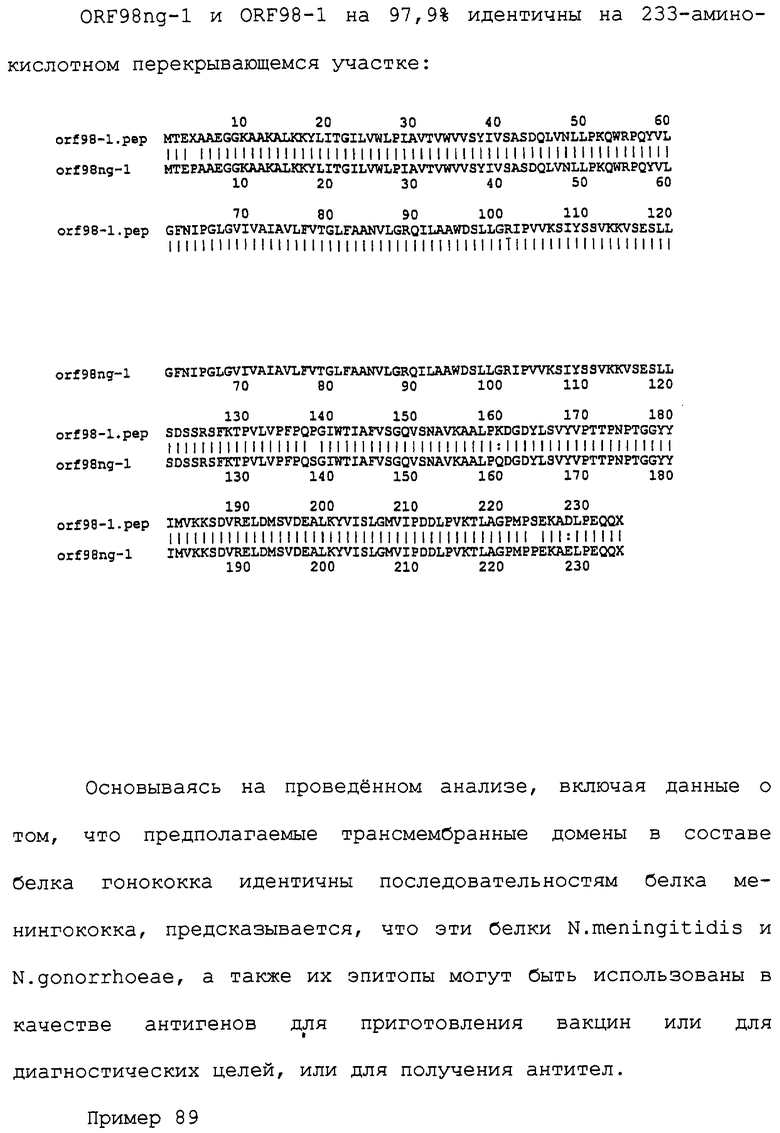


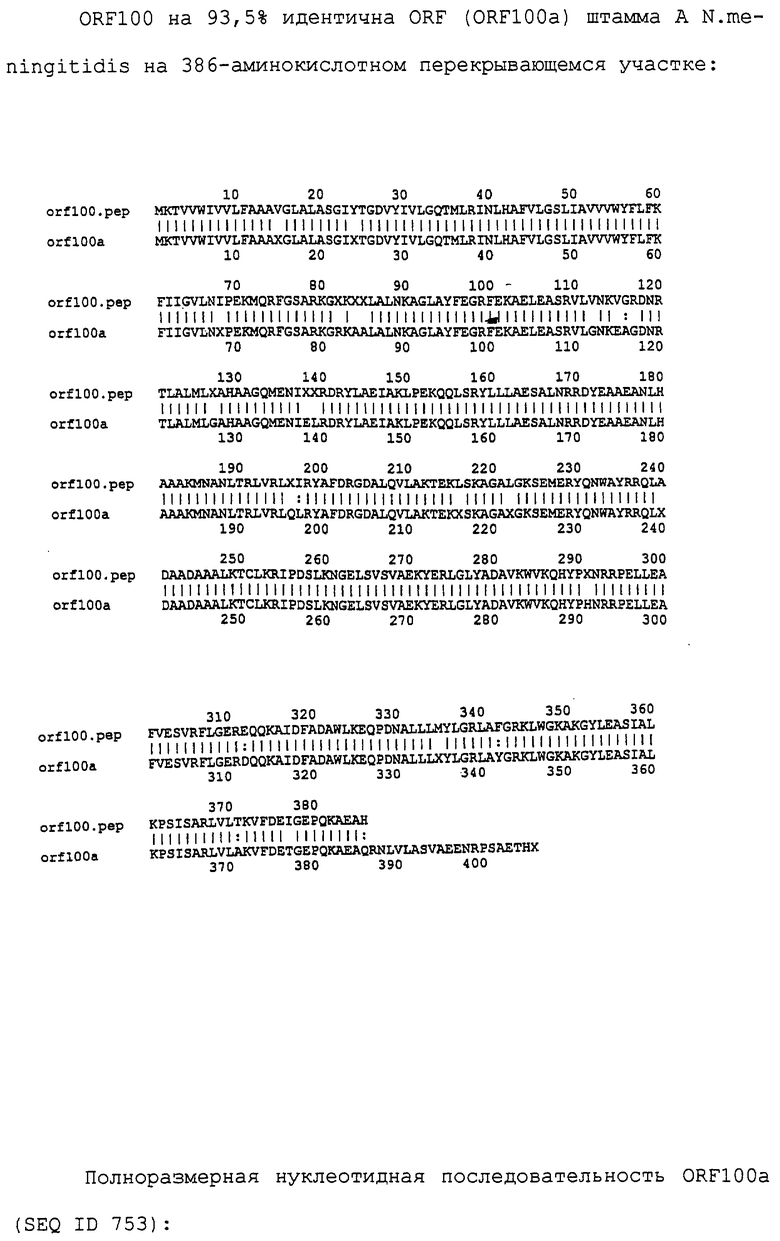

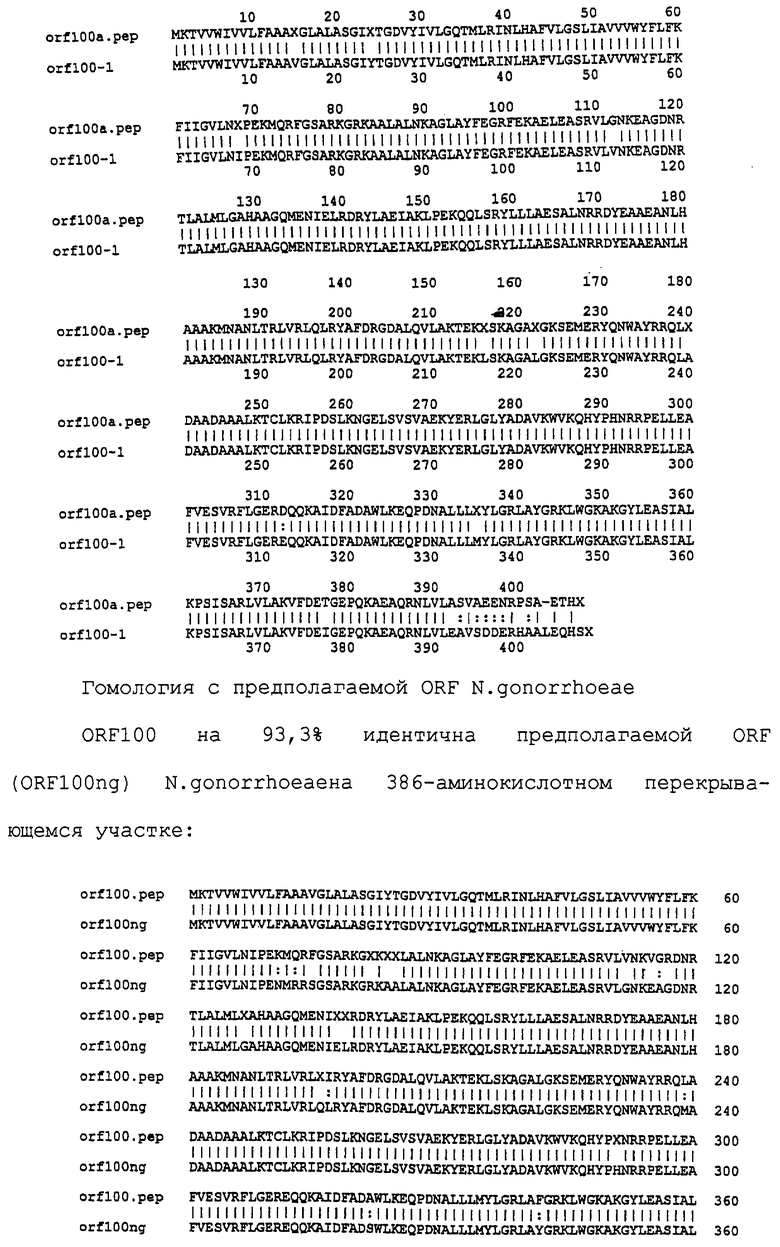









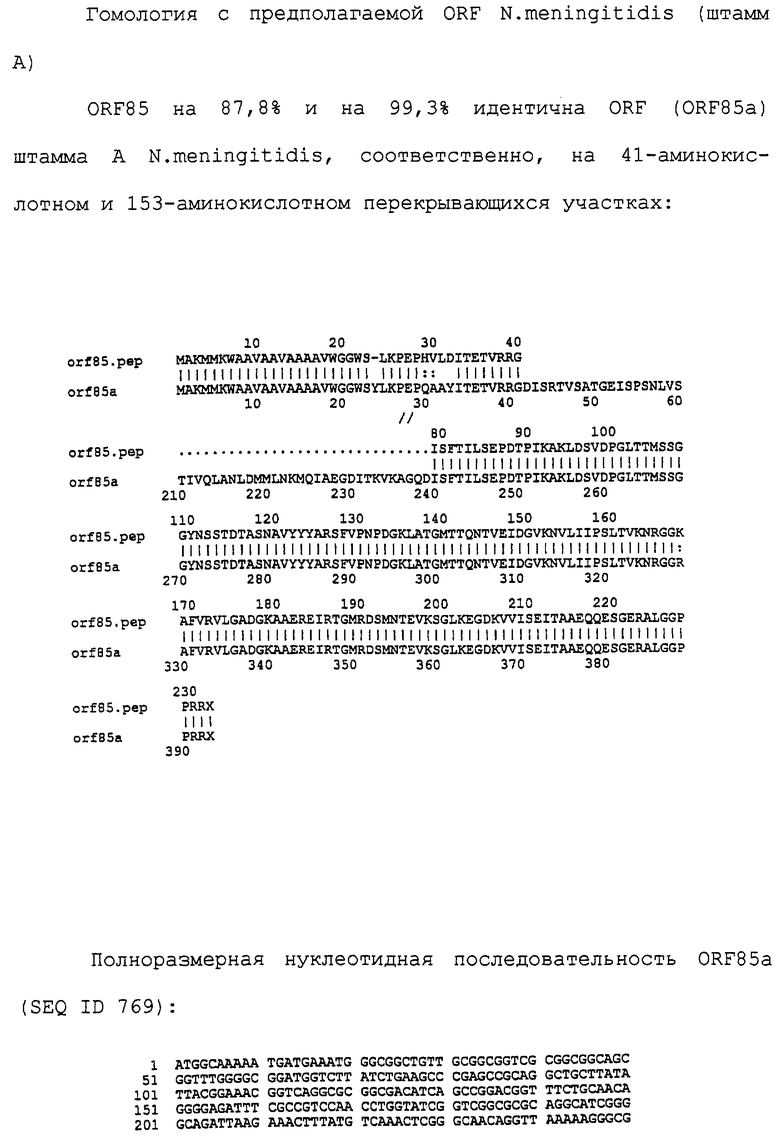



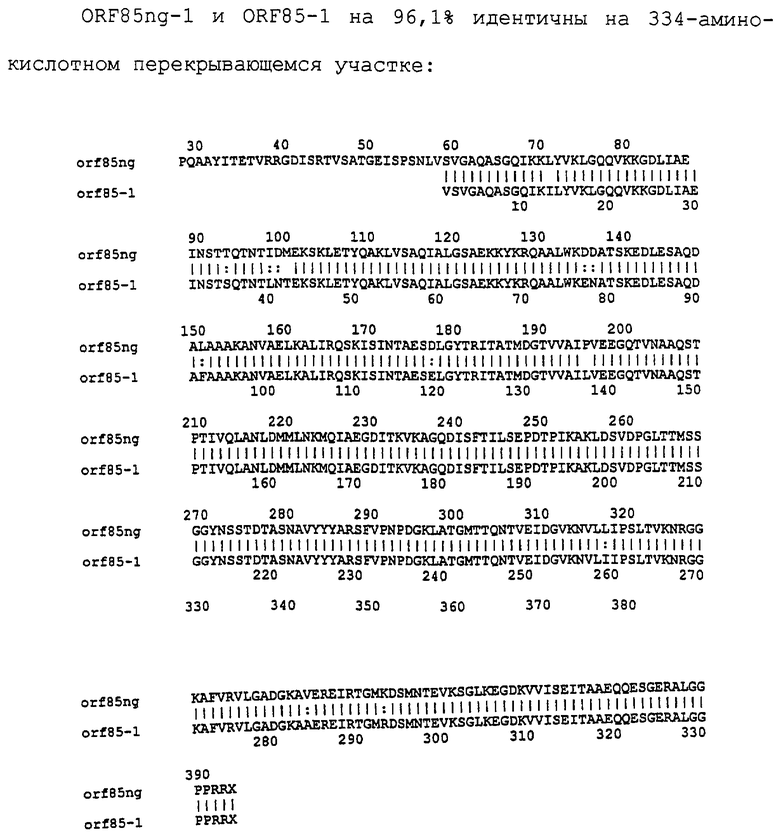




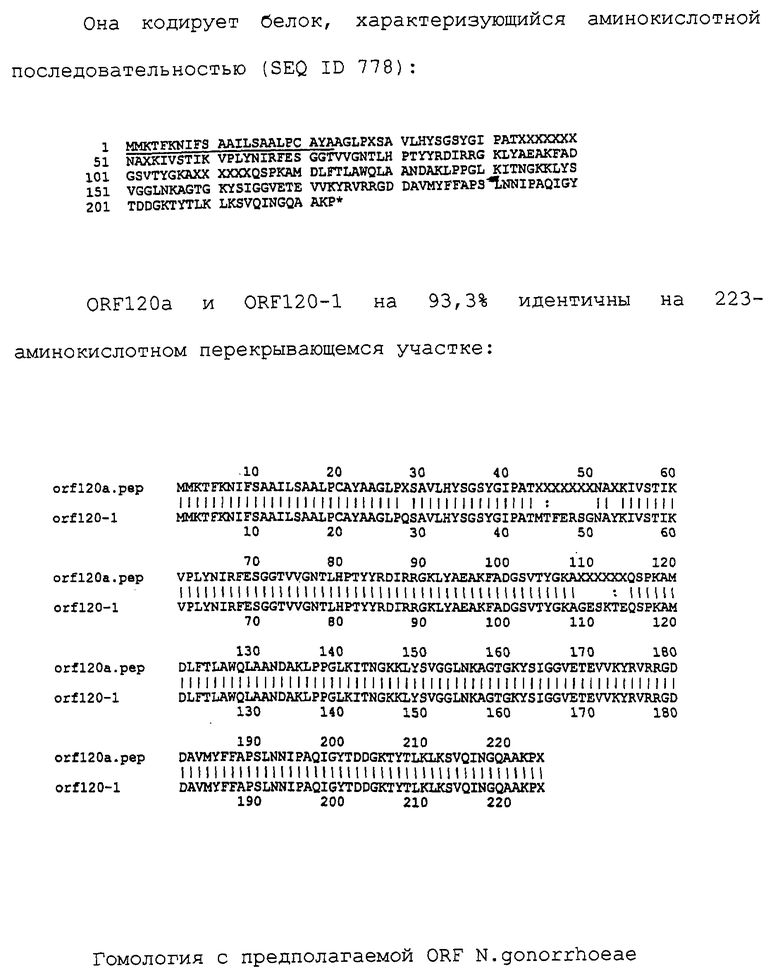



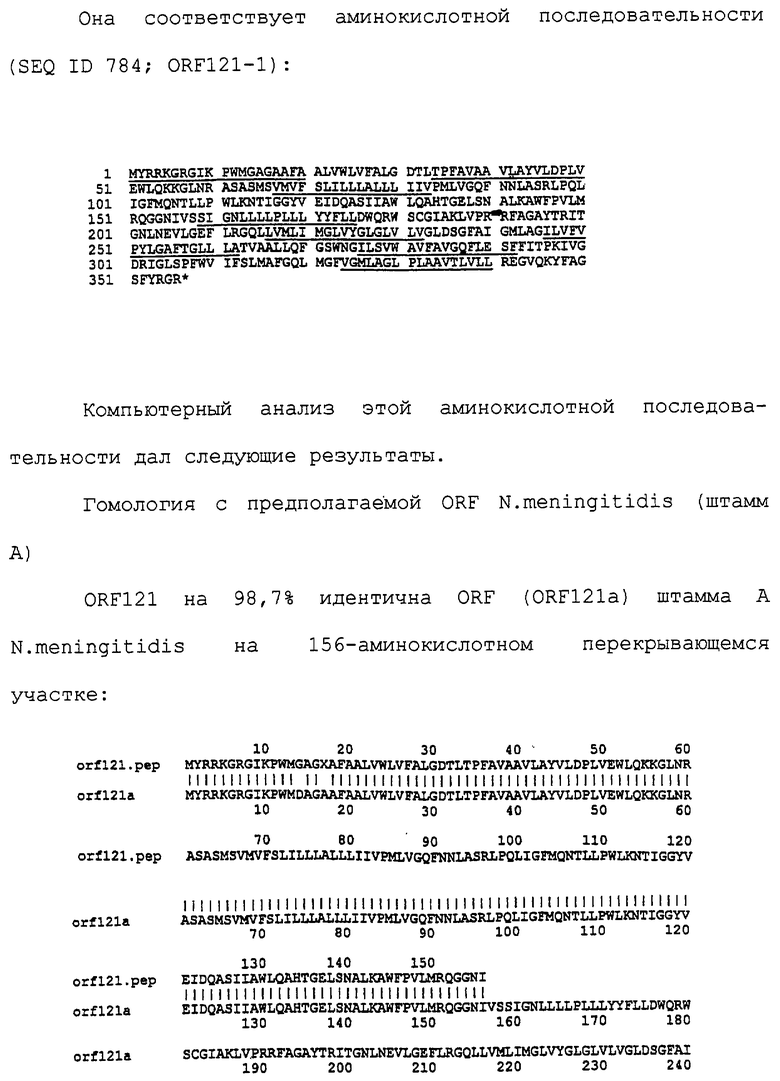

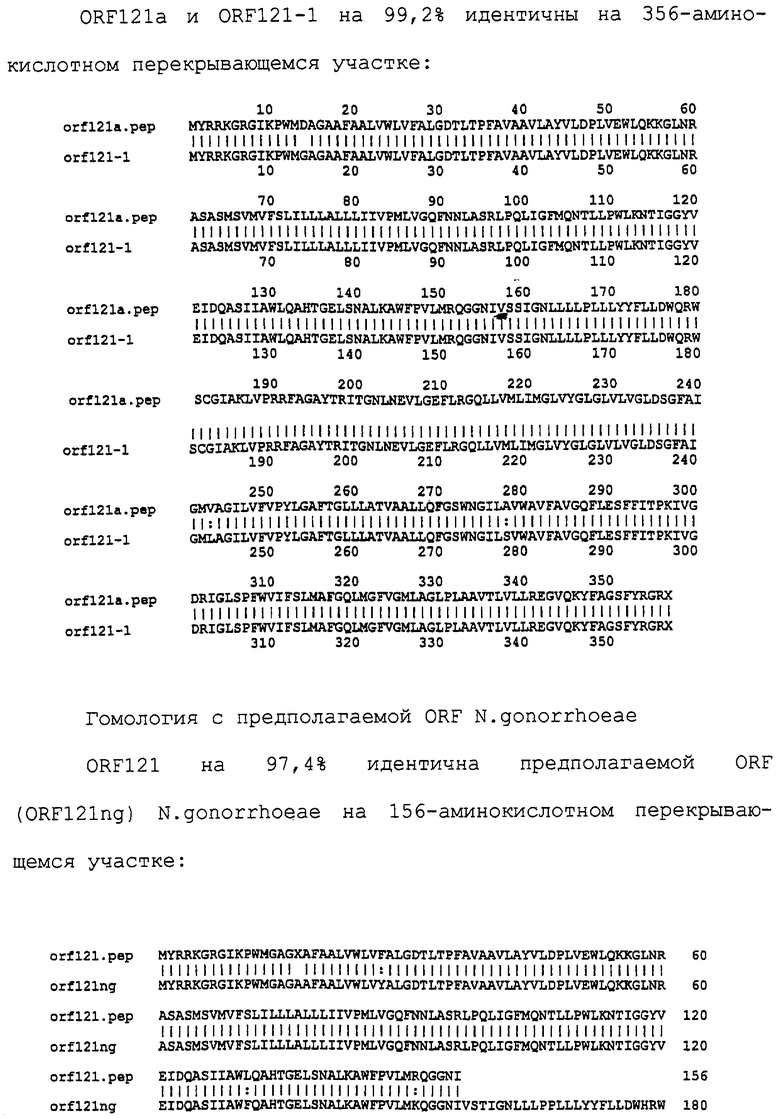







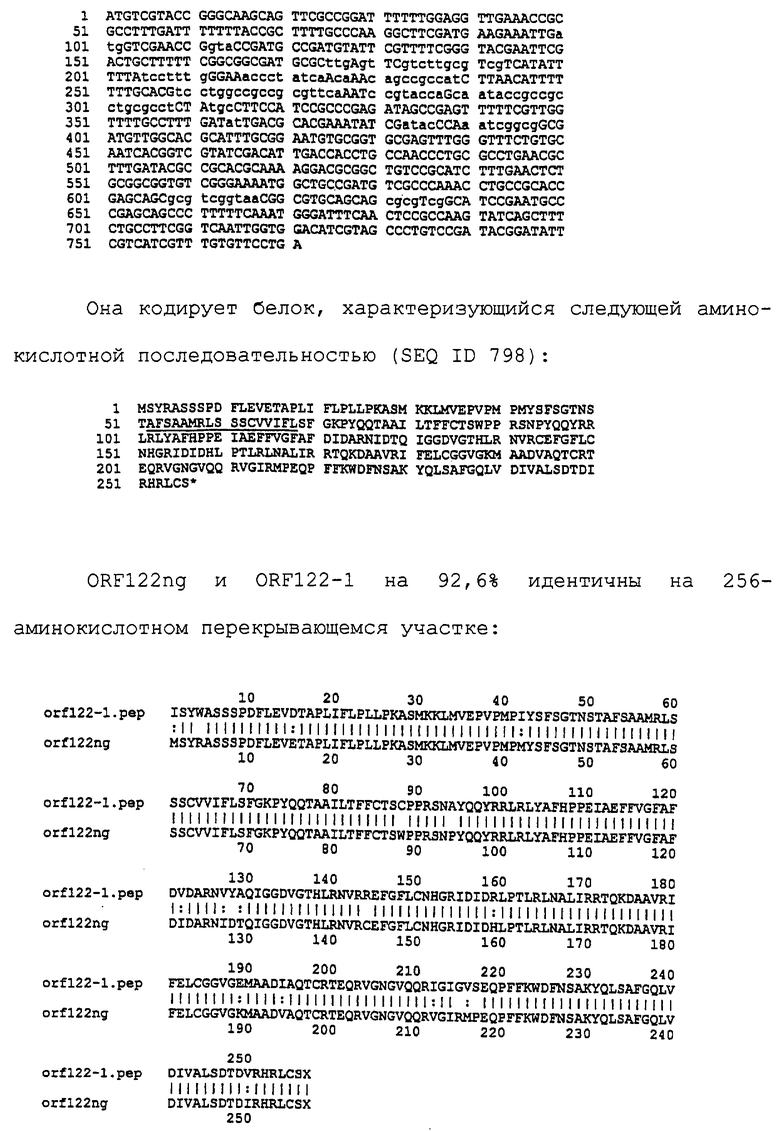









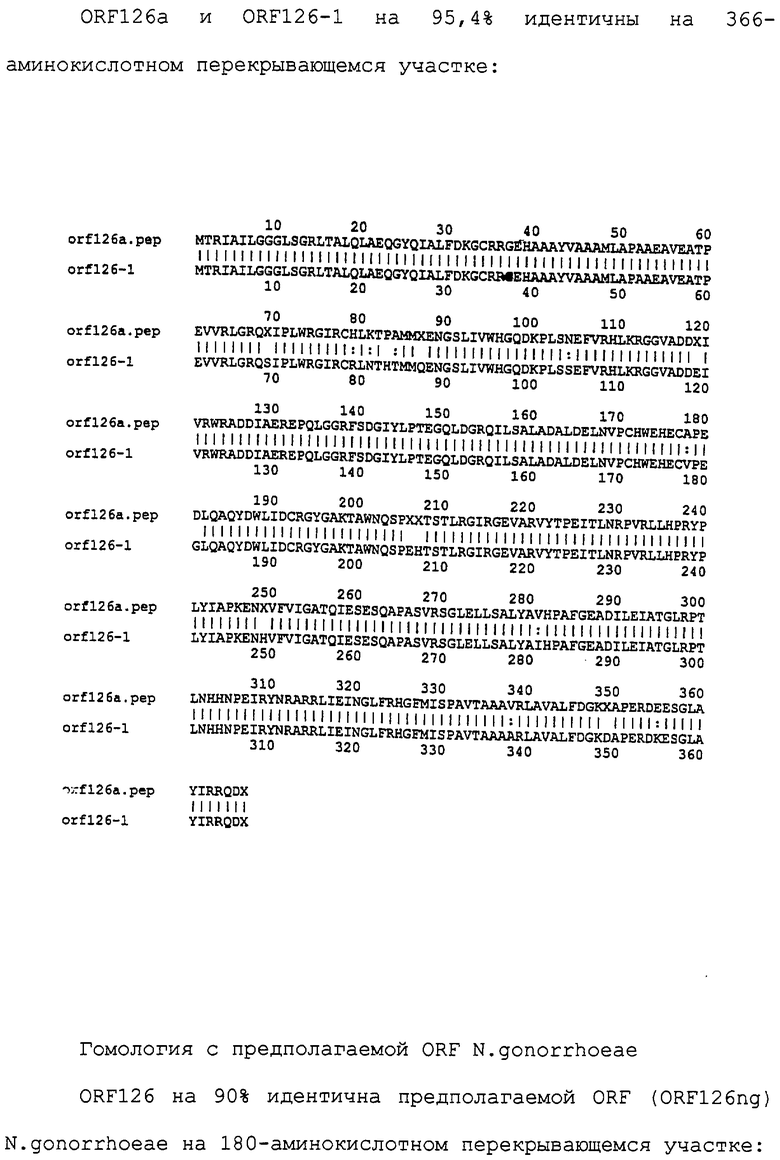

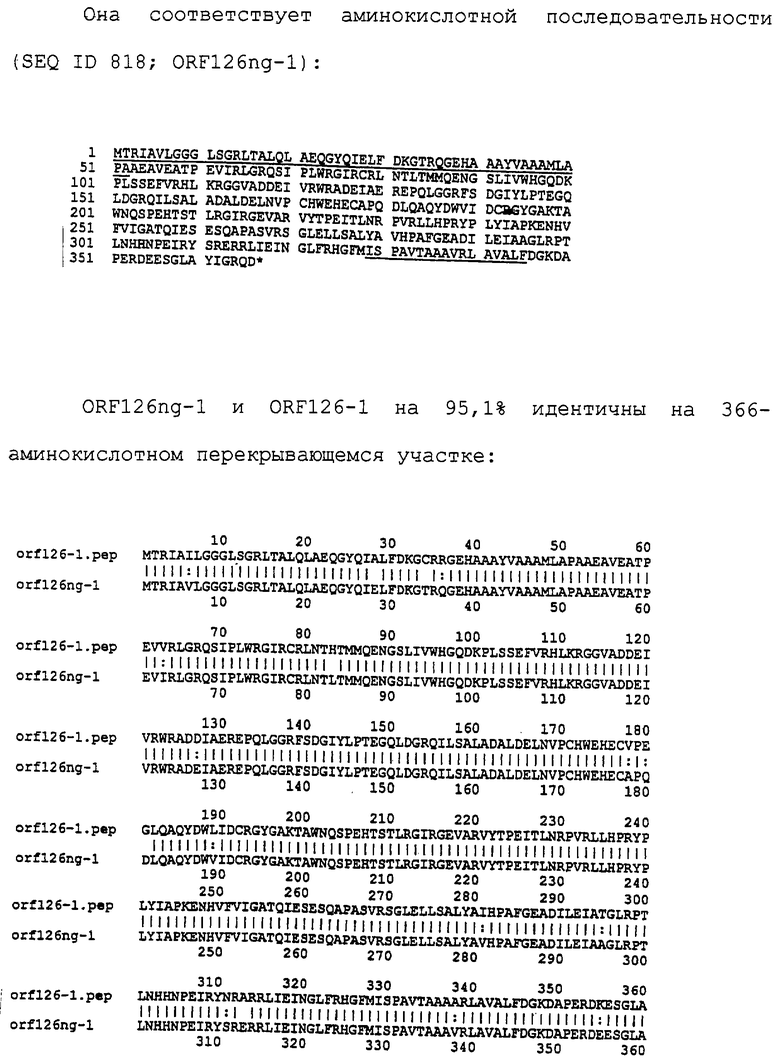









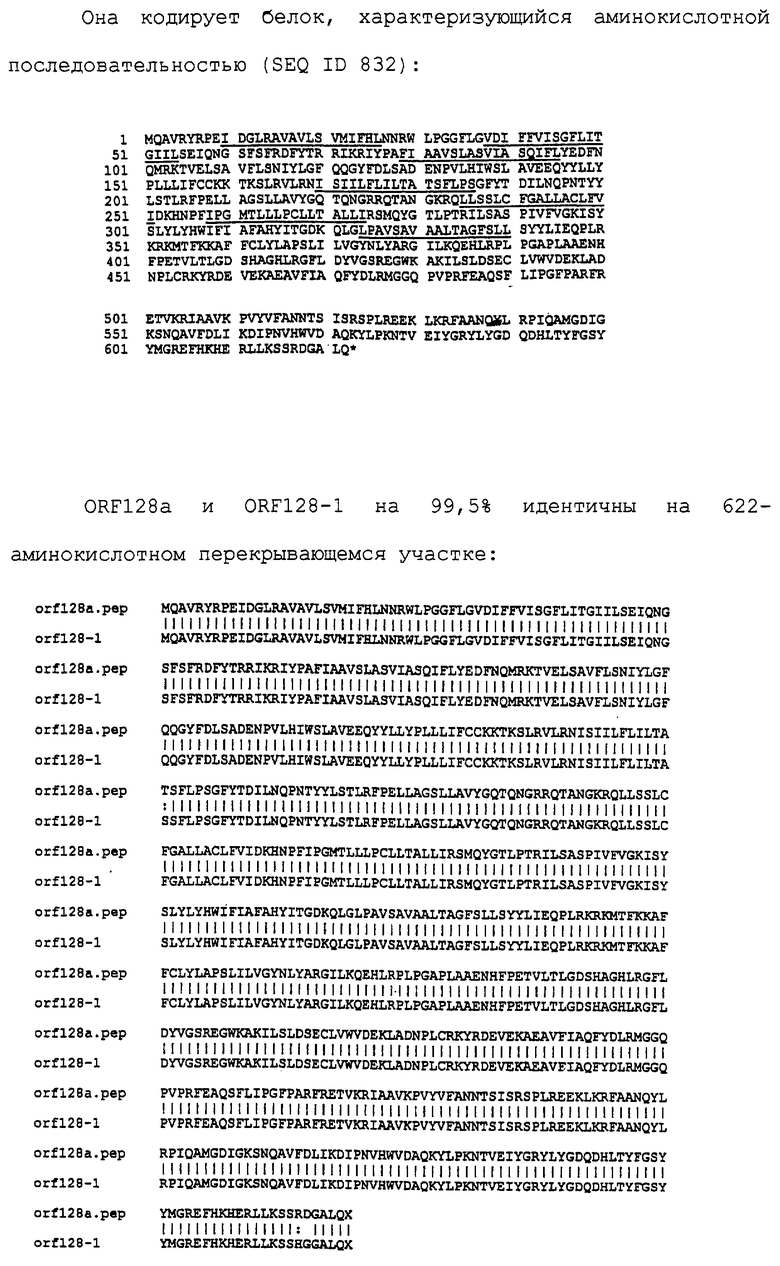

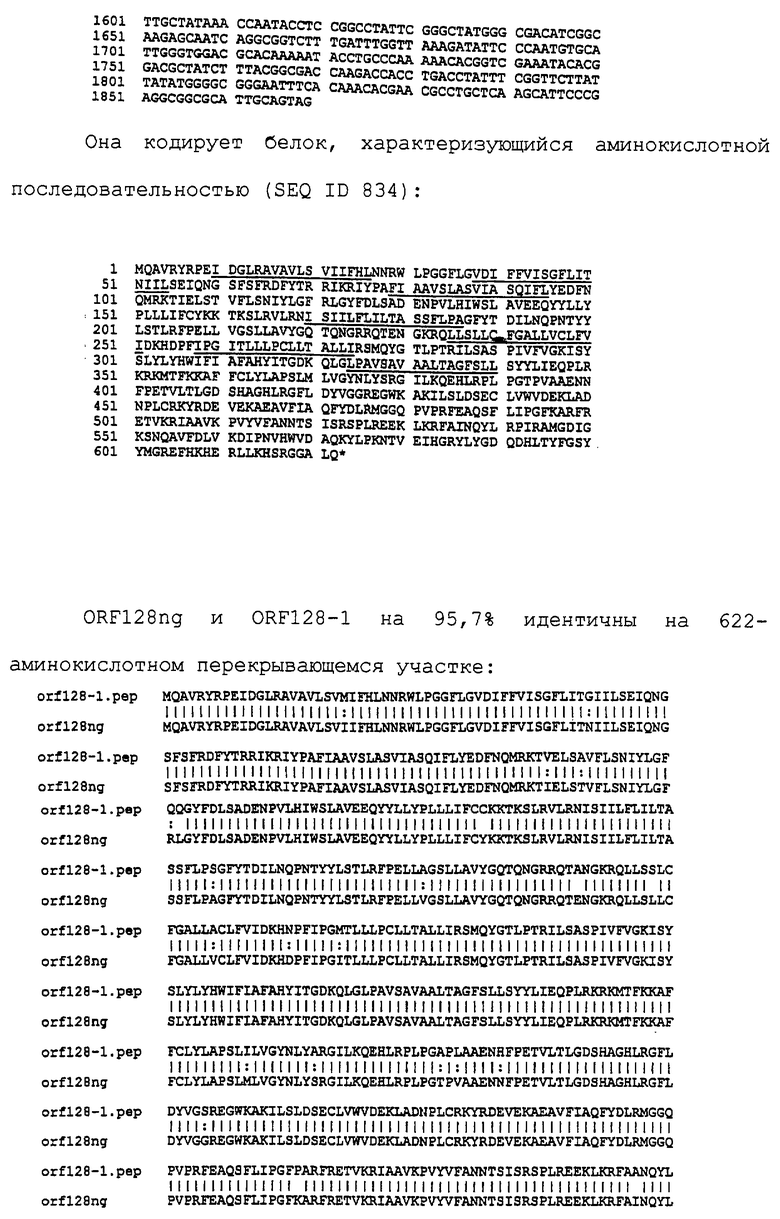



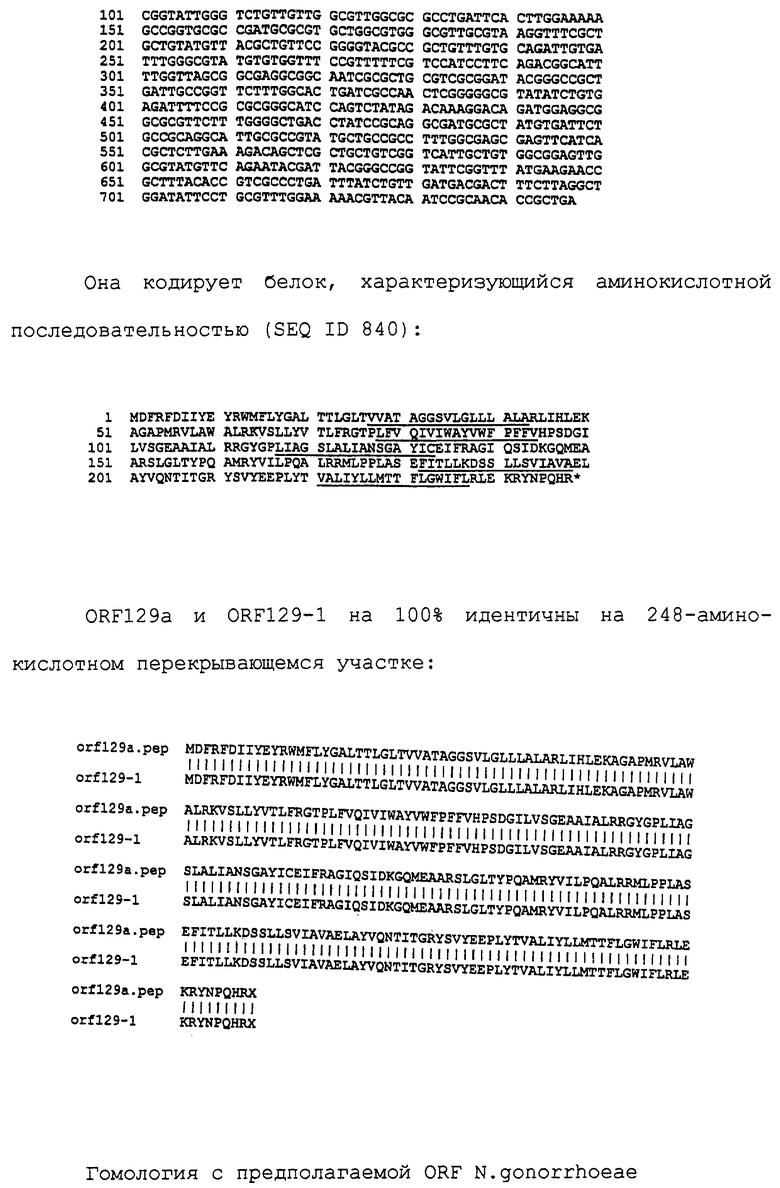
















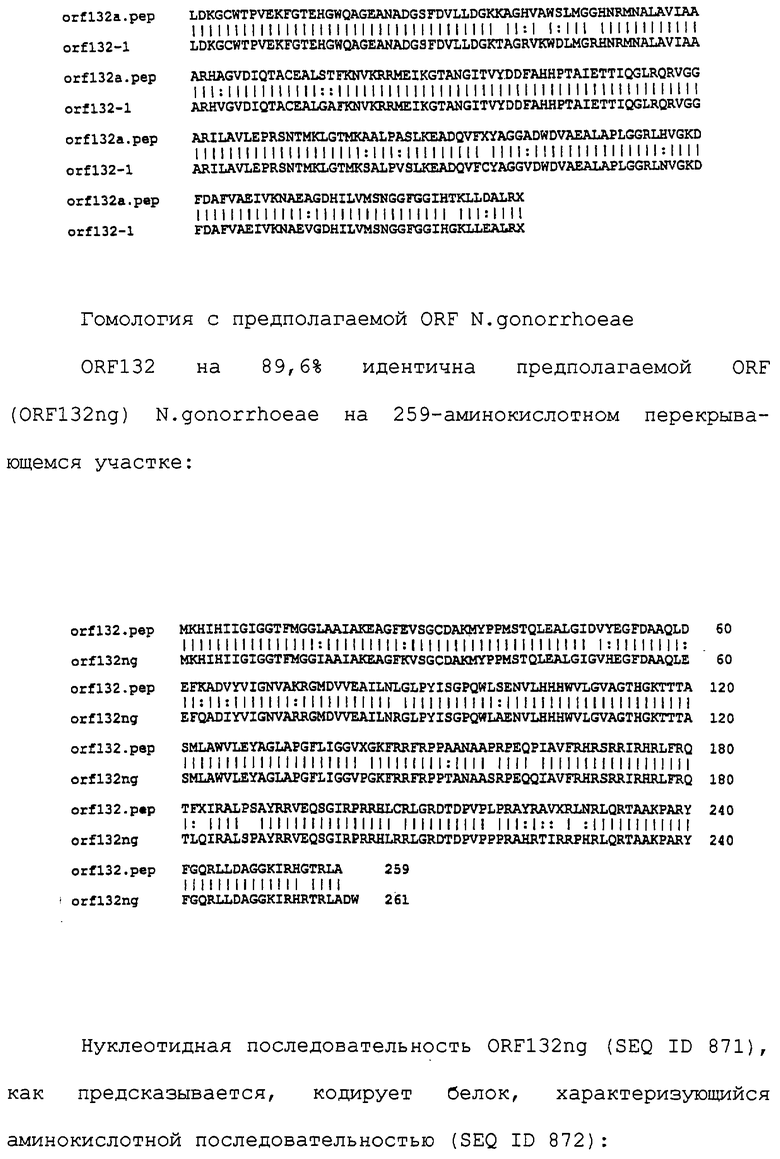

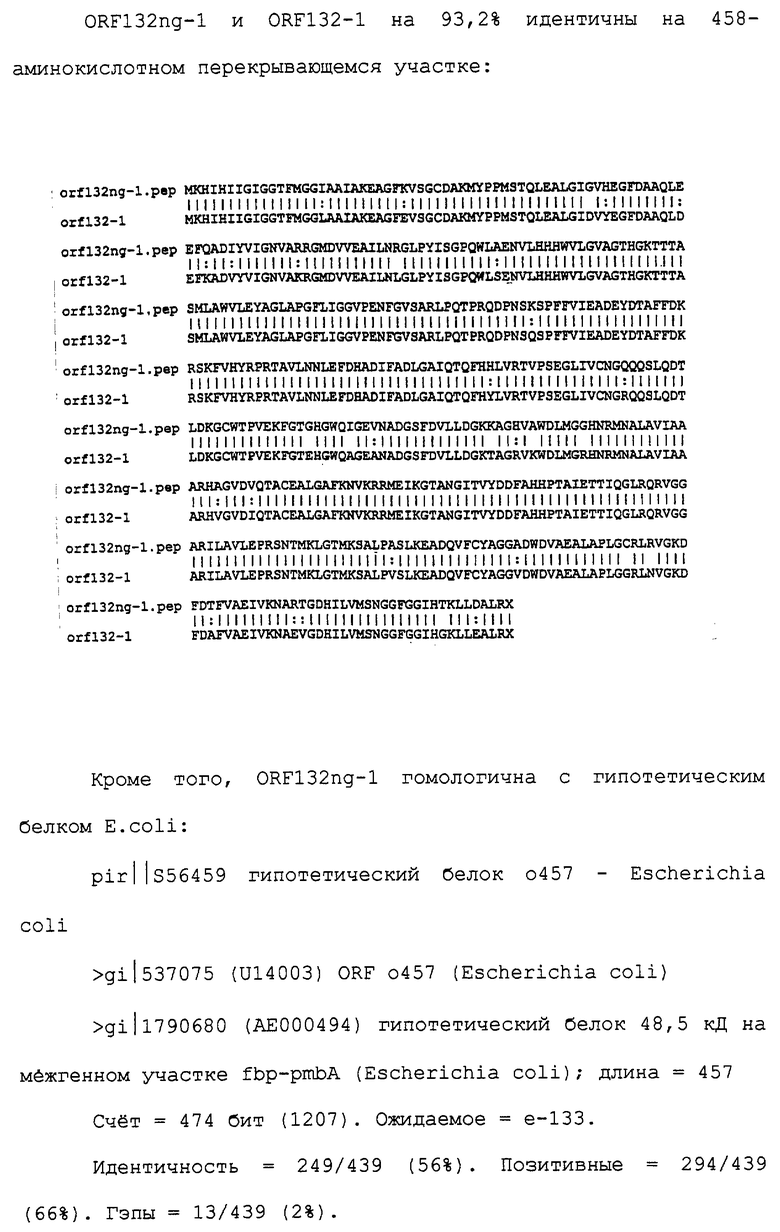





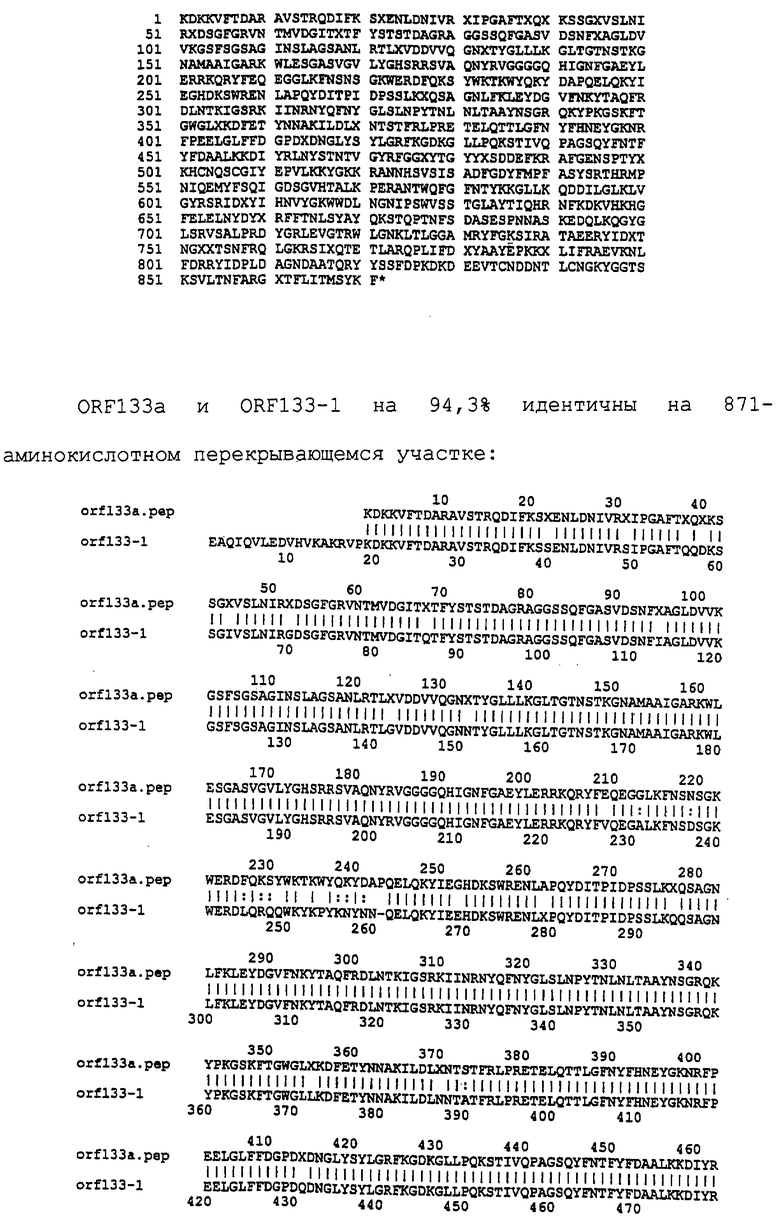



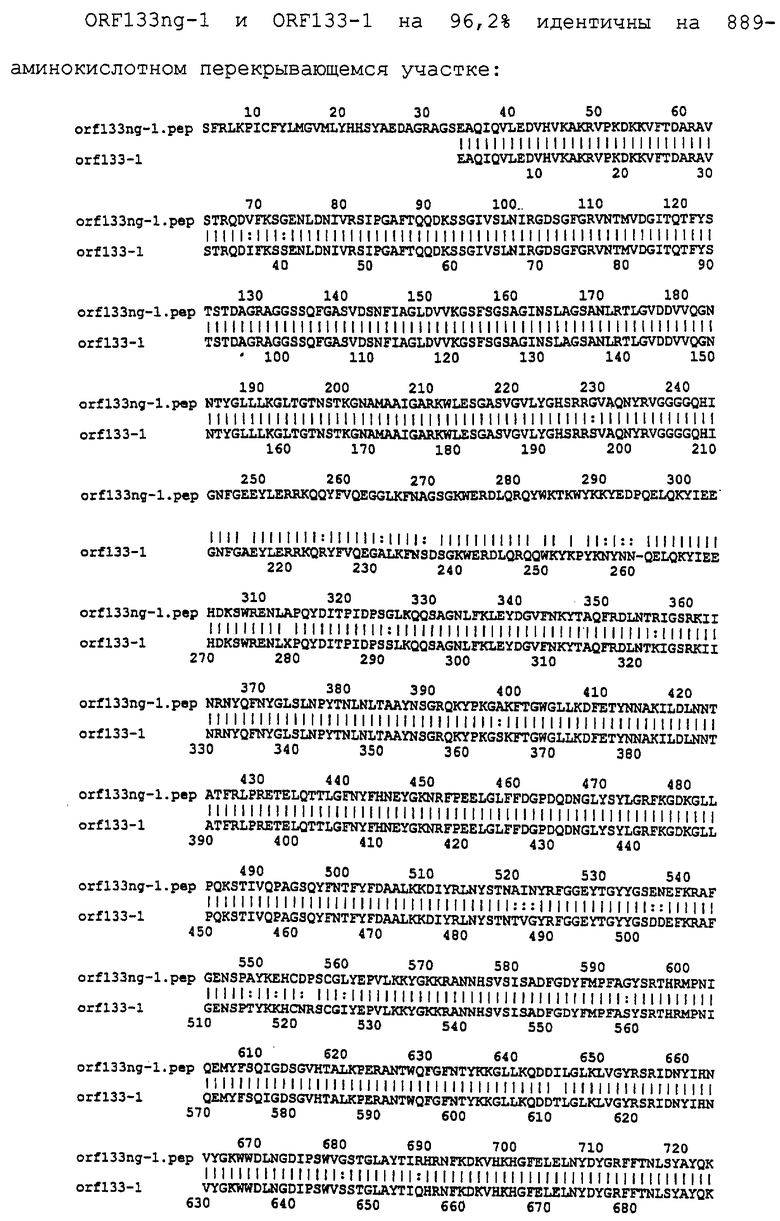





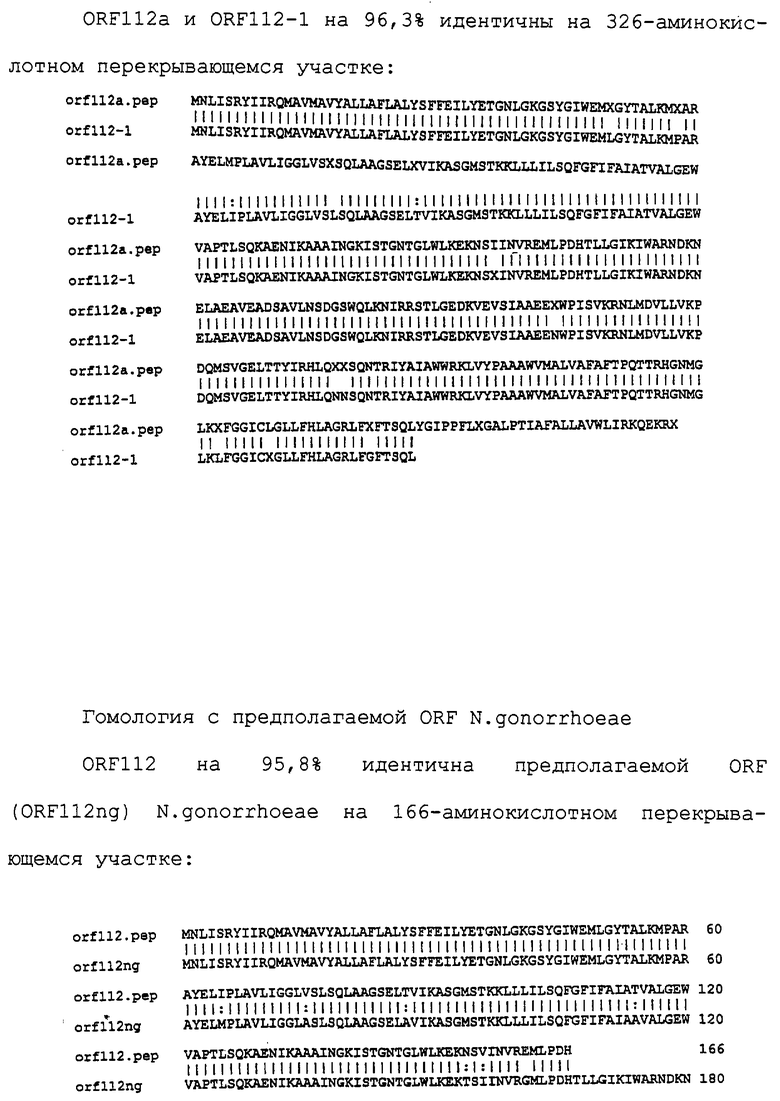
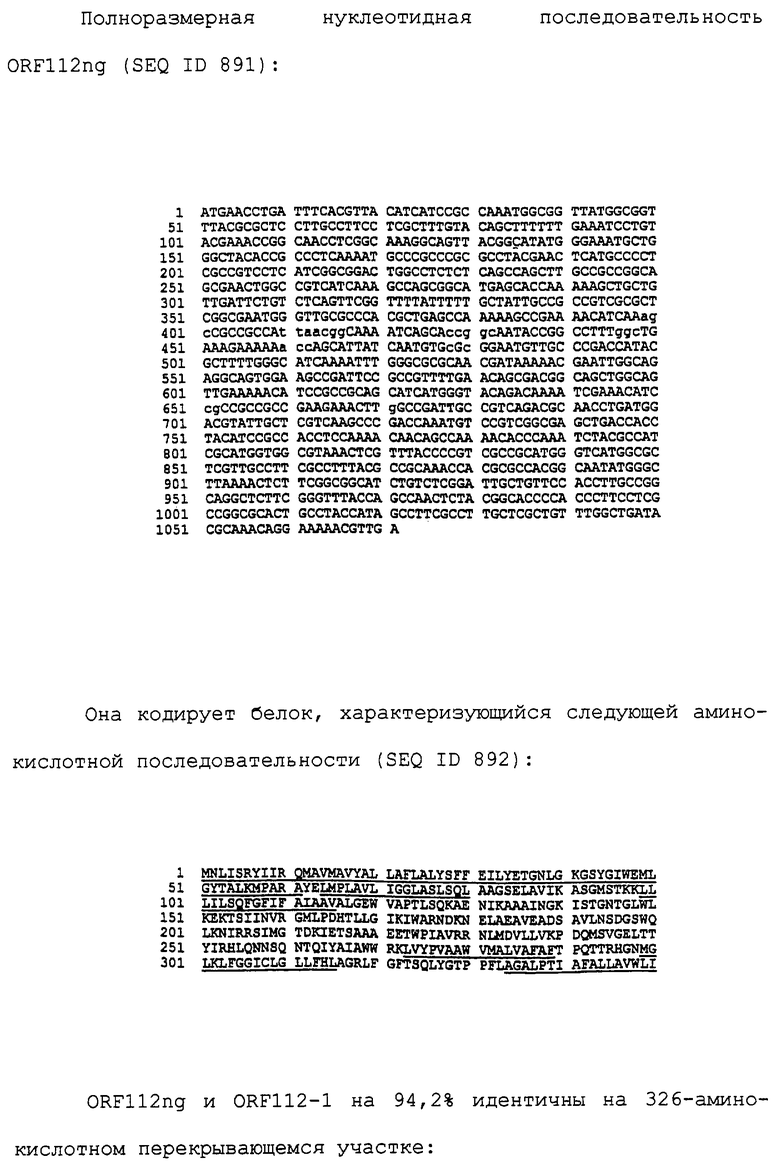

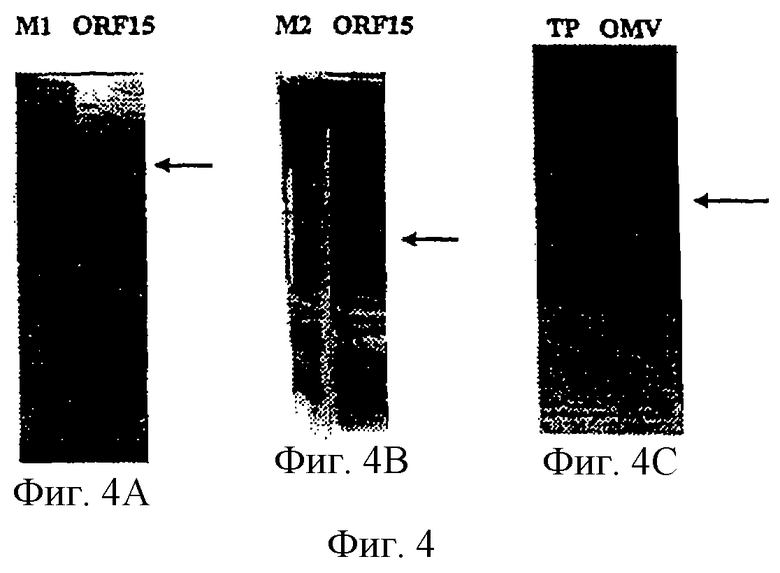
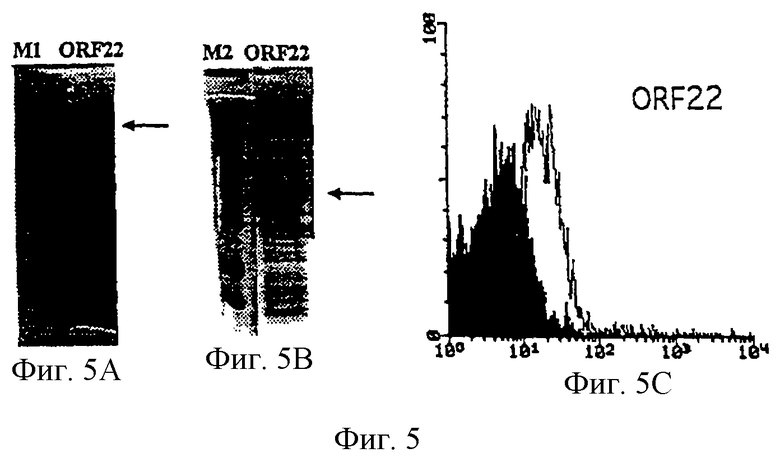
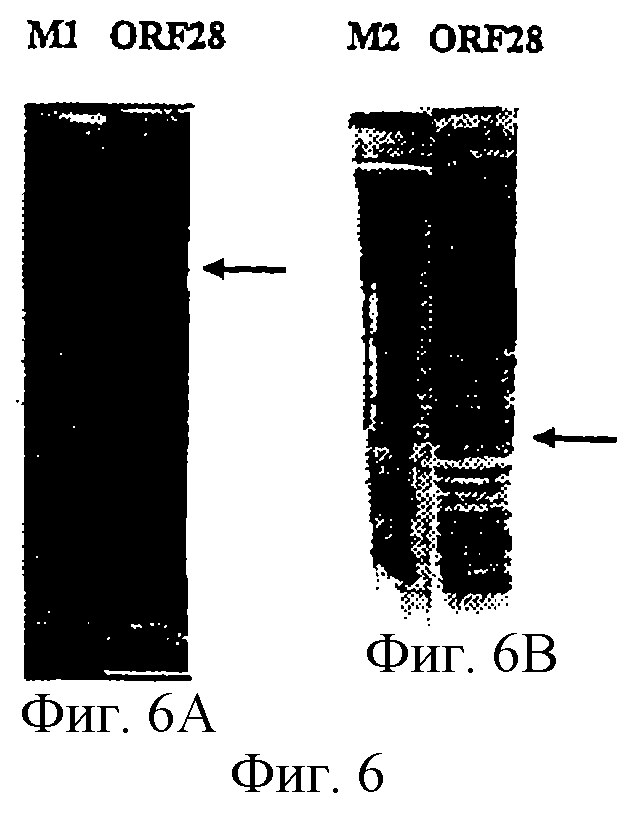
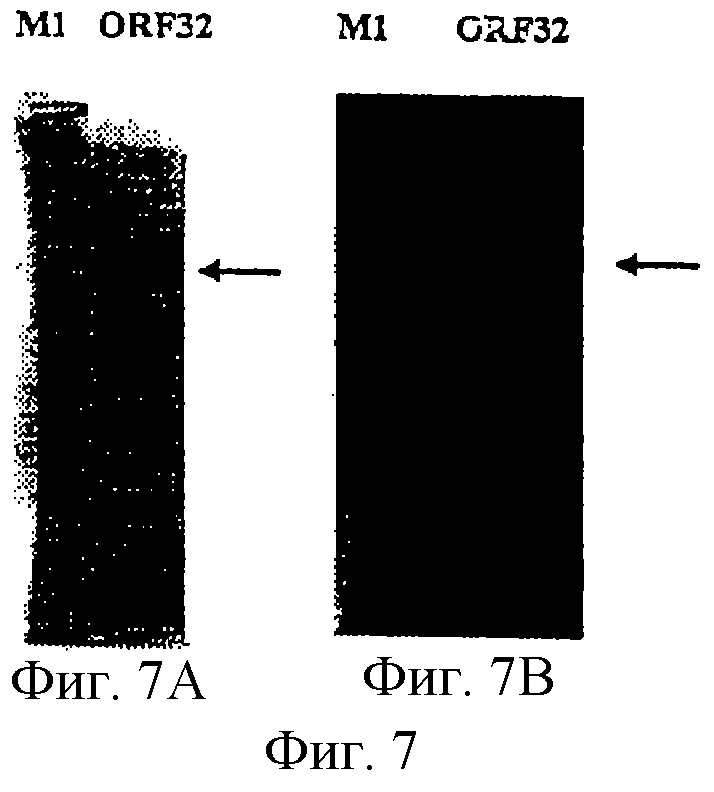
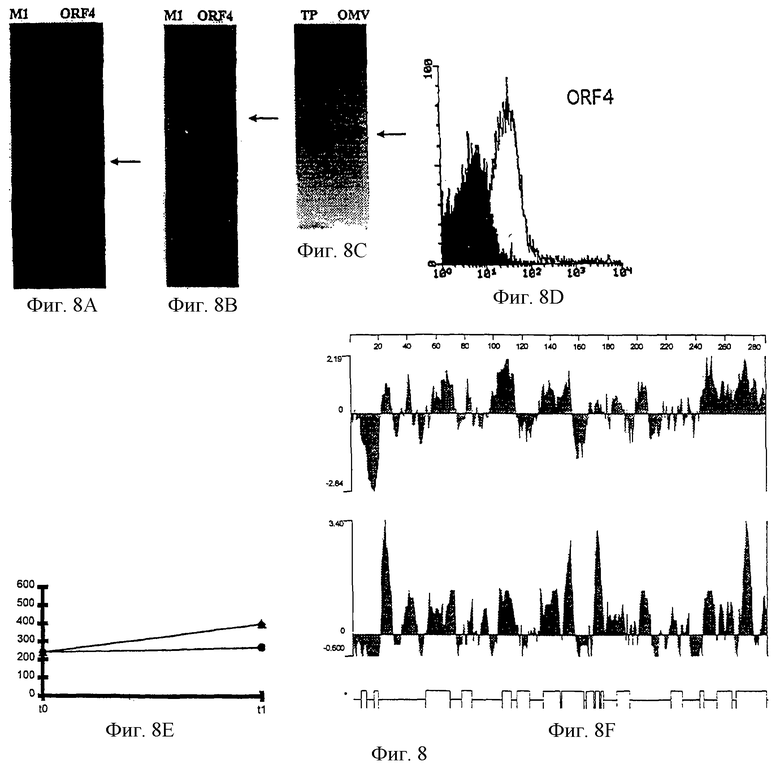
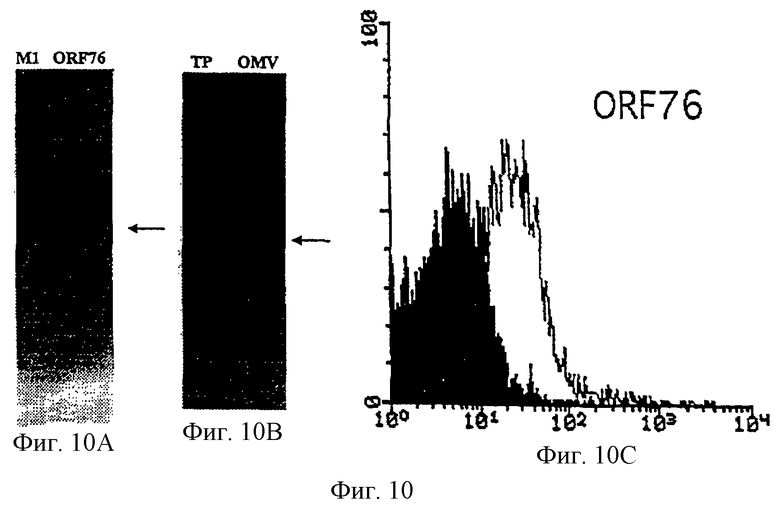

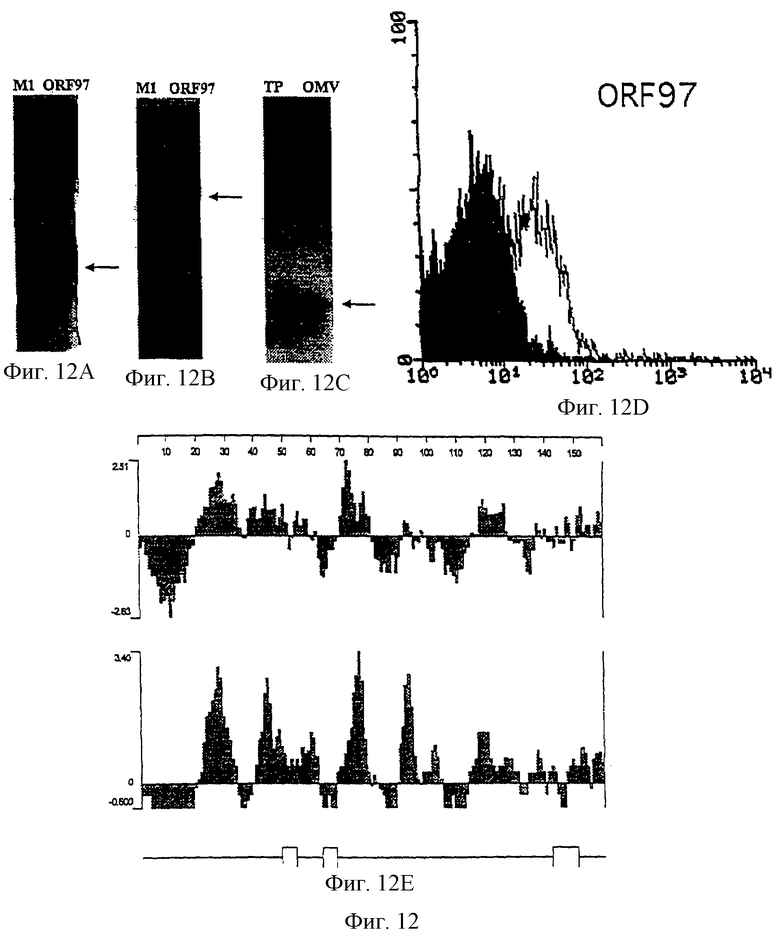
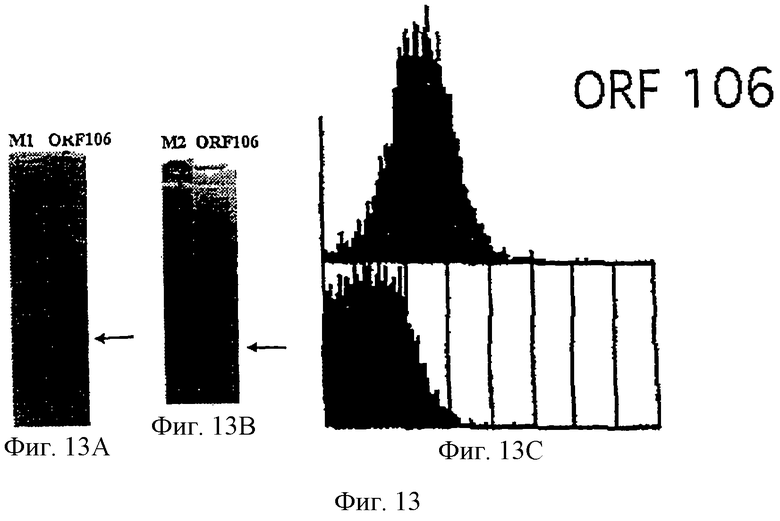
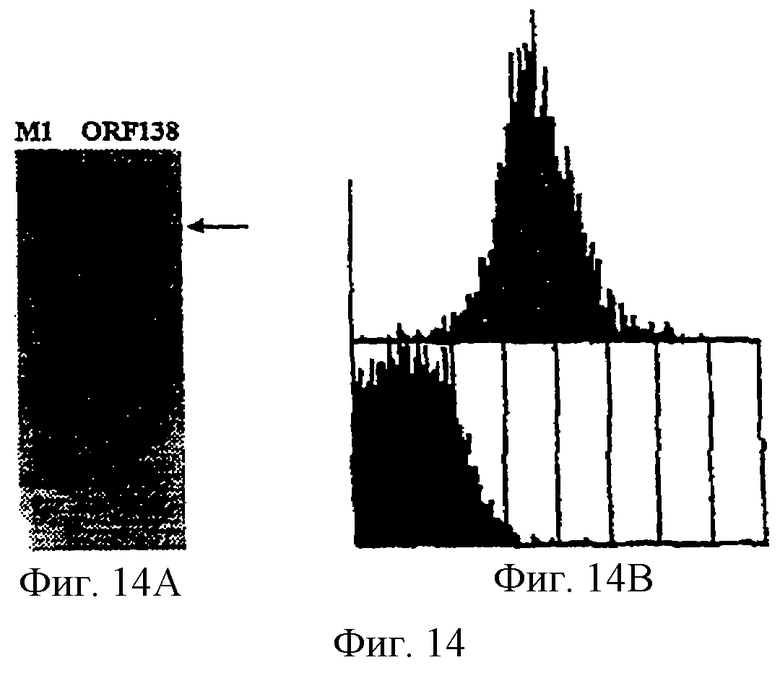
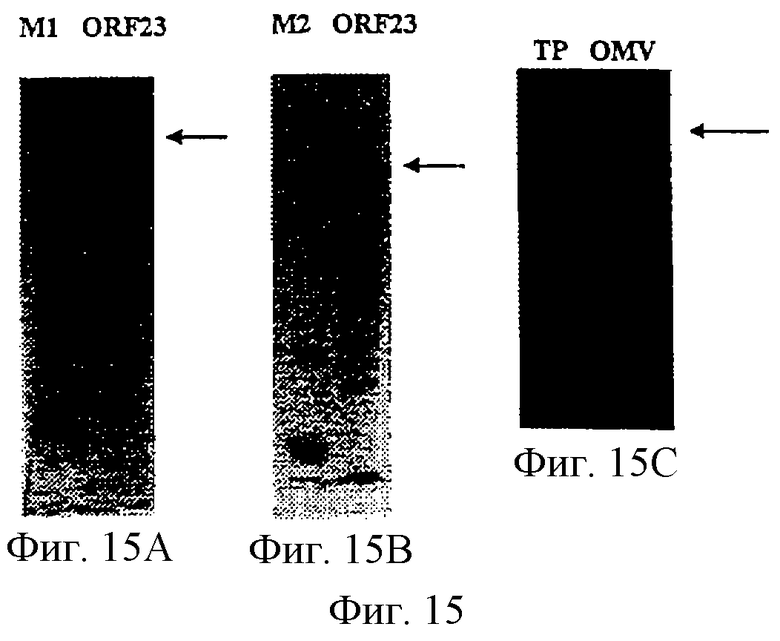
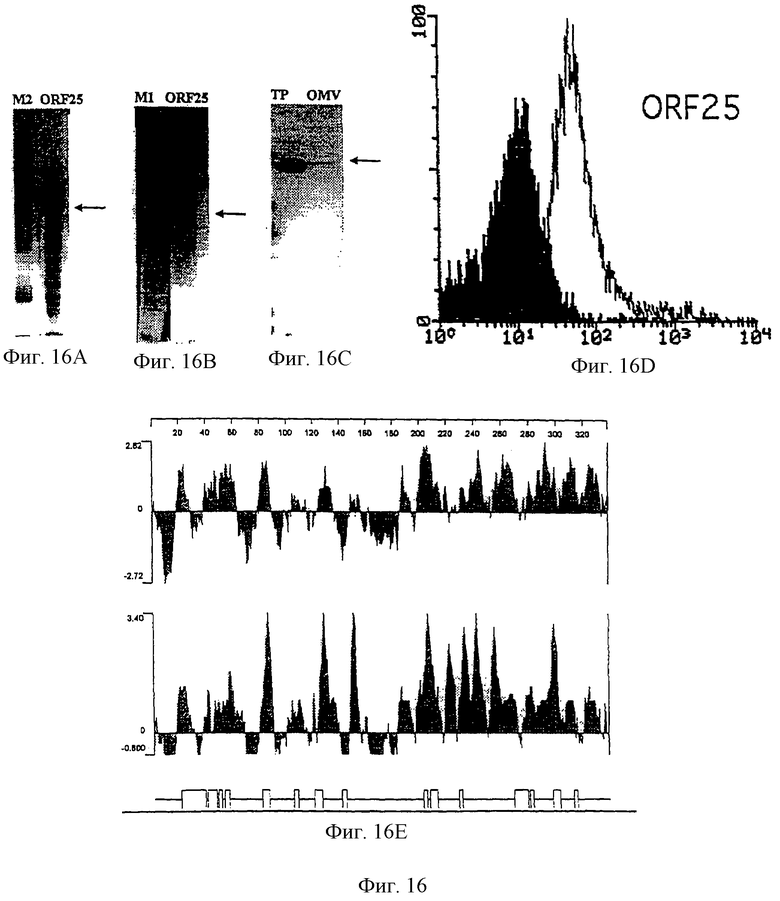

Настоящее изобретение представляет белки бактерий менингококка Neisseria meningitidis (штаммы А и В) и Neisseria gonorrhoeae. Аминокислотные последовательности заявленных белков представлены в описании. Представлены соответствующие нуклеотидные последовательности, кодирующие заявленные белки. Представленные белки в качестве антигенов входят в состав вакцин, иммуногенных композиций и(или) применимы для диагностических целей. Заявлено антитело, которое связывается с указанным белком. Изобретение позволяет повысить эффективность препаратов, используемых для диагностики, лечения и предупреждения инфекций, вызываемых Neisseria meningitidis и gonorrhoeae. 9 н. и 3 з.п. ф-лы, 61 ил., 2 табл.
| WO 9955873 А, 04.11.1999 | |||
| WO 9612020 А, 25.04.1996 | |||
| WO 9631618 А, 10.10.1996 | |||
| ЩЕЛКУНОВ С.Н | |||
| Конструирование гибридных молекул ДНК, Новосибирск, из-во “Наука”, 1987, стр.205-224. |
Авторы
Даты
2004-07-10—Публикация
1998-10-09—Подача