Все цитируемые в данном описании документы включены в качестве ссылки в их полном виде.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к области иммунизации против хламидиальной инфекции, в частности, против инфекции Chlamydia trachomatis.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Chlamydiae (хламидии) являются облигатными внутриклеточными паразитами эукариотических клеток, которые являются ответственными за эндемические, переносимые половым путем инфекции и различные другие патологические синдромы. Они занимают особое филогенетическое ответвление эубактерий, не имеющее близкого родства с какими-либо другими известными организмами, - они классифицируются в их собственном отряде (Chlamydiales), который содержит единственное семейство (Chlamydiaceae), которое, в свою очередь, содержит единственный род (Chlamydia, также называемый Chlamydophila). Особенной характеристикой хламидии является их уникальный жизненный цикл, в котором эта бактерия чередующимся образом меняется между двумя морфологически отличающимися формами: внеклеточной инфекционной формой (элементарными телами, ЕВ) и внутриклеточной неинфекционной формой (ретикулярными телами, RB). Этот жизненный цикл завершается реорганизацией RB в ЕВ, которые оставляют разрушенную клетку-хозяина готовыми инфицировать следующие клетки.
В настоящее время известны четыре хламидиальных вида: С. trachomatis, С. pneumoniae, С. pecorum и С. psittaci (например, ссылки 1, 2), и доступны геномные последовательности (ссылки 3-9).
Сероварианты (серовары) С. trachomatis человека делятся на два биоварианта (биовары). Серовары A-К индуцируют эпителиальные инфекции прежде всего в глазной ткани (А-С) или мочеполовых путях (D-K). Серовары L1, L2 и L3 являются агентами инвазивной венерической лимфогранулемы (LGV).
Хотя хламидиальная инфекция сама вызывает заболевание, считается, что у некоторых пациентов тяжесть симптомов обусловлена фактически отклоняющимся от нормы иммунным ответом. Невозможность освободиться от инфекции приводит к персистентной иммунной стимуляции и скорее не к помощи хозяину, а к хронической инфекции с тяжелыми последствиями, в том числе стерильности и слепоте (10). Кроме того, защита (иммунитет), сообщаемая природной хламидиальной инфекцией, обычно является неполной, временной и штамм-специфической.
Вследствие серьезного характера этого заболевания существует желание обеспечить подходящие вакцины. Они могут быть полезными (а) для иммунизации против хламидиальной инфекции или против индуцируемого хламидией заболевания (профилактической вакцинации) или (b) для ликвидации установленной хронической хламидиальной инфекции (терапевтической вакцинации). Однако, будучи внутриклеточным паразитом, эта бактерия может обычно избегать опосредованных антителами иммунных реакций.
Различные антигенные белки были описаны для С. trachomatis, и, в частности, клеточная поверхность была мишенью подробного исследования (например, 1, 11). Они включают, например, Рgр3 (12, 13, 14), МОМР (15), Нsp60 (GroEL) (16) и Hsp70 (DnaK-подобный) (17). Однако не все из них оказались эффективными вакцинами, так что целью данного изобретения является идентификация антигенов С. trachomatis, которые индуцируют иммунный ответ во время природной инфекции, для обеспечения антигенов и иммуногенов, пригодных для применения в разработке вакцин. Другой целью является идентификация антигенов, применимых для диагностики (например, иммунодиагностики) С. trachomatis.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Ссылка 18 описывает различные белки из С. pneumoniae, которые были эмпирически подтверждены как являющиеся иммунореактивными, иммунодоступными и/или присутствующими в элементарных телах. Эти свойства данных белков не были получаемыми из информации о геномной последовательности. Ссылка {18} описывает, что эти белки могут быть использованы в лечении или предупреждении инфекции, вызываемой бактериями Chlamydia, причем главным объектом является С. pneumoniae. Белки С. pneumoniae могут быть также использованы для лечения или предупреждения инфекции другими видами Chlamydia вследствие межвидовой перекрестной реактивности.
С. pneumoniae является близкородственной относительно С. trachomatis, как показано сравнениями полных геномов (3, 4, 5).
Данное изобретение относится к белкам С. trachomatis (SEQ ID NO:1-261 с нечетными номерами), которые соответствуют белкам С. pneumoniae, описанным в ссылке 18. Эти белки могут быть использованы в лечении или предупреждении инфекции, вызываемой бактериями Chlamydia, в частности С. trachomatis. Особенно предпочтительными белками являются белки, снабженные примечанием "гипотетический белок" (см. таблицу I в данном описании), или которые считали ранее белками, имеющими цитоплазматическую локализацию.
Белки С. trachomatis
Данное изобретение обеспечивает белки, содержащие одну или более аминокислотных последовательностей с нечетными номерами из SEQ ID NO:1-261.
Оно обеспечивает также белки, содержащие последовательности, которые имеют, по меньшей мере, х% идентичность с одной или более аминокислотными последовательностями с нечетными номерами из SEQ ID NO:1-261. В зависимости от конкретной последовательности х обозначает предпочтительно 50% или более (например, 60%, 70%, 80%, 90%, 95%, 99% или более). Эти белки включают мутанты и аллельные варианты. Обычно 50% или большая идентичность между двумя белками считается указанием на функциональную эквивалентность. Идентичность между белками предпочтительно определяют с использованием алгоритма поиска гомологии Смита-Уотермана, осуществляемого в программе MPSRCH (Oxford Molecular), с использованием поиска аффинных гэпов с параметрами штраф за открывание гэпа=12 и штраф за удлинение гэпа=1.
Данное изобретение обеспечивает, далее, белки, содержащие фрагменты аминокислотных последовательностей с нечетными номерами из SEQ ID NO:1-261. Эти фрагменты должны содержать, по меньшей мере, n последовательных аминокислот из этих последовательностей, и в зависимости от конкретной последовательности n равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 30, 40, 50, 75, 100, 150, 200 или более). Предпочтительно эти фрагменты содержат один или более эпитопов из этой последовательности. Другие предпочтительные фрагменты не содержат сигнального пептида.
Белки данного изобретения могут быть получены различными средствами, например химическим синтезом (по меньшей мере, частично), расщеплением более длинных полипептидов с использованием протеаз, трансляцией из РНК, очисткой из культуры клеток (например, рекомбинантной экспрессией или из культуры С. trachomatis) и т.д. Предпочтительным способом является гетерологичная экспрессия в Е. coli.
Белки данного изобретения могут принимать различные формы, например могут быть природными, слитыми, гликолизилированными, негликозилированными, липидированными и т.д.
Белки данного изобретения предпочтительно получают по существу в чистой форме (т.е. по существу не содержащей других белков С. trachomatis или клеточных белков хозяина).
Белки данного изобретения могут быть присоединены к твердому носителю. Они могут содержать детектируемую метку (например, радиоактивную или флуоресцентную метку или биотиновую метку).
Белки данного изобретения являются предпочтительно хламидиальными белками.
Нуклеиновые кислоты С. trachomatis
Данное изобретение обеспечивает нуклеиновые кислоты, содержащие одну или более нуклеотидных последовательностей с четными номерами из SEQ ID NO:2-262.
Настоящее изобретение также обеспечивает нуклеиновые кислоты, содержащие последовательности, которые имеют, по меньшей мере, х% идентичности с последовательностями с четными номерами SEQ ID NO:2-262. В зависимости от конкретной последовательности х обозначает предпочтительно 50% или более (например, 60%, 70%, 80%, 90%, 95%, 99% или более).
Кроме того, данное изобретение обеспечивает нуклеиновые кислоты, которые могут гибридизоваться с нуклеиновыми кислотами, содержащими нуклеотидные последовательности с четными номерами из SEQ ID NO:2-262. Реакции гибридизации могут выполняться в условиях различной "жесткости". Условия, которые увеличивают жесткость реакции гибридизации, широко известны и опубликованы в данной области. Примеры релевантных условий включают (в порядке увеличения жесткости): температуры инкубирования 25°С, 37°С, 50°С, 55°С и 68°С; концентрации буфера 10xSSC, 6xSSC, 1xSSC, 0,1xSSC и их эквиваленты с использованием других буферных систем; концентрации формамида 0%, 25%, 50% и 75%; периоды инкубации от 5 минут до 24 часов; 1, 2 или более стадий промывок; периоды инкубации промывок 1, 2 или 15 минут и промывные растворы 6xSSC, 1xSSC, 0,1xSSC или деионизованная вода. В некоторых вариантах выделенная нуклеиновая кислота данного изобретения селективно гибридизуется в условиях низкой жесткости; в других вариантах она селективно гибридизуется в условиях промежуточной жесткости; в других вариантах она селективно гибридизуется в условиях высокой жесткости. Примером набора условий гибридизации низкой жесткости является 50°С и 10xSSC. Примером условий гибридизации промежуточной жесткости является 55°С и 1xSSC. Примером условий гибридизации высокой жесткости является 68°С и 0,1 х SSC.
Обеспечены также нуклеиновые кислоты, содержащие фрагменты нуклеотидных последовательностей с четными номерами SEQ ID NO:2-262. Они должны содержать, по меньшей мере, n последовательных нуклеотидов из последовательностей С. trachomatis, и в зависимости от конкретной последовательности n равно 7 или более (например, 10, 12, 14, 15, 18, 20, 25, 30, 35, 40, 50, 75, 100, 200, 300 или более).
Согласно следующему аспекту данное изобретение обеспечивает нуклеиновую кислоту, кодирующую белки и фрагменты белков данного изобретения.
Данное изобретение обеспечивает нуклеиновую кислоту, содержащую последовательности, комплементарные последовательностям, описанным выше (например, для антисмысловых целей или целей зондирования).
Конечно, нуклеиновая кислота данного изобретения может быть получена многими путями, например химическим синтезом (по меньшей мере, частично), расщеплением более длинных полинуклеотидов с использованием рестрикционных ферментов (рестриктаз), из геномных библиотек или кДНК-библиотек, из самого организма и т.д.
Нуклеиновые кислоты данного изобретения могут принимать различные формы (например, быть одноцепочечными, двухцепочечными, линейными, кольцевыми, быть векторами, зондами и т.д.).
Нуклеиновые кислоты данного изобретения могут быть прикреплены к твердому носителю (например, к грануле, планшету, фильтру, пленке, предметному стеклу, смоле и т.д.). Нуклеиновые кислоты данного изобретения могут включать детектируемую метку (например, радиоактивную или флуоресцентную метку или биотиновую метку). Это особенно применимо, когда полинуклеотид должен быть использован в способах обнаружения нуклеиновых кислот, например, когда данная нуклеиновая кислота является праймером или зондом для использования в таких способах, как PCR, LCR, ТМА, NASBA, bDNA и т.д.
Нуклеиновые кислоты данного изобретения являются предпочтительно хламидиальными нуклеиновыми кислотами.
Термин "нуклеиновая кислота" включает ДНК, РНК, гибриды ДНК/РНК и аналоги ДНК или РНК, такие как аналоги, содержащие модифицированные скелеты молекул или основания, а также пептиднуклеиновые кислоты (ПНК) и т.д.
Нуклеиновые кислоты данного изобретения могут быть выделены и получены по существу в чистом виде, обычно не в виде интактной хромосомы. Обычно эти полинуклеотиды получают по существу не содержащими природно встречающихся последовательностей нуклеиновых кислот, являющихся обычно, по меньшей мере, на приблизительно 50% (по массе) чистыми, обычно, по меньшей мере, на приблизительно 90% чистыми.
Нуклеиновые кислоты могут быть использованы, например, для получения полипептидов; в качестве зондов для обнаружения нуклеиновой кислоты в биологических образцах; для генерирования дополнительных копий полинуклеотидов; для генерирования рибозимов или антисмысловых олигонуклеотидов и в качестве одноцепочечных ДНК-зондов или в качестве образующих тройную цепь олигонуклеотидов и т.д.
Данное изобретение обеспечивает векторы, содержащие нуклеотидные последовательности данного изобретения, (например, клонирующие векторы или экспрессирующие векторы) и трансформированные ими клетки-хозяева.
Композиции
Согласно следующему аспекту данное изобретение обеспечивает композиции, содержащие белок и/или нуклеиновую кислоту данного изобретения. Эти композиции предпочтительно являются иммуногенными композициями, такими как вакцины, и пригодны для целей иммунизации и вакцинации. Вакцины данного изобретения могут быть профилактическими или терапевтическими и будут обычно содержать антиген, который может индуцировать антитела, способные ингибировать (а) хламидиальную адгезию, (b) хламидиальное вхождение и/или (с) успешную репликацию в клетке-хозяине. Эти вакцины предпочтительно индуцируют любые клеточно-опосредованные Т-клеточные ответы, которые необходимы для клиренса хламидий из хозяина.
Данное изобретение обеспечивает также нуклеиновую кислоту или белок в соответствии с данным изобретением для применения в качестве медикаментов (например, в качестве вакцин).
Данное изобретение обеспечивает также применение нуклеиновой кислоты или белка в соответствии с данным изобретением в приготовлении лекарственного средства (например, вакцины или иммуногенной композиции) для лечения или предупреждения инфекции, обусловленной Chlamydia. Ею является обычно С. trachomatis, но вследствие межвидовой перекрестной реактивности она может быть также С. pneumoniae, С. pecorum или С. psitacci. Для профилактики это лекарственное средство предпочтительно индуцирует иммунный ответ, который является специфическим в отношении ЕВ-формы Chlamydia, для лечения это лекарственное средство предпочтительно индуцирует иммунный ответ, который является специфическим в отношении RB-формы Chlamydia.
Данное изобретение обеспечивает также применение нуклеиновой кислоты или белка в соответствии с данным изобретением в приготовлении лекарственного средства (например, вакцины или иммуногенной композиции) для нейтрализации элементарных тел Chlamydia trachomatis.
Данное изобретение обеспечивает также способ лечения (например, иммунизации) пациента (например, человека), предусматривающий введение пациенту терапевтически эффективного количества нуклеиновой кислоты или белка данного изобретения.
Данное изобретение обеспечивает способ индукции иммунного ответа у пациента, предусматривающий введение пациенту иммунологически эффективного количества нуклеиновой кислоты или белка данного изобретения. Иммунный ответ может включать индукцию антител у пациента и/или индукцию клеточного иммунного ответа (например, CTL-ответа). Этот иммунный ответ может быть специфическим в отношении белка ЕВ или RB или в отношении белка, который экспрессируется в цитоплазме хозяина. Антительный ответ предпочтительно является специфическим в отношении ЕВ, тогда как клеточный иммунный ответ является предпочтительно специфическим в отношении цитоплазматического белка или предпочтительно в отношении RB-белка.
Данное изобретение обеспечивает также способ индукции антител, которые узнают белок данного изобретения, предусматривающий стадию введения пациенту элементарного тела или ретикулярного тела Chlamydia. Эти антитела являются предпочтительно специфическими в отношении ЕВ.
Данное изобретение обеспечивает также способ нейтрализации инфективности С. trachomatis, предусматривающий стадию введения пациенту белка, нуклеиновой кислоты или антитела данного изобретения. Этот способ предпочтительно нейтрализует ЕВ-инфективность.
Данное изобретение обеспечивает также способ обнаружения ЕВ или RB Chlamydia в биологическом образце, предусматривающий стадию контактирования антитела данного изобретения с этим образцом. Этим образцом может быть проба крови, другая жидкость тела или образец ткани. Этот способ может быть использован для диагностики хламидиальной инфекции.
Иммуногенные композиции данного изобретения могут также включать один или более из следующих антигенов:
- белковый антиген из Helicobacter pylori, такой как VacA, CagA, NAP, HopX, HopY (например, WO 98/04702) и/или уреазу;
- белковый антиген из серогруппы В N. meningitidis, такой как в WO99/24578, WO99/36544, WO99/57280, WO00/22430, Tettelin et al. (2000) Science 287:1809-1815, Pizza et al. (2000) Science 287:1816-1820, и WO96/29412, причем предпочтительными являются белок '287' и его производные;
- препарат везикул наружной мембраны (OMV) из серогруппы В N. meningitidis, такой как описанный в WO01/52885; Bjune et al. (1991) Lancet 338(8775): 1093-1096; Fukasawa et al. (1999) Vaccine 17:2951-2958; Rosenqvist et al. (1998) Dev. Biol. Stand. 92:323-333 и т.д.;
- сахаридный антиген из серогруппы А, С, W135 и/или Y N. meningitidis, такой как олигосахарид, описанный в Costantino et al. (1992) Vaccine 10:691-698, и из серогруппы С (см. также Costantino et al. (1999) Vaccine 17:1251-1263);
- сахаридный антиген из Streptococcus pneumonias (например, Watson (2000) Pediatr Infect Dis J 19:331-332; Rubin (2000) Pediatr Clin North Am 47:269-285, v; Jedrzejas (2001) Microbiol Mol Biol Rev 65:187-207);
- антиген из вируса гепатита А, такой как инактивированный вирус (например. Bell (2000) Pediatr Infect Dis J 19:1187-1188; Iwarson (1995) APMIS 103:321-326);
- антиген из вируса гепатита В, такой как антигены поверхности и/или коры (например, Gerlich et al. (1990) Vaccine 8 Suppi: S63-68 & 79-80);
- антиген из вируса гепатита С (например, Hsu et al. (1999) Clin Liver Dis 3:901-915);
- антиген из Bordetella pertussis, такой как коклюшный голотоксин (РТ) и нитевидный гемагглютинин (FHA) из В. pertussis, необязательно также в комбинации с пертактином и/или агглютиногенами 2 и 3 (например, Gustafsson et al. (1996) N. Engl. J. Med. 334:349-355; Rappuoli et al. (1991) TIBTECH 9:232-238);
- дифтерийный антиген, такой как дифтерийный токсоид (например, часть 3 Vaccines (1988) eds. Plotkin & Mortimer. ISBN 0-7216-1946-0), например, мутант CRM197 (например, Del Guidice et al. (1998) Molecular Aspects of Medicine 19:1-70);
- столбнячный антиген, такой как столбнячный токсоид (например, часть 4 Plotkin & Mortimer);
- сахаридный антиген из Haemophilus influenzae В.;
- антиген из N. gonorrhoeae (например, WO99/24578, WO99/36544, WO99/57280);
- антиген из Chlamydia pneumoniae (например, PCT/IB01/01445; Kalman et al. (1999) Nature Genetics 21:385-389; Read et al. (2000) Nucleic Acids Res 28:1397-406; Shirai et al. (2000) J. Infect. Dis. 181 (Suppl 3):S524-S527; WO99/27105; WO00/27994; WO00/37494);
- антиген из Chlamydia trachomatis (например, WO99/28475);
- антиген из Porphyromonas gingivalis (например, Ross et al. (2001) Vaccine 19:4135-4142);
- антиген (антигены) полио (например, Sutter et al. (2000) Pediatr Clin North Am 47:287-308; Zimmerman & Spann (1999) Am Fam Physician 59:113-118, 125-126), такой как IPV или OPV;
- антиген (антигены) бешенства (например, Dreesen (1997) Vaccine 15 Suppl:S2-6), такой как лиофилизированный инактивированный вирус (например, MMWR Morb Mortal Wkly Rep 1998 Jan 16; 47(1):12, 19; RabAvert™);
- антигены кори, эпидемического паротита и/или краснухи (например, 9, 10 и 11 Plotkin & Mortimer);
- антиген (антигены) гриппа (например, часть 19 Plotkin & Mortimer), такие как поверхностные белки гемагглютинина и/или нейраминидазы;
- антиген из Moraxella catarrhalis (например, McMichael (2000) Vaccine 19 Suppl 1:S101-107);
--антиген из Staphylococcus aureus (например, Kuroda et al. 2001) Lancet 357(9264):1225-1240; см. также страницы 1218-1219);
- антиген из Streptococcus agalactiae (например, см. WO02/34771);
- антиген из Streptococcus pyogenes (например, см. WO02/34771).
Если включен сахаридный или углеводный антиген, он предпочтительно конъюгирован с белком-носителем для усиления иммуногенности (например, Ramsay et al. (2001) Lancet 357 (9251):195-196; Lindberg (1999) Vaccine 17 Suppi 2:328-36; Conjugate Vaccines (eds. Cruse et al.) ISBN 3805549326, в частности, vol. 10:48-114 и т.д.). Предпочтительными белками-носителями являются бактериальные токсины или токсоиды, такие как дифтерийный или столбнячный токсоиды. Особенно предпочтительным является дифтерийный токсоид CRM197. Другие подходящие белки-носители включают белок наружной мембраны N. meningitidis (например, ЕР-0372501), синтетические пептиды (например, ЕР-0378881), белки теплового шока (например, WO93/17712), коклюшные белки (например, WO98/58668, ЕР-0471177), белок D из H. influenzae (например, WO00/56360), токсин А или В из С. difficile (например, WO00/61761) и т.д. Может быть использована любая подходящая реакция конъюгации с любым подходящим линкером, если это необходимо.
Токсические белковые антигены могут быть детоксицированы, если необходимо, (например, детоксикацией коклюшного токсина химическими и/или генетическими средствами).
Если в композицию включен дифтерийный антиген, предпочтительно также включать столбнячный и коклюшный антигены. Подобным образом, если включен столбнячный антиген, предпочтительно также включать дифтерийный и коклюшный антигены. Подобным образом, если включен коклюшный антиген, предпочтительно также включать дифтерийный и столбнячный антигены.
Антигены предпочтительно адсорбированы на соли алюминия.
Антигены в этой композиции обычно присутствуют в концентрации, по меньшей мере, 1 мкг/мл каждый. Обычно концентрация любого конкретного антигена должна быть достаточной для индукции иммунного ответа на этот антиген.
Данное изобретение обеспечивает также композиции, содержащие два или более белков данного изобретения.
Способы
Данное изобретение обеспечивает способ получения белков данного изобретения, предусматривающий стадию культивирования клетки-хозяина данного изобретения в условиях, которые индуцируют экспрессию белка.
Данное изобретение обеспечивает способ получения белка или нуклеиновой кислоты данного изобретения, где этот белок или эту нуклеиновую кислоту синтезируют частично или полностью химическими средствами.
Данное изобретение обеспечивает способ обнаружения С. trachomatis в образцах, где этот образец контактирует с антителом, которое связывается с белком данного изобретения.
Далее следует краткое изложение стандартных способов и процедур, которые могут использоваться для осуществления данного изобретения (например, для применения описанных последовательностей для иммунизации). Это краткое изложение не является ограничением данного изобретения, но дает примеры, которые могут быть использованы, но не являются обязательными.
Общая часть
В практике данного изобретения будут использоваться, если нет других указаний, общепринятые способы молекулярной биологии, микробиологии, рекомбинантных ДНК и иммунологии, которые находятся в рамках компетенции в данной области. Такие способы полностью объясняются в литературе, например в Sambrook Molecular Cloning; A Laboratory Manual, Second Edition (1989) and Third Edition (2001); DNA Cloning, Volumes I and II (D.N. Glover ed. 1985); Oligonucleotide Synthesis (M.J. Gait ed, 1984); Nucleic Acid Hybridization (B.D. Hames & S.J. Higgins eds. 1984); Transcription and Translation (B.D. Hames & S.J. Higgins eds. 1984); Animal Cell Culture (R.I. Freshney ed. 1986); Immobilized Cells and Enzymes (IRL Press, 1986); В. Perbal, A Practical Guide to Molecular Cloning (1984); The Methods in Enzymology series (Academic Press, Inc.), especially volumes 154 & 155; Gene Transfer Vectors for Mammalian Cells (J.H. Miller and M.P. Calos eds. 1987, Cold Spring Harbor Laboratory); Mayer and Walker, eds. (1987), Immunochemical Methods in Cell and Molecular Biology (Academic Press, London); Scopes, (1987) Protein Purification: Principles and Practice, Second Edition (Springer-Verlag, N.Y.), and Handbook of Experimental Immunology, Volumes I-IV (D.M. Weir and С.С. Blackwell eds 1986).
В данном описании используются стандартные аббревиатуры для нуклеотидов и аминокислот.
Определения
Композиция, содержащая X, является "по существу свободной от" Y, когда, по меньшей мере, 85% по массе общего количества X+Y в этой композиции составляет X. Предпочтительно Х содержит, по меньшей мере, приблизительно 90% по массе общего количества X+Y в этой композиции, более предпочтительно, по меньшей мере, приблизительно 95% или даже 99% по массе.
Термин "содержащий" означает "включающий в себя", а также "состоящий", например, композиция, "содержащая" X, может состоять исключительно из Х или может включать что-нибудь дополнительно к X, например, X+Y.
Термин "гетерологичные" относится к двум биологическим компонентам, которые не обнаруживаются вместе в природе. Этими компонентами могут быть клетки-хозяева, гены или регуляторные районы, такие как промоторы. Хотя гетерологичные компоненты не обнаруживаются вместе в природе, они могут функционировать вместе, например, когда промотор, гетерологичный в отношении гена, функционально связан с этим геном. Другим примером является пример, когда хламидиальная последовательность является гетерологичной для мышиной клетки-хозяина. Другими примерами могли бы быть два эпитопа из одного и того же белка или различных белков, которые были собраны в единый белок в расположении, не обнаруживаемом в природе.
"Начало репликации" является полинуклеотидной последовательностью, которая инициирует и регулирует репликацию полинуклеотидов, таких как экспрессирующий вектор. Начало репликации ведет себя как автономная единица репликации полинуклеотида в клетке, способная реплицироваться под своим собственным контролем. Начало репликации может быть необходимым для вектора для его репликации в конкретной клетке-хозяине. С определенными началами репликации экспрессирующий вектор может репродуцироваться при высоком количестве копий в присутствии подходящих белков внутри клетки. Примерами начал репликации являются автономно реплицирующиеся последовательности, которые являются эффективными в дрожжах, и вирусный Т-антиген, эффективный в клетках COS-7.
"Мутантная последовательность" определяется как ДНК, РНК или аминокислотная последовательность, отличающаяся, но имеющая идентичность последовательности с нативной или описанной последовательностью. В зависимости от конкретной последовательности степень идентичности последовательности между нативной или описанной последовательностями и мутантной последовательностью составляет предпочтительно более чем 50% (например, 60%, 70%, 80%, 90%, 95%, 99% или более, при расчете с использованием алгоритма Смита-Уотермана, как описано выше). В данном контексте, "аллельный вариант" молекулы нуклеиновой кислоты, или района, для которого обеспечена последовательность нуклеиновой кислоты в данном описаниии, является молекулой нуклеиновой кислоты, или районом, которые встречаются по существу в том же самом локусе в геноме другого или второго изолята и которые, вследствие природной изменчивости, вызванной, например, мутацией или рекомбинацией, имеют сходную, но не идентичную последовательность нуклеиновой кислоты. Аллельный вариант кодирующего района обычно кодирует белок, имеющий сходную активность относительно активности белка, кодируемого геном, с которым его сравнивают. Аллельный вариант может также содержать изменение в 5'- или 3'-нетранслируемых районах этого гена, например в районах регуляторного контроля (например, см. патент США 5753235).
Системы экспрессии
Хламидиальные нуклеотидные последовательности могут экспрессироваться в ряде различных систем экспрессии, например в системах экспрессии, используемых клетками млекопитающих, бакуловирусами, растениями, бактериями и дрожжами.
i. Системы млекопитающих
Системы экспрессии млекопитающих известны в данной области. Промотор млекопитающих является любой последовательностью ДНК, способной связывать РНК-полимеразу млекопитающих и инициировать направленную к 3'-концу транскрипцию кодирующей последовательности (например, структурного гена) в мРНК. Промотор будет иметь район инициации транскрипции, который обычно расположен проксимально относительно 5'-конца кодирующей последовательности, и ТАТА-блок, обычно расположенный в 25-30 парах оснований (п.н.) "слева" от начала транскрипции. Считают, что ТАТА-блок управляет РНК-полимеразой II, заставляя ее начинать синтез РНК в правильном сайте. Промотор млекопитающих содержит также "левый" промоторный элемент, обычно расположенный в 100-200 п.н. слева от ТАТА-блока. "Левый" промоторный элемент определяет скорость, с которой инициируется транскрипция, и может действовать в любой ориентации (Sambrook et al. (1989) "Expression of Cloned Genes in Mammalian Cells", In Molecular Cloning: A Laboratory Manual, 2nd ed.).
Гены вирусов млекопитающих являются часто высокоэкспрессируемыми и имеют большой диапазон хозяев; таким образом, последовательности, кодирующие гены вирусов млекопитающих, обеспечивает особенно полезные промоторные последовательности. Примеры включают ранний промотор SV40, мышиный промотор LTR вируса опухоли молочной железы, главный поздний промотор аденовируса (Ad MLP) и промотор вируса простого герпеса. Кроме того, последовательности, произведенные не из вирусных генов, такие как мышиный ген металлотионеина, также обеспечивают полезные промоторные последовательности. Экспрессия может быть либо конститутивной, либо регулируемой (индуцибелной), зависящей от промотора, который может индуцироваться глюкокортикоидом в гормон-чувствительных клетках.
Присутствие энхансерного элемента (энхансера), в комбинации с описанными выше промоторными элементами, обычно будет увеличивать уровни экспрессии. Энхансером является регуляторная последовательность ДНК, которая может стимулировать транскрипцию до 1000-кратного уровня при связывании с гомологичными или гетерологичными промоторами, причем синтез начинается в нормальном стартовом сайте РНК. Энхансеры являются также активными, когда они помещены "слева" или "справа" от начала транскрипции, либо в нормальной, либо в реаранжированной ориентации, или на расстоянии более чем 1000 нуклеотидов от промотора (Maniatis et al. (1987) Science 236:1237; Alberts et al. (1989) Molecular Biology of the Cell, 2nd ed.). Энхансерные элементы, полученные из вирусов, могут быть особенно полезными, так как они обычно имеют более широкий спектр хозяев. Примеры включают энхансер раннего гена SV40 (Dijkema et al. (1985) EMBO J. 4:761) и энхансер/промоторы, полученные из длинного концевого повтора (LTR) вируса саркомы Рауса (Gorman et al. (1982) PNAS USA 79:6777) и из цитомегаловируса человека (Boshart et al. (1985) Cell 41:521). Дополнительно некоторые энхансеры являются регулируемыми и становятся активными только в присутствии индуктора, такого как гормон или ион металла (Sassone-Corsi and Borelli (1986) Trends Cenet. 2:215; Maniatis et al. (1987) Science 236:1237).
Молекула ДНК может экспрессироваться внутриклеточно в клетках млекопитающих. Промоторная последовательность может быть непосредственно связана с молекулой ДНК, и в этом случае первой аминокислотой на N-конце рекомбинантного белка всегда будет метионин, который кодируется стартовым кодоном ATG. Если желательно, N-конец может быть отщеплен от этого белка инкубацией in vitro с цианогенбромидом.
Альтернативно чужеродные белки могут также секретироваться из клетки в среду для выращивания посредством создания химерных молекул ДНК, которые кодируют слитый белок, включающий фрагмент лидерной последовательности, которая обеспечивает секрецию чужеродного белка в клетках млекопитающих. Предпочтительно имеются сайты процессинга, кодируемые между этим лидерным фрагментом и чужеродным геном, которые могут расщепляться in vivo или in vitro. Фрагмент лидерной последовательности обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот, которые управляют секрецией этого белка из клетки. Аденовирусный, состоящий из трех частей лидер является примером лидерной последовательности, которая обеспечивает секрецию чужеродного белка в клетках млекопитающих.
Обычно последовательности терминации транскрипции и последовательности полиаденилирования, узнаваемые клетками млекопитающих, являются регуляторными районами, расположенными 3' (справа) от стоп-кодона трансляции, и, следовательно, вместе с промоторными элементами фланкируют кодирующую последовательность. 3'-конец зрелой мРНК образуется сайт-специфическим посттрансляционным расщеплением и полиаденилированием (Birnstiel et al. (1985) Cell 41:349; Proudfoot and Whitelaw (1988) "Termination and 3' end processing of eukaryotic RNA. In Transcription and splicing (ed. B.D. Hames and D.M. Glover); Proudfoot (1989) Trends Biochem. Sci. 14:105). Эти последовательности управляют транскрипцией мРНК, которая может транслироваться в полипептид, кодируемый ДНК. Примеры сигналов терминации транскрипции/полиаденилирования включают эти элементы, происходящие из SV40 (Sambrook et al. (1989) "Expression of cloned genes in cultured mammalian cells." In Molecular Cloning: A Laboratory Manual).
Обычно описанные выше компоненты, содержащие промотор, сигнал полиаденилирования и последовательность терминации транскрипции, помещают вместе в экспрессионные конструкции. Энхансеры, интроны с функциональными донорными и акцепторными сайтами сплайсинга и лидерные последовательности могут быть включены в экспрессионную конструкцию, если это желательно. Экспрессионные конструкции часто поддерживаются в репликоне, таком как внехромосомный элемент (например, плазмиды), способном к стабильному сохранению в хозяине, таком как клетки млекопитающих или бактерии. Системы репликонов млекопитающих включают системы, произведенные из вирусов животных, которые требуют для репликации транс-активирующих факторов. Например, плазмиды, содержащие системы репликации паповавирусов, таких как SV40 (Gluzman (1981) Cell 23:175) или полиомавирус, реплицируются до чрезвычайно высокого количества копий в присутствии подходящего вирусного Т-антигена. Дополнительные примеры репликонов млекопитающих включают репликоны, полученные из бычьего папилломавируса и вируса Эпштейна-Барра. Кроме того, этот репликон может иметь две системы репликации, что позволяет ему сохраняться, например, в клетках млекопитающих для экспрессии и в прокариотическом хозяине для клонирования и амплификации. Примеры таких челночных (млекопитающее-бактерии) векторов включают рМТ2 (Kaufman et al. (1989) Mol. Cell. Biol. 9:946) и pHEBO (Shimizu et al. (1986) Mol. Cell. Biol 6:1074).
Используемая процедура трансформации зависит от трансформируемого хозяина. Способы введения гетерологичных полинуклеотидов в клетки млекопитающих известны в данной области и включают опосредованную декстраном трансфекцию, осаждение фосфатом кальция, опосредованную полибреном трансфекцию, слияние протопластов, электропорацию, инкапсулирование полинуклеотида (полинуклеотидов) в липосомах, прямую микроинъекцию ДНК в ядра.
Клетки млекопитающих, доступные в качестве хозяев для экспрессии, известны в данной области и включают многие иммортализованные клеточные линии, доступные из Американской коллекции типовых культур (АТСС), в том числе, но не только, клетки яичника китайского хомячка (СНО), клетки HeLa, клетки почки детеныша хомячка (ВНК), клетки почки обезьяны (COS), клетки печеночно-клеточной карциномы человека (например, Нер G2) и ряд других клеточных линий.
ii. Системы бакуловируса
Полинуклеотиды, кодирующие белок, могут быть также введены в подходящий экспрессирующий вектор насекомых и функционально связаны с регуляторными элементами в этом векторе. Конструирование векторов использует способы, которые известны в данной области. Обычно компоненты этой экспрессионной системы включают вектор-переносчик, обычно бактериальную плазмиду, которая содержит как фрагмент генома бакуловируса, так и удобный сайт рестрикции для встраивания гетерологичного гена или генов, которые должны быть экспрессированы; бакуловирус дикого типа с последовательностью, гомологичной бакуловирус-специфическому фрагменту в векторе-переносчике (это делает возможным гомологичную рекомбинацию для встраивания гетерологичного гена в геном бакуловируса), и подходящие клетки-хозяева насекомых и среды для выращивания.
После встраивания ДНК-последовательности, кодирующей этот белок, в вектор-переносчик этот вектор и вирусный геном дикого типа трансфицируют в клетку-хозяина насекомого, где этому вектору и вирусному геному представляют возможность рекомбинироваться. Упакованный рекомбинантный вирус экспрессируется и рекомбинантные бляшки идентифицируют и очищают. Материалы и способы для систем экспрессии бакуловирус/клетка насекомого являются коммерчески доступными в форме набора из, inter alia, Invitrogen, San Diego CA (набор "MaxBac"). Эти способы обычно известны специалистам с квалификацией в данной области и полностью описаны в работе Summers and Smith, Texas Agricultural Experiment Station Bulletin No. 1555 (1987) (далее называемой "Summers and Smith").
Перед встраиванием ДНК-последовательности, кодирующей белок, в бакуловирусный геном вышеописанные компоненты, содержащие промотор, лидер (если желательно), представляющую интерес кодирующую последовательность и последовательность терминации транскрипции, обычно собирают в промежуточную перемещающую конструкцию (вектор-переносчик). Эта конструкция может содержать единственный ген и функционально связанные регуляторные элементы; множественные гены, каждый с его собственным набором функционально связанных регуляторных элементов, или множественные гены, регулируемые одним и тем же набором регуляторных элементов. Промежуточные, переносящие конструкции часто поддерживаются в репликоне, таком как внехромосомный элемент (например, плазмиды), способном стабильно сохраняться в хозяине, таком как бактерия. Репликон имеет систему репликации, что позволяет ему сохраняться в подходящем хозяине для клонирования и амплификации.
В настоящее время наиболее часто используемым вектором-переносчиком для введения чужеродных генов в AcNPV является рАс373. Были сконструированы также многочисленные другие векторы, известные специалистам с квалификацией в данной области. Они включают, например, pVL985 (который изменяет стартовый кодон полиэдрина с ATG на АТТ и который вводит BamHI-клонирующий сайт в 32 парах оснований справа от АТТ; см. Luckow and Summers, Virology (1989) 17:31.
Эта плазмида обычно содержит также сигнал полиаденилирования полиэдрина (Miller et al. (1988) Ann. Rev. Microbiol., 42:177) и прокариотический ген устойчивости к ампициллину (amp) и начало репликации для отбора и размножения в Е. coli.
Бакуловирусные векторы-переносчики обычно содержат бакуловирусный промотор. Бакуловирусный промотор является любой ДНК-последовательностью, способной связывать бакуловирусную РНК-полимеразу и инициировать транскрипцию в направлении 5'→3' кодирующей последовательности (например, структурного гена) в мРНК. Промотор будет иметь район инициации транскрипции, который обычно помещен проксимально относительно 5'-конца кодирующей последовательности. Этот район инициации транскрипции обычно включает сайт связывания РНК-полимеразы и начало транскрипции. Бакуловирусный вектор-переносчик может также иметь второй домен, называемый энхансером, который, если он присутствует, находится обычно дистально относительно структурного гена. Экспрессия может быть либо регулируемой, либо конститутивной.
Структурные гены, обильно транскрибируемые в поздние периоды вирусного инфекционного цикла, обеспечивают особенно полезные промоторные последовательности. Примеры включают последовательности, происходящие из гена, кодирующего вирусный белок полиэдрон, Friesen et al., (1986) "The Regulation of Baculovirus Gene Expression." in: The Molecular Biology of Baculoviruses (ed. Walter Doerfler); EPO Publ. Nos. 127839 and 155476; и ген, кодирующий белок р10, Vlak et al., (1988), J. Gen. Virol. 69:765.
ДНК, кодирующие подходящие сигнальные последовательности, могут быть получены из генов для секретируемых белков насекомых или бакуловируса, например гена полиэдрина бакуловируса (Carbonell et al. (1988) Gene, 73:409). Альтернативно, поскольку сигналы посттрансляционных модификаций клеток млекопитающих (таких как отщепление сигнального пептида, протеолитическое расщепление и фосфорилирование), по-видимому, узнаются клетками насекомых, и эти сигналы, требующиеся для секреции и ядерного накопления, являются, по-видимому, также консервативными между клетками беспозвоночных и клетками позвоночных, лидерные последовательности, происходящие не из насекомых, такие как происходящие из генов, кодирующих α-интерферон человека, Maeda et al., (1985), Nature 315:592; высвобождающий гастрин пептид человека, Lebacq-Verheyden et al., (1988), Molec. Cell. Biol. 8:3129; IL-2 человека. Smith et al., (1985) Proc. Natl. Acad. Sci. USA 82:8404; мышиный IL-3, Miyajima et al., (1987) Gene 58:273 и глюкоцереброзидазу человека, Martin et al. (1988) DNA, 7:99, могут быть также использованы для обеспечения секреции в насекомых.
Рекомбинантный полипептид или полипротеин может экспрессироваться внутриклеточно или, если он экспрессируется с правильными регуляторными последовательностями, может секретироваться. Хорошая внутриклеточная экспрессия неслитых чужеродных белков обычно требует гетерологичных генов, которые в идеале имеют короткую лидерную последовательность, содержащую подходящие сигналы инициации трансляции, предшествующие стартовому сигналу ATG. Если желательно, метионин на N-конце может быть отщеплен от зрелого белка посредством инкубирования in vitro с цианогенбромидом.
Альтернативно рекомбинантные полипротеины или белки, которые природно не секретируются, могут секретироваться из клетки насекомого посредством создания химерных молекул ДНК, которые кодируют слитый белок, включающий фрагмент лидерной последовательности, который обеспечивает секрецию чужеродного белка в насекомых. Этот фрагмент лидерной последовательности обычно кодирует сигнальный пептид, содержащий гидрофобные аминокислоты, которые направляют транслокацию этого белка в эндоплазматическую сеть (ретикулум).
После встраивания этой ДНК-последовательности и/или гена, кодирующего предшественник продукта экспрессии данного белка, клетку-хозяина насекомого котрансформируют гетерологичной ДНК вектора-переносчика и геномной ДНК бакуловируса дикого типа, обычно посредством котрансфекции. Промотор и последовательность терминации транскрипции этой конструкции будет обычно содержать сегмент размером 2-5 т.п.н. бакуловирусного генома. Способы введения гетерологичной ДНК в желаемый сайт в бакуловирусе известны в данной области (см. Summers and Smith выше; Ju et al. (1987); Smith et al., Mol. Cell Biol. (1983) 3:2156, и Luckow and Summers (1989)). Например, встраивание может быть встраиванием в ген, такой как ген полиэдрина, гомологичной рекомбинацией посредством двойного кроссинговера; встраивание может быть также встраиванием в сайт рестриктазы, сконструированный в желаемом бакуловирусном гене. Miller et al., (1989), Bioassays 4:91. Эта ДНК-последовательность, при клонировании вместо гена полиэдрина в экспрессирующий вектор, фланкирована как 5'-, так и 3'-полиэдрин-специфическими последовательностями и расположена справа от промотора полиэдрина.
Затем новообразованный бакуловирусный экспрессирующий вектор упаковывают в инфекционный рекомбинантный бакуловирус. Гомологичная рекомбинация происходит при низкой частоте (между ˜1% и ˜5%); следовательно, большая часть вируса, получаемого после котрансфекции, все еще является вирусом дикого типа. Таким образом, необходим способ для идентификации рекомбинантных вирусов. Преимуществом этой системы экспрессии является визуальный скрининг, позволяющий отличить рекомбинантые вирусы. Белок полиэдрин, который продуцируется природными вирусами, продуцируется при очень высоких уровнях в ядрах инфицированных клеток в поздние периоды после инфицирования вирусом. Накапливаемый белок полиэдрин образует тела включений, которые также содержат погруженные в них частицы. Эти тела включений, размером до 15 нм, имеют высокое преломление, придающее им яркий светящийся вид, который легко визуализируется под световым микроскопом. Клетки, инфицированные рекомбинантым вирусом, не имеют тел включения. Для отличения рекомбинантого вируса от вируса дикого типа супернатант после трансфекции используют для образования бляшек помещением на монослой клеток насекомых способами, известными специалистам с квалификацией в данной области. А именно, бляшки подвергают скринингу под световым микроскопом на присутствие (являющееся признаком вируса дикого типа) или отсутствие (являющееся признаком рекомбинантного вируса) тел включения. "Current Proticols in Microbiology" Vol. 2 (Ausubel et al. td.) at 16.8 (Suppl. 10, 1990); Summers & Smith, выше; Miller et al. (1989).
Для инфицирования в несколько клеток насекомых были разработаны рекомбинантные бакуловирусные векторы. Например, были разработаны рекомбинантные бакуловирусы для, inter alia: Aedes aegypti, Autographa californica, Bombyx mori, Drosophila melanogaster, Spodoptera frugiperda и Trichoplusia ni (WO 89/046699; Carbonelli et al., (1985) J. Virol. 56:153; Wright (1986) Nature 321:718; Smith et al., (1983) Mol. Cell Biol. 3:2156, и см. в общем Fraser et al. (1989) In vitro Cell Dev. Biol. 25:225).
Клетки и среды для культур клеток являются коммерчески доступными как для прямой, так и для слитой экспрессии гетерологичных полипептидов в бакуловирусной системе экспрессии; технология культуры клеток обычно известна специалистам с квалификацией в данной области. См., например. Summers & Smith, выше.
Затем модифицированные клетки насекомых могут выращиваться в подходящей питательной среде, которая представляет возможность для стабильного сохранения плазмиды (плазмид), присутствующей в модифицированном насекомом-хозяине. Когда ген продукта экспрессии находится под индуцибельным контролем, этот хозяин может выращиваться до высокой плотности, после чего экспрессию индуцируют. Альтернативно, когда экспрессия является конститутивной, этот продукт будет непрерывно экспрессироваться в среду, и питательная среда должна непрерывно циркулироваться для удаления представляющего интерес продукта и пополнения израсходованных питательных веществ. Продукт может быть очищен такими способами, как хроматография, например ВЭЖХ, аффинная хроматография, ионообменная хроматография и т.д.; электрофорез; центрифугирование в градиенте плотности; экстракция растворителем или т.п. Если нужно, продукт может быть очищен дополнительно по мере необходимости, например, для удаления по существу любых белков насекомого, которые также секретируются в среду или происходят из лизиса клеток насекомого, для обеспечения таким образом продукта, который является, по меньшей мере, по существу не содержащим остатков клеток (дебриса) хозяина, например белков, липидов и полисахаридов.
Для получения экспрессии белка рекомбинантные клетки-хозяева, произведенные из трансформантов, инкубируют в условиях, которые обеспечивают возможность экспрессии кодирующей рекомбинантный белок последовательности. Эти условия будут варьироваться в зависимости от выбранной клетки-хозяина. Однако эти условия являются легко устанавливаемыми специалистами с обычной квалификацией в данной области на основе того, что известно в данной области.
iii. Системы растений
Существуют многочисленные генетические системы экспрессии культур клеток растений и целых растений, известные в данной области. Примеры генетических систем экспрессии клеток растений включают системы экспрессии, описанные в патентах, таких как патент США 5693506; патент США 5659122 и патент США 5608143. Дополнительные примеры генетической экспрессии в культуре клеток растений были описаны Zenk, Phytochemistry 30:3861-3863 (1991). Описания сигнальных пептидов белков растений могут быть найдены, кроме ссылок, описанных выше, в Vaulcombe et al., Mol. Gen. Genet. 209:33-40 (1987); Chandler et al. Plant Molecular Biology 3:407-418 (1984); Rogers, J. Biol. Chem. 260:3731-3738 (1985); Rothstein et al. Gene 55:353-356 (1987); Whittier et al., Nucleic Acids Research 15:2515-2535 (1987); Wirsel et al., Molecular Microbiology 3:3-14 (1989); Yu et al., Gene 122:247-253 (1992). Описание регуляции экспрессии генов растений фитогормонами, гибберелловой кислотой и секретируемыми ферментами, индуцируемыми гибберелловой кислотой, может быть найдено в R.L. Jones and J. MacMillin, Gibberellins: in: Advanced Plant Physiology, Malcolm B. Wilkins, ed., 1984 Pitman Publishing Limited, London, pp.21-52. Ссылки, которые описывают другие метаболически регулируемые гены: Sheen, Plant Cell, 2:1027-1038 (1990); Mass et al., EMBO J. 9:3447-3452 (1990); Benkel and Hickey, Proc. Natl. Acad. Sci. 84:1334-1339 (1987).
Обычно с использованием способов, известных в данной области, желаемую полинуклеотидную последовательность встраивают в экспрессионную кассету, содержащую генетические регуляторные элементы, предназначенные для функционирования в растениях. Эту экспрессионную кассету вводят в желаемый экспрессирующий вектор с последовательностями-компаньонами слева и справа от этой экспрессионной кассеты, пригодными для экспрессии в растении-хозяине. Последовательности-компаньоны имеют плазмидное или вирусное происхождение и обеспечивают необходимые свойства вектору, создавая возможность для этого вектора перемещать ДНК из первоначального хозяина для клонирования, такого как бактерии, в желаемое растение-хозяин. Базовая бактериальная/растительная векторная конструкция будет предпочтительно обеспечивать начало репликации для широкого спектра прокариотических хозяев; селектируемый маркер прокариот; и для трансформации с использованием Agrobacterium, Т-ДНК-последовательности для опосредованного Agrobacterium переноса в хромосомы растений. В том случае, если гетерологичный ген не поддается легкому обнаружению, эта конструкция будет предпочтительно иметь также ген селектируемого маркера, подходящий для определения, было ли растение трансформировано. Общий обзор подходящих маркеров, например, для членов семейства злаков, можно найти в Wilmink and Dons, 1993, Plant Mol. Biol. Reptr, 11(2):165-185.
Последовательности, подходящие для создания возможности интеграции гетерологичной последовательности в геном растения, также рекомендованы. Они могут включать последовательности транспозонов и т.п. для гомологичной рекомбинации, а также Ti-последовательности, которые делают возможной случайное встраивание гетерологичной экспрессионной кассеты в геном растения. Подходящие селектируемые маркеры прокариот включают устойчивость в отношении антибиотиков, таких как ампициллин или тетрациклин. Другие ДНК-последовательности, кодирующие дополнительные функции, могут также присутствовать в векторе, как это известно в данной области.
Молекулы нуклеиновых кислот данного изобретения могут быть включены в экспрессионную кассету для экспрессии представляющего интерес белка (белков). Обычно используют только одну экспрессионную кассету, хотя возможным является использование двух или более кассет. Рекомбинантная экспрессионная кассета будет содержать, кроме последовательности, кодирующей гетерологичный белок, следующие элементы: район промотора, 5'-нетранслируемые последовательности растений, инициирующий кодон, в зависимости от того, является ли этот структурный ген уже снабженным им или нет, и последовательность терминации транскрипции и трансляции. Уникальные сайты рестриктаз на 5'-и 3'-концах этой кассеты обеспечивают возможность легкого встраивания в предварительно существующий вектор.
Гетерологичная кодирующая последовательность может быть последовательностью для любого белка, относящегося к данному исследованию. Последовательность, кодирующая представляющий интерес белок, будет кодировать сигнальный пептид, который делает возможными процессинг и транслокацию этого белка, по мере необходимости, и не будет обычно содержать никакой последовательности, которая может привести к связыванию желаемого белка данного изобретения с мембраной. Поскольку для большей части инициирующий район транскрипции будет геном, который экспрессируется и транслоцируется во время прорастания, посредством использования сигнального пептида, который обеспечивает транслокацию, можно обеспечить также транслокацию представляющего интерес белка. Таким путем представляющие интерес белок (или белки) будут транслоцироваться из клетки, в которой они экспрессируются, и могут быть эффективным образом собраны. Обычно секреция в семенах происходит через слой щиткового эпителия в эндосперм семени. Хотя и необязательно, чтобы этот белок секретировался из клеток, в которых этот белок продуцируется, это облегчает выделение и очистку рекомбинантного белка.
Поскольку конечная экспрессия желаемого генного продукта будет происходить в эукариотической клетке, желательно определить, содержит ли какая-либо часть клонированного гена последовательности, которые будут исключаться в виде интронов аппаратом сплайсом хозяина. Если это так, мог бы проводиться сайт-направленный мутагенез района "интрона" для предотвращения потери части генетического транскрипта в виде ложного интронного кода. Reed and Maniatis, Cell 41:95-105, 1985.
Вектор может микроинъецироваться непосредственно в клетки растений с использованием микропипеток для механического переноса рекомбинантной ДНК. Crossway, Mol. Gen. Genet. 202:179-185, 1985. Генетический материал может быть также перенесен в клетку растения с использованием полиэтиленгликоля. Krens et al., Nature, 296, 72-74, 1982. Другим способом введения сегментов нуклеиновых кислот является баллистическое проникновение малыми частицами с высокой скоростью, содержащими нуклеиновую кислоту либо в матриксе малых гранул или частиц, либо на поверхности, Klein et al. Nature, 327, 70-73, 1987, и Knudsen and Muller, 1991, Planta, 185:330-336, описывающие бомбардировку частицами эндосперма ячменя для получения трансгенного ячменя. Еще одним способом введения могло бы быть слияние протопластов с другими частицами, миниклетками, клетками, лизосомами или другими поддающимися слиянию имеющими на поверхности липиды телами, Fraley et al., Proc. Natl. Acad. Sci. USA, 79, 1859-1863, 1982.
Вектор может быть также введен в клетки растений электропорацией (Fromm et al., Proc. Natl. Acad. Sci. USA 82:5824, 1985). В этом способе протопласты растений электропорируют в присутствии плазмид, содержащих генную конструкцию. Электрические импульсы поля высокой силы делают биомембраны обратимо проникаемыми, позволяя выполнять введение плазмид. Электропорированные протопласты растений вновь восстанавливают клеточную стенку, делятся и образуют каллус растения.
Все растения, из которых могут быть выделены и культивированы протопласты для получения целых регенированных растений, могут быть трансформированы ДНК данного изобретения, так что получают целые растения, которые содержат перенесенный ген. Известно, что практически все растения могут быть регенерированы из культивируемых клеток или тканей, в том числе, но не только, все основные виды сахарного тростника, сахарной свеклы, хлопчатника, плодовых и других деревьев, бобовых и овощных культур. Некоторые подходящие растения включают, например, виды из родов Fragaria, Lotus, Medicago, Onobrychis, Trifolium, Trigonella, Vigna, Citrus, Linum, Geranium, Manihot, Daucus, Arabidopsis, Brassica, Raphanus, Sinapis, Atropa, Capsicum, Datura, Hyoscyamus, Lycopersicon, Nicotiana, Solanum, Petunia, Digitalis, Majorana, Cichorium, Helianthus, Lactuca, Bromus, Asparagus, Antirrhinum, Hererocallis, Nemesia, Pelargonium, Panicum, Pennisetum, Ranunculus, Senecio, Salpiglossis, Cucumis, Browaalia, Glycine, Lolium, Zea, Triticum, Sorghum и Datura.
Средства для регенерации варьируются от вида к виду растений, но обычно сначала получают суспензию трансформированных протопластов, содержащих копии гетерологичного гена. Образуется каллусная ткань, и могут быть индуцированы побеги из каллуса, которые затем укореняют. Альтернативно образование зародышей может быть индуцировано из суспензии протопластов. Эти зародыши проращивают в виде природных зародышей для образования растений. Культуральные среды обычно содержат различные аминокислоты и гормоны, такие как ауксин и цитокинины. Предпочтительно также добавлять к среде глутаминовую кислоту и пролин, особенно для таких видов, как кукуруза и люцерна. Побеги и корни обычно развиваются одновременно. Эффективная регенерация будет зависеть от среды, от генотипа и от истории культуры. При регуляции этих трех переменных регенерация является полностью воспроизводимой и повторяемой.
В некоторых системах культур клеток растений желаемый белок настоящего изобретения может секретироваться или альтернативно белок может быть экстрагирован из целого растения. Если желаемый белок настоящего изобретения секретируется в среду, он может быть собран. Альтернативно зародыши и не содержащие зародышей половинки семян или другая ткань растения могут быть механически разрушены для высвобождения любого секретируемого белка между клетками и тканями. Эта смесь может быть суспендирована в буферном растворе для выделения растворимых белков. Затем используют общепринятые способы выделения и очистки для очистки рекомбинантного белка. Параметры времени, температуры, рН, кислорода и объемы должны корректироваться посредством рутинных способов для оптимизации экспрессии и выделения гетерологичного белка.
iv. Бактериальные системы
Бактериальные способы экспрессии известны в данной области.
Бактериальный промотор является любой ДНК-последовательностью, способной связывать бактериальную РНК-полимеразу и инициировать транскрипцию в направлении 3' кодирующей последовательности (например, структурного гена) в мРНК. Промотор будет иметь район инициации транскрипции, который обычно помещен проксимально относительно 5'-конца кодирующей последовательности. Этот район инициации транскрипции обычно включает сайт связывания РНК-полимеразы и начало транскрипции. Бактериальный промотор может также включать второй домен, называемый оператором, который может перекрываться со смежным сайтом связывания РНК-полимеразы, в котором начинается синтез РНК. Оператор делает возможной негативно регулируемую (индуцибельную) транскрипцию, когда репрессорный белок гена может связываться с оператором и тем самым ингибировать транскрипцию специфического гена. В отсутствие негативных регуляторных элементов, таких как оператор, может происходить конститутивная экспрессия. Кроме того, позитивная регуляция может достигаться посредством последовательности гена, связывающей активаторный белок, которая, если она присутствует, находится обычно проксимально (5') относительно последовательности связывания РНК-полимеразы. Примером активаторного белка гена является катаболитный активаторный белок (CAP), который способствует инициации транскрипции lac-оперона в Escherichia coil (E. coli) (Raibaud et al. (1984) Annu. Rev. Genet. 18:173). Таким образом, регулируемая экспрессия может быть либо позитивной, либо негативной, тем самым либо усиливающей, либо уменьшающей транскрипцию.
Последовательности, кодирующие ферменты метаболических путей, обеспечивают особенно применимые промоторные последовательности. Примеры включают промоторные последовательности, происходящие из ферментов метаболизации сахаров, таких как галактоза, лактоза (lac) (Chang et al. (1977) Nature 198: 1056) и мальтоза. Дополнительные примеры включают промоторные последовательности, происходящие из биосинтетических ферментов, таких как триптофан (trp) (Goeddel et al. (1980) Nuc. Acids Res. 8:4057; Yelverton et al. (1981) Nucl. Acids Res. 9:731; патент США 4738921, ЕР-А-0036776 и ЕР-А-0121775). Система промотора γ-лактамазы (bla) (Weissman (1981) "The cloning of interferon and other mistakes." In Interferon 3 (ed. I. Gresser)), системы промоторов бактериофаг лямбда PL (Shimatake et al. (1981) Nature 292:128) и Т5 (патент США 4689406) также обеспечивают применимые промоторные последовательности.
Кроме того, синтетические промоторы, которые не встречаются в природе, также функционируют в качестве бактериальных промоторов. Например, последовательности активации транскрипции одного бактериального промотора или промотора бактериофага могут быть соединены с последовательностями оперона другого бактериального промотора или промотора бактериофага с образованием синтетического гибридного промотора (патент США 4551433). Например, tac-промотор является гибридным trp-lac-промотором, состоящим из промотора trp и последовательностей lac-оперона, который регулируется Iac-репрессором (Amann et al. (1983) Gene 25:167; de Boer et al. (1983) Proc. Natl. Acad. Sci. 80:21). Кроме того, бактериальный промотор может включать природно встречающиеся промоторы небактериального происхождения, которые способны связывать бактериальнную РНК-полимеразу и инициировать транскрипцию. Природно встречающийся промотор небактериального происхождения может быть также объединен с совместимой РНК-полимеразой для получения высоких уровней экспрессии некоторых генов в прокариотах. Система РНК-полимераза бактериофага Т7/промотор Т7 является примером сопряженной промоторной системы (Studier et al. (1986) J. Mol. Biol. 189:113; Tabor et al. (1985) Proc. Natl. Acad. Sci. 82:1074). Кроме того, гибридный промотор может также состоять из промотора бактериофага и операторного района Е. coli (ЕРО-А-0267851).
Кроме функционирования промоторной последовательности, для экспрессии чужеродных генов в прокариотах полезным является также эффективный сайт связывания рибосом. В Е. coli сайт связывания рибосом называют последовательностью Шайна-Дальгарно (SD), и он включает инициирующий кодон (ATG) и последовательность длиной 3-9 нуклеотидов, расположенную в 3-11 нуклеотидах "слева" от инициирующего кодона (Shine et al. (1975) Nature 254:34). Считается, что последовательность SD стимулирует связывание мРНК с рибосомой посредством спаривания оснований между последовательностью SD и 3' рРНК 16S Е. coli (Steitz et al. (1979) "Genetic signals and nucleotide sequences in messenger RNA." In Biological Regulation and Development: Gene Expression (ed. R.F. Goldberger)). Для экспрессии эукариотических генов и прокариотических генов со слабым сайтом связывания рибосом см. (Sambrook et al. (1989) "Expression of cloned genes in Escherichia coli." In Molecular Cloning: A Laboratory Manual).
Молекула ДНК может экспрессироваться внутриклеточно. Промоторная последовательность может быть непосредственно связана с молекулой ДНК, и в этом случае первой аминокислотой на N-конце всегда будет метионин, который кодируется стартовым кодоном ATG. Если желательно, метионин на N-конце может быть отщеплен от этого белка инкубированием in vitro с цианогенбромидом или инкубированием либо in vivo, либо in vitro с бактериальной метионин-N-концевой пептидазой (ЕРО-А-0219237).
Слитые белки обеспечивают альтернативу прямой экспрессии. Обычно ДНК-последовательность, кодирующую N-концевую часть эндогенного бактериального белка или другого стабильного белка, сливают с 5'-концом гетерологичных кодирующих последовательностей. После экспрессии эта конструкция будет давать слияние двух аминокислотных последовательностей. Например, ген бактериофага лямбда может быть присоединен на 5'-конце чужеродного гена и экспрессирован в бактериях. Полученный слитый белок предпочтительно сохраняет сайт для процессирующего фермента (фактора Ха) для отщепления белка бактериофага от чужеродного гена (Nagai et al. (1984) Nature 309:810). Слитые белки могут также быть приготовлены с последовательностями из генов lacZ (Jia et al. (1987) Gene 60:197), trpE (Allen et al. (1987) J. Biotechnol. 5:93; Makoff et al. (1989) J. Gen. Microbiol. 135:11) и Chey (EP-A-0324647). Последовательность ДНК на границе этих двух аминокислотных последовательностей может кодировать или может не кодировать сайт расщепления. Другим примером является слитый с убиквитином белок. Такой слитый белок получают с использованием района убиквитина, который предпочтительно сохраняет сайт для процессирующего фермента (например, специфической в отношении процессинга убиквитина протеазы) для отщепления убиквитина от чужеродного белка. Посредством этого способа может быть выделен природный чужеродный белок (Miller et al. (1989) Bio/Technology 7:698).
Альтернативно чужеродные белки могут также секретироваться из клетки посредством создания химерных молекул ДНК, которые кодируют слитый белок, включающий фрагмент сигнальной пептидной последовательности, которая обеспечивает секрецию чужеродного белка в бактериях (патент США 4336336). Этот фрагмент сигнальной последовательности обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот, которые управляют секрецией этого белка из клетки. Этот белок либо секретируется в среду для выращивания (грамположительные бактерии), либо в периплазматическое пространство, расположенное между внутренней и наружной мембранами клетки (грамотрицательные бактерии). Предпочтительно имеются сайты процессинга, которые могут расщепляться либо in vivo, либо in vitro, кодируемые между фрагментом сигнальной последовательности и чужеродным геном.
ДНК, кодирующая подходящие сигнальные последовательности, может быть получена из генов секретируемых бактериальнных белков, таких как ген наружной мембраны Е. coli (ompA) (Masui et al. (1983), in: Experimental Manipulation of Gene Expression; Ghrayeb et al. (1984) EMBO J. 3:2437) и сигнальная последовательность щелочной фосфатазы Е. coli (phoA) (Oka et al. (1985) Proc. Natl. Acad. Sci. 82:7212). В качестве дополнительного примера сигнальная последовательность гена альфа-амилазы из различных штаммов Bacillus может быть использована для секреции чужеродных белков из В. subtilis (Palva et al. (1982) Proc. Natl. Acad. Sci. USA 79:5582; EP-A-0244042).
Обычно последовательности терминации транскрипции, узнаваемые бактериями, являются регуляторными районами, локализованными 3' относительно стоп-кодона трансляции, и, следовательно, вместе с промотором фланкируют кодирующую последовательность. Эти последовательности управляют транскрипцией мРНК, которая может транслироваться в полипептид, кодируемый данной ДНК. Последовательности терминации транскрипции часто включают ДНК-последовательности из приблизительно 50 нуклеотидов, способные образовывать структуры стебля-петли, которые способствуют терминации транскрипции. Примеры включают последовательности терминации транскрипции, произведенные из генов с сильными промоторами, таких как ген trp в Е. coli, а также другие биосинтетические гены.
Обычно описанные выше компоненты, содержащие промотор, сигнальную последовательность (если желательно), представляющую интерес кодирующую последовательность и последовательность терминации транскрипции, помещают вместе в экспрессионные конструкции. Экспрессионные конструкции часто поддерживаются в репликоне, таком как внехромосомный элемент (например, плазмиды), способный стабильно сохраняться в хозяине, таком как бактерии. Репликон имеет систему репликации, что позволяет ему сохраняться в прокариотическом хозяине либо для экспрессии, либо для клонирования и амплификации. Кроме того, репликон может быть либо высококопийной, либо низкокопийной плазмидой. Высококопийная плазмида будет обычно иметь количество копий в диапазоне от приблизительно 5 до приблизительно 200, обычно от приблизительно 10 до приблизительно 150. Хозяин, содержащий высококопийную плазмиду, предпочтительно будет содержать, по меньшей мере, приблизительно 10 и более предпочтительно, по меньшей мере, приблизительно 20 плазмид. Высококопийный или низкокопийный вектор может быть отобран в зависимости от действия вектора и чужеродного белка на хозяина.
Альтернативно экспрессионные конструкции могут быть интегрированы в бактериальный геном с помощью интегрирующегося вектора. Интегрирующиеся векторы обычно содержат, по меньшей мере, одну последовательность, гомологичную бактериальной хромосоме, которая позволяет вектору интегрироваться. Интеграции, по-видимому, происходят вследствие рекомбинации между гомологичной ДНК в векторе и бактериальной хромосоме. Например, интегрирующиеся векторы, сконструированные с ДНК из различных штаммов Bacillus, интегрируются в хромосому Bacillus (ЕР-А-0127328). Интегрирующиеся векторы могут также состоять из последовательностей бактериофага или транспозонов.
Обычно внехромосомные и интегрирующиеся экспрессионные конструкции могут содержать селектируемые маркеры для обеспечения возможности отбора трансформированных бактериальных штаммов. Селектируемые маркеры могут быть экспрессированы в бактериальном хозяине и могут включать гены, которые делают бактерии устойчивыми к лекарственным средствам, таким как ампициллин, хлорамфеникол, эритромицин, канамицин (неомицин) и тетрациклин (Davies et al. (1978) Annu. Rev. Microbiol. 32:469). Селектируемые маркеры могут также включать биосинтетические гены, такие как гены, участвующие в биосинтетических путях гистидина, триптофана и лейцина.
Альтернативно некоторые из описанных выше компонентов могут быть помещены вместе в трансформирующие векторы. Трансформирующие векторы обычно включают селектируемый маркер, который либо является сохраненным в репликоне, либо встроен в интегрирующийся вектор, как описано выше.
Экспрессирующие и трансформирующие векторы, либо внехромосомные репликоны, либо интегрирующиеся векторы, были разработаны для трансформации во многие бактерии. Например, экспрессирующие векторы были разработаны, inter alia, для следующих бактерий: Bacillus subtilis (Palva et al. (1982) Proc. Natl. Acad. Sci. USA 7P:5582; EP-A-0036259 и ЕР-А-0063953; WO84/04541), Escherichia coli (Shimatake et al. (1981) Nature 2P2:128; Amann et al. (1985) Gene 40:183; Studier et al. (1986) J. Mol. Biol. 189:113; EP-A-0036776, EP-A-0136829 и EP-A-0136907), Streptococcus cremoris (Powell et al. (1988) Appl. Environ. Microbiol. 54:655); Streptococcus lividans (Powell et al. (1988) Appl. Environ. Microbiol. 54:655), Streptomyces lividans (патент США 4745056).
Способы введения экзогенной ДНК в бактериальных хозяев хорошо известны в данной области и обычно включают трансформацию бактерий, обработанных CaCl2 или другими агентами, такими как двухвалентные катионы и ДМСО. ДНК может быть также введена в бактериальные клетки электропорацией. Процедуры трансформации обычно варьируются в зависимости от бактериальных видов, которые должны быть трансформированы. См., например, (Masson et al. (1989) FEMS Microbiol. Lett. 60:273; Palva et al. (1982) Proc. Natl. Acad. Sci. USA 79:5582; EP-A-0036259 и EP-A-0063953; WO84/04541, Bacillus), (Miller et al. (1988) Proc. Natl. Acad. Sci. 55:856; Wang et al. (1990) J. Bacteriol 172:949, Campylobacter), (Cohen et al. (1973) Proc. Natl. Acad. Sci. 69:2110; Dower et al. (1988) Nucleic Acids Res. 16:6121; Kushner (1978) "An improved method for transformation of Escherichia coli with ColE1-derived plasmids. In Genetic Engineering: Proceedings of the International Symposium on Genetic Engineering (eds. H.W. Boyer and S. Nicosia); Mandel et al. (1970) J. Mol. Biol 53:159; Taketo (1988) Biochim. Biophys. Acta 949:318; Escherichia), (Chassy et al. (1987) FEMS Microbiol. Lett. 44:173 Lactobacillus); (Fiedler et al. (1988) Anal Biochem 170:38, Pseudomonas); (Augustin et al. (1990) FEMS Microbiol Lett. 66:203, Staphylococcus), (Barany et al. (1980) J. Bacteriol 144:698; Harlander (1987) "Transformation of Streptococcus lactis by electroporation, in: Streptococcal Genetics (ed. J. Ferretti and R. Curtiss III); Perry et al. (1981) Infect. Immun. 32:1295; Powell et al. (1988) Appl. Environ. Microbiol. 54:655; Somkuti et al. (1987) Proc. 4th Evr. Cong. Biotechnology 1:412, Streptococcus).
v. Экспрессия в дрожжах
Системы экспрессии дрожжей хорошо известны специалисту с обычной квалификацией в данной области. Дрожжевой промотор является любой ДНК-последовательностью, способной связывать дрожжевую РНК-полимеразу и инициировать транскрипцию в направлении 3' кодирующей последовательности (например, структурного гена) в мРНК. Промотор будет иметь район инициации транскрипции, который обычно помещен проксимально относительно 5'-конца кодирующей последовательности. Этот район инициации транскрипции обычно включает сайт связывания РНК-полимеразы ("ТАТА-блок") и начало транскрипции. Дрожжевой промотор может также включать второй домен, называемый "левой" активаторной последовательностью (UAS), которая, если она присутствует, находится обычно дистально относительно структурного гена. UAS делает возможной регулируемую (индуцируемую) экспрессию. В отсутствие UAS происходит конститутивная экспрессия. Регулируемая экспрессия может быть либо позитивной, либо негативной, тем самым либо усиливающей, либо уменьшающей транскрипцию.
Дрожжи являются ферментирующим организмом с активным метаболическим путем; следовательно, последовательности, кодирующие ферменты в метаболическом пути, обеспечивают особенно полезные промоторные последовательности. Примеры включают промоторы алкогольдегидрогеназы (ADH) (ЕР-А-0284044), энолазы, глюкокиназы, глюкозо-6-фосфатизомеразы, глицеральдегид-3-фосфатдегидрогеназы (GAP или GAPDH), гексокиназы, фосфофруктокиназы, 3-фосфоглицератмутазы и пируваткиназы (PyK) (ЕРО-А-0329203). Дрожжевой ген РНO5, кодирующий кислую фосфатазу, также обеспечивает полезные промоторные последовательности (Myanohara et al. (1983) Proc. Natl. Acad. Sci. USA 80:1).
Кроме того, синтетические промоторы, которые не встречаются в природе, также функционируют в качестве дрожжевых промоторов. Например, последовательности UAS одного дрожжевого промотора могут быть соединены с районом активации транскрипции другого дрожжевого промотора с образованием синтетического гибридного промотора. Примеры таких гибридных промоторов включают регуляторную последовательность ADH, связанную с районом активации транскрипции GAP (патенты США №4876197 и 4880734). Другие примеры гибридных промоторов включают промоторы, которые состоят из регуляторных последовательностей генов ADH2, GAL4, GAL10 или РНO5, комбинированных с районом активации транскрипции гена гликолитического фермента, такого как GAP или PyK (ЕР-А-0164556). Кроме того, дрожжевой промотор может включать природно встречающиеся промоторы недрожжевого происхождения, которые способны связывать дрожжевую РНК-полимеразу и инициировать транскрипцию. Примеры таких промоторов включают, inter alia, (Cohen et al. (1980) Proc. Natl. Acad. Sci. USA 77:1078; Henikoff et al. (1981) Nature 283:835; Hollenberg et al. (1981) Curr. Topics Microbiol. Immunol. 96:119; Hollenberg et al. (1979) "The Expression of Bacterial Antibiotic Resistance Genes in the Yeast Saccharomyces cerevisiae," in: Plasmids of Medical, Environmental and Commercial Importance (eds. K.N. Timmis and A. Punier); Mercerau-Puigalon et al. (1980) Gene 11:163; Panthier et al. (1980) Curr. Genet. 2:109).
Молекула ДНК может экспрессироваться внутриклеточно в дрожжах. Промоторная последовательность может быть непосредственно связана с молекулрй ДНК, и в этом случае первой аминокислотой на N-конце рекомбинантного белка всегда будет метионин, который кодируется стартовым кодоном ATG. Если желательно, метионин на N-конце может быть отщеплен от этого белка инкубированием in vitro с цианогенбромидом.
Слитые белки обеспечивают альтернативу системам экспрессии дрожжей, также как в системах экспрессии млекопитающих, бакуловирусов и бактерий. Обычно ДНК-последовательность, кодирующую N-концевую часть эндогенного дрожжевого белка или другого стабильного белка, сливают с 5'-концом гетерологичных кодирующих последовательностей. При экспрессии эта конструкция будет давать слияние этих двух аминокислотных последовательностей. Например, ген супероксиддисмутазы (SOD) дрожжей или человека может быть присоединен на 5'-конце чужеродного гена и экспрессирован в дрожжах. ДНК-последовательность на границе этих двух аминокислотных последовательностей может кодировать или может не кодировать сайт расщепления. См., например, ЕР-А-0196056. Другим примером является слитый белок убиквитина. Такой слитый белок получают с районом убиквитина, который предпочтительно сохраняет сайт для процессирующего фермента (например, убиквитин-специфической процессирующей протеазы) для отщепления убиквитина от чужеродного белка. Посредством этого способа может быть выделен нативный чужеродный белок (например, WO 88/024066).
Альтернативно чужеродный белок может быть секретирован из клетки в среду для выращивания созданием химерных молекул ДНК, которые кодируют слитый белок, включающий фрагмент лидерной последовательности, которая обеспечивает секрецию чужеродного белка в дрожжах. Предпочтительно имеются сайты процессинга, кодируемые между этим лидерным фрагментом и чужеродным геном, которые могут расщепляться in vivo или in vitro. Фрагмент лидерной последовательности обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот, которые управляют секрецией этого белка из клетки.
ДНК, кодирующие подходящие сигнальные последовательности, могут быть получены из генов для секретируемых дрожжевых белков, таких как гены для инвертазы (ЕР-А-0012873; JPO 62096086) и А-фактора (патент США 4588684). Альтернативно существуют лидеры недрожжевого происхождения, такие как лидер интерферона, которые также обеспечивают секрецию в дрожжах (ЕР-А-0060057).
Предпочтительным классом лидеров секреции являются лидерные последовательности, которые используют фрагмент дрожжевого гена альфа-фактора, который содержит как сигнальную "пре"-последовательность, так и "про"-район. Типы фрагментов альфа-фактора, которые могут быть использованы, включают полноразмерный пре-про-лидер альфа-фактора (приблизительно 83 аминокислотных остатка), а также укороченные лидеры альфа-фактора (обычно приблизительно 25 - приблизительно 50 аминокислотных остатков) (патенты США 4546083 и 4870008; ЕР-А-0324274). Дополнительные лидеры, использующие фрагмент лидера альфа-фактора, который обеспечивает секрецию, включают гибридные лидеры альфа-фактора, сконструированные с препоследовательностью первых дрожжей, но с про-районом из альфа-фактора вторых дрожжей (например, см. WO 89/02463).
Обычно последовательности терминации транскрипции, узнаваемые дрожжами, являются регуляторными районами, локализованными 3' относительно стоп-кодона трансляции, и, следовательно, вместе с промотором фланкируют кодирующую последовательность. Эти последовательности управляют транскрипцией мРНК, которая может транслироваться в полипептид, кодируемый данной ДНК. Примеры последовательности терминации транскрипции и других узнаваемых дрожжами последовательностей терминации включают последовательности, кодирующие гликолитические ферменты.
Обычно описанные выше компоненты, содержащие промотор, лидер (если желательно), представляющую интерес кодирующую последовательность и последовательность терминации транскрипции, помещают вместе в экспрессионные конструкции. Экспрессионные конструкции часто поддерживаются в репликоне, таком как внехромосомный элемент (например, плазмиды), способный стабильно сохраняться в хозяине, таком как дрожжи или бактерии. Репликон может иметь две системы репликации, что позволяет ему сохраняться, например, в дрожжах для экспрессии и в прокариотическом хозяине для клонирования и амплификации. Примеры таких челночных (дрожжи-бактерии) векторов включают YEp24 (Botstein et al. (1979) Gene 8:17-24), pC1/1 (Brake et al. (1984) Proc. Natl. Acad. Sci. USA 81:4642-4646) и YRpl7 (Stinchcomb et al. (1982) J. Mol. Biol. 158:157). Кроме того, репликон может быть либо высококопийной, либо низкокопийной плазмидой. Высококопийная плазмида будет обычно иметь количество копий в диапазоне от приблизительно 5 до приблизительно 200, обычно от приблизительно 10 до приблизительно 150. Хозяин, содержащий высококопийную плазмиду, предпочтительно будет содержать, по меньшей мере, приблизительно 10 и более предпочтительно, по меньшей мере, приблизительно 20 плазмид. Высококопийный или низкокопийный вектор может быть отобран в зависимости от действия вектора и чужеродного белка на хозяина. См., например. Brake et al., выше.
Альтернативно экспрессионные конструкции могут быть интегрированы в дрожжевой геном с помощью интегрирующегося вектора. Интегрирующиеся векторы обычно содержат, по меньшей мере, одну последовательность, гомологичную дрожжевой хромосоме, которая позволяет вектору интегрироваться, и предпочтительно содержат две гомологичные последовательности, фланкирующие экспрессионную конструкцию. Интеграции, по-видимому, происходят вследствие рекомбинации между гомологичной ДНК в векторе и дрожжевой хромосоме (Orr-Weaver et al. (1983) Methods in Enzymol. 101:228-245). Интегрирующийся вектор может быть направлен на специфический локус в дрожжах посредством выбора подходящей гомологичной последовательности для включения в этот вектор. См. Orr-Weaver et al., выше. Одна или более экспрессионных конструкций могут интегрироваться, возможно, воздействуя на уровни продуцируемого рекомбинантного белка (Rine et al. (1983) Proc. Natl. Acad. Sci. USA 80:6750). Хромосомные последовательности, включенные в вектор, могут встречаться либо в виде единственного сегмента в векторе, что приводит к интеграции всего вектора, либо в виде двух сегментов, гомологичных смежным сегментам в хромосоме и фланкирующих экспрессионную конструкцию в векторе, что приводит к стабильной интеграции только экспрессионной конструкции.
Обычно внехромосомные и интегрирующиеся экспрессионные конструкции могут содержать селектируемые маркеры для обеспечения возможности отбора дрожжевых штаммов, которые были трансформированы. Селектируемые маркеры могут также включать биосинтетические гены, которые могут экспрессироваться в дрожжевом хозяине, такие как гены ADE2, HIS4, LEU2, TRP1 и ALG7, и ген устойчивости к G418, которые придают устойчивость дрожжевым клеткам к туникамицину и G418 соответственно. Кроме того, подходящий селектируемый маркер может также обеспечивать дрожжи способностью расти в присутствии токсических соединений, таких как металл. Например, присутствие СОР1 позволяет дрожжам расти в присутствии ионов меди (Butt et al. (1987) Microbiol, Rev. 51:351).
Альтернативно некоторые из описанных выше компонентов могут быть помещены вместе в трансформирующие векторы. Трансформирующие векторы обычно включают селектируемый маркер, который либо является сохраненным в репликоне, либо встроен в интегрирующийся вектор, как описано выше.
Экспрессирующие и трансформирующие векторы, либо внехромосомные репликоны, либо интегрирующиеся векторы, были разработаны для трансформации во многие дрожжи. Например, экспрессирующие векторы были разработаны, inter alia, для следующих дрожжей: Candida albicans (Kurtz et al. (1986) Mol. Cell. Biol. 6:142), Candida maltosa (Kunze et al. (1985) J. Basic Microbiol. 25:141), Hansenula polymorpha (Gleeson et al. (1986) J. Gen. Microbiol. 132:3459; Roggenkamp et al. (1986) Mol Gen. Genet. 202:302), Kluyveromyces fragilis (Das et al. (1984) J. Bacteriol. 158:1165), Kluyveromyces lactis (De Louvencourt et al. (1983), J. Bacteriol. 154:737; Van den Berg et al. (1990) Bio/Technology 5:135), Pichia guillerimondii (Kunze et al. (1985) J. Basic Microbiol 25:141), Pichia pastoris (Cregg et al. (1985) Mol Cell Biol 5:3376; патенты США №4837148 и 4929555), Saccharomyces cerevisiae (Hinnen et al. (1978) Proc. Natl. Acad. Sci. USA 75:1929; Ito et al. (1983) J. Bacteriol 153:163), Schizosaccharomyces pombe (Beach and Nurse (1981) Nature 300:706) и Yarrowia lipolytica (Davidow et al. (1985) Curr. Genet. 10:380471 Gaillardin et al. (1985) Curr. Genet. 10:49).
Способы введения экзогенной ДНК в дрожжевых хозяев хорошо известны в данной области и обычно включают либо трансформацию сферопластов, либо трансформацию интактных дрожжевых клеток, обработанных щелочными катионами. Процедуры трансформации обычно варьируются в зависимости от видов дрожжей, которые должны быть трансформированы. См., например, (Kurtz et al. (1986) Mol. Cell. Biol. 6:142; Kunze et al. (1985) J. Basic Microbiol. 25:141; Candida); (Gleeson et al. (1986) J. Gen. Microbiol. 132:3459; Roggenkamp et al. (1986) Mol. Gen. Genet. 202:302; Hansenula); (Das et al. (1984) J. Bacteriol 158:1165; De Louvencourt et al. (1983) J. Bacterial 154:1165; Van den Berg et al. (1990) Bio/Technology 8:135; Kluyveromyces); (Cregg et al. (1985) Mol. Cell. Biol. 5:3376; Kunze et al. (1985) J. Basic Microbiol. 25:141; патенты США №№4837148 и 4929555; Pichia); (Hinnen et al. (1978) Proc. Natl. Acad. Sci. USA 75;1929; Ito et al. (1983) J. Bacteriol. 153:163 Saccharomyces); (Beach & Nurse (1981) Nature 300:706; Schizosaccharomyces); (Davidow et al. (1985) Curr. Genet. 70:39; Gaillardin et al. (1985) Curr. Genet. 10:49; Yarrowia).
Фармацевтические композиции
Фармацевтические композиции могут содержать полипептиды и/или нуклеиновую кислоту данного изобретения. Эти фармацевтические композиции содержат терапевтически эффективное количество либо полипептидов, антител, либо полинуклеотидов заявленного изобретения.
Термин "терапевтически эффективное количество" обозначает в данном контексте количество терапевтического агента, достаточное для лечения, ослабления или предупреждения рассматриваемого заболевания или состояния или для проявления детектируемого терапевтического или превентивного действия. Это действие может быть обнаружено, например, посредством химических маркеров или уровней антигенов. Терапевтические действия включают также уменьшение физических симптомов, таких как понижение температуры тела. Точное эффективное количество для субъекта будет зависеть от размера и здоровья субъекта, характера и степени конкретного состояния и терапевтических веществ или комбинации терапевтических веществ, выбранных для введения. Таким образом, невозможно указать точное эффективное количество заранее. Однако эффективное количество для конкретной ситуации может быть определено рутинным экспериментированием и находится в рамках оценки практикующего врача.
Для целей данного изобретения эффективная доза будет составлять приблизительно 0,01 мг/кг - 50 мг/кг или 0,05 мг/кг - приблизительно 10 мг/кг ДНК-конструкций в индивидууме, в который ее вводят.
Фармацевтическая композиция может также содержать фармацевтически приемлемый носитель. Термин "фармацевтически приемлемый носитель" обозначает носитель для введения терапевтического агента, такого как антитела или полипептид, гены и другие терапевтические агенты. Этот термин относится к любому фармацевтическому носителю, который сам не индуцирует образования антител, вредных для индивидуума, получающего эту композицию, и который может быть введен без чрезмерной токсичности. Подходящими носителями могут быть большие, медленно метаболизируемые макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и неактивные вирусные частицы. Такие носители хорошо известны специалистам с квалификацией в данной области.
Здесь могут быть использованы фармацевтически приемлемые соли, например соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты, сульфаты и т.п., и соли органических кислот, такие как ацетаты, пропионаты, малонаты, бензоаты и т.п. Подробное обсуждение фармацевтически приемлемых наполнителей доступно в Remington's Pharmaceutical Sciences (Mack Pub. Co., N.J. 1991).
Фармацевтически приемлемые носители в терапевтических композициях могут содержать жидкости, такие как вода, солевой раствор, глицерин и этанол. Кроме того, в таких носителях могут присутствовать вспомогательные вещества, такие как увлажняющие или эмульгирующие агенты, буферящие рН вещества и т.п. Обычно терапевтические композиции готовят в виде инъекционных растворов, либо в виде жидких растворов, либо в виде суспензий; могут быть также приготовлены твердые формы, подходящие для растворения или суспендирования в жидких носителях перед инъекцией. В определение фармацевтически приемлемого носителя включены липосомы.
Способы доставки
После приготовления композиции данного изобретения могут непосредственно вводиться субъекту. Субъектами для лечения могут быть животные; в частности, лечение может применяться для человека.
Прямая доставка этих композиций будет обычно либо выполняться посредством инъекции, подкожно, внутрибрюшинно, внутривенно или внутримышечно, либо осуществляться доставкой в интерститиальное пространство ткани. Композиции могут также вводиться в повреждение. Другие способы введения включают пероральное и легочное введение, суппозитории и трансдермальные или чрескожные введения (например, см. WO 98/20734), иглы и генное ружье или гипоспреи. Лечение в виде введения доз может быть схемой введения одной дозы или схемой введения множественных доз.
Вакцины
Вакцины в соответствии с данным изобретением могут быть либо профилактическими (т.е. для предупреждения инфекции), либо терапевтическими (т.е. для лечения заболевания после инфицирования).
Такие вакцины содержат иммунизирующие антиген (антигены), иммуноген (иммуногены), полипептид (полипептиды), белок (белки) или нуклеиновую кислоту, обычно в комбинации с "фармацевтически приемлемыми носителями", которые включают любой носитель, который сам не индуцирует образования антител, вредных для индивидуума, получающего данную композицию. Подходящие носители являются обычно большими, медленно метаболизируемыми макромолекулами, такими как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, липидные агрегаты (такие как масляные капельки или липосомы) и неактивные вирусные частицы. Такие носители хорошо известны специалистам с обычной квалификацией в данной области. Кроме того, эти носители могут действовать в качестве иммуностимулирующих агентов ("адъювантов"). Кроме того, антиген или иммуноген может быть конъюгирован с бактериальным токсоидом, таким как токсоид из дифтерийного, столбнячного, холерного, Н. pylori и т.д. патогенов.
Предпочтительные адъюванты для усиления эффективности композиции включают, но не ограничиваются ими: (1) соли алюминия (квасцы), такие как гидроксид алюминия, фосфат алюминия, сульфат алюминия и т.д.; (2) эмульсионные формы типа масло-в-воде (с другими специфическими иммуностимулирующими агентами, такими как мурамилпептиды (см. ниже) или компонентами стенок бактериальных клеток, или без них), такими как, например, (a) MF59™ (WO 90/14837; часть 10 в Vaccine design: the subunit and adjuvant approach, eds. Powell & Newman, Plenum Press 1995), содержащий 5% сквален, 0,5% Твин 80 и 0,5% Span 85 (необязательно содержащий различные количества МТР-РЕ (см. ниже), хотя и необязательно), приготовленный в виде субмикронных частиц с использованием микрофлюидизатора, такого как микрофлюидизатор модели 110Y (Microfluidics, Newton, MA), (b) SAF, содержащий 10% сквален, 0,4% Твин 80, 5% блокированный плуроником полимер L121, и thr-MDP (см. ниже), либо микрофлюидизированный в субмикронную эмульсию, либо перемешанный на вортексе для получения эмульсии с большим размером частиц, и (с) адъювантная система Ribi™ (RAS), (Ribi Immunochem, Hamilton, MT), содержащая 2% сквален, 0,2% Твин 80 и один или более компонентов бактериальных стенок из группы, состоящей из монофосфориллипида A (MPL), димиколата трегалозы (TDM) и скелета клеточных стенок (CWS), предпочтительно MPL+CWS (Detox™); (3) сапониновые адъюванты, такие как Stimulon™ (Cambridge Bioscience, Worcester, MA), могут быть использованы или из них могут быть приготовлены частицы, такие как ISCOM (иммуностимулирующие комплексы); (4) полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA); (5) цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 и т.д.), интерфероны (например, гамма-интерферон), макрофагальный колониестимулирующий фактор (M-CSF), фактор некроза опухолей (TNF) и т.д.; (6) другие вещества, которые действуют в качестве иммуностимулирующих агентов для усиления эффективности композиции. Предпочтительными являются квасцы и MF59™.
Как упоминалось выше, мурамилпептиды включают, но не ограничиваются ими, N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1',2' -дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (МТР-РЕ) и т.д.
Иммуногенные композиции (например, иммунизирующий антиген/иммуноген/полипептид/белок/нуклеиновая кислота, фармацевтически приемлемый носитель и адъювант) обычно будут содержать разбавители, такие как вода, солевой раствор, глицерин, этанол и т.д. Кроме того, в таких носителях могут присутствовать вспомогательные вещества, такие как увлажняющие или эмульгирующие агенты, буферящие рН вещества и т.п.
Обычно иммуногенные композиции готовят в виде инъекционных растворов, либо в виде жидких растворов, либо в виде суспензий; могут быть также приготовлены твердые формы, подходящие для растворения или суспендирования в жидких носителях перед инъекцией. Препарат может быть также эмульгирован или инкапсулирован в липосомах для усиленного адъювантного действия, как обсуждалось выше при описании фармацевтически приемлемых носителей.
Иммуногенные композиции, используемые в качестве вакцин, содержат иммунологически эффективное количество антигенных или иммуногенных полипептидов, а также любой другой из вышеупомянутых компонентов, если это необходимо. Под "иммунологически эффективным количеством" имеют в виду, что введение этого количества индивидууму либо в единственной дозе, либо в виде части ряда доз является эффективным для лечения или профилактики. Это количество варьируется в зависимости от здоровья и физического состояния получающего лечение индивидуума, таксономической группы получающего лечение индивидуума (например, примата, не являющегося человеком, примата и т.д.), способности иммунной системы индивидуума синтезировать антитела, степени желаемой защиты, формы вакцины, оценки лечащим врачом медицинской ситуации и других релевантных факторов. Ожидается, что это количество будет находиться в относительно широком диапазоне, который может быть определен с использованием рутинных испытаний.
Иммуногенные композиции обычно вводят парентерально, например, инъекцией, либо подкожной, внутримышечной, либо трансдермальной/чрескожной (например, WO 98/20734). Дополнительные формы, пригодные для других способов введения, включают пероральные и легочные формы, суппозитории и трансдермальные применения. Лечение в виде введения доз может быть схемой введения единственной дозы или схемой введения множественных доз. Вакцина может вводиться вместе с другими иммунорегуляторными агентами.
В качестве альтернативы вакцинам на основе белков может использоваться ДНК-вакцинация (например, Robinson & Torres (1997) Seminars in Immunology 9:271-283; Donnelly et al. (1997) Annu Rev Immunol 15:617-648; см. в описании ниже).
Носители для доставки генов
Носители для генотерапии, для доставки конструкций, включающих кодирующую последовательность терапевтического агента данного изобретения, для доставки млекопитающему для экспрессии в этом млекопитающем, могут вводиться либо локально, либо системно. Эти конструкции могут использовать вирусный или невирусный подходы в режиме введения in vivo или ex vivo. Экспрессия такой кодирующей последовательности может быть индуцирована с использованием эндогенных промоторов млекопитающих или гетерологичных промоторов. Экспрессия кодирующей последовательности in vivo может быть либо конститутивной, либо регулируемой.
Данное изобретение включает носители для доставки генов, способные экспрессировать рассматриваемые последовательности нуклеиновых кислот. Носителем для доставки генов является предпочтительно вирусный вектор и более предпочтительно ретровирусный, аденовирусный, аденоассоциированный вирусный (AAV), герпесвирусный или альфавирусный вектор. Вирусный вектор может быть также астровирусным, коронавирусным, ортомиксовирусным, паповавирусным, парамиксовирусным, парвовирусным, пикорнавирусным, поксвирусным или тогавирусным вектором. См. в общем виде Jolly (1994) Cancer Gene Therapy 1:51-64; Kimura (1994) Human Gene Therapy 5:845-852; Connelly (1995) Human Gene Therapy 6:185-193 и Kaplitt (1994) Nature Genetics 6:148-153.
Ретровирусные векторы хорошо известны в данной области, и авторы данного изобретения предполагают, что любой ретровирусный вектор для генотерапии применим в данном изобретении, в том числе ретровирусы типа В, С и D, ксенотропные ретровирусы (например, NZB-Xl, NZB-X2 и NZB9-1 (см. O'Neil (1985) J. Virol. 53:160), политропные ретровирусы, например MCF и MCF-MLV (см. Kelly (1983) J. Virol. 45:291), спумавирусы и лентивирусы. См. RNA Tumor Viruses, Second Edition, Cold Spring Harbor Laboratory, 1985.
Части ретровирусного вектора для генотерапии могут происходить из различных ретровирусов. Например, ретровирусные LTR могут происходить из вируса мышиной саркомы, сайт связывания тРНК - из вируса саркомы Рауса, сигнал упаковки - из вируса мышиного лейкоза и начало инициации синтеза второй цепи - из вируса лейкоза птиц.
Эти рекомбинантные ретровирусные векторы могут быть использованы для получения компетентных в отношении трансдукции ретровирусных векторных частиц введением их в подходящие пакующие клеточные линии (см. патент США 5591624). Ретровирусные векторы могут быть сконструированы для сайт-специфической интеграции в ДНК клетки-хозяина включением химерного фермента интегразы в эту ретровирусную частицу (см. WO 96/37626). Предпочтительно этот рекомбинантный вирусный вектор является дефектным по репликации рекомбинантным вирусом.
Линии пакующих клеток, пригодные для применения с вышеописанными ретровирусными векторами, хорошо известны в данной области, они могут быть легко приготовлены (см. WO 95/30763 и WO 92/05266) и могут быть использованы для создания линий клеток-продуцентов (также называемых векторными клеточными линиями или VCL) для получения рекомбинантных векторных частиц. Предпочтительно линии пакующих клеток получают из исходных клеток человека (например, клеток НТ1080) или исходных клеток норки, что исключает инактивацию в сыворотке человека.
Предпочтительные ретровирусы для конструирования ретровирусных векторов для генотерапии включают вирус лейкоза птиц, вирус бычьего лейкоза, вирус лейкоза мышей, индуцирующий очаг вирус клеток норки, вирус мышиной саркомы, вирус ретикулоэндотелиоза и вирус саркомы Рауса. Особенно предпочтительные вирусы лейкоза мышей включают 407ОА и 150 4А (Hartley and Rowe (1976) J. Virol 19:19-25), Abelson (ATCC No. VR-999), Friend (ATCC No. VR-245), Graffi, Gross (ATCC No. VR-590), Kirsten, вирус саркомы Гарвея и вирус мышиного лейкоза Раушера (ATCC No. VR-998) и Молони (ATCC No. VR-190). Такие ретровирусы могут быть получены из депозитариев или коллекций, таких как Американская коллекция типовых культур (ATCC) в Rockville, Maryland, или выделены из известных источников с использованием обычных доступных способов.
Примеры известных ретровирусных векторов для генотерапии, применимых в данном изобретении, включают векторы, описанные в заявках на патент GB 2200651, ЕР 0415731, ЕР 0345242, ЕР 0334301, WO 89/02468; WO 89/05349, WO 89/09271, WO 90/02806, WO 90/07936, WO 94/03622, WO 93/25698, WO 93/25234, WO 93/11230, WO 93/10218, WO 91/02805, WO 91/02825, WO 95/07994, US 5219740, US 4405712, US 4861719, US 4980289, US 4777127, US 5591624. См. также Vile (1993) Cancer Res 53:3860-3864; Vile (1993) Cancer Res 53:962-967; Ram (1993) Cancer Res 53 (1993) 83-88; Takamiya (1992) J. Neurosci Res 33:493-503; Baba (1993) J. Neurosurg 79:729-735; Mann (1983) Cell 33:153; Cane (1984) Proc Nati Acad Sci 81:6349 и Miller (1990) Human Gene Therapy 1.
Аденовирусные векторы для генотерапии человека также известны в данной области и применимы в данном изобретении. См., например, Berkner (1988) Biotechniques 6:616 и Rosenfeld (1991) Science 252:431; WO 93/07283, WO 93/06223 и WO 93/07282. Примеры известных аденовирусных векторов для генотерапии, применимые в данном изобретении, включают векторы, описанные в процитированных выше документах и в WO 94/12649, WO 93/03769, WO 93/19191, WO 94/28938, WO 95/11984, WO 95/00655, WO 95/27071, WO 95/29993, WO 95/34671, WO 96/05320, WO 94/08026, WO 94/11506, WO 93/06223, WO 94/24299, WO 95/14102, WO 95/24297, WO 95/026997, WO 94/28152, WO 94/24299, WO 95/09241, WO 95/25807, WO 95/05835, WO 94/18922 и WO 95/09654. Альтернативно, может использоваться введение ДНК, связанной с убитым аденовирусом, как описано в Curiel (1992) Hum. Gene Ther. 3:147-154. Носители для доставки генов данного изобретения включают также аденоассоциированные вирусные векторы (AAV). Ведущими и предпочтительными примерами таких векторов для применения в данном изобретении являются векторы на основе AAV-2, описанные в Srivastava, WO 93/09239. Наиболее предпочтительные AAV-векторы включают два инвертированных концевых повтора AAV, в которых нативные D-последовательности модифицированы заменой нуклеотидов, так что сохраняются, по меньшей мере, от 5 нативных нуклеотидов и до 18 нативных нуклеотидов, предпочтительно, по крайней мере, от 10 нативных нуклеотидов и до 18 нативных нуклеотидов, наиболее предпочтительно 10 нативных нуклеотидов, а остальные нуклеотиды D-последовательности делегированы или заменены неприродными нуклеотидами. Нативные D-последовательности инвертированных концевых повторов AAV являются последовательностями из 20 последовательных нуклеотидов в каждом инвертированном концевом повторе AAV (т.е. имеется одна последовательность на каждом конце), которые не участвуют в образовании HP. Неприродным замещающим нуклеотидом может быть любой нуклеотид, иной, чем нуклеотид, обнаруживаемый в природной D-последовательности в том же положении. Другими применимыми примерами AAV-векторов являются pWP-19, pWN-1, оба из которых описаны в Nahreini (1993) Gene 124:257-262. Другим примером такого AAV-вектора является psub201 (см. Samulski (1987) J. Virol. 61:3096). Другим примером AAV-вектора является двойной-D-ITR-вектор. Конструирование двойного-D-ITK-вектора описано в патенте США 5478745. Другими векторами являются векторы, описанные в патенте США 4797369, Carter, и патенте США 5139941, Muzyczka, патенте США 5474935, Chartejee, и WO 94/288157, Kotin. Еще одним примером AAV-вектора, применимого в данном изобретении, является SSV9AFABTKneo, который содержит энхансер AFP и промотор альбумина и управляет экспрессией преимущественно в печени. Его структура и конструирование описаны в Su (1996) Human Gene Therapy 7:463-470. Дополнительные AAV-векторы для генотерапии описаны в патентах США 5354678, 5173414, 5139941 и 5252479.
Векторы для генотерапии данного изобретения включают также герпесвирусные векторы. Ведущими и предпочтительными примерами являются векторы вируса простого герпеса, содержащие последовательность, кодирующую полипептид тимидинкиназы, такие как векторы, описанные в патенте США 5288641 и ЕР 0176170 (Roizman). Дополнительные примеры векторов вируса простого герпеса включают HFEM/ICP6-LacZ, описанный в WO 96/04139 (Wistar), pHSVlac, описанный в Geller (1988) Science 241:1667-1669 и в WO 90/09441 и WO 92/07945, HSV Us3::pgC-lacZ, описанный в Fink (1992) Human Gene Therapy 3:11-19, и HSV 7134, 2 RH 105 и GAL4, описанные в ЕР 0453242 (Breakefild), и векторы, депонированные АТСС в виде номеров доступа АТСС VR-977 и АТСС VR-260.
Рассматриваются также альфавирусные векторы для генотерапии, которые могут применяться в данном изобретении. Предпочтительными альфавирусными векторами являются векторы вируса Синдбис, тогавирусов, вируса леса Семлики (АТСС VR-67; АТСС VR-1247), вируса Миддлеберг (АТСС МК-370), вируса реки Росса (АТСС VR-373; АТСС VR-1246), вируса Венесуэльского лошадиного энцефалита (АТСС VR-923; АТСС VR-1250; АТСС VR-1249; АТСС VR-532) и вирусов, описанных в патентах США 5091309, 5217879 и WO 92/10578. Более конкретно, применимыми являются альфавирусы, описанные в патенте США с регистрационным номером 08/405627, поданном 15 марта 1995 года, WO 94/21792, WO 92/10578, WO 95/07994, US 5091309 и US 5217879. Такие альфавирусы могут быть получены из депозитариев или коллекций, таких как АТСС в Rockville, Maryland, или выделены из известных источников с использованием коммерчески доступных способов. Предпочтительно используют альфавирусные векторы с уменьшенной цитотоксичностью (см. USSN 08/679640).
ДНК-векторные системы, такие как эукариотические слоистые системы экспрессии, также применимы для экспрессии нуклеиновых кислот данного изобретения. См. WO 95/07994 в отношении описания эукариотических слоистых систем экспрессии. Предпочтительно эукариотические слоистые системы экспрессии данного изобретения получают из альфавирусных векторов и наиболее предпочтительно из векторов вируса Синдбис.
Другие вирусные векторы, подходящие для использования в данном изобретении, включают векторы, произведенные из полиовируса, например АТСС VR-58, и векторы, описанные в Evans, Nature 339 (1989) 385 и Sabin (1973) J. Biol. Standartization 1:115; риновируса, например АТСС VR-1110, и вирусов, описанных в Arnold (1990) J. Cell Biochem L401; поксвирусов, таких как поксвирус канарейки или вирус коровьей оспы, например АТСС VR-111 и АТСС VR-2010, и вирусов, описанных в Fisher-Hoch (1989) Proc. Natl. Acad. Sci. 86:317; Flexner (1989) Ann NY Acad Sci 569:86, Flexner (1990) Vaccine 8:17; в патентах США 4603112 и 4769330 и WO 89/01973; вируса SV40, например АТСС VR-305, и вирусов, описанных в Mulligan (1979) Nature 277:108 и Madzak (1992) J. Gen Virol 73:1533; вируса гриппа, например, АТСС VR-797 и рекомбинантных вирусов гриппа, полученных с использованием способов обратной генетики, как описано в патенте США 5166057 и в Enami (1990) Proc. Natl. Acad. Sci. 87:3802-3805; Enami & Palese (1991) J. Virol 65:2711-2713 и Luytjes (1989) Cell 59:110, (см. также McMichael (1983) NEJ Med 309:13 и Yap (1978) Nature 273:238 и Nature (1979) 277:108); вируса иммунодефицита человека, как описано в ЕР-0386882 и в Buchschacher (1992) J. Virol. 66:2731; вируса кори, например, АТСС VR-67 и VR-1247, и вирусов, описанных в ЕР-0440219; ауравируса, например АТСС VR-368; вируса Бебару, например АТСС VR-600 и АТСС VR-1240; вируса Кабассу, например АТСС VR-922; вируса Чикуньгунья, например АТСС VR-64 и АТСС VR-1241; вируса форта Морган, например АТСС VR-924; вируса Гета, например АТСС VR-369 и АТСС VR-1243; вируса Кизилагач, например АТСС VR-927; вируса Маяро, например АТСС VR-66; вируса Мукамбо, например АТСС VR-580 и АТСС VR-1244; вируса Ндуму, например АТСС VR-371; вируса Пиксуна, например АТСС VR-372 и АТСС VR-1245; вируса Тонате, например АТСС VR-925; вируса Тринити, например АТСС VR-469; вируса Юна, например АТСС VR-374; вируса Уотароа, например АТСС VR-926; вируса Y-62-33, например АТСС VR-375; вируса о'Нъонг-нъонг, вируса Восточного энцефалита, например АТСС VR-65 и АТСС VR-1242; вируса Западного энцефалита, например АТСС VR-70, АТСС VR-1251, АТСС VR-622 и АТСС VR-1252; коронавируса, например АТСС VR-740, и вирусов, описанных в Hamre (1966) Proc Soc Exp Biol Med 121:190.
Доставка композиций данного изобретения в клетки не ограничивается вышеупомянутыми вирусными векторами. Могут быть использованы другие способы и среды доставки, такие как, например, экспрессирующие векторы нуклеиновых кислот, поликатионная конденсированная ДНК, связанная или не связанная только с убитым аденовирусом, например, см. патент США с регистрационным номером 08/366787, поданный 30 декабря 1994 года, и Curiel (1992) Hum Gene Ther 3:147-154, лиганд-связанная ДНК, например, см. Wu (1989) J. Biol Chem 264:16985-16987, эукариотические клетки-носители для доставки, например, см. патент США с регистрационным номером 08/240030, поданный 9 мая 1994 года, и патент США с регистрационным номером 08/404796, депонирование светополимеризуемых гидрогелей, ружье для частиц для переноса генов, используемое вручную, как описано в патенте США 5149655, ионизирующая радиация, как описано в патенте США 5206152 и в WO 92/11033, нейтрализация ядерного заряда или слияние с клеточными мембранами. Дополнительные подходы описаны в Philip (1994) Mol Cell Biol 14:2411-2618 и в Woffendin (1994) Proc. Natl. Acad. Sci. 91:1581-1585.
Может быть использован перенос генов с использованием частиц, см., например, патент США 60/023867. Вкратце, последовательность может быть введена в общепринятые векторы, которые содержат обычные регуляторные последовательности для экспрессии на высоком уровне, и затем инкубирована с синтетическими молекулами для переноса генов, такими как связывающие ДНК полимерные катионы, подобные полилизину, протамину и альбумину, связанные с нацеливающими на клетку лигандами, такими как асиалоорозомукоид, как описано в Wu & Wu (1987) J. Biol. Chem. 262:4429-4432, инсулин, как описано в Hucked (1990) Biochem Phannacol 40:253-263, галактоза, как описано в Plank (1992) Bioconjugate Chem 3:533-539, лактоза или трансферрин.
Может использоваться также "голая" ДНК. Примеры способов введения "голой" ДНК описаны в WO 90/11092 и патенте США 5580859. Эффективность поглощения может быть улучшена с использованием биодеградируемых гранул из латекса. Покрытые ДНК гранулы из латекса эффективно транспортируются в клетки после инициации эндоцитоза этими гранулами. Этот способ может быть усовершенствован обработкой гранул для увеличения гидрофобности и тем самым облегчения разрушения эндосомы и высвобождения ДНК в цитоплазмы.
Липосомы, которые могут действовать в качестве носителей для доставки генов, описаны в патенте США 5422120, WO 95/13796, WO 94/23697, WO 91/14445 и ЕР-524968. Как описано в USSN 60/023867, при невирусной доставке последовательности нуклеиновых кислот, кодирующие полипептид, могут быть встроены в общепринятые векторы, которые содержат обычные регуляторные последовательности для экспрессии на высоком уровне, и затем инкубированы с синтетическими молекулами для переноса генов, такими как связывающие ДНК полимерные катионы, подобные полилизину, протамину и альбумину, связанные с нацеливающими на клетку лигандами, такими как асиалоорозомукоид, инсулин, галактоза, лактоза или трансферрин. Другие системы доставки включают использование липосом для инкапсулирования ДНК, содержащей ген, находящийся под контролем различных тканеспецифических или повсеместно активных промоторов. Следующая невирусная система доставки, пригодная для применения, включает механические системы доставки, такие как подход, описанный в Woffendin et al. (1994) Proc. Natl. Acad. Sci. USA 91(24):11581-11585. Кроме того, кодирующая последовательность и продукт ее экспрессии могут доставляться депонированием светополимеризуемых являющихся гидрогелями материалов. Другие общепринятые способы доставки генов, которые могут быть использованы для доставки кодирующей последовательности, включают, например, использование ружья для частиц для переноса генов, применяемого вручную, как описано в патенте США 5149655, использование ионизирующей радиации для активации переносимых генов, как описано в патенте США 5206152 и в WO 92/11033.
Примеры липосомных и поликатионных носителей для доставки генов описаны в патентах США 5422120 и 4762915; в WO 95/13796; WO 94/23697 и WO 91/14445; в ЕР-0524968 и в Stryer, Biochemistry, pages 236-240 (1975); W.H.Freeman, San Francisco; Szoka (1980) Biochem Biophys Acta 600:1; Bayer (1979) Biochem Biophys Acta 550:464; Rivnay (1987) Meth Enzymol 149:119; Wang (1987) Proc. Natl. Acad. Sci. 84:7851; Plant (1989) Anal Biochem 176:420.
Полинуклеотидная композиция может содержать терапевтически эффективное количество носителей для генотерапии, определенное выше. Для целей данного изобретения эффективная доза будет находиться в диапазоне приблизительно от 0,01 мг/кг до 50 мг/кг или от 0,05 мг/кг до приблизительно 10 мг/кг ДНК-конструкций в индивидууме, в который ее вводят.
Способы доставки
После приготовления полинуклеотидные композиции данного изобретения (1) могут быть введены непосредственно субъекту; (2) доставлены ex vivo в клетки, полученные из субъекта, или (3) доставлены in vitro для экспрессии рекомбинантного белка. Субъектами для лечения могут быть млекопитающие или птицы. Могут также лечиться люди.
Прямая доставка этих композиций обычно будет выполняться инъекцией, подкожной, внутрибрюшинной, внутривенной или внутримышечной, или доставкой в интерстициальное пространство ткани. Эти композиции могут также доставляться в повреждения. Другие способы введения включают пероральное и легочное введение, суппозитории и трансдермальные или чрескожные введения (например, см. WO 98/20734), иглы и генные ружья или гипоспреи. Введение в виде доз может быть схемой введения единственной дозы или схемой введения множественных доз.
Способы доставки ex vivo и повторной имплантации трансформированных клеток в субъект известны в данной области и описаны, например, в WO 93/14778. Примеры клеток, применимых во введениях ех vivo, включают, например, стволовые клетки, в частности гемопоэтические клетки, клетки лимфы, макрофаги, дендритные клетки или опухолевые клетки.
Обычно доставка нуклеиновых кислот в применениях как ех vivo, так и in vitro может выполняться следующими процедурами, такими как, например, опосредованная декстраном трансфекция, осаждение фосфатом кальция, опосредованная полибреном трансфекция, слияние протопластов, электропорация, инкапсулирование полинуклеотида (полинуклеотидов) в липосомах и прямая микроинъекция ДНК в ядра, как хорошо известно в данной области.
Полинуклеотидные и полипептидные фармацевтические композиции
Кроме фармацевтически приемлемых носителей и солей, описанных выше, следующие дополнительные агенты могут быть использованы с полинуклеотидными и/или полипептидными композициями.
А. Полипептиды
Одним из примеров являются полипептиды, которые включают, без ограничения, асиалоорозомукоид (ASOR); трансферрин; асиалогликопротеины; антитела; фрагменты антител; ферритин; интерлейкины; интерфероны, гранулоцитарный-макрофагальный колониестимулирующий фактор (GM-CSF), гранулоцитарный колониестимулирующий фактор (G-CSF), макрофагальный колониестимулирующий фактор (M-CSF), фактор стволовых клеток и эритропоэтин. Могут быть также использованы вирусные антигены, такие как белки оболочки, а также белки из других инвазивных организмов, такие как пептид из 17 аминокислот из белка циркумспорозоита Plasmodium falciparum, известного как RII.
В. Гормоны, витамины и т.д.
Другими группами, которые могут быть включены, являются, например, гормоны, стероиды, андрогены, эстрогены, тиреоидный гормон или витамины, фолиевая кислота.
С. Полиалкилены, полисахариды и т.д.
С желаемыми полинуклеотидами/полипептидами в композиции может быть также включен полиалкиленгликоль. В предпочтительном варианте полиалкиленгликолем является полиэтиленгликоль. Кроме того, могут быть включены моно-, ди- или полисахариды. В предпочтительном варианте этого аспекта полисахаридом является декстран или ДЭАЭ-декстран, а также хитозан и поли(сополимер лактид-гликолид).
Р. Липиды и липосомы
Желаемый полинуклеотид/полипептид может быть также инкапсулирован в липидах или упакован в липосомах перед доставкой в субъект или в клетки, полученные из субъекта.
Липидное инкапсулирование обычно выполняют с использованием липосом, которые способны стабильно связывать или захватывать и удерживать нуклеиновую кислоту. Отношение конденсированного полинуклеотида к липиду в препарате может варьироваться, но будет обычно приблизительно 1:1 (мг ДНК : микромоль липида) или с большим содержанием липида. В отношении обзора, касающегося применения липосом в качестве носителей для доставки нуклеиновых кислот, см. Hug and Sleight (1991) Biochim. Biophys. Acta 1097:1-17; Straubinger (1983) Meth. Enzymol. 101:512-527.
Липосомные препараты для применения в данном изобретении включают катионные (положительно заряженные), анионные (отрицательно заряженные) и нейтральные препараты. Было показано, что катионные липосомы опосредуют внутриклеточную доставку плазмидной ДНК (Felgner (1987) Proc. Natl. Acad. Sci. USA 84:7413-7416); мРНК (Malone (1989) Proc. Natl. Acad. Sci. USA 86:6077-6081) и очищенных факторов транскрипции (Debs (1990) J. Biol. Chem. 265:10189-10192) в функциональной форме.
Катионные липосомы являются легко доступными. Например, N-{1-(2, 3-диолеилокси)пропил}-N,N,N-триэтиламмоний (DOTMA) - липосомы доступны под товарным названием Липофектин из GIBCO BRL, Grand Island, NY (см. также Felgner, выше). Другие коммерчески доступные липосомы включают трансфектазу (DDAB/DOPE) и DOTAP/DOPE (Boerhinger). Другие катионные липосомы могут быть получены из легко доступных материалов с использованием способов, хорошо известных в данной области. См., например, Szoka (1978) Proc. Natl. Acad. Sci. USA 75:4194-4198; WO 90/11092 в отношении описания синтеза DOTAP (1,2-бис(олеоилокси)-3-(гриметиламмонио)пропан)-липосом.
Подобным образом анионные и нейтральные липосомы являются легко доступными, например, из Avanti Polar Lipids (Birmingham, AL), или могут быть легко получены из легко доступных материалов. Такие материалы включают фосфатидилхолин, холестерин, фосфатидилэтаноламин, диолеоилфосфатидилхолин (DOPC), диолеоилфосфатидилглицирин (DOPG), диолеоилфосфатидилэтаноламин (DOPE), среди прочих. Эти материалы могут быть также смешаны с исходными материалами DOTMA и DOTAP в подходящих соотношениях. Способы приготовления липосом с использованием этих материалов хорошо известны в данной области.
Липосомы могут включать многослойные везикулы (MLV), небольшие однойслойные везикулы (SUV) или большие однослойные везикулы (LUV). Различные комплексы липосома-нуклеиновая кислота готовят с использованием способов, известных в данной области. См., например, Straubinger (1983) Meth. Immunol. 101:512-527; Szoka (1978) Proc. Natl. Acad. Sci. USA 75:4194-4198; Papahadjopoulos (1975) Biochim. Biophys. Acta 394:483; Wilson (1979) Cell 17:77; Deamer & Bangham (1976) Biochim. Biophys. Acta 443:629; Ostro (1977) Biochim. Biophys. Res. Commun. 76:836; Fraley (1979) Proc. Natl. Acad. Sci. USA 76:3348; Enoch & Strittmatter (1979) Proc. Natl. Acad. Sci. USA 76:145; Fraley (1980) J. Biol. Chem. (1980) 225:10431; Szoka & Papahadjopoulos (1978) Proc. Natl. Acad. Sci. USA 75:145 и Schaefer-Ridder (1982) Science 215:166.
E. Липопротеины
Кроме того, липопротеины могут быть включены с доставляемыми полинуклеотидом/полипептидом. Примеры липопротеинов, которые могут быть использованы, включают хиломикроны, HDL, IDL, LDL и VLDL. Могут быть также использованы мутанты, фрагменты или слияния этих белков. Могут быть также использованы модификации природно встречающихся липопротеинов, такие как ацетилированный LDL. Эти липопротеины могут нацеливать доставку полинуклеотидов на клетки, экспрессирующие рецепторы липопротеинов. Предпочтительно, если липопротеины включают с доставляемым полинуклеотидом, то в эту композицию не включают нацеливающий лиганд.
Природно встречающиеся липопротеины включают липидную и белковую части. Белковую часть называют апопротеином. В настоящее время апопротеины А, В, С, D и Е были выделены и идентифицированы. По меньшей мере, два из них содержат несколько белков, обозначаемых римскими цифрами, AI, AII, AIV; CI, CII, CIII.
Липопротеин может содержать более чем один апопротеин. Например, природно встречающиеся хиломикроны содержат А, В, С и Е, с течением времени эти липопротеины теряют А и приобретают апопротеины С и Е. VLDL содержит апопротеины А, В, С и Е, LDL содержит апопротеин В; HDL содержит апопротеины А, С и Е.
Аминокислоты этих апопротеинов известны и описаны, например, в Breslow (1985) Annu Rev. Biochem. 54:699; Law (1986) Adv. Exp. Med. Biol. 151:162; Chen (1986) J. Biol Chem 261:12918; Kane (1980) Proc. Natl. Acad. Sci. USA 77:2465 и Utermann (1984) Hum Genet 65:232.
Липопротеины содержат различные липиды, в том числе триглицериды, холестерин (свободный и эфиры) и фосфолипиды. В природно встречающихся липопротеинах состав липидов варьируется. Например, хиломикроны содержат в основном триглицериды. Более подробное описание содержания липидов в природно встречающихся липопротеинах можно найти, например, в Meth. Enzymol. 128 (1986). Состав липидов выбирают таким образом, чтобы способствовать конформации апопротеина для связывающей рецептор активности. Состав липидов может быть также выбран для облегчения гидрофобного взаимодействия и ассоциации со связывающей полинуклеотид молекулой.
Природно встречающиеся липопротеины могут быть выделены из сыворотки, например, ультрацентрифугированием. Такие способы описаны в Meth. Enzymol (выше); Pitas (1980) J. Biochem. 255:5454-5460 и Mahey (1979) J. Clin. Invest 64:743-750. Липопротеины могут быть также получены in vitro или рекомбинантными способами экспрессией генов апопротеинов в желаемой клетке-хозяине. См., например, Atkinson (1986) Annu Rev Biophys Chem 15:403 и Radding (1958) Biochim Biophys Ada 30:443. Липопротеины могут быть также куплены у коммерческих фирм-поставщиков, таких как Biomedicals Technologies, Inc., Stoughton, Massachusetts, USA. Дополнительное описание липопротеинов можно найти в Zuckermann et al. PCT/US97/14465.
F. Поликатионные агенты
Поликатионные агенты могут быть включены, с липопротеином или без липопротеина, в комбинации с желаемым доставляемым полинуклеотидом/полипептидом.
Обычно поликатионные агенты обнаруживают общий положительный заряд при физиологически релевантном рН и способны нейтрализовать электрический заряд нуклеиновых кислот для облегчения доставки в желаемое местоположение. Эти агенты применяют как in vitro, ex vivo, так и in vivo. Поликатионные агенты могут быть использованы для доставки нуклеиновых кислот в живой субъект внутримышечно, подкожно и т.д.
Далее следуют примеры применимых полипептидов в качестве поликатионных агентов: полилизин, полиаргинин, полиорнитин и протамин. Другие примеры включают гистоны, протамины, человеческий сывороточный альбумин, ДНК-связывающие белки, негистоновые хромосомные белки, белки оболочки из ДНК-вирусов, такие как Х174, факторы транскрипции также содержат домены, которые связывают ДНК и, следовательно, могут быть применимы в качестве конденсирующих нуклеиновую кислоту агентов. Вкратце, факторы транскрипции, такие как С/СЕВР, c-jun, c-fos, АР-1, АР-2, АР-3, CPF, Prot-1, Sp-1, Oct-1, Oct-2, CREP и TFIID, содержат основные домены, которые связывают ДНК-последовательности.
Органические поликатионные агенты включают спермин, спермидин и пуртресцин.
Размеры и физические свойства поликатионного агента могут быть экстраполированы из приведенного выше перечня для конструирования других полипептидных поликатионных агентов или для получения синтетических поликатионных агентов.
Синтетические поликатионные агенты, которые являются применимыми, включают, например, ДЭАЭ-декстран, полибрен. Липофектин™ и липофектАМИН™ являются мономерами, которые образуют поликатионные комплексы при комбинировании с полинуклеотидом/полипептидом.
Гибридизация нуклеиновых кислот
"Гибридизация" обозначает связь двух последовательностей нуклеиновых кислот друг с другом посредством образования водородных связей. Обычно одна последовательность будет фиксироваться на твердом носителе, а другая будет в свободном виде в растворе. Затем эти две последовательности помещают в контакт друг с другом в условиях, благоприятствующих образованию водородных связей. Факторы, которые влияют на это связывание, включают тип и объем растворителя; температуру реакции; время гибридизации; перемешивание; агенты для блокирования неспецифического присоединения жидкофазной последовательности к твердому носителю (реагент Денхардта или BLOTTO); концентрацию этих последовательностей; применение соединений для увеличения скорости ассоциации последовательностей (декстрансульфата или полиэтиленгликоля) и жесткость условий промывки после гибридизации. См. Sambrook et al. (выше) vol.2, chapter 9, pp.9.47-9.57.
"Жесткость" обозначает условия в реакции гибридизации, которые благоприятствуют ассоциации очень сходных последовательностей по сравнению с последовательностями, которые различаются. Например, должна быть выбрана комбинация температуры и концентрации соли, которая является на приблизительно 12-20°С более низкой, чем рассчитанная Тm исследуемого гибрида. Эта температура и солевые условия могут быть часто определены эмпирически в предварительных экспериментах, в которых пробы геномной ДНК, иммобилизованные на фильтрах, гибридизуют с представляющей интерес последовательностью и затем промывают в условиях различной жесткости. См. Sambrook et al., стр.9.50.
Переменными, которые должны приниматься во внимание при проведении, например, блоттинга по Саузерну, являются (1) сложность блоттируемой ДНК и (2) гомология между зондом и детектируемыми последовательностями. Общее количество исследуемого фрагмента (фрагментов) может варьироваться в пределах 10, от 0,1-1 мкг для продукта расщепления плазмиды или фага до 10-9-10-8 г для однокопийного гена в высокосложном эукариотическом геноме. Для полинуклеотидов меньшей сложности могут использоваться существенно более короткие периоды блоттинга, гибридизации и экспонирования, меньшее количество исходных полинуклеотидов и более низкая специфическая активность зондов. Например, однокопийный ген дрожжей может быть детектирован со временем экспонирования всего лишь 1 час, начиная с 1 мкг дрожжевой ДНК, блоттингом в течение двух часов и гибридизацией в течение 4-8 часов с зондом 108 имп/мин/мкг. Для однокопийного гена млекопитающего консервативный подход должен начинаться с 10 мкг ДНК, блоттинга в течение ночи и гибридизации в течение ночи в присутствии 10% декстрансульфата с использованием зонда, большего, чем 108 имп/мин/мкг, что приводит ко времени экспонирования ˜24 часа.
Несколько факторов могут влиять на температуру плавления (Тm) гибрида ДНК-ДНК между зондом и представляющим интерес фрагментом и, следовательно, подходящие условия для гибридизации и промывания. Во многих случаях зонд не является на 100% гомологичным фрагменту. Другие обычно встречающиеся переменные включают длину и общее (G+C) содержание гибридизующихся последовательностей, ионную силу и содержание формамида в буфере для гибридизации. Эффекты всех из этих факторов могут быть выражены приближенно единым уравнением:
Тm=81+16, 6(log10Ci)+0,4{%(G+C)}-0,6(%формамид)-
600/n-1,5(% ошибочных спариваний),
где Ci обозначает концентрацию соли (одновалентных ионов), а n обозначает длину гибрида в п.н. (слегка модифицировано из Meinkoth & Wahl (1984) Anal. Biochem. 138:267-284).
В построении эксперимента по гибридизации некоторые факторы, влияющие на гибридизацию нуклеиновых кислот, могут быть подходящим образом изменены. Температуру гибридизации и промывки и концентрацию соли во время промывок легче всего корректировать. По мере увеличения температуры гибридизации (т.е. жесткости) становится менее вероятным, что произойдет гибридизация между цепями, которые являются негомологичными, и в результате происходит уменьшение фона. Если радиоактивно меченый зонд является не полностью гомологичным с иммобилизованным фрагментом (как это часто имеет место в экспериментах по гибридизации семейств генов и межвидовой гибридизации), температура гибридизации должна быть понижена, и фон будет увеличиваться. Температура отмывок влияет на интенсивность полос гибридизации и степень фона аналогичным образом. Жесткость промывок также увеличивается с уменьшением концентраций соли.
Обычно подходящими температурами гибридизации в присутствии 50% формамида являются 42°С для зонда, который на 95%-100% гомологичен с фрагментом-мишенью, 37°С для 90%-95% гомологии и 32°С для 85%-90% гомологии. Для более низких гомологий содержание формамида должно быть уменьшено, а температуру корректируют с использованием приведенного выше уравнения. Если гомология между зондом и фрагментом-мишенью неизвестна, самым простым подходом является проведение сначала гибридизации в условиях гибридизации и промывок, которые не являются жесткими. Если после радиоавтографии наблюдаются неспецифические полосы или высокий фон, фильтр может быть отмыт при высокой жесткости и повторно подвергнут экспонированию. Если время, требуемое для экспонирования, делает этот подход непрактичным, следует испытывать несколько жесткостей гибридизации и/или промывок параллельно.
Анализы зондов нуклеиновых кислот
Такие способы, как ПЦР, анализы с разветвленным ДНК-зондом или способы блоттинга с использованием зондов нуклеиновых кислот в соответствии с данным изобретением, могут определять присутствие кДНК или мРНК. Говорят, что зонд "гибридизуется" с последовательностью данного изобретения, если он может образовать дуплекс или двухцепочечный комплекс, который является достаточно стабильным для детектирования.
Зонды нуклеиновых кислот будут гибридизоваться с хламидиальными нуклеотидными последовательностями данного изобретения (как со смысловой, так и с антисмысловой цепью). Хотя многочисленные различные нуклеотидные последовательности будут кодировать конкретную аминокислотную последовательность, нативная хламидиальная последовательность является предпочтительной, так как она является действительной последовательностью, присутствующей в клетках. мРНК представляет кодирующую последовательность, и следовательно, зонд должен быть комплементарным кодирующей последовательности; одноцепочечная кДНК является комплементарной мРНК, и, следовательно, кДНК-зонд должен быть комплементарным некодирующей последовательности.
Последовательность зонда не должна быть идентичной хламидиальной последовательности (или ее комплементу) некоторая вариация в этой последовательности и длине может приводить к увеличенной чувствительности анализа, если зонд нуклеиновой кислоты может образовывать дуплекс с нуклеотидами-мишенями, которые могут быть детектированы. Зонд нуклеиновой кислоты может также включать дополнительные нуклеотиды для стабилизации образованного дуплекса. Дополнительная хламидиальная последовательность может также быть полезной в качестве метки для обнаружения образованного дуплекса. Например, некомплементарная последовательность может быть присоединена к 5'-концу зонда, причем остальная часть последовательности зонда является комплементарной хламидиальной последовательности. Альтернативно некомплементарные основания или более длинные последовательности могут быть рассеяны в зонде при условии, что последовательность зонда имеет достаточную комплементарность с хламидиальной последовательностью для гибридизации с ней и образования в результате дуплекса, который может быть детектирован.
Точная длина и последовательность зонда будут зависеть от условий гибридизации, таких как температура, солевые условия и т.п. Например, для диагностических применений, в зависимости от сложности анализируемой последовательности, зонд нуклеиновой кислоты обычно содержит, по меньшей мере, 10-20 нуклеотидов, предпочтительно 15-25, более предпочтительно ≥30 нуклеотидов, хотя он может быть и более коротким. Короткие праймеры обычно требуют более низких температур для образования достаточно стабильных гибридных комплексов с матрицей.
Зонды могут быть получены синтетическими процедурами, такими как триэфирный способ Matteucci et al. (J. Am. Chem. Soc. (1981) 103:3185), или в соответствии с Urdea et al. (Proc. Natl. Acad. Sci. USA (1983) 80:7461), или с использованием коммерчески доступных автоматических синтезаторов олигонуклеотидов.
Химическая природа зонда может быть выбрана в соответствии с предпочтением экспериментатора. Для некоторых применений подходящими являются ДНК или РНК. Для других применений могут быть включены модификации, например могут быть использованы модификации скелета, такие как фосфоротиоаты или метилфосфонаты, для увеличения полупериода существования in vivo, изменения аффинности РНК, увеличения устойчивости к нуклеазам и т.д. (например, см. Agrawal and lyer (1995) Curr Opin Biotechnol 6:12-19; Agrawal (1996) TIBTECH 14:376-387); могут быть также использованы аналоги, такие как пептиднуклеиновые кислоты (например, см. Согеу (1997) TIBTECH 15:224-229; Buchardt et al. (1993) TIBTECH 11:384-386).
Альтернативно хорошо известным средством для обнаружения малых количеств нуклеиновых кислот-мишеней является полимеразная цепная реакция (ПЦР). Этот анализ описан в Mullis et al. (Meth. Enzymol. (1987) 155:335-350)); патенты США 4683195 и 4683202. Два "праймера" гибридизуются с нуклеиновыми кислотами-мишенями и используются для праймирования (затравки) реакции. Эти праймеры могут содержать последовательность, которая не гибридизуется с последовательностью мишени амплификации (или ее комплементом), для улучшения стабильности дуплекса или, например, для включения удобного сайта рестрикции. Обычно такая последовательность будет фланкировать желаемую хламидиальную последовательность.
Термостабильная полимераза создает копии нуклеиновых кислот-мишеней из этих праймеров с использованием исходных нуклеиновых кислот-мишеней в качестве матрицы. После генерирования порогового количества нуклеиновых кислот-мишеней этой полимеразой они могут детектироваться более традиционными способами, такими как блоттинг по Саузерну. При использовании метода блоттинга по Саузерну меченый зонд будет гибридизоваться с хламидиальной последовательностью (или ее комплементом).
мРНК или кДНК могут также детектироваться традиционными способами блоттинга, описанными в Sambrook et al. (выше). мРНК или кДНК, полученная из мРНК с использованием фермента полимеразы, может быть очищена и выделена с использованием гель-электрофореза. Затем нуклеиновые кислоты на геле блоттируют (промакают) на твердый носитель, такой как нитроцеллюлоза. Твердый носитель подвергают действию меченого зонда и затем отмывают для удаления любого негибридизованного зонда. Затем детектируют дуплексы, содержащие меченый зонд. Обычно зонд метят радиоактивно мечечным радикалом.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1-44 показывают данные из примеров 1-44. Когда фигура показывает гель, дорожка 1 находится с левой стороны фигуры.
Для Вестерн-блотов испытывали две пробы для каждого белка.
Левую дорожку в паре использованных полосок мембран окрашивали сыворотками до иммунизации, тогда как правую дорожку используемых полосок мембран окрашивали иммунными сыворотками. В Вестерн-блотах на фиг.1-5, 35В, 37В, 38В и 39 маркеры находятся при 66, 45, 30, 20,1 и 14,4 кДа. В Вестерн-блотах на фиг.6-16, 20В, 23С, 24D, 27Е, 38А, 40, 41, 42 и 43 маркеры находятся при 172,6, 111,4, 79,6, 61,3, 49,0, 36,4, 24,7, 19,2 и 13,1 кДа.
В Вестерн-блотах на фиг.1-5 дорожки 2 и 3 показывают контрольные сыворотки, индуцированные против GST-слитых контрольных антигенов. В Вестерн-блотах на фиг.1-5 дорожки 4 и 5 показывают контрольные сыворотки, индуцированные против His-меченых контрольных антигенов.
Низкомолекулярные маркеры массы подвергали электрофорезу в дорожке 1 гелей очистки.
СПОСОБЫ ПРОВЕДЕНИЯ ИЗОБРЕТЕНИЯ
Таблица I дает названия белков С. pneumoniae из ссылки 18, номера доступа GenBank и названия этих белков, номера доступа GenBank и названия соответствующих белков С. trachomatis данного изобретения и SEQ ID-номера (SEQ ID NO:1-262, причем нечетные номера являются аминокислотными последовательностями, а четные номера являются нуклеотидными последовательностями) для белков С. trachomatis. Они могут экспрессироваться и использоваться таким же образом, как описано в ссылке 18 для соответствующих белков С. pneumoniae. Белки С. trachomatis применимы для диагностических и иммуногенных целей. Эти свойства не являются очевидньми только из последовательности.
Различные тесты могут быть использованы для оценки иммуногенности in vivo белков данного изобретения. Например, эти белки могут экспрессироваться рекомбинантно и использоваться для скрининга сывороток пациентов при помощи иммуноблота. Положительная реакция между этим белком и сывороткой пациента указывает на то, что у данного пациента выработался иммунный ответ на рассматриваемый белок, т.е. этот белок является иммуногеном. Этот способ может быть также использован для идентификации иммунодоминантных белков.
Рекомбинантный белок может быть также удобным образом использован для получения антител, например, в мыши. Эти белки могут быть использованы для прямого подтверждения, что белок локализован на клеточной поверхности С. trachomatis (например, с использованием антител в Вестерн-блоте против интактных Chlamydia). Меченое антитело (например, флуоресцентное мечение для FACS) может инкубироваться с интактными бактериями, и присутствие метки на бактериальной поверхности подтверждает местоположение данного белка. Фигуры FACS показывают профиль рассеяния препарата Chlamydia, используемого в данном анализе, смещение пика, получаемое при связывании антител против рекомбинантного антигена с клетками Chlamydia (белая зона=контрольная зона; затемненная зона=проба, прореагировавшая с антителом), количественный статистический анализ Колмогорова-Смирнова (К-С) и результаты вычислений программного обеспечения анализа FACS.
Пример 1
СТ242 (SEQ ID NO: 57 и SEQ ID NO:58) экспрессировали в Е. coli. Рекомбинантный продукт очищали как в виде GST-слитого белка (фиг.1А; дорожки 4 и 5, хромотографические фракции 1 и 2, ожидаемая молекулярная масса 42,4 кДа), так и в виде His-меченого слитого белка (фиг.1В; дорожки 2-4, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 16,4 кДа).
Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.1С; His-меченый: дорожки 12 и 13; GST-слияние: дорожки 20 и 21). Дорожка 12 показывает мембранные полоски, окрашенные сыворотками до иммунизации в отношении His-меченого СТ242, тогда как дорожка 13 показывает мембранные полоски, окрашенные иммунными сыворотками в отношении His-меченого СТ242. Дорожка 20 показывает мембранные полоски, окрашенные сыворотками до иммуннизации в отношении GST-слияния СТ242, тогда как дорожка 21 показывает мембранные полоски, окрашенные иммунными сыворотками в отношении GST-слияния СТ242.
Эти эксперименты показывают, что СТ242 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 2
СТ045 (SEQ ID NO:71 и SEQ ID NO:72) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого белка (фиг.2А; дорожки 4-6, фракции хроматографии 1, 2 и 3, ожидаемая молекулярная масса 55,8 кДа). Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.2В, дорожки 8 и 9) и для FACS- анализа (фиг.2С, величина К-С 16,81).
Эти эксперименты показывают, что СТ045 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 3
СТ381 (SEQ ID NO:105 и SEQ ID NO:106) экспрессировали в Е. coli. Рекомбинантный продукт очищали как в виде GST-слитого белка (фиг.3А; дорожки 2 и 3, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 52,7 кДа), так и в виде His-меченого слитого белка (фиг.3А; дорожки 7-9, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 26,7 кДа). Этот рекомбинантный His-меченый белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.3В; His-меченый: дорожки 6 и 7; GST-слияние: дорожки 16 и 17) и для FACS-анализа (фиг.3С; GST-меченый, величина К-С 35,98; Фиг.3D: His-меченый, величина К-С 32,54).
Эти эксперименты показывают, что СТ381 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 4
СТ396 (SEQ ID NO:107 и SEQ ID NO:108) экспрессировали в Е. coli. Рекомбинантный продукт очищали как в виде GST-слитого белка (фиг.4А; дорожки 6 и 7, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 99,5 кДа), так и в виде His-меченого слитого белка (фиг.4В; дорожки 5-7, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 73,5 кДа). Этот рекомбинантный His-меченый белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.4С; дорожки 14 и 15). Рекомбинантный His-меченый белок и GST-слитый белок использовали также для FACS-анализа (фиг.40; His-меченый, величина К-С 34, 50; фиг.4Е: GST-слитый, величина К-С 32, 76).
Эти эксперименты показывают, что СТ396 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 5
СТ398 (SEQ ID NO: 111 и SEQ ID NO:112) экспрессировали в Е. coli. Рекомбинантный продукт очищали как в виде GST-слитого белка (фиг.5А; дорожки 8 и 9, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 54,8 кДа), так и в виде His-меченого слитого белка (фиг.5В; дорожки 8-10, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 28,8 кДа). Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.5С; His-меченый: дорожки 10 и 11; GST-слияние: дорожки 18 и 19) и для FACS-анализа (фиг.5D; GST-слияние, величина К-С 31,24; фиг.5Е; His-меченый, величина К-С 26, 10).
Эти эксперименты показывают, что СТ398 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 6
СТ089 (SEQ ID NO:61 и SEQ ID NO:62) экспрессировали в Е. coli. Рекомбинантный продукт очищали как в виде GST-слитого белка (фиг.6С; дорожка 2, хроматографическая фракция 1, ожидаемая молекулярная масса 70,8 кДа), так и в виде His-меченого слитого белка (фиг.6С; дорожки 3, 4 и 5, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 44,8 кДа). Эти рекомбинантные белки использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.6А; GST-слияние: дорожки 14 и 15; His-меченый: дорожки 16 и 17) и для FACS-анализа (фиг.6В; His-меченый, величина К-С 26, 59).
Эти эксперименты показывают, что СТ089 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 7
СТ443 (SEQ ID NO:125 и SEQ ID NO:126) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка. Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.7А; дорожки 10 и 11) и для FACS-анализа (фиг.7 В; величина К-С 21, 28).
Эти эксперименты показывают, что СТ443 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 8
СТ541 (SEQ ID NO:149 и SEQ ID NO:150) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде GST-слитого белка (фиг.8С; дорожки 2 и 3, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 51,6 кДа). Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.8А; дорожки 6 и 7) и для FACS-анализа (фиг.8В; величина К-С 9,94).
Эти эксперименты показывают, что СТ541 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 9
СТ547 (SEQ ID NO:151 и SEQ ID NO:152) экспрессировали в Е. coli. Рекомбинантный продукт очищали как в виде GST-слитого белка (фиг.9D; дорожки 4 и 5, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 58,3 кДа), так и в виде His-меченого слитого белка. Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.9А; His-меченый: дорожки 20 и 21) и для FACS-анализа (фиг.9В; GST-слияние, величины К-С 14,60 и 15,57; фиг.9С; His-меченый, величина К-С 28,21).
Эти эксперименты показывают, что СТ547 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 10
СТ587 (SEQ ID NO:189 и SEQ ID NO:190) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка (фиг.10С; дорожки 5, 6 и 7, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 47,5 кДа). Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.10А; дорожки 12 и 13) и для FACS-анализа (фиг.10В; His-меченый, величина К-С 20,85).
Эти эксперименты показывают, что СТ587 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 11
СТ266 (SEQ ID NO:77 и SEQ ID NO:78) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка (фиг.11С; дорожки 11 и 12, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 44,1 кДа). Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.11А; дорожки 4 и 5) и для FACS-анализа (фиг.11В; величина К-С 21,29).
Эти эксперименты показывают, что СТ266 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 12
СТ444 (SEQ ID NO:127 и SEQ ID NO:128) экспрессировали в Е. coli. Рекомбинантный продукт очищали как в виде GST-слитого белка (фиг.12В; дорожки 2 и 3, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 87,3 кДа), так и в виде His-меченого слитого белка. (фиг.12С; дорожки 3 и 4, хроматографические фракции 2 и 3, ожидаемая молекулярная масса 9,0 кДа). Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.12А; дорожки 16 и 17) и для FACS-анализа (фиг.12D; GST-меченый, величина К-С 14,98; фиг.12Е; His-меченый, величина К-С 13, 28).
Эти эксперименты показывают, что СТ444 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 13
СТ559 (SEQ ID NO:199 и SEQ ID NO:200) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого белка (фиг.13С; дорожки 2, 3 и 4, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 34,9 кДа). Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.13А; дорожки 6 и 7) и для FACS-анализа (фиг.13В; величина К-С 23,21).
Эти эксперименты показывают, что СТ559 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 14
СТ681 (SEQ ID NO:155 и SEQ ID NO:156) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка (фиг.14С; дорожки 5 и 6, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 41,8 кДа). Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.14А; дорожки 10 и 11) и для FACS-анализа (фиг.14В; величина К-С 34,66).
Эти эксперименты показывают, что СТ681 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 15
СТ713 (SEQ ID NO:201 и SEQ ID NO:202) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка (фиг.15В; дорожки 4, 5 и 6, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 35,4 кДа). Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.15А; дорожки 12 и 13) и для FACS-анализа (фиг.15С; величина К-С 25,82).
Эти эксперименты показывают, что СТ713 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 16
СТ823 (SEQ ID NO:229 и SEQ ID NO:230) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка (фиг.16С; дорожки 7, 8 и 9, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 53,9 кДа). Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.16А; дорожки 14 и 15) и для FACS-анализа (фиг.16В; величина К-С 26,62).
Эти эксперименты показывают, что СТ823 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 17
СТ114 (SEQ ID NO:243 и SEQ ID NO:244) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка (фиг.17; дорожки 6 и 7, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 48,5 кДа).
Пример 18
СТ198 (SEQ ID NO:43 и SEQ ID NO:44) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка (фиг.18А; дорожка 6, хроматографическая фракция 1, ожидаемая молекулярная масса 56,3 кДа). Этот His-меченый рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали для FACS-анализа (фиг.18В).
Эти эксперименты показывают, что СТ198 присутствует только в части гетерогенной популяции ЕВ (как это имеет обычно место для хламидиальных препаратов). Там, где он присутствует, он является экспонированным на поверхности и иммунодоступным белком. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 19
СТ241 (SEQ ID NO:55 и SEQ ID NO:56) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка (фиг.19; дорожка 4, хроматографическая фракция 3, ожидаемая молекулярная масса 85,3 кДа).
Пример 20
СТ350 (SEQ ID NO:27 и SEQ ID NO:28) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка (фиг.20А; дорожки 2, 3 и 4, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 61,3 кДа) и GST-меченого слитого белка (фиг.20А; дорожки 7, 8 и 9, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 87,3 кДа). Эти рекомбинантные белки использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.20В; His-меченый, дорожки 4 и 5; GST-меченый, дорожки 8 и 9).
Пример 21
СТ351 (SEQ ID NO:25 и SEQ ID NO:26) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка (фиг.21; дорожки 2 и 3, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 76,1 кДа).
Пример 22
СТ391 (SEQ ID NO:251 и SEQ ID NO:252) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка (фиг.22; дорожки 8 и 9, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 32,6 кДа).
Пример 23
СТ077 (SEQ ID NO:65 и SEQ ID NO:66) экспрессировали в Е. coli. Рекомбинантный продукт очищали как в виде GST-меченого слитого белка (фиг.23; дорожки 2 и 3, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 59,7 кДа), так и в виде His-меченого слитого белка. Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.23С; дорожки 6 и 7) и для FACS-анализа (фиг.23В; His-меченый, величина К-С 9,17).
Эти эксперименты показывают, что СТ077 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 24
СТ181 (SEQ ID NO:245 и SEQ ID NO:246) экспрессировали в Е. coli. Рекомбинантный продукт очищали как в виде GST-меченого слитого белка (фиг.24А; дорожка 4, хроматографическая фракция 1, ожидаемая молекулярная масса 50,1 кДа), так и в виде His-меченого слитого белка (фиг.24В; дорожки 2, 3 и 4, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 32,0 кДа). GST-меченый рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.24D, дорожки 4 и 5 (указанные стрелками)) и для FACS-анализа (фиг.24С; величина К-С 7,62).
Эти эксперименты показывают, что СТ181 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 25
СТ589 (SEQ ID NO:185 и SEQ ID NO:186) экспрессировали в Е. coli. Рекомбинантный продукт очищали как в виде GST-меченого слитого белка (фиг.25А; дорожки 4 и 5, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 89,4 кДа), так и в виде His-меченого слитого белка (фиг.25В; дорожки 2 и 3, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 63,4 кДа). His-меченый рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали для FACS-анализа (фиг.25С).
Эти эксперименты показывают, что СТ589 присутствует только в части гетерогенной популяции ЕВ (как это имеет обычно место для хламидиальных препаратов). Там, где он присутствует, он является экспонированным на поверхности и иммунодоступным белком. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 26
СТ597 (SEQ ID NO:179 и SEQ ID NO:180) экспрессировали в Е. coli. Рекомбинантный продукт очищали как в виде GST-меченого слитого белка (фиг.26А; дорожки 5 и 6, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 36,0 кДа), так и в виде His-меченого слитого белка (фиг.26В; дорожки 2, 3 и 4, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 10,3 кДа).
Пример 27
СТ623 (SEQ ID NO:163 и SEQ ID NO:164) экспрессировали в Е. coli. Рекомбинантный продукт очищали как в виде GST-меченого слитого белка (фиг.27А; дорожки 3 и 4, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 71,8 кДа), так и в виде His-меченого слитого белка (фиг.27В; дорожки 2, 3 и 4, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 45,8 кДа). Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.27Е; GST-меченый, дорожка 4 (указанная стрелкой); His-меченый, дорожка 13 (указанная стрелкой) и для FACS-анализа (фиг.27С; GST-меченый: величина К-С 15,89; фиг.270: His-меченый: величина К-С 20,27).
Эти эксперименты показывают, что СТ623 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 28
СТ700 (SEQ ID NO:261 и SEQ ID NO:262) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде GST-меченого слитого белка (фиг.28А; дорожки 5, 6 и 7, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 73,7 кДа). Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали для FACS-анализа (фиг.28В; величина К-С 8,72).
Эти эксперименты показывают, что СТ700 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 29
СТ761 (SEQ ID NO:217 и SEQ ID N0:218) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде GST-меченого слитого белка (фиг.29А; дорожки 6 и 7, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 63,9 кДа). Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали для FACS-анализа (фиг.29В; величина К-С 11,45).
Эти эксперименты показывают, что СТ761 является экспонированным на поверхности и иммуно доступным белком и что он является полезным иммуногеном. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 30
СТ415 (SEQ ID NO:117 и SEQ ID NO:118) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде GST-меченого слитого белка (фиг.30; дорожки 3 и 4, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 55,4 кДа).
Пример 31
СТ454 (SEQ ID NO:253 и SEQ ID NO:254) экспрессировали в E. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка (фиг.31; дорожки 2 и 3, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 56,2 кДа).
Пример 32
СТ467 (SEQ ID NO:129 и SEQ ID NO:130) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде GST-меченого слитого белка (фиг.32; дорожки 3 и 4, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 65,6 кДа).
Пример 33
СТ551 (SEQ ID NO:257 и SEQ ID NO:258) экспрессировали в Е. coli. Рекомбинантный продукт очищали как в виде His-меченого слитого белка (фиг.33А; дорожки 5, 6 и 7, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 34,1 кДа), так и в виде GST-меченого слитого белка (фиг.33В; дорожки 4 и 5, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 60,1 кДа).
Пример 34
СТ567 (SEQ ID NO:195 и SEQ ID NO:196) экспрессировали в Е. coli. Рекомбинантный продукт очищали как в виде GST-меченого слитого белка (фиг.34А; дорожки 8 и 9, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 44,0 кДа), так и в виде His-меченого слитого белка (фиг.34В; дорожки 7 и 8, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 18,3 кДа).
Пример 35
СТ569 (SEQ ID NO:193 и SEQ ID NO:194) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка (фиг.35А; дорожки 2, 3 и 4, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 11,2 кДа). Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.35В; дорожки 8 и 9, указанные стрелкой).
Пример 36
СТ647 (SEQ ID NO:169 и SEQ ID NO:170) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде GST-меченого слитого белка (фиг.36; дорожки 6 и 7, хроматографические фракции 1 и 2, ожидаемая молекулярная масса 45,7 кДа).
Пример 37
СТ600 (SEQ ID NO:173 и SEQ ID NO:174) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка (фиг.37А; дорожки 5, 6 и 7, хроматографические фракции 1, 2 и 3, ожидаемая молекулярная масса 19,5 кДа). Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.37В; дорожки 10 и 11, указанные стрелками) и для FACS-анализа (фиг.37С, величина К-С 10,46).
Эти эксперименты показывают, что СТ600 является экспонированным на поверхности и иммунодоступным белком и что он является полезным иммунотелом. Эти свойства не являются очевидными только из последовательности этого белка.
Пример 38
СТ279 (SEQ ID NO:247 и SEQ ID NO:248) экспрессировали в Е. coli. Рекомбинантный продукт очищали как в виде GST-меченого слитого белка, так и в виде His-меченого слитого белка. Рекомбинантный His-меченый белок и рекомбинантный GST-меченый белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блотах (фиг.38А; His-меченый: дорожка 5 (указанная стрелкой); фиг.38В: GST-меченый: дорожки 12 и 13 (указанные стрелкой)).
Пример 39
СТ560 (SEQ ID NO:259 и SEQ ID NO:260) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка. Рекомбинантный His-меченый белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.39; дорожки 6 и 7 (указанные стрелкой)).
Пример 40
СТ389 (SEQ ID NO:249 и SEQ ID NO:250) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде GST-меченого слитого белка. Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.40; дорожки 16 и 17 (указанные стрелкой)).
Пример 41
СТ456 (SEQ ID NO:255 и SEQ ID NO:256) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде GST-меченого слитого белка. Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.41; дорожки 2 и 3 (указанные стрелкой)).
Пример 42
СТ622 (SEQ ID NO:161 и SEQ ID NO:162) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка. Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.42; дорожка 9 (указанная стрелкой)).
Пример 43
СТ759 (SEQ ID NO:213 и SEQ ID NO:214) экспрессировали в Е. coli. Рекомбинантный продукт очищали в виде His-меченого слитого белка. Этот рекомбинантный белок использовали для иммунизации мышей, сыворотки которых использовали в Вестерн-блоте (фиг.43; дорожки 8 и 9 (указанные стрелкой)).
Пример 44
Анализы нейтрализации in vitro, которые показывают способность сывороток, полученных из мышей, которые были иммунизированы различными рекомбинантными белками данного изобретения, ингибировать инфективность С. trachomatis для эукариотических клеток в культуре, выполняли с использованием клеток LLCMK2 (эпителиальных клеток почки макака резус). Серийные четырехкратные разведения мышиных поликлональных антител готовили в SP (сахарозо-фосфатном) буфере. Мышиные антисыворотки к целым ЕВ использовали в качестве положительного контроля, а сыворотки до иммунизации и SP-буфер (отдельно) использовали в качестве отрицательных контролей. Очищенные ЕВ из С. trachomatis (серовара D) разводили в SP-буфере таким образом, что разведения содержали 3х105 IFU/мл, и 10 мкл этой суспензии добавляли к каждому разведению сыворотки в конечном объеме 100 мкл. Взаимодействию антитело-ЕВ давали длиться в течение 30 минут при 37°С. Затем 100 мкл реакционной смеси из каждой пробы добавляли на верхнюю поверхность промытых ФСБ монослоев клеток LLCMK2 в 96-луночном микротитрационном планшете и центрифугировали при 805xg в течение 1 часа при 37°С. Все сыворотки и контроли испытывали в двух повторностях. После удаления избытка инокулята эти клетки ополаскивали один раз ФСБ, пополняли 200 мкл среды DMEM, дополненной 25% ФТС и 1 мкг/мл циклогексимида, и инкубировали при 37°С в течение 48 часов. Эти клетки фиксировали метанолом и типичные цитоплазматические включения, генерированные происходящей внутриклеточной хламидиальной инфекцией, окрашивали моноклональным антителом против Chlamydia, конъюгированным с флуоресцеином (Meridian Diagnostics). При адекватных разведениях и отношениях ЕВ: клетка-хозяин количество наблюдаемых включений считается равным количеству жизнеспособных хламидий, которые были первоначально способными к успешному установлению инфекции клетки-хозяина (названному образующими включения единицами, IFU). Меченые флуоросцеином включения считали в четырех полях зрения микроскопа на одну лунку при увеличении 40х. Ингибирование инфективности, вызываемое взаимодействием с антителами, рассчитывали в виде процентного уменьшения среднего IFU по сравнению с SP-контролем (только буфер). В соответствии с обычной практикой, эти сыворотки отмечали как "нейтрализующие", если они могли вызывать 50%-ное или большее уменьшение инфективности, однако, с учетом сложности полного анализа скрининга (например, изменения клетки-хозяина или хламидиального изолята, или варьирования в условиях окружающей среды в приготовлении инфекционного инокулята), сыворотки, способные ингибировать инфективность ЕВ до более низкой степени, должны также рассматриваться в качестве вакцин-кандидатов для дополнительных исследований. Фиг.44А показывает пример результата, полученного из положительной в отношении нейтрализации сыворотки, тогда как фиг.44 В показывает пример результата, полученного из отрицательной в отношении нейтрализации сыворотки.
Анализы нейтрализации in vitro проводили с использованием сывороток, полученных из мышей, иммунизированных рекомбинантными белками, упомянутыми в примере 1-10, 13-22, 24-26 и 29-37. Эти результаты представлены в таблице II. Эти результаты показывают, что СТ045, СТ242, СТ381, СТ396, СТ398, СТ467, СТ547, СТ587 и СТ681 являются, все, особенно хорошими кандидатами для вакцин, для предупреждения инфицирования С. trachomatis. Эти свойства не являются очевидными только из этих последовательностей.
В дополнительных экспериментах сыворотки, индуцированные против С. trachomatis, испытывали против ЕВ С. pneumoniae на перекрестно-нейтрализующую активность. Эта процедура была такой же, как описанная выше, но очищенные ЕВ из С. pneumonias разводили в SP-буфере таким образом, что они содержали 3х106 IFU/мл, и 10 мкл этой суспензии добавляли к каждому разведению сыворотки в конечном объеме 100 мкл. Сыворотки, полученные с использованием СТ242 и СТ467, были способны перекрестно нейтрализовать ЕВ С. pneumoniae.
Должно быть понятно, что данное изобретение было описано только в качестве примера и что могут быть произведены модификации без отклонения от идеи и объема данного изобретения.
ССЫЛКИ (содержания которых включены здесь в полном объеме в качестве ссылок)
{1} Raulston (1995) Mol Microbiol 15:607-616.
{2} Everett (2000) Vet Microbiol 75:109-126.
{3} Kalman et al. (1999) Nature Genetics 21:385-389.
{4} Read et al. (2000) Nucleic Acids Res 28:1397-1406.
(5) Shirai et al. (2000) Nucleic Acids Res 28:2311-2314.
{6} Stephens et al. (1998) Science 282:754-759.
{7} International patent application WO 99/27105.
{8} International patent application WO 00/27994.
{9} International patent application WO 99/28475.
{10} Ward (1995) Apms. 103:769-96.
{11} Moulder (1991) MicrobiolRev 55(1); 143-190.
{12} Comanducci et al. (1994) Infect Immun 62(12): 5491-5492.
{13) ЕР-А-0499681.
{14} International patent application WO 95/28487.
{15} Murdin et al. (1993) Infect Immun 61:4406-4414.
{16} Cerrone et al. (1991) Infect Immun 59(1):79-90.
{17} Raulston et al. (1993) J. Biol. Chem. 268:23139-23147.
{18} International patent application WO 02/02606.


| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА ВЕЗИКУЛ НАРУЖНЫХ МЕМБРАН (OMV), СОДЕРЖАЩАЯ БЕЛКИ НАРУЖНОЙ МЕБРАНЫ N.Meningitidis СЕРОЛОГИЧЕСКОЙ ГРУППЫ В | 2001 |
|
RU2279889C2 |
| АНТИГЕНЫ НЕЙССЕРИЙ | 1998 |
|
RU2347813C2 |
| АНТИГЕННЫЕ ПЕПТИДЫ NEISSERIA | 2000 |
|
RU2281956C2 |
| БЕЛОК, ПОЛУЧЕННЫЙ ИЗ NEISSERIA MENINGITIDIS, ПРОЯВЛЯЮЩИЙ СВОЙСТВА АНТИГЕНА, АНТИТЕЛО, ФРАГМЕНТ НУКЛЕИНОВОЙ КИСЛОТЫ (ВАРИАНТЫ) И СОДЕРЖАЩАЯ ИХ КОМПОЗИЦИЯ | 1999 |
|
RU2233331C2 |
| АНТИГЕННЫЕ ПЕПТИДЫ NEISSERIA | 2000 |
|
RU2284332C2 |
| ПРОИЗВОДСТВО БЕЛКОВ | 2005 |
|
RU2429243C2 |
| БЕЛОК, ПОЛУЧЕННЫЙ ИЗ NEISSERIA MENINGITIDIS, ПРОЯВЛЯЮЩИЙ СВОЙСТВА АНТИГЕНА, АНТИТЕЛО, НУКЛЕИНОВАЯ КИСЛОТА (ВАРИАНТЫ) И СОДЕРЖАЩАЯ ИХ КОМПОЗИЦИЯ | 2000 |
|
RU2233328C2 |
| АНТИГЕНЫ NEISSERIA MENINGITIDIS | 1999 |
|
RU2343159C2 |
| АНТИГЕННЫЕ МЕНИНГОКОККОВЫЕ ПЕПТИДЫ (ВАРИАНТЫ) | 2000 |
|
RU2253678C2 |
| БЕЛОК, СООТВЕТСТВУЮЩИЙ АНТИГЕННОМУ БЕЛКУ NEISSERIA MENINGITIDIS И ОБЛАДАЮЩИЙ ИММУНОГЕННЫМИ СВОЙСТВАМИ (ВАРИАНТЫ), СВЯЗЫВАЮЩЕЕСЯ С НИМ АНТИТЕЛО, НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ (ВАРИАНТЫ) И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2232191C2 |





















































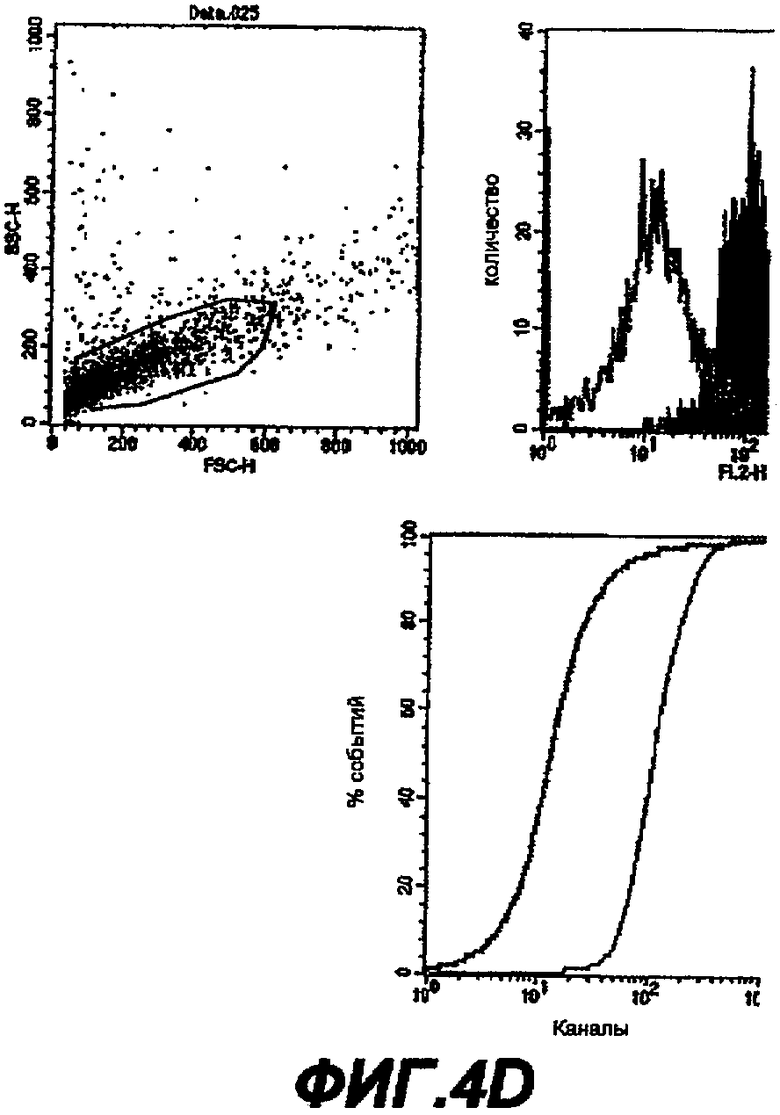
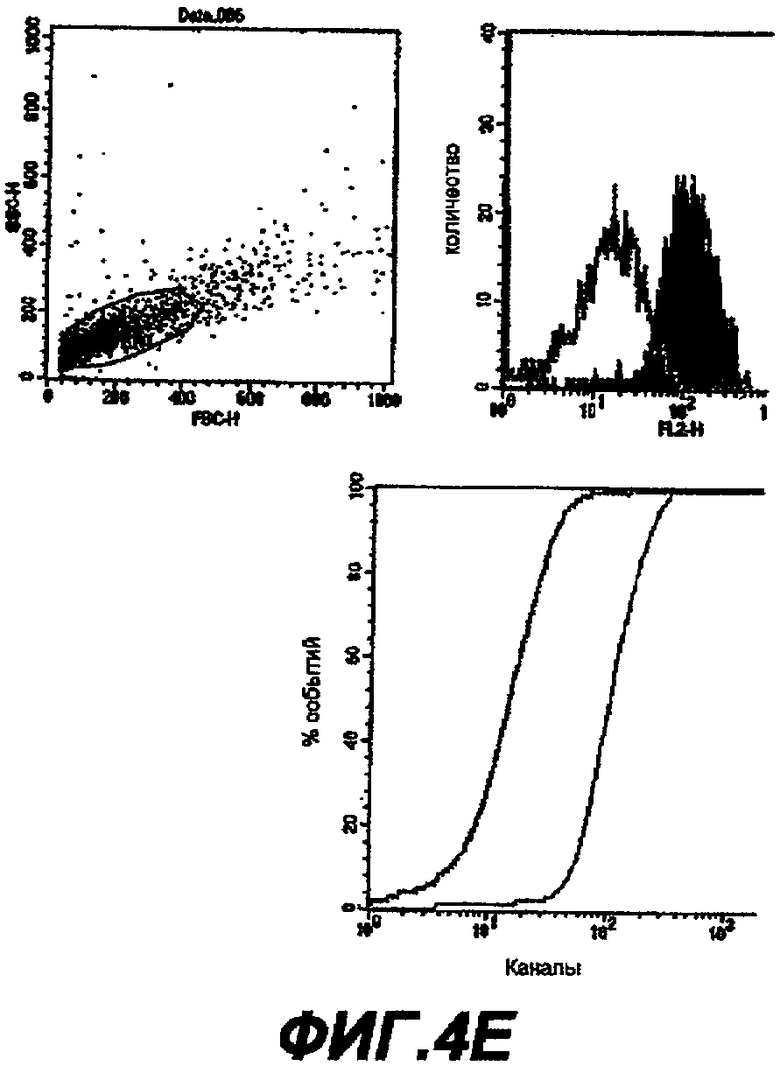
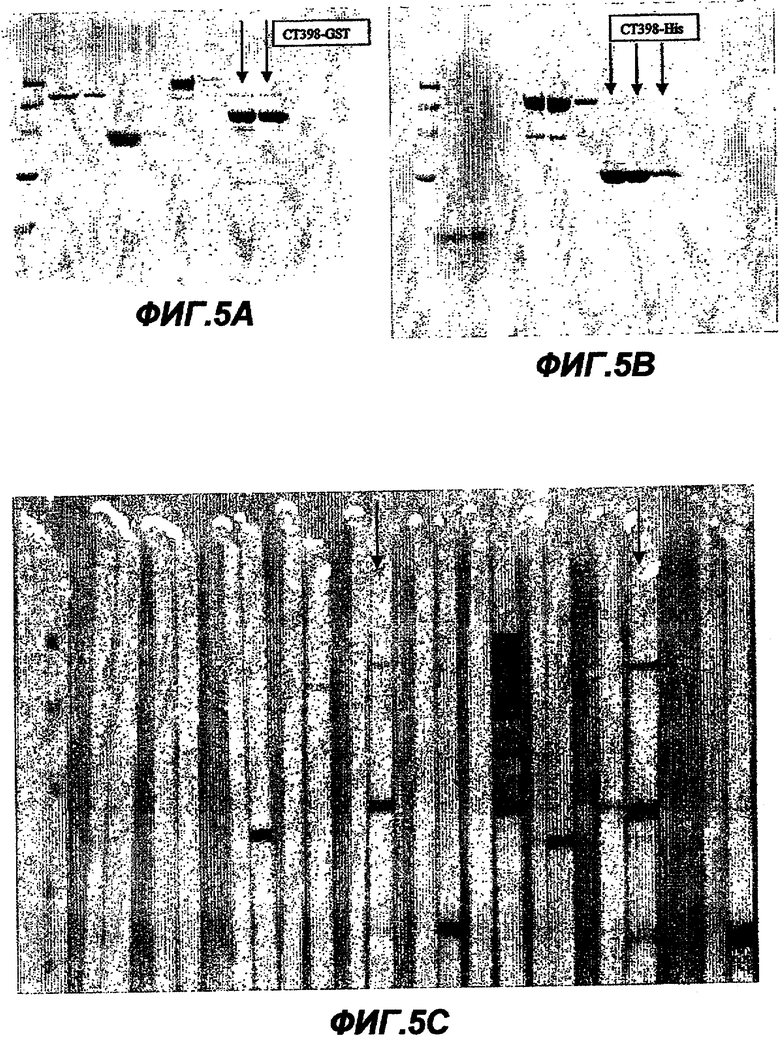
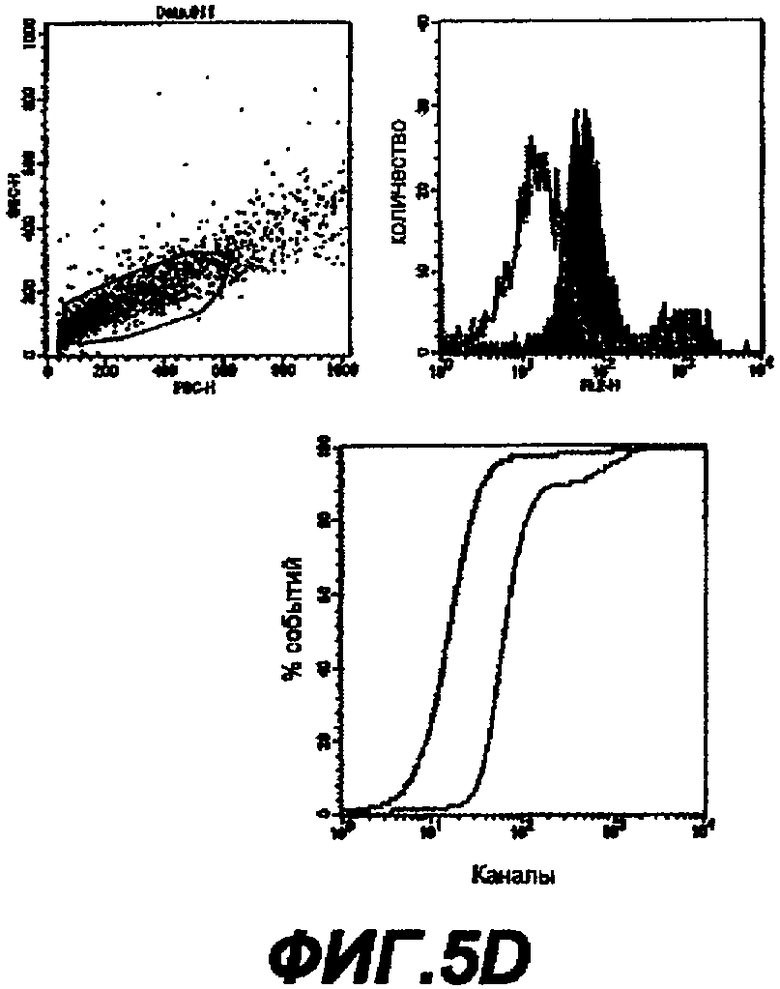
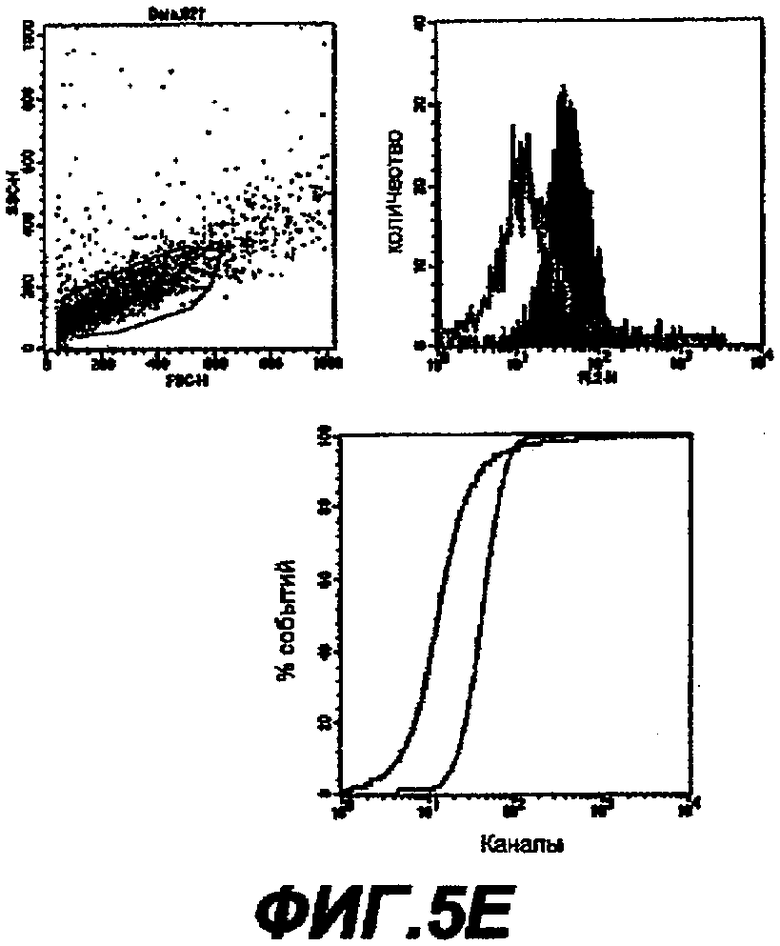
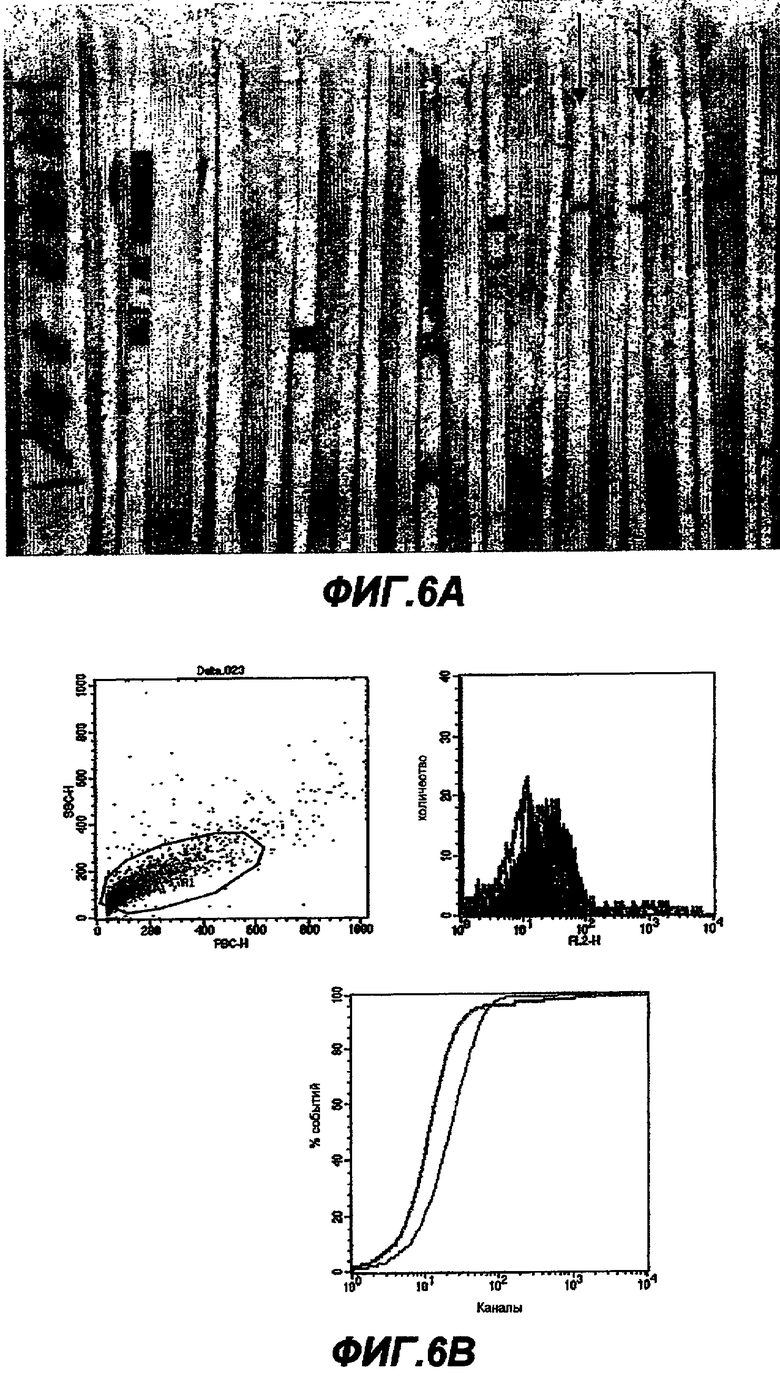


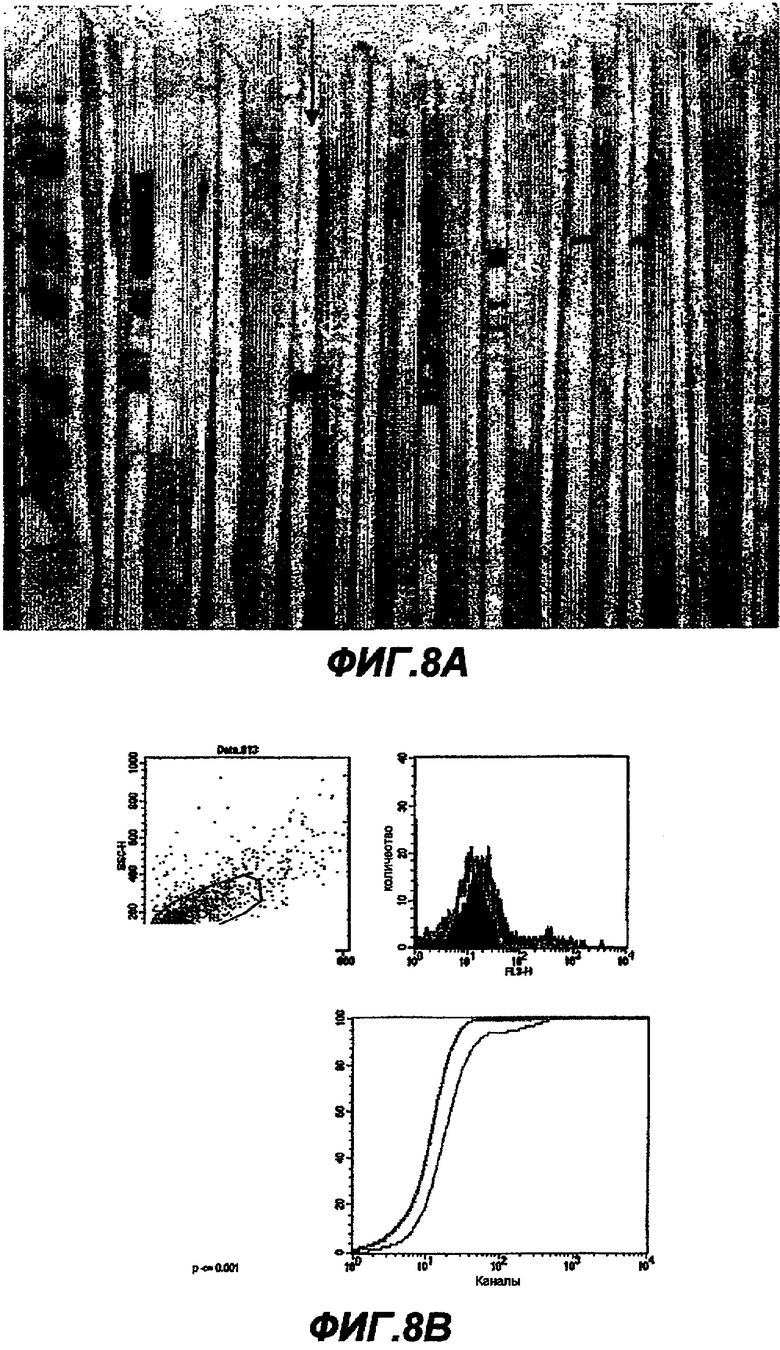
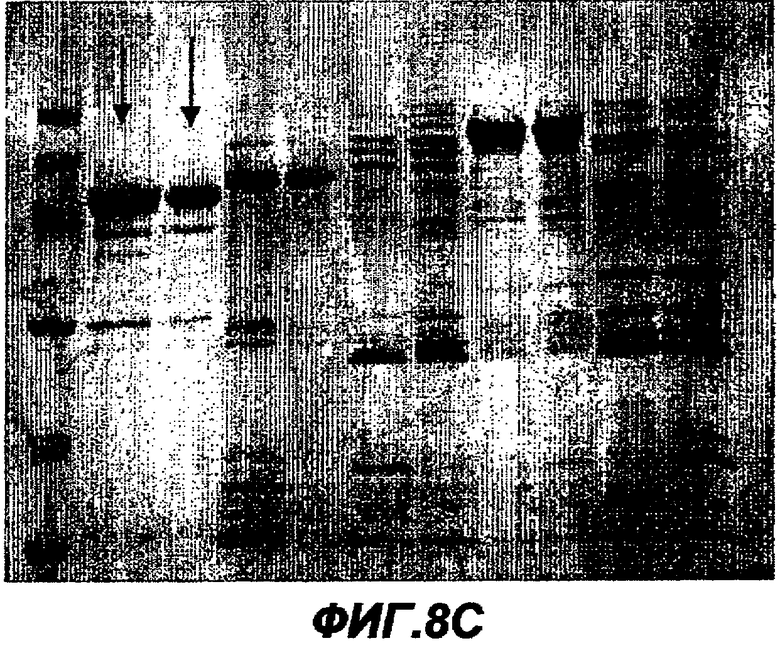
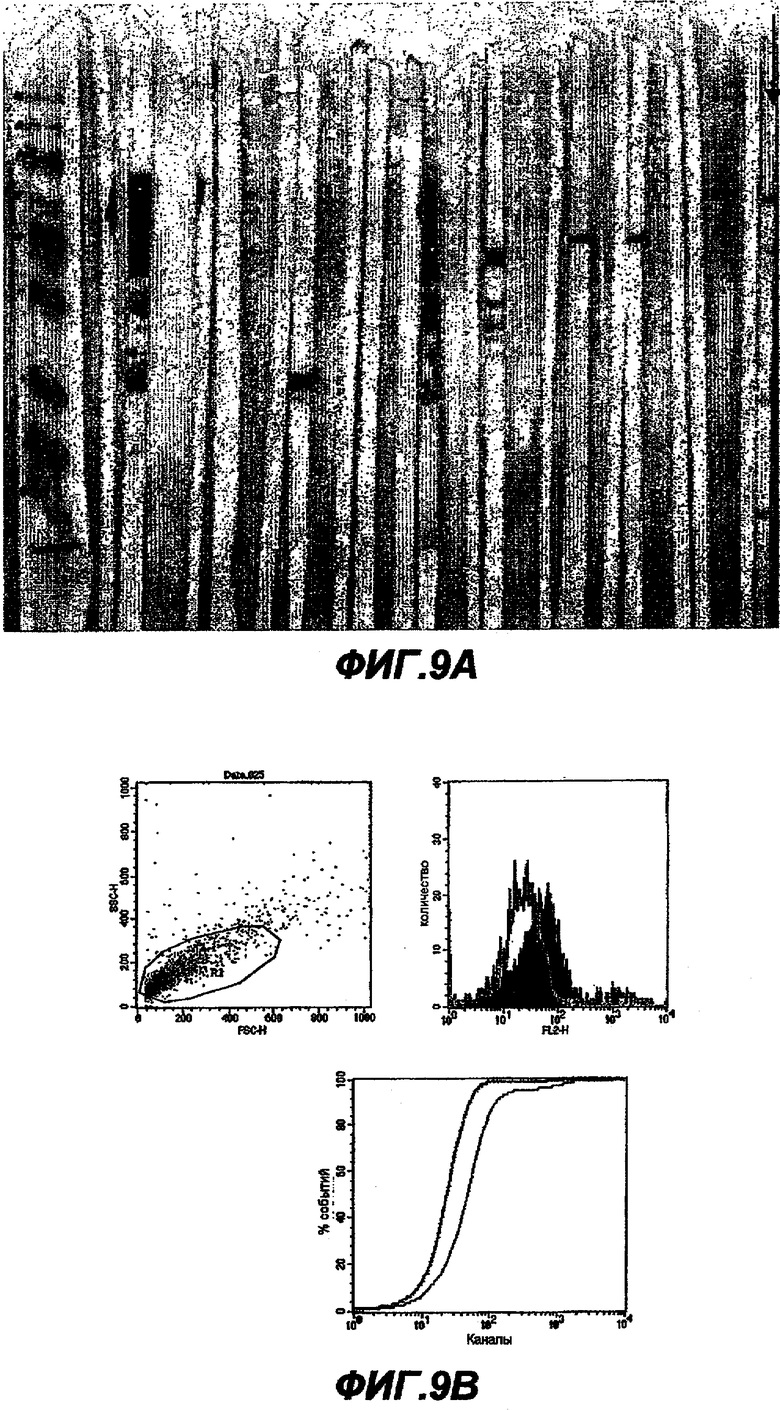
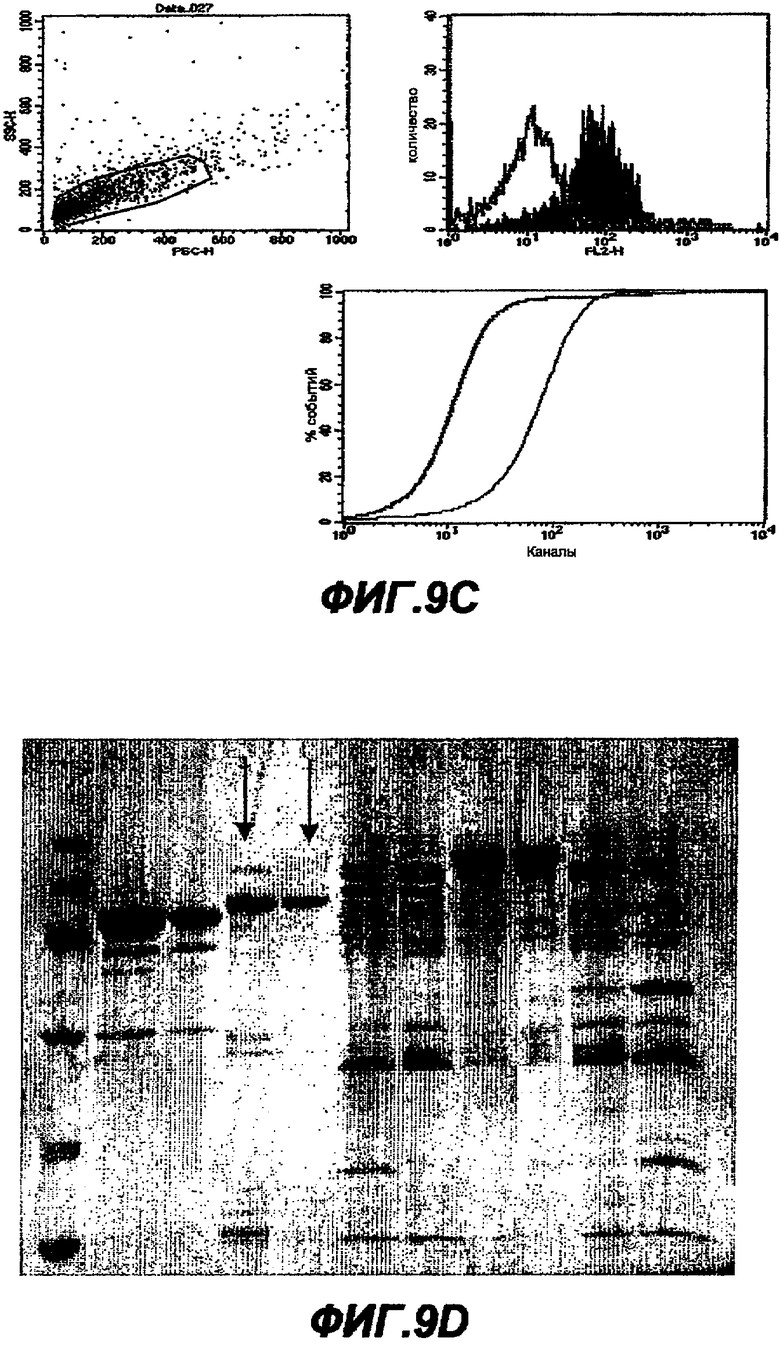
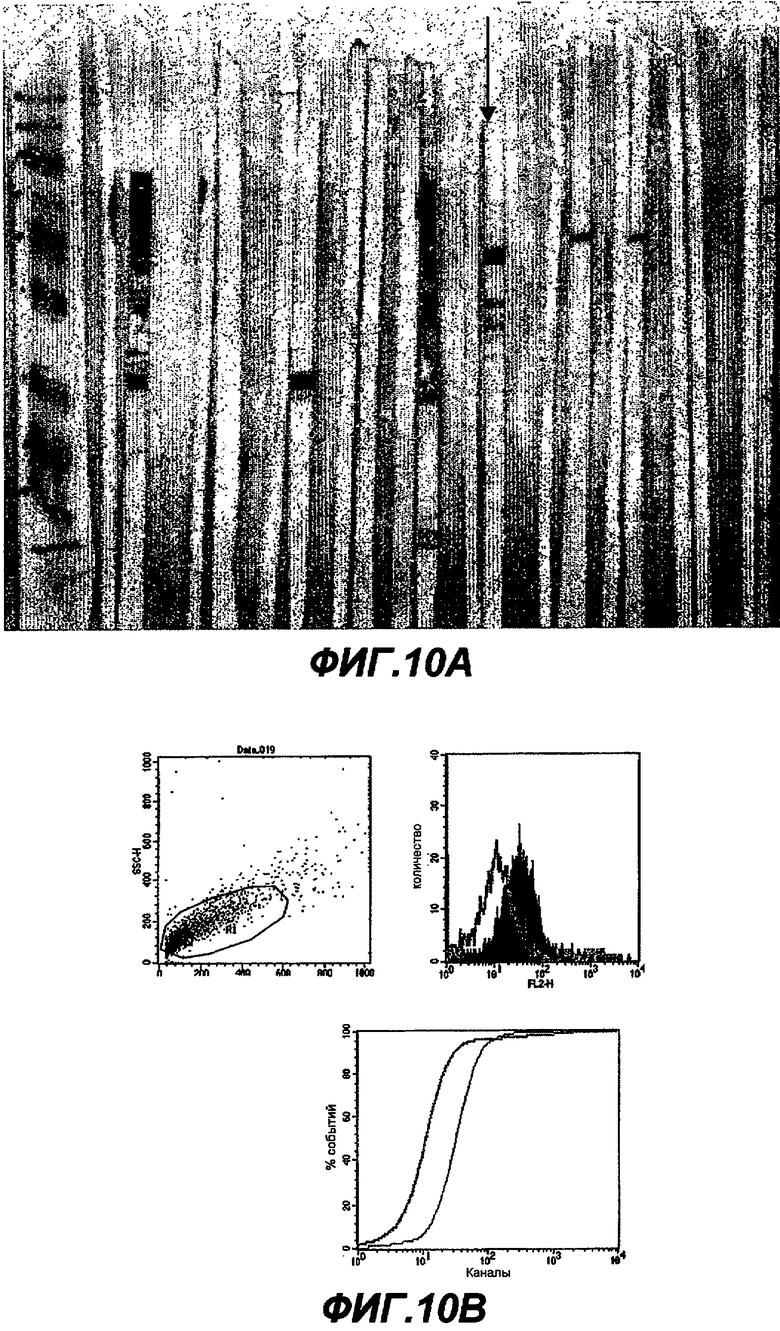
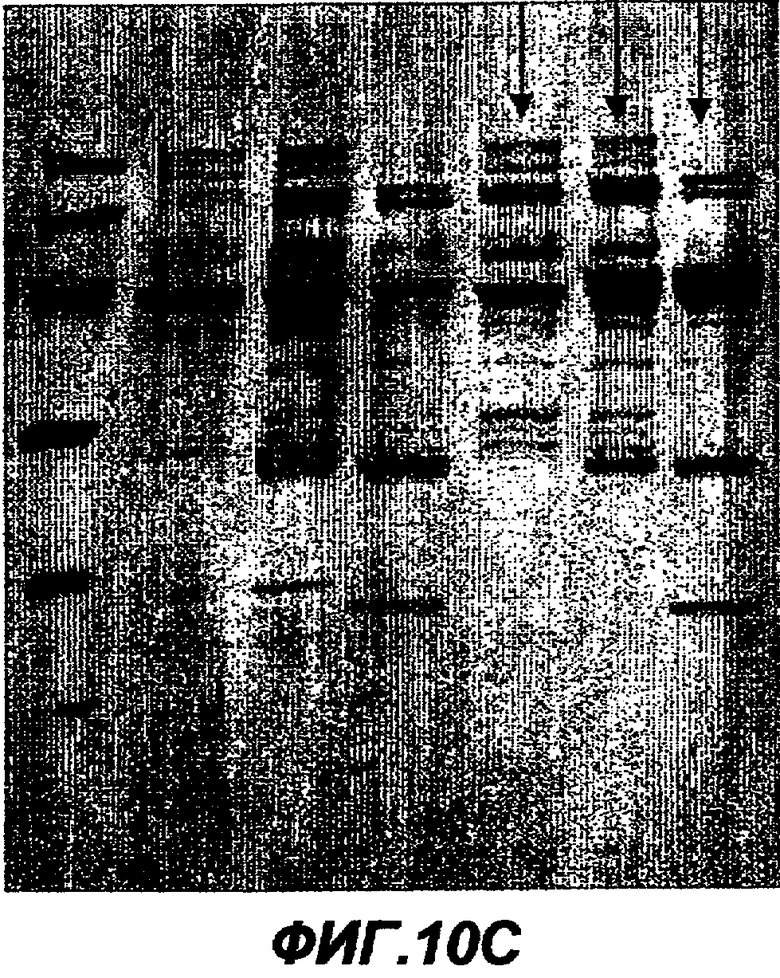



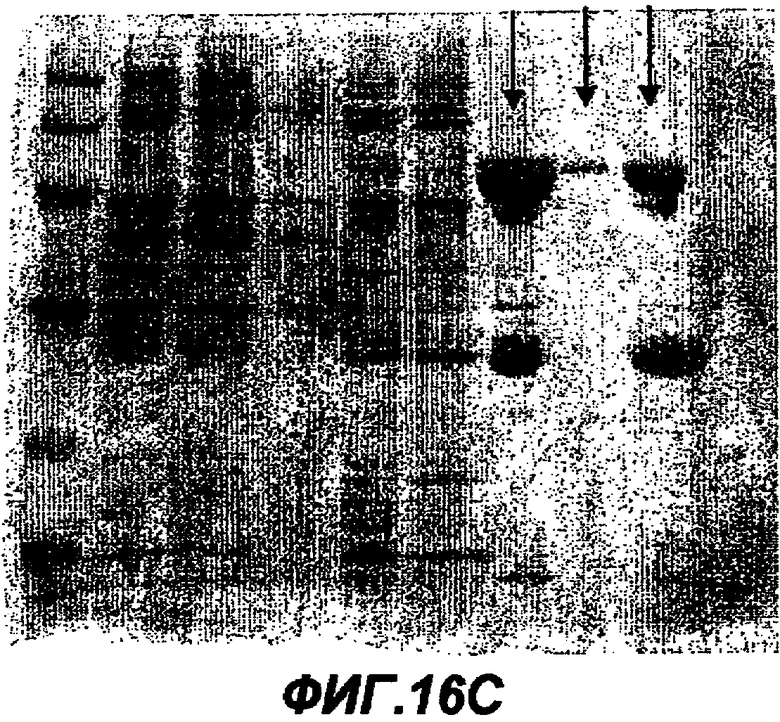
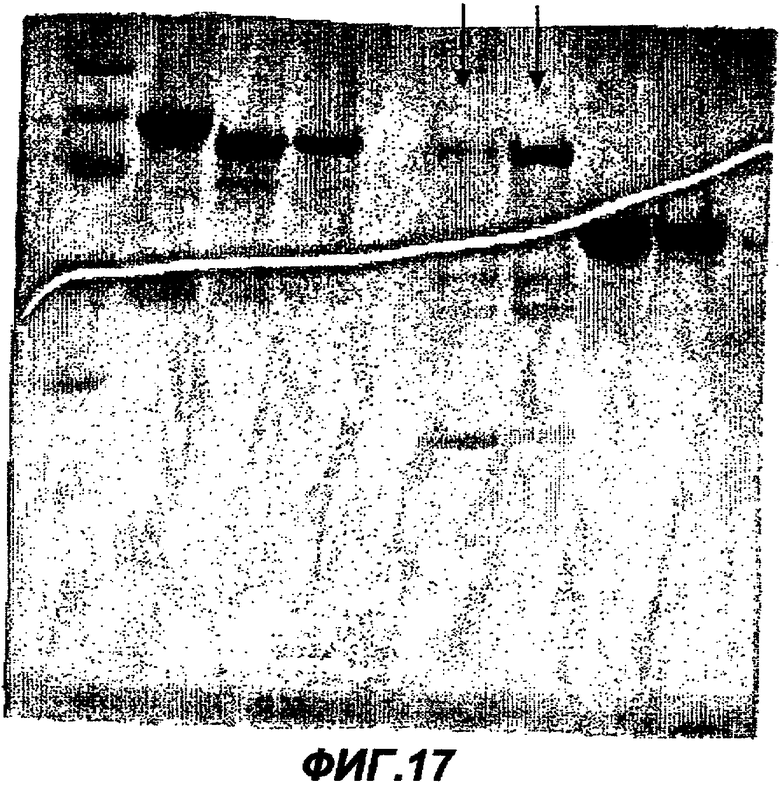
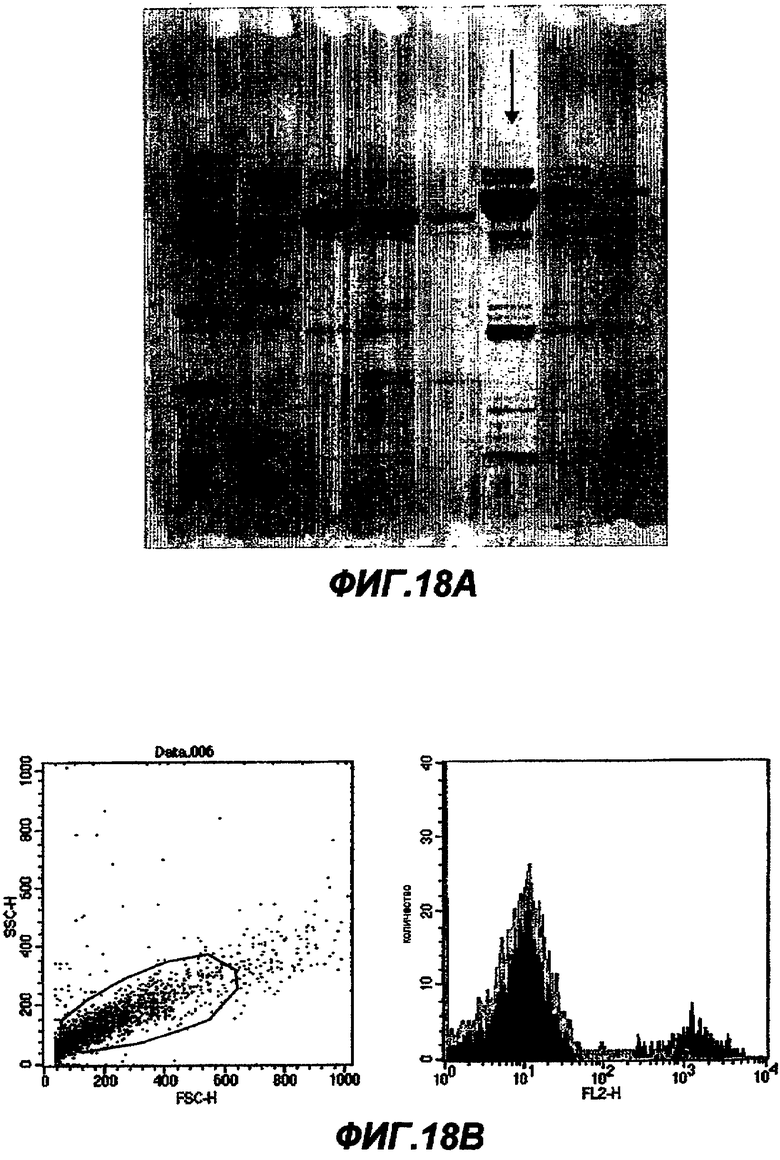
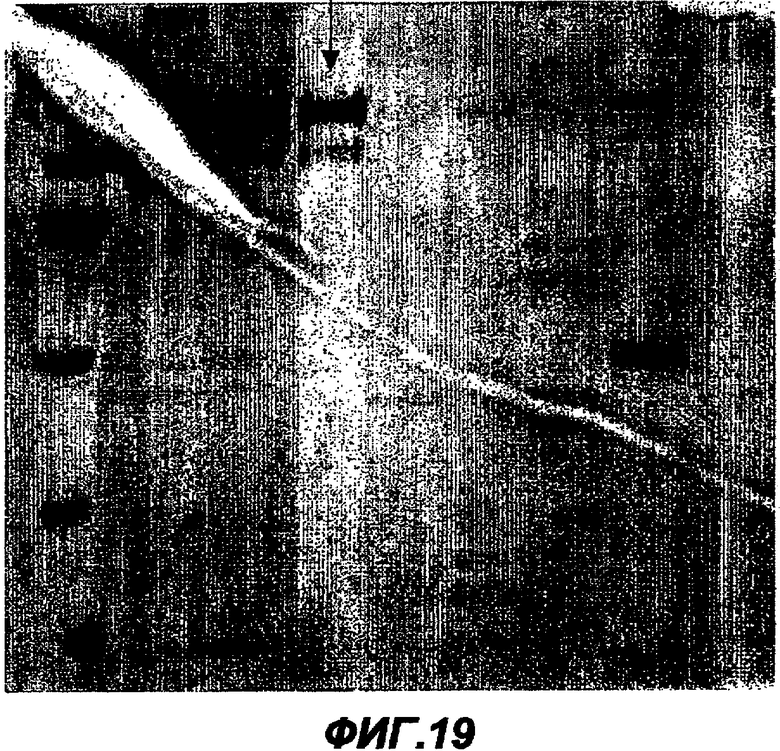






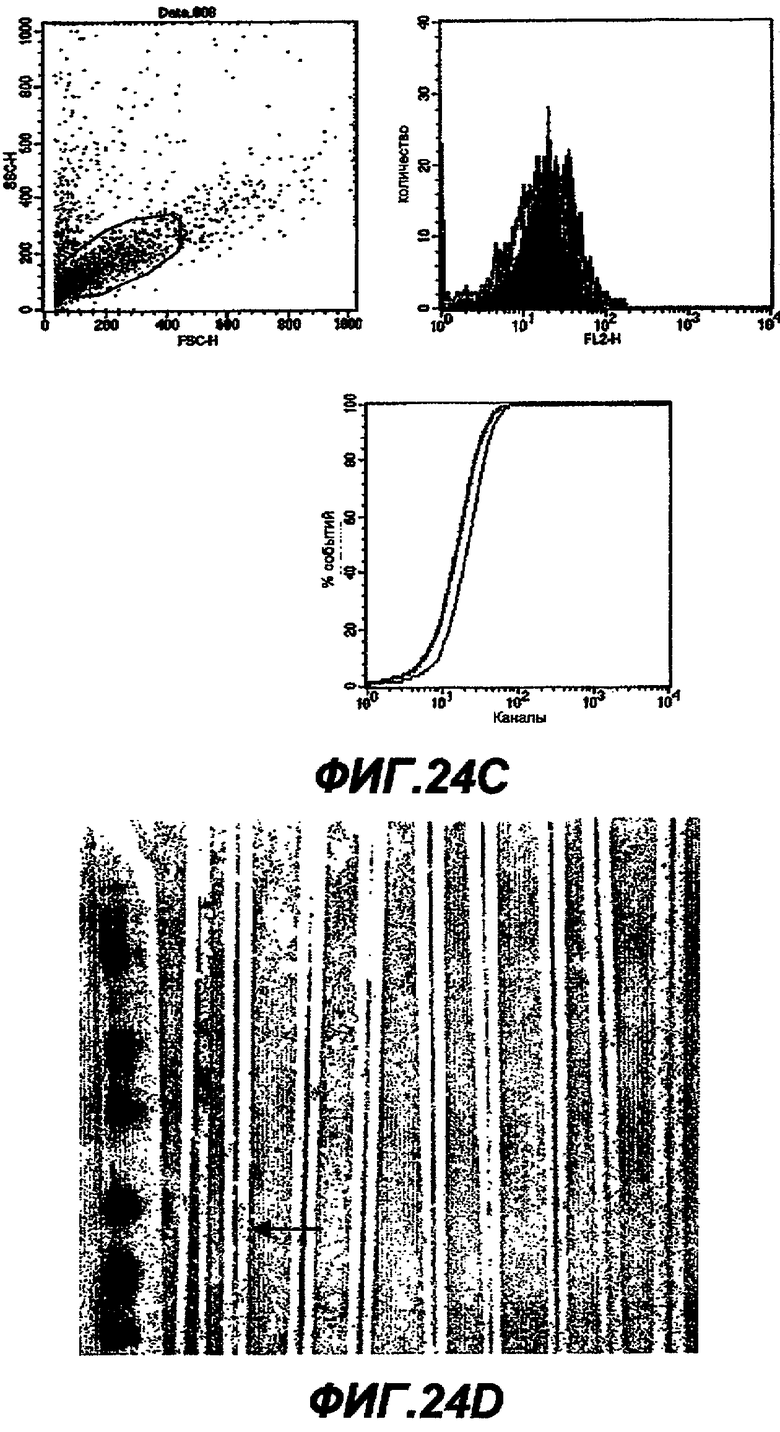



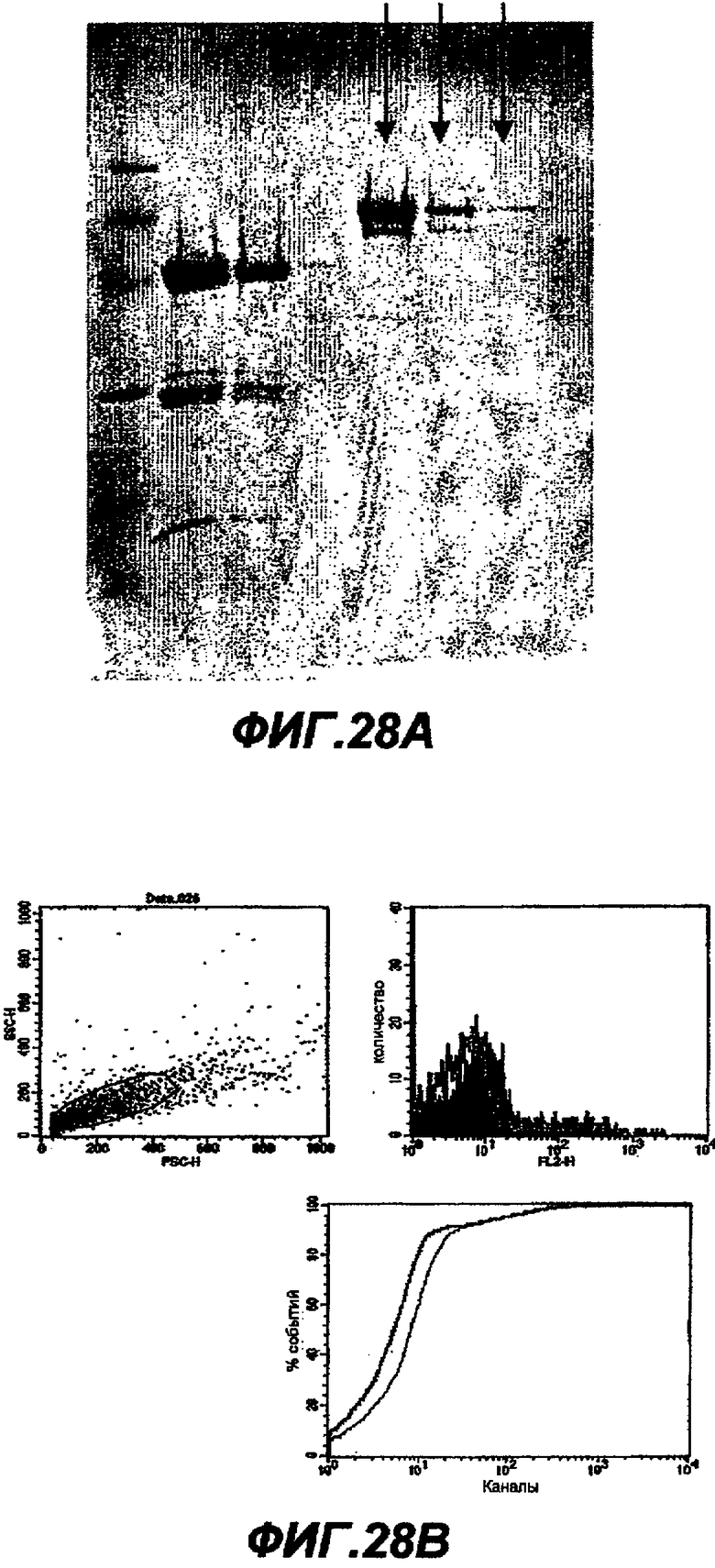
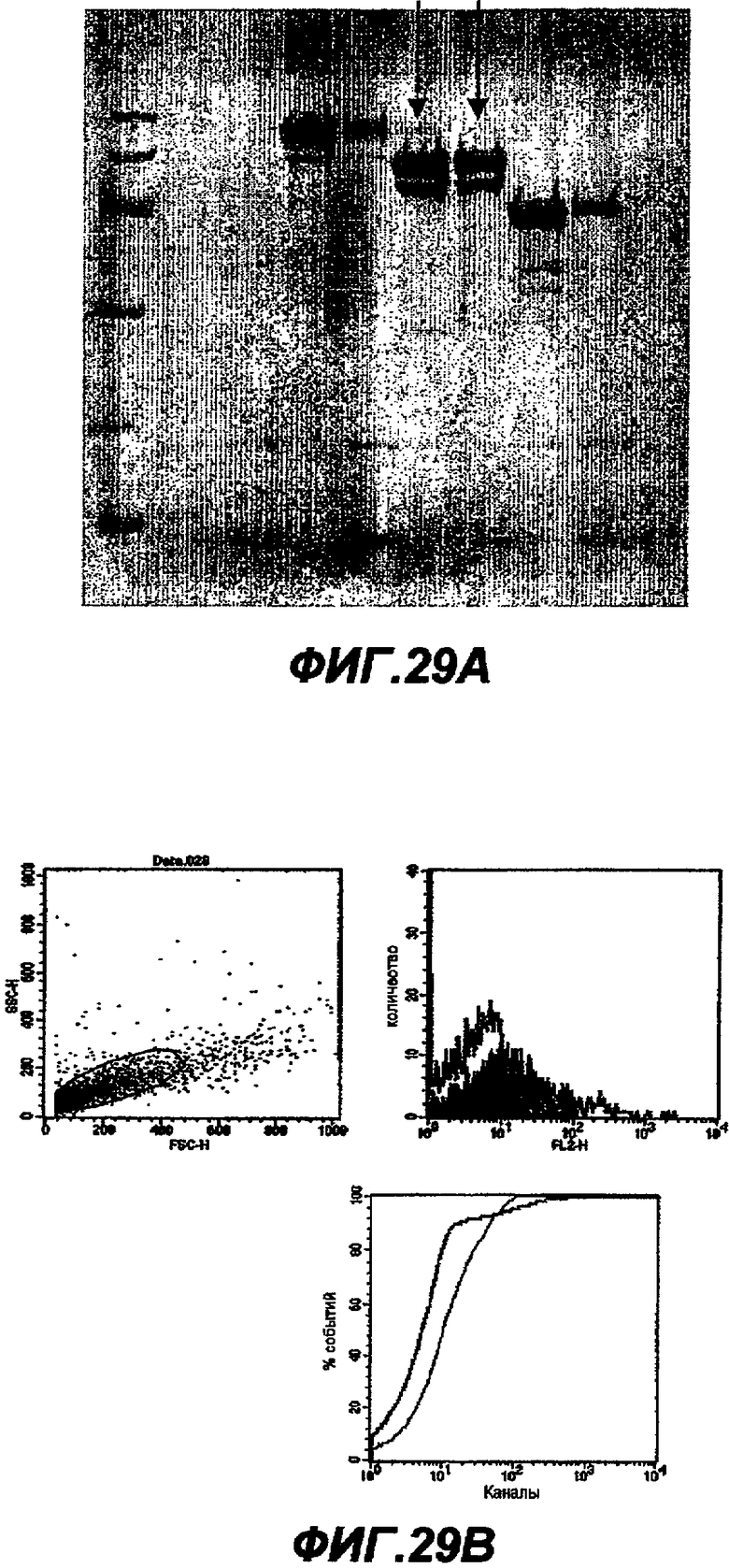

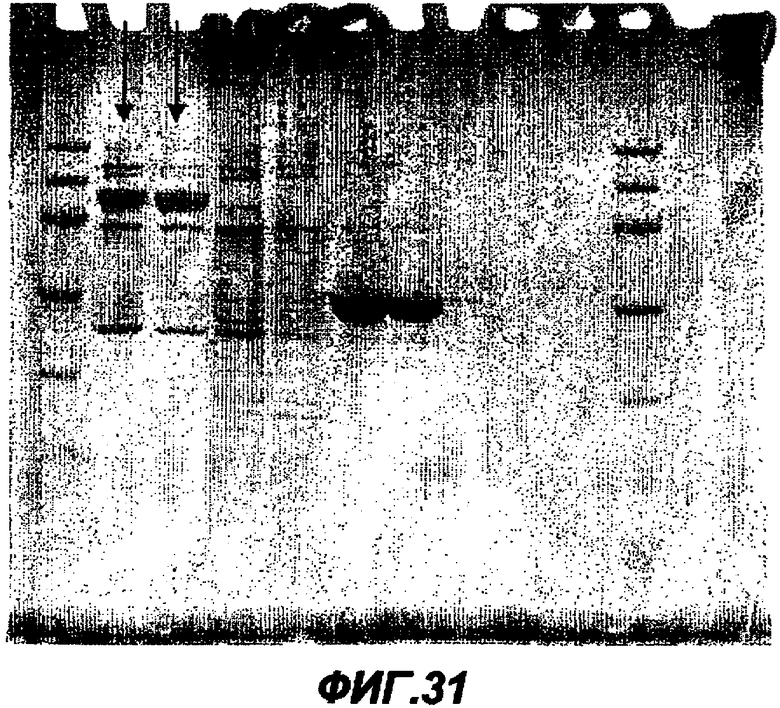
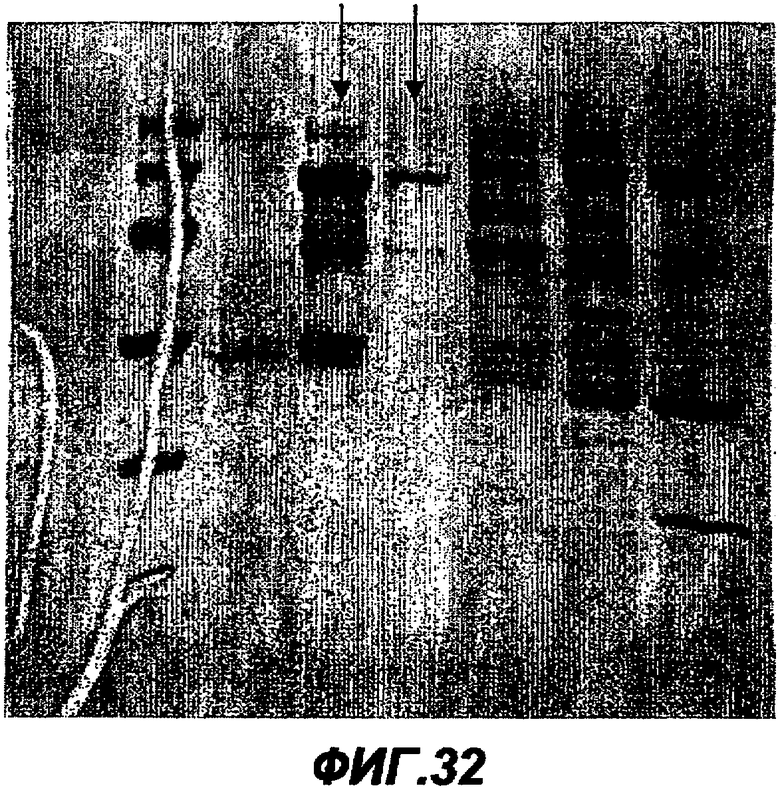
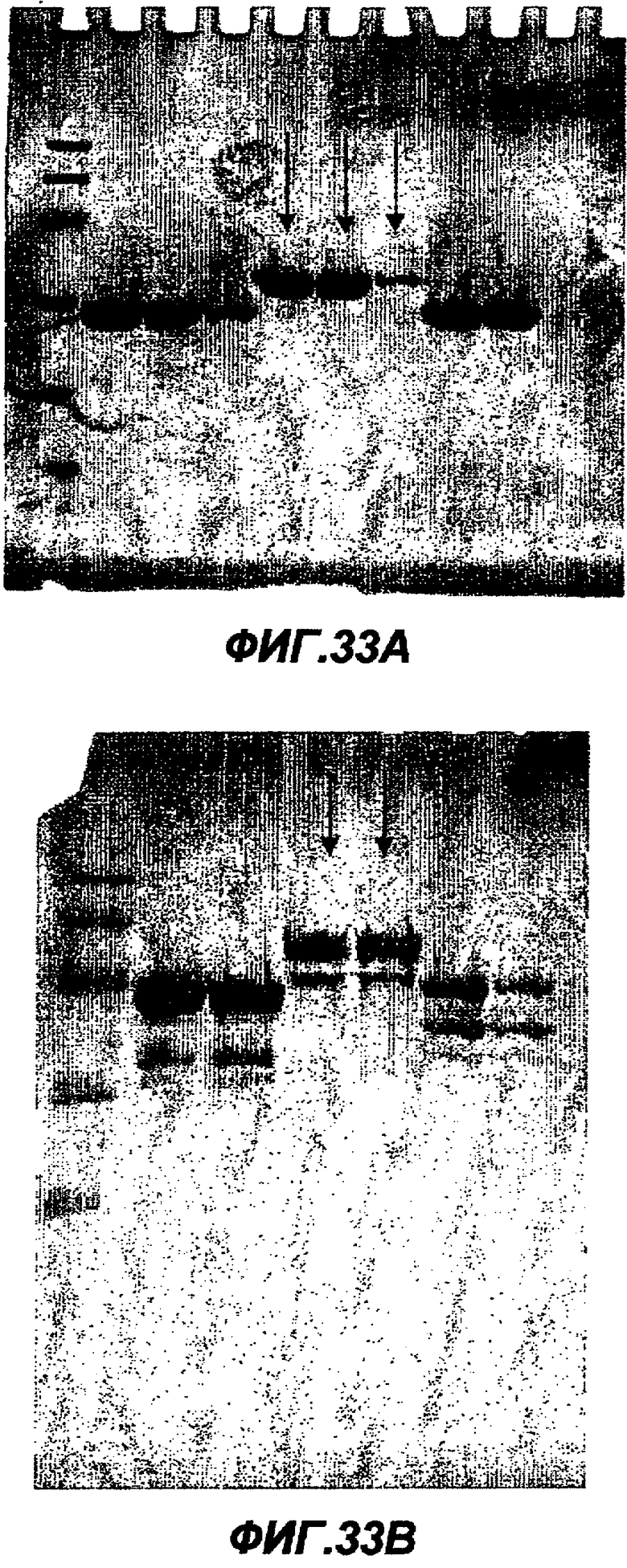
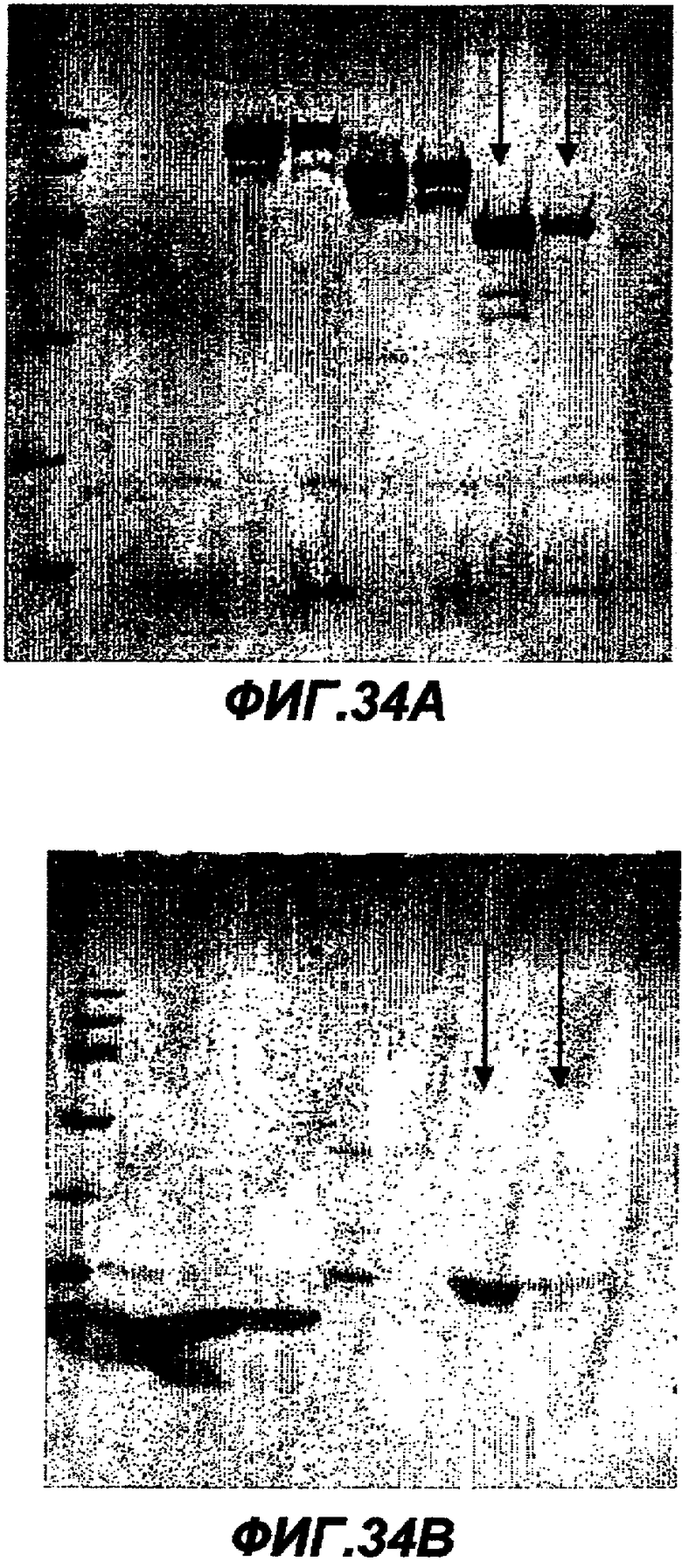



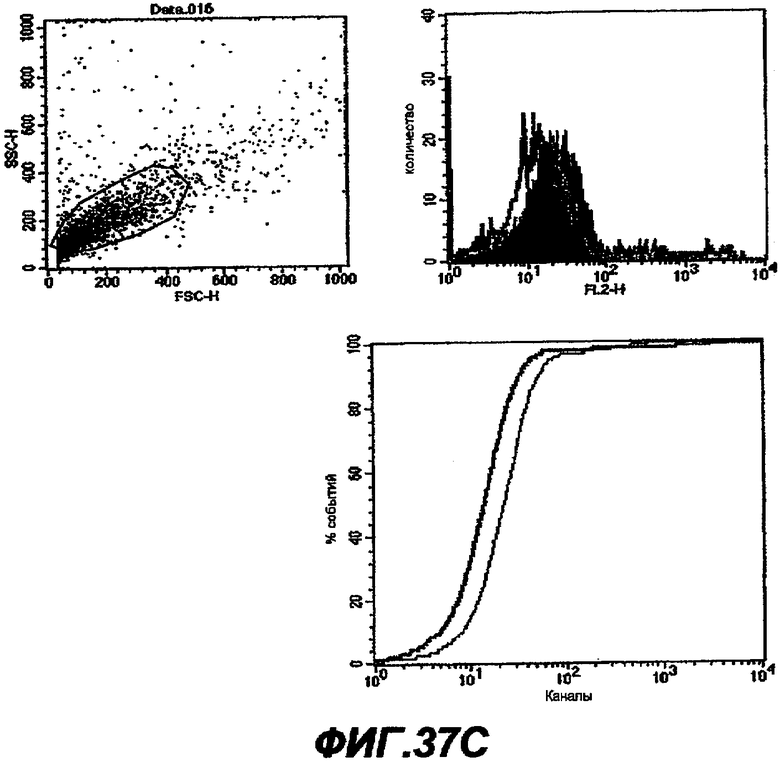




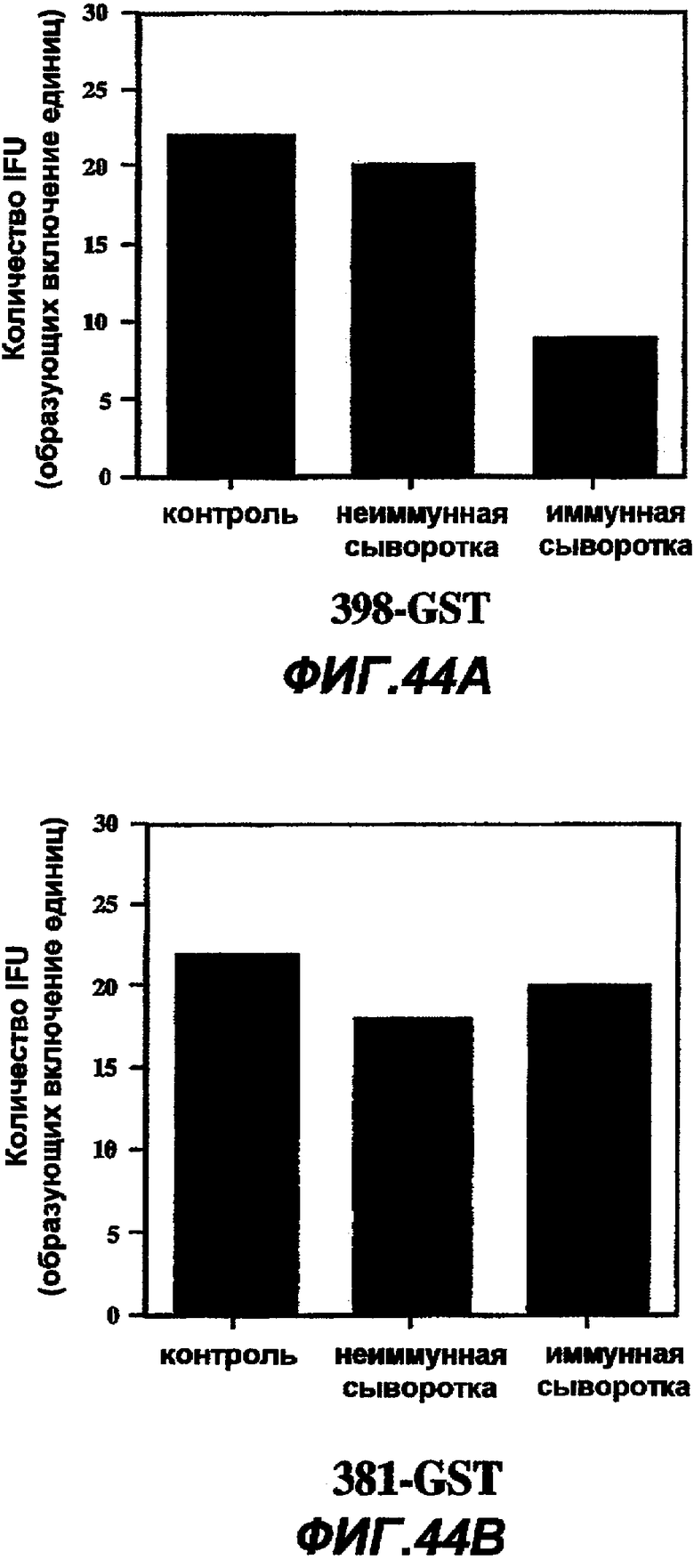
Изобретение относится к лекарственным средствам для профилактики или лечения инфекций, вызванных Chlamydia trachomatis. Указанные лекарственные средства (варианты) состоят из иммуногенного белка или нуклеиновой кислоты, кодирующей соответствующий иммуногенный белок (соответствующие последовательности представлены в списке последовательностей). Лекарственные средства на основе иммуногенного белка или кодирующей его нуклеиновой кислоты используют в составе иммуногенной композиции для индукции гуморального иммунитета, которая применяется в качестве фармацевтического средства. Изобретение охватывает способ нейтрализации инфективности указанных бактерий у пациента, а также способ иммунизации пациента против инфекции, вызванной Chlamydia trachomatis, с использованием иммуногенных композиций. Использование идентифицированных по изобретению антигенов и иммуногенов обеспечивает получение более эффективных вакцинных и лечебно-диагностических препаратов. 6 н. и 1 з.п. ф-лы, 106 ил., 2 табл.
| Ведущий механизм для врубовой машины | 1932 |
|
SU34483A1 |
| WO 9928475 А, 10.06.1999 | |||
| СПОСОБ ЛЕЧЕНИЯ РЕАКТИВНОГО УРОГЕННОГО АРТРИТА | 1998 |
|
RU2135175C1 |
| СПОСОБ ЛЕЧЕНИЯ УРОГЕНИТАЛЬНОЙ ХЛАМИДИЙНОЙ, УРЕАПЛАЗМЕННОЙ И МИКОПЛАЗМЕННОЙ ИНФЕКЦИИ | 1995 |
|
RU2137483C1 |
Авторы
Даты
2008-08-20—Публикация
2002-12-12—Подача