Данное изобретение относится к применению соединений в качестве фунгицидов.
Публикация WO 95/22532 относится к замещенным фенилтриазолинонам, заявленным в качестве гербицидов, и в ней, в частности, патентуется соединение формулы А, характеристические данные для которого отсутствуют.
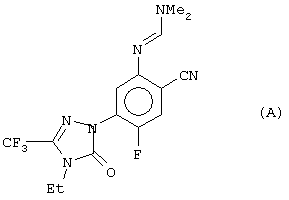
Реферат, заявленная композиция и заявленное применение относятся только к применению таких соединений в качестве гербицидов, и в самом деле описание подтверждает изобретение только данными гербицидной активности. В описании есть предложение, в котором отмечено, что некоторые соединения проявляют фунгицидную активность, хотя данные по фунгицидной активности не приведены. Не указано, какие соединения являются фунгицидами, и нет подтверждения того, что соединение А могло бы служить фунгицидом.
В патенте США 3284289 описывается способ защиты растений от вредных грибков с помощью фениламидинового соединения.
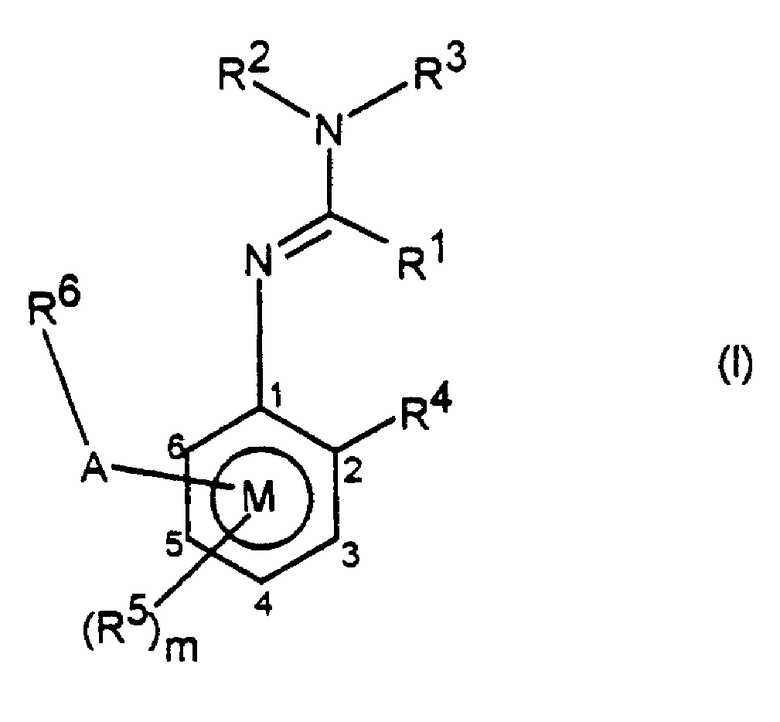
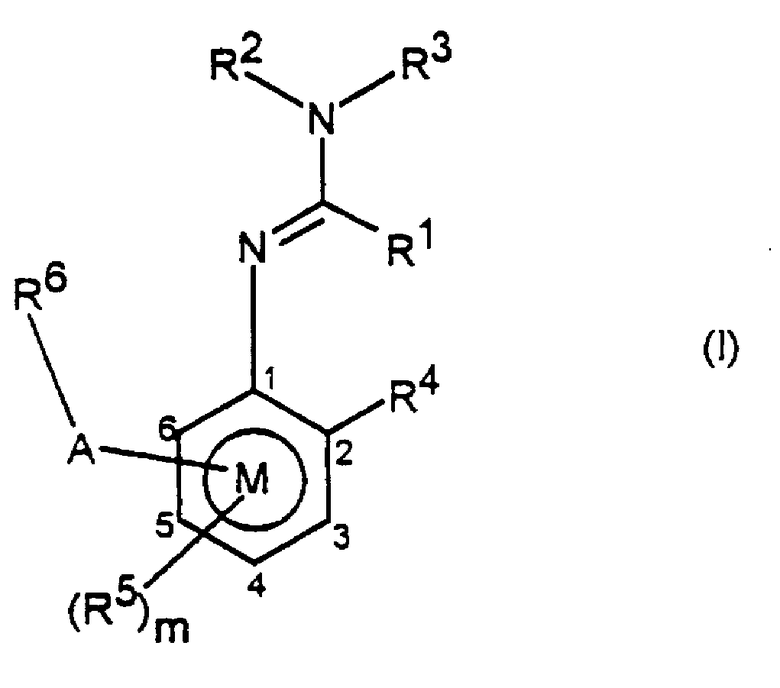
Заявителями данного изобретения было установлено, что некоторые амидины обладают фунгицидной активностью. Таким образом, данное изобретение предоставляет применение соединения общей формулы I и его солей в качестве фунгицидов
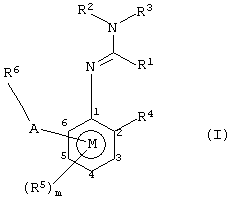
где R1 представляет алкил, алкенил, алкинил, карбоциклил или гетероциклил, каждый из которых может быть замещенным, или водород;
R2 и R3, которые могут быть одинаковыми или различными, представляют собой любую группу, определенную для R1; цианогруппу; ацил; -ORa или -SRa, где Ra представляет алкил, алкенил, алкинил, карбоциклил или гетероциклил, каждый из которых может быть замещенным, или R2 и R3 или R2 и R1 вместе с соединяющими их атомами могут образовывать кольцо, которое может быть замещенным;
R4 представляет алкил, алкенил, алкинил, карбоциклил или гетероциклил, каждый из которых может быть замещенным; гидроксильную группу; меркаптогруппу; азидогруппу; нитрогруппу; галоген; цианогруппу; ацил; необязательно замещенную аминогруппу; цианатогруппу; тиоцианатогруппу; -SFs; -ORa; -SRa или -Si(Ra)3;
m принимает значения от 0 до 3;
когда присутствуют R5, которые могут быть одинаковыми или различными, они принимают значения, определенные для R4;
R6 представляет необязательно замещенный карбо- или гетероциклил и
А представляет прямую связь, -О-, -S(O)n-, -NR9-, -CR7=CR7-, -С≡С-, -A1-, -A1-A1-, -O-(A1)k-O-, -O-(А1)k-, -А3-, -А4-, -А1O-, -A1S(O)n-, -А2-, ОА2-, -NR9A2-, -ОА2-А1-, -ОА2-C(R7)=C(R8)-, -S(O)nA1-, -A1-A4-, -A1-A4-C(R8)=N-N=CR8-, -A1-A4-C(R8)=N-X2-X3-, -А1-А4-А3-, -A1-A4-N(R9)-, -А1-А4-Х-СН2-, -А1-А4-А1-, -А1-А4-СН2Х-, -А1-А4-С (R8)=N-X2-XЗ-X1-, -A1-X-C(R8)=N-, -A1-X-C(R8)=N-N=CR8, -А1-Х-С (R8)=N-N(R9) -, -А1-Х-А2-Х1-, -А1-О-А3-, -A1-O-C(R7)=C(R8)-, -A1-O-N(R9)-A2-N(R9)-, -A1-O-N(R9)-A2-, -A1-N(R9)-A2-N(R9)-, -A1-N(R9)-A2-, -A1-N(R9)-N=C(R8)-, -А3-А1-, -A4-A3-, -A2-NR9-, -A1-A2-X1-, -А1-А1-А2-X1-, -O-A2-N(R9)-A2-, -CR7=CR7-A2-X1-, -C≡C-A2-X1-, -N=C(R8)-A2-X1-, -C(R8)=N-N=C(R8)-, -С(R8)=N-N(R9)-, -(CH2)2-O-N=C(R8)- или -X-A2-N(R9)-,
где
n равно 0, 1 или 2,
k принимает значения от 1 до 9,
А1 представляет -CHR7-,
А2 представляет -С(=Х)-,
А3 представляет -C(R8)N-O-,
А4 представляет -O-N=C(R8)-,
X представляет О или S,
X1 представляет О, S, NR9 или прямую связь,
X2 представляет О, NR9 или прямую связь,
X3 представляет водород, -С(=)-, -SO2- или прямую связь,
R7, которые могут быть одинаковыми или различными, представляют алкил, циклоалкил или фенил, каждый из которых может быть замещенным, или водород, галоген, цианогруппу или ацил;
R8, которые могут быть одинаковыми или различными, представляют алкил, алкенил, алкинил, алкоксигруппу, алкилтиогруппу, карбо- или гетероциклил, каждый из которых может быть замещенным, или представляют водород;
R9, которые могут быть одинаковыми или различными, представляют необязательно замещенный алкил, необязательно замещенный карбо- или гетероциклил, водород или ацил, или две группы R9 на А вместе с соединяющими их атомами образуют 5-7-членное кольцо, где фрагмент, изображенный на правой стороне связующей группы А, присоединен к R6
или -A-R6 и R5 вместе с бензольным кольцом М образуют необязательно замещенную конденсированную кольцевую систему.
Предпочтительно R1 представляет алкил, алкенил или алкинил, каждый из которых может быть замещен алкоксигруппой, галогеналкоксигруппой, алкилтиогруппой, галогеном или необязательно замещенным фенилом (предпочтительно фенилом, необязательно замещенным алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой или алкилтиогруппой, каждый из которых содержит от 1 до 5 атомов углерода, или галогеном), или водород. Особенно предпочтительно R1 представляет C1-С10 алкил (например, метил) или водород.
Предпочтительно R2 и R3, которые могут быть одинаковыми или различными, представляют алкил, алкенил или алкинил, каждый из которых может быть замещен алкоксигруппой, галогеналкоксигруппой, алкилтиогруппой, галогеном или необязательно замещенным фенилом (предпочтительно фенилом, необязательно замещенным алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой или алкилтиогруппой, каждый из которых содержит от 1 до 5 атомов углерода, или галогеном) или представляют водород, алкоксигруппу, алкоксиалкоксигруппу, бензилоксигруппу, цианогруппу или алкилкарбонил. Особенно предпочтительно R2 и R3, которые могут быть одинаковыми или различными, представляют C1-С10 алкил (например, метил или этил) или водород.
Предпочтительно R4 представляет алкил, алкенил или алкинил, каждый из которых может быть замещен алкоксигруппой, галогеналкоксигруппой, алкилтиогруппой, галогеном или необязательно замещенным фенилом (предпочтительно фенилом, необязательно замещенным алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой или алкилтиогруппой, каждый из которых содержит от 1 до 5 атомов углерода, или галогеном); или представляет гидроксильную группу; галоген; цианогруппу; ацил (предпочтительно -C(=O)Rc, -C(=S)Rc- или -S(O)pRc, где Rc представляет алкил, галогеналкил, алкоксигруппу, галогеналкоксигруппу, алкилтиогруппу, аминогруппу, моноалкиламиногруппу, диалкиламиногруппу или фенил, необязательно замещенный алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой или алкилтиогруппой); алкоксигруппу; галогеналкоксигруппу или алкилтиогруппу. Особенно предпочтительно R4 представляет C1-С10 алкил (например, метил или этил) или галоген.
Предпочтительно m равно 0 или 1, особенно предпочтительно m равно 1.
R5, когда присутствует, предпочтительно представляет группу, определенную выше для предпочтительных значений R4. Особенно предпочтительно R5 представляет C1-C10 алкил или галоген.
R5, когда присутствует, предпочтительно присоединен в положении 5 кольца M.
Предпочтительно А представляет прямую связь, -О-, -S(O)nA1-, -О (A1)]k-, -S(O)n-, -NR9A2-, -A2-, -OA2-, -OA2-A1-, -NR9-или -О(A1)kO-. Особенно предпочтительно А представляет прямую связь, -О-, -S-, -NR9-, -CHR7- или -O-CHR7-. Еще более предпочтительно А представляет прямую связь или -О-. R9, когда присутствует, представляет алкил, алкенил или алкинил, каждый из которых может быть замещен алкоксигруппой, галоалкоксигруппой, алкилтиогруппой, галогеном или необязательно замещенным фенилом (предпочтительно фенилом, необязательно замещенным алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой или алкилтиогруппой, каждый из которых содержит от 1 до 5 атомов углерода, или галогеном), или представляет водород (особенно предпочтительно R9 представляет C1-С10 алкил или водород). R7, когда присутствует, представляет алкил, алкенил или алкинил, каждый из которых может быть замещен алкоксигруппой, галогеналкоксигруппой, алкилтиогруппой, галогеном или необязательно замещенным фенилом (предпочтительно фенилом, необязательно замещенным алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой или алкилтиогруппой, каждый из которых содержит от 1 до 5 атомов углерода, или галогеном), или представляет гидроксильную группу; галоген; цианогруппу, ацил; алкоксигруппу, галогеналкоксигруппу; алкилтиогруппу или водород (особенно предпочтительно R7 представляет C1-С10 алкил или водород).
Предпочтительно А присоединен в положение 4 бензольного кольца М.
Предпочтительно R6 представляет необязательно замещенный фенил или необязательно замещенный ароматический гетероциклил [предпочтительно тиазолил, изотиазолил, тиадиазолил (особенно предпочтительно 1,2,4-тиадиазолил), пиридил или пиримидинил].
Когда R6 является замещенным, он может быть замещен одним или несколькими заместителями, которые могут быть одинаковыми или различными и могут быть выбраны из предпочтительного перечня: алкил, алкенил, алкинил, карбо- или гетероциклил, каждый из которых может быть замещенным; гидроксильная группа; меркаптогруппа; азидогруппа; нитрогруппа; галоген; цианогруппа; ацил; необязательно замещенная аминогруппа; цианатогруппа; тиоцианатогруппа; -SF5; -ORa; -SRa и -Si(Ra)3, где Ra представляет алкил, алкенил, алкинил, карбоциклил или гетероциклил, каждый из которых может быть замещенным.
Предпочтительными заместителями R6 являются гидроксильная группа; галоген; цианогруппа; ацил (предпочтительно -C(=O)Rc, -C(=S)Rc или -S(O)pRc, где Rc представляет алкил, галогеналкил, алкоксигруппу, галогеналкоксигруппу, алкилтиогруппу, аминогруппу, моноалкиламиногруппу, диалкиламиногруппу или фенил, необязательно замещенный алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой или алкилтиогруппой); аминогруппу; алкиламиногруппу; диалкиламиногруппу; алкил; галогеналкил; RaO-aлкил; ацилоксилалкил; цианооксиалкил; алкоксигруппу; галогеналкоксигруппу; алкилтиогруппу; карбоциклил (предпочтительно циклогексил или циклопентил), необязательно замещенный алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой или алкилтиогруппой, и бензил, необязательно замещенный алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой или алкилтиогруппой.
Особенно предпочтительными заместителями R6 являются циклопентил, циклогексил или бензил, необязательно замещенный алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой или алкилтиогруппой, или галоген; алкил; галогеналкил; алкоксиалкил; гидроксиалкил; алкоксигруппа или алкилтиогруппа.
В предпочтительном воплощении изобретение предоставляет применение соединения общей формулы I и его солей в качестве фунгицидов, где
R1 представляет алкил, алкенил или алкинил, каждый из которых может быть замещен алкоксигруппой, галогеналкоксигруппой, алкилтиогруппой, галогеном или фенилом, необязательно замещенным алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой, алкилтиогруппой или галогеном, или представляет водород;
R2 и R3, которые могут быть одинаковыми или различными, принимают значения, определенные для R1, или представляют алкоксигруппу, алкоксиалкоксигруппу, бензилоксигруппу, цианогруппу или алкилкарбонил;
R4 представляет алкил, алкенил или алкинил, каждый из которых может быть замещен алкоксигруппой, галогеналкоксигруппой, алкилтиогруппой, галогеном или фенилом, необязательно замещенным алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой, алкилтиогруппой или галогеном, или представляет гидроксильную группу; галоген; цианогруппу; ацил (предпочтительно -С(=O)Rc, -C(=S)Rс или -S(O)pRc, где Rc представляет алкил, галогеналкил, алкоксигруппу, галогеналкоксигруппу, алкилтиогруппу, аминогруппу, моноалкиламиногруппу, диалкиламиногруппу или фенил, необязательно замещенный алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой или алкилтиогруппой);
m равно 0 или 1;
R5, когда присутствует, представляет группу, определенную для R4;
А представляет прямую связь, -О-, -S-, -NR9-, -CHR7- или -O-CHR7-, где R9, когда присутствует, представляет алкил, алкенил или алкинил, каждый из которых может быть замещен алкоксигруппой, галогеналкоксигруппой, алкилтиогруппой, галогеном или фенилом, необязательно замещенным алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой, алкилтиогруппой или галогеном, или представляет водород, и R7 представляет группу, определенную для R9, или гидроксильную группу; галоген; цианогруппу; ацил; алкоксигруппу; галогеналкоксигруппу или алкилтиогруппу;
А присоединен в положении 4 бензольного кольца М и
R6 представляет фенил или ароматический гетероциклил, необязательно замещенный одним или несколькими заместителями, которые могут быть одинаковыми или различными и могут быть выбраны из следующего перечня: гидроксильная группа; галоген; цианогруппа; ацил (предпочтительно -C(=O)Rc, -C(=S)Rc или -S(O)pRc, где Rc представляет алкил, галогеналкил, алкоксигруппу, галогеналкоксигруппу, алкилтиогруппу, аминогруппу, моноалкиламиногруппу, диалкиламиногруппу или фенил, необязательно замещенный алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой или алкилтиогруппой); аминогруппа; алкиламиногруппа; диалкиламиногруппа; алкил; галогеналкил; RaO-алкил; ацилоксиалкил; цианооксиалкил; алкоксигруппа; галогеналкоксигруппа; алкилтиогруппа; карбоциклил (предпочтительно циклогексил или циклопентил), необязательно замещенный алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой или алкилтиогруппой, и бензил, необязательно замещенный алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой или алкилтиогруппой.
Большинство соединений общей формулы I являются новыми соединениями. Следовательно, в соответствии со вторым аспектом, изобретение предоставляет соединения формулы I, где
R1 представляет алкил, алкенил, алкинил, карбоциклил или гетероциклил, каждый из которых может быть замещенным, или представляет водород;
R2 и R3, которые могут быть одинаковыми или различными, представляют любую группу, определенную для R1, или вместе с азотом, к которому присоединены, могут образовывать кольцо, которое может быть замещенным;
R4 представляет алкил, алкенил, алкинил, карбоциклил или гетероциклил, каждый из которых может быть замещенным;
m равно 1;
R5 представляет любую группу, определенную для R4 и присоединенную в положение 5 бензольного кольца М;
R6 представляет необязательно замещенный карбо- или гетероциклил, и
А представляет прямую связь; -О-; -S-; -NR9-, где R9 представляет алкил, алкенил или алкинил, каждый из которых может быть замещен алкоксигруппой, галогеналкоксигруппой, алкилтиогруппой, галогеном или необязательно замещенным фенилом; -CHR7- или -O-CHR7-, где R7 представляет алкил, алкенил или алкинил, которые могут быть замещены алкоксигруппой, галогеналкоксигруппой, алкилтиогруппой, галогеном или фенилом, необязательно замещенным алкилом, галогеналкилом, алкоксигруппой, галогеналкоксигруппой или алкилтиогруппой, или представляет гидроксильную группу; галоген; цианогруппу; ацил; алкоксигруппу; галогеналкоксигруппу, или алкилтиогруппу;
где -A-R6 находится в положении 4 бензольного кольца М, и фрагмент, изображенный с правой стороны связи А, присоединен к R6
или -A-R6 и R5 вместе с бензольным кольцом М образуют необязательно замещенную конденсированную кольцевую систему.
Любая алкильная группа может быть прямой или разветвленной и предпочтительно содержит от 1 до 10 атомов углерода, особенно предпочтительно от 1 до 7, еще более предпочтительно от 1 до 5 атомов углерода.
Любая алкенильная или алкинильная группа может быть прямой или разветвленной, предпочтительно содержит от 2 до 7 атомов углерода и может содержать до 3 двойных или тройных связей, которые могут быть сопряженными, например бутадиенил или пропаргил.
Любая карбоциклильная группа может быть насыщенной, ненасыщенной или ароматической и содержать от 3 до 8 атомов в кольце. Предпочтительными насыщенными карбоциклильными группами являются циклопропил, циклопентил или циклогексил. Предпочтительные ненасыщенные карбоциклильные группы содержат до 3 двойных связей. Предпочтительной ароматической карбоциклильной группой является фенил. Термин “карбоциклический” следует рассматривать аналогично. Кроме того, термин “карбоциклил” включает любое конденсированное сочетание карбоциклильных групп, например нафтил, фенантрил, инданил или инденил.
Любая гетероциклильная группа может быть насыщенной, ненасыщенной или ароматической и содержать от 5 до 7 атомов в кольце, из которых до 4 атомов могут представлять собой гетероатомы, такие как азот, кислород и сера. Примерами гетероциклильных групп являются фурил, тиенил, пирролил, пирролинил, пирролидинил, имидазолил, диоксолланил, оксазолил, тиазолил, имидазолил, имидазолинил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тиадиазолил, пиранил, пиридил, пиперидинил, диоксанил, морфолино, дитианил, тиоморфолино, пиридазинил, пиримидинил, пиразинил, пиперазинил, сульфоланил, тетразолил, триазинил, азепинил, оксазепинил, тиазепинил, диазепинил и тиазолинил. Кроме того, термин “гетероциклил” включает конденсированные гетероциклильные группы, например бензимидазолил, бензоксазолил, имидазопиридинил, бензоксазинил, бензотиазинил, оксазолопиридинил, бензофуранил, хинолинил, хиназолинил, хиноксалинил, дигидрохиназолинил, бензотиазолил, фталимидо, бензофуранил, бензодиазепинил, индолил и изоиндолил. Термин “гетероциклический” следует рассматривать аналогично.
Любая алкильная, алкенильная, алкинильная, карбоциклильная или гетероциклильная группа, когда является замещенной, может быть замещена одним или несколькими заместителями, которые могут быть одинаковыми или различными и могут быть выбраны из следующего перечня: гидроксильная группа; меркаптогруппа; азидогруппа; нитрогруппа; галоген; цианогруппа; ацил; необязательно замещенная аминогруппа; необязательно замещенный карбоциклил; необязательно замещенный гетероциклил; цианатогруппа; тиоцианатогруппа; -SF5; -ORa; -SRa и -Si(Ra)3, где Ra представляет алкил, алкенил, алкинил, карбоциклил или гетероциклил, каждый из которых может быть замещенным. В случае любой карбоциклильной или гетероциклильной группы перечень дополнительно включает алкил, алкенил и алкинил, каждый из которых может быть замещенным. Предпочтительными заместителями на любой алкильной, алкенильной и алкинильной группе являются алкоксигруппа, галогеналкоксигруппа или алкилтиогруппа, каждая из которых содержит от 1 до 5 атомов углерода; галоген или необязательно замещенный фенил. Предпочтительными заместителями на любой карбоциклильной или гетероциклильной группе являются алкил, галогеналкил, алкоксигруппа, галогеналкоксигруппа или алкилтиогруппа, каждый из которых содержит от 1 до 5 атомов углерода; галоген или необязательно замещенный фенил.
В случае любой алкильной группы или любого ненасыщенного углеродсодержащего кольца в любой карбоциклильной или гетероциклильной группе перечень включает двухвалентную группу, такую как оксо- или иминогруппа, которая может быть замещенной необязательно замещенной аминогруппой, Ra или -ORa (где Ra принимает значения, определенные выше). Предпочтительными группами являются оксо-, имино-, алкилимино-, оксимино-, алкилоксимино- или гидразоногруппа.
Любая аминогруппа, когда является замещенной там, где это нужно, может быть замещена одним или двумя заместителями, которые могут быть одинаковыми или различными и выбраны из следующего перечня: необязательно замещенный алкил, необязательно замещенная аминогруппа, -ORa (где Ra принимает значения, определенные выше) и ацильная группа. Альтернативно два заместителя вместе с атомом азота, к которому они присоединены, могут образовывать гетероциклильную группу, предпочтительно 5-7-членную гетероциклильную группу, которая может быть замещенной и может содержать другие гетероатомы, например морфолино-, тиоморфолиногруппа или пиперидинил.
Термин “ацил” включает остатки серу- и фосфорсодержащих кислот, а также карбоновых кислот. Обычно остатки обозначаются общими формулами -C(=Xa)Rb, -S(O)pRb и -Р(=Xa) (ORa) (ORa), в которых подходящий Хa представляет О или S, Rb принимает значения, определенные для Ra, -ORa, -SRa, и представляет необязательно замещенную аминогруппу или ацил, и р равно 1 или 2. Предпочтительными группами являются -C(=O)Rc, -C(=S)Rc и -S(O)p, где Rc представляет алкил, C1-C5 алкоксигруппу, C1-C5 алкилтиогруппу, фенил, гетероциклил или аминогруппу, которые могут быть замещенными.
Комплексы соединений изобретения обычно получают из соли формулы МАn2, в которой М представляет двухвалентный катион металла, например меди, марганца, кобальта, никеля, железа или цинка, и An представляет анион, например хлорид, нитрат или сульфат.
В случаях, когда соединения изобретения существуют в виде Е и Z изомеров, изобретение включает отдельные изомеры, а также их смеси.
В случаях, когда соединения изобретения существуют в виде таутомерных изомеров, изобретение включает отдельные таутомеры, а также их смеси.
В случаях, когда соединения изобретения существуют в виде оптических изомеров, изобретение включает отдельные изомеры, а также их смеси.
Соединения данного изобретения обладают фунгицидной активностью, в частности, в отношении болезней растений, вызываемых грибками, например болезней милдью, в частности настоящей мучнистой росы злаков (Erysiphe graminis) и ложной мучнистой росы винограда (Plasmopara viticola), пирикуляриоза риса (Pyricularia oryzae), глазковой пятнистости злаковых (Pseudocercosporella herpotrichoides), rice sheath blight (Pellicularia sasakii), серой плесени (Botrytis cinerea), выпревания [Rhizictonia solani], бурой ржавчины пшеницы (Puccinia recondita), фитофтороза томатов или картофеля (Phytophthora infestans), парши яблони (Venturia inaequalis), пятнистость колосковой чешуи (glume blotch) (Leptosphaeria nodorum). Другие грибки, против которых могут быть активными соединения данного изобретения, включают другие виды настоящей мучнистой росы, другие виды ржавчины и другие общие патогены, берущие начало из Deuteromycete, Ascomycere, Phycomycete и Basidomycete.
Изобретение также предоставляет способ уничтожения грибков на зараженных участках или участках, которые могут подвергаться заражению, способ включает нанесение на указанный участок соединения формулы I.
Изобретение также предоставляет сельскохозяйственную композицию, включающую соединение формулы I в смеси с приемлемым для сельскохозяйственного применения наполнителем или носителем.
Композиция изобретения, конечно, может включать более одного соединения данного изобретения.
Кроме того, композиция может включать один или несколько дополнительных активных ингредиентов, например соединения, которые, как известно, обладают регулирующей рост растения активностью, гербицидными, фунгицидными, инсектицидными, акарицидными, антимикробными или антибактериальными свойствами. Альтернативно соединение изобретения может использоваться последовательно с другим активным ингредиентом.
Наполнитель или носитель в композиции изобретения может быть твердым или жидким, необязательно в сочетании с поверхностно-активным веществом, например дисперсантом, эмульгатором или смачивающим агентом. Подходящие поверхностно-активные вещества включают анионные соединения, такие как карбоксилат, например металлкарбоксилат жирной кислоты с длинной цепью; N-ацилсаркоцинат; сложные моно- или диэфиры фосфорной кислоты и этоксилатов жирных спиртов или алкилфенолэтоксилатов или солей таких сложных эфиров; сульфаты жирных спиртов, такие как натрийдодецилсульфат, натрийоктадецилсульфат или натрийцетилсульфат; сульфаты этоксилированных жирных спиртов; сульфаты этоксилированных алкилфенолов; лигнинсульфонаты; нефтяные сульфонаты; алкиларилсульфонаты, такие как алкилбензолсульфонаты или низшие алкилнафталинсульфонаты, например бутилнафталинсульфонат; соли сульфированных продуктов реакции конденсации нафталина и формальдегида; соли сульфированных продуктов реакции конденсации фенола и формальдегида или более сложные сульфонаты, такие как амидсульфонаты, например сульфированный продукт конденсации олеиновой кислоты и N-метилтаурина; диалкилсульфосукцинаты, например натрийсульфонат диоктилсукцината; кислотные производные алкилгликозидов и алкилполигликозидных производных и их соли металлов, например производные алкилполигликозидцитрата или -тартрата, или сложные моно-, ди- и триалкиловые эфиры лимонной кислоты и их соли металлов.
Неионные поверхностно-активные вещества включают продукты конденсации сложных эфиров жирных кислот, жирных спиртов, амидов жирных кислот или жирных алкил- или алкенилзамещенных фенолов с этиленоксидом и/или пропиленоксидом; сложные жирные эфиры простых эфиров многоатомных спиртов, например сложные сорбитанэфиры жирных кислот; продукты конденсации таких сложных эфиров с этиленоксидом, как, например, сложные полиоксиэтиленсорбитанэфиры жирных кислот; алкилгликозиды, алкилполигликозидные производные; блок-сополимеры этиленоксида и пропиленоксида; ацетиленовые гликоли, такие как 2,4,7,9-тетраметил-5-децин-4,7-диол, этоксилированные ацетиленовые гликоли; акриловые основные привитые сополимеры; алкоксилированные силоксановые поверхностно-активные вещества или поверхностно-активные вещества имидазолинового типа, например 1-гидроксиэтил-2-алкилимидазолин.
Примеры катионных поверхностно-активных веществ включают, например, алифатический моно-, ди- или полиамин в виде ацетата, нафтената или олеата; кислородсодержащий амин, такой как аминоксид, полиоксиэтиленалкиламин или полиоксипропиленалкиламин; амидсопряженный амин, полученный конденсацией карбоновой кислоты с ди- или полиамином, или четвертичную аммониевую соль.
Композиции данного изобретения могут иметь любую форму, известную для сельскохозяйственных препаратов (например, раствор, аэрозоль, дисперсия, водная эмульсия, микроэмульсия, дисперсионный концентрат, порошок для распыления, препарат для обработки семян, фумигант, дым, диспергируемый порошок, эмульсионный концентрат, гранулы или импрегнированная лента). Кроме того, она может иметь форму, подходящую для прямого применения, или представлять собой концентрат или первичную композицию, которые необходимо разбавлять подходящим количеством воды или другого разбавителя перед применением.
Дисперсионный концентрат включает соединение изобретения, растворенное в одном или нескольких смешиваемых с водой или полусмешиваемых с водой растворителях, с одним или несколькими поверхностно-активным(и) и/или полимерным(и) веществом(ами). Добавление препарата в воду приводит к кристаллизации активного ингредиента, причем этот процесс, контролируемый поверхностно-активными и/или полимерными веществами, приводит к получению тонкой дисперсии.
Порошок для распыления (dusting powder) включает соединение данного изобретения, тщательно смешенное и измельченное с твердым порошкообразным наполнителем, например с каолином.
Эмульсионный концентрат включает соединение данного изобретения, растворенное в смешивающемся с водой растворителе, и при добавлении к воде в присутствии эмульгатора образует эмульсию или микроэмульсию.
Гранулированный твердый препарат включает соединения данного изобретения в смеси с наполнителями, подобными тем, с которыми оно может применяться в порошках для распыления, но смесь гранулирована известными способами. Альтернативно он включает активный ингредиент, абсорбированный или нанесенный в виде покрытия на предварительно полученный гранулированный носитель, например фуллерову землю (Fuller's earth), аттапульгит, диоксид кремния или твердые частицы известняка.
Смачивающиеся порошки, гранулы или твердые частицы обычно включают активный ингредиент в смеси с подходящими поверхностно-активными веществами и инертный порошкообразный наполнитель, такой как глина или диатомовая земля.
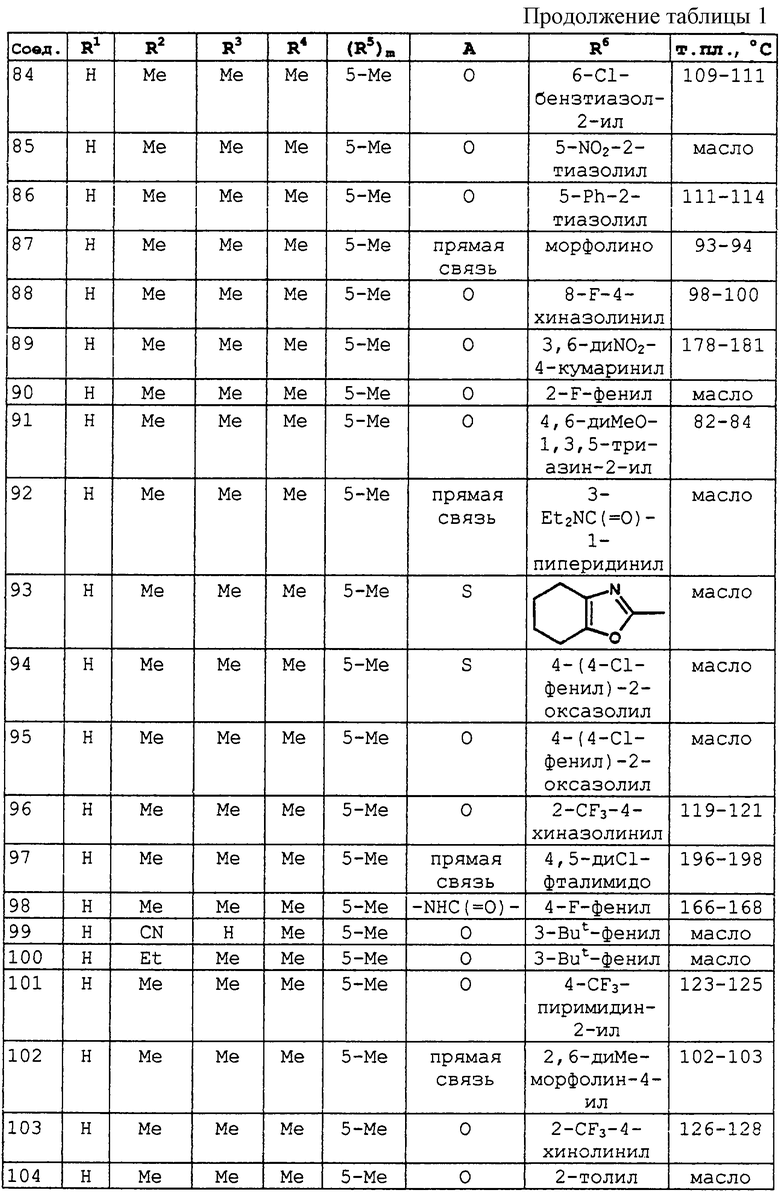
Другой подходящий концентрат представляет собой текучий концентрат суспензии, который получен измельчением соединения данного изобретения с водой или другой жидкостью, поверхностно-активными веществами или суспендирующим агентом.
Концентрация активного ингредиента в композиции данного изобретения при применении на растения предпочтительно находится в интервале от 0,0001 до 1,0 процента по массе, особенно предпочтительно от 0,0001 до 0,01 процента по массе. В первичной композиции количество активного ингредиента может изменяться в широких пределах и составлять, например, от 5 до 95 процентов от массы композиции.
При применении соединение данного изобретения обычно наносится на семена, на растения или на места их произрастания. Следовательно, соединение может наноситься непосредственно на почву до или после посева, чтобы присутствие активного соединения в почве могло уничтожать рост грибков, способных воздействовать на семена. Когда почва обрабатывается непосредственно, активное соединение может применяться любым способом, который позволяет ему одновременно смешиваться с почвой, таким как опрыскивание, разброс твердых гранул или внесение активного ингредиента во время посева в борозду вместе с семенами. Подходящая доза находится в интервале от 5 до 1000 г на гектар, более предпочтительно от 10 до 500 г на гектар.
Альтернативно активное соединение может наноситься непосредственно на растение, например, опрыскиванием или распылением, или в то время, когда грибки начинают появляться на растении, или до появления грибков в качестве защитной меры. В обоих случаях предпочтительным способом применения является лиственное опрыскивание. Обычно важно получить хороший результат уничтожения грибков на ранних стадиях развития растения, поскольку это время, когда растения может подвергаться наиболее тяжелому повреждению. Раствор для опрыскивания или порошок обычно может содержать довсходовый или послевсходовый гербицид, если это необходимо. На практике иногда можно обрабатывать корни, луковицы, клубни или другие вегетативные части растения перед или во время посадки, например, погружением корней в подходящую жидкую или твердую композицию. Когда активное соединение наносится непосредственно на растение, подходящая доза применения составляет от 0,025 до 5 кг на гектар, предпочтительно от 0,05 до 1 кг на гектар.
Кроме того, соединения данного изобретения могут наноситься на собранные плоды, овощи или семена для профилактики заражения во время хранения.
Соединения данного изобретения также могут наноситься на растения или части растений, которые были генетически модифицированы для проявления таких особенностей, как фугицидная и/или гербицидная резистентность.
Соединения данного изобретения также могут использоваться и для обработки грибковых заражений в древесине, и в общественном здравоохранении. Соединения данного изобретения также могут использоваться для обработки грибковых заражений у домашних и сельскохозяйственных животных.
Соединения данного изобретения могут быть получены различными путями по известным способам.
Соединения общей формулы I могут быть получены из соединений общей формулы II согласно схеме 1. Для осуществления превращения могут использоваться следующие реакции:
a) взаимодействие с R2R3NC(R1)(OR)2, где R представляет группу, такую как алкил;
b) взаимодействие с ROC(R1)=NCN;
c) когда R1 представляет водород, взаимодействие с H(C=O)NR2R3 в присутствии РОСl3 или SOCl2 или
d) в две стадии - взаимодействием с фосгеном с образованием изоцианата и затем обработкой R2R3N(С=O)R1.
Схема 1

Кроме того, группы R2 и R3 в соединениях общей формулы I могут превращаться в другие группы, определенные для R2 и R3, обработкой подходящим амином либо ацилированием или алкилированием, когда R2 или R3 представляет водород.
Соединения общей формулы II могут быть получены восстановлением нитрогруппы в соединениях формулы III, как показано на схеме 2. Предпочтительные условия реакции включают взаимодействие с хлоридом олова в концентрированной соляной кислоте.
Схема 2

Соединения формулы IIа, то есть соединения общей формулы II, в которых А представляет прямую связь, могут быть получены в соответствии со схемой реакций 3, где Xv представляет отщепляемую группу.
Схема 3

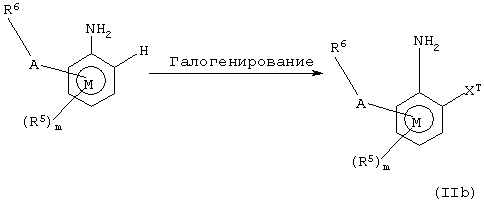
Соединения формулы IIb, то есть соединения общей формулы II, в которых R4 представляет галоген, могут быть получены в соответствии со способом, представленным на схеме 4, где XT представляет галоген. Когда R4 является бромом, предпочтительные условия реакции включают перемешивание с бромом в подходящем растворителе.
Схема 4
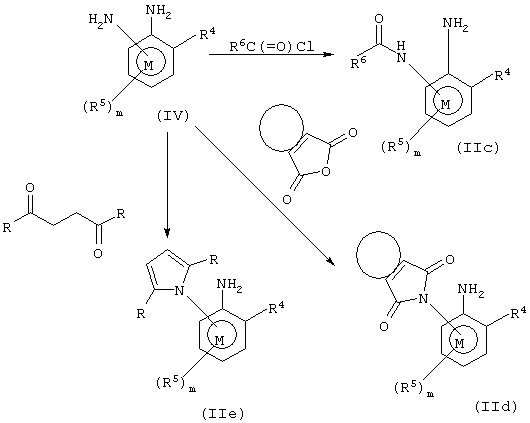
Соединения формулы IIс, то есть соединения общей формулы II, в которых А представляет NHC(=O)-; соединения формулы IId, то есть соединения формулы II, в которых А представляет прямую связь, R6 представляет необязательно замещенную фталимидогруппу, и кривая линия, соединяющая положения 3 и 4 во фталимидогруппе, представляет необязательно замещенное карбоциклическое кольцо, и соединения формулы IIе, то есть соединения общей формулы II, в которых А представляет прямую связь и R6 представляет пирролил, необязательно замещенный в положениях 2 и 5 одной или несколькими группами R, которые могут быть одинаковыми или различными, могут быть получены из соединений формулы IV в соответствии с методикой, представленной на схеме 5. При получении некоторых соединений формулы IV для улучшения выходов может потребоваться защита (удаление защиты) аминогруппы, находящейся в орто-положении относительно R4.
Схема 5
Соединения формулы IIIa, то есть соединения общей формулы III, в которых А представляет группу Аz, могут быть получены взаимодействием соединений формулы V с соединениями формулы VI в соответствии со схемой 6. Аz представляет группу, которая в соединении V в основных условиях образует анион. Альтернативно Аz представляет основной первичный или вторичный атом азота. Xz представляет отщепляемую группу, предпочтительно галоген. Когда Аz является кислородом, предпочтительные условия реакций включают обработку V гидридом натрия с последующим добавлением VI. Когда Аz является серой, предпочтительные условия реакции включают взаимодействие V с VI в присутствии третичного аминного основания, такого как этилдиизопропиламин. Когда Аz представляет -CHR7, предпочтительные условия реакции включают обработку V трет-бутоксидом натрия в диметилформамиде при низкой температуре. Когда Аz представляет основной атом азота, основание не требуется.
Схема 6
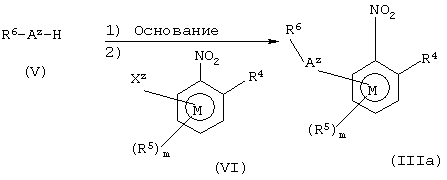
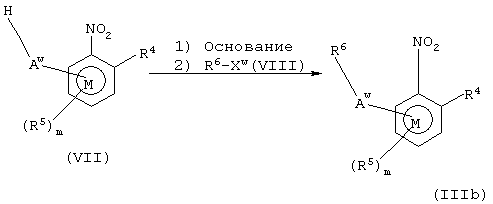
Соединения формулы IIIb, то есть соединения общей формулы III, в которых А представляет группу Аw, могут быть получены взаимодействием соединений формулы VII с соединениями формулы VIII согласно схеме 7. Аw представляет группу, которая в соединении VII в основных условиях образует анион. Xw является отщепляемой группой, предпочтительно галогеном. Предпочтительные основные условия включают взаимодействие VII с карбонатом калия или гидридом натрия с последующим добавлением VIII.
Схема 7
Соединения формулы IIIc, то есть соединения общей формулы III, в которых А представляет О, могут быть получены взаимодействием соединений формулы IX с бороновыми кислотами формулы Х в соответствии со схемой 8. Предпочтительные условия реакции включают реакцию с ацетатом меди и триметиламином.
Схема 8

Соединения формулы IIId, то есть соединения формулы III, в которых А представляет прямую связь, могут быть получены в соответствии со схемой 9 из соединений формулы XI, где Xz представляет отщепляемую группу, предпочтительно галоген.
Схема 9

Соединения формулы III, в которых А представляет прямую связь и R6 представляет гетероциклил, могут быть получены различными методами, известными квалифицированному химику (например, см. "Comprehensove Heterocyclic Chemistry", vols 1-7, A.R. Katritzky and C.W. Rees). Например, способы получения соединений формулы III, содержащих 1,2,4-оксадиазол-3-ил (соединение IIIе) и 1,3,4-оксадиазол-2-ил (соединение IIIf) показаны на схемах 10 и 11.
Схема 10
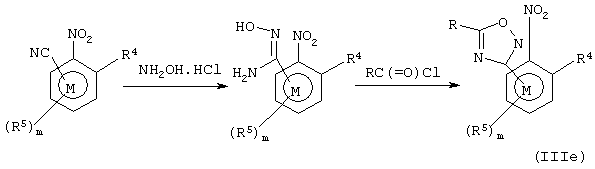
Схема 11
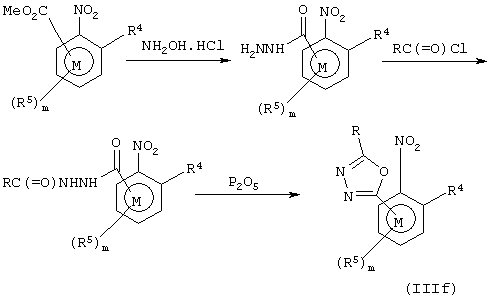
Альтернативно с помощью химических превращений, аналогичных описанным выше, соединения формулы I могут быть получены введением R6 после образования амидинового фрагмента.
В частности, заявителями данного изобретения было установлено, что обработка соединений формулы XII в соответствии со схемой 7 приводит к получению с особенно высоким выходом соединений формулы Iа, то есть соединений общей формулы I, в которых А представляет кислород (см. схему 12). Соединения формулы XII могут быть получены способами, аналогичными способам, описанным в публикации Tetrahedron Letters, 38 (31). 5403-5406.
Схема 12
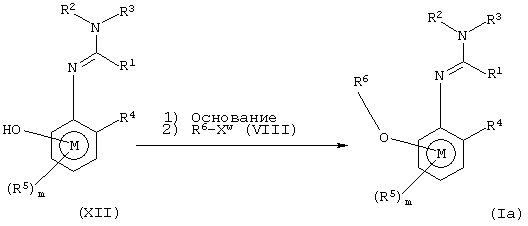
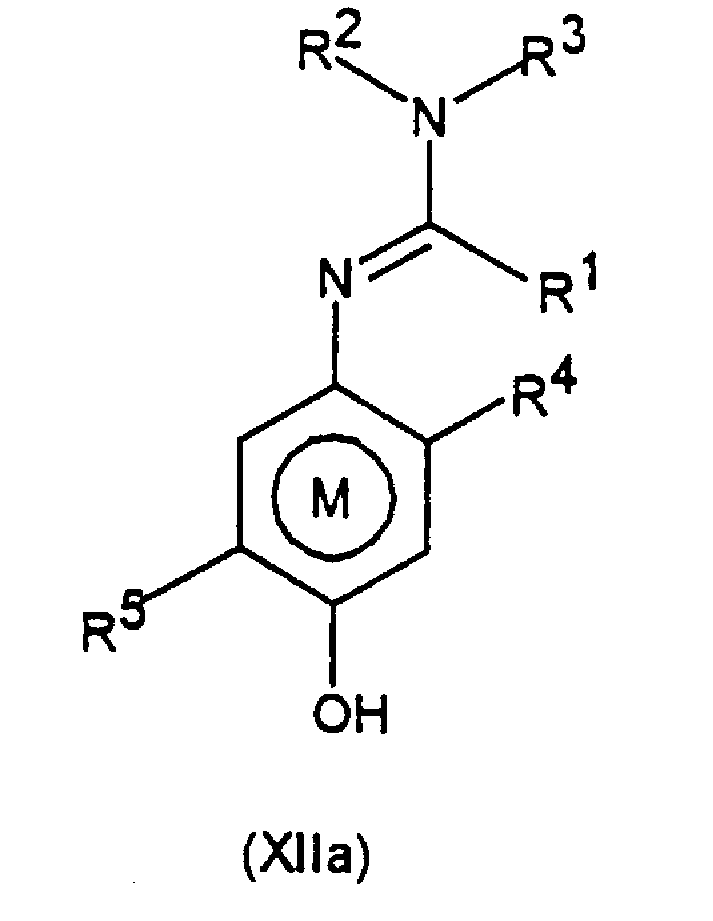
Некоторые соединения общей формулы XII являются новыми соединениями, следовательно, согласно третьему аспекту изобретение предоставляет соединения общей формулы ХIIа

где R1 представляет алкил, алкенил, алкинил, карбоциклил или гетероциклил, каждый из которых может быть замещенным, или представляет водород;
R2 и R3, которые могут быть одинаковыми или различными, представляют любою группу, определенную для R1; цианогруппу; ацил; -ORa или -SRa, где Ra представляет алкил, алкенил, алкинил, карбоциклил или гетероциклил, каждый из которых может быть замещенным, или R2 и R3, или R2 и R1 вместе с соединяющими их атомами могут образовывать кольцо, которое может быть замещенным;
R4 представляет алкил, алкенил, алкинил, карбоциклил или гетероциклил, каждый из которых может быть замещенным, и
R5 представляет любую группу, определенную для R4, при условии, что R5 не является трет-бутилом.
Другие способы будут понятны квалифицированному специалисту в данной области, так как это способы получения исходных соединений и промежуточных продуктов.
Кроме того, соединения данного изобретения могут быть получены с использованием методов комбинаторной химии.
Изобретение иллюстрируется приведенными далее примерами. Структуры выделенных новых соединений подтверждены данными ЯМР и/или другими подходящими анализами. Спектры протонного ЯМР (1Н ЯМР) получены в дейтерохлороформе, химические сдвиги (δ) представленны в миллионных долях вниз от тетраметилсилана.
Пример 1
N,N-Диметил-N'-[4-(3-трифторметилбензилтио)-2,5-ксилил]формамидин (Соединение 3)
Продукт со стадии b) (1,0 г) и N,N-диметилформамиддиметилацеталь (1,0 мл) нагревают до 100°С и выдерживают при этой температуре в течение 4 часов. После охлаждения смесь очищают хроматографией на силикагеле (элюирование: диэтиловый эфир), в результате получают указанное в заголовке соединение.
1H ЯМР (δ): 2,15 (с, 3Н, АrСН3), 2,20 (с, 3Н, АrСН3), 3,00 (с, 6Н, N(СН3)2), 3,95 (с, 2Н,  ).
).
Получение исходных соединений
a) 2-Нитро-5-(3-трифторметилбензилтио)-п-ксилол
Смесь 3-трифторметилбензилмеркаптана (3,42 г), диизопропилэтиламина (2,3 г) и 3-хлор-6-нитро-ксилола (3,0 г) в сухом N-метилпирролидиноне (20 мл) нагревают до 130°С и выдерживают при этой температуре в течение 6 часов. После охлаждения смесь выливают в ледяную воду и полученную смесь фильтруют с получением твердого осадка, который промывают ледяной водой и затем сушат на воздухе. Твердое вещество очищают хроматографией на силикагеле [элюирование: петролейный эфир (60-80°С)/этилацетат (9:1)], в результате получают указанный в заголовке продукт в виде твердого вещества, т. пл. 85-87°С.
b) 4-(3-Трифторметилбензилтио)-2,5-ксилидин
К смеси хлорида олова (10,8 г) в концентрированной соляной кислоте (24 мл) и этанола (50 мл) при перемешивании добавляют продукт со стадии а), описанной выше, смесь нагревают до 75°С и выдерживают при этой температуре в течение 3 часов. После охлаждения медленно с охлаждением добавляют раствор гидроксида калия. Смесь экстрагируют диэтиловым эфиром (х3), объединенные экстракты промывают рассолом, сушат (MgSO4), фильтруют и выпаривают досуха, остаток очищают хроматографией на силикагеле [элюирование: петролейный эфир (т.кип.60-80°С)/этилацетат (3:1)], в результате получают указанный в заголовке продукт, т. пл. 58-60°С.
Пример 2
N,N-Диэтил-N'-[4-(3-трифторметилфенокси)-2,5-ксилил]формамидин (Соединение 37)
Под атмосферой азота оксихлорид фосфора (2,18 г) в сухом диэтиловом эфире (3 мл) при перемешивании по каплям добавляют в раствор N,N-диэтилформамида (1,43 г) в сухом диэтиловом эфире (3 мл) и перемешивание продолжают в течение 20 минут. Перемешивание прекращают и смеси дают отстояться для разделения на два слоя. Верхний эфирный слой удаляют декантированием, нижний слой промывают диэтиловым эфиром (х3). Затем по каплям добавляют продукт со стадии b) (2 г) в диэтиловом эфире (4 мл). После добавления смесь энергично перемешивают в течение 1 часа при комнатной температуре. Верхний эфирный слой удаляют декантированием, нижний слой промывают эфиром (х2). Нижний слой выливают в воду, рН смеси доводят до 9 с помощью раствора карбоната натрия. Смесь экстрагируют диэтиловым эфиром (х3), объединенные экстракты сушат (MgSO4), фильтруют и выпаривают досуха, получают масло, которое очищают хроматографией на силикагеле (элюирование: диэтиловый эфир), в результате получают указанное в заголовке соединение.
1H ЯМР (δ): 1,20 (т, 6Н,  ), 2,10 (с, 3Н, АrСН3), 2,20 (с, 3Н, АrСН3), 3,30-3,50 (уш., 4Н,
), 2,10 (с, 3Н, АrСН3), 2,20 (с, 3Н, АrСН3), 3,30-3,50 (уш., 4Н,  ).
).
Получение исходных соединений
а) 2-Нитро-5-(3-трифторметилфенокси)-п-ксилол
К суспензии гидрида натрия (0,4 г 60% в масле) в сухом N-метилпирролидиноне (10 мл) медленно добавляют 3-трифторметилфенол (1,62 г). После прекращения выделения пузырьков добавляют 3-хлор-6-нитро-п-ксилол (1,85 г) и смесь перемешивают при 120-140°С в течение 5 часов. После охлаждения смесь выливают в воду и полученную смесь экстрагируют диэтиловым эфиром (х3). Объединенные органические экстракты сушат (MgSO4), фильтруют и выпаривают, получают указанное в заголовке соединение в виде твердого вещества, т. пл. 68-71°С.
b) 4-(3-Трифторметилфенокси)-2,5-ксилидин
Данное соединение получают в соответствии с методикой получения продукта стадии b) примера 1.
Пример 3
N-Этил-N-метил-N'-[4-(3-трифторметилфенокси)-2,5-ксилил)формамидин (Соединение 45)
Смесь продукта примера 4 (1 г) и метилэтиламина (0,885 г) в ацетонитриле (20 мл) перемешивают при комнатной температуре в течение 1,5 часа. Растворитель удаляют в вакууме и добавляют воду. Смесь экстрагируют диэтиловым эфиром (х3) и объединенные эфирные экстракты сушат (MgSO4), фильтруют и выпаривают досуха. Остаток очищают хроматографией на силикагеле [элюирование: этилацетат/петролейный эфир (т. кип.40-60°С) (4:6)], получают указанное в заголовке соединение.
1H ЯМР δ (м.д.): 1,20 (т, 3Н, 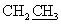 ), 2,10 (с, 3Н, АrСН3), 2,20 (с, 3Н, АrСН3), 3,00 (с, 3Н, NСН3), 3,40 (уш., 2Н, NCH2).
), 2,10 (с, 3Н, АrСН3), 2,20 (с, 3Н, АrСН3), 3,00 (с, 3Н, NСН3), 3,40 (уш., 2Н, NCH2).
Пример 4
N-Циано-N'-[4-(3-трифторметилфенокси)-2,5-ксилил]формамидин (Соединение 44)
К раствору продукта со стадии b) примера 2 (2 г) в этаноле (5 мл) по каплям при комнатной температуре добавляют этилцианоимидат (0,7 г) и перемешивание продолжают при комнатной температуре в течение 2 часов. Этанол удаляют в вакууме, получают сырой осттаток, который очищают растиранием с петролейным эфиром (т. кип.40-60°С) и затем хроматографией на силикагеле [элюирование: этилацет/петролейный эфир (т. кип.40-60°С)], в результате получают указанный в заголовке продукт, т. пл. 138-140°С.
Пример 5
N,N-Диметил-N'-[4-(3-фенил-1,2,4-тиадиазол-5-илокси)-2,5-ксилил]формамидин (Соединение 48)
К суспензии исходного соединения (см. ниже) (0,57 г) в диметилформамиде (10 мл) добавляют карбонат калия (0,62 г) и раствор перемешивают при комнатной температуре в течение 40 минут. Добавляют 5-бром-3-фенил-1,2,4-тиадиазол (0,72 г) и смесь перемешивают при 60°С в течение 3 часов. После охлаждения смесь выливают в воду (150 мл) и экстрагируют диэтиловым эфиром (3×70 мл). Объединенные эфирные экстракты промывают водой (20 мл), сушат (MgSO4), фильтруют и выпаривают досуха, получают сырой твердый продукт, который очищают хроматографией на силикагеле (элюирование: диэтиловый эфир), в результате получают указанное в заголовке соединение в виде твердого вещества, т. пл. 100-105°С.
Получение исходных соединений
N,N-Диметил-N'-(4-гидрокси-2,5-ксилил)формамидин
Данное соединение получают из 4-амино-2,5-диметилфенола в соответствии с методикой, описанной в примерах 1, 2 или 3, т.пл. 212°С.
Пример 6
N,N-Диметил-N'-[4-(3-трифторметилфенокси)-2,6-ксилил]формамидин (Соединение 20)
Данное соединение получают из продукта стадии b), описанной ниже, и диметилформамиддиметилацеталя в соответствии с методикой, описанной в примере 1.
1H ЯМР δ (м.д.): 2,15 (с, 6Н, АrСН3), 3,00 (с, 6Н, N(CH3)2).
Получение исходных соединений
а) 2-Нитро-5-(3-трифторметилфенокси)-м-ксилол
Смесь 3,5-диметил-4-нитрофенола (1,67 г), 3-трифтометилбензолбороновой кислоты (3,8 г), ацетата меди(III) (1,82 г) и триэтиламина (2,02 г) в дихлорметане (50 мл) перемешивают при комнатной температуре в течение 48 часов. Смесь выпаривают досуха и остаток очищают хроматографией на силикагеле [элюирование: петролейный эфир (т. кип.60-80°С)/этилацетат (19:1)], в результате получают указанный в заголовке продукт в виде масла.
b) 4-(3-Трифторметилфенокси)-2,6-ксилидин
Данное соединение получают из продукта стадии а), описанной выше, в соответствии с методикой стадии b) примера 1.
Пример 7
N,N-Диметил-N'-[6-бром-4-(3-трифторметилфенокси)-2,5-ксилил]формамидин (Соединение 12)
Указанное в заголовке соединение получают из продукта стадии с), описанной ниже, и диметилформамиддиметилацеталя в соответствии с методом, описанным в примере 1.
1H ЯМР δ (м.д.): 2,17 (с, 3Н, АrСН3), 2,22 (с, 3Н, АrСН3), 3,05 (с, 6Н, N(СН3)2).
Получение исходных соединений
a) 2-Нитро-5-(3-трифторметилфенокси)-п-ксилол
Указанное в заголовке соединение получают из 2,5-диметил-4-нитрофенона и 3-трифторметилбензолбороновой кислоты в соответствии с методикой, описанной в примере 6, стадии а).
b) 4-(3-Трифторметилфенокси)-2,5-ксилидин
Указанное в заголовке соединение получают из продукта стадии а) в соответствии с методикой примера 1 стадии b).
c) 6-Бром-4-(3-трифторметилфенокси)-2,5-ксилидин
К раствору продукта со стадии b), описанной выше, (1,12 г) в дихлорметане (20 мл) при перемешивании по каплям добавляют бром (0,64 г) в дихлорметане (5 мл) при 0°С. Смесь промывают раствором бикарбоната натрия, сушат (MgSO4), фильтруют и выпаривают, получают сырое масло, которое очищают хроматографией на силикагеле [элюирование: этилацетат/ петролейный эфир (т. кип.60-80°С) (1:4)], в результате получают указанное в заголовке соединение.
Пример 8
N,N-Диметил-N'-[4-(3-трифторметилфенил)-2,5-ксилил]формамидин (Соединение 53)
Указанное в заголовке соединение получают из продукта стадии с), описанной ниже, и диметилформамиддиметилацеталя в соответствии с методикой, описанной в примере 1.
1H ЯМР δ (м.д.): 2,00 (с, 3Н, АrСН3), 2,20 (с, 3Н, АrСН3), 3,00 (с, 6Н, (NСН3)2).
Получение исходных соединений
a) N-(4-Бром-2,5-ксилил)пиваламид
К раствору 4-бром-2,5-ксилидина (8 г) в пиридине (60 мл) при комнатной температуре добавляют пивалоилхлорид (4,78 мл). Спустя 30 минут смесь выливают в смесь разбавленная соляная кислота/ледяной раствор. Осадок отфильтровывают и промывают водой, в результате получают указанное в заголовке соединение.
b) N-(4-(3-Трифторметилфенил)-2,5-ксилил)пиваламид
К раствору продукта со стадии а) (9,1 г) в диметоксиэтане (14 мл) добавляют хлорид трифенилфосфинпалладия(II) (каталитическое количество) и полученную смесь перемешивают в течение 10 минут. Добавляют 3-трифторметилфенилбороновую кислоту (6,03 г), бикарбонат натрия (8,1 г) и воду (102 мл) и смесь кипятят с обратным холодильником в течение 4 часов. После охлаждения добавляют 1/н. раствор гидроксида натрия (94 мл) и смесь экстрагируют этилацетатом. Органические экстракты промывают насыщенным раствором хлорида натрия, сушат (МgSО4) и концентрируют, в результате получают указанный в заголовке продукт.
c) 4-(3-Трифторметилфенил)-2,5-ксилидин
Продукт со стадии b) (10,4 г) в ледяной уксусной кислоте (36 мл) обрабатывают соляной кислотой (24,5 мл 15% раствора) при 70°С. Смесь перемешивают в течение 3 дней при 100°С. После охлаждения добавляют воду и полученную смесь экстрагируют этилацетатом. Органическую фазу промывают раствором бикарбоната натрия, сушат (MgSO4) и концентрируют, в результате получают указанный в заголовке продукт.
Пример 9
N,N-Диметил-N'-[4-(3-трифторметилбензил)-2,5-ксилил]формамидин (Соединение 264)
Указанное в заголовке соединение получают из продукта стадии d), описанной ниже, в соответствии с методикой, описанной в примере 1, т. пл. 75-77°С.
Получение исходных веществ
a) 2-Нитро-5-(α-циано-3-трифторметилбензил)-п-ксилол
Указанное в заголовке соединение получают из 2-хлор-5-нитро-п-ксилола и 3-трифторметилбензилцианида в соответствии с методикой, описанной в публикации J. Med. Chem., 40, 3942 (1997).
b) 2-Нитро-5-(3-трифторметилбензоил)-п-ксилол
трет-Бутоксид калия (1,12 г) добавляют к раствору продукта стадии а) (3,3 г) в сухом диметилформамиде (30 мл) при 0°С и перемешивают при 0°С в течение 5 минут. По каплям добавляют пероксид водорода (3,5 мл, 30%) и перемешивание продолжают в течение 6 часов при температуре примерно 3°С. Реакционную смесь оставляют при комнатной температуре на 2 дня. Реакционную смесь выливают в разбавленную соляную кислоту (500 мл) и добавляют метабисульфит натрия. Смесь экстрагируют диэтиловым эфиром (2×20 мл), промывают водой (2×20 мл), сушат (МgSO4) и концентрируют с получением сырого продукта. Растирание с петролейным эфиром (т. кип.40-60°С) приводит к получению твердого вещества, которое перекристаллизовывают из диизопропилового эфира, в результате получают указанное в заголовке соединение.
c) 2-Нитро-5-(3-трифторметилбензил)-п-ксилол
К раствору продукта со стадии b) (1 г) в дихлорметане (20 мл) при 0°С добавляют раствор трифторметансульфоновой кислоты (0,6 мл) в дихлорметане (10 мл). Добавляют триэтилсилан (0,8 мл) в дихлорметане (10 мл) и смесь перемешивают при 0°С в течение 10 минут. Добавляют дополнительную порцию трифторметансульфоновой кислоты (0,6 мл) и дополнительную порцию триэтилсилана (0,8 мл). Смеси дают нагреться до комнатной температуры и перемешивают в течение 1 часа. Смесь выливают в насыщенный раствор бикарбоната натрия (100 мл) и твердое неорганическое вещество отфильтровывают. Слои отделяют и водный слой экстрагируют дихлорметаном (2×50 мл). Объединенные органические слои выпаривают и остаток перекристаллизовывают, в результате получают твердое вещество, т. пл. 75-77°С.
d) 4-(3-Трифторметилбензил)-2,5-ксилидин
Указанное в заголовке соединение получают из продукта стадии с) в соответствии с методикой примера 1 стадии b).
Пример 10
N,N-Диметил-N'-[4-(4-фторбензамидо)-2,5-ксилил)формамидин (Соединение 98)
Указанное в заголовке соединение получают из исходного вещества в соответствии с методикой примера 1, т. пл. 166-168°С.
Получение исходных соединений
N-(4-Амино-2,5-ксилил)-4-фторбензамид
К раствору п-ксилилендиамина (3,0 г) и этилдиизопропиламина (3,8 мл) в дихлорметане (300 мл) при 0°С по каплям добавляют 4-фторбензоилхлорид (3,5 г). Смесь нагревают до комнатной температуры и перемешивание продолжают в течение 4 часов. Добавляют воду (200 мл) и смесь перемешивают в течение 30 минут. Смесь фильтруют, промывают водой и дихлорметаном. Органическую фазу промывают водой, сушат (МgSO4) и выпаривают, в результате получают твердое вещество, т. пл. 174-176°С.
Пример 11
N,N-Диметил-N'-(4-фталимидо-2,5-ксилил)формамидин (Соединение 80)
Указанное в заголовке соединение получают из исходного соединения в соответствии с методикой, описанной в примере 1, т. пл. 170-173°С.
Получение исходных соединений
N-(4-Амино-2,5-ксилил)фталимид
К раствору п-ксилилендиамина (1,0 г) в N-метилплирролидиноне добавляют фталевый ангидрид (1,1 г) в N-метилпирролидиноне (10 мл). Смесь нагревают до 150°С и выдерживают при этой температуре в течение 4 часов. После охлаждения смесь выливают в воду и затем фильтруют. Осадок на фильтре промывают водой и сушат, т. пл. 167-169°С.
Пример 12
N,N-Диметил-N'-[4-(2,5-диметил-1-пирролил)-2,5-ксилил]формамидин (Соединение 79)
Указанное в заголовке соединение получают из продукта стадии с), описанной ниже, в соответствии с методикой, описанной в примере 1, т. пл. 90-91°С.
Получение исходных соединений
a) N-(4-Амино-2,5-ксилил)ацетамид
К раствору п-ксилолдиамина (2,0 г) в дихлорметане (200 мл) при температуре ниже 10°С добавляют N,N-диизопропиламин (2,52 мл), затем по каплям добавляют ацетилхлорид (1,15 г). Смеси дают нагреться до комнатной температуры и перемешивают в течение ночи. Добавляют воду и суспензию фильтруют. Отфильтрованное твердое вещество промывают дихлорметаном (2×100 мл) и водой (100 мл). Все фильтраты объединяют и органический слой отделяют. Органический слой промывают водой, сушат (MgSO4) и выпаривают, в результате получают указанное в заголовке соединение в виде твердого вещества, т. пл. 133-135°С.
b) N-[4-(2,5-Диметил-1-пирролил)-2,5-ксилил]ацетамид
Продукт со стадии а) (1,0 г) добавляют к ацетонилацетону (0,7 мл), смесь нагревают до 140°С и выдерживают при этой температуре в течение 4 часов. После охлаждения смесь растворяют в дихлорметане и раствор фильтруют через MgSO4. После выпаривания получают сырой продукт, который очищают хроматографией на силикагеле (элюирование: диэтиловый эфир), в результате получают указанное в заголовке соединение.
с) 2,5-Диметил-4-(2,5-диметил-1-пирролил)анилин
Смесь продукта со стадии b) (0,6 г), водного раствора гидроксида натрия (10 мл, 10%) и этанола (30 мл) кипятят с обратным холодильником в течение 24 часов. После охлаждения смесь экстрагируют диэтиловым эфиром (х2). Объединенные эфирные экстракты промывают водой, сушат (МgSO4) и концентрируют, в результате получают сырой продукт. Фильтрование через силикагель приводит к получению указанного в заголовке соединения.
Пример 13
N,N-Диметил-N'-[4-(2-бензо[b]тиофенил)-2,5-ксилил)формамидин (Соединение 187)
Указанное в заголовке соединение получают из продукта со стадии b), описанной ниже, по методике примера 1, т. пл. 67-68°С.
Получение исходных соединений
а) 2-(4-Нитро-2,5-ксилил)бензо[b]тиофен
Смесь 2-бром-5-нитро-п-ксилола (200 г), 2-бензо[b]тиофенбороновой кислоты (200 г), (PH3P)4Pd (0,36 г) в толуоле (60 мл) и этанола (22 мл) кипятят с обратным холодильником в течение ночи. Добавляют этилацетат и воду и органическую фазу отделяют. Органическую фазу промывают водой, сушат (MgSO4) и фильтруют через рыхлый слой диоксида кремния, в результате получают указанное в заголовке соединение.
b) 2,5-Диметил-4-(2-бензо[b]тиофенил)анилин
Указанное в заголовке соединение получают из продукта стадии а), описанное выше, в соответствии с методикой стадии b) примера 1.
Пример 14
N,N-[-Диметил-N'-{4-[5-(4-хлорфенил)-1,2,4-оксадиазол-3-ил]-2-толил}формамидин (Соединение 179)
Указанное в заголовке соединение получают из продукта стадии с), описанной ниже, в соответствии с методикой, описанной в примере 1, т. пл. 136-137°С.
Получение исходных соединений
a) 3-Метил-4-нитробензамидоксим
К раствору 3-метил-4-нитробензонитрила (5 г) в этаноле (100 мл) при комнатной температуре добавляют гидрохлорид гидроксиламина (2,25 г) и затем триэтиламин (4,5 мл). Смесь кипятят с обратным холодильником в течение 2,5 часов. После охлаждения смесь упаривают до одной трети первоначального объема и выливают в воду (200 мл). Смесь фильтруют, в результате получают указанное в заголовке соединение в виде твердого вещества, т. пл. 127-129°С.
b) 5-(4-Хлорфенил)-3-(3-метил-4-нитрофенил)-1,2,4-оксадиазол
К раствору продукта со стадии а) (1,9 г) и триэтиламина (1,62 мл) в дихлорметане (50 мл) при комнатной температуре добавляют 4-хлорбензоилхлорид (2,05 г). Смесь перемешивают при комнатной температуре в течение 2 часов и промывают водой. Добавляют толуол (100 мл) и смесь нагревают и выдерживают в условиях Дина-Старка в течение 5 часов. После охлаждения смесь фильтруют и концентрируют. Растирание с диизопропиламином и петролейным эфиром (т. кип. 40-60°С) приводит к получению указанного в заголовке продукта, т. пл. 145-147°С.
с) 4-[5-(4-Хлорфенил)-1,2,4-оксадиазол-3-ил]-2-метиланилин
Указанное в заголовке соединение получают из продукта со стадии b) в соответствии с методикой примера 1, стадия b).
Пример 15
N,N-Диметил-N'-[4-(5-трет-бутил-1,3,4-оксадиазол-2-ил)-2-метилфенил]формамидин (Соединение 211)
Указанное в заголовке соединение получают из продукта стадии с), описанной ниже, в соответствии с методом примера 1, т. пл. 79-80°С.
Получение исходных соединений
a) N-(3-Метил-4-нитробензоил)-N'-пивалоилгидразин
К раствору 3-метил-4-нитробензоилгидразина (3,9 г) в дихлорметане (100 мл) добавляют триэтиламин (3,06 мл) с последующим добавлением пивалоилхлорида (2,6 мл). Смесь перемешивают при комнатной температуре в течение 2 часов. Смесь промывают водой, сушат (MgSO4) и концентрируют. Растирание с петролейным эфиром (т. кип. 60-80°С) приводит к получению указанного в заголовке соединения, т. пл. 125-127°С.
b) 5-трет-Бутил-2-(3-метил-4-нитрофенил)-1,3,4-оксадиазол
Продукт, полученный на стадии а) (5,0 г), перемешивают в толуоле (200 мл) и обрабатывают пентоксидом фосфора (10 г). Смесь кипятят с обратным холодильником в течение 2 часов и затем выливают в ледяную воду. Смесь экстрагируют диэтиловым эфиром, экстракт сушат (MgSO4) и концентрируют. Остаток очищают хроматографией на силикагеле [элюирование: диэтиловый эфир/петролейный эфир (т. кип. 60-80°С)], в результате получают указанное в заголовке соединение, т. пл. 123-125°С.
с) 2-(4-Амино-3-метил)-5-трет-бутил-1,3,4-оксадиазол
Указанное в заголовке соединение получают из продукта стадии b) в соответствии с методикой стадии b) примера 1.
Пример 16
N-Циано-N-метил-N'-[4-(4-хлор-3-трифторметилфенокси)-2-ксилил]формамидин (Соединение 373)
Продукт со стадии с) (0,4 г) в тетрагидрофуране (10 мл) обрабатывают гидридом натрия (0,05 г), добавляют йодметан (0,075 мл) и смесь перемешивают. Смесь гасят водой и экстрагируют дихлорметаном. Экстракты сушат (MgSO4) и выпаривают. Полученный остаток очищают хроматографией на силикагеле, в результате получают указанное в заголовке соединение.
1H ЯМР δ (м.д.): 2,10 (с, 3Н, АrСН3), 2,20 (с, 3Н, АrСН3), 3,35 (с, 3Н, NСН3).
Пример 17
N-Циано-N'-[4-(4-хлор-3-трифторметилфенокси)-2,5-ксилил]формамидин (Соединение 397)
Указанное в заголовке соединение получают в соответствии с методикой примера 4 из продукта стадии b), описанной выше, т. пл. 111-114°С.
Получение исходных соединений
а) 2-Нитро-5-(4-хлор-3-трифторметилфенокси)-п-ксилол
Указанное в заголовке соединение получают в соответствии с методикой стадии а) примера 2.
b) 4-(2-Хлор-3-трифторметилфенокси)-2,5-ксилидин
Указанное в заголовке соединение получают в соответствии с методикой стадии b) примера 1 из продукта стадии а), описанной выше.
Приведенные далее соединения формулы Iа (см. таблицу 1), то есть соединения общей формулы I, в которых -A-R6 находится в пара-положении относительно амидинового фрагмента, могут быть получены методами, аналогичными приведенным в примерах 1-17, где фрагмент, расположенный с правой стороны связи А, присоединен к R6.
Соединения таблицы 1, которые не имеют отдельных температур плавления, имеют характеристические 1H ЯМР, представленные в таблице 2.
Приведенные далее соединения формулы Ib (см. Таблицу 3), то есть соединения общей формулы I, в которых R1 представляет водород, R3 представляет метил, R4 представляет метил, R5 представляет метил, замещенный в положении 5 фенильного кольца, -A-R6 находится в пара-положении относительно амидинового фрагмента и представляет 3-Вut-феноксигруппу, могут быть получены по аналогичным методикам примеров 1 - 17, где фрагмент, изображенный с правой стороны связи А, присоединен к R6.
Соединения Таблицы 3, у которых нет температур плавления, имеют характеристические 1H ЯМР, которые представлены в таблице 4.
Пример 18
Сульфатная соль N,N-диметил-N'-[4-(3-трифторметилфенокси)-2,5-ксилил]формамидина (Соединение 602)
К раствору Соединения 1 (см. таблицу 1) (0,3 г) в этаноле (0,3 мл) по каплям добавляют концентрированную серную кислоту (0,098 г). Смесь фильтруют, полученное твердое вещество промывают диэтиловым эфиром, в результате получают указанное в заголовке соединение в виде твердого вещества, т. пл. 178-180°С.
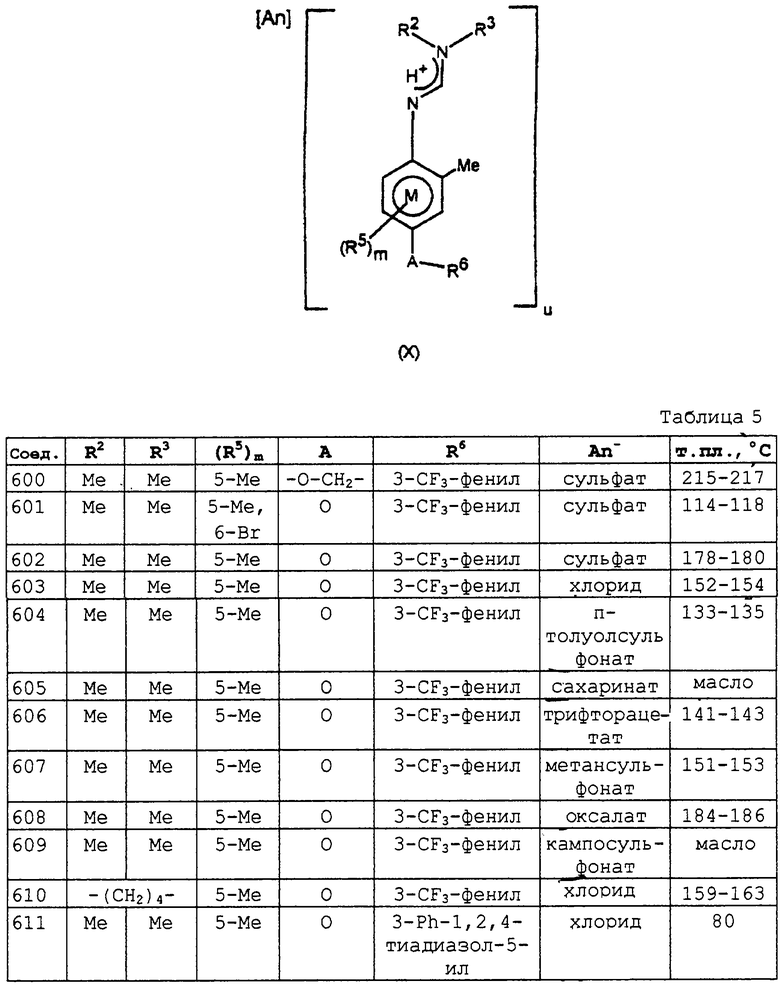
Приведенные далее соединения формулы Х (см. таблицу 5), то есть соли общей формулы I, в которых -A-R6 находится в пара-положении относительно амидинового фрагмента, R1 представляет водород, R4 представляет метил, An представляет анион и u равно 1 или 2 в зависимости от валентности аниона, могут быть получены по методикам, аналогичным примеру 18.
Соединения таблицы 5, у которых нет температур плавления, имеют следующие характеристические данные 1H ЯМР в СDСl3.
Соединение 605
1H ЯМР δ (м.д.): 2,15 (с, 3Н, АrСН3), 2,25 (с, 3Н, АrСН3), 3,20 (с, 3Н, N(СН3)), 3,25 (с, 3Н, N(СН3)), 10,20-10,80 (уш. 1Н, NH).
Соединение 609
1H ЯМР δ (м.д.): 0,75 (с, 3Н, ССН3), 1,05 (с, 3Н, ССН3) 1,25 (д, 2Н, СН2), 1,75-1,95 (м, 3Н), 2,15 (с, 3Н, АrСН3), 2,20 (м, 1Н, СН), 2,25 (с, 3Н, АrСН3), 2,35 (д, 1Н, СН), 2,60 (т, 1Н, СН), 2,85 (д, 1Н, СН), 3,20 (с, 3Н, N(СН3)), 3,30 (с,3Н, N(СН3)).
Приведенные далее соединения формулы Iс (см. таблицу 6), то есть соединения общей формулы I, в которых R1 и R5 представляют водород, R2, R3 и R4 представляют метил, могут быть получены по аналогичным методикам примеров 1-17, где фрагмент, изображенный с правой стороны связи А, присоединен к R6.
Примеры испытаний
Соединения данного изобретения были испытаны на активность в отношении одного или нескольких из следующих возбудителей болезней:
Phytophthora infestans: фитофтороз томатов
Plasmopara viticola: ложная мучнистая роса винограда
Erysiphe graminis f. sp. tritici: настоящая мучнистая
роса пшеницы
Pyrlcularia oryzae: пирикуляриоз риса
Leptosphaeria nodorum: пятнистость колосковой чешуи
Водные растворы или дисперсии соединений в нужной концентрации, включающие смачивающий агент, наносятся опрыскиванием или смачиванием основания стебля тестируемых растений, как это подходит. Спустя определенное время растения или части растений инокулируют соответствующими тестируемыми патогенами до или после применения соединений, как это подходит, и выдерживают в контролируемых условиях окружающей среды, подходящих для поддержания роста растения и развития болезни. По истечении соответствующего времени визуально определяют степень заражения поврежденной части растения. Соединения оценивают по шкале от 1 до 3, где 1 означает небольшой или отсутствие контроля, 2 означает средний контроль и 3 означает хороший или полный контроль. В концентрации 500 ч/млн (маc./об.) или менее активность с оценкой 2 или более в отношении указанных грибков проявили следующие соединения:
Phytophthora infestans
1, 8, 28, 30, 36, 46 и 271.
Plasmopara viticola
149, 331, 373 и 364.
Erysiphe graminis f. sp. tritici
1-5, 7-9, 11-13, 15-24, 26, 28-41, 43, 45, 46, 48, 51, 52, 55, 56, 58, 59, 61, 62, 65, 68, 76, 84, 86, 90, 100, 101, 104-106, 109, 112, 113, 120, 123, 124, 130, 135, 138, 139, 140, 141, 143, 146, 149, 160, 166, 171, 173-175, 183, 187-190, 193-196, 200, 203-205, 207-209, 213, 215-217, 223, 225, 228, 231, 232, 234, 237, 246, 250, 252, 253, 256, 258, 259, 261, 262, 264, 266-272, 277, 279, 281, 282, 284, 286-288, 290, 291, 295, 298, 299, 301, 303, 310-312, 318, 325, 326, 330, 331, 335, 346, 347, 349, 351, 353, 355-357, 359, 361, 364, 365-368, 370-372, 374, 376-379, 392, 396, 398, 502, 504, 600, 601, 610 и 611.
Pyricularia oryzae
7,17, 20, 21, 23, 26-28, 30, 32, 34, 36, 38, 41, 43, 45, 51, 54, 55, 59, 63, 94, 140, 143, 146, 163, 225, 325, 352, 353, 360, 368, 600 и 611.
Leptosphaeria nodorum
1, 2, 5, 7, 8, 15, 27, 29, 35, 37, 41, 43, 45, 48, 56, 59, 61, 72, 100, 130, 160, 170, 181, 194, 208, 214, 235, 246, 283, 284, 290, 303, 310, 311, 312, 325, 326, 351, 364, 369, 378 и 392.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ИНДАЗОЛА КАК АНТАГОНИСТЫ КРФ | 2003 |
|
RU2341518C2 |
| ГАМК-ЕРГИЧЕСКИЕ МОДУЛЯТОРЫ | 2004 |
|
RU2376292C2 |
| ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2534804C1 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА С КОНДЕНСИРОВАННЫМ ЦИКЛОМ | 2002 |
|
RU2318822C2 |
| ПРОИЗВОДНЫЕ БЕНЗОТИАЗОЛА, ХАРАКТЕРИЗУЮЩИЕСЯ АГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ К БЕТА-2-АДРЕНОРЕЦЕПТОРАМ | 2003 |
|
RU2324687C2 |
| N-АЛКИНИЛ-2-(ЗАМЕЩЕННЫЕ АРИЛОКСИ)-АЛКИЛТИОАМИДНЫЕ ПРОИЗВОДНЫЕ КАК ФУНГИЦИДЫ | 2004 |
|
RU2352559C2 |
| ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ | 2009 |
|
RU2518462C2 |
| АЦЕТАМИДНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ФУНГИЦИДОВ | 2005 |
|
RU2396268C2 |
| ИНГИБИТОРЫ ГЛЮКОЗИЛЦЕРАМИДСИНТАЗЫ 2-АЦИЛАМИНОПРОПАНОЛЬНОГО ТИПА | 2009 |
|
RU2578947C2 |
| КОНДЕНСИРОВАННЫЕ ТРИАЗОЛАМИНЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ Р2Х7 | 2010 |
|
RU2533122C2 |
















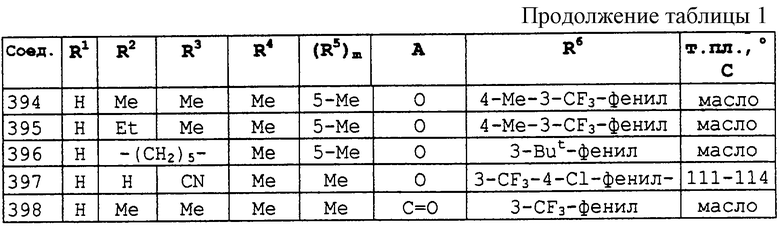
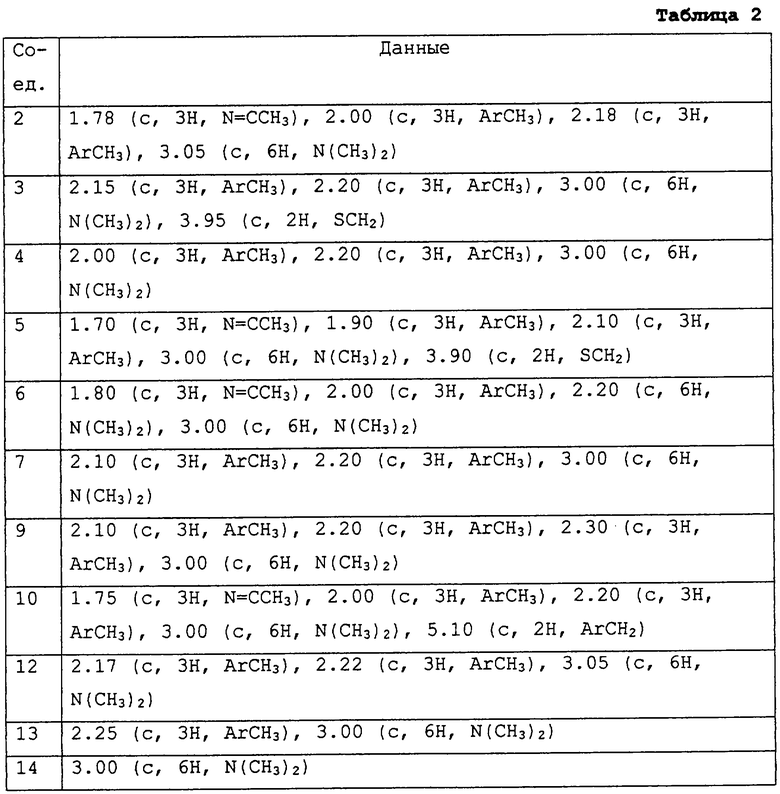
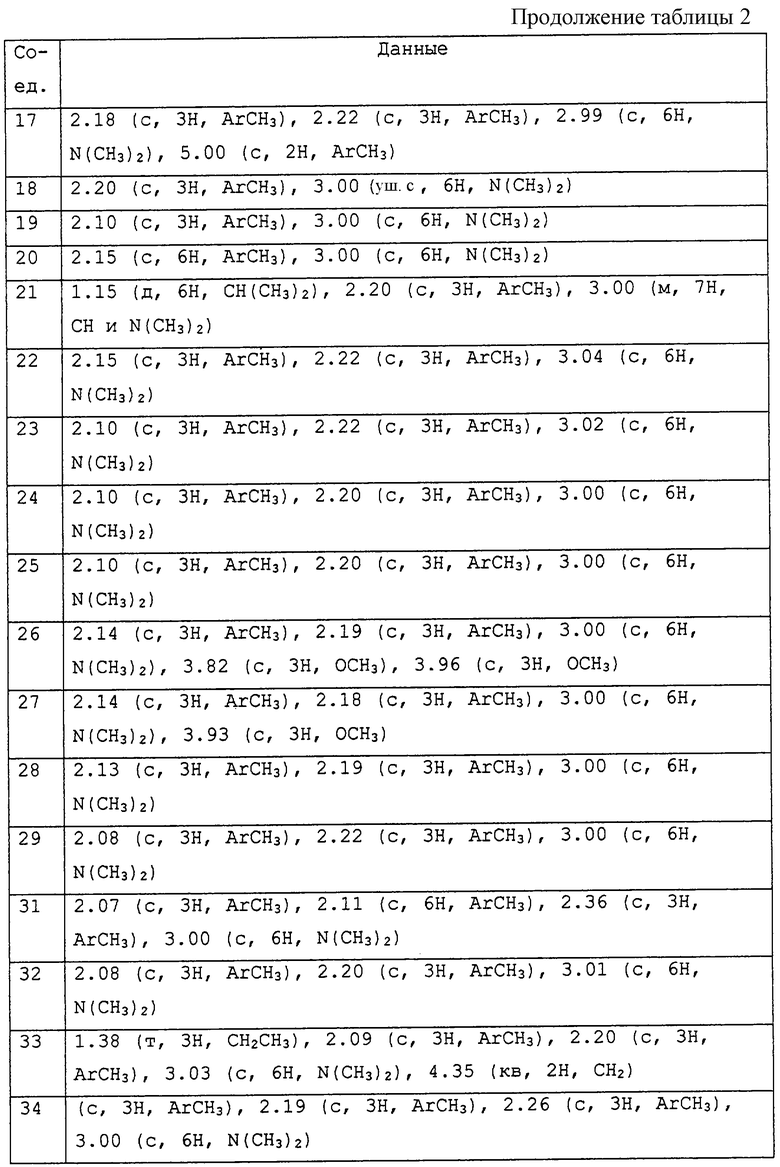
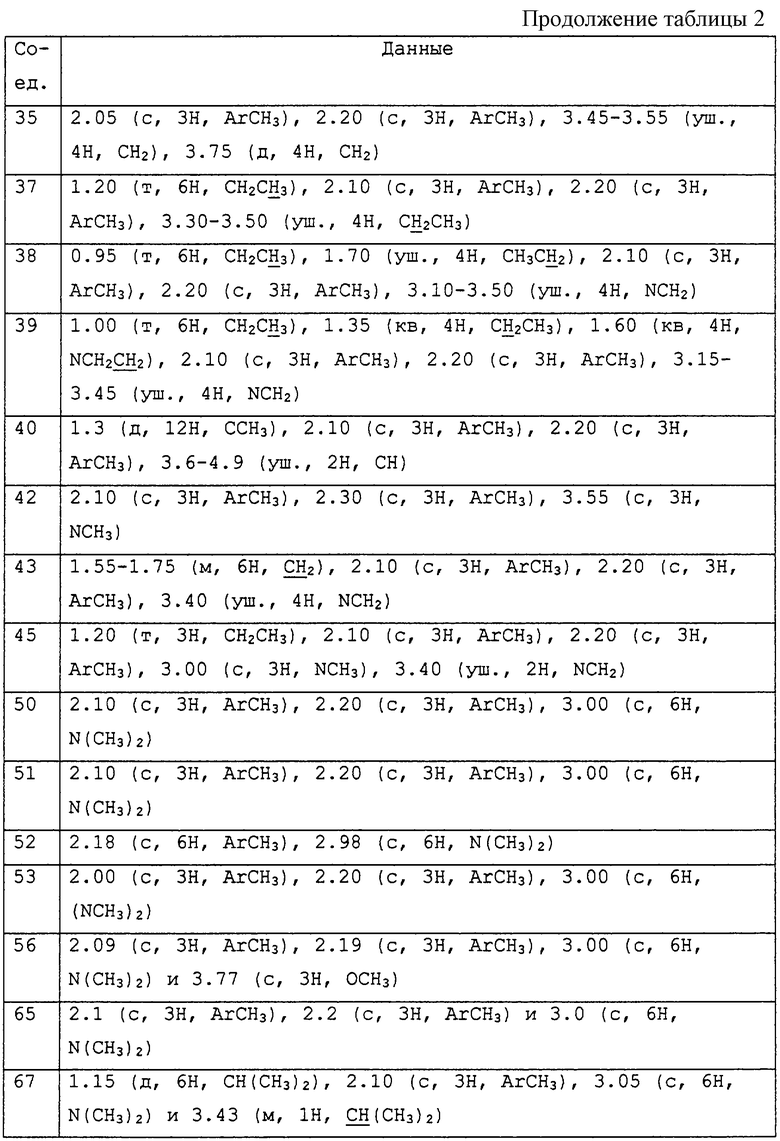

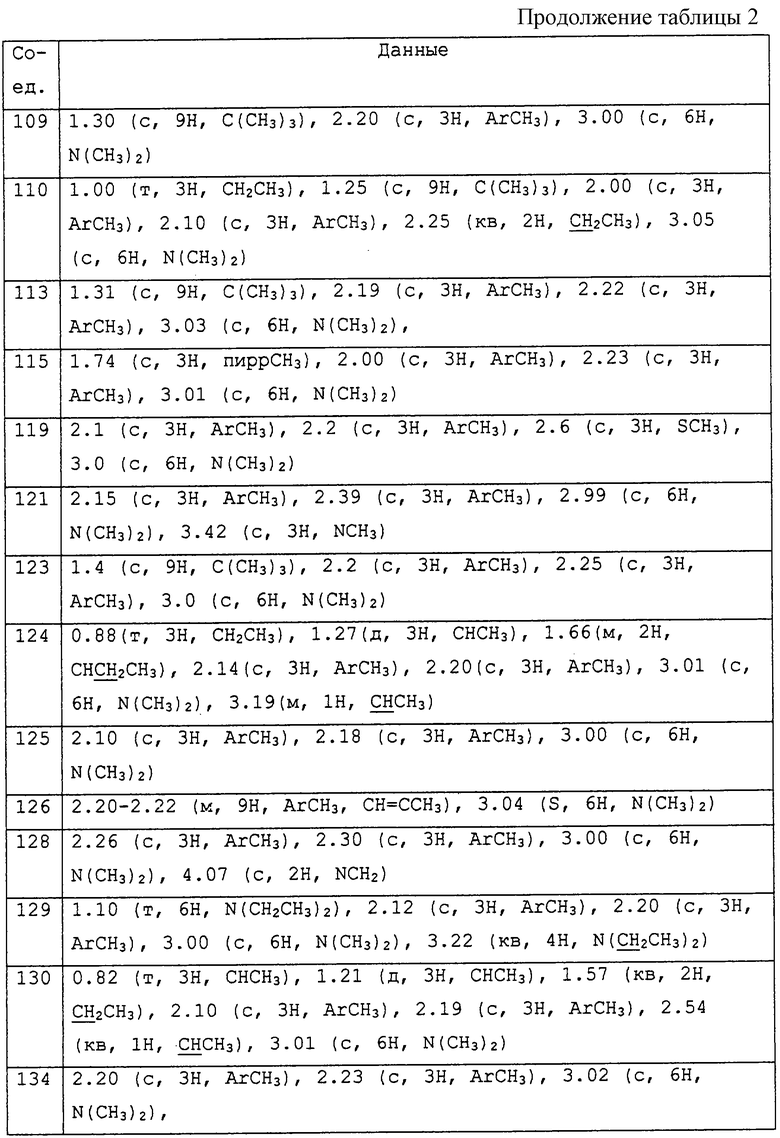


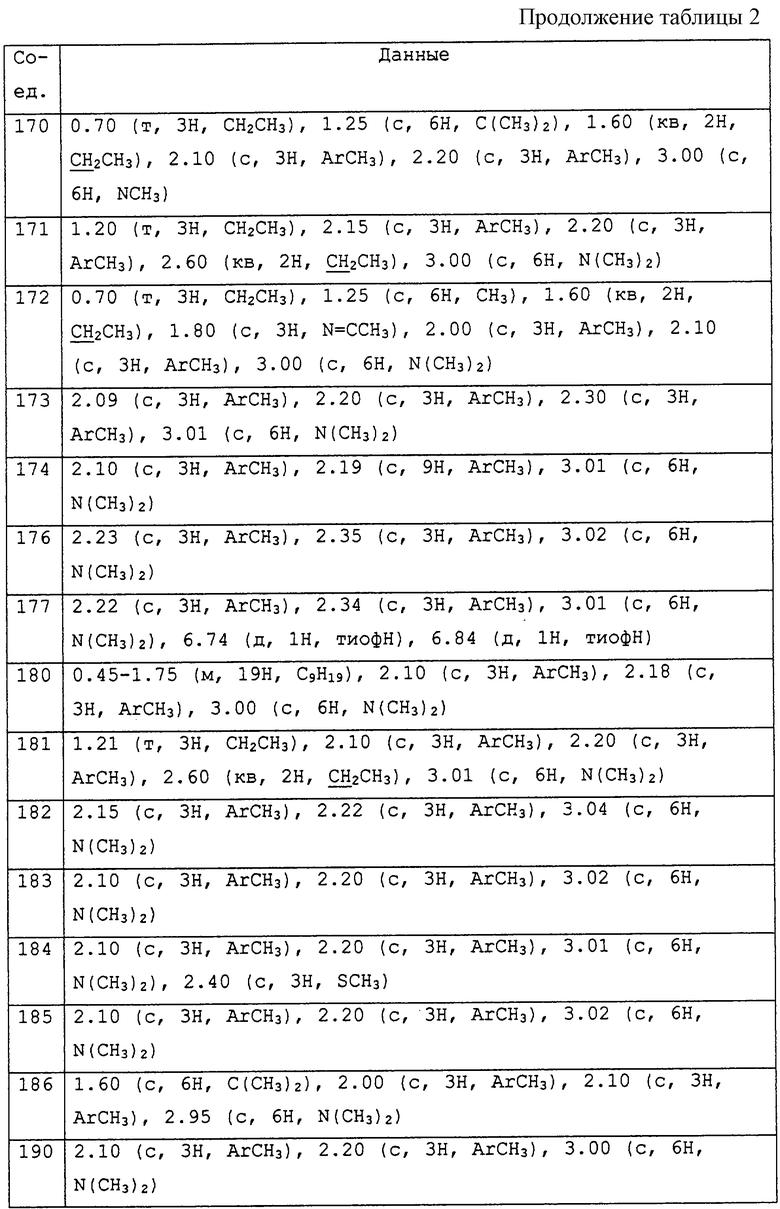



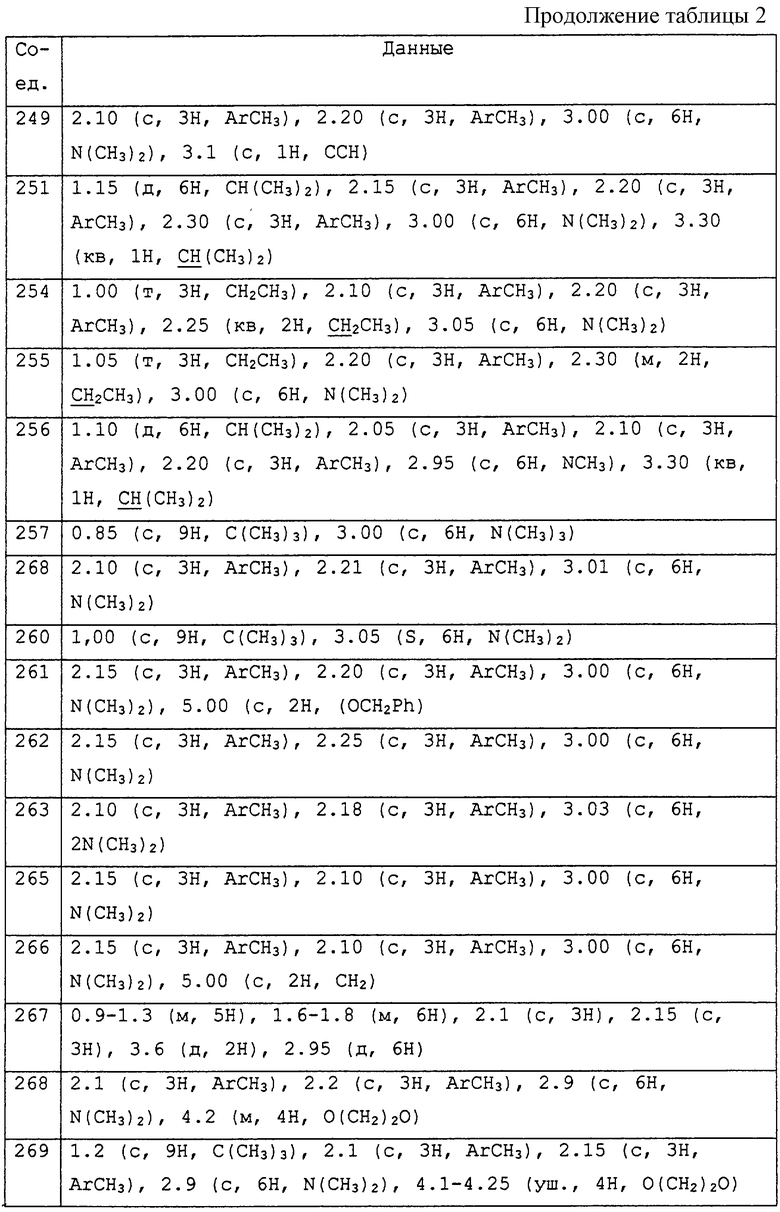
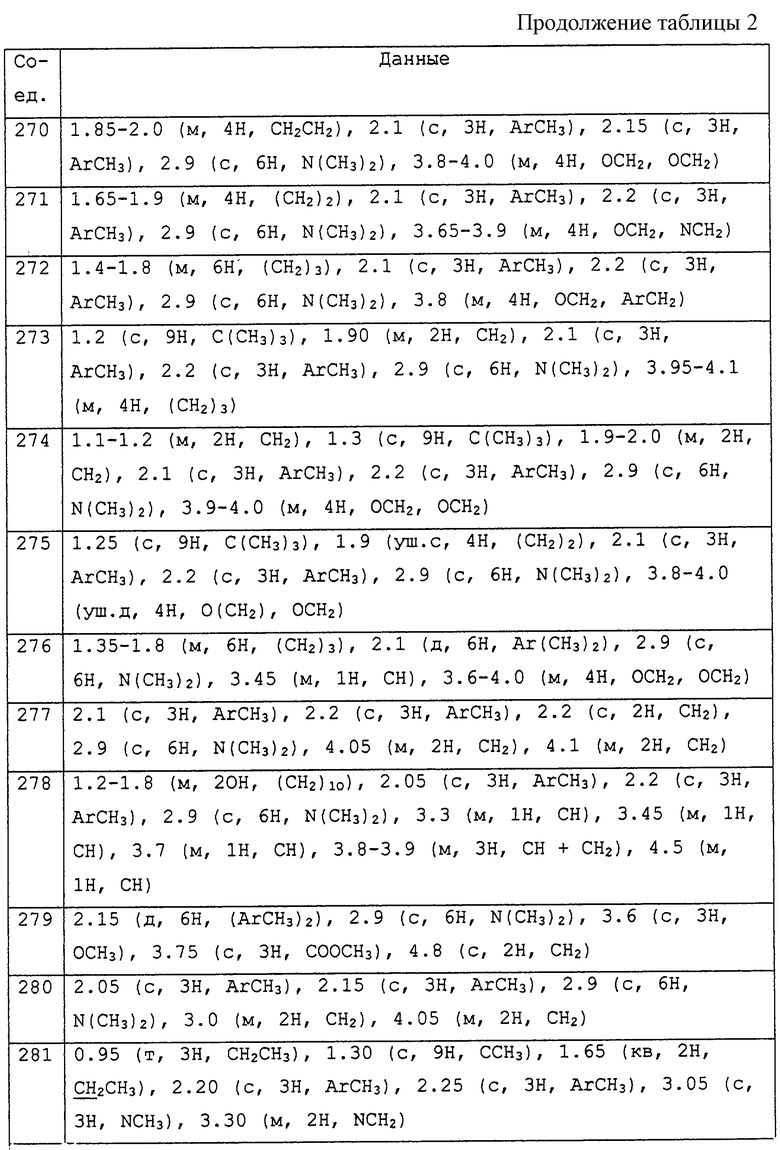
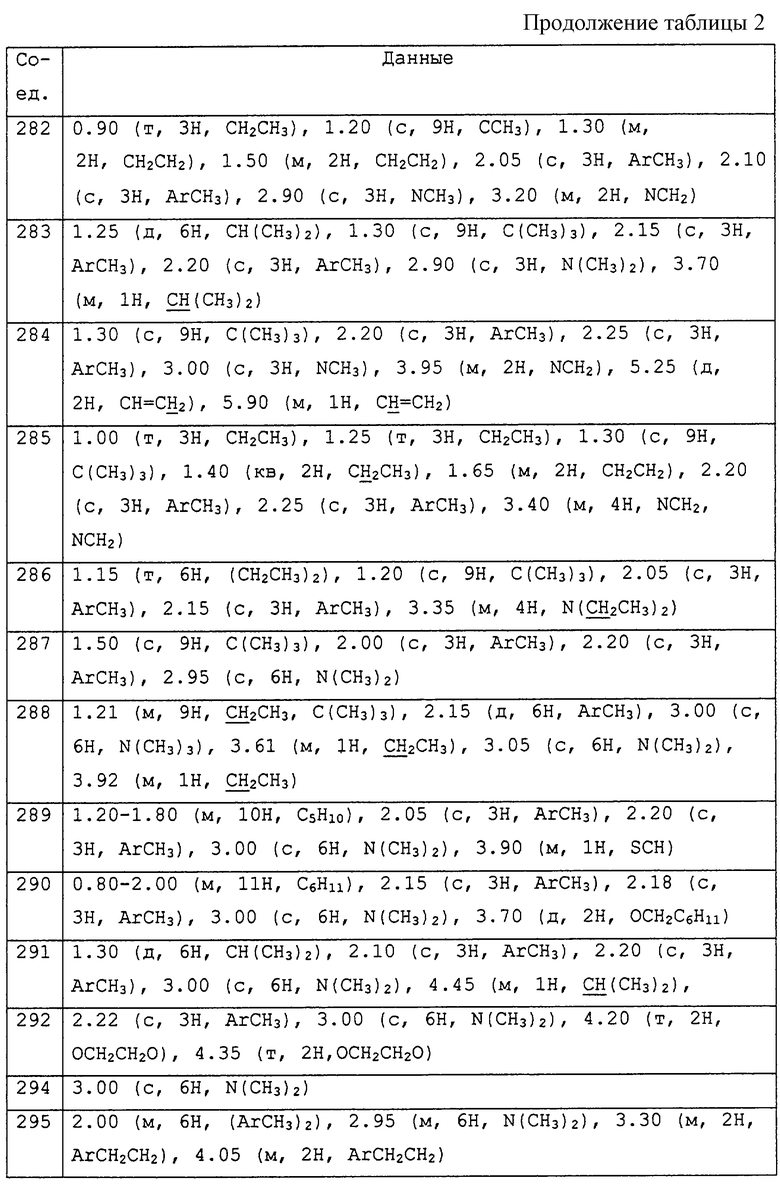






Описываются соединения общей формулы
где R1 обозначает С1-С10 алкил, водород; R2 и R3 могут быть различными и представляют водород, С1-С10алкил, возможно замещенный фенилом, С2-С7алкенил, цианогруппу, -ORa (Ra представляет С1-С10алкил), фенил, С3-С6циклоалкил, -C(=O)Rc, (Rc представляет C1-C5алкил) или R2и R3 вместе с соединяющими их атомами могут образовывать -(СН2)2-О-(СН2)2, -(СН2)4-, -(СН2)5-; R4 представляет С1-С10 алкил, галоген; m = 0 до 3; R5 обозначает С1-С10 алкил, галоген, нитро; R6 представляет собой фенил, нафтил, 5,6,7,8-тетрагидронафтил, С3-С6 циклоалкил, 9-оксофлуоренил; А представляет прямую связь, -О-, -S(O)n-, -O-(A1)k-O-, -NR9A2-. Описывается промежуточное соединение формулы (ХIIa)
Описывается также способ уничтожения грибков в очагах заражения. Полученные соединения обладают высокой активностью по отношению к таким возбудителям бактерий, как фитофтороз томатов, ложная мучнистая роса винограда, пирикуляриоз риса. 5 c. и 18 з.п. ф-лы, 6 табл.

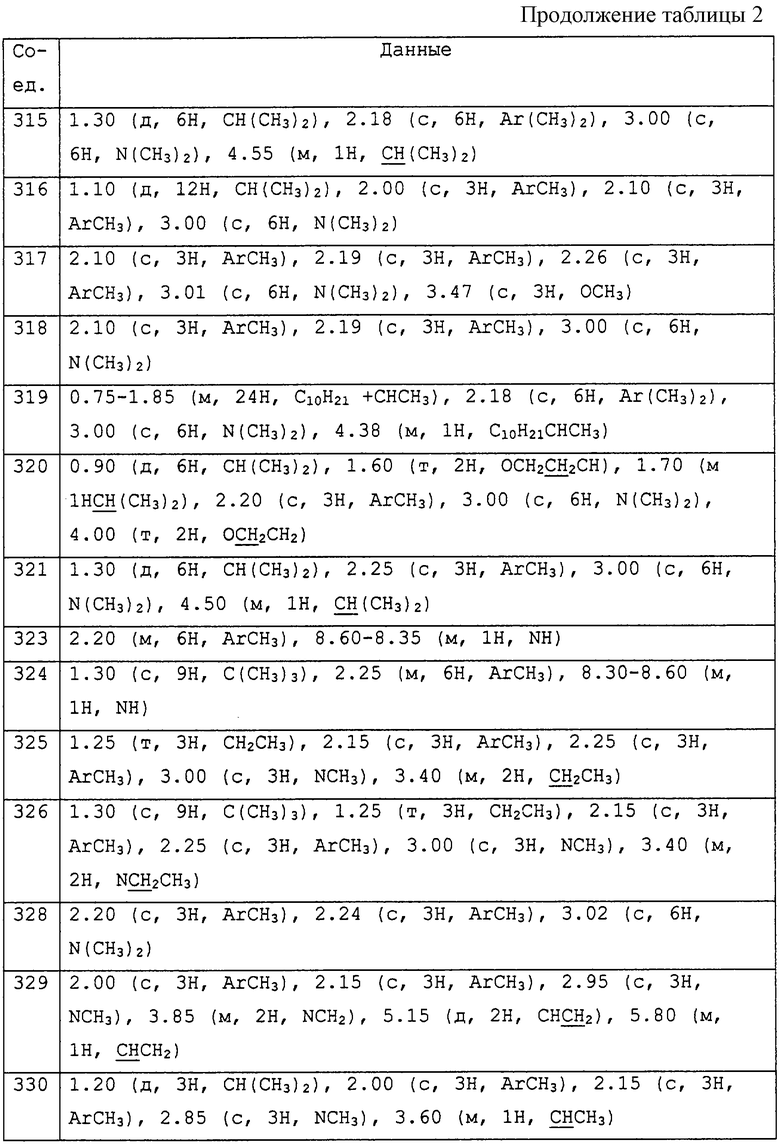
где R1 представляет С1-С10 алкил, водород;
R2 и R3, которые могут быть различными и представляют водород, С1-С10алкил, возможно замещенный фенилом, С2-С7алкенил, цианогруппу, -ORa (Ra представляет С1-С10алкил), фенил, С3-С6циклоалкил, -C(=O)Rc, где Rc представляет C1-C5алкил, или R2 и R3 вместе с соединяющими их атомами могут образовывать -(СН2)2-О-(СН2)2, -(СН2)4-, -(СН2)5-;
R4 представляет С1-С10алкил, который может быть замещен галогеном, галоген;
m принимает значения от 0 до 3;
R5 представляет С1-С10алкил, галоген, нитро;
R6 представляет собой фенил, нафтил, 5,6,7,8-тетрагидронафтил, С3-С6 циклоалкил, 9-оксофлуоренил, гетероциклическую группу, которая может быть насыщенной, ненасыщенной или ароматической, содержащей от 5 до 7 атомов углерода в кольце, из которых до 4 атомов могут представлять собой гетероатомы, такие как азот, кислород и сера и конденсированной, и каждая группа необязательно замещена одним или несколькими заместителями, выбранными из гидроксильной группы, галогена, циано, нитро, ОSO2СF3, -C(=O)Rc, (Rc обозначает С1-С5алкил, ди С1-С5алкиламино, С1-С5алкокси, фенил, возможно замещенный галогеном), диС1-С5 алкиламино, С3-С6 циклоалкила, галоген С1-С5алкила, тиазолила, тиeнила, диметиламинометиленамина, С1-С10алкила, С2-С7алкенила, С2-С7алкинила, фенила, -ORa (Ra обозначает С1-С5алкил, С2-С7алкенил, С2-С7алкинил, фенил, диметилпиримидинил, дихлорпиридил, тиадиазолил, -C(=O)Rc (Rc обозначает С1-С5алкил)), -SRa (Ra обозначает С1-С5алкил, фенил, С3-С6циклоалкил), тиадиазолила, и последние 7 групп, начиная с С1-С10 алкила, могут быть замещены одним или несколькими заместителями, которые могут быть одинаковыми или различными и выбраны из гидроксильной группы, галогена, нитро, циано, С1-С5алкила, галоген С1-С5алкила, С1-С5алкокси, -Si(Ra)3(Ra обозначает С1-С5алкил), метоксикарбонилметокси, С3-С6циклоалкила, фенокси (возможно замещенного С1-С5алкилом, галогеном), фенила (возможно замещенного С1-С5алкилом, галоген С1-С5алкилом), галоген С1-С5алкокси, бифенила, -C(=O)Rс (Rc обозначает С1-С5алкокси, фенила, возможно замещенного галоген С1-С5алкилом), тетрагидрофуранила, тетрагидропиранила, С1-С5алкил-COO-C1-C5алкила, С1-С5 алкоксикарбонил-N-метоксиимино, СН2СООСl-С5алкила, метоксикарбонилметокси,
А представляет прямую связь, -О-, -S(O)n-, -O-(A1)k-O-, -O-(A1)k-, -A2-, -NR9A2-, -ОА2-А1, -S(O)nA1-, -OA2-,
где n равно 0 или 2,
k принимает значения от 1 до 9;
А1 представляет -CHR7-;
А2 представляет -С(=Х)-;
X представляет О;
R7 представляет С1-С5 алкил, водород, циано, -C(=O)Rc (Rc обозначает С1-С5алкил);
R9 представляет незамещенный С1-С5алкил, водород;
где фрагмент, изображенный с правой стороны связующей группы А, присоединен к R6.
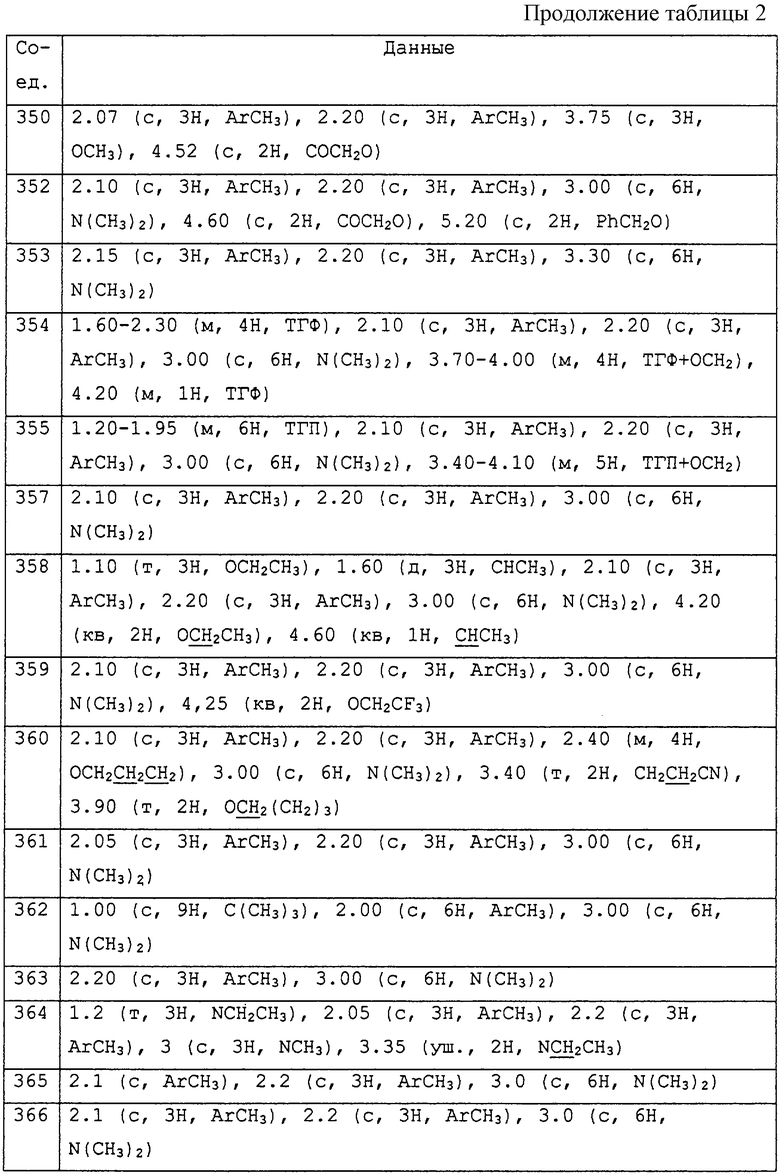
где R1 представляет С1-С10алкил, водород;
R2 и R3, которые могут быть различными, представляют водород, С1-С10алкил, возможно замещенный фенилом, С2-С7алкенил, цианогруппу, С1-С5алкоксигруппу, С1-С10 алкилкарбонил;
R4 представляет С1-С10алкил, который может быть замещен галогеном, галоген;
m принимает значения 0 или 1;
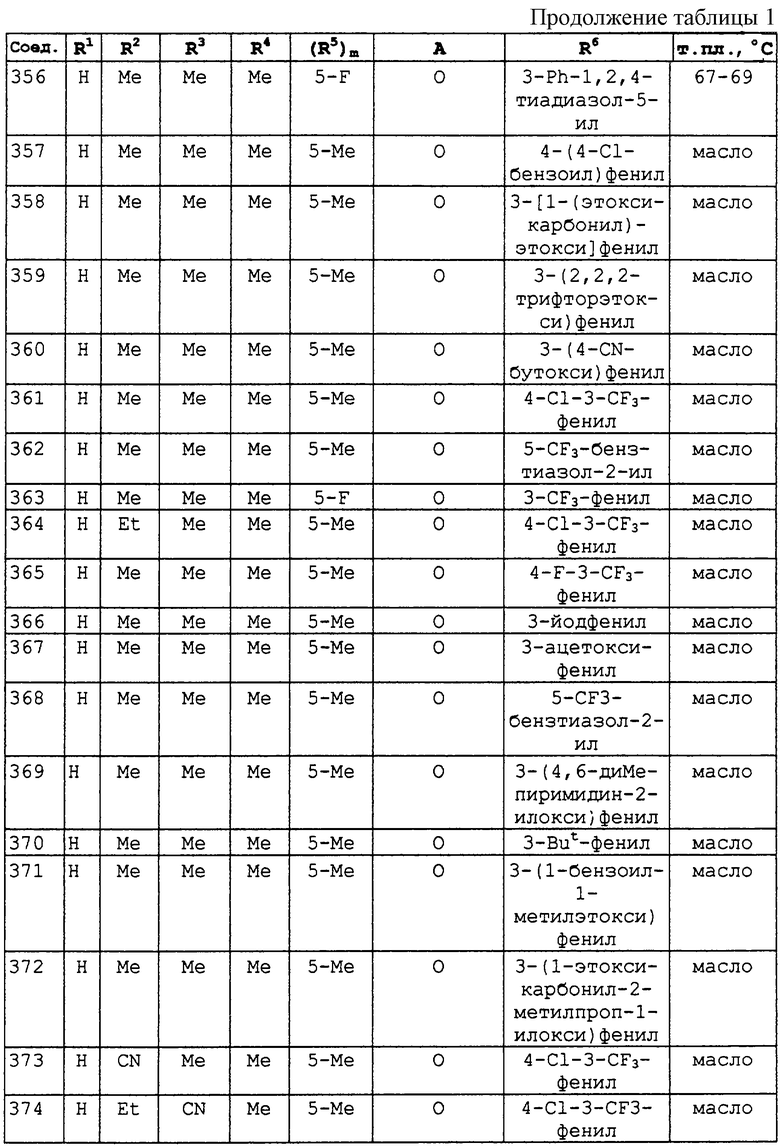
R5 представляет С1-С10алкил, галоген, водород;
А представляет прямую связь, -О- , -S-, -CHR7-, -O-CHR7-, где R7 представляет незамещенный С1-С5 алкил, водород, циано, -C(=O)Rc (Rc обозначает С1-С5 алкил);
А присоединен в положении 4 бензольного кольца М;
R6 представляет собой фенил или ароматический гетероциклил, содержащий от 5 до 7 атомов углерода в кольце, из которых до 4 атомов могут представлять собой гетероатомы, такие как азот, кислород и сера и конденсированный, и каждая группа необязательно замещена одним или несколькими заместителями, которые могут быть одинаковыми или различными и могут быть выбраны из следующего перечня: С1-С10алкила, галогена, галоген С1-С10алкила, галоген С1-С10алкокси, ди С1-С5алкиламиногруппы, циано, -C(=O)Rc (Rc обозначает С1-С5алкил, С1-С5алкокси, диалкиламино, фенил, возможно замещенный галогеном, галоген С1-С5алкилом), С1-С10алкокси, С1-С5алкилтио, С3-С6циклоалкила, фенила, необязательно замещенного галоген С1-С5алкокси, галоген С1-Салкилом, С1-С5алкокси, бензила, замещенного С1-С5алкилом.

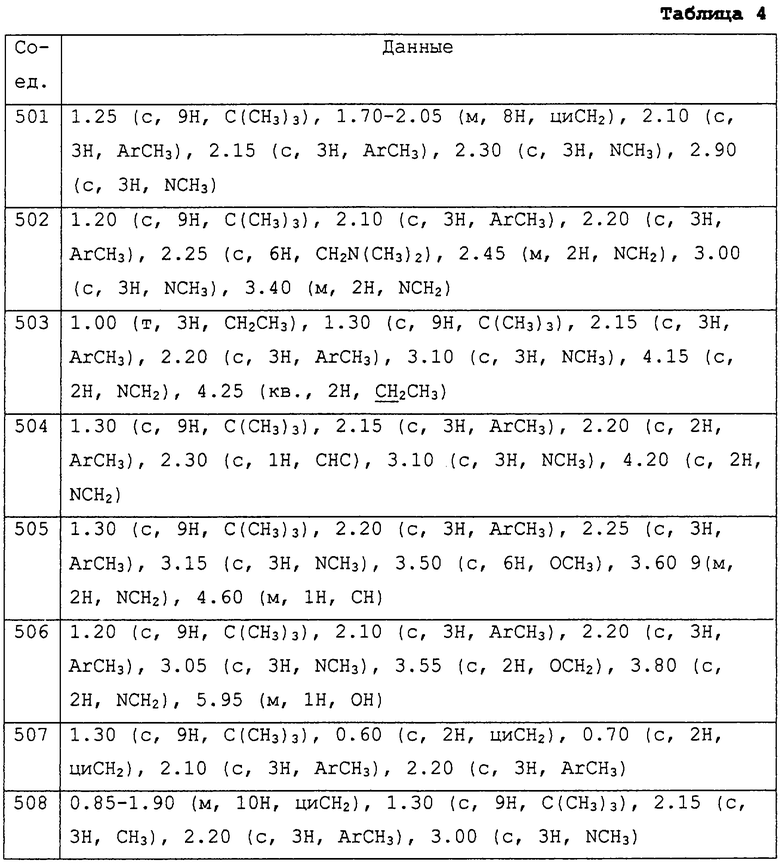
где R1 представляет С1-С10 алкил, водород;
R2 и R3, которые могут быть различными, представляют водород, С1-С10алкил, С2-С7 алкенил, С3-С6 циклоалкил, бензил или R2 и R3 вместе с соединяющими их атомами могут образовывать -(СН2)2-О-(СН2)2-, -(СН2)4-, -(СН2)5-;
R4 представляет С1-С10алкил, который может быть замещен галогеном;
m равен 1;
R5 обозначает С1-С10алкил и присоединен в положении 5 бензольного кольца М;
R6 представляет собой фенил, нафтил, 5,6,7,8-тетрагидронафтил, С3-С6циклоалкил, 9-оксофлуоренил, гетероциклическую группу, которая может быть насыщенной, ненасыщенной или ароматической, содержащей от 5 до 7 атомов углерода в кольце, из которых до 4 атомов могут представлять собой гетероатомы, такие как азот, кислород и сера и конденсированной, и каждая группа необязательно замещена одним или несколькими заместителями, выбранными из гидроксильной группы, галогена, циано, нитро, -C(=O)Rc (Rc обозначает С1-С5алкил, диС1-С5алкиламино, С1-С5алкокси, фенил, возможно замещенный галогеном), ди С1-С5алкиламино, С3-С6циклоалкила, галоген С1-С5алкила, тиазолила, тиенила, диметиламинометиленамина, С2-С7алкенилокси, С2-С7алкинилокси, С1-С10алкила, С2-С7алкенила, С2-С7алкинила, фенила, -ORa (Ra обозначает С1-С5алкил, фенил, диметилпиримидинил, дихлорпиридил, тиадиазолил, -C(=O)Rc (Rc обозначает С1-С5алкил)), -SRa (Ra обозначает С1-С5алкил, фенил, С3-С6циклоалкил), тиадиазолила, и последние 7 групп начиная с С1-С10алкила могут быть замещены одним или несколькими заместителями, которые могут быть одинаковыми или различными и выбраны из галогена, нитро, циано, С1-С5алкила, галоген С1-С5алкила, С1-С5алкокси, -Si(Ra) (Ra обозначает С1-С5 алкил), С3-С6циклоалкила, фенокси (возможно замещенного С1-С5 алкилом, галогеном), фенила (возможно замещенного С1-С5 алкилом, галоген С1-С5 алкилом), галоген С1-С5алкокси, бифенила, -C(=O)Rc (Rc обозначает С1-С5алкил, С1-С5алкокси, фенила, возможно замещенного галоген С1-С5алкилом), тетрагидрофуранила, тетрагидропиранила, метоксикарбонилметокси;
А представляет прямую связь, -О- , -S-, -CHR7-, -O-CHR7-, где R7 представляет незамещенный С1-С10алкил, водород, циано, -C(=O)Rc (Rc обозначает С1-С5алкил);
где -A-R6 находится в положении 4 бензольного кольца М и фрагмент, изображенный с правой стороны связующей группы А, присоединен к R6.
R2 и R3, которые могут быть различными, представляют водород, С1-С10алкил, С2-С7алкенил, бензил; R4 представляет С1-С10алкил; m равен 1; R5 обозначает С1-С10алкил и присоединен в положении 5 бензольного кольца М; R6 представляет собой фенил, нафтил, 5,6,7,8-тетрагидронафтил, С3-С6циклоалкил, 9-оксофлуоренил, гетероциклическую группу, которая может быть насыщенной, ненасыщенной или ароматической, содержащей от 5 до 7 атомов углерода в кольце, из которых до 4 атомов могут представлять собой гетероатомы, такие как азот, кислород и сера и конденсированной, и каждая группа необязательно замещена одним или несколькими заместителями, выбранными из гидроксильной группы, галогена, циано, нитро, -C(=O)Rc (Rc обозначает С1-С5алкил, ди С1-С5алкиламино, С1-С5алкокси, фенил, возможно замещенный галогеном), ди С1-С5алкиламино, С3-С6циклоалкила, галоген С1-С5алкила, тиазолила, тиенила, диметиламинометиленамина, С2-С7алкенилокси, С2-С7алкинилокси, С1-С10алкила, С2-С7алкенила, С2-С7алкинила, фенила, -ORa (Ra обозначает С1-С5алкил, фенил, диметилпиримидинил, дихлорпиридил, тиадиазолил, -C(=O)Rc (Rc обозначает С1-С5алкил)), -SRa (Ra обозначает С1-С5алкил, фенил, С3-С6циклоалкил), тиадиазолила, и последние 7 групп начиная с С1-С10 алкила могут быть замещены одним или несколькими заместителями, которые могут быть одинаковыми или различными и выбраны из галогена, нитро, циано, С1-С5алкила, галоген С1-С5алкила, С1-С5алкокси, -Si(Ra) (Ra обозначает С1-С5алкил), С3-С6циклоалкила, фенокси (возможно замещенного С1-С5алкилом, галогеном), фенила (возможно замещенного С1-С5алкилом, галоген С1-С5алкилом), галоген С1-С5алкокси, бифенила, -C(=O)Rc (Rc обозначает С1С5алкил, С1-С5 алкокси, фенила, возможно замещенного галоген С1-С5алкилом), тетрагидрофуранила, тетрагидропиранила, метоксикарбонилметокси; А представляет прямую связь, -О- , -S-, -CHR7-, -O-CHR7-, где R7 представляет незамещенный С1-С10алкил, водород, циано, -C(=O)Rc (Rc обозначает С1-С5алкил);
где -A-R6 находится в положении 4 бензольного кольца фрагмент, изображенный с правой стороны связующей группы А, присоединен к R6.
N’-[4-(3-трет-бутилфенокси)-2,5-диметилфенил]-N,N-диметилимидоформамид,
N’-[4-(3-трет-бутилфенокси)-2,5-диметилфенил]-N-этил-N-
метилимидоформамид,
N-аллил-N’-[4-(3-трет-бутилфенокси)-2,5-диметилфенил]-N-
метилимидоформамид,
N’-(4-{[4-(2-хлорфенил)-1,3-тиазол-2-ил]окси}-2,5-
диметилфенил)-N,N-диметилимидоформамид,
N’-[2,5-диметил-4-(3-феноксифенокси)фенил]-N-этил-N-
метилимидоформамид,
N’-{4-[4-хлор-3-(трифторметил)фенокси]-2,5-диметилфенил}-N,N-диметилимидоформамид,
N’-{4-[4-хлор-3-(трифторметил)фенокси]-2,5-диметилфенил}-N-этил-N-метилимидоформамид,
N’-{4-[3-(1-метокси-1-метилэтил)фенокси]-2,5-диметилфенил}-N,N-диметилимидоформамид,
N-этил-N’-{4-[4-фтор-3-(трифторметил)фенокси]-2,5-
диметилфенил}-N-метилимидоформамид.
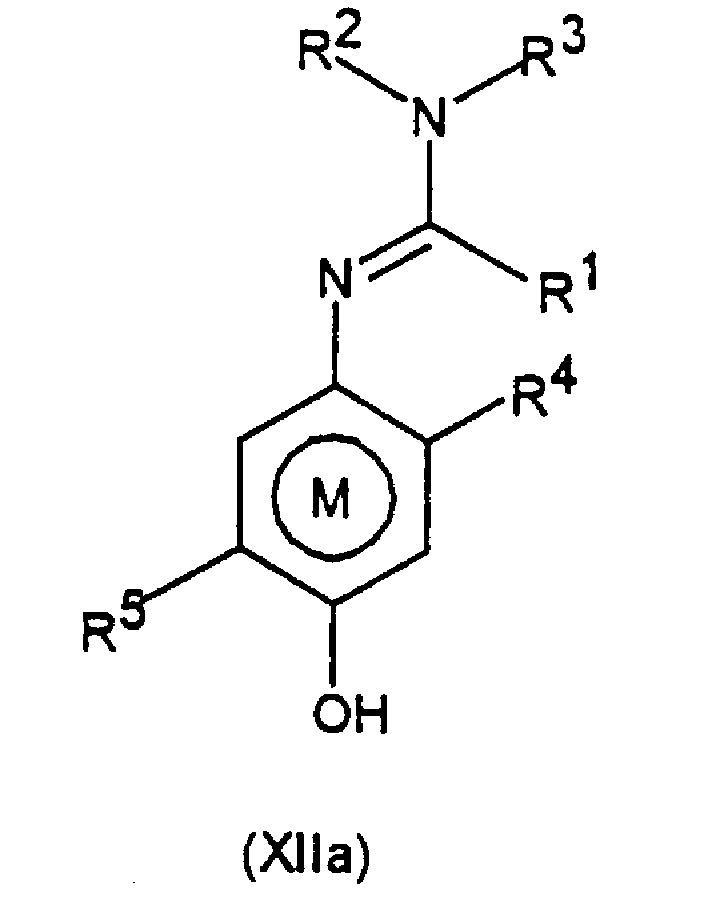
где R1 представляет С1-С10 алкил, водород;
R2 и R3, которые могут быть различными, представляют водород, С1-С10алкил, возможно замещенный фенилом, С2-С7алкенил, цианогруппу, -ORa, где Ra представляет С1-С10алкил, фенил, С3-С6циклоалкил, -С(=О)Rc, где Rc представляет С1-С5алкил, или R2 и R3 вместе с соединяющими их атомами могут образовывать –(СН2)2-О-(СН2)2-, -(СН2)4-, -(СН2)5-;
R4 представляет С1-С10алкил, который может быть замещен галогеном, галоген;
R5 представляет С1-С10алкил, галоген, нитро;
при условии, что R5 не является трет-бутилом.
| US 3284289, 08.11.1966 | |||
| US 4209319, 24.06.1980 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ ОБЪЕМА ГАЗА В ЗАМКНУТОЙ ПОЛОСТИ ПЕРЕМЕННОГО ОБЪЕМА | 1972 |
|
SU429281A1 |
| Средство для борьбы с клещами | 1973 |
|
SU651643A3 |
Авторы
Даты
2004-08-20—Публикация
2000-02-04—Подача