Изобретение относится к биотехнологии и касается способа получения питательной среды "Лимфокар" для культивирования лимфоцитов периферической крови человека и животных при проведении цитогенетических исследований.
В цитогенетической практике известно использование диагностических зарубежных наборов (Difco Co. (USA), Life Technologies Inc. (USA) (1,2), но их недостатком являются значительные затраты времени на дозирование каждого (часто дефицитного) компонента набора в отдельности. Такие зарубежные наборы состоят из питательной среды (6 мл), сыворотки крови крупного рогатого скота (КРС) или эмбрионов коров (эмбриональная телячья сыворотка) (1-1,5 мл) и фитогемагглютинина (50-200 мкг), к которым добавляют 0,5 мл венозной крови. Описана также культуральная среда, в которой эти компоненты предварительно смешаны и лиофилизированы (3). Обладая определенными преимуществами, такая среда тем не менее имеет недостатки, что и ранее упомянутые наборы. Эти недостатки определяются нестабильностью сыворотки, включенной в данную культуральную среду. Поскольку сыворотки крови являются белковым раствором сложного биохимического состава, возможность их стандартизации существенно ограничена.
Одним из путей решения проблемы стандартизации и одновременно оптимизации сывороток для культивирования лимфоцитов является удаление из нативной сыворотки компонентов, ингибирующих пролиферацию лимфоцитов. Поэтому задачей предлагаемого изобретения стала разработка готовой формы питательной среды, улучшение ростовых свойств которой в отношении лимфоцитов периферической крови достигается путем замещения СКРС фракцией сыворотки, свободной от ингибирующих факторов.
Ростовые качества сыворотки крупного рогатого скота достаточны для культивирования лимфоцитов, но в современной лабораторной практике эта сыворотка редко используется и заменяется эмбриональной телячьей сывороткой, поскольку последняя обладает наилучшими ростовыми качествами. Были учтены известные данные о возможном ингибирующем влиянии некоторых естественных сывороточных компонентов на пролиферативную активность лимфоцитов in vitro (4, 5, 6). С одной стороны, такие компоненты могут появляться в сыворотке из-за их микробиологической загрязненности во время сбора материала и до его стерилизации. С другой стороны, имеются данные (7), что некоторые окисленные ненасыщенные липиды, присутствующие в сыворотке крови, обладают выраженным ингибированием пролиферации лимфоцитов. При этом известно (8), что большинство липидов эффективно удаляется из растворов альбумина при его инкубировании с активированным углем при рН=3. Хотя альбумин является только одним из нескольких белков сыворотки крови, связывающих липиды, тем не менее можно было предположить, что обработка эмбриональной телячьей сыворотки активированным углем при рН=3 приведет к улучшению ее ростовых свойств в отношении лимфоцитов периферической крови. Этот принципиально новый подход и был реализован при разработке состава питательной среды "Лимфокар" для культивирования лимфоцитов, что обеспечило получение культуры активных лимфоцитов крови с митотическим индексом не менее 15%. При этом питательная среда соответствует следующим требованиям.
1. Все компоненты смешиваются в оптимальном соотношении.
2. Количество манипуляций со стерильными компонентами минимально.
3. Ростовые качества культуральной среды сохраняются в течение установленного срока хранения.
Получение питательной среды "Лимфокар" для культивирования лимфоцитов состоит из 2 процессов.
1. Приготовление растворителя - модифицированной среды RPMI-1640.
2. Приготовление лиофилизированной смеси стерильных компонентов.
Первоначально отдельно готовят модифицированную среду RPMI-1640 (далее именуется как растворитель), в которой, в отличие от стандартной питательной среды RPMI-1640, снижено содержание NaCl с 6 мг/мл до 4,8 мг/мл и отсутствует L-глутамин. Затем полученный раствор подвергают стерилизующей фильтрации через мембраны с диаметром пор 0,22 мкм и флаконируют.
Приготовление лиофилизированной смеси, согласно изобретению, состоит из нескольких этапов: обработки сыворотки, смешивания расчетных количеств других составляющих, стерилизации и флаконировании. Вначале сыворотку эмбрионов телят обрабатывают при рН=3,0 активированным углем для удаления всех связавшихся компонентов, затем в оставшейся фракции сыворотки (после доведения рН до 7,8) растворяют глутамин, пируват натрия, пенициллин-стрептомицин. ФГА-П добавляют в оптимальных соотношениях, поскольку при культивированиии лимфоцитов необходимо учитывать дозу ФГА-П и время культивирования клеток в его присутствии (9). При добавлении ФГА-П в концентрациях выше оптимальной может наблюдаться как ингибирование включения тимидина, так и подавление пролиферации клеток. Поэтому перед добавлением в среду ФГА-П контролируется его митогенная активность. Для этого вводится ФГА-П в различной концентрации от 40 мкг/мл до 80 мкг/мл в контролируемые образцы среды и определяется митотический индекс для образцов крови одного и того же здорового донора. Среднее количество ФГА-П 60 мкг/мл, что является оптимальным для данной серии среды, и митотический индекс составляет не менее 15%.
Далее полученный раствор подвергают стерилизующей фильтрации через мембраны с диаметром пор 0,22 мкм и разливают с помощью дозатора в стерильные пенициллиновые флаконы по 1 мл и лиофильно высушивают при следующем соотношении исходных составляющих:
Фракция эмбриональной телячьей сыворотки 1 мл
Фитогемагглютинин-П (ФГА-П) 60 мкг
L-глутамин 2,1 мг
Пируват натрия 5,39 мг
Стрептомицина сульфат 0,35 мг
Бензилпенициллина натриевая соль 350000 ЕД
При этом получается во флаконе лиофилизированная смесь стерильных компонентов.
Для приготовления питательной среды "Лимфокар" в каждый флакон необходимо добавить 7 мл отдельно приготовленного растворителя и 0,5 мл периферической крови доноров, а затем используют эти флаконы как ферментатор для культивирования лимфоцитов при 37°С в течение 72 час.
Предлагаемое техническое решение поясняется следующими примерами.
Пример 1.
В бутыли с сывороткой для осаждения токсических компонентов добавляют активированный уголь (из расчета: 1 л сыворотки-10 г акт. угля), предварительно отмытый раствором 0,2 М соляной кислоты. Затем доводят рН сыворотки до значения (3,0±0,3), добавляя раствор 0,2 М соляной кислоты, и инкубируют в течение 12 часов. Данный раствор центрифугируют при 10000 об/мин в течение 25 мин, при температуре 4-8°С. В результате образуется надосадочная жидкость и плотный осадок, надосадочную жидкость осторожно отделяют от осадка и используют в дальнейшей работе, осадок выливают.
На следующем этапе доводят рН сыворотки (надосадочной жидкости) до значения (7,8±0,2) путем добавления 0,2 М раствора гидроксида натрия. Затем к полученной фракции сыворотки 1000 мл добавляют 2,1 г L-глутамина, 5,39 г пирувата натрия, 70 мл раствора пенициллина-стрептомицина, содержащего 0,35 г стрептомицина сульфат, 350·106 ед. активности бензилпенициллина натриевой соли, затем добавляют 60 мг ФГА-П, растворенного в (60±1) мл стерильной деионизованной воды. Содержимое бутыля перемешивают в течение 15-20 минут до полного растворения и подвергают стерилизующей фильтрации через мембраны с диаметром пор 0,22 мкм с одновременным дозированием во флаконы по (1±0,1) мл, охлаждают до температуры "минус" 70°С не менее 12 час, а затем лиофильно высушивают в течение 36 часов. Замороженный образец лиофилизируется в вакууме 0,8 мкм рт.ст. При этом образец высыхает, не оттаивая, и не сопровождается вспениванием, что приводит к образованию на дне флакона мелкокристаллического продукта в форме “таблетки” повышенной растворимости. Получают 980-990 флаконов сухой лиофилизированной смеси стерильных компонентов. После смешивания мелкокристаллического белкового продукта с растворителем и получают однородный раствор - питательную среду "Лимфокар" для культивирования лимфоцитов крови человека и животных.
Пример 2.
В бутыли с сывороткой для осаждения токсических компонентов добавляют активированный уголь (из расчета: 1 л сыворотки - 10 г акт.угля). Далее см. пример 1. Затем к полученной фракции сыворотки 1000 мл добавляют 2,1 г L-глутамина, 5,39 г пирувата натрия, 70 мл раствора пенициллина-стрептомицина, содержащего 0,35 г стрептомицина сульфат, 350·106 ед. активности бензилпенициллина натриевой соли, затем добавляют 40 мг ФГА-П, растворенного в (40±1) мл стерильной деионизованной воды. Далее см. пример 1.
Пример 3.
Для определения контроля качества питательной среды "Лимфокар" к полученному раствору во флаконе добавляют 0,5 мл гепаринизированной крови произвольно отобранных доноров. Далее содержимое инкубируют при температуре (36±1)°С в течение 72 час, после чего останавливают клеточное деление на стадии метафазы, добавляя по 50 мкл 0,005%-ного раствора колхицина. И снова инкубируют при температуре (36±1)°С в течение 1 часа. Содержимое флаконов центрифугируют при 1000 об/мин в течение 7-10 мин.
Надосадочную жидкость сливают, осадок ресуспендируют в 10 мл раствора 0,56% калия хлористого, предварительно нагретого до температуры (36±1)°С. Затем клеточную суспензию инкубируют при температуре (36±1)°С в течение 10-12 мин, потом в вытяжном шкафу добавляют 2-3 мл свежеприготовленного фиксатора (этанол : ледяная уксусная кислота в соотношении 3:1). Осторожно перемешивают содержимое. Оставляют при температуре 2-4°С на 5-10 мин. Повторную смену фиксатора производят с помощью центрифугирования по описанной выше схеме через 15-20 мин. После центрифугирования оставляют 0,5 мл надосадочной жидкости, в которой ресуспендируют осадок. 5-7 капель клеточной суспензии наносят на обезжиренные охлажденные предметные стекла, которые высушивают либо при комнатной температуре, либо над пламенем горелки. После высушивания и окрашивания 2%-ным раствором красителя Гимза определяют митотический индекс по формуле:
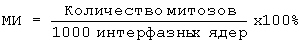 ,
,
который должен составлять не менее 15%.
Анализ экспериментальных данных показал, что вышеописанное изобретение - питательная среда "Лимфокар" для культивирования лимфоцитов крови человека и животных - в отличие от известных аналогов, содержит фракцию сыворотки с улучшенными ростовыми свойствами, что освобождает от необходимости создания асептических условий для культивирования лимфоцитов крови и стабилизирует среду при хранении. Предлагаемая среда удобна для использования в цитогенетической практике.
Литература:
1. Product Catalog for Microbiology, Tissue Culture and Cytogenetics, p.158, Difco Laboratories.
2. Product Catalogue and Reference Guide, Cytogenetics Products, p.7. Life Technologies.
3. Патент RU №2084523, кл. С 12 N 5/08, 1997.
4. C.W.Boone et al, In Vitro, vol.7, №3, 174-189, 1972.
5. C.R.Goodheart et al. Applied Microbiology, Oct., 525-528, 1973.
6. Philip C. Calder and Eric A. Newsholrne, Clinical Science, 82, 695-700, 1992.
7. Chow-Eng Low et al, J. of Lipid Research, vol.25, 1090-1095, 1984.
8. Raymond F.Chen, J. of Biological Chemistry, vol.242, №2, Issue of January, 25, 173-181, 1967.
9. Masayoshi Minegishi, at all, Leukemia Research Vol.19, №7, 433-442, 1995.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПИТАТЕЛЬНОЙ СРЕДЫ ДЛЯ КУЛЬТИВИРОВАНИЯ ЛИМФОЦИТОВ КРОВИ ЧЕЛОВЕКА | 1993 |
|
RU2084523C1 |
| СПЕЦИАЛИЗИРОВАННАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК АМНИОТИЧЕСКОЙ ЖИДКОСТИ И ФИБРОБЛАСТОВ ЧЕЛОВЕКА | 2009 |
|
RU2415929C2 |
| МАЛОСЫВОРОТОЧНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ФИБРОБЛАСТОВ ЧЕЛОВЕКА | 2011 |
|
RU2493250C2 |
| СПОСОБ ВЫЯВЛЕНИЯ ПАЦИЕНТОВ, ОБЛУЧЕННЫХ МАЛЫМИ ДОЗАМИ ИОНИЗИРУЮЩЕЙ РАДИАЦИИ | 2010 |
|
RU2430358C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТОВ МЕТАФАЗНЫХ ХРОМОСОМ СЕЛЬСКОХОЗЯЙСТВЕННОЙ ПТИЦЫ | 2006 |
|
RU2328733C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОЧНОГО ПРЕПАРАТА НА ОСНОВЕ АКТИВИРОВАННЫХ ЛИМФОЦИТОВ ИЗ ЛЕЙКОЦИТАРНЫХ ФИЛЬТРОВ | 2024 |
|
RU2835686C2 |
| СПОСОБ ЭКСПАНСИИ NK-КЛЕТОК ЧЕЛОВЕКА С ПОМОЩЬЮ ФИДЕРНЫХ КЛЕТОК | 2021 |
|
RU2781777C2 |
| СПОСОБ НАГРУЗКИ ДЕНДРИТНЫХ КЛЕТОК АНТИГЕНОМ ИНФЕКЦИОННОГО ПРОИСХОЖДЕНИЯ Opisthorchis felineus | 2011 |
|
RU2486238C1 |
| БИОЛОГИЧЕСКИ АКТИВНЫЙ ПРЕПАРАТ "ЛИМФОКИНИН", ОБЛАДАЮЩИЙ ИММУНОМОДУЛИРУЮЩИМИ СВОЙСТВАМИ | 1993 |
|
RU2048816C1 |
| ВАКЦИНА ПРОТИВ ТЕЙЛЕРИОЗА | 2005 |
|
RU2404800C2 |
Изобретение относится к биотехнологии и касается способа получения питательной среды используемой для культивирования лимфоцитов периферической крови человека и животных при проведении цитогенетических исследований. Среду готовят смешиванием растворителя - питательной среды RPMI-1640 с мелкокристалическим белковым лиофилизированным стерильным продуктом следующего состава: сыворотка эмбрионов телят, предварительно обработанная активированным углем при pH 2,7-3,2 с последующим доведением pH до 7,6-8,0, фитогемагглютинин-П (ФГА-П), L-глутамин, пируват натрия, стрептомицина сульфат, бензилпенициллина натриевая соль. При этом RPMI-1640 используют с содержанием хлористого натрия 4,8 мг/мл и отсутствием L-глутамина. Изобретение обеспечивает получение культуры активных лимфоцитов крови с митотическим индексов не менее 15%, ростовые качества среды стабильны в течение продолжительного срока хранения.
Способ получения питательной среды для культивирования лимфоцитов периферической крови человека и животных путем смешивания питательной среды RPM 1-1640 с сывороткой крови, фитогемагглютинином-П (ФГА-П), L-глутамином, стрептомицина сульфатом, бензилпенициллина натриевой солью, фильтрующей стерилизации смеси, дозирования и лиофильного высушивания, отличающийся тем, что в состав среды дополнительно вводят пируват натрия, из сыворотки крови используют сыворотку эмбрионов телят, предварительно обработанную активированным углем при рН 2,7-3,3, с последующим доведением рН до 7,6-8,0, а питательную среду RPM1-1640 используют с содержанием хлористого натрия 4,8 мг/мл и отсутствием L-глутамата и вносят ее в высушенную смесь при следующем содержании исходных компонентов:
Сыворотка эмбрионов
телят, предварительно обработанная активированным
углем при рН 2,7-3,3 с последующим доведением
рН до 7,6-8,0 1 мл
Фитогемагглютинин-П (ФГА-П) 600 мкг
L-глутамин 2,1 мг
Пируват натрия 5,39 мг
Стрептомицина сульфат 0,35 мг
Бензилпенициллина натриевая соль 350 000 ЕД
| СПОСОБ ПОЛУЧЕНИЯ ПИТАТЕЛЬНОЙ СРЕДЫ ДЛЯ КУЛЬТИВИРОВАНИЯ ЛИМФОЦИТОВ КРОВИ ЧЕЛОВЕКА | 1993 |
|
RU2084523C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУХИХ СТЕРИЛЬНЫХ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ КУЛЬТУР КЛЕТОК | 1996 |
|
RU2107724C1 |
Авторы
Даты
2004-09-20—Публикация
2002-05-22—Подача