Изобретение относится к области молекулярной биологии и биоорганической химии и может быть использовано для изготовления ДНК-чипов.
Создание микрочипов с иммобилизованными наборами олигонуклеотидов (ДНК-чипов) требует разработки эффективных способов иммобилизации олигонуклеотидов на твердые носители. Такие ДНК-чипы, представляющие собой твердые подложки с большим числом иммобилизованных олигонуклеотидов, могут использоваться для решения широкого спектра задач в молекулярной биологии, медицине, биотехнологии для анализа экспрессии генов, анализа мутаций, диагностики генетических, инфекционных и онкологических заболеваний.
Известны способы получения ДНК-чипов, включающие предварительную обработку стеклянной поверхности (твердой подложки) путем формирования на ней агарозной пленки [V.Afanassiev, V.Hanemann, S.Wolfl, Nucl.Acids Res., 2000, V.28, e66 (i-v)] или пленки из полилизина [R.Jenison, S.Yang, A.Haeberli, B.Polisky, Nature Biotechnology, 2001, V.19, 62-65] или полиэтиленимина [P.H.Lee, S.P.Sawan, Z.Modurson, L.J.Amold, M.A.Reynolds, Bioconjugate Chemistry, 2002, v.13, 97-103]. Агарозную пленку затем модифицируют с целью образования на поверхности альдегидных групп, наносят олигонуклеотид, содержащий аминолинкер и после образования ковалентных связей с поверхностью в виде оснований Шиффа их восстанавливают боргидридом натрия. В случае стеклянных слайдов, покрытых полилизином или полиэтиленимином, для образования ковалентной связи между подложкой и олигонуклеотидом, содержащим аминолинкер, используют бифункциональные сшивающие агенты.
Недостатками известных способов являются необходимость длительной предварительной подготовки твердой поверхности, использование дополнительных химических обработок для активирования поверхности, а также использование дополнительных реагентов, обеспечивающих образование ковалентной связи олигонуклеотида при соприкосновении с подложкой. При этом химическая реакция, приводящая к присоединению олигонуклеотида к поверхности, проходит с недостаточно высокой эффективностью, поскольку протекает на твердой фазе.
Наиболее близким к заявляемому способу - прототипом является способ получения ДНК-чипов [C.Consolandi, B.Castiglioni, R.Bordoni, E.Busti, C.Battaglia, L.R.Bernardi, G.De Bellis. Nucleosides, Nucleotides, Nucleic Acids, 2002, v.21, 561-580], заключающийся в том, что стеклянные слайды обрабатывают 3-глицидоксипропилтриметоксисиланом для введения эпоксигрупп на поверхность стекла, после чего стекла обрабатывают раствором полилизина в течение 1 часа, промывают и сушат. Затем аминогруппы полилизина активируют, погружая слайды в раствор 1,4-фенилендиизоцианата на 2 часа. После промывания и высушивания слайды хранят в темноте под вакуумом до использования. Полученные слайды используют для приготовления ДНК-чипов, для чего раствор олигонуклеотида, содержащего аминолинкер, наносят в виде рядов точек на поверхность слайда, слайды помещают на ночь в камеру с повышенной влажностью. Затем слайды обрабатывают в течение 15 мин буфером, содержащим этаноламин, для блокирования непрореагировавших изотиоцианатных групп, отмывают буфером и водой. После этого готовые ДНК-чипы пригодны для использования в последующих реакциях, основанных на методе молекулярной гибридизации.
Недостатком способа является необходимость длительной предварительной подготовки твердой подложки, а также использование дополнительных реагентов, обеспечивающих образование ковалентной связи олигонуклеотида при соприкосновении с подложкой. Реакция присоединения олигонуклеотида к поверхности протекает на твердой фазе, что приводит к низкой эффективности иммобилизации. Способ не позволяет варьировать поверхностную емкость иммобилизованных олигонуклеотидов на ДНК-чипах, а также предусматривает использование только стеклянных слайдов в качестве твердой подложки.
Технической задачей изобретения является упрощение известного способа и повышение его функциональных возможностей.
Поставленная техническая задача достигается предлагаемым способом, заключающимся в следующем.
Предварительно проводят синтез конъюгата олигонуклеотида с соответствующим линкером по стандартной методике [Годовикова Т.С., Зарытова В.Ф., Халимская Л.М. Биоорганическая химия, 1986, т.12, 475-481]. В качестве линкера используют различные полиамины. Олигонуклеотид, содержащий 5’- или 3’-концевую фосфатную группу, активируют парой трифенилфосфин-дипиридилдисульфид в присутствии нуклеофильного катализатора в абсолютном органическом растворителе (диметилсульфоксид или диметилформамид), после чего образующееся активное производное инкубируют с полиамином в подходящем растворителе (диметилсульфоксид, диметилформамид или вода), что приводит к образованию конъюгата пoлиaмин-oлигoнyклeoтид (PA-oligo)
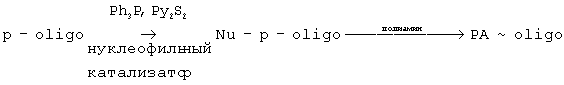
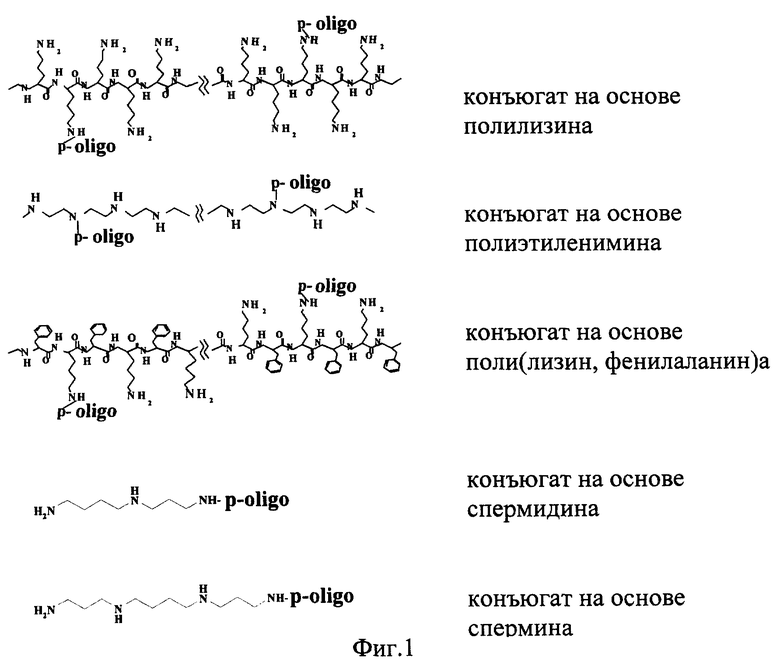
В качестве нуклеофильного катализатора преимущественно используют метилимидазол, диметиламинопиридин или N-окись диметиламинопиридина. В качестве полиамина могут использоваться различные полиамины, содержащие от 3 до 1000 аминогрупп в молекуле, в частности спермин, спермидин, полилизин, поли (лизин-фенилаланин), полиэтиленимин (фиг.1). К одной молекуле полиамина могут присоединиться несколько молекул олигонуклеотида. Соотношение PA/oligo можно варьировать, меняя исходное количество взятых в реакцию компонентов (полиамина и олигонуклеотида).
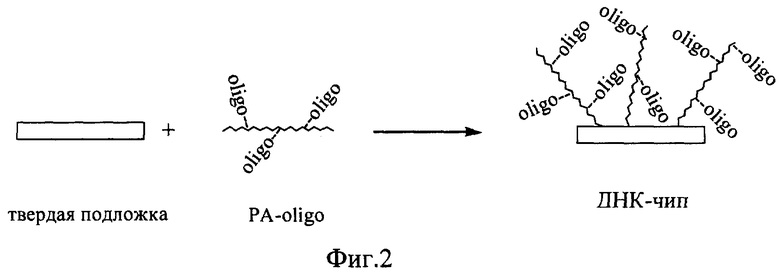
Полученный раствор конъюгата PA-oligo разбавляют диметилсульфоксидом или водой до необходимой концентрации, равной от 1· 10-7 М до 1· 10-3, добавляют раствор NaOH до конечной концентрации 0,01-0,001 М, полученную реакционную смесь наносят на поверхность твердой подложки в виде рядов точек в объеме 0.1-1.0 мкл и высушивают на воздухе с последующей отмывкой от несвязавшихся компонентов (фиг.2). Затем подложку обрабатывают раствором уксусного ангидрида в течение 5 мин для блокирования свободных аминогрупп, отмывают и используют в качестве ДНК-чипа. В качестве твердой подложки могут использоваться любые материалы (как гранулированные, так и в виде плоских поверхностей): стекло, кремний, капрон, нитроцеллюлоза, бумага, пластиковые планшеты, металл, керамика, полимеры разной природы.
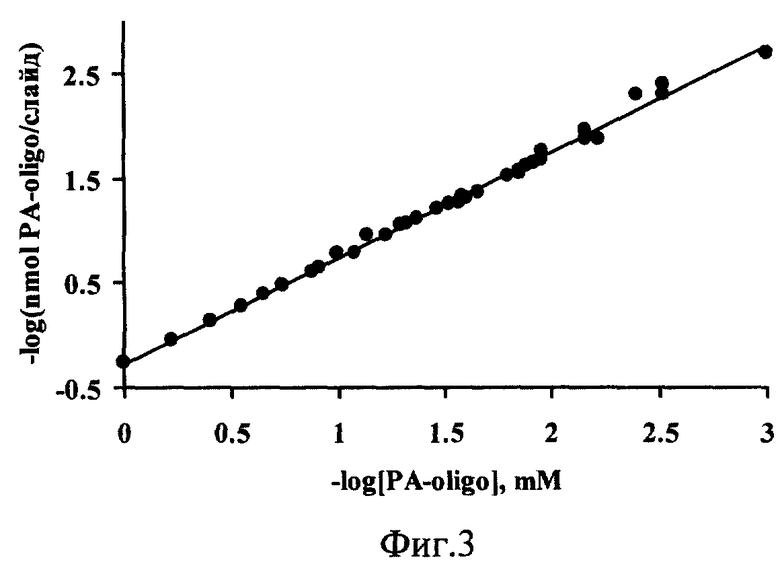
Способ обеспечивает прочное связывание конъюгата PA-oligo с подложкой: промывание ДНК-чипов калий-фосфатным буфером (рН 7.0) и водой (~90°С) приводит к потере 10-20% иммобилизованного олигонуклеотида по сравнению со слайдами; промытыми буфером и водой при комнатной температуре; даже после отмывки детергентом олигонуклеотид все еще остается связанным с поверхностью (50%). Количество связавшегося с поверхностью иммобилизованного конъюгата PA-oligo и соответственно его поверхностная емкость линейно зависит от его концентрации в исходном растворе в широком диапазоне концентраций - от 1· 10-7 М до 1· 10-3 М (фиг.3). (Эксперименты проведены с использованием [32P]-меченного олигонуклеотида). Выход иммобилизации, т.е. отношение связавшегося с поверхностью олигонуклеотида к количеству наносимого конъюгата из раствора не зависит от концентрации исходного конъюгата и составляет 90-95%. Таким образом, изменяя концентрацию конъюгата PA-oligo в исходном растворе, можно получать ДНК-чипы с заранее заданной поверхностной емкостью иммобилизованных олигонуклеотидов.
Иммобилизованные конъюгаты PA-oligo проявляют с помощью раствора феназиний бромида (фиг.4) [Зарытова В.Ф., Кутявин И.В., Левина А.С., Мамаев С.В., Подыминогин М.А. Докл. АН СССР, 1988, т.302, 102-104] или с помощью конъюгата стрептавидин-щелочная фосфатаза и хромогенных субстратов в случае, если олигонуклеотид содержит биотиновую метку (фиг.5) [Кабилов М.Р., Пышный Д.В., Дымшиц Г.М., Гашникова Н.М., Покровский А.Г., Зарытова В.Ф., Иванова Е.М. Мол. биология, 2002, т.36, 424-431].
Для демонстрации возможности использования полученных предлагаемым способом ДНК-чипов в гибридизационном анализе проводили следующие эксперименты. Стеклянные слайды с иммобилизованным конъюгатом PA-oligo обрабатывали буфером, содержащим 400-звенный фрагмент ДНК, содержащий биотиновую метку и имеющий в своей структуре участок, комплементарный иммобилизованному олигонуклеотиду. В контрольном эксперименте использовали аналогичный фрагмент ДНК, не имеющий комплементарного участка. После проведения реакции с фрагментами ДНК слайды отмывали буфером, и присоединившиеся фрагменты ДНК проявляли по биотиновой метке с помощью конъюгата стрептавидин-щелочная фосфатаза и хромогенных субстратов. Из фиг.6 видно, что при исходной концентрации иммобилизованного олигонуклеотида 4· 10-7-8· 10-7 М происходит специфическое связывание только того фрагмента ДНК, который содержит участок, комплементарный иммобилизованному олигонуклеотиду.
Определяющими отличиями предлагаемого способа от прототипа являются следующие.
1. Проводят предварительный синтез конъюгата полиамин-олигонуклеотид (PA-oligo), что позволяет:
- практически количественно присоединять олигонуклеотид к твердой подложке; реакция, приводящая к образованию ковалентной связи между олигонуклеотидом и линкером, впоследствии иммобилизованным на поверхность, происходит с максимальной эффективностью;
- присоединять конъюгат к любой твердой поверхности и таким образом расширить функциональные возможности способа, т.е. использовать получаемые конъюгаты как универсальные производные олигонуклеотидов для приготовления ДНК-чипов различного формата (ДНК-чипы на плоских слайдах и пленках, на пластиковых планшетах, на гранулированных носителях);
- избежать использования кросс-сшивающих или активирующих реагентов в процессе иммобилизации олигонуклеотидных конъюгатов на твердую поверхность;
- присоединять несколько молекул олигонуклеотида к полиамину, что повышает эффективность иммобилизации.
- присоединять олигонуклеотид, содержащий полиаминовый линкер, к немодифицированной поверхности, что позволяет значительно упростить и ускорить процесс приготовления ДНК-чипов.
2. Нанесение раствора, содержащего конъюгат полиамин-олигонуклеотид, на твердую подложку осуществляют в концентрации 1· 10-7 М - 1· 10-4 М в присутствии 0.01-0.001М NaOH, что позволяет присоединять конъюгат к твердой поверхности в количестве, задаваемом его исходной концентрацией и, таким образом, варьировать поверхностную емкость иммобилизованного олигонуклеотида в широком интервале (от 3· 10-6 до 3· 10-3 нмол/мм2).
Пример 1.
Предварительно осуществляют синтез конъюгата олигонуклеотида с полилизином (PA-oligo). К раствору олигонуклеотида pGCATCAAG (1· 10-2 мкмол) в 60 мкл диметилсульфоксида (DMSO) добавляют по 10 мг трифенилфосфина (Рh3Р), дипиридилдисульфида (Py2S2) и диметиламинопиридина (DMAP). Реакционную смесь встряхивают при 37°С в течение 15 мин, после чего активированный олигонуклеотид осаждают эфиром и переосаждают 2 раза 2% раствором LiClO4 в ацетоне. Остаток растворяют в 96 мкл воды и добавляют 4 мкл 0.1 М водного раствора полилизина (концентрация дана в расчете на остаток лизина). Реакционную смесь оставляют на 1 час при комнатной температуре. Образование конъюгата полилизин-олигонуклеотид (PA-oligo) проверяют с помощью ТСХ в системе изопропанол-аммиак-вода (6:1:3). Продукт имеет нулевую подвижность в отличие от исходного олигонуклеотида. Реакционную смесь, содержащую конъюгат PA-oligo, используют для иммобилизации на твердую поверхность. Раствор PA-oligo может храниться в течение нескольких месяцев перед использованием. Перед нанесением на подложку к раствору добавляют NaOH до концентрации 0.01 М. Затем раствор конъюгата с концентрацией 1· 10-4 М с помощью микропипетки наносят на поверхность стеклянной подложки по 0.1 мкл в виде рядов точек (диаметр образующихся пятен ~0.5 mm2). В качестве твердой подложки используют стекло. После нанесения капель подложку высушивают, промывают 0.5 М К-фосфатным буфером (рН 7) и водой. Получают ДНК-чип с поверхностной плотностью иммобилизованного олигонуклеотида в пятне 3· 10-3 нмол/мм2. Для визуализации иммобилизованных конъюгатов слайды окрашивают с помощью раствора феназиний бромида в 0.2 М Ка2СО3 (фиг.4).
Пример 2.
Эксперимент проводят, как в примере 1, но перед нанесением на подложку к раствору конъюгата добавляют NaOH до концентрации 0.001 М.
Пример 3.
Эксперимент проводят, как в примере 1, но в качестве полиамина используют спермидин. В качестве олигонуклеотида используют pGGCA-bio (bio - остаток биотина, присоединенный к 3’-концевому фосфату через пропилендиаминовый линкер). Раствор конъюгата наносят на стеклянную подложку микропипеткой по 2 мкл (диаметр образующихся пятен ~2 mm2). Визуализацию иммобилизованного конъюгата PA-oligo проводят по биотиновой метке с помощью конъюгата стрептавидин-щелочная фосфатаза и хромогенных субстратов (фиг.5).
Пример 4.
Эксперимент проводят, как в примере 1, но в качестве растворителя на стадии реакции с полиамином используют диметилсульфоксид (DMSO). Для этого активированный олигонуклеотид после взаимодействия с парой Рh3Р-Py2S2 в присутствии DMAP осаждают эфиром и переосаждают два раза эфиром из DMSO. Затем осадок растворяют в 96 мкл DMSO и добавляют 4 мкл 0.1 М раствора полилизина в DMSO.
Пример 5.
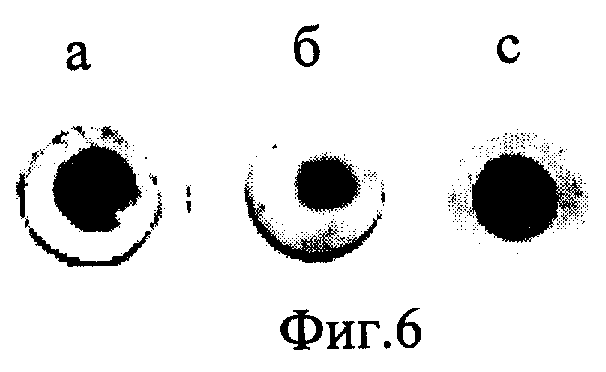
Эксперимент проводят, как в примере 1, но в качестве твердой подложки используют нитроцеллюлозу, нейлон и полихлорвинил (фиг.6 а, б и с соответственно). Проявление пятен проводят с использованием конъюгата стрептавидин-щелочная фосфатаза и хромогенных субстратов.
Пример 6.
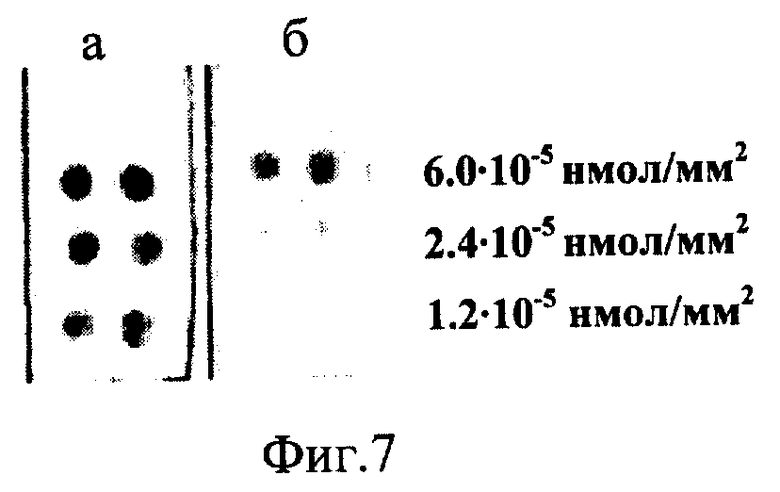
Синтез PA-oligo проводят, как в примере 1. В качестве олигонуклеотида используют 15-мер GATTATTTGGAAAAGp. Реакционную смесь после синтеза конъюгата PA-oligo разбавляют водой до необходимой концентрации (2· 10-6 М, 8· 10-7 М и 4· 10-7 М) и добавляют NaOH до концентрации 0.01 М. Конъюгат наносят на стеклянные слайды, высушивают и промывают, как описано в примере 1. Поверхностная плотность иммобилизованных олигонуклеотидов на слайдах оценена как 6.0· 10-5 нмол/мм2, 2.4· 10-5 нмол/мм2 и 1.2· 10-5·нмол/мм2 в соответствии с выбраными концентрациями. На поверхность подложки наносят смесь диоксан-вода (1:1), содержащую 1% уксусного ангидрида, 1% метилимидазола и 2% триэтиламина. Через 10-15 мин подложку отмывают водой. Слайды погружают в водный раствор БСА (2.5 мг/мл), через 30 мин вынимают и проводят гибридизацию с фрагментами ДНК. Для этого слайды покрывают буферным раствором, содержащим БСА (0.25 мг/мл) и комплементарный или некомплементарный 400-звенные фрагменты ДНК (7· 10-8 М), несущие биотиновую метку. Гибридизацию проводят при 62°С в буфере, содержащем 0.5 М NaCl, 0.1 М Трис-HCl (рН 7.5) и 0.01 М MgCl2. Слайды отмывают буфером, содержащим 0.1 М NaCl, 0.02 М Трис-НСl (рН 7.5), 0.002 М MgCl2, 0.05% Tween-20 и БСА (0.06 мг/мл). Затем биотиновую метку в составе ДНК, адсорбированной на поверхность слайда, проявляют с помощью конъюгата стрептавидин-щелочная фосфатаза и хромогенных субстратов. Специфическое связывание комплементарного фрагмента ДНК (фиг.7а) происходит при поверхностной плотности конъюгата PA-oligo 2.4· 10-5 нмол/мм2 и 1.2· 10-5 нмол/мм2. Некомплементарный фрагмент (фиг.7б) связывается при более высокой поверхностной плотности иммобилизованного конъюгата PA-oligo (6.0· 10-5 нмол/мм2).
Предлагаемый способ получения ДНК-чипов обладает следующими преимуществами перед известным способом:
- иммобилизацию олигонуклеотидов на поверхность твердой подложки осуществляют более простой, воспроизводимой и эффективной процедурой;
- иммобилизация конъюгатов PA-oligo на твердую поверхность протекает практически количественно;
- поверхностную емкость иммобилизованных олигонуклеотидов варьируют путем изменения исходной концентрации конъюгата PA-oligo;
- для получения олигонуклеотидных конъюгатов используют полиамины с числом аминогрупп в молекуле от 3 до 1000;
- способ обеспечивает получение стабильных коньюгатов, которые могут храниться в растворе в течение, по крайней мере, нескольких месяцев перед использованием;
- конъюгаты олигонуклеотидов с полиаминами могут присоединяться к любой твердой поверхности, что делает их универсальными производными для получения ДНК-чипов любого формата.
Кроме того, предлагаемый способ обеспечивает “трехмерную” иммобилизацию олигонуклеотидов на твердую поверхность, что позволяет имитировать “растворный” (более эффективный, чем твердофазный) вариант проведения последующих реакций с биополимерами. Иммобилизованные олигонуклеотиды находятся на оптимальном расстоянии от поверхности твердой подложки, что позволяет избежать стерических затруднений при последующих взаимодействиях с биомолекулами, находящимися в растворе.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАНОКОМПОЗИТЫ ДИОКСИДА ТИТАНА ДЛЯ ИНАКТИВАЦИИ ВИРУСНОГО ГЕНОМА ВНУТРИ КЛЕТОК, СПОСОБ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2444571C2 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОРАЗМЕРНОЙ СИСТЕМЫ ДОСТАВКИ ФРАГМЕНТОВ НУКЛЕИНОВЫХ КИСЛОТ И ИХ АНАЛОГОВ В КЛЕТКИ МЛЕКОПИТАЮЩИХ | 2012 |
|
RU2499045C1 |
| НАНОКОМПОЗИТ С АКТИВНЫМ ЛИГАНДОМ, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ АДРЕСНОЙ ИНАКТИВАЦИИ ВИРУСА ГРИППА ВНУТРИ КЛЕТКИ | 2012 |
|
RU2496878C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДНК-ЧИПОВ (ВАРИАНТЫ) | 2005 |
|
RU2315114C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДНК-ЧИПА | 2007 |
|
RU2340677C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОГЕЛЯ С ТЕРМООТЩЕПЛЯЕМЫМИ НУКЛЕИНОВЫМИ КИСЛОТАМИ | 2022 |
|
RU2826936C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДНК-ЧИПОВ | 2006 |
|
RU2321574C2 |
| Способ получения системы доставки фрагментов нуклеиновых кислот в клетки млекопитающих | 2016 |
|
RU2646113C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОДНОНУКЛЕОТИДНЫХ ЗАМЕН В ИЗВЕСТНЫХ ПОСЛЕДОВАТЕЛЬНОСТЯХ НУКЛЕИНОВЫХ КИСЛОТ | 2003 |
|
RU2247781C2 |
| СПОСОБ И ПРОДУКТ ДЛЯ ЛОКАЛИЗОВАННОЙ ИЛИ ПРОСТРАНСТВЕННОЙ ДЕТЕКЦИИ НУКЛЕИНОВОЙ КИСЛОТЫ В ОБРАЗЦЕ ТКАНИ | 2012 |
|
RU2603074C2 |


Изобретение относится к области молекулярной биологии и биоорганической химии и может быть использовано для изготовления ДНК-чипов. Для изготовления чипа предварительно проводят синтез конъюгата полиамин-олигонуклеотид (PA-oligo) по стандартной методике. Для этого олигонуклеотид, содержащий 5’- или 3’-концевую фосфатную группу, активируют парой трифенилфосфин-дипиридилдисульфид в присутствии нуклеофильного катализатора в абсолютном органическом растворителе, после чего образующееся активное производное инкубируют с полиамином в подходящем растворителе (диметилсульфоксид, диметилформамид или вода). В качестве нуклеофильного катализатора используют преимущественно метилимидазол, диметиламинопиридин или N-окись диметиламинопиридина. В качестве полиамина используют различные полиамины, содержащие от 3 до 1000 аминогрупп в молекуле. Полученный раствор конъюгата PA-oligo разбавляют до необходимой концентрации, равной 1·10-7-1·10-4 М, добавляют NaOH до конечной концентрации 0,01-0,001 М, полученную реакционную смесь наносят на твердую подложку в виде рядов точек и высушивают на воздухе с последующей отмывкой от несвязавшихся компонентов. В качестве твердой подложки используют стекло, кремний, капрон, нитроцеллюлозу, бумагу, пластиковые планшеты, металл, керамику, полимеры разной природы. Способ более прост в исполнении, позволяет получать ДНК-чипы с заданной поверхностной плотностью иммобилизованных олигонуклеотидов. 2 з.п. ф-лы, 7 ил.
| CONSOLANDI С | |||
| et al | |||
| Nucleosides, Nucleotides, Nucleic Acids | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| СПОСОБ ИММОБИЛИЗАЦИИ ОЛИГОНУКЛЕОТИДОВ, СОДЕРЖАЩИХ НЕПРЕДЕЛЬНЫЕ ГРУППЫ, В ПОЛИМЕРНЫХ ГИДРОГЕЛЯХ ПРИ ФОРМИРОВАНИИ МИКРОЧИПА | 1999 |
|
RU2175972C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ МИКРОЧИПОВ НА ОСНОВЕ ОЛИГОНУКЛЕОТИДОВ | 1999 |
|
RU2157385C1 |
| Способ получения акролеина из глицерина | 1936 |
|
SU52208A1 |
| WO 9828444 А, 08.09.2000 | |||
| US 5851772 A, 22.12.1998. | |||
Авторы
Даты
2004-09-20—Публикация
2003-04-14—Подача