Изобретение относится к молекулярной биологии и может быть использовано для получения ДНК-чипов с иммобилизованными олигонуклеотидными зондами (ОНЗ) с последующим их использованием для параллельного выявления анализируемых последовательностей ДНК методом обратной молекулярной гибридизации, в том числе с использованием ДНК-зависимых ферментов.
ДНК-чипы, состоящие из плоских твердофазных носителей (мембраны, подложки или слайды) и иммобилизованных на них нуклеиновых кислот (НК) и их фрагментов (олигонуклеотидные зонды), в последнее десятилетие успешно используются специалистами, работающими в областях биохимии, генной инженерии и молекулярной биологии как для исследовательских целей [DNA arrays. Methods and protocol, Edited by J.B.Rampal, Human PRESS, New Jersey, 2003], так и в качестве инструментов медицинской диагностики инфекционных, онкологических и наследственных заболеваний [Veltman J.A. Curr. Opin. Pediatr., 2006, V.18, P.598-603].
Несмотря на широкий спектр применения ДНК-чипов, существуют два способа их получения: непосредственный синтез олигонуклеотидных зондов (ОНЗ) на поверхности носителя [Beier M., et al. Nucleic Acids Res., 2000, V.28, P. 11] и постсинтетическое присоединение (или иммобилизация) олигонуклеотидных зондов на носитель [Beaucage S.L., et al. Curr. Med. Chem, 2001, V.8, P.1213-1244]. Способ иммобилизации НК является важным аспектом для проведения гибридизационного анализа, поскольку от него зависит как эффективность присоединения олигонуклеотидного зонда к поверхности носителя (емкость ДНК-чипа), так и обеспечение сохранности и доступности олигонуклеотидной последовательности зонда для последующего взаимодействия с анализируемой ДНК в гетерофазной системе.
Первый способ (синтез на поверхности) позволяет сразу получать зонды на носителе, т.е. исчезает необходимость удаления синтезированных олигонуклеотидов с носителя, выделения олигонуклеотидов из реакционной смеси и иммобилизации их на носитель. Однако одновременно это является и недостатком, так как в этом случае присоединенными оказываются и продукты неполного синтеза олигонуклеотидного зонда, т.е. возникают трудности обеспечения качества (или полной сохранности) олигонуклеотидов на поверхности.
Второй способ - постсинтетическое присоединение олигонуклеотидов на носитель, с этой точки зрения, обеспечивает получение подложки с равными (по отношению к иммобилизованному олигонуклеотиду) качественными и количественными (емкостными) свойствами. Постсинтетическое получение ДНК-чипа можно подразделить на следующие подходы: с предварительной активацией олигонуклеотидного зонда и/или активацией поверхности носителя.
Наиболее ближайшим к предлагаемому способу - прототипом является способ получения ДНК-чипа путем иммобилизации (присоединения) олигонуклеотидных зондов к капроновому носителю с помощью ультрафиолетового (УФ) облучения с последующим использованием его для выявления методом параллельного гибридизационного анализа анализируемых последовательностей нуклеиновых кислот, в том числе содержащих точечные мутации [Saiki R.K., et al. Proc. Natl. Acad. Sci U.S.A, 1989, V.86, P.6230-6234]. Для получения ДНК-чипа используют ОНЗ следующей структуры: (N)19 3' (Т)400. О наличии искомых последовательностей нуклеиновых кислот судят после проведения обратной гибридизации, когда образование гибридизационных комплексов ДНК и олигонуклеотидных зондов детектируют с помощью репортерных группировок, вводимых в анализируемую ДНК.
Недостатками прототипа являются:
1) введение длинной последовательности поли(Т) в состав ОНЗ с помощью ферментов, что затрудняет стандартизацию и масштабирование при получении зонда;
2) невозможность использования ДНК-зависимых ферментов для введения репортерной группы на 3'-конец мобилизованного олигонуклеотида после образования гибридизационного комплекса анализируемая ДНК/олигонуклеотид и соответственно ковалентного присоединения метки к поверхности носителя.
Технической задачей изобретения является упрощение способа, повышение поверхностной емкости ДНК-чипа и увеличение интенсивности специфических сигналов при анализе ДНК, обеспечиваемых ДНК-чипами.
Поставленная техническая задача достигается предлагаемым способом получения ДНК-чипа, заключающимся в следующем.
Предварительно проводят синтез олигонуклеотидного зонда (ОНЗ) заданной структуры (Т)t˜5'(N)n, где:
(T)t - последовательность поли(Т), длиною t нуклеотидов, расположенная на 5'-конце олигонуклеотидной части зонда и представляющая собой повторяющиеся тимидилатные основания Т;
˜ - диэтиленгликолевый линкер, который связывает последовательность поли(Т)t с олигонуклеотидной частью зонда;
(N)n - олигонуклеотидная часть зонда, вовлеченная в процесс образования гибридизационного комплекса с анализируемой ДНК, где N - нуклеотидные основания А, С, G, Т, a n - длина олигонуклеотидной части (или общее количество N);
5' - конец олигонуклеотидной части, через которую она соединена с последовательностью поли(Т) посредством диэтиленгликолевого линкера.
Далее на поверхность капроновой мембраны, смоченной одним из стандартных буферных растворов (PBS, SSC, ТЕ), наносят в задаваемом порядке 0.2-0.5 мкл зондов в концентрации 1·10-7М-1·10-4М. Количество точек нанесения зависит от количества зондов. Затем капроновую мембрану подвергают ультрафиолетовому облучению в дозе 0.08-1.33 Дж/см2. После завершения фотоинициированного облучения капроновую мембрану промывают последовательно водой и этиловым спиртом и высушивают на воздухе.
Полученные иммобилизованные ОНЗ со структурой (T)t˜5'(N)n формируют гибридизационные комплексы с последовательностью анализируемой ДНК. Выявление анализируемой последовательности происходит после ковалентного введения репортерной группы в состав иммобилизованного ОНЗ (и соответственно на поверхность ДНК-чипа) с помощью ДНК-зависимых ферментов. Введение репортерной группы проводят при температуре 15-70°С в течение 10-60 минут. Ковалентное присоединение метки, в свою очередь, позволяет использовать жесткие отмывочные процедуры для удаления неприсоединенной репортерной группы (в денатурирующих условиях: при повышенной температуре, в присутствии спирта и в отсутствие соли). В результате использования жестких отмывочных условий уровень неспецифического сигнала (или фона) значительно снижается, в то время как относительная интенсивность специфических сигналов анализа увеличивается.
Выявление ДНК методом параллельного анализа с помощью полученного капронового ДНК-чипа, несущего фотоиммобилизованные зонды, может быть осуществлено в условиях гетерофазной обратной гибридизации, при этом введение репортерной группы в гибридизационный комплекс происходит при использовании ДНК-зависимых ферментов, таких как полимеразы (например, Taq ДНК полимераза или секвеназа) или лигазы (например, Т4 ДНК лигаза, Taq ДНК полимераза).
Эксперименты проводили на нуклеиновых кислотах, являющихся продуктами симметричной амплификации ДНК, которые предварительно денатурировали нагреванием при 95-100°С в течение 2-10 мин или добавлением 0.1-0.2 М NaOH. Реакцию выявления анализируемой последовательности НК проводили в интервале температур 15-70°С в течение 10-60 мин в стандартных буферных растворах:
PBS: 0.5 М NaCl, 10 mM EDTA, 10 mM фосфат натрия рН 7.2.
SSPE: 0.18 М NaCl, 10 mM фосфат натрия, 1 mM EDTA, рН 7.0.
SSC: 15 mM цитрат натрия, 150 mM NaCl, рН 7.0.
ТЕ: 10 mM tris рН 7.8, 1 mM EDTA, 0.5 M NaCl.
Определяющими существенными отличиями предлагаемого способа от прототипа являются:
1. В качестве фотоиммобилизуемого на капрон олигонуклеотидного зонда используют зонд со структурой (T)t˜5'(N)n, состоящий из олигонуклеотидной части, короткого тимидилатного домена и связывающего их диэтиленгликолевого линкера, что позволяет упростить способ, поскольку олигонуклеотидные зонды заданной структуры (T)t˜5'(N)n могут быть получены уже не с помощью фермента (например, дезоксирибонуклеотидилтрансферазы), как в прототипе, а непосредственно в ходе стандартного автоматического фосфорамидитного синтеза олигонуклеотидов. Причем длина тимидилатного домена должна составлять не менее 1/4 и не более одной целой длины олигонуклеотидной части зонда. Минимальная длина определяется среднестатистическим распределением нуклеотидных оснований в последовательности среднестатистического олигонуклеотида, а поскольку нуклеотидных оснований четыре (А, С, G, Т), то длина зонда делится на четыре.
2. Нанесение ОНЗ на капроновую мембрану, смоченную буферным раствором, осуществляют в концентрации 1·10-7-1·10-4 М, что позволяет повысить качество ОНЗ за счет повышения его емкости и увеличения интенсивности специфического сигнала выявления ДНК при анализе.
Максимальная емкость ОНЗ на капроновый носитель составляет 4.5 пмоль на точку, в то время как максимальная емкость в прототипе составляет 3.5 пмоль на точку. Количество точек нанесения ОНЗ на капроновую мембрану размером 0.5×1.5 см зависит от плотности и объема раствора нанесения ОНЗ и может составлять от 2 до 20 точек на ДНК-чип.
3. Фотоиммобилизацию нанесенных на капроновый носитель олигонуклеотидных зондов проводят путем ультрафиолетового облучения в дозе 0.08-1.33 Дж/см2, что позволяет обеспечить в процессе иммобилизации минимальное повреждение олигонуклеотидной части ОНЗ заданной структуры, при максимальной количественной характеристике иммобилизации ОНЗ (емкости). Причем конструкция ОНЗ после проведения УФ-иммобилизации позволяет обеспечить ковалентное введение метки на поверхность капронового носителя с помощью ДНК-зависимых ферментов.
Предлагаемый способ иллюстрируется следующими примерами конкретного выполнения.
Пример 1. Синтез олигонуклеотидного зонда I.
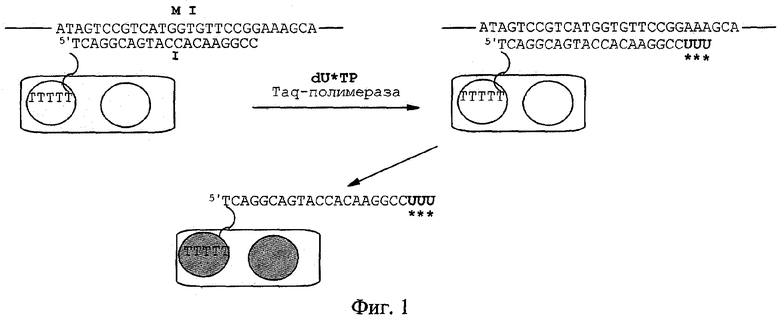
Синтез ОНЗ I, конструкции (T)5˜5'(N)20, проводили на автоматическом ДНК-синтезаторе ASM-700 в рамках фосфитамидного метода. Для этого на первом этапе синтезировали олигонуклеотидную часть ОНЗ (N)20, используя в качестве исходных материалов коммерчески доступные растворы фосфитамидных дезоксирибонуклеотидных мономеров (N=А, С, G, Т) в концентрации 10-1 М. Далее к полученной олигонуклеотидной части ОНЗ присоединяли линкер (˜), используя в качестве синтона фосфитамидный мономер на основе диэтиленгликоля (deg) в концентрации 10-1 М. На третьем этапе к олигонуклеотидной части, содержащей линкер ˜(N)20, присоединяли тимидилатный домен (T)5, вводя последовательно пять фосфитамидных дезоксирибонуклеотидов на основе коммерчески доступного синтона-тимидина (10-1 М). В результате получили ОНЗ I со структурой TTTTT˜5'TCAGGCAGTACCACAAGGCC, в которой длина тимидилатного домена (T)5 составляла 1/4 длины олигонуклеотидной части (N)20 зонда ОНЗ I.
Пример 2. Синтез олигонуклеотидного зонда II.
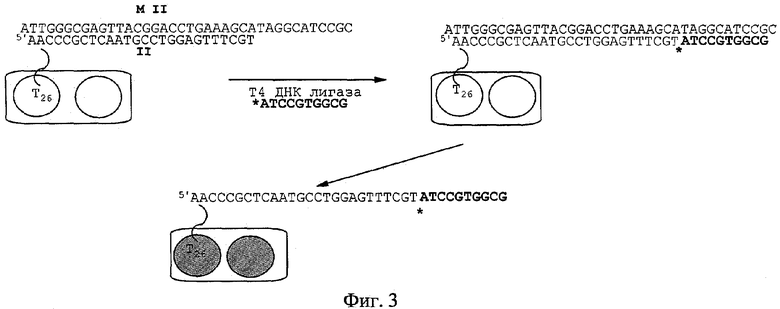
Синтез ОНЗ II, конструкции (T)26˜(N)26, проводили аналогично примеру 1, при этом на третьем этапе к олигонуклеотидной части ˜(N)26 присоединяли тимидилатный домен (Т)26, вводя последовательно двадцать шесть остатков тимидина. В результате получили ОНЗ II со структурой TTTTTTTTTTTTTTTTTTTTTTTTTT˜5'AACCCGCTCAATGCCTGGAGTTTCGT, в которой длина тимидилатного домена соответствовала длине олигонуклеотидной части ОНЗ.
Пример 3. Получение ДНК-чипа, содержащего ОНЗ I.
На поверхность капронового носителя (размером 0.5×1.5 см), смоченную 1 мл буферного раствора PBS, наносили 0.2 мкл зонда I в концентрации 1·10-7 М. Количество точек нанесения зависит от количества зондов (в данном случае 2 точки). Капроновый носитель при комнатной температуре помещали под ртутную лампу, доза облучения составляла 0.08 Дж/см2. После завершения фотоинициированного облучения капроновую мембрану промывали последовательно бидистиллированной водой (2 мл × 3 раза), этиловым спиртом (2 мл × 3 раза). После завершения промывок капроновый носитель высушивали на воздухе при комнатной температуре в течение 15 минут. Максимальная емкость ДНК-чипа составила 4.5 пмоля на точку нанесения ОНЗ.
Пример 4. Получение ДНК-чипа, содержащего ОНЗ II.
На поверхность капронового носителя (размером 0.5×1.5 см), смоченную 1 мл буферного раствора PBS, наносили 0.5 мкл зонда II в концентрации 1·10-4 М. Количество точек нанесения зависит от количества зондов. Капроновый носитель при комнатной температуре помещали под ртутную лампу, доза облучения составляла 1.33 Дж/см2. Последующую обработку носителя проводили аналогично примеру 3.
Пример 5. Способ выявления ДНК с помощью ДНК-чипа и ковалентного введения репортерной группы с помощью ДНК-зависимого фермента (Taq ДНК полимеразы).
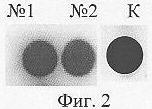
ДНК-чип, содержащий ОНЗ I, инкубировали при Т=70°С в течение 10 мин в 50 мкл буфера SSPE с ДНК М I (10-6 М) в присутствии дезоксинуклеотидтрифосфата dU*TP (10-5 М), несущего биотиновую репортерную группу (*), Taq ДНК полимеразы (2 ед.акт.). По окончании реакции ДНК-чип промывали последовательно буферным раствором (2 мл × 2 раза при комн.температуре), водой (2 мл × 2 раза при 100°С), 20% этиловым спиртом (2 мл × 2 раза при комн.температуре). Далее проводили обработку ДНК-чипа конъюгатом стрептавидин-щелочная фосфатаза. Визуализацию биотиновой репортерной группы на ДНК-чипе контролировали с помощью хромогенных субстратов NBT и BCIP по мере появления темно-синего окрашивания точек нанесения зондов. На фиг.1 представлена описанная выше схема выявления ДНК М I, на фиг.2 - сканированное изображение ДНК чипа, содержащего две точки нанесения ОНЗ I (№1 и №2), после выявления ДНК М I с помощью ДНК полимеразы. Видно, что в каждой точке наблюдается специфический сигнал выявления. Интенсивность сигнала выявления, отражающая качественную характеристику получаемого ДНК-чипа, составила 97% (за 100% принималась интенсивность окрашивания черного контроля К, представленного на фиг.2).
Пример 6. Способ выявления ДНК с помощью ДНК-чипа и ковалентного введения метки с помощью ДНК-зависимого фермента - Т4 ДНК лигазы.
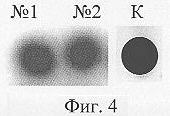
ДНК чип, содержащий ОНЗ II, инкубировали при Т=15°С в течение 60 мин в 50 мкл стандартного лигазного буфера с ДНК М II (10-6 М) в присутствии дополнительного зонда *ATCCGTGGCG (10-5 М), содержащего радиоактивную репортерную группу (*), Т4 ДНК лигазы (25 ед.акт.). По окончании реакции ДНК-чип промывали, как описано в примере 5. Визуализацию радиоактивной репортерной группы на ДНК-чипе контролировали с помощью рентгеновской пленки по мере появления темных пятен в точках нанесения зондов. На фиг.3 представлена описанная выше схема выявления ДНК М II, на фиг.4 - сканированное изображение рентгеновской пленки, содержащей две точки нанесения ОНЗ II, после проведения всех процедур. Видно, что в каждой точке наблюдается специфический сигнал выявления. Интенсивность сигнала выявления, отражающая качественную характеристику получаемого ДНК-чипа, составила 95% (за 100% принималась интенсивность окрашивания черного контроля К на фиг.4).
Использование способа позволит получать ДНК-чипы с высокой поверхностной емкостью, а также повысить эффективность параллельного выявления анализируемых последовательностей ДНК методом обратной молекулярной гибридизации за счет высокой интенсивности сигнала выявления ДНК, обеспечиваемого ДНК-чипами, получаемыми заявляемым способом.
Изобретение относится к молекулярной биологии и может быть использовано для анализа последовательностей ДНК. На капроновой мембране иммобилизуют олигонуклеотидные зонды, в которых олигонуклеотидная последовательность соединена с политимидиновой последовательностью посредством диэтиленгликолевого линкера. Иммобилизацию осуществляют с помощью ульрафиолетового облучения в дозе 0.08-1.33 Дж/см2. Применение изобретения позволяет получить ДНК-чип с высокой поверхностной емкостью и проводить анализ последовательностей ДНК с повышенной эффективностью. 4 ил.
Способ получения ДНК-чипа путем иммобилизации олигонуклеотидных зондов на капроновой мембране с помощью ульрафиолетового облучения с последующей отмывкой мембраны от неприсоединившихся компонентов и высушиванием, отличающийся тем, что в качестве олигонуклеотидного зонда используют зонд со структурой (T)t˜5'(N)n, где (T)t - последовательность поли(Т) длиною t нуклеотидов, «˜» - диэтиленгликолевый линкер, (N)n - олигонуклеотидная часть зонда, вовлеченная в процесс образования гибридизационного комплекса с анализируемой ДНК длиной n нуклеотидов, «5'» - конец олигонуклеотидной части, через которую она соединена с последовательностью поли(Т) посредством диэтиленгликолевого линкера, при этом ультрафиолетовое облучение осуществляют в дозе 0,08-1,33 Дж/см2, а нанесение зонда на мембрану проводят в концентрации 1·10-7М-1·10-4М.
| Proc | |||
| Natl | |||
| Acad | |||
| Sci U.S | |||
| A, 1989, V.86, р.6230-6234 | |||
| WO 8911548, 30.11.1989 | |||
| US 5643724, 01.07.1997 | |||
| СПОСОБ ВЫЯВЛЕНИЯ АНАЛИЗИРУЕМОЙ ПОСЛЕДОВАТЕЛЬНОСТИ ДНК | 2003 |
|
RU2259402C2 |
| Устройство для управления телескопом | 1974 |
|
SU511559A1 |
| Membrane immobilization of nucleic acids, http://www.devicelink.com/ivdt/archive/01/09/002.html, 01.09.2002, part 2: Probe attachment techniques. | |||
Авторы
Даты
2008-12-10—Публикация
2007-05-07—Подача