Изобретение может быть использовано для переработки вторичных отходов, например электронного лома, омедненных отходов металлических циркония и гафния, отходов сверхпроводниковых материалов в медной оболочке.
Известен способ растворения меди в горячей концентрированной серной кислоте [Реми Г. Курс неорганической химии. М.: Мир, 1974, т.2]. По этому способу в результате растворения образуется сульфат меди и выделяется оксид (II) серы.
Наиболее близок к изобретению по технической сущности способ обработки медьсодержащих отходов, включающий растворение меди водным раствором серной кислоты и переработку отработанных растворов [И.Ф.Худяков и др. Металлургия вторичных тяжелых цветных металлов. М.: Металлургия, 1987, с.214-217].
Недостатком данного способа является образование токсичного газа, который необходимо улавливать (нейтрализовать).
Технический результат, на достижение которого направлен предлагаемый способ, - устранение указанного недостатка и повышение эффективности процесса за счет регулирования процеса растворения меди и восстановления выделяющегося оксида азота.
Технический результат достигается тем, что способ обработки медьсодержащих отходов включает растворение меди раствором серной кислоты и переработку отработанных растворов. В раствор серной кислоты вводят нитрат аммония в количестве до 1,0-1,1 моль/моль меди. Кроме того, нитрат аммония вводят в раствор порционно по мере протекания реакции растворения меди. Отработанный раствор после отделения от него твердых компонентов регенерируют и используют повторно.
Нитрат-ион исполняет роль окислителя, необходимого для перевода меди в раствор, а ион аммония - роль восстановителя выделяющихся при растворении меди оксидов азота до молекулярного азота.
В процессе растворения меди раствором, содержащим серную кислоту и нитрат аммония, т.е. смесь ионов Н+, NH
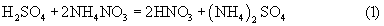
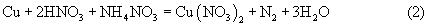
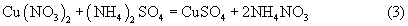
В результате суммарная реакция растворения такова:
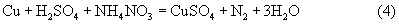
Возможна также и реакция растворения меди с образованием оксида азота (II) с последующим ее восстановлением ионом аммония до молекулярного азота:
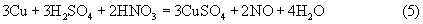
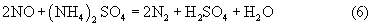
Вследствие того что растворимость сульфата меди в водных растворах значительно меньше, чем нитрата (при температуре 20°С - примерно в 15-20 раз), быстро достигается ее предел, кристаллы сульфата выделяются из раствора и могут быть легко отделены от него.
Способ осуществляют следующим образом.
Обрабатываемые медьсодержащие отходы помещают в реактор и заливают выщелачивающим раствором. В качестве последнего используют водный раствор серной кислоты (с содержанием H2SO4 не более 250 г/л), в котором растворен нитрат аммония в соответствии с реакцией (4).
Процесс растворения проводят при комнатной температуре. Скорость растворения меди (ее уменьшение облегчает восстановление оксидов азота аммонием в растворе) можно регулировать постепенным (порционным) введением нитрата аммония в реактор. При необходимости ускорить растворение меди в начальный момент температуру первой порции раствора можно повысить до 25-30°С.
После окончания растворения меди отходы отделяют от раствора и осадка сульфата меди, промывают водой, сушат и отправляют на утилизацию.
Отработанный раствор отфильтровывают от осадка сульфата меди и регенерируют его, доукрепляя серной кислотой до исходной концентрации и растворяя в нем нитрат аммония в количестве, соответствующем соотношению вводимых реагентов H2SO4:NH4NO3=1:1. Раствор после регенерации используют для очистки от меди следующей порции отходов.
Пример 1
Растворение медной фольги толщиной 0,04 мм проводили серной кислотой с концентрацией 252 г/л (расход - 1,65 моль/моль Сu), в которой растворили нитрат аммония (1,1 моль/моль Сu). Время полного растворения образца фольги составило 24 часа. В газовую фазу перешло 64% азота в молекулярном виде, 36% - в виде закиси. В растворе выпал осадок сульфата меди.
Пример 2
Растворение проводили при том же соотношении реагентов, что и в примере 1, за исключением того, что нитрат аммония вводили в раствор двумя равными порциями (по 0,55 моль/моль Сu): в исходный раствор и через 3 часа после начала растворения образца. Полное растворение образца достигнуто через 48 часов. В газовую фазу перешло 98% азота в молекулярном виде и только 2% - в виде закиси.
Пример 3
При растворении медной фольги толщиной 0,04 мм расход серной кислоты с концентрацией 252 г/л увеличен до 2,0 моль/моль Сu. Нитрат аммония введен в раствор в количестве, соответствующем уравнению (4), но двумя равными порциями (по 1,0 моль/моль Сu): в исходный раствор и через 3 часа после начала растворения образца.
Полное растворение образца достигнуто через 5 часов при практически 100%-ном выделении азота в молекулярном виде.
Пример 4
Остаточное содержание серной кислоты в отработанном растворе примера 3 составило 126 г/л, т.е. около 50% от исходного. На растворение меди израсходовано также 50% введенного в раствор нитрата аммония.
После отделения от него осадка сульфата меди раствор регенерировали введением в него концентрированной серной кислоты и опыт повторили: получены те же результаты.
Однако в связи с тем, что при температуре 21°С отмечено замедление начала реакции растворения, часть исходного раствора была подогрета до 30°С, что привело к резкой активизации процесса.
Из приведенных примеров видно, что использование для растворения меди смеси серной кислоты и нитрата аммония позволяет, изменяя количество вводимого в раствор нитрата аммония и способ его введения, регулировать процессы растворения меди и восстановления выделяющегося при этом оксида азота (II).
Техническая эффективность предлагаемого способа обработки медьсодержащих отходов заключается в том, что при его использовании:
- достигнута возможность управления процессом путем контролируемой подачи нитрата аммония в раствор;
- сочетание относительно низких концентраций нитратиона в растворе и температуры процесса растворения обеспечивает снижение скорости растворения меди и выделения оксидов азота, что создает благоприятные условия для перевода последних в элементарный азот и в результате резко облегчает очистку отходящих газов; эффект восстановления оксидов азота нитратом аммония усиливается при порционном введении выщелачивающего раствора в реактор;
- вследствие взаимодействия оксида азота (II) с нитратом аммония в газовую фазу в основном выделяется молекулярный азот;
- отработанный раствор легко регенерируется как по кислотности, так и по нитрат-иону (окислителю), иону аммония (восстановителю) и их соотношению, необходимому для образования молекулярного азота; в результате резко снижает количество отходов, требующих переработки.
Таким образом, существенно увеличивается эффективность использования реагентов и снижается количество отходов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ РАСТВОРЕНИЯ МЕДИ | 2003 |
|
RU2243163C2 |
| СПОСОБ ОБРАБОТКИ МЕДЬСОДЕРЖАЩИХ МАТЕРИАЛОВ | 2014 |
|
RU2560894C1 |
| Способ выщелачивания металлической меди | 2020 |
|
RU2749961C1 |
| СПОСОБ ПЕРЕРАБОТКИ МЕДЬСОДЕРЖАЩИХ ОТХОДОВ | 2001 |
|
RU2226559C2 |
| Способ приготовления медьсодержащих цеолитов и их применение | 2020 |
|
RU2736265C1 |
| СПОСОБ ПОЛУЧЕНИЯ МОНОГИДРАТА АЦЕТАТА МЕДИ (II) | 2003 |
|
RU2246480C1 |
| СПОСОБ УТИЛИЗАЦИИ ОТРАБОТАННОГО МЕДНО-АММИАЧНОГО РАСТВОРА | 2016 |
|
RU2622072C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕКСАГИДРАТА СУЛЬФАТА МЕДИ-АММОНИЯ | 2003 |
|
RU2251527C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОКСАЛАТА МЕДИ (II) | 2002 |
|
RU2234494C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ АЛМАЗОВ ИЗ МАТРИЦЫ ИНСТРУМЕНТА | 2019 |
|
RU2716692C1 |
Изобретение может быть использовано для переработки медьсодержащих отходов. Способ включает растворение меди водным раствором серной кислоты в присутствии нитрата аммония. Нитрат аммония вводят в количестве до 1-1,1 моля/моль меди. Нитрат аммония вводят в раствор порционно по мере протекания реакции растворения меди, обеспечивается эффективность использования реагентов и снижение количества отходов. 2 з.п. ф-лы.
| ХУДЯКОВ И.Ф | |||
| и др | |||
| Металлургия вторичных тяжелых цветных металлов | |||
| - М.: Металлургия, 1987, с.214-217 | |||
| ВСЕСО!<ЭЗНА>&1 | 0 |
|
SU379659A1 |
| Способ извлечения меди из отходов | 1980 |
|
SU908891A1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНСЕРВОВ "ЧОРБА" | 2006 |
|
RU2311856C2 |
Авторы
Даты
2004-09-20—Публикация
2003-05-06—Подача