Настоящая заявка является частичным продолжением одновременно рассматриваемой заявки США, Szostak и др., рег. №09/007005, поданной 14 января 1998, притязания по которой вытекают из предварительных заявок США, Szostak и др., рег. №60/064491, поданной 6 ноября 1997 и в настоящее время отозванной, и рег. №60/035963, поданной 21 января 1997 и в настоящее время отозванной.
Настоящее изобретение относится к способам отбора белка.
Настоящее изобретение было осуществлено на средства, выделенные правительством в соответствии с грантом F32 GM17776-01 и F32 GM17776-02. Правительство имеет определенные права на это изобретение.
Существующие в настоящее время методы выделения РНК- и ДНК-молекул основаны на их функциях. Так, например, эксперименты Ellington и Szostak (Nature 346: 818 (1990); и Nature 355: 850 (1992)) и Tuerk & Gold (Science 249: 505 (1990); и J. Mol. Biol. 222: 739 (1991)) продемонстрировали, что очень редко молекулы нуклеиновых кислот с нужными свойствами (то есть менее чем 1 из 1013) могут быть выделены из многокомпонентных пулов молекул путем проведения повторных циклов отбора и амплификации. По сравнению с традиционными генетическими методами отбора эти методы имеют те преимущества, что (i) могут быть скринированы очень крупные пулы-кандидаты (>1015), (ii) жизнеспособность хозяина и in vivo условия не имеют особого значения, и (iii) отбор может быть осуществлен даже, если не существуют метода генетического скрининга in vivo. Эффективность отбора in vitro была продемонстрирована при определении новых РНК- и ДНК-последовательностей, обладающих в высокой степени специфическими функциями связывания с белком (см., например, Tuerk & Gold, Science 249: 505 (1990); Irvine et al., J. Mol. Biol. 222: 739 (1991); Oliphant et al., Mol. Cell. Biol. 9: 2944 (1989); Blackwell et al., Science 250: 1104 (1990); Pollock & Treisman, Nuc. Acids. Res. 18: 6197 (1990); Thiesen & Bach, Nuc. Acids. Res. 18: 3203 (1990); Bartel et al. Cell. 57: 529 (1991); Stormo & Yoshioka, Proc. Natl. Acad. Sci. USA 88: 5699 (1991); и Bock et al., Nature 355: 564 (1992)), функциями связывания с небольшими молекулами (Ellington & Szostak, Nature 346: 818 (1990); Ellington & Szostak, Nature 355: 850 (1992)) и каталитическими функциями (Green et al., Nature 347: 406 (1990); Robertson & Joyce, Nature 344: 467 (1990); Beaudry & Joyce, Science 257: 635 (1992); Bartel & Szostak, Science 261: 1411 (1993); Lorsch & Szostak, Nature 371: 31-36 (1994); Cuenoud & Szostak, Nature 375: 611-614 (1995); Chapman & Szostak, Chemistry and Biology 2: 325-333 (1995); и Lohse & Szostak, Nature 381: 442-444 (1996)). Аналогичная схема отбора и амплификации белков не была продемонстрирована.
Краткое описание изобретения
Целью настоящего изобретения является осуществление принципов in vitro отбора и in vitro эволюции, применяемых к белкам. Настоящее изобретение облегчает выделение белков с нужными свойствами из крупных пулов частично или полностью рандомизированных аминокислотных последовательностей. Кроме того, настоящее изобретение позволяет решить проблему выделения и амплификации последовательности белка путем ковалентного связывания кодирующей последовательности мРНК с молекулой белка.
В общих чертах, способ настоящего изобретения представляет собой протокол in vitro или in situ транскрипции/трансляции, который позволяет генерировать белок, ковалентно связанный с 3'-концом его собственной мРНК, то есть гибрид "РНК-белок". Указанный способ осуществляют путем синтеза и in vitro или in situ трансляции молекулы мРНК с пептидным акцептором, присоединенным к ее 3'-концу. Одним из предпочтительных пептидных акцепторов является пуромицин, нуклеозидный аналог, который присоединяется к С-концу растущей пептидной цепи и терминирует трансляцию. В одной из предпочтительных конструкций ДНК-последовательность включена между концом транскрипта и пептидным акцептором, который был сконструирован для того, чтобы вызвать остановку рибосомы в конце открытой рамки считывания, что дает пептидному акцептору (например, пуромицину) дополнительное время для присоединения растущей пептидной цепи перед гидролизом связи петидил-тРНК.
Полученный гибрид "РНК-белок" позволяет осуществлять, если это необходимо, повторные циклы отбора и амплификации, так как данные о последовательности белка могут быть получены путем обратной транскрипции и амплификации (например, путем ПЦР-амплификации, а также каким-либо другим методом амплификации, включая методы амплификации на основе РНК, такие как 3SR или TSA). Амплифицированная нуклеиновая кислота может быть затем транскрибирована, модифицирована и in vitro или in situ транслирована с образованием гибридов "мРНК-белок" для проведения следующего цикла отбора. Возможность проводить множество циклов отбора и амплификации позволяет достичь обогащения очень редких молекул и их выделения, например выделения одной нужной молекулы из пула, имеющего 1015 членов. Это, в свою очередь, дает возможность выделить новые или улучшенные белки, которые специфически узнают практически любую мишень, или которые катализируют нужные химические реакции.
В соответствии с этим в первом своем аспекте настоящее изобретение относится к способу отбора нужного белка, включающему стадии: (а) продуцирования популяции РНК-молекул-кандидатов, каждая из которых содержит последовательность инициации трансляции и старт-кодон, функционально присоединенный к последовательности, кодирующей белок-кандидат, и каждая из которых функционально присоединена к пептидному акцептору у 3'-конца данной последовательности, кодирующей белок-кандидат; (b) in vitro или in situ трансляции последовательностей, кодирующих белок-кандидат, с продуцированием популяции гибридов-кандидатов "РНК-белок; и (с) отбора нужного гибрида "РНК-белок", и тем самым отбора нужного белка.
В своем родственном аспекте настоящее изобретение относится к способу отбора ДНК-молекулы, кодирующей нужный белок, включающему стадии: (а) продуцирования популяции РНК-молекул-кандидатов, каждая из которых содержит последовательность инициации трансляции и старт-кодон, функционально присоединенный к последовательности, кодирующей белок-кандидат, и каждая из которых функционально присоединена к пептидному акцептору у 3'-конца последовательности, кодирующей белок-кандидат; (b) in vitro или in situ трансляции последовательностей, кодирующих белок-кандидат, с продуцированием популяции гибридов-кандидатов "РНК-белок"; (с) отбора нужного гибрида "РНК-белок"; и (d) генерирования из РНК-части указанного гибрида ДНК-молекулы, кодирующей нужный белок.
В другом своем родственном аспекте, настоящее изобретение относится к способу отбора белка, имеющего измененную функцию по сравнению с исходным белком, где указанный способ включает стадии: (а) продуцирования популяции РНК-молекул-кандидатов из популяции ДНК-матриц, каждая ДНК-матрица-кандидат содержит последовательность, кодирующую белок-кандидат и отличающуюся от последовательности, кодирующей исходный белок, где каждая из указанных РНК-молекул содержит последовательность инициации трансляции и старт-кодон, функционально присоединенный к последовательности, кодирующей белок-кандидат, и каждая из указанных молекул функционально присоединена к пептидному акцептору у 3'-конца; (b) in vitro или in situ трансляции последовательностей, кодирующих белок-кандидат, с продуцированием популяции гибридов-кандидатов "РНК-белок"; (с) отбора нужного гибрида "РНК-белок", имеющего измененную функцию, и тем самым отбора белка, имеющего измененную функцию.
В еще одном своем родственном аспекте настоящее изобретение относится к способу отбора ДНК-молекулы, кодирующей белок, имеющий измененную функцию по сравнению с исходным белком, включающий стадии: (а) продуцирования популяции РНК-молекул-кандидатов из популяций ДНК-матриц-кандидатов, причем каждая ДНК-матрица-кандидат содержит последовательность, кодирующую белок-кандидат, которая отличается от последовательности, кодирующей исходный белок, и где каждая РНК-молекула включает последовательность инициации трансляции и старт-кодон, функционально присоединенный к последовательности, кодирующей белок-кандидат, и каждая РНК-молекула функционально присоединена к пептидному акцептору у 3'-конца; (b) in vitro или in situ трансляции последовательностей, кодирующих белок-кандидат, с продуцированием популяции гибридов-кандидатов "РНК-белок"; (с) отбора гибрида РНК-белок, имеющего измененную функцию; и (d) генерирования из указанной РНК-части гибрида ДНК-молекулы, кодирующей белок, имеющий измененную функцию.
В еще одном родственном аспекте настоящее изобретение относится к способу отбора нужной РНК, включающему стадии: (а) продуцирования популяции РНК-молекул-кандидатов, каждая из которых содержит последовательность инициации трансляции и старт-кодон, функционально присоединенный к последовательности, кодирующей белок-кандидат, и каждая из которых функционально присоединена к пептидному акцептору у 3'-конца последовательности, кодирующей белок-кандидат; (b) in vitro или in situ трансляции последовательностей, кодирующих белок-кандидат, с продуцирова-нием популяции гибридов-кандидатов "РНК-белок"; и (с) отбора нужного гибрида "РНК-белок", и тем самым отбора нужной РНК.
В предпочтительных вариантах вышеуказанных способов пептидным акцептором является пуромицин; каждая из РНК-молекул-кандидатов, кроме того, включает стоп-последовательность, или, кроме того, включает ДНК-последовательность или аналог ДНК-последовательности, ковалентно связанный с 3'-концом указанной РНК; популяция РНК-молекул-кандидатов включает, по крайней мере, 109, предпочтительно, по крайней мере, 1010, более предпочтительно, по крайней мере, 1011, 1012 или 1013, а наиболее предпочтительно, по крайней мере, 1014 различных РНК-молекул; указанную реакцию in vitro-трансляции осуществляют в лизате, полученном от эукариотической клетки или ее части (т.е. эту реакцию, например, осуществляют в лизате ретикулоцита или лизате зародыша пшеницы); указанную реакцию in vitro-трансляции осуществляют в экстракте, полученном из прокариотической клетки (например, E.coli) или ее части; указанная стадия отбора предусматривает связывание нужного белка с иммобилизованным партнером по связыванию; данная стадия отбора предусматривает проведение анализа на функциональную активность нужного белка; данная молекула ДНК является амплифицированной; данный способ, кроме того, предусматривает повторение стадий вышеуказанных способов отбора; данный способ, кроме того, предусматривает транскрибирование РНК-молекулы из ДНК-молекулы и повторение стадий (a)-(d); а после стадии трансляции in vitro данный способ, кроме того, включает стадию инкубирования в присутствии 50-100 мМ Мg2+; а указанный гибрид РНК-белок, кроме того, включает последовательность нуклеиновой кислоты или аналог последовательности нуклеиновой кислоты, расположенный непосредственно у пептидного акцептора, который увеличивает гибкость.
В других родственных аспектах настоящее изобретение относится к гибриду РНК-белок, отобранному любым из способов настоящего изобретения; к рибонуклеиновой кислоте, ковалентно связанной амидной связью с аминокислотной последовательностью, где данная аминокислотная последовательность кодируется рибонуклеиновой кислотой; и к рибонуклеиновой кислоте, которая включает последовательность инициации трансляции и старт-кодон, функционально присоединенный к последовательности, кодирующей белок-кандидат, где указанная рибонуклеиновая кислота функционально присоединена к пептидному акцептору (например, к пуромицину) у 3'-конца данной последовательности, кодирующей белок-кандидат.
Во втором своем аспекте настоящее изобретение относится к способу отбора нужного белка или нужной РНК путем обогащения пула последовательностей. Этот способ предусматривает проведение стадий: (а) продуцирования популяции РНК-молекул-кандидатов, каждая из которых включает последовательность инициации трансляции и старт-кодон, функционально присоединенный к последовательности, кодирующей белок-кандидат, и каждая из которых функционально присоединена к пептидному акцептору у 3'-конца данной последовательности, кодирующей белок-кандидат; (b) in vitro- или in situ-трансляции последовательностей, кодирующих белок-кандидат, с продуцированием популяции гибридов-кандидатов "РНК-белок"; (с) контактирования популяции гибридов РНК-белок с партнером по связыванию, специфичным для РНК-части или белковой части гибрида "РНК-белок" в условиях, которые, в основном, способствуют отделению комплексов гибрида "партнер по связыванию-РНК-белок" от несвязанных членов этой популяции; (d) высвобождения связанных гибридов "РНК-белок" из этих комплексов; и (е) контактирования данной популяции гибридов "РНК-белок" стадии (d) с партнером по связыванию, специфичным для белковой части нужного гибрида "РНК-белок" в условиях, которые, в основном, способствуют отделению комплекса "партнер по связыванию-РНК-белок" от несвязанных членов указанной популяции и, тем самым, отбора нужного белка и нужной РНК.
В предпочтительных вариантах осуществления изобретения указанный способ, кроме того, предусматривает повторение стадий (а)-(е). Кроме того, для проведения этих повторных стадий в целях селективного обогащения нужным гибридом "РНК-белок" могут быть использованы те же самые или другие партнеры по связыванию в любом порядке. В другом предпочтительном варианте стадия (d) предусматривает использование партнера по связыванию (например, моноклонального антитела), специфичного для белковой части нужного гибрида. Эту стадию предпочтительно проводят после обратной транскрипции РНК-части гибрида с продуцированием ДНК, кодирующей нужный белок. При необходимости указанная ДНК может быть выделена и/или ПЦР-амплифицирована. Этот способ обогащения может быть использован для отбора нужного белка, либо он может быть использован для отбора белка, имеющего измененную функцию по сравнению с исходным белком.
В других предпочтительных вариантах осуществления способов обогащения пептидным акцептором является пуромицин; каждая из РНК-молекул кандидатов, кроме того, включает стоп-последовательность или, кроме того, включает ДНК-последовательность или аналог ДНК-последовательности, ковалентно связанный с 3'-концом указанной РНК; указанная популяция РНК-молекул-кандидатов включает, по крайней мере, 109, предпочтительно, по крайней мере, 1010, более предпочтительно, по крайней мере, 1011, 1012 или 1013, а наиболее предпочтительно, по крайней мере, 1014 различных РНК-молекул; указанную реакцию in vitro-трансляции осуществляют в лизате, полученном из эукариотической клетки или ее части (эту реакцию, например, осуществляют в лизате ретикулоцита или лизате зародыша пшеницы); указанную реакцию in vitro-трансляции осуществляют в экстракте, полученном от прокариотической клетки (например, E.coli) или ее части; указанная ДНК-молекула является амплифицированной; по крайней мере, один из партнеров по связыванию является иммобилизованным на твердом носителе; после стадии трансляции in vitro, данный способ, кроме того, включает стадию инкубирования, осуществляемую в присутствии 50-100 мМ Mg2+; а указанный гибрид "РНК-белок", кроме того, включает последовательность нуклеиновой кислоты или аналог последовательности нуклеиновой кислоты, расположенный возле пептидного акцептора, что увеличивает гибкость.
В своем родственном аспекте настоящее изобретение относится к способам продуцирования библиотек (например, библиотек белка, ДНК или РНК-гибридов) или к способам отбора нужных молекул (например, молекул белка, ДНК- или РНК-молекул или молекул, имеющих конкретную функцию или измененную функцию), включающим стадию посттрансляционного инкубирования в присутствии высшей соли (включая, но не ограничиваясь ею, высшая соль, которая содержит одновалентный катион, такой как К+, NH
В другом своем родственном аспекте настоящее изобретение относится к наборам для осуществления любого из способов отбора, описанных в настоящей заявке.
В третьем и последнем своем аспекте настоящее изобретение относится к микрочипам, которые включают массив иммобилизованных одноцепочечных нуклеиновых кислот, нуклеиновых кислот, гибридизированных с гибридами РНК-белок. Предпочтительным белковым компонентом гибрида "РНК-белок" является белок, кодируемый РНК.
Используемый здесь термин "популяция" означает более чем одну молекулу (например, более чем одну РНК, ДНК или гибридную молекулу "РНК-белок"). Поскольку способы настоящего изобретения облегчают отбор, который начинается, если это необходимо, с большого числа членов молекул-кандидатов, составляющих "популяцию" настоящего изобретения, состоящую предпочтительно из более чем 109 молекул, более предпочтительно из более чем 1011, 1012 или 1013 молекул, а наиболее предпочтительно из более чем 1013 молекул.
Термин "отбор" означает, в основном, отделение одной молекулы от других молекул в популяции. Используемый здесь термин стадия "отбора" означает, по крайней мере, 2-кратное, предпочтительно 30-кратное, более предпочтительно 100-кратное, а наиболее предпочтительно 1000-кратное обогащение данной популяции нужными молекулами по сравнению с ненужными молекулами после проведения данной стадии отбора. Как показано в настоящей заявке, стадия отбора может повторяться любое число раз, и в данном способе могут быть объединены различные типы стадий отбора.
Термин "белок" означает любые две или более природные или модифицированные аминокислоты, связанные друг с другом одной или более пептидными связями. Термины "белок" и "пептид" являются взаимозаменяемыми.
Термин "РНК" означает последовательность, состоящую из двух или более ковалентно связанных природных или модифицированных рибонуклеотидов. Одним из примеров модифицированной РНК, охватываемой этим термином, является фосфоротиоат-РНК.
Термин "последовательность инициации трансляции" означает любую последовательность, имеющую функциональный сайт присоединения рибосомы. В бактериальных системах эту область иногда называют последовательностью Шайна-Дальгарно.
Термин "старт-кодон" означает три основания, которые являются признаком начала последовательности, кодирующей белок. Обычно такими основаниями являются AUG (или ATG), однако в данном способе они могут быть заменены на любой другой подходящий триплет.
Термин "ковалентно связанный" с пептидным акцептором означает, что данный пептидный акцептор присоединен к "кодирующей белок последовательности" либо непосредственно через ковалентную связь, либо опосредованно с помощью другой ковалентно связанной последовательности (например, ДНК, соответствующей стоп-сайту).
Термин "пептидный акцептор" означает любую молекулу, способную присоединяться к С-концу растущей пептидной цепи благодаря каталитической активности пептидилтрансферазной функции рибосомы. Обычно такие молекулы содержат (i) нуклеотид или нуклетид-подобную составляющую (например, аденозин или аналог аденозина (допускается диметилирование в N-6-амино-положении)), (ii) аминокислоту или составляющую, подобную аминокислоте (например, любую из 20 D- или L-аминокислот или любой их аналог (например, O-метилтирозин или любой из аналогов, описанных Ellman et al., Meth. Enzymol. 202: 301, 1991) и (iii) связь между двумя группами (например, сложноэфирную, амидную или кетоновую связь в 3'-положении или менее предпочтительно в 2'-положении); при этом предпочтительно, чтобы эта связь, в основном, не нарушала образование кольца из природной рибонуклеотидной конформации. Пептидный акцептор может также содержать нуклеофильную группу, которая может быть, но не ограничивается ими, аминогруппой, гидроксильной группой или сульфгидрильной группой. Кроме того, пептидные акцепторы могут состоять из нуклеотидных миметиков, аминокислотных миметиков или миметиков из объединенных нуклеотид-аминокислотных структур.
Понятие "пептидный акцептор, находящийся в положении у 3'-конца кодирующей белок последовательности" означает, что данная молекула пептидного акцептора расположена за конечным кодоном указанной кодирующей белок последовательности. Этот термин включает, но не ограничивается ими, молекулу пептидного акцептора, которая расположена непосредственно у 3'-конца кодирующей белок последовательности, а также молекулу, которая отделена от конечного кодона кодирующей или некодирующей последовательностью-интроном (например, последовательностью, соответствующей стоп-сайту). Этот термин также включает конструкции, в которых кодирующие или некодирующие последовательности следуют за (т.е., с 3'-конца) молекулой пептидного акцептора. Кроме того, этот термин включает, но не ограничивается ими, молекулу пептидного акцептора, которая является ковалентно связанной (либо непосредственно, либо опосредованно через встраиваемую последовательность нуклеиновой кислоты) с кодирующей белок последовательностью, а также молекулу, которая присоединена к кодирующей белок последовательности путем нековалентного связывания, например путем гибридизации с использованием второй последовательности нуклеиновой кислоты, которая связывается у 3'-конца или возле 3'-конца последовательности, кодирующей белок, и которая сама является связанной с молекулой пептидного акцептора.
Термин "измененная функция" означает любое качественное или количественное изменение функции молекулы.
Термин "стоп-последовательность" означает последовательность нуклеиновой кислоты, которая замедляет уровень или прекращает трансляцию под действием рибосомы.
Термин "партнер по связыванию", используемый в настоящем описании, означает любую молекулу, которая имеет специфическую ковалентную или нековалентную аффинность по отношению к части нужного гибрида РНК-белок. Примерами партнеров по связыванию являются, но не ограничиваются ими, члены пар антиген/антитело, пар белок/ингибитор, пар рецептор/лиганд (например, пар рецептор клеточной поверхности/лиганд, таких как пары рецептор гормона/пептидный гормон), пар фермент/субстрат (например, пар ки-наза/субстрат), пар лектин/углевод, агрегатов олигомерных или гетероолигомерных белков, пар ДНК-связывающий белок/сайт связывания с ДНК, пар РНК/белок и дуплексов нуклеиновой кислоты, гетеродуплексов или лигированных цепей, а также любая молекула, способная образовывать одну или несколько ковалентных или нековалентных связей (например, дисульфидных связей) с любой частью гибрида "РНК-белок". Партнерами по связыванию являются, но не ограничиваются ими, любой из "мотивов для отбора", представленных на фиг.2.
Термин "твердый носитель" означает, но не ограничивается ими, любую колонку (или материал колонки), гранулы, тест-пробирку, чашку для микротитрования, твердую частицу (например, агарозу или сефарозу), микрочип (например, чип из кремния, кремниевого стекла или золота) или мембрану (например, мембрану липосомы или везикулы), с которыми может связываться аффинный комплекс либо прямо, либо опосредованно (например, посредством других промежуточных партнеров по связыванию, таких как другие антитела или белок А), или в которые аффинный комплекс может быть погружен (например, посредством рецептора или канала).
Термин "высшая соль" означает соль, имеющую концентрацию одновалентного катиона, по крайней мере, 200 мМ, а предпочтительно, по крайней мере, 500 мМ или даже 1 М, и/или концентрацию двухвалентного катиона или катиона с более высокой валентностью, по крайней мере, 25 мМ, предпочтительно, по крайней мере, 50 мМ, а наиболее предпочтительно, по крайней мере, 100 мМ.
Настоящее изобретение имеет ряд значительных преимуществ. Прежде всего, это первый пример данного типа схемы отбора и амплификации белков. Описанный способ позволяет решить проблему, связанную с необходимостью выделения нуклеотидных последовательностей, соответствующих нужным выделенным белкам (поскольку реплицироваться могут только нуклеиновые кислоты). В частности, многие используемые ранее способы, которые позволяли выделять белки из частично или полностью рандомизированных пулов, предусматривали проведение стадии in vivo. Способами такого типа являются: технология моноклональных антител (Milstein, Sci. Amer. 243: 66 (1980); и Schultz et al., J. Chem. Engng. News 68:26 (1990)), фаговое отображение (Smith, Science 228: 1315 (1985); Parmley & Smith, Gene 73: 305 (1988); и McCafferty et al., Nature 348: 552 (1990)), использование гибридов пептид-lac-репрессор (Cull et al., Proc. Natl. Acad. Sci. USA 89: 1865 (1992)) и классические методы генетического отбора. В отличие от способа настоящего изобретения каждый из этих способов основан на топологической связи между белком и нуклеиновой кислотой так, чтобы данная информация о белке сохранялась и могла быть получена в считываемой форме нуклеиновой кислоты.
Кроме того, настоящее изобретение имеет преимущества по сравнению с известным методом трансляции (Tuerk & Gold, Science 249: 505 (1990); Irvine et al., J. Mol. Biol. 222: 739 (1991); Korman et al., Proc. Natl. Acad. Sci. USA 79: 1844-1848 (1982); Mattheakis et al., Proc. Natl. Acad. Sci. USA 91: 9022-9026 (1994); Mattheakis et al., Meth. Enzymol. 267: 195 (1996); и Hanes & Pluckthun, Proc. Natl. Acad. Sci. USA 94: 4937 (1997)), методом, в котором проводят отбор на определенное свойство растущей белковой цепи, которая, кроме того, образует комплекс с рибосомой и ее мРНК. В отличие от известного метода трансляции способ настоящего изобретения не основан на сохранении целостности трехкомпонентного комплекса "мРНК:рибосома:растущая цепь", то есть комплекса, который является очень непрочным, а следовательно, известный способ ограничен в отношении технически возможных типов отбора.
Способ настоящего изобретения также имеет преимущества по сравнению с методом разветвленного синтеза, предложенным Brenner & Lerner (Proc. Natl. Acad. Sci., USA, 89: 5381-5383 (1992)), в котором генерируют гибриды ДНК-пептид, и генетическую информацию теоретически получают после одного цикла отбора. В отличие от метода разветвленного синтеза способ настоящего изобретения не требует регенерации пептида из ДНК-части гибрида (который в методе разветвленного синтеза обычно получают посредством отдельных циклов химического синтеза). В соответствии с этим способ настоящего изобретения позволяет проводить повторные циклы отбора с использованием популяций молекул-кандидатов. Кроме того, в отличие от метода разветвленного синтеза, который, в основном, ограничен отбором достаточно коротких последовательностей, способ настоящего изобретения может быть использован для отбора молекул белка, имеющих значительную длину.
Еще одно преимущество настоящего изобретения заключается в том, что метод отбора и направленной эволюции позволяет использовать очень большие и комплексные библиотеки последовательностей-кандидатов. В противоположность этому существующие методы отбора белков, которые основаны на проведении стадии in vivo, обычно ограничены относительно небольшими библиотеками с несколько ограниченной множественностью. Это преимущество является особенно важным при отборе функциональных последовательностей белка, если учесть, что, например, для пептида, состоящего только из 10 аминокислот, существует 1013 возможных последовательностей. В классических генетических методах, то есть в методах с использованием гибрида lac-peпpeccopa и в способах фагового отображения, максимальная множественность обычно приходится на величину порядка ниже 1013 членов. Большой размер библиотеки также является преимуществом для ее применений в методах направленной эволюции, которые заключаются в том, что окружающие последовательности могут быть использованы для более глубокого исследования данной исходной последовательности.
Способ настоящего изобретения также отличается от предшествующих способов тем, что стадия отбора не зависит от окружающих последовательностей ("контекста"). Во многих других схемах отбора указанный "контекст", в котором, например, присутствует экспрессированный белок, может в значительной степени влиять на природу генерированной библиотеки. Так, например, экспрессированный белок не сможет соответствующим образом экспрессироваться в конкретной системе или не может быть соответствующим образом отображен (например, на поверхности фаговой частицы). Альтернативно экспрессия белка может фактически препятствовать проведению одной или нескольких критических стадий в цикле отбора, например влиять на жизнеспособность или инфекционность фага либо на связывание с lac-репрессором. Эти негативные факторы могут приводить к потерям функциональных молекул или к ограничениям на характер процедур отбора, которые могут быть использованы.
И наконец, способ настоящего изобретения имеет преимущества, поскольку он обеспечивает контроль за набором белков, которые могут быть протестированы. В некоторых методах (например, в отборе с использованием антитела) имеется незначительный или вообще отсутствует контроль за природой исходного пула. В других методах (например, с использованием lac-гибридов и фагового отображения) пул кандидатов должен быть экспрессирован в "контексте" гибридного белка. В противоположность этому гибридные конструкции "РНК-белок" позволяют осуществлять контроль за природой пулов кандидатов, доступных для скрининга. Кроме того, размер пула кандидатов может быть таким же большим, как РНК- или ДНК-пулы (~1015 членов), и ограничен лишь объемом осуществляемой реакции in vitro трансляции. Создание пула кандидатов полностью зависит от целей эксперимента; произвольные области могут быть скринированы отдельно либо в "контексте" нужного гибридного белка, и большинство возможных последовательностей, если не все, могут быть экспрессированы в пулах кандидатов гибридов "РНК-белок".
Другие признаки и преимущества настоящего изобретения будут очевидны из нижеследующего подробного описания и формулы изобретения.
Подробное описание изобретения
Сначала приводится описание чертежей.
Краткое описание чертежей.
На фигурах 1А-1С схематически представлены стадии продуцирования гибридов РНК-белок. На фиг.1А проиллюстрирована конструкция образца ДНК для генерирования РНК-части гибрида. На фиг.1В проиллюстрировано генерирование конъюгата РНК/пуромицин. На фиг.1С проиллюстрировано генерирование гибрида РНК-белок.
На фиг.2 схематически представлен протокол генерализованного отбора настоящего изобретения.
На фиг.3 схематически представлен протокол синтеза минимальных трансляционных матриц, содержащих 3'-пуромицин. На стадии (А) показано присоединение защитных групп к реакционным функциональным группам на пуромицине (5'-OH и NH2); в качестве модифицированных групп эти группы соответствующим образом защищены для их использования в олигонуклеотидном синтезе на основе фосфорамидита. Указанный защищенный пуромицин был присоединен к стеклу с контролируемым аминогексилом размером пор (CPG) посредством группы 2'-ОН с использованием стандартной схемы присоединения ДНК посредством ее 3'-ОН (Gait, Oligonucleotide Synthesis, A Practical Approach, The Practical Approach Series (IRL Press, Oxford, 1984)). В стадии (В) минимальная трансляционная матрица (называемая "43-Р"), которая содержит 43 нуклеотида, была синтезирована с использованием стандартного метода химического синтеза РНК и ДНК (Millipore, Bedford, MA), защищена с использованием NН4OН и TBAF и подвергнута гель-очистке. Данная матрица содержит 13 оснований РНК у 5'-конца, за которыми следуют 29 оснований ДНК, присоединенных к 3'-пуромицину у его 5'-ОН. Данная РНК-последовательность содержит (i) консенсусную последовательность Шайна-Дальгарно, комплементарную пяти основаниям 16S рРНК (Stormo et al., Nucleic Acids Research 10: 2971-2996 (1982); Shine & Dalgarno, Proc. Natl. Acad. Sci. USA 71: 1342-1346 (1974); и Steitz & Jakes, Proc. Natl. Acad. Sci. USA 72: 4734-4738 (1975)), (ii) спейсер из пяти оснований и (iii) один старт-кодон AUG. Эта ДНК-последовательность представляет собой dA27dCdCP, где "Р" означает пуромицин.
На фиг.4 схематически представлен предпочтительный способ получения защищенного CPG-связанного пуромицина.
На фиг.5 схематически представлены возможные методы включения метионина в матрицу настоящего изобретения. Как показано в реакции (А), данная матрица связывается с рибосомой, образуя, тем самым, комплекс инициации 70S. Fmet-тРНК связывается с Р-сайтом и представляет собой пару оснований, связанную с матрицей. Пуромицин у 3'-конца данной матрицы вводит А-сайт путем внутримолекулярной реакции и образует амидную связь с N-формилметионином через пептидилтрансферазный центр, что, тем самым, приводит к деацилированию тРНК. Экстракция реакционной смеси фенолом/хлороформом приводит к образованию матрицы с ковалентно присоединенным метионином. Как показано, реакция (В) представляет собой нежелательную внутримолекулярную реакцию матрицы с олигонуклеотидами, содержащими пуромицин. Как указывалось ранее, минимальная матрица стимулирует образование рибосомы 70S, содержащей fmet-тРНК, связанную с Р-сайтом. После этого осуществляется включение второй матрицы в транс-положение с получением ковалентно связанного метионина.
На фиг.6А-6Н представлены фотографии, иллюстрирующие включение 35S-метионина (35S-met) в трансляционные матрицы. На фиг.6А продемонстрирована зависимость реакции от магния (Мg2+). На фиг.6В продемонстрирована основная стабильность продукта; изменение подвижности, показанное на этой фигуре, соответствует потере 5'-РНК-последовательности 43-Р (называемой также "Met-матрицей") с продуцированном части ДНК-пуромицин, называемой 30-Р. Удерживание метки после обработки основанием соответствует образованию пептидной связи между 35S-метионином и 3'-пуромицином данной матрицы. На фиг.6С продемонстрировано ингибирование образования продукта в присутствии ингибиторов пептидилтрансферазы. На фиг.6D продемонстрирована зависимость включения 35S-метионина от последовательности, кодирующей матрицу. На фиг.6Е продемонстрирована зависимость длины ДНК-матрицы от включения 32S-метионина. На фиг.6F проиллюстрировано образование цис- или транс-продукта с использованием матриц 43-Р и 25-Р. На фиг.6G проиллюстрировано образование цис- или транс-продукта с использованием матриц 43-Р и 13-Р. На фиг.6Н проиллюстрировано образование цис- или транс-продукта с использованием матриц 43-Р и 30-Р в системе лизата ретикулоцита.
На фиг.7А-7С схематически проиллюстрированы конструкции для тестирования на образование и отбор пептидного гибрида. На фиг.7А показан LP77 ("лигированный продукт", длина 77 нуклеотидов) (также называемый "короткой mус-матрицей") (SEQ ID NO:1). Эта последовательность содержит метку EQKLISEEDL эпитопа моноклонального антитела против c-myc (SEQ ID NO:2) (Evan et al., Mol. Cell. Biol. 5: 3610-3616 (1985)), фланкированную 5'-старткодоном и 3'-линкером. Эта 5'-область содержит бактериальную последовательность Шайна-Дальгарно, идентичную последовательности 43-Р. Данная кодирующая последовательность была оптимизирована для трансляции в бактериальных системах. В частности, 5'-UTR 43-Р и LP77 содержат последовательность Шайна-Дальгарно, комплементарную пяти основаниям 16S рРНК (Steitz & Jakes, Proc. Natl. Acad. Sci. USA 72: 4734-4738 (1975)) и расположенную аналогично последовательностям рибосомного белка (Stormo et al., Nucleic Acids Res. 10: 2971-2996 (1982)). На фиг.7В показан LP 154 (лигированный продукт, длина: 154 нуклеотида) (также называемый "длинной mус-матрицей") (SEQ ID NO:3). Эта последовательность содержит код для генерирования пептида, используемого для выделения антитела против с-mус. 5'-конец содержит усеченный вариант расположенной выше последовательности TMV (обозначенной "ТЕ"). Данная 5'-UTR содержит 22 нуклеотидных последовательности, происходящих от 5'-UTR-TMV, охватывающей два прямых повтора ACAAAUUAC (Gallie et al., Nucl. Acids. Res. 16: 883 (1988)). На фиг.7С показан пул #1 (SEQ ID NO:4), который является примером последовательности, используемой для отбора пептидов. Конечные семь аминокислот из исходного myc-пептида были включены в указанную матрицу и служат в качестве 3'-константной области, необходимой для ПЦР-амплификации этой матрицы. Известно, что данная последовательность не является частью эпитопа, связывающегося с антителом.
На фиг.8 представлена фотография, иллюстрирующая синтез гибридов РНК-белок с использованием матриц 43-Р, LP77 и LP154 и системы трансляции ретикулоцитов ("ретикул.") и зародышей пшеницы ("пшеница"). В левой части этой фигуры проиллюстрировано включение 35S-метионина в каждую из этих трех матриц. В правой части данной фигуры проиллюстрировано получение продуктов после обработки каждой из этих трех матриц РНКазой А для удаления кодирующей области РНК; показаны гибриды "меченная 35S-метионином ДНК-белок". ДНК-часть каждого из них идентична олигонуклеотиду 30-Р. Таким образом, различия в подвижности были пропорциональны длине кодирующих областей, что соответствует присутствию белков различной длины в каждом случае.
На фиг.9 представлена фотография, иллюстрирующая восприимчивость к протеазе гибрида РНК-белок, синтезированного из LP154 и проанализированного путем электрофореза в денатурирующем полиакриламидном геле. Дорожка 1 содержит 32P-меченую 30-Р. Дорожки 2-4, 5-7 и 8-10 содержат 35S-меченые транслирующие матрицы, полученные в результате проведения реакций с лизатом ретикулоцита без обработки или с обработкой РНКазой А, либо с обработкой РНКазой А и протеиназой К соответственно.
На фиг.10 представлена фотография, иллюстрирующая результаты реакций иммунопреципитации с использованием in vitro-транслированного белка mус-эпитопа из 33 аминокислот. На дорожке 1 и 2 показаны продукты трансляции белка mус-эпитопа и матриц β-глобина соответственно. На дорожках 3-5 показаны результаты иммунопреципитации пептида myc-эпитопа с использованием моноклонального антитела с-mус и промывочных буферов PBS, DB и PBSTDS соответственно. На дорожках 6-8 показаны те же самые реакции иммунопреципитации, но с использованием продукта трансляции β-глобина.
На фиг.11 представлена фотография, на которой продемонстрирована иммунопреципитация гибрида "РНК-белок" из реакции трансляции in vitro. Показаны пикомоли матрицы, используемой в данной реакции. На дорожках 1-4 показана РНК124 (РНК-часть гибрида LP154), а на дорожках 5-7 показан гибрид "РНК-белок" LP154. После иммунопреципитации с использованием моноклонального антитела против с-mус и белка G-сефарозы, образцы обрабатывали РНКазой А и полинуклеотид-киназой Т4, а затем загружали на содержащий мочевину денатурирующий полиакриламидный гель для визуализации гибрида. На дорожках 1-4 для образцов, которые либо не содержат матрицу, либо содержат только РНК-части длинной mус-матрицы (РНК124), гибрида не наблюдалось. На дорожках 5-7 полосы, соответствующие данному гибриду, были четко визуализированы. Указано положение 32P-меченой 30-Р, а в верхней части этой фигуры указано количество встроенной матрицы.
На фиг.12 представлен график, на котором показано количество гибридного материала, полученного в результате реакции трансляции in vitro. Интенсивность полос гибрида, показанных на дорожках 5-7 фиг.11, и полосы 30-Р (выделенной параллельно на dT25, не показано) количественно оценивали на люминофорных визуализирующих пластинах и строили график зависимости функции от концентрации включенного LP154. Количество выделенной модифицированной 30-Р (левая ось у) прямо пропорционально встроенной матрице (ось х), а количество гибрида "линкер-пептид" (правая ось у) было постоянным. В результате проведения данного анализа было вычислено, что на 1 мл образца реакции трансляции было получено ~1012 гибридов.
На фиг.13 схематически представлена тиопропилсефароза и dТ25-агароза и способность этих субстратов взаимодействовать с гибридами "РНК-белок" настоящего изобретения.
На фиг.14 представлена фотография, на которой продемонстрированы результаты последовательного выделения гибридов настоящего изобретения. На дорожке 1 показана 32P-меченая 30-Р. На дорожках 2 и 3 показан LP154, выделенный в результате реакций трансляции и обработанный РНКазой. На дорожке 2 LP154 был выделен последовательно с использованием тиопропилсефарозы, а затем с использованием dТ25-агарозы. На дорожке 3 показано выделение только с использованием dТ25-агарозы. Результаты показали, что данный продукт содержит свободный тиол подобно предпоследнему цистеину в последовательности, кодирующей mус-эпитоп.
На фиг.15А и 15В показаны фотографии, на которых продемонстрировано образование гибридных продуктов с использованием матриц β-глобина, проанализированных с помощью ПААГ с ДСН и трицином (электрофореза в полиакриламидном геле). На фиг.15А показано включение 35S либо без матрицы (дорожка 1), либо с матрицей син-β-глобина (дорожки 2-4), либо с матрицей LP-β-глобина (дорожки 5-7). На фиг.15В (дорожки, помеченные как показано на фиг.15А) показан 35S-меченый материал, выделенный с помощью аффинной хроматографии олигонуклеотидов. При отсутствии 30-Р-хвоста (дорожки 2-4) никакого материала выделено не было.
На фиг.16А-16С представлены диаграммы и фотографии, иллюстрирующие обогащение mус-дцДНК по отношению к дцДНК пула благодаря in vitro-отбору. На фиг.16А схематически представлен протокол этого отбора. Четыре смеси mус-матриц и матриц пула транслировали in vitro и выделяли на dT25-arapose, а затем на ТР-сефарозе для очистки гибридов матриц от немодифицированных матриц. Затем гибриды "мРНК-пептид" подвергали обратной транскрипции для ингибирования какой-либо вторичной или третичной структуры, присутствующей в данных матрицах. Аликвоты каждой смеси удаляли перед (фиг.16В) и после (фиг.16С) аффинного отбора, амплифицировали посредством ПЦР в присутствии меченого праймера и гидролизовали рестриктирующим ферментом, который расщеплял только mуc-ДНК. Включенные смеси матриц представляли собой чистый mуs (дорожка 1) или mуc:пул, 1:20, 1:200 или 1:2000 (дорожки 2-4). Из-за преимущественной трансляции и обратной транскрипции mуc-матрицы уровень неотобранного материала отклонялся от уровней включенного материала. Обогащение количества mус-матрицы в процессе проведения данной стадии отбора вычисляли исходя из изменения отношения пул:mуs до и после отбора.
На фиг.17 представлена фотография, иллюстрирующая трансляцию mуc-РНК-матриц. Были использованы следующие линкеры: дорожки 1-4, dA27dCdCP; дорожки 5-8, dA27rCrCP; и дорожки 9-12, dA21C9C9C9dAdCdCP. На каждой дорожке концентрация РНК-матрицы составляла 600 нМ, a 35S-Met использовали для мечения. Реакционные условия были следующими: дорожки 1, 5 и 9 - 30°С, 1 час; дорожки 2, 6 и 10 - 30°С, 2 часа; дорожки 3, 7 и 11 - 30°С, 1 час, -20°С, 16 часов; и дорожки 4, 8 и 12 - 30°С, 1 час, -20°С, 16 часов с 50 мМ Mg2+. На этой фигуре "А" представляет свободный пептид, а "В" представляет гибрид "мРНК-пептид".
На фиг.18 представлена фотография, иллюстрирующая трансляцию mус-РНК-матриц, меченных 32S. Используемым линкером был dА21С9С9С9dАdСdСР. Трансляцию проводили в течение 90 минут при 30°С, а инкубирование осуществляли при -20°С в течение 2 дней без дополнительного количества Mg2+. Концентрации мРНК-матриц составляли 400 нМ (дорожка 3), 200 нМ (дорожка 4), 100 нМ (дорожка 5) и 100 нМ (дорожка 6). На дорожке 1 показан гибрид "мРНК-пептид", меченный 35S-Met. На дорожке 2 показана мРНК, помеченная 32P. На дорожке 6 реакцию проводили в присутствии 0,5 мМ кэп-аналога.
На фиг.19 представлена фотография, иллюстрирующая трансляцию mус-РНК-матрицы с использованием лизата, полученного от Ambion (дорожка 1), Novagen (дорожка 2) и Amersham (дорожка 3). Используемым линкером был dA27dCdCP. Концентрация матрицы составляла 600 нМ, a 35S-Met использовали для мечения. Трансляции осуществляли при 30°С в течение 1 часа, а инкубирование проводили при -20°С в течение ночи в присутствии 50 мМ Мg2+.
На фиг.20 представлен график, иллюстрирующий обогащение гибридами РНК-пептид, связанными посредством моноклонального антитела 9Е10 против mуc, в процессе проведения шести циклов in vitro-селекции.
На фиг.21 показан график, иллюстрирующий анализы на конкурентное связывание с синтетическими mус-пептидами.
На фиг.22 схематически проиллюстрированы аминокислотные последовательности 12 отобранных пептидов из произвольной 27-мерной библиотеки.
На фиг.23 представлена фотография, иллюстрирующая влияние длины линкера на образование гибрида. На этой фигуре, Мус-матрицы, содержащие длинные линкеры [N]=13, 19, 25, 30, 35, 40, 45 или 50 нуклеотидов (dA10-47dCdCP), анализировали на образование гибридов путем электрофореза в ПААГ с ДСН. Также показан гибкий линкер F (dA21[C9]3dAdCdCP). Трансляцию проводили с использованием 600 нМ матрицы при 30°С в течение 90 минут, а затем добавляли 50 мМ Мg2+ и инкубировали при -20°С в течение двух дней.
На фиг.24 представлена фотография, иллюстрирующая совместную трансляцию mус и мРНК-λФПазу. На этой фигуре 200 нМ РНК-λФПазы (РНК716) и/или 50 нМ myc-PHK (PHK152), содержащие жесткий линкер F (dA21[C9]3dAdCdCP), транслировали с использованием [35S]-Met. Затем добавляли Мg2+ (75 мМ) и проводили инкубирование при -20°С. У перекрестно сшитых продуктов (гибрида "mус-матриц" с белком λФПазы) полос не наблюдалось.
Далее следует описание общего способа отбора белков, обладающих нужными функциями, с использованием гибридов, в которых данные белки являются ковалентно связанными с их собственными информационными РНК. Указанные гибриды "РНК-белок" синтезируют путем in vitro- или in vivo-трансляции пулов мРНК, содержащих пептидный акцептор, присоединенный к их 3'-концам (фиг.1В). В одном предпочтительном варианте осуществления настоящего изобретения после сквозного прочитывания открытой рамки считывания транскрипта рибосома, когда она достигает определенного стоп-сайта, останавливается, и акцепторная группа занимает рибосомный А-сайт и акцептирует растущую пептидную цепь из пептидил-тРНК в Р-сайте, в результате чего образуется гибрид "РНК-белок" (фиг.1С). Ковалентная связь между белком и РНК (в форме амидной связи между 3'-концом мРНК и С-концом белка, который она кодирует) позволяет после отбора путем обратной транскрипции данной РНК получить генетическую информацию в данном белке и амплифицировать эту информацию (например, посредством ПЦР). После получения гибрида отбор или обогащение проводят на основе свойств гибрида мРНК-белок, или, альтернативно, может быть проведена обратная транскрипция с использованием мРНК-матрицы, которую присоединяют к данному белку во избежание какого-либо влияния одноцепочеченой РНК на этот отбор. При использовании конструкции мРНК-белок отобранные гибриды могут быть протестированы в целях определения, какая именно составляющая (белок, РНК или обе молекулы) обеспечивают нужную функцию.
В одном из предпочтительных вариантов пуромицин (подобный тирозиладенозилу) действует как акцептор для присоединения растущей цепи пептида к ее мРНК. Пиромицин представляет собой антибиотик, который действует путем терминации элонгации пептидной цепи. В качестве миметика аминоацил-тРНК он действует как универсальный ингибитор синтеза белка путем связывания с А-сайтом, акцептирования растущей пептидной цепи и отделения рибосомы (при Kd=10-4 M) (Traut & Monro, J. Mol. Biol. 10: 63 (1964); Smith et al., J. Mol. Biol. 13: 617 (1965)). Одной из наиболее привлекательных особенностей пуромицина является то, что он образует стабильную амидную связь с растущей пептидной цепью, что позволяет, тем самым, получать более стабильные гибриды, чем потенциальные акцепторы, которые образуют нестабильные сложноэфирные связи. В частности, молекула пептидил-пуромицина содержит стабильную амидную связь между пептидом и O-метилтирозиновой частью пуромицина. O-метилтирозин, в свою очередь, связан путем стабильной амидной связи с 3'-аминогруппой, модифицированной аденозиновой частью пуромицина.
Другими акцепторами, которые могут быть выбраны, являются тРНК-подобные структуры у 3'-конца мРНК, а также другие соединения, которые действуют аналогично пуромицину. Такими соединениями являются, но не ограничиваются ими, любое соединение, которое имеет аминокислотную связь с аденином или аденин-подобным соединением, таким как аминокислота-нуклеотиды, фенилаланил-аденозин (A-Phe), тирозил-аденозин (А-Туr) и аланин-аденозин (А-Аlа), а также структуры с амидной связью, такие как фенилаланил-3'-дезокси-3'-аминоаденозин, аланил-3'-дезокси-3'-аминоаденозин и тирозил-3'-дезокси-3'-аминоаденозин; причем в любом из этих соединений может быть использована любая из природных L-аминокислот или их аналоги. Кроме того, в настоящем изобретении может быть также использован сложный тРНК-подобный конъюгат 3'-структура-пуромицин.
Предпочтительная схема отбора настоящего изобретения показана на фиг.2. Стадии, входящие в эту схему отбора, обычно осуществляют следующим образом.
Стадия 1. Получение ДНК-матрицы
Поскольку эта стадия направлена на генерирование гибридов "РНК-белок" настоящего изобретения, то синтезируют РНК-часть данного гибрида. Это может быть осуществлено путем прямого химического синтеза РНК или, чаще всего, путем транскрибирования соответствующей двухцепочечной ДНК-матрицы.
Такие ДНК-матрицы могут быть созданы стандартными методами (включая любые методы, используемые в методах рекомбинантных ДНК, методах химического синтеза или в тех и других). В принципе, для этой цели может быть использован любой метод, который позволяет продуцировать одну или несколько матриц, содержащих известную, произвольную, рандомизированную или мутагенизированную последовательность. В одном из конкретных способов синтезируют олигонуклеотид (например, содержащий произвольные основания) и перед его транскрипцией подвергают амплификации (например, с помощью ПЦР). Химический синтез может быть также использован для продуцирования кластера произвольных последовательностей, который может быть затем встроен в середину последовательности, кодирующей известный белок (см., например, главу 8.2 Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons and Greene Publisching Company, 1994). Указанный последний способ дает высокую плотность мутаций возле нужного конкретного сайта в белке.
Альтернативой полной рандомизации последовательности ДНК-матрицы является неполная рандомизация, и пул, синтезированный таким способом, обычно называется "допированным" пулом. Примером такого метода, осуществляемого на РНК-последовательности, является метод, описанный, например, Ekiand et al. (Nucl. Acids Research 23: 3231 (1995)). Неполная рандомизация может быть осуществлена химически посредством реакций "неоднозначного" синтеза так, чтобы каждая смесь для реакции присоединения содержала избыток одного основания и небольшие количества каждого из других оснований; и осуществление этого способа может быть достигнуто путем тщательного контроля за концентрацией оснований и частотой нужной мутации. Частично рандомизированные пулы могут быть также генерированы методом проведения подверженной ошибкам ПЦР, например, описанным Beaudry & Joyce (Science 257: 635 (1992)) и Bartl & Szostak (Science 261: 1411 (1993)).
Для создания ДНК-конструкции также существует множество методов, в которых исходят из известной последовательности, а затем создают мутагенизированный ДНК-пул. Примеры таких методов описаны у Ausubel et al. (см., главу 8); Sambrook et al. (Molecular Cloning: A Laboratory Manual, chapter 15, Cold Spring Harbor Press, New York, 2nd ed. (1989); Cadwell et al. (PCR Methods and Applications 2: 28 (1992)); Tsang et al. (Meth. Enzymol. 267: 410 (1996)); Reidhaar-Olsen et al. (Meth. Enzymol. 208: 564 (1991)); и Ekiand & Bartel (Nucl. Acids. Res. 23: 3231 (1995)). Произвольные последовательности могут быть также генерированы методом "перетасовки", описанным Stemmer (Nature 370: 389 (1994)). И наконец, серия из двух или более гетерологичных генов может быть подвергнута рекомбинации in vitro с получением исходной библиотеки (Crameri et al. Nature 391: 288-291 (1998)).
ОРС могут быть сконструированы из произвольных последовательностей рядом способов, в зависимости от выбранных кодонов. Стоп-кодонов в открытой рамке считывания предпочтительно избегать. Могут быть использованы полностью рандомизированные библиотеки последовательностей (NNN-кодирующих), содержащих определенное количество стоп-кодонов (3/64=4,7% на кодон), которое может быть неприемлемо высоким для всех кроме самых коротких библиотек. Такие библиотеки также содержат редко используемые кодоны, которые могут иногда приводить к недостаточной трансляции. Кодоны NNG/С дают несколько пониженную частоту стоп-кодонов (1/32+3,1% на кодон), но обеспечивают доступ к "наилучшим" кодонам для всех 20 аминокислот в системах трансляции млекопитающих. Кодоны NNG/C являются менее оптимальными при их применении в бактериальных системах трансляции, где наилучшие кодоны оканчиваются на А или Т в 7 случаях (AEGKRTV). Существует несколько растворов, которые дают очень низкую частоту стоп-кодонов (~1,0%), где содержание аминокислот аналогично наблюдаемому в глобулярных белках, при использовании трех различных нуклеотидных смесей, кодонов N1N2N3 (LaBean & Kauffman, Protein Science 2: 1249-1254 (1993)) (и цитируемые здесь работы). И наконец, для библиотек конфигураций в соответствии с типом аминокислоты может быть использовано почти бесконечное число полурациональных стратегий конструирования. Так, например, гидрофобные (h) или полярные (р) аминокислоты могут быть выбраны с использованием кодонов NTN или NAN соответственно (Beasley & Hecht, J. Biol. Chem. 272: 2031-2034 (1997)). Эти структуры могут быть получены так, чтобы предпочтительно образовывалась α-спираль (phpphhpp..) или β-складка (phphph...).
ОРС, сконструированная из синтетических последовательностей, может также содержать стоп-кодоны, полученные исходя из инсерций или делеций в синтетической ДНК. Эти дефекты могут иметь негативные последствия, обусловленные альтерациями трансляционной рамки считывания. Оценка ряда пулов синтетических генов, сконструированных из синтетических олигонуклеотидов, показала, что инсерции и делеции происходят с частотой ~0,6% на положение или 1,8% на кодон. Точная частота этих событий варьируется, и предполагается, что она зависит от источника и длины синтетической ДНК. В частности, чем длиннее последовательности, тем выше частота инсерций и делеций (Haas et al., Current Biology 6: 315-324 (1996)). Для уменьшения сдвигов рамки считывания в ОРС может быть использован простой раствор, предназначенный для работы с относительно короткими сегментами синтетической ДНК (80 нуклеотидов или менее), которые могут быть очищены до гомогенности. Более длинные ОРС могут быть затем генерированы путем рестрикции и лигирования некоторых более коротких последовательностей.
Для оптимизации схемы отбора настоящего изобретения могут быть также модифицированы последовательности и структуры у 5' и 3'-концов матриц. Это может быть осуществлено предпочтительно двумя отдельными стадиями отбора, каждая из которых предусматривает инсерцию рандомизированных доменов в матрицу, расположенную возле соответствующего конца, с последующим отбором. Эти стадии отбора могут служить (i) для максимизации количества полученного гибрида (и таким образом, для максимизации множественности библиотеки) или (ii) для получения оптимизированных последовательностей трансляции. Кроме того, указанный метод может быть, в основном, применен в сочетании с мутагенной ПЦР для оптимизации трансляционных матриц как в кодирующей, так и в некодирующей областях.
Стадия 2. Генерирование РНК
Как указывалось выше, РНК-часть гибрида РНК-белок может быть синтезирована методом химического синтеза с использованием стандартной методики олигонуклеотидного синтеза. Альтернативно, и в частности, если используются более длинные РНК-последовательности, то РНК-часть генерируют путем in vitro-транскрипции ДНК-матрицы. В одном предпочтительном способе для ферментативного генерирования РНК-цепи используют полимеразу Т7. Транскрипцию, обычно, осуществляют в том же самом объеме, что и ПЦР-реакцию (ПЦР-ДНК, полученную из 100 мкл-реакции, используют для 100 мкл-транскрипции). Если необходимо, то эта РНК может быть генерирована с 5'-кэпом с использованием большого молярного избытка m7GpppG по отношению к GTP в реакции транскрипции (Gray & Hentze, EMBO J. 13: 3882-3891 (1994)). Другими РНК-полимеразами, подходящими для этой цели, являются, но не ограничиваются ими, SP6, Т3 и РНК-полимеразы E.coli (описанные, например, Ausubel et al. (см., главу 3). Кроме того, синтезированной РНК может быть целиком или частично модифицированная РНК. В одном из конкретных примеров фосфортионат-РНК может быть продуцирована (например, путем Т7 транскрипции) с использованием модифицированных рибонуклеотидов и стандартных методов. Такие модифицированные РНК имеют то преимущество, что они являются стабильными по отношению к действию нуклеаз. Затем образцы полноразмерной РНК очищают из транскрипционной реакционной смеси, как было описано ранее, с использованием ПААГ, содержащего мочевину, с последующим обессоливанием на NAP-25 (Pharmacia) (Roberts and Szostak, Proc. Natl. Acad. Sci., USA, 94: 1227-12302 (1997)).
Стадия 3. Лигирование пуромицина с матрицей
Затем пуромицин (или любой другой подходящий пептидный акцептор) ковалентно связывают с последовательностью матрицы. Эта стадия может быть осуществлена с использованием ДНК-лигазы Т4 для присоединения пуромицина непосредственно к РНК-последовательности, либо предпочтительно данный пуромицин может быть присоединен посредством ДНК-"шунта" с использованием ДНК-лигазы Т4 или любого другого фермента, способного соединять вместе две нуклеотидные последовательности (см., фиг.1В) (см., также, например, Ausubel et al., см. выше, глава 3, разделы 14 и 15). Для присоединения пуромицин-подобных соединений к РНК могут быть также использованы тРНК-синтетазы. Так, например, фенилаланил-тРНК-синтетаза связывает фенилаланин с фенилаланил-тРНК-молекулами, содержащими 3'-аминогруппу, генерируя РНК-молекулы с пуромицин-подобными 3'-концами (Fraser & Rich, Proc. Natl. Acad. Sci., USA, 70: 2671 (1973)). Другими подходящими пептидными акцепторами, которые могут быть использованы, являются, но не ограничиваются ими, любые соединения, имеющие аминокислоту, связанную с аденином или аденин-подобным соединением, таким как аминокислота-нуклеотиды, фенилаланил-аденозин (A-Phe), тирозил-аденозин (А-Туr) и аланил-аденозин (A-Ala), a также связанные с амидом структуры, такие как фенилаланил-3'-дезокси-3'-аминоаденозин, аланил-3'-дезокси-3'-аминоаденозин и тирозил-3'-дезокси-3'-аминоаденозин; причем в любом из этих соединений могут быть использованы любые природные L-аминокислоты или их аналоги. Ряд пептидных акцепторов описан, например, Krayevsky & Kukhanova, Progress in Nucleic Acids Research and Molecular Biology 23: 1 (1979).
Стадия 4. Генерирование и выделение гибридов РНК-белок
Для генерирования гибридов "РНК-белок" могут быть использованы любые in vitro или in situ системы трансляции. Как показано ниже, предпочтительными являются эукариотические системы, а особенно предпочтительными являются две системы, а именно системы зародышей пшеницы и системы лизатов ретикулоцитлов. Однако, в принципе, в настоящем изобретении может быть использована любая система трансляции, которая позволяет получать гибрид "РНК-белок" и которая не оказывает значительного разрушающего действия на РНК-часть данного гибрида. Кроме того, для снижения степени разрушения РНК в любой из этих систем в реакционную трансляционную смесь могут быть включены антисмысловые олигонуклеотиды, блокирующие деградацию; причем такие олигонуклеотиды специфически гибридизуются с последовательностями и покрывают последовательности в РНК-части молекулы, которая стимулирует разрушение (см., например, Hanes & Pluckthun, Proc. Natl. Acad. Sci., USA, 94: 4937 (1997)).
Как указывалось выше, в настоящем изобретении может быть использовано любое число эукариотических систем трансляции. Такими системами являются, но не ограничиваются ими, лизаты дрожжей, асциты, опухолевые клетки (Leibowitz et al., Meth. Enzymol. 194: 536 (1991)) и яйцеклетки Xenopus. Подходящими бактериальными системами in vitro-трансляции являются, но не ограничиваются ими, системы, описанные Zubay (Ann. Rev. Genet. 7: 267 (1973)); Chen & Zubay (Meth. Enzymol. 101: 44 (1983)); и Ellman (Meth. Enzymol. 202: 301 (1991)).
Кроме того, реакции трансляции могут быть проведены in situ. В одном конкретном примере трансляция может быть осуществлена путем введения мРНК в яйцо Xenopus стандартными методами.
После генерирования гибридов РНК-белок они могут быть выделены из трансляционной реакционной смеси любым стандартным методом очистки белков или РНК. Обычно используются методы очистки белков. Как показано ниже, например, очистка гибрида может быть облегчена с использованием подходящих хроматографических реагентов, таких как dТ25-агароза или тиопропил-сефароза. Однако очистка может также, или альтернативно, предусматривать очистку на основе РНК-части данного гибрида; методы такой очистки описаны, например, Ausubel и др. (см. выше, главу 4).
Стадия 5: Отбор нужного гибрида РНК-белок
Отбор нужного гибрида РНК-белок может быть осуществлен любым способом, подходящим для селективного разделения или выделения нужного гибрида из популяции гибридов-кандидатов. Примерами методов выделения являются, но не ограничиваются ими, селективное связывание, например, с партнером по связыванию, который непосредственно или опосредованного иммобилизован на колонке, сфере, мембране или другом твердом носителе; и иммунопреципитация с использованием антитела, специфичного для белковой части данного гибрида. Первый из этих методов дает возможность использовать иммобилизованный мотив для отбора, который может состоять из молекул любого типа, с которыми он связывается. Список возможных молекул для отбора мотивов представлен на фиг.2. Отбор может быть также осуществлен на основе использования молекул-субстратов, присоединенных к аффинной метке (например, субстрат-биотин), которые реагируют с молекулой-кандидатом, или на основе другого типа взаимодействия с гибридной молекулой. Кроме того, белки могут быть отобраны исходя из их каталитической активности способом, аналогичным описанному Bartel и Szostak для выделения РНК-ферментов (см. выше); и в соответствии с конкретным методом нужные молекулы выбирают, исходя из их способности связываться с молекулой-мишенью, после чего эти функциональные молекулы выделяют, исходя из присутствия указанной мишени. В настоящем изобретении предусматривается использование схем отбора для выделения новых или улучшенных каталитических белков с использованием того же самого метода или какого-либо другого метода функционального отбора.
Кроме того, как описано в настоящей заявке, отбор нужного гибрида "РНК-белок" (или его ДНК-копии) может быть облегчен путем обогащения этим гибридом пула молекул-кандидатов. Для осуществления такого необязательного обогащения популяцию гибридов-кандидатов "РНК-белок" подвергают контактированию с партнером по связыванию (например, с одним из вышеуказанных партнеров по связыванию), который является специфичным для РНК-части или для белковой части данного гибрида, в условиях, которые, в основном, позволяют отделять комплекс "партнер по связыванию - гибрид" от несвязанных членов в данном образце. Эта стадия может быть повторена, и данный метод предпочтительно включает, по крайней мере, две последовательных стадии обогащения, в одной из которых осуществляют отбор гибридов с использованием партнера по связыванию, специфичного для данной РНК-части, а в другой осуществляют отбор гибридов с использованием партнера по связыванию, специфичного для данной белковой части. Кроме того, если стадии обогащения, направленные на ту же самую часть гибрида (например, белковую часть), повторяют, то предпочтительно использовать других партнеров по связыванию. В одном конкретном примере, описанном в настоящей заявке, популяцию молекул обогащают нужными гибридами сначала с использованием партнера по связыванию, специфичного для РНК-части данного гибрида, а затем, в двух последовательных стадиях, с использованием двух других партнеров по связыванию, каждый из которых является специфичным для белковой части гибрида. И снова, эти комплексы могут быть отделены от компонентов образца любыми стандартными методами разделения, включая, но не ограничиваясь ими, колоночную аффинную хроматографию, центрифугирование или иммунопреципитацию.
Более того, элюирование гибрида РНК-белок из комплекса для обогащения (или отбора) может быть осуществлено рядом методов. Например, как описано в данной заявке, для выделения нужного гибрида РНК-белок может быть проведена стадия денатурации или неспецифического химического элюирования. Проведение такой стадии облегчает отделение компонентов комплекса друг от друга или от ассоциированного твердого носителя в относительно неспецифическом способе путем разрушения нековалентных связей между данными компонентами и/или между компонентами и твердым носителем. Как описано в настоящей заявке, одним характерным примером денатурирующего реагента или неспецифического реагента для химического элюирования является 4% HOAc/H2O. Другими примерами денатурирующих реагентов или реагентов для неспецифического химического элюирования являются гуанидин, мочевина, высококонцентрированная соль, детергент или любые другие средства с помощью которых могут быть, в основном, удалены нековалентные аддукты. Альтернативно может быть использован метод специфического химического элюирования, в котором используется химическое вещество, способствующее специфическому высвобождению гибридной молекулы. В одном конкретном примере, если линкерная "ножка" нужного гибридного белка содержит одну или более дисульфидных связей, то связанные гибридные аптамеры могут быть проэлюированы путем добавления, например, DTT, что приводит к восстановлению дисульфидной связи и высвобождению связанной мишени.
Альтернативно элюирование может быть осуществлено путем специфического разрушения аффинных комплексов; и такие методы позволяют селективно высвобождать компоненты комплекса путем добавления избытка одного члена данного комплекса. Так, например, при отборе путем АТР-связывания элюирование осуществляют путем добавления избытка АТР к смеси для инкубирования. И наконец, может быть проведена стадия ферментативного элюирования. В соответствии с этим методом сама связанная молекула или экзо-генно присоединенная протеаза (или другой соответствующий гидролитический фермент) расщепляет и высвобождает либо мишень, либо фермент. В одном конкретном примере сайт присоединения протеазы может быть включен в любой из компонентов комплекса, и связанные молекулы элюируют путем добавления протеазы. Альтернативно при каталитическом отборе элюирование может быть проведено как стадия отбора для выделения молекул, способных к самостоятельному отделению (например, путем отщепления) от твердого носителя.
Стадия 6. Генерирование ДНК-копии РНК-последовательности с использованием обратной транскриптазы
Если необходимо, ДНК-копия отобранной последовательности РНК гибрида можно легко получить посредством обратной транскрипции данной РНК-последовательности с использованием стандартных методов (например, с использованием обратной транскриптазы Superscript). Эта стадия может быть осуществлена перед стадией отбора или обогащения (например, как показано на фиг.16) или после этой стадии. Альтернативно процесс обратной транскрипции может быть осуществлен перед выделением гибрида из трансляционной in vitro или in situ-смеси.
Затем ДНК-матрицу амплифицируют либо в виде неполной, либо в виде полноразмерной двухцепочечной последовательности. Предпочтительно в этой стадии полноразмерные ДНК-матрицы генерируют с использованием соответствующих олигонуклеотидов и ПЦР-амплификации.
Эти стадии, а также реагенты и способы осуществления этих стадий подробно описаны в нижеследующих конкретных примерах. Эти примеры приводятся в целях иллюстрации настоящего изобретения и не должны рассматриваться как его ограничения.
Генерирование матриц для гибридов "РНК-белок"
Как показано на фиг.1А и 2, схема отбора настоящего изобретения предпочтительно позволяет использовать двухцепочечные ДНК-матрицы, которые включают ряд нужных элементов. Первым их этих элементов является промотор, используемый в сочетании с нужной РНК-полимеразой для синтеза мРНК. Как показано на фиг.1А и в настоящем описании, предпочтительным является промотор Т7, хотя может быть использован любой промотор, способный регулировать синтез из линейной двухцепочечной ДНК.
Второй элемент матрицы, показанный на фиг.1А, является 5'-нетранслируемой областью (или 5'UTR) и соответствует РНК, расположенной выше сайта инициации трансляции. На фиг.1А показан предпочтительный 5'UTR (называемый "ТЕ"), который представляет собой делеционный мутант 5'-нетранслируемой области вируса мозаики табака, а в частности, соответствует основаниям, расположенным непосредственно с 5'-конца от сайта инициации трансляции TMV; где последовательность этого UTR представляет собой rGrGrG
rArCrA rArUrU rArCrU rArUrU rUrArC rArArU rUrArC rA (где первые 3 нуклеотида G встроены для усиления транскрипции) (SEQ ID NO:5). Может быть использован любой другой подходящий 5'UTR (см., например, Kozak, Microbiol. Rev. 47: 1 (1983); и Jobling et al., Nature 325: 622 (1987)).
Третьим элементом, показанным на фиг.1А, является сайт инициации трансляции. В основном, им является кодон AUG. Однако имеются примеры, где в природных кодирующих последовательностях вместо AUG присутствуют другие кодоны, и эти кодоны могут быть использованы в схеме отбора настоящего изобретения. На эффективность трансляции влияют конкретные последовательности контекста, окружающие этот кодон (Kozak, Microbiological Reviews 47: 1-45 (1983); и Kozak, J. Biol. Chem. 266: 19867-19870 (1991)). Последовательность 5'RNNAUGR дает хороший контекст старт-кодона для большинства последовательностей, при этом предпочтительным в качестве первого пурина (-3) является А, а предпочтительным в качестве второго пурина (+4) является G (Kozak, Microbiological Reviews 47: 1-45 (1983); и Kozak, J. Mol. Biol. 196: 947-950 (1987)).
Четвертым элементом на фиг.1А является открытая рамка считывания белка (называемая ОРС), которая кодирует данную последовательность белка. Эта открытая рамка считывания может кодировать любую природную, произвольную, рандомизированную, мутагенизированную или полностью синтетическую последовательность белка. Наиболее важным отличительным признаком ОРС и смежной 3'-константной области является то, что ни одна из них не содержит стоп-кодонов. Присутствие стоп-кодонов должно приводить к преждевременной терминации синтеза белка, что предупреждает образование гибрида.
Пятым элементом, показанным на фиг.1А, является константная 3'-область. Эта последовательность облегчает ПЦР-амплификацию последовательностей пулов и лигирование пуромицинсодержащего олигонуклеотида с мРНК. Если это необходимо, то данная область может также включать стоп-сайт, последовательность которого вызывает остановку рибосомы, что дает акцепторной части (например, пуромицину) дополнительное время для акцептирования растущей пептидной цепи из пептидил-тРНК; этот стоп-сайт более подробно обсуждается ниже.
Для разработки методики настоящего изобретения гибриды "РНК-белок" были сначала генерированы с использованием в высокой степени упрощенных мРНК-матриц, содержащих 1-2 кодона. Этот метод был выбран по двум причинам. Во-первых, матрицы этого размера могут быть легко получены методами химического синтеза. И, во-вторых, небольшая открытая рамка считывания позволяет легко анализировать важные особенности данной реакции, включая эффективность связывания, гетерогенность концов, зависимость от матрицы и точность трансляции.
Создание конструкции
Основную конструкцию использовали для генерирования тестируемых гибридов "РНК-белок". Молекула состоит из мРНК, содержащей последовательность Шайна-Дальгарно (SD) для инициации трансляции, которая содержит делеции в 3 основания в последовательности SD от рибосомного белка L1 и которая комплементарна 5 основаниям 16S рРНК (то есть rGrGrA rGrGrA rGrGrA rA) (SEQ ID NO:6) (Stormo et al., Nucleic Acids Research 10: 2971-2996 (1982); Shine & Dalgarno, Proc. Natl. Acad. Sci. USA 71: 1342-1346 (1974); и Steitz & Jakes, Proc. Natl. Acad. Sci. USA 72: 4734-4738 (1975)), (ii) старт-кодона AUG, (iii) ДНК-линкера, действующего как стоп-сайт (т.е. 5'-(dA)27), (iv) dCdC-3' и (v) 3'-пуромицина (Р). Poly-dA-последовательность была выбрана из-за известного низкого содержания матрицы тРНК в А-сайте (Morgan et al., J. Mol. Biol. 26: 477-497 (1967); Ricker & Kaji, Nucleic Acids Research 19: 6573-6578 (1991)) и сконструирована так, чтобы она функционировала в качестве хорошего стоп-сайта. Длину oligo dT-линкера выбирают так, чтобы охватить расстояние между декодирующим сайтом и пептидилтрансферазным центром рибосомы в ~60-70 A. dCdCP имитирует ССА-конец тРНК и конструируется для того, чтобы облегчить связывание пуромицина с А-сайтом рибосомы.
Химический синтез минимальной матрицы 43-Р
Для синтеза конструкции 43-Р (показана на фиг.3) пуромицин сначала присоединяют к твердому носителю таким способом, чтобы он был совместим со стандартным фосфорамидитным методом химического синтеза олигонуклеотидов. Схема синтеза для данного олигонуклеотида схематически представлена на фиг.3 и более подробно описана ниже. Для присоединения пуромицина к твердому носителю из стекла с регулируемым размером пор (CPG), аминогруппу защищают трифторацетильной группой, описанной в Applied Biosystems User Bulletin #49, для ДНК-синтезатора модели 380 (1988). Затем осуществляют защиту 5'ОН с использованием стандартного DMT-C1-метода (Gait, Oligonucleotide Syntesis a practical approach The Practical Approach Series (IRL Press, OxFord, 1984)), а присоединение к аминогексил-CPG посредством 2'ОН осуществляют точно таким же методом, как и метод, в котором должен быть использован 3'ОН для присоединения дезоксинуклеозида (см. фиг.3 и Gait, см., выше, р.47). После этого 5' DMT-CPG-связанный защищенный пуромицин может быть использован для удлинения цепи фосфорамидитными мономерами. Синтез олигонуклеотида в направлении 3'→5' осуществляют в следующем порядке: (i) 3'-пуромицин, (ii) pdCpdC, (iii) ~27 звеньев dA в качестве линкера, (iv) AUG, и (v) последовательность Шайна-Дальгарна. Последовательность конструкции 43-Р показана ниже.
Синтез CPG-пуромицина
Синтез защищенного CPG-пуромицина осуществляют в соответствии с общим методом, используемым для дезоксинуклеозидов, описанным ранее (Gait, Oligonucleotide Synthesis a practical approach The Practical Approach Series (IRL Press, OxFord, 1984)). Основными отправными точками являются выбор соответствующей N-блокирующей группы, присоединение пуромицина 2'ОН к твердому носителю и проведение реакции присоединения к твердому носителю. В последнем случае указанную реакцию проводят при очень малых концентрациях активированного нуклеотида, поскольку этот материал является значительно более ценным, чем твердый носитель. Получаемый выход (~20 мкмоль/г носителя) является вполне достаточным учитывая условия реакционного разведения.
Синтез N-трифторацетилпуромицина
267 мг (0,490 ммоль) пуромицин·НСl сначала превращали в форму свободного основания путем растворения в воде с добавлением карбонатного буфера рН 11, и экстракции (3х) в хлороформ. Органическую фазу выпаривали досуха и взвешивали (242 мг, 0,513 ммоль). Затем свободное основание растворяли в 11 мл сухого пиридина и 11 мл сухого ацетонитрила и добавляли при перемешивании 139 мкл (2,0 ммоль) триэтиламина (TEA; Fluka) и 139 мкл (1,0 ммоль) ангидрида трифторуксусной кислоты (TFAA; Fluka). Затем к мутному раствору добавляли TFAA в 20 мкл-аликвотах до тех пор, пока весь исходный материал не был израсходован, на что указывала тонкослойная хроматография (ТСХ) (93:7, хлороформ/МеОН) (всего 280 мкл). Эта реакция протекала в течение одного часа. На этой стадии с помощью тонкослойной хроматографии были выявлены две полосы, обе из которых имели большую подвижность, чем исходный материал. Обработка реакционной смеси NH4OH и водой приводила к уменьшению продукта до одной полосы. После хроматографии на силикагеле (93:7, хлороформ/МеОН) получали 293 мг (0,515 ммоль) продукта, N-TFA-Pur. Продукт данной реакции схематически показан на фиг.4.
Синтез N-трифторацетил-5'-DMT-пуромицина
Продукт вышеуказанной реакции разделяли на аликвоты и упаривали 2х вместе с сухим пиридином для удаления воды. Для испытания множества реакционных условий приготавливали множество пробирок. Для реакций в небольших масштабах 27,4 мг (48,2 мкмоль) N-TFA-Pur растворяли в 480 мкл пиридина, содержащего 0,05 экв. DMAP и 1,4 экв. TEA. К этой смеси добавляли 20,6 мг диметокситритилхлорида (60 мкмоль), и реакционную смесь оставляли при перемешивании до завершения реакции. Реакцию прекращали добавлением в раствор равного объема воды (приблизительно 500 мкл). Поскольку данная реакция оказалась успешной, то была осуществлена крупномасштабная реакция. В частности, 262 мг (0,467 ммоль) N-TFA-Pur растворяли в 2,4 мл пиридина, а затем добавляли 1,4 экв. TEA, 0,05 экв. DMAP и 1,2 экв. диметокситритилхлорида (Sigma). Через приблизительно два часа добавляли еще 50 мг (0,3 экв.) диметокситритил·Сl (DMT·Cl), и оставляли для прохождения реакции еще на 20 минут. Реакцию прекращали путем добавления 3 мл воды, и реакционную смесь подвергали совместному выпариванию (3х) с СН3СN. Затем реакционную смесь очищали смесью хлороформ/МеОН, 95:5, на колонке диаметром 2 мм со 100 мл двуокиси кремния (сухим). Вследствие неполной очистки вторую идентичную колонку элюировали смесью хлороформ/МеОН, 97:5:2,5. Полный выход составил 325 мг или 0,373 ммоль (или выход 72%). Продукт этой реакции схематически показан на фиг.4.
Синтез N-трифторацетил, 5'-DMT, 2'-сукцинил-пуромицина
В реакции небольшого масштаба 32 мг (37 мкмоль) продукта, синтезированного как описано выше, объединяли с 1,2 экв. DMAP, растворенного в 350 мкл пиридина. К полученному раствору добавляли 1,2 эквивалентов янтарного ангидрида в 44 мкл сухого CH3CN и оставляли на ночь для перемешивания. Тонкослойная хроматография выявила небольшое количество оставшегося исходного материала. В крупномасштабной реакции 292 мг (336 мкмоль) полученного ранее продукта объединяли с 1,2 экв. DMAP в 3 мл пиридина. К полученному раствору добавляли 403 мкл 1 М янтарного ангидрида (Fluka) в сухом СН3СN и смесь оставляли на ночь для перемешивания. Тонкослойная хроматография снова показала небольшое количество оставшегося исходного материала. Эти две реакционные смеси объединяли и добавляли еще 0,2 экв. DMAP и сукцината. Полученный продукт выпаривали совместно с толуолом (1х) и сушили в высоком вакууме с получением желтой пены. Затем добавляли СН2Сl2 (20 мл), и полученный раствор дважды экстрагировали 15 мл 10% охлажденной льдом лимонной кислоты, а затем дважды экстрагировали очищенной водой. Полученный продукт сушили, снова растворяли в 2 мл CH2Cl2 и осаждали при перемешивании путем добавления 50 мл гексана. Затем продукт подвергали вихревому перемешиванию и центрифугировали при 600 об/мин в течение 10 минут в лабораторной центрифуге. Большую часть элюента удаляли, а остальную часть продукта сушили, сначала в низком вакууме, а затем в высоком вакууме в сушильном шкафу. Выход этого продукта реакции составлял приблизительно 260 мкмоль для постадийного выхода ~70%.
Синтез N-трифторацетил-5'-DMT, 2'-сукцинил-СРG-пуромицина
Продукт, полученный в предыдущей стадии, растворяли в 1 мл диоксана (Fluka), а затем в смеси 0,2 мл диоксана/0,2 мл пиридина. К полученному раствору добавляли 40 мг п-нитрофенола (Fluka) и 140 мг дициклогексилкарбодиимида (DCC; Sigma), и реакционную смесь оставляли на 2 часа для прохождения реакции. Нерастворившуюся циклогексилмочевину, полученную в этой реакции, удаляли центрифугированием, и раствор продукта добавляли к 5 г стекла с регулируемым аминогексилом размером пор (CPG), суспендированного в 22 мл сухого ДМФ, и перемешивали в течение ночи. Затем смолу промывали ДМФ, метанолом и эфиром и сушили. Полученную смолу, содержащую 22,6 мкмоль тритила на г, тщательно анализировали в допустимых пределах для данного типа носителя. Затем этот носитель кэпировали путем инкубирования с 15 мл пиридина, 1 мл уксусного ангидрида и 60 мг DMAP в течение 30 минут. Полученный материал на колонке давал отрицательный результат (отсутствие окраски) на нингидриновый тест в отличие от результатов, полученных перед блокированием, при котором этот материал продуцировал темно-синюю окраску. Продукт этой реакции схематически показан на фиг.4. Альтернативно пуромицин-CPG может быть получен промышленным способом.
Синтез конъюгата мРНК-пуромицин
Как обсуждалось выше, пуромицин, связанный с олигонуклеотидом, может быть использован в любом из двух способов для генерирования конъюгата мРНК-пуромицин, который действует как трансляционная матрица. Для очень коротких открытых рамок считывания пуромицин-олигонуклеотид обычно удлиняют химическим способом с использованием РНК- или ДНК-мономеров, в результате чего получают полностью синтезированную матрицу. Если требуются более длинные открытые рамки считывания, то, обычно, РНК или ДНК-олигонуклеотид лигируют с 3'-концом мРНК с использованием ДНК-шунта и ДНК-лигазы Т4, как описано Moore & Sharp (Science 256: 992 (1992)).
In vitro-трансляция и тестирование гибридов "РНК-белок"
Матрицы, генерированные как описано выше, были транслированы in vitro с использованием как бактериальных, так и эукариотических систем in vitro-трансляции следующим образом.
In vitro-трансляция минимальных матриц
43-Р и родственные конъюгаты РНК-пуромицин добавляли в несколько различных систем in vitro-трансляции, включая: (i) систему S30, происходящую от MRE600 E.coli (Zubay, Ann. Rev. Genet. 7: 267 (1973); Collins, Gene 6: 29 (1979); Chen & Zubay, Methods Enzymol, 101: 44 (1983); Pratt, in Transcription and Translation: A Practical Approach, B.D. Harmmes, S.J. Higgins, Eds. (IRL Press, Oxford, 1984) pp. 179-209; и Ellman et al., Methods Enzymol. 202: 301 (1991)), полученную как описано Ellman et al. (Methods Enzymol. 202: 301 (1991)); (ii) рибосомную фракцию, происходящую от того же штамма и полученную как описано Kudlicki et al. (Anal. Chem. 206: 389 (1992)); и (iii) систему S30, происходящую от BL21 E.coli, и полученную как описано Lesley et al. (J. Biol. Chem. 266: 2632 (1991)). В каждом случае был использован премикс, полученный как описано Lesley et al. (J. Biol. Chem. 266: 2632 (1991)), а инкубирование осуществляли в течение 30 минут.
Исследование природы данного гибрида
Матрицу 43-Р сначала тестировали с использованием экстрактов трансляции S30 из Е.coli. На фиг.5 (Реакция "А") проиллюстрированы нужные внутримолекулярные (цис) реакции, где 43-Р связывается с рибосомой и действует в одно и то же время как матрица, и как fMet-акцептор. Сначала было протестировано включение 35S-метионина и его положение в данной матрице, и полученные результаты проиллюстрированы на фиг.6А и 6В. После экстракции in vivo-трансляционной реакционной смеси с фенолом/хлороформом и анализа продуктов с помощью электрофореза В ДСН-ПААГ появлялась 35S-меченая полоса с такой же подвижностью, как и подвижность матрицы 43-Р. Количество этого синтезированного материала зависит от концентрации Mg2+ (фиг.6А). Оптимальная концентрация Мg2+ составляет в пределах от 9 до 18 мМ, что соответствует оптимальной трансляции в данной системе (Zubay, Ann. Rev. Genet. 7: 267 (1973); Collins, Gene 6: 29 (1979); Chen & Zubay, Methods Enzymol, 101: 44 (1983); Pratt, in Transcription and Transiation: A Practical Approach, B.D. Hammes, S.J. Higgins, Eds. (IRL Press, Oxford, 1984) pp. 179-209; и Ellman et al., Methods Enzymol. 202: 301 (1991); Kudlicki et al. (Anal. Chem. 206: 389 (1992)); и Lesley et al. (J. Biol. Chem. 266: 2632 (1991)). Кроме того, включенная метка была устойчивой к обработке NH4OH (фиг.6В), что указывает на то, что данная метка была локализована на 3'-половине молекулы (стабильной по отношению к основанию ДНК-части) и была присоединена посредством устойчивой к основанию связи, как и ожидалось для амидной связи между пуромицином и fMet.
Зависимость от рибосомы и матрицы
Для того чтобы продемонстрировать, что наблюдаемая выше реакция происходит на рибосоме, было протестировано действие специфических ингибиторов пептидилтрансферазной функции рибосомы (фиг.6С) и эффект изменения последовательности, кодирующей метионин (фиг.6В). На фиг.6С ясно показано, что данная реакция сильно ингибируется пептидилтрансферазными ингибиторами, виргиниамицином, гоугеротином и хлорамфениколом (Моnrо & Vazques, J. Mol. Biol. 28: 161-165 (1967); и Vazque & Monro, Biochemica et Biophysical Acta 1423: 155-173 (1967)). На фиг.6D продемонстрировано, что замена одного основания в матрице, А на С, отменяет включение 35S-метионина в 9 мМ Mg2+ и значительно снижает его количество в 18 мМ (что свидетельствует о том, что высокие уровни Mg2+ приводят к неправильному считыванию транскрипта). Эти эксперименты продемонстрировали, что данная реакция происходит на рибосоме зависимым от матрицы способом.
Длина линкера
Была также протестирована зависимость реакции от длины линкера (фиг.6Е). Для этого конструировали исходную матрицу так, чтобы линкер был расположен на расстоянии от декодирующего сайта (занятого AUG данной матрицы) до акцепторного сайта (занятого пуромициновой молекулой), где это расстояние равно приблизительно расстоянию между антикодоновой петлей и акцепторным "стеблем" в тРНК и составляет примерно 60-70 A. Первый протестированный линкер имел длину 30 нуклеотидов из расчета минимум 3,4 A на основание (≥102 A). В диапазоне между 30 и 21 нуклеотидами (n=27-18; длина ≥102-71 A), были замечены небольшие изменения в эффективности реакции. В соответствии с этим длина линкера может варьироваться. Хотя предпочтительная длина линкера составляет от 21 до 30 нуклеотидов, в настоящем изобретении могут быть также использованы линкеры, имеющие длину менее чем 80 нуклеотидов, а предпочтительно менее чем 45 нуклеотидов.
Внутримолекулярные или межмолекулярные реакции
И наконец, авторами настоящего изобретения было проанализировано, происходит ли данная реакция по внутримолекулярному типу (фиг.5, "реакция А"), как это было бы желательно, или по межмолекулярному типу (фиг.5, "реакция В"). Этот тест проводили путем добавления олигонуклеотидов с 3'-пуромицином, но без последовательности связывания с рибосомой (то есть без матриц 25-Р, 13-Р и 30-Р), к трансляционным реакционным смесям, содержащим матрицу 43-Р (фиг.6F, 6G и 6Н). Если эта реакция происходит по межмолекулярному механизму, то должны быть помечены также более короткие олигонуклеотиды. Как продемонстрировано на фиг.6F-Н, в трех более коротких олигонуклеотидах наблюдалось небольшое включение 35S-метионина, что указывает на то, что данная реакция происходит, главным образом, по внутримолекулярному механизму. Ниже показаны последовательности 25-Р (SEQ ID NO:10), 13-Р (SEQ ID NO:9) и 30-Р (SEQ ID NO:8).
Лизат ретикулоцитов
На фиг.6Н продемонстрировано, что для in vitro-трансляции в матрицу 43-Р может быть включен 35S-метионин с использованием, помимо вышеуказанных лизатов E.coli, лизата кроличьих ретикулоцитов (см. ниже). Эта реакция, как это желательно, происходит, главным образом, по внутримолекулярному механизму.
Синтез и тестирование гибридов, содержащих метку эпитопа с-mус
Были также сконструированы репрезентативные гибриды, которые в своей белковой части содержали эпитоп-метку для моноклонального анти-с-mус антитела 9Е10 (Evan et al., Mol. Cell. Biol. 5:3610 (1985)).
Конструирование матриц
Конструировали три исходных матрицы меток для меток-эпитопов (то есть LP77, LP154 и Pool #1), которые показаны на фиг.7А-С. Первые две матрицы содержали последовательность для указанной с-mус-эпитопной метки EQKLISEEDL (SEQ ID NO:2), a третья матрица представляла собой конструкцию, используемую в синтезе пула для произвольного отбора. LP77 кодировала последовательность из 12 аминокислот, причем кодоны оптимизировали на бактериальную трансляцию. LP154 и ее производные содержали мРНК-последовательность, кодирующую 33 аминокислоты, где кодоны оптимизировали на эукариотическую трансляцию. Для выделения антитела 9Е10 использовали кодированную аминокислотную последовательность MAEEQKLISEEDLLRKRREQKLKHKLEQLRNSCA (SEQ ID NO:7), соответствующую исходному пептиду. Пул Pool #1 содержал 27 кодонов NNG/C (для генерирования произвольных пептидов), за которыми следовала последовательность, соответствующая последним семи аминокислотам mус-пептида (которые не были частью последовательности mус-эпитопа). Эти последовательности показаны ниже.
Системы in vitro-трансляции с использованием ретикулоцитов или зародышей пшеницы
Матрицы 43-Р, LP77 и LP154 тестировали в системах трансляции экстрактов кроличьих ретикулоцитов и зародышей пшеницы (Promega, Boehringer Mannhiem) (фиг.8). Трансляцию осуществляли при 30°С в течение 60 минут. Матрицы выделяли с использованием dT25-агарозы при 4°С. Матрицы элюировали из агарозы с использованием 15 мМ NaOH, 1 мМ EDTA, нейтрализовали буфером NaOAc/HOAc, сразу осаждали этанолом (2,5-3 об.), промывали (100% этанолом) и сушили на скоростном вакуумном концентраторе. На фиг.8 показано, что 35S-метионин вводили во все три матрицы, как в системах зародышей пшеницы, так и в системах ретикулоцитов. Меньшее разрушение матрицы наблюдалась в реакциях слияния, полученных в системе ретикулоцитов, а поэтому эта система является предпочтительной для генерирования гибридов "РНК-белок". Кроме того, эукариотические системы вообще являются более предпочтительными, чем бактериальные системы. Поскольку эукариотические клетки обычно содержат более низкие уровни нуклеаз, то в этих клетках, время жизни мРНК, в основном, в 10-100 раз больше, чем в бактериальных клетках. В экспериментах с использованием одной конкретной системы трансляции E.coli, образование гибридов не наблюдалось с использованием матрицы, кодирующей с-mус-эпитоп; при этом мечение матрицы в различных участках продемонстрировало, что это, вероятно, обусловлено разрушением РНК- и ДНК-участков данной матрицы.
Для оценки пептидной части этих гибридов, образцы обрабатывали РНКазой для удаления кодирующих последовательностей. После этой обработки продукт 43-Р проходил с подвижностью, почти идентичной подвижности 32P-меченого олигонуклеотида 30-Р, что соответствовало очень небольшому размеру пептида (вероятно только метионина), присоединенного к 30-Р. В случае LP77 удаление кодирующей последовательности продуцировало продукт с меньшей подвижностью, чем подвижность олигонуклеотида 30-Р, что соответствовало указанию на то, что пептид из 12 аминокислот был присоединен к пуромицину. И наконец, в случае LP154, удаление кодирующей последовательности продуцировало продукт с еще меньшей подвижностью, что соответствовало присоединению последовательности из 33 аминокислот к олигонуклеотиду 30-Р. На дорожке ретикулоцита LP154, обработанного РНКазой, не наблюдалось какого-либо олигонуклеотида, что обусловлено ошибкой загрузки. На фиг.9 было показано, что подвижность этого продукта аналогична подвижности продукта, продуцированного в экстракте зародыша пшеницы. В целом, эти результаты показали, что продукты, устойчивые к действию РНКазы были присоединены к концу олигонуклеотидов 30-Р, что размеры этих продуктов были пропорциональны длине кодирующих последовательностей, и что эти продукты были абсолютно равномерными по своему размеру. Кроме того, хотя обе системы продуцировали аналогичные гибридные продукты, система ретикулоцитов имела преимущество благодаря более высокой стабильности матрицы.
Чувствительность к РНКазе А и протеиназе К
Как показано на фиг.9, чувствительность к РНКазе А и протеиназе К тестировали с использованием гибрида LP154. Как показано на дорожках 2-4, включение 35S-метионина было продемонстрировано для матрицы LP154. При обработке этого продукта РНКазой А подвижность данного гибрида снижалась, но была еще значительно выше, чем подвижность 32Р-меченого олигонуклеотида 30-Р, что соответствовало присоединению пептида из 33 аминокислот к 3'-концу. Если этот материал был также обработан протеиназой К, то 35S-сигнал полностью исчезал, что также соответствовало указанию на то, что эта метка присутствовала в пептиде у 3'-конца фрагмента 30-Р. Аналогичные результаты были получены в эквивалентных экспериментах с использованием гибридов 43-Р и LP77.
Для подтверждения того, что мечение матрицы 35S-Меt было результатом трансляции, а более конкретно, результатом пептидилтрансферазной активности рибосомы, то была проведена оценка действия различных ингибиторов на реакцию мечения. Все специфические ингибиторы эукариотической пептидилтрансферазы, анизомицина, гоугеротина и спарсомицина (Vazquez, Inhibitors of Protein Biosynthesis (3pringer-Verlag, New York), pp.312 (1979)), а также ингибиторы транслокации, циклогексимид и эметин (Vazquez, Inhibitors of Protein Biosynthesis (Springer-Verlag, New York), pp.312 (1979)) на ~95% снижали образование гибрида РНК-пептид при использовании длинной mус-матрицы и экстракта трансляции лизата ретикулоцитов.
Эксперименты по иммунопреципитации
В эксперименте, разработанном для иллюстрации эффективности иммунопреципитации гибрида мРНК-пептид, была сделана попытка проведения иммунопреципитации свободного с-mус-пептида, генерированного при in vitro-трансляции. На фиг.10 показаны результаты этих экспериментов, проанализированные путем электрофореза пептида в ПААГ с ДСН. На дорожках 1 и 2 показан меченый материал реакций трасляции, содержащих либо РНК124 (РНК-часть LP154), либо мРНК β-глобина. На дорожках 3-8 показана иммунопреципитация образцов этих реакций с использованием моноклонального антитела против с-mус в некоторых условиях с применением других буферов (описанных ниже). На дорожках 3-5 показано, что пептид, происходящий от РНК124, был эффективно иммунопреципитирован, при этом наилучшим случаем является дорожка 4, где было выделено ~83% по всему количеству преципитируемой ТСА. На дорожках 6-8 показано небольшое количество белка β-глобина, что указывает на >100-кратную очистку. Полученные результаты показали, что пептид, кодируемый РНК124 (и LP154), может иметь количественный выход в соответствии с данной схемой иммунопреципитации.
Иммунопреципитация гибрида
Далее авторами настоящего изобретения была протестирована способность к иммунопреципитации химерного продукта "РНК-пептид" с использованием реакции трансляции LP154 и моноклонального антитела 9Е10 против с-mус (Фиг.11). Продукты трансляции, полученные в реакции ретикулоцитов, были выделены путем иммунопреципитации (как описано в данной заявке) и обработаны 1 мкг РНКазы А при комнатной температуре в течение 30 минут для удаления кодирующей последовательности. Это позволяло генерировать 5'ОН, который был помечен 32P с использованием полинуклеотидкиназы Т4 и проанализирован путем проведения электрофореза в денатурирующем ПААГ. На фиг.11 продемонстрировано, что был выделен продукт с подвижностью, аналогичной подвижности гибрида с-mус-эпитопа с 30-Р, генерированного путем обработки гибрида LP154 РНКазой (см. выше), однако соответствующий продукт не был выделен при трансляции только РНК-части этой матрицы (РНК124). На фиг.12 определяли количество выделенного гибридного белка и строили график зависимости этого количества от количества немодифицированного 30-Р (на этой фигуре не показано). Количественное отношение немодифицированный линкер:гибрид "линкер-mус-пептид" показало, что 0,2-0,7% встроенного транскрипта было превращено в гибридный продукт. Более высокая фракция встроенной РНК была превращена в гибридный продукт в присутствии тестируемых концентраций мРНК, и было получено приблизительно 0,8-1,0×1012 молекул гибрида на один мл трансляционного экстракта.
Кроме того, результаты, полученные авторами, показали, что пептиды, присоединенные к молекуле РНК, были кодированы этой мРНК, т.е. данный растущий пептид не был перенесен к пуромицину какой-либо другой мРНК. При этом каких-либо свидетельств о перекрестном переносе не было обнаружено при совместном инкубировании линкера (30-Р) с длинной mус-матрицей в трансляционных экстрактах в отношении максимум 20:1, и не было замечено, чтобы в присутствии свободного линкера значительно снижалось количество длинного продуцированного mус-гибрида. Аналогично совместная трансляция коротких и длинных матриц, 43-Р и LP154, продуцировала только гибридные продукты, наблюдаемые при трансляции одной матрицы, и не продуцировала продукты с промежуточной подвижностью, как ожидалось для гибридов короткой матрицы с длинным myc-пептидом. Оба этих результата дают основание предположить, что образование гибридов происходит, главным образом, между растущим пептидом и мРНК, связанной с той же самой рибосомой.
Последующее выделение
В качестве дополнительного подтверждения природы продукта in vitro-транслированной матрицы LP154 авторы настоящего изобретения проводили оценку поведения этого продукта на хроматографических средах двух различных типов. Тиопропил(ТП)-сефароза позволяет выделить продукт, содержащий свободный цистеин (например, LР154-продукт, который имеет цистеиновый остаток, смежный с С-концом) (фиг.13). Аналогичным образом, dТ25-агароза позволяет выделить матрицы, содержащие поли-dА-последовательность (например, 30-Р) (фиг.13). На фиг.14 продемонстрировано, что при последующем выделении на ТР-сефарозе, а затем на dТ25-агарозе получали тот же самый продукт, что и при выделении лишь на dТ25-агарозе. Тот факт, что продукт in vitro-трансляции содержал поли-А-хвост и свободный тиол, явно указывает на то, что данный продукт трансляции представлял собой нужный гибрид "РНК-пептид".
Вышеуказанные результаты указывали на возможность проведения синтеза гибридов "мРНК-пептид" и выделения их целиком из in vitro-трансляционных экстрактов. Очевидно, что пептидные части синтезированных таким образом гибридов имеют нужные последовательности, как было продемонстрировано путем иммунопреципитации и выделения с использованием соответствующих хроматографических методов. В соответствии с результатами, представленными выше, эти реакции являются внутримолекулярными и происходят зависимым от матрицы способом. И наконец, даже при модификации матрицы менее чем на 1% система настоящего изобретения облегчает отбор на основе комплексов кандидатов, состоящих примерно из 1013 молекул.
Отбор с выделением с-mус-эпитопов
Для отбора дополнительных с-mус-эпитопов генерировали крупную библиотеку трансляционных матриц (например, 1015 членов), содержащих рандомизированную область (см. фиг.7С и ниже). Эту библиотеку использовали для генерирования ~1012-1013 гибридов (как описано в данной заявке), которые обрабатывали антителом против с-mус (например, путем иммунопреципитации или с использованием антитела, иммобилизованного на колонке или другом твердом носителе) для обогащения с-mус-кодирующих матриц в повторных циклах in vitro-отбора.
Модели для образования гибридов
Не претендуя на какую-либо конкретную теорию, авторы настоящего изобретения высказали предположение относительно модели механизма образования гибрида, при котором трансляция инициируется обычным способом, а удлинение происходит по концу открытой рамки считывания. Когда рибосома достигает ДНК-части данной матрицы, трансляция прекращается. На этой стадии комплекс может подвергаться двум процессам: диссоциации растущего пептида или переносу растущего пептида к пуромицину у 3'-конца матрицы. Эффективность реакции переноса, вероятно, зависит от ряда факторов, которые влияют на стабильность остановленного трансляционного комплекса и встраиванию 3'-пуромицинового остатка в А-сайт пептидилтрансферазного центра. После реакции переноса гибрид "РНК-белок", очевидно, остается в виде комплекса с рибосомой, поскольку известные факторы высвобождения не могут гидролизовать стабильную амидную связь между РНК и пептидными доменами.
Как классическая модель для удлинения (Watson, Bull. Soc. Chim. Biol. 46: 1399 (1964)), так и модель промежуточного состояния (Mozald & Noller, Nature 342: 142 (1989)) требуют, чтобы А-сайт был свободен для внедрения пуромицина в пептидилтрансферазный центр. Для внедрения пуромицина в свободный А-сайт данный линкер должен либо создавать внешнюю петлю вокруг рибосомы, или проходить непосредственно от декодирующего сайта через А-сайт до пептидилтрансферазного центра. Описанные здесь данные не позволяют провести явные различия между этими альтернативами, поскольку наиболее короткий тестируемый линкер (21 нуклеотид) является все же достаточно длинным для того, чтобы огибать рибосому с внешней стороны. В некоторых моделях структуры рибосомы (Frank et al., Nature 376: 441 (1995)) мРНК проходит через канал, который простирается на любой стороне декодирующего сайта, и в этом случае, для того чтобы пуромицин достигал пептидилтрансферазного центра через А-сайт, необходимо, чтобы данный линкер выходил из указанного канала.
Очевидно, что перенос растущей цепи пептида к пуромицину является медленным процессом по сравнению с процессом удлинения, на что указывает гомогенность и длина пептида, присоединенного к линкеру. Если во время удлинения пуромицин эффективно конкурирует с аминоацил-тРНК, то ожидается, что гибриды "линкер-пептид", присутствующие в гибридных продуктах, должны быть гетерогенными по своему размеру. Более того, очевидно, что рибосома не осуществляет считывания в линкерную область, на что указывает сходство подвижностей в геле для гибрида Met-матрица и немодифицированного линкера. dА3n должен кодировать (лизин)n, который должен до некоторой степени снижать подвижность линкера. Низкую скорость выхода мРНК можно объяснить низкой скоростью ее образования по сравнению со скоростью транслокации. Предварительные результаты дают основание предположить, что количество образованного гибридного продукта заметно увеличивается после продолжительного посттрансляционного инкубирования при низкой температуре, что, вероятно, обусловлено увеличением времени, необходимого для переноса растущей пептидной цепи к пуромицину.
Подробное описание материалов и методов
Ниже приводится подробное описание материалов и методов, относящихся к in vitro-трансляции и к тестированию гибридов "РНК-белок", включая гибриды, имеющие mус-эпитопную метку.
Последовательности
Для генерирования вышеописанных гибридов "РНК-белок" был использован ряд олигонуклеотидов. Эти олигонуклеотиды имели следующие последовательности.



Все перечисленные олигонуклеотиды даны в направлении 5’→3’. Рибонуклеотидные основания обозначены строчными буквами "r" перед буквами, обозначающими нуклеотид; Р означает пуромицин; rN обозначает равные количества rА, rG, rC и rU; rS указывает на равные количества rG и rC; а все другие обозначения оснований указывают на ДНК-олигонуклеотиды.
Химические соединения
Пуромицин, НСl, стекло с регулируемым длинноцепочечным алкиламином размером пор, гоугеротин, хлорамфеникол, виргиниамицин, DMAP, диметилтринитрилхлорид и ангидрид уксусной кислоты были получены от фирмы Sigma Chemical (St. Louis, МО). Пиридин, диметилформамид, толуол, ангидрид янтарной кислоты и пара-нитрофенол были получены от фирмы Fluka Chemical (Ronkonkoma, NY). мРНК бета-глобина получали от Novagen (Madison, WI). TMV РНК была получена от Boehringer Mannhiem (Indianapolis, IN).
Ферменты
Протеиназа К была получена от Promega (Madison, WI). РНКаза без ДНКазы, была либо получена в соответствии с протоколом, описанным Сэмбруком и др. (см. выше), либо закуплена у Boehringer Mannheim. Полимераза Т7 была получена в соответствии с протоколом, опубликованным Grodberg & Dunn (J. Bacteriol. 170: 1245 (1988)), с модификациями Zawadski & Gross (Nucl. Acids. Res. 19: 1948 (1991)). ДНК-лигаза Т4 была получена от New England Biolabs (Beverly, MA).
Количественная оценка включения радиоактивной метки
Для полос геля с радиоактивной меткой количество присутствующей радиоактивной метки (35S или 32P) в каждой полосе определяли путем проведения количественной оценки либо с использованием блот-анализатора Betagen 603 (Betagen, Waltham, MA), либо с использованием люминофорных визуализирующих пластин (Molecular Dynamics, Sunnyvale, CA). Для жидких и твердых образцов, количество присутствующей радиоактивной метки (35S или 32Р) определяли путем подсчета на сцинтилляционном счетчике (Beckman, Columbia, MD).
Визуализация геля
Гели визуализировали путем авторадиографии (с использованием пленки Kodak XAR) или с использованием люминофорных визуализирующих пластин (Molecular Dynamics).
Синтез CPG-пуромицина
Подробные схемы синтеза CPG-пуромицина описаны выше.
Ферментные реакции
В основном, нуклеиновые кислоты для проведения киназных реакций, реакций транскрипции, ПЦР и реакций трансляции с использованием экстрактов из E.coli получали аналогичным образом. Каждый препаративный протокол начинали с экстракции с использованием равного объема фенола/хлороформа, 1:1, а затем проводили центрифугирование и выделение водной фазы. Ацетат натрия (рН 5,2) и спермидин добавляли до конечной концентрации 300 мМ и 1 мМ соответственно, и образец осаждали добавлением 3 объемов 100% этанола и инкубирования при -70°С в течение 20 минут. Затем образцы центрифугировали при >12000g, супернатант удаляли и осадок промывали избытком 95% этанола при 0°С. После этого полученный осадок сушили в вакууме и ресуспендировали.
Олигонуклеотиды
Все синтетические ДНК и РНК синтезировали на синтезаторе Millipore Expedite стандартными методами химического синтеза для каждой из них в соответствии с рекомендацией производителей (Milligen, Bedford, MA). Олигонуклеотиды, содержащие 3’-пуромицин, синтезировали на колонках с CPG-пуромицином, упакованных 30-50 мг твердого носителя (~20 мкмоль пуромици-на/грамм). Олигонуклеотиды, содержащие 3'-биотин, синтезировали на колонках с использованием 1 мкмоль биометки CPG от Glen Research (Sterling, VA). Олигонуклеотиды, содержащие 5'-биотин, синтезировали путем присоединения биометки фосфорамидита (Glen Research) в качестве 5'-основания. Олигонуклеотиды, лигируемые с 3'-концами РНК-молекул, либо химически фосфорилировали у 5'-конца (с использованием химического фосфорилирующего реагента от Glen Research) перед деблокированием, либо ферментативно фосфорилировали с использованием АТР и полинуклеотидкиназы Т4 (New England Biolabs) после деблокирования. Образцы, содержащие только ДНК (и 3'-пуромицин или 3'-биотин), подвергали деблокированию путем добавления 25% NH4OH с последующим инкубированием в течение 12 часов при 55°С. Образцы, содержащие РНК-мономеры (например, 43-Р), подвергали деблокированию путем добавления этанола (25% об./об.) к раствору NH4OH, а затем инкубировали в течение 12 часов при 55°С. 2'ОН деблокировали с использованием 1 М TBAF в ТГФ (Sigma) в течение 48 часов при комнатной температуре. TBAF удаляли с использованием колонки с сефадексом NAP-25 (Pharmacia, Piscataway, NJ).
Если необходимо, то для осуществления теста на присутствие 3'-гидроксильной группы пуромицин-олигонуклеотид может быть радиоактивно помечен у 5'-конца с использованием полинуклеотидкиназы Т4, а затем использован в качестве праймера для удлинения терминальной дезоксинуклеотидилтрансферазой. Присутствие первичного амина в пуромицине может быть проанализировано посредством реакции с аминопроизводными реагентами, такими как NHS-LC-биотин (Pierce). Олигонуклеотиды, такие как 30-Р, обнаруживают детектируемое изменение подвижности при электрофорезе в денатурирующем ПААГ, проводимом после реакции, что указывает на количественную реакцию с данным реагентом. Олигонуклеотиды, не содержащие пуромицина, не реагируют с NHS-LC-биотином и не обнаруживают изменения подвижности.
Затем деблокированные ДНК- и РНК-образцы очищали с использованием электрофореза в денатурирующем ПААГ, а затем подвергают либо смачиванию, либо электроэлюированию из геля с использованием элюирующей ловушки Elutrap (Schleicher & Schuell, Keene, NH) и обессоливанию с использованием либо колонки с сефадексом NAP-25, либо преципитации этанолом, как описано выше.
Конструирование mуc-ДНК
Были сконструированы две ДНК-матрицы, содержащие метку с-mус-эпитоп. Первая матрица была создана из комбинации олигонуклеотидов 64.27 (5'-GTT CAG GTC TTC YYG AGA GAT CAG TTT CTG TTC CAT TTC GTC CTC CCT ATA GTG AGT CGT ATT A-3') (SEQ ID NO:18) и 18.109 (5'-TAA TAC GAC TCA СТА TAG-3') (SEQ ID NO:19). В результате транскрипции с использованием этой матрицы продуцировалась РНК 47.1, которая кодировала пептид MEQKLISEEDLN (SEQ ID NO:20). После лигирования РНК 47.1 с 30-Р получали LP77, показанный на фиг.7А.
Вторую матрицу сначала изготавливали в виде одного олигонуклеотида длиной в 99 оснований, обозначенного RWR 99.6 и имеющего последовательность 5'-AGC GCA AGA GTT AGC CAG CTG TTC CAG TTT GTG TTT CAG CTG TTC ACG ACG TTT ACG CAG CAG GTC TTC TTC AGA GAT CAG TTT CTG TTC TTC AGC CAT-3' (SEQ ID NО:21). Двухцепочечные транскрипционные матрицы, содержащие эту последовательность, конструировали посредством ПЦР с использованием олигонуклеотидов RWR 21.103 (5'- AGC GCA AGA GTT AGC CAG CTG-3') (SEQ ID NО:22) и RWR 63.26 (5'- TAA TAC GAC TCA СТА TAG GGA CAA TTA СТА TTT АСА АТТ АСА ATG GCT GAA GAA CAG AAA CTG -3') (SEQ ID NO:23) в соответствии с опубликованными протоколами (Ausubel et al., см. выше, глава 15). В результате транскрипции с использованием этой матрицы получали РНК, которую обозначали РНК 124 и которая кодирует пептид:
MAEEQKLISEEDLLRKRREQLKHKLEQKRNSCA (SEQ ID NO:24). Этот пептид содержал последовательность, используемую для вырабатывания моноклонального антитела 9Е10 при конъюгировании с белком-носителем (Oncogene Science Technical Bulletin). РНК 124 имела длину в 124 нуклеотида, а после лигирования РНК124 с 30-Р получали LP154, показанный на фиг.7В. Последовательность РНК 124 представляет собой (SEQ ID NO:32):
5'-rGrGrG rArCrA rArUrU rArCrU rArUrU rUrArC rArArU rUrArC rArArUrG rGrCrU rGrArA rGrArA rCrArG rArArA rCrUrG rArUrC rUrCrU rGrArA rGrArC rCrUrG rGrarC rCrUrG rCrUrG rArArA rCrGrU rCrGrU rGrArA rCrArG rCrUrG rArArA rCrArC rArArA rCrUrG rGrAra rCrArG rCrUrG rCrGrU rArArC rUrCrU rUrGrC rGrCrU-3'
Конструирование рандомизированного пула
Рандомизированный пул конструировали в виде одного нуклеотида длиной в 130 оснований, обозначенного RWR 130.1. Эта последовательность представляет собой, в направлении от 3'-конца: 3'-CCCTGTTAATGATAAATGTTAATGTTAC (NNS)27 GTC GAC GCA TTG AGA TAC CGA-5' (SEQ ID NO:25). N означает произвольное положение, и эта последовательность была генерирована в соответствии со стандартной схемой синтеза. S означает равную смесь оснований dG и dC. ПЦР проводили с использованием олигонуклеотида 42.108 (5'-ТАА TAC GAC ТСА СТА TAG GGA САА ТТА СТА ТТТ АСА АТТ АСА) (SEQ ID NO:26) и 21.103 (5'-AGC GCA AGA GTT ACG CAG CTG) (SEQ ID NO:27). В результате транскрипции этой матрицы получали РНК, обозначенную Pool 130.1. После лигирования Pool 130.1 с 30-Р получали Рооl #1 (также обозначаемый LP160), показанный на фиг.7С.
Семь циклов ПЦР осуществляли в соответствии с опубликованными протоколами (Ausubel et al., см. выше), за исключением того, что (i) исходная концентрация RWR 130.1 составляла 30 наномоль, (ii) каждый праймер использовали в концентрации 1,5 мкМ, (iii) концентрация dNTP составляла 400 мкМ для каждого основания, и (iv) полимеразу Taq (Boehringer Mannhiem) использовали в концентрации 5 единиц на 100 мкл. Двухцепочечный продукт очищали путем электрофореза в неденатурирующем ПААГ и выделяли путем электроэлюирования. Количество ДНК определяли как по УФ-поглощению при 260 нм, так и по сравнению этидийбромидной флуоресценции с известными стандартами.
Ферментативный синтез РНК
Реакции транскрипции двухцепочечных ПЦР-ДНК и синетических олигонуклеотидов проводили как описано ранее (Milligan and Uhlenbeck, Meth. Enzymol. 180: 51 (1989)). Полноразмерную РНК очищали с помощью электрофореза в денатурирующем ПААГ, подвергали электроэлюированию и обессоливали как описано выше. Концентрацию РНК пула оценивали по коэффициенту экстинкции 1300 ОП/мкмоль; РНК 124, 1250 ОП/мкмоль; РНК 47.1, 480 ОП/мкмоль. В результате транскрипции двухцепочечной ДНК пула получали ~90 наномоль РНК пула.
Ферментативный синтез конъюгатов РНК-пуромицин Лигирование последовательностей матричных mус-РНК и РНК пула с пуромицином, содержащим олигонуклеотид, осуществляли с использованием ДНК-шунта, обозначенного 19.35 (5'-ТТТ ТТТ ТТТ TAG CGC AAG A) (SEQ ID NO:28) с использованием процедуры, аналогичной процедуре, описанной Moore & Sharp (Science 250: 992 (1992)). Реакционная смесь состояла из мРНК, "шунта" и пуромицин-олигонуклеотида (30-Р, dA27dCdCP) в молярном отношении 0,8:0,9:1,0, и 1-2,5 единиц ДНК-лигазы на один пикомоль мРНК пула. Реакции проводили в течение одного часа при комнатной температуре. Для конструирования гибридов РНК пула концентрация мРНК составляла ~6,6 мкмоль. После лигирования, конъюгат РНК-пуромицин получали как описано выше для ферментативных реакций. Преципитат ресуспендировали, и полноразмерные гибриды очищали с помощью электрофореза на денатурирующем ПААГ, и выделяли путем электроэлюции как описано выше. Концентрацию РНК пула оценивали с использованием коэффициента экстинкции 1650 ОП/мкмоль, и mус-матрицы - 1600 ОП/мкмоль. Таким образом, было получено 2,5 наномоль конъюгата.
Получение dТ25-cтрептавидин-агарозы
dT25, содержащий 3'-биотин (синтезированный на колонках с фосфорамидитной биологической меткой (Glen Reasearch) и обессоленный на колонке NAP-25 (Pharmacia)) инкубировали при концентрации 1-10 мкМ или даже 1-20 мкМ с суспензией стрептавидин-агарозы (50 об.% агарозы, Pierce, Rockford, IL) в течение 1 часа при комнатной температуре в ТЕ (10 мМ Трис-хлорид, рН 8,2, 1 мМ EDTA) и промывали. Затем связывающую способность агарозы оценивали оптически по исчезновению биотин-dТ25 из раствора и/или путем титрования смолы с известными количествами комплементарного олигонуклеотида.
Реакции трансляции с использованием экстрактов и рибосомы, происходящих E.coli
В основном, реакции трансляции проводили с использованием закупленных наборов (например, набор E.coli S30 Exstract for Linear Templates, Promega, Madison, WI). Однако для генерирования экстрактов S30, полученных в соответствии с опубликованными протоколами (например, Ellman et al., Meth. Enzymol. 202: 301 (1991)), а также рибосомной фракции, полученной как описано Kudlicki et al. (Anal. Chem. 206: 389 (1992)), может быть также использован штамм MRE600 E.coli (полученный из АТСС, Rockville, MD). Стандартную реакцию осуществляли в 50 мкл-объеме с использованием 20-40 мкКи 35S в качестве маркера. Реакционая смесь состояла из смеси 30% (об./об.) экстракта, 9-18 мМ MgCl2, 40% (об./об.) премикса, не содержащего метионина (Promega), и 5 мкМ матрицы (например, 43-Р). Для экспериментов по совместному инкубированию олигонуклеотид 13-Р и 25-Р добавляли в концентрации 5 мкМ. Для экспериментов с использованием рибосом вместо лизата добавляли 3 мкл раствора рибосомы на реакцию. Все реакционные смеси инкубировали при 37°С в течение 30 минут. Матрицы очищали как описано выше в ферментных реакциях.
Реакции трансляции с использованием зародышей пшеницы
Реакции трансляции, показанные на фиг.8, осуществляли с использованием коммерчески доступных наборов, не содержащих метионина (Promega), в соответствии с рекомендациями производителей. Концентрации матриц составляли 4 мкМ для 43-Р и 0,8 мкМ для LP77 и LP154. Реакции осуществляли при 25°С с использованием 30 мкКи 35S-метионина в полном объеме 25 мкл.
Реакции трансляции с использованием ретикулоцитов
Реакции трансляции осуществляли либо с использованием коммерчески доступных наборов (Novagen, Madison, WI), либо с использованием экстракта, полученного в соответствии с опубликованными протоколами (Jackson & Hunt, Meth. Enzymol. 96: 50 (1983)). Обогащенную ретикулоцитами кровь получали от Pel-Freez Biologicals (Rogers, AK). В обоих случаях реакционными условиями были условия, рекомендованные для использования с лизатом Red Nova Lysate (Novagen). Реакционные смеси состояли из 100 мМ КСl, 0,5 мМ МgОАс, 2 мМ DTT, 20 мМ HEPES, рН 7,6, 8 мМ фосфата креатина, 25 мкМ каждой аминокислоты (за исключением метионина, если используется 35S-Met), и 40% (об./об.) лизата. Инкубирование осуществляли при 30°С в течение 1 часа. Концентрации матриц зависят от проводимого эксперимента, но обычно они составляют от 50 нМ до 1 мкМ, за исключением матрицы 43-Р (фиг.6Н), концентрация которой составляла 4 мкМ.
Для генерирования рандомизированного пула реакцию трансляции в объеме 10 мл осуществляли при концентрации матрицы ~0,1 мкМ (1,25 наномоль матрицы). Кроме того, 32Р-меченую матрицу включали в данную реакцию для определения количества материала, присутствующего в каждой стадии процедуры очистки и отбора. После трансляции при 30°С в течение 1 часа, реакционную смесь охлаждали на льду в течение 30-60 минут.
Выделение гибрида с использованием dТ25-стрептавидин-агарозы или oligo dT-целлюлозы
После инкубирования, реакционную смесь для трансляции приблизительно 150-кратно разводили буфером для выделения (1,0 М NaCl, 0,1 М трис-хлорида, рН 8,2, 10 мМ EDTA и либо 1 мМ DTT, либо 0,2% тритона Х-100), содержащим более чем 10х молярный избыток dТ25-биотин-стрептавидин-агарозы, где концентрация dT25 составляла ~10 мкМ (объем суспензии равен или превышает объем лизата), или oligo-dT-целлюлозу (Pharmacia), и инкубировали при перемешивании при 4°С в течение одного часа. Затем агарозу удаляли из смеси либо путем фильтрации (Millipore ultrafree MC filters), либо путем центрифугирования и промывали 2-4 раза холодным буфером для выделения. Затем матрицу выделяли из dТ25-стрептавидин-агарозы путем проведения повторных промывок 50-100 мкл-аликвотами 15 мМ NaOH, 1 мМ EDTA при 4°С или чистой водой при комнатной температуре. Элюент сразу нейтрализовали в 3 М NaОАс, рН 5,2, 10 мМ спермидине и осаждали этанолом или использовали непосредственно для последующей стадии очистки. Для реакции пула общая высвобождающаяся радиоактивность составляла приблизительно 50-70% от выделенной включенной матрицы.
Выделение гибрида с использованием тиопропил-сефарозы
Гибриды, содержащие цистеин, могут быть очищены с использованием тиопропилсефарозы 6В, как показано на фиг.13 (Pharmacia). В экспериментах, описанных в данной заявке, выделение осуществляли либо непосредственно из реакции трансляции, либо после первоначального выделения гибрида (например, с использованием стрептавидин-агарозы). Для образцов, очищенных прямым способом, отношение лизата к сефарозе составляло 1:10 (об./об.). Для пула 0,5 мл суспензии сефарозы использовали для выделения всего гибридного материала из 5 мл реакционной смеси. Образцы разводили в суспензии 50:50 (об./об.) тиопропилсефарозы в 1 х ТЕ 8,2 (10 мМ Трис-Cl, 1 мМ EDTA, рН 8,2), содержащем РНКазу без ДНКазы (Boehringer Mannhiem) и инкубировали с перемешиванием вращением в течение 1-2 ч при 4°С для завершения реакции. Избыток жидкости удаляли, и сефарозу повторно промывали буфером для выделения, содержащим 20 мМ DTT, и выделяли центрифугированием или фильтрацией. Гибриды элюировали из сефарозы с использованием раствора 25-30 мМ дитиотреитола (DTT) в 10 мМ трис-хлорида, рН 8,2, 1 мМ EDTA. Затем гибрид концентрировали путем комбинирования выпаривания в высоком вакууме, преципитации этанолом, как описано выше, и, если необходимо, анализировали с помощью электрофореза в ДСН-трицин-ПААГ. Для реакции в пуле общая высвобождающаяся радиоактивность показала, что приблизительно 1% матрицы превращался в гибрид.
В некоторых случаях dT25 добавляли к данному элюату и перемешивали вращением в течение 1 часа при 4°С. Агарозу промывали три раза холодным буфером для выделения, выделяли фильтрацией, и связанный материал элюировали как описано выше. Затем добавляли носитель тРНК, и гибридный продукт осаждали этанолом. Образец ресуспендировали в ТЕ, рН 8,2, содержащем РНКазу А без ДНКазы для удаления РНК-части матрицы.
Реакции иммунопреципитации
Иммунопреципитацию пептидов из реакций трансляции (фиг.10) осуществляли путем смешивания 4 мкл трансляционной реакционной смеси, содержащей ретикулоциты, 2 мкл нормальной мышиной сыворотки и 20 мкл белка G + агарозы A (Calbiochem, La Jolla, CA), с 200 мкл либо PBS (58 мМ Na2HPO4, 17 мМ NaH2PO4, 68 мМ NaCl), либо буфера для разведения (10 мМ Трис-хлорида, рН 8,2, 140 мМ NaCl, 1% об./об. тритона Х-100), либо PBSTDS (PBS + 1% тритона X-100, 0,5% дезоксихолата, 0,1% ДСН). Затем образцы перемешивали вращением в течение одного часа при 4°С, а затем центрифугировали при 2500 об/мин в течение 15 минут. Элюент удаляли и добавляли 10 мкл моноклонального антитела 9Е10 против с-mус (Calbiochem, La Jolla, CA) и 15 мкл белка G + агарозы А, а затем смесь перемешивали вращением в течение 2 часов при 4°С. Затем образцы промывали двумя 1 мл-объемами либо PBS, либо буфера для разведения, либо PBSSTDS. К полученной смеси добавляли 40 мкл буфера для загрузки геля (Calbiochem Product Bulletin), и 20 мкл загружали на денатурирующий ПААГ, как описано Shagger & von Jagow (Anal. Biochem. 166: 368 (1987)).
Иммунопреципитацию гибридов (как показано на фиг.11) осуществляли путем смешивания 8 мкл трансляционной реакционной смеси, содержащей ретикулоциты, с 300 мкл буфера для разведения (10 мМ трис-хлорида, рН 8,2, 140 мМ NaCl, 1% об./об. тритона Х-100), 15 мкл белка G-сефарозы (Sigma) и 10 мкл (1 мкг) антитела 9Е10 против c-myc (Calbiochem), с последующим перемешиванием вращением в течение нескольких часов при 4°С. После выделения образцы промывали, обрабатывали РНКазой А без ДНКазы, метили с использованием полинуклеотидкиназы и 32Р-гамма-АТР и разделяли с помощью электрофореза в денатурирующем ПААГ с мочевиной (фиг.11).
Обратная транскрипция гибридного пула
Реакции обратной транскрипции осуществляли в соответствии с рекомендациями производителей для Superscript II, за исключением того, что матрицу, воду и праймер инкубировали при 70°С в течение только двух минут (Gibco BRL, Grand Island, NY). Для мониторинга удлинения в некоторые реакции включали 50 мкКи альфа-32Р-dСТР; в других реакциях мониторинг обратной транскрипции осуществляли с использованием 5'-32Р-меченых праймеров, которые были получены с использованием 32P-αАТР (New England Nuclear, Boston, MA) и полинуклеотидкиназы Т4 (New England Biolabs, Beverly, MA).
Получение белка G- и антитела-сефарозы
Две аликвоты 50 мкл суспензии конъюгата "белок G-сефароза" (50 об.% твердого вещества) (Sigma) промывали буфером для разведения (10 мМ трис-хлорид, рН 8,2, 140 мМ NaCl, 0,025% NaN3, 1% об./об. Тритона Х-100) и выделяли путем центрифугирования. Первую аликвоту сохраняли для использования в предколонке перед отбором матрицы. После ресуспендирования второй аликвоты в буфере для разведения добавляли 40 мкг моноклонального антитела АВ-1 против c-myc (Oncogene Science) и реакционную смесь инкубировали в течение ночи при 4°С с перемешиванием путем вращения. Затем, комплекс "антитело-сефароза" очищали центрифугированием в течение 15 минут при 1500-2500 об/мин в микроцентрифуге и промывали 1-2 раза буфером для разведения.
Отбор
После выделения гибрида и синтеза комплементарной цепи всю реакционную смесь с обратной транскриптазой использовали непосредственно в процессе отбора. В данной заявке описаны два протокола. Для первого цикла реакционную смесь с обратной транскриптазой добавляли непосредственно к комплексу "антитело-сефароза", полученному как описано выше, и инкубировали в течение 2 часов. Для проведения последующих циклов перед использованием колонки с антителом реакционную смесь инкубировали в течение ~2 часов с промытым конъюгатом "белок G-сефароза" для уменьшения числа связующих материалов, которые взаимодействуют с белком G, а не с иммобилизованным антителом.
Элюирование данного пула из матрицы можно осуществить несколькими методами. В первом методе проводили промывку матрицы для отбора 4%-ной уксусной кислотой. Эта процедура приводит к высвобождению пептида из матрицы. Альтернативно, вместо или помимо указанного метода с применением уксусной кислоты, может быть проведена более жесткая промывка (например, с использованием мочевины или другого денатурирующего вещества).
ПЦР отобранных гибридов
Отобранные молекулы амплифицировали с помощью ПЦР в соответствии со стандартными протоколами (например, Fitzwater & Polisky, Meth. Enzymol. 267: 275 (1996); и Conrad et al., Meth. Enzymol. 267: 336 (1996)), описанными выше для конструирования пула. Для гарантии того, что этот амплифицированный пул генерируется в результате проводимого отбора, на данной стадии может оказаться желательным осуществление ПЦР-контроля. Наиболее важным фактором является чистота праймера. Пары должны быть амплифицированы в отсутствие встроенной матрицы вследствие того, что иногда может происходить загрязнение последовательностями пула или контрольными конструкциями. При обнаружении загрязнения должны быть синтезированы новые праймеры. Для гарантии того, что эти выделенные гибриды не будут иметь КДНК-примеси, перед стадией RT они должны быть подвергнуты стадии ПЦР. И наконец, должно быть проведено сравнение числа циклов, необходимых для осуществления ПЦР до и после отбора. Большое число циклов, необходимых для амплификации данной последовательности (>25-30 циклов ПЦР), может указывать на неудачную реакцию RT или на трудности, связанные с парами праймеров.
Синтез и тестирование гибридов бета-глобина
Для синтеза гибридной конструкции β-глобина кДНК β-глобина генерировали из 2,5 мкг мРНК глобина путем реакции обратной транскрипции с 200 пмолями праймера 18.155 (5' GTG GTA ТТТ GTG AGC CAG) (SEQ ID NO:29) и обратной транскриптазы Superscript (Gibco BRL) в соответствии с протоколом, рекомендованным производителями. Эта праймерная последовательность была комплементарна 18 нуклеотидам β-глобина, расположенным с 5'-конца от стоп-кодона. Для присоединения промотора Т7 20 мкл реакционной смеси для обратной транскрипции удаляли и подвергали 6 циклам ПЦР с использованием праймеров 18.155 и 40.54 (5' ТАА ТАС GAC ТСА СТА TAG GGA CAC TTG CTT TTG АСА САА С) (SEQ ID NO:30). Затем полученную мРНК "син-β-глобина" генерировали путем нерегулируемой транскрипции Т7, как описано Milligan & Uhlenbeck (Methods Enzymol. 180: 51 (1989)) и эту РНК подвергали гель-очистке, электроэлюировали и обессоливали, как описано в данной заявке. Затем генерировали "LР-β-глобин" из конструкции "син-β-глобин" путем лигирования этой конструкции с 30-Р методом, описанным Moore & Sharp (Science 256: 992 (1992)) с использованием праймера 20.262 (5' ТТТ ТТТ ТТТ Т GTG GTA TTT G) (SEQ ID NO:31) в качестве шунта. Затем продукт реакции лигирования подвергали гель-очистке, электроэлюировали и обессоливали, как описано выше. Концентрацию конечного продукта определяли по оптической плотности при 260 нм.
Эти матрицы β-глобина транслировали in vitro, как описано в таблице 1, в полном объеме 25 мкл, каждой. Затем добавляли Мg2+ из 25 мМ исходного раствора. Все реакционные смеси инкубировали при 30°С в течение одного часа и оставляли на ночь при -20°С. Затем дважды определяли число им/мин осаждаемого dT25 с использованием 6 мкл лизата и усредняли с вычетанием фона.
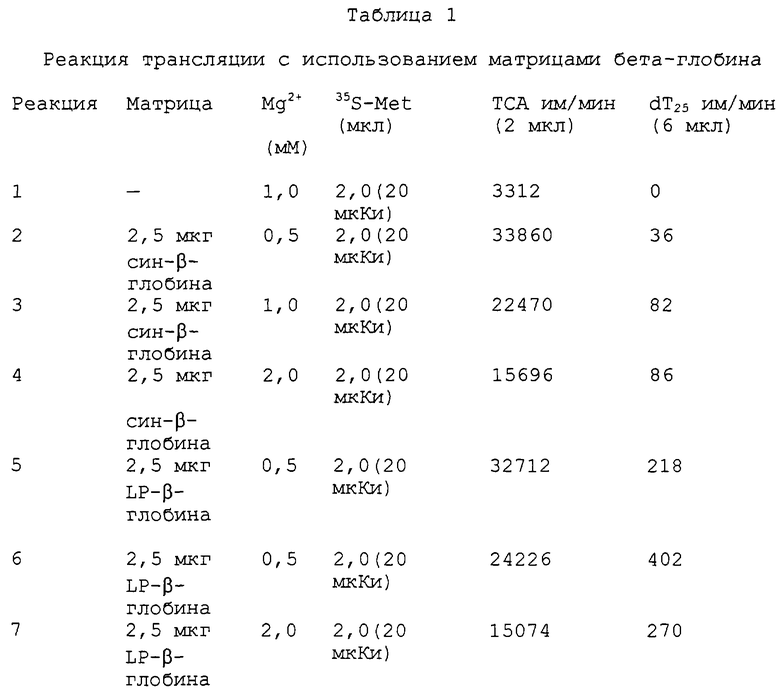
Для получения образцов для гель-анализа 6 мкл каждой трансляционной реакционной смеси смешивали с 1000 мкл буфера для выделения (1 М NaCl, 100 мМ трис-Cl, рН 8,2, 10 мМ EDTA, 0,1 мМ DTT), 1 мкл РНКазы А (без ДНКазы, Boehringer Mannhiem) и 20 мкл 20 мкМ dТ25-стрептавидин-агарозы. Образцы инкубировали при 4°С в течение одного часа при перемешивании вращением. Избыток буфера для выделения удаляли и образцы наносили на фильтр Millipore MC в целях удаления какого-либо оставшегося буфера для выделения. Затем образцы четыре раза промывали 50 мкл Н2О и два раза 50 мкл 15 мМ NaOH, 1 мМ EDTA. Образец (300 мкл) нейтрализовали 100 мкл ТЕ, рН 6,8 (10 мМ трис-Cl, 1 мМ EDTA), добавляли 1 мкл 1 мг/мл РНКазы А (как описано выше), и образцы инкубировали при 37°С. Затем добавляли 10 мкл 2 х ДСН-буфера для загрузки (125 мМ Трис-Cl, рН 6,8, 2% ДСН, 2% β-меркаптоэтанола, 20% глицерина, 0,001% бромфенолового синего), и образец лиофилизовали досуха и ресуспендировали в 20 мкл Н2O и 1% β-меркаптоэтанола. После этого образцы загружали на пептидразделяющий гель, описанный Schagger & von Jagow (Analitical Biochemistry 166: 368 (1987)) и визуализировали с помощью авторадиографии.
Результаты этих экспериментов представлены на фиг.15А и 15В. Как показано на фиг.15А, 35S-метионин был включен в белковую часть гибридов "син-β-глобин" и "LP-β-глобин". Полученный белок был гетерогенным, но одна сильная полоса обнаруживала подвижность, ожидаемую для мРНК β-глобина. Кроме того, как показано на фиг.15В, после выделения dT25 и расщепления РНКазой А на дорожках син-β-глобина не оставалось 35S-меченого материала (фиг.15В, дорожки 2-4). В противоположность этому, на дорожках LP-β-глобина наблюдалась гомогенность размеров 35S-меченого продукта.
Эти результаты свидетельствуют о том, что, как указывалось выше, гибридный продукт выделялся с помощью аффинной хроматографии олигонуклеотидов, только когда данная матрица содержала 3'-пуромицин. Это было подтверждено сцинтилляционным подсчетом (см. таблицу 1). Как и ожидалось, полученный материал содержал 30-Р-линкер, слитый с определенной частью β-глобина. Гибридный продукт был абсолютно гомогенным по размеру, на что указывал гель-анализ. Однако, поскольку данный продукт обнаруживал мобильность, почти аналогичную подвижности природного β-глобина (фиг.15А и 15 В, контрольные дорожки), то было трудно определить точную длину белковой части гибридного продукта.
Дополнительная оптимизация образования гибрида "РНК-белок"
Было обнаружено, что некоторые факторы способствуют повышению эффективности образования гибридов "РНК-белок". Образование гибрида, то есть перенос растущей пептидной цепи от ее тРНК к пуромициновой части у 3'-конца мРНК, является медленной реакцией, которая происходит после первоначальной относительно быстрой трансляции открытой рамки считывания с генерированием растущей пептидной цепи. Степень образования гибрида может быть значительно увеличена путем посттрансляционного инкубирования в условиях повышенного содержания Мg2+ (предпочтительно, в пределах 50-100 мМ) и/или путем использования более гибкого линкера между мРНК- и пуромициновой частью. Кроме того, длительное инкубирование (12-48 часов) при низких температурах (предпочтительно, -20°С) также приводит к увеличению выхода гибридов с меньшими разрушениями мРНК, чем те, которые получают в течение инкубирования при 30°С. При комбинации этих факторов вплоть до 40% включенной мРНК может быть превращено в гибридные продукты "мРНК-пептид", как показано ниже.
Синтез конъюгатов мРНК-пуромицин
В этих экспериментах по оптимизации пуромицинсодержащий линкер лигировали с 3'-концами мРНК с использованием бактериофаговой ДНК-лигазы Т4 в присутствии комплементарных ДНК-шунтов, в основном, как описано выше. Поскольку ДНК-лигаза Т4 предпочитает точное спаривание оснований возле стыка лигирования и продукты нерегулируемой транскрипции с участием РНК-полимеразы Т7, Т3 или SP6 являются часто гетерогенными у своих 3'-концов (Nucleic Acids Research 15: 8783 (1987)), то были эффективно лигированы лишь те РНК, которые содержали правильный 3'-концевой нуклеотид. При использовании стандартного ДНК-шунта приблизительно 40% продуктов нерегулируемой транскрипции были лигированы с пуромицин-oligo. Количество лигированного продукта возрастало при использовании избыточной РНК, но оно не возрастало при использовании избыточного пуромицин-oligo. Не претендуя на какую-либо конкретную теорию, можно сказать, что ограничивающим фактором для лигирования является количество РНК, которая полностью комплементарна соответствующей области ДНК-шунта.
Для лигирования тех транскриптов, которые оканчивались дополнительным нематричным нуклеотидом у 3'-конца (называемых "N+1-продуктами"), использовали смесь стандартного ДНК-шунта с новым ДНК-шунтом, содержащим дополнительное произвольное основание на стыке лигирования. Эффективность лигирования увеличивалась более чем на 70% для характерной mус-РНК-матрицы (то есть РНК 124) в присутствии указанного смешанного ДНК-шунта.
В дополнение к этому модифицированному способу с использованием ДНК-шунта эффективность образования конъюгата мРНК-пуромицин может быть дополнительно оптимизирована с учетом следующих трех факторов. Во-первых, предпочтительно сконструировать или использовать мРНК, у которой отсутствуют 3'-концы, имеющие любую значимую, стабильную вторичную структуру, которая должна препятствовать отжигу к олигонуклеотидному шунту. Кроме того, поскольку высокая концентрация соли иногда приводит к неэффективности реакции лигирования, то в данной процедуре предпочтительно проводить стадию тщательного обессоливания олигонуклеотидов с использованием колонок NAP-25. И наконец, поскольку эта реакция лигирования протекает относительно быстро и, в основном, завершается за 40 минут при комнатной температуре, то обычно не используются более длительные периоды инкубирования, которые часто приводят к нежелательнму разрушению РНК.
С использованием вышеуказанных условий конъюгаты мРНК-пуромицин были синтезированы следующим образом. Лигирование последовательности mуc-РНК (РНК124) с пуромицинсодержащим олигонуклеотидом осуществляли с использованием либо стандартного ДНК-шунта (например, 5'-TTTTTTTTTTAGCGCAAGA) (SEQ ID NO:32), либо шунта, содержащего произвольное основание (N) на стыке лигирования (например, 5'-TTTTTTTTTTAGCGCAAGA) (SEQ ID NO:33). Реакционные смеси состояли из мРНК, ДНК-шунта и пуромицин-олигонуклеотида в молярном отношении 1,0:1,5-2,0:1,0. Может быть также использовано альтернативное молярное отношение 1,0:1,2:1,4. Сначала смесь этих компонентнов нагревали при 94°С в течение 1 минуты, а затем охлаждали на льду в течение 15 минут. Реакции лигирования осуществляли в течение одного часа при комнатной температуре в 50 мМ Трис-HCl (рН 7,5), 10 мМ MgCl2, 10 мМ DTT, 1 мМ АТР, 25 мкг/мл BSA, 15 мкМ пуромицин-олигонуклеотида, 15 мкМ мРНК, 22,5-30 мкМ ДНК-шунта, ингибитора РНКзина (Promega) при концентрации 1 ед./мкл и 1,6-2,5 единиц ДНК-лигазы Т4 на один пикомоль пуромицин-олигонуклеотида. После инкубирования добавляли EDTA до конечной концентрации 30 мМ, и реакционные смеси экстрагировали смесью фенол/хлороформ. Полноразмерные конъюгаты очищали с помощью электрофореза в денатурирующем ПААГ, выделяли электроэлюированием и обессоливали.
Общие условия трансляции с использованием ретикулоцитов
Помимо повышения эффективности синтеза конъюгата "мРНК-пуромицин", реакции трансляции были также оптимизированы следующим образом. Реакции осуществляли в лизатах кроличьих ретикулоцитов, полученных от различных коммерческих источников (Novagen, Madison, WI; Amersham, Arlington Heights, IL; Boehringer Mannhiem, Indianopolis, IN; Ambion, Austin, TX; и Promega, Madison, WI)). Типичные реакционные смеси (конечный объем 25 мкл) состояли из 20 мМ HEPES, pH 7,6, 2 мМ DTT, 8 мМ фосфата креатина, 100 мМ КСl, 0,75 мМ Мg (ОАс)2, 1 мМ АТР, 0,2 мМ GTP, 25 мкМ каждой аминокислоты (0,7 мкМ метионина, если используется 35S-Met), РНКазина при концентрации 1 ед./мкл и 60% (об./об.) лизата. Конечная концентрация матрицы составляла в пределах от 50 нМ до 800 нМ. Для каждого инкубирования все компоненты, за исключением лизата, осторожно смешивали на льду, а замороженный лизат оттаивали непосредственно перед использованием. После добавления лизата реакционную смесь тщательно смешивали путем мягкого пипетирования и инкубировали при 30°С для инициации трансляции. Для различных мРНК оптимальные концентрации Мg2+ и К+ варьировались в пределах от 0,25 мМ до 2 мМ и от 75 мМ до 200 мМ соответственно, и предпочтительные концентрации были определены в предварительных экспериментах. В частности, для плохо транслируемых мРНК иногда также оптимизировали концентрации гемина, фосфата креатина, тРНК и аминокислот. Для реакций с образованием гибридов хлорид калия был, в основном, более предпочтительным, чем ацетат калия, а смесь КСl и КОАс иногда давала лучшие результаты.
После трансляции при 30°С в течение 30-90 минут реакционную смесь охлаждали на льду в течение 40 минут и добавляли Mg2+ или К2+. На этой стадии конечную концентрацию Мg2+ также оптимизировали для различных мРНК-матриц, и эта концентрация составляла в пределах от 50 мМ до 100 мМ (при этом для пулов смешанных матриц предпочтительно использовали 50 мМ). Количество добавленного К2+ обычно составляло в пределах от 125 мМ до 1,5 М. Для реакций с Mg2+ полученную смесь предпочтительно инкубировали при -20°С в течение 16-48 часов, но инкубирование должно проводиться минимум 12 часов. Если добавляли К+ или Мg2+/К+, то смесь инкубировали при комнатной температуре в течение одного часа.
Для визуализации меченых гибридных продуктов 2 мкл реакционной смеси смешивали с 4 мкл загрузочного буфера, и смесь нагревали при 75°С в течение 3 минут. Затем эту смесь загружали на ДСН-полиакриламидный гель, содержащий 6% глицин (для 32P-Met-меченых матриц) или на ДСН-полиакриламидный гель, содержащий 8% трицин (для 35S-Met-меченых матриц). В качестве альтернативы этому способу гибридные продукты могут быть также выделены с использованием dТ25-стрептавидин-агарозы или тирпропил-сефарозы (или обеих), в основном, как описано в настоящей заявке.
Для удаления РНК-части конъюгата РНК-линкер-пуромицин-пептид для последующих анализов с помощью элекрофореза в ДСН-ПААГ после проведения посттрансляционного инкубирования добавляли соответствующее количество EDTA, а реакционную смесь обессоливали с использованием колонки Microcon-10 (или Microcon-30). 2 мкл полученной смеси (всего приблизительно 25 мкл) смешивали с 18 мкл буфера для РНКазы Н (30 мМ Трис-HCl, рН 7,8, 30 мМ (NH4)2SO4, 8 мМ MgCl2, 1,5 мМ β-меркаптоэтанола и соответствующее количество комплементарного ДНК-шунта), и эту смесь инкубировали при 4°С в течение 45 минут. Затем добавляли РНКазу Н и расщепление осуществляли при 37°С в течение 20 минут.
Количество пуромицин-олигонуклеотида
Количество пуромицин-олигонуклеотида также имеет важное значение для эффективного продуцирования гибридных продуктов. Связывание 5'-DMT-, 2'-сукцинил-, N-трифторацетил-пуромицина с CPG было не таким эффективным, как связывание стандартных нуклеотидов. При этом проводили тщательный мониторинг самой реакции связывания во избежание образования CPG со слишком низкой концентрацией связанного пуромицина, и непрореагировавшие аминогруппы на CPG были полностью инактивированы во избежание последующего синтеза олигонуклеотидов, не содержащих 3'-концевой пуромицин. Важно также избегать использования CPG, содержащего очень мелкие частицы, которые могут приводить к образованию комков в клапанах в процессе проведения последующих стадий автоматизированного синтеза олигонуклеотидов.
Кроме того, перед крупномасштабным использованием синтезированный пуромицин-олигонуклеотид предпочтительно тестируют для гарантии присутствия пуромицина у 3'-конца. В экспериментах, проводимых авторами настоящего изобретения, гибрид не обнаруживался в том случае, если пуромицин был замещен дезоксиаденозином, содержащим первичную аминогруппу у 3'-конца. Для тестирования присутствия 3'-концевых гидроксильных групп (то есть на нежелательный синтез олигонуклеотидов, не содержащих 3'-концевого пуромицина), этот пуромицин-олигонуклеотид может быть сначала радиоактивно помечен (например, 5'-фосфорилированием), а затем использован в качестве праймера для удлинения под действием концевой дезоксинуклеотидилтранс-феразы. В присутствии 3'-концевой пуромициновой части не должно происходить удлинения продукта.
Время проведения трансляции и посттрансляционного инкубирования
Реакция трансляции была относительно быстрой и в основном, завершалась за 25 минут при 30°С. Однако реакция образования гибрида протекала медленнее. При использовании стандартного линкера (dA27dCdCP) при 30°С синтез гибрида достигал своего максимального уровня лишь в последующие 45 минут. Посттранскрипционное инкубирование может быть осуществлено при более низких температурах, например при комнатной температуре, 0°С или при -20°С. Меньшее разрушение мРНК-матрицы наблюдалось при -20°С, а наилучшие результаты образования гибрида были получены после инкубирования при -20°С в течение 2 дней.
Влияние концентрации Мg2+ или К+
Высокая концентрация Mg2+ или К+ при посттрансляционном инкубировании значительно стимулировала образование гибрида. Так, например, для mуc-РНК-матрицы, описанной выше, 3-4-кратная стимуляция образования гибрида наблюдалась с использованием стандартного линкера (dA27dCdCP) в присутствии 50 мМ Mg2+ в течение 16-часового инкубирования при -20°С (фиг.17, сравнение дорожек 3 и 4). Эффективное образование гибрида также наблюдалось с использованием посттрансляционного инкубирования в присутствии концентрации 50-100 мМ Мg2+, если данные реакции осуществляли при комнатной температуре в течение 30-45 минут. Аналогично, добавление 250-500 мМ К+ приводило к более чем 7-кратному усилению образования гибрида по сравнению с контролем, в который не добавляли К+. Оптимальные концентрации К+ обычно составляли от 300 мМ до 600 мМ (500 мМ для пулов). Посттрансляционное добавление NH4Cl также приводило к усилению образования гибрида. Выбор ОАс- или Сl- в качестве аниона не оказывал значительного влияния на образование гибрида.
Длина и последовательность линкера
Была также оценена зависимость реакции образования гибрида на длину линкера. В пределах 21-30 нуклеотидов (n=18-27), наблюдалось небольшое изменение эффективности реакции образования гибрида (как описано выше). Аналогичные результаты были получены для линкеров из 19-30 нуклеотидов, а наибольший уровень образования гибрида наблюдался для линкеров из 25 нуклеотидов (фиг.23). Более короткие линкеры (например, 13 или 16 нуклеотидов в длину) или более длинные линкеры (например, линкеры, имеющие более чем 40 нуклеотидов в длину) давали гораздо более низкий уровень образования гибридов. Кроме того, хотя использование конкретных линкеров с большей длиной (то есть из 45 нуклеотидов и 54 нуклеотидов) также приводило до некоторой степени к снижению эффективности образования гибрида, однако для оптимизации эффективности реакции образования гибрида, вероятно, могут быть использованы еще более длинные линкеры.
Что касается линкерной последовательности, замена дезокси-рибонуклеотидных остатков возле 3'-конца на рибонуклеотидные остатки не приводит к значительному изменению эффективности образования гибрида. Однако последовательность dCdCP (или rСrСР) у 3'-конца данного линкера имеет важное значение для образования гибрида. Замена dCdCP на dUdUP приводит к значительному снижению эффективности образования гибрида.
Гибкость линкера
Была также протестирована зависимость реакции образования гибрида от гибкости линкера. В этих экспериментах было определено, что эффективность образования гибрида была низкой в том случае, когда жесткость была увеличена путем отжига с комплементарным олигонуклеотидом возле 3'-конца. Аналогично, если использовали более гибкий линкер (например, dA21C9C9C9dAdCdCP, где С9 представляет НО (СН2СН2O)3РO2), то эффективность образования гибрида значительно увеличивалась. По сравнению со стандартным линкером (dA27dCdCP) использование более жесткого линкера (dA21C9C9C9dAdCdCP) способствует повышению эффективности образования гибрида для РНК124 более чем в 4 раза (фиг.17, сравнение дорожек 1 и 9). Кроме того, в отличие от матрицы со стандартным линкером, посттрансляционный гибрид которого продуцируется плохо в отсутствие высокой концентрации Мg2+ (фиг.17, дорожки 3 и 4), матрица с гибким линкером не требует увеличения концентрации Мg2+ для продуцирования хорошего выхода гибридного продукта при продолжительном посттрансляционном инкубировании при -20°С (фиг.17, сравнение дорожек 11 и 12). Следовательно, этот линкер был наиболее подходящим в том случае, если не требовалось проведения посттрансляционных добавлений высоких концентраций Mg2+. Кроме того, данный жесткий линкер также позволял продуцировать гибрид с оптимальными выходами в присутствии увеличенной концентрации Mg2+.
Количественная оценка эффективности гибрида
Эффективность гибрида может быть представлена либо в виде фракции транслированного пептида, превращенного в гибридный продукт, либо в виде фракции встроенной матрицы, превращенной в гибридный продукт. Для определения фракции транслированного пептида, превращенного в гибридный продукт, данный транслированный пептид метили 35S-Met. В этих экспериментах, где был использован линкер dA27dCdCP или dA27rCrCP, после 1-часового трансляционного инкубирования при 30°С примерно 3,5% транслированного пептида было гибридизовано с его мРНК. После инкубирования в течение ночи при -20°С эта величина увеличивалась до 12%. Если посттрансляционное инкубирование осуществляли в присутствии высокой концентрации Mg2+, то с матрицей гибридизовалось более чем 50% трансляционного пептида.
Для матрицы с жестким линкером после 1-часовой трансляции при 30°С с данной матрицей гибридизовалось приблизительно 25% транслированного пептида. Эта величина увеличивалась более чем на 50% после ночного инкубирования при -20°С и более чем на 75% в том случае, когда посттрансляционное инкубирование проводили в присутствии 50 мМ Мg2+.
Для определения процента превращения встроенной матрицы в гибридный продукт трансляцию осуществляли с использованием 32Р-меченой матрицы "мРНК-линкер". Если использовали гибкий линкер, а посттрансляционное инкубирование осуществляли при -20°С без добавления Мg2+, то примерно 20%, 40%, 40%, 35% и 20% встроенной матрицы было превращено в гибрид "мРНК-пептид", где концентрация встроенной РНК-матрицы составляла 800, 400, 200, 100 и 50 нМ соответственно (фиг.18). Аналогичные результаты были получены в том случае, если посттрансляционное инкубирование осуществляли в присутствии 50 мМ Мg2+. Наилучшие результаты были достигнуты с использованием лизатов, полученных от Novagen, Amersham или Ambion (фиг.19).
Если данная мРНК-матрица является длинной, то различия в подвижности между мРНК и гибридами мРНК-пептид, определенные с помощью электрофореза в ПААГ с ДСН, могут быть очень небольшими. В таких случаях эта матрица может быть 32Р-помечена у 5'-конца линкера (например, с использованием [32Р]γАТР и полинук-леотидкиназы Т4 с последующим ее лигированием с конъюгатом мРНК-пуромицин). Затем, после трансляции/инкубирования, длинная РНК-часть может быть расщеплена РНКазой Н в присутствии комплементарного ДНК-шунта, и эффективность этого гибрида определяют путем количественной оценки отношения немодифицированного линкера к гибриду линкер-пептид. По сравнению с расщеплением РНКазой А, при котором продуцируются 3'-Р и 5'-ОН, данный метод имеет преимущество, заключающееся в том, что 32P у 5'-конца этого линкера не удаляется.
Для обработки РНКазой Н, EDTA добавляли после посттрансляционного инкубирования для разрушения рибосом, и реакционную смесь обессоливали на колонке микрокон-10 (или микрокон-30). 2 мкл полученной смеси объединяли с 18 мкл буфера для РНКазы Н (30 мМ трис-HCl, рН 7,8, 30 мМ (NH4)2SO4, 8 мM MgCl2, 1,5 мМ β-меркаптоэтанола и избыток комплементарного ДНК-шунта), и смесь инкубировали при 4°С в течение 45 минут. Затем добавляли РНКазу Н, и расщепление осуществляли при 37°С в течение 20 минут.
Внутримолекулярный или межмолекулярный механизм образования гибрида в процессе посттрансляционного инкубирования
Помимо вышеописанных экспериментов, авторы настоящего изобретения проводили тест для того, чтобы определить, является ли реакция образования гибрида, которая протекает при -20°С в присутствии Mg2+, внутримолекулярной или межмолекулярной по своей природе. Свободный линкер (dA27dCdCP или dA21C9C9С9dAdCdCP, где С9 представляет О(CH2CH2O)3РO2-) совместно инкубировали с матрицей, содержащей ДНК-линкер, но без пуромицина у 3'-конца, в условиях трансляционного и посттрансляционного инкубирования, описанных выше. В этих экспериментах в продукт линкер-пептид не было включено какого-либо детектируемого количества (т.е. менее чем 2% от нормального уровня) 35S-Met, что дало основание предположить, что посттрансляционное образование гибрида происходило, главным образом, между растущей пептидной цепью и мРНК, связанной с той же рибосомой.
В дополнительных экспериментах совместное инкубирование осуществляли с матрицами и пуромицин-олигонуклеотидами, гибридные и перекрестносшитые продукты которых (матрицы, гибридизованные с неправильным белком) могли быть разделены с помощью электрофореза. Для всех оцениваемых матриц и линкерных комбинаций какого-либо образования перекрестносшитых продуктов не наблюдалось. В этих экспериментах гибридные перекрестносшитые продукты могут образовываться по двум различным трансмеханизмам: (1) реакции свободных матриц или линкеров с пептидом в комплексе "пептид-мРНК-рибосома" или (2) реакции матрицы одного комплекса с пептидом другого комплекса. Один конкретный пример анализа вероятности последнего события показан на фиг.24. Таким образом, матрицу лямбда-протеинфосфатазы (λ-ПФазы), которая синтезирует белок длиной в 221 аминокислоту, подвергали совместному инкубированию с mус-матрицей, генерирующей пептид из 33 аминокислот. Сами по себе обе эти матрицы демонстрируют образование гибрида после посттрансляционного инкубирования. При их смешивании наблюдается образование лишь отдельных гибридных продуктов. После гибридизации белка λ-протеинфосфатазы с mус-матрицей никакого образования перекрестносшитых продуктов не наблюдалось. Аналогичные эксперименты показали отсутствие перекрестносшитых продуктов с некоторыми другими комбинациями: mус-матрица + матрицы одного кодона; стандартный линкер + mус-матрица в отношении 20:1; и гибкий линкер + mус-матрица. Эти эксперименты являются убедительным аргументом против обоих возможных транс-механизмов образования гибрида.
Влияние длины линкера на образование гибрида было таким же, как и при цис-механизме. Снижение длины линкера с 19 до 13 нуклеотидов приводило к резкому снижению ожидаемого количества гибридного продукта в том случае, когда длина цепи больше не могла достигать пептидил-трансферазного центра от декодирующего сайта (фиг.23). Однако этот эффект может быть также вызван окклюзией пуромицина внутри рибосомы в том случае, если доминирующим является транс-механизм (например, если матрицы, связанные с рибосомой, образуют гибрид посредством транс-механизма). Уменьшение образования гибрида с более длинными линкерами снова является аргументом против реакции этого типа, поскольку после освобождения пуромицина от рибосомы, никакого уменьшения образования гибрида для транс-реакции наблюдаться не должно.
Результаты оптимизации
Как было продемонстрировано выше, с использованием подвижного линкера и/или при осуществлении посттрансляционного инкубирования в присутствии высокой концентрации Мg2+ эффективность образования гибрида увеличивалась приблизительно на 40% от включения мРНК. Эти результаты показали, что на один мл реакционной смеси для трансляции in vitro может быть генерировано вплоть до 1014 молекул гибрида мРНК-пептид, что дает возможность продуцировать пулы гибридов мРНК-пептид с очень большой множественностью в целях их использования в экспериментах по in vitro-отбору.
Селективное обогащение гибридов РНК-белок
Авторы настоящего изобретения продемонстрировали целесообразность использования гибридов "РНК-пептид" в экспериментах по отбору и эволюции путем увеличения количества конкретного гибрида "РНК-пептид" из комплексного пула гибридов случайных последовательностей на основе кодированного пептида. В частности, авторами настоящего изобретения был получен ряд смесей, в которых небольшое количество известной последовательности (в данном случае длинной mус-матрицы, LP154) было объединено с некоторым количеством пула случайных последовательностей (т.е. LP160). Эти смеси были транслированы, а продукты гибрида "РНК-пептид" были отобраны с помощью описанной в данной заявке аффинной хроматографии по сродству к олигонуклеотиду и дисульфиду. Гибриды mус-матрица подвергали селективной иммунопреципитации моноклональным антителом против mуc (фиг.16А). Для определения обогащения, полученного в этой селективной стадии, аликвоты смеси гибридов "кДНК/мРНК-пептид" до и после иммунопреципитации амплифицировали с помощью ПЦР в присутствии радиоактивно меченного праймера. Амплифицированную ДНК расщепляли рестрикционной эндонуклеазой, которая разрезала последовательность mус-матрицы, но не пул (фиг.16В и 16С). Определение количественного отношения разрезанной и неразрезанной ДНК показало, что mус-последовательность была 20-40-кратно обогащена по отношению к рандомизированной библиотеке путем иммунопреципитации.
Эти эксперименты осуществляли следующим образом.
Реакции трансляции Реакции трансляции осуществляли, в основном, как описано выше. В частности, реакции осуществляли при 30°С в течение одного часа в соответствии с рекомендациями производителей (Novagen) и замораживали в течение ночи при -20°С. Было получено два варианта из шести образцов, один из которых содержал 35S-метионин, а другой содержал холодный метионин, добавленный к конечной концентрации 52 мкМ. Реакционные смеси 1-6 содержали соответствующие количества матриц, описанных в таблице 2. Все числа в таблице 2 представлены в пикомолях матрицы на 25 мкл реакционной смеси.

Получение комплекса dТ25-стрептавидин-агароза
Комплекс "стрептавидин-агароза" (Pierce) три раза промывали ТЕ 8,2 (10 мМ Трис-Cl, рН 8,2, 1 мМ EDTA) и ресуспендировали с получением 1:1 (об./об.) суспензии в ТЕ 8,2. Затем 3'-биотинил-Т25, синтезированный с использованием биометки CPG (Glen Research), добавляли до нужной конечной концентрации (обычно 10 или 20 мкМ) и инкубировали при перемешивании в течение 1 часа. После этого комплекс dТ25-стрептавидин-агароза три раза промывали ТЕ 8,2 и хранили при 4°С до последующего использования.
Очистка матриц из трансляционных реакционных смесей
Для очистки матриц из трансляционных реакционных смесей брали 25 мкл каждой реакционной смеси и добавляли к 7,5 мл буфера для выделения (1 М NaCl, 100 мМ Трис-Cl, рН 8,2, 10 мМ EDTA, 0,1 мМ DTT) и 125 мкл 20 мкМ dТ25-стрептавидин-агарозы. Полученный раствор инкубировали при 4°С при перемешивании вращением в течение одного часа. Пробирки центрифугировали, и элюент удаляли. Затем добавляли 1 мл буфера для выделения, суспензию ресуспендировали, и смеси переносили в микроцентрифужные 1,5 мл-пробирки. После этого образцы четыре раза промывали 1 мл-аликвотами охлажденного льдом буфера для выделения. Горячие и холодные образцы от идентичных реакционных смесей объединяли на фильтре Millipore MC и элюировали из dТ25-агарозы путем промывания 2 объемами 100 мкл Н2O, 0,1 мМ DTT и 2 объемами 15 мМ NaOH, 1 мМ EDTA (4°C) с последующей нейтрализацией.
К этому элюенту добавляли 40 мкл 50% суспензии промытой тиопропилсефарозы (Pharmacia), и инкубирование осуществляли при 4°C с перемешиванием в течение 1 часа. Затем образцы три раза промывали 1 мл ТЕ 8,2, и элюент удаляли. Затем к твердому веществу (полный объем приблизительно 20-30 мкл) добавляли 1 мкл 1 М DTT, и образец инкубировали в течение нескольких часов, затем удаляли и четыре раза промывали 20 мкл Н2О (общий объем 90 мкл). Элюент содержал 2,5 мМ тиопиридон, на что указывало УФ-поглощение. 50 мкл этого образца осаждали этанолом путем добавления 6 мкл 3 М NaOAс, рН 5,2, 10 мМ спермина, 1 мкл гликогена (10 мг/мл, Boehringer Mannhiem) и 170 мкл 100% EtOH, а затем инкубировали 30 минут при -70°С и центрифугировали в течение 30 минут при 13000 об/мин в микроцентрифуге.
Реакции обратной транскриптазы
Реакции обратной транскрипции осуществляли как на осажденных этанолом образцах, так и на образцах тиопиридонового элюента, как описано ниже. Для осажденных этанолом образцов 30 мкл ресуспендированной матрицы, Н2O до 48 мкл и 200 пикомоль праймера 21.103 (SEQ ID NO:22) отжигали при 70°С в течение 5 минут и охлаждали на льду. К этому образцу добавляли 16 мкл буфера для первой цепи (250 мМ Трис-Cl, рН 8,3, 375 мМ КСl и 15 мМ MgCl2), поставляемого от Gibco BRL, (Grand Island, NY), 8 мкл 100 мМ DTT и 4 мкл 10 мМ NTP и уравновешивали при 42°С, после чего добавляли 4 мкл обратной транскриптазы Superscript II (Gibco BRL, Grand Island, NY). К ТР-сефарозному элюенту (35 мкл) добавляли Н2O (13 мкл), и реакции осуществляли как описано выше. После инкубирования в течение одного часа аналогично пронумерованные образцы объединяли (общий объем 160 мкл). 10 мкл образца сохраняли для ПЦР каждого образца, не прошедшего отбор, а 150 мкл образца сохраняли для иммунопреципитации.
Иммунопреципитация
Для осуществления иммунопреципитации 170 мкл реакции обратной транскрипции длбавляли к 1 мл буфера для разведения (10 мМ трис-Cl, рН 8,2, 140 мМ NaCl, 1% об./об. тритона Х-100) и 20 мкл конъюгата белков G/A (Calbiochem, La Jolla, CA) и предварительно осветляли путем инкубирования при 4°С при вращении в течение 1 часа. Элюент удаляли, и добавляли 20 мкл конъюгата G/A и 20 мкл моноклонального антитела (1 мкг, 12 пикомоль), после чего образец инкубировали с вращением в течение двух часов при 4°С. Конъюгат осаждали микроцентрифугированием при 2500 об/мин в течение 5 минут, элюент удаляли, конъюгат три раза промывали 1 мл-аликвотами охлажденного льдом буфера для разведения. Затем образец промывали 1 мл охлажденного льдом 10 мМ Трис-Cl, рН 8,2, 100 мМ NaCl. Связанные фрагменты удаляли с использованием 3 объемов замороженного 4% НОАс, и образцы лиофилизовали досуха.
ПЦР отобранных образцов и образцов, не прошедших отбор
ПЦР-реакции осуществляли путем добавления 20 мкл концентрированного NH4OH к 10 мкл неотобранного материала и всего отобранного материала, и каждую смесь инкубировали в течение 5 минут при 55°С, 70°С и 90°С для разрушения любой РНК, присутствующей в образце. Затем образцы упаривали досуха с использованием скоростного вакуумного испарителя. 200 мкл ПЦР-смеси (1 мкМ праймеры 21.103 и 42.108, 200 мкМ dNTP в ПЦР-буфере + Мg2+ (Boehringer Mannhiem) и 2 мкл полимеразы Taq (Boehringer Mannhiem). 16 циклов ПЦР проводили на образце №2, не прошедшем отбор, и 19 циклов проводили на всех остальных образцах.
Затем образцы амплифицировали в присутствии 5'-32P-меченого праймера 21.103 в соответствии с таблицей 3 и два раза очищали отдельно с использованием наборов для прямой очистки ПЦР Wizard (Promega) в целях удаления всех праймеров и более коротких фрагментов.
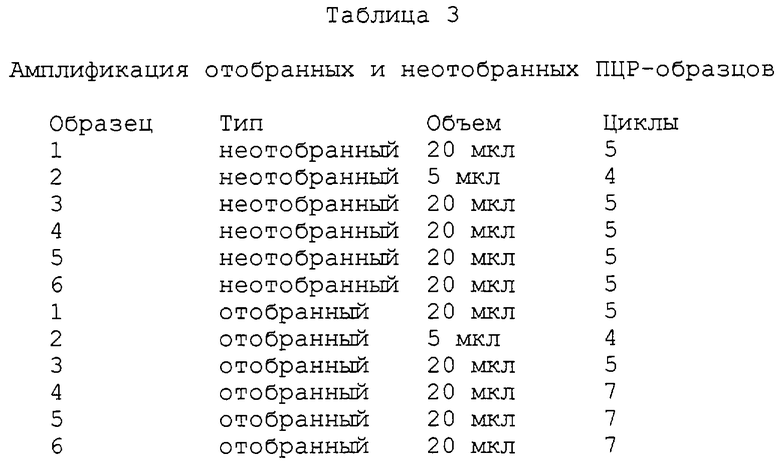
Рестрикционный гидролиз
32Р-меченую ДНК, полученную для каждой из вышеуказанных ПЦР-реакций, добавляли в равных количествах (им./мин образца) к реакционной смеси для рестрикционного расщепления в соответствии с таблицей 4. Полный объем каждой реакции составляли 25 мкл. К каждой реакционной смеси добавляли 0,5 мкл AlWnI (5 единиц (New England Biolabs)). Образцы инкубировали при 37°С в течение 1 часа, и фермент подвергали термоинактивации путем 20-минутного инкубирования при 65°С. Затем образцы смешивали с 10 мкл денатурирующего загрузочного буфера (1 мл формамид сверхвысокой степени очистки (USB), 20 мкл 0,5 М EDTA и 20 мкл 1 М NaOH), нагревали до 90°С в течение 1 минуты, охлаждали и загружали на 12% денатурирующий полиакриламидный гель, содержащий 8 М мочевины. После электрофореза гель фиксировали 10% (об./об.) НОАс, 10% (об./об.) МеОН, Н2O.
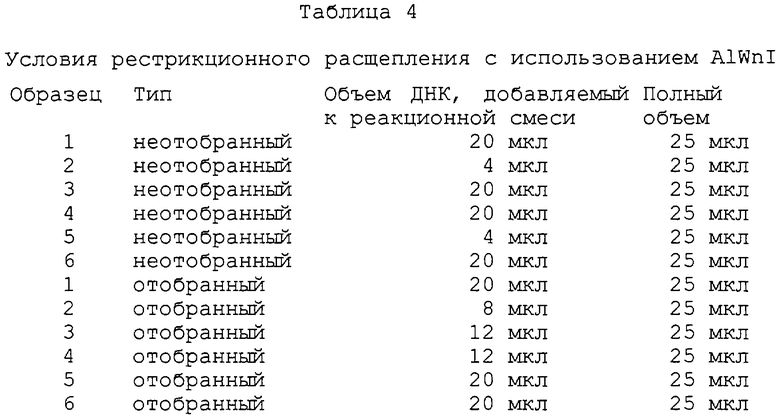
Количественная оценка расщепления
Количество mуc-ДНК или ДНК пула, присутствующей в образце, оценивали с использованием люминофорного визуализатора (Molecular Dynamics). Количество материала, присутствующего в каждой полосе, определяли как интегральный объем равных прямоугольников, построенных вокруг полос геля. Общее число им./мин зарегистрированное в каждой полосе, вычисляли как объем минус фон. При этом использовали три значения фона: (1) среднее для идентичных квадратов, находящихся за пределами площади, которую, как считалось, занимал гель; (2) число им/мин на дорожке пула, не прошедшего отбор, где должна была быть mус-полоса (полоса на геле в данном положении отсутствует); и (3) нормализованное значение, которое репродуцировало значение, наиболее близкое к 10-кратным приращениям матрицы между неотобранными дорожками. Дорожки 2, 3 и 4 на фиг.16В и 16С иллюстрируют обогащение целевой последовательности по сравнению с последовательностью-пулом. Иллюстрируемое обогащение на дорожке 3 (неотобранный/отобранный) дало наибольшее значение (в 17, 43 и 27 раз больше при использовании методов 1-3 соответственно), что обусловлено оптимизацией отношения сигнал - шум для этого образца. Полученные результаты систематизированы в таблице 5.

Во второй серии экспериментов, эти же самые пур-продукты один раз очищали с использованием набора для прямой очиски ПЦР-продуктов Wizard, и гидролизаты количественно оценивали вышеуказанным методом (2). В этих экспериментах были получены аналогичные результаты; для образцов, эквивалентных вышеуказанным образцам на дорожках 2, 3 и 4, было определено 10,7; 38 и 12-кратное обогащение.
In vztro-отбор из большой библиотеки гибридов "РНК-пептид"
В другом эксперименте, иллюстрирующем отбор нужных гибридных молекул из больших библиотек, генерировали набор из 2×1013 рандомизированных гибридов "РНК-пептид" с использованием модификации метода, описанного выше. Для этого получали ДНК-библиотеку, содержащую 27 рандомизированных кодонов, исходя из схемы синтеза 5'-(NNS)27-3' (где N представляет эквимолярные количества A, G, С и Т, a S представляет либо G, либо С). Каждый кодон NNS представляет собой смесь из 32 триплетов, которые включали кодоны для всех 20 природных аминокислот. Рандомизированная область была фланкирована двумя сайтами связывания с праймерами для обратной транскрипции и ПЦР, а также последовательностями, кодирующими промотор Т7 и сайт инициации трансляции. РНК, синтезированная путем in vitrо-транскрипции, была модифицирована посредством прямого лигирования матрицы с олигонуклеотидным линкером, содержащим пуромицин на своем 3'-конце, dA27dCdCP.
Очищенная лигированная РНК была in vitro транслирована в экстракте кроличьих ретикулоцитов с получением гибрида "РНК-белок" следующим образом: 123-мерную ДНК PP.01 (5'-AGC TTT TGG TGC TTG TGC ATC (SNN) 27 CTC CTC GCC CTT GCT САС CAT - 3', N=А, G, С, Т; S=С, G) (SEQ ID NO:34) синтезировали и очищали на 6% денатурирующем полиакриламидном геле. 1 нмоль очищенной ДНК (6×1014 молекул) амплифицировали в 3 циклах ПЦР (94°С, 1 минута; 65°С, 1 минута; 72°С, 2 минуты) с использованием 1 мкМ праймеров PIF (5'-AGC TTT TGG TGC TTG TGC ATC - 3') (SEQ ID NО:35) и РТ7 (5'-ТАА ТАС GAC ТСА СТА TAG GGA САА ТТА СТА TTT АСА АТТ АСА ATG GTG AGC AAG GGC GAG GAG-3') (SEQ ID NO:36) в полном объеме 5 мл (50 мМ KCl, 10 мМ Трис-HCl, рН 9,0, 0,1% тритон Х-100, 2,5 мМ MgCl2, 0,25 мМ dNTP, 500 единиц полимеразы Taq, Promega). После преципитации ДНК снова растворяли в 100 мкл ТЕ (10 мМ Трис-HCl, рН 7,6, 1 мМ EDTA, рН 8,0). ДНК (60 мкл) была транскрибирована в РНК в реакции (1 мл) с использованием набора для in vitro-транскрипции Megashortscript от Ambion. Реакционную смесь дважды экстрагировали смесью фенол/СНСl3 и избыток NTP удаляли путем очистки на колонке NAP-25 (Pharmacia). Пуромицинсодержащий линкер 30-Р (5'-dA27dCdCP) синтезировали как описано в данной заявке и присоединяли к 3'-концу библиотеки РНК путем прямого лигирования с матрицей. РНК (25 нмоль) инкубировали с эквимолярными количествами линкера и шунта (5'-TTT TTT TTT TNA GCT TTT GGT GCT TG - 3') (SEQ ID NO:37) в реакционной смеси (1,5 мл), содержащей буфер для ДНК-лигазы Т4 (Promega) и 1200 единиц ДНК-лигазы Т4 (Promega). После инкубирования при комнатной температуре в течение 4 часов лигированную РНК отделяли от нелигированной РНК на 6% денатурирующем полиакриламидном геле, элюировали из геля и снова растворяли (200 мкл ddH2O). Для генерирования гибридных молекул мРНК-пептид лигированная РНК (1,25 нмоль) была транслирована в полном объеме 7,5 мл с использованием набора, содержащего кроличьи ретикулоциты, Rabbit Reticulocyte IVT от Ambion, в присутствии 3,7 мкКи 35S-метионина. После инкубирования (30 минут при 30°С) реакционную смесь доводили до конечной концентрации 530 мМ КСl и 150 мМ MgCl2 и инкубировали еще в течение 1 часа при комнатной температуре. После завершения реакции трансляции образование гибрида усиливалось примерно в 10 раз благодаря указанному добавлению 530 мМ КСl и 150 мМ MgCl2.
С использованием этого усовершенствованного метода было получено приблизительно 1013 очищенных гибридных молекул на один мл. Гибриды "РНК-белок" очищали из неочищенной трансляционной реакционной смеси с помощью аффинной хроматографии для олигонуклеотидов, и РНК-часть присоединенных молекул подвергали обратной транскрипции, а затем проводили стадию отбора с использованием обратной транскриптазы без РНКазы Н как описано ниже. Транслированные гибридные продукты инкубировали с dT25-целлюлозой (Pharmacia) в буфере для инкубирования (100 мМ трис-НСl, рН 8,0, 10 мМ EDTA рН 8,0, 1 М NaCl и 0,25% тритон Х-100, 1 час при 4°С). Целлюлозу выделяли фильтрацией и промывали буфером для инкубирования с последующей элюцией гибридных продуктов ddH2O. РНК подвергали обратной транскрипции (25 мМ Трис-HCl, рН 8,3, 75 мМ KCl, 3 мМ MgCl2, 10 мМ DTT и 0,5 мМ dNTP с 2 ед. обратной транскриптазы Superscript II (Gibco BRL)) с использованием 5-кратного избытка "шунта" в качестве праймера.
Для исследования эффективности технологии отбора гибридов "РНК-белок" данную библиотеку использовали в целях отбора пептидов, связанных с моноклональным антителом против с-mус с применением иммунопреципитации в качестве метода отбора. Пять циклов повторного отбора и амплификации приводили к увеличению связывания популяции гибридных молекул с анти mуc моноклональным антителом 9Е10 (Evan et al., Mol.Cell Biol. 5:3610 (1985)). В каждом из первых трех циклов отбора было выделено путем элюирования менее чем 1% библиотеки, используемой для стадии отбора, однако, в четвертом цикле отбора было выделено и проэлюировано примерно 10% библиотеки, связанной с антителом. В пятом цикле отбора процент связывающихся молекул возрастал до 34%. Этот результат хорошо соответствовал процентному количеству с-mус-гибридной конструкции дикого типа, которая связывалась с антителом против с-mус при этих условиях (35%). В шестом цикле отбора какого-либо обогащения не наблюдалось, и гибридные молекулы, полученные после пятого и шестого циклов, использовали для характеризации и определения последовательности отобранных пептидов.
Для осуществления этих экспериментов исходную библиотеку из 2 х 1013 молекул инкубировали с 12-кратным избытком с-mус-связывающего антитела 9Е10 (Chemicon) в буфере для отбора (1х PBS, 0,1% BSA, 0,05% Твин) в течение 1 часа при 4°С. Комплексы "пептидный гибрид-антитело" осаждали добавлением конъюгата белок А - сефароза. После дополнительного инкубирования в течение 1 часа при 4°С сефарозу выделяли фильтрацией, и выходящий поток (FT) собирали. Сефарозу промывали пятью объемами буфера для отбора (W1-W5) в целях удаления неспецифически связывающих веществ, и связывающиеся пептиды элюировали четырьмя объемами 15 мМ уксусной кислоты (Е1-Е4). кДНК-часть элюированных гибридных молекул амплифицировали с помощью ПЦР, и полученную ДНК использовали для генерации обогащенной популяции гибридных продуктов, которые подвергали дополнительным циклам отбора. Для удаления из пула пептидов, обладающих сродством к конъюгату белок А - сефароза, во втором цикле отбора проводили предварительный отбор на конъюгате белок А - сефароза. При этом за ходом отбора наблюдали путем определения процентного содержания гибрида "35S-меченая РНК-пептид", который элюировали из иммунопреципитата уксусной кислотой. Полученные результаты представлены на фиг.20.
Пул отобранных пептидов был продемонстрирован для специфического связывания антитела против mус, используемого для отбора. Эксперименты по связыванию негибридизированных пептидов, проводимые цикле 6, показали аналогичное связывание с антителом, которое наблюдалось для гибридного пептида, что свидетельствовало о том, что часть нуклеиновой кислоты гибридных молекул не является необходимой для связывания (данные не приводятся).
Гибридные продукты, полученные в шестом цикле отбора, оценивали при трех различных условиях иммунопреципитации, а именно: (1) без антитела против mус, (2) с моноклональным антителом против интегрина, ASC-3, которое является тем же самым изотипом, но которое не связывается с эпитопом mуc и (3) с антителом против myc, 9E10. Эксперименты осуществляли путем инкубирования 35S-меченых гибридных продуктов "РНК-пептид", полученных в результате шестого цикла отбора (0,2 пмоль) в буфере для отбора (1 × PBS, 0,1% BSA, 0,05% твин) в течение 1 часа при 4°С, либо с использованием моноклонального антитела против интегрина β4, ASC-3 (100 пмоль; Chemicon), либо без использования этого антитела. Комплексы пептидный гибрид-антитело осаждали конъюгатом белок А - сефароза. После промывки сефарозы пятью объемами буфера для отбора связанные молекулы элюировали добавлением 15 мМ уксусной кислоты.
В контрольном экперименте без антитела не могло быть детектировано какого-либо значительного связывания, что свидетельствует о том, что отобранные пептиды не являются неспецифически связанными с конъюгатом белок А - агароза. Кроме того, какого-либо связывания с моноклональным антителом против интегрина не наблюдалось, что указывает на то, что эти отобранные пептиды были специфически связаны с антителом против myc. Эксперимент по конкурентному связыванию с синтетическим mус-пептидом осуществляли для того, чтобы определить, взаимодействуют ли отобранные пептидные гибридные молекулы с антигенсвязывающим сайтом антитела против myc, 9E10. Если 35S-меченые гибридные молекулы, полученные после проведения 6 циклов отбора, инкубировали с моноклональным антителом против mуc и с повышенными количествами немеченого mус-пептида, то наблюдалось снижение процентного соотношения связывающих молекул. Эти результаты представлены на фиг.21. На этой фигуре 0,2 пмоль 35S-меченых гибридных продуктов "РНК-пептид", полученных в результате проведения шести циклов отбора, инкубировали с 100 пмоль моноклонального антитела против myc, 9E10, в присутствии 0, 0,2, 1,2 или 10 нмоль синтетического myc-пептида (Calbiochem). Комплексы "пептидный гибрид - антитело" осаждали добавлением конъюгата "белок А - сефароза". Значения, представленные как среднее процентное содержание гибридных молекул, которые связаны с антителом и которые могут быть проэлюированы 15 мМ уксусной кислотой, определяли в реакции связывания с тремя повторами. Данные конкурентного связывания показали, что большинство выделенных гибридных молекул были специфичны для mуc-связывающего сайта.
Анализ последовательностей 116 отдельных клонов, полученных в результате проведения пяти и шести циклов отбора, позволил идентифицировать одну последовательность, которая встречалась дважды и содержала с-mус-эпитоп дикого типа, EQKLISEEDL (SEQ ID NO:2). Третья последовательность была почти идентична двум другим, но обнаруживала две точковые мутации в нуклеотидах, одна из которых представляла собой мутацию с заменой Ilе на Val в консервативной области mус-эпитопа. Все последовательности содержали "консенсусный" мотив Х (Q, EOXLISEXX (L,M) (SEQ ID NO:38), который имел большое сходство с с-mус-эпитопом. Наиболее высококонсервативной была область "сердцевины" из четырех аминокислот, LISE. На фиг.22 показаны аминокислотные последовательности из 12 отобранных пептидов, выбранных из рандомизированной 27-мерной библиотеки. В верхней части этой фигуры показана аминокислотная последовательность с-mус-эпитопа. Из этих показанных последовательностей включены только последовательности, содержащие данный консенсусный мотив. Остатки в пептидах, которые соответствуют консенсусу, выделены светлыми участками. Клон R6-63 содержал mус-эпитоп дикого типа. Остатки консенсуса (частота >50% в данном положении) показаны в нижней части этой фигуры.
Принимая во внимание тот факт, что консервативный мотив содержал одну аминокислоту, которая была кодирована определенной 5'-праймерной областью, авторы настоящей заявки определили, что известный с-mус-эпитоп из 10 аминокислот был представлен лишь примерно 60 раз в исходном пуле из 2×1013 молекул. Наблюдаемое повышенное количество эпитопа дикого типа в пяти циклах отбора явно соответствовало фактору обогащения >200 на цикл отбора, то есть фактору, который был подтвержден в отдельной серии экспериментов.
Анализы на иммунопреципитацию, осуществляемые на двенадцати отобранных последовательностях, показанных на фиг.22, подтверждали специфическое связывание полученных из данной библиотеки гибридов "РНК-пептид" с антигенсвязывающим сайтом моноклонального антитела против mус. Как и гибриды "РНК-пептид", все двенадцать последовательностей связывались с указанным антителом против mус и не обнаруживали связывание с конъюгатом "белок А - сефароза". Конкурентное связывание в антителом против mуc также сравнивали с использованием 35S-меченых гибридных продуктов (происходящих от двенадцати последовательностей) и немеченого синтетического mус-пептида. В используемых условиях меченый mус-гибрид дикого типа связывался на 9% в присутствии немеченого mус-пептида, и процент связывания варьировался в пределах от 0,4 до 12% для тестируемых двенадцати последовательностей. Эти данные показали, что указанные последовательности связываются с антителом против mуc с аффиностью, аналогичной аффинности mус-гибрида дикого типа.
Очистка пептидов, содержащих последовательность-мотив, и гибриды с иммобилизованной РНК
РНК-связывающие сайты для λ-boxBR (Cilley & Williamson, RNA 3: 57-67 (1997)), BIV-TAR (Puglisi et al., Science 270: 1200-1203 (1995)) и HIV-RRE (Battiste et al., Science 273: 1547-1551 (1997)), содержащие 3'-биотиновую группу, были синтезированы с применением стадартной химии с использованием фосфорамидитов. Эти синтезированные РНК-образцы деблокировали, обессоливали и подвергали гель-очистке, как описано в данной заявке. Затем 3'-биотинил-РНК-сайты были иммобилизованы путем смешивания концентрированного маточного раствора РНК с 50% (об./об.) суспензии стрептавидин-агарозы ImmunoPure (Pierce) в 1 × ТЕ 8,2 при конечной концентрации РНК 5 мМ в течение одного часа (25°С) при встряхивании. Осуществляли две реакции трансляции, содержащие (1) матрицу, кодирующую пептидный фрагмент 1 N, или (2) мРНК глобина (Novagen) в качестве контроля. Аликвоты (50 мкл 50% суспензии об./об.) каждой иммобилизованной РНК промывали и ресуспендировали в 500 мкл буфера для связывания (100 мМ КСl, 1 мМ MgCl2, 10 мМ Hepes•КОН рН 7,5, 0,5 мМ EDTA, 0,01% NP-40, 1 мМ DTT, 50 мкг/мл дрожжевой тРНК). Реакции связывания осуществляли добавлением 15 мкл трансляционной реакционной смеси, содержащей либо N-пептид, либо глобиновые матрицы, в пробирки, содержащие один из трех иммобилизованных сайтов связывания, с последующим инкубированием при комнатной температуре в течение одного часа. Затем гранулы осаждали центрифугированием и промывали 2×100 мкл связывающего буфера. Затем добавляли РНКазу А (без ДНКазы, 1 мкл, 1 мг/мл) (Boehringer Mannhiem) и инкубировали в течение одного часа при 37°С для высвобождения связанных молекул. Супернатант удаляли и смешивали с 30 мкл загрузочного буфера с ДСН и анализировали с помощью электрофореза в ПААГ с ДСН•трицином. Ту же самую схему использовали для выделения N-пептидных гибридов, за исключением того, что после трансляции добавляли 35 мМ МgСl2, а затем инкубировали при комнатной температуре в течение одного часа для стимуляции образования гибрида.
Результаты этих экспериментов показали, что N-пептид сохранял свою нормальную специфичность связывания как при синтезе in vitro, так и при его генерировании в виде гибрида "РНК-гибрид" со своей собственной мРНК. Этот результат имел решающее значение. Присоединение длинной последовательности нуклеиновой кислоты к С-концу пептида или белка (то есть образования гибрида) может приводить к нарушению полипептидной функции по сравнению к негибридизированной последовательностью. Благодаря своей относительно высокой способности к неспецифическому связыванию с нуклеиновыми кислотами, пептиды с обогащенным аргинином мотивом (ARM) дают возможность проводить жесткий функциональный тест гибридной системы. Тот факт, что гибрид "N-пептид-мРНК" (перед синтезом кДНК) сохраняет функцию свободного пептида, указывает на то, что специфичность сохраняется даже в том случае, когда существует вероятность образования либо аутоспецифических, либо неспецифических комплексов.
Использование систем отбора белков
Системы отбора настоящего изобретения имеют коммерческое применение в любой области, в которой белковая технология используется для решения терапевтических, диагностических или промышленных проблем. Эта технология отбора используется для улучшения или модификации существующих белков, а также для выделения новых белков с желательными функциями. Эти белки могут иметь природные последовательности, либо они могут иметь модифицированные формы, либо они могут иметь частично или полностью синтезированные последовательности. Кроме того, эти способы могут быть также использованы для выделения или идентификации ценных нуклеиновых кислот или небольших молекул-мишеней.
Выделение новых связывающих реагентов
В одном конкретном варианте технология получения гибридов "РНК-белок", описанная в настоящей заявке, может быть использована для выделения белков, обладающих свойствами специфического связывания (например, связывание с лигандом). Белки, обладающие способностью к высокоспецифическому связыванию, могут быть использованы в качестве распознающих реагентов, не являющихся антителами, что позволяет использовать технологию образования гибрида "РНК-белок" вместо традиционной технологии с применением моноклональных антител. Реагенты типа антитела, выделенные данным методом, могут быть использованы в любой области, где применяются традиционные антитела, включая диагностическое и терапевтическое применение.
Улучшение человеческих антител
Настоящее изобретение может быть также использовано для улучшения человеческих или "очеловеченных" антител для лечения заболеваний любого ряда. Для этой цели были разработаны библиотеки антител, которые были скринированы in vitro, что позволяет избежать необходимости применения таких методов, как слияние клеток или фаговое отображение. В одном из своих важных применений настоящее изобретение может быть использовано для улучшения библиотек одноцепочечных антител (Ward et al., Nature 341:544 (1989); и Goulot et al., J. Mol. Biol. 213: 617 (1990)). Для этих целей вариабельная область может быть сконструирована либо из человеческого источника (для минимизации возможных негативных иммунных реакций у реципиента), либо она может содержать полностью рандомизированный кластер (для максимизации множественности библиотеки). Для скрининга в целях улучшения молекул антител пул молекул-кандидатов тестировали на связывание с молекулой-мишенью (например, с антигеном, иммобилизованным как показано на фиг.2). Затем, поскольку уровень отбора прогрессирует от стадии к стадии, то для следующей стадии связывания используют более высокую степень жесткости. Для увеличения жесткости изменяют такие условия, как число стадий промывки, концентрация избыточного конкурента, условия забуферивания, продолжительность реакции связывания и выбор матрицы для иммобилизации.
Одноцепочечные антитела могут быть использованы либо непосредственно для терапии, либо опосредованно для конструирования стандартных антител. Такие антитела могут быть использованы для различных целей, включая выделение антиаутоиммунных антител, подавление иммунного ответа и разработку вакцин против вирусных болезней, таких как СПИД.
Выделение новых катализаторов
Настоящее изобретение может быть также использовано для отбора новых каталитических белков. In vitro-отбор и эволюция ранее использовались для выделения новых каталитических РНК и ДНК, а в настоящем изобретении они используются для выделения новых белковых ферментов. В одном конкретном примере этого способа катализатор может быть выделен непосредственно путем отбора на связывание с химическим аналогом межфазового катализатора. В другом конкретном примере прямое выделение может быть осуществлено путем отбора на образование ковалентной связи с субстратом (например, с использованием субстрата, связанного с аффинной меткой) или путем расщепления (например, путем отбора на способность разрушать специфическую связь и тем самым высвобождать каталитические члены библиотеки из твердого носителя).
Этот способ выделения новых катализаторов имеет, по крайней мере, два важных преимущества по сравнению с методами каталитических антител (см. обзор Schultz et al., J. Chem. Engng. News 68: 26 (1990)). Во-первых, в методе каталитических антител исходный пул, в основном, ограничивается характерной для иммуноглобулинов укладкой цепи; в отличие от этого исходная библиотека гибридов "РНК-белок" может быть либо полностью рандомизированной, либо она может состоять, без ограничений, из вариантов известных ферментных структур или белковых остовов. Кроме того, выделение каталитических антител обычно основано на предварительном отборе на связывание с аналогами переходного состояния с последующим трудоемким скринингом на активные антитела; и снова, в противоположность этому, прямой отбор на катализ может быть осуществлен способом с использованием библиотеки гибридов "РНК-белок", как было ранее продемонстрировано с использованием библиотек РНК. В альтернативном способе выделения белковых ферментов могут быть объединены способы с использованием аналога переходного состояния и способы прямого отбора.
Ферменты, полученные этим методом, являются в высокой степени ценными. Так, например, в настоящее время существует крайняя необходимость в разработке новых и эффективных промышленных катализаторов, которые ускоряли бы химические процессы. Главное преимущество настоящего изобретения заключается в том, что оно может быть осуществлено в произвольно выбранных условиях и не ограничивается, например, in vivo-условиями. А поэтому настоящее изобретение облегчает выделение новых ферментов или улучшенных вариантов существующих ферментов, которые могут иметь высокоспецифические трансформации (и тем самым минимизировать образование нежелательных побочных продуктов), функционируя в предварительно определенных условиях, например при повышенных температурах, давлении или концентрациях растворителя.
in vitro интерактивная ловушка
Технология с использованием гибридов "РНК-белок" может быть также использована для скрининга кДНК-библиотек и клонирования новых генов на основе взаимодействий "белок - белок". В этом методе кДНК-библиотеку генерируют из нужного источника (например, методом Ausbel et al., см. выше, глава 5). Для каждого кДНК-кандидата, пептидный акцептор (например, хвост пуромицина) лигируют (например, методом, описанным выше для генерирования LP77, LP154 и LP160). Затем генерируют гибриды "РНК-белок", как описано выше, после чего эти гибриды (или улучшенные варианты этих гибридов) тестируют на их способность взаимодействовать с конкретными молекулами, как описано выше. Если необходимо, то в этом способе можно избежать использования стоп-кодонов и 3'UTR-областей либо (i) добавлением тРНК супрессора для сквозного прочитывания стоп-области, либо (ii) удалением фактора высвобождения из реакции трансляции путем иммунопреципитации, либо (iii) комбинированием (i) и (ii), либо (iv) удалением стоп-кодонов и 3'UTR из ДНК-последовательностей.
Тот факт, что стадия взаимодействия протекает in vitro, позволяет осуществлять тщательный контроль за жесткостью реакции с использованием неспецифического конкурента и соответствующих условий, таких как температура и ионные концентрации. Модификация нормальных небольших молекул с использованием негидролизуемых аналогов (например, АТР на АТРgS) дает возможность осуществлять отбор, который позволяет выявить другие конформеры тех же самых молекул. Этот способ может быть использован как для клонирования, так и для функциональной идентификации многих белков, поскольку РНК-последовательность отобранного партнера по связыванию ковалентно связывается с ним, а поэтому может быть легко выделена. Кроме того, этот способ может быть использован для идентификации функций и взаимодействий ~50-100000 генов человека, последовательности которых в настоящее время определяются в соответствии с "Проектом по определению генома человека".
Использование гибридов "РНК-белок" в формате "микрочипов"
"ДНК-чипы" состоят из пространственно детерминированных матриц иммобилизованных олигонуклеотидов или клонированных фрагментов кДНК или геномных ДНК и применяются для быстрого секвенирования и определения профиля транскриптов. Путем отжига смеси гибридов "РНК-белок" (например, генерированных из пула клеточных ДНК или РНК) с таким ДНК-чипом можно генерировать "чип белкового отображения", в котором каждое пятно, соответствующее одной иммобилизованной последовательности, способно отжигаться с соответствующей ей РНК-последовательностью в пуле гибридов "РНК-белок". В этом способе соответствующий белок иммобилизуют пространственно определенным образом, исходя из его связи со своей собственной мРНК, и чипы, содержащие серии ДНК-последовательностей, отображают соответствующую серию белков. Альтернативно пептидные фрагменты этих белков могут быть отображены, если библиотека белков генерируется из более мелких фрагментов кДНК или геномных ДНК.
Такие упорядоченные отображения белков и пептидов имеют много применений. Так, например, они представляют собой мощный инструмент для идентификации ранее неизвестных взаимодействий "белок - белок". В одном конкретном формате этого способа белок-зонд метят детектируемой меткой (например, флуоресцентным красителем), и меченый белок инкубируют с чипом белкового отображения. В этом способе идентичность белков, способных связываться с белком-зондом, определяют по расположению пятен на данном чипе, который становится меченым благодаря связыванию с зондом. Другим применением этого способа является быстрое определение белков, которые были химически модифицированы под действием модифицирующих ферментов (например, протеинакиназ, ацилтрансфераз и метилтрансфераз). Благодаря инкубированию чипа белкового отображения с нужным ферментом и радиоактивно меченным субстратом с последующей промывкой и авторадиографией, может быть легко определена локализация, а следовательно, и идентичность этих белков, являющихся субстратами для модифицирующего фермента. Кроме того, использование этого способа с упорядоченным расположением небольших пептидов позволяет дополнительно определять локализацию таких участков модификации.
Технология белкового отображения может быть осуществлена с использованием массивов нуклеиновых кислот (включая РНК, но предпочтительно ДНК), иммобилизованных на любом подходящем твердом носителе. Примерами твердых носителей являются носители, изготовленные из таких материалов, как стекло (например, стеклянные пластинки), кремний или кремниевое стекло (например, микрочипы), или золото (например, золотые пластинки). Методы связывания нуклеиновых кислот с конкретными областями на таких твердых поверхностях, например фотолитографические методы, хорошо известны специалистам и могут быть использованы в целях изготовления твердых носителей (таких как ДНК-чипы) для использования в настоящем изобретении. Примерами методов, которые могут быть использованы для этих целей, являются, но не ограничиваются ими, методы, описанные Schena et al., Science 270: 467-470 (1995); Kozal et al., Nature Medicine 2: 753-759 (1996); Cheng et al., Nucleic. Acids Research 24: 380-385 (1996); Lipshutz et al., BioTechniques 19: 442-447 (1995); Pease et al., Proc. Natl. Acad. Sci., USA, 91: 5022-5026 (1994); Fodor et al., Nature 364: 555-556 (1993); Pirrung et al., патент США №6143854 и Fodor et al. WO 92/10092.











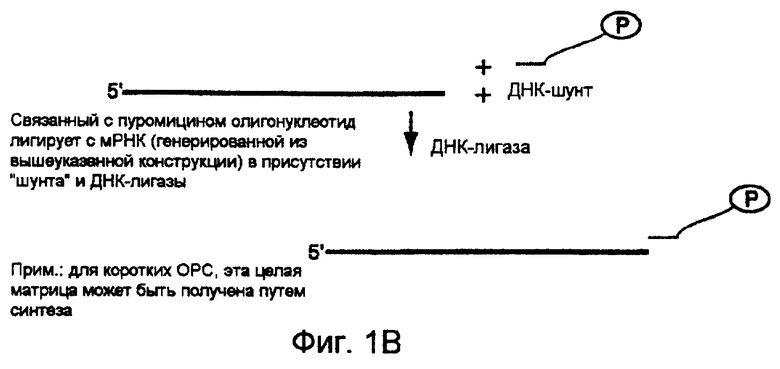
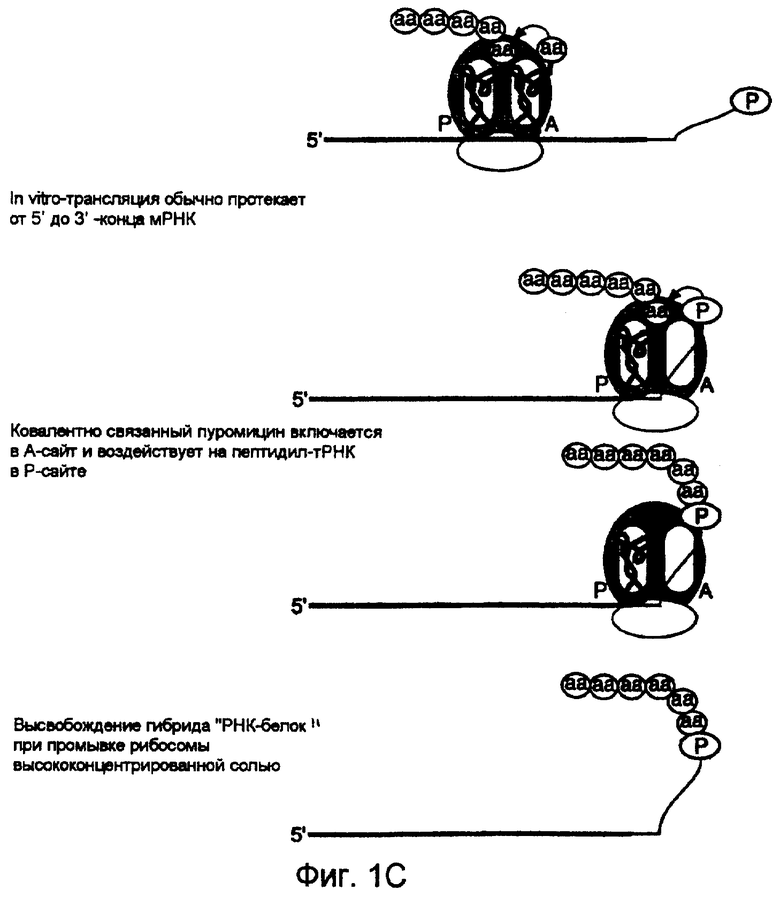
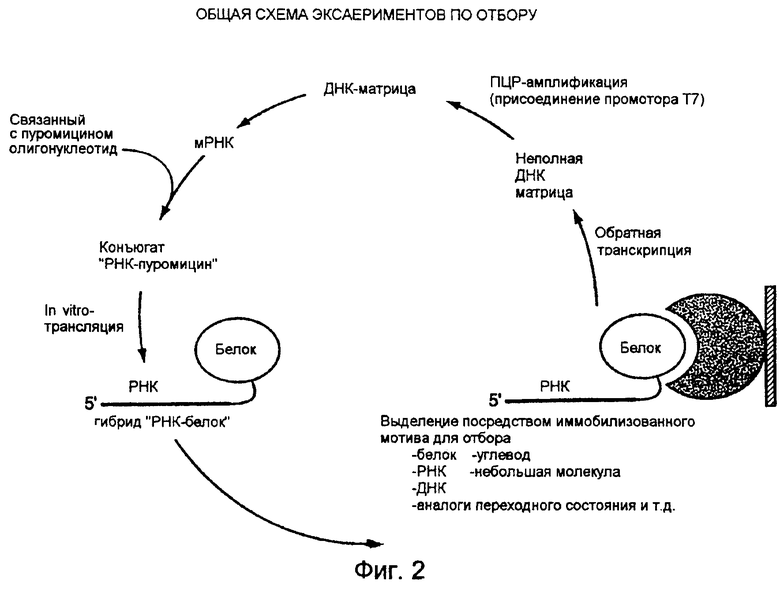
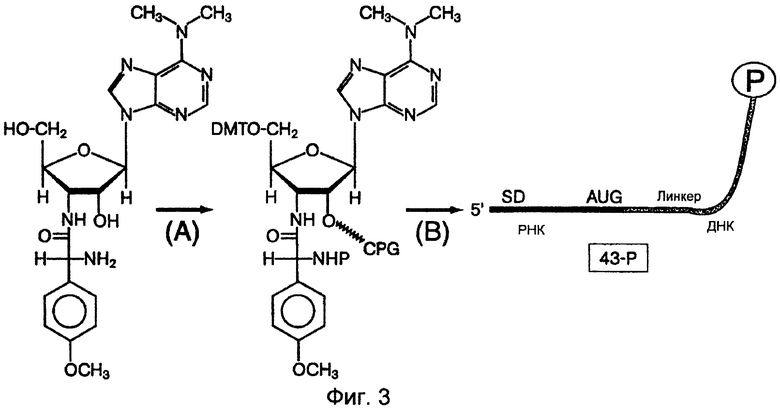
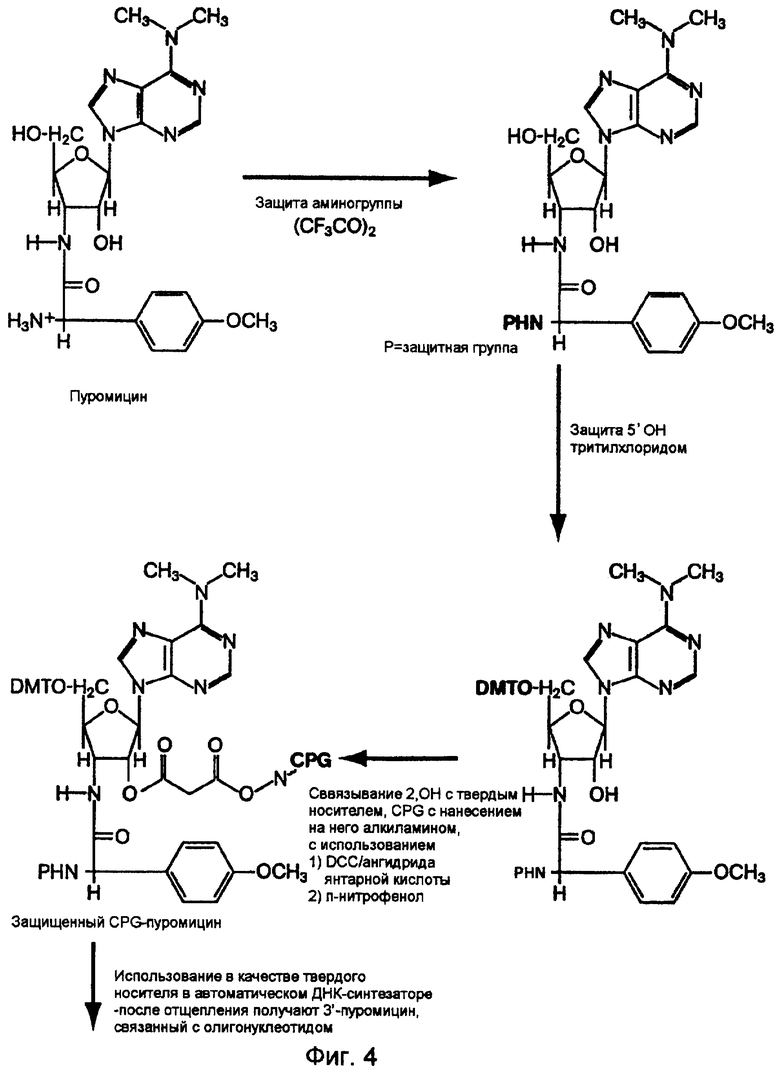
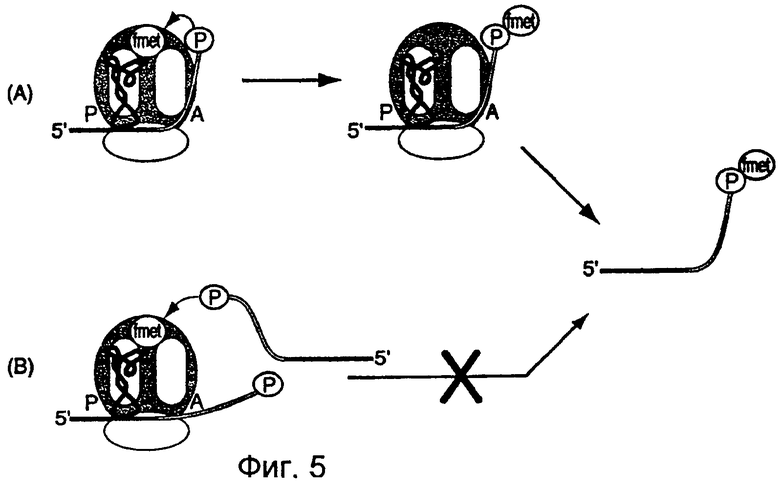


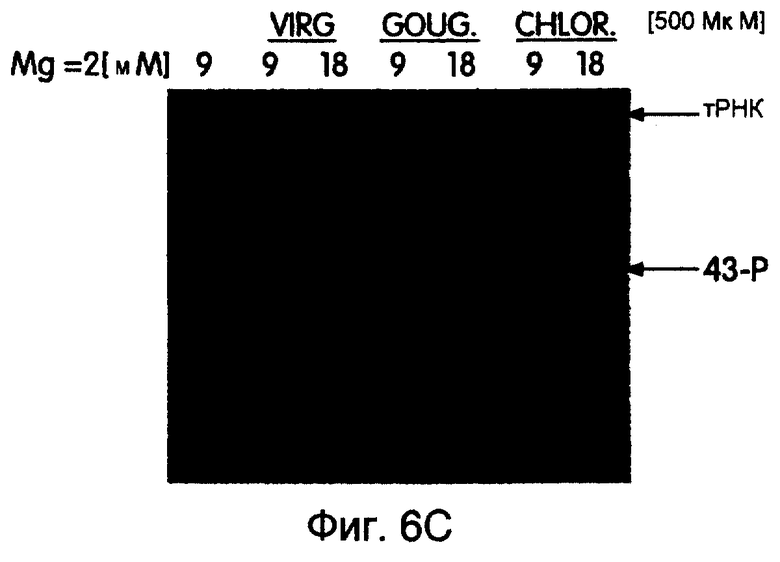
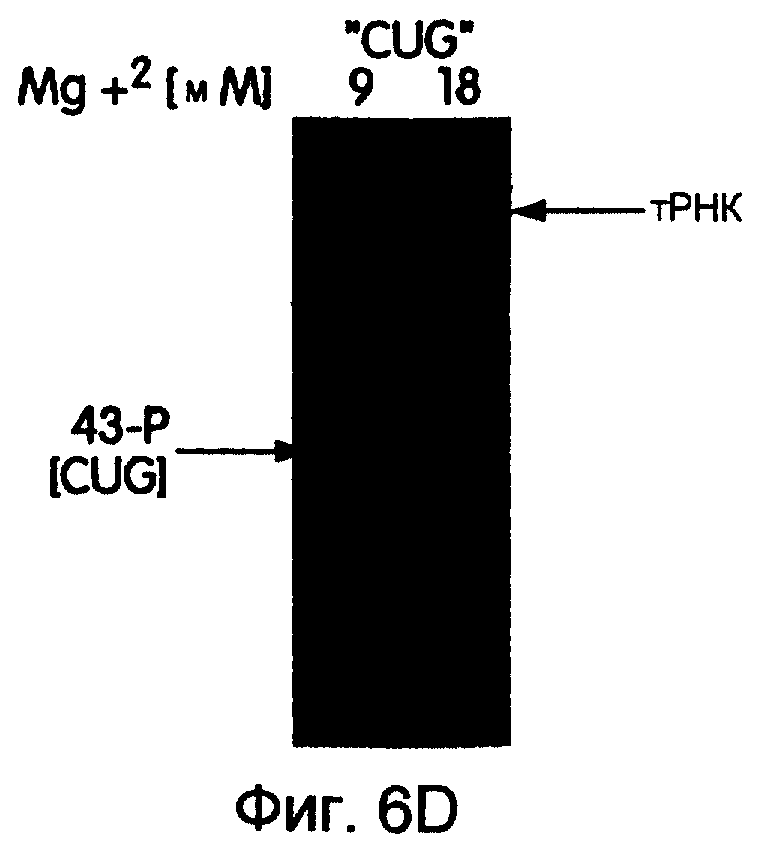
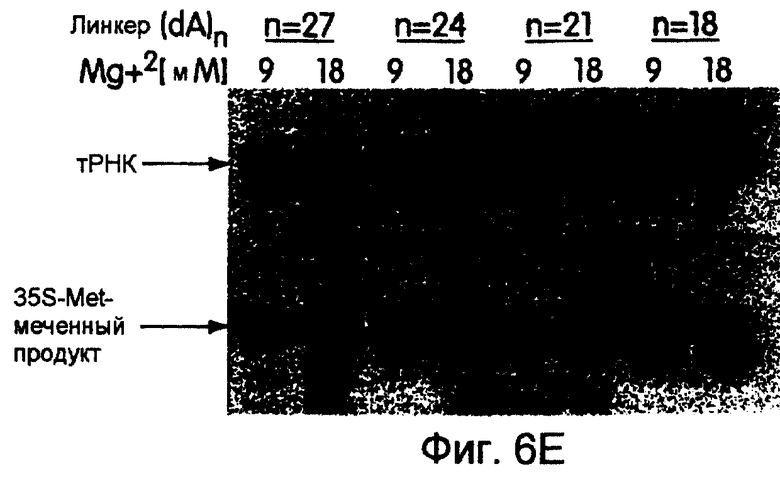
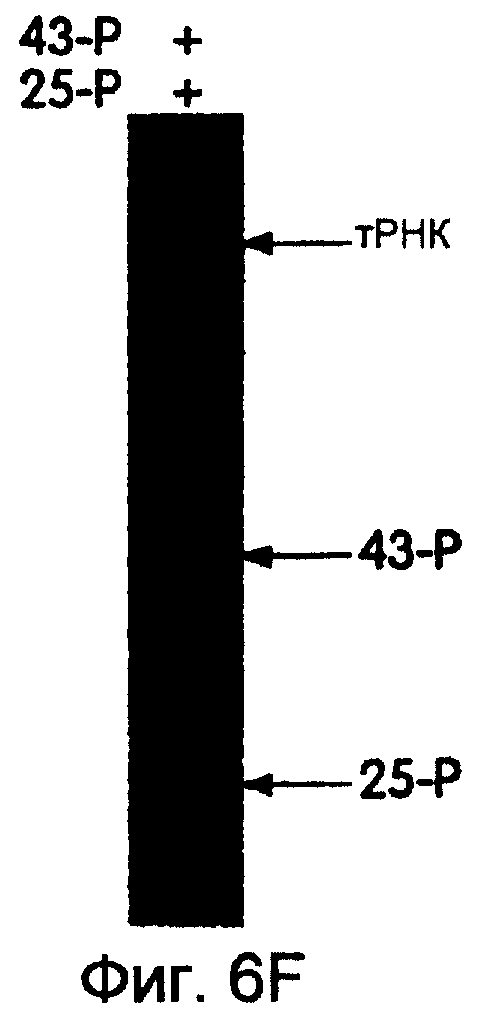
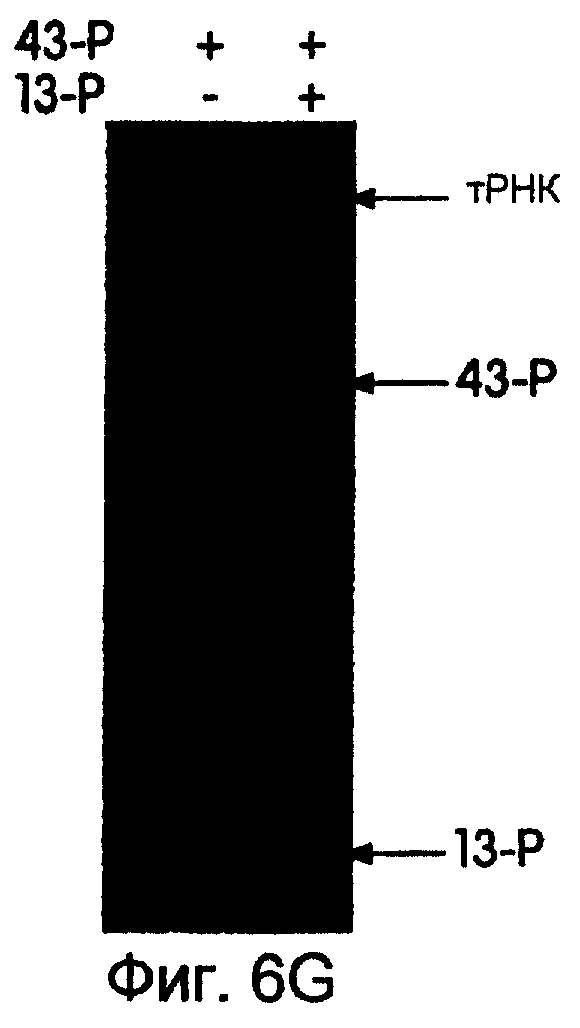
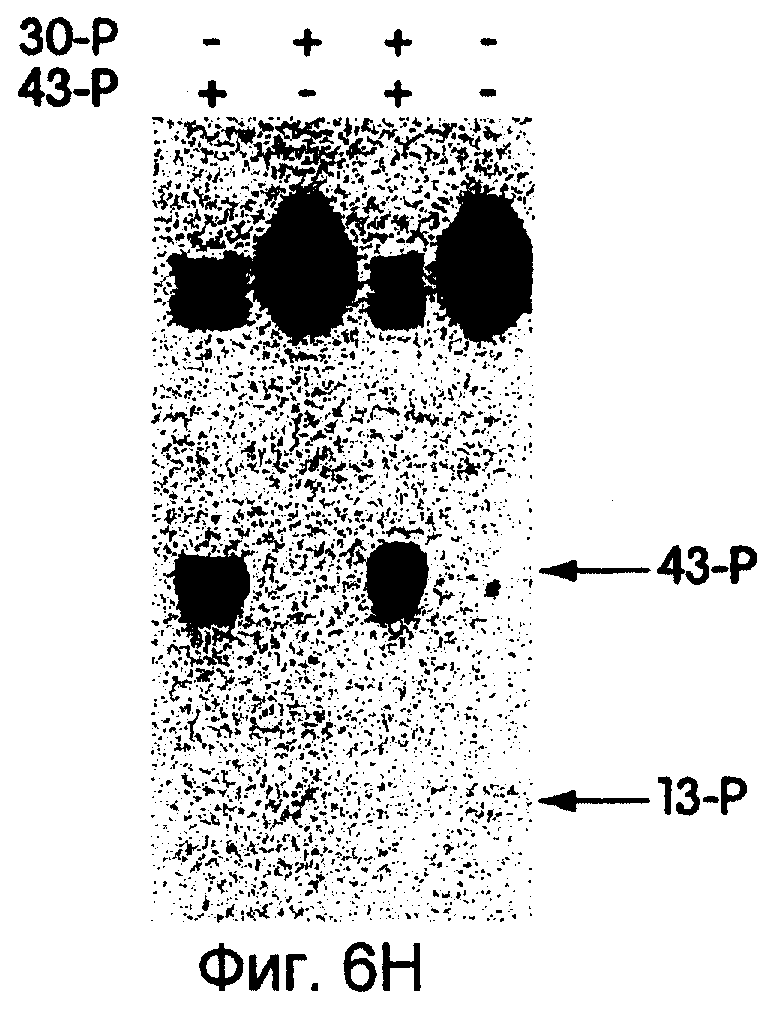
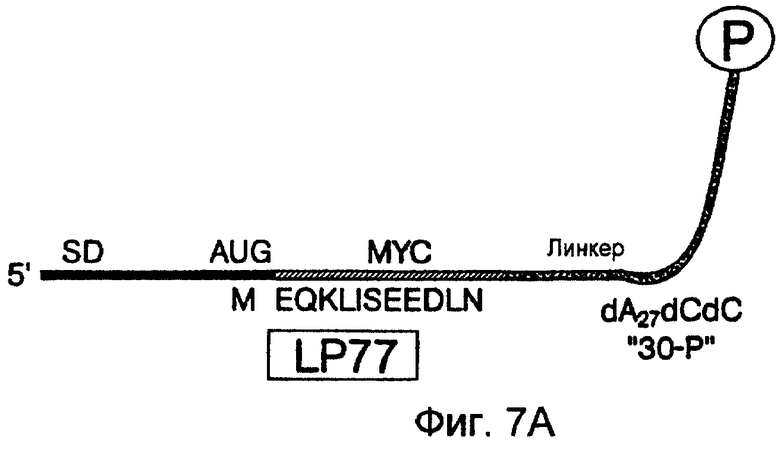
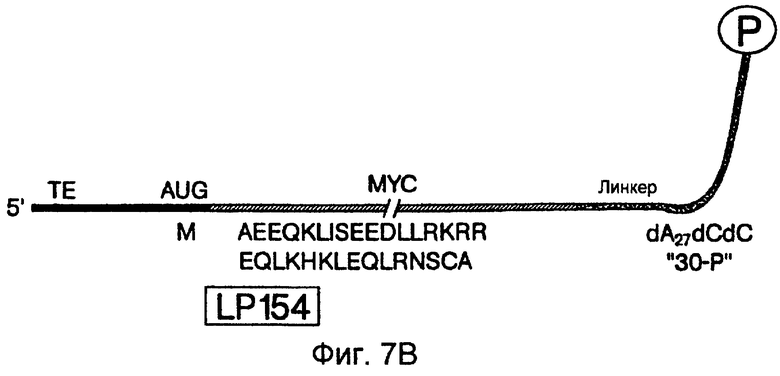

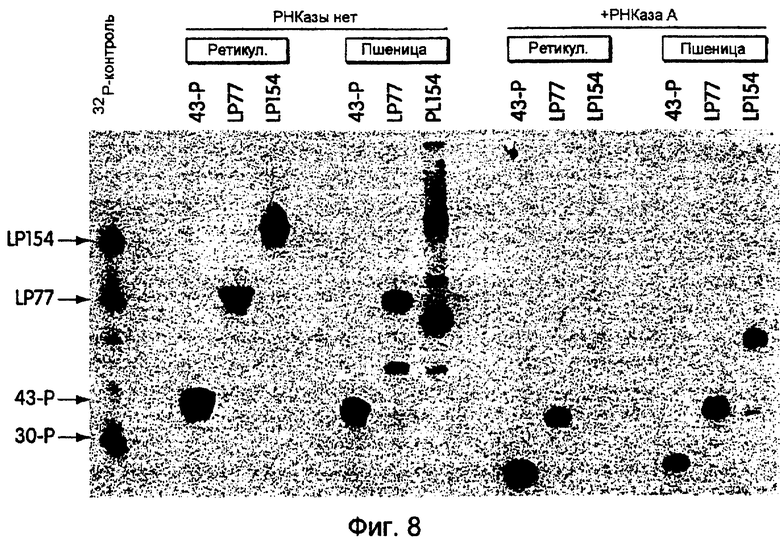
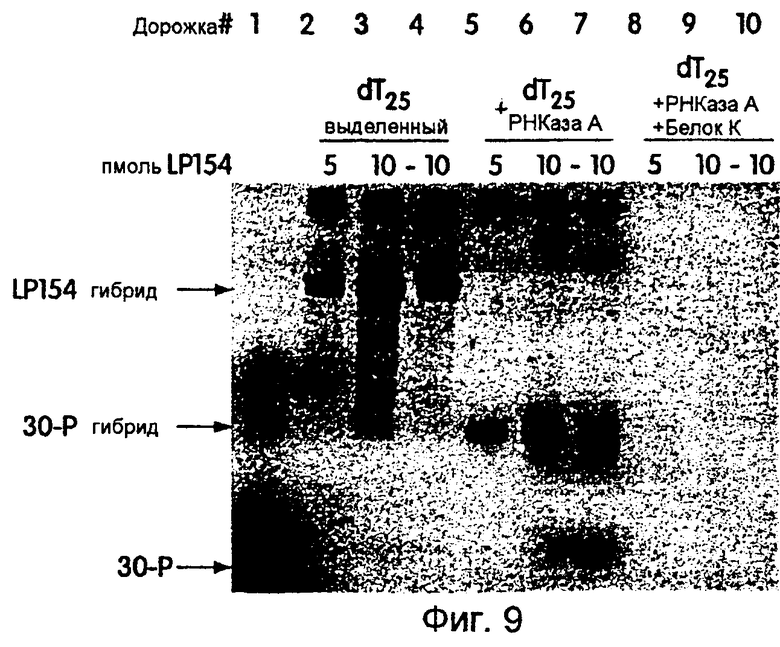
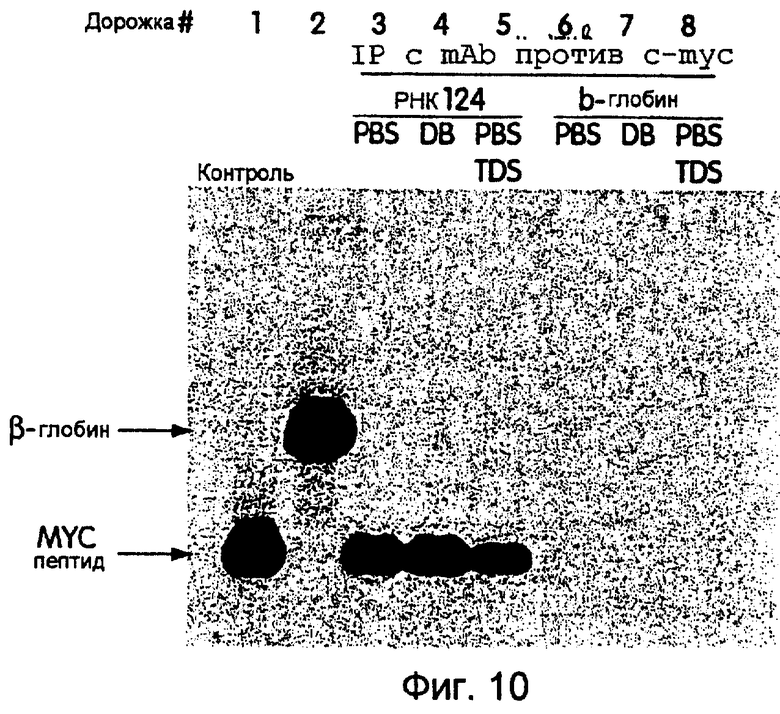
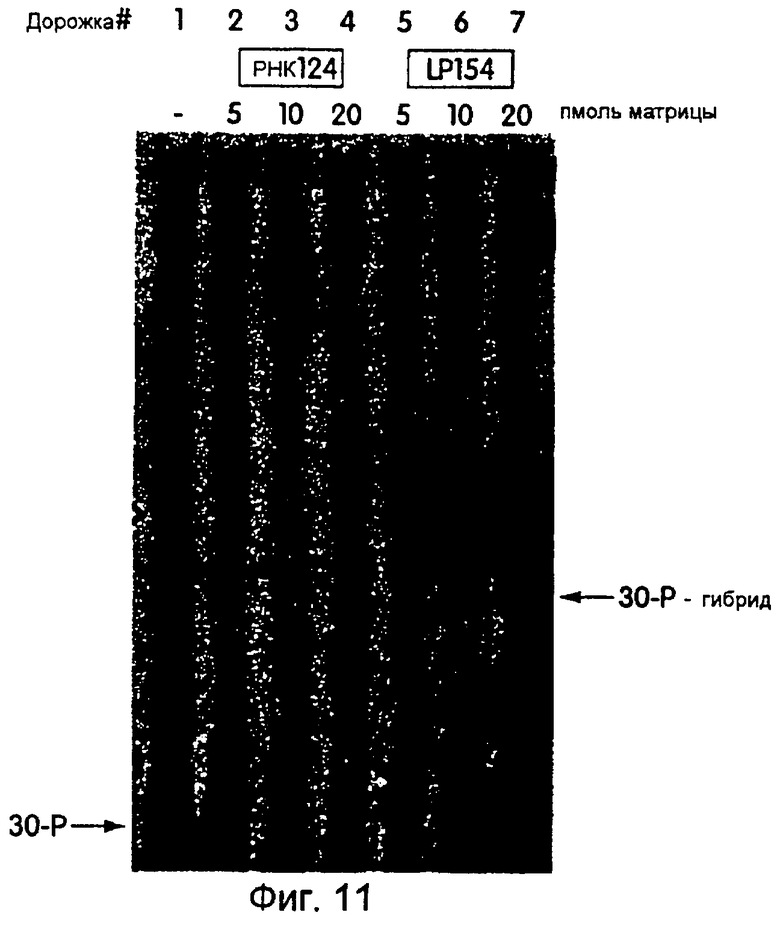
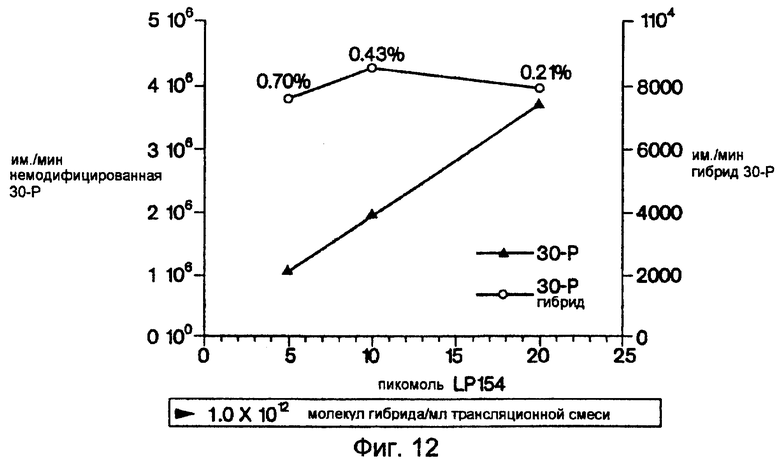

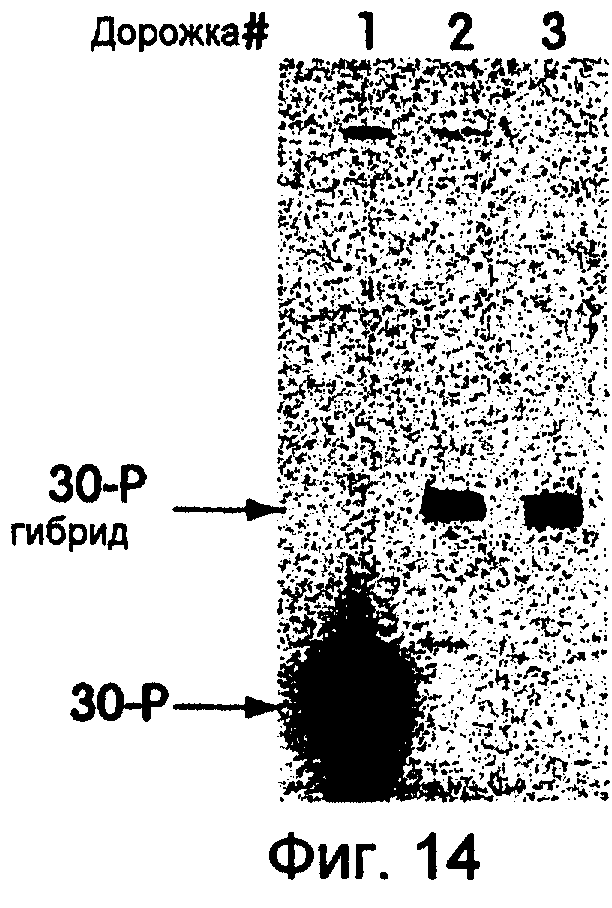
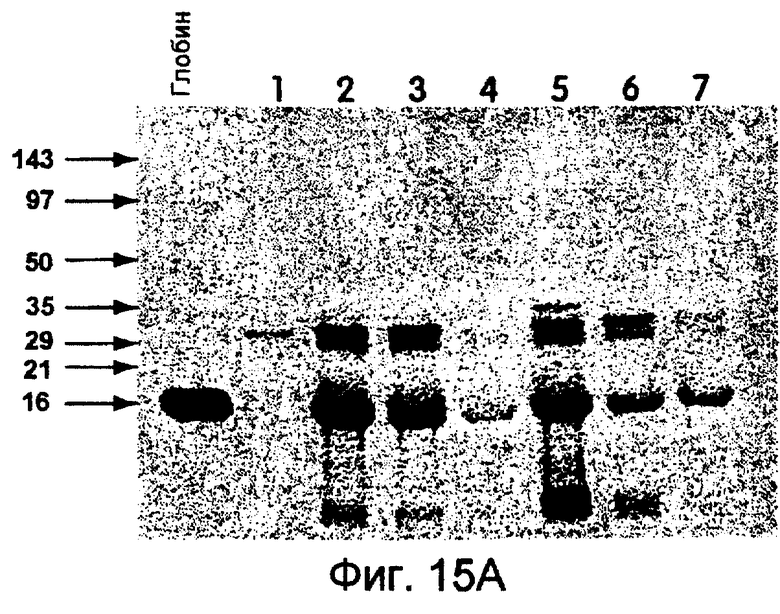
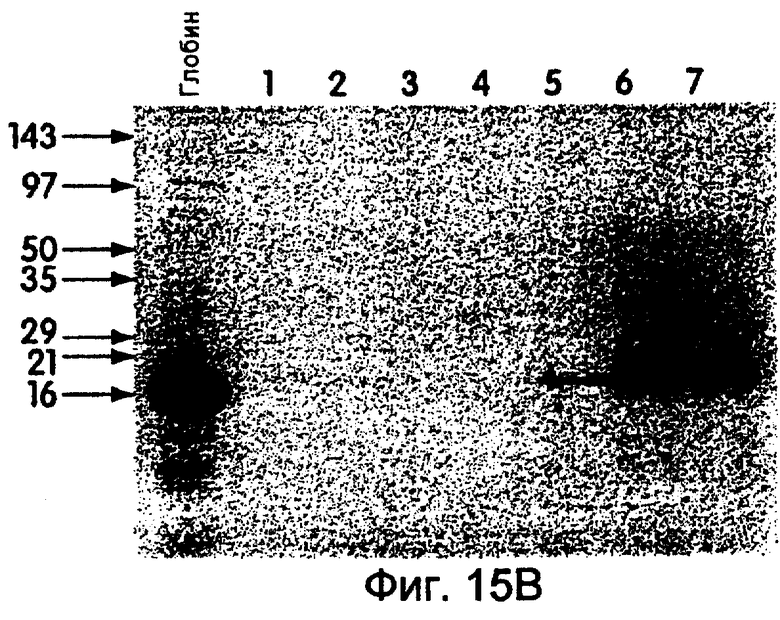
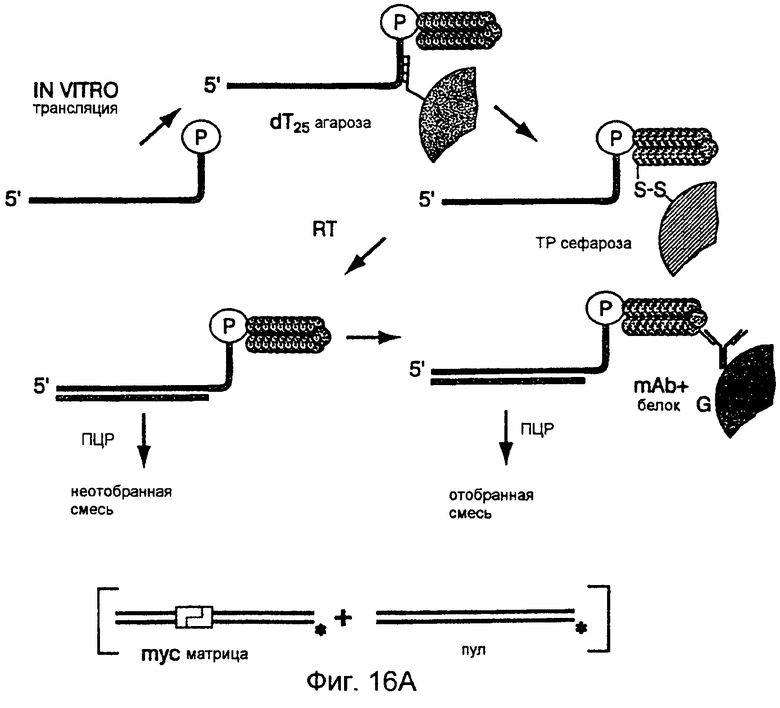
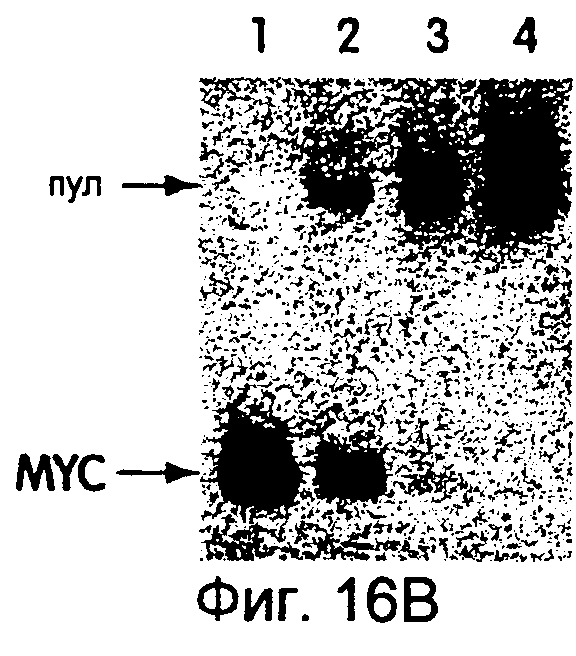

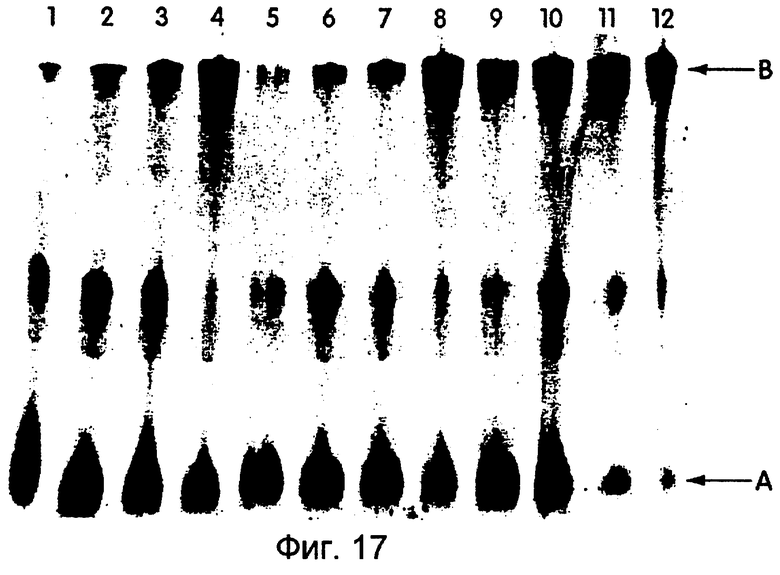
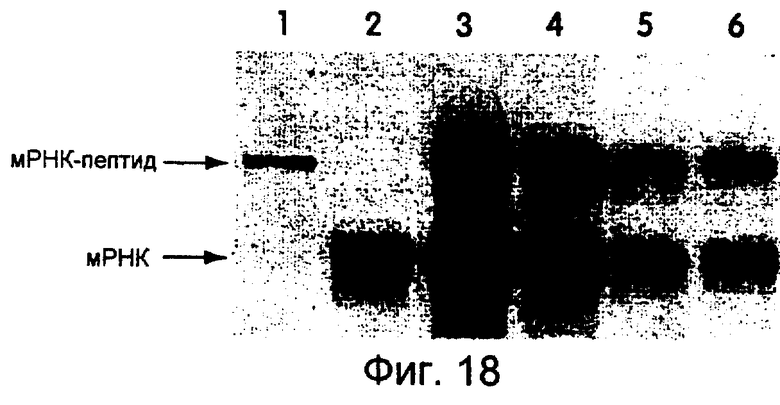
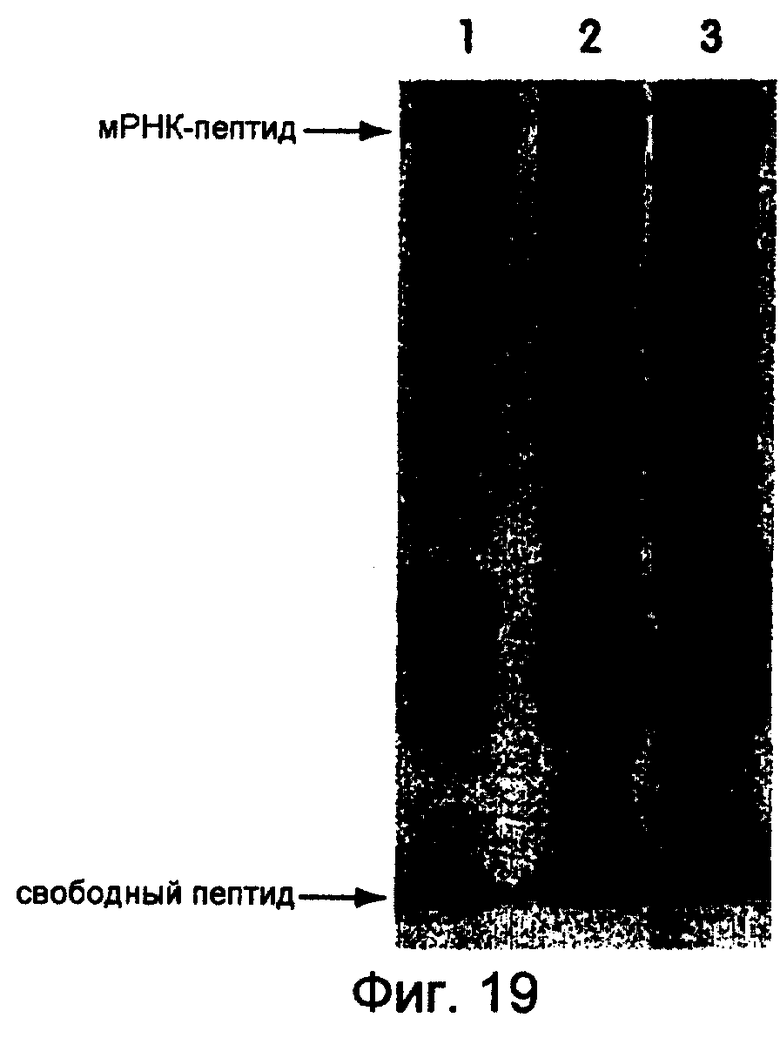
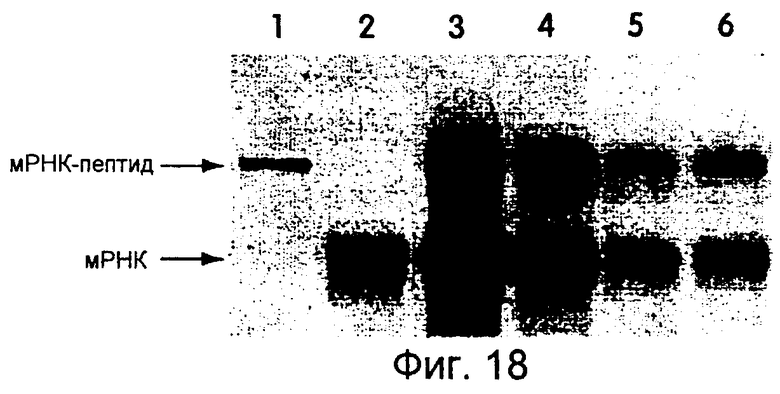
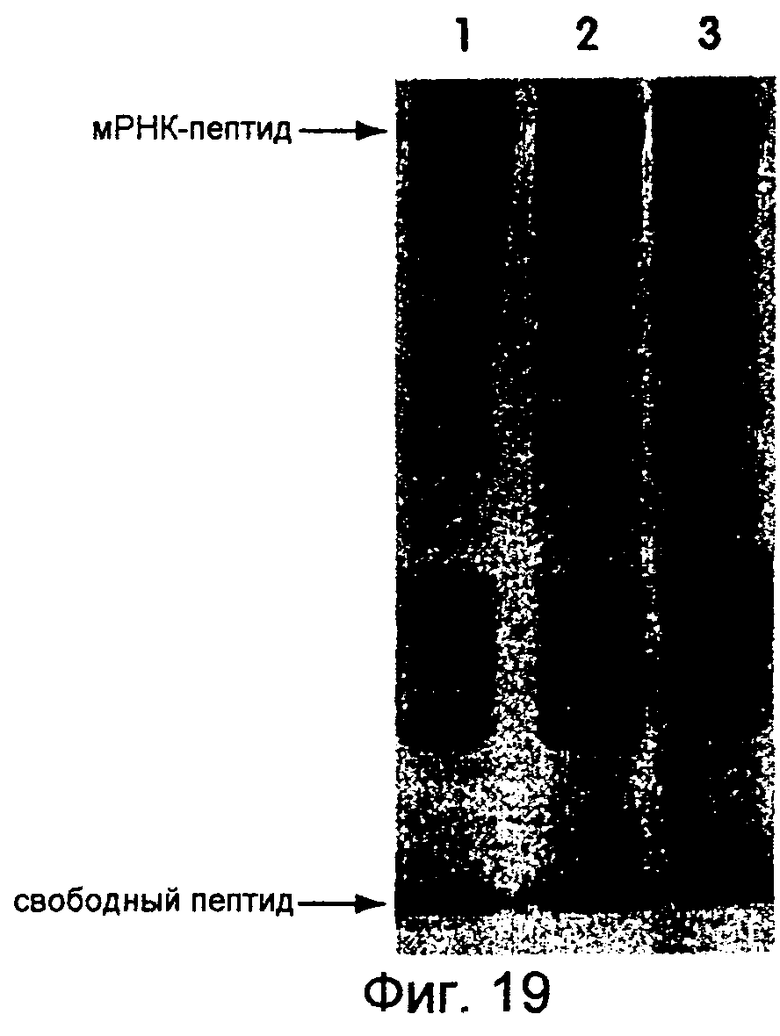
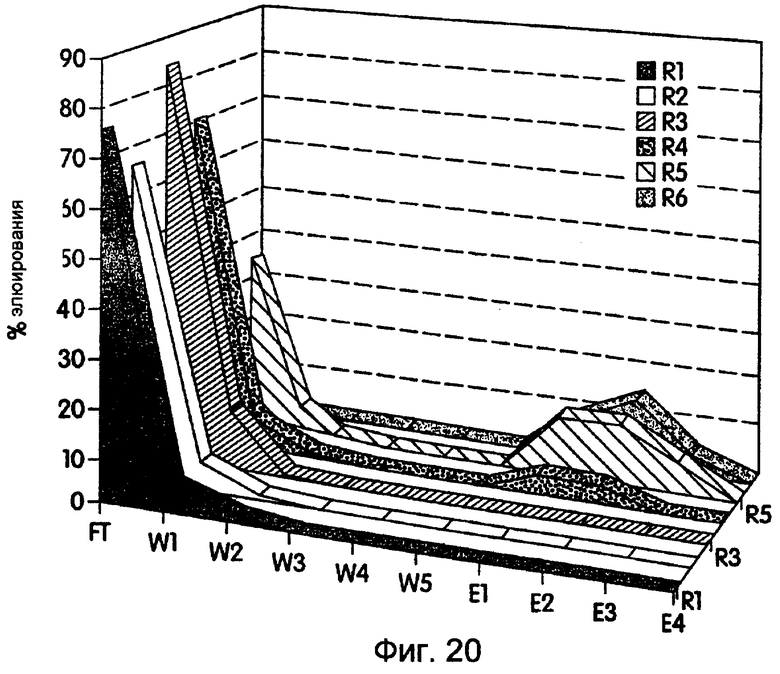
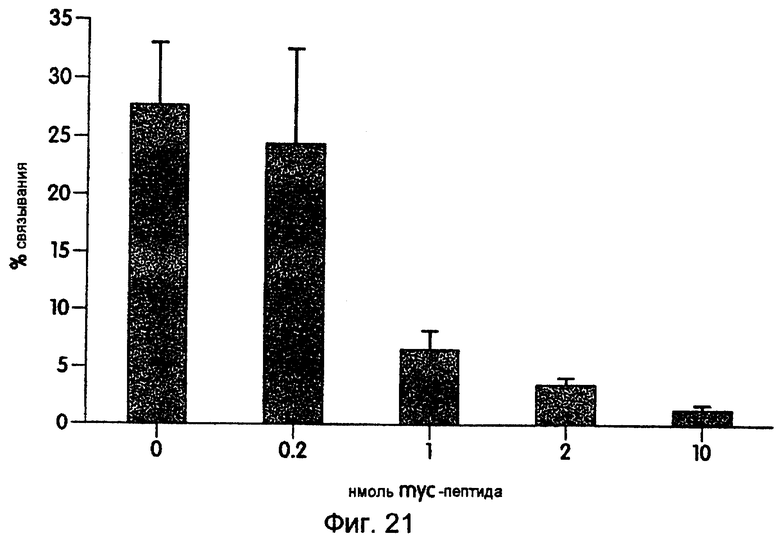
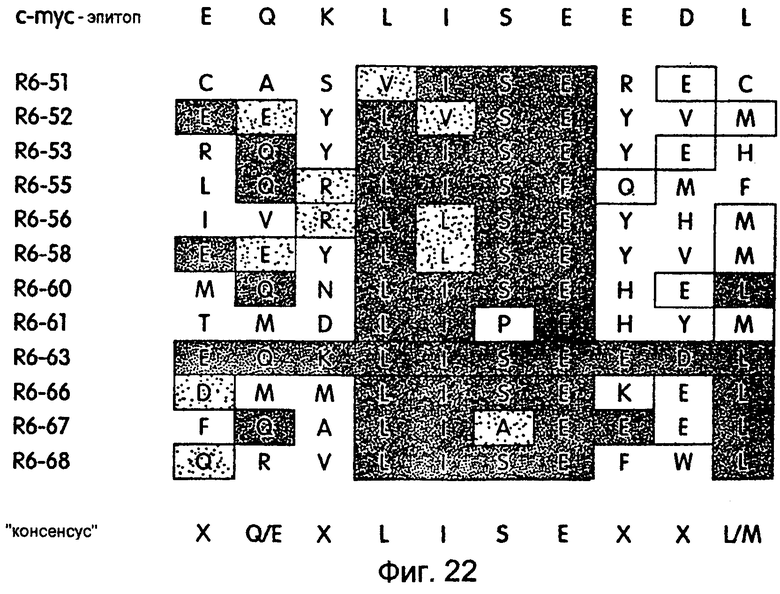

Изобретение относится к биотехнологии и может быть использовано для выделения белков с нужными свойствами из крупных пулов и нуклеиновых кислот (НК). Изобретение предусматривает получение гибридов "РНК-белок", которое включает стадию посттрансляционного инкубирования с высокой концентрацией одновалентного катиона. В качестве одновалентного катиона используют Na+, K+ или NH

 .
.
| US 5843701 А, 01.12.1998.US 5643768 А, 01.07.1997. |
Авторы
Даты
2004-10-20—Публикация
2000-02-01—Подача