Область изобретения
Настоящее изобретение касается новых интерферон-α/β-связывающих белков, способного модулировать активность различных подтипов интерферона-α (IFN-α), а также активность интерферона-β. Изобретение, в частности, касается клонирования молекул ДНК, кодирующих указанные белки, их экспрессии в клетках-хозяевах и антител против указанных белков.
В заявке на выдачу патента Израиля 103052 описывается и заявляется растворимый рецепторный белок интерферона-α с молекулярной массой около 45000 Да, выявленный по методу вестерн-блоттинга с помощью моноклональных антител против рецептора интерферона-α. В указанной заявке описывается и заявляется также другой растворимый связывающий интерферон-α белок, имеющий молекулярную массу около 40000 Да, который выявили с помощью связывания с 125I-IFN-α2 и иммуноосаждением с помощью анти-IFN-α моноклональных антител. Если их выделяют из сыворотки крови, то указанные соединения имеют молекулярную массу 50 кДа. В заявке на выдачу патента Израиля 106591 описывается и заявляется указанный выше интерферон-α-связывающий белок с молекулярной массой 40000 Да (далее обозначается "IFNAB-ВР" или "IFNAB-BPII"), который выделяется из мочи в гомогенном виде и имеет последовательность, которая отличается от любого известного белка. IFNAB-BP связывает и блокирует активность различных подтипов интерферона-α, а также интерферона-β. По этой причине характеристики связывания IFNAB-BP значительно отличаются от ранее описанных рецепторов интерферона на поверхности клеток, которые соответствуют лишь интерферону-αβ человека.
В соответствии с настоящим изобретением две комплементарные молекулы ДНК (кДНК), кодирующие предшественники IFNAB-BP, клонируют и определяют последовательность их аминокислотных остатков. Вероятно, обе они получаются из одного и того же гена, например, путем альтернативного сплайсинга. Описывается также продуцирование двух рекомбинантных белков, обозначаемых IFNAB-BPI и IFNAB-BPII, в клетках млекопитающих и других клетках-хозяевах. Заявляются также поликлональные и моноклональные антитела, направленные против IFNAB-BP, применимые для блокирования рецептора интерферона, для проведения иммуноанализов и иммуноочистки IFNAB-BPI и IFNAB-BPII.
IFNAB-BPI и IFNAB-BPII способны модулировать активность интерферонов типа I, т.е. различных подтипов интерферона-α, a также интерферона-β. Таким образом, они могут подавлять нежелательное воздействие интерферонов типа I.
Предпосылки изобретения
Интерфероны типа I (IFN-α, IFN-β и IFN-ω) составляют семейство близких по своей структуре цитокинов, которые обычно выделяют по их способности придавать устойчивость к вирусным инфекциям. Сообщалось о разнообразной биологической активности интерферонов типа 1, включая подавление пролиферации клеток, индукцию антигенов МНС класса I и некоторых других иммунорегулирующих активностях (1). Интерферон-α и интерферон-β применимы для лечения различных вирусных заболеваний, в том числе гепатита С (2, 3) и бородавок (4, 5), а также некоторых злокачественных заболеваний, таких как волосато-клеточный лейкоз (6), хронический злокачественный лейкоз (7) и саркома Калоши (8).
Интерферон-α был обнаружен в сыворотках различных пациентов, страдающих аутоиммунными заболеваниями, такими как системная красная волчанка (9), а также больных СПИДом (10). Интерферон-α принимает участие в развитии ювенильного диабета (11). Кроме того, сообщалось, что повышенная экспрессия интерферона-α в белом веществе микроглии может вносить вклад в патологию болезни Альцгеймера. Далее, было показано, что терапия с использованием интерферона-α приводит в ряде случаев к нежелательным побочным эффектам, в том числе к лихорадке и неврологическим заболеваниям (12). Следовательно, существуют патологические состояния, в которых нейтрализация активности интерферона может принести пользу пациенту.
Как и в случае других цитокинов, интерферон-α проявляет свою биологическую активность путем связывания на поверхности клетки с рецептором, который является специфическим для всех подтипов интерферона-α, а также для интерферона-β (13). Рецептор интерферона-α человека (IFNAR) был идентифицирован и клонирован из клеток Дауди (14). Клонированный рецептор имеет одну трансмембранную область, внеклеточную и внутриклеточную область. При экспрессии в мышиных клетках указанный рецептор придает восприимчивость по отношению к интерферону-α человека, однако оказывает незначительное воздействие по отношению к другим видам интерферона-α и интерферона-β, указывая на то, что в реакции на воздействие интерферона-α и различных подтипов интерферона-β могут принимать участие дополнительные компоненты.
В других исследованиях показано, что дополнительные компоненты или субъединицы рецептора вовлекаются в связывание интерферона-α и интерферона-β (15-17). Более того, сообщалось, что уже описанный рецептор (14) принимает участие в связывании всех видов интерферона-α и интерферона-β (18).
Связывающие цитокины белки (растворимые рецепторы цитокинов) соответствуют областям связывания внеклеточного лиганда соответствующих рецепторов цитокина на поверхности клетки. Их получают либо альтернативным сплайсингом пре-мРНК, общей для рецептора на поверхности клетки, либо протеолитическим расщеплением рецептора на поверхности клетки. Подобные растворимые рецепторы ранее были описаны, в том числе среди прочих растворимые рецепторы IL-6 и IFN-γ (19-21), TNF (22-24), IL-1 (25-27), IL-4 (25, 28), IL-2 (29, 30), IL-7 (31) и IFN-α (32).
Сущность изобретения
В настоящем изобретении заявляются молекулы ДНК, кодирующие известные IFN-α/β-связывающие белки (IL106591). Указанные молекулы ДНК на самом деле кодируют два различных белка, IFNAB-BPI и IFNAB-BPII, получаемые, вероятно, от одинаковой пре-мРНК путем альтернативного сплайсинга, который приводит к образованию двух молекул мРНК, одна из которых имеет размер приблизительно 1,5 тыс. нуклеотидов, а другая имеет размер приблизительно 4,5 тыс. нуклеотидов, при этом каждая из них кодирует один из связывающих белков - м-РНК размером 1,5 тыс. нуклеотидов, кодирует IFNAB-BPI, а мРНК размером 4,5 тыс. нуклеотидов кодирует IFNAB-BPII. Термин IFNAB-BP относится как к IFNAB-BPI, так и к IFNAB-BPII. IFNAB-BP, выделенный из мочи, идентифицирован как IFNAB-BPII.
Таким образом, в настоящем изобретении заявляется молекула ДНК, кодирующая IFN-α/β-связывающие белки, выбранные из IFNAB-BPI, IFNAB-BPII, слитых белков и мутеинов IFNAB-BPI и IFNAB-BPII, их функциональных производных и их активных фракций.
В изобретении также заявляются реплицируемые экспрессирующие векторы, включающие указанные молекулы ДНК, трансформированные с их помощью клетки-хозяева и белки, продуцированные указанными трансформированными клетками-хозяевами. Термин “молекулы ДНК” включает геномные ДНК, комплементарные ДНК, синтетические ДНК и их комбинации.
Изобретение относится также к молекулам ДНК, которые гибридизуются в жестких условиях с указанными выше молекулами ДНК и кодируют белки, обладающие той же биологической активностью, что и молекулы IFNAB-BP.
В настоящем изобретении заявляются также способы получения функционально активных IFNAB-BPI и IFNAB-BPII, слитых белков, мутеинов или их активных фракций в клетках-хозяевах, способных их продуцировать.
В настоящем изобретении заявляются также рекомбинантные IFNAB-BPI и IFNAB-BPII, слитые белки, мутеины или их ативные фракции, а также соли всех указанных соединений и фармацевтические композиции, содержащие IFNAB-BPI или IFNAB-BPII, слитые белки, мутеины, их активные фракции, а также соли указанных соединений.
IFNAB-BPI и IFNAB-BPII подавляют биологическую активность природных лейкоцитов человека и интерферонов фибробластов, а также рекомбинантных интерферонов IFN-α2, IFN-αB, IFN-αС и IFN-β человека. IFNAB-BPI соответствует новому трансмембранному белку, который является лиганд-связывающим рецептором IFN-α/β. IFNAB-BPII представляет собой растворимый рецептор, который в основном соответствует внеклеточному лиганд-связывающему домену IFNAB-BPI.
Описание чертежей
На фиг.1 показана стратегия клонирования IFNAB-BPI и IFNAB-BPII:
(А) Средний ряд: Последовательность внутреннего CNBr пептида (27 аминокислотных остатков, cb7), полученного из IFNAB-BPII с молекулярной массой 40000 Да, выделенного из мочи.
Верхний и средний ряды: синтетические смысловые (вверху) и антисмысловые (внизу), генетически вырожденные олигонуклеотиды, полученные на основе пептидной последовательности и используемые для обратной транскрипции (лишь антисмысловой праймер) и для полимеразной цепной реакции (PCR).
(B) Гель-электрофорез в агарозе продуктов PCR, полученных с использованием указанных выше смысловых и антисмысловых праймеров. Для генерирования кДНК, играющей роль матрицы в PCR, используют следующие молекулы РНК и праймеры: (1) Поли А+РНК клеток Дауди, антисмысловой праймер. (2) Поли А+PHK клеток Дауди, олиго-d(Т) праймер. (3) Общая РНК клеток WISH, антисмысловой праймер. Размер (т.п.н.) ДНК-маркеров приведен в левой части.
(C) Верхний ряд: Невырожденная часть последовательности, полученной из клонов pBluescript продукта PCR с размером 101 т.п.н.
Нижний ряд: Трансляция полученной невырожденной последовательности ДНК в ожидаемую последовательность, которая представляет собой часть последовательности пептидов сb7 (остатки 9-20).
На фиг.2 показана кДНК и транслированная полипептидная последовательность клона q10, несущего кДНК IFNAB-BPI:
Указанный клон выделяют из библиотеки лямбда gt11, полученной из кДНК клеток HeLa человека, скринингом с синтетическим олигонуклеотидом, соответствующим последовательности невырожденной ДНК, приведенной на фиг.1(С). Последовательность, соответствующая N-концу IFNAB-BPI, выделенного из мочи, и его CNBr-пептидам, подчеркнута, а под чертой приведено название соответствующей последовательности (n1, N-конец 1; n2, N-конец 2; cb3, CNBr пептид 3; cb6, CNBr пептид 6; cb7, CNBr пептид 7). Гидрофобная последовательность, соответствующая сигнальному(ым) пептиду(ам) и трансмембранной области (tm), подчеркнута дважды.
Жирные цифры с правой стороны указывают на количество аминокислотных остатков. Обычные цифры соответствуют нуклеотидным остаткам, принимая инициатор А в ATG за номер 1.
На фиг.3 показано определение мРНК методом нозерн-блоттинга с использованием специфического зонда, общего для последовательности IFNAB-BPI и IFNAB-BPII:
Зонд, содержащий 397 пар нуклеотидов, соответствующих нуклеотидам 218-614 IFNAB-BPI, получают полимеразной цепной реакцией, используя подходящие праймеры и стохастическую метку праймеров с помощью [32P]. Поли А+РНК из клеток Дауди человека, нанесенную на нитроцеллюлозу и гибридизованную со специфическим зондом, анализируют методом электрофореза в агарозе (1,5%). Размер рибосомальной РНК указан с правой стороны.
На фиг.4 показана последовательность нуклеотидов и аминокислот полного клона кДНК с размером 1,5 тыс. нуклеотидов, соответствующего IFNAB-BPI. Аминокислотные остатки в однобуквенных кодах нумеруются жирными цифрами, начиная с кодона инициации трансляции. Подчеркнуты области гидрофобного лидера и трансмембранные области. Последовательность N-концевых белков IFNAB-BP, выделенного из мочи (из кодона 27), и внутренние CNBr пептиды подчеркнуты пунктирной линией (однако остатки Сys и N-гликозилированные остатки Asn не обнаруживаются). Сигналы N-гликозилирования помечены звездочками, а сигналы полиаденилирования подчеркнуты дважды.
На фиг.5 показаны частичные последовательности нуклеотидов и аминокислот клона кДНК размером 4,5 тыс. нуклеотидов, соответствующего IFNAB-BPII. Аминокислотные остатки в однобуквенных кодах нумеруются жирными цифрами, начиная с кодона инициации трансляции. Подчеркнута область гидрофобного лидера. Последовательность N-концевых белков IFNAB-BP, выделенного из мочи (из кодона 27), и внутренние CNBr пептиды подчеркнуты пунктирной линией (остатки Cys и N-гликозилированные остатки Asn не обнаруживаются). Сигналы N-гликозилирования и кодоны остановки помечены звездочками.
На фиг.6 показана генная конструкция вектора экспрессии млекопитающих для экспрессии внеклеточной области IFNAB-BPI для связывания лиганда.
(A) Смысловые и антисмысловые синтетические олигонуклеотиды, используемые для получения ДНК, которая кодирует внеклеточную область IFNAB-BPI для связывания лиганда, путем полимеразной цепной реакции.
(B) Гель-электрофорез в агарозе продукта полимеразной цепной реакции размером приблизительно 850 пар нуклеотидов, полученного с помощью указанных выше смысловых и антисмысловых праймеров и ДНК клона q10.
(C) Структура peF-BOS-IFNAB-BP-I, вектора экспрессирующего в клетках млекопитающих для получения растворимого IFNAB-BPI.
На фиг.7 показана экспрессия IFNAB-BPI и IFNAR в различных клетках:
Экспрессия IFNAB-BPI в различных клетках показана в виде SDS-PAGE (7,5% акриламида, невосстанавливающие условия) экстрактов из клеток с помощью детергентов с последующим иммуноблоттингом анти-IFNAB-BPII антителом кролика и 125I-белка А. Клон 369.11 представляет собой клетки NIH-3T3, экспрессирующие IFNAB-BPI; клон 470.6 представляет собой клетки NIH-3T3, экспрессирующие IFNAR; а клон 508.12 экспрессирует оба белка. Показаны также контрольные клетки NIH-3T3 и клетки Дауди человека. Формы IFNAB-BPI с массой 51 кДа (в мышиных клетках) и 102 кДа (в клетках Дауди) указаны стрелками. Указатели молекулярной массы приведены с левой стороны.
На фиг.8 представлены данные по связыванию 125I-IFN-α2 с различными клетками-хозяевами:
(А) Насыщение связывания 1255I-IFN-α2 с клетками NIH-3T3, экспрессирующими IFNAB-BPI (клон 369.11, ), и клетками, экспрессирующими как IFNAB-BPI, так и IFNAR (клоны 508.12, •), и отсутствие связывания с клетками, экспрессирующими лишь IFNAR (клон 470.6, Δ). (В) Анализ Скэтчарда связывания 125I-IFN-α2 с указанными выше клетками. Данные по связыванию были обработаны с использованием программы LIGAND. Следующие клетки показывают высокое сродство насыщения: клетки Дауди человека (Δ), позитивные клетки IFNAB-BPI (клон 369.11, •) и клон 508.12, экспрессирующий как IFNAB-BPI, так и IFNAR ( ).
).
На фиг.9 обобщены результаты исследований системы BIAcore, которые определяют сродство IFNAB-BPII, выделенного из мочи, к IFN-α2:
IFN-α2 иммобилизовали на чувствительном элементе и пропускали через него различные концентрации IFNAB-BPII, выделенного из мочи. Кривая "Относительная величина реакции в зависимости от времени" характеризует процесс связывания и диссоциации. Кажущаяся константа диссоциации составляет 3,12×10-9 M.
На фиг.10 приведены результаты ELISA анализа IFNAB-BPII, выделенного из мочи.
Чистый IFNAB-BPII, выделенный из мочи, последовательными двукратными разведениями разбавляли до указанной концентрации, помещали на микротитровальные планшеты для проведения анализа ELISA, которые предварительно покрывают моноклональными анти-IFNAB-BPII антителами. Планшеты затем подвергали взаимодействию с кроличьими анти-IFNAB-BPII антителами с последующим добавлением козьих антител против кроличьих антител, коньюгированных с пероксидазой хрена, и субстрата АВТS/Н2О. Считывание планшетов проводили при длине волны 405/630 нм. Нижний порог обнаружения составляет 30 пг/мл.
Подробное описание изобретения
В соответствии с заявкой на выдачу патента Израиля 106591 белок связывания IFN-α/β, имеющий молекулярную массу 40000 Да (IFNAB-BP), выделяли хроматографически в две стадии из обычной мочи. Неочищенные белки, выделенные из мочи, помещали в колонку, содержащую IFN-α2, сшитый с агарозой. Колонку промывали для удаления не представляющих интерес белков, а затем связанные белки элюировали при низком значении рН. Элюированные белки затем разделяли с помощью ВЭЖХ с определением размеров и получали несколько пиков белков, один из которых отличается своей способностью специфично взаимодействовать с 125I-IFN-α2 и блокировать антивирусную активность интерферона-α и интерферона-β. Эти белки далее охарактеризовывали микроанализом последовательности аминокислотных остатков N-конца, с помощью которого получена основная последовательность N-концевой области:
Asp-Ser-Pro-Asp-Tyr-Thr-Asp-Glu-Ser-Arg-Thr-Phe-Lys-Ile-Arg-Leu-Arg.
Была выделена минорная полипептидная последовательность, соответствующая основной последовательности, но содержащая дополнительно три аминокислотных остатка (Ile-XXX-Tyr) со стороны N-конца приведенной выше последовательности (XXX обозначает неидентифицированную аминокислоту). При сравнении полученной последовательности было установлено, что она полностью отличается от последовательности известного IFN-αB рецептора (14). Она отличается также от любого другого известного белка и не кодируется ни одной известной последовательностью ДНК, что показано при сравнении с данными библиотек Swissprot и Genbank при использовании программы FastA (33).
Образец IFNAB-BPII, выделенного из мочи, расщепляли с помощью CNBr, разделяли с помощью SDS-PAGE, наносили методом электроблоттинга на мембрану из поливинилдифторида и полученные при расщеплении фрагменты подвергали операции микроопределения первичной структуры. Один из фрагментов имел молекулярную массу менее 10 кДа и следующую внутреннюю последовательность (Met предшествует действительной последовательности):
Met-Val-Lys-Phe-Pro-Ser-Ile-Val-Glu-Glu-Glu-Leu-Gln-Phe-Asp-Leu-Ser-Leu-Val-Ile-Glu-Glu-Gln-Ser-Glu-Gly-Ile (27 остатков)
Эта внутренняя последовательность обратно транслируется в смысловые и антисмысловые праймеры, к которым добавлены подходящие сайты рестрикции. Полная РНК очищали от клеток человека и первую цепь кДНК генерировали с помощью обратной траскриптазы, используя в качестве праймера либо антисмысловые олигонуклеотиды, либо олиго-d(T). Полученный фрагмент кДНК затем амплифицировали полимеразной цепной реакцией, используя комбинацию смысловых и антисмысловых вырожденных праймеров. Анализ продуктов PCR на 3%-ном геле агарозы показывает специфическую олигонуклеотидную полосу. Эту ДНК подвергали расщеплению рестриктазами, клонировали на pBluescript ("Stratagene") и трансфектировали этим вектором подходящую E.coli. Определяли последовательность аминокислотных остатков нескольких независимых клонов. Последовательность участка, ограниченного смысловыми и антисмысловыми вырожденными праймерами, инвариантна и кодируется ожидаемой последовательностью указанного выше CNBr пептида (сb7) из IFNAB-ВР, выделенного из мочи. Синтезировали олигонуклеотид, соответствующий невырожденной внутренней последовательности, делали метку на конце и использовали для скрининга библиотек кДНК.
Скрининг лямбда gt11 библиотеки кДНК клеток HeLa человека ("Clontech") дал несколько положительных клонов. Один из этих клонов, обозначенный как q10, имеет открытую рамку считывания генетической информации, которая соответствует сигнальному пептиду, внеклеточной области, трансмембранной области и короткой цитоплазматической области. Пептидные последовательности, полученные из IFNAB-BP, выделенного из мочи, все находятся внутри внеклеточной области, обозначенной как q10. Небольшое количество аминокислотных остатков пептидной последовательности были неправильными вследствие ограничений технологии определения первичной структуры (в основном вследствие невозможности идентифицировать Сys и низкие уровни пиков, соответствующие Ser).
Смысловые и антисмысловые праймеры, соответствующие концам нуклеотидной последовательности 219-613 клона ql0 (фиг.2), использовали для получения с помощью PCR специфического зонда, используя клон ql0 в качестве ДНК-матрицы. Полученную ДНК метили [32P] и использовали для гибридизации по методу нозерн-блоттинга поли А+мРНК из двух клеточных линий человека. В обоих случаях наблюдаются две специфические полосы, одна соответствует мРНК с длиной 1,5 тыс. нуклеотидов, а другая соответствует мРНК с длиной 4,5 тыс. нуклеотидов. Первичный продукт трансляции мРНК с длиной 1,5 тыс. нуклеотидов обозначают как предшественник IFNAB-BPI. Первичный продукт трансляции мРНК с длиной 4,5 тыс. нуклеотидов обозначают как предшественник IFNAB-BPII.
Указанный выше специфический зонд использовали для скрининга дополнительной библиотеки кДНК человека и идентифицировали две группы клонов кДНК. Одна группа (около 20 индивидуальных клонов) имеет длину 1,5 тыс. нуклеотидов и кодирует тот же самый предшественник трансмембранного белка, который кодирует клон ql0. Вторая группа (2 индивидуальных клона) имеет длину 4,5 тыс. нуклеотидов. Эти размеры совпадают с размерами двух образцов мРНК, а потому мРНК с размером 1,5 тыс. нуклеотидов кодирует IFNAB-BPI, а мРНК с размером 4,5 тыс. нуклеотидов кодирует IFNAB-BPII. Определение последовательности аминокислотных остатков клонов с размером 4,5 тыс. нуклеотидов показало, что они кодируют предшественник усеченного растворимого рецептора, соответствующего кодонам 1-239 клона q10. Однако кодоны 238 и 239 были отличны, и за ними следовал кодон остановки. Анализ последовательности аминокислотных остатков белка, проведенный для С-конца 40000 IFNAB-BP, выделенного из мочи, показывает, что он кодируется кДНК с размером 4,5 тыс. нуклеотидов, что определяется последними двумя аминокислотными остатками, и таким образом IFNAB-BP, выделенный из мочи, определен как IFNAB-BPII. Термин "предшественник" в контексте настоящего изобретения используется для обозначения первичного продукта трансляции, который включает сигнальный пептид.
ДНК, кодирующая предшественник усеченной растворимой формы IFNAB-BPI, синтезировали с помощью PCR. Полученный продукт PCR вводили в вектор, способный экспрессироваться в клетках млекопитающего, и использовали для трансфекции различных клеток млекопитающих, таких как COS-клетки обезьяны. Указанные клетки экспрессируют высокие уровни биологически активного рекомбинантного растворимого IFNAB-BPI.
Аналогично с помощью PCR синтезировали ДНК, кодирующую предшественника IFNAB-BPII. Полученный продукт PCR вводили в вектор, способный экспрессироваться в клетках млекопитающего, и использовали для трансфекции различных клеток млекопитающих, таких как клетки COS обезьяны. Указанные клетки экспрессируют высокие уровни биологически активного рекомбинантного IFNAB-BPII.
Аналогично с помощью PCR синтезировали ДНК, кодирующую предшественник IFNAB-BPI. Полученный продукт PCR вводили в вектор, способный экспрессироваться в клетках млекопитающего, и использовали для трансфекции различных клеток млекопитающих, таких как клетки NIH-3T3 мыши. Указанные клетки экспрессируют высокие уровни IFNAB-BPI человека. Клетки способны связывать интерферон IFN-α2 человека с высоким сродством (Кd=3,6×10-9 М). Если совместно экспрессировали IFNAB-BPI человека и ранее клонированный рецептор IFNAR интерферона IFN-αB человека (14) в клетках NIH-3T3 мыши, то сродство комплексного рецептора возрастает приблизительно в 10 раз (Кd=4×10-10 М). Наоборот, если в клетках мыши экспрессируются лишь IFNAR человека, то сродство к IFN-α2 человека не проявляется. Таким образом, составной белок, содержащий два присоединенных полипептида, один из которых содержит область связывания лиганда IFNAB-BPI или IFNAB-BPII, а второй полипептид содержит внеклеточную область IFNAR, будет проявлять большее сродство к IFN-α по сравнению с одним IFNAB-BPI или одним IFNAB-BPII.
Сродство IFNAB-BPII, выделенного из мочи, к IFN-α человека определяли в системе BIAcore ("Pharmacia", Швеция). IFN-α2 иммобилизовали на чувствительный элемент и давали связывать IFNAB-BPII. На основе значений Коn и Koff получали значение Kd, равное 3,12-9 М. Это значение очень близко к величине, полученной с клетками NIH-3T3, экспрессирующими IFNAB-BPI.
Рассмотренные выше операции клонирования, выделения клона, идентификации, характеристики и определения первичной структуры более подробно рассмотрены далее в примерах.
IFNAB-BPI и IFNAB-BPII могут быть получены из других типов рекомбинантных клеток, таких как клетки прокариотов, в частности, E.coli, или клетки эукариотов, такие как СНО, дрожжевые клетки или клетки насекомых. Методы конструирования подходящих векторов, несущих ДНК, которая кодирует полный IFNAB-BPI или IFNAB-BPII и пригодна для трансформирования (в частности, E.coli и дрожжевых клеток) или инфицирования клеток насекомых, с целью получения рекомбинантного IFNAB-BPI и IFNAB-BPII, хорошо известны из области техники. См., например, Ausubel et al., "Current Protocols in Molecular Biology", Current Protocols, 1993; и Sambrook et al., eds. "Molecular Cloning: A Laboratory Manual", 2nd ad.. Cold Spring Harbor Press, 1989.
Изобретение также касается активных мутеинов и активных фракций IFNAB-BPI и IFNAB-BPII и слитых белков, включающих дикие IFNAB-BPI и IFNAB-BPII или их активные мутеины, или их активные фракции, слитые с другим полипептидом или белком и проявляющие похожую способность блокировать биологическую активность IFN-α и IFN-β, или других цитокинов, которые участвуют во взаимодействии с рецептором интерферона альфа/бета.
ДНК, кодирующая IFNAB-BPI или IFNAB-BPII, их активные фракции, мутеины или слитые белки, или оперативно присоединенные сигналы транскрипции или трансляции, вводят в векторы эукариотов, которые способны встраиваться в нужную последовательность гена в хромосоме клетки-хозяина. Чтобы можно было выделить клетки, которые устойчиво интегрировали введенную ДНК в свои хромосомы, используют один или два маркера, которые позволяют провести отбор клеток-хозяев, содержащих вектор экспрессии. Маркер может вносить прототрофию в ауксотрофные клетки, биоцидную резистентность, например, по отношению к антибиотикам, или толерантность к тяжелым металлам, таким как медь и т.п. Селективный ген-маркер может быть либо непосредственно присоединен к ДНК последовательностям гена, которые нужно экспрессировать, либо введен в ту же клетку путем совместной трансфекции. Для оптимального синтеза одноцепочечного белка связывания мРНК могут потребоваться дополнительные элементы. Эти элементы могут включать сигналы сплайсинга, а также промоторы транскрипции, усилители и сигналы терминации (34).
С целью экспрессии белков IFNAB-BPI или IFNAB-BPII, их активных фракций или производных молекула ДНК, которую необходимо ввести в выбранные клетки, преимущественно встраивается в плазмиду или вирусный вектор, способный автономно реплицироваться в клетке-хозяине.
Важными факторами при выборе конкретной плазмиды или вирусного вектора являются: простота распознавания клеток-хозяев, содержащих вектор, и их селекции из клеток, не содержащих вектор; количество копий вектора, которые должны быть воспроизведены в данном хозяине; и, в случае необходимости, возможность осуществления "челночного" перемещения вектора между клетками-хозяевами и другими объектами. Предпочтительными прокариотическими векторами являются плазмиды, такие как плазмиды, способные к репликации в E.coli, например, pBR322, ColE1, pSC101, pACYC 184 и т.д. (35); плазмиды Bacillus, такие как рС194, рС221, рТ127 и т.д. (36); плазмиды Streptomyces, в том числе pIJ101 (37); бактериофаги Streptomyces, такие как ФС31 (38), и плазмиды Pseudomonas (39, 40).
Предпочтительными эукариотическими плазмидами являются BPV, вирус осповакцины, SV40, 2-микронная плазмида и т.д. или их активные производные. Указанные плазмиды хорошо известны из области техники (41-45).
Как только вектор или последовательность ДНК, содержащие генно-инженерные конструкции, подготовлены для экспрессии, экспрессирующий вектор может быть введен в соответствующую клетку-хозяина различными подходящими способами, такими как трансформация, трансфекция, липофекция, конъюгация, слияние клеток, электропорация, осаждение фосфатом кальция, прямая микроинъекция и т.п.
Клетки-хозяева, которые следует использовать по настоящему изобретению, могут быть как прокариотическими, так и эукариотическимими. Предпочтительными прокариотическими клетками-хозяевами являются бактерии, такие как E.coli, Bacillus, Streptomyces, Pseudomonas, Salmonella, Serrata и т.п. Наиболее предпочтительными прокариотическими клетками-хозяевами являются клетки E.coli. Бактериями-хозяевами, представляющими особый интерес, являются E.coli K12 штамм 294 (АТСС 31446), E.coli X1776 (АТСС 31537), E.coli W3110 (F-, λ-, прототрофные (АТСС 27325)) и другие кишечные бактерии, такие как Salmonella typhimurium или Serrata narcescens, а также различные виды Pseudomonas. В этих условиях белки не гликозилируются. Прокариотическая клетка-хозяин должна быть совместима с репликоном и контролирующей последовательностью в экспрессирующей плазмиде.
Однако поскольку IFNAB-BPI и IFNAB-BPII являются гликозилированными белками, эукариотические хозяева имеют предпочтение перед прокариотическими хозяевами. Предпочтительными эукариотическими хозяевами являются клетки млекопитающих, в частности клетки человека, обезьяны, мыши и клетки яичников китайского хомячка (клетки СНО), поскольку они вносят посттрансляционные модификации в молекулы белков, включая правильную укладку цепи, правильное образование дисульфидных связей, а также гликозилирование в нужных местах. Модификацию пептидов после трансляции, в том числе высокую степень гликозилирования маннозой, могут осуществлять также дрожжевые клетки и клетки насекомых. Существует ряд стратегий проведения рекомбинации ДНК, в которых используются последовательности высокопродуктивных промоторов и плазмид, позволяющих получить большое количество копий, которые могут быть применены для воспроизводства нужных белков в дрожжевых клетках и клетках насекомых. Дрожжевые клетки узнают последовательность лидера в продуктах подвергнутого клонированию гена млекопитающих и выделяют пептиды, содержащие лидерную последовательность. После введения вектора клетки-хозяева выращивают в селективной среде, которая селективно способствует росту клеток, содержащих вектор. Экспрессия клонированных последовательностей гена приводит к продуцированию IFNAB-BPI или IFNAB-BPII, слитых белков, или мутеинов, или их активных фракций. Экспрессированные белки затем выделяют и очищают в соответствии с любой известной методикой, включая экстракцию, осаждение, хроматографию, электрофорез и т.п. или с помощью аффинной хроматографии с использованием анти-IFNAB-BPI моноклокальных антител, иммобилизованных на гелевом носителе, помещенном в колонку. Неочищенные препараты, содержащие указанные рекомбинантные IFNAB-BPI или IFNAB-BPII, их активные фракции или производные, пропускают через колонку, в которой IFNAB-BPI или IFNAB-BPII, их активные фракции или производные связываются в колонке со специфическим антителом, в то время как примеси проходят сквозь колонку. После промывки белок элюируют с геля в условиях, которые обычно используются для этой цели, т.е. при высоком или низком значении рН, в частности рН 11 или рН 2.
В контексте настоящего изобретения термин "мутеины" обозначает аналоги IFNAB-BPI или IFNAB-BPII, в которых один или несколько аминокислотных остатков природного IFNAB-BPI или IFNAB-BPII, или их активных фракций замещены другими аминокислотами или удалены, или один или несколько аминокислотных остатков добавлены к природной последовательности IFNAB-BPI или IFNAB-BPII, не изменяя существенно активность полученных продуктов по сравнению с IFNAB-BPI или IFNAB-BPII дикого типа или их активными фракциями. Указанные мутеины получают известными синтетическими способами и/или сайт-направленным мутагенезом или другими подходящими способами.
Любой подобный мутеин предпочтительно имеет последовательность аминокислот, практически дублирующую последовательность IFNAB-BPI и IFNAB-BPII, так что они имеют существенно идентичную активность таковой IFNAB-BPI и IFNAB-BPII или их активных фракций. Один тип активности IFNAB-BPI и IFNAB-BPII заключается в ее способности связываться с одним или большим количеством интерферонов типа I, таких как нативные интерфероны лейкоцитов и фибробластов человека, а также с рекомбинантными интерферонами человека IFN-α, IFN-αB, IFN-αС и IFN-β. Поскольку мутеин обладает способностью к связыванию с одним или большим количеством указанных интерферонов, его можно использовать для очистки этих интерферонов, например, с помощью аффинной хроматографии, а потому можно считать, что они обладают практически аналогичной активностью по отношению к IFNAB-BPI и IFNAB-BPII. Таким образом, можно установить, обладает ли данный мутеин практически той же активностью, что IFNAB-BPI или IFNAB-BPII, проведя обычные исследования, которые заключаются в тестировании указанного мутеина с помощью, например, простого конкурентного анализа с целью определить, связывается ли он с интерфероном, содержащим подходящую метку, в частности с помощью радиоиммуноанализа или твердофазного ИФА. Указанный анализ следует повторить с несколькими образцами интерферона типа I, поскольку мутеин, который связывается с любым образцом интерферона типа I и сохраняет значительную активность IFNAB-BPI или IFNAB-BPII, обладает по крайней мере одним из указанных эффектов IFNAB-BPI или IFNAB-BPII и, таким образом, обладает по отношению к ним аналогичной активностью.
В настоящем описании любой подобный мутеин обладает по крайней мере 40%-ной идентичностью или гомологичностью по отношению к последовательности IFNAB-BPI либо IFNAB-BPII. Более предпочтительно он обладает 50%-ной, по крайней мере 60%-ной, по крайней мере 70%-ной, по крайней мере 80%-ной, а наиболее предпочтительно 90%-ной идентичностью или гомологичностью по отношению к указанным последовательностям.
Myтеины полипептидов или белков IFNAB-BPI или IFNAB-BPII или их активных фракций, которые могут использоваться в соответствии с настоящим изобретением, или кодирующие их нуклеиновые кислоты включают ограниченный набор практически соответствующих последовательностей взаимозаменяемых пептидов или полинуклеотидов, которые могут быть легко получены любым специалистом без проведения большого количества экспериментов, если взять за основу методики и рекомендации, представленные в настоящем описании. Для подробного описания химии и структур белков, см. G.E. Schuiz et al., Principles of Protein Structure, Springer-Verlag, New York, 1978; и Т.Е. Creighton, Proteins: Structure and Molecular Properties, W.H.Freeman & Co., San Francisco, 1983, которые приводятся здесь в качестве ссылки. Для примеров замен нуклеотидных последовательностей, таких как предпочтительные кодоны, см. Ausubel et al., в параграфах А.1.1-А.1.24, и Sambrook et al, в Приложениях С и D.
Предпочтительными изменениями для мутеинов в соответствии с настоящим изобретением являются так называемые "консервативные" замены. Консервативные замены аминокислот в полипептидах, или белках, или активных фракциях IFNAB-BPI и IFNAB-BPII могут включать синонимичные аминокислоты внутри группы, которые в значительной степени обладают похожими физико-химическими свойствами, так что замены между членами группы приведут к сохранению биологической функции молекулы (Grantham, Science, 1974, Vol.185, pp.862-864). Очевидно, что в указанных выше последовательностях могут быть осуществлены инсерции или делении аминокислот, которые не изменяют функции последовательностей, особенно в том случае, если инсерции или делеции затрагивают лишь несколько аминокислот, в частности, в пределах тридцати, преимущественно менее десяти, и не приводят к перемещению аминокислот, которые являются принципиально важными для функциональной конформации, в частности, остатков цистеина (Anfinsen, "Principles that Govern the Folding of Protein Chains", Science, 1973, Vol.181, pp.223-230). Белки или мутеины, получаемые в результате указанных делеций и/или инсерций, входят в объем притязаний по настоящему изобретению.
Предпочтительные группы синонимичных аминокислот приведены в таблице I. Более предпочтительные группы синонимичных аминокислот приведены в таблице II; и наиболее предпочтительные группы синонимичных аминокислот приведены в таблице III.



Примеры проведения замен аминокислот в белках, которые могут быть использованы для получения мутеинов полипептидов, или белков, или активных фракций IFNAB-BPI или IFNAB-BPII для использования по настоящему изобретению, включают любые известные стадии, такие как представленные в патентах США RE 33653, 4959314, 4588585 и 4737462, выданных Mark et al.; 5116943, выданном Koths et al, 4965195, выданном Namen et al; 4879111, выданном Chong et al; и 5017691, выданном Lee et al; и лизинзамещенные белки, приведенные в патенте США 4904584 (Shaw et al).
В другом предпочтительном варианте осуществления настоящего изобретения любой мутеин IFNAB-BPI или IFNAB-BPII или их активных фракций содержит аминокислотную последовательность, практически соответствующую аминокислотной последовательности IFNAB-BPI или IFNAB-BPII. Подразумевается, что термин "практически соответствующий" включает в себя белки с небольшими изменениями по сравнению с последовательностью природного белка, которые не оказывают воздействия на основные свойства природного белка, особенно если это касается их способности связывать один или несколько интерферонов типа I, а следовательно, к способности ингибировать in situ связывание интерферона типа I с природным рецептором интерферона типа I. Типы изменений, которые обычно могут рассматриваться как попадающие под определение "практически соответствующий", являются такие, которые приводят при использовании обычных методик мутагенеза ДНК, кодирующей указанные белки, к незначительным модификациям и отбору по требуемой активности, как это описано ранее.
Мутеины в соответствии с настоящим изобретением включают белки, кодируемые нуклеиновой кислотой, такой как ДНК или РНК, которые в строго контролируемых условиях гибридизуются в ДНК или РНК, кодирующую IFNAB-BPI или IFNAB-BPII, в соответствии с настоящим изобретением. Изобретение включает и такую нуклеиновую кислоту, которая также может использоваться в качестве зонда для идентификации и очистки желательной нуклеиновой кислоты. Более того, такая нуклеиновая кислота является первым кандидатом для установления, кодируют ли она полипептид, который сохраняет функциональную активность IFNAB-BPI или IFNAB-BPII по настоящему изобретению. Термин "жесткие условия" относится к условиям гибридизации и условиям последующей промывки, которые специалисты называют "жесткими". См., Ausubel et al., Current Protocols in Molecular Biology, см. выше, Interscience, NY, параграф 6.3 и 6.4 (1987, 1992) и Sambrook et al., см. выше. Не внося ограничений в настоящее изобретение, примеры строго контролируемых условий включают условия промывки на 12-20°С ниже вычисленного значения Тm изучаемого гибрида, например, 2×SSC и 0,5% додецилсульфоната натрия (SDS) в течение 5 мин, 2×SSC и 0,1% SDS в течение 15 мин; 0,1×SSC и 0,5% SDS при температуре 37°С в течение 30-60 мин, а затем 0,1×SSC и 0,5% SDS при температуре 68°С 30-60 мин. Для специалиста очевидно, что жесткость условий зависит также от длины последовательностей ДНК, олигонуклеотидных зондов (таких как содержащие 10-40 нуклеотидов) или смешанных нуклеотидных зондов. Если используются зонды, то предпочтительно применять тетраметиламмонийхлорид, а не SSC. См., Ausubel, см. выше.
Термин "слитый белок" относится к полипептидам, включающим IFNAB-BPI или IFNAB-BPII, или активные фракции, или их мутеины, слитые с другим белком, который, например, более длительное время циркулирует в жидкостях организма. IFNAB-BPI или IFNAB-BPII или их активные фракции могут, таким образом, быть слиты с другими белком, полипептидом и т.п., например иммуноглобулином или его фрагментом.
Термин "соли" в контексте настоящего изобретения относится как к солям карбоксильной группы, так и кислотно-аддитивным солям по аминогруппе IFNAB-BPI, IFNAB-BPII, их активных фракций, мутеинов или их слитых белков. Соли карбоксильной группы могут быть получены известными из данной области техники способами и включают неорганические соли, например соли натрия, кальция, аммония, железа или цинка и т.п., и соли органических оснований, в частности, образованные, например, аминами, такими как триэтаноламин, аргинин или лизин, пиперидин, прокаин и т.п. Кислотно-аддитивные соли включают, например, соли минеральных кислот, таких как, например, соляная кислота или серная кислота, и соли органических кислот, таких как, например, уксусная кислота или щавелевая кислота. Конечно, любые такие соли должны обладать практически идентичной активностью по отношению к IFNAB-BPI или IFNAB-BPII или их активным фракциям.
"Функциональные производные", которые используются по настоящему изобретению, охватывают производные IFNAB-BPI или IFNAB-BPII или производные их активных фракций и их мутеинов и слитых белков, которые могут быть получены из функциональных групп, встречающихся в виде боковых цепей в остатках либо N-либо С-концевых групп, в соответствии со способами, известными из области техники, и включаются в объем притязаний по настоящему изобретению до тех пор, пока они остаются фармацевтически приемлемыми, т.е. не нарушают активность белка, которая практически аналогична активности IFNAB-BPI, IFNAB-BPII, и не сообщают токсичных свойств содержащим их композициям. Указанные композиции могут, например, включать полиэтиленгликолевые боковые цепи, которые могут маскировать антигенные сайты и приводить к увеличению времени циркуляции IFNAB-BPI или IFNAB-BPII или их активных фракций в жидкостях организма. Другие производные включают алифатические сложные эфиры по карбоксильной группе, амиды по карбоксильной группе, получаемые реакцией с аммиаком или первичными или вторичными аминами, N-ацильные производные по свободной аминогруппе аминокислотных остатков с ацильными фрагментами (например, алканоильными или карбоксильными ароильными группами) или O-ацильные производные по свободным гидроксильным группам (например, остатков серила или треонила), образованные с ацильными фрагментами.
В качестве "активных фракций" IFNAB-BPI или IFNAB-BPII, мутеинов или слитых белков в настоящем изобретении рассматриваются любые фрагменты или предшественники полипептидной цепи молекулы белка, или слитые фрагменты, содержащие любые указанные фрагменты IFNAB-BPI или IFNAB-BPII, самостоятельно или в сочетании с молекулами или присоединенными к ним остатками, или агрегаты любых указанных выше молекул белка, при условии, что указанные фракции обладают практически такой же активностью, что IFNAB-BPI или IFNAB-BPII.
Настоящее изобретение относится также к фармацевтическим композициям, включающим фармацевтически приемлемый носитель и IFNAB-BPI или IFNAB-BPII по настоящему изобретению или их активные мутеины, слитые белки и их соли, функциональные производные или их активные фракции.
Фармацевтические композиции по настоящему изобретению получают путем смешивания IFNAB-BPI или IFNAB-BPII или их производных с физиологически приемлемым носителем, и/или стабилизирующей добавкой, и/или наполнителем и готовят в виде дозированной формы, например, лиофилизацией доз в пузырьках.
Способ введения может быть любым, известным для аналогичных средств, и зависит от состояния, подвергаемого лечению, в частности внутривенной, внутримышечной, подкожной или внутриочаговой инъекцией или местным применением или продолжительным вливанием и т.п. Количество назначаемого активного соединения будет зависеть от пути введения подвергаемого лечению заболевания и состояния пациента. Местная инъекция, например, требует меньшее количество белка по отношению к весу тела, чем внутривенное вливание.
Как указывается в заявке на выдачу патента Израиля 106591, белок, связывающий IFN-α/β (или как обозначено здесь IFNAB-BPII) ингибирует антивирусную активность IFN-α2, IFN-αB, IFN-αC и IFN-β, но не IFN-γ, что указывает на то, что IFNAB-BPI и IFNAB-BPII являются белками, связывающими интерфероны общего типа I. Таким образом, они полезны для модулирования или блокирования биологической активности различных подтипов IFN-α и IFN-β, например, при диабете I типа, различных аутоиммунных заболеваниях, при отторжении трансплантатов, СПИД и аналогичных заболеваниях, при которых наблюдается аномальная экспрессия IFN-α или IFN-β, т.е. IFNAB-BPI и IFNAB-BPII могут использоваться при любых состояниях, где избыток IFN-α или IFN-β либо эндогенно воспроизводится, либо вводится экзогенно.
Таким образом, IFNAB-BPI и IFNAB-BPII, их активные фракции, мутеины, слитые белки, функциональные производные и их активные фракции предназначены для лечения аутоиммунных болезней, других воспалительных заболеваний у млекопитающих, для устранения токсичности, вызванной назначением интерферона альфа или бета, для лечения ювенильного диабета, системной красной волчанки и СПИД.
Как указано ранее, белки по настоящему изобретению могут найти и нетерапевтическое применение, такое как очистка образцов интерферона типа I.
Под термином "антитело" подразумеваются поликлональные антитела, моноклональные антитела, химерные антитела, антиидеотипические антитела вплоть до антител, которые могут содержать метку в растворимой или связанной форме, а также их активные фракции, полученные по известным методикам, которые включают, не ограничиваясь, ферментативное расщепление, пептидный синтез или рекомбинантные методы.
Поликлональные антитела представляют собой гетерогенную популяцию молекул антител, выделяемых из сыворотки животных, которым введена антигенная вакцина. Моноклональное антитело включает практически гомогенную популяцию антител, специфичных к антигену, при этом указанная популяция содержит практически одинаковые эпитоп-связывающие фрагменты. Моноклональные антитела могут быть получены по методам, известным специалистам в данной области техники. См., например, публикацию Kohler and Milstein, Nature, 256: 495-497 (1975; патент США 4376110; монографии Ausubel et al., eds., см. выше, Harlow and Lane, ANTIBODIES: A LABORATORY MANUAL, Cold Spring Harbor Laboratory (1988) и Colligen et al., eds., Current Protocols in Immunology, Greene Publishing Assoc. and Wiley Inter science, N.Y. (1992, 1993), которые приводят здесь в качестве справочного материала. Указанные антитела могут быть представителями любого класса иммуноглобулинов, в том числе IgG, IgM, IgE, IgA, GILD, и любого их подкласса. Гибридома, воспроизводящая моноклональные антитела по настоящему изобретению, может быть выращена в условиях in vitro, in situ или in vivo. Продуцирование моноклональных антител с большим титром в условиях in situ или in vivo представляет собой предпочтительный способ продуцирования.
Химерными антителами являются молекулы, разные части которых происходят от разных видов животных, такие как содержащие гипервариабельный фрагмент, полученный из мышиных моноклональных антител, и константный фрагмент иммуноглобулина человека, Химерные антитела в основном используют для снижения иммуногенности и для увеличения выхода продуцирования, например, в том случае, когда мышиные моноклональные антитела могут быть с большим выходом получены из гибридов, но обладают большей иммуногенностью в организме человека, так что используют химерные человеческие/мышиные моноклональные антитела. Химерные антитела и способы их продуцирования известны из области техники (Cabilly et al., Proc. Natl. Acad. Sci. USA 81: 3273-3277 (1884);, Morrison et al., Proe. Natl. Acad. Sci. USA 81: 6851-6855 (1984); Boulianne et al., Nature 312: 643-646 (1984); Cabilly et al., заявка на выдачу Европейского патента 125023 (опубликована 14 ноября 1984); Neuberger et al., Nature 314: 268-270 (1985); Taniguchi et al., заявка на выдачу Европейского патента 171496 (опубликована 19 февраля 1985); Morrison et al., заявка на выдачу Европейского патента 125023 (опубликована 5 марта 1986); Neuberger et al., заявка на выдачу Международного патента WO 8601533 (опубликована 13 марта 1986); Kudo et al., заявка на выдачу Европейского патента 184187 (опубликована 11 июня 1986); Morrison et al., заявка на выдачу Европейского патента 173494 (опубликована 11 марта 1986); Sahagan et al., J. Immunol. 137: 1066-1074 (1986); Robinson et al., заявка на выдачу Международного патента WO 9702671 (опубликована 7 мая 1987); Liu et al., Proc. Natl. Acad. Sci. USA 84: 3439-3443 (1987); Sun et al., Proc. Natl. Acad. Sci. USA 84: 214-218 (1987); Better et al., Science 240: 1041-1043 (1988); и Harlow and Lane, ANTIBODIES: A LABORATORY MANUAL, см. выше. Указанные ссылки на литературные источники приведены здесь для справки.
Антиидиотипическое (анти-Id) антитело представляет собой антитело, которое распознает уникальные детерминанты, в основном связанные с антиген-связывающим фрагментом антитела. Антиидиотипическое антитело может быть получено путем вакцинации животного того же вида и генетического типа (например, штамм мыши), что и источник моноклонального антитела, с использованием моноклонального антитела, против которого вырабатывается антиидиотипическое антитело. Животное, подвергнутое вакцинации, распознает и реагирует на идиотипические детерминанты содержащегося в вакцине антитела, вырабатывая антитело против этих идиотипических детерминант (анти-Id антитело). См., например, патент США 4699880, который включен в данное описание во всей своей полноте в качестве ссылки.
Анти-Id антитело может использоваться также в качестве "иммуногена" с целью вызвать иммунный ответ у другого животного, при этом продуцируется так называемое анти-антиидиотипическое (анти-анти-Id) антитело. Анти-анти-Id антитело может быть эпитопно идентично исходному моноклональному антителу, которое индуцировало анти-Id антитело. Так, используя антитела по отношению к идиотипическим детерминантам моноклонального антитела, можно определить другие клоны, экспрессирующие антитела с идентичной специфичностью.
Таким образом, моноклональные антитела, генерированные против IFNAB-BPI, IFNAB-BPII и родственных им белков по настоящему изобретению, могут использоваться для индуцирования антиидиотипических антител в организмах подходящих животных, таких как мыши BALB/c. Клетки селезенки, взятые у таких мышей, подвергнутых вакцинации, используют для продуцирования антиидиотипических гибридов, секретирующих антиидиотипические моноклональные антитела. Более того, антиидиотипические моноклональные антитела можно связать с носителем, таким как гемоцианин моллюска (KLH), и дополнительно использовать для вакцинации мышей BALB/c. Сыворотка, взятая у этих мышей, будет содержать анти-антиидиотипические моноклональные антитела, специфичные для эпитопа IFNAB-BPI или IFNAB-BPII.
Антиидиотипические моноклональные антитела имеют, таким образом, идиотипические эпитопы, или "идиотопы", структурно похожие на исследуемый эпитоп, такой как IFNAB-BPI или IFNAB-BPII.
Также подразумевается, что термин "антитело" включает как неповрежденные (целые) молекулы, так и их активные фракции, такие как, например, Fab и F(ab')2, которые способны связывать антиген. У фрагментов Fab и F(ab')2 отсутствует фрагмент Fc неповрежденного антитела, они легче очищаются из кровообращения и могут обладать меньшим неспецифическим связыванием с тканями, чем целое антитело (Wahl et al., J. Nucl. Med. 24: 316-325 (1983)).
Очевидно, что Fab и F(аb')2 и другие фрагменты антител, полезных по настоящему изобретению, могут использоваться для определения и количественной оценки IFNAB-BPI, IFNAB-BPII и родственных белков в соответствии со способами, приведенными в настоящем описании для целых молекул антител. Указанные фрагменты обычно получают протеолитическим расщеплением, используя такие ферменты, как папаин (для получения фрагментов Fab) или пепсин (для получения фрагментов F(ab')2).
Как указывается, антитело "способно связывать" молекулу, если оно способно специфически взаимодействовать с молекулой, связывая тем самым молекулу с антителом. Под термином "эпитоп" подразумевается та часть любой молекулы, способной связываться антителом, которая может быть распознана указанным антителом. Эпитопы, или "антигенные детерминанты", обычно состоят из химически активных поверхностных группировок молекул, таких как аминокислоты или боковые цепи сахаров, и имеют специфические пространственные структурные характеристики, а также специфические характеристики зарядов.
"Антиген" - это молекула или часть молекулы, способная связываться антителом, которая дополнительно может индуцировать у животного продуцирование антитела, способного связываться с эпитопом этого антигена. Антиген может иметь один или несколько эпитопов. Специфическая реакция, о которой сказано выше, свидетельствует о том, что антиген будет реагировать высокоселективно с соответствующим ему антителом и не реагировать с большинством других антител, которые могут индуцироваться другими антигенами.
Антитела, включая фрагменты антител, полезных по настоящему изобретению, могут использоваться для количественного или качественного определения IFNAB-BPI, IFNAB-BPII или родственных белков в образце или для обнаружения клеток, которые экспрессируют указанные белки по настоящему изобретению. Это может быть осуществлено методами иммунофлюоресценции с использованием флуоресцентно меченого антитела (см. далее) в сочетании с применением оптического микроскопа, проточной цитометрии и флюориметрического обнарушения. Антитела (или их фрагменты), полезные по настоящему изобретению, могут применяться гистологически, как при иммунофлуоресцентной или иммуноэлектронной микроскопии, для in situ обнаружения IFNAB-BPI, IFNAB-BPII или родственных белков по настоящему изобретению. In situ обнаружение можно провести, взяв образец ткани у пациента и введя меченое антитело по настоящему изобретению в этот образец. Антитело (или фрагмент) преимущественно вводят путем нанесения или накладывания меченого антитела (или фрагмента) на биологический образец. При использовании этой процедуры становится возможным определить не только присутствие IFNAB-BPI, IFNAB-BPII или родственных белков, но и их распределение в исследуемых тканях. Используя настоящее изобретение, специалист должен понимать, что любые из большого числа гистологических методов (такие как методики окрашивания) могут быть модифицированы для проведения указанного обнаружения in situ.
Указанные методы анализа IFNAB-BPI, IFNAB-BPII или родственных белков по настоящему изобретению обычно заключаются в инкубировании биологического образца, такого как биологическая жидкость, экстракт ткани, свежесобранные клетки, такие как лимфоциты или лейкоциты, или клетки, которые подвергают инкубации в культуре ткани, в присутствии меченого обнаруживаемой меткой антитела, способного идентифицировать IFNAB-BPI, IFNAB-BPII или родственные белки, и в обнаружении антитела любым из многочисленных методов, хорошо известных в данной области.
Биологический образец можно нанести на твердую подложку или носитель, такой как нитроцеллюлоза, или на другую твердую подложку или носитель, который способен иммобилизовать клетки, частицы клеток или растворимые белки. Подложку или носитель затем можно промыть подходящими буферами, а затем обработать меченным обнаруживаемой меткой антителом в соответствии с настоящим изобретением. Твердая подложка или носитель может быть промыта буфером во второй раз для удаления несвязанного антитела. Количество связанной метки на указанной твердой подложке или носителе можно затем определить обычными способами.
Под терминами "твердофазная подложка", "твердофазный носитель", "твердая подложка", "твердый носитель", "подложка" или "носитель" подразумевается любая подложка или носитель, способные связывать антиген или антитела. Хорошо известными подложками или носителями являются стекло, полистирол, полипропилен, полиэтилен, декстран, нейлон-амилаза, природная и модифицированная целлюлоза, полиакриламиды, габр и магнетит. Для целей настоящего изобретения носитель по своей природе может быть как частично растворимым, так и нерастворимым. Материал подложки может иметь практически любую возможную структурную конфигурацию, обеспечивающую присоединение связанной молекулы к антигену или антителу. Так, конфигурация подложки или носителя может быть сферической, как шарик, или цилиндрической, как внутренняя поверхность пробирки или внешняя поверхность стержня. Или же поверхность может быть плоской, такой как лист бумаги, индикаторная бумага и т.п. Предпочтительными подложками или носителями являются полистирольные шарики. Специалистам в данной области техники известны многие другие подходящие носители для связывания антитела или антигена, либо же они могут подыскать подходящий носитель, используя рутинные эксперименты.
Активность связывания для данной серии антител в соответствии с настоящим изобретением может быть определена в соответствии с хорошо известными способами. Специалисты в данной области техники смогут выбрать оперативные и оптимальные условия проведения анализа для каждого определения, применяя рутинные способы эксперимента.
При проведении анализа могут быть добавлены другие операции, такие как промывка, перемешивание, встряхивание, фильтрование и т.п., что является обычным или необходимым в каждой конкретной ситуации.
Одним из способов, позволяющих пометить обнаруживаемой меткой антитело по настоящему изобретению, является связывание его с ферментом и применение иммуноферментного анализа (ИФА). В свою очередь указанный фермент, нанесенный на подходящую подложку, будет взаимодействовать с субстратом так, что образуется химический фрагмент, который может быть обнаружен, например, спектрофотометрически, флюориметрически или визуально. Ферментом, который может быть использован для того, чтобы пометить антитело обнаруживаемой меткой, является, не ограничиваясь, малатдегидрогеназа, стафилококковая нуклеаза, дельта-5-стероидизомераза, дрожжевая алкогольдегидрогеназа, альфа-глицерофосфатдегидрогеназа, триозофосфатизомераза, пероксидаза хрена, щелочная фосфатаза, аспарагиназа, глюкозооксидаза, бета-галактозидаза, рибонуклеаза, уреаза, каталаза, глюкозо-6-фосфатдегидрогеназа, глюкоамилаза и ацетилхолинэстераза. Определение можно провести колориметрическими способами, в которых используют хромогенный субстрат для фермента. Определение можно также провести визуальным сопоставлением степени протекания ферментативной реакции субстрата по сравнению с аналогично приготовленными стандартами.
Определение можно осуществить, используя многие другие иммуноанализы. Например, с помощью радиоактивной метки антител или фрагментов антител можно определить IFNAB-BPI или IFNAB-BPII, используя радиоиммуноанализ. Подходящую методику проведения радиоиммуноанализа можно найти в монографии Т.S.Work et. al., Laboratory Techniques and Biochemistry in Molecular Biology, North Holland Publishing Company, NY (1978), в частности в главе под названием "An Introduction to Radioimmune Assay and Related Techiques", которая приводится здесь в качестве ссылки. Радиоактивный изотоп может быть обнаружен с помощью счетчика гамма-излучения или сцинтилляционного счетчика или методом авторадиографии.
Можно также пометить антитело по настоящему изобретению с помощью флюоресцентного соединения. Если содержащее флюоресцентную метку антитело освещают светом с нужной длиной волны, то его присутствие затем можно обнаружить благодаря флюоресценции. Среди наиболее часто используемых для метки флюоресцентных соединений можно назвать изотиоцианат флюоресцеина, родамин, фикоэритрин, фикоцианин, аллофикоцианин, о-фталевый альдегид и флюорескамин.
Антитело можно также пометить обнаруживаемой меткой, используя флюоресцентные металлы, такие как 152Еu или другие лантаноиды. Эти металлы могут быть присоединены к антителу с использованием таких хелатирующих металлы групп, как диэтилентриаминпентауксусная кислота.
Антитело можно также пометить обнаруживаемой меткой путем присоединения к биотину. Биотинилированное антитело можно затем обнаружить авидином или стрептавидином, связанным с флюоресцентным соединением или с ферментом, таким как пероксидаза, или с радиоактивным изотопом и т.п.
Антитело можно также пометить обнаруживаемой меткой, связывая его с хемилюминесцентным соединением. Присутствие хемилюминисцентно меченого соединения затем определяют, обнаруживая появление люминесценции, которая возникает при протекании химической реакции. Примерами наиболее полезных соединений для хемилюминесцентной метки являются люминол, изолюминол, тероматический сложный эфир акридиния, имидазол, соль акридиния и сложный эфир щавелевой кислоты.
Аналогично, для метки антитела по настоящему изобретению можно использовать биолюминесцентное соединение. Биолюминесценция является разновидностью хемилюминесценции, которая проявляется в биологических системах, в которых каталитически активный белок увеличивает эффективность хемилюминесцентной реакции. Присутствие биолюминесцентного белка определяют, обнаруживая появление люминесценции. Важными биолюминесцентными соединениями, используемыми для введения метки, являются люциферин, люцифераза и акворин.
Молекула антитела по настоящему изобретению может быть адаптирована для использования в иммунометрическом анализе, известном также как "двухсайтный" или "сэндвичевый" анализ. В обычном иммунометрическом анализе некоторое количество не содержащего метку антитела (или фрагмента антитела) наносят на твердую подложку или носитель и добавляют некоторое количество меченого обнаруживаемой меткой растворимого антитела для того, чтобы осуществить определение и/или количественную оценку тройного комплекса, образованного между антителом на твердой фазе, антигеном и меченым антителом.
Типичный, и предпочтительный, иммунометрический анализ включает "прямые" анализы, в которых антитело, присоединенное к твердой фазе, вначале контактирует с исследуемым образцом для экстракции антигена из образца за счет образования бинарного комплекса антитело на твердой фазе - антиген. По истечении необходимого инкубационного периода твердую подложку или носитель промывают для удаления остатков жидкого образца, в том числе непрореагировавшего антигена, если он остался, а затем она взаимодействует с раствором, содержащим неизвестное количество меченого антитела (который функционирует как "молекула-репортер"). После второго инкубационного периода, в течение которого меченое антитело образует комплекс с антигеном, связанным с твердой подложкой или носителем с помощью не содержащего метку антитела, твердую подложку или носитель промывают второй раз для удаления непрореагировавшего меченого антитела.
В другом типе "сэндвичевого" анализа, который может быть также полезен для антигенов по настоящему изобретению, используются так называемые "одновременный" или "обратный" анализы. "Одновременный" анализ включает проведение одной стадии инкубации, во время которой антитело, связанное с твердой подложкой или носителем, и меченое антитело одновременно добавляются к исследуемому образцу. По завершении инкубации твердую подложку или носитель промывают для удаления остатков жидкого образца и меченого антитела, не образовавшего комплекс. Присутствие содержащего метку антитела, связавшегося с твердой подложкой или носителем, затем определяют как и в обычном "прямом" сэндвичевом анализе.
В "обратном" анализе последовательно добавляют к жидкому образцу вначале раствор меченого антитела, а затем не содержащее метку антитело, нанесенное на твердую подложку или носитель после соответствующего инкубационного периода. После второй инкубации твердую фазу промывают обычным образом, чтобы освободить ее от остатков исследуемого образца и раствора непрореагировавшего меченого антитела. Определение содержащего метку антитела, связанного с твердой подложкой или носителем, затем проводят так же, как в "одновременном" и "прямом" анализах.
Настоящее изобретение относится также к молекулам ДНК, кодирующим любые белки по настоящему изобретению, как указано ранее, реплицируемые экспрессирующие носители, содержащие любую из указанных молекул ДНК, клетки-хозяева, трансформированные с помощью любого из указанных носителей экспрессии, включая прокариотические, эукариотические и клетки-хозяева, преимущественно клетки COS обезьяны.
Изобретение относится также к способу получения любого белка по настоящему изобретению путем культивирования трансформированных клеток в соответствии с настоящим изобретением и выделения белка, кодируемого молекулой ДНК и носителем экспрессии в указанных трансформированных клетках-хозяевах.
Изобретение далее иллюстрируется следующими примерами, не ограничивающими настоящее изобретение.
Пример 1. Секвенирование (определение аминокислотной последовательности) белка IFNAB-BPII, выделенного из мочи
Чистый IFNAB-BP, полученный, как указано в заявке на выдачу патента Израиля 106591, наносили на мембрану из поливинилдифторида (Pro-Spin, "Applied Biosystems", США) и мембрану подвергали секвенированию на микроанализаторе модели 475 ("Applied Biosystems", США). Получена следующая главная последовательность:

Далее, определяли второй полипептид, содержащий три дополнительных аминокислотных остатка (Ile-xxx-Tyr) на N-конце основной последовательности (ххх обозначает неидентифицированную аминокислоту). Полученная последовательность полностью отличается от уже известного рецептора IFN-B (IFNAR, ссылка 14), и она отлична от любого известного белка. Она отличается также от любого белка, кодируемого известной ДНК последовательностью, что установлено поиском в базах данных Swissprot и Genebank с использованием программы FastA (33). Таким образом, этот белок является новым белком, связывающим IFN-α. Методом выделения клонов кДНК (см. далее) было установлено, что остаток 10 представляет собой Cys, а не Arg, а остаток 15 представляет собой Ser, а не Arg. Более того, ххх идентифицирован как Ser. Известно, что Cys нельзя определить с помощью микроанализатора аминокислотной последовательности, а Ser иногда разрушается при проведении анализа, а потому его нельзя определить.
Образец IFNAB-BP, выделенного из мочи, ферментировали с помощью CNBr, разделяли на SDS-PAGE и наносили в виде пятна на мембрану из поливинилендифторида. На мембране после окрашивания с помощью Кумасси синего выделяли семь отдельных пептидных полос, обозначенных как cbl-cb7. Каждую полосу иссекали и подвергали микросеквенированию. Один из этих пептидов, cb7, имеет массу меньше 10000 и дает следующую внутреннюю последовательность (реальная последовательность начинается с Met):

Другой пептид, cb3, имеет следующую последовательность (реальная последовательность начинается с Met):

Остаток 13 позднее идентифицирован как Cys, как определено из последовательности кДНК (см. ниже). Остатки Cys нельзя идентифицировать при проведении микросеквенирования белка.
Другой пептид, сb6, имеет следующую последовательность (реальная последовательность начинается с Met):

Остаток 4 позднее был идентифицирован как Asn, что определено из последовательности кДНК (см. ниже). Этот остаток Asn является частью потенциальной сигнальной последовательности гликозилирования (Asn-Phe-Thr), и отсутствие сигнала Asn в последовательности белка указывает на то, что он действительно подвергнут гликозилированию.
В другом пептиде полосы были идентифицированы с помощью секвенирования в виде продуктов неполной ферментации под действием CNBr. Они имеют последовательность либо N-концевого участка, ранее определенного для IFNAB-BP, или ту же самую внутреннюю последовательность, что и сb3, сb6 или cb7.
Пример 2. Секвенирование С-концевого пептида IFNAB-BPII, выделенного из мочи
Образец FNAB-BPII, выделенного из мочи (приблизительно 10 мкг), восстанавливали с помощью ДДТ, алкилировали йодацетамидом и подвергали ферментации с эндопротеиназой Lys С ("Boehringer Mannheim", Германия) в соотношении фермент-субстрат, равном 1:50. Полученную смесь пептидов разделяли с помощью жидкостной хроматографии высокого давления с обращенной фазой на колонке с RP18 (Aquapore RP18, "Applied Biosystems Inc."), применяя градиент ацетонитрила в 0,1%-ном водном растворе трифторуксусной кислоты. Индивидуальные пики пептидов связывали ковалентно с мембранами Sequalon AA ("Millipore", Bedford, штат Массачусетс) и подвергали секвенированию N-концевой последовательности, как указано ранее. Один из пептидов идентифицирован как С-концевой пептид, имеющий следующую последовательность:
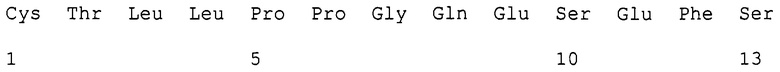
С-концевая последовательность соответствует последовательности клона кДНК размером 4,5 тыс. нуклеотидов (см. далее), и ее можно отличить от предполагаемого белка, кодируемого кДНК размером 1,5 тыс. нуклеотидов, с помощью двух последних аминокислотных остатков (Phe12-Ser13 вместо Ser-Ala). Таким образом, растворимый рецептор, выделенный из мочи, идентифицирован как IFNAB-BPII. Он независимо транслируется из специфической мРНК размером 4,5 тыс. нуклеотидов и не образуется при распространении рецептора поверхности клетки.
Пример 3. Конструирование вырожденных смыслового и антисмыслового праймеров и идентификация невырожденной последовательности IFNAB-BP кДНК
Последовательность пептида cb7 обратно транслировали в смысловой (аминокислоты 1-8) и антисмысловой (аминокислоты 27-20) праймеры. Декануклеотиды и нонануклеотиды, включающие последовательности рестрикции эндонуклеазы ВаmН I и Sal I, соответственно, добавляют к 5'-концам олигонуклеотидов праймера (фиг.1,А). Полную РНК экстрагировали из клеток Дауди и клеток WISH и первую цепь кДНК генерировали обратной транскриптазой, используя в качестве праймера либо смесь антисмысловых олигонуклеотидов, либо олиго-d(Т). Полученный фрагмент кДНК амплифицировали с помощью полимеразной цепной реакции (PCR), используя совместно смысловые и антисмысловые праймеры вырождения. Анализ продуктов PCR на 3%-ном агарозном геле показал ожидаемую полосу размером 101 пар нуклеотидов, полученную с помощью кДНК как из клеток Дауди, так и клеток WISH (фиг.1,В). Фрагмент размером 101 пар нуклеотидов отрезали с помощью ВаmН I и Sal I, клонировали на pBluescript II KS ("Stratagene") и секвенировали 5 клонов. Последовательность участка, фланкированного смысловыми и антисмысловыми праймерами, инвариантна и кодирует ожидаемую последовательность аминокислотных остатков 9-19 пептида cb7 (фиг.1,С). Затем синтезировали олигонуклеотид размером 35 пар нуклеотидов, соответствующий невырожденной внутренней последовательности, и использовали его для скрининга библиотек кДНК.
Пример 4. Идентификация частичных клонов кДНК IFNAB-BPI
Синтетический невырожденный олигонуклеотид размером 35 пар нуклеотидов по примеру 2 метили с помощью [32P] и использовали для скрининга библиотеки лямбда gt11 кДНК клеток человека HeLa ("Clontech"). Идентифицированы пять положительных клонов. Один из этих клонов, обозначенный q10, содержит вставку размером 1,4 тыс. нуклеотидов. Секвенирование клона ql0 позволяет выделить последовательность, содержащую открытую рамку считывания генетической информации, в которой идентифицированы сигнальный пептид, внеклеточная область, трансмембранная область и часть внутриклеточной области (фиг.2). Последовательности ДНК, кодирующие N-концевую последовательность белка, а также первичную структуру трех CNBr пептидов сb3, сb6 и cb7 IFNAB-BP, выделенного из мочи, идентифицировали с помощью внеклеточной области, кодируемой ДНК клона ql0. Некоторые остатки Cys и Ser (не подчеркнуты, фиг.2) не были корректно определены в процессе секвенирования белка. Тем не менее известно, что методы, используемые при секвенировании белка, не позволяют назвать остатки Cys, а часто теряются и остатки Ser. Не были также определены остатки Asn в пептиде cb6, что указывает на то, что он подвергнут гликозилированию. Сравнение последовательности ДНК клона ql0 с базой данных Genbank не выявляет идентичности с какой-либо известной последовательностью. Таким образом, клон содержит новую последовательность ДНК.
Пример 5. Нозерн-блоттинг мРНК человека
Зонд ДНК, содержащий радиоактивную метку, получали из клона q10 и использовали для гибридизации по методу нозерн-блоттинга поли-A+ мРНК от двух клеточных линий человека: Дауди и WISH. В обоих случаях наблюдали две специфические полосы, одну, соответствующую 1,5 тыс. нуклеотидов, и вторую, соответствующую 4,5 тыс. нуклеотидов. На основе интенсивности полос оценивали, что количество мРНК размером 1,5 тыс. нуклеотидов приблизительно вдвое превышает количество мРНК размером 4,5 тыс. нуклеотидов. Сигнал, полученный от РНК из клеток WISH, едва различим, в то время как сигнал РНК из клеток Дауди (фиг.3) хорошо заметен. мРНК размером 1,5 тыс. нуклеотидов транслировали в предшественник IFNAB-BPII, который является рецептором интерферона на поверхности клетки. Более длинная мРНК представляет собой другую матрицу, кодирующую отличный белок, у которого совпадает с IFNAB-BPI по крайней мере 100 аминокислотных остатков. Указанный белок является предшественником IFNAB-BPII, который, как позднее показано, является рецептором интерферона-α/β.
Пример 6. Идентификация клонов полной кДНК IFNAB-BPI И IFNAB-BPII
Библиотека моноцитарных кДНК, сконструированная в фаге λpCEV9 (J.S.Gutkind et al., Molec. Cell. Biol. 1991, Vol. 11, pp. 1500-1507), подвергается затем скринингу зондом размером 397 пар нуклеотидов, полученным с помощью PCR от кодирующего фрагмента клона q10. Было выделено 22 клона со вставкой размером 1,5 тыс. нуклеотидов и два клона со вставкой размером 4,5 тыс. нуклеотидов от 10 независимых фагов. Проводили анализ последовательности ДНК двух клонов размером 1,5 тыс. нуклеотидов (λpCEV9-m6 и λpCEV9-m24), а также полной открытой рамки считывания генетической информации двух клонов размером 4,5 тыс. нуклеотидов (λpCEV9-ml9 и λpCEV9-m27). Клоны размером 1,5 тыс. нуклеотидов кодировали полный предшественник IFNAB-BPI, который является рецептором на поверхности клетки, с открытой рамкой считывания генетической информации размером 331 кодон (фиг.4). Белок и пептидные последовательности CNBr, полученные из IFNAB-ВР, выделенного из мочи (подчеркнут пунктиром, фиг.4), идентифицировали транслированной последовательностью ДНК. Частичное секвенирование двух клонов размером 4,5 тыс. нуклеотидов оснований выявило ту же 5' последовательность из 237 кодонов, что и содержащаяся в клонах размером 1,5 тыс. нуклеотидов, за которой следует другая последовательность, включающая сигнал терминации после кодона 239 (фиг.5). В общем, различаются следующие кодоны: кодон 13 (Leu вместо His); кодон 108 (Thr вместо Не) и кодоны 238-240 (Phe-Ser-Stop вместо Ser-Ala-Ser). Ни в одной из трех рамок считывания генетической информации в обоих клонах размером 4,5 тыс. нуклеотидов после стоп-кодона не было найдено ни одной открытой рамки считывания генетической информации. Следовательно, клоны кДНК размером 4,5 тыс. нуклеотидов кодируют предшественник усеченного растворимого рецептора, который представляет собой IFNAB-BPII, идентичный по своей С-концевой последовательности рецептору, выделенному из мочи. Две мРНК, кодирующие предшественники обоих белков, как IFNAB-BPI, так и IFNAB-BPII, получают из того же гена, вероятно путем альтернативного сплайсинга.
Пример 7. Конструирование вектора экспрессии млекопитающего и продуцирование рекомбинантных растворимых IFNAB-BPI и IFNAB-BPII
ДНК, кодирующую сигнальную последовательность и внеклеточную область IFNAB-BPI, генерировали путем PCR с помощью VENT ДНК полимеразы ("Stratagene"), используя синтетические смысловые и антисмысловые праймеры, содержащие сайты рестрикции Xba I (фиг.6,А), и используя в качестве матрицы q10 ДНК. Полученный в результате PCR продукт (фиг.6,В) разрезают с помощью Xba I и лигируют с вектором экспрессии pEF-BOS, получая pEF-BOS-sABR (фиг.6,С, ссылка 46). Генетическая конструкция подтверждается секвенированием ДНК. Способные к трансформации E.coli трансформировали и выделяли клоны, содержащие последовательность IFNAB-BPI в нужной ориентации. Для трансфекции клеток COS обезьяны использовали генетическую конструкцию pEF-BOS-sABR. Указанные клетки экспрессировали 12 нг/мл рекомбинантного растворимого IFNAB-BPI, который получали из супернатанта клеточной культуры, как определено методом ELISA (твердофазного иммуноферментного анализа) и по его способности ингибировать биологическую (антивирусную) активность альфа и бета интерферонов человека. Аналогично, фрагмент ДНК, кодирующий IFNAB-BPII в клоне размером 4,5 тыс. нуклеотидов, вводят в вектор, способный экспрессироваться в клетках млекопитающего, как это описано для внеклеточной области IFNAB-BPI, и используют для трансформации клеток. Эти клетки продуцируют активный IFNAB-ВРII, который секретируется в среду выращивания указанных клеток.
Пример 8. Конструирование эукариотических экспрессирующих векторов и экспрессия IFNAB-BPI и IFNAR в мышиных клетках.
ДНК, кодирующую полный IFNAB-BPI, генерировали путем PCR с помощью VENT ДНК полимеразы ("Stratagene"), используя синтетические смысловые и антисмысловые праймеры, содержащие сайты рестрикции Хbа I и используя в качестве матрицы плазмиду pCEV9-m6. Полученный в результате PCR продукт разрезали с помощью Хbа I и сшивали с вектором экспрессии pEF-BOS, получая pEF-BOS-IFNABR. кДНК, соответствующую IFNAR (14), генерировали с помощью RT-PCR (48), используя специфические олигонуклеотиды. Амплифицированный продукт клонировали в сайт рестрикции Хbа I вектора экспрессии pEF-BOS (46), получая pEF-BOS-IFNAR. Указанная генная конструкция подтверждается секвенированием ДНК. Способные к трансформации E.coli трансформировали и выделили клоны, содержащие последовательности IFNAB-BPI и IFNAR в нужной ориентации.
Получали мышиные клетки, устойчиво экспрессирующие клонированные кДНК IFNAB-BPI. Экспоненциально растущие клетки NIH-3T3 (1,5×106 на чашках размером 10 см) подвергали совместной трансфекции методом осаждения фосфатом кальция (49) вместе с pSV2neo (2 мкг) и pEF-BOS-IFNABR (10 мкг ДНК). Независимо идентифицировали и субклонировали колонии, резистентные к G418. Клоны, экспрессирующие высокие уровни IFNAB-BPI, идентифицировали путем связывания антитела против IFNAB-BPI, выделенного из мочи, и путем связывания 125I-IFN-α2 (таблица IV).
Для связывания анти-IFNAB-BPII антител клетки (1×106) высевали в лунки размером 35 мм (планшеты с 6 лунками "Costar") и выращивали до слияния (20 ч). Клетки промывали с помощью модифицированной по способу Дульбекко средой Игла, содержащей 2% фетальной телячьей сыворотки и 0,1% азида натрия (среда Воша) с последующим инкубированием в течение 20 мин со средой Воша. Антитела анти-IFNAB-BPII кролика (2 мл, 1:500 в среде Воша) добавляли к промытым клеткам и клетки инкубировали в течение 2 ч при комнатной температуре. Клетки промывали 3 раза, добавляли 125I-белок А (2 мл, 250000 импульсов в минуту в среде Воша) и клетки дополнительно инкубировали в течение 45 минут. Клетки промывали 3 раза, собирали с помощью трипсина и проводили подсчет.
Для связывания 125I-IFN-α2 клетки (1×106) высевали в лунки размером 35 мм (планшеты с 6 лунками, "Costar") и выращивали до слияния (20 ч). Клетки промывали с помощью модифицированной по способу Дульбекко средой Игла, содержащей 2% фетальной телячьей сыворотки и 0,1% азида натрия (среда Воша) с последующим инкубированием в течение 20 мин со средой Воша. Добавляли 125I-IFN-α2 (2-3×105 импульсов в минуту, 108 единиц/мг, 5×107 импульсов в минуту) и инкубировали еще в течение 2 ч при комнатной температуре. Клетки промывали 3 раза, собирали с помощью трипсина и проводили подсчет.
После экстрагирования позитивных клонов (в частности, клона 369.11) с помощью детергента в невосстанавливающих условиях методом SDS-PAGE с последующим иммуноблоттингом с указанным выше антителом получали сильную полосу с массой приблизительно 51 кДа (фиг.7).
Мышиные клетки, экспрессирующие IFNAR, получали аналогично путем трансфекции плазмидой pEF-BOS-IFNAR. Клон № 470.6 является IFNAR-позитивным, что определяют по способности IFN-αB человека эффективно стимулировать антивирусную ответную реакцию в указанных клетках. Как и ожидалось, другие интерфероны типа I (в частности, IFN-α) не активны в клоне 470.6.
В клоны 369.11 и 470.6, экспрессирующие IFNAB-BPI и IFNAR, методом трансфекции вводили белок комплементарного рецептора (pEF-BOS-IFNAR и pEF-BOS-IFNABR соответственно). С целью достижения устойчивой совместной экспрессии в клоны, резистентные к G418, экспрессирующие либо IFNAR либо IFNAB-BPI, методом трансфекции вводят pSV2hydro (2 мкг) совместно или с pEF-BOS-IFNABR, или pEF-BOS-IFNAR, как указано ранее. Выделяли и субклонировали клоны, резистентные к гигромицину и G418, которые совместно экспрессируют как IFNAR, так и IFNAB-BPI. IFNAR-позитивные клоны, полученные из клона 369.11, идентифицируют по их антивирусному отклику по отношению к IFN-αB человека, в то время как IFNAB-BPI-позитивные, полученные из клона 470.6, идентифицируют путем связывания антител анти-IFNAB-BPII и 125I-IFN-α2. Клон 508.12, полученный из клона 369.11, и клон 1306, полученный из клона 470.6, связывают как 125I-IFN-α2, так и антитело IFN-α/αR (Таблица IV). Далее, они дают ответную реакцию на интерферон IFN-αB человека в антивирусном анализе. Таким образом, был сделан вывод, что эти клоны экспрессируют как IFNAB-BPI, так и функциональный IFNAR.

Пример 9. Определение сродства IFNAB-BPI и IFNAR, экспрессированных в мышиных клетках
Клоны, экспрессирующие либо IFNAR, либо IFNAB-BPI, исследовали на связывание 125I-huIFN-α2 и данные по связыванию оценивали с помощью анализа Скэтчарда. Клетки (1×106) высевали в лунки размером 35 мм (планшеты с 6 лунками, "Costar") и выращивали до слияния (20 ч). Клетки промывали с помощью модифицированной по способу Дульбекко средой Игла, содержащей 2% фетальной телячьей сыворотки и 0,1% азида натрия (среда Воша) с последующим инкубирвоанием в течение 20 мин с той же средой. Добавляли 125I-IFN-α2 (2-3×105 импульсов в минуту, 10 единиц/мг, 5×107 импульсов в минуту) вместе с указанными концентрациями не содержащего метку IFN-α2 и инкубирование продолжали еще в течение 2 часов при комнатной температуре. Клетки промывали 3 раза, собирали с помощью трипсина и проводили подсчет. Результаты теста по связыванию обрабатывали, используя программу LIGAND (50).
Клетки, экспрессирующие только IFNAR (клон 470.6), не обладают способностью специфически связываться с 125I-IFN-α2 (фиг.8), и, следовательно, нельзя получить значений Кd. этих предполагаемых сайтов связывания. Напротив, для клонов 470.6 наблюдается сильное, специфическое связывание вплоть до насыщения с клетками, экспрессирующими только IFNAB-BPI (клон 369.11). Значения Kd для этого связывания составляет 3,6×10 М при температуре 23°С (таблица V).
Связывание 125I-IFN-α2 с клетками 508.12 (экспрессирующим как IFNAB-BPI, так и IFNAR) оценивали по методу Скэтчарда и результаты сравнивали с результатами, полученными для клона 369.11 (экспрессирующего лишь IFNAB-BPI). При совместной экспрессии IFNAB-BPI и IFNAR получали связывание до насыщения и сродство по отношению к IFN-α2 увеличивается приблизительно в 10 раз (фиг.8), достигая значения, характерного для рецептора клеток Дауди (Kd=4,0×10-10 М по сравнению с 1,6×10-10 М соответственно, таблица V). Полученные результаты указывают, что IFNAR и IFNAB-BPI взаимодействуют при связывании лиганда.
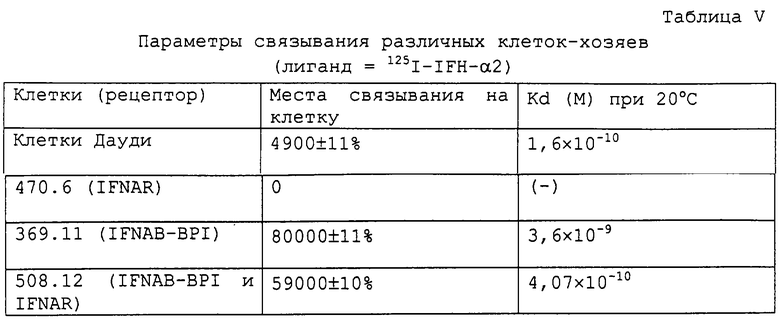
Пример 10. Определение сродства IFNAB-BPII, выделенного из мочи
IFN-α2 человека иммобилизовали на чувствительном элементе BIAcore ("Pharmacia", Швеция) по автоматизированной методике, разработанной поставщиком. Иммобилизуют приблизительно 30 фмол IFN-α2. Выделенный из мочи IFNAB-BPII, разведеный забуференным фосфатом физиологическим раствором (PBS) с целью получения нескольких концентраций (28-112 нМ), пропускали через сенсограмный чип и регистрировали степень ассоциации и диссоциации (в PBS). Из полученных результатов рассчитывали значение Kd, равное 2,12×10-9 М (фиг.9). Таким образом сродство IFNAB-BPII, выделенного из мочи, весьма напоминает сродство IFNAB-BPI, экспрессированного в клетках-хозяевах.
Пример 11. Экспрессия IFNAB-BPI и IFNAB-BPII в E.coli, дрожжевых клетках и клетках насекомых.
IFNAB-BPI и IFNAB-BPII продуцируются также дополнительными рекомбинантными клетками, такими как прокариотические клетки, в частности E.coli, или другими эукариотическими клетками, такими как дрожжевые клетки и клетки насекомых. Хорошо известные способы вполне подходят для конструирования подходящих векторов, несущих ДНК, которая кодирует либо IFNAB-BPI, либо IFNAB-BPII или их активные фракции, пригодных для трансформирования клеток E.coli и дрожжевых клеток или для инфицирования клеток насекомых, с целью воспроизводства рекомбинантного IFNAB-BPI или IFNAB-BPII. Для экспрессии в дрожжевых клетках вырезали ДНК, кодирующую IFNAB-BPI или IFNAB-BPII (примеры 5 и 6), и вводили в вектор экспрессии, подходящий для трансфекции дрожжевых клеток. Для экспрессии в клетках насекомых ДНК, кодирующую IFNAB-BPI или IFNAB-BPII, вставляли в бакуловирус и инфицировали клетки насекомых указанным рекомбинантным бакуловирусом. Для экспрессии в E.coli ДНК, кодирующую как IFNAB-BPI, так и IFNAB-BPII, подвергали сайт-направленному мутагенезу, используя подходящие олигонуклеотиды, так что инициирующий кодон ATG встраивали непосредственно перед первым кодовом зрелого IFNAB-BPI (фиг.2) или IFNAB-BPII. По другому способу такую ДНК можно получить методом PCR, используя подходящие смысловые и антисмысловые праймеры. Полученные конструкции кДНК затем встраивали в подходящим образом сконструированные прокариотические векторы экспрессии, применяя методы, хорошо известные из области техники (35).
Пример 12. Конструирование рекомбинантных слитых белков IFNAB-BPI и IFNAB-BPII
Продуцирование белков, содержащих либо лиганд-связывающую область IFNAB-BPI, либо IFNAB-BPII, слитые с постоянным участком тяжелой цепи IgG1, может быть осуществлено следующим образом: ДНК IFNAB-BPI или IFNAB-BPII подвергают сайт-направленному мутагенезу, используя подходящие олигонуклеотиды, так что уникальный сайт рестрикции встраивается непосредственно перед и после последовательностей, кодирующих внеклеточные лиганд-связывающие области. По другому способу такая ДНК может быть получена методом PCR при использовании специально сконструированных праймеров, несущих сайты рестрикции. Другая плазмида, включающая постоянный участок тяжелой цепи IgG1, в частности pRKC042Fcl (47), подвергается аналогичному сайт-направленному мутагенезу с целью встраивания того же уникального сайта рестрикции как можно ближе к Asp 216 тяжелой цепи IgG1, так что он позволяет осуществить согласованную по фазе трансляцию слитого белка. Фрагмент двухцепочечной ДНК, включающий нетранслированные последовательности в 5'-направлении и кодирующий либо IFNAB-BPII, либо лиганд-связывающую область IFNAB-BPI, получают расщеплением по уникальному сайту рестрикции. Подвергнутая мутации pRKC042Fcl расщепляется аналогичным образом с образованием большого фрагмента, содержащего плазмиду и последовательности IgGI. Два этих фрагмента затем связывают, получая новую плазмиду, кодирующую предшественник полипептида, включающий либо IFNAB-BPII, либо лиганд-связывающую область IFNAB-BPI и приблизительно 227 С-концевых аминокислот тяжелой цепи IgG1 (участок петли и области СН2 и СН3). ДНК, кодирующая слитые белки, может быть выделена из плазмиды посредством расщепления с использованием подходящих ферментов рестрикции, а затем вставлена в эффективные прокариотические или эукариотические векторы экспрессии.
Пример 13. Конструирование рекомбинантных белков слияния IFNAB-BPI и IFNAB-BPII совместно с IFNAR
Продуцирование белков, содержащих внеклеточную область либо IFNAB-BPI, либо IFNAB-BPII, слитую с постоянным участком тяжелой цепи IgG1, может быть осуществлена, как описано в примере 12.
Продуцирование белка, содержащего внеклеточную область IFNAR, слитую с постоянным участком легкой цепи IgG1, может быть осуществлено аналогично. Эукариотический вектор экспрессии, кодирующий либо лиганд-связывающую область IFNAB-BPI, слитую с постоянным участком тяжелой цепи IgG1, или IFNAB-BPII, слитый с постоянным участком тяжелой цепи IgG1, используют для совместной трансфекции подходящих клеток-хозяев млекопитающих вместе с эукариотическим вектором экспрессии, кодирующим внеклеточную область IFNAR, слитую с постоянным участком легкой цепи IgG1. Положительные трансфектанты секретируют сложный белок, включающий постоянные участки IgG1, внеклеточную область IFNAR, которая замещает изменяемые участки легких цепей IgG1, и либо IFNAB-BPII, либо лиганд-связывающую область IFNAB-BPI, замещающую изменяемые участки тяжелых цепей IgG1.
В другом примере постоянные области тяжелых и легких цепей переключаются, а именно: внеклеточная область IFNAR сливается с постоянными областями тяжелой цепи IgG2, в то время как лиганд-связывающую область либо IFNAB-BPI, либо IFNAB-BPII сливают с постоянными участками легких цепей IgG2.
Исходя из результатов примера 9, можно ожидать, что указанные слитые белки будут проявлять приблизительно в 10 раз более высокое сродство по отношению к IFN-α по сравнению с IFNAB-BPI или IFNAB-BPII.
Пример 14. Получение поликлональных антител к IFNAB-BP
Кроликам первоначально вводили подкожно 5 мкг чистого препарата IFNAB-BP, выделенного из мочи, эмульгированного в полном адъюванте Фрейнда. Через три недели им снова подкожно вводили 5 мкг препарата в неполном адъюванте Фрейнда. Через интервалы в 10 дней вводят дополнительно 4 инъекции в виде раствора в PBS. Через 10 дней после последней иммунизации у кроликов берут кровь на анализ. За изменением уровня содержания антител следят с методом твердофазного радиоиммунного анализа, используя поливинилхлоридные 96-луночные планшеты, покрытые в течение ночи при 4°С с помощью IFNAB-BP (1 мкг/мл) в забуференном фосфатом физиологическом растворе (PBS). Планшеты затем в течение ночи при температуре 4°С блокировали бычьим сывороточным альбумином (0,5%), Tween 20 ("Sigma", США, 0,05%) в PBS. Планшеты подвергали взаимодействию с пятикратно разведенной имунной сывороткой (антисывороткой) кролика в течение 4 ч при комнатной температуре, промывали и подвергали взаимодействию с 125I-белком А (105 распадов в минуту на лунку) в течение 35 мин при комнатной температуре в PBS. Затем планшеты промывали; отдельные лунки отрезали и проводили подсчет. Титр рассчитывали как обратную величину максимального разбавления, которое дает число импульсов, в десять раз большее, чем антисыворотка. Титр после 5 инъекций составляет более 1:60000.
За развитием уровня содержания антитела следят также по способности антисыворотки блокировать антивирусную активность IFN-α2 человека. Предварительно приготовленные монослои клеток WISH человека на планшетах, содержащих 96 лунок, инкубировали с вдвое разведенными растворами антисыворотки, начиная с разведения 1:250 в ячейке с номером 1, в течение 1 ч при температуре 37°С. Затем добавляли IFN-α2 (10 ед./мл, конечная) и через 1 ч при температуре 37°С в ячейки вводили вирус везикулярного стоматита. Титр нейтрализации после 7 иммунизаций составлял 120000 антивирусных ед./мл.
Пример 15. Получение моноклональных антител к IFNAB-BP
Самкам мышей Balb/C (в возрасте 3 месяца) вначале подкожно вводили 2 мкг очищенного IFNAB-BP в виде эмульсии в полном адъюванте Фрейнда, а через три недели - подкожно в неполном адъюванте Фрейнда. С интервалом в 10 дней вводили подкожно дополнительно 3 инъекции в PBS. Методом твердофазного радиоиммунного анализа определяли титр связывания, равный 1:60000 (см. пример 9). Конечные повторные вакцинации проводили внутрибрюшинно за 4 и 3 дня до слияния для мыши, показывающей наибольший титр связывания. Слияние проводят с использованием NSO/1 клеточной линии миеломы и лимфоцитов, полученных как из селезенки, так и лимфатических узлов животного, являющегося партнером при осуществлении слияния. Слитые клетки распределяли в микрокультуральных планшетах и отбирали гибридомы в модифицированной по способу Дульбекко среде Игла, в которую дополнительно добавлен гипоксантин-аминоптерин-тимидин и 15% сыворотки лошади. Гибридомы, которые, как было выявлено, продуцируют антитела к IFNAB-BP, субклонировали по методу ограниченного разведения и вводили мышам Balb/C, которых примировали пристаном для продуцирования асцитов. Изотипы антител определяют, используя коммерчески доступный набор для ELISA ("Amersham", Великобритания).
Отбор гибридом, продуцирующих анти-IFNAB-BP моноклональные антитела, проводили следующим образом: супернатанты гибридом исследовали на присутствие анти-IFNAB-BP антител методом обращенного твердофазного радиоиммунного анализа (IRIA). Полихлорвиниловые микротитровальные планшеты ("Dynatech Laboratories", Александрия, штат Вирджиния) покрывали очищенными методом аффинной хроматографии козьими антителами анти-мышиной сыворотки F(ab)2 ("Jackson Labs", США) (10 мкг/мл, 100 мкл на лунку). После инкубирования при температуре 4°С в течение ночи планшеты промывали дважды PBS, содержащим бычий сывороточный альбумин (0,5%) и Tween 20 (0,05%), и блокировали в промывочном растворе при температуре 37°С в течение по крайней мере 2 ч. Добавляли супернатант культуры гибридомы (100 мкл на лунку) и планшеты инкубировали в течение 4 ч при температуре 37°С. Затем пластины три раза промывали промывочным раствором и добавляли 125I-IFNAB-BP (100 мкл, 105 импульсов в минуту), вновь инкубируя в течение 16 ч при температуре 4°С. Планшеты промывали 3 раза и отдельные лунки отрезали и проводили подсчет, используя счетчик гамма-частиц. Образцы, которые дают количество импульсов, которое по крайней мере в 5 раз выше, чем значения для отрицательного контрольного образца, считаются положительными (таблица VI). Отбирали пять положительных клонов, подвергали их субклонированию для проведения дальнейших исследований и охарактеризовывали. Все клоны представляют собой изотип IgG1.
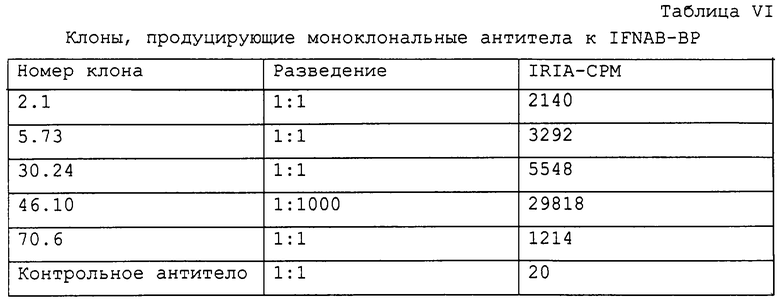
Пример 16. Аффинная хроматография IFNAB-BP с моноклональными антителами
Антитела против IFNAB-BP использовали для очистки IFNAB-BP аффинной хроматографией. В данном примере для аффинной хроматографии использовали моноклональное антитело №5.73. Асцитную жидкость, содержащую моноклональное антитело, секретируемое гибридомой №5.73, очищали осаждением сульфатом аммония при 50%-ном насыщении с последующим экстенсивным диализом относительно PBS. Около 10 мг иммуноглобулинов связывали с 1 мл Affigel 10 ("Bio-Rad", США) по методике, рекомендованной изготовителем.
250 мл белков, выделенных из мочи человека (эквивалентно 250 л неочищенной мочи), наносили на 0,5 мл колонку с антителом анти-IFNAB-BP при температуре 4°С со скоростью потока 0,25 мл/мин. Колонку промывали PBS до тех пор, пока в промывных водах не обнаруживали белка. IFNAB-BP элюировали 25 мМ буферного раствора, содержащего лимонную кислоту, с рН 2,2 (8×1 фракции объема колонки) и немедленно нейтрализовали 1 М раствором карбоната натрия. Анализ SDS PAGE по окрашиванию серебром элюированных фракций выявляет основную полосу с молекулярной массой 40000 Да. Дальнейшую очистку этого препарата проводили с помощью хроматографии по размеру молекул.
Пример 17. ELISA (твердофазный иммуноферментный) анализ IFNAB-BPII
Титрационные микропланшеты (Dynatech или Maxisorb) покрывали анти-IFNAB-BP моноклональным антителом №46.10 (Ig фракция, 120 мкл на лунку, 10 мкг/мл в PBS) в течение ночи при температуре 4°С. Планшеты промывали PBS, содержащим бычий сывороточный альбумин (0,5%), Tween 20 (0,05%) и азид натрия (0,02%) (блокирующий раствор) и блокировали в том же растворе в течение ночи при температуре 37°С. Исследуемые образцы серийно разводили в два раза (начиная с 1:4) в блокирующем растворе, содержащем 0,1% NP40 и 0,65 М NaCl, и добавляли в лунки (100 мкл на лунку) на 4 ч при температуре 37°С. Затем планшеты промывали 3 раза PBS, содержащим 0,05% Tween 20 (PBS/Tween), с последующим добавлением анти-IFNAB-BPII сыворотки кролика (1:1000 в блокирующем растворе, но без азида натрия, 100 мкл на лунку) и снова инкубировали в течение ночи при температуре 4°С. Планшеты промывали 3 раза PBS/Tween (100 мкл на лунку) и добавляли на 2 ч при комнатной температуре конъюгат козьего-анти-кроличьего антитела и пероксидазы хрена (HRP, "Jackson Labs", 1:10000 в PBS/Tween, 100 мкл на лунку) в течение 2 ч при комнатной температуре. Планшеты промывали 3 раза PBS/Tween и окрашивали, добавляя в каждую лунку в качестве субстрата 100 мкл свежеприготовленного раствора ABTS (2,2'-азино-бис-(3-этилбензтиазолин-6-сульфоновая кислота, Sigma, 10 мг; 6,4 мл Н2O, 2,2 мл 0,2 М Na2HPO4, 1,4 мл 0,2 М лимонной кислоты, 1 мкл Н2O2). Окраска появляется через 30 мин, а остановить реакцию можно добавлением 100 мкл на лунку 0,2 М лимонной кислоты. Планшеты считывали с помощью автоматического ELISA анализатора на длине волны 405 нм, проводя коррекцию относительно неспецифического считывания при 630 нм. Наименьший предел обнаружения в данном анализе составлял 30 пг/мл (фиг.10).
Приведенное описание специфических вариантов осуществления изобретения выявляет общую сущность изобретения, так что остальные исследователи могут, используя полученные сведения, легко модифицировать и/или адаптировать их для различного применения специфических вариантов осуществления изобретения, не выходя за рамки основной концепции, а потому подразумевается, что указанные адаптации и модификации соответствуют сущности изобретения и входят в объем притязаний описанных вариантов его осуществления. Следует понимать, что приведенная в настоящем описании фразеология и терминология используется в целях описания, а не ограничения настоящего изобретения.
Источники информации
1. Taylor, J.L. and Grossberg, S.E. (1990). Recent progress in interferon research: molecular mechanisms of regulation, action and virus circumvention. Virus Research 15:1-26.
2. Bisceglie A.M., Martin, P., Kassianides, C., Lisker-Melman, M., Murray, L., Waggoner, J., Goodmann, Z., Banks, M.S. and Hoofnagle, J.H. (1989). Recombinant interferon alpha therapy for chronic hepatitis C. A randomized, double-bind, placebo-controlled trial. New Eng. J. Med. 321:1506-1510.
3. McDonnell, W.M. and Eita G.H. (1992). Acute hepatitis C infection: interferon finally succeeds. Gastroenterology (US) 103:1359-1360.
4. Friedman-Kien, A.E., Eron, L.J., Conant, M., Growdon, W., Badiak, H., Bradstreet, P.W., Fedorczyk, D., Trout, R. and Plesse, T.F. (1988). Natural interferon alpha for treatment of condylomata acuminata. J. Am. Med. Assn., 259: 533-538.
5. Mains, J. and Handley, J. (1992). Interferon: current and future clinical uses in infectious disease practice. Int. J. Stud. AIDS 3:4-9.
6. Berman, E., Heller, G., Kempin, S., Gee, Т., Tran, L. and Clarkson, B. (1990). Incidence of response and long term follow up in patients with hairy cell leukemia treated with recombinant interferon Alpha-2a, Blood.75; 839-845.
7. Talpaz M., Kantarjian, H.M., McCredie, K.B., Keating, M.J., Trujillo, J. and Gutterman, J. (1987), Clinical investigation of human alpha interferon in chronic myelogenous leukemia. Blood 69:1280-1288.
8. De Wit, R., Schattenkerk, J.K.M.E., Boucher, C.A.B., Bakker, P.J.M., Veenhof, K.H.N. and Danner, S.A. (1988). Clinical and virological effects of high-dose recombinant-interferon-a in disseminated AIDS-related Kaposi's sarcoma. Lancet 2: 1214-1222.
9. Klippel, J.H., Carrete, S., Preble, D.T., Friedman, R.M. and Grimley P.M. (1985). Serum alpha interferon and lymphocyte inclusions in systemic lupus erythematosus. Annals of the Rheumatic Diseases 44:104-108.
10. Lau, A.S., Der, S.D., Read, S.E., and Williams, B.R. (1991). Regulation of tumor necrosis factor receptor expression by acid-labile interferon-alpha from AIDS sera. AIDS Res. Hum. Retroviruses 7:545-552.
11. Stewart, Т.А. (1993). Induction of type I diabetes by interferon-a in transgenic mice. Science 260:1942-1946.
12. Tsavaris, N., Mylonakis, N., Bacoyiannis, C., Tsoutsos, H., Karabelis, A., and Kosmidis, P. (1993). Treatment of renal cell carcinoma with escalating doses of alpha-interferon. Chemotherapy (Switzerland) 39:361-366.
13. Branka, A.A. and Baglioni, C. (1981). Evidence that types I and II interferons have different receptors. Nature 294:768-770.
14. Uze G., Lutfalla, G. and Gresser, I. (1990). Genetic transfer of a functional human interferon a receptor into mouse cells: cloning and expression of its cDNA. Cell 60: 225-234.
15. Colamonici, O.R. et al. (1990). Characterization of three monoclonal antibodies that recognize the interferon-a2 receptor. Proc. Natl. Acad. Sci. USA 87:7230-7234.
16. Platanias, L.C. et al. (1992). Expression of the IFN-a receptor in hairy cell leukemia, Brit. J. Haematology 82:541-546.
17. Colaminici, O.R. et al. (1993). Identification of a novel subunit of the type I Interferon receptor localized to human chromosome 21. J. Biol. Chem. 268:10895-10899.
18. Benoit, P. et al. (1993). A monoclonal antibody to recombinant human IFN-a receptor inhibits biologic activity of several species of human IFN-a, IFN-b and IFN-omega. J. Immunol. 150:707-716.
19. Novick, D., Engelmann, H., Wallach, D. and Rubinstein, M. (1989). Soluble cytokine receptors are present in normal human urine. J. Exp. Med. 170: 1409-1414.
20. Novick, D., Engelmann, H., Wallach, D., Leitner, O., Revel, M. and Rubinstein, M. (1990). Purification of soluble cytokine-receptors from normal human urine by ligand-affinity and immuno-affinity chromatography. J. Chromatography 510: 331-337.
21. Novick, D., Engelmann, H., Revel, M., Leitner, O. and Rubinstein M. (1991). Monoclonal antibodies to the soluble IL-6 receptor: affinity purification, ELISA, and inhibition of ligand binding. Hybridoma 10:137-146.
22. Engelmann, H., Novick, D. and Wallach D. (1990). Two tumor-necrosis-factor binding proteins purified from human urine. Evidence for immunological cross reactivity with cell surface tumor-necrosis-factor receptors. J. Biol. Chem. 265: 1531-1536.
23. Engelmann, H., Aderka, D., Rubinstein, M., Rotman, D. and Wallach, D. (1989). A tumor necrosis factor-binding protein purified to homogeneity from human urine protects cells from tumor necrosis factor toxicity. J. Biol. Chem. 264:11974-11980.
24. Seckinger, P., Isaaz, S. and Dayer, J.M. (1988) A human inhibitor of tumor necrosis factor alpha. J. Exp. Med. 167:1511-1516.
25. Maliszewski, C.R. and Fanslow, W.C. (1990). Soluble receptors for IL-1 and IL-4. Biological activity and therapeutic potential. Trends in Biotechnol. 8:324-329.
26. Eastgate, J.A., Symons, J.A. and Duff G.W. (1990). Identification of an interleukin-1 beta binding protein in human plasma. FEBS Letters 260:213-216.
27. Fanslow, F.W., Sims, J.E., Sasenfeld, H., Morrisey, P.J., Gillis, S., Dower, S.K. and Widmer, M.B. (1990). Regulation of alloreactivity in vivo by soluble form of the interleukin-1 receptor. Science 248:739-742.
28. Mosley, В., Beckman, M.P., March, C. J., Idzerda, R.L., Gimpel, S. D., VandenBos, Т., Friend, D., Alpert, A., Anderson, D., Jackson, J., Wignall, J.M. Smith C., Gallis, В., Sims, J.E., Urdal, D., Widmer, M.B., Cosman, D. and Pari, L.S. (1989). The murine interleukin-4 receptor: molecular cloning and characterization of secreted and membrane forms. Cell 59:335-348.
29. Marcon, L., Fritz, M.E., Kurman, C.C., Jensen, J.C. and Nelson, D.L. (1988). Soluble TAC peptide is present in the urine of normal individuals and at elevated levels in patients with adult T-cell leukemia. Clin. Exp. Immunol. 73:29-33.
30. Josimovic-Alasevic, O., Hermann, Т. and Diamanstein, T. (1988). Demonstration of two distinct forms of released lowaffinity type interleukin-2 receptors. Eur. J. Immunol. 18:1855-1857.
31. Goodwin, R.G., Friend, D., Ziegler, S.F., March. C.J., Namen, A.E. and Park, L.S. (1990). Cloning of the human and murine interleukin-7 receptors: demonstration of a soluble form and homology to a new receptor superfamily. Cell 60:941-951.
32. Novick, D., Cohen, B. and Rubinstein, M. (1992). Soluble IFN-a receptor molecules are present in Body Fluids, FEBS Letters, 314:445-448.
33. Pearson, W.R. and Lipman, D.G. (1988), Improved tools for biological sequence comparison, Proc. Natl. Acad. Sci. USA, 85:2444-2448.
34. Okayama, H. and Berg, P. (1983) AcDNA cloning vector that permits expression of cDNA inserts in mammalian cells. Mol. Cell. Biol. 3:280-289.
35. Maniatis et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York, 1982.
36. Gryczan, Т., "The Molecular Biology of the Bacilli", Academic Press, NY (1982), pp.307-329.
37. Kendall, K.J. et al. (1987). J. Bacteriol. 169:4177-4183.
38. Chater, KF. et al., in "Sixth International Symposium on Actinomycetales Biology", Akademiai Kaido, Budapest, Hungary (1986), pp.45-54.
39. John, J.F., et al. (1986). Rev. Infect. Dis. 8:693-704.
40. Izaki, К. (1978). Jpn. J. Bacteriol. 33:729-742.
41. Botstein, D., et al. (1982). Miami Wint. Symp. 19:265-274.
42. Broach, JR., in "The Molecular Biology of the Yeast Saccharomyces: Life Cycle and Inheritance", Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, pp. 445-470 (1981).
43. Broach, J.R., (1982). Cell 28:203-204.
44. Bollon, D.P., et al. (1980). J. Clin. Hematol. Oncol. 10:39-48.
45. Maniatis, Т., in "Cell Biology: A Comprehensive Treatise, Vol. 3: Gene Expression", Academic Press, NY, pp. 563-608 (1980).
46. Mizushima, S. and Nagata, S. (1990). pEF-BOS, a powerful mammalian expression vector. Nucleic Acid Res. 18:5322-5328.
47. Byrn R.A. et al., 1990, Nature (London) 344:667-670.
48. Frohman, M.A., Dush, M.K. and Martin, G.R. (1988). Proc. Nat'1. Acad. Sci. USA, 85, 8998-9002.
49. Graham, F.L. and Van der Eb, A.J. (1973) Virology, 52, 456-467.
50. Munson, P.J. and Rodbard, D. (1980). Anal. Biochem., 107, 220-239.




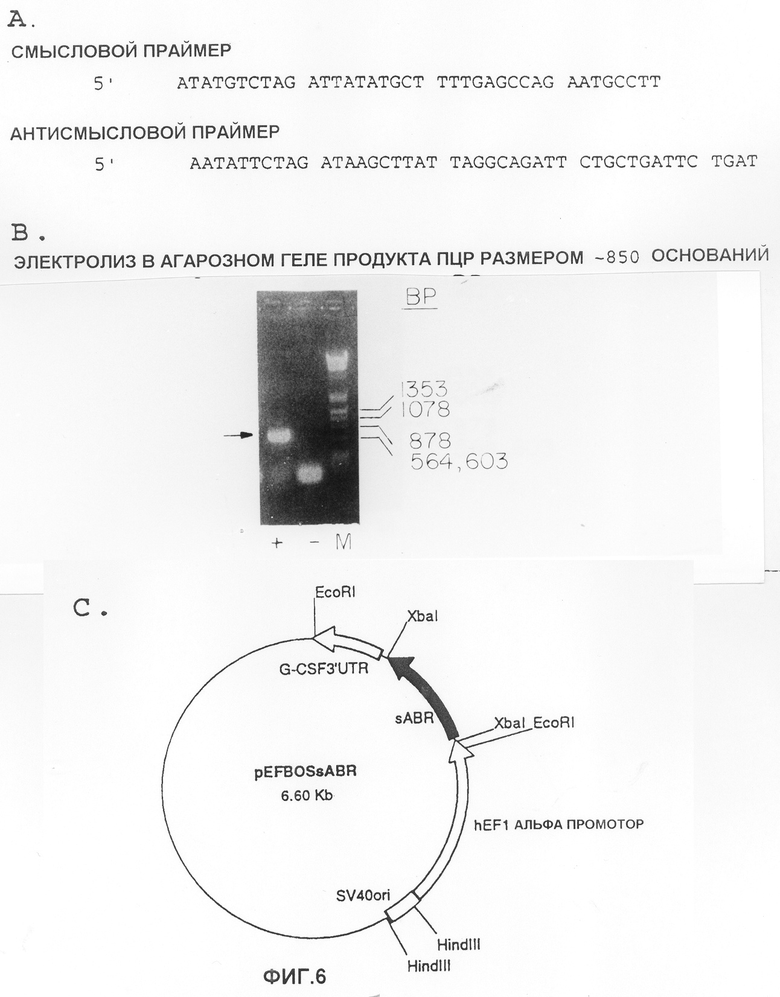


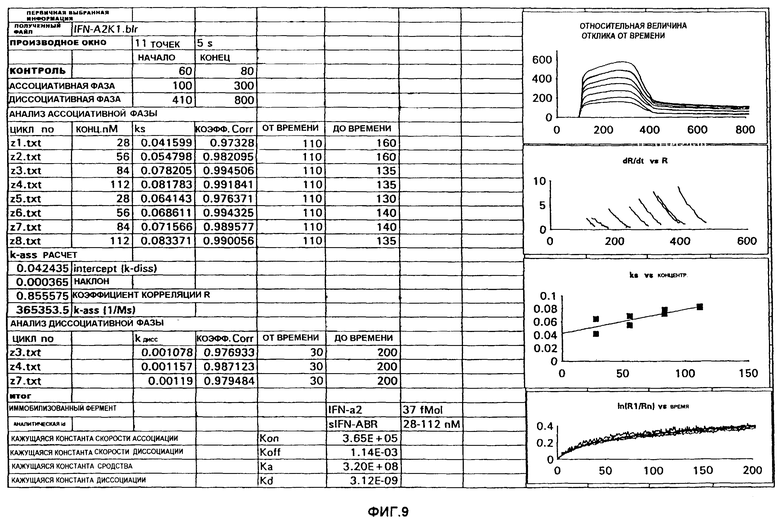
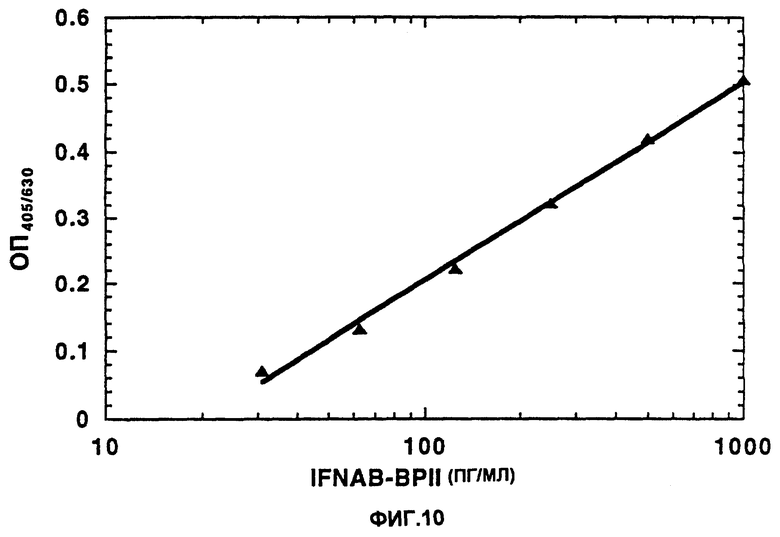
Изобретение относится к области биотехнологии, в частности к генной инженерии, и может быть использовано в медицине. Получены новые связывающие интерферон белки, которые способны модулировать активность различных подтипов интерферона-α, а также активность интерферона-β. Описано клонирование фрагмента ДНК, кодирующего интерферон-α/β связывающий белок IFNAB-BPII, и экспрессия полученного фрагмента ДНК в клетках-хозяевах как с образованием соответствующего полипептида, так и в форме слитых белков. Предложено практическое использование полученных белков в составе фармкомпозиций для лечения заболеваний, нуждающихся в ингибировании активности IFN-α или IFN-β. 12 с. и 1 з.п. ф-лы, 10 ил., 6 табл.

SYDSPDYTDESCTFKISLRNFRSILSWELKNHSIVPTHYTLLYTIMSKPEDLKVVKNCANTT
RSFCDLTDEWRSTHEAYVTVLEGFSGNTTLFSCSHNFWLAIDMSFEPPEFEIVGFTNHINVM
VKFPSIVEEELQFDLSLVIEEQSEGIVKKHKPEIKGNMSGNFTYIIDKLIPNTNYCVSVYLE
HSDEQAVIKSPLKCTLLPPGQESEFS,
или его функционально активный мутеин, полученный путем консервативных замен в указанной последовательности, или его функционально активный фрагмент.
MLLSQNAFIFRSLNLVLMVYISLVFGISYDSPDYTDESCTFKISLRNFRSILSWELKNHSIV
PTHYTLLYTIMSKPEDLKVVKNCANTTRSFCDLTDEWRSTHEAYVTVLEGFSGNTTLFSCSH
NFWLAIDMSFEPPEFEIVGFTNHINVMVKFPSIVEEELQFDLSLVIEEQSEGIVKKHKPEIKGNMSGNFTYIIDKLIPNTNYCVSVYLEHSDEQAVIKSPLKCTLLPPGQESEFS,
или его функционально активный мутеин, полученный путем консервативных замен в указанной последовательности, или его функционально активный фрагмент.
Приоритет по пунктам:
| COLAMINICI O.R | |||
| et al | |||
| J | |||
| Biol | |||
| Chem., 268, p | |||
| БЕСФИТИЛЬНАЯ ГОРЕЛКА ДЛЯ КЕРОСИНОВОЙ КУХНИ | 1926 |
|
SU10895A1 |
| BENOIT P | |||
| et al., J | |||
| Jmmunol., 150, p.707-716, 1993. | |||
Авторы
Даты
2004-07-20—Публикация
1995-02-06—Подача