ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому способу клонирования генов для селективного и эффективного выделения генов, кодирующих мембраносвязанные белки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Синтезируемые в клетках белки могут быть классифицированы по их индивидуальным характеристикам следующим образом: белки, локализованные во внутриклеточных органеллах, таких как ядро, митохондрия, цитоплазма и т.д.; белки, которые функционируют, будучи связанными с клеточной мембраной, такие как рецепторы и каналообразующие молекулы; и белки, которые функционируют, будучи секретированными во внеклеточную среду, такие как факторы роста и цитокины, и т.д. В частности, белковые молекулы, связанные с клеточной мембраной, отвечают за биологически важные функции, такие как реакции клеток на факторы роста и факторы дифференциации, воспалительные реакции, межклеточные взаимодействия, реакции на гормоны и т.д., и, следовательно, могут являться молекулами-мишенями для диагностических и терапевтических средств, предназначенных для лечения различных типов заболеваний.
В последние годы, как показывает проект по типированию генома, проводится массовое клонирование генов с применением случайных подходов, и собрано огромное количество информации по последовательностям генов, например большое количество ESTs (экспрессируемых маркеров последовательностей) (Matsubara, К Artificial Organs (1996) 20, 823-827). Однако идентификация белка, обладающего целевой функцией, исходя из этих ESTs, никаким образом не является легкой задачей, и для того, чтобы предсказать и анализировать функцию кодируемого белка, исходя из информации о генной последовательности, требуется много времени и усилий. Следовательно, давно существует потребность в способе отбора, по меньшей мере, до некоторой степени, гена, кодирующего белок, который предположительно обладает целевой функцией, на стадии случайного клонирования кДНК.
В качестве решения этой проблемы были разработаны способы клонирования с применением белковой локализации. Например, белки, секретируемые во внеклеточную среду, имеют аминокислотную последовательность, включающую от 15 до 30, или около того, аминокислотных остатков, необходимых для секреции, которые обычно называются секреторной сигнальной последовательностью или лидерной последовательностью.
Tashiro et al. сосредоточили свое внимание на особенностях синтеза этих секреторных белков и разработали способ клонирования, который позволяет специфично отобрать ген, кодирующий секреторный белок (Tashiro et al., Science (1993) 261, 300-603). Если сигнальная последовательность белков, которые обычно секретируются из клетки наружу, например рецептора интерлейкина-2 (IL-2), удалена, они становятся неспособными экспрессироваться на клеточной мембране. Если кДНК, кодирующая секреторную сигнальную последовательность, является гибридной, то рецептор IL-2 может реэкспрессироваться на клеточной мембране в виде гибридного белка. Поскольку клетки, экспрессирующие гибридный белок рецептор IL-2, могут быть отобраны путем распознавания антителами рецептора IL-2, может быть выделена кДНК, кодирующая белок, сигнальная последовательность которого, введенная в клетки, является функционирующей. Этот способ обычно называют SST (улавливание сигнальной последовательности) способ, так как он позволяет селективно клонировать ген, кодирующий сигнальную последовательность. Был также разработан способ клонирования для дрожжей на основе того же принципа (патент США №5536637).
Однако даже если генный фрагмент, кодирующий белок, включающий сигнальную последовательность, получают по этому способу, неизвестно, является ли он секреторным белком или мембраносвязанным белком. Кроме того, этот способ требует применения библиотеки кДНК, включающей 5’ конец, но методики эффективного составления библиотеки кДНК, которая избирательно содержит 5’ конец, не являются в необходимой степени простыми, универсальными методиками.
Недавно Ishihara et al. and Nakauchi et al. опубликовали способ ТМТ (трансмембранного улавливания), который позволяет более селективно клонировать ген, кодирующий мембраносвязанный белок (Yoshikazu Ichihara and Yoshikazu Kurozawa, Abstracts from the Annual Meeting of the Molecular Biology Society of Japan (1998), №3-509-P-533, Nakauchi et al. WO98/03645). Способ Ishihara et al. основан на принципе, противоположном вышеупомянутому способу SST. А именно гибридизуют внеклеточную область рецептора IL-2 и белок, содержащий область, связанную с клеточной мембраной, кодируемую кДНК, проводят экспрессию рецептора IL-2 на поверхности клеточной мембраны и клетки отбирают, используя антитела против рецептора IL-2. Модельный эксперимент с использованием этого способа подтверждает экспрессию гибридных молекул между типом I или типом II мембраносвязанных белков, или мембраносвязанным белком, заякоренным гликозилфосфатидилинозитолом (GPI), и рецептора IL-2 на клеточной мембране с использованием антител против рецептора IL-2.
Однако при введении библиотеки кДНК в пределах отобранных кДНК также получают белки, не включающие трансмембранную область и мембраносвязанную область. Другими словами, селективность клонирования гена, кодирующего мембраносвязанный белок, в способе ТМТ не является достаточно высокой. Это показывает, например, что, хотя в принципе должны секретироваться все гибридные белки, не имеющие трансмембранной области и GPI якоря, на клеточной мембране могут также происходить в зависимости от структур и аминокислотных составов гибридных белков неспецифическая агглютинация, не обусловленная наличием трансмембранной области и GPI якоря.
Кроме того, в случае применения способа ТМТ в гибридном белке экспрессируется эпитоп, распознаваемый антителами. Поэтому даже если гибридные белки экспрессируются вышеописанным способом и неспецифически абсорбируются на клеточной мембране, антитела будут распознавать и связывать этот эпитоп, если он является доступным. Кроме того, те молекулы на поверхности мембраны, которые находятся на их пути к секреции во внеклеточную среду, также распознаются антителами. Следовательно, желательно, чтобы селективность клеток, экспрессирующих мембраносвязанный белок, полученная при использовании способа ТМТ, была дополнительно улучшена.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение решает проблемы способа ТМТ и предоставляет способ клонирования генов, обладающий превосходной селективностью.
Характерной особенностью настоящего изобретения является выделение гена, кодирующего мембраносвязанный белок, путем присоединения функционального белка к самому гибридному белку, в отличие от традиционного способа ТМТ, несущего эпитоп, распознающий антитела. Настоящий способ таким образом создает возможность селективного выделения генов, кодирующих мембраносвязанные белки.
А именно настоящее изобретение предоставляет:
(1) способ выделения гена, кодирующего мембраносвязанный белок, причем этот способ включает стадии
(i) введение в клетки вектора, включающего ДНК, кодирующую секретируемый функциональный белок, обладающий сродством связывания с антигеном, и кДНК, лигированную ниже 3’ области ДНК, кодирующей функциональный белок,
(ii) экспрессия в клетках гибридного белка, состоящего из секретируемого функционального белка, обладающего сродством связывания с антигеном, и белка, кодируемого кДНК,
(iii) отбор клеток, связывающихся с антигеном путем взаимодействия клеток, экспрессирующих гибридный белок на клеточной мембране, с антигеном, и
(iv) выделение кДНК, встроенной в вектор, из отобранных клеток,
(2) способ по пункту (1), где вектор, вводимый в клетки на стадии (i), получают путем введения кДНК в вектор в сайте ферментативной рестрикции ниже 3’ области ДНК, кодирующей функциональный белок,
(3) способ по пункту (1), где вектор, вводимый в клетки на стадии (i), получают путем введения в вектор ДНК, включающей ДНК, кодирующую функциональный белок, и кДНК, лигированной ниже 3' области ДНК, кодирующей функциональный белок,
(4) способ по любому из пунктов (1)-(3), где ДНК, кодирующую функциональный белок, и кДНК ниже ее 3’ области лигируют с помощью ДНК, кодирующей пептидный линкер,
(5) способ по любому из пунктов (1)-(4), где кДНК, полученную из библиотеки кДНК, получают из клеток млекопитающих,
(6) способ по любому из пунктов (1)-(5), где вектор, вводимый в клетки на стадии (i), включает ДНК, кодирующую секреторную сигнальную последовательность выше 5’ области ДНК, кодирующей функциональный белок,
(7) способ по любому из пунктов (1)-(6), где функциональным белком является антитело,
(8) способ по любому из пунктов (1)-(7), где функциональным белком, обладающим сродством связывания с антигеном, является одноцепочечное антитело, которое предпочтительно является моновалентным или бивалентным,
(9) способ по любому из пунктов (1)-(8), где вектор содержит ДНК, в которой ДНК, кодирующая константный участок антитела, лигирована ниже 3’ области ДНК, кодирующей одноцепочечное антитело,
(10) способ по любому из пунктов (1)-(9), где антиген связан с подложкой,
(11) способ по пункту (10), где подложка предназначена для культивирования клеток,
(12) способ по любому из пунктов (1)-(11), включающий определение, действительно ли ген, полученный из клеток, включает новую последовательность,
(13) способ по пункту (12), включающий скрининг библиотеки кДНК для получения полноразмерного гена из гена, полученного из клеток, гена, включающего новую последовательность,
(14) способ по пункту (13), включающий выделение полноразмерного гена из гена, полученного из клеток, гена, включающего новую последовательность,
(15) набор для выделения гена, кодирующего мембраносвязанный белок, этот набор включает вектор, имеющий сайт распознавания рестрикционного фермента для вставки кДНК ниже 3’ области ДНК, кодирующей секретируемый функциональный белок, обладающий сродством связывания с антигеном, и
(16) набор по пункту (15), дополнительно включающий подложку, с которой связан антиген, и/или клетки, в которые введен вектор.
В качестве мембраносвязанных белков, которые могут быть выделены с помощью способа данного изобретения, могут быть приведены, например, мембраносвязанные белки типа I или типа II, GPI-якорного типа мембраносвязанные белки и подобные им. Мембраносвязанные белки типа I или типа II представляют собой белки, включающие трансмембранные области, которые связываются с мембраной после выхода из клетки N-концевой области или С-концевой области экспрессируемых полипептидов. Трансмембранные области представляют собой области, которые пронизывают насквозь внутреннюю и внешнюю части клеточной мембраны, и так как эта трансмембранная область остается в клеточной мембране, белки фиксируются на клеточной мембране. Трансмембранная область обычно состоит из участков аминокислотной последовательности белка, обогащенных гидрофобными остатками аминокислот. С помощью коммерчески доступной компьютерной программы, например, пакет программного обеспечения для GCG анализа последовательностей (GCG Sequence Analysis Software Package) (Genetic Computer Group, Oxford Molecular Group, Inc.), можно легко предсказать, обладает белок трансмембранной областью или нет. Мембраносвязанные белки GPI-якорного типа представляют собой белки, которые подвергаются модификациям с помощью GPI и внедряются в липидный слой клеточной мембраны посредством GPI (GPI-якорный тип мембраносвязанных белков).
В первой стадии ((i)) способа выделения данного изобретения в клетки вводят вектор, включающий ДНК, кодирующую секретируемый функциональный белок, обладающий сродством связывания с антигеном, и ДНК, в которой кДНК лигирована ниже ее 3’ области.
Термин "функциональный белок, обладающий сродством связывания с антигеном" обозначает белок, который может функционально связываться с определенным антигеном. В качестве функциональных белков предпочтительны те белки, у которых константа связывания составляет 107 М или выше. Более предпочтительно 108 М или выше, и еще более предпочтительно 109 М или выше. Функциональными белками являются, например, антитела, фрагменты антител, одноцепочечные антитела и т.д. Антитела включают две тяжелые цепи (Н цепи) и две легкие цепи (L цепи), эти Н цепи и L цепи связаны посредством дисульфидных связей с образованием единой молекулы антитела. Н цепи и L цепи состоят из вариабельного участка (v участок, Fv) и константного участка (с участок, Fc). Фрагменты антител являются белковыми участками антител, обладающими сродством связывания к антигенам, в качестве примера могут быть приведены Fab, F(ab’)2, Fv и другие. Одноцепочечное антитело (далее здесь упоминается как одноцепочечный Fv (scFv)) представляет собой белок, обладающий сродством связывания с антигеном, белок, в котором Н цепь Fv и L цепь Fv сшиты посредством линкера, и в качестве примера могут быть приведены моновалентное одноцепочечное антитело и бивалентное одноцепочечное антитело. Моновалентные одноцепочечные антитела имеют антигенсвязывающий сайт, включающий одну Н цепь Fv и L цепь Fv, а бивалентные одноцепочечные антитела имеют структуру, в которой две молекулы моновалентных одноцепочечных антител сшиты посредством линкера и имеют два антигенсвязывающих сайта.
К антителам, фрагментам антител или одноцепочечным антителам могут относиться такие, в которых один или несколько аминокислотных остатков могут быть удалены, встроены и/или заменены другими аминокислотными остатками с различными целями, такими как улучшение константы связывания, или такие, которые гибридизованы с другими пептидами или полипептидами, причем все они охватываются термином функциональный белок настоящего изобретения. Кроме того, в качестве антитела, фрагмента антитела или одноцепочечного антитела могут использоваться модифицированные антитела. Примерами модифицированных антител являются химерные антитела и гуманизированные (приближенные к человеческим) антитела. Химерные антитела представляют собой антитела, включающие V область и С область антител, полученных из разных животных. Гуманизированные антитела представляют собой антитела, включающие участок, определяющий комплементарность (CDR), из антитела, полученного из животного, отличающегося от человека, и каркасный участок (FR) и С область из антитела, полученного из человека.
Антигеном, обладающим сродством связывания к функциональному белку данного изобретения, может быть любое вещество, обладающее антигенными свойствами. Примерами являются белки, пептиды, сахара и подобные вещества, предпочтительно белки. Белки, использующиеся в качестве антигенов, представляют собой, например, белки, экспрессирующиеся в клетках или микроорганизмах, сывороточные белки, цитокины, внутриклеточные белки, мембранные белки и т.д.
ДНК, кодирующие антитела, могут быть получены с помощью хорошо известных средств. Например, они могут быть выделены из клеток, продуцирующих антитела, например из гибридом, иммортализированных лимфоцитов, сенсибилизированных антигеном, и клеток, продуцирующих рекомбинантные антитела после введения гена антитела. Кроме того, может быть также использована ДНК, уже которая была выделена и встроена в вектор. Происхождение и тип ДНК, кодирующей антитело, не имеют значения, если она может быть использована в настоящем изобретении.
ДНК, кодирующая фрагмент антитела или одноцепочечное антитело, может быть сконструирована из ДНК, кодирующей антитело с помощью обычно использующихся следующих способов. ДНК, кодирующую моновалентное одноцепочечное анититело, получают путем лигирования ДНК, кодирующей Н цепь V области (Н цепь Fv) антитела, ДНК, кодирующей линкер, и ДНК, кодирующей L цепь V области (L цепь Fv). Линкер не расщепляется, пока он может стерически воспроизводить Н цепь Fv и L цепь Fv так, чтобы они имели антигенное сродство. Предпочтительно он является пептидным линкером и включает, например, от 12 до 19 аминокислотных остатков (Huston, J.S. et al., Proc. Natl. Acad. Sci. U.S.A. (1988) 85, 5879-5883). В качестве примера может быть приведен пептидный линкер, имеющий следующую аминокислотную последовательность: GlyGlyGlyGlySerGlyGlyGlyGlySerGlyGlyGlyGlySer ((Gly4Sеr)3) (SEQ ID NO: 1). ДНК, кодирующую бивалентное одноцепочечное антитело, конструируют путем сшивки 5’ конца и 3’ конца двух молекул ДНК, кодирующих моновалентные одноцепочечные антитела, с помощью ДНК, кодирующей пептидный линкер. Пептидный линкер, лигирующий два одноцепочечных антитела, включает, например, аминокислотную последовательность GlyGlyGlyGlySerGlyGlyGlyGlySerGlyGlyGlyGlySer ((Gly4Sеr)3) (SEQ ID NO: 1).
Для того, чтобы увеличить эффективность клонирования в данном изобретении, например, при использовании одноцепочечного Fv в качестве функционального белка, является предпочтительным, чтобы С конец содержал небольшое количество гидрофобных аминокислот, конкретно, может использоваться одноцепочечный Fv, в котором удален шарнирный участок, как описано в примерах, приведенных ниже. Кроме того, предпочтительным является то, что в данном изобретении стабильность и эффективность экспрессии могут быть увеличены путем лигирования дополнительно домена начала репликации секреторного белка, например ДНК, кодирующей аминокислоты константного участка антитела, как описано ниже в примерах, с С-концом одноцепочечного Fv.
Для функционального белка, который должен секретироваться, может быть использована секреторная сигнальная последовательность. А именно достаточно лигировать ДНК, кодирующую секреторную сигнальную последовательность выше 5’ области ДНК, кодирующей функциональный белок, обладающий сродством связывания с антигеном. В качестве секреторной сигнальной последовательности применяется последовательность, подходящая для клеток, использующихся для экспрессии библиотеки кДНК и секреции белков. Секреторной сигнальной последовательностью может быть сигнальная последовательность любого секреторного белка, если она может способствовать секреции функционального белка. Предпочтительно полученными из животных секреторными сигнальными последовательностями являются последовательности, полученные из млекопитающих, например сигнальная последовательность человеческого иммуноглобулина (Kabat, E. et al., Sequences of Proteins of Immunological Interest, US Department of Health and Human Services (1991)), цитокинов и рецепторов цитокинов.
кДНК, лигированную ниже 3’ области ДНК, кодирующей функциональный белок, предпочтительно получают из библиотеки кДНК. В качестве библиотеки кДНК может использоваться библиотека, полученная с использованием хорошо известных методов, или коммерчески доступная библиотека. Библиотека кДНК может быть получена путем выделения мРНК из целевых образцов и синтеза кДНК на выделенной мРНК.
Источниками, из которых может быть выделена мРНК, являются, например, млекопитающие, животные, отличные от млекопитающих, растения, дрожжи, бактерии или сине-зеленые водоросли, но предпочтительно используются млекопитающие. В качестве примеров млекопитающих могут быть приведены люди, обезьяны, кролики, крысы, мыши и им подобные, особенно предпочтительными являются люди. Животными, отличными от млекопитающих, являются, например, насекомые, такие как плодовые мушки (Drosophila) и т.д.
Источниками, из которых может быть выделена мРНК, могут быть любые источники, например клетки, полученные из живого организма, устоявшихся клеточных линий, эмбрионов, тканей, крови или органов. Типичными примерами являются остеобласты, кроветворные стволовые клетки, клетки гладкой мускулатуры, нейроны, клетки стромы, ES клетки, клетки печени, кишечника, легких, почек, лимфатических узлов и т.д.
Выделение мРНК может быть произведено путем суспендирования образцов для выделения в присутствии традиционно используемого буфера в соответствии с традиционными методиками. Для получения общей мРНК в качестве первой стадии выделения мРНК может применяться метод ультрацентрифугирования с гуанозином (Chirgwin, J.M. et al., Biochemistry (1979) 18, 5294-5299) или метод AGPC (Chomczynski, P. and Sacchi, N., Anal. Biochem. (1987) 162, 156-159) и им подобные. Далее, для выделения мРНК из общей мРНК, например, может быть использован набор для очистки мРНК (Pharmacia) и т.п. Например, может быть также использован набор для очистки мРНК QuickPrep (Pharmacia) в качестве коммерчески доступного набора для концентрирования мРНК посредством аффинной очистки с использованием олиго dТ.
кДНК синтезируют на полученной мРНК с использованием обратной транскриптазы. Можно использовать коммерчески доступную обратную транскриптазу. Одноцепочечная кДНК, комплементарная мРНК, может быть синтезирована с использованием олиго dT праймера, комплементарного поли А мРНК, или с использованием олигонуклеотида случайной последовательности в качестве праймера. Например, для синтеза кДНК может быть использован набор для синтеза первой цепи кДНК с обратной транскриптазой AMV (Seikagaku Corporation) и подобные ему. Двухцепочечную кДНК получают из полученной одноцепочечной кДНК с помощью ДНК-полимеразы.
Кроме того, библиотека кДНК может быть выборочно сокращена для конкретной цели в соответствии с традиционными методиками. Для конкретной цели, например, для получения кДНК гена, в котором продуктивность экспрессии варьирует, может быть применен метод дифференциального клонирования (Lau, L.F. et al., and Nathans, D. EMBO J. (1985) 4, 3145-3151), дифференциальный дисплейный метод (Liang, P. and Pardee, А.В. Science (1992) 257, 967-971), метод вычитающего клонирования (Nucleic Acids Research (1988) 16, 10937), метод серийного анализа экспрессии генов (метод SAGE) (Velculescu, V.E. et al. Science (1995) 270, 484-487). Для сокращения (библиотеки) кДНК, кодирующей секреторный белок, может также применяться метод SST (Tashiro, К. et al., Science (1993) 261, 300-603) и метод, описанный в патенте США №5536637.
Векторами могут быть любые векторы, которые могут трансформировать клетки и способствуют экспрессии содержащихся в них ДНК. Предпочтительно в качестве экспрессирующего вектора выбрать вектор, который может работать в клетке, которая должна быть трансформирована. Примерами экспрессирующих векторов являются плазмидные векторы и вирусные векторы.
Полученную кДНК встраивают в вектор. Например, кДНК может быть введена в вектор ниже 3’ области ДНК, кодирующей функциональный белок, которая уже содержится в векторе. С этой целью подходящий сайт ферментативной рестрикции, например сайт мультиклонирования, конструируют ниже 3’ области ДНК, кодирующей функциональный белок, и кДНК вводят в этот сайт. А также вначале кДНК может быть вначале лигирована ниже ДНК, кодирующей функциональный белок, и затем полученная ДНК может быть введена в вектор. Конструкция ДНК может быть введена в подходящий сайт ферментативной рестрикции, включенный в векторную ДНК. При получении вектора ДНК, кодирующая функциональный белок, и кДНК, расположенная ниже 3’ области, могут быть лигированы непосредственно, или могут быть лигированы через ДНК, кодирующую пептидный линкер, для облегчения связывания функционального белка с антигеном.
Экспрессирующий вектор предпочтительно содержит участок, регулирующий экспрессию, необходимый для экспрессии целевой ДНК в клетках. В качестве участков, регулирующих экспрессию, могут быть приведены промоторы/энхансеры, а именно человеческий EF1α промотор, HCMV промотор или SV40 промотор и им подобные. Полученные таким образом экспрессирующие векторы могут быть введены в клетки с помощью традиционных методов. Примерами таких методов являются метод электрофореза (EMBO J. (1982) 1, 841-845), кальций фосфатный метод (Virology (1973) 52, 456-467), липосомальный метод, DEAE декстрановый метод и др.
Клеткой, которая подвергается трансформации, может являться любая клетка, если секреторная сигнальная последовательность и участок, регулирующий последовательность, содержащиеся в векторе, функционируют в этих клетках и предпочтительно представляют собой животные клетки, например COS, CHO, BAF3 и др.
На второй стадии ((ii)) способа данного изобретения гибридный белок, состоящий из секретируемого функционального белка, обладающего сродством связывания с антигеном, и белка, кодируемого кДНК, экспрессируется в клетках. Конкретно клетки трансформируют с помощью вектора, содержащего ДНК, кодирующую вышеупомянутый гибридный белок, и культивируют в условиях, подходящих для роста клеток. Культуру ведут в соответствии с традиционными методами. Например, в качестве культуральной среды можно использовать DMEM, MEM, RPMI1640 и IMDM, их можно использовать вместе с растворами с добавлением сыворотки, такими как фетальная телячья сыворотка.
Для того, чтобы экспрессировать ДНК в клетках, можно использовать систему, индуцирующую экспрессию ДНК. Например, если используются системы, регулирующие экспрессию с использованием тетрациклина или промоторов/энхансеров, которые экспрессируются в ответ на стимулы, такие как цитокины, липополисахариды (LPS), стероидные гормоны и др., возможно индуцировать экспрессию ДНК в клетках путем стимуляции клеток. При экспрессии ДНК продуцируется гибридный белок, содержащий генные продукты гена, кодирующего функциональный белок, и кДНК. Если кДНК кодирует мембраносвязанный белок, секреторная сигнальная последовательность изымается в процессе синтеза гибридного белка на гранулярном эндоплазматическом ретикулюме (ER), и гибридный белок экспрессируется на клеточной мембране. Если ДНК, кодирующая пептидный линкер, лигирована между ДНК, кодирующей функциональный белок, и кДНК, экспрессируется гибридный белок, включающий пептидный линкер между функциональным белком и генным продуктом кДНК.
Третья стадия ((iii)) способа данного изобретения включает выбор клеток, связывающихся с антигеном, путем взаимодействия клеток, экспрессирующих гибридный белок на клеточной мембране, с антигеном. Предпочтительно антиген является связанным с подложкой. Примерами подложек являются подложки для культивирования клеток, предпочтительно планшеты, такие как пластиковые планшеты, многолуночные планшеты, культуральные чашки или шарики. В качестве шариков могут использоваться магнитные шарики. Антиген может быть присоединен к подложке с помощью традиционных методов. Например, антиген может быть присоединен к подложке путем добавления антигена к планшету в присутствии подходящего буфера, оставления на ночь и промывания. Антиген может быть присоединен к подложке через антитело, которое специфично связывается с антигеном. Например, после того, как антитело, специфично связывающееся с антигеном, добавляют и фиксируют на планшете, может быть добавлен антиген для присоединения его к подложке. Альтернативно, антиген, который не связан с подложкой и клеткой, может быть присоединен первым, и затем клетка может связываться с подложкой с помощью антитела, которое специфично связывается с антигеном, иммобилизованном на подложке. После связывания антигена, не связанного с подложкой и клеткой, антиген и клетка могут быть поперечно сшиты с помощью агентов для поперечной сшивки, таких как DMS (диметилсульберимидат), BS3 (бис(сульфосукцинимидил)суберат) и DSS (дисукцинимидил суберат).
Несвязанные с антигеном клетки удаляют, а клетки, связанные с антигеном, могут быть отобраны путем инкубирования планшета в условиях, при которых клетки могут связываться с антигеном на планшете, и после того, как клетки свяжутся с антигеном, планшет промывают в подходящих условиях. Для выбора клеток, связанных с антигеном, можно также использовать проточную цитометрию (FACS (клеточный сортер с возбуждением флуоресценции)). Клетки, отобранные с помощью таких методов, собирают. В результате повторения этих методов от двух до нескольких раз целевые клетки могут быть получены с большей избирательностью.
Четвертая стадия ((iv)) способа данного изобретения включает выделение кДНК, встроенной в вектор, из отобранных клеток. Вначале вектор экстрагируют из клеток, связанных с планшетом, в которые был введен этот вектор, затем выделяют кДНК, содержащуюся в векторе. Если используют плазмидный вектор, то его экстрагируют, вводят в Е.coli, амплифицируют там и готовят препараты для выделения кДНК. Далее определяют нуклеотидную последовательность выделенного гена. Альтернативно, конструируют праймер на основе нуклеотидной последовательности данного вектора, с его помощью амплифицируют кДНК и определяют нуклеотидную последовательность. Если используют ретровирусный вектор, кДНК амплифицируют методом PCR подобным образом и определяют нуклеотидную последовательность.
Способ настоящего изобретения может включать стадию анализа для определения, действительно ли выделенный ранее ген включает новую последовательность. Новизну последовательности выделенной ДНК можно анализировать путем анализа гомологии последовательности (эквивалентность аминокислотных остатков) с использованием базы данных ДНК, например GENBANK, EMBL и др. После определения гомологии может следовать алгоритм, описанный в "Wilbur, W.J. and Lipman, D.J., Proc. Natl. Acad. Sci. USA (1983) 80, 726-730".
Способ настоящего изобретения может также включать стадию скрининга библиотеки кДНК для получения полноразмерного гена из ранее выделенного гена. Следуя традиционным методам, скрининг библиотеки кДНК может быть проведен следующим образом. Вначале выделенный ген метят, используют в качестве зонда и подвергают гибридизации с библиотекой кДНК. Затем, используя метку, определяют клон ДНК, связанный с фрагментом выделенного гена.
Способ настоящего изобретения может также включать стадию выделения полноразмерного гена из выделенного ранее гена. Это может быть проведено путем скрининга библиотеки кДНК, как описано выше, выделения клонов кДНК, детектированных с помощью традиционных методов, и определения их нуклеотидной последовательности.
Кроме того, настоящее изобретение включает набор, использующийся для выделения гена, кодирующего вышеупомянутый мембраносвязанный белок. Набор данного изобретения включает вектор, имеющий сайт распознавания рестрикционного фермента для вставки кДНК ниже 3’ области ДНК, кодирующей секретируемый, функциональный белок, обладающий сродством связывания с антигеном. Предпочтительно набор данного изобретения дополнительно включает подложку, с которой связан антиген, и/или клетки, в которые должен быть введен вектор. Дополнительно могут содержаться промывочные растворы для пэннинга (метод анализа путем "просеивания" анализируемого содержимого через сорбент или подложку с иммобилизованным лигандом), агенты для поперечной сшивки для образования мостиковых связей клеток с антигеном, библиотека кДНК, растворы для сбора ДНК путем растворения отобранных клеток и др.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 схематично показана структура экспрессирующего вектора для клонирования pTMT-SR345. "SR345" на фигуре определяет внеклеточную область человеческого рецептора IL-6, "NEOr" - ген устойчивости к неомицину, "EF1α" - область промотора/энхансера фактора элонгации пептидной цепи 1α, "SV40E" - ранний промотор/энхансер SV40 и "Аmрr" - ген устойчивости к ампициллину.
На фиг.2 схематично показана структура экспрессирующего вектора pTMT-scFv. "scFv" на фигуре определяет одноцепочечное антитело, а "Ig’s" - секреторный сигнальный пептид антитела. Другие символы имеют такое же значение, как на фиг.1.
На фиг.3 показано число колоний, выделенных с помощью пэннинга с использованием клеток COS-7, в которые была введена плазмидная ДНК.
На фиг.4 схематично показана структура экспрессирующего вектора pTMT-BvGS3. "hPM1-BvGS3" на фигуре определяет бивалентное одноцепочечное антитело. Другие символы имеют такое же значение, как на фиг.1 и фиг.2.
На фиг.5 показана гистограмма, полученная при анализе клеток COS-7, в которые были введены различные типы плазмидной ДНК, с помощью проточного цитометра с использованием крысиных поликлональных антител против гуманизированных РМ-1 антител.
На фиг.6 показана гистограмма, полученная при анализе клеток COS-7, в которые были введены различные типы плазмидной ДНК, с помощью проточного цитометра с использованием мышиных антител МТ-18 против рецептора IL-6.
На фиг.7 схематично показана структура экспрессирующего вектора pTMT-shPM1F-K. "shPM1F-Kappa" на фигуре определяет одноцепочечное антитело. Другие символы имеют такое же значение, как на фиг.1 и фиг.2.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Способ клонирования данного изобретения может быть, например, осуществлен, как описано ниже, но настоящее изобретение никоим образом этим не ограничивается.
Пример 1: Конструирование экспрессирующего вектора для клонирования pTMT-SR345
Конструируют экспрессирующий клонирующий вектор pTMT-SR345. SR345, кодируемый ДНК, содержащейся в экспрессирующем клонирующем векторе pTMT-SR345, представляет собой часть внеклеточного участка человеческого рецептора IL-6, и состоит из 345 аминокислотных остатков из N-конца. В экспрессирующем клонирующем векторе pTMT-SR345 белок, кодируемый кДНК, встроенной ниже ДНК, кодирующей SR345, экспрессируется в виде гибридного белка с SR345. Нуклеотидная последовательность, кодирующая SR345, показана в SEQ ID NO: 2 вместе с аминокислотной последовательностью.
Вначале, для того чтобы амплифицировать фрагмент величиной прибл. 1,1 т.п.н. (тысяч оснований) из кДНК рецептора IL-6, содержащий кДНК, кодирующую SR345 (Yamasaki, К. et al, Science (1988) 241, 825-828), конструируют PCR праймеры IL6R1 (SEQ ID NO: 3) и IL6R2 (SEQ ID NO: 4). Реакционную смесь для PCR (100 мкл), содержащую 10 мМ Tris-HCl (рН 8,3), 50 мМ KCl, 0,1 мM dNTP, 1,5 мM MgCl2, 100 пмоль каждого из вышеупомянутых праймеров, 100 нг матрицы ДНК (кДНК, кодирующей рецептор IL-6) и 5 единиц фермента Ampli-Taq Gold подвергают денатурации при 94°С, 30 циклам инкубации, состоящим из 1 мин при 94°С, 1 мин при 55°С и 1 мин при 72°С, и, наконец, инкубируют 10 мин при 72°С. Амплифицированный фрагмент ДНК собирают, очищают методом гель-электрофореза в 1% низкоплавкой агарозе, расщепляют с помощью EcoRI и вставляют в EcoRI сайт экспрессирующего вектора pCOS1. Полученным продуктом трансфицируют Е.coli и готовят препараты плазмид для получения тех из них, в которых фрагмент ДНК встроен в правильном направлении. Экспрессирующий вектор pCOS1 конструируют из плазмиды HEF-PMh-g γ 1 (см. WО92/19759) путем делеции содержащихся генов с помощью расщепления под действием EcoRI и Smal и лигирования с помощью EcoRI-NotI-BamHI Adaptor (TaKaRa).
Далее EcoRI сайт выше SR345 удаляют с помощью следующего метода. Вначале плазмиду частично расщепляют с помощью EcoRI и собирают линейные молекулы, полученные путем расщепления по одному сайту. Затупляют концы с помощью ДНК-полимеразы I (фрагмент Klenow), проводят рециркуляризацию и трансфицируют Е.coli для получения экспрессирующего вектора для клонирования pTMT-SR345. Структура экспрессирующего вектора для клонирования pTMT-SR345 приведена на фиг.1.
Пример 2: Конструирование экспрессирующего вектора рТМТ-scFv
Конструируют экспрессирующий вектор pTMT-scFv. Одноцепочечное антитело (scFv), кодируемое ДНК, содержащейся в экспрессирующем векторе pTMT-scFv, конструируют, используя вариабельный участок гуманизированного моноклонального антитела РМ-1, который распознает человеческий рецептор IL-6, и линкерный участок. В экспрессирующем векторе pTMT-scFv белок, кодируемый кДНК, встроенной ниже ДНК, кодирующей scFv, экспрессируется в виде гибридного белка с scFv. Нуклеотидная последовательность гена scFv приведена в SEQ ID NO: 5 вместе с аминокислотной последовательностью.
1) Амплификация фрагмента ДНК, кодирующего V-участок антитела
Гены Н-цепи и L-цепи V-участка гуманизированного антитела РМ1 (Sato, К et al. Cancer Res. (1993) 53, 851-856) амплифицируют методом PCR. Обратный праймер ТМТ1 (SEQ ID NO: 6) для Н-цепи V-участка конструируют таким образом, чтобы он гибридизовался с ДНК, кодирующей N-конец Н-цепи V-участка, и включал сайт распознавания рестрикционного фермента SalI. Прямой праймер LINK1 (SEQ ID NO: 7) для Н-цепи V-участка конструируют таким образом, чтобы он гибридизовался с ДНК, кодирующей С-конец Н-цепи V-участка, и включал 5’ конец последовательности линкерного участка. Кроме того, обратный праймер LINK3 (SEQ ID NO: 8) для L-цепи V-участка конструируют таким образом, чтобы он гибридизовался с ДНК, кодирующей N-конец L-цепи V-участка, и включал 3’ конец последовательности линкерного участка. Прямой праймер SCP-C (SEQ ID NO: 9) для L-цепи V-участка конструируют таким образом, чтобы он гибридизовался с нуклеотидной последовательностью, кодирующей аминокислотную последовательность, образующую L-цепь константного участка шарнирного сайта, а также включал сайт распознавания рестрикционного фермента HindIII, нуклеотидную последовательность, кодирующую FLAG пептид (SEQ ID NO: 10) и два повторяющихся трансляционных стоп-кодона.
Реакционную смесь для PCR (100 мкл), содержащую 10 мМ Tris-HCl (рН 8,3), 50 мM KCl, 0,1 мМ dNTP, 1,5 мМ MgCl2, 100 пмоль каждого из вышеупомянутых праймеров, 100 нг матрицы ДНК и 5 единиц фермента AmpliTaq Gold, подвергают денатурации при 94°С в течение 9 мин, 30 циклам инкубации, состоящим из 30 сек при 94°С и 1 мин при 60°С, и, наконец, инкубируют 5 мин при 60°С. Продукт PCR очищают, используя 1,5% низкоплавкий агарозный гель.
2) Амплификация фрагмента ДНК, кодирующего линкерный участок
Фрагмент ДНК, кодирующий линкерный участок, включающий аминокислотную последовательность (Gly4Ser)3, амплифицируют методом PCR с использованием экспрессирующего вектора для получения гуманизированного одноцепочечного антитела pSCFVT-hM21 (см. WO95/14041). Обратный праймер LINK2 (SEQ ID NO: 11) конструируют таким образом, чтобы он гибридизовался с 5’ концом линкерного участка, а также включал 3’ конец последовательности ДНК Н-цепи V-участка. Прямой праймер LINK4 (SEQ ID NO: 12) конструируют таким образом, чтобы он гибридизовался с 3’ концом линкерного участка, а также включал последовательность ДНК 5" конца L-цепи V-участка. PCR проводят, используя 100 нг матрицы ДНК (pSCFVT-hM21) в упомянутых выше условиях и продукт PCR очищают, используя 1,5% низкоплавкий агарозный гель.
3) Конструирование одноцепочечного Fv гуманизированного антитела РМ1
Полученный выше фрагмент ДНК, кодирующий L-цепь и Н-цепь V-участков, и фрагмент ДНК, кодирующий линкерный участок, подвергают сборке с помощью метода PCR, добавляют обратный праймер ТМТ1 и прямой праймер ТМТ2 (SEQ ID NO: 13) для амплификации фрагмента ДНК полной цепи, кодирующего scFv гуманизированного РМ1. Прямой праймер ТМТ2 конструируют таким образом, чтобы он гибридизовался с последовательностью ДНК, кодирующей сайт распознавания рестрикционного фермента HindIII и FLAG пептид, а также включал два повторяющихся трансляционных стоп-кодона и сайт распознавания рестрикционного фермента EcoRI. Первичную PCR проводят следующим образом: 98 мкл реакционной смеси для PCR, содержащей 10 мМ Tris-HCl (рН 8,3), 50 мМ КСl, 0,1 мМ dNTP, 1,5 мМ MgCl2, прибл. 100 нг каждого из вышеупомянутых продуктов PCR и 5 единиц фермента AmpliTaq Gold, подвергают вначале денатурации при 94°С и затем для лигирования каждого фрагмента ДНК проводят 2 цикла, состоящие из 2 мин при 94°С, 2 мин при 55°С и 2 мин при 72°С. Вторичную PCR проводят следующим образом: К вышеописанному реакционному раствору для PCR добавляют 100 пмоль каждого праймера, проводят 30 циклов, состоящих из 30 сек при 94°С и 1 мин при 60°С, и, наконец, смесь инкубируют 5 мин при 60°С.
После очистки продукта PCR с использованием 1,5% низкоплавкого агарозного геля его подвергают расщеплению под действием SalI и NotI и вставляют в экспрессирующий вектор pSFLAG, включающий человеческий EF1α промотер и лидерную последовательность антитела (SEQ ID NO: 14). После секвенирования ДНК получают плазмиду pTMT-scFv, содержащую фрагмент ДНК, включающий корректную последовательность ДНК. Структура экспрессирукщего вектора pTMT-scFv схематически демонстрируется на фиг.2. Конструирование pSFLAG проводят, как описано ниже. Два перекрывающихся олигонуклеотида S-FLAG1 (SEQ ID NO: 15) и S-FLAG2 (SEQ ID NO: 16) в смысловом и антисмысловом направлениях соответственно конструируют и синтезируют так, чтобы они кодировали сайт распознавания рестрикционного фермента, лидерную последовательность антитела (SEQ ID NO: 14), FLAG пептид (SEQ ID NO: 10) и сайты распознавания рестрикционных ферментов Kpnl, NotI и BamHI. Реакционную смесь, содержащую 100 пмоль каждого из синтезированных олигонуклеотидов, инкубируют 5 мин при 96°С, в течение 20 мин температуру снижают до 65°С и инкубируют 5 мин при 65°С. Затем в течение 20 мин температуру снижают до 42°С, смесь инкубируют еще 5 мин и затем два нуклеотида подвергают отжигу путем понижения температуры до комнатной в течение 20 мин. Этот фрагмент ДНК вставляют в pCOS1, расщепленный EcoRI и BamHI.
Пример 3: Конструирование экспрессирующих систем для гибридных белков SR345-gp130 и scFv-gp130
(А) SR345-gp130
Передающая цитокиновый сигнал молекула gp130 представляет собой мембраносвязанный белок I типа (Таgа, Т. et al., Cell (1989) 58, 573-581, Saito, M., et al., J. Immunol. (1992) 148, 4066-4071). Для того, чтобы обеспечить экспрессию гибридного белка, включающего SR345 и частичную последовательность мышиного gp130, в клетках COS, часть кДНК мышиного gp130 лигируют в экспрессирующий вектор pTMT-SR345 ниже кДНК, кодирующей растворимый рецептор IL-6 (SR345). Было сконструировано два типа гибридных белков в соответствии с различиями в частичных областях gp130. Один из них представляет собой мембраносвязанный гибридный белок (SR345-mgpTMIC), в котором трансмембранная область gр130 и последующая внутриклеточная область являются лигированными, а другой представляет собой секреторный гибридный белок (SR345-mgpIC), в котором лигирована только внутриклеточная область gp130. SEQ ID NO: 17 демонстрирует аминокислотную последовательность и нуклеотидную последовательность полноразмерного мышиного gр130.
1) Создание экспрессирующего вектора для получения мембраносвязанного гибридного белка SR345-mgpTMIC
Полноразмерную кДНК мышиного др130 расщепляют с помощью EcoRI с получением EcoRI фрагмента величиной прибл. 1,1 т.п.н. EcoRI фрагмент кодирует аминокислоты от 603-его положения до 917-ого положения (С конец) мышиного др130, и содержит участки, кодирующие часть (15 аминокислот) внеклеточной области мышиного др130 и целиком последующую трансмембранную область и внутриклеточную область. Этот EcoRI фрагмент вставляют в EcoRI сайт экспрессирующего вектора PTMT-SR345 для создания экспрессирующего вектора для получения мембраносвязанного гибридного белка SR345-mgpTMIC.
2) Создание экспрессирующего вектора для получения секреторного гибридного белка SR345-mgpIC
Для получения фрагмента кДНК, кодирующего внутриклеточную область мышиного gр130, были синтезированы праймеры для PCR, mgp2 (SEQ ID NO: 20; включая ДНК, кодирующую 646-651 аминокислоты аминокислотной последовательности SEQ ID NO: 17), к которому были добавлены HindIII и EcoRI сайты, и mgр3 (SEQ ID NO: 19; включая ДНК, кодирующую 912-917 аминокислоты (С конец) аминокислотной последовательности SEQ ID NO: 17), и с использованием этих праймеров был получен фрагмент кДНК величиной приблизительно 1 т.п.н., кодирующий мышиный gр130. Этот фрагмент величиной прибл. 1 т.п.н. кодирует 646-917 аминокислоты аминокислотной последовательности SEQ ID NO: 17, что соответствует внутриклеточной области, в которой утрачены шесть аминокислот из N-конца. Полученный таким образом фрагмент кДНК расщепляют с помощью EcoRI и вставляют в EcoRI сайт экспрессирующего вектора pTMT-SR345 для получения экспрессирующего вектора для получения секреторного гибридного белка SR345-mgpIC.
(В) scFv-gp130
Для того, чтобы экспрессировать в клетках COS гибридный белок, включающий scFv и часть области мышиного gр130, кДНК фрагмента мышиного gр130 лигируют в векторе pTMT-scFv ниже кДНК scFv. Было сконструировано два типа гибридных белков в соответствии с различиями в частичных областях др130. Один из них представляет собой мембраносвязанный гибридный белок (scFv-mgpTMIC), в котором трансмембранная область gр130 и последующая внутриклеточная область являются лигированными, а другой представляет собой секреторный гибридный белок (scFv-mgpIC), в котором лигирована только внутриклеточная область gр130.
1) Создание экспрессирующего вектора для получения мембраносвязанного гибридного белка scFv-mgpTMIC
Для получения фрагмента кДНК, кодирующего всю внутриклеточную и трансмембранную область мышиного gр130, были синтезированы праймеры для PCR, mgp1 (SEQ ID NO: 18; включая ДНК, кодирующую 603-608 аминокислоты аминокислотной последовательности SEQ ID NO: 17), к которому был добавлен HindIII сайт, и mgp3 (SEQ ID NO: 19; включая ДНК, кодирующую 912-917 аминокислоты (С конец) аминокислотной последовательности SEQ ID NO: 17), к которому был добавлен NotI сайт, и с использованием этих праймеров был получен фрагмент кДНК величиной приблизительно 1,1 т.п.н., кодирующий мышиный gр130. Этот фрагмент величиной прибл. 1,1 т.п.н. кодирует 603-917 аминокислоты (С-конец) аминокислотной последовательности SEQ ID NO: 17, что включает часть внеклеточной области мышиного др130 (15 аминокислот) и целиком последующие трансмембранную и внеклеточную области. Полученный таким образом фрагмент кДНК расщепляют с помощью HindIII и NotI и вставляют в HindIII-NotI сайты экспрессирующего вектора pTMT-scFv для получения экспрессирующего вектора для получения мембраносвязанного гибридного белка scFv-mgpTMIC.
2) Создание экспрессирующего вектора для получения секреторного гибридного белка scFv-mgpIC
Для получения фрагмента кДНК, кодирующего внутриклеточную область мышиного gp130, были синтезированы праймеры для PCR, mgp2 (SEQ ID NO: 20; включая ДНК, кодирующую 646-651 аминокислоты аминокислотной последовательности SEQ ID NO: 17), к которому были добавлены HindIII-EcoRI сайты, и mgр3 (SEQ ID NO: 19; включая ДНК, кодирующую 912-917 аминокислоты (С конец) аминокислотной последовательности SEQ ID NO: 17), к которому был добавлен NotI сайт, и методом PCR с использованием этих праймеров был получен фрагмент кДНК величиной приблизительно 1 т.п.н., кодирующий мышиный gр130.
Этот фрагмент величиной прибл. 1 т.п.н. кодирует 646-917 аминокислоты (С-конец) аминокислотной последовательности SEQ ID NO: 17, что соответствует внутриклеточной области, в которой утрачены шесть аминокислот из N-конца. Полученный таким образом фрагмент кДНК расщепляют с помощью HindIII и NotI и вставляют в HindIII-NotI сайты экспрессирующего вектора pTMT-scFv для получения экспрессирующего вектора для получения секреторного гибридного белка scFv-mgpIC.
Пример 4: Экспрессия с использованием клеток COS
Каждый тип из вышеупомянутых экспрессирующих векторов трансфицируют в клетки COS, осуществляют неустойчивую экспрессию гибридного белка и подтверждают, что клетки, экспрессирующие гибридный белок на клеточной мембране, выборочно концентрируются путем пэннинга. В качестве отрицательного контроля используют клетки COS, трансфицированные экспрессирующим вектором, не содержащим гены. В качестве положительного контроля используют клетки COS, трансфицированные экспрессирующим вектором Р3.19, который получают путем введения ДНК, кодирующей белок антиген НМ1.24 (WO 98/14580), в вектор pCOS1, которые собирают методом пэннинга с использованием соответствующего антитела.
1) Трансфекция в клетки COS
Плазмидную ДНК трансфицируют в клетки COS, используя Lipofect AMINE PLUS™ Reagent (GIBCO-BRL). А именно клетки COS-7, высеянные в количестве 1×105 клеток/лунку (6-луночный планшет) за день до трансфекции, культивируют в течение ночи и промывают культуральной средой DMEM, не содержащей сыворотки (GIBCO-BRL), затем к ним добавляют 0,8 мл такой же культуральной среды. Отдельно готовят следующую смесь: 1 мкг плазмидной ДНК и 6 мкл PLUS Reagent добавляют к 0,1 мл культуральной среды DMEM, не содержащей сыворотки. Затем смесь инкубируют в течение 15 минут при комнатной температуре, смешивают с 0,1 мл LipofectAMINE раствора (4 мкл LipofectAMINE/0,1 мл культуральной среды DMEM, не содержащей сыворотки) и инкубируют еще 15 минут при комнатной температуре. Далее эту смесь добавляют к вышеупомянутым клеткам COS-7 и инкубируют в течение 3 часов при 37°С. Затем к клеткам добавляют культуральную среду DMEM (1 мл), содержащую 20% фетальной телячьей сыворотки (GIBCO-BRL) (конечная концентрация сыворотки = 10%). После культивирования в течение ночи объем культуральной среды увеличивают до 3 мл культуральной среды DMEM, содержащей 10% фетальной телячьей сыворотки, и инкубируют в течение 3 дней при 37°С и 5% СO2.
2) Приготовление чашки для пэннинга
При использовании экспрессирующего вектора pTMT-SR345 чашку, покрытую мышиными антителами МТ18 против человеческого рецептора IL-6 (см. непрошедшую экспертизу патентную заявку Японии № Hei 2-288898) получают в соответствии со способом Seed, В. et al., Proc. Natl. Acad. Sci. USA. (1987) 84, 3365-3369. А именно мышиные антитела против рецептора IL-6 добавляют к 50 мМ Tris-HCl (pH 9,5) до получения концентрации 10 мкг/мл. Приготовленный таким образом раствор антитела (3 мл) инкубируют при комнатной температуре в течение 2 часов в чашке для культивирования клеток диаметром 60 мм. После трехкратного промывания культуральной чашки 0,15 М раствором NaCl добавляют PBS, содержащий 5% фетальной телячьей сыворотки, 1 мМ EDTA и 0,02% NаN3, и затем после блокировки пэннинг проводят, как описано ниже.
При использовании pTMT-scFv получают два типа чашек для пэннинга. Одну покрывают рецептором IL-6 растворимого типа (SR344) (Yasukawa, К. et al., J. Biochem. (1990) 108, 673-676), а другую покрывают вышеупомянутыми мышиными антителами против рецептора IL-6. Концентрацию SR344 доводят до 2 мкг/мл с помощью 50 мМ Tris-HCl (pH 9,5) и чашки для пэннинга получают, как описано выше. При использовании в качестве отрицательного контроля pCOS-1 применяют чашку, покрытую вышеупомянутыми мышиными антителами против рецептора IL-6. При использовании в качестве положительного контроля экспрессирующего вектора Р3.19 для белкового антигена НМ1.24 применяют чашку, покрытую антителом против антигена НМ1.4.
3) Пэннинг
pCOS-1- или рТМТ-SR345-трансфицированные клетки COS-7 отделяют от плашки с помощью PBS, содержащего 1 мМ EDTA, промывают один раз PBS, содержащим 5% фетальной телячьей сыворотки, суспендируют в 2 мл PBS, содержащего 5% фетальной телячьей сыворотки и 0,02% NaN3, и добавляют к чашке для пэннинга, покрытой мышиными антителами против рецептора IL-6.
pTMT-scFv-трансфицированные клетки COS-7 подвергают пэннингу тремя различными методами. В одном методе после отделения, как описано выше, и однократного промывания PBS, содержащим 5% фетальной телячьей сыворотки, клетки COS-7 суспендируют в 500 мкл PBS, содержащего 2 мкг/мл SR344, 5% фетальной телячьей сыворотки и 0,02% NaN3, и инкубируют на льду в течение 1 часа. После трехкратного промывания охлажденным во льду PBS клетки повторно суспендируют в PBS, содержащем 0,2 мМ агента для поперечной сшивки бис(сульфосукцинимидил) суберата (BS3; PIERCE) и 50 мМ Hepes (pH 8,0), и дополнительно инкубируют на льду в течение 30 мин. Затем 1 М Tris-HCl (pH 8,0) добавляют к 50 мМ и инкубируют дополнительно на льду в течение 10 мин для удаления избыточного количества агента для поперечной сшивки. После промывания клеток PBS их добавляют к чашке для пэннинга, покрытой мышиными антителами против рецептора IL-6. Во втором методе клетки COS-7, проинкубированные с SR344, добавляют к чашке для пэннинга, покрытой мышиными антителами против рецептора IL-6 без обработки агентом для поперечной сшивки. В третьем методе клетки COS-7 добавляют к чашке, непосредственно покрытой SR344. Время инкубации на льду, обработка Tris-HCl и промывание были одинаковыми во всех трех методах.
Клетки COS-7, трансфицированные экспрессирующим вектором Р3.19 для белкового антигена НМ1.24, добавляют к чашке для пэннинга, покрытой антителом против антигена НМ1.24 (WO 98/14580). После инкубации вышеупомянутых различных типов клеток COS-7 на различных чашках для пэннинга в течение 2 ч при комнатной температуре чашки осторожно промывают три раза PBS, содержащим 5% фетальной телячьей сыворотки и 0,02% NаN3, и плазмидные ДНК собирают из клеток, связанных с чашками для пэннинга, используя 0,6% SDS и раствор, содержащий 10 мМ EDTA. Эффект концентрации в результате пэннинга оценивают путем трансфекции 1/5-ной части выделенной плазмидной ДНК в Е.coli DH5a с помощью электропореза, и по числу появившихся ампициллин-устойчивых колоний. Эти результаты показаны в фиг.3.
При использовании экспрессирующего вектора pTMT-SR345, SR345-mgpIC приводит к появлению большего числа колоний, чем SR345-mgpTMIC, и, следовательно, никакой специфичности против мембраносвязанного белка не наблюдается. С другой стороны, при использовании экспрессирующего вектора рТМТ-scFv во всех методах пэннинга scFv-mgpTMIC приводит к появлению большего числа колоний, чем scFv-mgpIC, и, следовательно, клетки, экспрессирующие мембраносвязанный белок, специфически концентрируются. Селективность была более очевидной в тех случаях, когда использовался агент для поперечной сшивки.
Таким образом, вышеприведенные результаты демонстрируют, что кДНК, кодирующую мембраносвязанный белок, получают с более высокой эффективностью и избирательностью путем экспрессии на клеточной поверхности функционального белка (одноцепочечного антитела) в виде гибридного белка, чем путем экспрессии только эпитопа, распознаваемого антителом как гибридный белок.
Обычно несколько повторяющихся пэннингов повышают селективность клонирования, но, как показано настоящим примером, в настоящем изобретении, где функциональный белок экспрессируется на клеточной мембране, выдающаяся селективность наблюдается в первом пэннинге. Следовательно, клонирование гена, кодирующего мембраносвязанный белок, может быть проведено с предельной эффективностью и селективностью путем применения пэннинга дополнительно несколько раз.
Пример 5: Конструирование экспрессирующей системы гибридного белка с использованием гуманизированного бивалентного одноцепочечного Fv
1. Конструирование экспрессирующего вектора для получения бивалентного одноцепочечного Fv гуманизированного антитела РМ1
Экспрессирующий вектор для получения бивалентного одноцепочечного Fv конструируют на основе Fv гуманизированного антитела РМ1. Одноцепочечный Fv гуманизированного антитела РМ1 (hPMi-BvGSB), имеющий бивалентный вариабельный участок, конструируют следующим образом: две молекулы одноцепочечного Fv2 гуманизированного антитела РМ1, как описано в примере 2, лигируют через пептидный линкер, включающий (Gly4Sеr)3 (SEQ ID NO: 1). Аминокислотная последовательность и нуклеотидная последовательность hPM1-BvGS3 приведены в SED ID NO: 21.
Конструирование экспрессирующего вектора pTMT-BvGS3 осуществляют следующим образом. Ген, кодирующий одноцепочечный Fv гуманизированного антитела РМ1, имеющий в С-конце линкер, включающий (Gly4Sеr)3, амплифицируют методом PCR. ТМТ-1 (SEQ ID NO: 6) используют в качестве обратного праймера. Кроме того, прямой праймер BvGS3 (SEQ ID NO: 22) конструируют таким образом, чтобы он гибридизовался с ДНК, кодирующей С-конец L-цепи V-участка, а также включал нуклеотидную последовательность, кодирующую линкер и сайт распознавания рестрикционного фермента SalI. PCR проводят, используя 100 нг pTMT-scFv в качестве матрицы ДНК в таких же условиях, как описано выше, и продукт PCR очищают, используя 1,5% низкоплавкого агарозного геля.
Продукт PCR расщепляют с помощью рестрикционного фермента SalI и вставляют в клонирующий вектор pBluescriptII (Stratagene). После секвенирования ДНК плазмиду, содержащую фрагмент ДНК, включающий корректную последовательность ДНК, расщепляют с помощью рестрикционного фермента Sall с получением гена, кодирующего одноцепочечный Fv гуманизированного антитела РМ1, имеющий в С-конце линкер, включающий (Gly4Ser)3. Далее путем вставки фрагмента ДНК, полученного, как описано выше, в pTMT-scFv получают hPM1-BvGS3 экспрессирующий вектор TMT-BvGS3. Структура hPM1-BvGS3 экспрессирующего вектора pTMT-BvGS3 схематически показана на фиг.4.
2. Конструирование экспрессирующего вектора для получения гибридного белка hPM1-BvGS3-gp130
В экспрессирующий вектор pTMT-BvGS3 лигируют кДНК части мышиного gр130 ниже кДНК, кодирующей hPM1-BvGS3, для конструирования экспрессирующей системы гибридного белка, включающего hPM1-BvGS3 и частичную область gр130. Конструируют два типа гибридных белков в соответствии с различиями в лигируемых частичных областях gр130. Один из них представляет собой мембраносвязанный гибридный белок (BvGS3-mgpTMIC), в котором лигированы трансмембранная область gр130 и последующая внутриклеточная область, а другой представляет собой секреторный гибридный белок (BvGS3-mgpIC), в котором лигирована только внутриклеточная область gp130. BvGS3-mgpTMIC и BvGS3-mgpIC получают в примере 3 (В)-1) и 2) соответственно и путем вставки их в сайты HindIII-NotI pTMT-BvGS3 конструируют экспрессирующий вектор для мембраносвязанного гибридного белка рТМТ-BvGS3-mgpTMIC и экспрессирующий вектор для секреторного гибридного белка pTMT-BvGS3-mgpIС.
Пример 6: Анализ экспрессии с помощью проточного цитометра
Каждый тип экспрессирующих векторов, конструированных выше, pTMT-BvGS3, pTMT-BvGS3-mgpIC и pTMT-BvGS3-mgpTMIC, трансфицируют в клетки COS-7, осуществляют неустойчивую экспрессию гибридного белка и экспрессию на клеточной мембране анализируют с помощью проточного цитометра (FACScan, Beckton Dickinson). Анализы экспрессии проводят двумя методами. Один включает детекцию крысиными поликлональными антителами против гуманизированного антитела РМ-1, а другой включает детекцию мышиными антителами против рецептора IL-6 МТ-18 в присутствии антитела против растворимого рецептора IL-6. В результате было подтверждено, что мембраносвязанный гибридный белок BvGS3-mgpTMIC сильно экспрессируется на клеточной мембране в форме, которая может распознавать растворимый рецептор IL-6. Клетки, трансфицированные экспрессирующим вектором pCOS-1, используют в качестве отрицательного контроля.
1) Трансфекция в клетки COS-7
Плазмидную ДНК трансфицируют в клетки COS-7, используя набор для трансфекции FuGENEТМ6 (Boehringer-Mannheim).
А именно клетки COS-7, высеянные в количестве 5х104 клеток/лунку (6-луночный планшет) за день до трансфекции, культивируют в течение ночи при 37°С и 5% CO2 в 2 мл культуральной среды DMEM (GIBCO-BRL), содержащей 10% фетальной телячьей сыворотки. В день трансфекции 6 мкл FuGENE™6 добавляют к 0,1 мл культуральной среды DMEM, не содержащей сыворотки, и после инкубирования в течение 5 мин при комнатной температуре смешивают с 2 мкг плазмидной ДНК и инкубируют еще 15 мин при комнатной температуре. Далее эту смесь добавляют к вышеупомянутым клеткам COS-7 и инкубируют в течение трех дней при 37°С и 5% CO2.
2) Окрашивание клеток COS-7
Вышеупомянутые клетки COS-7 отделяют с помощью PBS, содержащего 1 мМ EDTA, промывают PBS, содержащим 5% фетальной телячьей сыворотки, суспендируют в 50 мкл буфера FACS (PBS, содержащий 2% фетальной телячьей сыворотки и 0,05% NaN2), и окрашивают с помощью следующих двух типов методов.
A) Окрашивание с использованием крысиных поликлональных антител против гуманизированного антитела РМ-1
Крысиные поликлональные антитела против гуманизированного антитела РМ-1 (2 мкг/реакцию) добавляют к вышеупомянутым клеткам COS-7, инкубируют в течение 30 мин на льду, промывают дважды 1 мл буфера FACS и ресуспендируют в 50 мкл буфера FACS. Далее, добавляют 2 мкл/реакцию FITC (флюоресцеин изотиоцианат)-меченных анти-крысиных IgG козла (AMERICAN QUAREX) и для отдельного окрашивания мертвых клеток 2,5 мкг/реакцию PI (пропидий йодида) и инкубируют в течение 30 мин на льду в темноте. После инкубации клетки дважды промывают 1 мл буфера FACS и ресуспендируют в 0,5 мл буфера FACS для анализа с помощью проточного цитометра.
B) Окрашивание с использованием мышиных антител МТ-18 против рецептора IL-6
Рецептор IL-6 растворимого типа (3 мкг/реакцию) добавляют к вышеупомянутым клеткам COS-7 и инкубируют в течение 4 ч на льду, промывают дважды 1 мл буфером FACS и ресуспендируют в 50 мкл буфера FACS. Далее, добавляют 2 мкг/реакцию мышиных антител МТ-18 против рецептора IL-6 и инкубируют в течение 30 мин на льду. После инкубации клетки промывают дважды 1 мл буфера FACS и ресуспендируют в 50 мкл буфера FACS. Далее, добавляют 2 мкл/реакцию FITC-меченных антимышиных IgG2b козла (Dainippon Seiyaku) и для отдельного окрашивания мертвых клеток 2,5 мкг/реакцию PI (пропидия йодида) и инкубируют в течение 30 мин на льду в темноте. После инкубации клетки дважды промывают 1 мл буфера FACS и ресуспендируют в 0,5 мл буфера FACS для анализа с помощью проточного цитометра.
3) Анализ экспрессии с помощью проточного цитометра
Анализ методом окрашивания с помощью PI и FSC (Forward Scatter) обнаружил, что присутствует популяция клеток, окрашенная PI (мертвые клетки). Мертвые клетки мешают проведению анализа, так как они неспецифически окрашиваются FITC. Следовательно, клеточная популяция, которая не окрашивается PI (живые клетки), отделяется, и анализ проводят только для этой популяции.
В результате окрашивания с использованием кроличьих поликлональных антител гуманизированного антитела РМ-1 никакой экспрессии секреторного белка hPM1-BvGS3 на клеточной мембране не наблюдали, однако наблюдали высокую степень экспрессии мембраносвязанного гибридного белка BvGS3-mgpTMIC. Исходя из этого факта, можно предположить, что BvGS3-mgpTMIC, который имеет трансмембранную область, не секретируется и улавливается на клеточной мембране. Однако, с другой стороны, детектируют экспрессию BvGS3-mgpIC на клеточной мембране, несмотря на то, что он является секреторным гибридным белком. Предполагают, что это происходит вследствие того, что по своим характеристикам BvGS3-mgpIC отличается от BvGS3, а именно по молекулярному размеру и структуре, гиброфобной области, содержащейся в mgpIC, встроенной ниже его, и др. А именно предполагают, что благодаря различиям в характеристиках BvGSS-mgpIC не проходит через клеточную мембрану так быстро, как BvGS3, этот процесс занимает для него больше времени. В результате количество локализованного на клеточной мембране белка увеличивается, и все белки, чьи эпитопы вытесняются на клеточную поверхность, обнаруживаются с помощью кроличьих поликлональных антител против гуманизированного РМ-1. Эти результаты приведены на фиг.5.
С другой стороны, в случае окрашивания с использованием мышиных антител МТ-18 против рецептора IL-6 подобно результатам окрашивания с использованием кроличьих поликлональных антител против гуманизированного антитела РМ-1, хотя для секреторного белка hPM1-BvGS3 экспрессию не детектируют, степень экспрессии мембраносвязанного гибридного белка BvGS3-mgpTMIC была высокой. Однако для секреторного гибридного белка BvGSS-mgpIC получают результаты, отличающиеся от результатов, полученных с использованием кроличьих поликлональных антител против гуманизированного антитела РМ-1, и любая экспрессия обнаруживается на клеточной мембране с трудом. Это показывает, что, хотя мембраносвязанный гибридный белок BvGS3-mgpTMIC экспрессируется на клеточной мембране, образуя функциональную конформацию, которая способна распознавать рецептор IL-6 растворимого типа, большая часть секреторного гибридного белка BvGS3-mgpIC, хоть и локализована на клеточной мембране, не обладает функциональной конформацией, способной распознавать рецептор IL-6 растворимого типа. Эти результаты показаны на фиг.6.
Таким образом, результаты, полученные с помощью проточного цитометра, позволяют предположить, что, если всего лишь один эпитоп, распознаваемый антителом, экспрессируется в виде гибридного белка, то даже секреторные гибридные белки будут выбираться как ложноположительные, если они локализованы на клеточной мембране. С другой стороны, если функциональный белок данного изобретения (например, одноцепочечное антитело) экспрессируется на поверхности клетки в виде гибридного белка, появляется возможность более селективного и эффективного клонирования кДНК, кодирующей мембраносвязанный белок.
Пример 7
1. Конструирование одноцепочечного Fv гуманизированного антитела РМ1
Для улучшения эффективности клонирования конструируют три других типа одноцепочечного Fv и их бивалентного одноцепочечного Fv. Так как шарнирный участок (SEQ ID NO: 5, аминокислотная последовательность с 242-ого по 256-ое положение), добавленный во время конструирования вышеупомянутого одноцепочечного Fv гуманизированного антитела РМ1, содержит аминокислотные остатки с высокой степенью гидрофобности, для более стабильной внеклеточной экспрессии конструируют следующие три типа одноцепочечного Fv гуманизированного антитела РМ1. А именно для удаления гидрофобной области из С-конца конструируют одноцепочечный Fv без шарнирной области и обозначают его как shPM1(ΔEL) (SEQ ID NO: 23). Кроме того, так как понятно, что стабильность и эффективность экспрессии будут увеличиваться при добавлении к С-концу одноцепочечного Fv некоторого домена, полученного из секреторного белка, к С-концу одноцепочечного Fv (SEQ ID NO: 23) добавляют аминокислотную последовательность, кодируемую человеческой κ-цепью константного участка или человеческой мембраннного типа μ-цепью константного участка экзона 4 (Dorai, H and Gillies S.D. Nucleic Acid Res., 17, 6412, 1989). Хотя 107-ой аминокислотный остаток человеческой κ-цепи константного участка изначально является цистеином, в данное время используют последовательность, в которой он заменен на серин (SEQ ID NO: 24). Кроме того, в качестве аминокислотной последовательности, кодируемой мембраннного типа μ-цепью константного участка экзона 4, используют последовательность, из которой удалены трансмембранный и внутриклеточный участки (SEQ ID NO: 25). Последовательности, в которых к С-концу одноцепочечного Fv добавлены соответствующие последовательности, упомянутые выше, обозначают shPMI-Kappa (SEQ ID NO: 26) и shPM1-MCH4 (SEQ ID NO: 27).
2. Конструирование экспрессирующего вектора shPM1(ΔEL)
Ген, кодирующий shPM1(ΔEL), амплифицируют методом PCR. Используют обратный праймер EF-1 (SEQ ID NO: 28) и прямой праймер SCP-C2 (SEQ ID NO: 29). PCR проводят с использованием 100 нг рТМТ-scFv в качестве матрицы ДНК в описанных выше условиях, и продукт PCR очищают, используя 1,5% низкоплавкий агарозный гель. Прямой праймер SCP-C2 гибридизуют с ДНК, кодирующей С-конец L-цепи V-участка, и добавляют нуклеотиды, кодирующие сайты распознавания рестрикционных ферментов HindIII-NotI и FLAG пептид (SEQ ID NO: 10).
После очистки продукт PCR подвергают расщеплению под действием EcoRI и NotI, продукт расщепления вставляют в вектор pSFLAG для получения shPM1 (ΔEL) экспрессирующего вектора pTMT-shPM1F. Более того, рТМТ-shPM1F-BVGS3, экспрессирующий вектор для получения shPM1 (ΔЕL)-BvGS3 (SEQ ID NO: 30), одноцепочечного Fv, который имеет бивалентный вариабельный участок, и у которого удален шарнирный участок, получают так же, как и в примере 5.
3. Конструирование экспрессирующего вектора shPM1-Kappa
Ген, кодирующий гибридный белок гуманизированного антитела РМ1 одноцепочечного Fv (SEQ ID NO: 23) и человеческой κ-цепи константного участка (SEQ ID NO: 24), конструируют путем PCR сборки. А именно после того, как гены, кодирующие одноцепочечный Fv гуманизированного антитела РМ1 и человеческую κ-цепь константного участка, отдельно амплифицируют с помощью PCR, они собираются в соответствии с их комплементарностью, и полноразмерный ген амплифицируют с использованием внешнего праймера.
Вначале ген, кодирующий κ-цепь константного участка, амплифицируют методом PCR. Обратный праймер Kappa1 (SEQ ID NO: 31) конструируют так, чтобы он мог гибридизоваться с нуклеотидной последовательностью, кодирующей шарнирный участок человеческой κ-цепи константного участка и аминокислотные остатки от Pro в 12-ом положении до Gly в 21-ом положении последующей аминокислотной последовательности (SEQ ID NO: 24). Прямой праймер Карра2 (SEQ ID NO: 32) конструируют так, чтобы он гибридизовался с нуклеотидной последовательностью, кодирующей аминокислотные остатки от Ser в 101-ом положении до Ser в 111-ом положении человеческой κ-цепи константного участка С-конца (SEQ ID NO: 24), и включал нуклеотидную последовательность, кодирующую сайты распознавания рестрикционных ферментов HindIII и NotI и FLAG пептид (SEQ ID NO: 10), а также два стоп-кодона. Используя эти праймеры, 107-ой аминокислотный остаток последовательности SEQ ID NO: 24, который изначально представляет собой остаток цистеина, заменяют остатком серина. PCR проводят в условиях, подобных условиям вышеописанного способа, с использованием двух видов вышеупомянутых праймеров и экспрессирующего вектора RV1-PM1a для получения L-цепи гуманизированного антитела РМ1 (см. WO92/19759) в качестве матрицы ДНК. Продукт PCR очищают, используя 1,5% низкоплавкий агарозный гель.
Далее, ген, кодирующий одноцепочечный Fv гуманизированного антитела РМ1, амплифицируют тем же способом. PCR проводят в тех же условиях, что и выше, используя EF1 (SEQ ID NO: 28) в качестве обратного праймера, SCP-K (SEQ ID NO: 33) в качестве прямого праймера, и pTMT-scFv в качестве матрицы ДНК. Прямой праймер SCP-K конструируют так, чтобы он гибридизовался с нуклеотидной последовательностью, кодирующей С-конец одноцепочечного Fv, показанной в SEQ ID NO:5, и включал нуклеотидную последовательность, которая комплементарна 5’-концу гена κ-цепи, амплифицированного PCR. Продукт PCR очищают тем же способом.
Используя метод, описанный в примере 2-3), амплифицируют полноразмерный фрагмент кДНК, кодирующий shPM1-Kappa. А именно 100 нг каждого из вышеупомянутых фрагментов ДНК собирают с помощью первичной PCR и затем для амплификации полноразмерного фрагмента кДНК добавляют 100 нг каждого из обратного праймера EF-1 (SEQ ID NO: 28) и прямого праймера Карра2 (SEQ ID NO: 32).
После очистки продукта PCR с использованием 1,5% низкоплавкого агарозного геля его подвергают расщеплению под действием рестрикционных ферментов EcoRI и NotI и вставляют в вектор pSFLAG для получения shPM1-Kappa экспрессирующего вектора pTMT-shPM1F-K (фиг.7). Более того, с помощью методов, подобных использованным в примере 5, получают экспрессирующий вектор pTMT-shPM1FK-BvGS3 для получения одноцепочечного Fv, имеющего бивалентный вариабельный участок, и shPM1-Kappa-BvGS3 (SEQ ID NO: 34).
4. Конструирование экспрессирующего вектора shPM1-MCH4
Ген, кодирующий гибридный белок, состоящий из одноцепочечного Fv гуманизированного антитела РМ1 (SEQ ID NO: 23) и частичной последовательности человеческой μ-цепи константного участка (SEQ ID NO: 25), конструируют путем PCR сборки. А именно гены, кодирующие одноцепочечный Fv гуманизированного антитела РМ1 и частичную последовательность человеческой μ-цепи константного участка, отдельно амплифицируют с помощью PCR и собирают в соответствии с их комплементарностью. Полноразмерный ген затем амплифицируют с использованием внешнего праймера.
Вначале ген, кодирующий константный участок человеческой μ-цепи, амплифицируют методом PCR. Обратный праймер МСН4-1 (SEQ ID NO: 35) конструируют так, чтобы он гибридизовался с нуклеотидной последовательностью, кодирующей 5’-конец константного участка человеческой μ-цепи экзона 4, и включал нуклеотидную последовательность 3’-конца одноцепочечного Fv гуманизированного антитела РМ1 (SEQ ID NO: 23). Прямой праймер МСН4-2.1 (SEQ ID NO: 36) конструируют так, чтобы он гибридизовался с нуклеотидной последовательностью, кодирующей внеклеточную область константного участка человеческой мембранного типа μ-цепи, и включал сайт распознавания рестрикционного фермента HindIII. PCR проводят в условиях, подобных использующимся в вышеописанном методе, с использованием двух типов вышеупомянутых праймеров и кДНК, полученной из клеточной линии человеческой миеломы CL-4 с помощью традиционных методов, в качестве матрицы ДНК. Продукт PCR очищают, используя 1,5% низкоплавкий агарозный гель.
Далее, ген, кодирующий одноцепочечный Fv гуманизированного антитела РМ1, амплифицируют таким же образом. PCR проводят в тех же условиях, как описано выше для использования EF1 (SEQ ID NO: 28) в качестве обратного праймера, SCP-Mu (SEQ ID NO: 37) в качестве прямого праймера и рТМТ-scFv в качестве матрицы ДНК. Прямой праймер SCP-Mu конструируют так, чтобы он гибридизовался с нуклеотидной последовательностью, кодирующей одноцепочечный Fv С-конца, показанной в SEQ ID NO: А, и включал нуклеотидную последовательность, комплементарную 5’-концу гена частичной последовательности μ-цепи, амплифицированного методом PCR. Продукт PCR очищают тем же способом.
Используя метод, описанный в примере 2-3), амплифицируют полноразмерный фрагмент кДНК, кодирующий shPM1-MCH4. Конкретно, 100 нг каждого из вышеупомянутых фрагментов ДНК собирают с помощью первичной PCR и затем для амплификации полноразмерного фрагмента кДНК добавляют 100 пмоль каждого из обратного праймера EF-1 (SEQ ID NO; 28) и прямого праймера МСН4-2.2 (SEQ ID NO: 38). Прямой праймер МСН4-2.2 конструируют так, чтобы он гибридизовался с 3’-концом нуклеотидной последовательности, кодирующей амплифицированную ранее частичную последовательность человеческой мембранного типа μ-цепи, и включал нуклеотидную последовательность, кодирующую FLAG пептид, два стоп-кодона и сайт распознавания рестрикционного фермента Notl.
После очистки продукта PCR с использованием 1,5% низкоплавкого агарозного геля его расщепляют с помощью рестрикционных ферментов EcoRI и Notl и вставляют в вектор pSFLAG для получения shPM1-MCH4 экспрессирующего вектора pTMT-shPM1F-MCH4 (фиг.7). Более того, используя методы, описанные в примере 5, получают экспрессирующий вектор pTMT-shPM1FM-BvGSS для получения одноцепочечного Fv, имеющего бивалентный вариабельный участок, и shPM1-MCH4-BvGS3 (SEQ ID NO: 39).
Пример 8: Скрининг библиотеки STX561 кДНК с помощью метода ТМТ с использованием shPM1-kappa экспрессирующего вектора (фиг.7)
1. Получение библиотеки кДНК STX561
мРНК из линии мышиных кроветворных стволовых клеток STX561 получают с помощью традиционного метода и кДНК, синтезированную на ней, вставляют в ТМТ экспрессирующий вектор shPM1-kappa для получения библиотеки кДНК STX561. Библиотеку кДНК получают, используя набор для синтеза кДНК (STRATAGENE, набор для синтеза кДНК). В основном следуют инструкции по использованию набора STRATAGENE для синтеза кДНК с модификациями, описанными ниже. Конкретно, в качестве обратной транскриптазы используют Superscript II, GIBCO-BRL, в качестве праймера для первого синтеза используют праймер NotI-dT (Pharmacia Biotech, праймер, присоединный к первой цепи набора для синтеза кДНК), в качестве адаптера к 5’-концу кДНК добавляют адаптер сайта HindIII-Smal, в качестве колонки для фракционирования по размеру используют Size sep 400 Spun Column of Pharmacia Biotech.
Конкретно, библиотеку кДНК получают следующим образом:
Исходное вещество представляет собой 5 мкг мРНК, и вначале из 3’ поли-А "хвоста" с помощью обратной транскриптазы синтезируют первую цепь (Superscript II, GICO-BRL), используя праймер NotI-dT (Pharmacia Biotech, праймер, присоединный к первой цепи набора для синтеза кДНК). Затем после синтеза второй цепи с помощью ДНК-полимеразы оба конца кДНК затупляют и добавляют адаптер сайта HindIII-Smal (Takara). После расщепления обоих концов с помощью HindIII и NotI проводят фракционирование по размеру (Pharmacia Biotech, Size sep 400 Spun Column) для удаления фрагментов кДНК размером 0,5 т.п.н. или меньше. Собранную кДНК вставляют в сайты HindIII-NotI TMT экспрессирующего вектора shPM1-kappa и вектор вводят в Е. coli DH10B (electroMAX DH10B, GIBCO-BRL) с помощью метода электропореза для получения библиотеки STX561 кДНК.
Библиотеку STX561 кДНК разделяют на пулы по 1000 клонов/пул и два ее пула (пул № # kappa-1, #kappa-6), всего 2000 клонов, используют для скрининга методом TMT.
2. Скрининг библиотеки STX кДНК методом пэннинга
1) Трансфекция в клетки COS-7
2 мкг каждой из плазмидных ДНК, полученных из #kappa-1 и #kappa-6 трансфицируют в клетки COS-7, используя FuGENEТМ6 (Boehringer-Mannheim).
А именно клетки COS-7, высеянные в количестве 1×105 клеток/лунку (6-луночный планшет) за день до трансфекции, культивируют в течение ночи при 37°С и 5% СO2 в 2 мл культуральной среды DMEM (GIBCO-BRL), содержащей 10% фетальной телячьей сыворотки. В день трансфекции 6 мкл FuGENEТМ добавляют к 0,1 мл культуральной среды DMEM, не содержащей сыворотки, инкубируют в течение 5 мин при комнатной температуре, затем смешивают с 2 мкг плазмидной ДНК и инкубируют еще 15 мин при комнатной температуре. Далее эту смесь добавляют к вышеупомянутым клеткам COS-7 и инкубируют в течение 3 дней при 37°С и 5% СО2.
2) Приготовление чашки для пэннинга
Чашку для пэннинга, покрытую антителами козла против мышиных IgG (Dainippon. Seiyaku, антимышиные IgG козла (Н+L цепи)), получают в соответствии с методом "Seed, В. et al., Proc. Natl. Acad. Sci. USA. (1987) 84, 3365-3369". А именно антитела козла против мышиных IgG добавляют к 50 мМ Tris-HCl (pH 9,5) до получения концентрации 10 мкг/мл. Полученный таким образом раствор (3 мл) добавляют к чашке для культивирования клеток диаметром 60 мм и инкубируют при комнатной температуре в течение 3 часов. После трехкратного промывания 0,15 М раствором NaCl добавляют PBS, содержащий 5% фетальной телячьей сыворотки, 1 мМ EDTA и 0,02% NaN3, и затем, после блокировки, пэннинг проводят следующим образом.
3) Пэннинг
Клетки COS-7, трансфицированные, как описано выше, отделяют от плашек с помощью PBS, содержащего 1 мМ EDTA, промывают один раз PBS, содержащим 5% фетальной телячьей сыворотки, суспендируют в 50 мкл буфера FACS (PBS, содержащий 2% фетальной телячьей сыворотки и 0,05% NaN2).
Рецептор IL-6 растворимого типа (2 мкг) добавляют к суспензии клеток и инкубируют в течение 90 мин на льду. Далее, после двукратного промывания буфером FACS клетки суспендируют в 50 мкл буфера FACS. Затем 1,5 мкг мышиных антител МТ-18 против рецептора IL-6 добавляют к суспензии клеток и суспензию инкубируют в течение 30 мин на льду. Клетки дважды промывают буфером FACS, суспендируют в 2 мл PBS, содержащего 5% фетальной телячьей сыворотки и 0,02% NaN3, и добавляют к чашке для пэннинга, покрытой антителами козла против мышиных IgG.
После инкубирования вышеупомянутых клеток COS-7 на чашках для пэннинга при комнатной температуре в течение приблизительно 2 часов чашки осторожно промывают три раза PBS, содержащим 5% фетальной телячьей сыворотки и 0,02% NаN3, и плазмидную ДНК собирают из клеток, связанных с чашками для пэннинга, используя раствор Hirts’ solution (раствор, содержащий 0,6% SDS и 10 мМ EDTA). Половину собранной плаэмидной ДНК трансфицируют в 40 мкл Е.coli DH10B (electroMAX DH10B, GIBCO-BRL) методом электропореза и после инкубирования в течение 1 ч в 1 мл культуральной среды SOC отбирают аликвоту объемом 50 мкл для проверки титра и высевают на чашку, содержащую LB-ампициллин (100 мкг/мл). С другой стороны, оставшуюся культуру переносят в 500 мл жидкой культуральной среды, содержащей LB-ампициллин (100 мкг/мл), и культивируют. После культивирования в течение ночи плазмидную ДНК получают с помощью набора для очистки плазмидной ДНК (Plasmid-Maxi, QIAGEN), хранят в замороженном состоянии при -20°С.
Порцию массой 1 мкг каждой плазмидной ДНК, полученной на пул, повторно трансфицируют в клетки COS-7, используя 3 мкл FuGENEТМ6 (Boehringer-Mannheim), второй пэннинг, выделение и получение плазмидной ДНК проводят, как описано выше.
3. Анализ нуклеотидной последовательности и кодируемая аминокислотная последовательность полученного клона кДНК
После первого и второго пэннинга колонии свободно собирают из чашек для проверки титра и после культивирования каждой в 2 мл жидкой культуральной среды, содержащей LB-ампициллин (100 мкг/мл), получают плазмидные ДНК. Далее, еще одну кДНК вставку анализируют методом рестрикционного ферментного анализа с использованием Smal и NotI, секвенирование проводят с 5’ стороны, и в результате анализа их нуклеотидной последовательности и кодируемой ею аминокислотной последовательности было обнаружено, что гены мембраносвязанных белков могут быть выборочно отсортированы с помощью метода ТМТ. Результаты приведены в таблице 1.
Первый пэннинг
Второй пэннинг
В первом пэннинге были получены известные мембраносвязанные белки, цитохромоксидаза (1 клон), NADH-дегидрогеназа (2 клона) и АТР-синтаза (1 клон). С другой стороны, во втором пэннинге были получены известные мембраносвязанные белки, цитохромоксидаза (1 клон), NADH-дегидрогеназа (2 клона) и АТР-синтаза (3 клона). Все указанные выше белки представляют собой мембраносвязанные белки, локализованные на внутренней мембране митохондрий. Например, известно, что АТР-синтаза относится к типу белков с однократным пронизыванием мембраны, цитохромоксидаза - к типу белков с двукратным пронизыванием мембраны, и NADH-дегидрогеназа - к типу белков с пятнадцатикратным пронизыванием мембраны. Эти результаты показывают, что метод ТМТ дает возможность выделять не только мембраносвязанные белки типа I, но также белки, имеющие множественные трансмембранные области.
Получение клона последовательности поли Т во втором пэннинге является возможным благодаря вставке кДНК, включающей поли А в противоположном направлении. Поли Т транслируется в аминокислотную последовательность, в которой остатки фенилаланина, являющиеся гидрофобными, выстроены в линию, и считается, что она должна выделяться, так как является предельно гидрофобной.
Кроме того, процентное содержание мембраносвязанных белков, содержащихся в собранных клонах, во втором пэннинге выше, чем в первом. Это показывает, что мембраносвязанные белки селективно концентрируются в результате повторяющихся пэннингов.
Таким образом, обнаружено, что в настоящей системе скрининга библиотеки кДНК метод ТМТ является эффективным методом селективного клонирования мембраносвязанных белков типа I и мембраносвязанных белков, включающих множественные трансмембранные области.
ПРОМЫШЛЕННОЕ ПРИМЕНЕНИЕ
Считается, что из-за структурных затруднений молекулы антител не могут с легкостью проявлять антигенсвязывающую активность, если они находятся в состояниях, при которых они аккумулируются на клеточной мембране в процессе секреции, и при которых они могут агглютинировать с гибридными белками вследствие неприродных структур и аминокислотного состава. Следовательно, в настоящем изобретении клетки, функционально экспрессирующие на клеточной поверхности гибридные белки антител, могут быть выборочно отсортированы путем использования чашки для пэннинга, полученной с использованием антигена, распознающего антитело. А именно настоящее изобретение предоставляет способ предельно селективного клонирования генов, кодирующих связанные с клеточной мембраной белки, путем эффективного удаления клеток, имеющих на клеточной поверхности гибридные белки, антигенсвязывающая активность которых является низкой или отсутствует.
































| название | год | авторы | номер документа |
|---|---|---|---|
| МОДИФИЦИРОВАННОЕ АГОНИСТИЧЕСКОЕ АНТИТЕЛО | 2001 |
|
RU2295537C2 |
| ДЕГРАДИРОВАННОЕ АНТИТЕЛО, ЯВЛЯЮЩЕЕСЯ АГОНИСТОМ TPO | 2001 |
|
RU2287534C2 |
| НАПРАВЛЕННЫЕ НА ОПУХОЛЬ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ FZD10 И ИХ ПРИМЕНЕНИЕ | 2006 |
|
RU2412203C2 |
| МОНОМОЛЕКУЛЯРНЫЙ ХИМЕРНЫЙ Т-КЛЕТОЧНЫЙ РЕЦЕПТОР К РАКОВОМУ АНТИГЕНУ СА125 | 2018 |
|
RU2747095C2 |
| СПОСОБ СВЯЗЫВАНИЯ ИНТЕРЕСУЮЩИХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ | 2004 |
|
RU2392324C2 |
| СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ ВИРУСА БЕШЕНСТВА НЕЙТРАЛИЗУЮЩИЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА И НУКЛЕИНОВЫЕ КИСЛОТЫ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2001 |
|
RU2272809C2 |
| ICAM-4 И ЕГО ДИАГНОСТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ | 1998 |
|
RU2208230C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2011 |
|
RU2774414C2 |
| АНТИТЕЛО ПРОТИВ МОЛЕКУЛЫ КЛЕТОЧНОЙ АДГЕЗИИ L1 ИЛИ ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И СОДЕРЖАЩИЙ ЕГО ХИМЕРНЫЙ РЕЦЕПТОР АНТИГЕНА | 2019 |
|
RU2789360C2 |
| PSCAXCD3, CD19XCD3, C-METXCD3, ЭНДОСИАЛИНXCD3, EPCAMXCD3, IGF-1RXCD3 ИЛИ FAP-АЛЬФАXCD3 БИСПЕЦИФИЧЕСКОЕ ОДНОЦЕПОЧЕЧНОЕ АНТИТЕЛО С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2009 |
|
RU2547600C2 |
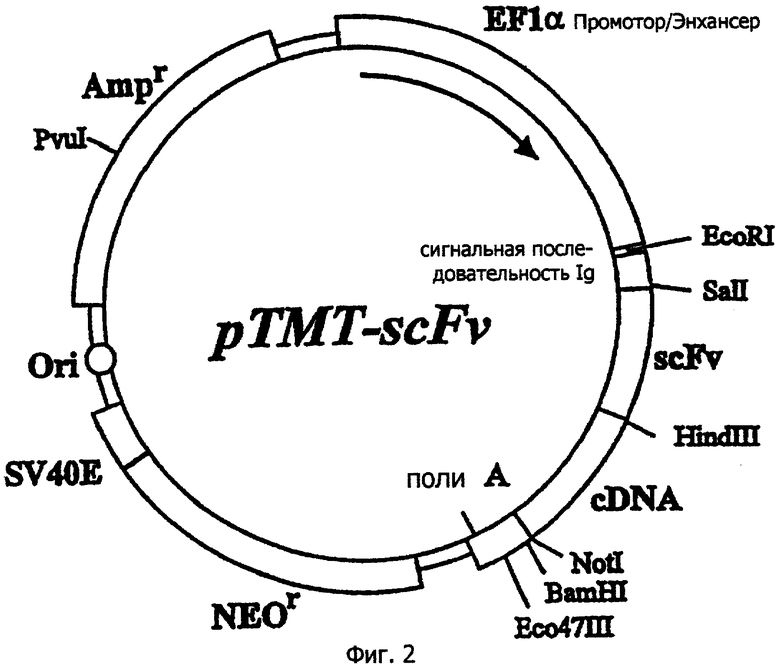
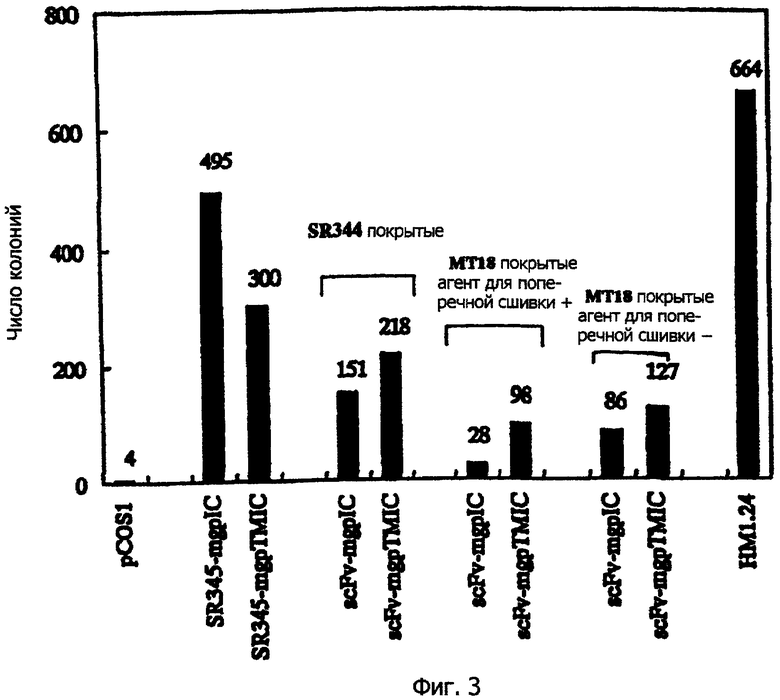
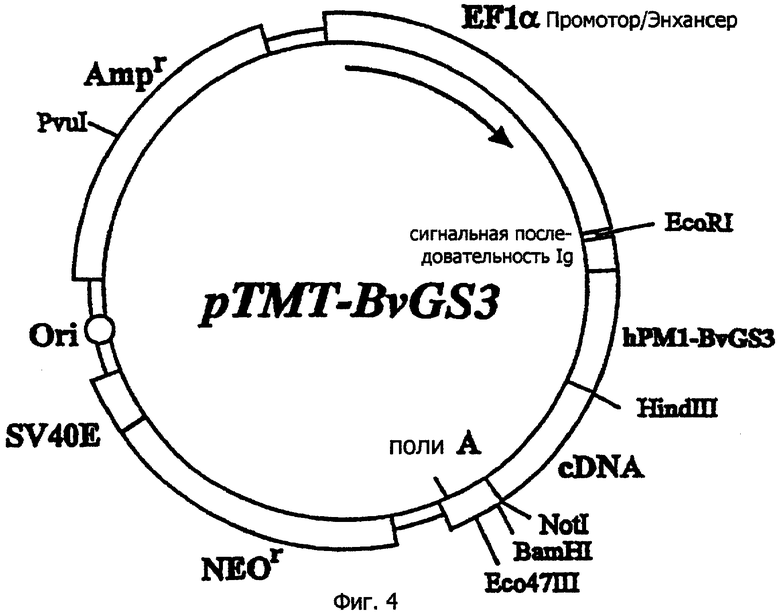
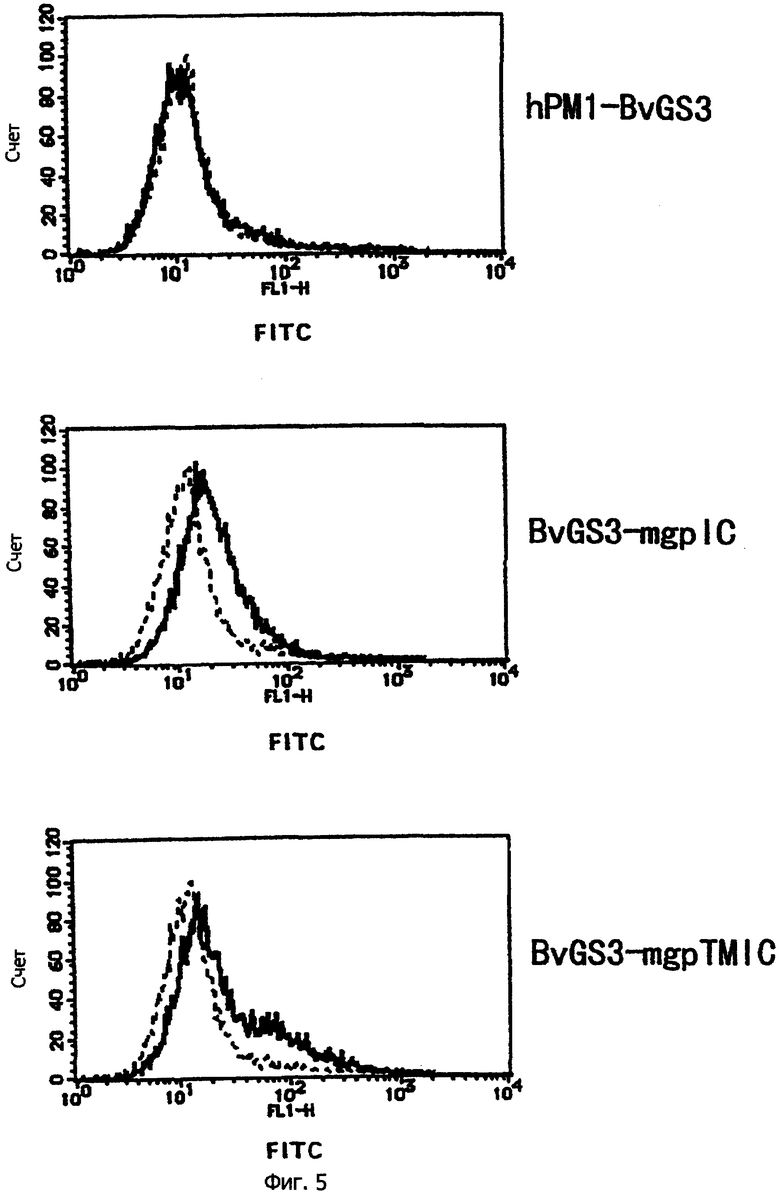

Изобретение относится к области генной инженерии и может быть использовано для обнаружения и получения генов любых мембраносвязанных белков, применяемых в различных отраслях хозяйственной деятельности. Предложен способ выявления генов, кодирующих трансмембранные белки, предусматривающий экспрессию в клетке-хозяине химерной последовательности нуклеиновой кислоты, состоящей из фрагмента ДНК, кодирующего секретируемый белок, способный связывать антиген, и тестируемого фрагмента ДНК; взаимодействие клеток, экпрессирующих слитый белок, с антигеном; отбор клеток на поверхности которых связан указанный антиген; выделение из рекомбинантного вектора, содержащегося в отобранных клетках тестируемого фрагмента ДНК и при необходимости определение его последовательности. Разработаны векторные конструкции и включающие их наборы, предназначенные для осуществления предложенного способа. Изобретение позволяет существенно упростить процесс скрининга библиотек и клонирования генов трансмембранных белков. 4 с. и 23 з.п. ф-лы, 7 ил., 1 табл.
(i) введение в клетки рекомбинантного экспрессирующего вектора, содержащего (а) ДНК, кодирующую секретируемый белок, обладающий аффинностью связывания с антигеном и выбранный из группы, состоящей из антитела, его фрагмента и одноцепочечного антитела, и (б) тестируемый фрагмент кДНК, предположительно кодирующий мембраносвязанный белок, который лигирован ниже 3′-области ДНК (а) так, что при этом обеспечивается возможность экспрессии соответствующего слитого белка,
(ii) культивирование клеток в условиях, способствующих экспрессии в клетках гибридного белка, состоящего из секретируемого белка, обладающего аффинностью связывания с антигеном, и белка, кодируемого тестируемым фрагментом кДНК,
(iii) взаимодействие клеток с антигеном и отбор клеток, связывающих указанный антиген на клеточной мембране,
(iv) выделение из отобранных клеток фрагмента кДНК, встроенного в вектор и, при необходимости, определение его последовательности,
(v) необязательно последующий скрининг библиотеки кДНК для получения полноразмерной кодирующей последовательности и ее выделение.
Приоритет по пунктам и признакам:
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| TASHIRO K | |||
| ET AL., Science, 1993, 261, 600-603. | |||
Авторы
Даты
2005-02-20—Публикация
1999-04-30—Подача