Область техники, к которой относится изобретение
Изобретение касается способа снижения уровня пролиферации клеток карциномы путем введения гормон роста-высвобождающих пептидов и их антагонистов. Изобретение также относится к соединениям, ингибирующим пролиферацию онкогенных клеток.
Уровень техники
Секреция гормона роста (GH) регулируется двумя пептидами гипоталамуса: GH-высвобождающим гормоном (GHRH), который оказывает стимулирующее действие на высвобождение GH, и соматостатином, который проявляет ингибирующее воздействие. В последние несколько лет рядом исследователей продемонстрировано, что секреция GH может также стимулироваться синтетическими олигопептидами, названными GH-высвобождающими пептидами (GHRP), такими как гексарелин и различные аналоги гексарелина (см. статью Ghigo и соавт., European Journal of Endocrinology, 136, 445-460, 1997). Данные соединения действуют с помощью механизма, который отличается от механизма действия GHRH (см. раздел, написанный C.Y. Bowers в монографии "Ксенобиотические стимуляторы секреции гормона роста" ("Xenobiotic Growth Hormone Secretagogues") под ред. В. Bercu и R.F. Walker, стр.9-28, Springer-Verlag, New York, 1996) и путем взаимодействия со специфическими рецепторами, локализованными в гипоталамусе и гипофизе ((а) см. статью G. Muccioli и соавт., Journal of Endocrinology, 157, 99-106, 1998; (b) сообщение G. Muccioli, "Распределение в тканях рецепторов GHRP у человека" ("Tissue Distribution of GHRP Receptors in Humans"), Тезисы IV Европейского конгресса по эндокринологии (Abstracts IV European Congress of Endocrinology), Sevilla, Spain, 1998). Недавно было показано, что рецепторы GHRP присутствуют не только в системе гипоталамуса-гипофиза, но даже в различных человеческих тканях, которые обычно не связаны с высвобождением GH (см. выше статью G. Muccioli и соавт. (а)).
GHRP и их антагонисты описаны, например, в следующих публикациях: работа C.Y. Bowers, supra, раздел, написанный R. Deghenghi, "Гормон роста-высвобождающие пептиды" ("Growth Hormone Releasing Peptides"), там же, 1996, стр.85-102; статья R. Deghenghi и соавт., "Маленькие пептиды как потенциальные агенты, высвобождающие гормон роста" ("Small Peptides as Potent Releasers of Growth Hormone"), J. Ped. End. Metab., 8, стр.311-313, 1996; статья R. Deghenghi, "Создание непроницаемых пептидов как стимуляторов секреции гормона роста" ("The Development of Impervious Peptides as Growth Hormone Secretagogues"), Acta Pediatr. Suppl., 423, стр.85-87, 1997; статью К. Veeraraganavan и соавт., "Гормон роста-высвобождающие пептиды (GHRP), связывающие переднюю долю гипофиза и мембраны гипоталамуса свиньи" ("Growth Hormone Releasing Peptides (GHRP) Binding to Porcine Anterior Pituitary and Hypothalamic Membranes"), Life Sci., 50, стр.1149-1155, 1992 и международную заявку Т.С. Somers и соавт. "Низкомолекулярные пептидомиметики - стимуляторы секреции гормона роста" ("Low Molecular Weight Peptidomimetic Growth Hormone Secretagogues), WO 96/15148, 23 мая 1996 г.
Сущность изобретения
Данное изобретение касается способа снижения или ингибирования пролиферации онкогенных клеток, где способ предусматривает использование гормон роста-высвобождающего пептида (GHRP) или антагониста гормон роста-высвобождающего пептида. Соединения, используемые в соответствии с изобретением, могут быть также определены как стимуляторы секреции гормона роста или их антагонисты. Количества данных соединений являются эффективными для снижения или ингибирования пролиферации онкогенных клеток. Данные соединения определяют по признаку замещения ими радиоактивного маркера 125I-Tyr-Ala-His-D-Mrp-Ala-Trp-D-Phe-Lys-NH2(125I-Tyr-Ala-Гексарелина) из содержащей опухоль ткани млекопитающего.
Изобретение относится также к соединениям, описанным в данном контексте, демонстрирующим связывание с онкогенной тканью и, как было обнаружено, действующим на специфический рецептор, вызывая таким образом снижение числа онкогенных клеток. Предпочтительно, когда опухоли являются опухолями легкого, молочной железы, щитовидной железы или поджелудочной железы.
Вышеупомянутые соединения включают ряд известных соединений (см. выше), но другие соединения, используемые в изобретении, не были описаны ранее и включают спиролактам, бициклическую или трициклическую структуру пептидомиметика. Одним общим признаком для всех соединений, используемых в изобретении, является присутствие по меньшей мере одного остатка лизина.
Сведения, подтверждающие возможность осуществления изобретения
В данном описании использованы следующие сокращения: D -правовращающий энантиомер, GH - гормон роста, Мrр - 2-метил-Тrр, IМА - имидазолилацетил, GAB - γ -аминобутирил, INIP - изопекотинил, АIВ -аминоизобутирил, Nal - β -нафтилаланин, ТХМ - транексамил, т.е. 4 -(аминометил)-циклогексанкарбонил, D-HNH - D-1,2,3,4,5,6-гексагидроноргарман-3-карбоксилат, HAIC-(2S,5S)-5-амино-1,2,4,5,6,7-гексагидро-азепино[3,2,1-ги]индол-4-он-2-карбоксилат, АТАВ-2-R-(2β, 5β, 8β)-8-амино-7-оксо-4-тиа-1-аза-бицикло[3.4.0]нонан-2-карбоксилат и Ala, Lys, Phe, Trp, His, Thr, Cys, Tyr, Leu и Ile - аминокислоты аланин, лизин, фенилаланин, триптофан, гистидин, треонин, цистеин, тирозин, лейцин и изолейцин, соответственно.
В одном из вариантов изобретения подходящие соединения, предназначенные для снижения или ингибирования пролиферации онкогенных клеток, имеют общую формулу I:
AA1-AA2-AA3-AA4-Lys-R (I)
в которой
АА1 является IMA, GAB, IN IP, ТХМ, AIB, HIs-D-Trp-, His-D-Mrp, Thr-D-Trp,
Thr-D-Mrp, D-Thr-D-Trp, D-Thr-D-Mrp, D-Ala-D-Nal, IMA-D-Trp, IMA-D-Mrp,
D-Thr-His-D-Trp, D-Thr-His-D-Mrp, Cys-Tyr-GAB, Ala-His-Trp,
Ala-His-D-Mrp, Tyr-Ala-His-D-Trp, Tyr-Ala-His-D-Mrp, D-Ala-D-Trp,
или D-Ala-D-Mrp;
AA2 является Ala, D-Nal, D-Lys, D-Mrp, или Trp;
AA3 является D-Trp, D-Nal, D-Trp, Mrp, Phe, или D-Phe;
AA4 является D-Trp, Mrp, D-Mrp, Phe или D-Phe; и
R является -NН2, Thr-NH2 или D-Thr-NH2.
Соединения, содержащие молекулу D-Mrp, являются предпочтительными. В другом варианте осуществления подходящие соединения включают соединения, описанные в патентной заявке США № 09/089954 от 3 июня 1998 г. Данные соединения представляют собой пептиды общей формулы II:
А -В -D-Mrp -С -Е (II)
в которой
А представлено Н или Туr;
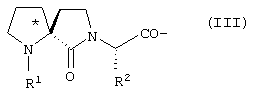
В является спиролактамом общей формулы III
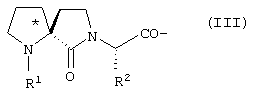
где R1 представлено Н или Туr, R2 представляет собой боковую цепь любой природной аминокислоты, и конфигурация относительно * является (R), (S) или их смесью; трициклическим соединением формулы IV
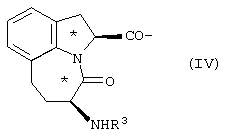
где R3 представлено Н или Туr, и конфигурация относительно * является (R), (S) или их смесью; бициклическим соединением формулы V
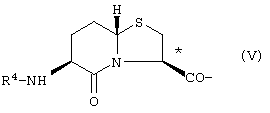
где R4 представлено Н или Туr, и конфигурация относительно * является (R), (S) или их смесью;
D-Mrp является Dextro-2-Methyl-Trp;
С является Trp-Phe-Lys, D-Trp-Phe-Lys, Mrp-Phe-Lys, D-Mrp-Phe-Lys, Trp-Lys, D-Trp-Lys, Mrp-Lys, D-Mrp-Lys, Ala-Trp-D-Phe-Lys, Ala-Mrp-D-Phe-Lys, Ala-D-Mrp-D-Phe-Lys, D-Lys-Trp-D-Phe-Lys, D-Lys-Mrp-D-Phe-Lys, D-Lys-D-Mrp-D-Phe-Lys, или трициклическим соединением формулы VI
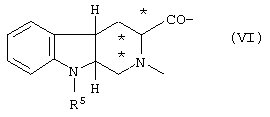
где R5 представлено Н или SO2Me, конфигурации относительно * являются либо (R), (S), либо их смесью, а Е представлено Lys-NH2 или -NH2 при условии, что Е является Lys-NH2, когда С предварительно определено, как трициклическое соединение VI.
В соответствии с данным изобретением было показано, что GH-высвобождающие соединения и соединения, которые не высвобождают GH, являются эффективными при лечении опухолей. Предпочтительно, когда опухоль, лечение которой предусматривается в соответствии с изобретением, является опухолью легкого, молочной железы, щитовидной железы или поджелудочной железы.
В частности, предпочтительные GH-высвобождающие соединения общей формулы I включают следующие соединения:
His-D-Trp-Ala-Trp-D-Phe-Lys-NH2,
His-D-Trp-Ala-Mrp-D-Phe-Lys-NH2,
D-Thr-His-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
Thr-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
IMA-D-Mrp-D-Trp-Phe-Lys-NH2,
IMA-D-Mrp-D-Nal-Phe-Lys-NH2,
GAB-D-Mrp-D-Mrp-D-Mrp-Lys-NH2,
D-Ala-D-Nal-Ala-Trp-D-Phe-Lys-NH2,
INIP-D-Nal-D-Nal-Phe-Lys-NH2,
INIP-D-Nal-D-Trp-Phe-Lys-NH2,
IMA-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
INIP-D-Mrp-D-Trp-Phe-Lys-NH2,
INIP-D-Mrp-D-Nal-Phe-Lys-NH2,
GAB-D-Mrp-D-Trp-Phe-Lys-NH2,
TXM-D-Mrp-D-Trp-Phe-Lys-NH2,
GAB-D-Mrp-Mrp-Phe-Lys-NH2,
Ala-His-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
His-D-Mrp-Ala-Trp-D-Phe-Lys-Thr-NH2,
His-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
D-Thr-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
GAB-D-Mrp-D-Nal-Phe-Lys-NH2,
GAB-D-Mrp-D-Mrp-Mrp-Lys-NH2,
Cys-Tyr-GAB-D-Mrp-D-Mrp-Mrp-Lys-NH2,
Tyr-Ala-His-D-Mrp-Ala-Trp-D-Phe-Lys-NH2, и
D-Ala-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
тогда как предпочтительные соединения общей формулы I, которые не высвобождают GH, включают:
His-D-Trp-D-Lys-Trp-D-Phe-Lys-NH2,
His-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2,
His-Ala-D-Trp-Lys-Mrp-D-Phe-Lys-NH2,
His-D-Mrp-D-Lys-Mrp-D-Phe-Lys-NH2,
His-Ala-D-Trp-Ala-Mrp-D-Phe-Lys-NH2, и
His-D-Trp-Ala-Mrp-D-Phe-Lys-NH2.
Предпочтительные соединения общей формулы II включают следующие соединения:
[S,S-cпиpo(Pro-Leu)]-D-Mrp-D-Trp-Phe-Lys-NH2,
[S,S-cпиpo(Pro-Leu)]-D-Mrp-Mrp-Lys-NH2,
[S,S-cпиpo(Pro-Leu)]-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
[S,S-cпиpo(Pro-Leu)]-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2,
Tyr-[S,S-cпиpo(Pro-Leu)]-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2,
[S,S-cпиpo(Pro-Ile)]-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2,
[S,S-cпиpo(Pro-Leu)]-D-Mrp-D-HNH-(SO2CH3)-Phe-Lys-NH2,
HAIC-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2, и
ATAB-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2,
где S,S-cпиpo(Pro-Leu) и S,S-спиро(Рrо-Ilе) представлены
4-метил-2S(6'-оксо-(5'-S)1',7'-диазаспиро[4,4]нонан-7'-ил]пентаноатом и
3-метил-2S[6'-оксо-(5'-S)1',7'-диазаспиро[4,4]нонан-7'-ил]пентаноатом,
соответственно.
Данные структуры имеют формулу
где R1 представлено Н и R2 является боковой цепью Leu или Ilе (см. статью Р. Ward и соавт., J. Med. Chem., 33, 1848 (1990)). Кроме того, трициклическое соединение HNH получают известным способом гидрирования соответствующих тетрагидро-норгарман-3-карбоновых кислот формулы
Структуры, соответствующие формулам III, IV, V и VI, составляют основу молекул пептидомиметиков, преимущество которых состоит в том, что они замкнуты в конфигурации β -складки, имитируя таким образом природные аминокислоты.
Если требуется, можно также использовать фармацевтически приемлемые соли данных соединений. Данные соли включают органические или неорганические соли, такие как гидрохлорид, гидробромид, фосфат, сульфат, ацетат, сукцинат, аскорбат, тартрат, глюконат, бензоат, малат, фумарат, стеарат или памоат.
Все соединения можно эффективно синтезировать в соответствии с обычными способами пептидной химии, такими как твердофазный синтез пептидов, который описан в монографии Е. Atherton и R.C. Sheppard "Твердофазный синтез пептидов" ("Solid Phase Peptide Synthesis"), IRL Press at Oxford University Press, 1989, синтез в жидкой фазе, который описан в монографии J. Jones "Химический синтез пептидов" ("The Chemical Synthesis of Peptides"), Clarendon Press, Oxford, 1994, или комбинация твердофазного способа и способа синтеза в жидкой фазе, как известно в области техники.
Твердофазный синтез начинается с С-конца соединений. Подходящий исходный материал может быть приготовлен, например, путем присоединения требуемой защищенной α -аминокислоты к хлорметилированной смоле, гидроксиметилированной смоле, смоле на основе бензгидриламина (ВНА) или к смоле на основе пара-метил-бензгидриламина (р-Ме-ВНА). В качестве примера доступной хлорметилированной смолы приведем BIOBEADS SX1, производимую BioRad Laboratories, Richmond, California. Приготовление гидроксиметилированной смолы описано Bodansky и соавт., Chem. Ind. (London), 38, 15997 (1966). Смола на основе ВНА описана Pietta и Marshall, Chem. Comm., 650 (1970) и производится в промышленном масштабе фирмой Peninsula Laboratories Inc., Belmont, California.
После начального присоединения защитную группу α -аминокислоты можно удалить с помощью различных реагентов, таких как трифторуксусная кислота (ТФУ) или хлористоводородная кислота (НСl), растворенных в органических растворителях при комнатной температуре. После удаления защитной группы α -аминокислоты остальные защищенные природные аминокислоты или карбоновые кислоты, соответствующие структурам согласно общим формулам III, IV, V и VI, которые также содержат аминокислоты, могут быть постадийно связаны в желаемом порядке. Каждая защищенная аминокислота в общем может вступать в реакцию в приблизительно трехкратном избытке с помощью подходящего активирования карбоксильной группы, например, дициклогексилкарбодиимидом (DCC) или диизопропилкарбодиимидом (DIC), растворенным, например, в метиленхлориде (CH2Cl2), диметилформамиде (DMF) или других смесях. После завершения синтеза желаемой аминокислотной последовательности требуемое соединение можно отщепить от смолы-носителя посредством обработки таким реагентом, как фтористый водород (HF), который отщепляет не только соединение от смолы, но также и защитные группы боковых цепей. При использовании хлорметилированной смолы обработка HF приводит к образованию соединения, которое имеет концевую кислотную группу и присутствует в свободной форме. При использовании смол на основе ВНА или р-Ме-ВНА обработка HF приводит непосредственно к образованию соединения, которое имеет концевую амидную группу и присутствует в свободной форме.
Лекарственные средства, используемые для лечения опухолей у млекопитающего, включая человека, могут содержать соединение, соответствующее данному изобретению, или его фармацевтически приемлемую соль или комбинации соединений, соответствующих данному изобретению, или их фармацевтически приемлемых солей, необязательно в смеси с носителем, наполнителем, растворителем, разбавителем, матриксом или покрытием для задержанного выхода. Примеры данных носителей, наполнителей, растворителей и разбавителей можно найти в Справочнике по фармацевтическим наукам Ремингтона (Remington's Pharmaceutical Sciences) под ред. A.R. Gennaro 18-е изд., Mack Publishing Company, Easton, PA, 1990.
Любое из соединений, соответствующих данному изобретению, может быть получено компетентным специалистом в данной области с целью приготовления лекарственных средств, которые являются пригодными для парентерального, защечного, ректального, вагинального, чрескожного, легочного или перорального способа введения.
Тип состава лекарственного средства, содержащего соединение, может быть выбран в соответствии с желаемой скоростью доставки. Например, при необходимости быстрой доставки соединений предпочтительными являются назальный или внутривенный способы.
Лекарственные средства могут вводиться млекопитающим, в том числе человеку, в терапевтически эффективной дозе, которая может быть легко установлена компетентным специалистом в данной области и которая может варьировать в соответствии с видом, возрастом, полом и массой тела пациента или субъекта, которого лечат, а также способом введения. Например, для человека при внутривенном введении предпочтительная доза лежит в интервале от приблизительно 1 мкг до приблизительно 25 мкг всего количества соединения/кг массы тела. При пероральном введении обычно требуются увеличенные количества. Например, для человека при пероральном введении уровень дозы составляет, как правило, от приблизительно 30 мкг до приблизительно 1000 мкг суммарного количества соединения/кг массы тела. Точный уровень может быть легко определен эмпирически на основе вышеописанного.
Примеры
Следующие примеры иллюстрируют эффективность наиболее предпочтительных используемых для лечения опухолей соединений, соответствующих данному изобретению.
1. Материалы и способы
а) Химические продукты
Гексарелин (His-D-Mrp-Ala-Trp-D-Phe-Lys-NH2), Ala-Гексарелин (Ala-His-D-Mrp-Ala-Trp-D-Phe-Lys-NH2), Туr-Ala-Гексарелин (Tyr-Ala-His-D-Mrp-Ala-Trp-D-Phe-Lys-NH2), MK0677 (N-[1(R)-([1,2-дигидро-1-метансульфонилспиро-(3Н-индол,3,4'-пиперидин)-1'-ил]-2-(фенилметокси)этил]-2-амино-метилпропанамидметансульфонат), ЕР80317 (HAIC-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2) и D-(Lys)3-GHRP6 (His-D-Trp-D-Lys-Trp-D-Phe-Lys-NH2) поставляются фирмой Europeptides (Argenteuil, France). Человеческий GHRH (GHRH 1-44) и соматостатин (соматостатин 1-14) приобретают в фирме Bachem (Bubendorf, Switzerland). Человеческий рекомбинантный эпидермальный фактор роста (EGF) и все реагенты для культуры ткани приобретают в фирме Sigma Chemical Co. (St. Louis, МО, USA), 3H-тимидин приобретают в фирме Pharmacia-Amersham Italia (Milan, Italy).
б) Человеческие ткани
Хирургические образцы опухолей собирают в Департаменте биомедицинских наук и онкологии человека (Отделение патологии)
Туринского университета (Department of Biomedical Sciences and Human Oncology (Division of Pathology)). Фрагмент опухоли, соседний с используемым для гистопатологической диагностики, немедленно замораживают при -80° С и хранят в течение 2-60 месяцев до дальнейшей обработки с целью изучения связывания. Используют 13 образцов инвазионных карцином молочной железы (10 дуктальной и 3 лобулярной), 14 -образцов неэндокринных карцином легкого (5 - сквамозных клеток и 9 - аденокарцином), 11 образцов эндокринных опухолей легкого, 9 образцов эндокринных опухолей поджелудочной железы и 12 образцов карцином щитовидной железы (7 - фолликулярной природы и 5 - медуллярной природы). Нормальные незлокачественные ткани соответствующих органов также анализируют параллельно с отдельными опухолями.
в) Линии опухолевых клеток
Клетки карциномы легкого человека (CaLul), T47D и MDA-MB231, соответственно, линии клеток эстроген-зависимого и эстроген-независимого рака молочной железы приобретают в АТСС (Rockville, MD, USA). Клетки культивируют стандартным способом в колбах объемом 25 см3 при 37° С при содержании CO2 5% в атмосфере 95% влажности в среде RPMI с добавлением 10% FCS (сыворотки телячьих эмбрионов), пенициллина-стрептомицина и фунгизона. После достижения состояния субконфлюэнтности клетки отделяют от колб с помощью трипсина/EDTA (этилендиаминтетрауксусной кислоты).
г) Анализ рецептора GHRP
Рецепторы GHRP определяют на мембранах опухоли, как описано в статье G. Muccioli и соавт. (см. Journal of Endocrinology, 157, 99-106, 1998), используя 125I-Туr-Alа-Гексарелин в качестве лиганда. Специфическое связывание рассчитывают как разницу между связыванием в отсутствие и в присутствии избытка немеченого Tyr-Ala-Гексарелина и выражают как процент увеличения радиоактивности. Результаты изучения насыщения и конкурентного связывания анализируют с помощью программы GraphPAD Prism 2 (программное обеспечение GraphPAD, San Diego, CA, USA).
д) Исследование пролиферации клеток
Синтез ДНК оценивают по включению 3H-тимидина, как описано в статье G. Muccioli и соавт. (Journal of Endocrinology, 153, 365-371,1997). Голодающие клетки инкубируют только с основной средой или EGF (1 нг/мл) в отсутствие или в присутствии различных концентраций (от 10-8 до 10-6 моль/л) Гексарелина, Ala-Гексарелина, Tyr-Ala-Гексарелина, МК0677, (D-Lys)3-GHRP6 или ЕР80317. После инкубирования в течение 20 часов добавляют 3H-тимидин и продолжают инкубирование еще в течение 4 часов. Реакцию останавливают и собирают клетки на полоски стекловолоконного фильтра. Включение 3H-тимидина измеряют с помощью сцинтилляционного счетчика.
Исследования роста клеток проводят, как описано в статье Р. Cassoni и соавт. (Virchows Archiv., 425, 467-472, 1994). Клетки высевают в трех повторностях в 24-луночные планшеты с густотой 5000-10000 клеток/мл. Через двадцать четыре часа после посева среду меняют. Гексарелин или Ala-Гексарелин добавляют, куда требуется, в концентрациях, лежащих в интервале от 10-8 до 10-6 моль/л. Среду меняют каждые 48 часов. Клетки подсчитывают два независимых исследователя через 48 и 72 или 96 час обработки двойным слепым методом с использованием гемоцитометра.
е) Статистический анализ
Результаты исследования пролиферации клеток выражают как средние значения или средние значения ± стандартная ошибка, если не указано иначе. Статистическую значимость определяют с использованием теста Mann-Whitney или одностороннего теста ANOVA. Все эксперименты выполняют по меньшей мере по три раза.
2. Результаты
а) Идентификация рецепторов для GHRP и их антагонистов в различных опухолях человека
Идентификацию рецепторов для GHRP и их антагонистов проводят с помощью определения распределения связывания Tyr-Ala-Гексарелина с радиоактивной меткой с мембранами различных эндокринных и неэндокринных опухолей человека различной природы (*Р<0,01 относительно оответствующей неопухолевой ткани). Для неэндокринных опухолей легкого молочной железы, а также эндокринных карцином поджелудочной железы и щитовидной железы (фолликулярного типа) показывают среднее значение специфического связывания, которое является статистически более высоким, чем обнаруженное в соответствующей неопухолевой нормальной ткани. Напротив, не обнаруживают никакой разницы в значениях специфического связывания нормальной ткани и эндокринных опухолей, легкого или щитовидной железы (медуллярного типа).
б) Биохимические характеристики рецепторов для GHRP и их антагонистов
Для того, чтобы определить, проявляет ли связывание 125I-Tyr-Ala-Гексарелина с мембранами опухоли свойства, типичные для взаимодействия лиганда и рецептора, более детально исследуют связывание радиоактивного маркера на неэндокринной карциноме легкого, которая показывает самое высокое значение специфического связывания. Связывание 125I-Туr-Alа-Гексарелина с мембранами опухоли представляет собой функцию повышения концентраций лиганда с радиоактивной меткой. Данное исследование представляет доказательство насыщаемого специфического связывания, и анализ по Scatchard (верхняя панель) указывает на присутствие центров с высокой аффинностью, относящихся к одному классу.
Специфичность связывания 125I-Туг-Ма-Гексарелина устанавливают на основании определения способности различных соединений конкурировать лигандом с радиоактивной меткой за опухолевые центры связывания. Связывание радиоактивного маркера замещают доза-зависимым образом Гексарелином, Ala-Гексарелином, Tyr-Ala-Гексарелином и антагонистами GHRP, такими как D-(Lys)3-GHRP6 и ЕР 80317, производным (амино-азепино-индол)-D-(Lуs) Гексарелина, которое не высвобождает GH у новорожденных крыс. Незначительный уровень замещения наблюдают в присутствии МК0677 - непептидильного миметика GHRP, который связывает рецепторы GHRP гипофиза. Напротив, в присутствии GHRH или соматостатина не наблюдают никакой конкуренции.
в) Эффект GHRP и его антагонистов на включение 3H-тимидина
Гексарелин в концентрации 10-6 моль/л обладает способностью ингибировать как базовое, так и стимулированное EGF включение 3Н-тимидина в клетки карциномы легкого человека (*Р<0,05, **Р<0,01 относительно контроля). Данный антипролиферативный эффект наблюдают также при инкубировании клеток в присутствии Ala-Гексарелина, Tyr-Ala-Гексарелина или антагонистов GHRP, таких как (D-Lys)3-GHRP6 и ЕР80317 в концентрации 10-6 моль/л. Напротив, слабое ингибирование наблюдают в присутствии МК0677. Эксперименты с использованием возрастающих концентраций Гексарелина, Ala-Гексарелина, Tyr-Ala-Гексарелина, (D-Lys)3-GHRP6 и ЕР80317 показывают, что данные соединения ингибируют пролиферативный эффект EGF в отношении клеток карциномы легкого человека, ингибируемых доза-зависимым образом. Величина ЕС50 составляет 5,6× 10-8 моль/л для ЕР80317, 6,5× 10-8 моль/л для Tyr-Ala-Гексарелина, 8× 10-8 моль/л для Гексарелина, 9× 10-8 моль/л для (D-Lys)3-GHRP6 и 1× 10-7 моль/л для Ala-Гексарелина.
г) Эффект GHRP на рост клеток
В клетках карциномы легкого человека Гексарелин в концентрации 10-8 моль/л вызывает уменьшение числа клеток по сравнению с контролем при достижении значительного эффекта (-47%) только через 96 часов. Данный эффект далее увеличивается при концентрации 10-7 моль/л и 10-6 моль/л, и его отмечают в любой точке исследуемого периода времени (**Р<0,001; ***Р<0,0001 относительно контроля).
В клетках рака молочной железы человека T47D Гексарелин в концентрации 10-8 моль/л вызывает уменьшение числа клеток по сравнению с контролем при достижении значительного эффекта (-54%) только через 96 часов. Данный эффект далее увеличивается при концентрации 10-7 моль/л и 10-6 моль/л, и его отмечают в любой точке исследуемого периода времени (**Р<0,001; ***Р<0,0001 относительно контроля). Аналогичный антипролиферативный эффект также проявляет Ala-Гексарелин в отношении данных опухолевых клеток (**Р<0,001; ***Р<0,0001 относительно контроля).
В клетках рака молочной железы человека MDA-MB231 Гексарелин в концентрации 10-8 моль/л вызывает уменьшение числа клеток по сравнению с контролем при достижении значительного эффекта (-33%) только через 72 часов. Данный эффект далее увеличивается при концентрации 10-7 моль/л и 10-6 моль/л, и его отмечают в любой точке исследуемого периода времени (*Р<0,01; **Р<0,001, ***Р<0,0001 относительно контроля). Аналогичный антипролиферативный эффект также проявляет Ala-Гексарелин в отношении данных опухолевых клеток (*Р<0,01; **Р<0,001; ***Р<0,0001 относительно контроля).
Данные результаты показывают, что синтетические гормоны роста-высвобождающие пептиды и их антагонисты ингибируют рост клеток карциномы человека in vitro. Антипролиферативный эффект опосредуется через специфический рецептор.
Описан способ снижения или ингибирования пролиферации онкогенных клеток путем использования гормон роста-высвобождающего соединения или его антагониста, которые способны вытеснять радиоактивный маркер 125I-Tyr-Ala-His-D-Mrp-Ala-Trp-D-Phe-Lys-NHz из содержащей опухоль ткани. Опухоли могут представлять собой опухоли легкого, молочной железы, щитовидной железы или поджелудочной железы. Предпочтительные соединения представляют собой пептиды, которые содержат остатки метилтриптофана и лизина. 3 н. и 10 з.п. ф-лы.
АА1-АА2-АА3-AA4-Lys-R (I)
в которой АА1 является IMA, GAB, INIP, TXM, AIB, His-D-Trp-, His-D-Mrp, Thr-D-Trp, Thr-D-Mrp, D-Thr-D-Trp, D-Thr-D-Mrp, D-Ala-D-Nal, IMA-D-Trp, IMA-D-Mrp, D-Thr-His-D-Trp, D-Thr-His-D-Mrp, Cys-Tyr-GAB, Ala-His-Trp, Ala-His-D-Mrp, Tyr-Ala-His-D-Trp, Tyr-Ala-His-D-Mrp, D-Ala-D-Trp или D-Ala-D-Mrp;
AA2 является Ala, D-Nal, D-Lys, D-Mrp или Trp;
AA3 является D-Trp, D-Nal, D-Trp, Mrp, Phe или D-Phe;
AA4 является D-Trp, Mrp, D-Mrp, Phe или D-Phe;
R является -NH2, Thr-NH2 или D-Thr-NH2; и
б) соединений общей формулы II
A-B-D-Mrp-C-E (II)
в которой А представлено Н или Туr;
В является спиролактамом общей формулы III
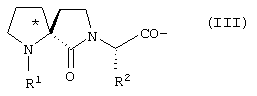
где R1 представлено Н или Туr, R2 представляет собой боковую цепь любой природной аминокислоты и конфигурация относительно * является (R), (S) или их смесью,
трициклическим соединением формулы IV
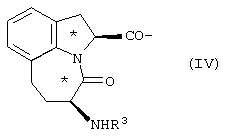
где R3 представлено Н или Туr и конфигурация относительно * является (R), (S) или их смесью,
бициклическим соединением формулы V
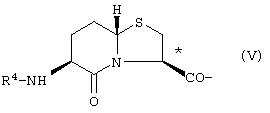
где R4 представлено Н или Туr и конфигурация относительно * является (R), (S) или их смесью;
D-Mrp является Dextro-2-Methyl-Trp;
С является Trp-Phe-Lys, D-Trp-Phe-Lys, Mrp-Phe-Lys, D-Mrp-Phe-Lys, Trp-Lys, D-Trp-Lys, Mrp-Lys, D-Mrp-Lys, Ala-Trp-D-Phe-Lys, Ala-Mrp-D-Phe-Lys, Ala-D-Mrp-D-Phe-Lys, D-Lys-Trp-D-Phe-Lys, D-Lys-Mrp-D-Phe-Lys, D-Lys-D-Mrp-D-Phe-Lys,
или трициклическим соединением формулы VI
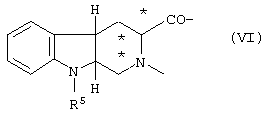
где R5 представлено Н или SO2Me и конфигурации относительно * являются либо (R), (S), либо их смесью, а Е представлено Lys-NH2 или -NН2 при условии, что E является Lys-NH2, когда С предварительно определено, как трициклическое соединение VI.
His-D-Trp-Ala-Trp-D-Phe-Lys-NH2,
His-D-Trp-Ala-Mrp-D-Phe-Lys-NH2,
D-Thr-His-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
Thr-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
IMA-D-Mrp-D-Trp-Phe-Lys-NH2,
IMA-D-Mrp-D-Nal-Phe-Lys-NH2,
GAB-D-Mrp-D-Mrp-D-Mrp-Lys-NH2,
D-Ala-D-Nal-Ala-Trp-D-Phe-Lys-NH2,
INIP-D-Nal-D-Nal-Phe-Lys-NH2,
INIP-D-Nal-D-Trp-Phe-Lys-NH2,
IMA-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
INIP-D-Mrp-D-Trp-Phe-Lys-NH2,
INIP-D-Mrp-D-Nal-Phe-Lys-NH2,
GAB-D-Mrp-D-Trp-Phe-Lys-NH2,
TXM-D-Mrp-D-Trp-Phe-Lys-NH2,
GAB-D-Mrp-Mrp-Phe-Lys-NH2,
Ala-His-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
His-D-Mrp-Ala-Trp-D-Phe-Lys-Thr-NH2,
His-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
D-Thr-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
GAB-D-Mrp-D-Nal-Phe-Lys-NH2,
GAB-D-Mrp-D-Mrp-Mrp-Lys-NH2,
Cys-Tyr-GAB-D-Mrp-D-Mrp-Mrp-Lys-NH2,
Tyr-Ala-His-D-Mrp-Ala-Trp-D-Phe-Lys-NH2 или
D-Ala-D-Mrp-Ala-Trp-D-Phe-Lys-NH2.
His-D-Trp-D-Lys-Trp-D-Phe-Lys-NH2,
His-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2,
His-Ala-D-Trp-Lys-Mrp-D-Phe-Lys-NH2,
His-D-Mrp-D-Lys-Mrp-D-Phe-Lys-NH2,
His-Ala-D-Trp-Ala-Mrp-D-Phe-Lys-NH2 или
His-D-Trp-Ala-Mrp-D-Phe-Lys-NH2.
[S,S-спиро(Pro-Leu)]-D-Mrp-D-Trp-Phe-Lys-NH2,
[S,S-спиро(Pro-Leu)]-D-Mrp-Mrp-Lys-NH2,
[S,S-cпиpo(Pro-Leu)]-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
[S,S-cпиpo(Pro-Leu)]-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2,
Tyr-[S,S-cпиpo(Pro-Leu)]-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2,
[S,S-cпиpo(Pro-lle)]-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2,
[S,S-cпиpo(Pro-Leu)]-D-Mrp-D-HNH-(SО2CH3)-Phe-Lys-NH2,
HAIC-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2 или
ATAB-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2.
His-D-Trp-D-Lys-Trp-D-Phe-Lys-NH2,
His-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2,
His-Ala-D-Trp-Lys-Mrp-D-Phe-Lys-NH2,
His-D-Mrp-D-Lys-Mrp-D-Phe-Lys-NH2,
His-Ala-D-Trp-Ala-Mrp-D-Phe-Lys-NH2 или
His-D-Trp-Ala-Mrp-D-Phe-Lys-NH2.
[S,S-cпиpo(Pro-Leu)]-D-Mrp-D-Trp-Phe-Lys-NH2,
[S,S-cпиpo(Pro-Leu)]-D-Mrp-Mrp-Lys-NH2,
[S,S-cпиpo(Pro-Leu)]-D-Mrp-Ala-Trp-D-Phe-Lys-NH2,
[S,S-cпиpo(Pro-Leu)]-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2,
Tyr-[S,S-cпиpo(Pro-Leu)]-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2,
[S,S-cпиpo(Pro-lle)]-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2,
[S,S-cпиpo(Pro-Leu)]-D-Mrp-D-HNH-(SО2CH3)-Phe-Lys-NH2,
HAIC-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2 или
ATAB-D-Mrp-D-Lys-Trp-D-Phe-Lys-NH2.
| WO 9516707, 22.06.1995 | |||
| WO 9844922, 15.10.1998 | |||
| ХОЛОДОВ Л.Е., ЯКОВЛЕВ В.П | |||
| Клиническая фармакокинетика | |||
| - М.: Медицина, 1985, с.84, 98, 160, 191, 391 | |||
| БЕЛИКОВ В.Г | |||
| Фармацевтическая химия | |||
| - М.: Высшая школа, 1993, т | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Краткий курс молекулярной фармакологии | |||
| /Под ред | |||
| П.В.Сергеева | |||
| - М., 1975, с.10. | |||
Авторы
Даты
2004-11-20—Публикация
1999-11-11—Подача