Изобретение относится к области медицины, а именно к композициям и способам потенцирования терапевтических эффектов интерферонов, и может быть использовано для приготовления лекарственных препаратов интерферона для использования в медицине и ветеринарии.
Интерферонами называются белки естественного происхождения, обладающие антивирусной, антипролиферативной и иммунорегулирующей активностью. Следующее определение интерферонов было принято международным комитетом по разработке номенклатуры интерферонов: "Для того, чтобы квалифицировать фактор как интерферон, он должен быть белком, проявляющим неспецифическую антивирусную активность по меньшей мере в гомологичных клетках через клеточные метаболические процессы, включающие синтез как РНК, так и белка" J. Interferon Research, I: pp. vi (1980).
Известно четыре различных класса интерферонов человека. Pestka et al., Ann. Rev. Biochem., 56: 727 (1987); Emanuel and Pestka. J. Biol. Chem. 268: 12565 (1993). Три главных человеческих интерферона известны как интерферон альфа, интерферон бета и интерферон гамма.
Интерферон альфа является преобладающим классом человеческих интерферонов. Известно 23 подкласса интерферона альфа. Все подклассы интерферона альфа проявляют сходную антивирусную, антипаразитическую и антипролиферативную активность, хотя и могут различаться в относительных активностях. Интерферон альфа используется главным образом как стандартная терапия против вирусных инфекций. Он также активен против ряда опухолей.
Интерферон бета используется для лечения склероза.
Интерферон гамма используется в лечении полиартрита.
Стандартизация активности интерферона в Международных Единицах (ME) является критической для клинического использования интерферонов как терапевтических агентов. Интерфероны стандартизуют по ингибированию цитопатологического действия вируса на клетки. Rubinstein. Familletti, and Pestka, J. Virol., 37: 755 (1981); Armstrong. "Cytopathic Effect Inhibition Assay for Interferon: Microculture Plate Assay," in Methods in Enzymology, 78: 381-387 (1981); Familletti, Rubinstein, and Pestka, "A Convenient and Rapid Cytopathic Effect Inhibition Assay for Interferon," in Methods in Enzymology, 78: 387-394 (1981). В этом методе одна единица активности интерферона определяется как количество интерферона, снижающее индуцированный вирусом цитопатологический эффект на 50%, и калибруется по международному референс-стандарту в ME.
Однако терапия интерферонами имеет ряд недостатков. Терапевтическая эффективность интерферонов часто снижается вследствие нарушенного биологического ответа к интерферону, известного как интерфероновая резистентность. Интерфероновая резистентность часто наблюдается при вирусных заболеваниях, таких как гепатит С, ВИЧ, грипп и герпес. Goodbourn et al, J.Gen.Virol., 81: 2341-64(2000). Интерфероновая резистентность часто возникает при воспалении и действии специфических цитокинов, например интерлейкина-8. Khabar et al., J.Exp.Med., 186: 1077-85 (1997); Polyak et al., J. Virology. 75: 6095-6106 (2001): Polyak et al., J.Virology, 75: 6209-6211 (2001).
Известен способ комбинированной терапии, включающей введение пациентам, в том числе интерферон резистентным, потенцирующей комбинации человеческого интерферона и глутатиона или его предшественника или индуктора. Патент РФ 2145235 С1 от 10.02.2000.
Терапия интерферонами часто сопровождается нежелательными побочными эффектами, зависящими от величины дозы и продолжительности терапии. Обычно эти побочные эффекты включают головную боль, усталость, ознобы, лихорадку и мышечную боль.
Терапия рекомбинантными интерферонами имеет высокую курсовую стоимость лечения, особенно в случае лечения хронических заболеваний типа вирусного гепатита С и волосато-клеточной лейкемии.
Задачей изобретения является увеличение терапевтической эффективности интерферона, уменьшение на этой основе лечебных доз интерферона, а также снижение резистентности к интерферону у млекопитающих, в том числе у человека.
Сущность изобретения состоит в том, что в способе потенцирования терапевтического эффекта интерферона в млекопитающего вводят интерферон в количестве от 1 до 1×107 ME в день и янтарную кислоту или ее фармацевтически приемлемую соль в количестве от 0,1 до 250 мг на кг веса тела млекопитающего. Введение интерферона и янтарной кислоты или ее фармацевтически приемлемой соли может быть последовательным во времени или одновременным. В случае последовательного введения интерферон может быть введен до или после введения янтарной кислоты или ее фармацевтически приемлемой соли.
Кроме того, сущность изобретения состоит в том, что композиция для потенцирования терапевтического эффекта интерферона в млекопитающем содержит интерферон в количестве от 1 до 1×107 ME и янтарную кислоту или ее фармацевтически приемлемую соль в количестве от 0,1 до 250 мг на кг веса тела млекопитающего.
Вследствие потенцирования терапевтического эффекта интерферона терапевтический эффект может быть достигнут с меньшим количеством интерферона, чем обычные лечебные дозы. Поэтому, используя настоящее изобретение, становится возможным снизить стоимость лечения и минимизировать потенциальные побочные эффекты, связанные с большими терапевтическими дозами интерферона и тем не менее достичь терапевтического эффекта.
Вследствие потенцирования терапевтического эффекта интерферона терапевтический эффект может быть достигнут в млекопитающих с нарушенным биологическим ответом на интерферон, известным как резистентность к интерферону.
В способе потенцирования терапевтического эффекта интерферона интерферон и янтарная кислота или ее соль могут быть введены млекопитающему разнообразными путями, включая оральный (через кишечный тракт или слизистую рта), интраназальный, ректальный, парентеральный (подкожными, внутривенными или внутримышечными инъекциями), или ингаляциями распыляемого раствора.
В способе потенцирования терапевтического эффекта интерферона интерферон и янтарная кислота или ее соль могут быть введены млекопитающему в различных дозированных лекарственных формах, включая таблетки, капсулы, леденцы, порошки, распыляемые растворы, аэрозоли, водные растворы, эликсиры и сиропы. Фармацевтические ингредиенты, которые могут быть использованы в составе лекарственных форм, могут включать абсорбенты, буферы, красители, отдушки, растворители, смачивающие агенты, покрытия, подсластители, антиоксиданты и пластификаторы.
Настоящее изобретение не ограничивается каким-либо специфическим интерфероном, но может быть использовано для любого интерферона, известного к настоящему моменту или открытого впоследствии. Тем не менее человеческий рекомбинантный интерферон альфа является предпочтительным интерфероном для использования в соответствии с настоящим изобретением.
Следующие примеры демонстрируют изобретение.
Пример 1. Совместное введение интерферона и янтарной кислоты потенцирует антивирусный эффект интерферона.
Антивирусный эффект интерферона и его комбинации с янтарной кислотой оценивали по ингибированию цитопатологического эффекта (ЦПЭ) вируса (Armstrong, Methods in Enzymol., v.78 (PtA), pp. 381-387 (1981). Был использован человеческий рекомбинантный интерферон альфа. Клетки L41M (Российская коллекция. Институт цитологии РАН) инкубировали с последовательными разбавлениями интерферона (исходный титр 1×106 МЕ/мл) (контроль), 0,25 мг/мл натрия янтарнокислого гексагидрата, или последовательными разбавлениями интерферона (исходный титр 1х106 МЕ/мл) плюс 0,25 мг/мл натрия янтарнокислого гексагидрата в течение 24 часов. Среду декантировали, клетки обработали вирусом везикулярного стоматита и инкубировали 24 часа до развития цитопатологического эффекта. Способность интерферона ингибировать индуцированный вирусом цитопатологический эффект оценивали в терминах конечных титров интерферона. За конечный титр интерферона принимали величину, обратную к разбавлению, которая обеспечивала 50% защиту клеток в каждом из трех независимых опытов. Данные представлены в таблице 1 как увеличение ингибирующей активности интерферона по отношению к контролю.
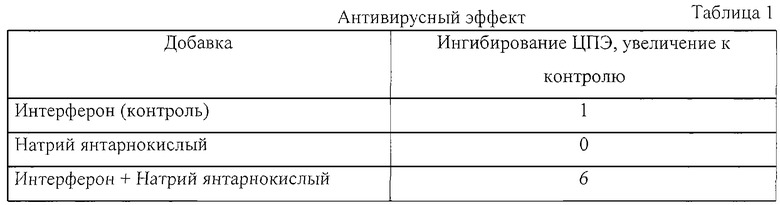
Данные таблицы 1 показывают, что совместное введение интерферона и янтарной кислоты потенцировало антивирусный эффект интерферона. Действительно, желаемая 50% защита клеток была достигнута при концентрациях интерферона, в 6 раз меньших, если интерферон вводился вместе с янтарной кислотой по сравнению с интерфероном, введенным без янтарной кислоты.
Данные представлены в таблице 1.2 как количество интерферона, обеспечивающее 50% защиту клеток в ЦПЭ тесте.

Данные таблицы 1.2 показывают, что желаемая 50% защита клеток была достигнута при меньшей дозе интерферона, если интерферон вводился с солью янтарной кислоты.
Тест, использованный в примере 1, является способом стандартизации активности интерферона в Международных Единицах активности (ME). Далее, стандартизованный интерферон используется в клинической практике в соответствии с определенной активностью препарата интерферона в ME. Из таблицы видно, что интерферон в контроле обеспечил 50% защиту клеток в дозе 1 МЕ/мл, что соответствует стандарту. Комбинация “Интерферон + Натрий янтарнокислый” обеспечила 50% защиту клеток при дозе интерферона 0.17 МЕ/мл. По условиям стандартизации этой комбинации должна быть приписана и будет приписана активность 1 МЕ/мл. Препарат стандартизованный будет применяться в соответствии с инструкцией по применению для каждого заболевания в дозе в соответствии с инструкцией, выраженной в ME, но интерферона в нем по количеству будет в 6 раз меньше, чем в препарате без янтарнокислой соли. При этом на этикетке того и другого препарата будет обозначена одна и та же доза интерферона в ME.
Пример 2. Совместное введение интерферона и янтарной кислоты потенцирует антивирусный эффект интерферона при интерфероновой резистентности.
Антивирусный эффект интерферона и его комбинации с янтарной кислотой оценивали по ингибированию цитопатологического эффекта (ЦПЭ) вируса везикулярного стоматита, как описано в примере 1. Клетки гепатомы человека HepG2 (Российская коллекция. Институт цитологии РАН) были обработаны интерлейкином-8 (30 нг/мл) при 37°С в течение 24 часов для создания резистентности к последующему действию интерферона. Клетки инкубировали с последовательными разбавлениями интерферона (исходный титр 1×106 МЕ/мл), 0,25 мг/мл натрия янтарнокислого гексагидрата, или последовательными разбавлениями интерферона (исходный титр 1×106 МЕ/мл) плюс 0,25 мг/мл натрия янтарнокислого гексагидрата в течение 24 часов. Среду декантировали, клетки обработали вирусом везикулярного стоматита и инкубировали 24 часа до развития цитопатологического эффекта. В контроле клетки использовали без предварительной обработки интерлейкином-8 и инкубировали с последовательными разбавлениями интерферона (исходный титр 1×106 МЕ/мл). Данные по ингибированию ЦПЭ представлены в таблице 2 в процентах к контролю. Контроль (100%) относится к исходной антивирусной активности интерферона в отсутствие предобработки клеток интерлейкином-8 (ИЛ-8).

Данные таблицы 2 показывают, что совместное введение интерферона и янтарной кислоты потенцировало антивирусный эффект интерферона в условиях резистентности клеток к интерферону, вызванной ИЛ-8.
Пример 3. Совместное введение интерферона и янтарной кислоты потенцирует противоопухолевый эффект интерферона.
Миелома была привита 10-12-недельным мышам-самцам линии DBA/BALB(F1) весом 20-25 г путем интраперитонеальной инъекции 2×106 клеток миеломы NS/0. Мышей разделили на группы и вводили интраперитонеально физ. раствор (контроль), интерферон (1×106 МЕ/кг), натрий янтарнокислый гексагидрат (5 мг/кг), или интерферон (1×106 МЕ/кг) плюс натрий янтарнокислый гексагидрат (5 мг/кг) в период с 3 по 7 день с момента имплантации опухоли. Эффект лечения определяли по задержке роста опухоли и увеличению выживаемости в сравнении с контролем. Данные по росту опухоли представлены в таблице 3 как средняя масса опухоли ± стандартное отклонение (n=5). Данные по выживаемости мышей представлены в таблице 4 в процентах к начальному количеству мышей в каждой группе (n=16). Достоверность отличия результатов полученных в опыте к контролю, оценивали по t-критерию Стьюдента. Отличие было принято статистически достоверным, если р<0.01.
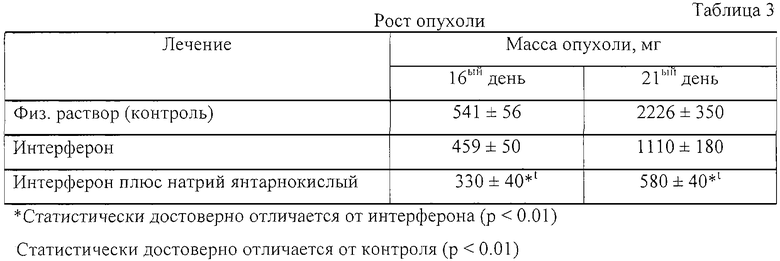
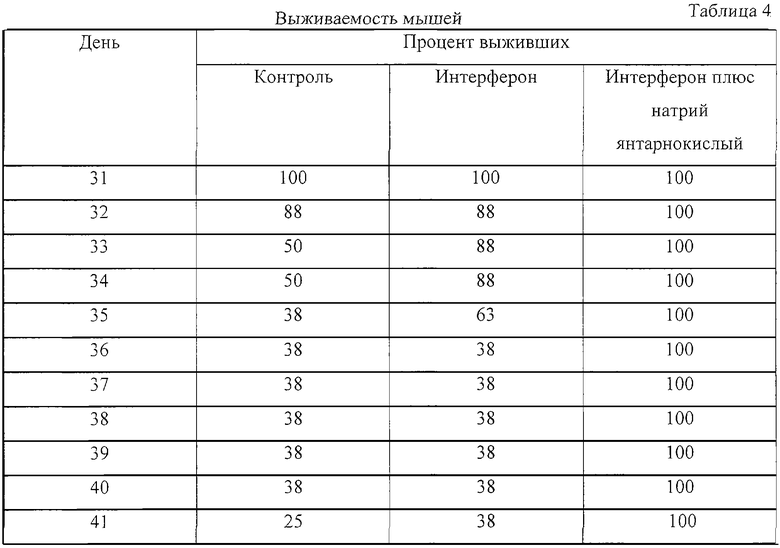
Данные таблиц 3 и 4 показывают, что введение янтарной кислоты вместе с интерфероном потенцировало противоопухолевый эффект интерферона.
Пример 4. Совместное введение интерферона и янтарной кислоты потенцирует противоопухолевый эффект интерферона.
Эритролейкемия Фрейнда была привита 10-12 недельным мышам-самцам линии DBA/BALB(F1) весом 20-25 г путем интраперитонеальной инъекции 2×106 клеток эритролейкемии. Мышей разделили на группы и вводили сублингвально физ. раствор (контроль), интерферон (1×106 МЕ/кг), натрий янтарнокислый гексагидрат (3 мг/кг), или интерферон (1×106 МЕ/кг) плюс натрий янтарнокислый гексагидрат (3 мг/кг) в период с 3 по 7 день с момента имплантации опухоли. Эффект лечения определяли по задержке роста опухоли по сравнению с контролем на 16 день с момента имплантации опухоли. Данные по росту опухоли представлены в таблице 5 как средняя масса опухоли ± стандартное отклонение (n=5). Достоверность отличия результатов полученных в опыте к контролю оценивали по t-критерию Стьюдента.

Данные таблицы 5 показывают, что введение янтарной кислоты вместе с интерфероном потенцировало противоопухолевый эффект интерферона.
Пример 5. Совместное введение интерферона и янтарной кислоты потенцирует противоопухолевый эффект интерферона.
Опухоль Р388 была привита 10-12 недельным мышам-самцам линии DBA/BALB(F1) весом 20-25 г путем интраперитонеальной инъекции 2×106 опухолевых клеток. Мышей разделили на группы и вводили интраперитонеально физ. раствор (контроль), интерферон (1×105 МЕ/кг), натрий янтарнокислый гексагидрат (5 мг/кг), или интерферон (1×105 МЕ/кг) плюс натрий янтарнокислый гексагидрат (5 мг/кг) в период с 3 по 7 и с 12 по 14 дни с момента имплантации опухоли. Эффект лечения определяли по задержке роста опухоли по сравнению с контролем на 14 день с момента имплантации опухоли. Данные по росту опухоли представлены в таблице 6 как средняя масса опухоли ± стандартное отклонение (n=5). Достоверность отличия результатов, полученных в опыте к контролю, оценивали по t-критерию Стьюдента.

Данные таблицы 6 показывают, что введение янтарной кислоты вместе с интерфероном потенцировало противоопухолевый эффект интерферона.
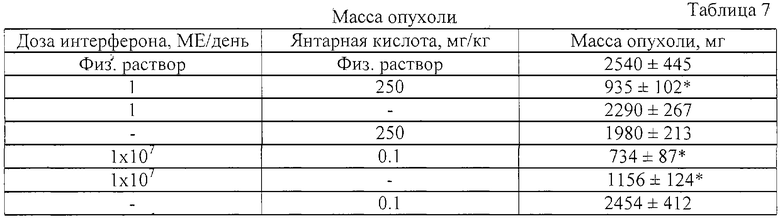
Пример 6. Совместное введение интерферона и янтарной кислоты потенцирует противоопухолевый эффект интерферона.
Миелома была привита мышам-самцам линии DBA/BALB(F1), как указано в примере 3. Мышам вводили интраперитонеально физ. раствор (контроль), раствор интерферона, или интерферон с янтарной кислотой (все растворы были забуферены до рН 7.0) в течение 21 дня с момента имплантации опухоли. Эффект лечения определяли по задержке роста опухоли на 21 день с начала опыта. Данные по росту опухоли представлены в таблице 7 как средняя масса опухоли ± стандартное отклонение (n=5). Достоверность отличия результатов, полученных в опыте к контролю, оценивали по t-критерию Стьюдента. Отличие было принято статистически достоверным, если р<0.05.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ НОВООБРАЗОВАНИЙ | 2005 |
|
RU2275920C1 |
| СПОСОБ ЛЕЧЕНИЯ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ | 2005 |
|
RU2281765C1 |
| ЯНТАРНОКИСЛЫЙ БИС(2-ГИДРОКСИ-N,N,N-ТРИМЕТИЛЭТАНАМИНИЙ) ДЛЯ ЛЕЧЕНИЯ ИНСУЛИНОВОЙ РЕЗИСТЕНТНОСТИ, САХАРНОГО ДИАБЕТА, ГИПЕРЛИПИДЕМИИ И ДИСЛИПИДЕМИИ | 2000 |
|
RU2228174C2 |
| СПОСОБ УЛУЧШЕНИЯ КОГНИТИВНОЙ ФУНКЦИИ | 2005 |
|
RU2281766C1 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ ЖИВОТНЫХ | 2010 |
|
RU2482871C2 |
| АЛЛОФЕРОНЫ-ИММУНОМОДУЛИРУЮЩИЕ ПЕПТИДЫ | 1999 |
|
RU2172322C1 |
| ПРИМЕНЕНИЕ ХОЛИНОВОЙ СОЛИ ЯНТАРНОЙ КИСЛОТЫ В ПРОИЗВОДСТВЕ СРЕДСТВ ЛЕЧЕНИЯ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЫ | 2018 |
|
RU2689384C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО АЛЬФА 16-ИНТЕРФЕРОНА ЧЕЛОВЕКА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ НА ОСНОВЕ РЕКОМБИНАНТНОГО АЛЬФА 16-ИНТЕРФЕРОНА ЧЕЛОВЕКА | 2007 |
|
RU2380405C2 |
| ИНТРАНАЗАЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ 2-ЭТИЛ-6-МЕТИЛ-3-ОКСИПИРИДИНА | 2017 |
|
RU2670609C1 |
| ПРОТИВООПУХОЛЕВЫЕ И АНТИВИРУСНЫЕ ПЕПТИДЫ | 2004 |
|
RU2267496C2 |
Изобретение относится к области медицины, а именно к композициям и способам потенцирования терапевтических эффектов интерферонов, и может быть использовано для приготовления лекарственных препаратов интерферона для использования в медицине и ветеринарии. В способе потенцирования терапевтического эффекта интерферона в млекопитающего вводят интерферон в количестве от 1 до 1×107 МЕ в день и янтарную кислоту или ее фармацевтически приемлемую соль в количестве от 0,1 до 250 мг на кг веса тела млекопитающего. Композиция для потенцирования терапевтического эффекта интерферона в млекопитающем содержит интерферон в количестве от 1 до 1×107 МЕ и янтарную кислоту или ее фармацевтически приемлемую соль в количестве от 0,1 до 250 мг на кг веса тела млекопитающего. Технический результат: потенцирование позволяет достичь терапевтический эффект с меньшим количеством интерферона, чем обычные лечебные дозы, снизить стоимость лечения интерфероном и снизить побочные эффекты интерферона. 2 с. и 8 з.п. ф-лы, 8 табл.
| ТЕРАПЕВТИЧЕСКАЯ КОМБИНАЦИЯ, СОДЕРЖАЩАЯ ЧЕЛОВЕЧЕСКИЙ ИНТЕРФЕРОН, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ОСНОВЕ ИНТЕРФЕРОНА (ВАРИАНТЫ) | 1993 |
|
RU2145235C1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА К ПИЩЕ | 2000 |
|
RU2165160C1 |
| СОЛЬ ЯНТАРНОЙ КИСЛОТЫ 4-[2-АМИНО-6-(ЦИКЛОПРОПИЛАМИНО)-9Н-ПУРИН-9-ИЛ]-2-ЦИКЛОПЕНТЕН-1-МЕТАНОЛА В КАЧЕСТВЕ ПРОТИВОВИРУСНОГО АГЕНТА | 1995 |
|
RU2145324C1 |
| US 4659570 A, 21.04.1987 | |||
| Угольный комбайн | 1948 |
|
SU80879A1 |
Авторы
Даты
2004-12-20—Публикация
2001-09-27—Подача