Настоящее изобретение относится к новой соли (1S,4R) 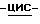 4-[2-амино-6-(циклопропиламино)-9H-пурин-9-ил] -2-циклопентен-1-метанола, проявляющей противовирусную активность, в частности анти-ВИЧ-активность, к способу получения такой соли и к фармацевтическим составам, содержащим такую соль и обладающим противовирусной активностью, в частности анти-ВИЧ-активностью.
4-[2-амино-6-(циклопропиламино)-9H-пурин-9-ил] -2-циклопентен-1-метанола, проявляющей противовирусную активность, в частности анти-ВИЧ-активность, к способу получения такой соли и к фармацевтическим составам, содержащим такую соль и обладающим противовирусной активностью, в частности анти-ВИЧ-активностью.
Соединение (1S,4R) 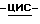 4-[2-амино-6-(циклопропиламино)-9H- пурин-9-ил] -2-циклопентен-1-метанол и его противовирусное применение, особенно против ВИЧ-инфекций, описано в Европейском патенте N 0434450, где также упомянуты фармацевтически приемлемые производные, особенно соли, сложные эфиры и соли этих сложных эфиров данного соединения, и, в частности, описаны хлористоводородные соли данного соединения.
4-[2-амино-6-(циклопропиламино)-9H- пурин-9-ил] -2-циклопентен-1-метанол и его противовирусное применение, особенно против ВИЧ-инфекций, описано в Европейском патенте N 0434450, где также упомянуты фармацевтически приемлемые производные, особенно соли, сложные эфиры и соли этих сложных эфиров данного соединения, и, в частности, описаны хлористоводородные соли данного соединения.
Использование соли соединения хорошо известно специалистам, и соли присоединения кислот к указанному соединению описаны в EP 0434450. Трудно предсказать физические характеристики любой конкретной соли соединения; в то же время небольшие, но важные различия в физических свойствах могут означать большую экономию при производстве и приготовлении фармацевтического продукта, содержащего это соединение.
Соединение (1S,4R) 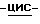 4-[2-амино-6-(циклопропиламино)-9H- пурин-9-ил] -2-циклопентен-1-метанол в настоящее время проходит клинические испытания как анти-ВИЧ-фармацевтический агент. Существует необходимость получения данного соединения в форме, удобной для легкого выделения в крупномасштабном производстве и для легкой переработки в приемлемый продукт для введения людям. Мы обнаружили, что получение данного соединения в виде свободного основания приводит к получению смолы, которая поглощает растворители и поэтому не годится для крупномасштабной очистки или для производства состава без дополнительной очистки.
4-[2-амино-6-(циклопропиламино)-9H- пурин-9-ил] -2-циклопентен-1-метанол в настоящее время проходит клинические испытания как анти-ВИЧ-фармацевтический агент. Существует необходимость получения данного соединения в форме, удобной для легкого выделения в крупномасштабном производстве и для легкой переработки в приемлемый продукт для введения людям. Мы обнаружили, что получение данного соединения в виде свободного основания приводит к получению смолы, которая поглощает растворители и поэтому не годится для крупномасштабной очистки или для производства состава без дополнительной очистки.
Задачей настоящего изобретения является получение образованной присоединением кислоты соли (1S,4R) 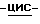 4-[2-амино-6-(циклопропиламино)- 9H-пурин-9-ил]-2-циклопентен-1-метанола, которую можно легко и воспроизводимо получать из эквимолярных количеств этой кислоты и указанного соединения в большом масштабе с высоким выходом, причем полученная соль стабильна, легко выделяема, например, быстрым и эффективным фильтрованием и фармацевтически приемлема. Задачей настоящего изобретения является также получение фармацевтического состава, содержащего такую соль, и разработка способа получения такой соли.
4-[2-амино-6-(циклопропиламино)- 9H-пурин-9-ил]-2-циклопентен-1-метанола, которую можно легко и воспроизводимо получать из эквимолярных количеств этой кислоты и указанного соединения в большом масштабе с высоким выходом, причем полученная соль стабильна, легко выделяема, например, быстрым и эффективным фильтрованием и фармацевтически приемлема. Задачей настоящего изобретения является также получение фармацевтического состава, содержащего такую соль, и разработка способа получения такой соли.
Согласно первому аспекту данного изобретения предложена соль янтарной кислоты (1S,4R) 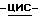 4-[2-амино-6-(циклопропиламино)-9H- пурин-9-ил]-2-циклопентен-1-метанола, в дальнейшем именуемая как соединение по изобретению.
4-[2-амино-6-(циклопропиламино)-9H- пурин-9-ил]-2-циклопентен-1-метанола, в дальнейшем именуемая как соединение по изобретению.
Мы обнаружили, что преимущества соли янтарной кислоты вышеуказанного соединения над известными солями хлористоводородной кислоты делают соли янтарной кислоты особенно подходящими и выгодными для получения в большом масштабе и использования при получении фармацевтических препаратов для введения людям. Преимущества соли янтарной кислоты состоят в получении ее с высоким выходом при производстве в промышленном масштабе.
Дальнейшие аспекты изобретения включают:
а) Соединение по изобретению, проявляющее противовирусную активность, в частности анти-ВИЧ-активность.
б) Соединение по изобретению для получения фармацевтической композиции, пригодной для лечения или профилактики вирусной инфекции.
в) Способ получения соединения по изобретению, при котором смешивают (1S, 4R) 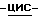 4-[2-амино-6-(циклопропиламино)-9H-пурин-9-ил]- 2-циклопентен-1-метанол в подходящем растворителе с янтарной кислотой в воде при температуре дефлегмации и дают раствору охладиться до температуры окружающей среды с последующим сбором выпавших кристаллов и возможной перекристаллизацией из подходящего растворителя.
4-[2-амино-6-(циклопропиламино)-9H-пурин-9-ил]- 2-циклопентен-1-метанол в подходящем растворителе с янтарной кислотой в воде при температуре дефлегмации и дают раствору охладиться до температуры окружающей среды с последующим сбором выпавших кристаллов и возможной перекристаллизацией из подходящего растворителя.
г) Фармацевтический состав, обладающий противовирусной активностью, в частности анти-ВИЧ-активностью, включающий активный ингредиент, и по меньшей мере один фармацевтически приемлемый носитель, причем в качестве активного ингредиента он содержит соединение по изобретению. Фармацевтический состав представлен в виде таблетки или капсулы. Фармацевтический состав является пригодным для парентерального введения.
Соединение по изобретению особенно полезно для профилактики или лечения ВИЧ-инфекций.
Примеры клинических состояний, вызванных ВИЧ-инфекциями, которые можно лечить в соответствии с данным изобретением, включают Синдром Приобретенного Иммунодефицита (СПИД) или симптомы, которые часто предваряют СПИД, или родственные клинические состояния, такие как СПИД-зависимый комплекс (СЗК), прогрессирующая генерализованная лимфаденопатия (ПГЛ), саркома Канозиса, тромбоцитопеническая пурпура, связанные со СПИДом неврологические состояния, такие как рассеянный склероз или тропический парапарез, а также анти-СПИД антитело-положительные и ВИЧ-положительные состояния, включая СПИД бессимптомных пациентов.
В качестве дополнительного аспекта данного изобретения мы предлагаем способ получения соединения по изобретению, который включает растворение (1S, 4R) 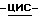 4-[2-амино-6-циклопропиламино)-9H- пурин-9-ил]-2-циклопентен-1-метанола и янтарной кислоты в воде предпочтительно в эквимолярных количествах в подходящем растворителе, например водном этаноле или изопропаноле. Такие растворы удобно получить кипячением с обратным холодильником. При остывании до комнатной температуры из указанного раствора с высоким выходом выпадают кристаллы соединения по изобретению. Для увеличения чистоты продукта, если требуется, можно применять, по желанию, промывку и перекристаллизацию. Соединение по изобретению, будучи в кристаллической форме, представляет возможности для широкомасштабного производства путем быстрого и эффективного фильтрования.
4-[2-амино-6-циклопропиламино)-9H- пурин-9-ил]-2-циклопентен-1-метанола и янтарной кислоты в воде предпочтительно в эквимолярных количествах в подходящем растворителе, например водном этаноле или изопропаноле. Такие растворы удобно получить кипячением с обратным холодильником. При остывании до комнатной температуры из указанного раствора с высоким выходом выпадают кристаллы соединения по изобретению. Для увеличения чистоты продукта, если требуется, можно применять, по желанию, промывку и перекристаллизацию. Соединение по изобретению, будучи в кристаллической форме, представляет возможности для широкомасштабного производства путем быстрого и эффективного фильтрования.
Соединение в соответствии с изобретением может быть введено индивидуально или в сочетании с другими терапевтическими агентами, пригодными для лечения ВИЧ-инфекций, такими как нуклеозидные ингибиторы обратной трансциптазы (НИОТ), например зидовудин, зальцитабин, ламивудин, диданозин, ставудин, 5-хлор-2',3'-дидезокси-3'-фтороуридин и (2R,5S)-5-фтор-1-[2-(гидроксиметил)-1,3-оксатиолан-5-ил]цитозин, не-НИОТ'ы, например невирапин и ингибиторы α-APA, ВИЧ-протеазы например сакинавир или YX-478, или анти-ВИЧ-агенты, например растворимый CD-4, иммунные модуляторы, например интерлейкин II, эритиропоетин, тукаресол и интерфероны, например α-интерферон. Кроме того, соединение по изобретению может быть введено в сочетании с другими терапевтическими агентами, подходящими для лечения ВГВ-инфекций, например ламивудином, (2R,5S)-5-фтор-1-[2-(гидроксиметил)-1,3- оксатиолан-5-ил]цитозином, иммунными модуляторами и интерферонами, как описано ранее. Такие сочетания можно вводить вместе или поочередно при условии, что любой промежуток между введением каждого терапевтического агента не уменьшает их аддитивного действия.
В то время как возможно вводить отдельно одно соединение по изобретению, предпочтительно и выгодно представить соединение по изобретению в виде фармацевтического состава, что и представляет дальнейший аспект данного изобретения. Фармацевтический состав включает соединение по изобретению вместе с одним или несколькими приемлемыми носителями для него и, по желанию, другими терапевтическими агентами. Этот носитель (носители) может быть "приемлемым" в смысле совместимости с другими ингредиентами состава и не вредным для его реципиентов.
Соединения по изобретению могут быть введены любым путем, соответствующим состоянию, которое следует лечить, причем подходящие пути включают оральный, ректальный, назальный, местный (включая трансдермальный, букальный и подъязычный), вагинальный и парэнтаральный (включая подкожный, внутримышечный, внутривенный, внутрикожный, интратекальный и эпидуральный). Будет показано, что предпочтительный путь может меняться, например, в зависимости от состояния реципиента.
Для каждого из вышеуказанных применений и показаний количество требующегося индивидуального активного ингредиента будет зависеть от большого числа факторов, включая тяжесть состояния, которое надо лечить, и личность реципиента, и будет, в конечном счете, находиться на усмотрении лечащего врача. Обычно, однако, для каждого из этих применений и показаний подходящая эффективная доза будет находиться в пределах от 3 до 120 мг на килограмм веса реципиента в день, предпочтительно в пределах от 6 до 90 мг на килограмм веса тела в день и наиболее предпочтительно в пределах от 15 до 60 мг на килограмм веса тела в день. Эта доза может, если желательно, быть представлена как две, три, четыре или более субдоз, вводимых через соответствующие интервалы в течение дня.
Составы включают те, которые подходят для орального, ректального, назального, местного (включая букальный и подъязычный), вагинального или парэнтерального (включая подкожный, внутримышечный, внутривенный, внутрикожный, интратекальный или эпидуральный) введения. Составы могут соответственно быть представлены в форме единичных доз и могут быть получены любым из методов, хорошо известных в фармации. Такие методы включают стадию связывания активного ингредиента с носителем, который содержит один или более дополнительных ингредиентов. Обычно составы готовят равномерным и однородным смешением активного ингредиента с жидкими носителями или тонко измельченными твердыми носителями, или теми и другими и затем, если необходимо, формированием продукта.
Составы по настоящему изобретению, подходящие для орального введения, могут быть представлены в виде дискретных единиц, таких как капсулы, облатки или таблетки, причем каждая содержит определенное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной жидкости или в не-водной жидкости; или в виде жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле. Активный ингредиент может также быть представлен в виде пилюли или пасты или может находиться внутри липосом.
Таблетку можно изготовить прессованием или формованием, по желанию с одним или несколькими дополнительными ингредиентами. Прессованные таблетки могут быть изготовлены прессованием на подходящем станке активного ингредиента в свободно-текучей форме, такой как порошок или гранулы, необязательно смешанные со связующим (например, повидоном, желатином, гидроксипропилметилцеллюлозой), смазывающим веществом, инертным разбавителем, дезинтегрантом (например, крахмалгликолятом натрия, сшитым повидоном, сшитой натрий карбоксиметилцеллюлозой), поверхностно-активным или диспергирующим агентом. Формованные таблетки можно изготовлять формованием на соответствующем станке измельченного в порошок соединения, смоченного инертным жидким разбавителем. Таблетки могут по желанию быть с покрытием или без покрытия и могут быть сформированы так, чтобы давать медленное или контролируемое высвобождение находящегося в ней активного ингредиента, используя, например, гидроксипропилметилцеллюлозу в различных соотношениях для получения желаемого профиля высвобождения.
Капсулу можно изготовить заполнением свободным или прессованным порошком или на соответствующем станке по желанию с одной или несколькими добавками. Примеры подходящих добавок включают связующие, такие как повидон, желатин, смазочное вещество, инертные разбавители, дезинтегранты, как для таблеток. Можно также изготовить капсулы так, чтобы они содержали пилюли или дискретные субединицы для получения медленного или контролируемого высвобождения основного ингредиента. Этого можно достигнуть экструдированием и скатыванием в шарик влажной смеси лекарственного соединения плюс экструзионная кислота (например, микрокристаллическая целлюлоза) плюс разбавитель, такой как лактоза. Полученные таким образом сферические частицы могут быть покрыты полупроницаемой мембраной (например, этилцеллюлозой, Eudragit WE30D), чтобы получить свойства замедленного высвобождения.
При инфекции глаза или другой наружной ткани, например рта или кожи, составы предпочтительно применять в виде мази или крема для местного применения, содержащих активный ингредиент в количестве, например, от 0,075 до 20% по весу, предпочтительно от 0,2 до 15% по весу и наиболее предпочтительно от 0,5 до 10% по весу. При приготовлении в виде мази активные ингредиенты могут быть использованы либо с парафиновой, либо со смешивающейся с водой мазевой основой. Альтернативно, активные ингредиенты можно приготовить в виде крема с кремовой основой масло-в-воде или основой как вода-в-масле.
Если желательно, водная фаза кремовой основы может включать, например, по меньшей мере 40-45% по весу многоатомного спирта, т.е. спирта, имеющего две или более гидроксильные группы, такие как пропиленгликоль, бутан-1,3-диол, маннит, сорбит, глицерин и полиэтиленгликоль и их смеси. Местные составы могут по желанию включать соединение, которое усиливает абсорбцию или проникновение активного ингредиента через кожу или другие пораженные участки. Примеры таких усилителей дермального проникновения включают диметилсульфоксид и родственные аналоги.
Масляная фаза эмульсий в соответствии с данным изобретением может быть составлена из известных ингредиентов известным способом. В то время как эта фаза может включать просто эмульгатор (иначе известный как эмульгент), желательно включать смесь по меньшей мере одного эмульгатора с жиром или маслом или и с жиром, и с маслом. Предпочтительно гидрофильный эмульгатор включают вместе с липофильным эмульгатором, который действует как стабилизатор. Предпочтительно также включать как масло, так и жир. Вместе эмульгатор (эмульгаторы) совместно или без стабилизатора (стабилизаторов) образует так называемый эмульсифирующий воск, и этот воск вместе с маслом и/или жиром образуют так называемую основу эмульсифирующей мази, которая образует масляную дисперсную фазу кремовых составов.
Эмульгаторы и стабилизаторы эмульсии, пригодные для использования в составе настоящего изобретения, включают Твин 60, Спэн 80, цетостеариловый спирт, миристиловый спирт, глицерилмоностеарат и лаурилсульфат натрия.
Соединение (1S,4R) 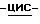 4-[2-амино-6-(циклопропиламино)-9H-ил]- 2-циклопентен-1-метанол может быть синтезировано в соответствии с EP 0434450 или, альтернативно, заявкой PCT N GB/9500225, которые включены здесь посредством ссылки.
4-[2-амино-6-(циклопропиламино)-9H-ил]- 2-циклопентен-1-метанол может быть синтезировано в соответствии с EP 0434450 или, альтернативно, заявкой PCT N GB/9500225, которые включены здесь посредством ссылки.
Янтарная кислота коммерчески доступна (Aldrich Chemical Company, Дорсет, Англия).
Пример А
Получение соли янтарной кислоты (1S,4R) 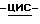 4-[2-амино-6- (циклопропиламино)-9H-пурин-9-ил]-2-циклопентен-1-метанола.
4-[2-амино-6- (циклопропиламино)-9H-пурин-9-ил]-2-циклопентен-1-метанола.
Раствор (1S,4R) 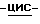 4-[2-амино-6-(циклопропиламино)-9H-пурин- 9-ил]-2-циклопентен-1-метанола (30,93 г, 0,102 моль) в абсолютном этаноле (96 мл) добавили к раствору янтарной кислоты (Aldrich, 99%, 12,15 г, 0,102 моль) в воде (130 мл). Смесь довели до кипения с обратным холодильником, и полученный раствор обработали углем (0,4 г) и отфильтровали через слой целита. По мере медленного остывания раствора до температуры окружающей среды образовывались светло-желтые кристаллы (38,0 г). Это твердое вещество перекристаллизовали из воды (500 мл) с получением сукцината (1S,4R)
4-[2-амино-6-(циклопропиламино)-9H-пурин- 9-ил]-2-циклопентен-1-метанола (30,93 г, 0,102 моль) в абсолютном этаноле (96 мл) добавили к раствору янтарной кислоты (Aldrich, 99%, 12,15 г, 0,102 моль) в воде (130 мл). Смесь довели до кипения с обратным холодильником, и полученный раствор обработали углем (0,4 г) и отфильтровали через слой целита. По мере медленного остывания раствора до температуры окружающей среды образовывались светло-желтые кристаллы (38,0 г). Это твердое вещество перекристаллизовали из воды (500 мл) с получением сукцината (1S,4R) 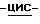 4-[2-амино-6-(циклопропиламино)- 9H-пурин-9-ил]-2-циклопентен-1-метанола в виде белого порошка (34,9 г, 80%), т.пл. 168-169oC.
4-[2-амино-6-(циклопропиламино)- 9H-пурин-9-ил]-2-циклопентен-1-метанола в виде белого порошка (34,9 г, 80%), т.пл. 168-169oC.
1H-ЯМР (ДМСО-d6) δ: 12,70-11,70 (brm, 2, 2 карбоксил H), 7,62 (s, 1, пурин CH), 7,30 (d, J = 4,1 Гц), 6,10 (m, 1, =CH), 5,90-5,75 (m, 3, =CH и NH2), 5,40 (m, 1, NCH), 5,20-4,50 (dr m, 1, OH), 3,46 (d, J = 5,9 Гц, 2, OCH2), 3,10 (br m, 1, CH циклопропила), 2,85 (br m, 1, CH), 2,70-2,50 (m, 1, CH), 2,40 (s, 4, 2 CH2 сукцината), 1,70-1,50 (m, 1, CH), 0,75-0,50 (m, 4, 2 CH2 циклопропила).
Анализ. Рассчитано для C14H18N6O• C4H6O4•050H2O: C 52,29; H 6,09; N 20,33. Найдено: C 52,33; H 6,09; N 20,38.
Пример Б: промышленное получение соли янтарной кислоты (1S,4R)-цис-4-[2-амино-6-(циклопропиламино)-9H-пурин-9-ил]-2- циклопентен-1-метанола.
К суспензии хлорпурина (96 кг, 1 вес. часть) в IMSG (10 об., 7,94 вес. частей), перемешанной при 15-20oC, добавляют циклопропиламин (1,375 об., 1,13 вес. частей, 6,0 экв.). Полученный раствор нагревают при температуре дефлегмации и поддерживают эту температуру в течение четырех часов до тех пор, пока не завершится образование (1S,4R)-цис-4-[2-амино-6-(циклопропиламино)- 9H-пурин-9-ил] -2-циклопентен-1-метанола. Смесь затем вновь охлаждают до 20oC и добавляют IMSG (5,99 об., 4,76 вес. частей), затем добавляют уголь (0,104 вес. частей) и харборлит (0,05 вес. частей). Эту смесь нагревают до 45-50oC и выдерживают при этой температуре в течение 90 минут.
Реакционную смесь слегка охлаждают до 40-45oC и осветляют, пропуская через фильтр-пресс для удаления угля и харборлита. Если необходимо, это осветление может быть завершено по частям. Фильтровальную лепешку промывают теплым (40-45oC) IMSG (2х2,0 об., 1,59 вес. частей, 1х1,0 об., 0,794 вес. частей).
Фильтрат и промывки концентрируют в вакууме до примерно 3 об., добавляют IMSG (предварительно нагретый до 40-45oC, 3,5 об., 2,78 вес. частей) и эту порцию повторно концентрируют в вакууме до примерно 3 об. Эту порцию разбавляют IMSG (предварительно нагретый до 40-45oC, 3,5 об., 2,78 вес. частей) и эту порцию снова повторно концентрируют в вакууме до 3 об.
Полученный концентрат нагревают до 45-55oC и добавляют водный раствор янтарной кислоты (0,469 вес. частей, 1,2 экв.) в воде (8 об.), предварительно нагретый до 60-65oC, поддерживая температуру реакционной смеси выше 50oC. Температуру реакционной смеси доводят до 65-70oC для полного растворения, затем медленно охлаждают до 50-52oC и добавляют соответствующий затравочный кристалл (0,001 вес. частей). Раствор перемешивают при 48-52oC до тех пор, пока не установится кристаллизация. Полученную суспензию охлаждают до 20-25oC в течение по меньшей мере 90 минут, затем до 0-5oC в течение по меньшей мере 30 минут и выдерживают при 0-5oC в течение по меньшей мере одного часа перед сбором продукта путем фильтрации.
Полученную лепешку дважды промывают смесью вода:IMSG (2х1,6 вес. частей/об, вода: 2х0,4 об., 0,32 вес. частей IMSG). Продукт высушивают в вакууме при температуре до 45oC.
Выход: 105,6 кг, 110% мас./мас., 82,2% от теоретич.
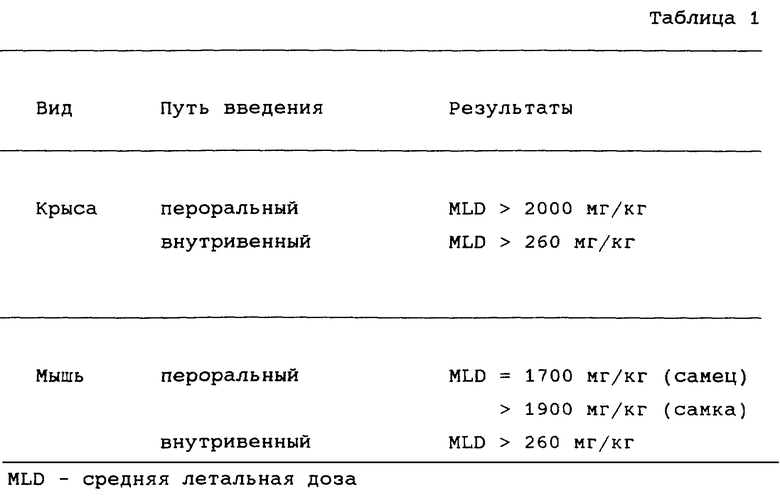
Пример В: данные по токсичности соли янтарной кислоты (1S,4R)-цис-4-[2-амино-6-(циклопропиламино)-9H-пурин-9-ил]-2- циклопентен-1-метанола.
Исследования кратковременных токсических эффектов однократных доз соли янтарной кислоты (1S,4R)-цис-4-[2-амино-6-(циклопропиламино)- 9H-пурин-9-ил] -2-циклопентен-1-метанола приведены в таблице.
Пример В: Составы для таблеток
Влажным гранулированием ингредиентов с раствором повидона были получены следующие составы A, B и C, после чего добавляли стеарат магния и прессовали.
Состав A, мг/таблетка:
(a) Активный ингредиент - 250; 250
(b) Лактоза В.Р. - 210; 26
(c) Повидон В.Р. - 15; 9
(d) Крахмалгликолят натрия - 20; 12
(e) Стеарат магния - 5; 3
Всего: - 500; 300
Состав B, мг/таблетка:
(a) Активный ингредиент - 250; 250
(b) Лактоза - 150; -
(c) Авицель РН 101 - 60; 26
(d) Повидон В.Р. - 15; 9
(e) Крахмалгликолят натрия - 20; 12
(f) Стеарат магния - 5; 3
Всего: - 500; 300
Состав C (Состав контролируемого высвобождения)
Состав получен влажным гранулированием ингредиентов (см. ниже) с раствором повидона, после чего добавляли стеарат магния и прессовали.
Состав, мг/таблетка:
(a) Активный ингредиент - 500
(b) Гидроксипропилметилцеллюлоза (Methocel K4M Premium) - 112
(c) Лактоза В.Р. - 53
(d) Повидон В.Р.С. - 28
(e) Стеарат магния - 7
Всего: - 700
Капсулы изготовляют диспергированием активного ингредиента в лецитине и арахисовом масле и заполнением этой дисперсией мягких желатиновых капсул.
Состав C (Капсулы с контролируемым высвобождением)
Следующий состав для капсул с контролируемым высвобождением приготовляют экструдированием ингредиентов a, b и с, используя экструдер, после чего формуют экструдат в шарики и сушат. Сухие шарики затем покрывают контролирующей высвобождение мембраной (d) и заполняют ими состоящую из двух частей твердую желатиновую капсулу.
Состав, мг/капсула
(a) Активный ингредиент - 250
(b) Микрокристаллическая целлюлоза - 125
(c) Лактоза В.Р. - 125
(d) Этилцеллюлоза - 13
Всего: - 513
Пример D: состав для инъекций
Активный ингредиент - 0,200 г
Стерильный, свободный от пирогена фосфатный буфер (pH 7,0) - До 10 мл
Активный ингредиент растворяют в большей части фосфатного буфера (35-40oC), затем доводят до объема и фильтруют через стерильный микропористый фильтр в стерильный янтарного цвета стеклянный сосуд на 10 мл, и стерильно тщательно закрывают или запаивают.
Пример E: внутримышечная инъекция
Активный ингредиент - 0,20 г
Бензиловый спирт - 0,10 г
Гликофурол 75 - 1,45 г
Вода для инъекций - До 3,00 мл
Активный ингредиент растворяют в гликофуроле. Затем добавляют бензиловый спирт и растворяют, и добавляют воду до 3 мл. Затем смесь фильтруют через стерильный микропористый фильтр и запаивают в стерильный стеклянный сосуд объемом 3 мл (тип 1).
Пример F: сиропообразная суспензия
Активный ингредиент - 0,2500 г
Раствор сорбита - 1,5000 г
Глицерин - 2,0000 г
Способная к диспергированию целлюлоза - 0,0750 г
Бензоат натрия - 0,0050 г
Вкусовая добавка, Peach 17.42.3169 - 0,0125 мл
Очищенная вода - 5,0000 мл
Бензоат натрия растворяют в порции очищенной воды и добавляют раствор сорбита. Добавляют и диспергируют активный ингредиент. В глицерине диспергируют загуститель (способную к диспергированию целлюлозу). Обе дисперсии смешивают и доводят до требуемого объема очищенной водой.
Пример G: суппозиторий, мг/суппозиторий
Активный ингредиент (631m) - 250
Твердый жир, BP (Witepsol H-15 - Dynamit NoBel) - 1770
Всего: - 2020
Активный ингредиент используют в виде порошка, в котором по меньшей мере 90% частиц имеют диаметр 0,63 мкм или меньше. Одну пятую Witepsol H15 расплавляют в чашке с нагреваемыми паром стенками при 45oC максимум. Активный ингредиент просеивают через 200 мкм сито и добавляют к расплавленной основе при перемешивании, используя мешалку Silverson, снабженную режущей головкой, пока не будет достигнута однородная дисперсия. Выдерживая смесь при 45oC, добавляют к суспензии оставшийся Witepsol H15, и перемешивают для обеспечения гомогенного смешения. Всю суспензию пропускают через сито из нержавеющей стали 2501m и при постоянном перемешивании дают остыть до 40oC. При температуре от 38oC до 40oC 2,02 г смеси помещают в соответствующие пластиковые отливки. Суппозиториям дают остыть до комнатной температуры.
Пример H: Пессарии, мг/пессарий
Активный ингредиент 631m - 250
Безводная декстроза - 380
Картофельный крахмал - 363
Стеарат магния - 7
Всего: - 1000
Указанные выше ингредиенты смешивают непосредственно, и приготовляют пессарии прямым прессованием получившейся смеси.
Пример I: Местный препарат - крем
Активное соединение - 5,00 г
Глицерин - 2,00 г
Цетостеариловый спирт - 6,75 г
Лаурилсульфат натрия - 0,75 г
Белый мягкий парафин - 2,50 г
Жидкий парафин - 5,00 г
Хлоркрезол - 0,10 г
Очищенная вода - До 100,00 г
Активное соединение растворяют в смеси очищенной воды и глицерина и нагревают до 70oC. Нагревают оставшиеся ингредиенты вместе при 70oC. Соединяют обе части вместе и эмульгируют. Охлаждают и заполняют контейнеры.
Настоящее изобретение относится к соли янтарной кислоты (1S,4R)-цис-[2-амино-6-(циклопропиламино)-9Н-пурин-9-ил] -2-цик-лопентен-1-метанола или ее сольвату, к фармацевтическим составам, содержащим такое соединение, и к использованию этого соединения или фармацевтических составов в медицинской терапии или в методах лечения или профилактики вирусной инфекции, особенно инфекции вируса иммунодефицита человека (ВИЧ) и вируса гепатита В (ВГВ). 3 с. и 4 з.п. ф-лы, 1 табл.
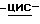 4-[2-амино-6-(циклопропиламино)-9Н-пурин-9-ил]-2-циклопентен-1-метанола.
4-[2-амино-6-(циклопропиламино)-9Н-пурин-9-ил]-2-циклопентен-1-метанола.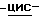 4-[2-амино-6-(циклопропиламино)-9Н-пурин-9-ил]-2-циклопентен-1-метанол в подходящем растворителе с янтарной кислотой в воде при температуре дефлегмации и дают раствору охладиться до температуры окружающей среды с последующим сбором выпавших кристаллов и возможной перекристаллизацией из подходящего растворителя.
4-[2-амино-6-(циклопропиламино)-9Н-пурин-9-ил]-2-циклопентен-1-метанол в подходящем растворителе с янтарной кислотой в воде при температуре дефлегмации и дают раствору охладиться до температуры окружающей среды с последующим сбором выпавших кристаллов и возможной перекристаллизацией из подходящего растворителя.
| Способ получения производных пуринов или их солей | 1983 |
|
SU1537138A3 |
| КОММУТАТОР ДЛЯ НАБОРА ЗАДАЧ НА АНАЛОГОВЫХ ВЫЧИСЛИТЕЛЬНЫХ МАШИНАХ | 0 |
|
SU344450A1 |
| EP 0349252 A, 03.01.90. | |||
Авторы
Даты
2000-02-10—Публикация
1995-08-25—Подача