Изобретение относится к области фармакологии и медицины, а именно, к интраназальным фармацевтическим композициям янтарнокислого 2-этил-6-метил-3-оксипиридина, известного также как 2-этил-6-метил-3-гидроксипиридин, в виде спрэя, для профилактики и лечения широкого круга заболеваний.
2-Этил-6-метил-3-оксипиридин известный из уровня техники антиоксидант с широким профилем биологической активности, включая нейропротекторную активность. Воронина Т.А. Пионер антиоксидантной нейропротекции. 20 лет в клинической практике // РМЖ. 2016. №1. С. 1-1. 2-Этил-6-метил-3-оксипиридин применяется в виде различных лекарственных форм, в том числе, в виде растворов для инъекций, гранулированных порошков, капсул, таблеток для перорального применения, гелей, перевязочных материалов. Патенты РФ 2065299, 2144822, 2145855, 2149648, 2293558, 2205640, 2380089. Однако, интраназальные композиции 2-этил-6-метил-3-оксипиридина в виде спрэя неизвестны. Мы установили, что 2-этил-6-метил-3-оксипиридин достоверно эффективнее как нейропротектор при интраназальном введении, чем при инъекционном, что позволяет многократно снизить дозу, так уменьшить побочные эффекты 2-этил-6-метил-3-оксипиридина, и при этом достичь желаемой терапевтической эффективности.
Задачей настоящего изобретения является создание фармацевтической композиции для интраназального введения в виде спрэя на основе янтарнокислой соли 2-этил-6-метил-3-оксипиридина, позволяющей повысить терапевтическую эффективность при снижении терапевтической дозы указанного средства.
В настоящем изобретении раскрыта фармацевтическая композиция для интраназального введения, характеризующаяся тем, что содержит 0,1-5,0 мас. % янтарнокислой соли вещества формулы (I)
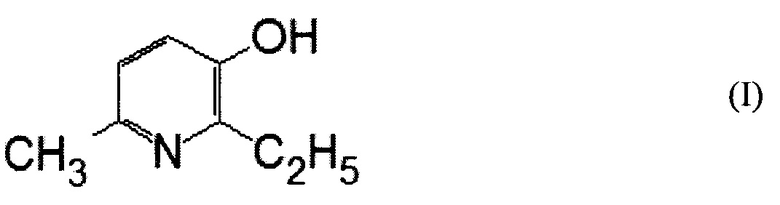
2
и воду в качестве растворителя. Фармацевтическая композиция может содержать вспомогательное вещество.
Вещество формулы (I) известно под названием 2-этил-6-метил-3-оксипиридин или 2-этил-6-метил-3-гидроксипиридин. Способ получения вещества формулы (I) хорошо известен из уровня техники и янтарнокислая соль вещества формулы (I) является коммерчески доступной.
Предпочтительно, терапевтически эффективное количество янтарнокислой соли вещества формулы (I) в единичной дозированной форме фармацевтической композиции настоящего изобретения составляет от 0,1 до 50 мг. Дозировка по данному изобретению будет варьировать в зависимости от возраста и массы тела больного и тяжести состояния, по поводу которого проводится лечение. Например, лекарственный препарат может быть введен внутрь один или два раза в сутки, один день или более. Термин "лечение заболевания" означает лечение, контроль, предотвращение и/или уменьшение проявления одного или нескольких клинических признаков (симптомов) заболевания у нуждающегося в таком лечении млекопитающего. Неисключительные примеры млекопитающих в контексте данного изобретения включают людей и домашних животных, например собак и кошек. В предпочтительном варианте млекопитающим является человек.
Термин "терапевтически эффективное количество" относится к такому количеству янтарнокислой соли вещества формулы (I), которое достаточно для того чтобы обеспечить желаемый терапевтический эффект.
Термин «вспомогательное вещество» относится к веществам неорганического или органического происхождения, используемым в процессе производства, изготовления лекарственных препаратов для придания им необходимых физико-химических свойств. Такими вспомогательными веществами являются растворители и наполнители, консерванты, антиоксиданты, поверхностно-активные вещества (ПАВ), пленкообразователи, регуляторы рН среды, и корригенты.
Примерами приемлемых растворителей и наполнителей являются вода, спирт этиловый, жирные масла растительного и животного происхождения, минеральные масла, глицерин, этилацетат, хлористый этил, пропиленгликоль, димексид (диметилсульфоксид), полиэтиленоксиды с различными молекулярными массами, полисилоксановые соединения, и этилцеллюлоза.
Примерами приемлемых консервантов являются Трилон Б, метабисульфит натрия, метилпарагидроксибензоат, пропилпарагидроксибензоат, этилпарагидроксибензоат, сорбиновая кислота и ее соли, бензойная кислота, натрия бензоат, этоний, и катамин АБ. Предпочтительными консервантами настоящего изобретения являются Трилон Б и метабисульфит натрия. Предпочтительное содержание Трилона Б в составе фармацевтической композиции настоящего изобретения составляет от 0,01 до 0,2 мас. %. Предпочтительное содержание метабисульфита натрия в составе фармацевтической композиции настоящего изобретения составляет от 0,01 до 1,5 мас. %.
Примерами приемлемых антиоксидантов являются бутилокситолуол, бутилоксианизол, витамин Е, аскорбиновая кислота.
Примерами приемлемых поверхностно-активных веществ являются полисорбаты (твины), спены, пентол, препарат ОС-20, эмульсионные воски, эмульгатор №1, эмульгатор Т-2, спирты синтетические жирные первичные, триэтаноламиновые соли высших жирных кислот, олеиновая кислота.
Примерами приемлемых пленкообразователей являются производные целлюлозы и акриловой кислоты.
Примерами приемлемых регуляторы рН среды являются буферные растворы, натрия фосфат одно- и двузамещенный, натрия цитрат, натрия гидроксид, натрия гидрокарбонат, натрия тетраборат.
Для приготовления фармацевтических композиций по данному изобретению используют методы и фармацевтические процедуры, хорошо известные из уровня техники, например, описанные в Фармацевтическом научном справочнике Ремингтона. Remington's Pharmaceutical Sciences, seventeenth edition, ed. Alfonso R. Gennaro, Mack Publishing Company, Easton, Pa., Eighteenth edition, 1990.
Фармацевтическая композиция на основе янтарнокислой соли вещества формулы (I) предпочтительно изготавливается в виде водного раствора с рН от 4 до 6,5. Выбор интервала рН связан с тем, что он соответствует рН, при котором активность лизоцима, антимикробного фермента в составе назального секрета, является максимальной. Используя фармацевтическую композицию на основе вещества формулы (I) или его фармацевтически приемлемой соли в виде водного раствора в интервале рН от 4 до 6,5 возможно сохранить антимикробную активность слизистой носа и предотвратить инфекции, связанные с инактивацией лизоцима при рН>6,5.
Следующие примеры демонстрируют изобретение. Примеры имеют иллюстративное значение и не предназначены для ограничения объема изобретения тем или иным образом.
Пример 1.
Пример иллюстрирует фармацевтическую композицию для интраназального введения, содержащую вещество формулы (I).
Янтарнокислая соль вещества формулы (I) смешивается с фармацевтической очищенной водой в соотношениях, указанных в Таблице 1. Полученный раствор разливается во флаконы объемом 10 мл и снабжается устройством для интраназального введения в виде спрэя.

Пример 2.
Пример иллюстрирует фармацевтическую композицию для интраназального введения, содержащую вещество формулы (I) и метабисульфит натрия.
Янтарнокислая соль вещества формулы (I) смешивается с фармацевтической очищенной водой и метабисульфитом натрия в соотношениях, указанных в Таблице 2. Полученный раствор разливается во флаконы объемом 10 мл и снабжается устройством для интраназального введения в виде спрэя.

Пример 3.
Пример иллюстрирует фармацевтическую композицию для интраназального введения, содержащую вещество формулы (I) и Трилон Б.
Янтарнокислая соль вещества формулы (I) смешивается с фармацевтической очищенной водой и Три лоном Б в соотношениях, указанных в Таблице 3. Полученный раствор разливается во флаконы объемом 10 мл и снабжается устройством для интраназального введения в виде спрэя.

Пример 4.
Пример иллюстрирует фармацевтическую композицию для интраназального введения, содержащую вещество формулы (I) в водном растворе при рН от 4 до 6,5.
Янтарнокислая соль вещества формулы (I) смешивается с фармацевтической очищенной водой и доводится янтарной кислотой до рН 4-6.5 при соотношениях, указанных в Таблице 4. Полученный раствор разливается во флаконы объемом 10 мл и снабжается устройством для интраназального введения в виде спрэя.

Пример 5.
Данный пример демонстрирует преимущество интраназальной фармацевтической композиции настоящего изобретения.
Фармацевтическую композицию тестировали на модели хронической церебральной гиперперфузии, вызванной перманентной перевязкой двух сонных артерий. Ni JW, et al., Brain Res 1994, 653(1-2):231-6. Эта модель приводит к достоверному дефициту памяти, который может быть оценен в классическом тесте условного рефлекса пассивного избегания (УРПИ). Storozheva Zlet al, ВМС Pharmacol. 2008, 23;8:1. Тест УРПИ является базовым для исследования фармакологической активности лекарственных средств. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ, под редакцией Хабриева РУ, издание 2-е, Москва, 2005. Самцам крысам Вистар выполняли перевязку двух сонных артерий (операция) или ложную перевязку (ложная операция). Через 30 мин после перевязки артерий, контрольным ложнооперированным крысам вводили дистиллированную воду интраназально 7 дней один раз в день (n=10) или физиологический раствор внутрибрюшинно 7 дней один раз в день (n=10). Через 30 мин после перевязки артерий, контрольным оперированным крысам вводили физиологический раствор внутрибрюшинно 7 дней один раз в день (n=9), дистиллированная вода интраназально 7 дней один раз в день (n=8), фармацевтическую композицию из Примера 1 с содержанием 5 мас. % вещества формулы (I) в виде бутандиоата интраназально в дозе 0,2 мг/кг веса тела 7 дней один раз в день (n=10), фармацевтическую композицию из Примера 1 с содержанием 5 мас. % вещества формулы (I) в виде бутандиоата внутрибрюшинно в дозе 25 мг/кг веса тела 7 дней один раз в день (n=10). Тест УРПИ выполнялся на 15 день (обучение) и 16 день (тестирование) со дня проведения операции. Время захода в темный отсек в сеансе тестирования (латентный период), проводимом через 24 часа после сеанса обучения, является показателем долговременной памяти оборонительного поведения в тесте УРПИ. Таблица 5 показывает среднюю продолжительность латентного периода в день тестирования ± стандартную ошибку.

* Достоверно отличается от соответствующего ложнооперированного контроля, р<0,05.
# Достоверно отличается от соответствующего оперированного контроля, р<0,05.
Результаты теста показывают, что интраназальное введение вещества (I) в дозе 0,2 мг/кг в составе фармацевтической композиции достоверно улучшало обучение и память в тесте УРПИ у оперированных животных с хронической церебральной гипоперфузией в сравнении с контролем, тогда как это же вещество, в составе точно такой же композиции, но введенное внутрибрюшинно, было неэффективным в указанном тесте в дозе 25 мг/кг, которая превышала в 50 раз эффективную дозу при интраназальном введении. Введение интраназального спрэя при разном содержании вещества (I) в растворе в диапазоне 0,1-10,0 масс. %, но в той же дозе 0,2 мг/кг, давало статистически неотличимые результаты эффективности, и латентный период в сеансе тестирования составлял 127,8±13,5; 142,6±9,8; и 136,3±10,8 секунды для содержания вещества 0,1; 5,0; и 10,0 мас. % соответственно (n=10 в каждой группе, р>0,05 между группами), но было достоверно эффективнее по сравнению с внутрибрюшинным введением (р<0,05). Таким образом, интраназальная фармацевтическая композиция настоящего изобретения обладает многократно более высокой эффективностью по сравнению с инъекционными фармацевтическими композициями вещества формулы (I), известными из уровня техники.
Настоящее изобретение относится к фармацевтической композиции для интраназального введения в виде спрэя, содержащей 0,1-5,0 мас.% янтарнокислой соли 2-этил-6-метил-3-оксипиридина и воду в качестве растворителя. Композиция дополнительно в качестве вспомогательного вещества содержит стабилизатор, выбранный из группы, состоящей из Трилона Б и метабисульфита натрия. Композиция приготовлена в виде водного раствора с pH 4-6,5. Интраназальный спрэй янтарнокислой соли 2-этил-6-метил-3-оксипиридина обеспечивает большую эффективность указанного активного вещества, чем его инъекционное введение в той же дозе. Изобретение обеспечивает многократное снижение эффективных доз янтарнокислой соли 2-этил-6-метил-3-оксипиридина при одновременном повышении терапевтической эффективности в сравнении с инъекциями. 2 з.п. ф-лы, 5 табл., 5 пр.
1. Фармацевтическая композиция для интраназального введения в виде спрэя, характеризующаяся тем, что содержит 0,1÷5,0 мас. % янтарнокислой соли вещества формулы (I)
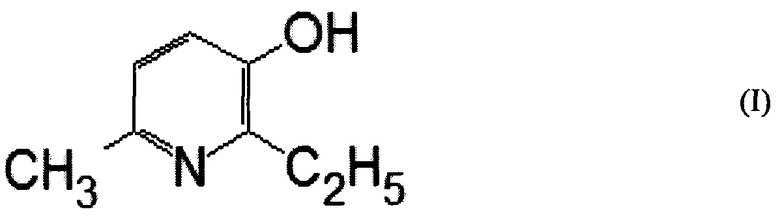
и воду в качестве растворителя.
2. Фармацевтическая композиция по п. 1, отличающаяся тем, что содержит в качестве вспомогательного вещества стабилизатор, выбранный из группы, состоящей из Трилона Б и метабисульфита натрия.
3. Фармацевтическая композиция по п. 1, отличающаяся тем, что имеет рН раствора от 4 до 6,5.
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКИХ ФАРИНГИТОВ РАСТВОРОМ НОВОКАИНА И МЕКСИДОЛА | 2009 |
|
RU2394567C1 |
| М.Д.Машковский | |||
| Лекарственные средства | |||
| Пособие для врачей, Москва, "Новая волна", Издатель Умеренков, 2012, стр.722, 723 | |||
| СТАБИЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ, СОДЕРЖАЩИЙ МЕКСИДОЛ | 2002 |
|
RU2205640C1 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ ДЛЯ ИНЪЕКЦИЙ | 2008 |
|
RU2380089C2 |
| СТАБИЛЬНАЯ ЖИДКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ КОМПЛЕКСА 3-(2,2,2-ТРИМЕТИЛГИДРАЗИНИЙ) ПРОПИОНАТ-2-ЭТИЛ-6-МЕТИЛ-3-ГИДРОКСИПИРИДИНА ДИСУКЦИНАТА, ОБЛАДАЮЩАЯ АНТИГИПОКСИЧЕСКИМ, АНТИОКСИДАНТНЫМ И АДАПТОГЕННЫМ ДЕЙСТВИЕМ | 2013 |
|
RU2527347C1 |
| Д.Ю | |||
| Пенионжкевич и др | |||
| Новые технологии нейрометаболической терапии при цереброваскулярных заболеваниях | |||
| Журнал Неврологии и Психиатрии, 2009, 7, стр.19-22 | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
Авторы
Даты
2018-10-24—Публикация
2017-05-15—Подача