Приоритет этой формулы изобретения Международной заявки РСТ принадлежит США №08/665,926, зарегистрирована 19 июня 1996, США Предварительная заявка 60/021,087 зарегистрирована 2 июля 1996, и США Предварительная заявка 60/022,999 зарегистрирована 2 августа 1996. В этой заявке заключены ссылки на различные публикации. Содержание этих публикаций в полноте раскрывается с помощью ссылки, приведенной в данной заявке.
Введение
Настоящее изобретение относится в основном к области генной инженерии и особенно к области генов для рецепторных тирозинкиназ и родственных им лигандов, их введению в рекомбинантные ДНК-векторы и продукции кодированных белков в реципиентных штаммах микроорганизмов и реципиентных эукариотических клетках. Точнее, настоящее изобретение связано с новыми лигандами, известными как TIE-лиганд-3 и ТIЕ-лиганд-4, которые связывают TIE-2-рецептор, а также способами получения и использования новых лигандов. Кроме того, изобретение связано с последовательностями нуклеиновой кислоты, кодирующими TIE-лиганд-3 и ТIЕ-лиганд-4, способами получения нуклеиновых кислот и генных продуктов. Новые TIE-лиганды, а также нуклеиновые кислоты, кодирующие их, могут быть полезны в диагностике и лечении определенных заболеваний, затрагивающих эндотелиальные клетки и связанные TIE-рецепторы, таких как неопластические заболевания, включающие опухолевый ангиогенез, заживление ран, тромбоэмболические заболевания, атеросклероз и воспалительные процессы. Кроме того, лиганды могут быть использованы для стимуляции пролиферации и/или дифференцировки гематопоэтических стволовых клеток.
Биологически активные лиганды согласно изобретению могут быть использованы для стимуляции роста, выживания клеток, миграции, и/или дифференцировки, и/или стабилизации или дестабилизации клеток, экспрессирующих TIE-рецептор. Биологически активные TIE-лиганды могут быть использованы in vitro для поддержания экспрессирующих TIE-рецептор клеток в культуре. Клетки и ткани, экспрессирующие TIE-рецептор, включают, например, сердечные и сосудистые эндотелиальные клетки, эпителий хрусталика глаза и сердечный эпикард и ранние гематопоэтические клетки. С другой стороны, подобные лиганды могут быть использованы, чтобы способствовать клеткам, полученным генно-инженерной техникой в экспрессии TIE-рецептора. Далее лиганды и родственные им рецепторы могут быть использованы в аналитических системах для идентификации агонистов или антагонистов рецептора.
Предпосылки к созданию изобретения
Поведение клетки, отвечающее за развитие, сохранение и восстановление дифференцированных клеток и тканей, регулируется, по большей части, с помощью межклеточных сигналов, передаваемых посредством факторов роста и подобных лигандов и их рецепторов. Рецепторы расположены на клеточной поверхности отвечающих клеток, и они связывают пептиды или полипептиды, известные как факторы роста, а также другие подобные гормонам лиганды. Результатом этого взаимодействия являются быстрые биохимические изменения в отвечающих клетках, а также быстрая и продолжительная регуляция клеточной экспрессии генов. Несколько рецепторов, связанных с различными клеточными поверхностями, могут связывать специфические факторы роста.
Фосфорилирование тирозированных остатков в белках с помощью тирозинкиназ является одним из ключевых путей, с помощью которого сигналы передаются через плазматическую мембрану. Несколько известных в настоящее время генов белка тирозинкиназы кодируют трансмембранные рецепторы для полипептидных факторов роста и гормонов, таких как эпидермальный фактор роста (EGF), инсулин, инсулиноподобный фактор-1 роста (IGF-1), полученные из тромбоцитов, факторы роста (PDGF-A и - В) и факторы роста фибробластов (FGF) (Heldin et al., Cell Regulation, 1, 555-566, 1990; Ulrich, et al., Cell, 61, 243-254, 1990). В каждом примере эти факторы проявляют присущее им действие путем связывания с внеклеточной частью родственных им рецепторов, которое приводит к активации той части тирозинкиназы, которая находится на цитоплазматическом участке рецептора. Рецепторы факторов роста эндотелиальных клеток представляют особый интерес благодаря возможному вовлечению факторов роста в некоторые важные физиологические и патологические процессы, такие как образование и развитие сосудов, ангиогенез, атеросклероз и воспалительные процессы (Folkmann, et al., Science, 235, 442-447, 1987). Также рецепторы некоторых гематопоэтических факторов роста являются тирозинкиназами; они включают c-fms, который является рецептором колониестимулирующего фактора 1 (Sherr, et al., Cell, 41, 665-676, 1985) и с-kit, незрелый рецептор гематопоэтического фактора роста, о котором сообщено в публикации (Huang, et al., Cell, 63, 225-233, 1990).
Рецепторные тирозинкиназы подразделяются на эволюционные подсемейства, основанные на характерной структуре их эктодоменов (Ulrich, et al., Cell, 61, 243-254, 1990). Подобные подсемейства включают киназу, подобную рецептору EGF (подкласс I) и киназу, подобную рецептору инсулина (подкласс II), каждая из которых содержит повторяющиеся гомологичные богатые цистеином последовательности во внеклеточных доменах. Единственная богатая цистеином область также найдена во внеклеточных доменах eph-подобных киназ (Hirai, et al., Science, 238, 1717-1720, 1987. Lindberg, et al., Mol. Cell. Biol, 10, 6316-6324, 1990; Lhotak, et al., Mol, Cell. Biol., 11, 2496-2502, 1991). PDGF-рецепторы, а также с-fms и c-kit-рецепторные тирозинкиназы можно сгруппировать в подкласс III, в то время как FGF-рецепторы образуют подкласс IV. Типичными для членов обоих этих подклассов являются внеклеточные скрученные части, стабилизированные дисульфидными связями внутри цепей. Эти так называемые иммуноглобулино-подобные сгибы найдены в белках суперсемейства иммуноглобулинов (Ig), которое содержит широкое разнообразие других клеточных поверхностных рецепторов, имеющих либо связанные с клеткой, либо растворимые лиганды (Williams, et al., Ann. Rev. ImmunoL, 6, 381-405, 1988).
Рецепторные тирозинкиназы отличаются по их специфичности и сродству. Вообще рецепторные тирозинкиназы являются гликопротеинами, которые состоят из (1) внеклеточного домена, способного связывать специфические факторы роста; (2) трансмембранного домена, который обычно является α-спиральной частью белка; (3) домена, расположенного рядом с мембранной, где рецептор может регулироваться с помощью, например, белкового фосфорилирования; (4) тирозинкиназного домена, который является ферментативным компонентом рецептора; и (5) карбоксильного концевого хвоста, который у многих рецепторов вовлекается в распознавание и субстратов для тирозинкиназ.
Процессы, такие как альтернативный сплайсинг и альтернативный выбор генного промотора или участков полиаденилирования, как сообщают, способствуют продуцированию некоторых различных полипептидов от одного и того же гена. Эти полипептиды содержат или не содержат различные домены, перечисленные выше. Как следствие, некоторые внеклеточные домены могут быть экспрессированы как отдельные, секретируемые белки, а некоторые формы рецептора могут не иметь тирозинкиназного домена и содержать только внеклеточный домен, включенный в плазматическую мембрану посредством трансмембранного домена плюс короткого карбоксильного концевого хвоста.
Ген, кодирующий трансмембранную тирозинкиназу эндотелиальных клеток, первоначально идентифицирован с помощью RT-ПЦР как неизвестный гомологичный тирозинкиназе кДНК-фрагмент из человеческих лейкемических клеток, описанный в публикации Partanen, et al., Proc. Natl. Acad. Sci. USA 87, 8913-8917, 1990. Этот ген и кодированный им белок названы “TIE”, что означает “тирозинкиназа с Ig и EGF-гомологичными доменами” (Partanen, et al., Mol. Cell. Biol., 12, 1698-1707, 1992).
Сообщалось, что tie-мРНК присутствует во всех эмбриональных тканях человека и мыши. При проверке оказалось, tie-мРНК локализована в эндотелиальных клетках сердца и сосудов. В частности, tie-мРНК локализована на эндотелии кровеносных сосудов и эндокардиальных клетках 9,5-18,5-дневных мышиных эмбрионов. Повышенная tie-экспрессия обнаружена в процессе неоваскуляризации, связанной с развитием фолликулов яичников и грануляцией тканей в кожных ранах. Таким образом, полагают, что TIE играют роль в ангиогенезе, который является важным моментом при разработке лечения твердых опухолей и некоторых других ангиогенез-зависимых заболеваний, таких как диабетическая ретинопатия, псориаз, атеросклероз и артрит.
Две структурно сходных TIE-рецепторных белка крысы, как сообщают, кодируются различными генами со сходными профилями экспрессии. Один ген, названный tie-1, представляет крысиный гомолог человеческого tie (Maisonpierre, et al., Oncogene, 8, 1631-1637, 1993). Другой ген, tie-2, может быть крысиным гомологом мышиного tek-гена, который, как сообщают, подобно tie, эрепрессируется у мыши исключительно в эндотелиальных клетках и их предполагаемых предшественниках (Dumont et al., Oncogene, 8, 1293-1301, 1993). Человеческий гомолог tie-2 описан в документе Ziegler, U.S. Patent № 5.447,860, который вышел 5 сентября 1995 г., где он обозначен как “ork”. Этот документ во всей его полноте включен в настоящее описание.
Было найдено, что оба гена широко экспрессируются в эндотелиальных клетках эмбриональной и послеродовой тканей. Существенные уровни транскриптов tie-2 также находятся в других эмбриональных клеточных популяциях, включая эпителий хрусталика, эпикард сердца и области мезенхимы (Maisonpierre, et al., Oncogene, 8, 1631-1637, 1993).
Преобладающая экспрессия TIE-рецептора в сосудистом эндотелии предполагает, что TIE играет роль в развитии и сохранении сосудистой системы. Его участие отмечено в детерминации, пролиферации, дифференцировке эндотельных клеток и клеточной миграции и превращении в сосудистые элементы. Анализ мышиных эмбрионов, характеризующихся недостаточностью в TIE-2, иллюстрирует его важное значение в ангиогенезе, особенно в образовании сосудистой сети в эндотелиальных клетках. В зрелой сосудистой системе TIE могут функционировать в процессах выживания сохранения эндотелиальных клеток и в ответе на патогенные воздействия.
TIE-рецепторы также экспрессируются в незрелых гематопоэтических стволовых клетках, В-клетках и субпопуляции мегакариотических клеток, таким образом предполагая роль лигандов, которые связывают эти рецепторы на ранних стадиях гематопоэза, в дифференцировки мегакариоцитов (Iwama et al., Biochem. Biophys. Res. Communications, 195, 301-309, 1993; Hashiyama et al.,, Blood, 87, 93-101, 1996; Batard et al., Blood, 87, 2212-2220, 1996).
Заявители ранее индетифицировали ангиогенный фактор, который первоначально был назван лиганд-1 TIE-2 (TL1), но также на него ссылаются как ангиопоэтин-1 (Ang1), который передает сигналы через TIE-2-рецептор и является существенным для нормального развития сосудистой системы у мыши. С помощью гомологичного скрининга заявители также идентифицировали Ang1, названный лиганд-2 TIE-2 (TL2), или ангиопоэтин-2 (Ang2), который существует как антагонист Ang1 и TIE-2-рецептора. Для описания клонирования и секвенирования TL1 (Ang1) и TL2 (Ang2), а также для способов их получения и использования здесь дается ссылка на Международную заявку РСТ № WO 96/11269, опубликованную 18 апреля 1996 г., и Международную заявку РСТ № WO 96/31598, опубликованную 10 октября 1996 г., обе в Regeneron Pharmaceuticals, Inc.; и S. Davis et al., Cell, 87, 1161-1169, 1969, каждая из которых здесь представлена ссылкой. Отсутствие Ang1 вызывает серьезные сосудистые нарушения в развивающемся мышином эмбрионе. Ang1 и Ang2 обеспечивают естественно возникающие положительные и отрицательные регуляторы ангиогенеза. Положительная или отрицательная регуляция TIE-2, вероятно, приводит к различным результатам, в зависимости от комбинации одновременно действующих ангиогенных сигналов.
Краткое содержание изобретения
Настоящее изобретение обеспечивает композицию, содержащую TIЕ-лиганд-3 или ТIЕ-лиганд-4, в основном свободную от других белков. Изобретение также обеспечивает выделенную молекулу нуклеиновой кислоты, кодирующую TIE-лиганд-2, и выделенную молекулу нуклеиновой кислоты, кодирующую ТIЕ-лиганд-4. Выделенная нуклеиновая кислота может быть ДНК, кДНК или РНК. Изобретение также обеспечивает вектор, содержащий выделенную молекулу нуклеиновой кислоты, кодирующую TIE-лиганд-3 или ТIЕ-лиганд-4. Далее изобретение представляет систему хозяин-вектор для продукции в соответствующей хозяйской клетке полипептида, обладающего биологической активностью TIE-лиганда-3 или ТIЕ-лиганда-4. Подходящая хозяйская клетка может быть бактериальной, дрожжевой, клеткой насекомого или млекопитающего. Изобретение также раскрывает способ получения полипептида, обладающего биологической активностью TIE-лиганда-3 или TIE-лиганда-4, который включает растущие клетки системы хозяин-вектор в условиях, позволяющих получать полипептиды и выделять их этим способом.
Изобретение, описывающее выделенную молекулу нуклеиновой кислоты, кодирующую TIE-лиганд-3 или TIE-лиганд-4, далее раскрывает конструкцию лиганда, фрагмента или его производного, или другой молекулы, которая является агонистом или антагонистом рецептора в качестве терапевтического средства для лечения больных, страдающих нарушениями, вовлекающими клетки, ткани и органы, которые экспрессируют TIE-рецептор. Настоящее изобретение также обеспечивает антитело, которое специфическим образом связывает подобную терапевтическую молекулу. Антитело может быть моноклональным или поликлональным. Изобретение также раскрывает способ применения подобного моноклонального или поликлонального антитела для определения количества терапевтической молекулы в пробе, взятой от больного с целью контроля курса терапии.
Настоящее изобретение также обеспечивает антитело, которое специфически связывает TIE-лиганд-3 или TIE-лиганд-4. Антитело может быть моноклональным или поликлональным. Таким образом, изобретение раскрывает терапевтические композиции, содержащих антитело, которое специфически связывает TIE-лиганд-3 или ТIЕ-лиганд-4, и фармацевтически приемлемый носитель. Изобретение также раскрывает способ торможения роста кровеносного сосуда у млекопитающего путем введения эффективного количества терапевтической композиции, содержащей антитело, которое специфически связывает TIE-лиганд-3 или ТIЕ-лиганд-4, в фармацевтически приемлемом носителе.
Изобретение далее раскрывает терапевтическую композицию, содержащую TIE-лиганд-3 или ТIЕ-лиганд-4 в фармацевтически приемлемом носителе. Изобретение также раскрывает способ стимулирования неоваскуляризации у больного путем введения эффективного количества терапевтической композиции, содержащей TIE-лиганд-3 или TIE-лиганд-4 в фармацевтически приемлемом носителе. В одном варианте способ можно использовать для стимулирования заживления ран. В другом варианте способ можно использовать для лечения ишемии. В следующем варианте TIE-лиганд-3 или ТТЕ-лиганд-4 используется либо отдельно, либо в комбинации с другими гематопоэтическими факторами для стимуляции пролиферации или дифференцировки гематопоэтических стволовых клеток, В-клеток или мегакариоцитов.
Альтернативно, в изобретении представлено, что TIE-лиганд-3 или ТIЕ-лиганд-4 можно сочетать с цитотоксическим агентом и терапевтической композицией, приготовленной из них. Изобретение далее относится к телу рецептора, которое специфически связывает TIE-лиганд-3 или ТIЕ-лиганд-4. Изобретение далее раскрывает терапевтические композиции, содержащие тело рецептора, которое специфически связывает TIE-лиганд-3 или ТIЕ-лиганд-4 в фармацевтически приемлемом носителе. Изобретение также раскрывает способ торможения роста кровеносного сосуда у млекопитающего путем введения эффективного количества терапевтической композицией, содержащей тело рецептора, которое специфически связывает TIE-лиганд-3 или TIЕ-лиганд-4 в фармацевтически приемлемом носителе.
Изобретение также относится к антагонисту TIE-рецептора, а также способу ингибирования биологической активности TIE-лиганд-3 или ТIЕ-лиганд-4 у млекопитающего, включающему введение млекопитающему эффективного количества антагониста TIE. Согласно изобретению, антагонистом может быть TIE-лиганд-3 или ТIЕ-лиганд-4, как описано здесь, антитело или другая молекула, способная к специфическому связыванию рецептора TIE-лиганд-3 или ТIЕ-лиганд-4, или TIE-рецептора, или тела лиганда, содержащего фибриногеноподобный домен TIE-лиганд-3 или ТIЕ-лиганд-4.
Краткое описание фигур
Фигуры 1А и 1В - тело рецептора TIE-2 (TP TIE-2 тормозит развитие кровеносных сосудов в хориоаллантоидной мембране куриного эмбриона (ХАМ). Один кусочек поглощающей желатиновой пленки (Gelfoam), вымоченный с 6 мкг TP, помещают немедленно под ХАМ 1-дневного куриного эмбриона. После дальнейших 3 дней инкубации 4-дневные эмбрионы и окружающие ХАМ удаляют и изучают. Фигура 1А: эмбрионы, обработанные ЕНК-1-ТР (rЕНК-1 ecto/hIgGl Fc), были жизнеспособны и обладали нормально развитыми кровеносными сосудами в окружающей их ХАМ. Фигура 1В: все эмбрионы, обработанные TIE-2-TP (rTIE-2 ecto/h IgG1 Fc), погибли, уменьшились в размере и были почти полностью лишены окружающих кровеносных сосудов.
Фигура 2 - схематическое представление гипотетической роли TIE-2/TIE-лигандов в ангиогенезе. TL1 отмечен в виде (•), TL2 - в виде (*), TIE-2 - в виде (Т), VEGF - в виде ([]), и fik-1 (VEGF рецептор) - в виде (Y).
Фигура 3 - схематическое представление TIE-2-лигандов, показывающее суперскрученный и фибриногеноподобный домены и конструирование мультимеров фибриногеноподобных доменов с использованием антител против myc в качестве меток, а также мечение Fc.
Фигура 4 - типичная кривая связывания TIE-2IgG с иммобилизованным TL1 в количественном анализе связывания в бесклеточной среде.
Фигура 5 - типичная кривая, показывающая связывание тела-лиганда 1 TIE-2, содержащего фибриногеноподобный домен лиганда, связанного с доменом Fc иммуноглобулина IgG (TLl-fFc), с иммобилизованным TIE-2-эктодоменом в количественном анализе связывания в бесклеточной среде.
Фигура 6А-6В - нуклеотидные и соответствующие им аминокислотные (однобуквенный код) последовательности ТIЕ-лиганда-3. Кодирующие последовательности начинаются с положения 47. Фибриногеноподобный домен начинается с положения 929.
Фигура 7 - сравнение аминокислотных последовательностей семейства лигандов TIE. mAng3=mTL3=мышиный TIE-лиганд-3; hAng4=hTL4=человеческий ТIЕ-лиганд-4; hAngl=hTLl=человеческий TIE-2-лиганд 1; mAngl=mTLl=мышиный TIE-2-лиганд 1; mAng2=mTL2=мышиный TIE-2-лиганд; hAng2=mTL2=человеческий TIE-2-лиганд 2. Подчеркнутые области указывают консервативные участки гомологии среди членов семейства.
Фигура 8Ф-8С - нуклеотидные и соответствующие им аминокислотные (однобуквенный код) последовательности TIE-лиганда-4. Стрелка указывает положение нуклеотида 569.
Фигура 9 - BIAcore-анализ для оценки связывания ангиопоэтина-4 с TIE1- и TIE2-рецепторами. Анализы связывания с BIAcore указанных ангиопоэтинов или химерных ангиопоэтинов, включая ангиопоэтин-4 или Ang4Chim, с BIAcore-чипами, покрытыми иммобилизованными TIE1- и ТIЕ2-рецепторами, осуществляли при наличии конкуренции с избыточными количествами либо нерелевантного растворимого рецептора (TrkB), либо растворимых TIE1- или ТIЕ2-рецепторов.
Фигура 10 - Активация ТIЕ2-рецептора с помощью Ang4Chim. Три клеточных линии (EAhy926, bEND и MG 3Т3) подвергали воздействию Ang4Chim, и определяли фосфорилирование TIE2.
Подробное изложение сущности изобретения
Как в деталях ниже описано, заявители выделили и идентифицировали новые лиганды, родственные TIE-2-лигандам, которые связывают TIE-2-рецептор. Новые лиганды, которые могут быть очищены из природного материала или сделаны рекомбинантным способом, называются здесь TIE-лиганд-3 (TL3) и TIE-лиганд-4 (TL4). Другие члены семейства TIE-лиганда называются здесь TIE-лиганд I (TL1), также известный как ангиопоэтин-1 (Ang1) и TIE-2-лиганд 2 (TL2), также известный как ангиопоэтин-2 (Ang2). 3аявители здесь описывают семейство TIE-лигандов и идентифицируют консервативные области гомологии среди членов семейства. Новые лиганды TL3 и TL4 должны быть проверены, чтобы определить, имеют ли они функции и применение, подобные тем, которые имеют известные лиганды TLI (Ang1) и TL2 (Ang2) в ангиогенезе и гематопоэзе.
Настоящее изобретение включает новые лиганды и их аминокислотные последовательности, а также их функционально эквивалентные варианты, содержащие природно встречающиеся аллельные вариации, а также белки или пептиды, содержащие заместители, делении или включенные мутаций описанных последовательностей, которые связывают TIE-рецептор и действуют как их агонисты или антагонисты. Подобные варианты включают такие, в которых аминокислотные остатки замещены на остатки в последовательности, приводящие к незаметному изменению. Например, один или более аминокислотных остатков в последовательности может быть заменен другой аминокислотой (аминокислотами) подобной полярности, который действует как функциональный эквивалент, приводящий к незаметному изменению. 3аместители аминокислоты в последовательности могут быть выбраны из других членов группы, к которой принадлежит аминокислота. Например, группа неполярных (гидрофобных) аминокислот включает аланин, лейцин, изолейцин, валин, пролин, фенилаланин, тоиптофан и метионин, Полярные нейтральные аминокислоты включают глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин. Положительно заряженные (основные) аминокислоты включают аргинии, лизин и гистидин. Отрицательно заряженные (кислые) аминокислоты включают аспарагиновую и глутаминовую кислоты.
Также включены в сферу изобретения белки или их фрагменты или их производные, которые проявляют такую же биологическую активность, что и TIE-лиганд-3 или TIE-лиганд-4, описанные здесь, и производные, которые по-разному модифицированы в прогрессе трансляции или после нее, протеолитического расщепления, связывания с молекулой антитела или другим клеточным лигандом и т.д. Функционально эквивалентные молекулы также включают молекулы, которые содержат модификации, включающие N-концевые модификации, являющиеся результатом экспрессии в отдельном рекомбинантном хозяине, такие, например, как N-концевое метилирование, которое имеет место в определенных бактериальных (например, Е.Coli) экспрессирующих системах. Функциональные эквиваленты также включают мутанты, в которых заменяемой аминокислотой является цистеин, чтобы повысить стабильность молекул и предотвратить образование нежелательных поперечных связей.
Настоящее изобретение также включает нуклеотидную последовательность, которая кодирует белок, описанный здесь как TIE-лиганд-3, нуклеотидную последовательность, которая кодирует белок, описанный здесь как ТIЕ-лиганд-4, а также хозяйские клетки, включающие дрожжевые, бактериальные, вирусные клетки и клетки млекопитающих, которых с помощью генно-инженерного способа продуцируют белок путем трансфекции, трансдукции, заражения, электропорации или микроинъекции нуклеиновой кислоты, кодирующей TIE-лиганд-3 или ТIЕ-лиганд-4, описанные здесь, в подходящий зкспрессирующий вектор. Настоящее изобретение также включает введение нуклеиновой кислоты, кодирующей TIE-лиганд-3 или ТIЕ-лиганд-4, методами генной терапии, как описано, например в публикации Finkel and Epstein FASEB J., 9, 843-851, 1995; Guzman et al., PNAS, USA, 91, 10732-10736, 1994.
Специалистам данной области должно быть понятно, что настоящее изобретение включает последовательности ДНК и РНК, которые гибридизуются с соответствующей полученной последовательностью, кодирующей TIE-лиганд-3 или TIE-лиганд-4 с умеренной точностью, как описано, например у Sambrook et al., Molecular Cloning: A Laboratory Manual, 2 ed. Vol. 1, pp. 101-104, Cold Spring Harbor Laboratory Press, 1989. Таким образом, молекула нуклеиновой кислоты согласно изобретению включает одну последовательность, полученную из аминокислотной последовательности, кодирующей TIE-лиганд-3 или ТIЕ-лиганд-4, полученной, как описано здесь, а также молекулу с последовательностью нуклеиновых кислот, которая гибридизуется с подобной последовательностью нуклеиновой кислоты, а также последовательность нуклеиновой кислоты, которая производится из вышеуказанных последовательностей с применением генетического кода, но которая кодирует лиганд, связывающий TIE-рецептор и имеющий аминокислотную последовательность и другие первичные, вторичные и третичные характеристики, которые достаточно воспроизводят лиганд, описанный здесь, таким образом, чтобы придать молекуле такую же биологическую активность, какую имеют TIE-лиганд-3 или ТIЕ-лиганд-4, описанные здесь.
Таким образом, настоящее изобретение включает выделенную и очищенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую TIE-лиганд-3 млекопитающих, где нуклеотидная последовательность выбирается из группы, состоящей из:
a) нуклеотидной последовательности, содержащей кодирующую область TIE-лиганд-3 млекопитающих, как показано на фиг.6А-6В;
b) нуклеотидной последовательности, содержащей кодирующую область фибриногеноподобного домена TIE-лиганда-3, как показано на фиг.6А-6В;
c) нуклеотидной последовательности, которая умеренно строго гибридизуется с нуклеотидной последовательостью (а) или (b) и которая кодирует лиганд, связывающий TIE-рецептор;
и
d) нуклеотидной последовательности, которая, если бы не вырожденность генетического кода, должна гибридизоваться с) нуклеотидной последовательностью (а), (b) или (с) и которая кодирует лиганд, связывающий TIE-рецептор.
Далее настоящее изобретение включает выделенный и очищенный TIE-лиганда-3, кодируем выделенной молекулой нуклеиновой кислоты согласно изобретению. Изобретение также раскрывает вектор, который включает выделенную молекулу нуклеиновой кислоты, содержащую последовательность, кодирующую TIE-лиганда-3 млекопитающих.
Настоящее изобретение также включает выделенную и очищенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую человеческий ТIЕ-лиганда-4, где нуклеотидная последовательность выбирается из группы, состоящей из:
(а) нуклеотидной последовательности, содержащей кодирующую область человеческого ТIЕ-лиганда-4, включенную в вектор и обозначенную как hTL-4, депонированной 2 июля 1996 (АТСС Accession № 98095);
(b) нуклеотидной последовательности, содержащей кодирующую область фибриногеноподобного домена ТIЕ-лиганда-4, включенную в вектор и обозначенную как hTL-4, депонированной 2 июля 1996 (АТСС Accession № 98095);
(c) нуклеотидной последовательности, которая гибридизуется при умеренно строгих условиях до нуклеотидной последовательности (а) или (b) и которая кодирует лиганд, связывающий TIE-рецептор; и
(d) нуклеотидной последовательности, которая, если бы не вырожденность генетического кода, должна гибридизоваться с нуклеотидной последовательностью (а), (b) или (с), которая кодирует лиганд, связывающий TIE-рецептор.
Далее настоящее изобретение включает выделенную и очищенную молекулу нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую человеческий ТIЕ-лиганд-4, где нуклеотидная последовательность выбирается из группы, состоящей из:
(a) нуклеотидной последовательности, содержащей кодирующую область человеческого ТIЕ-лиганда-4, как показано на фиг.8А-8С;
(b) нуклеотидной последовательности, содержащей кодирующую область фибриногеноподобного домена ТIЕ-лиганда-4, человека, как показано на фиг.8А-8С;
(c) нуклеотидной последовательности, которая гибридизуется в умеренно строгих условиях с нуклеотидной последовательностью (а) или (b) и которая кодирует лиганд, связывающий TIE-рецептор; и
(d) нуклеотидной последовательности, которая, в результате вырождения генетического кода, отличается от нуклеотидной последовательности (а), (b) или (с), которая кодирует TIE-2-лиганд, связывающий TIE-рецептор.
Далее настоящее изобретение обеспечивает выделенный и очищенный ТIЕ-лиганд-4, кодируем выделенной молекулой нуклеиновой кислоты согласно изобретению. Изобретение также относится к вектору, который включает выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую ТIЕ-лиганд-4 человека.
Любой из известных специалистам в данной области методов введения ДНК-фрагментов в вектор может быть использован для конструирования экспрессирующих векторов, кодирующих TIE-лиганд-3 или ТIЕ-лиганд-4, с применением соответствующих контрольных сигналов транскрипции/трансляции и кодирующих белок последовательностей. Эти методы могут включать рекомбинантную ДНК и способы синтеза и рекомбинации in vivo (генетические рекомбинации). Экспрессия нуклеотидной последовательности, кодирующей TIE-лиганд-3 или ТIЕ-лиганд-4 или их пептидные фрагменты, может регулироваться с помощью второй нуклеотидной последовательности, которая связана с последовательностью, кодирующей TIE-лиганд-3 или TIE-лиганд-4, такую, что белок или пептид TIE-лиганда-3 или TIE-лиганда-4 экспрессируется в клетках хозяина, трансформированных рекомбинантной молекулой ДНК. Например, экспрессия TIE-лиганда-3 или ТIЕ-лиганда-4, описанная здесь, может контролироваться любым элементом промотор/усилитель, известным в данной области. Промоторы, которые могут быть использованы для контроля экспрессии лиганда, включают в качестве неограничивающего примера длинный концевой повтор, как описано в публикации Squinto et al., Cell, 65, 1-20, 1991; раннюю промоторную область SV40 (Bernoist and Chambon, Nature, 290, 304-310), CMV-промотор, 5'-концевой повтор М-MulV, дромотор, заключенный в длинном 3'-концевом повторе вируса саркомы Рауса (Yamamoto et al., Cell, 22, 787-797, 1980) промотор тимидин киназы герпеса (Wagner et al., Proc. Natl. Acad, Sci. U.S.A., 78, 144-145, 1981), промотор аденовируса, регуляторные последовательности металлотионоинового гена (Brinster et al., Nature, 296, 39-42, 1982), экспрессирующие векторы прокариот, такие как промотор β-лактамазы (Villa-Kamaroff et al., Proc. Natl. Acad, Sci. U.S.A., 75, 3727-3731, 1978), или tac-промотор (DeBoer et al., Proc. Natl. Acad, Sci. U.S.A., 80, 21-25, 1983), см. также “Полезные белки из рекомбинантных бактерий” в Scientific American, 242, 74-94, 1980; промоторные элементы из дрожжей или других грибов, такие как Gal 4-промотор, промотор ADH (алкогольдегидрогеназа), промотор PGK (фосфоглициринкиназа), промотор щелочной фосфатазы и следующие транскрипционные контрольные области животных, которые проявляют тканевую специфичность и используются в трансгенных животных; контрольная область гена эластазы I, которая активна в панкреатических ацинарных клетках (Swift et al., Cell, 38, 639-646, 1984; Ornitz et al., Cold Spring Harbor Symp. Quant. Biol., 50, 399-409, 1986; MacDonald, Hepatology, 7, 425-515, 1987); контрольная область гена инсулина, которая активна в панкреатических бета-клетках (Hanahan, Nature, 315, 115-122, 1985); контрольная область гена иммуноглобулина, которая активна в лимфоидных клетках (Grosscheld et al., Cell, 38, 647-658, 1984; Adames et al., Nature, 318, 533-538, 1985; Alexander et al., Mol. Cell. Biol., 7, 1436-1444, 1987); контрольная область вируса опухоли молочной железы мыши, которая активна в тестикулярных клетках, клетках молочной железы, лимфоидных и тучных клетках (Leder et al.. Cell, 45, 485-495, 1986); контрольная область гена альбумина, который активен в печени (Pinkert et al., Genes and Devel, 1, 268-276, 1987), контрольная область гена альфа-фетопротеина, который активен в печени (Krumlauf et al., Mol. Cell. Biol., 5, 1639-1648, 1985; Hammer et al., Science, 235, 53-58, 1987); контрольная область гена альфа 1-антитрипсина, которая активна в печени (Kelsey et al., Genes and DeveL, 1, 161-171, 1987), контрольная область гена бета-глобина, которая активна в миелоидных клетках (Mogram et al., Nature, 315, 338-340, 1985; Kollias et al., Cell, 46, 89-94, 1986); контрольная область гена миелинового основного белка, которая активна в олигодендроцитах в мозге (Readhead et al., Cell, 48, 703-712, 1987); контрольная область гена легкой цепи-2 миозина, которая активна в скелетных мышцах (Shani, Nature, 314, 283-286, 1985), и контрольная область гонадотропного рилизинг гормона, которая активна в гипоталамусе (Mason et al., Science, 234, 1372-1378, 1986). Далее изобретение включает получение соединений антисенсов, которые проявляют способность специфически гибридизоваться с последовательностью РНК, кодирующей TIE-лиганд-3 или TIE-лиганд-4, для модуляции его экспрессии (Ecker, U.S. Патент № 5,166,195, вышедший 24 ноября 1992 г.).
Таким образом, согласно изобретению экспрессирующие векторы, способные к репликации в бактериальном или эукариотическом хозяине, содержащие нуклеиновую кислоту, кодирующую TIE-лиганд-3 или ТIЕ-лиганд-4, описанные здесь, используются для того, чтобы трансформировать клетки хозяина, которые будут прямо экспрессировать такую нуклеиновую кислоту для продукции TIE-лиганд-3 или TIE-лиганд-4, который затем может быть превращен в биологически активную форму. Как подрузамевается здесь, биологически активная форма включает форму, способную связывать TIE-рецептор и вызывать биологический эффект, такой как функция дифференцировки, или влиять на фенотип клетки, экспрессирующей рецептор. Подобные биологически активные формы могут, например, вызывать фосфорилирование тирозинкиказного домена TIE-рецептора. Иначе, биологическая активность лигана может проявляться через действие лиганда как антагониста к TIE-рецептору. В альтернативных вариантах активная форма TIE-лиганд-3 или TIЕ-лиганд-4 является формой, которая может распознавать TIE-рецептор и тем самым действовать как мишень для рецептора, что используется как в диагностике, так и в терапии. В соответствии с подобными вариантами, активная форма не принуждает любую экспрессирующую ТIЕ-клетку осуществлять любые изменения в фенотипе.
Экспрессирующие векторы, содержащие генные вставки, могут быть идентифицированы с помощью 4 основных способов:
(а) ДНК-ДНК гибридизации; (b) наличие или отсутствия “маркера” генных функций; (с) экспрессии вставленных последовательностей и (d) выявления методом ПЦР. В первом способе присутствие чужеродного гена, вставленного в экспрессирующий вектор, может быть обнаружено с помощью ДНК-ДНК-гибридизации с использованием проб, содержащих последовательности, гомологичные вставленному гену, кодирующему TIE-лиганд-3 или ТIЕ-лиганд-4. Во втором способе рекомбинантный вектор в системе хозяина может быть идентифицирован и отобран на основании наличия или отсутствия определенных функций “маркерных” генов (например, тимидинкиназная активность, устойчивость к антибиотикам, трансформация фенотипа, нарушение телообразования в бакуловирусе и т.д), вызванных введением чужеродных генов в вектор. Например, если нуклеиновую кислоту, кодирующую TIE-лиганд-3 или ТIЕ-лиганд-4, вставить в маркерную генную последовательность вектора, то содержащие вставку рекомбинанты могут быть идентифицированы с помощью отсутствия маркерной генной функции. В третьем способе рекомбинантные экспрессирующие векторы могут быть идентифицированы при анализировании чужеродного генного продукта, экспрессированного рекомбинантом. Подобные анализы могут быть основаны, например, на физических или функциональных свойствах генного продукта TIE-лиганд-3 или ТIЕ-лиганд-4, например, на связывании лиганда с TIE-рецептором или его частью, причем рецептор может быть помечен, например, определяемым антителом или частью его, или с помощью связывания с антителами, полученными против белка TIE-лиганд-3 или ТIЕ-лиганд-4 или против его части. Клетки настоящего изобретения могут или транзитно, или, предпочтительно конститутивно или постоянно экспресировать описанные здесь TIE-лиганд-3 или ТIЕ-лиганд-4. В четвертом способе ДНК-нуклеотидные праймеры могут быть получены соответственно tie-специфической ДНК-последовательности. Эти праймеры можно затем использовать для ПЦР фрагмента гена tie (PCR Protocols: A Guide To Methoda and Applications, Edited by Michael A. Innis et al., Academic Press, 1990).
Рекомбинантный лиганд может быть очищен способом, который позволяет в дальнейшем образовать стабильный биологический активный белок. Предпочтительно, чтобы лиганд секретировал в культурную среду, из которой его можно выделить. И наоборот, лиганд может быть выделен из клеток либо в виде растворимых белков, либо в виде тел включения, из которых он может быть экстрагирован количественно с помощью 8 М гуанидингидрохлорида и диализован в соответствии с хорошо известным методом. Для дальнейшей очистки лиганда можно использовать аффинную хроматографию, подходящую ионообменную хроматографию, хроматографию, основанную на гидрофобном взаимодействии, хроматографию с обращенной фазой или гель-фильтрацию.
В дополнительных вариантах изобретения, как более детально описано в таймерах, рекомбинантный ген, кодирующий TIE-лиганд-3 или ТIЕ-лиганд-4, может быть использован для инактивации эндогенного гена путем гомологичной рекомбинации и тем самым создания клетки, ткани или животного, лишенного кодирующий TIE-лиганд-3 или ТIЕ-лиганд-4. В качестве неограничивающего область изобретения примера рекомбинантный ген, кодирующий кодирующий TIE-лиганд-3 или ТIЕ-лиганд-4, может быть получен генно-инженерной техникой так, чтобы он содержит вставленную мутацию, например, nео-ген, который будет инактивировать нативный ген, кодирующий кодирующий TIE-лиганд-3 или ТIЕ-лиганд-4. Подобная конструкция под контролем подходящего промотора может быть введена в клетку, в такую как эмбриональная стволовая клетка, с помощью способа, такого как трансфекция, трансдукция или инъекция. Содержащие конструкцию клетки могут быть затем отобраны на основании устойчивости G 418. Клетки, у которых отсутствует интактный ген, кодирующий кодирующий TIE-лиганд-3 или TIE-лиганд-4, можно идентифицировать, например, с помощью саузерн-блоттинга, ПЦР, нозерн-блоттинга или анализа экспрессии. Клетки, у которых отсутствует интактный ген, кодирующий TIE-лиганд-3 или ТIЕ-лиганд-4, можно слить с клетками эмбриона на ранней стадии развития, чтобы получить трансгенные животные, у которых отсутствует подобный лиганд. Подобное животное можно использовать для того, чтобы контролировать специфические in vivo процессы, связанные с лигандом.
Настоящее изобретение также обеспечивает антитела к TIE-лиганду-3 или ТIЕ-лиганду-4, описанному здесь, которые используют для определения лиганда, например, в диагностических целях. Для получения моноклональных антител против TIE-лиганда-3 или ТIЕ-лиганда-4 можно использовать любой технический прием, который обеспечивает продукцию молекул антител с помощью клеточных штаммов в культуре. В сфере настоящего изобретения находятся, например, гибридомная техника, первоначально разработанная Kohler and Milstein (Nature, 256, 495-497, 1975), а также триомная техника, гибридомная техника с человеческой В-клеткой (Kozbor et al., Immunology Today, 4, 72, 1983) и EBV-гибридомная техника для продукции человеческих моноклональных антител (Cole et al., in “Monoclonal Antibodies and Cancer Therapy”. Alan R. Inc. Pp. 77-96, 1985).
Моноклональные антитела могут включать человеческие моноклональные антитела или химерные человеческие-мышиные (или другие виды) моноклональные антитела. Человеческие моноклональные антитела могут быть получены с помощью любого из многочисленных технических приемов, известных в данной области (например, Teng et al., Proc. Natl. Acad. Sci. U.S.A., 80, 7308-7312, 1983; Kozbor et al., Immunology Today, 4, 72, 1983; Olsson et al., Meth. Enzymol., 92, 3-16, 1982). Полученные химерные молекулы антител могут содержать мышиный антиген-связывающий домен с человеческими константными областями (Morrison et al., Proc. Natl. Acad.. Sci. U.S.A., 81, 6851, 1984; Takeda et al., Nature, 314, 452, 1985).
Для получения поликлональных антител; к эпитопам TIE-лиганда-3 или TIE-лиганда-4, описанного здесь, могут быть использованы различные процедуры, известные в данной области. Для получения антител различных животных-хозяев, включая в качестве неограничивающего область, изобретения; примера кроликов, мышей и крыс, можно иммунизировать путем введения TIE-лиганда-3 или TIE-лиганда-4 или его фрагмента и производимого. Используются различные адъюванты для усиления иммунного ответа, зависящего от вида хозяина, которые включают в качестве неограничивающего примера адъювант Фрейнда (полный или неполный), минеральные гели, такие как гидроокись алюминия, поверхностно-активные вещества, такие как лизолецитин, плуроновые полиолы, полианионы, пептиды, масляные эмульсии, узкоспецифические гемоцианины [вызывают узкоспецифическую иммунную реакцию], динитрофенолы и применимые человеческие адъюванты, такие как BCG (Bacille Calmette-Guerin) и Corynebacterium parvum.
Молекулярный клон антитела к отобранному эпитопу TIE-лиганда-3 или TIE-лиганда-4 может быть получен с помощью известных технических приемов. Методологию рекомбинантных ДНК (Maniatis et al., Molecular Cloning, A Laboratory Mainuai, Cold Spring Harbor, New York) можно использовать для конструирования последовательностей нуклеиновой кислоты, которые кодируют молекулу моноклонального антитела или его антиген-связывающую область.
Настоящее изобретение относится к молекулам антител, а также к фрагментам подобных молекул антител. Фрагменты антител, которые содержат идиотип молекулы, могут быть произведены с помощью известных технических приемов. Например, подобные фрагменты в качестве неограничивающего примера включают Е(аb’)2-фрагмент, который можно получить путем расщепления молекулы антитела пепсином; Fab'-фрагменты, которые можно получить посредством восстановления дисульфидных мостиков F(ab')2-фрагмента, и Fab-фрагмент, которые можно получить путем обработки молекулы антитела папаином и восстанавливающим агентом. Молекулы антитела можно очистить с помощью известных технических приемов, например, иммуноабсорбции или иммунной аффинной хроматографии, хроматографических методов, таких как ВЭЖХ (высокоэффективная жидкостная хроматография), или комбинации этих методов.
Настоящее изобретение далее включает иммунный анализ для оценки количества TIE-лиганда-3 или TIE-лиганда-4 в биологическом образце на основании
a) контактирования биологического образца, по меньшей мере, с одним антителом, которое специфически связывает TIE-лиганд-3 или TIE-лиганд-4 так, что антитело образует комплекс с любым из этих лигандов, присутствующим в образце; и
b) измерения количества комплекса и тем самым измерения количества TIE-лиганда-3 или TIE-лиганда-4 в биологическом образце.
Настоящее изобретение включает далее способ измерения количества TIE-рецептора в биологическом образце на основании
а) контактирования биологического образца, по меньшей мере, с одним лигандом согласно изобретению так, что лиганд образует комплекс с TIE-рецептором; и
b) измерения количества комплекса и тем самым измерения количества TIE-рецептора в биологическом образце.
Настоящее изобретение также раскрывает применение TIE-лиганда-3 или TIE-лиганда-4 для поддержания выживания, и/или роста, и/или миграции, и/или дифференцировки клеток, экспрессирующих TIE-рецептор. Таким образом, лиганд может быть использован как добавка для поддержания, например, эндотелиальных клеток в культуре.
Далее обнаружение заявителями дополнительных лигандов для TIE-рецептора способствует утилизации систем, используемых для идентификации агонистов или антагонистов TIE-рецептора. Подобные системы могут быть полезны в идентификации молекул, способных стимулировать или тормозить ангиогенез. Например, в одном варианте антагонисты TIE-рецептора можно идентифицировать как молекулы-тесты, которые способны препятствовать взаимодействию TIE-рецептора с биологически активным ТIE-лигандом-3 или TIE-лигандом-4. Подобные антагонисты идентифицируются по способности 1) блокировать связывание биологически активного TIE-лиганда-3 или TIE-лиганда-4 с рецептором, как было проверено, например, с помощью BIAcore биосенсорной техники (BIAcore; Pharmacia Biosensor, Piscataway, NJ); или 2) блокировать способность биологически активного TIE-лиганда-3 или TIE-лиганда-4 вызывать биологический ответ. Подобные биологические ответы включают в качестве неограничивающего примера фосфорилирование TIE-рецептора или его компонентов с прямой последовательностью (считывание в прямом направлении от 5'к 3') пути передачи сигнала, или выживание, рост или дифференцировку клеток, несущих TIE-рецептор.
В одном варианте рост клеток, полученных генно-инженерной техникой для экспрессии TIE-рецептора, может зависить от добавления TIE-лиганда-3 или TIE-лиганда-4. Подобные клетки представляют собой полезные системы для идентификации дополнительных агонистов TIE-рецептора или антагонистов, способных препятствовать проявлению активности TIE-лиганда-3 или TIE-лиганда-4 на подобных клетках. Альтернативно аутокринные клетки, созданные генно-инженерной техникой для осуществления коэкспрессии TIE-лиганда-3 и рецептора, или TIE-лиганда-4 и рецептора, представляют собой полезные системы для анализа потенциальных агонистов или антагонистов.
Следовательно, настоящее изобретение раскрывает способ введения TIE-рецептора в клетки, которые обычно не экспрессируют этот рецептор, таким образом позволяя этим клеткам проявлять глубокие и легко различимые ответы на лиганд, который связывает этот рецептор. Тип вызванного ответа зависит от используемых клеток, а не от специфического рецептора, введенного в клетку. Можно выбрать соответствующие клеточные линии, чтобы получить самый выгодный ответ для анализа, а также для обнаружения молекул, которые могут действовать на тирозинкиназные рецепторы. Молекулы могут быть любого типа, включая в качестве неограничивающего примера пептидные и непептидные молекулы, которые могут действовать в описываемых системах по специфическому для рецепторов способу.
Одна из более полезных разрабатываемых систем включает введение TIE-рецептора (или химерного рецептора, содержащего внеклеточный домен другой рецепторной тирозинкиназы, такой, например, как trkC, и внутриклеточный домен TIE-рецептора) в линию фибробластов (например, NIH3T3 клетки), таким образом, подобный рецептор, который в норме не опосредует пролиферативные или другие ответы, можно после введения в фибробласты анализировать разнообразными хорошо установленными способами количественной оценки влияния факторов роста фибробластов (например, включение тимидина или другие способы оценки пролиферации (см. Van Zoelen, 1990, “Использование биологического анализа для определения полипептидных факторов роста” in Progress Factor Research, vol. 2, pp. 131-152; Zhan and M.Goldfarb, Mol. Cell. Biol., vol. 6, pp. 3541-3544, 1986). Эти анализы имеют дополнительное преимущество в том, что любой препарат можно проанализировать на линии клеток с введенным рецептором, а также на линии родительских клеток без рецептора; только специфические эффекты на линии клеток с рецептором должно быть оценены, как опосредованные введенным рецептором. Подобные клетки могут быть в дальнейшем созданы генно-инженерной техникой, чтобы экспрессировать TIE-лиганд-3 или TIE-лиганд-4, таким образом создавая аутокринную систему, используемую для анализа молекул, которые действуют как антагонисты/агонисты этого взаимодействия. Таким образом, настоящее изобретение обеспечивает клетки хозяина, содержащие нуклеиновую кислоту, кодирующую TIE-лиганд-3 или TIE-лиганд-4 и нуклеиновую кислоту, кодирующую TIE-рецептор.
Взаимодействие TIE-рецептора с TIE-лигандом-3 или TIE-лиганданом-4 также представляет полезную систему для идентификации малых молекул агонистов или антагонистов TIE-рецептора. Например, фрагменты, мутанты или производные TIE-лиганда-3 или TIE-лиганда-4 можно идентифицировать, когда они связывают TIE-рецептор, но не вызывают любой другой биологической активности. Кроме того характеристика TIE-лиганда-3 или TIE-лиганда-4 способствует определению активных частей молекулы. Далее идентификация лиганда способствует определению кристаллической структуры комплекса рецептор/лиганд с помощью рентгеноструктурного анализа, таким образом способствуя идентификации связывающего участка на рецепторе. 3нание связывающего участка даст представление о рациональной конструкции новых агонистов и антагонистов.
Специфическое связывание испытуемой молекулы с TIE-рецептором можно оценить разными способами. Например, истинное связывание испытуемой молекулы с клетками, экспрессирующими TIE, можно определить или измерить с помощью определения или измерения (i) испытуемой молекулы, связанной с поверхностью интактных клеток; (ii) испытуемой молекулы, связанной поперечными связями с TIE-белком в клеточных лизатах; или (iii) испытуемой молекулы, связанной с TIE in vitro. Специфическое взаимодействие между испытуемой молекулой и TIE можно оценить посредством использования реагентов, которые выявляют уникальные свойства этого взаимодействия.
В качестве специфического неограничивающего область изобретения примера способы изобретения можно использовать следующим образом. Рассмотрим случай, когда в образце нужно измерить TIE-лиганд-3 или TIE-лиганд-4. Образец в разной степени разведения (испытуемая молекула) параллельно с отрицательным контролем (NC), не содержащим активность TIE-лиганда-3 или TIE-лиганда-4, и положительным контролем (PC), содержащим известное количество TIE-лиганда-3 или TIE-лиганда-4, можно нанести на клетки, которые экспрессируют TIE в присутствии меченого активность TIE-лиганда-3 или TIE-лиганда-4 (в этом примере, радиоиодированный лиганд). Количество TIE-лиганда-3 или TIE-лиганда-4 в испытуемом образце можно оценить путем определения количества 125I-меченого TIE-лиганда-3 или 125I-меченого TIE-лиганда-4, который связывается с контролем и в каждом из разведений и затем путем сравнения величин в образце со стандартной кривой. Чем больше TIE-лиганда-3 или TIE-лиганда-4 в образце, тем меньше 125I-меченого лиганда, который будет связываться с TIE.
Количество 125I-меченого связанного лиганда можно определить путем измерения количества радиоактивности на клетку или с помощью поперечного связывания TIE-лиганда-3 или TIE-лиганда-4 с поверхностными белками клетки, используя DSS, как описано (Meakin and Shooter, Neuron, 6, 153-163, 1991), и путем определения количества меченого белка в клеточных экстрактах, используя, например, электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS), который может обнаружить меченый белок, имеющий размер, соответствующий комплексам TIE-рецептор/TIE-лиганд-3 или TIE-рецептор/TIE-лиганд-4. Специфическое взаимодействие испытуемой молекулы с TIE далее можно тестировать с помощью добавления к системы различных разведений немеченного контрольного лиганда, который не связывает TIE-рецептор и поэтому не должен оказывать существенного действия на конкуренцию между меченым TIE-лигандом-3 или TIE-лигандом-4 и испытуемой молекулой за связывание с TIE. Кроме того, можно ожидать, что молекула, способная нарушить связывание ТТЕ-рецептора с TIE-лигандом-3 или TIE-лиганд-4, такая как, в качестве неограничивающего примера, анти- TIE-антитело или тело рецептора тело TIE, как описано здесь, нарушает конкуренцию между 125I-меченым TIE-лигандом-3 или 125I-меченым TIE-лигандом-4 и испытуемой молекулой за связывание с TIE-рецептором.
Меченый TIE-лиганд-3 или TIE-лиганд-4 включает, в качестве неограничивающего примера, TIE-лиганд-3 или TIE-лиганд-4, ковалентно или нековалентно связанный с радиоажтивным веществом, флуоресцентным веществом, веществом с ферментативной активностью, веществом, которое может служить в качестве субстрата для фермента (являются предпочтительными ферменты и субстраты, реакция между которыми контролируется колориметрически) или веществом, которое может быть обнаружено с помощью молекулы антитела, которая предпочтительно является меченой.
Кроме того, специфическое связывание испытуемой молекулы с TIE можно оценить на основании вторичных биологических эффектов связывания TIE-лиганда-3 или TIE-лиганда-4 с TIE-рецептором, включая в качестве неограничивающего примера клеточный рост и/или дифференцировку или непосредственную экспрессию раннего гена или фосфорилирование TIE. Например, способность испытуемой молекулы вызывать дифференцировку можно тестировать в клетках, у которых отсутствует tie, и в сравнительных клетках, которые экспрессируют tie; дифференцировка в tie-экспрессирующих клетках, но не в сравнительных клетках, где отсутствует tie, должна указывать на специфическое взаимодействие испытуемой молекулы с TIE. Подобный анализ может быть выполнен с помощью определения непосредственной индукции раннего гена (например, fos и jun) в tie-минус и tie-плюс клетках или путем определения фосфорилирования TIE с использованием стандартного анализа фосфорилирования, известного в данной области. Подобный анализ может быть полезным в идентификации агонистов или антагонистов, которые неконкурентно связываются с TIE.
Подобным образом, настоящее изобретение раскрывает способ идентификации молекулы, которая имеет биологическую активность TIE-лиганда-3 или TIE-лиганда-4, включающий (i) выдерживание клетки, экспрессирующей tie, с испытуемой молекулой; (ii) определение специфического связывания испытуемой молекулы с TIE-рецептором, при котором специфическое связывание с TIE положительно коррелирует с TIE-подобной активностью. Специфическое связывание можно определить либо с помощью анализа прямого связывания, или с помощью вторичных биологических эффектов связывания, как обсуждалось выше. Подобный способ может быть особенно полезным в идентификации новых членов семейства TIE-лиганда или в фармацевтической промышленности, в скрининге большой массы пептидных и непептидных молекул (например, пептидомиметиков) на биологическую активность, связанную с TIE. В предпочтительном специфическом неограничивающем варианте изобретения можно приготовить многолуночный планшет с культурами клеток, содержащий в чередующихся рядах PC12 (или фибробласты, см. Infra) клетки, которые являются либо tie-минус или получены генно-инженерной техникой, чтобы быть tie-плюс. Разнообразные испытуемые молекулы можно затем добавлять так, что каждая колонка планшета или его часть содержит различные испытуемые молекулы. В каждой лунке может быть затем проведен тест на наличие или отсутствие роста и/или дифференцировки. Этим способом можно проверить крайне большое число испытуемых молекул на подобную активность.
В дополнительных вариантах изобретение раскрывает способы определения или измерения TIE-лигандоподобной активности или идентификации молекулы, имеющей подобную активность, включающий (i) выдерживание испытуемой молекулы с TIE-рецепторным белком in vitro при условиях, допускающих связывание и (ii) определение связывания испытуемой молекулы с TIE-рецепторным белком, при котором связывание испытуемой молекулы с TIE-рецептором коррелирует с TIE-лигандоподобной активностью. Согласно подобным способам, TIE-рецептор может быть значительно очищен или неочищен, может быть присоединен к твердой подложке (например, аффинная колонка или метод ELISA) или может быть включен в искусственную мембрану. Связывание испытуемой молекулы с TIE-рецептором можно оценить с помощью любого способа, известного в данной области. В предпочтительных вариантах связывание испытуемой молекулы можно определить или измерить посредством оценки ее способности конкурировать с меченым известным TIE-лигандом за связывание с TIE-рецептором.
Настоящее изобретение также раскрывает способ определения способности испытуемой молекулы функционировать как антагонисты TIE-лигандоподобной активности, включающий определение способности молекулы тормозить действие связывания TIE-лиганда с TIE-рецептором на клетке, которая экспрессирует рецептор. Подобный антагонист может или не может препятствовать связыванию TIE-рецептора с TIE-лигандом-3 или TIE-лигандом-4. Следствием связывания TIE-лиганда-3 или TIE~лиганда-4 с TIE-рецептором являются биологические и биохимические эффекты, включая в качестве неограничивающего примера клеточное выживание или пролиферацию, клеточную трансформацию, прямую индукцию раннего гена или TIE-фосфорилирование.
Далее настоящее изобретение раскрывает способ идентификации антител или других молекул, способных нейтрализовать лиганд или блокировать связывание с рецептором, а также молекулы, идентифицированные этим способом. Неограничивающим примером способа осуществления является анализ, который концептуально подобен анализу ELISA. Например, тело рецептора TIE может быть связано с твердой подложкой, такой как пластиковый многолуночный планшет. В качестве контроля известное количество TIE-лиганда-3 или TIE-лиганда-4, который помечен myc, может вводиться в лунку и любой меченый связывающий тело рецептора TIE-лиганд-3 или TIE-лиганд-4 может быть идентифицирован посредством репортерного антитела, направленного против метки Мус. Систему можно использовать для скрининга испытуемых образцов на молекулы, которые способны i) связываться с меченым лигандом и ii) связываться с телом рецептора и тем самым блокировать связывание с телом рецептора с помощью меченого лиганда. Например, испытуемый образец, содержащий представляющую интерес молекулу вместе с известным количеством меченого лиганда, можно ввести в лунку, и количество меченого лиганда, который связывается с телом рецептора, можно измерить. Путем сравнения количества связанного меченого лиганда в испытуемом образце с количеством в контроле можно идентифицировать образцы, содержащие молекулы, способные блокировать связывание лиганда с рецептором. Представляющие интерес идентифицированные молекулы можно выделить, используя способы, хорошо известные специалистам в данной области.
Если блокирующая лигандное связывание молекула найдена, то специалист в данной области должен знать, как выполнить вторичные анализы для определения того, связывается ли блокирующая молекула с рецептором или с лигандом, а также анализы для определения того, может ли блокирующая молекула нейтрализовать биологическую активность лиганда. Например, путем использования анализа связывания, в котором применяется BIAcore биосенсорная техника (или равнозначная ей), в которой либо TIE-тело рецептора, либо TIE-лиганд-3 или TIE-лиганд-4 или тело лиганда ковалентно прикрепляется к твердой подложке (например, карбоксиметилдекстран на золотой поверхности), специалист в данной области способен определить, связывается ли блокирующая молекула специфически с лигандом, телом лиганда или с телом рецептора. Чтобы определить, может ли блокирующая молекула нейтрализовать биологическую активность лиганда, специалист в данной области может выполнить анализ фосфорилирования (см. Пример 5 в Международной заявке № WO 96/31598, опубликованный 10 октября 1996) или, наоборот, функциональный биоанализ, такой как анализ на выживание клеток путем использования первичных культур, например, эндотелиальных клеток. И наоборот, блокирующая молекула, которая связывается с телом рецептора, может быть агонистом, и специалист в данной области должен знать, как определить это с помощью соответствующей идентификации дополнительных агонистов TIE-рецептора.
Кроме того, изобретение раскрывает композиции, в которых TIE-лиганд является рецептор-связывающим доменом TIE-лиганда-3 или TIE-лиганда-4, описанного здесь. Например, TIE-2-лиганд 1 содержит суперспиральный домен и фибриногеноподобный домен. Полагают, что фибриногеноподобный домен TIE-2-лиганда 2 начинается от или около такой же аминокислотной последовательности, как в лиганде 1 (FRDCA). Полагают, что фибриногеноподобный домен начинается от или около аминокислотной последовательности, которая кодируется нуклеотидами, начинающимися у положения 929, как представлено на фиг.6А-6В. Мультимеризация суперспиральных доменов в процессе получения лиганда препятствует очистке. Как описано в примере 7, заявители обнаружили, однако, что фибриногеноподобный домен содержит TIE-2-рецепторсвязывающий домен. Мономерные формы фибриногеноподобного домена, по-видимому, не связывают рецептор. Исследования с применением mус-меченного фибриногеноподобного домена, который “образует кластеры”, и с использованием анти-mус-антитела показывают связывание TIE-2-рецептора (Методы получения собранных в кластеры лигандов и тела лигандов описаны в публикации Davis et al., Science, 266, 816-819, 1994). Основываясь на этих данных, заявители получили “тела лигандов”, которые содержат фибриногеноподобный домен TIE-2-лигандов, связанный с Fс-доменом IgG (“fFc' s”). Эти тела лигандов, образующие димеры, эффективно связывают TIE-2-рецептор. Соответственно, настоящее изобретение раскрывает получение тел лигандов TIE~лиганда-3 или TIE-лиганда-4, которые можно использовать как агенты-мишени в диагностике или терапии, такие как агенты-мишени для опухолей и/или связанной сосудистой сети, где указан TIE-антагонист.
Далее настоящее изобретение относится к разработке лиганда, фрагмента или его производного, или другой молекулы, которая является агонистом или антагонистом рецептора, в качестве терапевтического средства для лечения больных, страдающих нарушениями в клетках, тканях или органах, которые экспрессируют TIE-рецептор. Подобные молекулы могут использоваться при лечении человека или животного или при диагностике.
Поскольку TIE-рецептор идентифицирован в связи с эндотелиальными клетками и, как здесь продемонстрировано, блокировка TIE-2-лиганда 1, по-видимому, препятствует образованию сосудистой системы, заявители ожидали, что TIE-лиганд-3 или ТIЕ-лиганд-4 можно использовать для индукции этого образования при заболеваниях или нарушениях, где подобное образование сосудистой системы указано. Подобные заболевания или нарушения включают заживление ран, ишемию и диабет. Лиганды можно тестировать на животных моделях и использовать как терапевтические средства, как описано для других агентов, таких как сосудистый эндотелиальный фактор роста (VEGF), другой специфический для эндотелиальных клеток фактор, который является антиогенным (Ferrara et al., U.S. Patent № 5,332,671, вышедший 26 июля 1994). Ссылка Ferrara, а также другие исследования описывают результаты изучения in vitro и in vivo, которые можно использовать для демонстрации действия ангиогенного фактора в увеличении кровотока к ишемическому миокарду, усилении заживления ран и в других случаях терапевтического использования, где происходит неоангиогенез (Sudo et al., Европейская патентная заявка 0550296 А2, опубликованная 7 июля 1993; Banai et al., Circulatioin, 89, 2183-2189, 1994; Unger et al., Am.J.PhysioL, 266< H1588-1595, 1994; Lazarous et al., Circulation, 91, 145-153, 1995). Согласно изобретению, TIE-лиганд-3 или TIE-лиганд-4 можно использовать отдельно или в комбинации с одним или более дополнительными фармацевтически активными соединениями, такими как, например, VEGF или основной фактор роста фибробластов (FGF), а также с цитокинами, нейротрофинами и т.д.
Наоборот, антагонисты TIE-рецептора, такие как тела рецепторов, как описано здесь в примерах 2 и 3, и TIE-2 лиганд-2, как описано в примере 9 в Международной заявке № WO 96/31598, опубликованной 10 октября 1996, следует использовать, чтобы предотвратить или ослабить образование сосудистой системы, таким образом предотвращая или ослабляя, например, опухолевый рост. Эти агенты можно использовать отдельно или в комбинации с другими композициями, такими как анти-VEGF-антитела, которые, как было показано, используются при лечении состояний, терапия которых заключается в блокировании ангиогенеза. 3аявители ожидали, что TIE-лиганд-3 или TIE-лиганд-4, описанные здесь, можно также использовать в комбинации с агентами, такими как антагонисты цитокинов, такие как IL-6-антагонисты, которые, как известно, тормозят воспаление.
Например, заявители определили, что TIE-лиганды экспрессируются в клетках опухолей или клетках, близко связанных с опухолями. Например, TIE-2-лиганд-2, по-видимому, прочно связан с опухолевыми эндотелиальными клетками”. Соответственно, этот и другие TIE-антагонисты могут быть полезными в предотвращении или ослаблении опухолевого роста. Кроме того, TIE-лиганды или тела лигандов можно использовать для доставки токсинов к несущей рецептор клетке. Иначе, другие молекулы, такие как факторы роста, цитокины или питательные вещества могут быть доставлены к клеткам, несущим TIE-рецептор, посредством TIE-лигандов или тел лигандов. TIE-лиганды или тела лигандов, такие как TIE-лиганд-3 или TIE-лиганд-4, можно использовать в качестве диагностических реагентов для определения TIE-рецептора in vivo и in vitro. В тех случаях, где болезненное состояние связано с TIE-рецептором, TIE-лиганды или тела лигандов, такие как TIE-лиганд-3 или TIE-лиганд-4, можно использовать как диагностические реагенты для определения заболевания с помощью, например, окрашивания ткани или получения изображения всего тела. Подобные реагенты включают радиоизотопы, флуорохромы, красители, ферменты и биотин. Подобные диагностические средства или агенты-мишени можно приготовить, как описано в публикациях Alitalo et al., WO 95/26364, опубликованной 5 октября 1995, и Burrows F. and P. Thorpe, PNAS USA, 90, 8996-9000, 1993, которые включены в данное описание.
В других вариантах TIE-лиганды, такие как TIE-лиганд-3 или TIE-лиганд-4, описанные здесь, используются как гематопоэтические факторы. Разнообразные гематопоэтические факторы и их рецепторы вовлекаются в пролиферацию, и/или дифференцировку, и/или миграцию различных типов клеток, содержащихся в крови. Поскольку TIE-рецепторы экспрессируются в ранних гематопоэтических клетках, экспрессирующиеся TIE-лиганды играют, по-видимому, сравнительную роль в пролиферации или дифференцировке или миграции этих клеток. Таким образом, TIE-содержащие композиции можно приготовить, проанализировать, проверить в биологических системах in vivo и in vitro и использовать в качестве терапевтических средств, как описано в любой из следующих ссылок: Sousa, U.S. Патент № 4,810,643, Lee et al., Proc. Natl. Acad. Sci. USA 82, 4360-4364, 1985; Wong et al., Science, 228, 810-814, 1985, Yokota et al., Proc. Natl. Acad. Sci. USA, 81, 1070, 1984; Bosselman et al., заявка WO 9105795, опубликованная 2 мая 1991, названная “Фандор стволовых клетки”, Krikness et al., заявка WO 95/19985, опубликованная 27 июля 1995, названная “Гемопоэтический фактор созревания”). Соответственно, TIE-лиганд-3 или TIE-лиганд-4 можно использовать для диагностики или лечения состояний, при которых нормальный гематопоэз подавлен, включая в качестве неограничивающего примера анемию, тромбоцитопению, лейкопению и гранулоцитопению. В предпочтительном варианте TIE-лиганд-3 или ТIЕ-лиганд-4 можно использовать для стимулирования дифференцировки предшественников клеток крови в тех ситуациях, когда больной имеет заболевание, такое как синдром приобретенного иммунного дефицита (AIDS), которое вызывает снижение нормального уровня клеток крови, или в клиничесхих установках, где желательно увеличение гематопоэтических популяций, таких как в сочетании с трансплантатом костного мозга, или в лечении аплазии или подавлении миелоцитов, вызванном радиацией, химической обработкой или химиотерапией. TIE-лиганд-3 или TIE-лиганд-4 согласно изобретению можно использовать только или в комбинации с другим фармацевтически активным агентом, таким как, например, цитокины, нейротрофины, интерлейкины и т.д. В предпочтительном варианте лиганд можно использовать в связи с любым из вышеупомянутых факторов, которые, как известно, вызывают пролиферацию стволовой клетки или других гематопоэтических предшественников или факторов, действующих на поздние клетки в гематопоэтическом пути метаболизма, включая в качестве неограничивающего примера гемопоэтический фактор созревания, тромбопоэтический фактор стволовой клетки, эритропоэтин, G-CFS, GM-CFS и т.д.
В альтернативном варианте антагонисты TIE-рецептора используют для диагностики или лечения больных, у которых желательным результатом является торможение гематопоэтического пути метаболизма, например, для лечения миелопролиферативных или других пролиферативных нарушений кровеобразующих органов, таких как тромбоцитозы, эритроцитозы и лейкозы. В подобных вариантах лечение может включать использование терапевтически эффективного количества TIE-лиганд-3 или TIE-лиганд-4, TIE-антитело, TIE-тело рецептора, конъюгат TIE-лиганд-3 или ТIЕ-лиганд-4 или тело рецептора или fFC, как описано здесь.
Настоящее изобретение также раскрывает фармацевтические композиции, содержащие TIE-лиганд-3 или TIE-лиганд-4 или тело лигандов, описанные здесь, пептидные фрагменты из них или их производные в фармакологически приемлемом носителе. Белки TIE-лиганд-3 или TIE-лиганд-4, пептидные фрагменты или производные можно назначать системно или локально. Любой подходящий способ введения, известный в данной области, можно использовать, включал в качестве неограничивающего примера внутривенный, подоболочечный, внутриартериальный, внутриносовой, оральный, подкожный, внутрибрюшинный или с помощью локальной инъекции или хирургического имплантата. Изобретение раскрывают также способы длительного высвобождения вводимых препаратов.
Настоящее изобретение также обеспечивает антитело, которое специфически связывает подобную терапевтическую молекулу. Антитело может быть моноклональным или поликлональным. Изобретение также раскрывает способ использования подобного моноклонального или поликлонального антитела для измерения количества терапевтической молекулы в образце, взятом от больного, с целью контролирования курса терапии.
Далее изобретение обеспечивает терапевтическую композицию, содержащую TIE-лиганд-3 или TIE-лиганд-4, или тело лиганда и цитотоксический агент, сопряженный или соединенный с ним. В одном варианте цитотоксический агент может быть радиоизотоп или токсин.
Изобретение также обеспечивает антитело, которое специфически связывает TIE-лиганд-3 или TIE-лиганд-4. Антитело может быть моноклональным или поликлональным.
Далее изобретение раскрывает способ очистки TIE-лиганда-3 или TIE-лиганда-4, включающий:
a) связывание, по меньшей мере, одного связывающего TIE-субстрата с твердым матриксом;
b) инкубацию субстрата а) с клеточным лизатом с образованием комплекса субстрата с любым из TIE-лиганда-3 или TIE-лиганда-4;
c) промывку твердого матрикса; и
d) элюцию TIE-лиганда-3 или TIE-лиганда-4 из связанного субстрата.
Субстрат может быть любым веществом, которое специфически связывает TIE-лиганд-3 или TIE-лиганд-4. В одном варианте субстрат выбирают из группы, состоящей из анти-TIE-лиганда-3 или TIE-лиганда-4 антител, TIE-рецептора и TIE-тела рецептора. Изобретение далее заявляет тело рецептора, которое специфически TIE-лиганд-3 или TIE-лиганд-4, а также терапевтическую композицию, содержащую тело рецептора в фармацевтически приемлемом носителе и способ блокирования роста кровеносных сосудов у человека, включающий введение эффективного количества терапевтической композиции.
Кроме того, настоящее изобретение раскрывает способ идентификации клетки, которая экспрессирует TIE-рецептор, который включает контактирование клетки с меченным TIE-лигандом-3 или ТТЕ-лигандом-4 или телом лиганда при условиях, позволяющих связывание меченого лиганда с TIE-рецептором, и определение того, связывается ли меченый лиганд с TIE-рецептором, тем самым идентифицируя клетку как экспрессирующую TIE-рецептор. Настоящее изобретение обеспечивает терапевтическую композицию, содержащую TIE-лиганд-3 или TIE-лиганд-4 или тело лиганда и связанный с ним цитотоксический агент. Цитотоксический агент может быть радиоизотоп или токсин.
Изобретение также раскрывает способ определения экспрессии TIE-лиганда-3 или TIE-лиганда-4 клеткой, который включает получение м-РНК из клетки, контактирование полученной м-РНК с молекулой меченой нуклеиновой кислоты, кодирующей TIE-лиганд-3 или TIE-лиганд-4 в условиях гибридизации, определение присутствия гибридизованной м-РНК с меченой молекулой, тем самым определяя экспрессию TIE-лиганда-3 или TIE-лиганда-4 в клетке.
Кроме того изобретение раскрывает способ определения экспрессии TIE-лиганда-3 или ТТЕ-лиганда-4 в тканевых срезах, который включает контактирование тканевых срезов с молекулой меченой нуклеиновой кислоты, кодирующей TIE-лиганд-3 или TIE-лиганд-4 в условиях гибридизации, определение присутствия м-РНК, гибридизованной с меченой молекулой, и тем самым определяя экспрессию TIE-лиганда-3 или TIE-лиганда-4 в тканевых срезах.
ПРИМЕР 1. Идентификация АВАЕ клеточной линии в качестве репортерных клеток для TIE-2 рецептора
Взрослые ВАЕ-клетки зарегестрированы в Европейском банке клеточных культур как ЕСАСС # 92010601 (См. PNAS 75, 2621, 1978). Нозерн-анализ (РНК) обнаружил средние уровни транскриптов tie-2 АВАЕ клеточной линии (эндотелиальные клетки артерий взрослого крупного рогатого скота) в соответствии с результатами in situ гибридизации, которые яродемонстрировали единственную локализацию tie-2 РНК в сосудистых эндотелиальных клетках. Поэтому мы проверили клеточные лизаты на присутствие TIE-2 белка, а также степень фосфорилирования этого белка по остаткам тирозина при нормальных условиях роста, по сравнению с условиями роста в бессывороточной среде.
АВАЕ клеточные лизаты собирали и подвергали иммунопреципитации с последующим вестерн-блоттингом иммунопреципитированных белков с TIE-2-специфической и фосфотирозин-специфической антисыворотками. Исключение или включение TIE-2 пептидов как специфических блокирующих молекул в процессе TIE-2-иммунопреципитации позволяют идентифицировать. TIE-2 как белок с мол. массой примерно 150 кДа, у которого стационарные уровни фосфотирозина снижаются до почти неопределяемых уровней посредством предварительного выращивания клеток в среде без сыворотки.
Культуру клеток выращивали и клеточные лизаты собирали следующим образом. Клетки АВДЕ с низким числом пассажей высевали в виде монослоя в пластиковых чашках Петри (Falcon) с плотностью 2×106 клеток/150 мм чашку и растили в Dulbecco модифицированной среде Eagle (DMEM), содержащей 10% сыворотки теленка, 2 мМ L-глутамина и по 1% пенициллина и стрептомицина в атмосфере 5% СO2. До сбора клеточных лизатов клетки содержали в среде процесса DMEM с глутамином, пенициллином и стрептомицином, но без сыворотки в течение 24 часов, после чего среду ударяли и чашки промывали холодным фосфатным солевым буферным раствором (ФБС), содержащим ортованадат натрия, фторид натрия, бензамидин натрия. Клетки лизировали в малом объеме этого буфера, дополнительно содержащем 1% NP40 детергента и протеазные ингибиторы ФМСФ и апротинин. Нерастворимые остатки удаляли из лизатов центрифугированием при 14,000×G в течение 10 мин при 4°С, супернатанты подвергали иммунопреципитации с антисывороткой, специфичной для TIE-2 рецептора, в присутствии или отсутствии блокирующих пептидов, добавленных к лизату при концентрации 20 мкг/мл. Иммунопреципитирующие белки разделяли электрофорезом в полиакриламидном геле (7,5% по Laemmli) и затем с помощью электрофореза переносили на мембрану PVDF и инкубировали с антисыворотками, специфичными по отношению к TIE-2 белку и фосфотирозину. TIE-2 белок определяли визуально с помощью инкубации мембраны с НКР-связанной вторичной антисывороткой с последующей обработкой реагентом ECL (Amersham).
ПРИМЕР 2. Клонирование и экспрессия тела рецептора TIE-2 для изучения TIE-2 лигандных взаимодействий, основанного на сродстве
Была создана экспрессионная конструкция, которая вырабатывает секретируемый белок, состоящий из целой внеклеточной части крысиного TIE-2, рецептора, вставленного в константную область человеческого иммуноглобулина гамма-1 (IgGl Fc). Вставленный белок называется TIE-2 “тело рецептора” (RB), и, как ожидают, существует в растворе как димер, образованный дисульфидными связями между индивидуальными (IgGl Fc) хвостовыми частями. Fc часть TIE-2 RB получена следующим образом. ДНК фрагмент, кодирующий Fc часть человеческого IgGl, который охватывает расстояние от “шарнирной области” до карбоксильного конца белка, был амплифицирован из к-ДНК человеческой плаценты с помощью ПЦР с олигонуклеотидами соответственно опубликованной последовательности человеческого IgGl; полученный ДНК фрагмент был клонирован в плазмидный вектор. Соответствующие рестрикционные фрагменты ДНК из плазмиды, кодирующие полную длину TIE-2 рецептора, и из человеческой IgGl Fc плазмиды были лигированы на любом участке короткого фрагмента, произведенного с помощью ПЦР, который был сконструирован таким образом, чтобы вставить в рамку считывания белок-кодирующие последовательности TIE-2 и человеческого Fc-фрагмена IgGl. Таким образом, полученный слитый белок TIE-2-эктодомен Fc точно замещает Fc-фрагмент IgGl в месте области, охватывающей TIE-2 трансмембранный и цитоплазматический домены. Альтернативный способ получения тела рецепторов описан в (Goodwill, et al., Cell, 73, 447-456, 1993).
Миллиграммовые количества тела рецептора TIE-2 были получены путем клонирования TIE-2 RB ДНК-фрагмента в вектор pVL1393 бакуловируса и последующего заражения клеточной линии SF-21AE насекомых Spodoptera flugiperda. Также можно использовать клеточную линию SF-9 (ATCC Accession № CRL-1711) или клеточную линию ВТ1-ТN-5b1-4. ДНК, кодирующая тело рецептора TIE-2, была клонирована как фрагмент Eco RI-Notl в переносимую плазмиду PVL1393 бакуловируса. Плазмидная ДНК была очищена с помощью центрифугирования в градиенте плотности хлорида цезия, рекомбинирована в вирусной ДНК путем смешивания 3 мкг плазмидной ДНК с 0,5 мкг Baculo-Gold ДНК (Фарминиген), с последующим введением в липосомы, используя 30 мкг липофектина (GIBCO-BRL). Смесь ДНК-липосомы была добавлена к клеткам SF-21AE (2×106 клеток/60 мм чашка) в среде TMN-FH (модифицированная среда для клеток насекомых, Грейса) (GIBCO-BRL) в течение 5 часов при 27°С с последующей инкубацией при 27°С в течение 5 дней в модифицированной среде, содержащей 5% эмбриональной сыворотки теленка. Тканевая культуральная среда была собрана для очистки полос рекомбинантных вирусов, которая была выполнена с использованием ранее описанных методов (O'Reilly, D.R., L.K.Milier, and V.A.Luckow, Baculovirus Expression Vectors - A Laboratory Manual, 1992, New-York: W.H. Freeman) за исключением того, что агарозное покрытие содержало 125 мкг/мл X-gal (5-бром-4-хлор-3-индолил-β-d-галактопиранозид; GIBCO-BRL). После 5 дней инкубации при 27°С нерекомбинантные полосы просчитывали с помощью положительной хромогенной реакции с X-gal субстратом, положение этих полос отмечали. Рекомбинантные полосы проявляли посредством добавления второго покрытия, содержащего 100 мкг/мл МТТ (3-[4,5-диметилтиазол-2-ил] 2,5-дифенилтетразолиумбромид; Sigma). Полосы предполагаемых рекомбинантных вирусов были отобраны и очищены с помощью множественных циклов выделения полос для гарантии гомогенности. Вирусные линии были получены с помощью последовательного множества пассажей очищенного из полос вируса. Были получены линии с низким пассажем одного вирусного клона (тело рецептора vTIE-2).
SF-21AE клетки выращивали в бессывороточной среде SF-900 II, GIBCO BSL), содержащей 1 Х раствор с антибиотиком и противогрибковым агентом (GIBCO BRL) и 25 мг/л гентамицина (GIBCO BRL). Плуроник F-68 был добавлен как поверхностно-активное вещество до конечной концентрации 1 г/л. Культуры (4 л) выращивали в биореакторе (Artisan Cell Station System) в течение по крайней мере трех дней до заражения. Клетки растили при 27°С с подачей газа до 50% растворенного кислорода при скорости подачи газа 80 мл/мин (аэрация у разбрызгивающего кольца). Перемешивание производили с помощью гидромешалки со скоростью 100 rpm. Клетки собирали в среднелогарифмической фазе роста (примерно 2×106 клеток/мл), концентрировали центрифугированием и заражали с 5 полосообразующими единицами тела рецептора vTIE-2 на клетку. Клетки и инокулят были доведены свежей средой до 400 мл, и вирус адсорбировали в течение 2 часов при 27°С во вращающейся колбе. Культуру затем ресуспендировали в свежей бессывороточной среде объемом 8 литров, и клетки инкубировали в биореакторе, используя ранее описанные условия.
Культуральные среды от SF-21AE клеток, зараженные vTIE-2 телом рецептора, отделяли центрифугированием (500×g, 10 минут) через 72 часа после заражения. рН клеточных супернатантов доводили до 8,0 NaOH. 3атем добавляли ЭДТА до конечной концентрации 10 ммоль и рН супернатанта вновь доводили до рН 8,0. Супернатанты фильтровали (0,45 мкм, Millipore) и помещали в колонку с А белком (protein A sepharose 4 fast flow или HiTrap protein A, Pharmacia). Колонку промывали ФБС, содержащем 0,5 М NaCl до тех пор, пока величина абсорбции, измеренная при 280 нм не снизилась до базовой линии. Колонку промывали ФБС и элюировали 0,5 М уксусной кислотой. Колоночные фракции немедленно нейтрализовали, путем элюции помещали в пробирки, содержащие 1 М Трис рН 9,0. Фракционные пики, содержащие TIE-2 тело рецептора, объединяли и диализовали против ФБС.
ПРИМЕР 3. Демонстрация в пользу того, что TIE-2 играет решающую роль в развитии сосудистой сети
Понимание функций TIE-2 было достигнуто посредством введения “избытка” растворимого тела рецептора TIE-2 в развивающуюся систему. Потенциальная способность тела рецептора TIE-2 связывать и, тем самым, нейтрализовать доступный TIE-2 лиганд приводит к наблюдаемому нарушению нормального развития сосудистой сети и тем самым характеризует лиганд. Для того, чтобы проверить можно ли использовать тело лиганда TIE-2 для нарушения резвития сосудистой сети в раннем эмбрионе цыпленка, небольшие кусочки биологически рассасывающейся пленки смачивали с телом рецептора TIE-2 и вводили немедленно под хориоаллантоидную мембрану в положения точно латеральные по отношению к первичному эмбриону.
В раннем эмбрионе цыпленка развивается верхняя поверхность желтка из малого диска клеток, которая покрывается хориоаллантоидной мембраной (ХАМ). Эндотелиальные клетки, развивающиеся в эмбрионе для образования сосудистой сети, происходят как из вне- так внутриэмбриональных клеточных источников. Произведенные вне эмбриона эндотелиальные клетки, которые представляют основной источник эндотелиальных клеток в эмбрионе, происходят из срастаний мензенхимы, которые располагаются латерально вокруг присущей эмбриону хориоаллантоидной мембраны прямо под ней. Как только эти клетки мезенхимы созревают, они становятся источником общего предшественника, как эндотелиальных, так и гематопоэтических клеточных линий, названного гемангиобластом. В свою очередь, гемангиобласт приводит к смешанной популяции ангиобластов (предшественников эндотелиальных клеток) и гематобластов (полипотентного гематопоэтического предшественника). Образование зачатков циркуляторной системы начинается, когда потомство эндотелиальных клеток отделяется, чтобы образовать сосуд, толщиной в одну клетку, который окружает первичные клетки крови. Пролиферация и миграция этих клеточных компонентов, в конечном счете, приводит к образованию обширной сети выполненных кровью микрососудов под ХАМ, которая охватывает эмбрион, соединяя с ограниченными, внутриэмбрионально произведенными сосудистыми элементами.
Оплодотворенные куриные яйца, полученные из Spafas Inc. (Boston, МА) инкубировали при 99,5°F с 55% относительной влажностью. После 24 часов развития яичную оболочку протирали 70%-ным этанолом и сверлом делали 1,5 мм отверстие наверху в тупом углу каждого яйца. Оболочку удаляли, чтобы возникло воздушное пространство непосредственно над эмбрионом. Небольшие прямоугольные кусочки стерильной Gelfoam (гелевой пленки) (Upjohn) разрезали скальпелем и вымачивали в равных концентрациях либо TIE-2 или ЕНК-1 тело рецептора. Тело рецептора ЕНК-1 было получено, как описано в примере 2, используя ЕНК-1 внеклеточный домен вместо TIE-2 внеклеточного домена (Maisonpierre et al., Oncogene, 8, 3277-3288, 1993). Каждый кусочек пленки поглощать примерно 6 мкг белка в 30 мкл. Стерильные хирургические щипцы использовали, чтобы сделать небольшую дырочку в ХАМ в положении, находящемся в нескольких миллиметрах латерально к первичному эмбриону. Большой кусок смоченной с телом рецептора пленки вводили под ХАМ и яичную оболочку закрепляли лейкопластырем. Другие яйца на подобной стадии обрабатывали параллельно телом рецептора неродственной экспрессированной нервными клетками рецепторной тирозинкиназы, ЕНК-1 (Maisonpierre et al., Oncogene, 8, 3277-3288, 1993). Эмбрионы развивались 4 дня и затем их проверяли. Эмбрионы удаляли путем тщательного разбивания оболочек в чашках с теплым ФБС и тщательно срезали эмбрион с окружающей ХАМ. Из 12 яиц, обработанных телом рецепторов, 6-TIE-2 и 5-ЕНК-1, эмбрионы развивались за пределами наблюдения в начале эксперимента. Значительные различия были заметны между этими развивающимися эмбрионами, как показано на фиг.1А и 1В. Те эмбрионы, которые были обработаны ЕНК-1 телом рецептора, развивались относительно нормально. Четыре из пяти обработанных ЕНК-1-эмбрионов были видны, как судили по наличию биения сердца. Кроме того, внеэмбриональная сосудистая система, которая видна благодаря наличию эритроцитов, была богата и распространена на несколько сантиметров латерально под ХАМ. В противоположность, эмбрионы, обработанные телом рецептора TIE-2, были чахлые, размером 2-5 мм в диаметре, по сравнению с эмбрионами, обработанными телом рецептора ЕНК-1, размер которых в диаметре составлял 10 мм. Все обработанные TIE-2 телом рецептора эмбрионы погибли и их ХАМ были лишены кровеносных сосудов. Способность TIE-2 тела рецептора блокировать развитие сосудов у цыпленка доказывает, что TIE-2 лиганд необходим для развития сосудистой системы.
ПРИМЕР 4. Конструкция TIE-2 тела лиганда
Экспрессионная конструкция была создана так, что она производила секретируемый белок, состоящий из полной последовательности человеческого TIE-2 лиганда 1 (TL1) или TIE-2 лиганда 2 (TL2), сшитого с постоянной областью иммуноглобулина гамма-1 человека (Fc-фрагмент IgGl). Эти сшитые белки названы TIE-2 “тела лигандов” (TL1-Fc и TL2-Fc). Fc часть TL1-Fc и TL2-Fc была получена следующим образом. Фрагмент ДНК, кодирующий Fc часть человеческого IgGl, которая распространяется от “шарнирной области” до карбоксильного конца белка, был амплифицирован из человеческой ялацентарной кДНК с помощью ПЦР с олигонуклеотидами, соответвевенно опубликованной последовательности человеческого IgGl; полученный фрагмент ДНК был клонирован в плазмидный вектор. Соответствующие рестрикционные фрагменты ДНК из плазмиды, кодирующие полную длину TL1 или TL2, и из человеческой IgGl Fc плазмиды были лигированы на любом участке короткого фрагмента, произведенного с помощью ПЦР, который был сконструирован таким образом, чтобы вставить в рамку считывания белок кодирующие последовательности TL1 или TL2 и человеческого Fc-фрагмента IgGl.
Миллиграммовые количества TL2-Fc были получены путем клонирования ТДНК фрагмента в вектор pVL1393 бакуловируса и последующего заражения клеточной линии SF-21АЕ насекомых Spodoptera flugiperdа. Также можно использовать клеточную линию SF-9 (ATCC Accession № CRL-1711) или клеточную линию BTI-TN-5bl-4. ДНК, кодирующая TL2-Fc, была клонирована как фрагмент Eco RI-Notl в переносимую плазмиду PVL1393 бакуловируса. Плазмидную ДНК рекомбинировали в вирусную ДНК путем смешивания 3 мкг плазмидной ДНК с 0,5 мкг Baculo-Gold ДНК (Фарминиген), с последующим введением в липосомы, используя 30 мкг липофектина (GIBCO-BRL). Смесь ДНК-липосомы была добавлена к клеткам SF-21AE (2×106 клеток/60 мм чашка) в среде TMN-FH (модифицированная среда для клеток насекомых, Грейса) (GIBCO-BRL) в течение 5 часов при 27°С с последующей инкубацией при 27°С c течение 5 дней в модифицированной среде, содержащей 5% эмбриональной сыворотки теленка. Тканевая культуральная среда была собрана для очистки полос рекомбинантных вирусов, которая была выполнена с использованием описанных методов (O'Reilly, D.R., L. К. Miller, and V.A.Luckow, Baculoviros Expression Vectors - A Laboratory Manual, 1992, New-York: W.H. Freeman) за исключением того, что агарозное покрытие содержало 125 мкг/мл Х-gаl (5-бром-4-хлор-3-индолил-β-d-галактопиранозид; GIBCO-BRL). После 5 дней инкубации при 27°С нерекомбинантные полосы просчитывали с помощью положительной хромогенной реакции с Х-gаl субстратом, положение этих полос отмечали. Рекомбинантные полосы проявляли посредством добавления второго покрытия, содержащего 100 мкг/мл МТТ (3-[4,5-диметилтиазол-2-ил]2,5-дифенилтетразолиумбромид; Sigma). Полосы предполагаемых рекомбинантных вирусов были отобраны и очищены с помощью множественных циклов выделения полос для гарантии гомогенности. Вирусные линии были получены с помощью последовательного множества массажей очищенного из полос вируса. Были получены линии с низким массажем одного вирусного клона (тело рецептора vTTE-2).
SF-21AE клетки выращивали в бессывороточной среде SF-900 II GIBCO BRL), содержащей 1 Х раствор с антибиотиком и противогрибковым агентом (СЕВСО BRL) и 25 мг/л гентамицина (GIBCO BRL). Плуроник F-68 был добавлен лак поверхностно-активное вещество до конечной концентрации 1 г/л.
Культуры (4 л) выращивали в биореакторе (Artisan Cell Station System) в течение по крайней мере трех дней до заражения. Клетки растили при 27°С с подачей газа до 50% растворенного кислорода при скорости, подачи газа 80 л/мин (аэрация у разбрызгивающего кольца). Перемешивание производили с помощью гидромешалки со скоростью 100 rpm. Клетки собирали в среднелогарифмической фазе роста (примерно 2×106 клеток/мл), концентрировали центрифугированием и заражали с 5 полосообразующими единицами тела рецептора vTIE-2 на клетку. Клетки и инокулят были доведены свежей средой до 400 мл, и вирус адсорбировали в течение 2 часов при 27°С во вращающейся колбе. Культуру затем ресуспендировали в свежей бессывороточной среде объемом 8 литров, и клетки инкубировали в биореакторе, используя ранее описанные условия.
Культуральные среды от SF-21AE клеток, зараженных vTL2-Fc, отделяли центрифугированием (500×g, 10 минут) через 72 часа после инфицирования. рН клеточных супернатантов доводили до 8,0 NaOH. 3атем добавляли ЭДТА до конечной концентрации 10 ммоль и рН супернатанта вновь доводили до рН 8,0. Супернатанты фильтровали (0,45 мкм, Millipore) и помещали в колонку с А белком (protean A sepharose 4 fast flow или HiTrap protein A, Pharmacia). Колонку промывали ФБС, содержащем 0,5 М NaCl до тех пор, пока величина абсорбции, измеренная при 280 нм не снизится до базовой линии. Колонку промывали ФБС и элюировали 0,5 М уксусной кислотой. Колоночные фракции немедленно нейтрализовали путем элюции в пробирки, содержащие 1 М Трис рН 9,0. Фракционные пики, содержащие TIE-2 тело рецептора, объединяли и диализовали против ФБС.
ПРИМЕР 5. Система рецептор/лиганд в ангиогенезе
Хотя лигандная система TIE-2/TIE играет, по-видимому, важную роль в биологии эндотелиальных клеток, не было показано, что система играет значительную активную роль на стадиях образования сосудистой сети от раннего до промежуточного периода развития (например, ангиобласт или пролиферация и миграция эндотелиальных клеток, образование трубочек и другие события на ранней стадии моделирования сосудистой системы). В противоположность рецепторам к факторам, которые, как известно, являются промежуточным звеном при развитии сосудистой системы, поздняя картина экспрессии TIE-2 и TL1 в процессе образования сосудистой системы предполагает, что эта система играет отдельную роль на более поздних стадиях развития сосудистой системы, включая структурную и функциональную дифференцировку и стабилизацию новых кровеносных сосудов. Картина экспрессии TIE-2/TL1 также находится в соответствии с ролью в сохранении структурной целостности и/или физиологических характеристик установленной сосудистой сети.
TIE лиганд 2 (TL2) является, по-видимому, конкурентным ингибитором TL1. Пространственно-временные характеристики экспрессии TL2 предполагают, что эта ингибиторная молекула играет множественные зависимые от ситуации роли, существенные для развития сосудистой системы или ремоделирования (например, дестабилизация/де-дифференцировка зрелых эндотелиальных клеток, позволяющая образование новых сосудов из существующей сосудистой сети, ингибирование несоответствующего образования кровеносных сосудов и регрессия/инволюция зрелых кровеносных сосудов). Фиг.2 является схематическим представлением гипотетической роли TIE-2/TIE лигандов в ангиогенезе. На этой фигуре TL1 представлен (•), TL2 - (*), TIE-2 - (Т), VEGF - ([]) и fik -1 (VEGF рецептор) - (Y).
ПРИМЕР 6. Конструкция и характеристика CYS-TL1 мутанта
TIE-2 лиганды имеют два основных структурных домена, один описан как “скрученный в спираль” домен, содержащий приближенную С-концевую 1/3 часть белка и другой “фибриногеноподобный” домен, содержащий приближенные N-концевые 2/3 белка. Хотя TIE-2 лиганды, обозначенные как TL1 и TL2, имеют подобную структурную гомологию, они проявляют различные физические и биологические свойства. При невосстанавливающих условиях электрофореза видно, что оба белка образуют ковалентные мультимерные структуры с TL1, существующим сначала как тример, и TL2, существующим как димер. Фигура 3 является схематическим представлением того, как TIE-2 лиганды могут взаимодействовать с образованием мультимеров. Исходя из биологической активности было показано, что TL1 является агонистом TIE-2 рецептора, как было продемонстрировано с помощью введения фосфорилирования в TIE-2 экспрессирующие клетки. С другой стороны, TL2 является, по-видимому, конкурентным ингибитором TL1. Исследования того, что факторы могут вносить вклад в различные физические и биологические свойства двух молекул, обнаружили присутствие цистеинового остатка (CYS 265), предшествующего фибриногеноподобному домену в TL1, но отсутствующему в TL2. Этот CYS 265 остаток в TL1 кодируется последовательностью TGC и локализован около нуклеотидов 1102-1104 у связи между скрученным в спираль и фибриногеноподобным доменами. Поскольку цистеиновые остатки обычно вовлекаются в образование дисульфидных связей, присутствие которых может вносить вклад как в третичную структуру, так и в биологические свойства молекулы, было предположено, что, возможно, присутствие CYS 265 в TL1 может частично быть ответственным за различные свойства двух молекул. Чтобы проверить эту гипотезу, была сконструирована экспрессионная плазмида, которая содержала мутанты в TL1, в которых CYS был замещен на аминокислоту, не образующую дисульфидные связи. Кроме этого TL1/CYS-мутанта была сконструирована вторая экспрессионная плазмида, в которой соответствующее положение в TL2 мутанте занимает остаток цистеина. Обе немутантная и мутантная экспрессионные плазмиды TL1 и TL2 были временно трансфецированы в COS клетки. Клеточные супернатанты, содержащие рекомбинантные белки, собирали и образцы подвергали электрофорезу в полиакриламидном геле с додецилсульфатом натрия как в восстанавливающих, так и в невосстанавливающих условиях и последующему Вестерн-блоттингу. Вестерн-блоттинг обоих немутантного и мутантного TL1 и TL2 белков обнаружил, что TL1/CYS- мутант ведет себя подобно TL2 в том, что он движется как димер, и что TL2/CYS+ мутант ведет себя подобно TL1 в том, что он способен образовывать тример, а также мультимеры высокого порядка. Интересно, когда проверяли два мутантных белка на их способность вызывать фосфорилирование в TIE-2 экспрессирующих клетках, TL1/CYS- мутант был способен активировать TIE-2 рецептор, в то время как TL2/CYS+ мутант не проявлял никакой активирующей способности.
ПРИМЕР 7. Конструирование и характеристика фибриногеноподобного домена только мутантов
Для того, чтобы проверить, содержит ли фибриногеноподобный домен (F домен) TIE-2 лигандов активирующую способность, были сконструированы экспрессионные плазмиды, из которых удален скрученный в спираль домен, оставляя только ту часть ДНК последовательности, которая кодирует F-домен (начиная от нуклеотида 1159, аминокислотный остаток Аrg 284). Эта мутантная конструкция была временно трансфецирована в COS клетки. Супернатант, содержащий рекомбинантный белок, собирали. Мутант TL1/F-домен проверяли на его способность связывать TIE-2 рецептор. Результаты показали, что как мономер мутант TL1/F-домен не способен связывать TIE-2 при определяемых уровнях. Однако, когда TL1/F-доменный мономер метили myc с последующим образованием кластеров с антителом, направленным против метки mус, он проявлял определяемое связывание с TIE-2. Однако этот мутант не был способен вызывать фосфорилирование в TIE-2 экспрессирующей клеточной линии. Фиг.3 показывает схематическое представление конструкции с F-доменом и ее способность плюс и минус связывать кластер антител.
ПРИМЕР 8. Анализ связывания тела рецептора и лигандное связывание и конкурентный анализ
Разработан количественный анализ связывания в бесклеточной среде для определения связывания TIE-2 тела рецептора либо лигандного связывания и конкуренции. В варианте анализа связывания тела рецептора TIE-2 лиганды (очищенные или частично очищенные; TLS или TL2) покрывают пластиной ELISA (ELISA - иммунодетекция с применением связанной формы (фермента). Добавляют затем тело рецептора с различными концентрациями, которое связывается с иммобилизованным лигандом дозозависимым образом. После 2 часов избыток тела рецептора отмывают, количество связанного в пластине тела рецептора определяют, используя специфические анти-человеческие Fc антитела, которые помечают щелочной фосфатазой. Избыток репортерного антитела отмывают, затем проводят АР реакцию с применением подкрашенного субстрата. Для количественной оценки результатов используют спектрофотометр. Фиг.4 показывает типичную кривую связывания TIE-2-IgG. Этот анализ применяли для оценки целостности комплекса после заражения крыс и мышей. Также можно использовать вариант анализа конкуренции лиганда, в котором очищенные или частично очищенные TIE лиганды конкурируют с иммобилизованным лигандом за тело рецептора. В варианте связывания лиганда и конкуренции связывания TIE-2 эктодомен закрывают пластиной ELISA. Fc-меченые фрагменты фибриногеноподобного домена TIE лигандов (TL1-fFc и TL2-fFc) связываются с эктодоменом и их можно определить, используя такие же античеловеческие Fc антитела, как описано выше. Фиг.5 показывает пример связывания TL1-fFc с эктодоменом TIE-2. Этот вариант анализа также можно использовать для определения количественных уровней TL1-fFc в сыворотке или других образцах. Если добавляется немеченый лиганд (или очищенный или неочищенный) в то же время, как TL1-fFc, устанавливается конкуренция между меченым фрагментом лиганда и лигандом с полной длиной. Лиганд с полной длиной может заменить Fc-меченый фрагмент и эти результаты укладываются на кривой конкуренции.
ПРИМЕР 9. EA.hy926 линию клеток можно использовать в качестве репортерной клеточной линии для активности TIE лиганда
EA.hy926 является гибридной линией клеток, полученной путем сшивания HUVEC с линией клеток А549, произведенной из карциномы легких человека (Edgell et al., Proc. Natl. Acad. Sci USA, 80, 3734-3737, 1983). EA.hy926 клетки, как было найдено, экспрессируют значительные уровни белка TIE-2 рецептора с низкими уровнями фосфотирозина. Плотность, при которой EA.hy926 клетки пассируют до их использования для рецепторного анализа, а также их степень склеивания во время анализа могут влиять на TIE-2 рецепторное содержание и индуцирование в ответ на обработку лигандом. С помощью выбора следующего режима для роста этих клеток EA.hy926 клетки можно использовать в качестве зависимой системы для анализа TIE-2 лигандной активности.
EA.hy926 клетки засевали при плотности 1,5×106 клеток в Т-75 колбы (Faiconware) и подпитывали каждый день средой Дюлбекко MEM с высоким содержанием глюкозы, 10% эмбриональной сывороткой крупного рогатого скота, L-глутамином, пенициллином и стрептомицином и 1-кратным гипоксантин-аминоптерин-тимидином (HAT Gibco/BRL). После 3-4 дней роста клетки вновь пассировали при 1,5×106 клеток на 1-75 колбу и растили еще 3-4 дня. Для анализа фосфорилирования клетки, полученные описанным выше способом, растили в среде, лишенной сыворотки, путем замены на культуральную среду DMEM с высоким содержанием глюкозы и инкубации 2-3 часа при 37°С. Эту среду удаляли из колбы и образцы кондиционированной среды или очищенного лиганда добавляли в колбу в конечном объеме 1,5 мл с последующей инкубацией при 37°С в течение 5 минут. Колбы удаляли из инкубатора и помещали в емкость со льдом. Среду удаляли и добавляли 1,25 мл лизирующего буфера, содержащего 1% нонидет Р-40, 0,5% дезоксихолат натрия, 0,1% ДДС-Na в 20 мМ трис рН 7,6, 150 мМ NaCl, 50 mM NaF, 1 мМ ортованадата натрия, 5 Мм бензамидина и 1 мМ ЭДТА, а также содержащего ингибиторы протеаз - ФМСФ, апротинин и лейпептин. В течение 10 минут выдерживания на льду мембраны солюбилизировали, чашки выскребали и клеточные лизаты осветляли микроцентрифугированием при максимальной скорости в течение 10 минут при 4°С. TIE-2 рецептор иммунопреципитировали из осветленного супернатанта путем инкубации на холоду с анти-TIE-2 поликлональной антисывороткой и белком G, конъюгированным с сефарозой. Сефарозу отмывали 3 раза холодным лизирующим буфером и кипятили 5 минут в буфере для образца по Laemmli; образец подвергали электрофорезу в 7,5% полиакриламидном геле с ДДС-Na. Разрешенные белки переносили на мембрану PVDF (Lamblia-P) и подвергали анализу с помощью Westem-блотта, используя анти-фосфотирозин антитело и реагент ECL. Было сделано последующее сравнение суммарных уровней TIE-2 белка на таких же блоттах путем извлечения анти-фосфотирозиновые-антитела и реинкубации с поликлональной антисывороткой, специфичной к эктодомену TIE-2.
ПРИМЕР 10. Выделение и секвенирование кДНК клона с полной длиной цепи, кодирующего TIE лиганд-3 млекопитающих
TIE лиганд-3 (TL3) клонировали из геномной библиотеки мышиного ВАС (Research Genetics) путем гибридизации дублетов библиотеки с мышиными TL1 или TL2 пробами, соответствующими полной кодирующей последовательности этих генов. Каждую копию библиотеки гибридизовали с использованием фосфатного буфера при 55°С в течение ночи. После гибридизации фильтры промывали, используя 2×SSC, 0,1% ДДС при 60°С, с последующим выдерживанием на рентгеновской пленке. Были зарегистрированы сильные сигналы гибридизации, соответствующие мышиному TL1 или TL2. Кроме того, были идентифицированы слабо гибридизованные мышиные TL1 или TL2. Соответствующую этим клонам ДНК очищали, обрабатывало рестрикционными ферментами и два фрагмента, которые гибридизовали с исходными пробами, клонировали в бактериальную плазмиду и секвенировали. Последовательность фрагментов содержала два экзона с гомологией к мышиному TL1 или TL2. Праймеры, специфические для этих последовательностей, были использованы как ПЦР-праймеры для идентификации тканей, содержащих транскрипты, соответствующие TL3. ПЦР-полоса, соответствующая TL3, была идентифицирована в библиотеке кДНК матки мыши в lambda gt-11 (Clontech Laboratories, Inc., Palo Alto, CA).
Полоски помещали на пластину при плотности 1,25×106/20×20 пластину и после стандартной процедуры были сделаны реплики на фильтрах (Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Ed., page 8.46, Cold Spring Harbor Laboratory, Cold Spring Harbor<New York). Дупликатные фильтры подвергали скринингу при умеренных условиях (2×SSC, 65°С) с 200 bp ПЦР радиоактивной пробой, приготовленной к мышиной TL3 последовательности. Гибридизацию проводили при 65°С в растворе, содержащем 0,5 мг/мл ДНК спермы лосося. Фильтры промывали в 2×SSC при 65°С и выдерживали на рентгеновской пленке в течение 6 часов. Два положительных клона, которые гибридизовали в дублет, отбирали. EcoRI переваривание ДНК-содержащего фага, полученного из этих клонов, указывает на наличие двух независимых клонов с вставками размерами примерно 1,2 кб и примерно 2,2 кб. Вставку EcoRI размером 2,2 кб клонировали в EcoRI участок pBluescript KS (Strategene). Анализ последовательности показал, что у более длинного клона отсутствует инициирующий метионин и сигнальный пептид, но он кодировал последовательности, гомологичные мышиному TL1 или TL2. Были синтезированы два TL3- специфические ПЦР праймеры:
US2: cctctgggctcgccagtttgttagg
US1: ccagctggcagatatcagg
Следующие ПЦР~реакции выполняли, используя библиотеки экспрессионных генов, полученных из мышиных клеточных линий C2cl2ras и MG87. В первичной ПЦР-реакции специфический праймер US2 был использован вместе с вектор-специфическими олигонуклеотидами, чтобы позволить амплификацию в любой ориентации. ПЦР выполняли в объеме 100 мл, используя 35 циклов 94°С 1 минуту; 42°С или 48°С 1 минуту; 72°С 1 минуту. Вторичная ПЦР-реакция включала второй специфический праймер, US1, который содержится в первичном ПЦР-продукте, вместе с такими же векторными олигонуклеотидами. Вторичные реакции проводили при 30 циклах, используя такие температуры и время, как ранее. ПЦР-продукты выделяли и подвергали секвенированию. На основании анализа последовательностей, полученных из суммы четырех независимых ПЦР реакций, используя две различные библиотеки кДНК, был определен 5' конец TL3 последовательности. Нозерн-анализ обнаружил от средних до низких уровней мышиного TL3 транскрипта в мышиной плаценте. Экспрессия мышиного TL3 состояла из транскрипта примерно 3 кb. Полная длина TL3-кодирующей последовательности приведена на фиг.6Ф-6В.
Мышиная TL3-последовательность может быть использована для получения человеческого клона, содержащего кодирующую последовательность ее человеческой копии, путем гибридизации либо человеческого гена либо кДНК с пробой, соответствующей мышиному TL3, как было описано ранее, например, в примере 8 в Международной заявке № WO 96/31598, опубликованной 10 октября 1996.
ПРИМЕР 11. Выделение клона геномного гена с полной длиной, кодирующего TIE-2-лиганд-4-человека
TIE-лиганд-4 (TL4) клонировали из мышиного ВАС геномной библиотеки (ВАС HUMAN (II), Genome Systems Inc.) путем гибридизации дублетов библиотеки либо с радиоактивной пробой человеческого лиганда TL1, соответствующей полной фибриногенкодирующей последовательности TL1, (нуклеотиды от 1153 до 1806) либо с радиоактивной пробой мышиного лиганда TL3, соответствующей сегменту из 186 нуклеотидов из области фибриногена мышиного TL3 (нуклеотиды от 1307 до 1492 на фиг.6А-6В). Каждую пробу метили посредством ПЦР, используя соответствующие олигонуклеотиды и стандартные условия ПЦР, за исключением того, что dCTP был заменен на Р32 dCTP. Чтобы отделить пробу от свободного Р32 dCTP, ПЦР смесь подвергали колоночной гель-фильтрации. Каждую копию библиотеки гибридизовали с применением фосфатного буфера и радиоактивной пробы при 55°С в течение ночи, используя стандартные условия гибридизации. После гибридизации фильтры промывали, используя 2×SSC, 0,1% ДДС-Na при 55°С, с последующим выдерживанием на рентгеновской пленке. Наблюдали сильные сигналы гибридизации, соответствующие человеческому ТL1. Кроме того наблюдали сигналы, принадлежащие слабо гибридизованным человеческому TL1 и мышиному TL3. Соответствующую этим клонам ДНК очищали, используя стандартный способ, затем обрабатывали рестрикционными фрагментами и один фрагмент, который гибридизовали с исходными пробами, клонировали в бактериальную плазмиду и секвенировали. Последовательность фрагмента содержала один экзон с гомологией к человеческому TL1 и мышинному TL3 и другим членам семейства TIE-лиганда. Специфические для этих последовательностей праймеры можно использовать как ПЦР-праймеры для идентификации тканей, содержащих транскрипты, соответствующие TL4. Полную последовательность человеческого TL4 можно получить путем секвенирования полного ВАС-клона, содержащегося в депонированных бактериальных клетках. Экзоны можно идентифицировать с помощью гомологии к известным членам семейства TIE-лиганда, таким как TL1, TL2 и TL3. Полную кодирующую TL4-последовательность можно определить с помощью сплайсинга вместе с экзонами из TL4 геномного клона, который в свою очередь, можно использовать для продуцирования TL4 белка. Кроме того, экзоны можно использовать в качестве проб для получения клона кДНК полной длины, который можно затем использовать для продуцированных TL4 белка. Экзоны можно идентифицировать из последовательности ВАС-клона посредством гомологии к белковым доменам, таким как домены фибриногена, скрученные в спираль домены и к белковым сигналам, таким как сигнальные пептидные последовательности. Недостающие экзоны из ВАС-клона можно получить с помощью идентификации близких ВАС-клонов, например, путем использования концов депонированного ВАС-клона в качестве проб для скриннинга человеческой геномной библиотеки, в том числе один используется здесь путем использования последовательности экзона, содержащейся в ВАС клоне для скрининга кДНК библиотеки, или путем выполнения 5f или 3' RACE процедуры, используя полинуклеотидные праймеры на основе последовательностей TL4 экзона.
Идентификация дополнительных членов семейства TIE лиганда
Новую последовательность TIE-лиганда-4 можно использовать для целесообразного поиска дополнительных членов семейства TIE-лиганда по методу, который включает консервативные семейства значительной гомологии между известными членами семейства. Например, выверка аминокислотных последовательностей TIE-лигандов выявляет несколько областей консервативной последовательности (см. Подчеркнутые области фиг.7). Для идентификации новых TIE-лигандов можно использовать вырождающиеся олигонуклеотиды на основании этих последовательностей в комбинации с известными или новыми гомологичными TIE-лиганду сегментами.
Высококонсервативные области среди TL1, TL2 и TL3 можно использовать в разработке дегенеративных олигонуклеотидных праймеров, с которыми для затравки ПЦР-реакции используют кДНК, кДНК-матрицы могут быть получены путем обратной транскрипции тканевых РНК, используя олиго-d (Т) или другие соответствующие праймеры. Аликвоты продуктов реакции ПЦР затем подвергали электрофорезу на агарозном геле. Полученные амплифидированные фрагменты ДНК клонировали путем введения в плазмиды, секвенировали и последовательности ДНК сравнивали с последовательностями всех известных TIE-лигандов.
Выбранные по размеру амплифицированные фрагменты ДНК из этих ПЦР-реакций клонировали в плазмиды, введенные в E.coli путем электропорации, и трансформированные клетки помещали на избирательный агар. Колонии бактерий из ПЦР трансформации анализировали путем секвенирования плазмидных ДНК, которые очищали с помощью стандартного способа.
Клонированные фрагменты, содержащие сегмент нового TIE лиганда, можно использовать в качестве проб для гибридизации для получения полной длины кДНК-клонов из кДНК библиотеки генов. Например, человеческую TL4 геномную последовательность можно использовать, чтобы получить клон человеческой кДНК, содержащий полную кодирующую последовательность человеческого TL4, с помощью гибридизации человеческой кДНК из библиотеки генов с пробой, соответствующей человеческому TL4, как было описано ранее.
ПРИМЕР 12. Клонирование полной кодирующей последовательности hTL4
Была получена 5'- и 3'-кодирующая последовательность из геномного человеческого TL4-клона, кодирующего человеческий TIE лиганд-4 (hTL-4 Accession № (98095) путем обработки рестрикционными ферментами, Саузерн-блоттинга и гибридизации hTL-4 клона с кодирующими последовательностями из мышиного TL3 с последующим клонированием и секвенированием гибридизованных фрагментов. Кодирующие последовательности, соответствующие N-концевым и С-концевым аминокислотам hTL-4, использовали для конструирования ПЦР праймеров (показано ниже), которые, в свою очередь, были использованы для ПЦР амплификации TL4 из кДНК яичника человека. Полоса продукта ПЦР была идентифицирована как соответствующая человеческому TL4 с помощью секвенирования ДНК с использованием секвенатора ABI 373А DNA и соответствующего стандартного набора Tag Dideoxy Terminator Cycle Sequencing Kit (Applied Biosystems, Inc., Foster City, CA). Этот продукт ПЦР клонировали в вектор pCR-script и несколько плазмидных клонов анализировали посредством секвенирования. Таким образом, была получена полная последовательность, кодирующая человеческий лиганд TL4, и показана на фиг.8А-8С. В другом варианте изобретения нуклеотид в положении 569 замещали с А на G, что приводило к замене аминокислоты с Q на R.
Описанные выше ПЦР-праймеры были обозначены следующим образом:
hTL4atg 5'-gcatgctatctcgagccaccATGCTCTCCCAGCTAGCCATGCTGCAG-3' hTL4 не 5'
gtgtcgacgcggccgctotagatcagacTTAGATGTCCAAAGGCCGTATCATCAT-3'
Прописные буквы указывают “хвостовые” последовательности, добавленные к ПЦР-праймерам для облегчения клонирования амплифицированных ПЦР-фрагментов.
ПРИМЕР 13. TIE-лиганд-4 связывается с TIE2-рецептором
Действия ангиопоэтина-1 (TL-1) и ангиопоэтина-2 (TL-2) осуществляются посредством их связывания с рецепторной тирозинкиназой TIE2. Ни TL-1, ни TL-2 не связывается с близкородственным TIE1-рецептором, для которого не имеется известного лиганда. Для определения возможности связывания ангиопоэтина-4 (TL-4) с любым из двух TIE-рецепторов выполняли два различных анализа связывания, включая связывание ангиопоэтина-4 или производного ангиопоэтина-4 с клетками, экспрессирующими TIE-рецепторы, или с BIAcore-чипами, на которых иммобилизованы TIE-рецепторы. Производное ангиопоэтина-4, используемое в данном эксперименте, представляет собой химерный ангиопоэтин, в котором N-концевой и суперспиральный сегменты ангиопоэтина-2 слиты с фибриногеноподобным доменом ангиопоэтина-4 с образованием Ang4Chim. В обоих исследованиях ангиопоэтин-4 и Ang4Chim связывались с TIE2-рецептором, но не с TIE1-рецептором (см. фиг.9, демонстрирующую результаты BIAcore-анализа). Кроме того, конкуренция за связывание с ангиопоэтином-4 или Ang4Chim наблюдалась при использовании избыточных количеств растворимых TIE2-рецепторов, но не растворимых TIEl-рецепторов или других нерелевантных растворимых рецепторов (фиг.9). Таким образом, с учетом специфичности связывания с TIE2-рецептором ангиопоэтин-4 является подлинным членом семейства ангиопоэтинов.
ПРИМЕР 14. TIE-лиганд-4 активирует TIE2-рецептор
Было обнаружено, что первые два члена семейства ангиопоэтинов, ангиопоэтин-1 (TL-1) и ангиопоэтин-2 (TL-2), имеют различающиеся активности, а именно первый является активатором, а второй - антагонистом экспрессируемых эндотелиальными клетками TIE2-рецепторов. С целью определения действий ангиопоэтина-4 (TL-4) на TIE2-рецепторы три различные клеточные линии (линия эндотелиальных клеток человека ЕАny926, линия эндотелиальных клеток мыши bEND и мышиные фибробласты MG 3Т3) подвергали воздействию Ang4Chim, и определяли способность этой молекулы активировать TIE2. Как показано на фиг.10, Ang4Chim мог активировать TIE2-рецепторы во всех трех клеточных линиях.
Депозиды
Следующее было отложено в Американскую коллекцию типов культур (АТСС), 12301 Parklawn Drive, Rockville, Maryland 20852 в соответствии с Будапештским договором. Рекомбинантный бакуловирус Autographa californica, кодирующий TIE-2-рецептор-тело, был отложен в АТСС 7 октября 1994 и обозначен как “vTIE-2 рецептор-тело” под АТСС каталожным номером VR2484. E.coli штамм DH10B, содержащий плазмиду pBeLoBacll с введенным человеческим геномом TL-4, кодирующим человеческий TIE лиганд-4, был отложен в АТСС 2 июля 1996 и обозначен как “hTL-4” под АТСС каталожным номером 98095.
Настоящее изобретение не ограничивается сферой тех специфических вариантов, которые описаны здесь. Действительно, различные модификации изобретения, кроме описанных здесь, будут очевидны для специалистов в данной области, исходя из предшествующего описания и сопровождающих его фигур. Подразумевается, что подобные модификации входят в объем прилагаемой формулы изобретения.
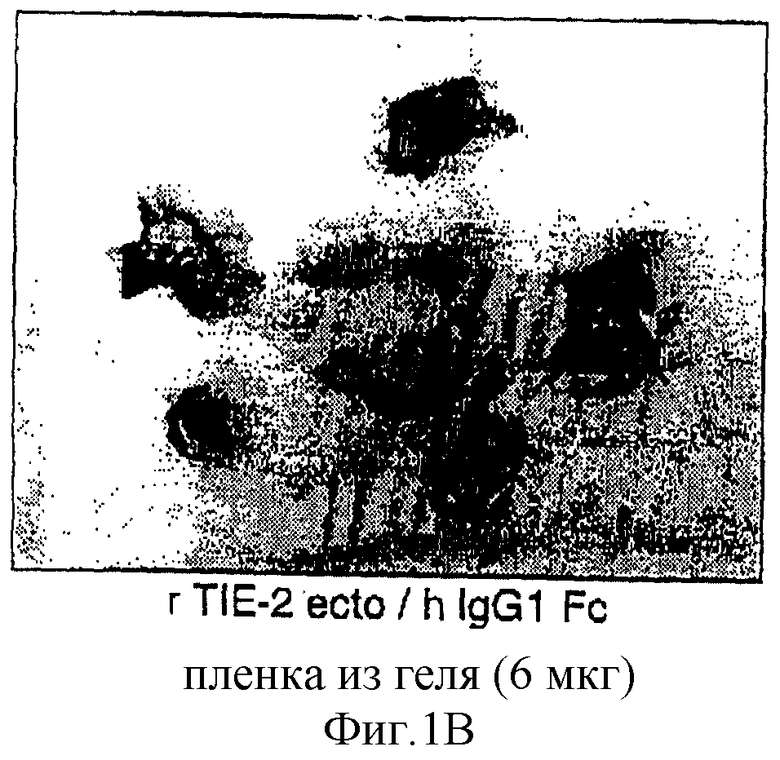
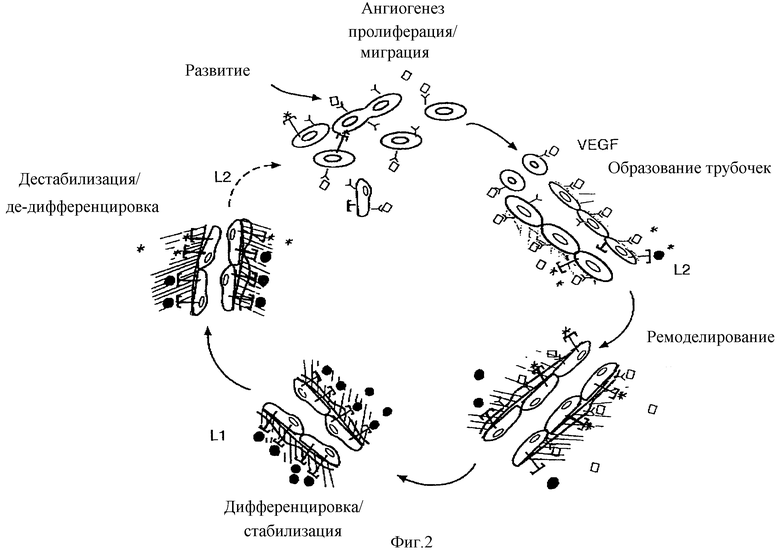
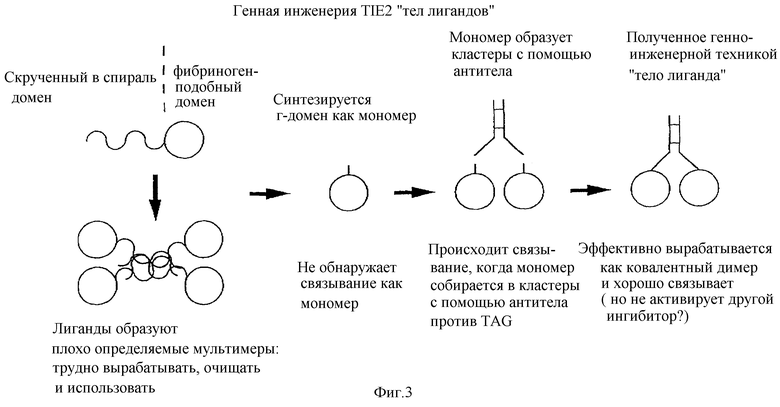
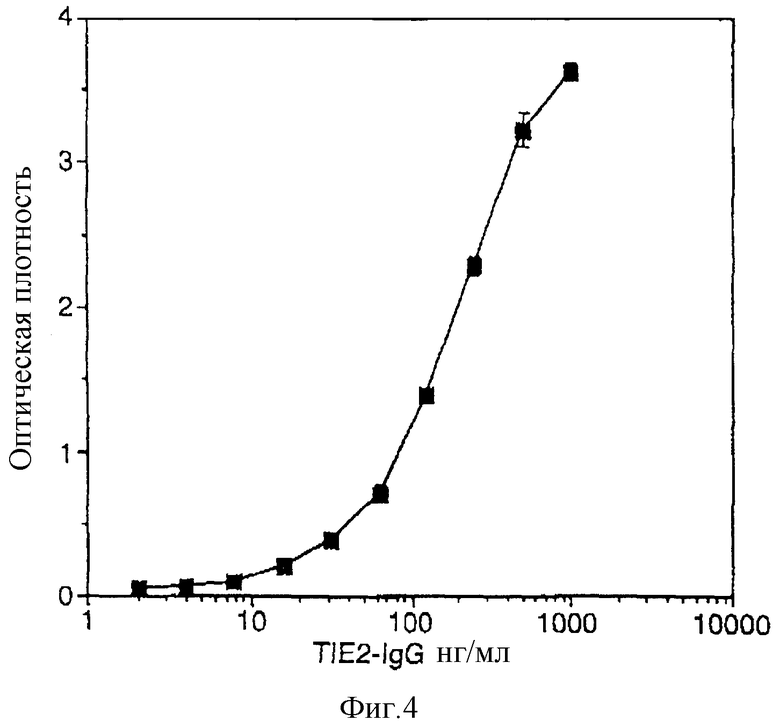
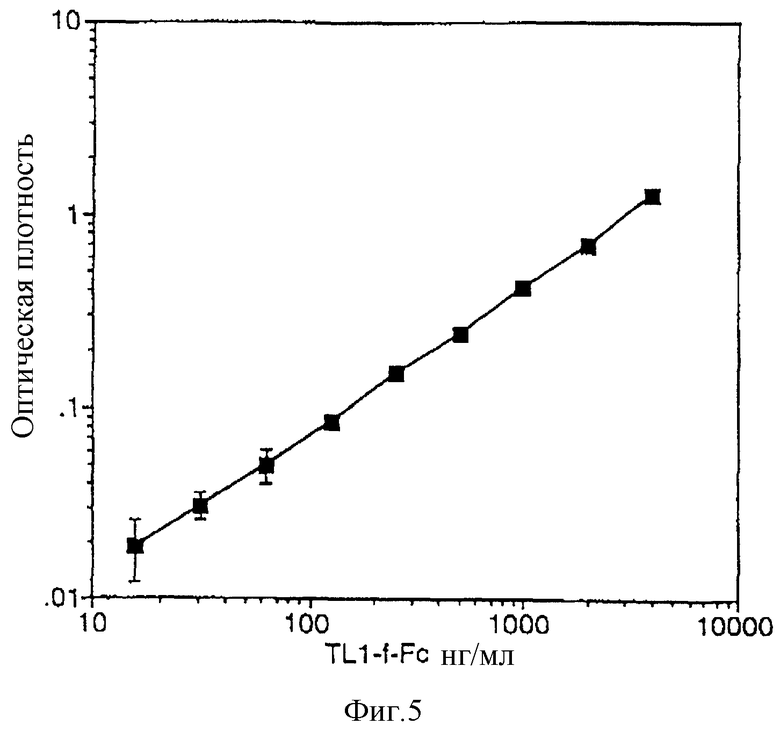





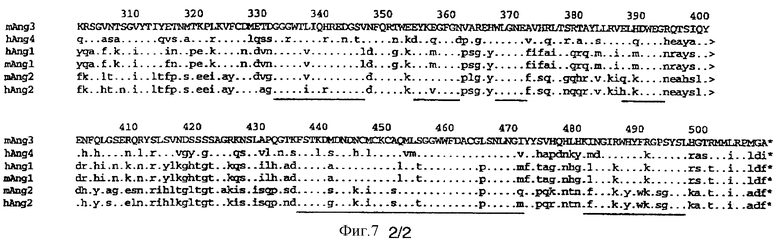



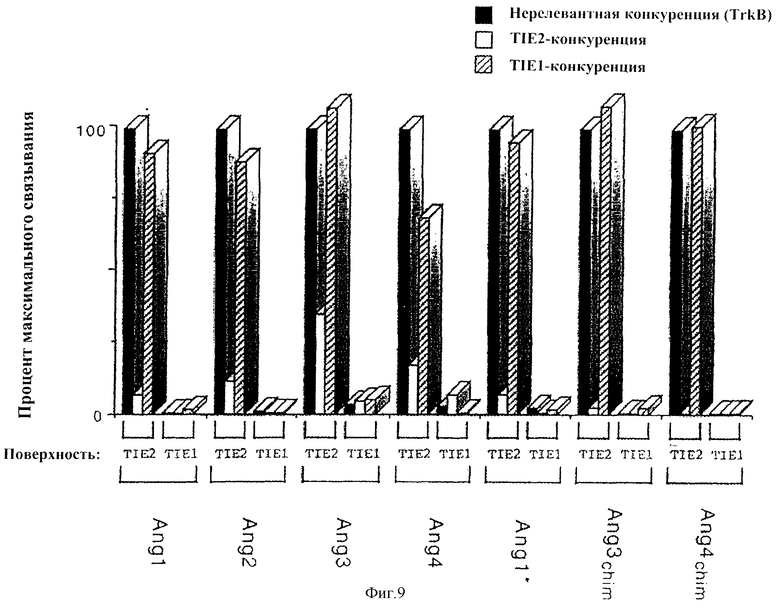
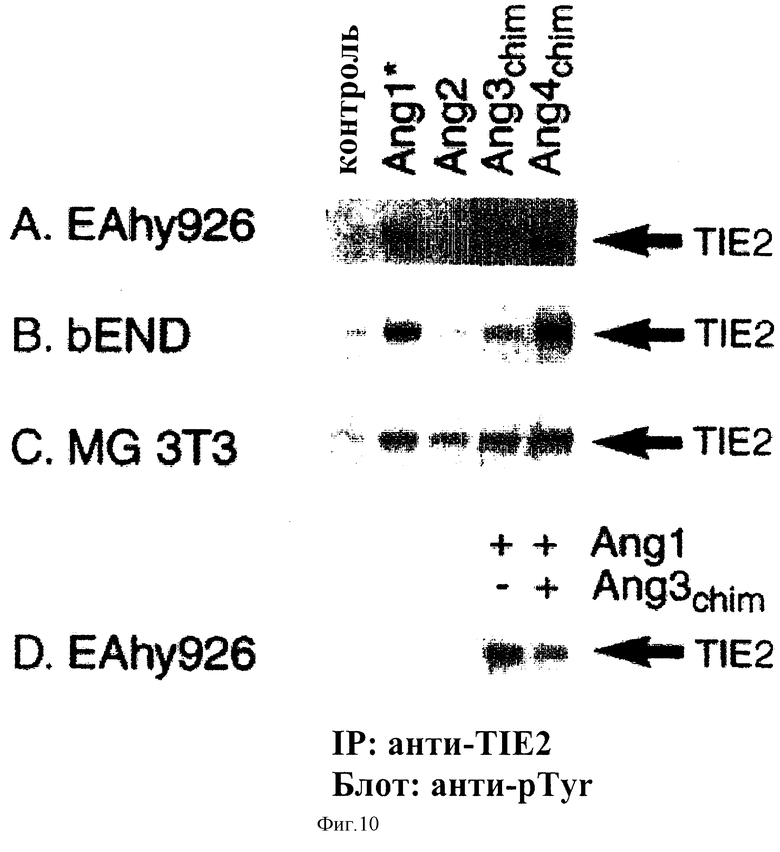
Изобретение относится к области биотехнологии и может быть использовано в медицине. Установлена нуклеотидная последовательность, кодирующая новый полипептид (TIE-лиганд-4), который относится к семейству TIE-лигандов, и определен ее фрагмент, относящийся к фибриногеноподобному домену (ФПД) нового полипептида. Сконструированы векторы, содержащие фрагмент нуклеиновой кислоты с кодирующей TIE-лиганд-4 или его ФПД последовательностью, которые использованы для трансформации клеток-хозяев и получения соответствующих рекомбинантных полипептидов. Предложено применение TIE-лиганда-4 в составе конъюгата с цитотоксическим агентом, а его ФПД - для образования “лиганд-тела”. 10 с. и 4 з.п. ф-лы, 10 ил.

Конвенционный приоритет по пп.1-14 установлен от 02.07.1996 в соответствии с заявкой 60/02187, поданной в Патентное ведомство СП ТА.
| US 5447860, 05.09.1995 | |||
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
Авторы
Даты
2004-12-20—Публикация
1997-06-19—Подача