По настоящей заявке испрашивается приоритет предварительной заявки США рег. № 60/638354, поданной 21 декабря 2004, и предварительной заявки США рег. № 60/711289, поданной 25 августа 2005, которые вводятся в настоящее описание посредством ссылки.
Область, к которой относится изобретение
Настоящее изобретение относится к моноклональным антителам против ангиопоэтина-2 (Ang-2) и к применению таких антител. Более конкретно, настоящее изобретение относится к полностью человеческим моноклональным антителам против Ang-2 и к применению указанных антител. В других своих аспектах, настоящее изобретение также относится к гибридомам или к другим клеточным линиям, экспрессирующим указанные антитела. Описанные антитела могут быть использованы в качестве диагностических средств и для лечения заболеваний, ассоциированных с активностью и/или со сверхпродуцированием Ang-2.
Предшествующий уровень техники
Ангиогенез представляет собой процесс образования новых капилляров из уже имеющихся кровеносных сосудов и является существенным компонентом процессов эмбриогенеза, нормального физиологического роста, репарации ткани и роста опухолей. Хотя ответы эндотелиальных клеток (ЭК) in vitro и рост кровеносных сосудов in vivo могут модулироваться различными факторами, однако, очевидно, что на сосудистые ЭК почти исключительно влияют только члены семейства сосудистых эндотелиальных факторов роста (VEGF) и ангиопоэтины. Yancopoulos et al., Nature 407:242-48 (2000).
Ангиопоэтины были обнаружены как лиганды для Tie, то есть для членов семейства тирозинкиназ, которые селективно экспрессируются в сосудистом эндотелии. Yancopoulos et al., Nature 407:242-48 (2000). В настоящее время известны четыре различных члена семейства ангиопоэтинов. Ангиопоэтины-3 и -4 (Ang-3 и Ang-4) могут представлять собой широко варьирующиеся аналоги одного и того же генного локуса у мышей и у человека. Kim et al., FEBS Let, 443:353-56 (1999); Kim et al., J Biol Chem 274:26523-28 (1999). Ang-1 и Ang-2 были впервые идентифицированы в экспериментах по культивированию тканей как агонист и антагонист, соответственно. Davis et al., Cell 87:1161-69 (1996); Maisonpierre et al., Science 277:55- 60 (1997). Все известные ангиопоэтины связываются, главным образом, с Tie-2, и оба Ang-1 и Ang-2 связываются с Tie-2 с аффинностью 3 нМ (Kd). Maisonpierre et al., Science 277:55-60 (1997). Было показано, что Ang-1 способствует увеличению продолжительности жизни эндотелиальных клеток и сохранению целостности эндотелия, Davis et al., Cell 87:1161-69 (1996); Kwak et al., FEBS Lett 448:249-53 (1999); Suri et al., Science 282:468-71 (1998); Thurston et al., Science 286: 2511-14 (1999); Thurston et al., Nat. Med. 6:460-63 (2000), тогда как Ang-2 обладает противоположным действием и стимулирует дестабилизацию и регрессию кровеносных сосудов в отсутствии факторов VEGF, ответственных за выживание клеток, или основных факторов роста фибробластов. Maisonpierre et al., Science 277:55-60 (1997). Однако во многих исследованиях функции Ang-2 высказывалось предположение о более сложной роли Ang-2. Ang-2 может представлять собой сложный регулятор ремоделирования сосудов, который играет роль как в развитии сосудов, так и в их деструкции. Для подтверждения такой роли Ang-2 были проведены анализы на его экспрессию, которые показали, что быстрое индуцирование Ang-2 вместе с VEGF приводит к развитию ангиогенеза у взрослых, а индуцирование Ang-2 в отсутствии VEGF приводит к деструкции сосудов. Holash et al., Science 284:1994-98 (1999); Holash et al., Oncogene 18:5356-62 (1999). В соответствии со своей зависимой от окружения ролью, Ang-2 связывается с тем же специфичным к эндотелию рецептором Tie-2, который активируется под действием Ang-1, но эта активация зависит от его окружения. Maisonpierre et al., Science 277:55-60 (1997).
Анализы ангиогенеза в роговице показали, что Ang-1 и Ang-2 имеют аналогичные эффекты, то есть их действие вместе с VEGF, которое стимулирует рост новых кровеносных сосудов, является синергическим. Asahara et al., Circ. Res. 83:233-40 (1998). На возможность увеличения дозозависимого эндотелиального ответа указывает наблюдение того факта, что Ang-2 может быть также про-ангиогенным при высокой концентрации in vitro. Kim et al., Oncogene 19:4549-52 (2000). При высокой концентрации Ang-2 действует как фактор выживания эндотелиальных клеток в процессе индуцированного депривацией сыворотки апоптоза, вызываемого активацией Tie-2 в каскадах реакций киназы PI-3 и Akt. Kim et al., Oncogene 19:4549-52 (2000).
В других in vitro экспериментах было высказано предположение, что при длительных воздействиях эффекты Ang-2 могут постепенно меняться от антагонического действия на агонистическое действие по отношению к Tie-2, а в наиболее поздних стадиях они могут непосредственно приводить к образованию сосудистых микротрубочек и стабилизации новых сосудов. Teichert-Kuliszewska et al., Cardiovasc. Res. 49:659-70 (2001). Кроме того, при культивировании ЭК на фибриновом геле, также наблюдалась активация Tie-2 под действием Ang-2, что, вероятно, указывает на то, что действие Ang-2 может зависеть от уровня дифференцировки ЭК. Teichert-Kuliszewska et al., Cardiovasc. Res. 49:659-70 (2001). В микрососудистых эндотелиальных клетках, культивированных в трехмерном коллагеновом геле, Ang-2 может также индуцировать активацию Tie-2 и стимулировать образование капилляро-подобных структур. Mochizuki et al., J. Cell. Sci. 115:175-83 (2002). Использование трехмерной сфероидной сокультуры в качестве in vitro модели созревания сосудов продемонстрировало, что прямое контактирование эндотелиальных клеток с мезенхимными клетками подавляет восприимчивость к VEGF, тогда как присутствие VEGF и Ang-2 индуцирует разрастание сосудов. Korff et al., Faseb J. 15:447-57 (2001). Etoh и др. продемонстрировали, что в ЭК, которые конститутивно экспрессируют Tie-2, экспрессия MMP-1, -9 и u-PA в высокой степени активируется ангиопоэтином Ang-2 в присутствии VEGF. Etoh, et al., Cancer Res. 61:2145-53 (2001). На in vivo модели мембраны зрачка, Лобов и др. показали, что Ang-2 в присутствии эндогенного VEGF индуцирует быстрое увеличение диаметра капилляров, ремоделирование базальной пластины, пролиферацию и миграцию эндотелиальных клеток, а также стимулирует образование новых кровеносных сосудов. Lobov et al., Proc. Natl. Acad. Sci. USA 99:11205-10 (2002). В противоположность этому, в отсутствии эндогенного VEGF, Ang-2 стимулирует гибель эндотелиальных клеток и деструкцию сосудов. Lobov et al., Proc. Natl. Acad. Sci. USA 99:11205-10 (2002). Аналогичным образом, на in vivo модели опухоли, Vajkoczy и др. продемонстрировали, что мультиклеточные агрегаты инициируют рост сосудов при развитии ангиогенеза посредством одновременной экспрессии VEGFR-2 и Ang-2 в эндотелии хозяина и в эндотелии опухоли. Vajkoczy et al., J. Clin. Invest. 109:777-85 (2002). На этой модели проиллюстрировано, что развивающаяся сеть капиллярных сосудов растущей опухоли характеризуется постоянным ремоделированием, вероятно, опосредованным экспрессией VEGF и Ang-2. Vajkoczy et al., J. Clin. Invest. 109:777-85 (2002).
В исследованиях Tie-2 и ангиопоэтина-1, дефицитные по этим белкам мыши обнаруживали аналогичные фенотипы, и было высказано предположение, что стимулированное ангиопоэтином-1 фосфорилирование Tie-2 опосредует ремоделирование и стабилизацию развивающихся сосудов, стимулирует развитие кровеносных сосудов в процессе ангиогенеза и способствует адгезии эндотелиальных клеток к “якорным” клеткам (Dumont et al., Genes & Development, 8:1897-1909 (1994); Sato, Nature, 376:70-74 (1995); (Thurston, G. et al., 2000 Nature Medicine: 6, 460-463)). Очевидно, что роль ангиопоэтина-1 сохраняется в организме взрослых индивидуумов, где он конститутивно экспрессируется в различных тканях широкого ряда (Hanahan, Science, 277:48-50 (1997); Zagzag, et al., Exp Neurology, 159:391-400 (1999)). В противоположность этому, экспрессия ангиопоэтина-2 ограничена, главным образом, участками ремоделирования сосудов, где он, вероятно, блокирует конститутивную функцию ангиопоэтина-1, ответственную за стабилизацию и развитие сосудов, что позволяет этим сосудам возвращаться в пластичное состояние и оставаться в состоянии, при котором они могут быть более восприимчивы к передаче сигналов (Hanahan, 1997; Holash et al., Oncogene 18:5356-62 (1999); Maisonpierre, 1997). Исследования экспрессии ангиопоэтина-2 при патологическом ангиогенезе показали, что опухоли многих типов обнаруживают экспрессию сосудистого ангиопоэтина-2 (Maisonpierre et al., Science 277:55-60 (1997)). Функциональные исследования, проведенные на мышиной модели ксенотрансплантата, позволяют предположить, что ангиопоэтин-2 участвует в ангиогенезе опухоли, и ассоциировать сверхэкспрессию ангиопоэтина-2 с увеличением роста опухоли (Ahmad, et al., Cancer Res., 61:1255-1259 (2001)). Другие исследования показали, что сверхэкспрессия ангиопоэтина-2 ассоциируется с гиперваскуляризацией опухоли (Etoh, et al., Cancer Res. 61:2145-53 (2001); Tanaka et al., Cancer Res. 62:7124-29 (2002)).
В последние годы было предложено применение ангиопоэтина-1, ангиопоэтина-2 и/или Tie-2 в качестве возможных противораковых терапевтических мишеней. Так, например, в патентах США №№ 6166185, 5650490 и 5814464 описаны лиганд против Tie-2 и антитела против рецепторов.
В исследованиях, проводимых с использованием растворимого Tie-2, сообщалось об уменьшении числа и размера опухолей у грызунов (Lin, 1997; Lin 1998). Siemester и др. (1999) получили человеческие клеточные линии меланомы, экспрессирующие внеклеточный домен Tie-2, а затем эти клетки инъецировали “голым” мышам, после чего был сделан вывод, что растворимый Tie-2 в значительной степени ингибирует рост опухоли и ее ангиогенез. Если учесть, что и ангиопоэтин-1, и ангиопоэтин-2 связываются с Tie-2, то, исходя из этих исследований, остается неясным, могут ли ангиопоэтин-1, ангиопоэтин-2 или Tie-2 служить привлекательной мишенью для противораковой терапии. Однако, очевидно, что терапия, направленная против ангиопоэтина-2, может быть эффективной для лечения таких заболеваний, как рак, прогрессирование которого зависит от степени нарушения ангиогенеза, где блокирование этого процесса может приводить к предотвращению прогрессирования заболевания (Folkman, J., Nature Medicine. 1: 27-31 (1995)). Кроме того, некоторые группы исследователей сообщали об использовании антител, которые связываются с ангиопоэтином-2, см. например, патент США № 6166185 и публикацию заявки на патент США № 2003/0124129 Al. Исследование эффекта локальной экспрессии ангиопоэтина-2 показало, что антагонистическое действие сигнала ангиопоэтин-1/Tie-2 приводит к ослаблению плотной сосудистой структуры и, тем самым, к передаче активирующих сигналов, подаваемых на эндотелиальные клетки (ЭК) индукторами ангиогенеза, например, VEGF. (Hanahan, 1997). Такой про-ангиогенный эффект, индуцируемый ингибированием ангиопоэтина-1, указывает на то, что терапия, направленная против ангиопоэтина-1, по-видимому, не может быть эффективной противораковой терапией.
Ang-2 экспрессируется во время развития сосудов на участках, где происходит ремоделирование кровеносных сосудов. Maisonpierre et al., Science 277:55-60 (1997). У взрослых индивидуумов экспрессия Ang-2 ограничена участками ремоделирования сосудов, а также в опухолях с высокой степенью васкуляризации, включая глиому (Оsada et al., Int. J. Oncol. 18:305-09 (2001); Koga et al., Cancer Res. 61:6248-54 (2001)), гепатоцеллюлярную карциному (Tanaka et al., J. Clin. Invest. 103:341-45 (1999)), карциному желудка (Etoh, et al., Cancer Res. 61:2145-53 (2001); Lee et al., Int. J. Oncol. 18:355-61 (2001)), опухоль щитовидной железы (Bunone et al., Am. J. Pathol. 155:1967-76 (1999)), не-мелкоклеточный рак легких (Wong et al., Lung Cancer 29:11-22 (2000)), рак толстой кишки (Ahmad et al., Cancer 92:1138-43 (2001)) и предстательной железы (Wurmbach et al., Anticancer Res. 20:5217-20 (2000)). Было обнаружено, что некоторые опухолевые клетки экспрессируют Ang-2. Так, например, Tanaka и др. (J. Clin. Invest. 103:341-45 (1999)) была детектирована мРНК Ang-2 в 10 из 12 образцов человеческой гепатоцеллюлярной карциномы (НСС). Группа Эллиса сообщала, что Ang-2 экспрессируется повсеместно в опухолевом эпителии. Ahmad et al., Cancer 92:1138-43 (2001). Другие исследователи сообщали аналогичные данные. Chen et al., J. Tongji Med. Univ. 21:228-30, 235 (2001). Исходя из определения уровней мРНК Ang-2 в архивированных образцах раковых тканей молочной железы человека, Sfilogoi и др. (Int. J. Cancer 103:466-74 (2003)) сообщали, что мРНК Ang-2 ассоциируется, главным образом, с дополнительной инвазией лимфоузлов, с коротким латентным периодом заболевания и, в целом, небольшой продолжительностью жизни. Tanaka и др. (Cancer Res. 62:7124-29 (2002)) наблюдали всего 236 пациентов с не-мелкоклеточным раком легких (NSCLC) на патологической стадии I-IIIа развития заболевания, соответственно. Проведенный ими иммуногистохимический анализ показал, что 16,9% пациентов с NSCLC были положительными по Ang-2. Плотность микрососудов в Ang-2-положительной опухоли была значительно выше, чем в Ang-2-отрицательной опухоли. Такой ангиогенный эффект Ang-2 наблюдался только в случае высокого уровня экспрессии VEGF. Кроме того, пложительная экспрессия Ang-2 является важным фактором, являющимся показателем неблагоприятного прогноза относительно продолжительности жизни после операции. Tanaka et al., Cancer Res. 62:7124-29 (2002). Однако какой-либо заметной корреляции между экспрессией Ang-1 и плотностью микрососудов обнаружено не было. Tanaka et al., Cancer Res. 62:7124-29 (2002). Эти результаты позволяют предположить, что Ang-2 является индикатором плохого прогноза для пациентов с раком различных типов.
Недавно, группа Yancopoulos, проводившая исследования на Ang-2-дефицитных мышиных моделях, сообщила, что Ang-2 необходим для постнатального ангиогенеза. Gale et al., Dev. Cell 3:411-23 (2002). Этими исследователями было показано, что генетически запрограммированная регрессия сосудистой сети стекловидного тела глаза отсутствует у Ang-2-/--мышей, а кровеносные сосуды их сетчатки не развивались из центральной артерии сетчатки. Gale et al., Dev. Cell 3:411-23 (2002). Эти исследователи также обнаружили, что делеция Ang-2 приводит к серьезному нарушению развития и функции лимфатических сосудов. Gale et al., Dev. Cell 3:411-23 (2002). Сохранение гена Ang-1 корректирует дефекты развития лимфатических сосудов, но не устраняет дефекты ангиогенеза. Gale et al., Dev. Cell 3:411-23 (2002).
Петерс (Peters) и коллеги сообщили, что растворимый Tie-2, при его доставке либо в виде рекомбинантного белка, либо в вирусном экспрессионном векторе, ингибирует in vivo рост мышиной карциномы молочной железы и меланомы у мышиных моделей. Lin et al., Proc. Natl Acad. Sci USA 95:8829-34 (1998); Lin et al., J. Clin. Invest. 100:2072-78 (1997). Плотность сосудов в обработанных таким образом опухолевых тканях значительно снижалась. Кроме того, растворимый Tie-2 блокировал ангиогенез в роговице крыс, стимулируемый средой, кондиционированной опухолевыми клетками. Lin et al., J. Clin. Invest. 100:2072-78 (1997). Кроме того, Isner и его группа продемонстрировали, что присоединение Ang-2 к VEGF индуцирует значительно более длительную и более обширную неоваскуляризацию, чем один VEGF. Asahara et al., Circ. Res. 83:233-40 (1998). Избыток растворимого рецептора Tie-2 предотвращает модуляцию VEGF-индуцированной неоваскуляризации под действием Ang-2. Asahara et al., Circ. Res. 83:233-40 (1998). Siemeister и др. (Cancer Res. 59:3185-91 (1999)) в исследованиях, проводимых на “голых” мышах с ксенотрансплантатами, показали, что сверхэкспрессия внеклеточных лиганд-связывающих доменов FIt-I или Tie-2 в указанных ксенотрансплантатах приводит к значительному ингибированию путей их реакций, которые не могут компенсировать друг друга, что позволяет предположить, что путь рецептора VEGF и путь Tie-2 должны рассматриваться как два независимых медиатора, играющих важную роль в процессе ангиогенеза in vivo. Siemeister et al., Cancer Res. 59:3185-91 (1999). Это подтверждается более поздними публикациями White et al., Proc. Natl. Acad. Sci. USA 100:5028-33 (2003). В этом исследовании было продемонстрировано, что резистентный к нуклеазе аптамер РНК, который специфически связывается с Ang-2 и ингибирует Ang-2, значительно ингибирует неоваскуляризацию, индуцированную bFGF в модели ангиогенеза в микрокармане роговицы крыс.
Краткое описание сущности изобретения
В одном из своих вариантов, настоящее изобретение относится к нацеленным на мишень связывающим агентам, которые специфически связываются с ангиопоэтином-2 и, тем самым, ингибируют опухолевый ангиогенез, и снижают рост опухоли. Механизмами, с помощью которых может быть достигнут этот эффект, могут быть, но не ограничиваются ими, ингибирование связывания Ang-2 с его рецептором Tie-2, ингибирование Ang-2-индуцированной передачи сигнала Tie-2 или усиление клиренса Ang-2 и, тем самым, уменьшение эффективной концентрации Ang-2.
В одном из вариантов изобретения, нацеленным связывающим агентом является полностью человеческое антитело, которое связывается с Ang-2 и предотвращает связывание Ang-2 с Tie-2. В еще одном своем варианте, настоящее изобретение относится к полностью человеческому моноклональному антителу, которое связывается с Ang-2 и Ang-1, а также ингибирует Ang-2-индуцированное фосфорилирование Tie-2. Указанное антитело может связываться с Ang-2 с Кd менее чем 100 пM, 30 пM, 20 пM, 10 пМ или 5 пМ.
Антитело может содержать аминокислотную последовательность тяжелой цепи, имеющую гипервариабельную область (комплементарность-определяющую область (CDR)), одна из последовательностей которой представлена в таблице 11. Следует отметить, что специалист в данной области может легко определить такие CDR. См. например, руководство Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols.1-3.
Один из вариантов настоящего изобретения включает полностью человеческие моноклональные антитела 3.3.2 (номер доступа в ATCC PTA-7258), 3.19.3 (номер доступа в ATCC PTA-7260) и 5.88.3 (номер доступа в ATCC PTA-7259), которые специфически связываются с Ang-2, как более подробно обсуждается ниже.
В еще одном своем варианте, настоящее изобретение относится к антителу, которое связывается с Ang-2 и содержит аминокислотную последовательность легкой цепи, имеющую CDR, содержащую одну из последовательностей, представленных в таблице 12. В некоторых вариантах изобретения, указанным антителом является полностью человеческое моноклональное антитело.
В другом своем варианте, настоящее изобретение относится к антителу, которое связывается с Ang-2 и содержит аминокислотную последовательность тяжелой цепи, имеющую одну из последовательностей CDR, представленных в таблице 11, и аминокислотную последовательность легкой цепи, имеющую одну из последовательностей CDR, представленных в таблице 12. В некоторых вариантах изобретения, указанным антителом является полностью человеческое моноклональное антитело. Другим вариантом настоящего изобретения является антитело, которое конкурирует с полностью человеческими антителами согласно изобретению за перекрестное связывание с Ang-2, а предпочтительно, антитело, содержащее аминокислотную последовательность тяжелой цепи, имеющую одну из последовательностей CDR, представленных в таблице 11, и аминокислотную последовательность легкой цепи, имеющую одну из последовательностей CDR, представленных в таблице 12. Другим вариантом настоящего изобретения является антитело, которое связывается с тем же эпитопом на Ang-2, что и полностью человеческие антитела согласно изобретению, а предпочтительно, антитело, содержащее аминокислотную последовательность тяжелой цепи, имеющую одну из последовательностей CDR, представленных в таблице 11, и аминокислотную последовательность легкой цепи, имеющую одну из последовательностей CDR, представленных в таблице 12.
Другие варианты настоящего изобретения включают человеческие моноклональные антитела, которые специфически связываются с ангиопоэтином-2, где указанные антитела содержат гипервариабельную область 1 (CDRl) тяжелой цепи, соответствующую каноническому классу 1. Описанные здесь антитела могут также включать гипервариабельную область 2 (CDR2) тяжелой цепи, соответствующую каноническому классу 3, гипервариабельную область 1 (CDR1) легкой цепи, соответствующую каноническому классу 2, гипервариабельную область 2 (CDR2) легкой цепи, соответствующую каноническому классу 1 и гипервариабельную область 3 (CDR3) легкой цепи, соответствующую каноническому классу 1.
Настоящее изобретение также относится к способам анализа уровня ангиопоэтина-2 (Ang-2) в образце, взятом у пациента, где указанный способ включает контактирование анти-Ang-2 антитела с биологическим образцом, взятым у пациента, и детектирование уровня связывания указанного антитела с Ang-2 в указанном образце. В более конкретных вариантах изобретения, указанным биологическим образцом является кровь.
В других своих вариантах, настоящее изобретение относится к композициям, включающим антитело или его функциональный фрагмент и фармацевтически приемлемый носитель.
В других своих вариантах, настоящее изобретение относится к способам эффективного лечения животного, страдающего заболеванием, ассоциированным с ангиогенезом, где указанные способы включают выбор животного, нуждающегося в лечении опухолевого или не-опухолевого заболевания, и введение указанному животному терапевтически эффективной дозы полностью человеческого моноклонального антитела, которое специфически связывается с ангиопоэтином-2 (Ang-2).
Ассоциированными с ангиогенезом заболеваниями, поддающимися лечению, могут быть опухолевые заболевания, такие как меланома, мелкоклеточный рак легких, не-мелкоклеточный рак легких, глиома, гепатоцеллюлярная карцинома (печени), опухоль щитовидной железы, рак желудочно-кишечного тракта (желудка), рак предстательной железы, рак молочной железы, рак яичника, рак мочевого пузыря, рак легких, глиобластома, рак эндометрия, рак почек, рак толстой кишки, рак поджелудочной железы, карцинома пищевода, рак головы и шеи, мезотелиома, саркомы, билиарная холангиокарцинома, аденокарцинома тонкой кишки, злокачественные опухоли у детей и плоскоклеточная карцинома.
В других своих вариантах, настоящее изобретение относится к способам ингибирования индуцированного ангиопоэтином-2 (Ang-2) ангиогенеза у животных. Такие способы включают выбор животного, нуждающегося в лечении Ang-2-индуцированного ангиогенеза, и введение указанному животному терапевтически эффективной дозы полностью человеческого моноклонального антитела, где указанное антитело специфически связывается с Ang-2.
В других своих вариантах, настоящее изобретение относится к применению антитела для приготовления лекарственного средства для лечения ассоциированных с ангиогенезом заболеваний у животного, где указанное моноклональное антитело специфически связывается с ангиопоэтином-2 (Ang-2). Ассоциированными с ангиогенезом заболеваниями, поддающимися лечению, могут быть опухолевые заболевания, такие как меланома, мелкоклеточный рак легких, не-мелкоклеточный рак легких, глиома, гепатоцеллюлярная карцинома (печени), опухоль щитовидной железы, рак желудочно-кишечного тракта (желудка), рак предстательной железы, рак молочной железы, рак яичника, рак мочевого пузыря, рак легких, глиобластома, рак эндометрия, рак почек, рак толстой кишки, рак поджелудочной железы, карцинома пищевода, рак головы и шеи, мезотелиома, саркомы, билиарная холангиокарцинома, аденокарцинома тонкой кишки, злокачественные опухоли у детей и плоскоклеточная карцинома.
В других вариантах изобретения, описанные здесь антитела могут быть использованы для приготовления лекарственного средства для эффективного лечения индуцированного ангиопоэтином-2 ангиогенеза у животного, где указанное моноклональное антитело специфически связывается с ангиопоэтином-2 (Ang-2).
В других описанных здесь вариантах, настоящее изобретение относится к моноклональным антителам, которые связываются с Ang-2 и влияют на функцию Ang-2. В других своих вариантах, настоящее изобретение относится к полностью человеческим антителам против Ang-2 и к препаратам антител против Ang-2, обладающим нужными и перспективными с терапевтической точки зрения свойствами, включая высокую аффинность связывания с Ang-2, способность к нейтрализации Ang-2 in vitro и in vivo и способность ингибировать Ang-2-индуцированный ангиогенез.
В предпочтительном варианте изобретения, описанные здесь антитела связываются с Ang-2 с очень высокими аффинностями (Kd). Так, например, человеческое, кроличье, мышиное, химерное или гуманизованное антитело обладают способностью связываться с Ang-2 с Kd, имеющим значения, но не ограничивающиеся ими, менее 10-5, 10-6, 10-7, 10-8, 10-9, 10-10, 10-11, 10-12, 10-13 или 10-14 М или любой интервал указанных значений, или любые значения в этом интервале. Аффинность и/или авидность могут быть измерены путем проведения анализа с использованием KinExA® и/или BIACORE®, как описано ниже.
В соответствии с этим, в одном из описанных здесь вариантов, настоящее изобретение относится к выделенным антителам или фрагментам этих антител, которые связываются с Ang-2. Как известно из уровня техники, такими антителами предпочтительно могут быть, например, поликлональные, олигоклональные, моноклональные, химерные, гуманизированные и/или полностью человеческие антитела. В других описанных здесь вариантах, настоящее изобретение также относится к клеткам, продуцирующим такие антитела.
В другом своем варианте, настоящее изобретение относится к полностью человеческому антителу, которое связывается с другими членами семейства, к которому принадлежит ангиопоэтин-2, включая, но не ограничиваясь ими, ангиопоэтин-1, ангиопоэтин-3 и ангиопоэтин-4. В другом своем варианте, настоящее изобретение относится к антителу, которое конкурирует с полностью человеческим антителом согласно изобретению за перекрестное связывание с Tie-2/Ang-2. В одном из вариантов изобретения, указанное антитело связывается с ангиопоэтином-2 и нейтрализует ангиопоэтин-2, а также связывается с ангиопоэтином-1 и нейтрализует ангиопоэтин-1.
Следует отметить, что варианты настоящего изобретения не ограничиваются какой-либо конкретной формой антитела или способом его генерирования или продуцирования. Так, например, анти-Ang-2 антителом может быть полноразмерное антитело (например, антитело, имеющее интактную человеческую Fc-область) или фрагмент антитела (например, Fab, Fab' или F(ab')2). Кроме того, указанное антитело может быть получено из гибридомы, которая секретирует такое антитело, или из рекомбинантно-полученной клетки, которая была трансформирована или трансфицирована геном или генами, кодирующими такое антитело.
Другие варианты настоящего изобретения включают выделенные молекулы нуклеиновой кислоты, кодирующие любые описанные здесь антитела; векторы, содержащие выделенные молекулы нуклеиновой кислоты; кодирующие анти-Ang-2 антитела; или клетку-хозяина, трансформированную любыми такими молекулами нуклеиновой кислоты. Кроме того, в одном из своих вариантов, настоящее изобретение относится к способу продуцирования анти-Ang-2 антитела путем культивирования клеток-хозяев в условиях, благоприятствующих экспрессии молекулы нуклеиновой кислоты и продуцированию антитела, а также последующему выделению такого антитела. Следует отметить, что варианты настоящего изобретения также включают любую молекулу нуклеиновой кислоты, которая кодирует антитело согласно изобретению или его фрагмент, включая последовательности нуклеиновой кислоты, оптимизированные для увеличения выходов антител или их фрагментов при трансфекции таких последовательностей в клетки-хозяева в целях продуцирования антител.
Другой вариант настоящего изобретения включает способ получения высокоаффинных антител против Ang-2 путем иммунизации млекопитающего человеческим Ang-2 или его фрагментом и одной или несколькими ортологичными последовательностями или их фрагментами.
Другие варианты изобретения основаны на генерировании и идентификации выделенных антител, которые специфически связываются с Ang-2. При заболеваниях, ассоциированных с ангиогенезом, таких как опухолевые заболевания, Ang-2 экспрессируется на повышенных уровнях. Ингибирование биологической активности Ang-2 может предотвращать Ang-2-индуцированный ангиогенез и другие желательные эффекты.
Другой вариант настоящего изобретения включает способ диагностики заболеваний или состояний, в которых антитело, полученное как описано в настоящей заявке, используется для детектирования уровня Ang-2 в образце, взятом у пациента. В одном из вариантов изобретения, образцом, взятым у пациента, является кровь или сыворотка крови. В других вариантах изобретения описаны способы идентификации факторов риска, диагностики заболевания и определения стадии заболевания, где указанные способы включают идентификацию сверхэкспресси Ang-2 с использованием анти-Ang-2 антител.
Другой вариант настоящего изобретения включает способ диагностики состояния, ассоциированного с экспрессией Ang-2 в клетках, посредством контактирования сыворотки или клетки с анти-Ang-2 антителом, с последующим детектированием присутствия Ang-2. Предпочтительными состояниями являются заболевания, ассоциированные с ангиогенезом, включая, но не ограничиваясь ими, опухолевые заболевания, такие как меланома, мелкоклеточный рак легких, не-мелкоклеточный рак легких, глиома, гепатоцеллюлярная карцинома (печени), глиобластома и карцинома щитовидной железы, желудка, предстательной железы, молочной железы, яичника, мочевого пузыря, легких, матки, почек, толстой кишки, поджелудочной железы, слюнных желез и ободочной кишки.
В другом своем варианте, настоящее изобретение включает аналитический набор для детектирования ангиопоэтина-2 и членов семейства ангиопоэтинов в тканях, клетках или физиологических жидкостях млекопитающих в целях скрининга на заболевания, ассоциированные с ангиогенезом. Указанный набор включает антитело, которое связывается с ангиопоэтином-2, и средство, являющееся индикатором реакции антитела с ангиопоэтином-2, если она происходит. Предпочтительным антителом является моноклональное антитело. В одном из вариантов изобретения, указанное антитело, связывающееся с Ang-2, является меченным. В другом варианте изобретения, указанным антителом является немеченное “первое” антитело, а указанный набор дополнительно включает средство для детектирования указанного “первого” антитела. В одном из вариантов изобретения, указанное средство включает меченное “второе” антитело, которым является антитело против иммуноглобулина. Предпочтительным антителом является антитело, меченное маркером, выбранным из группы, состоящей из флуорохрома, фермента, радионуклида и материала, который является непроницаемым для радиоактивного излучения.
Еще один вариант настоящего изобретения включает способы лечения заболеваний или состояний, ассоциированных с экспрессией Ang-2 у пациента, путем введения указанному пациенту эффективного количества анти-Ang-2 антитела. Анти-Ang-2 антитело может быть введено отдельно, либо оно может быть введено в комбинации с другими антителами или с химиотерапевтическим средством, или в комбинации с лучевой терапией. Так, например, смесь моноклональных, олигоклональных или поликлональных антител против Ang-2, которые блокируют ангиогенез, может быть введена в комбинации с лекарственным средством, которое, как было показано, непосредственно ингибирует пролиферацию опухолевых клеток. Указанный способ может быть осуществлен in vivo, а указанным пациентом, предпочтительно, является человек. В предпочтительном варианте изобретения, указанный способ включает лечение ассоциированных с ангиогенезом заболеваний, включая, но не ограничиваясь ими, опухолевые заболевания, такие как меланома, мелкоклеточный рак легких, не-мелкоклеточный рак легких, глиома, гепатоцеллюлярная карцинома (печени), глиобластома и карцинома щитовидной железы, желудка, предстательной железы, молочной железы, яичника, мочевого пузыря, легких, матки, почек, толстой кишки, поджелудочной железы, слюнных желез и ободочной кишки.
В другом своем варианте, настоящее изобретение относится к промышленному изделию, включающему контейнер. Такой контейнер включает композицию, содержащую анти-Ang-2 антитело, и вкладыш в упаковку или этикетку на этой упаковке, где указано, что данная композиция может быть использована для лечения ассоциированных с ангиогенезом заболеваний, характеризующихся сверхэкспрессией Ang-2.
В некоторых вариантах изобретения, пациенту вводят анти-Ang-2 антитело, а затем очищающий агент для удаления избыточного количества антитела из кровотока.
В другом своем варианте, настоящее изобретение относится к применению анти-Ang-2 антитела для приготовления лекарственного средства для лечения заболеваний, таких как заболевания, ассоциированные с ангиогенезом. В одном из вариантов изобретения, ассоциированными с ангиогенезом заболеваниями являются карциномы, такие как рак молочной железы, яичника, желудка, эндометрия, слюнных желез, легких, почек, толстой кишки, ободочной кишки, пищевода, щитовидной железы, поджелудочной железы, предстательной железы и мочевого пузыря. В другом варианте изобретения, ассоциированными с ангиогенезом заболеваниями являются, но не ограничиваются ими, опухолевые заболевания, такие как меланома, мелкоклеточный рак легких, не-мелкоклеточный рак легких, глиома, гепатоцеллюлярная карцинома (печени), саркома, рак головы и шеи, мезотелиома, билиарная холангиокарцинома, аденокарцинома тонкой кишки, злокачественные опухоли у детей и глиобластома.
Ang-2 представляет собой важный “переключатель" ангиогенеза. В соответствии с этим, предполагается, что подавление активности этой молекулы приводит к ингибированию патофизиологических процессов, а поэтому может служить эффективным средством для лечения различных ангиогенез-зависимых заболеваний. Помимо солидных опухолей и их метастазов, ангиогенез-зависимыми также являются злокачественные опухоли крови, такие как лейкозы, лимфомы и множественная миелома. Избыточный рост сосудов приводит к возникновению различных не-опухолевых расстройств. Такими не-опухолевыми ангиогенез-зависимыми заболеваниями являются: атеросклероз, гемангиома, гемангиоэндотелиома, ангиофиброма, нарушение развития сосудов (например, наследственная геморрагическая телеангиэктазия (НГТ) или синдром Ослера-Вебера), бородавки, пиогенные гранулемы, избыточный рост волос, саркома Капоши, келоидные рубцы, аллергический отек, псориаз, дисфункциональные маточные кровотечения, фолликулярные кисты, гиперстимуляция яичника, эндометриоз, респираторный дистресс-синдром, асцит, перитониальный склероз у пациента, подвергаемого диализу, образование спаек после хирургической операции на брюшной полости, ожирение, ревматоидный артрит, синовит, остеомиелит, избыточный рост паннуса, остеофит, гемофилическая артропатия, воспалительные и инфекцирнные процессы (например, гепатит, пневмония, гломерулонефрит), астма, полипы в носовой полости, регенерация печени, легочная гипертензия, ретинопатия недоношенных, диабетическая ретинопатия, возрастная дегенерация желтого пятна, лейкомаляция, неоваскулярная глаукома, неоваскуляризация трансплантата роговицы, трахома, тиреоидит, увеличение щитовидной железы и лимфопролиферативные расстройства.
Краткое описание графического материала
На фигуре 1 показан вестерн-блот-анализ, который показал, что mAb против Ang-2 ингибируют Ang-2-индуцированное фосфорилирование Tie-2, эктопически экспрессированного в клетках HEK293F.
На фигуре 2 представлена линейная кривая дозозависимого ингибирующего действия моноклональных анти-Ang-2 антител на Ang-2-индуцированное фосфорилирование Tie-2.
На фигуре 3 представлена линейная кривая, иллюстрирующая дозозависимое ингибирование связывания Ang-1 (верхний график) и Ang-2 (нижний график) с Tie-2, в присутствии mAb 3.19.3 или Tie-2/Fc.
На фигуре 4 показан вестерн-блот-анализ, иллюстрирующий ингибирование стимулированного ангиопоэтином-1 фосфорилирования Tie-2 в эндотелиальных клетках Eahy 926 под действием mAb 3.19.3. В этой системе наблюдается ингибирование индуцированного ангиопоэтином-1 фосфорилирования Tie-2. Концентрации антител представлены в нМ.
На фигуре 5 представлена линейная кривая, иллюстрирующая ингибирование стимулированного ангиопоэтином-1 фосфорилирования Tie-2 в эндотелиальных клетках Eahy 926 под действием mAb 3.19.3. IC50=99 нМ. Ось x представляет концентрацию mAb 3.19.3, а ось y представляет ответ.
На фигуре 6 схематически представлена диаграмма структуры человеческих белков Ang-2 и Ang-2443. Верхние цифры означают аминокислотные последовательности (эта диаграмма была взята из публикации Injune et al., (2000) JBC 275: 18550).
На фигуре 7 показана аминокислотная последовательность химерной молекулы мышь/человек (SEQ ID NO: 1). Человеческие остатки (клонированные в виде StuI-TfiI-фрагмента) 310-400 подчеркнуты.
На фигуре 8 показано сравнение аминокислотных последовательностей белков человеческого Ang-1 (SEQ ID NO: 2), человеческого Ang-2 (SEQ ID NO: 3) и мышиного Ang-2 (SEQ ID NO: 4). Сайты присоединения химерных молекул Ang-2 и точковые мутации обозначены жирным шрифтом.
На фигуре 9 показано сравнение аминокислотных последовательностей мышиного Ang-1 (SEQ ID NO: 5), человеческого Ang-1 (SEQ ID NO: 2), мышиного Ang-2 (SEQ ID NO: 4) и человеческого Ang-2 (SEQ ID NO: 3). Стрелки указывают на сайт отщепления для гидрофобных лидерных последовательностей. Эти стрелки определяют пределы суперcпирализованных и фибриноген-подобных доменов. Заштрихованные кружки означают консервативные цистеиновые остатки (этот график был взят из публикации Maisonpierre et al., 1997, Science 277:55).
На фигуре 10 представлена линейная кривая, иллюстрирующая дозозависимую перекрестную реактивность у мышей. Также показаны клоны моноклональных антител 5.2.1, 5.28.1, 3.19.3 и 3.31.2.
На фигуре 11 представлена линейная кривая, иллюстрирующая дозозависимое ингибирование связывания человеческого (черные треугольники) и мышиного (черные квадраты) Ang-2 с человеческим Tie-2 в присутствии mAb 3.19.3.
На фигуре 12 представлена гистограмма, иллюстрирующая анализ влияния антител на ангиогенез, индуцированный клетками MCF-7. На фигуре 12A продемонстрировано влияние анти-Ang-2 антител на число сосудистых ответвлений, где на оси x указаны экспериментальные группы, а на оси y указано среднее число сосудистых ответвлений (± ср.кв.от.). На фигуре 12B продемонстрировано влияние анти-Ang-2 антител на длину кровеносных сосудов, где на оси x указаны экспериментальные группы, а на оси y указана средняя длина кровеносных сосудов (± ср.кв.от.).
На фигуре 13 представлена линейная кривая, иллюстрирующая противоопухолевый эффект клона 3.19.3, моноклонального анти-Ang-2 антитела, проанализированный на мышиной модели ксенотрансплантата человеческой плоскоклеточной карциномы кожи с использованием клеточной линии A431. На оси x указано число дней после имплантации опухолевых клеток, а на оси у указан средний объем опухоли (± ср.кв.от. в см3). Черные треугольники обозначают объем опухоли, измеренный после имплантации опухолевых клеток мышам, которым был инъецирован клон 3.19.3 моноклонального анти-Ang-2 антитела; а черные кружки обозначают объем опухоли, измеренный после имплантации опухолевых клеток мышам, которым было инъецировано контрольное антитело изотипа PKl 6.3.1.
На фигуре 14А представлена линейная кривая, иллюстрирующая предотвращение роста опухоли в модели ксенотрансплантата человеческой аденокарциномы LoVo с указанным размером опухоли у мышей, обработанных 0,5, 2 и 10 мг/кг антитела или антитела контрольного изотипа. На оси x указано число дней после имплантации опухолевых клеток, а на оси у указан средний объем опухоли (± ср.кв.от. в см3). На фигуре 14B представлена линейная кривая, иллюстрирующая эффект ингибирования роста опухоли под действием mAb в модели ксенотрансплантата человеческой аденокарциномы толстой кишки SW480.
На фигуре 15A представлена линейная кривая, иллюстрирующая предотвращение роста опухоли в модели ксенотрансплантата НТ29. На оси x указано число дней после имплантации опухолевых клеток, а на оси у указан средний объем опухоли (± ср.кв.от. в см3). На фигуре 15В представлена линейная кривая, иллюстрирующая предотвращение роста опухоли в модели ксенотрансплантата Calu-6, где для мышей, обработанных 10 мг/кг клона mAb 3.3.2 или 3.19.3 или контрольным изотипом антитела, указан размер опухоли. На фигуре 15С представлена линейная кривая, иллюстрирующая плотность CD31+-окрашивания опухолей у мышей, имеющих опухоль MDA-MB-231 и обработанных контрольным IgG или 10 мг/кг 3.19.3 mAb. Представлены также результаты, полученные путем вычисления пороговым методом и методом ручного подсчета с использованием координатной сетки.
Подробное описание изобретения
Описанные здесь варианты осуществления настоящего изобретения относятся к моноклональным антителам, которые связываются с Ang-2. В некоторых вариантах изобретения, указанные антитела связываются с Ang-2 и ингибируют связывание Ang-2 с его рецептором, Tie-2. В других своих вариантах, настоящее изобретение относится к полностью человеческим анти-Ang-2 антителам и к препаратам антител, которые могут быть использованы в терапевтических целях. Такие препараты анти-Ang-2 антител, предпочтительно, обладают желательными терапевтическими свойствами, включая высокую аффинность связывания с Ang-2, способность нейтрализовать Ang-2 in vitro и способность ингибировать Ang-2-индуцированный ангиогенез in vivo.
В одном из своих вариантов, настоящее изобретение относится к антителу, которое связывается с Ang-2 и нейтрализует Ang-2, но не связывается с Ang-1. В другом варианте изобретения, указанное антитело связывается с Ang-2 и Ang-1, но нейтрализует только Ang-2. В другом варианте изобретения, антитело связывается с обоими Ang-2 и Ang-1 и нейтрализует связывание обоих Ang-1 и Ang-2 с Tie-2.
Варианты настоящего изобретения также включают выделенные связывающие фрагменты анти-Ang-2 антител. Такие связывающие фрагменты, предпочтительно, получают из полноразмерных человеческих анти-Ang-2 антител. Иллюстрированными фрагментами являются Fv, Fab' или другие известные фрагменты антител, которые более подробно будут описаны ниже. Варианты настоящего изобретения также включают клетки, экспрессирующие полноразмерные человеческие антитела против Ang-2. Примерами таких клеток являются гибридомы или клетки, созданные рекомбинантными методами, такие как клетки яичника китайского хомячка (CHO), варианты клеток CHO (например, DG44) и клетки NSO, продуцирующие антитела против Ang-2. Дополнительную информацию о вариантах клеток CHO можно найти в публикации Andersen and Reilly (2004) Current Opinion in Biotechnology 15, 456-462, которая во всей своей полноте вводится в настоящее описание посредством ссылки.
Кроме того, в других своих вариантах, настоящее изобретение относится к способам применения указанных антител для лечения заболеваний. Анти-Ang-2 антитела могут быть использованы для предупреждения Ang-2-опосредуемой передачи сигнала Tie-2 и, тем самым, для ингибирования ангиогенеза. Механизм действия такого ингибирования может включать ингибирование связывания Ang-2 с его рецептором, Tie-2; ингибирование Ang-2-индуцированной передачи сигнала Tie-2; или усиленный клиренс Ang-2, приводящий к снижению эффективной концентрации Ang-2, связывающегося с Tie-2. Заболеваниями, которые поддаются лечению посредством такого механизма ингибирования, являются, но не ограничиваются ими, опухолевые заболевания, такие как меланома, мелкоклеточный рак легких, не-мелкоклеточный рак легких, глиома, гепатоцеллюлярная карцинома (печени), глиобластома, а также рак и опухоли щитовидной железы, желудка, предстательной железы, молочной железы, яичника, мочевого пузыря, легких, матки, почек, толстой кишки, поджелудочной железы, слюнных желез и ободочной кишки.
Другие варианты настоящего изобретения включают диагностические анализы, в частности, для определения количества Ang-2 в биологическом образце. Набор для анализа может включать анти-Ang-2 антитела вместе с необходимыми метками для детектирования таких антител. Такие диагностические анализы могут быть применены для скрининга на ассоциированные с ангиогенезом заболевания, включая, но не ограничиваясь ими, опухолевые заболевания, такие как меланома, мелкоклеточный рак легких, не-мелкоклеточный рак легких, глиома, гепатоцеллюлярная карцинома (печени), глиобластома и карцинома щитовидной железы, желудка, предстательной железы, молочной железы, яичника, мочевого пузыря, легких, матки, почек, толстой кишки, поджелудочной железы, слюнных желез и ободочной кишки.
В соответствии с одним из своих аспектов, настоящее изобретение относится к антагонисту биологической активности ангиопоэтина-1 и ангиопоэтина-2, где указанный антагонист не связывается с ATP-связывающим сайтом Tie-2.
В соответствии с другим своим аспектом, настоящее изобретение относится к антагонисту биологической активности ангиопоэтина-1 и ангиопоэтина-2, где указанный антагонист связывается ангиопоэтином-1 и ангиопоэтином-2.
В соответствии с другим своим аспектом, настоящее изобретение относится к антагонисту биологической активности ангиопоэтина-1 и ангиопоэтина-2, где указанный антагонист не является соединением.
В одном из своих вариантов, настоящее изобретение относится к антагонисту биологической активности ангиопоэтина-1 и ангиопоэтина-2, где указанная антагонистическая активность, направленная против ангиопоэтина-1, и указанная антагонистическая активность, направленная против ангиопоэтина-2, заключены в одной молекуле. В своем альтернативном варианте, настоящее изобретение относится к антагонисту, где указанная антагонистическая активность против ангиопоэтина-1 и указанная антагонистическая активность против ангиопоэтина-2 заключены в более чем одной молекуле.
В одном из своих вариантов, настоящее изобретение относится к антагонисту биологической активности ангиопоэтина-1 и ангиопоэтина-2, где указанный антагонист может связываться:
i) с рецептором Tie-2;
ii) с ангиопоэтином-1 и/или с ангиопоэтином-2;
iii) с комплексом “рецептор Tie-2 - ангиопоэтин-1”; или
iv) с комплексом “рецептор Tie-2 - ангиопоэтин-2”; или
с любыми их комбинациями.
В одном из вариантов изобретения, антагонист биологической активности ангиопоэтина-1 и ангиопоэтина-2 может связываться с ангиопоэтином-1 и/или с ангиопоэтином-2 и/или с Tie-2 и, тем самым, предотвращать опосредуемую ангиопоэтином-1 и ангиопоэтином-2 передачу сигнала Tie-2 и ингибировать ангиогенез. Механизм действия такого ингибирования может включать:
i) связывание антагониста с ангиопоэтином-1 и ингибирование связывания ангиопоэтина-1 с его рецептором, Tie-2, и/или
ii) связывание антагониста с ангиопоэтином-2 и ингибирование связывания ангиопоэтина-2 с его рецептором, Tie-2, и/или
iii) усиление клиренса ангиопоэтина-1 и/или ангиопоэтина-2 и, тем самым, снижение эффективной концентрации ангиопоэтина-1 и/или ангиопоэтина-2, доступной для связывания с Tie-2, или
любую их комбинацию, достаточную для подавления биологической активности ангиопоэтина-1 и ангиопоэтина-2.
Не претендуя на какие-либо теоретические выводы, следует отметить, что механизмами, посредством которых может быть осуществлено ингибирование биологической активности ангиопоэтина-1 и ангиопоэтина-2, являются, но не ограничиваются ими, ингибирование связывания ангиопоэтина-1 и ангиопоэтина-2 с рецептором Tie-2; ингибирование индуцированной ангиопоэтином-1 и ангиопоэтином-2 передачи сигнала Tie-2, или усиления клиренса ангиопоэтина-1 и ангиопоэтина-2 и, тем самым, снижение эффективной концентрации ангиопоэтина-1 и ангиопоэтина-2.
В одном из своих вариантов, настоящее изобретение относится к антагонисту биологической активности ангиопоэтина-1 и ангиопоэтина-2, где указанным антагонистом является антитело. Предпочтительно, указанное антитело обладает способностью ингибировать биологическую активность ангиопоэтина-1 и/или ангиопоэтина-2 in vitro и in vivo. Предпочтительным антителом является поликлональное антитело или моноклональное антитело. Более предпочтительным антителом является моноклональное антитело, а еще более предпочтительным антителом является полностью человеческое моноклональное антитело. Наиболее предпочтительным антителом является полностью человеческое моноклональное антитело 3.19.3.
В одном из своих вариантов, настоящее изобретение относится к антителу, которое связывается с тем же эпитопом или с теми же эпитопами, что и полностью человеческое моноклональное антитело 3.19.3.
В одном из своих вариантов, настоящее изобретение относится к полностью человеческому антителу, которое связывается с ангиопоэтином-1 и предотвращает связывание ангиопоэтина-1 с Tie-2. В другом своем варианте, настоящее изобретение относится к полностью человеческому моноклональному антителу, которое связывается с ангиопоэтином-1 и ингибирует индуцированное ангиопоэтином-1 фосфорилирование Tie-2. В одном из вариантов изобретения, указанное антитело связывается с ангиопоэтином-1 с Кd, составляющим менее чем 1 наномоль (нМ). Более предпочтительно, указанное антитело связывается с Кd, составляющим менее чем 500 пикомоль (пМ). Более предпочтительно, указанное антитело связывается с Кd, составляющим менее чем 100 пикомоль (пМ). Еще более предпочтительно, указанное антитело связывается с Кd, составляющим менее чем 30 пикомоль (пМ). Еще более предпочтительно, указанное антитело связывается с Кd, составляющим менее чем 20 пМ. И наиболее предпочтительно, указанное антитело связывается с Кd, составляющим менее чем 10 или 5 пМ.
В одном из своих вариантов, настоящее изобретение относится к полностью человеческому антителу, которое связывается с ангиопоэтином-2 и предотвращает связывание ангиопоэтина-2 с Tie-2. В другом своем варианте, настоящее изобретение относится к полностью человеческому моноклональному антителу, которое связывается с ангиопоэтином-2 и ингибирует индуцированное ангиопоэтином-2 фосфорилирование Tie-2. В одном из вариантов изобретения, указанное антитело связывается с ангиопоэтином-1 с Кd, составляющим менее чем 1 наномоль (нМ). Более предпочтительно, указанное антитело связывается с Кd, составляющим менее чем 500 пикомоль (пМ). Более предпочтительно, указанное антитело связывается с Кd, составляющим менее чем 100 пикомоль (пМ). Еще более предпочтительно, указанное антитело связывается с Кd, составляющим менее чем 30 пикомоль (пМ). Еще более предпочтительно, указанное антитело связывается с Кd, составляющим менее чем 20 пМ. И наиболее предпочтительно, указанное антитело связывается с Кd, составляющим менее чем 10 или 5 пМ.
В одном из своих вариантов, настоящее изобретение относится к гибридоме, продуцирующей легкую цепь и/или тяжелую цепь антитела, описанные выше. Предпочтительно, указанная гибридома продуцирует легкую цепь и/или тяжелую цепь полностью человеческого моноклонального антитела. Более предпочтительно, указанная гибридома продуцирует легкую цепь и/или тяжелую цепь полностью человеческого моноклонального антитела 3.19.3, 3.3.2 или 5.88.3. Альтернативно, указанная гибридома продуцирует антитело, которое связывается с тем же эпитопом или с теми же эпитопами, что и полностью человеческое моноклональное антитело 3.19.3, 3.3.2 или 5.88.3.
В одном из своих вариантов, настоящее изобретение относится к молекуле нуклеиновой кислоты, кодирующей легкую цепь или тяжелую цепь антитела, описанного выше. Предпочтительно, настоящее изобретение относится к молекуле нуклеиновой кислоты, кодирующей легкую цепь или тяжелую цепь полностью человеческого моноклонального антитела. Более предпочтительно, настоящее изобретение относится к молекуле нуклеиновой кислоты, кодирующей легкую цепь или тяжелую цепь полностью человеческого моноклонального антитела 3.19.3.
В одном из своих вариантов, настоящее изобретение относится к вектору, содержащему молекулу или молекулы нуклеиновой кислоты, описанные выше, где указанный вектор кодирует легкую цепь и/или тяжелую цепь антитела, определенного выше.
В одном из своих вариантов, настоящее изобретение относится к клетке-хозяину, содержащей вектор, описанный выше. Альтернативно, указанная клетка-хозяин может содержать более чем один вектор.
Кроме того, в одном из своих вариантов, настоящее изобретение относится к способу получения антитела путем культивирования клеток-хозяев в условиях, которые благоприятствуют экспрессии молекулы нуклеиновой кислоты, продуцированию указанного антитела и последующему его выделению.
В одном из своих вариантов, настоящее изобретение относится к способу получения антитела, включающему трансфекцию, по меньшей мере, одной клетки-хозяина, по меньшей мере, одной молекулой нуклеиновой кислоты, кодирующей описанное выше антитело; экспрессию указанной молекулы нуклеиновой кислоты в указанной клетке-хозяине; и выделение указанного антитела.
В соответствии с другим своим аспектом, настоящее изобретение относится к способу ингибирования биологической активности ангиопоэтина-1 и ангиопоэтина-2, включающему введение описанного выше антагониста. Указанный способ может включать выбор животного, нуждающегося в предотвращении у него ассоциированного с заболеванием ангиогенеза, и введение указанному животному терапевтически эффективной дозы антагониста биологической активности ангиопоэтина-1 и ангиопоэтина-2.
В соответствии с другим своим аспектом, настоящее изобретение относится к способу ингибирования биологической активности ангиопоэтина-1 и ангиопоэтина-2, включающему введение описанного выше антитела. Указанный способ может включать выбор животного, нуждающегося в предотвращении у него ассоциированного с заболеванием ангиогенеза, и введение указанному животному терапевтически эффективной дозы антитела, ингибирующего биологическую активность ангиопоэтина-1 и ангиопоэтина-2.
В соответствии с другим своим аспектом, настоящее изобретение относится к способу предотвращения ассоциированного с заболеванием ангиогенеза у млекопитающего, включающему введение терапевтически эффективного количества антагониста биологической активности ангиопоэтина-1 и ангиопоэтина-2. Указанный способ может включать выбор животного, нуждающегося в предотвращении у него ассоциированного с заболеванием ангиогенеза, и введение указанному животному терапевтически эффективной дозы антагониста биологической активности ангиопоэтина-1 и ангиопоэтина-2.
В соответствии с другим своим аспектом, настоящее изобретение относится к способу предотвращения ассоциированного с заболеванием ангиогенеза у млекопитающего, включающему введение терапевтически эффективного количества антитела, ингибирующего биологическую активность ангиопоэтина-1 и ангиопоэтина-2. Указанный способ может включать выбор животного, нуждающегося в предотвращении ассоциированного с заболеванием ангиогенеза, и введение указанному животному терапевтически эффективной дозы антитела, ингибирующего биологическую активность ангиопоэтина-1 и ангиопоэтина-2. Указанное антитело может быть введено отдельно, либо оно может быть введено в комбинации с другими антителами или с химиотерапевтическим средством, или с лучевой терапией.
В соответствии с другим своим аспектом, настоящее изобретение относится к способу лечения рака у млекопитающего, включающему введение терапевтически эффективного количества антагониста биологической активности ангиопоэтина-1 и ангиопоэтина-2. Указанный способ может включать выбор животного, нуждающегося в лечении рака, и введение указанному животному терапевтически эффективной дозы антагониста биологической активности ангиопоэтина-1 и ангиопоэтина-2. Указанный антагонист может быть введен отдельно, либо он может быть введен в комбинации с другими антителами или с химиотерапевтическим средством, или с лучевой терапией.
В соответствии с другим своим аспектом, настоящее изобретение относится к способу лечения рака у млекопитающего, включающему введение терапевтически эффективного количества антитела, ингибирующего биологическую активность ангиопоэтина-1 и ангиопоэтина-2. Указанный способ может включать выбор животного, нуждающегося в лечении рака, и введение указанному животному терапевтически эффективной дозы антитела, ингибирующего биологическую активность ангиопоэтина-1 и ангиопоэтина-2. Указанное антитело может быть введено отдельно или в комбинации с другими антителами, либо в комбинации с химиотерапевтическим средством или с лучевой терапией.
В соответствии с другим своим аспектом, настоящее изобретение относится к применению антагониста биологической активности ангиопоэтина-1 и ангиопоэтина-2 для приготовления лекарственного средства для лечения ассоциированного с заболеванием ангиогенеза.
В соответствии с другим своим аспектом, настоящее изобретение относится к применению антитела, ингибирующего биологическую активность ангиопоэтина-1 и ангиопоэтина-2, для приготовления лекарственного средства для лечения ассоциированного с заболеванием ангиогенеза.
В предпочтительном варианте, настоящее изобретение может быть, в частности, применено для ингибирования ангиопоэтина-1 или ангиопоэтина-2 у пациентов с опухолью, которое зависит только или частично от рецептора Tie-2.
В другом своем варианте, настоящее изобретение включает аналитический набор для детектирования ангиопоэтина-1 и/или ангиопоэтина-2 в тканях, клетках или в физиологических жидкостях млекопитающих в целях скрининга на заболевания, ассоциированные с ангиогенезом. Указанный набор включает антитело, которое связывается с ангиопоэтином-1 и/или ангиопоэтином-2, и средство, являющееся индикатором реакции антитела с ангиопоэтином-1 и/или ангиопоэтином-2, если она происходит. Указанным антителом может быть моноклональное антитело. В одном из вариантов изобретения, антитело, которое связываются с Ang-2, является меченным. В другом варианте изобретения, указанным антителом является немеченное “первое” антитело, а указанный набор также включает средство для детектирования указанного “первого” антитела. В одном из вариантов изобретения, указанное средство включает меченное “второе” антитело, которым является антитело против иммуноглобулина. Предпочтительным антителом является антитело, меченное маркером, выбранным из группы, состоящей из флуорохрома, фермента, радионуклида и материала, который является непроницаемым для радиоактивного излучения.
Другие варианты, отличительные признаки и т.п., относящиеся к анти-Ang-2 антителам, более подробно описаны ниже.
Список последовательностей
Варианты настоящего изобретения включают специфические анти-Ang-2 антитела, перечисленные ниже в таблице 1. В этой таблице указан идентификационный номер каждого анти-Ang-2 антитела вместе с идентификационным номером (SEQ ID) генов соответствующей тяжелой цепи и легкой цепи.
Каждому антителу был присвоен идентификационный номер, который включает два или три числа, разделенные точкой, обычно используемой в десятичных числах. Для большинства антител приводится только два идентификационных номера, разделенных точками.
Однако в некоторых случаях было получено несколько клонов одного антитела. Хотя эти клоны имеют нуклеотидные последовательности и аминокислотные последовательности, идентичные соответствующим исходным последовательностями, однако, они могут быть также представлены отдельно, при этом номер клона указан числом, находящимся справа от второй разделяющей точки. Так, например, последовательности нуклеиновой кислоты и аминокислотные последовательности антитела 5.35 идентичны последовательностям антител 5.35.1, 5.35.2 и 5.35.3.
Определения
Если это не оговорено особо, то используемые здесь научные и технические термины имеют общепринятые значения, известные среднему специалисту в данной области. Кроме того, если это не очевидно из контекста описания, то существительные, употребляемые в единственном числе, могут означать и существительные во множественном числе, и наоборот. В общих чертах, номенклатура и способы, относящиеся к культивированию тканей, молекулярной биологии, химическим свойствам и к гибридизации белка и олиго- или полинуклеотидов, хорошо известны специалистам и широко применяются в данной области.
Стандартными методами являются методы рекомбинантных ДНК, олигонуклеотидный синтез и культивирование и трансформация тканей (например, электропорация, липофекция). Ферментативные реакции и методы очистки осуществляют в соответствии с инструкциями производителей или в соответствии со стандартными процедурами или процедурами, описанными в настоящей заявке. Вышеупомянутые процедуры обычно осуществляют стандартными методами, хорошо известными специалистам и описанными в различных общих и специальных руководствах, цитируемых и обсуждаемых в настоящем описании. См., например, руководство Sambrook et al. Molecular Cloning: A Laboratory Manual (3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y. (2001)), которое вводится в настоящее описание посредством ссылки. Используемая здесь номенклатура и лабораторные процедуры, и способы, относящиеся к аналитической химии, химии органического синтеза и медицинской и фармацевтической химии и описанные в настоящей заявке, хорошо известны специалистам и широко применяются в данной области. Для химического синтеза, химических анализов, приготовления фармацевтических препаратов, составления композиций, их доставки и лечения пациентов применяются стандартные методы.
В описании настоящего изобретения используются указанные ниже термины, которые, если это не оговорено особо, имеют значения, определенные ниже.
Антагонистом может быть полипептид, нуклеиновая кислота, углевод, липид, низкомолекулярное соединение, олигонуклеотид, олигопептид, интерферирующая РНК (иРНК), антисмысловая молекула, рекомбинантный белок, антитело или их конъюгаты или гибридные белки. Описание иРНК можно найти в публикации Milhavet O, Gary DS, Mattson MP. (Pharmacol Rev. 2003 Dec; 55(4):629-48. Review.), а описание антисмысловой молекулы можно найти в публикации Opalinska J.B., Gewirtz A.M. (Sci STKE. 2003 Oct 28; 2003(206):p.47.)
Ангиогенезом, ассоциированным с указанным заболеванием, может быть любой аномальный, нежелательный или патологический ангиогенез, например, опухолеассоциированный ангиогенез. Ассоциированными с ангиогенезом заболеваниями являются, но не ограничиваются ими, не-солидные опухоли, такие как лейкоз, множественная миелома или лимфома, а также солидные опухоли, такие как меланома, мелкоклеточный рак легких, не-мелкоклеточный рак легких, глиома, гепатоцеллюлярная карцинома (печени), карцинома, глиобластома, карцинома щитовидной железы, желчных протоков, кости, желудочно-кишечного тракта, головного мозга/ЦНС, головы и шеи, печени, желудка, предстательной железы, молочной железы, почек, яичек, яичника, кожи, шейки матки, легких, мышц, нервных клеток, пищевода, мочевого пузыря, легких, матки, вульвы, эндометрия, почек, ободочной кишки, поджелудочной железы, плевральных/перитонеальных мембран и слюнных желез, и плоскоклеточные опухоли.
Термин “соединение” означает любое низкомолекулярное соединение, молекулярная масса которого составляет менее чем примерно 2000 Дальтон.
Термин “Ang-2" означает молекулу ангиопоэтина-2.
Термин “нейтрализующий", относящийся к антителу, указывает на его способность элиминировать или значительно снижать активность антигена-мишени. В соответствии с этим, “нейтрализующее" анти-Ang-2 антитело обладает способностью устранять или значительно снижать активность Ang-2. Нейтрализующее анти-Аng-2 антитело может, например, действовать посредством блокирования связывания Ang-2 с его рецептором Tie-2. При блокировании такого связывания, Tie-2-опосредуемая передача сигнала значительно или полностью элиминируется. В идеальном случае, нейтрализующее антитело против Ang-2 ингибирует ангиогенез.
Используемый здесь термин “выделенный полинуклеотид” означает полинуклеотид, который был выделен из его окружающей среды. Такие полинуклеотиды могут быть геномными, кДНК или синтетическими. Выделенные полинуклеотиды, предпочтительно, не ассоциируются со всеми полинуклеотидами или с частью полинуклеотидов, с которыми они ассоциируются в природе. Выделенные полинуклеотиды могут быть функционально связаны к другому полинуклеотиду, с которым они не ассоциируются в природе. Кроме того, выделенные полинуклеотиды, предпочтительно, не встречаются в природе как часть более крупной последовательности.
Используемый здесь термин “выделенный белок" при температуре представляет собой общее понятие, означающее белок, который был выделен из его природного окружения. Такие белки могут быть продуцированы из геномной ДНК, кДНК, рекомбинантной ДНК, рекомбинантной РНК, либо они могут быть синтезированы или получены комбинацией тех и других способов, где указанный “выделенный белок”, по своему происхождению или источнику происхождения, (1) не ассоциируется с природными белками, (2) изолирован от других белков, происходящих от того же источника, например, от мышиных белков, (3) экспрессируется клетками различных типов или (4) не встречается в природе.
Используемый здесь термин "полипептид" представляет собой общее понятие, означающее нативный белок или фрагменты или аналоги полипептидной последовательности. Следовательно, природный белок, а также его фрагменты и аналоги представляют собой молекулы типа полипептидов. Предпочтительные полипептиды согласно изобретению включают молекулы тяжелой цепи человеческого иммуноглобулина и молекулы легкой каппа-цепи человеческого иммуноглобулина, а также молекулы антитела, образованные комбинациями, содержащими молекулы тяжелой цепи иммуноглобулина и молекулы легкой цепи иммуноглобулина, такие как молекулы легкой цепи каппа или лямбда иммуноглобулина, и наоборот, а также их фрагменты и аналоги. Предпочтительные полипептиды согласно изобретению могут также включать только молекулы тяжелой цепи человеческого иммуноглобулина или их фрагменты.
Используемый здесь термин “природный”, относящийся к определенному объекту, означает, что данный объект может существовать в природе. Так, например, полипептидная или полинуклеотидная последовательность, присутствующая в организме (включая вирусы), может считаться природной, если она выделена из ее природного источника, и если она не была специально модифицирована человеком в лабораторных или в каких-либо других условиях.
Используемый здесь термин “функционально связанный” относится к положениям описанных здесь компонентов, присоединенных друг к другу способом, обеспечивающим их “правильное” функционирование. Так, например, регуляторная последовательность, “функционально связанная” к кодирующей последовательности, связана с этой последовательностью так, чтобы могла осуществляться экспрессия кодирующей последовательности в условиях, пригодных для функционирования данных регуляторных последовательностей.
Используемый здесь термин “регуляторная последовательность" означает полинуклеотидные последовательности, необходимые для осуществления экспрессии и процессинга или для воздействия на экспрессию и процессинг кодирующих последовательностей, с которыми они связаны. Природа таких регуляторных последовательностей варьируется в зависимости от организма-хозяина; причем в прокариотах, такие регуляторные последовательности обычно включают промотор, сайт связывания с рибосомой и последовательность терминации транскрипции; а в эукариотах, такими регуляторными последовательностями обычно являются промоторы, энхансеры, интроны, последовательности терминации транскрипции, последовательности сигнала полиаденилирования и 5'- и 3'-нетранслируемые области. Термин “регуляторные последовательности" включает, как минимум, все компоненты, присутствие которых имеет важное значение для экспрессии и процессинга, а также он может включать дополнительные компоненты, присутствие которых является предпочтительным, например, лидерные последовательности, и последовательности, являющиеся партнерами для гибридных последовательностей.
Используемый здесь термин “полинуклеотид" означает полимерную форму нуклеотидной последовательности длиной, по меньшей мере, 10 нуклеотидов либо рибонуклеотидной или дезоксинуклеотидной последовательности, либо модифицированную форму, состоящую из нуклеотидов любого типа, либо из РНК-ДНК-гетеро-дуплексов. Этот термин включает одноцепочечные и двухцепочечные формы ДНК.
Используемый здесь термин “олигонуклеотид" означает природные и модифицированные нуклеотиды, связанные друг с другом природными и не-природными связями. Олигонуклеотиды представляют собой полинуклеотидную подпоследовательность, имеющую длину обычно в 200 нуклеотидов или менее. Предпочтительно, олигонуклеотиды имеют длину 10-60 нуклеотидов, а наиболее предпочтительно, длину в 12, 13, 14, 15, 16, 17, 18, 19 или 20-40 нуклеотидов. Обычно, олигонуклеотиды являются одноцепочечными, например, олигонуклеотиды, используемые в качестве зондов, хотя иногда они могут быть двухцепочечными, например, олигонуклеотиды, используемые для конструирования генных мутантов. Олигонуклеотиды могут быть смысловыми или антисмысловыми.
Используемый здесь термин “природные нуклеотиды” означает дезоксирибонуклеотиды и рибонуклеотиды. Используемый здесь термин “модифицированные нуклеотиды” означает нуклеотиды с модифицированными или с замещенными сахарными группами и т.п. Используемый здесь термин “олигонуклеотидные связи” включает такие олигонуклеотидные связи, как фосфортиоат, фосфордитиоат, фосфорселеноат, фосфордиселеноат, фосфоранилотиоат, фосфоранилидат, фосфорамидат и т.п. См., например, LaPlanche et al., Nucl. Acids. Res. 14:9081 (1986); Stec et al., J. Am. Chem. Soc. 106:6077 (1984); Stein et al., Nucl. Acids. Res. 16:3209 (1988); Zon et al., Anti-Cancer Drug Design 6:539 (1991); Zon et al., Oligonucleotides and Analogues: A Practical Approach, pp.87-108 (F.Eckstein Ed., Oxford University Press, Oxford England (1991)); Stec et al., патент США № 5151510; Uhlmann & Peyman Chemical Reviews, 90:543 (1990). Если необходимо, олигонуклеотид может включать метку для детекции.
Используемый здесь термин “селективная гибридизация” относится к детектируемому и специфическому связыванию. Полинуклеотиды, олигонуклеотиды и их фрагменты настоящего изобретения селективно гибридизуются с цепями нуклеиновой кислоты в таких условиях гибридизации и промывки, которые значительно минимизируют количество детектируемого связывания с неспецифическими нуклеиновыми кислотами. Для обеспечения селективной гибридизации, известной специалистам и обсуждаемой в настоящей заявке, могут быть использованы условия высокой жесткости. В общих чертах, гомология между последовательностями полинуклеотидов, олигонуклеотидов или фрагментов согласно изобретению и последовательностью представляющей интерес нуклеиновой кислоты составляет, по меньшей мере, 80%, а более предпочтительно, по меньшей мере, 85%, 90%, 95%, 99% и 100%.
Две аминокислотных последовательности являются гомологичными, если их последовательности являются частично или полностью идентичными. Так, например, 85%-ная гомология последовательностей означает, что при выравнивании этих двух последовательностей для сопоставления на их максимальное соответствие, 85% аминокислот являются идентичными. “Пробелы” (в любой из двух сопоставляемых последовательностей) позволяют максимизировать соответствие; при этом предпочтительная длина пробела составляет 5 аминокислот или менее, а более предпочтительно, 2 аминокислоты или менее. Альтернативно и предпочтительно, две последовательности белка (или полипептидные последовательности, происходящие от этих последовательностей и имеющие длину, по меньшей мере, в 30 аминокислот) считаются гомологичными в общепринятом смысле этого слова, если они имеют цену выравнивания более чем 5 (в единицах стандартного отклонения) при сопоставлении, осуществляемом с использованием программы ALIGN с матрицей данных по мутации и со штрафом за “пробел” 6 или более. (См. публикацию M.O. Dayhoff, Atlas of Protein Sequence and Structure, pp. 101-110 (Volume 5, National Biomedical Research Foundation, 1972)) и приложение 2 к этому тому (Supplement 2 to this volume, pp. 1-10). Две последовательности или их части являются более предпочтительными гомологами, если их аминокислоты идентичны на 50% или более при их оптимальном сопоставлении путем выравнивания с использованием программы ALIGN. Следует отметить, что в двух ортологичных последовательностях, могут присутствовать отличающиеся области гомологии. Так, например, функциональные сайты мышиных и человеческих ортологов могут иметь более высокую степень гомологии, чем не-функциональные области.
Используемый здесь термин “соответствует” означает, что полинуклеотидная последовательность является гомологичной (т.е. идентичной, но эволюционно неродственной) всей или части эталонной полинуклеотидной последовательности, либо этот термин означает, что данная полипептидная последовательность идентична эталонной полипептидной последовательности.
В противоположность этому, используемый здесь термин “комплементарный” означает, что комплементарная последовательность гомологична всей или части эталонной полинуклеотидной последовательности. Так, например, нуклеотидная последовательность “ТАТАС” соответствует эталонной последовательности “ТАТАС” и комплементарна последовательности “GТАТА”.
Для описания сходства между двумя или более полинуклеотидными или аминокислотными последовательностями используются следующие термины: “эталонная последовательность”, “окно сравнения”, “идентичность последовательностей”, “процент идентичности последовательностей” и “значительная идентичность”. Термин “эталонная последовательность” означает последовательность, которая используется в качестве основы для сравнения последовательностей; эталонная последовательность может представлять собой подпоследовательность более крупной последовательности, например, сегмент полноразмерной кДНК или генной последовательности, имеющейся в списке последовательностей, либо эта последовательность может содержать полноразмерную кДНК или генную последовательность. Вообще говоря, эталонная последовательность имеет длину, по меньшей мере, в 18 нуклеотидов или 6 аминокислот, обычно, по меньшей мере, 24 нуклеотида или 8 аминокислот, а чаще всего, по меньшей мере, 48 нуклеотидов или 16 аминокислот. Поскольку каждая из двух полинуклеотидных или аминокислотных последовательностей (1) может содержать последовательность (то есть часть полноразмерной полинуклеотидной или аминокислотной последовательности), которая является сходной у этих двух молекул, и (2) может, кроме того, содержать последовательность, которая отличается у этих двух полинуклеотидных или аминокислотных последовательностей, то сравнение последовательностей двух (или более) молекул обычно осуществляют путем сопоставления последовательностей этих двух молекул по “окну сравнения” для идентификации и сравнения локальных областей гомологии последовательностей. Используемый здесь термин “окно сравнения” означает концептуальный сегмент, состоящий, по меньшей мере, из 18 смежных нуклеотидов или из 6 аминокислот, где полинуклеотидная последовательность или аминокислотная последовательность могут сравниваться с эталонной последовательностью, состоящей, по меньшей мере, из 18 смежных нуклеотидов или из 6 аминокислот, и где часть полинуклеотидной последовательности в окне сравнения может содержать добавления, делеции, замены и т.п. (то есть пробелы), которые составляют 20 процентов или менее по сравнению с эталонной последовательностью (которая не содержит добавлений или делеций) и которые используются для оптимального выравнивания этих двух последовательностей. Оптимальное выравнивание последовательностей, осуществляемое для их сопоставления по окну сравнения, может быть осуществлено с использованием алгоритма локальной гомологии (Smith and Waterman Adv. Appl. Math. 2:482 (1981)), алгоритма выравнивания областей гомологии (Needleman and Wunsch, J. Mol. Biol. 48:443 (1970)), методом поиска сходства (Pearson and Lipman, Proc. Natl. Acad. Sci. (USA) 85:2444 (1988)) путем компьютерной реализации этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в Wisconsin Genetics Software Package Release 7.0 (Genetics Computer Group, 575 Science Dr., Madison, Wis.), GENEWORKSТМ или пакеты программ MACVECTOR®) или с использованием программы контроля и построения наилучшего выравнивания (то есть получения наиболее высокого процента гомологии по “окну сравнения”), достигаемого различными методами.
Термин “идентичность последовательностей” означает, что две полинуклеотидные или аминокислотные последовательности являются идентичными (то есть на нуклеотидном или аминокислотном уровне) в окне сравнения. Термин “процент идентичности последовательностей” означает процент, который вычисляют путем сравнения двух оптимально выравниваемых последовательностей по окну сравнения; определения числа положений идентичных оснований нуклеиновых кислот (например, А, Т, С, G, U или I) или остатков в обеих последовательностях с получением числа соответствующих положений; деления этого числа соответствующих положений на общее число положений в окне сравнения (то есть на размер окна); и умножения полученного результата на 100 с получением процента идентичности последовательностей. Используемый здесь термин “значительная идентичность” означает характеристику полинуклеотидной или аминокислотной последовательности, где указанный полинуклеотид или указанная аминокислота составляют последовательность, которая, по меньшей мере, на 85%, предпочтительно, по меньшей мере, на 90-95%, а более предпочтительно, по меньшей мере, на 99% идентична эталонной последовательности в окне сравнения, составляющем, по меньшей мере, 18 нуклеотидов (6 аминокислот), а часто в окне сравнения, составляющем, по меньшей мере, 24-48 нуклеотидов (8-16 аминокислот), где процент идентичности последовательностей вычисляют путем сравнения эталонной последовательности с последовательностью, которая может включать делеции или добавления, которые в целом составляют 20 процентов или менее по сравнению с эталонной последовательностью в окне сравнения. Эталонная последовательность может представлять собой подпоследовательность более крупной последовательности.
Используемые здесь двадцать главных аминокислот имеют общепринятые аббревиатуры. См. публикацию Immunology - A Synthesis (2nd Edition, E.S. Golub and D.R Gren. Eds., Sinauer Associates, Sunderland, Mass. (1991)), которая вводится в настоящее описание посредством ссылки. Стереоизомеры (например, D-аминокислоты) двадцати главных аминокислот, неприродных аминокислот, таких как α,α-дизамещенные аминокислоты; N-алкил-замещенных аминокислот, молочной кислоты и других редких аминокислот могут также служить подходящими компонентами полипептидов согласно изобретению. Примерами редких аминокислот являются: 4-гидроксипролин, γ-карбоксиглутамат, ε-N,N,N-триметиллизин, ε-N-ацетиллизин, О-фосфосерин, N-ацетилсерин, N-формилметионин, 3-метилгистидин, 5-гидроксилизин, σ-N-метиларгинин и другие аналогичные аминокислоты и иминокислоты (например, 4-гидроксипролин). В используемой здесь системе обозначения полипептидов, в соответствии с общепринятой практикой и с принятым соглашением о терминологии, левый конец аминокислоты называется амино-концом, а правый конец аминокислоты называется карбокси-концом.
Аналогичным образом, если это не оговорено особо, левым концом одноцепочечных полинуклеотидных последовательностей является 5'-конец, а направлением слева направо для двухцепочечных полинуклеотидных последовательностей считается 5'-направление (5' →). Направление присоединения растущих РНК-транскриптов 5' → 3' называется направлением транскрипции, при этом области последовательностей на ДНК-цепи, имеющей такую же последовательность, как и РНК-цепь, которые находятся со стороны 5'-конца по отношению к 5'-концу РНК-транскрипта, называются “предшествующими последовательностями (то есть расположенными выше по ходу транскрипции)”, а области последовательностей на ДНК-цепи, имеющей такую же последовательность, как и РНК-цепь, которые находятся со стороны 3'-конца по отношению к 3'-концу РНК-транскрипта, называются “последующими последовательностями (то есть расположенными ниже по ходу транскрипции)”.
Термин “в основном, идентичный”, используемый по отношению к полипептидам, означает, что две пептидных последовательности, при их оптимальном выравнивании, например, с помощью программ GAP или BESTFIT с использованием “весов” пробелов по умолчанию, имеют, по меньшей мере, 80%-ную идентичность последовательностей, предпочтительно, по меньшей мере, 90%-ную идентичность последовательностей, более предпочтительно, по меньшей мере, 95%-ную идентичность последовательностей, а наиболее предпочтительно, по меньшей мере, 99%-ную идентичность последовательностей. При этом, предпочтительно, чтобы положения остатков, которые не являются идентичными, отличались в результате консервативных аминокислотных замен. Термин “консервативные аминокислотные замены” означает взаимозаменяемые остатки, составляющие сходные боковые цепи. Так, например, группу аминокислот, имеющих алифатические боковые цепи, составляют глицин, аланин, валин, лейцин и изолейцин; группу аминокислот, имеющих алифатические гидроксильные боковые цепи, составляют серин и треонин; группу аминокислот, имеющих амид-содержащие боковые цепи, составляют аспарагин и глутамин; группу аминокислот, имеющих ароматические боковые цепи, составляют фенилаланин, тирозин и триптофан; группу аминокислот, имеющих основные боковые цепи, составляют лизин, аргинин и гистидин; а группу аминокислот, имеющих содержащие серу боковые цепи, составляют цистеин и метионин. Предпочтительными консервативными аминокислотными заменами являются замены в пределах таких групп, как валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутаминовая кислота-аспарагиновая кислота и аспарагин-глутамин.
Как обсуждается в настоящей заявке, небольшие изменения в аминокислотных последовательностях молекул антител или иммуноглобулинов рассматриваются как изменения, входящие в объем настоящего изобретения, при условии, что такие изменения в аминокислотной последовательности описанных здесь молекул антител или иммуноглобулинов будут составлять, по меньшей мере, 75%, более предпочтительно, по меньшей мере, 80%, 90%, 95%, а наиболее предпочтительно, 99%. В частности, рассматриваются также консервативные аминокислотные замены. Консервативными заменами являются замены, которые входят в семейство аминокислот, являющихся родственными по их боковым цепям. Генетически кодируемые аминокислоты обычно подразделяются на следующие семейства: (1) кислотные аминокислоты = аспартат, глутамат; (2) основные аминокислоты = лизин, аргинин, гистидин; (3) неполярные аминокислоты = аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан и (4) незаряженные полярные аминокислоты = глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Более предпочтительными семействами являются: серин и треонин, принадлежащие к семейству алифатических оксикислот; аспарагин и глутамин, принадлежащие к семейству амид-содержащих кислот; аланин, валин, лейцин и изолейцин, принадлежащие к семейству алифатических аминокислот, и фенилаланин, триптофан и тирозин, принадлежащие к семейству ароматических аминокислот. Так, например, следует ожидать, что отдельная замена лейцина изолейцином или валином, замена аспартата глутаматом, замена треонина серином или аналогичная замена какой-либо аминокислоты структурно родственной аминокислотой не будет оказывать значительно влияния на функцию связывания или свойства полученной молекулы, особенно, если эта замена не является аминокислотной заменой в каркасном участке. Продуцирование функционального пептида в результате такой аминокислотной замены может быть легко установлено путем анализа на удельную активность полипептидного производного. Такие анализы подробно описаны в настоящей заявке. Фрагменты или аналоги молекул антител или иммуноглобулинов могут быть легко получены средним специалистом. Предпочтительно, чтобы амино- и карбокси-концы этих фрагментов или аналогов находились вблизи границ функциональных доменов. Структурные и функциональные домены могут быть идентифицированы путем сравнения данных о нуклеотидных и/или аминокислотных последовательностях с данными о последовательностях, имеющихся в известных общедоступных базах данных или в базах данных, находящихся в частной собственности. Предпочтительно, для идентификации мотивов последовательностей или конформационных доменов предсказанных белков, которые встречаются в других белках с известной структурой и/или функцией, применяются методы компьютерного сравнения. Методы идентификации последовательностей белка, которые образуют известную трехмерную структуру, известны специалистам и описаны в работе Bowie et al., Science 253:164 (1991). Так, например, описанные ранее примеры продемонстрировали, что специалист в данной области может легко выявить мотивы последовательностей и структурные конформации, которые могут быть использованы для определения структурных и функциональных доменов в соответствии с приведенным здесь описанием антител.
Предпочтительными аминокислотными заменами являются замены, которые приводят: (1) к снижению чувствительности к протеолизу, (2) к снижению чувствительности к окислению, (3) к изменению аффинности связывания для образования белковых комплексов, (4) к изменению аффинности связывания и (5) к сообщению или модификации других физико-химических или функциональных свойств таких аналогов. Указанными аналогами могут быть различные мутеины с последовательностью, отличающейся от природной пептидной последовательности. Так, например, в природную последовательность (предпочтительно, в ту часть полипептида, которая расположена за пределами домен-образующих межмолекулярных контактов) могут быть внесены одна или множество аминокислотных замен (предпочтительно, консервативных аминокислотных замен). Консервативная аминокислотная замена не должна значительно влиять на структурные свойства родительской последовательности (например, аминокислотная замена не должна приводить к разрушению спирали, присутствующей в родительской последовательности, или к нарушению вторичной структуры других типов, которая характеризует родительскую последовательность). Примеры известных вторичных и третичных структур полипептида описаны в работах Protein, Structures and Molecular Principles (Creighton ed., W.H. Freeman and Company, New York 1984); Introduction to Protein Structure (C. Branden & J. Tooze eds., Garland Publishing, New York, N,Y. (1991)) и в работе Thornton et al., Nature 354:105 (1991), каждая из которых вводится в настоящее описание посредством ссылки.
Используемый здесь термин “фрагмент полипептида” означает полипептид, который имеет амино-концевую и/или карбокси-концевую делецию, но в котором остальная аминокислотная последовательность в соответствующих положениях аминокислот идентична природной аминокислотной последовательности, происходящей, например, от полноразмерной кДНК-последовательности. Фрагменты обычно имеют длину, по меньшей мере, 5, 6, 8 или 10 аминокислот, а предпочтительно, по меньшей мере, 14 аминокислот, более предпочтительно, по меньшей мере, 20 аминокислот, обычно, по меньшей мере, 50 аминокислот, а еще более предпочтительно, по меньшей мере, 70 аминокислот. Используемый здесь термин “аналог” означает полипептиды, которые состоят из сегмента, имеющего, по меньшей мере, 25 аминокислот, в основном, идентичных части выведенной аминокислотной последовательности, и которые обладают, по меньшей мере, одним из нижеследующих свойств, а именно, они (1) специфически связываются с Ang-2 в подходящих условиях связывания, (2) способны блокировать соответствующее связывание с Ang-2 или (3) способны ингибировать активность Ang-2. Обычно, полипептидные аналоги, по сравнению с природной последовательностью, содержат консервативную аминокислотную замену (добавление или делецию). Аналоги, обычно, имеют длину, по меньшей мере, 20 аминокислот, предпочтительно, по меньшей мере, 50 аминокислот или более, а чаще всего, они имеют такую же длину, как и полноразмерный природный полипептид.
Пептидные аналоги обычно используются в фармацевтической промышленности в качестве непептидных лекарственных средств, обладающих свойствами, аналогичными свойствам матричного пептида. Непептидные соединения этого типа называются “пептидными миметиками” или “пептидомиметиками”. См. публикации Fauchere, J. Adv. Drug. Res. 15:29 (1986); Veber & Freidinger, TINS p.392 (1985) и Evans et al., J. Med. Chem. 30:1229 (1987), которые вводятся в настоящее описание посредством ссылки. Такие соединения часто разрабатывают с помощью компьютерной программы молекулярного моделирования. Пептидные миметики, структурно сходные с терапевтически ценными пептидами, могут быть использованы для достижения эквивалентного терапевтического или профилактического эффекта. Обычно, пептидомиметики являются структурно сходными с репрезентативным полипептидом (то есть с полипептидом, который обладает биохимическими свойствами или фармакологической активностью), таким как человеческое антитело, и они обычно имеют одну или несколько пептидных связей, необязательно замененных связью, выбранной из группы, состоящей из -СН2NН-, -СН2S-, -СН2-СН2-, -СН=СН- (цис и транс), -СОСН2-, -СН(ОН)СН2- и -СН2SО-, в соответствии с хорошо известной методикой. Системная замена одной или нескольких аминокислот консенсусной последовательности D-аминокислотой того же типа (например, замена L-лизина на D-лизин) может быть использована для генерирования более стабильных пептидов. Кроме того, пептиды с конформационными ограничениями, содержащие консенсусную последовательность или вариант последовательности, в основном, идентичный консенсусной последовательности, могут быть генерированы известными методами (публикация Rizo & Gierasсh, Ann.Rev. Biochem. 61:387 (1992), которая вводится в настоящее описание посредством ссылки), например, путем присоединения внутренних цистеиновых остатков, способных образовывать внутримолекулярные дисульфидные мостики, которые циклизуют данный пептид.
Используемый здесь термин “антитело” означает полипептид или группу полипептидов, состоящих, по меньшей мере, из одного связывающего домена, который образуется в результате укладки полипептидных цепей, имеющих трехмерные связывающие области с внутренними поверхностными структурами и распределением заряда, комплементарными структурным особенностям антигенной детерминанты антигена. Обычно, антитело имеет тетрамерную форму, содержащую две идентичных пары полипептидных цепей, где каждая пара имеет одну “легкую” и одну “тяжелую” цепь. Вариабельные области каждой пары легкой/тяжелой цепей образуют сайт связывания с антителом.
Используемый здесь термин “нацеленный связывающий агент” означает антитело или его связывающий фрагмент, которые преимущественно связываются с сайтом-мишенью. В одном из вариантов изобретения, указанный нацеленный связывающий агент является специфичным только к одному сайту-мишени. В других вариантах изобретения, указанный нацеленный связывающий агент является специфичным более чем к одному сайту-мишени. В одном из вариантов изобретения, указанным нацеленным связывающим агентом может быть моноклональное антитело, а указанным сайтом-мишенью может быть эпитоп.
“Связывающие фрагменты” антитела получают методами рекомбинантных ДНК или путем ферментативного или химического гидролиза интактных антител. Связывающими фрагментами являются Fab, Fab', F(ab')2, Fv и одноцепочечные антитела. Антитела, если они не являются “биспецифическими” или “бифункциональными”, рассматриваются как антитела, каждое из которых имеет идентичные сайты связывания. Антитело, в основном, ингибирует адгезию рецептора к контррецептору, если избыток антитела снижает количество рецептора, связанного с контррецептором, по меньшей мере, примерно на 20%, 40%, 60% или 80%, а чаще всего, примерно, более чем на 85% (как было измерено в анализе на конкурентное связывание in vitro).
Aнтитело может представлять собой олигоклональное, поликлональное или моноклональное антитело, химерное антитело, CDR-гибридное антитело, мультиспецифическое антитело, биспецифическое антитело, каталитическое антитело, химерное антитело, гуманизованное антитело, полностью человеческое антитело, антиидиотипическое антитело и антитела, которые могут быть помечены в растворимой или в связанной форме, а также их фрагменты, варианты или производные, взятые отдельно или в комбинации с другими аминокислотными последовательностями, полученными известными методами. Антитело может происходить от организма любого вида. Термин “антитело” также включает связывающие фрагменты антител согласно изобретению, и такими репрезентативными фрагментами являются Fv, Fab, Fab', одноцепочечное антитело (svFC), димерная вариабельная область (диантитело) и стабилизированная дисульфидом вариабельная область (dsFv).
Термин “эпитоп” означает любую детерминанту белка, способную специфически связываться с иммуноглобулином или Т-клеточным рецептором. Эпитопные детерминанты обычно состоят из химически активных поверхностных групп молекул, таких как аминокислоты или сахарные боковые цепи, и могут, но не всегда, иметь специфическую трехмерную структуру, а также специфические зарядовые характеристики. Считается, что антитело специфически связывается с антигеном, если константа диссоциации составляет ≤1 мкМ, предпочтительно, ≤100 нМ, а наиболее предпочтительно, ≤10 нМ.
Используемый здесь термин “агент” означает химическое соединение, смесь химических соединений, биологическую макромолекулу или экстракт, полученный из биологических материалов.
Используемый здесь термин “активный” или “активность”, если он относится к полипептиду Ang-2, означает часть полипептида Ang-2, которая обладает биологической или иммунологической активностью нативного полипептида Ang-2. Используемый здесь термин “биологический” относится к биологической функции, обусловленной активностью нативного полипептида Ang-2. Предпочтительная биологическая активность Ang-2 включает, например, Ang-2-индуцированный ангиогенез.
Используемый здесь термин “млекопитающее” означает любое животное, относящееся к классу млекопитающих. Предпочтительным млекопитающим является человек.
Гидролиз антител ферментом папаином приводит к продуцированию двух идентичных антиген-связывающих фрагментов, также известных как “Fab”-фрагменты, и “Fc”-фрагмента, не обладающего антигенсвязывающей активностью, но обладающего способностью к кристаллизации. Гидролиз антител ферментом пепсином приводит к образованию F(ab')2-фрагмента, в котором два домена молекулы антитела являются связанными и содержат два антигенсвязывающих сайта. Такой F(ab')2-фрагмент обладает способностью перекрестно связываться с антигеном.
Используемый здесь термин “Fv” означает минимальный фрагмент антитела, содержащий сайты распознавания антигена и антигенсвязывающие сайты.
Используемый здесь термин “Fab” означает фрагмент антитела, содержащий константный домен легкой цепи и домен СН1 тяжелой цепи.
Термин “mAb” означает моноклональное антитело.
Используемый здесь термин “липосома” означает небольшую везикулу, которая может быть использована для доставки млекопитающему лекарственных средств, которые могут включать полипептид Ang-2 согласно изобретению или антитела против указанного полипептида Ang-2.
Используемый здесь термин “метка” или “меченный” относится к включению в полипептид детектируемой группы, например, радиоактивной метки, флуоресцентной метки, ферментативной метки, хемилюминесцентной метки или биотинильной группы. Радиоизотопами или радионуклидами могут быть 3Н, 14С, 15N, 35S, 90Y, 94Tc, 111In, 125I, 131I, флуоресцентными метками могут быть родамин, комплекс “лантанид-фосфор” или ФИТЦ, а ферментативными метками могут быть пероксидаза хрена, β-галактозидаза, люцифераза и щелочная фосфатаза.
Используемый здесь термин “фармацевтическое средство или лекарственное средство” означает химическое соединение или композицию, способные индуцировать нужный терапевтический эффект при их соответствующем введении пациенту. Другие общепринятые химические термины, используемые в настоящей заявке, описаны в руководстве The McGraw-Hill Dictionary of Chemical Terms (Parker S. Ed, McGraw-Hill, San Francisco (1985), которое вводится в настоящее описание посредством ссылки).
Используемый здесь термин “в основном, чистый” относится к рассматриваемой молекуле, которая является преобладающей молекулой (то есть присутствует в более высокой молярной концентрации по сравнению с любыми другими отдельными молекулами, имеющимися в данной композиции), а, предпочтительно, этот термин означает “в основном, очищенную фракцию”, то есть композицию, в которой рассматриваемая молекула составляет, по меньшей мере, примерно 50 процентов (на молярном уровне) от всех присутствующих макромолекул данного вида. Обычно, в основном, чистая композиция составляет примерно более 80 процентов от всех макромолекул, присутствующих в данной композиции, а более предпочтительно примерно более 85%, 90%, 95% и 99%. Наиболее предпочтительно, чтобы рассматриваемая молекула была очищена почти до полной гомогенности (где примеси, присутствующие в данной композиции, не могут быть детектированы стандартными методами детекции), так, чтобы указанная композиция состояла, в основном, из макромолекул одного вида.
Термин “пациент” включает человека и животных.
Человеческие антитела и “гуманизация” антител
Использование человеческих антител позволяет избежать некоторых проблем, возникающих при использовании антител, имеющих мышиные или крысиные вариабельные и/или константные области. Присутствие таких мышиных или крысиных белков может приводить к быстрому выведению антител, либо оно может приводить к вырабатыванию у пациента иммунного ответа против данного антитела. Для того чтобы избежать необходимости использования мышиных или крысиных антител, могут быть генерированы полностью человеческие антитела путем введения функционального участка человеческого антитела грызуну, другому млекопитающему или животному так, чтобы у них вырабатывались полностью человеческие антитела.
Один из методов генерирования полностью человеческих антител заключается в использовании мышей штаммов XenoMouse®, которые были выведены так, что они содержат соответствующим образом конфигурированные фрагменты локуса человеческой тяжелой цепи и локуса легкой цепи каппа зародышевой линии размером до менее чем 1000 т.п.н. См. Mendez et al. Nature Genetics 15:146-156 (1997) и Green and Jakobovits J. Exp. Med. 188:483-495 (1998). Штаммы XenoMouse® поставляются фирмой Abgenix, Inc. (Fremont, CA).
Получение штаммов мышей XenoMouse® также обсуждается и описывается в следующих заявках на патент США: в заявке рег.№ 07/466008, поданной 12 января 1990, 07/610515, поданной 8 ноября 1990, 07/919297, поданной 24 июля 1992, 07/922649, поданной 30 июля 1992, 08/031801, поданной 15 марта 1993, 08/112848, поданной 27 августа 1993, 08/234145, поданной 28 апреля 1994, 08/376279, поданной 20 января 1995, 08/430938, поданной 27 апреля 1995, 08/464584, поданной 5 июня 1995, 08/464582, поданной 5 июня 1995, 08/463191, поданной 5 июня 1995, 08/462837, поданной 5 июня 1995, 08/486853, поданной 5 июня 1995, 08/486857, поданной 5 июня 1995, 08/486859, поданной 5 июня 1995, 08/462513, поданной 5 июня 1995, 08/724752, поданной 2 октября 1996 и 08/759620, поданной 3 декабря 1996; в публикации заявки на патент США 2003/0093820, поданной 30 ноября, 2001; в патентах США №№ 6162963, 6150584, 6114598, 6075181 и 5939598, и в Японских патентных заявках №№ 3068180 В2, 3068506 В2 и 3068507 В2. См. также Европейский патент № EP 0463151 Bl, выданный и опубликованный 12 июня 1996, Международную патентную заявку № WO 94/02602, опубликованную 3 февраля 1994, Международную патентную заявку № WO 96/34096, опубликованную 31 октября 1996, WO 98/24893, опубликованную 11 июня 1998 и WO 00/76310, опубликованную 21 декабря 2000. Описание всех вышеупомянутых патентов, заявок и публикаций во всей своей полноте вводится в настоящее описание посредством ссылки.
В альтернативном методе, другие исследователи, включая исследователей GenPharm International, Inc., использовали “минилокусы”. Этот подход с использованием минилокусов заключается в том, что был имитирован локус экзогенного Ig путем включения фрагментов (отдельных генов) из локуса Ig. Таким образом, из одного или нескольких генов VН, одного или нескольких генов DН, одного или нескольких генов JН, константной мю-области и, обычно, второй константной области (предпочтительно, константной гамма-области) была создана конструкция для введения животному. Этот метод описан в патенте США № 5545807, Surani et al., и в патентах США №№ 5545806, 5625825, 5625126, 5633425, 5661016, 5770429, 5789650, 5814318, 5877397, 5874299 и 6255458, Lonberg и Kay, в патентах США №№ 5591669 и 6023010, Krimpenfort & Berns, в патентах США №№ 5612205, 5721367 и 5789215, Berns et al., и в патенте США № 5643763, Choi & Dunn, и в Международных заявках на патент США, GenPharm; в заявке рег. № 07/574748, поданной 29 августа 1990, заявке 07/575962, поданной 31 августа 1990, заявке 07/810279, поданной 17 декабря 1991, заявке 07/853408, поданной 18 марта 1992, заявке 07/904068, поданной 23 июня 1992, заявке 07/990860, поданной 16 декабря 1992, заявке 08/053131, поданной 26 апреля 1993, заявке 08/096762, поданной 22 июля 1993, заявке 08/155301, поданной 18 ноября 1993, заявке 08/161739, поданной 3 декабря 1993, заявке 08/165699, поданной 10 декабря 1993, и заявке 08/209741, поданной 9 марта 1994, описание которых вводится в настоящую заявку посредством ссылки. См. также Европатент № 0546073 В1, Международные патентные заявки №№ WO 92/03918, WO 92/22645, WO 92/22647, WO 92/22670, WO 93/12227, WO 94/00569, WO 94/25585, WO 96/14436, WO 97/13852 и WO 98/24884, и патент США № 5981175, описание которых во всей своей полноте вводится в настоящую заявку посредством ссылки. См. также публикации Taylor et al., 1992, Chen et al., 1993, Tuaillon et al., 1993, Choi et al., 1993, Londberg et al., 1994, Taylor et al. 1994 и Tuaillon et al., 1995, Fishwild et al., 1996, описание которых во всей своей полноте вводится в настоящую заявку посредством ссылки.
Kirin также продемонстрировал генерирование человеческих антител у мышей, которым путем слияния микроклеток, вводили большие фрагменты хромосом или полные хромосомы. См. Европейские патентные заявки №№ 773288 и 843961, описание которых во всей своей полноте вводится в настоящую заявку посредством ссылки. Кроме того, в результате кроссбридинга мышей Тс Kirin и мышей Medarex с минилокусом (Humab) были получены мыши KMTM. Эти мыши имели человеческую IgH-трансхромосому мышей Kirin и трансген каппа-цепи мышей Genpharm (Ishida et al., Cloning Stem Cells, (2002) 4:91-102).
Человеческие антитела могут быть также получены методами in vitro. Подходящими методами являются, но не ограничиваются ими, фаговое представление (CAT, Morphosys, Dyax, Biosite/Medarex, Xoma, Symphogen, Alexion (прежнее название Proliferon), Affimed), рибосомное представление (CAT), дрожжевое представление и т.п.
Получение антител
Описанные здесь антитела были получены с применением описанной ниже технологии выведения мышей XenoMouse®. Такие мыши способны продуцировать молекулы человеческого иммуноглобулина и антитела и являются дефицитными по продуцированию молекул мышиного иммуноглобулина и антител. Технология, применяемая для этих целей, описана в патентах, в патентных заявках и в работах, цитируемых в разделе “Предшествующий уровень техники” настоящей заявки. Однако, в частности, предпочтительный вариант получения трансгенных мышей и антител описан в заявке на патент США, рег.№ 08/759620, поданной 3 декабря 1996, и в Международных патентных заявках: в заявке № WO 98/24893, опубликованной 11 июня 1998, и в заявке WO 00/76310, опубликованной 21 декабря 2000, описание которых вводится в настоящую заявку посредством ссылки. См. также публикацию Mendez et al., Nature Genetics 15:146-156 (1997), описание которой вводится в настоящую заявку посредством ссылки.
Благодаря применению такой технологии были продуцированы полностью человеческие моноклональные антитела против различных антигенов. По существу, линии мышей XenoMouse® иммунизировали представляющим интерес антигеном (например, Ang-2), а затем лимфатические клетки (такие как В-клетки) выделяли у гипериммунизованных мышей, и полученные лимфоциты подвергали слиянию с клеточной линией миелоидного типа, в результате чего получали иммортализованные гибридомные клеточные линии. Такие гибридомные клеточные линии были скринированы и отобраны для идентификации гибридомных клеточных линий, продуцирующих антитела, специфичные к нужному антигену. В настоящей заявке описаны способы получения множества гибридомных клеточных линий, продуцирующих антитела, специфичные к Ang-1 и Ang-2. Кроме того, в настоящей заявке приводится характеризация антител, продуцируемых такими клеточными линиями, включая анализы на нуклеотидную и аминокислотную последовательности тяжелой и легкой цепей указанных антител.
Альтернативно, вместо слияния с миеломными клетками для получения гибридом, может быть проведен прямой анализ В-клеток. Так, например, CD19+-В-клетки могут быть выделены у гипериммунизированных мышей XenoMouse® и подвергнуты пролиферации и дифференцировке с получением антитело-секретирующих плазматических клеток. Затем антитела, выделенные из клеточных супернатантов, скринируют с помощью ELISA на реактивность с иммуногеном Ang-2. Эти супернатанты могут быть также скринированы на иммунореактивность с фрагментами Ang-2 в целях дополнительного картирования различных антител для анализа на связывание с представляющими интерес функциональными доменами на Ang-2. Такие антитела могут быть также скринированы на связывание с Ang-1, Ang-3 или Ang-4 и с другими родственными человеческими хемокинами, а также с крысиными и мышиными Ang-2, с Ang-2 приматов, не являющихся человеком, таких как собакоподобные обезьяны, и с ортологами Ang-2, где указанные ортологи используются для определения видовой перекрестной реактивности. В-клетки в лунках, содержащих представляющие интерес антитела, могут быть иммортализованы различными методами, включая слияние клеток с получением гибридом, либо в отдельных лунках, либо в лунках с пулом клеток, или путем инфицирования вирусом ЕВV или трансфекции известными иммортализующими генами, с последующим высеванием клеток в подходящую среду. Альтернативно, одиночные плазматические клетки, секретирующие антитела с нужной специфичностью, затем выделяют с использованием гемолитического анализа методом бляшек на Ang-1 или Ang-2-специфические антитела (см., например, Babcook et al., Proc. Natl. Acad. Sci. USA, 93:7843-7848 (1996)). Клетками, подвергаемыми лизису, предпочтительно, являются бараньи эритроциты (SRBC), покрытые антигеном Ang-2. Для скрининга антитела, способного ингибировать ангиопоэтин-1, с тем же успехом могут быть применены вышеуказанные методы, где вместо ангиопоэтина-2 используется ангиопоэтин-1.
В присутствии В-клеточной культуры, содержащей плазматические клетки, секретирующие нужный иммуноглобулин и комплемент, образование бляшек указывает на специфический Ang-1/Ang-2-опосредованный лизис бараньих эритроцитов, окружающих представляющие интерес плазматические клетки. Может быть выделена одиночная антигенспецифичная плазматическая клетка, присутствующая в центре бляшки, а затем из этой одиночной плазматической клетки может быть получена генетическая информация о специфичности данного антитела. Путем проведения ПЦР с обратной транскриптазой (ОТ-ПЦР) может быть клонирована ДНК, кодирующая вариабельные области тяжелой и легкой цепей данного антитела. Такая клонированная ДНК может быть затем встроена в подходящий экспрессионный вектор, предпочтительно в векторный кластер, такой как рсDNA, а более предпочтительно рсDNA, содержащий константные домены тяжелой и легкой цепей иммуноглобулина. Генерированный вектор может быть затем трансфецирован в клетки-хозяева, например, в клетки НЕК293 или в клетки СНО, и культивирован в подходящей питательной среде, модифицированной, если это необходимо, для индуцирования транскрипции, отбора трансформантов или амплификации генов, кодирующих нужные последовательности.
В общих чертах, антителами, продуцируемыми гибридомами, являются тяжелые цепи человеческого IgG2 вместе с полноразмерными легкими цепями каппа или лямбда человеческого антитела. Описанные здесь антитела имеют тяжелые цепи человеческого IgG4, а также тяжелые цепи человеческого IgG2. Такими антителами могут быть также человеческие антитела других изотипов, включая IgG1. Антитела, обладающие высокой аффинностью, обычно имеют КD примерно от 10-6 до 10-12 М или менее, как показывают измерения в твердой фазе и в растворе. Антитела, имеющие КD, по крайней мере, 10-11 М, являются предпочтительными для ингибирования активности Ang-1 и/или Ang-2.
При этом следует отметить, что антитела могут экспрессироваться в клеточных линиях, не являющихся гибридомными клеточными линиями. Последовательности, кодирующие конкретные антитела, могут быть использованы для трансформации подходящей клетки-хозяина млекопитающего. Трансформация может быть осуществлена любым известным методом введения полинуклеотидов в клетку-хозяина, включая, например, упаковку полинуклеотидов в вирус (или в вирусный вектор) и трансфекцию клетки-хозяина вирусом (или вектором), либо она может быть осуществлена в соответствии с процедурами трансфекции, известными специалистам и описанными в патентах США №№ 4399216, 4912040, 4740461 и 4959455 (которые вводятся в настоящее описание посредством ссылки). Такая процедура трансформации зависит от трансформируемого хозяина. Методы введения гетерологичных полинуклеотидов в клетки млекопитающих хорошо известны специалистам и включают опосредуемую декстраном трансфекцию; преципитацию фосфатом кальция; опосредуемую полибреном трансфекцию; слияние протопластов; электропорацию; инкапсулирование полинуклеотида(ов) в липосомах и прямую микроинжекцию ДНК в ядра.
Клеточные линии млекопитающих, подходящие в качестве хозяев для экспрессии, хорошо известны специалистам, и такими клеточными линиями являются многие иммортализованные клеточные линии, которые могут быть взяты из Американской коллекции типовых культур (АТСС), включая, но не ограничиваясь ими, клетки яичника китайского хомячка (СНО), клетки HeLa, клетки почек детеныша хомячка (ВНК), клетки почек обезьяны (COS), клетки человеческой гепатоцеллюлярной карциномы (например, Hep G2), эпителиальные клетки 293 почек человека и различные другие клеточные линии. Особенно предпочтительные клеточные линии могут быть выбраны путем выявления клеточных линий, которые экспрессируют и продуцируют высокие уровни антител, способных конститутивно связываться с Ang-2.
Исходя из способности mAb в значительной степени нейтрализовать активность ангиопоэтина-1 и ангиопоэтина-2 (как продемонстрировано в нижеследующих примерах), можно сделать вывод, что эти антитела будут обладать терапевтическим действием, направленным на устранение симптомов и лечение состояний, ассоциированных с экспрессией ангиопоэтина-1 и/или ангиопоэтина-2. В конкретных вариантах изобретения, описанные здесь антитела и способы могут быть применены для лечения симптомов, ассоциированных с ангиогенезом, индуцированным ангиопоэтином-1 и/или ангиопоэтином-2.
В соответствии с другим своим аспектом, настоящее изобретение относится к фармацевтической композиции, содержащей антагонист биологической активности ангиопоэтина-1 и ангиопоэтина-2 и фармацевтически приемлемый носитель. В одном из вариантов изобретения, указанный антагонист содержит антитело. В соответствии с другим своим аспектом, настоящее изобретение относится к фармацевтической композиции, содержащей антагонист биологической активности ангиопоэтина-2 и фармацевтически приемлемый носитель. В одном из вариантов изобретения, указанный антагонист содержит антитело.
Анти-Ang-2 антитела могут быть использованы для детектирования Ang-2 в образцах, взятых у пациента, и, соответственно, они могут быть использованы в качестве диагностических средств для лечения описанных здесь патологических состояний. Кроме того, исходя из способности этих антител значительно нейтрализовать активность Ang-2 (как продемонстрировано в нижеследующих примерах), можно сделать вывод, что эти анти-Ang-2 антитела будут обладать терапевтическим действием, направленным на устранение симптомов и лечение состояний, ассоциированных с экспрессией Ang-2. В конкретных вариантах изобретения, описанные здесь антитела и способы могут быть применены для устранения симптомов, ассоциированных с Ang-2-индуцированным ангиогенезом. Другие варианты изобретения включают применение описанных здесь антител и способов для лечения опосредуемых ангиогенезом заболеваний, включая опухолевые заболевания, такие как меланома, мелкоклеточный рак легких, не-мелкоклеточный рак легких, глиома, гепатоцеллюлярная карцинома (печени), опухоль щитовидной железы, рак желудочно-кишечного тракта (желудка), рак предстательной железы, рак молочной железы, рак яичника, рак мочевого пузыря, рак легких, глиобластома, рак эндометрия, рак почек, рак толстой кишки и рак поджелудочной железы.
Терапевтическое введение и композиции
Варианты настоящего изобретения включают стерильные фармацевтические композиции, которые содержат анти-Ang-2 антитела или антитела, связывающиеся как с Ang-1, так и с Ang-2, и которые могут быть использованы для лечения заболеваний. Такие композиции должны ингибировать связывание Ang-2 или Ang-1 и Ang-2 с их рецептором Tie-2, а поэтому они должны быть эффективными для лечения патологических состояний, при которых, например, наблюдается аномальное увеличение уровней Ang-1 и/или Ang-2 в сыворотке или в ткани. Aнти-Ang-2 антитела, предпочтительно, обладают адекватной аффинностью, позволяющей нейтрализовать Ang-2, а предпочтительно, обладают адекватной продолжительностью действия, что позволяет вводить эти антитела человеку гораздо реже. Aнти-Ang-1/Ang-2 антитела, предпочтительно, обладают адекватной аффинностью, позволяющей нейтрализовать Ang-1 и Ang-2, а предпочтительно, обладают адекватной продолжительностью действия, что позволяет вводить эти антитела человеку гораздо реже. Пролонгированное действие указанных антител позволяет применять схемы терапии с менее частым или с более удобным введением доз способом, альтернативным парентеральному введению, таким как подкожное или внутримышечное введение.
Стерильные композиции могут быть получены, например, путем фильтрации через стерильные фильтрующие мембраны до или после лиофилизации с последующим разведением антитела. Антитело обычно хранят в лиофилизованной форме или в растворе. Терапевтические композиции антител обычно помещают в контейнер, имеющий стерильное входное отверстие, например, пакет или сосуд для внутривенного введения, имеющий приспособление для подачи данной композиции, такой как пробка, протыкаемая иглой для подкожных инъекций.
Введение антитела может быть осуществлено известными методами, например, путем внутривенной, внутрибрюшинной, интрацеребральной, внутримышечной, внутриглазной, внутрисуставной, интратекальной инъекции или инфузии; путем ингаляции или путем введения в пораженные участки, либо путем применения систем пролонгированного высвобождения, описанных ниже. Антитело, предпочтительно, вводят непрерывно путем вливания или инъекции ударной дозы.
Эффективное количество используемого терапевтического антитела зависит, например, от целей терапии, способа введения и состояния пациента. В предпочтительном варианте, лечащий врач может устанавливать нужную дозу путем титрования и модифицировать способ введения, если это необходимо для получения оптимального терапевтического эффекта. Обычно, врач-клиницист назначает введение дозы антитела, подходящей для достижения нужного эффекта. Мониторинг эффективности этой терапии может быть легко осуществлен с помощью стандартных анализов или анализов, описанных в настоящей заявке.
Описанные здесь антитела могут быть приготовлены в смеси с фармацевтически приемлемым носителем. Такая терапевтическая композиция может быть введена внутривенно, интраназально или интрапульмонально, а предпочтительно, в виде жидкого или порошкообразного аэрозоля (в лиофилизованной форме). Указанная композиция, если это необходимо, может быть также введена парентерально или подкожно. При системном введении, такая терапевтическая композиция должна быть стерильной и апирогенной, и она может быть введена в виде парентерально приемлемого раствора, имеющего нужный рН, нужную изотоничность и стабильность. Эти условия хорошо известны специалистам. Вкратце, в описанных здесь вариантах изобретения, лекарственные композиции соединений, предназначенные для хранения или введения, получают путем смешивания соединения, имеющего нужную степень чистоты, с физиологически приемлемыми носителями, наполнителями или стабилизаторами. Указанные вещества являются нетоксичными для реципиентов в используемых дозах и концентрациях, и ими могут быть буферы, такие как Трис-HCl, фосфат, цитрат, ацетат и другие соли органических кислот; антиоксиданты, такие как аскорбиновая кислота; низкомолекулярные пептиды (имеющие примерно менее десяти остатков), такие как полиаргинин; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидинон; аминокислоты, такие как глицин, глутаминовая кислота, аспарагиновая кислота или аргинин; моносахариды, дисахариды и другие углеводы, включая целлюлозу или ее производные, глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; спирты ряда сахаров, такие как маннит или сорбит; противоионы, такие как натрий и/или неионогенные поверхностно-активные вещества, такие как твин, плюроники или полиэтиленгликоль.
Стерильные композиции для инъекций могут быть приготовлены в соответствии со стандартной фармацевтической практикой, описанной в руководстве Remington: The Science and Practice of Pharmacy (20th ed., Lippincott Williams & Wilkens Publishers (2003)). Так, например, может оказаться желательным растворение или суспендирование активного соединения в носителе, таком как вода или натуральное растительное масло, такое как кунжутное масло, арахисовое масло или масло из семян хлопчатника или синтетический жирный носитель, такой как этилолеат или т.п. Буферы, консерванты, антиоксиданты и т.п. могут быть введены в соответствии с общепринятой фармацевтической практикой.
Подходящими примерами препаратов пролонгированного высвобождения являются полупроницаемые матрицы твердых гидрофобных полимеров, содержащих полипептид, где указанные матрицы получают в виде формованных изделий, пленок или микрокапсул. Примерами матриц для пролонгированного высвобождения являются полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат), описанные Langer et al., J. Biomed. Mater. Res., 15:167-277 (1981) и Langer, Chem. Tech., (1982) 12:98-105 или поливиниловый спирт), полилактиды (патенты США № 3773919, ЕР 58481), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата (Sidman et al., Biopolymers, 22:547-556 (1983)), неразлагаемый этиленвинилацетат (Langer et al., см.выше), разлагаемые сополимеры молочной и гликолевой кислоты, такие как LUPRON DepotTM (микросферы для инъекций, состоящие из сополимера молочной и гликолевой кислоты и ацетата лейпролида), и поли-D-(-)-3-гидроксимасляная кислота (ЕР 133988).
Такие полимеры, как этиленвинилацетат и молочная кислота-гликолевая кислота, обеспечивают высвобождение молекул в течение периода времени свыше 100 дней, а некоторые гидрогели обеспечивают высвобождение белков за более короткие промежутки времени. Если инкапсулированные белки присутствуют в организме в течение длительного периода времени, то при 37ºС они могут денатурироваться или агрегироваться под действием влаги, что приводит к потере биологической активности и к возможному изменению иммуногенности. Для стабилизации белка могут быть разработаны рациональные стратегии в зависимости от используемого механизма. Так, например, если механизмом агрегации является образование межмолекулярной связи S-S посредством дисульфидного обмена, то стабилизация белка может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации из кислотных растворов, регулирования содержания влаги, использования соответствующих добавок и разработки конкретного состава полимерных матриц.
Композиции пролонгированного высвобождения также включают препараты кристаллов антител, суспендированных в подходящих композициях, способных поддерживать кристаллы в суспензии. Эти препараты, при их подкожной или внутрибрюшинной инъекции, могут продуцировать эффект пролонгированного высвобождения. Другие композиции также включают захваченные липосомами антитела. Липосомы, содержащие такие антитела, получают методами, известными per se и описанными в патенте США № DE 3218121; в работах Epstein et al., Proc. Natl. Acad. Sci., USA, (1985) 82:3688-3692; Hwang et al., Proc. Natl. Acad. Sci., USA, (1980) 77:4030-4034; в ЕР 52322; в ЕР 36676; в ЕР 88046, в ЕР 143949 и 142641; в Японской патентной заявке 83-118008; в патентах США №№ 4485045 и 4544545, и в ЕР 102324.
Дозы препарата антитела для данного пациента должны быть определены лечащим врачом с учетом различных факторов, которые, как известно, влияют на действие лекарственных средств, например, такие факторы, тяжесть и тип заболевания, масса тела, пол, режим питания пациента, время и способ введения лекарственного средства, другие медицинские показания, а также другие релевантные клинические факторы. Терапевтически эффективные дозы могут быть определены методами in vitro или in vivo.
Эффективное количество антител согласно изобретению, используемых в терапии, зависит, например, от целей терапевтического лечения, способа введения и состояния здоровья пациента. В соответствии с этим, в предпочтительном варианте, практикующий врач может самостоятельно подбирать нужную дозу и модифицировать способ введения, если это необходимо для достижения оптимального терапевтического эффекта. Типичная ежедневная доза может варьироваться примерно от 0,001 мг/кг до 100 мг/кг или более, в зависимости от вышеупомянутых факторов. Обычно, врач-клиницист назначает введение терапевтического антитела до тех пор, пока не будет достигнут нужный эффект. Мониторинг эффективности этой терапии может быть легко осуществлен с помощью стандартных анализов или анализов, описанных в настоящей заявке.
Следует отметить, что терапевтические средства, используемые в описанных здесь композициях и способах, могут быть введены вместе с подходящими носителями, наполнителями и другими средствами, включенными в данные препараты для улучшения переноса и доставки, и повышения толерантности и т.п. Такими препаратами являются, например, порошки, пасты, мази, желе, воски, масла, липиды, везикулы, содержащие липиды (катиогенные или аниогенные) (такие как липофектинТМ), ДНК-конъюгаты, безводные абсорбирующие пасты, эмульсии типа “масло в воде” и “вода в масле”, эмульсионный карбовакс (полиэтиленгликоли с различными молекулярными массами), полутвердые гели и полутвердые смеси, содержащие карбовакс. Для лечения и терапии согласно изобретению могут быть использованы любые вышеупомянутые смеси, при условии, что активный ингредиент в данной композиции не будет инактивироваться, и данная композиция будет физиологически совместимой и будет хорошо переноситься при данном способе введения. См. также публикации Baldrick P. "Pharmaceutical excipient development: the need for preclinical guidance", Regul. Toxicol. Pharmacol. 32(2):210-8 (2000), Wang W. "Lyophilization and development of solid protein pharmaceuticals", Int. J. Pharm. 203(1-2): 1-60 (2000), Charman WN "Lipids, lipophilic drugs, and oral drug delivery-some emerging concepts", J. Pharm. Sci. 89(8):967-78 (2000), Powell et al. "Compendium of excipients for parenteral formulations" PDA J. Pharm. Sci. Technol. 52:238-311 (1998) и указанную в них дополнительную информацию, относящуюся к лекарственным препаратам, наполнителям и носителям, хорошо известным химикам-фармацевтам.
Комбинации
Описанное здесь лечение, направленное на предотвращение ангиогенеза, может быть применено как монотерапия, либо оно может, помимо введения соединений согласно изобретению, включать проведение стандартных хирургических операций, лучевой терапии или химиотерапии. Такая химиотерапия может включать введение одного или нескольких противоопухолевых средств нижеследующих категорий:
(i) цитостатических средств, таких как антиэстрогены (например, тамоксифен, торемифен, ралоксифен, дролоксифен и иодоксифен), ингибиторы эстрогеновых рецепторов (например, фульвестрант), антиандрогены (например, бикалутамид, флутамид, нилутамид и ацетат ципротерона), антагонисты LHRH или агонисты LHRH (например, гозерелин, лейпрорелин и бузерелин), прогестероны (например, ацетат мегестрола), ингибиторы ароматазы (например, анастрозол, летрозол, воразол и экземестан) и ингибиторы 5*-редуктазы, такие как финастерид;
(ii) средств, ингибирующих инвазию раковых клеток (например, ингибиторов металлопротеиназы, таких как маримастат, и ингибиторов функции урокиназного рецептора активатора плазминогена);
(iii) ингибиторов функции факторов роста, например, ингибиторов, которыми являются антитела против факторов роста, антитела против рецепторов факторов роста (например, анти-erbb2 антитело трастузумаб [герцептинТМ] и анти-erbbl антитело цетуксимаб [C225]), ингибиторов фарнезилтрансферазы, ингибиторов тирозинкиназы и ингибиторов серин/треонинкиназы, например, ингибиторов семейства эпидермальных факторов роста (например, ингибиторов тирозинкиназы семейства EGFR, таких как N-(3-хлор-4-фторфенил)-7-метокси-6-(3-морфолинопропокси)хиназолин-4-амин (гефитиниб, AZDl839), N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амин (эрлотиниб, OSI 774) и 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3-морфолинопропокси)хиназолин-4-амин (CI 1033)), например, ингибиторов семейства факторов роста тромбоцитов, и, например, ингибиторов семейства факторов роста гепатоцитов;
(iv) антиангиогенных средств, таких как средства, ингибирующие действие васкулярного эндотелиального фактора роста (например, антитела против фактора роста васкулярных эндотелиальных клеток, бевацизумаба [авастинТМ], антител против рецептора васкулярного эндотелиального фактора роста, таких как анти-KDR антитела и анти-flt1 антитела, соединений, описанных в Международных патентных заявках WO 97/22596, WO 97/30035, WO 97/3285, WO 98/13354, WO 00/47212 и WO 01/32651) и соединений, которые действуют по другому механизму (например, линомида, ингибиторов функции интегрина avb3 и ангиостатина);
(v) средств, разрушающих сосуды, таких как комбретастатин A4, и соединений, описанных в Международных патентных заявках WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 и WO 02/08213;
(vi) терапевтических средств, содержащих антисмысловые последовательности, например, терапевтических средств, направленных на мишени, перечисленные выше, такие как ISIS 2503, и терапевтических анти-ras средств, содержащих антисмысловые последовательности;
(vii) средств, используемых в методах генотерапии, включая, например, методы замены аберрантных генов, таких как аберратный p53 или аберрантный BRCAl или BRCA2, GDEPT (генотерапия с использованием ферментного пролекарства), например, методы с использованием цитозиндеаминазы, тимидинкиназы или бактериального фермента нитроредуктазы, и методы, применяемые для повышения толерантности к химиотерапии или лучевой терапии, такой как терапия с использованием генов резистентности к многим лекарственным средствам; и
(viii) средств, используемых в методах иммунотерапии, включая, например, ex vivo и in vivo методы повышения иммуногенности опухолевых клеток пациента, такие как трансфекция цитокинами, такими как интерлейкин-2, интерлейкин-4 или гранулоцитарный-макрофагальный колониестимулирующий фактор, методы снижения энергии Т-клеток, методы с использованием трансфецированных иммунных клеток, таких как трансфецированные цитокинами дендритные клетки, методы с использованием трансфецированных цитокинами опухолевых клеточных линий и методы с использованием антиидиотипических антител.
В одном из вариантов изобретения, лечение антиангиогенными средствами согласно изобретению проводят в комбинации с другими средствами, которые ингибируют действие васкулярного эндотелиального фактора роста (VEGF) (например, антитела против васкулярного эндотелиального фактора роста клеток, бевацизумаба [авастинТМ], антитела против рецептора васкулярного эндотелиального фактора роста, такого как анти-KDR антитело и анти-flt1 антитело; соединения, описанные в Международных патентных заявках WO 97/22596, WO 97/30035, WO 97/3285, WO 98/13354, WO 00/47212 и WO 01/32651), и соединениями, которые действуют по другому механизму (например, линомида, ингибиторов функции интегрина avb3 и ангиостатина). В других вариантах изобретения, лечение антиангиогенными средствами согласно изобретению проводят в комбинации с другими средствами, которые ингибируют тирозинкиназную активность рецептора васкулярного эндотелиального фактора роста, KDR (например, AZD2171 или AZD6474). Подробное описание AZD2171 можно найти в публикациях Wedge et al. (2005) Cancer Research. 65(10):4389-400. Подробное описание AZD6474 можно найти в публикациях Ryan & Wedge (2005) British Journal of Cancer. 92 Suppl 1:S6-13. Обе эти публикации во всей своей полноте вводятся в настоящее описание посредством ссылки. В другом варианте изобретения, полностью человеческие антитела 3.19.3, 3.3.2 или 5.88.3 вводят отдельно или в комбинации с авастиномТМ, AZD2171 или AZD6474.
Такое комбинированное лечение может быть проведено путем одновременного, последовательного или раздельного введения доз отдельных компонентов. Такие комбинированные продукты включают соединения согласно изобретению или фармацевтически приемлемые соли в указанных выше интервалах доз и другое фармацевтически активное средство в допустимом интервале доз.
ПРИМЕРЫ
Нижеследующие примеры, включающие описание проводимых экспериментов и полученных результатов, приводятся лишь в иллюстративных целях и не должны рассматриваться как ограничение настоящего изобретения.
ПРИМЕР 1
ИММУНИЗАЦИЯ И ТИТРОВАНИЕ
Иммунизация
Рекомбинантный человеческий Ang-2, полученный от фирмы R&D Systems, Inc. (Minneapolis, MN кат. № 623-AM/CF), использовали в качестве антигена. Моноклональные антитела против Ang-2 продуцировали путем последовательной иммунизации мышей XenoMouse® (штаммы XenoMouse XMG2 и XMG4 (штамм 3C-1), Abgenix, Inc. Fremont, CA). Животные XenoMouse были иммунизованы путем введения всех инъекций в подушечку лапы. Общий объем каждой инъекции составлял 50 мкл на мышь, 25 мкл на подушечку лапы. Первая инъекция составляла 2,35 мкг рекомбинантного человеческого Ang-2 (rhAng-2, кат. № 623-AM/CF; лот № BN023202A) в апирогенном PBS Дульбекко (DPBS), в смеси (1:1 об/об) с 10 мкг CpG (15 мкл мышиного адъюванта ImmunEasy, кат. № 303101; лот № 11553042; Qiagen) на мышь. Затем вводили 6 бустер-инъекций, содержащих 2,35 мкг rhAng-2 в апирогенном DPBS, в смеси с 25 мкг Adju-Phos (алюмофосфатного геля; кат. № 1452-250, партия № 8937, HCI Biosector) и 10 мкг CpG на мышь, после чего вводили последнюю бустер-инъекцию, содержащую 2,35 мкг rhAng-2 в апирогенном DPBS, в отсутствии адъюванта. В соответствии с указанным протоколом, мыши XenoMouse были иммунизованы в дни 0, 3, 6, 10, 13, 17, 20 и 24, а слияние осуществляли на день 29.
Отбор животных для получения антител путем титрования
Титры анти-Ang-2 антител в сыворотке, полученной от иммунизованных мышей XenoMouse, определяли с помощью ELISA. Вкратце, полистироловые 96-луночные планшеты Costar Labcoat Universal Binding (Corning, Acton, MA) сенсибилизировали рекомбинантным Ang-2 (1 мкг/мл) в течение ночи при 4°С в буфере для сенсибилизации антигеном (0,1 M карбонатный буфер, pH 9,6, NaНСО3 8,4 г/л). На следующий день планшеты 3 раза промывали промывочным буфером (0,05% твина 20 в 1 × PBS) с использованием устройства для промывки планшетов Biotek. Затем планшеты блокировали 200 мкл/лунку блокирующего буфера (0,05% BSA, 0,1% твина 20, 0,01% тимерозала в 1 × PBS) и инкубировали при комнатной температуре в течение 1 часа. После блокирования в течение одного часа, планшеты 3 раза промывали промывочным буфером с использованием устройства для промывки планшетов Biotek. Сыворотку, взятую у Ang-2-иммунизованных мышей XenoMouse или у неиммунизованных животных XenoMouse, титровали в 0,5% BSA/PBS-буфере при разведениях 1:3 в дубликатах, начиная с разведения 1:100. Последнюю лунку оставляли для контроля. Эти планшеты инкубировали при комнатной температуре в течение 2 часов, а затем 3 раза промывали промывочным буфером с использованием устройства для промывки планшетов Biotek. После этого добавляли конъюгированное с пероксидазой хрена Fc-специфическое козье антитело против человеческих IgG (HRP, Pierce, Rockford, IL) при конечной концентрации 1 мкг/мл и инкубировали в течение 1 часа при комнатной температуре. Затем планшеты 3 раза промывали промывочным буфером с использованием устройства для промывки планшетов Biotek.
После промывки планшеты проявляли добавлением хромогенного субстрата TMB (BioFx BSTP-0100-01) в течение 10-20 минут или до тех пор, пока в лунках с негативным контролем не начинала появляться окраска. Затем ELISA-анализ прекращали добавлением раствора для прекращения реакции (650 нМ блокирующего реагента для TMB (BioFx BSTP-0100-01), разведенного 100 мл H2O на сосуд). Специфический титр для каждого животного XenoMouse® определяли по оптической плотности при 650 нм, и результаты систематизировали в приведенных ниже таблицах 2 и 3. Величина титра представляет собой величину, обратную величине наибольшего разведения сыворотки с величиной OD, которая в два раза превышает фоновую величину. Следовательно, чем выше эта величина, тем выше уровень гуморального иммунного ответа на Ang-2.
Группа 1: 10 мышей (штамм XМG2)
* PC = козье антитело против huAng-2 (R&D Systems, Catalog No. AF623), 1 мг/мл
Группа 2: 10 мышей (штамм XМG4)
* PC = козье антитело против huAng-2 (R&D Systems, Catalog No. AF623), 1 мг/мл
ПРИМЕР 2
ВЫДЕЛЕНИЕ ЛИМФОЦИТОВ, ВЫДЕЛЕНИЕ В-КЛЕТОК, СЛИЯНИЕ КЛЕТОК И ГЕНЕРИРОВАНИЕ ГИБРИДОМ.
Иммунизованных мышей умерщвляли путем смещения шейных позвонков, и у мышей каждой группы брали дренирующие лимфоузлы, а затем их объединяли. Лимфоидные клетки разрушали путем измельчения в DMEM для высвобождения клеток из тканей, и клетки суспендировали в DMEM. Клетки подсчитывали, и в клеточный осадок добавляли 0,9 мл DMEM на 100 миллионов лимфоцитов для осуществления мягкого, но полного ресуспендирования клеток. С использованием 100 мкл магнитных CD90+-сфер на 100 миллионов клеток, клетки метили путем их инкубирования с магнитными сферами при 4°С в течение 15 минут. Клеточную суспензию, меченную с использованием магнитных сфер и содержащую до 108 позитивных клеток (или всего до 2×109 клеток), загружали на колонку LS+, и эту колонку промывали DMEM. Общий выходящий поток собирали в виде CD90-негативной фракции (большую часть этих клеток, предположительно, составляли В-клетки).
Слияние клеток осуществляли путем смешивания промытых обогащенных В-клеток, описанных выше, с несекреторными миеломными клетками P3X63Ag8.653, закупленными у ATCC, кат.# CRL 1580 (Kearney et al., J. Immunol. 123, 1979, 1548-1550), в отношении 1:1. Клеточную смесь осторожно осаждали путем центрифугирования при 800×g. После удаления супернатанта клетки обрабатывали 2-4 мл раствора проназы (CalBiochem, кат. # 53702; 0,5 мг/мл в PBS) в течение не более чем 2 минуты. Затем для блокирования ферментативной активности добавляли 3-5 мл FBS и суспензию доводили до общего объема 40 мл путем добавления раствора для электрослияния клеток (ECFS, 0,3M сахароза, Sigma, Cat# S7903, 0,1 мM ацетат магния, Sigma, Cat# M2545, 0,1 мM ацетат кальция, Sigma, Cat# C4705). После центрифугирования супернатант удаляли и клетки ресуспендировали в 40 мл ECFS. Эту стадию промывки повторяли и клетки снова ресуспендировали в ECFS до концентрации 2×106 клеток/мл.
Электрослияние клеток проводили с использованием генератора слияния (Model ЕСМ2001, Genetronic, Inc., San Diego, CА). Размер камеры генератора слияния составлял 2,0 мл, и указанное устройство имело следующие параметры:
Условия измерения: напряжение: 50 В, время: 50 сек
Разрушение мембраны: напряжение: 3000 В, время: 30 мксек
Время выдерживания после слияния: 3 сек
После электрослияния клеточные суспензии осторожно вынимали из камеры для слияния в стерильных условиях и переносили в стерильные пробирки, содержащие одинаковые объемы среды для культивирования гибридом (DMEM, JRH Biosciences) с 15% FBS (Hyclone), в которую были добавлены L-глутамин, пенициллин/стрептомицин, OПИ (оксалоацетат, пируват, бычий инсулин) (все реагенты были получены от Sigma) и IL-6 (Boehringer Mannheim). Клетки инкубировали в течение 15-30 минут при 37оС, а затем центрифугировали при 400×g (1000 об/мин) в течение пяти минут. Эти клетки осторожно ресуспендировали в небольшом объеме среды для отбора гибридом (среды для культивирования гибридом, в которую добавляли 0,5x HA (Sigma, cat.# A9666)), и этот объем соответствующим образом корректировали путем добавления дополнительного количества среды для отбора гибридом, из расчета конечного культивирования 5×106 B-клеток на 96-луночный планшет и 200 мкл на лунку. Эти клетки осторожно смешивали и пипетировали в 96-луночные планшеты, а затем оставляли для роста. На 7-й или 10-й день половину среды удаляли, и клетки подпитывали средой для отбора гибридом.
ПРИМЕР 3
ОТБОР АНТИТЕЛ-КАНДИДАТОВ С ПОМОЩЬЮ ELISA.
После 14-дневного культивирования, супернатанты гибридом скринировали на Ang-2-специфические моноклональные антитела. ELISA-планшеты (Fisher, Cat. № 12-565-136) сенсибилизировали 50 мкл/лунку человеческого Ang-2 (2 мкг/мл) в буфере для сенсибилизации (0,1 М карбонатный буфер, рН 9,6, NaНСО3, 8,4 г/л), а затем инкубировали при 4ºС в течение ночи. После инкубирования планшеты 3 раза промывали промывочным буфером (0,05% Твин-20 в PBS). Затем добавляли 200 мкл/лунку блокирующего буфера (0,5% BSA, 0,1% Твин-20, 0,01% тимерозал в 1х PBS) и планшеты инкубировали при комнатной температуре в течение 1 часа. После инкубирования планшеты три раза промывали промывочным буфером. Затем добавляли 50 мкл/лунку супернатантов гибридомы и позитивный и негативный контроль, после чего планшеты инкубировали при комнатной температуре в течение 2 часов. Во время всего проведения эксперимента, в качестве позитивного контроля использовали сыворотку, взятую у Ang-2-иммунизованных мышей XenoMouse, Ang-2-группы 1 XMG2, подушечку лапы (fp) которых обозначали N160-7, а в качестве негативного контроля использовали сыворотку, взятую у KLH-иммунизованных мышей XenoMouse KLH-группы 1 XMG2, подушечку лапы (fp) которых обозначали L627-6.
После инкубирования планшеты три раза промывали промывочным буфером. После этого добавляли 100 мкл/лунку детектирующего ПХ-конъюгированного козьего антитела против huIgGFc (Caltag, Cat. № H10507), и планшеты инкубировали при комнатной температуре в течение 1 часа. Во второй процедуре скрининга позитивные образцы в первом скрининге скринировали в две стадии, в одной - для детектирования hIgG, а в другой - для детектирования легкой цепи каппа человеческого Ig (ПХ-конъюгированного козьего антитела против цепи каппа hIg)(Southern Biotechnology, Cat. № 2060-05), для того, чтобы продемонстрировать, что композиция полностью человеческого антитела содержит IgG и Ig-каппа. После инкубирования планшеты три раза промывали промывочным буфером. Затем добавляли 100 мкл/лунку ТМВ (BioFX Lab. Cat.№ TMSK-0100-01) и планшеты оставляли для проявления окраски примерно на 10 минут (до тех пор, пока в лунках негативного контроля не обнаруживалась едва заметная окраска). Затем добавляли 50 мкл/лунку раствора для прекращения реакции (блокирующего раствора ТМВ (BioFX Lab. Cat.# STPR-0100-01), и планшеты считывали на ELISA-планшет-ридере на длине волны 450 нм. Было получено 185 полностью человеческих антител IgG каппа против Ang-2.
Все антитела, которые связывались в ELISA-анализе, подвергали контрскринированию на связывание с Ang-1 с помощью ELISA для того, чтобы исключить антитела, перекрестно реагирующие с Ang-1. ELISA-планшеты (Fisher, Cat. № 12-565-136) сенсибилизировали 50 мкл/лунку рекомбинантного Ang-1 (2 мкг/мл, полученного от R&D Systems, Cat. № 293-AN-025/CF) в буфере для сенсибилизации (0,1 M карбонатный буфер, pH 9,6, NaНСО3, 8,4 г/л), а затем инкубировали при 4ºС в течение ночи. В описанных здесь экспериментальных условиях, если рекомбинантная молекула Ang-1 была иммобилизована на ELISA-планшете, то связывания антител с Ang-1 не наблюдалось. Однако описанный здесь метод контрскринирования имеет некоторые технические ограничения. Во-первых, эти антитела были получены от клеточных линий, а не от клонированной гибридомы. Сигналы связывания, поступающие от конкретного клона, который составляет лишь небольшой процент данной линии, могут быть ниже порога чувствительности детектирования. Во-вторых, в этом эксперименте некоторые эпитопы в антигене могут быть скрыты от антител, что обусловлено небольшими конформационными изменениями, индуцированными иммобилизацией антигена. По этим причинам перекрестная реактивность каждого антитела с Ang-1 была дополнительно оценена с использованием клонированных антител и системы Biacore (см. пример 8). Как описано в примере 8, было обнаружено, что только один клон (mAb 3.19.3) действительно обладал сильной перекрестной реактивностью с человеческим рекомбинантным Ang-1 (примеры 8, 9 и 12).
ПРИМЕР 4
ИНГИБИРОВАНИЕ СВЯЗЫВАНИЯ ANG-2 С TIE-2
Как обсуждается выше, биологический эффект Ang-2 заключается в его связывании с рецептором Tie-2. Моноклональные антитела, которые ингибируют связывание Ang-2/Tie-2, были идентифицированы посредством анализа на конкурентное связывание с применением модифицированного ELISA. Используемые mAb представляют собой продукты микроочистки из 50 мл истощающих супернатантов пула Ang-2-специфических гибридом (см. пример 3). 96-луночные планшеты Nunc ImmplatesТМ сенсибилизировали 100 мкл человеческого рекомбинантного гибридного белка Tie-2/Fc (R&D Systems, Inc., Cat. № 313-TI-100) при плотности 4 мкг/мл путем инкубирования в течение ночи при 4ºС. Планшеты четыре раза промывали забуференным фосфатом физиологическим раствором (PBS) на промывочном устройстве SkanTM Washer 300 (SKATRON). Лунки блокировали путем добавления 100 мкл ABX-блокирующего буфера (0,5% BSA, 0,1% твин, 0,01% тимерозал в PBS) в течение 1 часа.
В каждую лунку, содержащую или не содержащую анти-Ang-2 mAb при 100 мкг/мл, добавляли биотинилированный рекомбинантный человеческий Ang-2 (R&D Systems, Inc. Cat. No. BT623) при 100 нг/мл. Планшеты инкубировали при комнатной температуре в течение двух часов, а затем несвязанные молекулы удаляли путем отмывки. После этого, связанный биотинилированный Ang-2 детектировали с использованием 100 мкл/лунку конъюгата стрептавидин-ПХ при 1:200 путем инкубирования при комнатной температуре в течение получаса. После двухкратной промывки связанный стрептавидин детектировали с использованием ПХ-субстрата (R&D Systems, Cat. № DY998). Планшеты инкубировали в течение 30 минут, а затем для прекращения реакции добавляли блокирующий раствор 450 (100 мкл/лунку, BioFX, Cat# BSTP-0100-01). Оптическую плотность при 450 нм определяли на ридере Spectramax Plus.
В качестве позитивного контроля использовали растворимый рекомбинантный гибридный белок Tie-2/Fc с 10-кратным молярным избытком по отношению к Ang-2. При этой концентрации гибридный белок Tie-2/Fc на 80% ингибировал связывание Ang-2 с иммобилизованным Tie-2. Если этот факт использовать в качестве произвольного критерия, то можно сказать, что 74 из 175 Ang-2-связывающих mAb обнаруживали ингибирующую активность. Для удобства проведения процедур были отобраны 27 наилучших нейтрализующих антител для последующего клонирования гибридом.
Каждую гибридому клонировали методом лимитирующего разведения в соответствии с нижеследующими стандартными процедурами. От каждой гибридомы было взято три сестринских клона. Для каждого клона супернатант тестировали с помощью ELISA-анализа на связывание с человеческим Ang-2 и перекрестное связывание с Ang-1, как было описано выше, для того, чтобы убедиться, что каждое антитело является специфичным только к Ang-2. Затем определяли концентрации IgG в истощающих супернатантах, и один клон из трех сестринских клонов от каждой гибридомы, который имеет наибольший выход, был отобран для очистки IgG. Для дополнительной характеризации из каждого супернатанта было выделено 0,5-1 мг IgG.
Для количественной оценки активности mAb, направленной на ингибирование связывания Ang-2 с Tie-2, определяли титр очищенных mAb из всех наилучших 27 кандидатов с помощью анализа на конкурентное связывание. Каждую концентрацию mAb тестировали в дубликатах. Зависимость “концентрация - ответ” устанавливали по кривой, построенной с использованием графической компьютерной программы Graphpad PrismTM (нелинейной сигмоидной кривой). Максимальное ингибирование (эффективность) и IC50 (активность) вычисляли с использованием компьютерной программы. Десять моноклональных антител, обладающих относительно высокой эффективностью и активностью, отбирали для последующего исследования. Эффективность и активность этих 10 mAb проиллюстрирована в таблице 4.
Эффективность и активность наилучших 10 mAb
ПРИМЕР 5
КАРТИРОВАНИЕ АНТИТЕЛ
Картирование эпитопов проводили для того, чтобы определить, какие из анти-Ang-2 антител конкурируют друг с другом за перекрестное связывание, а поэтому, вероятно, связываются с одним и тем же эпитопом на Ang-2. Процесс картирования описан в заявке на патент США 20030175760, а также в публикации Jia et al., J. Immunol. Methods, (2004) 288:91-98, которые во всей своей полноте вводятся в настоящее описание посредством ссылки. Вкратце, сферы Luminex связывали с мышиным анти-hulgG антителом (Pharmingen# 555784) в соответствии с протоколом связывания белков, который можно найти на web-сайте Luminex. Предварительно связанные сферы получали для связывания с “первым” неизвестным антителом в соответствии с описанной ниже процедурой, при этом указанные сферы хранили в месте, защищенном от воздействия света. Для каждого неизвестного супернатанта использовали отдельные пробирки. Необходимый объем супернатанта вычисляли по следующей формуле: (n×2+10)×50 мкл (где n = общее число образцов). В этом анализе концентрация составляла 0,1 мкг/мл. Маточный раствор для каждой сферы слегка перемешивали и разводили в супернатанте до концентрации 2500 или 0,5×105 сфер/мл в 50 мкл/лунку.
Образцы инкубировали на шейкере в темноте при комнатной температуре в течение ночи.
Фильтрующий планшет предварительно смачивали добавлением 200 мкл промывочного буфера на лунку, а затем этот буфер отсасывали. В каждую лунку фильтрующего планшета добавляли 50 мкл каждой сферы. Образцы один раз промывали путем добавления 100 мкл/лунку промывочного буфера и отсасывания. В указанный фильтрующий планшет добавляли антиген и контроль при 50 мкл/лунку. Затем планшет закрывали, инкубировали в темноте в течение 1 часа на шейкере, после чего образцы 3 раза промывали. После этого добавляли “второе” неизвестное антитело при 50 мкл/лунку. Концентрация “первого” антитела составляла 0,1 мкг/мл. Затем планшеты инкубировали в темноте в течение 2 часов при комнатной температуре на шейкере, после чего образцы 3 раза промывали. Затем добавляли 50 мкл/лунку биотинилированного мышиного антитела против человеческих IgG (Pharmingen #555785), разведенного 1:500, и образцы инкубировали со встряхиванием в темноте в течение 1 часа при комнатной температуре.
Образцы 3 раза промывали. Затем добавляли 50 мкл/лунку стрептавидина-ФЭ, разведенного 1:1000, и образцы инкубировали в темноте в течение 15 минут при комнатной температуре со встряхиванием. После проведения двух циклов промывки на устройстве Luminex 100, образцы 3 раза промывали. Содержимое каждой лунки ресуспендировали в 80 мкл блокирующего буфера. Образцы осторожно перемешивали путем пипетирования несколько раз для ресуспендирования сфер. Затем образцы анализировали на устройстве Luminex 100. Результаты приводятся ниже в таблице 5.
Результаты картирования (Bin) для наилучших 24 позитивных анти-Ang-2 антител в функциональном анализе
ПРИМЕР 6
ОПРЕДЕЛЕНИЕ АФФИННОСТИ АНТИ-ANG-2 АНТИТЕЛ С ПОМОЩЬЮ АНАЛИЗА BIACORE
Скрининг низкого разрешения для 27 очищенных моноклональных антител
Для измерения аффинности антитела к антигену использовали поверхностный плазмонный резонанс без мечения (SPR) или Biacore. Для этих целей на поверхность чипа CM5 Biacore наносили козье анти-человеческое антитело при высокой плотности с применением рутинного метода связывания с амином. Все очищенные mAb разводили примерно до 8 мкг/мл в рабочем буфере HBS-P, содержащем 100 мкг/мл BSA и 10 мг/мл карбоксиметилдекстрана. Каждое mAb иммобилизовали на отдельной поверхности за время контактирования 42 секунды и промывали в течение 5 минут для стабилизации базового уровня mAb.
На все поверхности в течение одной минуты инъецировали Ang-2 при 90,9 нМ, а затем осуществляли диссоциацию в течение 10 минут. Данные двойного эталонного связывания получали путем вычитания величины сигнала из величины сигнала, полученного для контроля в проточной кювете, и вычитания уровня базового “дрейфа” буфера, инъецированного непосредственно перед инъекцией Ang-2. Данные для связывания Ang-2 с каждым mAb нормализовали на количество mAb, иммобилизованных на каждой поверхности, и определяли нормализованные и скорректированные на дрейф ответы для 27 mAb. По имеющимся данным строили общую кривую для модели взаимодействия 1:1 в целях определения кинетики связывания. Результаты кинетического анализа на связывание Ang-2, проводимого при 25ºС, приводятся в нижеследующей таблице, mAb перечислены в порядке убывания аффинности.
Скрининг низкого разрешения Ang-2 с помощью Biacore для 27 очищенных моноклональных антител
антитела (RU)
Звездочки, стоящие после значения kd для всех mAb, за исключением mAb 5.101 и 5.86, указывают на то, что эти величины kd являются постоянными и представляют собой наилучшую оценку для данного порядка величины, характеризующей показатели для низкой скорости диссоциации. Подбор модели для этих образцов не обнаруживал каких-либо заметных изменений в скорости такой диссоциации за относительно короткое время диссоциации, а поэтому для подбора данных скорости ассоциации необходимо, чтобы величина kd была постоянной. Данные для этих антител показали, что указанные антитела с такими величинами kd действуют так же, как и антитела с kd порядка 10-6 с-1, а поэтому эти взаимодействия могут быть в 10 раз или более сильными, чем взаимодействия, указанные выше.
Данные диссоциации обычно измеряли в течение 4-6 часов в экспериментах по кинетике высокого разрешения с использованием mAb, имеющих аффинности менее 100 пМ. Максимальное время диссоциации, которое может быть измерено без артефактов “дрейфа” от иммобилизованного на поверхности mAb, составляет 20 минут. Затухание почти недетектируемых сигналов для mAb с высокой аффинностью измеряли в течение относительно небольшого промежутка времени, а поэтому, величины kd могут значительно варьироваться в пределах значений, составляющих два порядка величины.
ПРИМЕР 7
ОПРЕДЕЛЕНИЕ АФФИННОСТИ АНТИ-ANG-2 АНТИТЕЛА С ПОМОЩЬЮ АНАЛИЗА BIACORE
Скрининг среднего/высокого разрешения Ang-2 с использованием трех очищенных моноклональных антител
Очищенные mAb 5.16, 5.35 и 5.41 разводили приблизительно до 8 мкг/мл в 10 мМ ацетата натрия, pH 5,0. Затем каждое разведенное mAB иммобилизовали на различных поверхностях проточных кювет (чип CM5 Biacore) рутинным методом связывания с амином.
Для получения данных скорости ассоциации произвольно инъецировали восемь концентраций (2-кратные разведения) Ang-2 в пределах 90,9-0,71 нМ в течение 90 секунд с тремя повторностями, при этом делали несколько инъекций буфера поочередно с инъекциями двойного контроля, с последующей диссоциацией в течение четырех минут. Поверхности антител регенерировали посредством двух 9-секундных впрысков 10 мM глицина-HCl, pH 1,5, после каждого цикла инъекций.
Для получения данных скорости диассоциации инъецировали три образца с 90,9 нМ Ang-2 в рабочем буфере HBS-P, содержащем 100 мкг/мл BSA, как описано выше, и величины диссоциации регистрировали в течение восьми часов. Инъекции образца делали поочередно с тремя циклами инъекций слепого контроля. Регенерацию осуществляли, как описано выше.
По имеющимся данным строили общую кривую для модели взаимодействия 1:1 с переносом массы с использованием CLAMP (David G. Myszka and Thomas Morton (1998) "CLAMP©: a biosensor kinetic data analysis program," TIBS 23, 149-150). Полученные константы связывания приводятся в таблице 7.
Скрининг среднего разрешения Ang-2 с помощью Biacore для 3 очищенных моноклональных антител
Значительное затухание сигнала измеряли в течение 8-часовой диссоциации. С использованием данных, полученных для 8-часовой диссоциации, программа CLAMP позволяет более точно определить величину kd для каждого mAb. В данном случае, kd для антител 5.16 и 5.35 составляет порядка 10-6 с-1.
Затем перекрестную реактивность антител против Ang-1 исследовали путем измерения аффинности связывания mAb с Ang-1, как описано в примере 8.
ПРИМЕР 8
ОПРЕДЕЛЕНИЕ АФФИННОСТИ АНТИ-ANG-1 АНТИТЕЛА С ПОМОЩЬЮ АНАЛИЗА BIACORE
Перекрестную реактивность антител против Ang-1 дополнительно исследовали путем измерения аффинности связывания mAb с Ang-1. В данном случае, вместо иммобилизации Ang-1, как проводили в описанном ELISA-анализе на перекрестное связывание (пример 3), осуществляли иммобилизацию анти-Ang-2 mAb на чипах CM5 Biacore, а затем инъецировали Ang-1 в растворе для определения скорости ассоцииации и диссоциации. Шесть mAb, включая 3.3.2, 3.31.2, 5.16.3, 5.86.1, 5.88.3 и 3.19.3, тестировали в этом эксперименте, как описано ниже, для определения уровня их перекрестного связывания с Ang-1.
Скрининг среднего разрешения для шести очищенных моноклональных антител
Для измерения аффинности антитела к Ang-1 использовали поверхностный плазмонный резонанс без мечения (SPR) или устройство Biacore 2000. Для этих целей на поверхность чипа CM5 Biacore наносили козье анти-человеческое антитело при высокой плотности с применением рутинного метода связывания с амином. Для проведения научных экспериментов, очищенные mAb (клоны 3.19.3, 3.3.2, 5.88.3, 5.86.1, 3.31.2, 5.16.3) разводили приблизительно до концентрации 2,5-3,5 мкг/мл в рабочем буфере HBS-P, содержащем 100 мкг/мл BSA. Уровень захвата для каждого mAb составлял приблизительно 150 RU. После каждого цикла по захвату проводили 5-минутную промывку для стабилизации базового уровня mAb.
На все поверхности для захвата антител в течение 1 минуты инъецировали один образец Ang-1, разведенный до 87,4 нМ в рабочем буфере. Для пяти mAb какого-либо обнаружимого связывания не наблюдалось, хотя было обнаружено, что Ang-1 связывается с mAb 3.19.3. Этот эксперимент повторяли с увеличением уровней связывания mAb с лунками в пределах 500-600 RU и инъецированием 380 нМ Ang-1 в течение одной минуты. И в этом случае было обнаружено, что mAb 3.19.3 связывалось с Ang-1.
Поскольку только Ang-1 обнаруживал активность связывания с mAb 3.19.3, то определяли аффинность связывания этого mAb с Ang-1 и Ang-2. Поскольку во время проведения вышеуказанного научного эксперимента Ang-1 обнаруживал низкую скорость диссоциации, то эксперимент по скринингу среднего разрешения на захват антител не давал достаточного количества данных скорости диссоциации, исходя из которых можно было бы точно вычислить величину kd. А поэтому, уровень связывания Ang-1 и Ang-2 с mAb 3.19.3 был измерен с помощью высокоразрешающего анализа Biacore в условиях.
ПРИМЕР 9
ОПРЕДЕЛЕНИЕ АФФИННОСТИ СВЯЗЫВАНИЯ MAB 3.19.3 С ANG-1 И ANG-2 С ПОМОЩЬЮ ВЫСОКОРАЗРЕШАЮЩЕГО АНАЛИЗА BIACORE
Очищенное mAb 3.19.3 разводили приблизительно до 12,5 мкг/мл в 10 мМ ацетата натрия, pH 4,0. Затем каждое mAb иммобилизовали на проточных кюветах 1-3 (чип CM5 Biacore) рутинным методом связывания с амином, а проточную кювету 4 использовали в качестве контроля.
Для получения данных скорости ассоциации произвольно инъецировали восемь концентраций (2-кратные разведения) Ang-1 в пределах 39,8-0,31 нМ (в рабочем буфере HBS-P, содержащем 100 мкг/мл BSA) в течение 90 секунд (скорость потока 100 мкл/мин) с тремя повторностями, при этом делали несколько инъекций буфера поочередно с инъекциями для двойного контроля, с последующей диссоциацией в течение четырех минут. Поверхности антител регенерировали посредством 6-секундных впрысков 10 мM NаОН после каждого цикла инъекций.
Для получения данных скорости диассоциации инъецировали три образца с 19,9 нM Ang-1, как описано выше, и величины диссоциации регистрировали в течение шести часов. Инъекции образца делали поочередно с тремя циклами инъекций слепого контроля. Регенерацию осуществляли как описано выше.
По имеющимся данным строили общую кривую для модели взаимодействия 1:1 с переносом массы с использованием CLAMP (David G. Myszka and Thomas Morton (1998) "CLAMP©: a biosensor kinetic data analysis program," TIBS 23, 149-150).
Исследование Ang-2, проводимое с помощью высокоразрешающего анализа Biacore с использованием очищенного MAb 3.19.3
Очищенное mAb 3.19.3 разводили приблизительно до 12,5 мкг/мл в 10 мМ ацетата натрия, pH 4,0. Затем mAB иммобилизовали на проточных кюветах 1-3 (чип CM5 Biacore) рутинным методом связывания с амином, а проточную кювету 4 использовали в качестве контроля.
Для получения данных скорости ассоциации произвольно инъецировали восемь концентраций (2-кратные разведения) Ang-2 в пределах 30,0-0,23 нМ (в рабочем буфере HBS-P, содержащем 100 мкг/мл BSA) в течение 90 секунд (скорость потока 100 мкл/мин) с тремя повторностями, при этом делали несколько инъекций буфера поочередно с инъекциями для двойного контроля, с последующей диссоциацией в течение четырех минут. Поверхности антител регенерировали посредством 6-секундных впрысков 15 мM NаОН после каждого цикла инъекций.
Для получения данных скорости диассоциации инъецировали три образца с 15,0 нM Ang-2, как описано выше, и величины диссоциации регистрировали в течение шести часов. Инъекции образца делали поочередно с тремя циклами инъекций слепого контроля. После каждого цикла инъекций, каждую поверхность регенерировали посредством 6-секундных впрысков 15 мM NаОН для оценки скорости диссоциации.
По имеющимся данным строили общую кривую для модели взаимодействия 1:1 с переносом массы с использованием CLAMP (David G. Myszka and Thomas Morton (1998) "CLAMP©: a biosensor kinetic data analysis program", TIBS 23, 149-150).
Результаты и обсуждение: исследование связывания Ang-1 и Ang-2 с MAb 3.19.3, проводимого с помощью высокоразрешающего анализа Biacore
Для каждого антигена проводили два независимых эксперимента. Результаты этих экспериментов приводятся ниже в таблице 8.
Результаты исследования связывания Ang-1 и Ang-2 с очищенным mAb 3.19.3, проводимого с помощью высокоразрешающего анализа Biacore
В вышеуказанной таблице значения kd для Ang-2 отмечены звездочками, поскольку эти величины оставались постоянными в процессе моделирования взаимодействия 1:1 с помощью компьютерной программы CLAMP. В экспериментах для Ang-2 какого-либо заметного сигнала диссоциации не было зарегистрировано, а поэтому наилучшая величина скорости диссоциации kd оставалась постоянной на уровне порядка 1×10-6 с-1. Период времени диссоциации для Ang-2 фактически имел тенденцию к его постоянному увеличению в процессе регистрации данных, проводимой в течение шести часов. Эта тенденция повторялась при проведении анализа на двух различных сенсорных чипах с использованием двух различных устройств, а затем оба эти устройства подвергали “суперочистке” в соответствии с протоколом. Для более точного измерения аффинности связывания mAb 3.19.3 с Ang-1 и Ang-2 проводили дополнительный эксперимент (см. пример 10) в целях определения Kd mAb 3.19.3 по отношению к этим антигенам.
Интересно отметить, что в случае, когда Ang-1 был иммобилизован на ELISA-планшете, mAb 3.19.3 не связывалось с Ang-1 в ELISA-анализе на связывание (пример 3). Такое несоотвествие можно объяснить тем, что если Ang-1 был иммобилизован на пластиковой поверхности, то к минорному эпитопу, играющему важную роль в связывании mAb 3.19.3, не был обеспечен соответствующий доступ. Однако, если Ang-1 находился в жидкой фазе, например, обеспечиваемой экспериментальными условиями Biacore, то этот эпитоп становился доступным для mAb 3.19.3, в результате чего происходило связывание.
ПРИМЕР 10
ОПРЕДЕЛЕНИЕ АФФИННОСТИ МАВ 3.19.3 ПО ОТНОШЕНИЮ К ЧЕЛОВЕЧЕСКОМУ Ang-2 С ПОМОЩЬЮ ВЫСОКОРАЗРЕШАЮЩЕГО АНАЛИЗА KINEXA (КИНЕТИЧЕСКОГО ЭКСКЛЮЗИОННОГО АНАЛИЗА)
При измерении аффинности mAb 3.19.3 против человеческого Ang-2 с помощью высокоразрешающего анализа Biacore (пример 9) какого-либо значимого сигнала диссоциации не было обнаружено. Период времени диссоциации для Ang-2 обнаруживал тенденцию к постоянному увеличению в процессе регистрации данных, проводимой в течение шести часов. Исходя из этого, kd mAb 3.19.3, связывающегося с человеческим Ang-2, определяли с применением технологии KinExA, для того, чтобы получить более достоверное значение kd. Для этой цели использовали устройство KinExA 3000. Сначала, в препарате 1 мл (~ 271 мкг) исходного Ang-2 (R&D Systems, Inc., Lot# BNO32510A), буфер заменяли на 1 × PBS, pH 7,0, с использованием 10-миллилитровой обессоливающей колонки (полиакриламидной колонки Pierce D-SaltTM с отсечкой молекулярной массы 6000, Lot# GF97965). Концентрация объединенных фракций составляла 1,7 мкМ, как было определено методом вычисления концентрации белка, описанным С. Nick Pace (Pace, et al., Protein Science, Vol. 4: 2411-2423, 1995). После этого, 450 мкл (~ 122 мкг) исходного Ang-2 связывали с 200 мг полиметилметакрилатных сфер (PMMA, Lot# 206-01), в течение ночи при 24ºС. Затем эти сферы центрифугировали и один раз промывали блокирующим буфером (1 × PBS, 10 мг/мл BSA), после чего их снова центрифугировали, а затем инкубировали в блокирующем буфере в течение одного часа при 24ºС. После блокирования сферы разводили приблизительно в 30 мл буфера HBS (0,01 M Hepes, 0,15 M NaCl, pH 7,4) в стандартном сосуде-резервуаре со сферами KinExA и помещали в указанное устройство.
kd -контролируемое титрование
Двенадцать растворов, содержащих сайт связывания mAb 3.19.3 в концентрации 25,3 пM, титровали с возрастающими концентрациями Ang-2. Для приготовления образцов Ang-2 проводили буферный обмен. Каждый раствор имел общий объем 25 мл, и этот раствор уравновешивали в течение 5 дней при ~24ºС. Растворы для титрования приготавливали в волюметрической стеклянной посуде, при этом концентрации Ang-2 варьировались от 5,09 нM до 99,3 фM. Метод, проводимый на устройстве KinExA для анализа этих растворов, состоял из стадии упаковки сфер, в которой PMMA-сферы упаковывали в стеклянные капиллярные трубочки, и уравновешенные растворы пропускали через колонку со сферами при скорости 0,25 мл/мин в течение 6 минут (1,5 мл) в дубликатах. Затем флуоресцентно меченное козье анти-человеческое (Fc-специфичечское) поликлональное антитело Сy-5 при 3,4 нМ пропускали через упаковку сфер в течение 1 минуты при скорости 0,5 мл/мин для мечения mAb свободными сайтами связывания, иммобилизованными на сферах. Флуоресцентное излучение упаковки сфер измеряли при 670 нм с возбуждением при 620 нм. Полученные результаты измерения флуоресценции преобразовывали в “% свободного сайта связывания mAb" по отношению к общей концентрации антигена с использованием прилагаемого пакета программ KinExA (version 1.0.3, Sapidyne, Inc.). Общая kd-контролируемая кривая титрования была построена с помощью программы KinExA, и эта кривая представляла собой изотерму равновесия 1:1 с поправочным коэффициентом “дрейфа”. Оптимальная величина kd, которая соответствовала этим данным, составляла 86,4 пM с нижним и верхним 95% доверительными пределами, составляющими 64,3 пM и 98,7 пM соответственно. Кривая mAb-контролируемого титрования не приводится.
ПРИМЕР 11
БЛОКИРОВАНИЕ ANG-2-ИНДУЦИРОВАННОГО ФОСФОРИЛИРОВАНИЯ TIE-2, ЭКТОПИЧЕСКИ ЭКСПРЕССИРОВАННОГО В КЛЕТКАХ HEK293
Как обсуждалось выше, Tie-2 представляет собой тирозинкиназный рецептор, специфичный для эндотелиальных клеток. In vitro эксперименты, проводимые с использованием васкулярных эндотелиальных клеток, показали, что Ang-1 индуцирует фосфорилирование Tie-2, а Ang-2 ингибирует фосфорилирование рецептора, индуцированное Ang-1. Однако, если Tie-2 экспрессируется эктопически, например, так, как это происходит в фибробластах, то Ang-2 также способен индуцировать фосфорилирование Tie-2 в некоторых условиях, включая, но не ограничиваясь ими, пролонгированное действие ангиопоэтина-2 или высоких концентраций ангиопоэтина-2.
Ang-2-индуцированное фосфорилирование Tie-2 также происходит в том случае, если рецептор экспрессируется в клетках HEK293F. Способность анти-Ang-2 mAb блокировать Ang-2-индуцированное фосфорилирование Tie-2 оценивали с использованием клеток HEK293F, трансфецированных человеческим рецептором Tie-2. Плазмидный вектор pORK/pBS-SK, имеющий кДНК Tie-2, получали из ATCC (последовательность BC033514: Cat. № 69003, Genbank). Последовательность кДНК подтверждали путем нуклеотидного секвенирования. 3,9 т.п.н. фрагмент, содержащий 3375 п.н. кДНК, кодирущую человеческий Tie-2, удаляли из вектора путем гидролиза ферментом EcoRI. Этот фрагмент субклонировали в функциональной ориентации в вектор pCR3.1, гидролизованный ферментом EcoRI в соответствии со стандартными процедурами. Отобранную плазмиду амплифицировали и очищали в соответствии со стандартными протоколами.
Tie-2-содержащую конструкцию, полученную в соответствии с вышеописанными процедурами, трансфецировали в клетки HEK293F методом трансфекции с использованием фосфата кальция. 1×106 клеток HEK293F культивировали в 100 мм-чашках для культивирования ткани, покрытых 1% желатином, при 37ºС с 5% СО2. Перед трансфекцией клетки подпитывали свежей средой в течение 2-3 часов. 10 мкг плазмидной ДНК растворяли в 248 мМ раствора фосфата кальция. Трансфекцию осуществляли стандартными методами. Стабильные трансфектанты отбирали путем инкубирования в 0,5 мг/мл G418. Стабильные трансфектанты, экспрессирующие Tie-2, идентифицировали с помощью FACS-анализа, проводимого с использованием мышиного анти-Tie-2 mAb (R&D Cat. № MAB313) и ФЭ-конъюгированного козьего антитела против мышиных IgG (Caltag, Cat. № M30004-4) для детектирования.
Для осуществления анализа на фосфорилирование Tie-2, HEK293F/Tie-2-трансфектанты культивировали в 60 мм чашках для культивирования клеток при плотности 2×106 клеток/чашку с полной средой при 37ºС с 5% СО2 до достижения субконфлюэнтности. Полную среду в каждой чашке заменяли 2 мл бессывороточной среды. Клетки инкубировали еще 16 часов. Затем среду снова заменяли 2 мл бессывороточной среды. После инкубирования в течение еще 2 часов клетки обрабатывали 0,1 мМ ортованадата натрия (Sigma, Cat. № S 6508) в течение 20 минут. Клетки обрабатывали Ang-2 (2 мкг/мл) в присутствии или в отсутствии mAb при 100 мкг/мл. Обработку проводили в дубликатах. При этом использовали негативный контроль без Ang-2-обработки. Клетки промывали охлажденным на льду TBS, содержащим ванадат, и подвергали лизису путем добавления 300 мкл/чашку охлажденного буфера для лизиса NP-40 (50 мМ Hepes, pH 7,2, в который были добавлены 0,15 M NaCl, 10% глицерин, 10 мM пирофосфата, 50 мМ NaF, 1% NP40, 100 ед/мл апротинина, 1 мМ PMSF, 0,1 мМ ортованадата, 10 мкM лейпептина и 10 мкM пепстатина A), и чашки помещали на 10 минут на лед. Обработанные клетки соскабливали с этих чашек в микропробирку, предварительно охлажденную на льду.
Клеточные лизаты подвергали кратковременной обработке ультразвуком и центрифугировали при 12000×g в течение 10 минут при 4ºС в настольной микроцентрифуге. Супернатанты собирали в свежие микропробирки, а затем в супернатант добавляли 1-5 мкг анти-Tie-2 mAb (R&D Systems, Inc.), после чего смесь подвергали легкому покачиванию в течение 2 часов при 4ºС. В полученную смесь добавляли 50 мкл иммобилизованного белка А, ImmunoPure (PIERCE Cat. № 20333), и смесь инкубировали, по меньшей мере, в течение 3 часов при 4ºС на платформе-качалке. Комплексы собирали путем центрифугирования при 12000×g в течение 10 минут. После осторожного удаления супернатанта, эти комплексы два раза промывали буфером для лизиса путем центрифугирования (12000×g, 4ºС) в течение 4 минут. Осадок ресуспендировали в 50 мкл 2 × буфера для электрофореза образцов (Invitrogen, Cat. № LC-2676), содержащего 1 мМ β-меркаптоэтанол или ДТТ, и кипятили в течение 5 минут, а затем центрифугировали (12000×g, 4ºС) в течение 5 минут. Супернатанты переносили в свежие пробирки.
Образцы загружали в лунки с ДСН-ПААГ-гелем (например, 4-20% трис-глициновым гелем, Invitrogen, Cat. № EC 6025). Электрофорез осуществляли в трис-глициновой буферной системе. После электрофореза гель блотировали на PVDF-мембрану (Invitrogen, Cat. № LC 2005) в соответствии со стандартным протоколом. Фосфорилирование тирозина подтверждали с использованием в качестве зонда антитело против фосфотирозина 4G10 при концентрации 1 мкг/мл (Upstate, Cat. № 05-321) путем инкубирования в течение 1 часа при комнатной температуре со встряхиванием и с последующей трехкратной промывкой 1 × TBST (TBS с 0,1% твина-20). Связанные антитела детектировали путем инкубирования с конъюгированным с пероксидазой хрена козьим антителом против мышиных IgG (Santa Cruz, Cat. № sc-2302) при разведении 1:10000, в течение 1 часа при комнатной температуре, и последующего усиления хемилюминесцентной реакции с использованием субстратной системы SuperSignal West Dura Extended Duration Substrate system (PIERCE Cat. № 34075). Затем блот очищали восстанавливающим буфером для промывки вестерн-блотов (Restore Western Blot Stripping Buffer) (PIERCE, Cat. № 21059) и снова зондировали специфическими антителами против RTK для проверки уровня загрузки образца.
Было обнаружено, что в случае, если человеческий Tie-2 эктопически экспрессировался в клетках HEK293F, то аутофосфорилирование Tie-2 не наблюдались. В ответ на обработку Ang-2 (2 мкг/мл), значительный уровень фосфорилирования тирозина был детектирован с использованием mAb против фосфорилированного тирозина (4G10) Tie-2, подвергнутого иммунопреципитации специфическим mAb. При концентрации 100 мкг/мл все протестированные анти-Ang-2 mAb значительно ингибировали фосфорилирование Tie-2, тогда как mAb контрольного изотипа не обнаруживали ингибирующего действия (фигура 1). Моноклональное антитело 5.103.1, которое не показано на фигуре 1, обладало аналогичным ингибирующим действием.
Для оценки способности анти-Ang-2 mAb ингибировать Ang-2-индуцированное фосфорилирование Tie-2 in vitro, был разработан метод на основе ELISA-анализа для количественной оценки фосфорилирования Tie-2. Вкратце, клеточные лизаты, полученные от HEK293F/Tie-2-трансфектантов, обрабатывали Ang-2 с использованием mAb при различных концентрациях. Весь Tie-2, полученный из указанного лизата, связывался с лунками 96-луночного ELISA-планшета, который был сенсибилизирован мышиным анти-hTie-2 mAb. Фосфорилированный Tie-2 детектировали с использованием ПХ-конъюгированного “первого” антитела 4G10 (закупленного у Upstate) и раствора ПХ-субстрата. OD при 650 нм определяли на ридере SpectraMax. Зависимость “концентрация - ответ” была установлена с помощью кривой, построенной с использованием графической компьютерной программы Graphpad PrismTM (нелинейной сигмоидной кривой). Максимальное ингибирование (эффективность) и IC50 (активность) вычисляли, как показано на фигуре 2. EC50 вычисляли, как показано в таблице 9.
Как сообщалось выше, было обнаружено, что mAb 3.19.3 перекрестно реагирует с Ang-1. Однако результаты начальных экспериментов не выявили какого-либо ингибирования фосфорилирования Tie-2, индуцированного ангиопоэтином-1 под действием mAb 3.19.3. Следует отметить, что эктопическая экспрессия Tie-2 может влиять на его восприимчивость к активации различными лигандами, на что указывает тот факт, что Ang-2 не индуцирует фосфорилирование Tie-2 в клетках HUVEC, однако, при этом было обнаружено, что он индуцирует стойкое фосфорилирование Tie-2 в том случае, если указанный рецептор эктопически экспрессируется в клетках HEK293.
Исходя из этих результатов были проведены дополнительные эксперименты для того, чтобы точно установить, способно ли mAb 3.19.3 ингибировать связывание Ang-1 и Ang-2 с клеточно-ассоциированным Tie-2. Кроме того, ингибирование индуцированного ангиопоэтином-1 фосфорилирования Tie-2 под действием mAb 3.19.3 было более детально исследовано методом, описанным в примере 12.
ПРИМЕР 12
АНТИТЕЛО ИНГИБИРУЕТ MAB 3.19.3 СВЯЗЫВАНИЕ АНГИОПОЭТИНА-1 С TIE-2 И ANG-1-ИНДУЦИРОВАННОЕ ФОСФОРИЛИРОВАНИЕ TIE-2
mAb 3.19.3 перекрестно реагирует с человеческим Ang-1 (примеры 8 и 9). Однако предварительные эксперименты показали, что mAb 3.19.3 не ингибирует Ang-1-индуцированное фосфорилирование Tie-2. Такое противоречие может объясняться тем, что: (1) для генерирования устойчивого сигнала фосфорилирования Tie-2 может требоваться высокая концентрация Ang-1, которая может быть гораздо выше физиологической концентрации; или (2) эктопическая экспрессия Tie-2 в HEK293 может изменять конформацию Tie-2 и, тем самым изменять его восприимчивость к действию различных лигандов. Для проверки этих гипотез mAb 3.19.3 тестировали в анализе на связывание, где Ang-1 или Ang-2 (3 нМ), связанные с Tie-2 клеточной поверхности, имели низкую концентрацию. В этом эксперименте было обнаружено, что mAb 3.19.3 ингибировало связывание обоих Ang-1 и Ang-2. Кроме того, для исследования Ang-1-индуцированного фосфорилирования Tie-2 использовали иммортализованные эндотелиальные клетки (EA.hy926/B3). Результаты этого эксперимента, более подробно описанного ниже, продемонстрировали, что mAb 3.19.3 ингибирует Ang-1-индуцированное фосфорилирование Tie-2 в зависимости от дозы.
HEK293F/Tie-2-трансфектанты оставляли для роста до 95% конфлюэнтности в культуральных колбах, а затем собирали. Была получена клеточная суспензия, из 4 миллионов клеток/мл в буфере FAC, а затем эту суспензию разделяли на аликвоты и распределяли по лункам 96-луночного полипропиленового планшета при концентрации 50 мкл на лунку. В клеточную суспензию добавляли mAb 3.19.3 в указанных концентрациях. Затем в эту клеточную суспензию добавляли растворы рекомбинантных человеческих Ang-1 и Ang-2 с последующим инкубированием при комнатной температуре в течение 2 часов. Клетки промывали путем центрифугирования планшета при 1200 об/мин в течение 5 минут, после чего супернатант удаляли путем отсасывания, и клетки ресуспендировали в 200 мкл на лунку буфера FACS. Процедуры промывки повторяли два раза. Затем клетки суспендировали в 100 мкл мышиного антитела против 6X-гистидина, разведенного до 2 мкг/мл в буфере FACS, и инкубировали при комнатной температуре в течение 30 минут. После промывки клетки суспендировали в 100 мкл ФЭ-конъюгированного козьего антитела против мышиных IgG, разведенного 1:100 в буфере FACS, и инкубировали при комнатной температуре в течение 30 минут. Объем образцов доводили до 300 мкл путем добавления буфера FACS и измеряли на устройстве FACS Calibur.
Полученные результаты представлены на фигуре 3 и систематизированы в таблице 10. Как было показано выше, растворимый Tie-2/Fc обнаруживал дозозависимое ингибирование связывания Ang-1 и Ang-2 посредством блокирования лигандов, тогда как mAb контрольного изотипа PK16.3.1 не участвовало в связывании с любым из этих лигандов. mAb 3.19.3 обнаруживало зависимое от концентрации ингибирование Ang-1 и Ang-2. Интересно отметить, что как и активность Tie-2/Fc, используемого в качестве стандарта, активность mAb 3.19.3 в связывании с Ang-2 превышала активность связывания с Ang-1.
Ингибирование связывания Ang-1 и Ang-2 с Tie-2
Полученные результаты показали, что mAb 3.19.3 не только связывается с человеческим Ang-1, но также блокирует его связывание с рецептором Tie-2. Это еще раз подтверждается ингибированием Ang-1-индуцированного фосфорилирования Tie-2 в иммортализованных эндотелиальных клетках, как описано ниже.
Активность mAb 3.19.3, направленная на ингибирование Ang-1-индуцированного фосфорилирования Tie-2, была количественно определена, как описано ниже. mAb обнаруживало заметное увеличение уровня ингибирования фосфорилирования Tie-2 при увеличении концентрации антитела, как показано на фигурах 4 и 5. IC50, вычисленная по кривой зависимости “доза - ответ”, составляла 99 нM.
Анализ на фосфорилирование рецептора, стимулированное лигандом ангиопоэтином-1 Tie-2
Клетки EA.hy926/B3 высевали в 6-луночные планшеты при плотности 2,5×105 клеток EA.hy926 на лунку в 2 мл-объеме среды DMEM, содержащей HAT и 10 % FCS, и инкубировали в течение 3 дней в стандартных условиях культивирования клеток млекопитающих.
Культуральную среду заменяли 2 мл среды DMEM (без FCS) и клетки выдерживали в бессывороточной среде в течение всего 2 часов. Тест-соединения двухкратно разводили в среде DMEM, содержащей 1% FCS, до достижения нужной конечной концентрации. После выдерживания клеток в бессывороточной среде в течение 1 часа 40 минут, среду удаляли и заменяли 1 мл разведениями тест-соединения. Аналогичным образом, для получения образцов, которые представляют собой стандарты 100% стимуляции лиганда, также использовали контроль, не обработанный соединением.
Инкубирование осуществляли еще 10 минут, а затем в каждую лунку добавляли 100 мкл 10 мМ ортованадата в растворе DMEM до достижения в каждой лунке конечной концентрации 1 мM ортованадата. Затем клетки инкубировали в течение последних 10 минут 2-часового периода культивирования в бессывороточной среде.
После завершения 2-часового периода культивирования в бессывороточной среде, в каждую лунку добавляли 1 мл ангиопоэтина-1 (разведенного до соответствующей концентрации в среде DMEM, содержащей 1 мМ ортованадата) и инкубировали при 37ºС в течение еще 10 минут.
Затем 6-луночный(ые) планшет(ы) охлаждали путем их помещения на охлажденную льдом металлическую пластину (которая сама находилась на льду). Клеточную среду удаляли, и клеточный слой промывали 5 мл холодного PBS, содержащего 1 мМ ортованадата. Затем в каждую лунку добавляли 1 мл охлажденного на льду буфера для лизиса (20 мМ трис, pH 7,6, 150 мМ NaCl, 50 мМ NaF, 0,1 % ДСН, 1% NP40, 0,5% DOC, 1 мМ ортованадата, 1 мМ EDTA, 1 мМ PMSF, 30 мкл/мл апротинина, 10 мкг/мл пепстатина, 10 мкг/мл лейпептина), и планшет оставляли на льду на 10-20 минут. Клетки соскабливали с планшета с помощью приспособления для соскабливания клеток, после чего весь раствор лизата переносили в 1,5-миллилитровую пробирку Эппендорфа и выдерживали на льду. Затем образцы центрифугировали в течение 3 минут при 13000 об/мин при 4ºС, и все последующие стадии проводили при 4ºС.
50 мкл каждого лизата оставляли для последующего проведения анализа на белок BCA (Pierce, Cat. № 23225) (в полипропиленовых микротитрационных планшетах Greiner для анализа на связывание с низкомолекулярным белком). Концентрацию белка определяли в стандартных аналитических условиях, обеспечиваемых данным набором. Еще 800 мкл каждого образца лизата переносили в свежую 2-миллилитровую пробирку Эппендорфа для проведения иммунопреципитации (ИП). Затем в лизаты добавляли 15 мкл (3 мг) анти-P-Y антитела (Santa Cruz Cat. № E2203) и оставляли на 2 часа при 4°С для инкубирования, после чего добавляли 600 мкл сфер Magnabind (с козьим антителом против мышиных IgG, Pierce Cat. № 21354). Сферы Magnabind получали следующим образом. Необходимый объем переносили в 15-миллилитровые конические пробирки. Затем в этих пробирках создавали магнитное поле, и жидкость удаляли. После этого добавляли свежий PBS в исходном объеме, и сферы ресуспендировали. Эту процедуру повторяли два раза. Затем лизат-содержащий раствор смешивали со сферами, и пробирки оставляли на ночь при 4ºС с вращением на роторном миксере.
Образцы в течение примерно 1 минуты подвергали действию магнита, и жидкость осторожно удаляли. Затем добавляли 1 мл буфера для лизиса, и пробирки вращали в течение 5 минут для промывки. Стадии промывки повторяли два раза. Затем жидкость полностью удаляли, и сферы ресуспендировали в 12 мкл горячего (94ºС) 2 × буфера Лэммли для загрузки образцов + bME, после чего их оставляли на 15 минут при комнатной температуре. Пробирки в течение 1 минуты подвергали действию магнита, и жидкость, которая отделялась от сфер, анализировали с помощью электрофореза в ДСН-ПААГ.
Образцы анализировали с помощью электрофореза в ДСН-ПААГ в 15 лунках с 4-12% бис-трис-гелей NuPAGE/MOPS (Novex). На одну лунку загружали всего 12 мкл каждого иммунопреципитата. Гели подвергали электрофорезу при 200 В/120 мА/25 Ватт в течение 55 минут, а затем образцы подвергали вестерн-блоттингу на нитроцеллюлозной мембране в течение 1 часа 30 минут при 50 В/250 мA. Затем все блоты обрабатывали 5% Marvel в PBS-твине в течение 1 часа при комнатной температуре, после чего промывали PBS-твином.
Кроличье анти-Tie-2 антитело (Santa Cruz Cat. № C1303) разводили 1:500 в 0,5% Marvel/PBS-твине и в каждый блот добавляли 12,5 мл этого антитела, и оставляли на ночь при 4°С. После этого блоты промывали PBS-твином, и в каждый блот добавляли козье антитело против кроличьего POD (Dako Cat. № P 0448) (1:5000-разведение в 0,5% Marvel/PBS-твина), а затем оставляли на 1 час при комнатной температуре. Блоты промывали PBS-твином, и каждый блот проявляли в течение 10 минут с использованием 12,5 мл (равные объемы раствора A и B) реагента Supersignal (PIERCE Cat. № 34080). Затем блоты переносили в рентгеновскую кассету и экспонировали с пленкой (5 сек/15 сек/30 сек/60 сек/150 секунд). На фигуре 4 показан вестерн-блот, иллюстрирующий результаты этого анализа. В этой системе наблюдалось ингибирование стимулированного ангиопоэтином-1 фосфорилирования Tie-2 под действием mAb 3.19.3.
Затем изображения каждого образца на пленке оценивали с использованием системы для анализа изображений FluorS BioRad. Плотность пикселей измеряли как OD/мм2 и выражали в процентах объема. Результаты, выраженные в процентах объема, нормализовали на 1 мг белка/иммунопреципитацию с использованием концентрации белка, определенной в анализе на ВСА и на объем лизата каждого образца, используемого в иммунопреципитации. Процент фосфорилирования каждого образца вычисляли, исходя из того, что за 100% принимали величину фосфорилирования необработанного контрольного образца на каждом геле, а процент ингибирования каждого образца вычисляли, исходя из того, что за 100% принимали величину фосфорилирования, которая сама представляла 0 %-ное ингибирование). Эти величины графически представлены на фигуре 5 и указывают, что IC50 для ингибирования стимулированного ангиопоэтином-1 фосфорилирования Tie-2 составляет 99 нМ.
В целом эти данные показали, что в данной системе mAb ингибирует индуцированное ангиопоэтином-1 фосфорилирование Tie-2.
ПРИМЕР 13
СТРУКТУРНЫЙ АНАЛИЗ АНТИ-ANG-2 АНТИТЕЛ
Вариабельные области тяжелых цепей и легких цепей антител секвенировали для определения их последовательностей ДНК. Полная информация о последовательностях анти-Ang-2 антител приводится в списке нуклеотидных последовательностей и аминокислотных последовательностей для каждой комбинации цепей гамма и каппа. Последовательности вариабельных областей тяжелой цепи анализировали для определения последовательностей VH-семейства, D-области и J-области. Затем эти последовательности транслировали для определения первичной аминокислотной последовательности и сравнивали с последовательностями VH-семейства, D-области и J-области зародышевой линии для оценки соматических гипермутаций.
В таблице 11 проиллюстрировано сравнение областей тяжелой цепи антител с их когнатной областью тяжелой цепи зародышевой линии. В таблице 12 проиллюстрировано сравнение областей легкой цепи каппа антител с их когнатной областью легкой цепи зародышевой линии.
Вариабельные (V) области цепей иммуноглобулина кодируются множеством ДНК-сегментов зародышевой линии, которые присоединяются к функциональным вариабельным областям (VHDJH или VKJK) в процессе B-клеточной онтогении. Молекулярные и генетические различия в гуморальных ответах на Ang-2 были исследованы более детально. Эти анализы выявили несколько участков, специфичных для анти-Ang-2 антител.
Анализ 152 отдельных антител, специфичных к Ang-2, выявил, что указанные антитела происходят от 21 различных генов VH зародышевой линии, а 112 из этих антител принадлежат к семейству VH3, при этом 46 антител происходят от сегмента гена VH3-33. В таблицах 11 и 12 приводятся результаты этого анализа.
Следует отметить, что аминокислотные последовательности сестринских клонов, собранных от каждой гибридомы, являются идентичными. Так, например, последовательности тяжелой цепи и легкой цепи mAb 3.19.3 идентичны последовательностям mAb 3.19 и 3.19.1., представленным в таблицах 11 и 12.
ПРИМЕР 14
ОПРЕДЕЛЕНИЕ КАНОНИЧЕСКИХ КЛАССОВ АНТИТЕЛ
Чотия и др. описали структуру антител, и в этом описании, для гипервариабельных областей каждой цепи иммуноглобулина они использовали термин “канонические классы” (J. Mol. Biol. 1987 Aug 20; 196(4):901-17). Были проанализированы атомные структуры Fab- и VL-фрагментов различных иммуноглобулинов для определения взаимосвязи между их аминокислотными последовательностями и трехмерными структурами их антигенсвязывающих сайтов. Чотия и др. обнаружили, что имеется относительно небольшое количество остатков, которые благодаря их упаковке, водородным связям или способности приобретать необычные фи-, пси- или омега-конформации, ответственны, главным образом, за конформацию главной цепи гипервариабельных областей. Было обнаружено, что эти остатки присутствуют в сайтах указанных гипервариабельных областей и в консервативной бета-складчатой каркасной структуре. Путем оценки последовательностей иммуноглобулинов с неизвестной структурой, Чотия и др. обнаружили, что многие иммуноглобулины имеют гипервариабельные области, которые, по своему размеру, аналогичны одной из известных структур и, кроме того, содержат идентичные остатки в сайтах, ответственных за наблюдаемую конформацию.
Это их открытие навело на мысль, что указанные гипервариабельные области имеют конформации, сходные с конформациями известных структур. Для пяти гипервариабельных областей репертуар конформаций, очевидно, ограничен относительно небольшим числом дискретных структурных классов. Эти наиболее часто встречающиеся конформации главной цепи гипервариабельных областей называются “каноническими структурами”. Последующие работы Чотия и др. (Nature 1989 Dec 21-28; 342(6252):877-83) и других авторов (Martin, et al. J. Mol. Biol. 1996 Nov 15; 263(5):800-15) подтвердили, что, по меньшей мере, в пяти из шести гипервариабельных областей антител имеется небольшой набор конформаций главной цепи.
CDR каждого описанного выше антитела анализировали для определения их канонических классов. Как известно, канонические классы было присвоены лишь CDRl и CDR2 тяжелой цепи антитела, а также CDRl, CDR2 и CDR3 легкой цепи антитела. Результаты этого анализа систематизировали в нижеследующей таблице (таблица 13). Данные канонических классов представлены в форме *HCDR1-HCDR2-LCDR1-LCDR2-LCDR3, где “HCDR" означает CDR тяжелой цепи, а “LCDR" означает CDR легкой цепи. Так, например, канонический класс 1-3-2-1-5 присваиваеся антителу, которое имеет HCDRl, соответствующую каноническому классу 1, HCDR2, соответствующую каноническому классу 3, LCDRl, соответствующую каноническому классу 2, LCDR2, соответствующую каноническому классу 1, и LCDR3, соответствующую каноническому классу 5.
Конкретный канонический класс присваивается в том случае, если аминокислоты в указанном антителе на 70% или более идентичны аминокислотам, определенным для каждого канонического класса. Если идентичность составляет менее 70%, то присвоенный канонический класс отмечен звездочкой (“*”), которая указывает на то, что для определения истинного канонического класса была сделана наилучшая оценка, исходя из длины каждой CDR, и полученные данные были объединены. В случае, если длина какого-либо CDR не соответствует какому-либо каноническому классу, то присвоенный канонический класс обозначали “Y”. Аминокислоты, определенные для каждого антитела, можно найти, например, в статьях Чотия и др., указанных выше. В таблице 13 приводятся данные канонических классов для каждого из анти-Ang-2 антител.
Канонические классы антител против Ang-2
В таблице 14 проиллюстрирован анализ, проведенный для определения числа антител в каждом классе. Канонические классы антител приводятся в левой колонке, а число антител, принадлежащих к конкретному каноническому классу, приводится в правой колонке.
Число анти-Ang-2 антител в каждом каноническом классе
1. Цифры, обозначенные *, означают, что это антитело имеет наилучшее соответствие данному классу, хотя в определенных положениях этого антитела имеются некоторые отклонения.
2. Y означает, что длина какого-либо CDR не соответствует данному каноническому классу.
ПРИМЕР 15
КАРТИРОВАНИЕ ЭПИТОПОВ АНТИТЕЛ ПРОТИВ Ang-2
Был проанализирован связывающий домен для 27 антител, нейтрализующих активность Ang-2.
Рекомбинантный человеческий Ang-2 закупали у фирмы R&D systems (623-AN). Козьи поликлональные антитела против человеческого Ang-2 (R&D systems AF623) отбирали на их способность распознавать rhAng-2 в прямом ELISA и вестерн-блот-анализах. Поликлональные антитела биотинилировали для детектирования с использованием ПХ-конъюгированным стрептавидина.
Все рестриктирующие ферменты были закуплены у фирмы New England Biolabs и были использованы в соответствии с инструкциями производителя. Все плазмиды ДНК очищали на центрифужных миниколонках (Invitrogen, Carlsbad, CA). Олигонуклеотидные праймеры, используемые для клонирования и сайт-направленного мутагенеза, были синтезированы фирмой Qiagen Operon.
Антитела: 27 человеческих анти-Ang-2 антител, происходящих от гибридомы, были отобраны, исходя из их способности ингибировать связывание rhAng-2 с его рецептором. Эти антитела перечислены ниже в таблице 15.
Характеризация эпитопов для 27 нейтрализующих анти-Ang-2 антител
Дот-блоты
RhAng-2 (R&D systems) наносили пятнами на нитроцеллюлозную мембрану в нативной или восстановленной форме с использованием устройства для микрофильтрации Bio-Dot. Все человеческие моноклональные антитела (MAb), вырабатываемые против человеческого Ang-2, связывались с невосстановленным Ang-2, но не связывались с его восстановленной формой, что указывает на то, что все mAb распознают конформационные эпитопы, которые, очевидно, разрушаются после восстановления белка.
Клонирование и экспрессии белков Angl и Ang-2
Для лучшего понимания структурной основы взаимодействия mAb с Ang-2 была использована серия химерных молекул Angl/Ang-2. Этот метод имеет то преимущество, что члены семейства ангиогенных белков являются структурно родственными. Хотя последовательности белков Ang-2 и Angl имеют только 60% гомологию, однако, оба они имеют одинаковую модульную структуру, состоящую из амино-концевого суперспирализованного домена и карбокси-концевого фибриноген-подобного домена.
Клонирование человеческого Ang-1 и Ang-2
Две альтернативно сплайсированные формы кДНК человеческого Ang-2 амплифицировали из эндотелиальной клеточной линии человеческой пупочной вены (HUVEC). ПЦР-амплификация кДНК HUVEC, проводимая с использованием Ang-2-специфических праймеров, указывала на присутствие полноразмерного Ang-2 (1491 п.н.) и варианта Ang-2443, состоящего из 1330 пар нуклеотидов (Injune et al., (2000) JBC 275: 18550). Ang-2443 представляет собой вариант, генерированный посредством альтернативного сплайсинга экзона B и удаления части суперспирализованного домена (аминокислоты 96-148). Обе кДНК Ang-2 клонировали в экспрессионный вектор pCR3.1 и экспрессировали в клетках 293F, как показано на фигуре 6. кДНК человеческого Ang-1 получали с помощью ОT-ПЦР, проводимой с использованием полноразмерной РНК, экстрагированной из клеточной линии человеческой молочной железы MDA-MB-231. 1,5 т.п.н. кДНК клонировали в экспрессионный вектор pCR3.1, и ее экспрессию детектировали в супернатанте временно трансфецированных клеток 293F.
ELISA
Связывание 27 mAb с супернатантами, полученными в результате временной трансфекции кДНК Ang-2 и Ang-l, тестировали с помощью ELISA с захватом антител. Ang-2, Ang-2443 и Ang-1 связывались с козьими поликлональными антителами против Ang-2 или Ang-1 (соответственно), присутствующими на ELISA-планшете. Связывание 27 наилучших человеческих моноклональных антител детектировали с использованием ПХ-конъюгированного козьего анти-человеческого антитела, а затем с использованием колориметрического субстрата пероксидазы хрена (активированный субстрат Enhanced K-Blue TMB, Neogen Corporation). Оптическую плотность в каждой лунке ELISA-планшетов измеряли при 450 нм на ридере для микротитрационных планшетов.
Трансфекция клеток 293F
Эмбриональные клетки почек человека 293F поддерживали в 10% фетальной бычьей сыворотке в модифицированной по способу Дульбекко среде Игла, в которую были добавлены пенициллин и стрептомицин. Клетки 293F подвергали временной трансфекции с использованием фосфата кальция. Через 72 часа среду собирали и фильтровали для проведения ELISA и вестерн-блот-анализов.
Было показано, что все 27 антител специфически связываются с антигенами Ang-2/Ang-2443. Какой-либо перекрестной реактивности с человеческим Ang-1 не было обнаружено. Аминокислоты 96-148 в суперспирализованном домене Ang-2, которые отсутствовали в последовательности белка Ang-2443 и которые представляли собой связывающий домен в каждом из 27 антител, были исключены.
Конструирование химерных молекул Ang-l/Ang-2
Для конструирования гибридных химерных белков ангиопоэтина были использованы рестрикционные сайты, обычно присутствующие в генах человеческих Ang-1 и Ang-2 в той же рамке считывания.
Были сделаны четыре конструкции: человеческие Ang-1/2Bsml, Ang-2/lBsmI, Ang-1/2SspI и Ang-2/1Sspl. Все белки экспрессировались и секретировались на детектируемых уровнях, как было определено с помощью ELISA-анализа с использованием поликлональных антител против человеческих Ang-1 и Ang-2.
Сайты присоединения аминокислот находятся в следующих положениях:
Bsml- 117(Ang-2)/l19(Ang-1)
Sspl- 353(Ang-2)/354(Ang-l)
Отличие в одной аминокислоте обусловлено тем, что в человеческом Ang-1 присутствует 497 остатков, а в человеческом Ang-2 присутствует 496 остатков. Все конструкции были экспрессированы в клетках 293F и детектированы с использованием козьих анти-человеческих поликлональных антител против Ang-1 и Ang-2. Наилучшие 27 антител тестировали на их способность связываться с химерными молекулами Ang-1/2. Все 27 антител обнаруживали аналогичную картину связывания только с конструкцией Ang-1/2BsmI. Результаты этих экспериментов показали, что связывающий домен для всех антител находится в положениях остатков 117-496, а наиболее вероятно, в фибриноген-связывающем домене, причем в гибридных белках SspI-Ang эпитоп, находящийся в непосредственной близости к положению аминокислоты 353, был разрушен.
Конструирование химерных молекул “мышиный/человеческий Ang-2”
Поскольку аминокислотная последовательность Ang-2 примерно на 55% идентична аминокислотной последовательности Ang-1, то достаточно трудно найти общий рестрикционный сайт, который может быть использован для клонирования химерных молекул. Последовательности мышиного и человеческого Ang-2 имеют большее сходство, т.е. они гомологичны примерно на 85%. кДНК мышиного Ang-2, клонированная в экспрессионный вектор pCMCsport, была закуплена у фирмы Invitrogen. 27 отобранных антител были протестированы на их иммунореактивность с рекомбинантным мышиным Ang-2. 6 из 27 антител, перекрестно реагирующих с мышиным Ang-2, обладали 100% иммунореактивностью по отношению к человеческому Ang-2, что указывает на то, что этот мышиный антиген сохраняет наибольший уровень имммунореактивности человеческого Ang-2 (данные систематизированы в таблице 16).
Химерная система “человек-мышь” была выбрана для картирования эпитопов, исходя из того, что большинство антител специфически связываются с человеческим антигеном Ang-2 и перекрестно не реагируют с мышиным Ang-2. Различные кДНК-конструкции Ang-2 генерировали и клонировали в экспрессионный вектор млекопитающих.
Конструкции мышиного/человеческого Ang-2 получали с использованием общего рестрикционного StuI-сайта, локализованного в фибриноген-связывающем домене, где точка стыка мышиных и человеческих аминокислот находится в положении остатка 311. Все mAb, специфичные к человеческому Ang-2, обладали способностью связываться с Stu1-сайтом мышиного/человеческого Ang-2, что указывает на то, что связывающий домен находится в фибриноген-связывающем домене в положениях остатков 311-496. Для сужения связывающего домена получали новую конструкцию, в которой мышиная последовательность в кДНК мышиного Ang-2 была заменена человеческим фрагментом StuI-TfiI (фигура 9).
Все антитела, специфичные к человеческому Ang-2, обнаруживали позитивный ELISA-сигнал, и их иммунореактивность по отношению к человеческому Ang-2 составляла 15-100%. Связывающий домен двух антител с уникальным геном, встречающимся в области VH, обозначаемой 5.35.1 (VH3-20) и 5.28.1 (VH3-43) и указанной в таблице 17, был картирован для области аминокислот 310-400.
Было показано, что антитела, перекрестно реагирующие с мышиным Ang-2, как и ожидалось, обладают 100% реактивностью и не могут быть картированы с использованием химерных конструкций мышь/человек.
Сайт-направленный мутагенез
Для определения остатков, играющих важную роль в связывании и присутствующих в сайте связывания различных антител, несколько остатков человеческого Ang-2 были мутированы и скринированы по всей панели антител на связывание в ELISA-анализе.
Поскольку прямое связывание, детектируемое с помощью ELISA, является нечувствительным к небольшим и умеренным изменениям аффинности, то значительные изменения в связывании, наблюдаемые после замены одной аминокислоты, вероятно, позволят идентифицировать ключевые сайты, которые взаимодействуют с антителом. Кроме того, поликлональные антитела против человеческого Ang-2 сохраняют 100% реактивность по отношению к каждой конструкции, что указывает на то, что такая процедура мутагенеза не вносит какие-либо значительные структурные замены в молекулу Ang-2. У всех 27 антител какого-либо эффекта от двух независимых замен VaI на Met в положении 345 (V345M) и His на GIn в положении 375 (H375Q) не наблюдалось, что указывало на то, что эти остатки не являются реактивными, или на то, что для осуществления изменений в конформационных эпитопах требуется более чем одна аминокислотная замена. Замена сразу двух остатков в положениях 365 и 367 приводила к резкому изменению уровня связывания одного антитела Mab 5.35.1. Анализ последовательности антитела 5.35.1 выявил одну область VH3-20 и одну область CDR3 на тяжелой и легкой цепях. Все точки присоединения химерных молекул Ang-2 и точковые мутации выделены на фигуре 8. На фигуре 9 проиллюстрировано сравнение аминокислотных последовательностей мышиного Ang-1 (SEQ ID NO:5), человеческого Ang-1 (SEQ ID NO:2), мышиного Ang-2 (SEQ ID NO:4), и человеческого Ang-2 (SEQ ID NO:3). Стрелки указывают на сайт отщепления для гидрофобных лидерных последовательностей. Эти стрелки определяют пределы суперcпирализованных и фибриноген-подобных доменов. Заштрихованные кружки означают консервативные цистеиновые остатки (эти данные были взяты из публикации Maisonpierre et al., 1997, Science 277:55).
Данные связывания со всеми молекулами Ang-2 систематизированы ниже в таблице 16:
деляли
Данные представлены как процент связывания по сравнению с человеческим Ang-2.
Анализ последовательности и перекрестная реактивность с мышиным Ang-2
Анализ последовательностей IgH и IgL осуществляли с использованием компьютерных программ для анализа последовательностей и путем соспоставления последовательностей генов VH с последовательностями зародышевой линии, имеющимися в базе данных. Эта компьютерная программа также позволяет проанализировать элементы D, рамку считывания, области вставки N, присоединение нуклеотидов Р, потерю нуклеотидов и длину CDR3. Анализ 27 отдельных антител, специфичных к CR64, выявил, что только 7 генов VH этих антител принадлежат к зародышевой линии, а 10 генов этих антител принадлежат к одному и тому же семейству VHl. Отбор нейтрализующих антител показал, что эти антитела экспрессировали одну и ту же VН Ig, а в некоторых случаях, одни и те же реаранжировки VHDJH, и что пары H- и L-цепей были консервативными. Эти результаты дают основание предположить, что для любого данного эпитопа, в образовании соответствующего паратопа участвуют только несколько членов репертуара зародышевой линии, а для каждого антигенного эпитопа, в образовании специфического паратопа может участвовать лишь ограниченное число пар генов L- и H-цепи.
Периодическая встречаемость аналогичных структур VH, VK и гипервариабельной области (комплементарность-определяющей области, CDR) в различных моноклональных антителах обусловлена тем фактом, что вся Ang-2-нейтрализующая активность ограничена фибриноген-подобным доменом, и этот вывод совпадает с мнением, высказанным в работе, опубликованной Procopio et al. (1999, JBC 274: 30196), что свидетельствует о том, что влияние Ang-2 на Tie-2 зависит от присутствия фибриноген-подобного домена. Данные картирования эпитопов показали, что моноклональные антитела связываются с Ang-2 посредством обширной пограничной области, которая включает большинство фибриноген-подобных доменов.
ПРИМЕР 16
ОПРЕДЕЛЕНИЕ ПЕРЕКРЕСТНОЙ РЕАКТИВНОСТИ С МЫШИНЫМ ANG-2
Перекрестную реактивность mAb против человеческого Ang-2 с мышиным Ang-2 анализировали с помощью ELISA. Для этой цели конструировали экспрессионный вектор, содержащий мышиный Ang-2, и эукариотические клетки подвергали временной трансфекции для продуцирования мышиного Ang-2.
Экспрессионную конструкцию мышиного ангиопоэтина-2 (mAng-2) получали у Research Genetics, дистрибьютера консорциума I.M.A.G.E consortium (см. сайт www/image.llnl.gov). кДНК мышиного Ang-2 (GenBank Accession № BC027216, IMAGE:3494566) получали из библиотеки NCI_CGAP_Lu29, которая представляет собой библиотеку опухолевых клеток легких. кДНК клонировали в экспрессионный вектор pCMV-SPORT6 (Invitrogen Carlsbad, CA) посредством SalI(5')- и Notl(3')-сайтов, и этот вектор содержал открытую рамку считывания из 496 аминокислот полноразмерного мышиного Ang-2 (mAng-2), а также 5'- и 3'-нетранслируемые фланкирующие области для всех 2471 пар нуклеотидов.
10 мкг вышеуказанной mAng-2-плазмиды трансфецировали в клетки HEK293F фосфатно-кальциевым методом. Приблизительно, 1×106 клеток HEK293F высевали на 10 см-планшет для культивирования тканей за один день до начала культивирования. Через 5 часов после трансфекции или после ночной трансфекции, среду заменяли и клетки культивировали еще 2-3 дня, а затем собирали супернатанты, содержащие секретированный белок mAng-2. Экспрессию mAng-2 подтверждали с помощью ELISA-анализа, проводимого с использованием поликлонального антитела, полученного от фирмы R&D Systems (catalog № AF623).
96-луночные планшеты Nunc Immplates сенсибилизировали кондиционированной средой, собранной из трансфектантов HEK293F/мышиного Ang-2, по 100 мкл в каждой лунке. Планшеты инкубировали при 4ºС в течение ночи, а затем четыре раза промывали забуференным фосфатом физиологическим раствором на промывочном устройстве Skan Washer 300 (SKATRON). Лунки блокировали 100 мкл ABX-блокирующего буфера (0,5% BSA, 0,1% Твин, 0,01% тимерозал в PBS) в течение 1 часа. Затем в лунки добавляли анти-Ang-2 mAb в соответствующих концентрациях, разведенные в блокирующем буфере, в объеме 100 мкл/лунку, и инкубировали при комнатной температуре, по меньшей мере, в течение 1 часа. mAb и каждое из их разведений тестировали в дубликате. После двухкратной промывки связанные mAb детектировали с использованием HPPO-конъюгированного козьего антитела против человеческого Fc (Caltag, Code Hl 0507) при разведении 1/1000 при комнатной температуре в течение 1 часа. Для детектирования хромогенной реакции добавляли 100 мкл субстрата TMB (TMB-microwell, BioFX, Cat. № TMSK-1000-01), а затем лунки три раза промывали PBS. Планшеты инкубировали в течение 30 минут, а затем реакцию прекращали путем добавления блокирующего раствора 650 (100 мкл/лунку, BioFX, Cat. № BSTP-0100-01). Оптическую плотность при 650 нм определяли на ридере Spectramax Plus.
В этом анализе было протестировано 27 наилучших нейтрализующих mAb. Оптическая плотность показала, что моноклональные антитела 3.19.3, 3.38, 5.2.1, 5.52.1, 5.56.1 и 5.78.1 обладают способностью связываться с мышиным Ang-2 в экспериментальных условиях. Для подтверждения этого, каждое связывающее антитело титровали с помощью ELISA. На фигуре 10 представлен график зависимости средних значений OD650 нм (± ср. кв.от.) от логарифмических концентраций mAb (мкг/мл). На этой фигуре также представлены клоны 5.2.1, 5.28.1, 3.19.3 и 3.31.2. Дозозависимое связывание моноклональных антител 5.2.1 и 3.19.3 с мышиным Ang-2 достигало насыщения примерно при 10 мкг/мл (фигура 10). Кривые связывания для этих двух mAb были типичными сигмоидальными кривыми зависимости “доза-ответ”. Зависимость от дозы и насыщение не наблюдались у протестированных антител в определенном интервале концентраций, за исключением клонов 5.2.1 и 3.19.3. На основании этих данных можно сделать вывод, что перекрестной реактивностью с мышиным Ang-2 обладали только mAb 5.2.1 и 3.19.3.
ПРИМЕР 17
ИНГИБИРОВАНИЕ СВЯЗЫВАНИЯ МЫШИНОГО ANG-2 С ЧЕЛОВЕЧЕСКИМ TIE-2
Моноклональное антитело 3.19.3 было отобрано для дальнейшего анализа его способности ингибировать связывание мышиного Ang-2 с человеческим Tie-2. Для этой цели ELISA-планшет сенсибилизировали 4 мкг/мл hTie-2/Fc (R&D Systems, Inc.) при 100 мкл/лунку, и лунки блокировали рутинным методом при 4ºС в течение ночи. Рекомбинантный мышиный Ang-2 (mAng-2) был использован в супернатанте культуры 293T/mAng-2-трансфектантов, описанных выше. В предварительно сенсибилизированные лунки добавляли 100 мкл mAng-2-содержащего супернатанта с mAb 3.19.3 в различных концентрациях и инкубировали при комнатной температуре в течение 1 часа.
В качестве контроля также использовали рекомбинантный человеческий Ang-2 (R&D Systems, Inc.), смешанный с антителом. Каждую концентрацию mAb тестировали с тремя повторностями. Связанный мышиный и человеческий Ang-2 детектировали с использованием козьего поликлонального антитела против человеческого Ang-2 (Santa Cruz Biotechnology, Santa Cruz, CA), которое перекрестно реагирует с мышиным Ang-2, связанным со “вторым” ПХ-конюъгированным кроличьим антителом против козьих IgG. Через 30 минут после добавления ПХ-субстрата определяли OD650. Было обнаружено, что mAb 3.19.3 ингибирует связывание человеческого и мышиного Ang-2 с человеческим Tie-2 в зависимости от дозы (фигура 11).
ПРИМЕР 18
ОПРЕДЕЛЕНИЕ ПЕРЕКРЕСТНОЙ РЕАКТИВНОСТИ С КАПИЛЛЯРНОЙ СЕТЬЮ ОБЕЗЬЯН
Поскольку Ang-2 специфически экспрессируется в ангиогенных эндотелиальных клетках, то обезьяньи клетки подвергали иммуногистохимическому окрашиванию анти-Ang-2 антителами для того, чтобы косвенно определить, может ли такое антитело перекрестно реагировать с обезьяньим Ang-2.
В этом эксперименте оценивали 10 наилучших нейтрализующих mAb, отобранных как описано в примере 4 (таблица 4), с использованием выделенной из обезьяньей ткани яичника, обогащенной эндотелиальными клетками. Полностью осушенные 6 мкм-срезы замороженной ткани яичника обезьян (собакоподобных обезьян) фиксировали ацетоном при 4ºС в течение 5 минут. После трехкратной PBS-промывки предметных стекол, эндогенную пероксидазу тканей блокировали 0,3% H2O2 в течение 10 минут. Затем ткани промывали PBS и блокировали 10 мкг/мл козьего Fab против человеческих IgG в течение 15 минут. Срезы тканей снова промывали PBS, а затем обрабатывали 10% нормальной козьей сывороткой в течение 10 минут. После дренирования сыворотки на срезы наносили каждое из 10 анти-Ang-2 mAb (10 мкг/мл) и инкубировали в течение 2 часов. Связанные анти-Ang-2 mAb детектировали с использованием 10 мкг/мл мышиного антитела против человеческих IgG в течение 15 минут, а затем инкубировали с конъюгированным с пероксидазой козьим антителом против мышиных IgG в течение 30 минут. Для получения оптимального результата окрашивание проводили с использованием AEC-субстратной системы (DAKO, Cat. № 3464) под микроскопом.
Было обнаружено, что все 10 mAb окрашивали ангиогенные васкулярные эндотелиальные клетки ткани яичника, тогда как mAb контрольного изотипа не давали такого окрашивания. Это указывает на то, что 10 mAb, представленных в таблице 4, перекрестно реагируют с обезьяньим Ang-2.
ПРИМЕР 19
MAB 3.19.3 ИНГИБИРУЕТ IN VIVO АНГИОГЕНЕЗ В АНАЛИЗЕ, ПРОВОДИМОМ В МАТРИКСНОМ БЛОКЕ MATRIGEL
Для in vivo оценки возможной антиангиогенной способности моноклональных анти-Ang-2 антител проводили анализ на ангиогенез в матриксном блоке Matrigel. Было обнаружено, что клетки MCF-7, при их культивировании in vitro или при имплантации иммунодефицитным мышам в качестве ксенотрансплантата, продуцируют Ang-2. При введениии MCF-7 в матрикс Matrigel и подкожной имплантации “голым” мышам наблюдался устойчивый рост сосудов в геле. Для получения модели матриксного блока Matrigel были использованы 6-8-недельные самки мышей BALB/c/nu/nu с массой тела от 18 до 20 г (Charles River Laboratories, Wilmington, MA). “Голым” мышам подкожно инъецировали в правый бок всего 0,5 мл Matrigel, содержащего 2×106 клеток MCF-7, с анти-Ang-2 антителами или без этих антител, или контрольные агенты (включая один Matrigel, контрольные изотипы Tie-2/Fc, IgG2 и IgG4, и анти-VEGF mAb). Каждая тест-группа включала по пять мышей. Концентрацию всех тестируемых mAb доводили до 100 мкг/мл.
Через семь дней блоки Matrigel собирали и оценивали на плотность кровеносных сосудов. Для этой цели мышей умерщвляли путем смещения шейных позвонков при глубокой анестезии. Блоки Matrigel вскрывали путем удаления покрывающего эти блоки кожного лоскута. Затем блоки Matrigel удаляли и получали цифровые фотографии. Блоки Matrigel осторожно вырезали и разрезали на две части. Одну часть быстро замораживали в TissueTek, а другую часть фиксировали в забуференном формалине. После этого, обе части заливали в парафин для получения срезов. Три среза толщиной 5-7 мкм, полученных от каждой мыши, разрезали и окрашивали гематоксилином и эозином. Затем срезы оценивали в фазоконтрастном микроскопе. Были получены репрезентативные микрофотографии [в двух форматах (100 Х и 400 Х)], которые оценивали на инфильтрацию эндотелиальных клеток и кровеносных сосудов.
Замороженные блоки Matrigel использовали для изготовления срезов (10 мкм-срезов) с помощью микротома Cryocut. Для каждой мыши изготавливали два независимых среза, которые использовали для окрашивания. Срезы блокировали BSA (0,1%), а затем обрабатывали моноклональным антителом, реагирующим с мышиным CD31, конъюгированным с фикоэритрином (при разведениях, рекомендованных производителем). После тщательных промывок срезы помещали под реагент, предотвращающий обесцвечивание (Vecta Shield), и наблюдали под УФ-микроскопом с использованием красного фильтра. В результате были получены репрезентативные цифровые изображения [в двух форматах (два изображения с увеличением 100 Х и 200 Х)]. Ядра подвергали контрастному окрашиванию DAPI. Окрашивание иммунофлуоресцентных изображений CD31 анализировали с помощью программы по скелетированию. Полученные данные обрабатывали для вычисления величин средней плотности, числа узлов и длины сосудов для каждой группы. Результаты представлены на фигурах 12A и 12B, где проиллюстрировано влияние анти-Ang-2 антител на число ответвлений кровеносных сосудов (фигура 12A) и на длину кровеносных сосудов (фигура 12B).
Этот эксперимент продемонстрировал, что по сравнению с одним матриксом Matrigel, клетки MCF-7, которые были введены в Matrigel, обладали способностью индуцировать значительный уровень ангиогенезе. Индуцированный ангиогенез может быть ингибирован анти-VEGF антителом, используемым в качестве позитивного контроля. Такой ангиогенез также значительно ингибировался растворимым рекомбинантным белком Tie-2/Fc, что позволяет предположить, что Ang-2, продуцируемый клетками MCF-7, играет определенную роль в ангиогенезе в данной модели. При связывании с любым Ang-2, Tie-2/Fc должен эффективно снижать уровень Ang-2, который был доступен для клеток MCF-7.
Однако остается неясным, каким образом антитело изотипа IgG2, PK16.1.3, используемое в качестве негативного контроля, влияет на ангиогенез, хотя было также обнаружено, что это антитело иногда препятствует росту опухоли в некоторых моделях ксенотрансплантатов (данные не приводятся). Контрольное антитело изотипа IgG4 не оказывало какого-либо влияния на ангиогенез в кэтой модели. Как показано на фигурах 12A и 12B, клоны 5.88.3, 3.3.2, 3.19.3 и 5.28.1 значительно ингибировали ангиогенез (P<0,05, т-критерий был проведен специалистами фирмы VasculoGen), тогда как другие клоны давали меньший эффект.
Было точно установлено, что Ang-2 экспрессируется эндотелиальными клетками в опухоли, а поэтому он рассмтаривается как аутокринный ангиогенный фактор. Однако было также обнаружено, что Ang-2 экспрессируется в опухолевых клетках многих типов in vitro и in vivo. Протестированные здесь mAb, за исключением 3.19.3, не обнаруживали перекрестную реакцию с мышиным Ang-2. В этой модели in vivo, mAb нейтрализовали только человеческий Ang-2, продуцируемый клетками MCF-7, но не мышиный Ang-2. Ингибирующее действие этих mAb дает основание предположить, что экспрессированный в опухоли Ang-2 может представлять собой паракринный фактор ангиогенеза. Общая антиангиогенная активность mAb, помимо нейтрализации Ang-2, экспрессированного сосудистым эндотелием, также вносит некоторый вклад в нейтрализацию опухолевого Ang-2.
ПРИМЕР 20
ОПРЕДЕЛЕНИЕ ТЕРАПЕВТИЧЕСКОЙ ЭФФЕКТИВНОСТИ MAB 3.19.3 В МОДЕЛИ С ПРЕДВАРИТЕЛЬНО ВВЕДЕННЫМИ КЛЕТКАМИ A431 В КАЧЕСТВЕ КСЕНОТРАНСПЛАНТАТА
Клон анти-Ang-2 mAb 3.19.3 не только связывался с мышиным Ang-2, но также ингибировал связывание мышиного Ang-2 с человеческим Tie-2. Противоопухолевая активность этого моноклонального антитела была протестирована у мышей с моделью ксенотранспланта человеческой кожной плоскоклеточной карциномы с использованием клеточной линии A431.
Клетки A431 культивировали в колбах рутинным методом до тех пор, пока эти клетки не достигали субконфлюэнтности. Для разработки модели были использованы иммунодефицитные 6-8-недельные самки мышей (Balb/c/nu/nu). Клетки A431 собирали и суспендировали в матриксе Matrigel. Клеточную суспензию, содержащую 5×106 клеток, внутрикожно инъецировали мышам в бок. Мыши были произвольно распределены по разным группам, каждая из которых содержала 11 мышей. В тот же самый день, а затем два раза в неделю, мышам внутрибрюшинно инъецировали 0,5 мг mAb 3.19.3 или антитело контрольного изотипа. Размер каждой опухоли измеряли два раза в неделю. Объем опухоли вычисляли по формуле: объем = длина × (ширина)2 × 0,5 (см3).
Как проиллюстрировано на фигуре 13, mAb 3.19.3 значительно замедляли рост опухолевого ксенотрансплантата A431. Средний объем опухоли у группы, которой вводили антитело контрольного изотипа, достигал примерно 1,5 см3 в конце эксперимента, тогда как через 10 дней после начала экспримента и в конце эксперимента скорость роста опухоли у обработанной группы значительно замедлялась, и размер опухоли составлял примерно 0,5 см3. На 23-й день отношение объемов T/C (обработка/контроль) составляло 1/3, что соответствовало 66%-му ингибированию роста опухоли.
Полученные результаты дают основание предположить, что при дозе, используемой в этом эксперименте по связыванию с мышиным Ang-2 и блокированию связывания этого лиганда с его рецептором Tie-2, mAb 3.16.3 способно значительно замедлять рост ксенотрансплантата A431 у “голых” мышей. Вероятно, что противоопухолевый эффект этого моноклонального антитела обусловлен ингибированием ангиогенеза у хозяина, как было продемонстрировано в анализах с использованием матриксного блока Matrigel. Механизм действия, направленного на ингибирование ангиогенеза, дополнительно проиллюстрирован в примере 22, где в качестве фармакодинамического маркера была использована плотность микрососудов (MVD) опухоли.
Механизм действия mAb 3.19.3 может не ограничиваться только его блокадой ассоциации и последующей передачи сигнала Ang-2/Tie-2. Как показано в примере 7, было также обнаружено, что это mAb связывается с Ang-1 и блокирует связывание Ang-1 с Tie-2. Интересно отметить, что это mAb также блокирует Ang-1-индуцированное фосфорилирование Tie-2. Известно, что Ang-1 участвует в развитии сосудов. Сравнение активности mAb 3.19.3, направленной на ингибирование связывания Ang-1 с Tie-2, с активностью, направленной на ингибирование связывания Ang-2 с Tie-2 (пример 12), показало, что mAb 3.19.3 является антагонистом преимущественно Ang-2. Не ограничиваясь какой-либо конкретной теорией, можно лишь отметить, что двойная блокада передачи сигнала от Ang-2 и Ang-1 подавляет ангиогенез, а следовательно и рост опухоли.
ПРИМЕР 21
MAB 3.19.3 ИНГИБИРУЕТ РОСТ ОПУХОЛИ В МОДЕЛЯХ С ПРИЖИВЛЕННЫМ КСЕНОТРАНСПЛАНТАТОМ
Ang-2 стимулируется ангиогенными эндотелиальными клетками, что приводит к развитию опухолей многих типов. Имеются все основания предполагать, что моноклональное антитело, которое блокирует связывание ассоциации Ang-2/Tie-2, обладает способностью ингибировать ангиогенез, а следовательно, и рост опухоли. В этом эксперименте была продемонстрирована терапевтическая эффективность анти-Ang-2 mAb. Поскольку mAb 3.19.3 перекрестно реагирует с мышиным Ang-2/Tie-2 и нейтрализует передачу сигнала мышиного Ang-2/Tie-2, то такое mAb было выбрано для иллюстрации in vivo эффективности ингибирования роста опухоли.
Для того, чтобы определить, ингибирует ли анти-Ang-2 mAb 3.19.3 также развивающуюся опухоль и другие опухоли, то есть не A-431, была использована модель с ксенотрансплантатом человеческой аденокарциномы толстой кишки LoVo. Дозы Mab 3.19.3, составляющие 0,5, 2 и 10 мг/кг, вводили внутрибрюшинно два раза в неделю. Такое введение начинали лишь тогда, когда средний объем опухоли достигал 0,2 см3. На этих развивающихся опухолях было также продемонстрировано, что mAb 3.19.3 обладает ингибирующим действием по сравнению с контрольным изотипом. На фигуре 14A показано, что 79%-ное ингибирование достигалось при 0,5 и 2 мг/кг (величины p составляли 0,022 и 0,027, соответственно), а 75%-ное ингибирование роста опухоли достигалось при 10 мг/кг (p=0,006).
Эффект ингибирования роста опухоли был воспроизведен на дополнительной модели с ксенотрансплантатом человеческой аденокарциномы толстой кишки SW480, размер которой доводили до среднего объема 0,2 см3. Хотя mAb 3.19.3 не давало значимого эффекта при 0,5 мг/кг, однако, было обнаружено, что на 53-й день после имплантации опухоли указанное mAb при концентрации 2 и 10 мг/кг обнаруживало 60%-ное ингибирование роста опухоли (p=0,003 и 0,006, соответственно) (фигура 14B).
В целом, вышеуказанные результаты показали, что анти-Ang-2 mAb 3.19.3 значительно ингибировало рост опухоли в трех тестируемых моделях. Интересно отметить, что LoVo и SW480 экспрессируют человеческий Ang-2. Однако два других mAb, которые не обладали перекрестной реактивностью с мышиным Ang-2, не оказывали какого-либо значительного ингибирующего действия на рост опухоли (данные не приводятся), несмотря на то, что человеческий Ang-2 экспрессировался опухолевыми клетками. Полученные результаты позволяют сделать вывод, что антагонист Ang-2 хозяина необходим для блокирования ангиогенеза и роста опухоли.
Как обсуждалось выше, Mab 3.19.3 перекрестно реагирует с Ang-1. Однако активность mAb 3.19.3 по отношению к связыванию с Ang-1/Tie-2 была гораздо ниже, чем активность по отношению к связыванию Ang-2/Tie-2 (Пример 12). Исходя из этого, можно сделать вывод, что терапевтическая эффективность, наблюдаемая в этих моделях, обусловлена, главным образом, антагонистическим действием на Ang-2. Однако нельзя полностью исключать и блокирование Ang-1 в этих моделях in vivo. Во время проведения всего эксперимента какого-либо заметного токсического действия, а также потери массы или кровотечений у животных не наблюдалось.
ПРИМЕР 22
IN VIVO ЭФФЕКТИВНОСТЬ MAB 3.19.3 В ДРУГИХ МОДЕЛЯХ С ОПУХОЛЕВЫМ КСЕНОТРАНСПЛАНТАТОМ
Противоопухолевую активность моноклонального антитела 3.19.3 тестировали у мышей с моделями ксенотрансплантата человеческой раковой опухоли с использованием 9 различных опухолевых клеточных линий.
Клетки аденокарциномы толстой кишки (Lovo, SW480, Colo205, HT29, HCTl 16), плоскоклеточной карциномы (A431), карциномы легких (Calu-6) и аденокарциномы молочной железы (MCF7, MDA-MB-231) культивировали в колбах рутинным методом до тех пор, пока клетки не достигали субконфлюэнтности. Для разработки модели были использованы иммунодефицитные 7-10-недельные самки мышей. Клетки собирали, суспендировали в матриксе Matrigel и подкожно инъецировали каждой мыши. Затем мышей произвольно распределяли по группам так, чтобы каждая группа содержала 10-12 мышей. В тот же самый день, а затем два раза в неделю, мышам внутрибрюшинно инъецировали 0,5 мг mAb 3.19.3 или антитела контрольного изотипа. Во всех экспериментах проводили обработку антителом контрольного изотипа. Размер каждой опухоли определяли два раза в неделю. Объем опухоли вычисляли по формуле: объем = длина × (ширина)2 × 0,5 (см3). Графическое сравнение уровней ингибирования роста опухоли проиллюстрировано для ксенотрансплантатов HT29 (фигура 15A) и Calu6 (фигура 15B).
Как показано в таблице 18, mAb 3.19.3 обнаруживало значимую активность во всех 7 тестируемых моделях подкожных ксенотрансплантатов и в обеих ортотопных моделях с неоптимизированной дозой и схемой введения.
Систематизированная in vivo эффективность mAb 3.19.3
* Ингибирование роста не было статистически значимым.
N.D. - не определяли
Опухолевую ткань MDA-MB-231 анализировали по плотности окрашивания CD31+-сосудов. Плотность CD31-окрашивания определяли путем вычисления пороговым методом и методом ручного подсчета с использованием координатной сетки. Было проанализировано одиннадцать опухолей на группу и, по меньшей мере, 20 изображений опухоли. Как показано на фигуре 15C, обработка мышей антителом 3.19.3 приводила к 40%-му снижению плотности CD31-окрашивания по сравнению с окрашиванием контрольным антителом IgG. Этот результат был статистически значимым для обоих методов подсчета, а именно порогового метода (p<0,015) и метода ручного подсчета с использованием координатной сетки (p<0,00004) в соответствии с односторонним т-критерием. Аналогичные подсчеты CD31+-сосудов были сделаны на ткани ex vivo для ксенотрансплантатов Colo205 и HCTl16. Эти образцы также обнаруживали аналогичное значимое уменьшение плотности CD31+-сосудов.
ПРИМЕР 23
ПРИМЕНЕНИЕ АНТИ-Ang-2 АНТИТЕЛ ДЛЯ ПРЕДОТВРАЩЕНИЯ АССОЦИИРОВАННЫХ С АНГИОГЕНЕЗОМ ЗАБОЛЕВАНИЙ
Для оценки in vivo эффективности лечения человека с различными солидными опухолями с применением анти-Ang-1 и анти-Ang-2 антител, пациентам периодически вводили эффективное количество анти-Ang-1 и анти-Ang-2 антитела. В определенные периоды курса лечения пациентов наблюдали на подавление роста опухоли. После проведения курса лечения было обнаружено, что у пациентов, которые проходили лечение анти-Ang-1 и анти-Ang-2 антителами, по сравнению с пациентами, которые не проходили такого лечения, наблюдалось относительное улучшение по одному или нескольким показателям, включая, но не ограничиваясь ими, уменьшение размера опухоли, замедление прогрессирования опухоли или увеличение продолжительности жизни.
ПРИМЕР 24
ПРИМЕНЕНИЕ АНТИ-Ang-2 АНТИТЕЛ В КАЧЕСТВЕ ДИАГНОСТИЧЕСКОГО СРЕДСТВА
Детекция антигена Аng-2 в образце
Для детектирования антигена Ang-1 или Ang-2 в образце может быть разработан твердофазный иммуноферментный анализ (ELISA). В этом анализе на лунки микротитрационного планшета, такого как 96-луночный микротитрационный планшет или 384-луночный микротитрационный планшет, в течение нескольких часов, адсорбировали “первое” полностью человеческое моноклональное антитело против Ang-1 и Ang-2. Иммобилизованное антитело служило в качестве антитела для захвата любого антигена, который может присутствовать в тест-образце. Затем лунки ополаскивали и обрабатывали блокирующим агентом, таким как молочный белок или альбумин, для предупреждения неспецифической адсорбции аналита.
Затем лунки обрабатывали тест-образцом, предположительно, содержащим антиген, или раствором, содержащим стандартное количество указанного антигена. Таким образцом может быть, например, проба сыворотки, взятая у индивидуума с подозрением на высокие уровни антигена в кровотоке, которые являются показателями патологии при диагностике.
После отмывания тест-образца или стандарта, лунки обрабатывали “вторыми” полностью человеческими моноклональными анти-Ang-1 и анти-Ang-2 антителами, которые были помечены путем конъюгирования с биотином. Могут быть также использованы моноклональные мышиные антитела или антитела, происходящие от других видов. Меченные анти-Ang-1 и анти-Ang-2 антитела служили в качестве детектирующих антител. После отмывания избытка “второго” антитела, лунки обрабатывали конъюгированной с авидином пероксидазой хрена (ПХ) и подходящим хромогенным субстратом. Концентрацию антигена в тест-образцах определяли путем сравнения со стандартной кривой, построенной по данным, полученным для стандартных образцов.
Такой ELISA-анализ является высокоспецифичным и в высокой степени чувствительным анализом для обнаружения антигенов Ang-1 и Ang-2 в тест-образце.
Определение концентрации антигена Ang-2 у пациентов
Для количественной оценки уровней Ang-1 и Ang-2 в человеческой сыворотке был разработан “сэндвич”-ELISA. В этом “сэндвич”-ELISA два полностью человеческих моноклональных анти-Ang-2 антитела распознавали различные эпитопы на молекуле Ang-2. Альтернативно, могут быть также использованы моноклональные мышиные антитела или антитела, происходящие от других видов. При этом, но необязательно, может быть использован ELISA-анализ, проводимый как описано ниже. 50 мкл анти-Ang-2 антитела для захвата в сенсибилизирующем буфере (0,1 M NaHCO3, pH 9,6) при концентрации 2 мкг/мл наносили на ELISA-планшеты (Fisher). После инкубирования при 4ºС в течение ночи, планшеты обрабатывали 200 мкл блокирующего буфера (0,5% BSA, 0,1% твина 20, 0,01% тимерозала в PBS) в течение 1 часа при 25°С. Планшеты промывали (3×) 0,05% твином 20 в PBS (промывочным буфером, WB). Нормальную сыворотку или сыворотку пациента (Clinomics, Bioreclaimation) разводили в блокирующем буфере, содержащем 50%-ую человеческую сыворотку. Планшеты инкубировали с пробами сыворотки в течение ночи при 4ºС, промывали WB, а затем инкубировали со 100 мкл/лунку биотинилированного детектирующего анти-Ang-2 антитела в течение 1 часа при 25ºС. После промывки планшеты инкубировали с ПХ-стрептавидином в течение 15 минут, промывали как описано выше, а затем обрабатывали 100 мкл/лунку o-фенилендиамина в H2O2 (проявляющий раствор Sigma) для развития окраски. Затем реакцию прекращали путем добавления 50 мкл/лунку Н2SO4 (2M) и анализировали на ELISA-планшет-ридере при 492 нм. Концентрацию антигена Ang-2 в пробах сыворотки вычисляли путем сравнения с разведениями очищенного антигена Ang-2 с помощью программы построения 4-параметрической кривой.
ВКЛЮЧЕНИЕ В ОПИСАНИЕ ИЗОБРЕТЕНИЯ ССЫЛОЧНОГО МАТЕРИАЛА
Все цитируемые здесь источники, включая патенты, патентные заявки, документы, справочные руководства и т.п., а также публикации, цитируемые в этих источниках, и еще не опубликованные работы, во всей своей полноте вводятся в настоящее описание посредством ссылки.
ЭКВИВАЛЕНТЫ
Авторы настоящего изобретения считают, что представленное выше описание изобретения является достаточным для его осуществления средним специалистом в данной области. В приведенном выше описании и примерах проиллюстрированы некоторые предпочтительные варианты осуществления изобретения и подробно описан наилучший способ, рассматриваемый заявителями. Однако при этом следует отметить, что независимо от подробного описания, представленного выше, настоящее изобретение может быть осуществлено многими способами и должно интерпретироваться в соответствии с прилагаемой формулой изобретения и любыми ее эквивалентами.
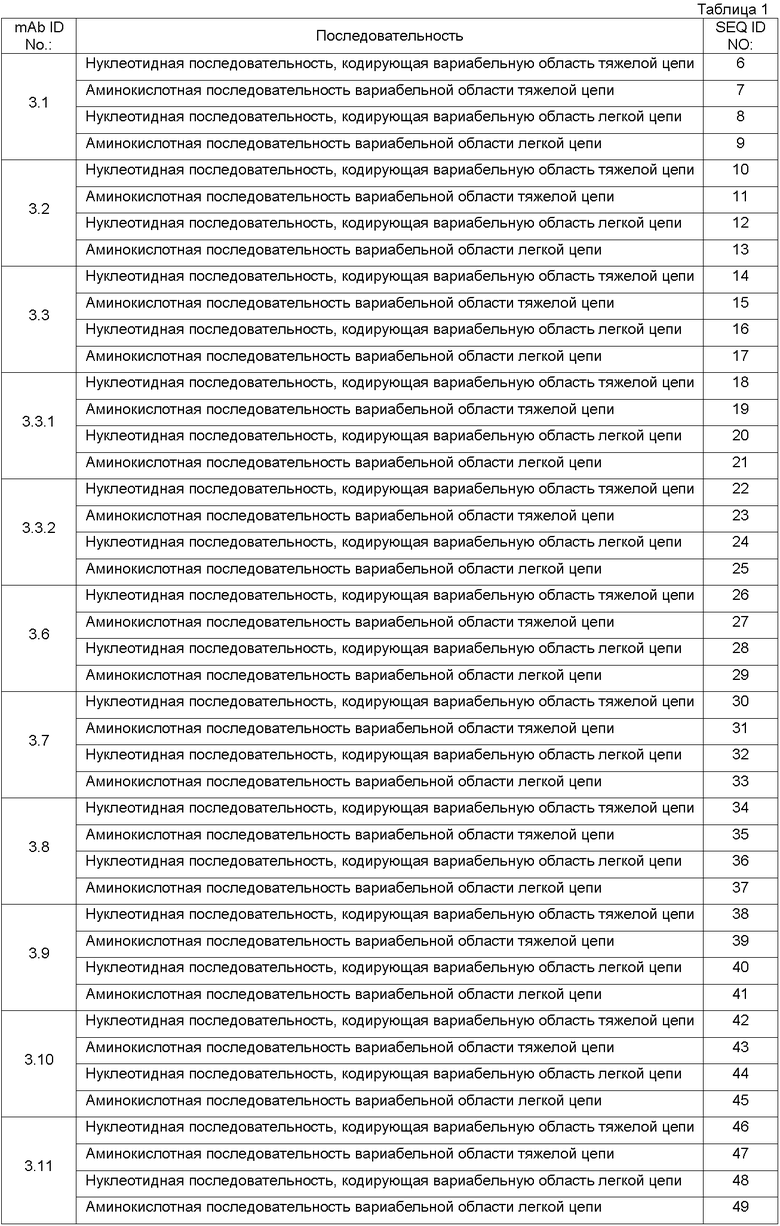
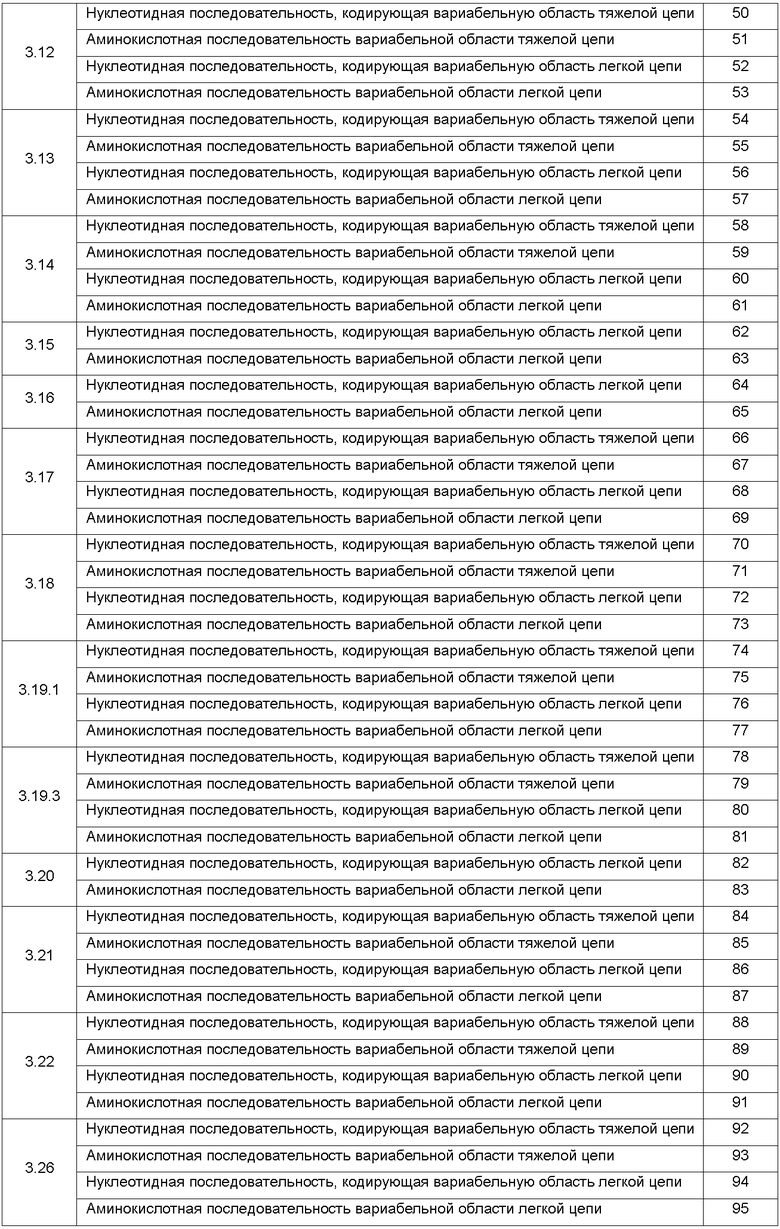
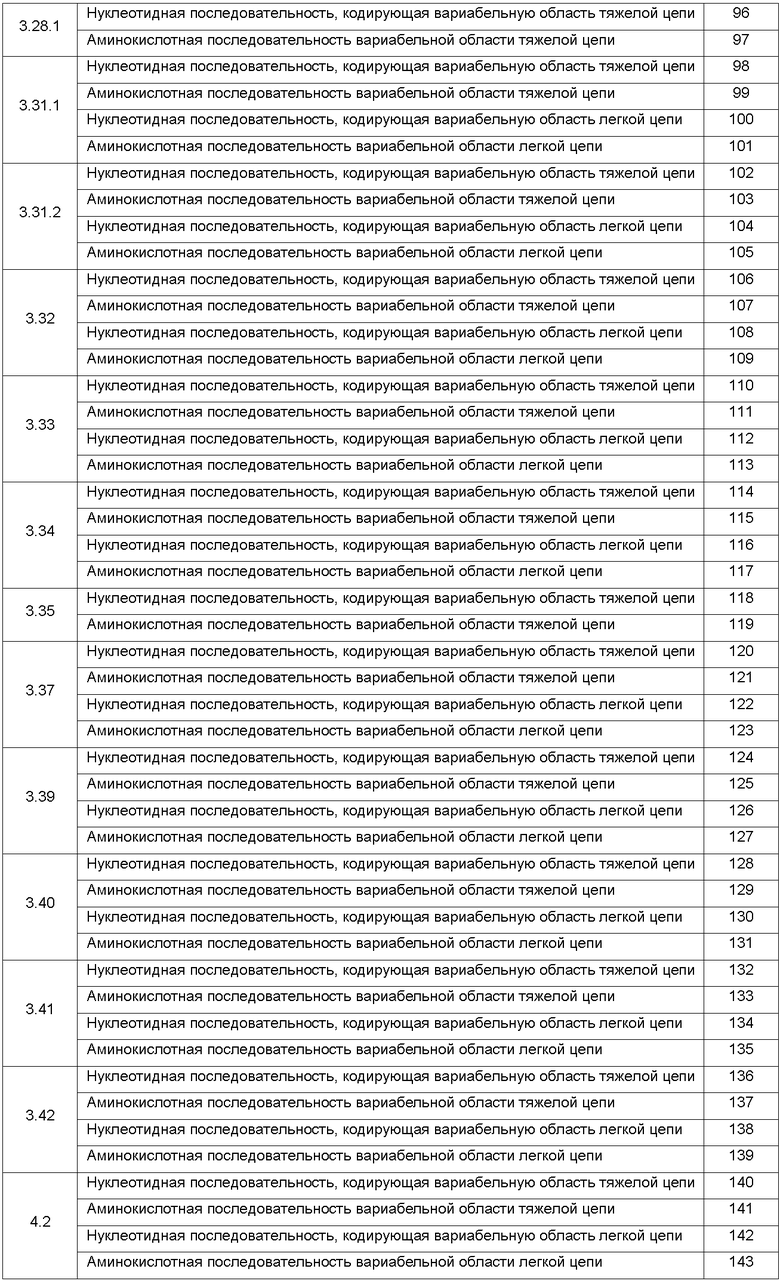
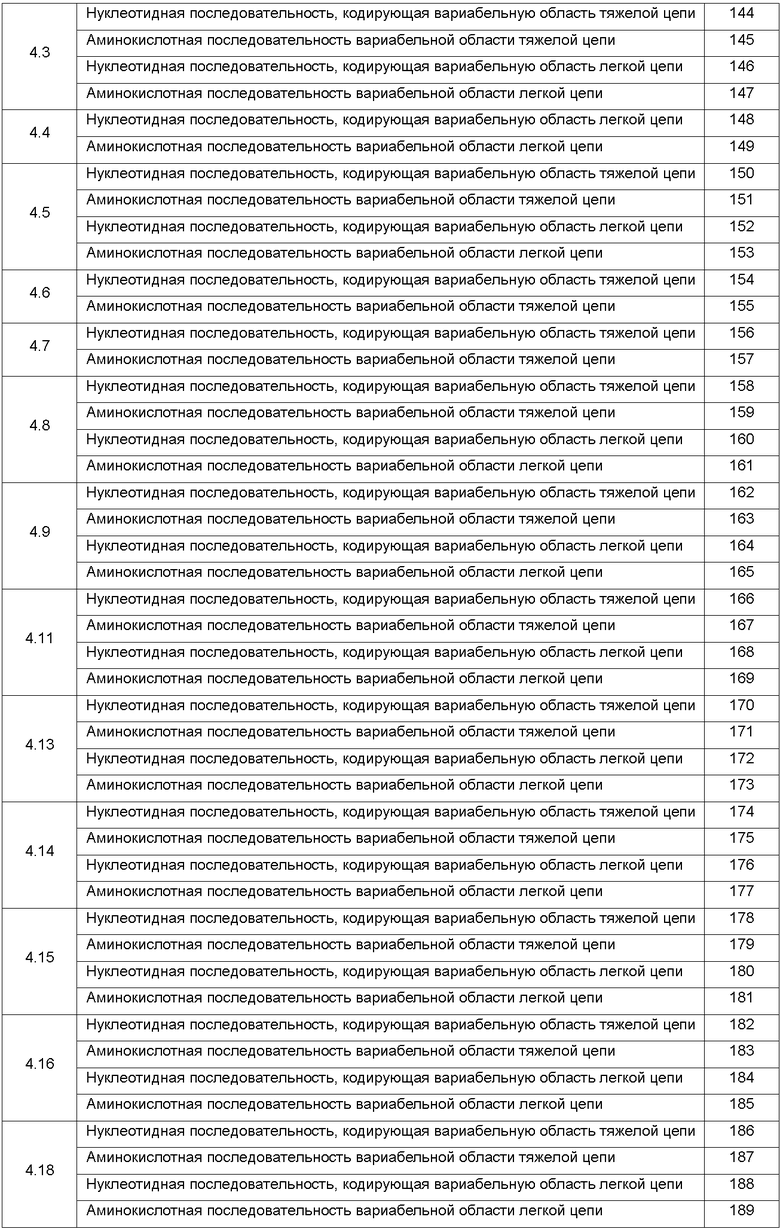



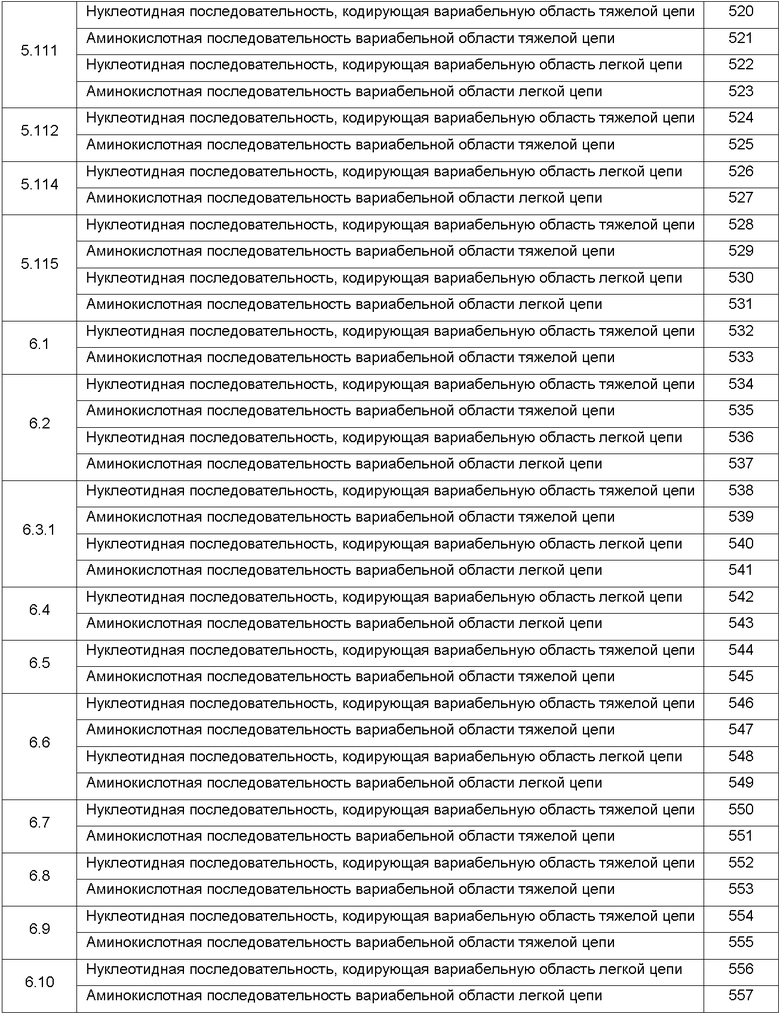
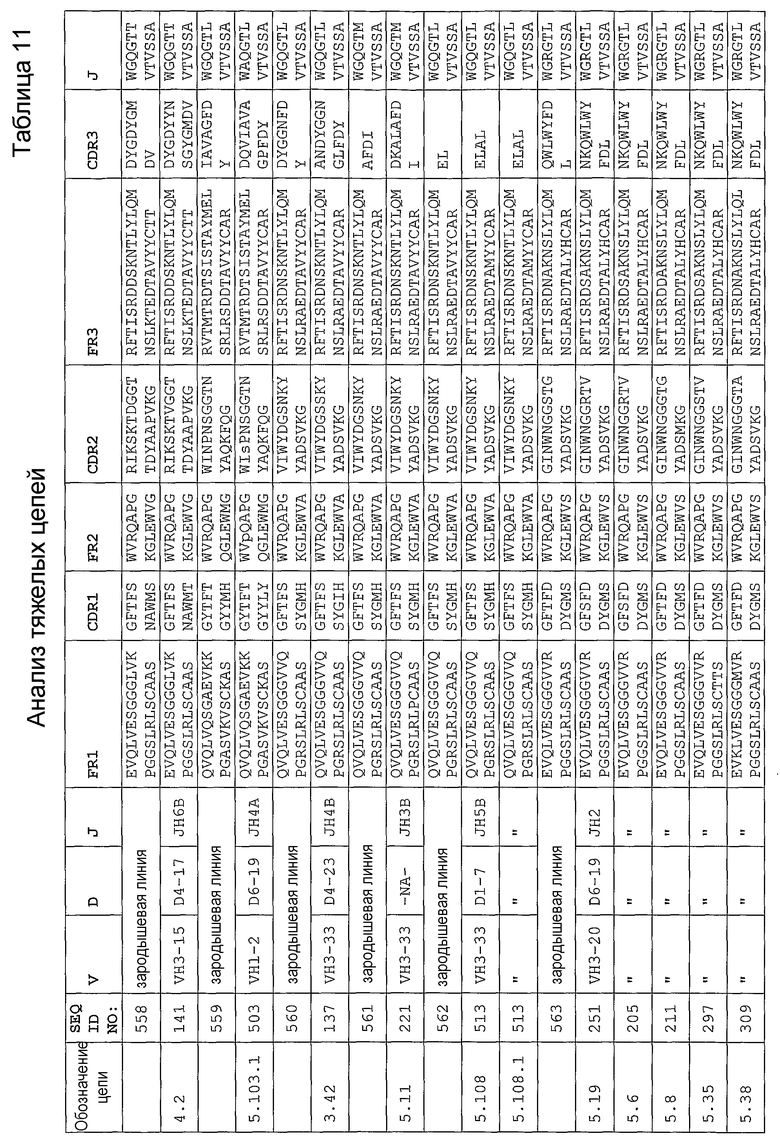
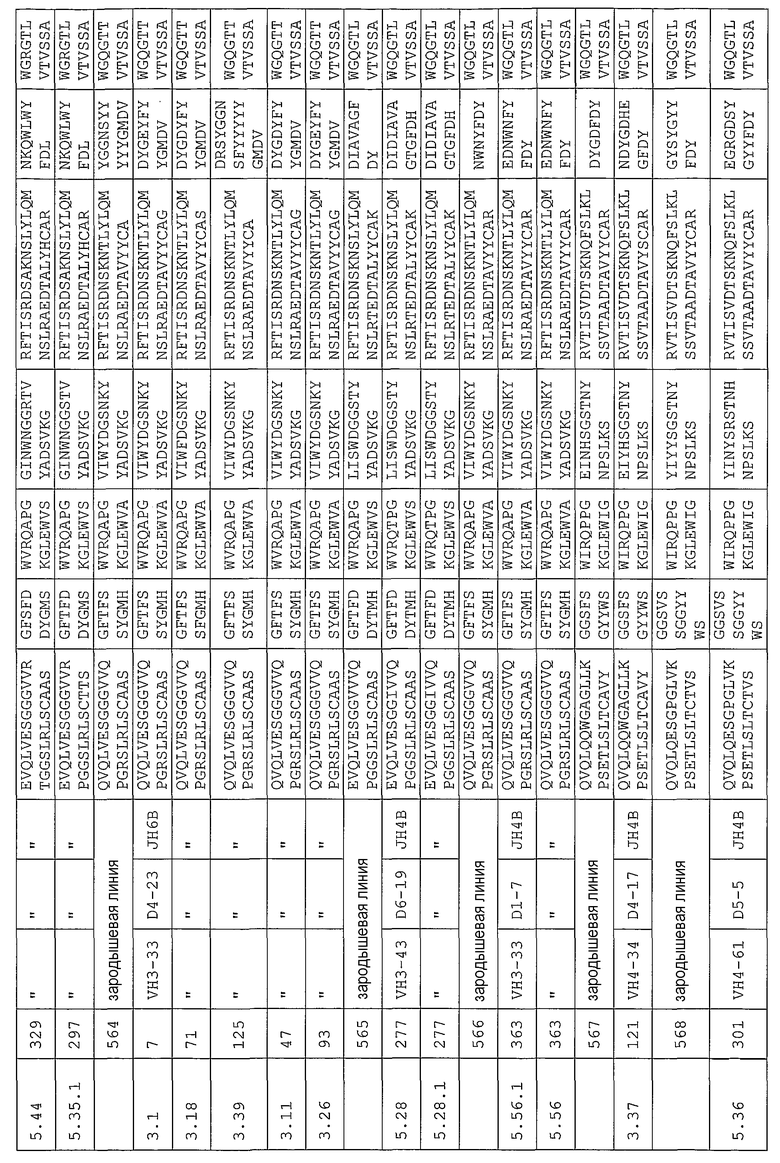
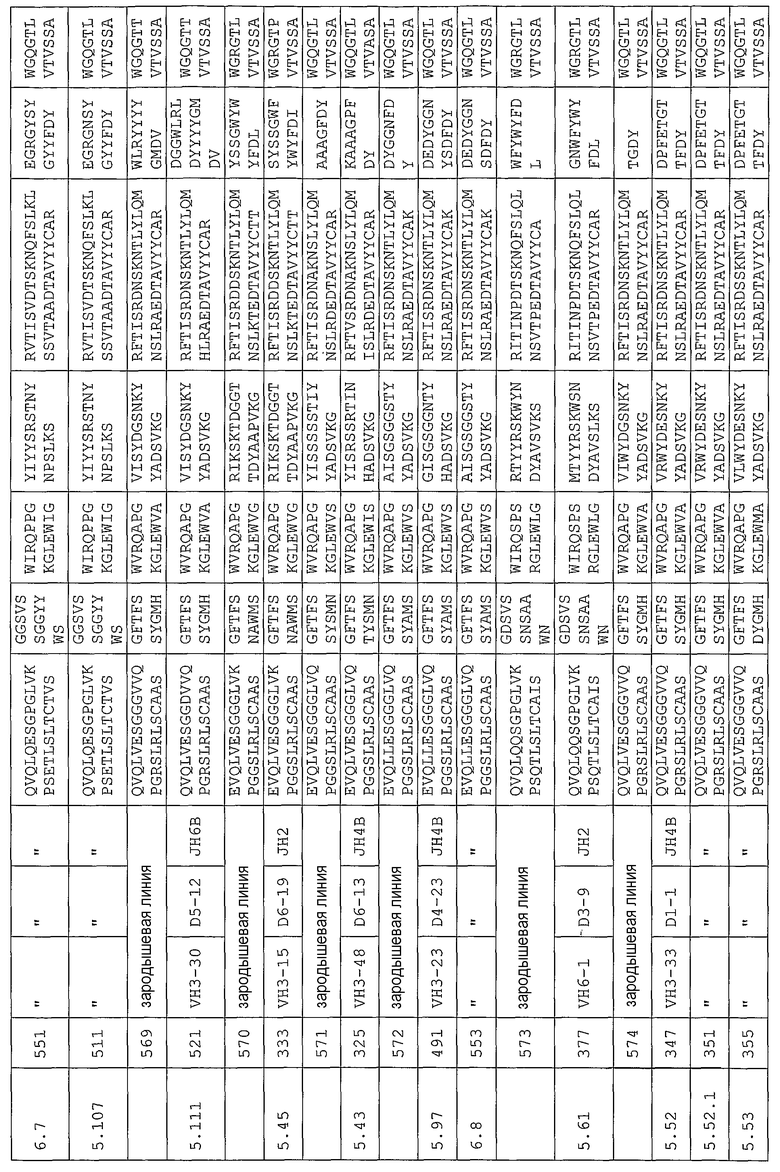
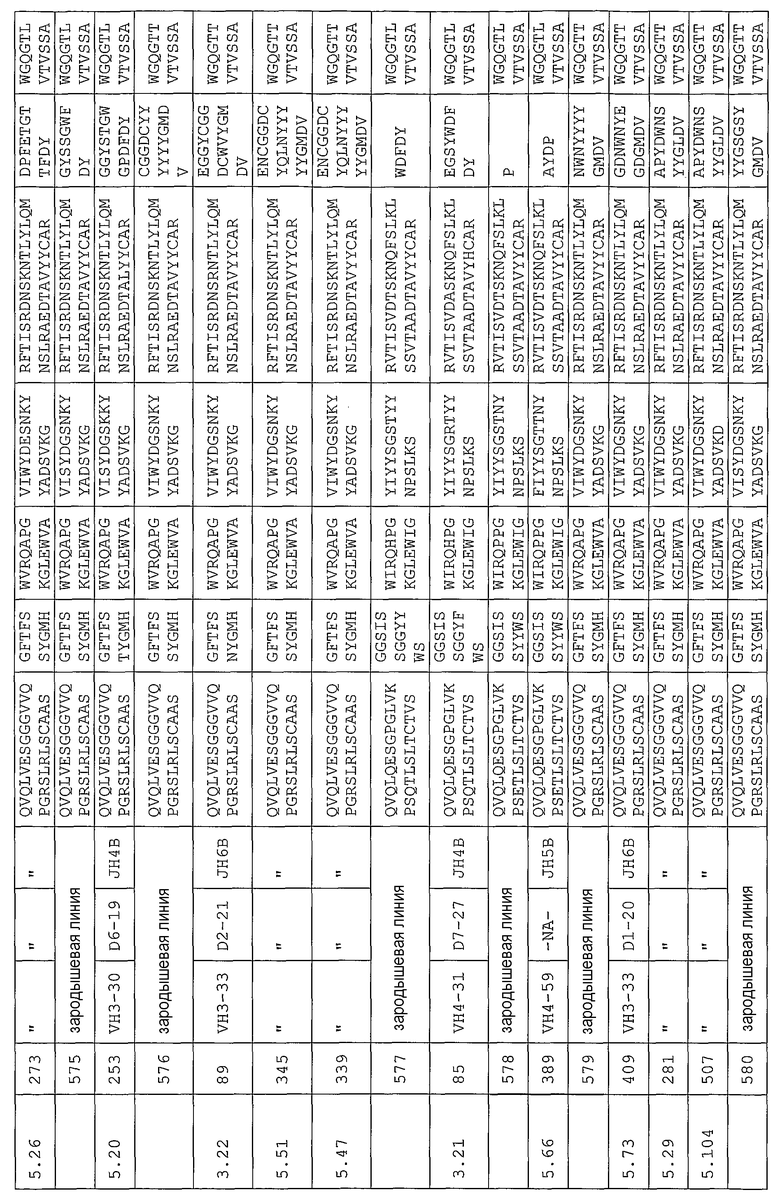

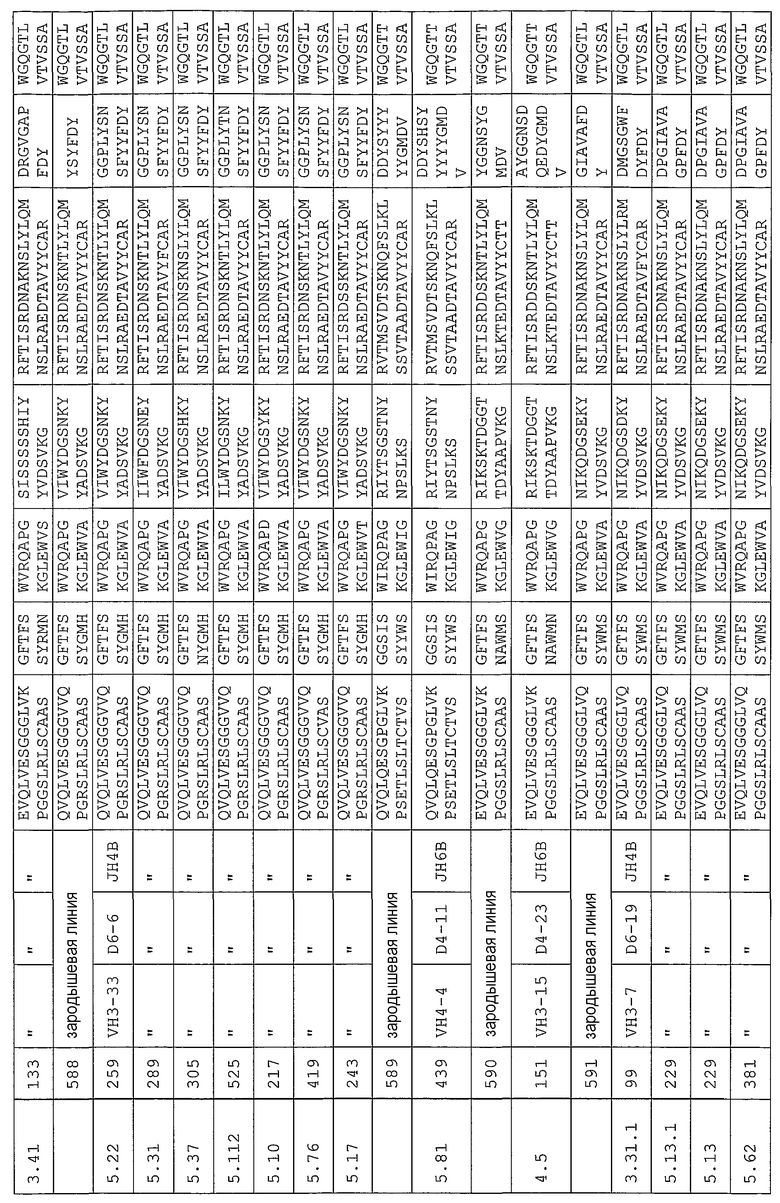
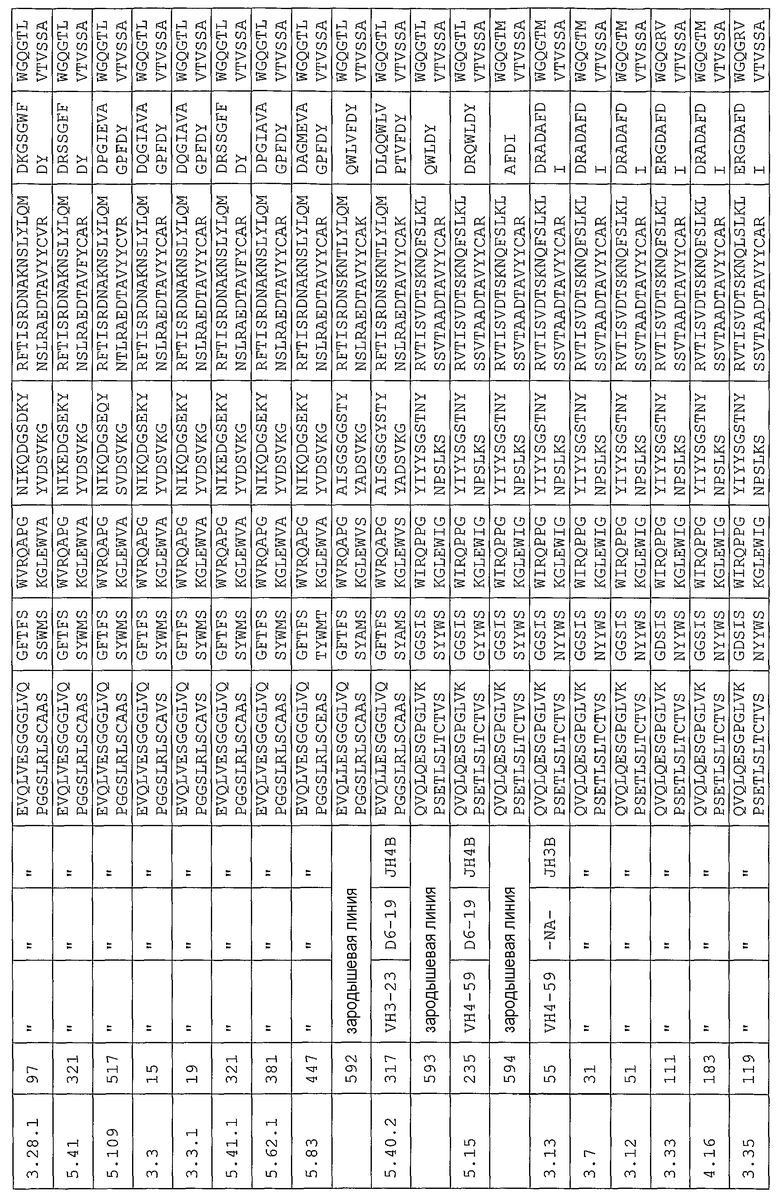

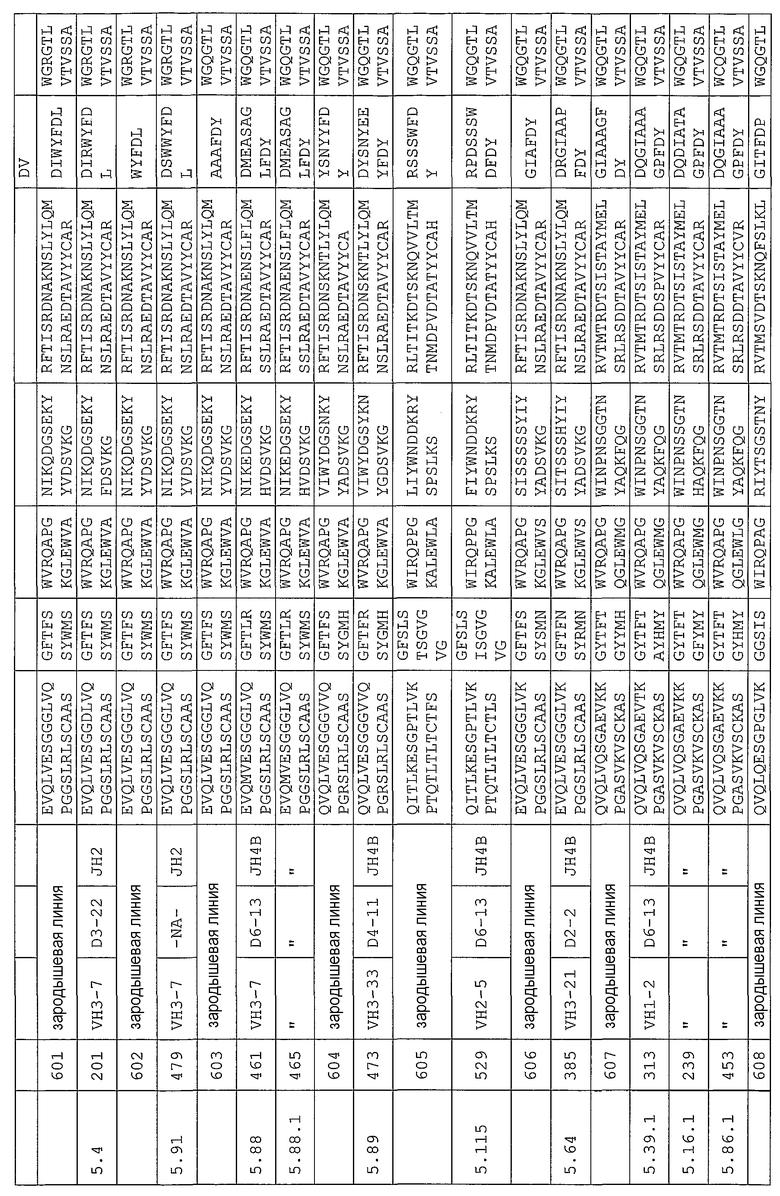

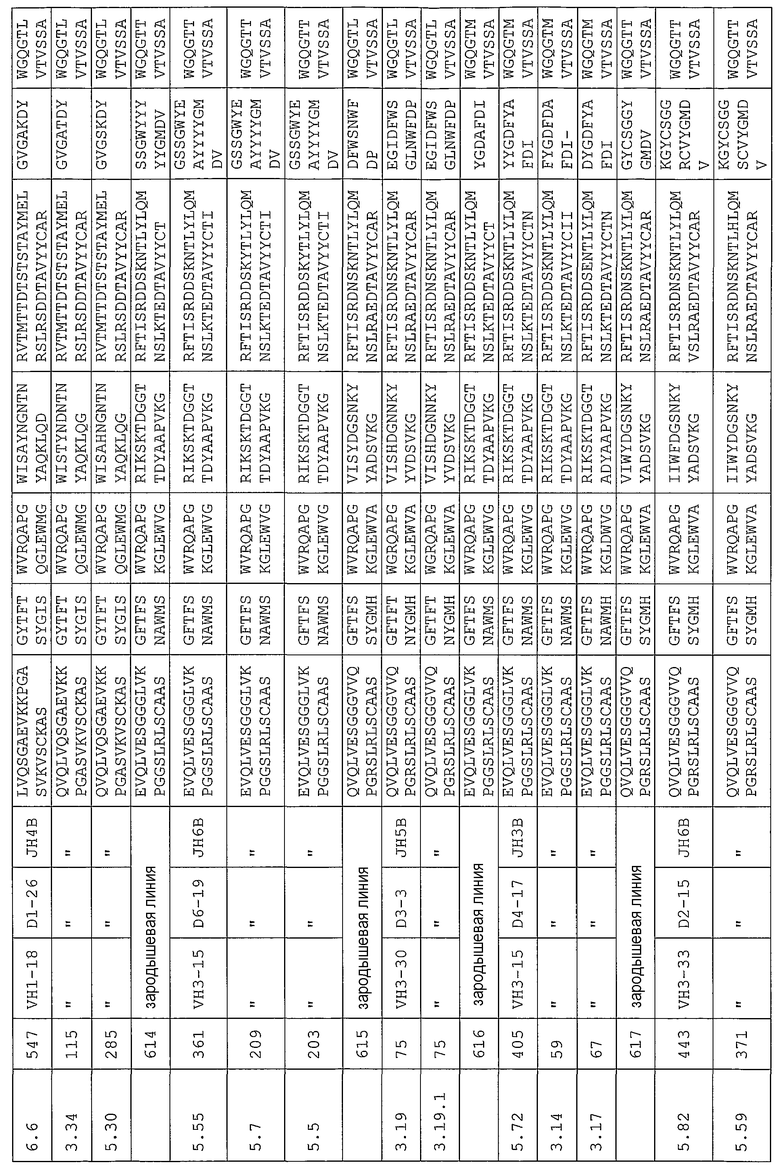
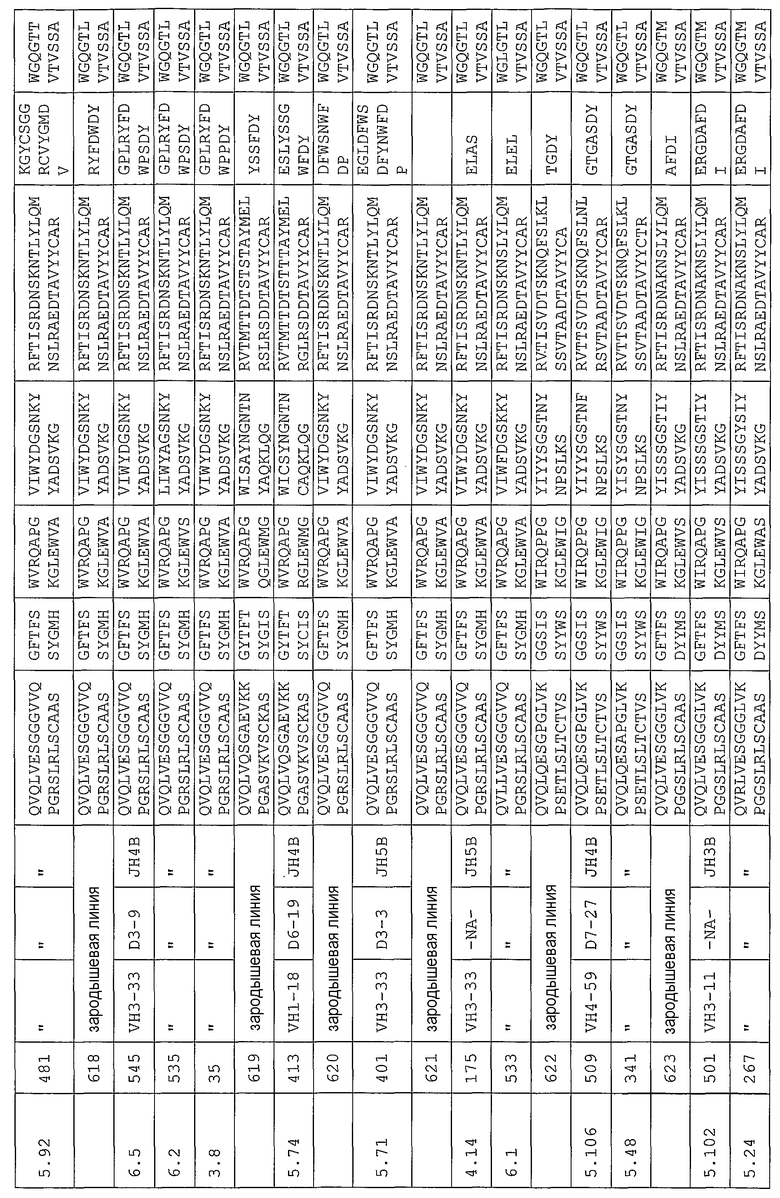

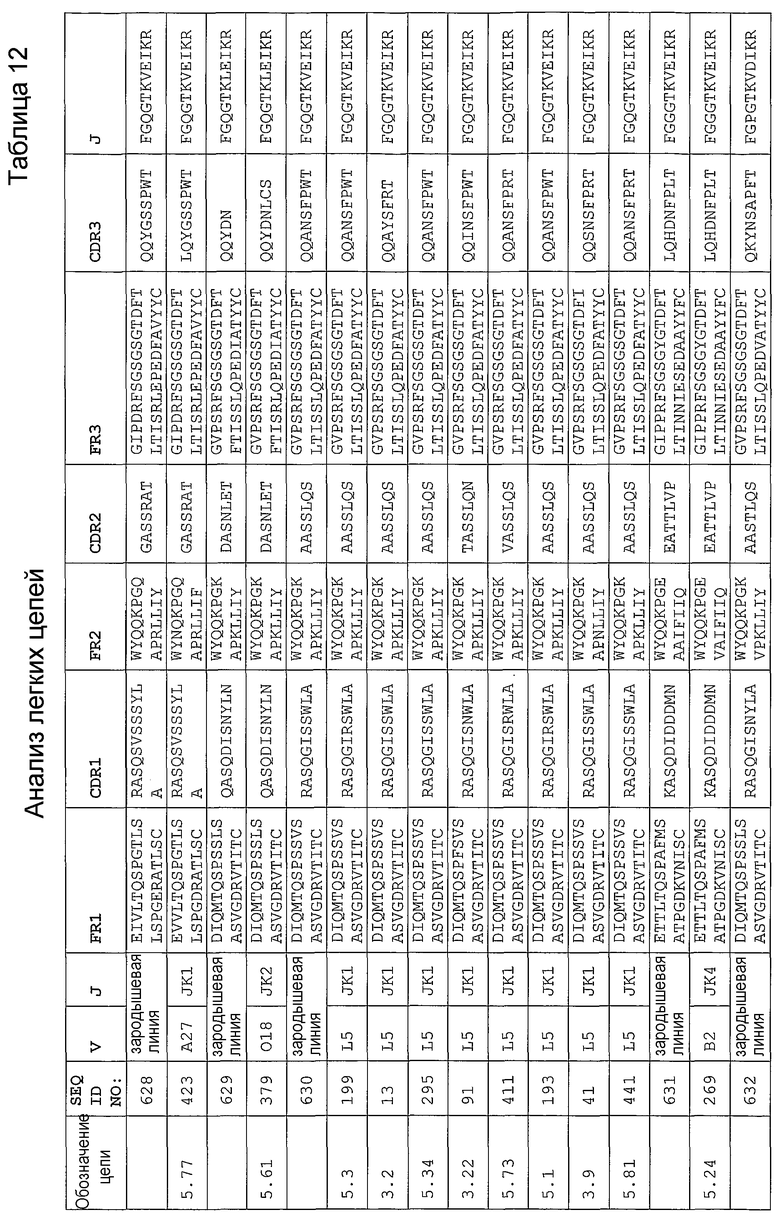
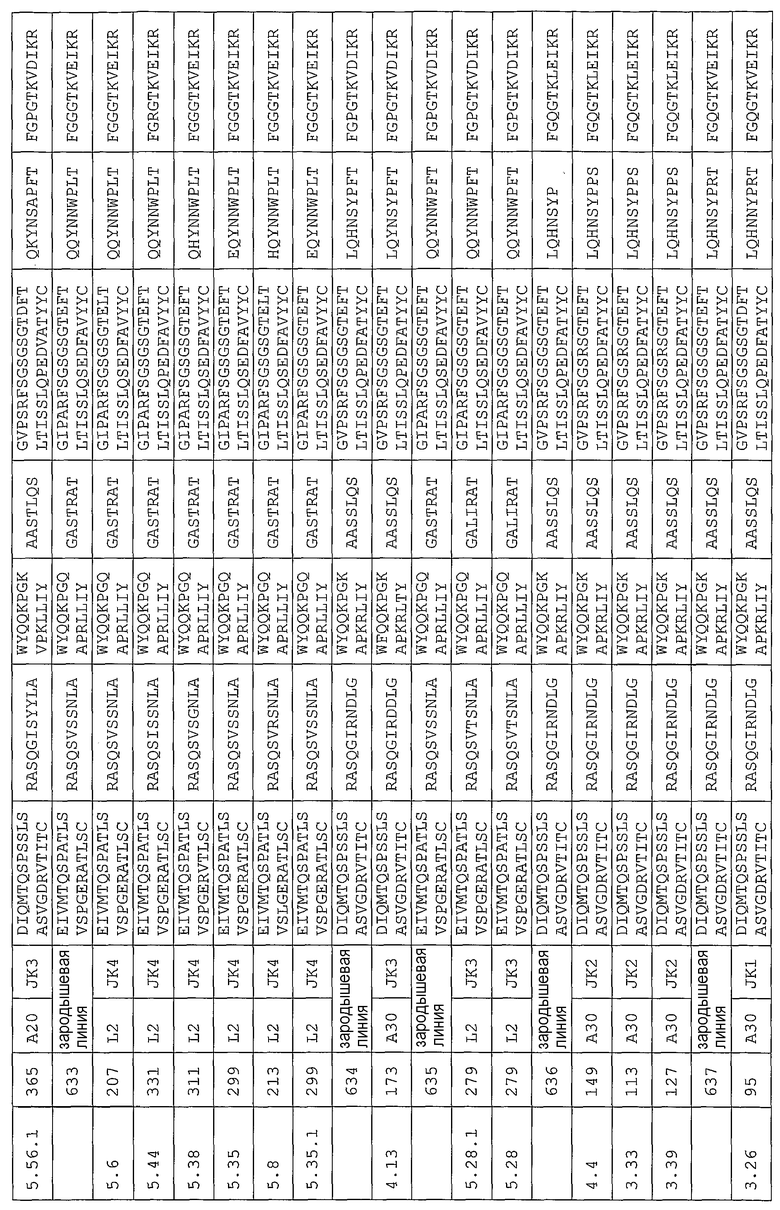
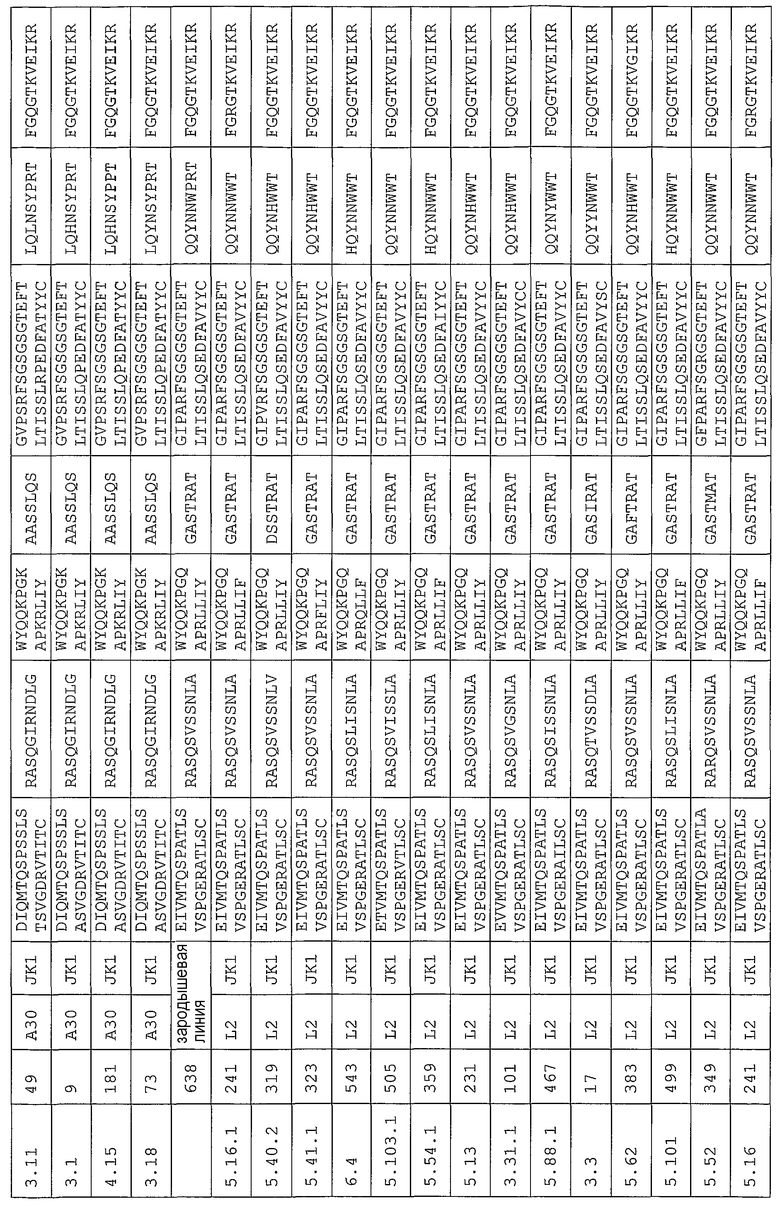

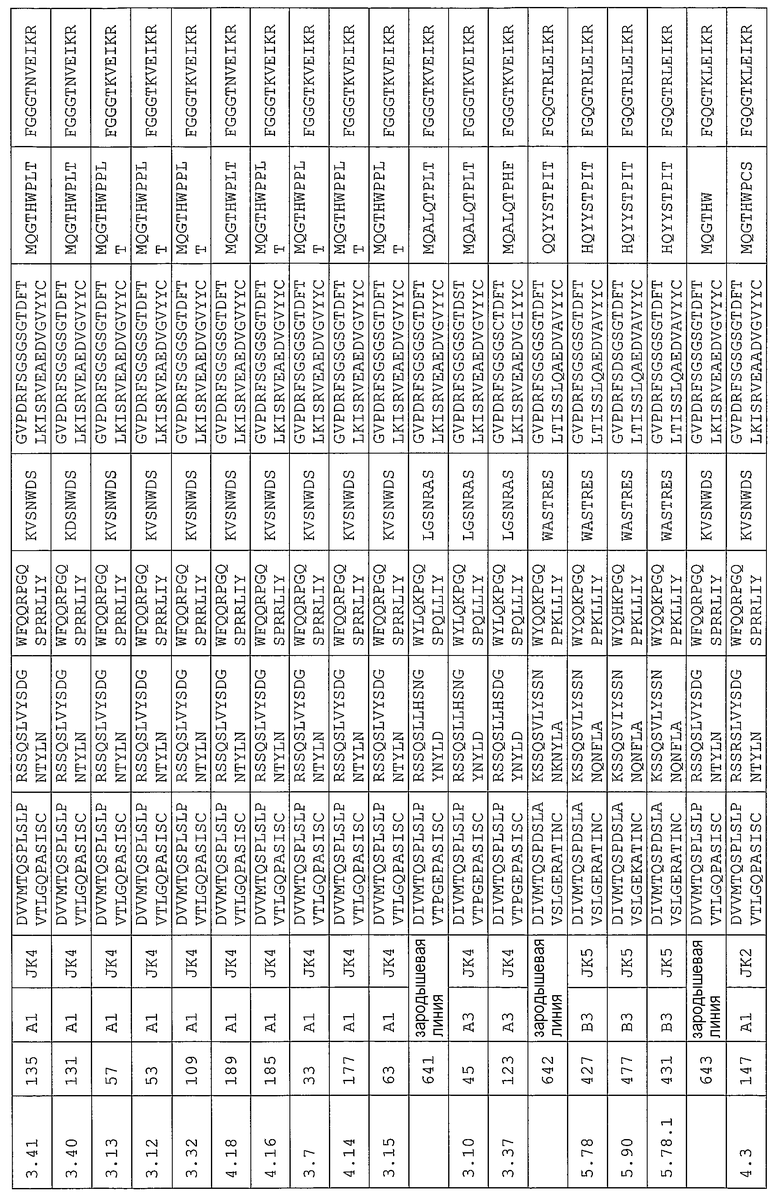
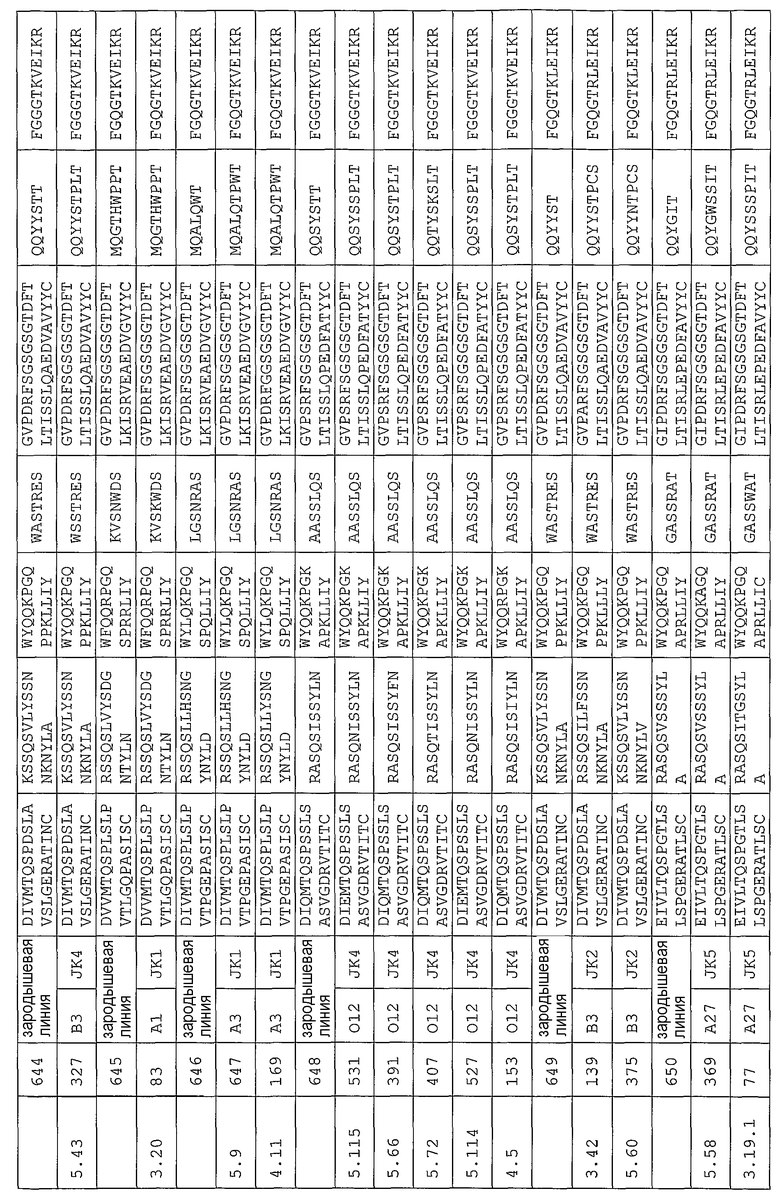
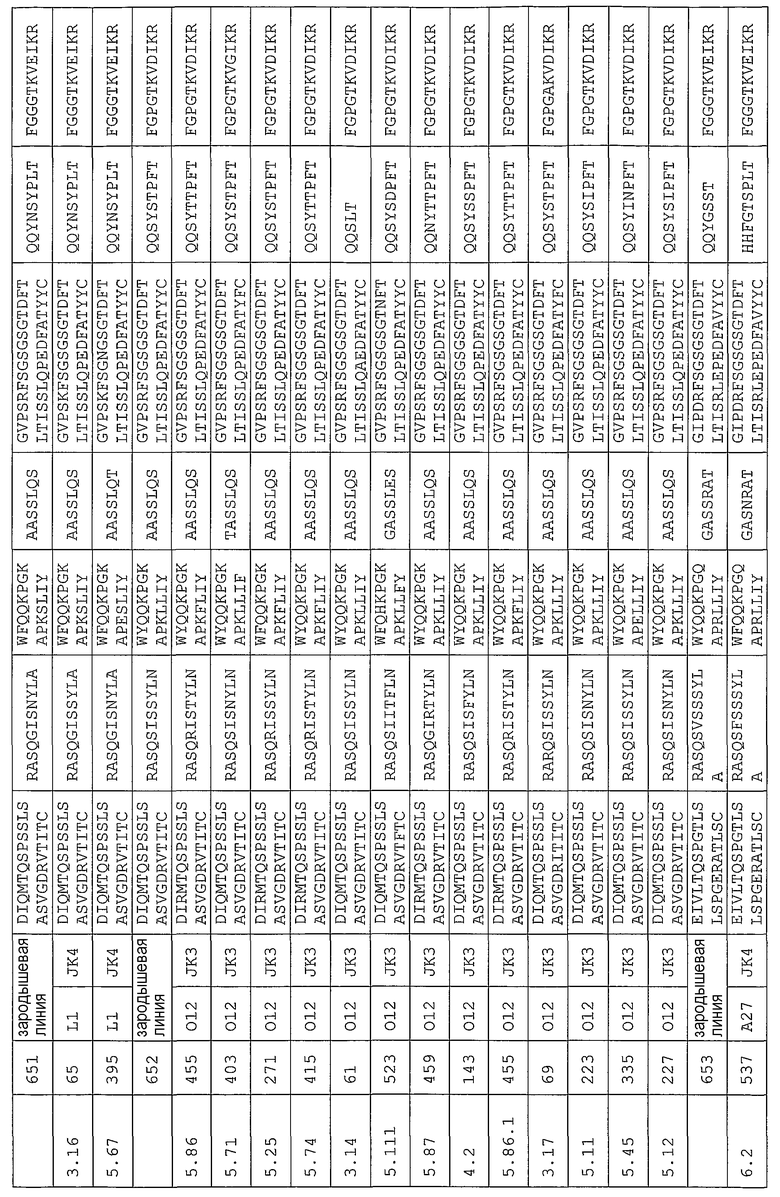
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКИЕ ДВУХВАЛЕНТНЫЕ АНТИТЕЛА АНТИ-VEGF/АНТИ-ANG-2 | 2011 |
|
RU2597973C2 |
| ВЫСОКОАФФИННЫЕ ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ АНГИОПОЭТИНУ-2 | 2010 |
|
RU2545399C2 |
| АНГИОПОЭТИН-2-СПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ АГЕНТЫ | 2005 |
|
RU2404992C2 |
| АНТИТЕЛО ДВОЙНОЙ НАПРАВЛЕННОСТИ В НОВОЙ ФОРМЕ И ЕГО ПРИМЕНЕНИЕ | 2009 |
|
RU2520824C2 |
| АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТ ЧЕЛОВЕЧЕСКИЙ БЕЛОК БЕТА-ТИРОЗИН ФОСФАТАЗУ (НРТРВЕТА), И ИХ ИСПОЛЬЗОВАНИЕ | 2007 |
|
RU2494108C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИ-VEGF/АНТИ-ANG-2 АНТИТЕЛА | 2009 |
|
RU2542382C2 |
| АНТИТЕЛА ПРОТИВ АНГИОПОЭТИНА-2 ЧЕЛОВЕКА | 2009 |
|
RU2569461C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К РЕЦЕПТОРУ 2 ФАКТОРА РОСТА ФИБРОБЛАСТОВ | 2009 |
|
RU2546254C9 |
| БИСПЕЦИФИЧЕСКИЕ АНТИ-VEGF/АНТИ-ANG-2 АНТИТЕЛА | 2014 |
|
RU2640253C2 |
| СВЯЗЫВАЮЩИЕ ПРОТЕИНЫ, СПЕЦИФИЧНЫЕ ПО ОТНОШЕНИЮ К ИНСУЛИН-ПОДОБНЫМ ФАКТОРАМ РОСТА, И ИХ ИСПОЛЬЗОВАНИЕ | 2013 |
|
RU2549703C2 |

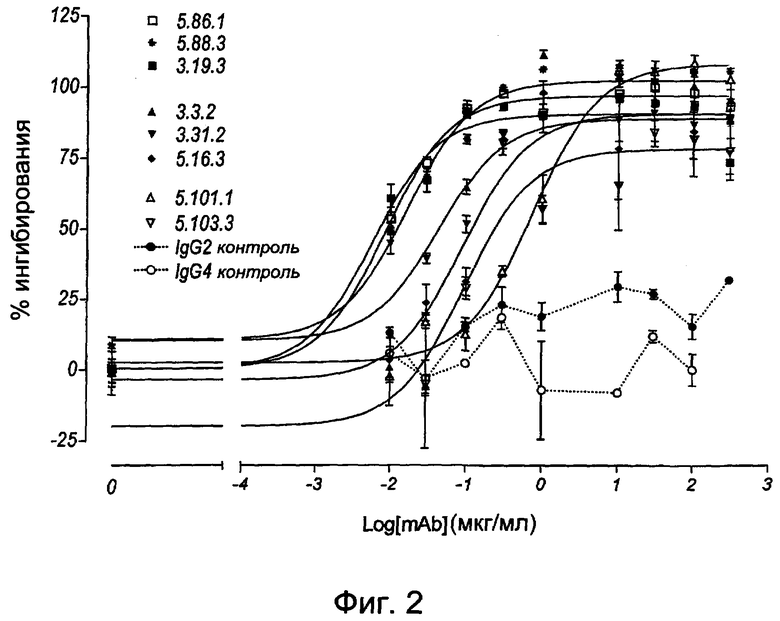

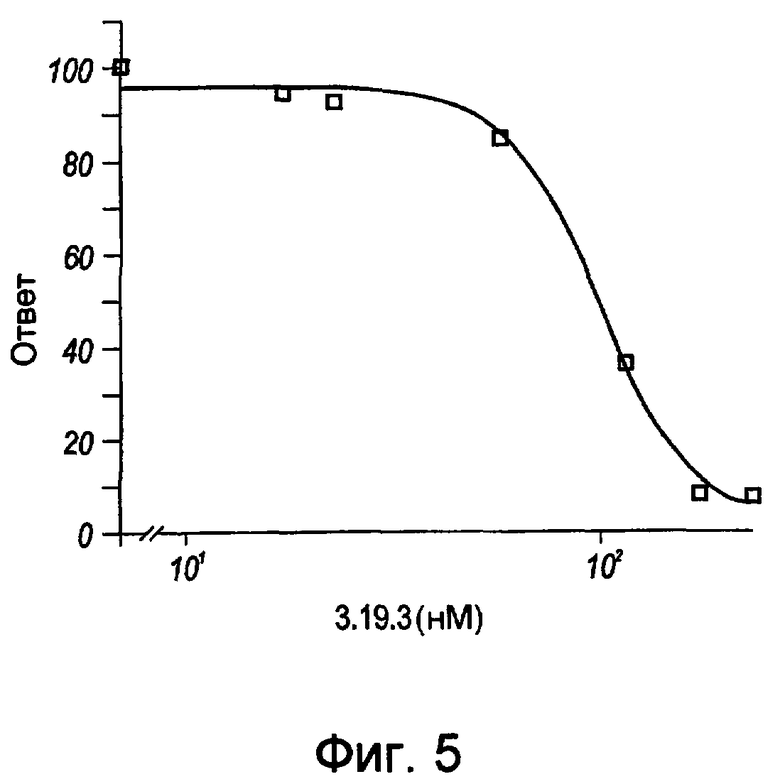
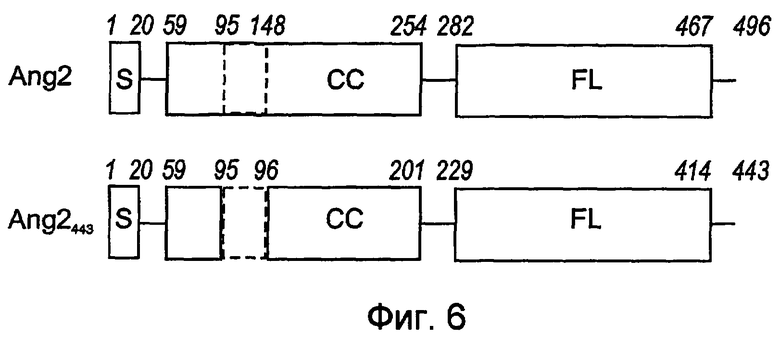





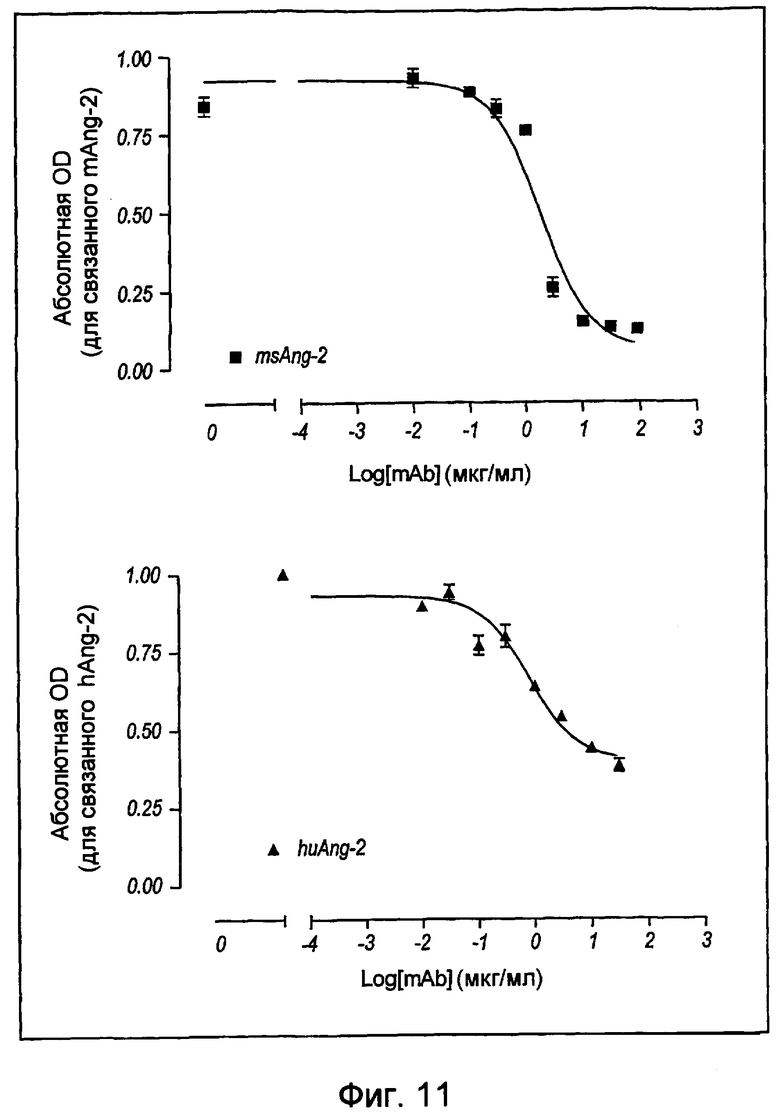
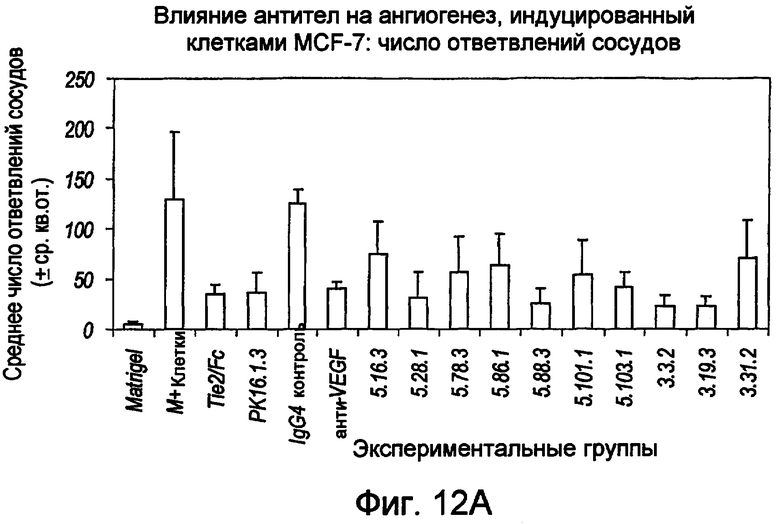
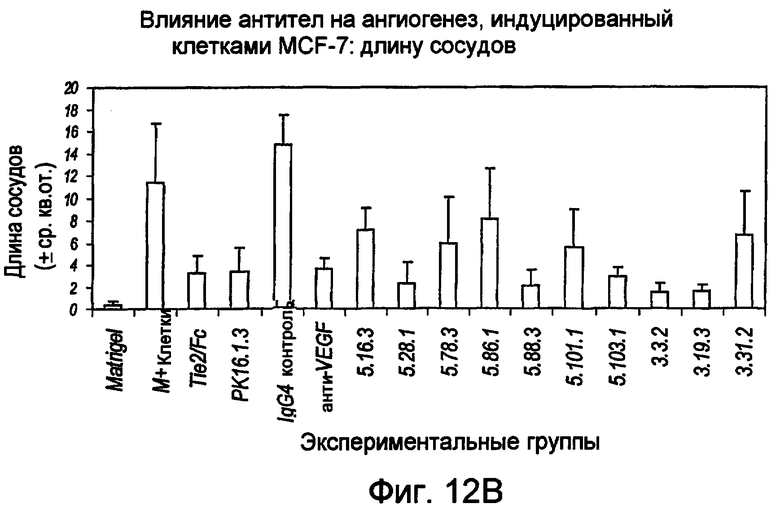
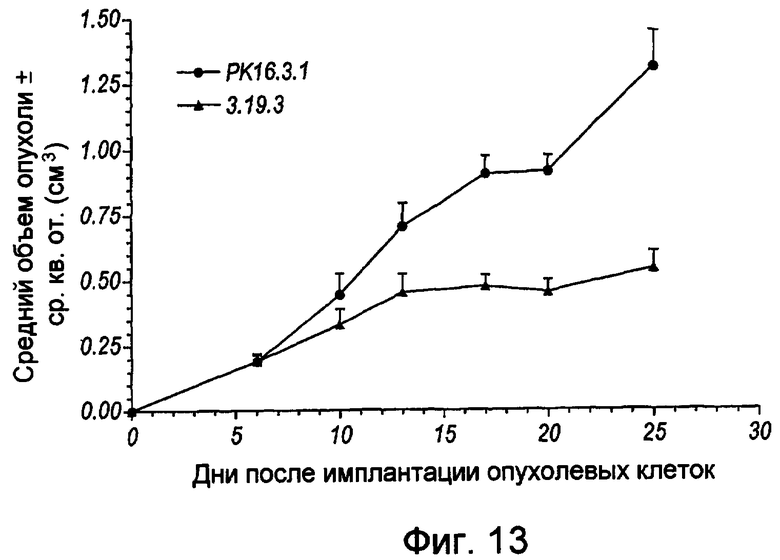
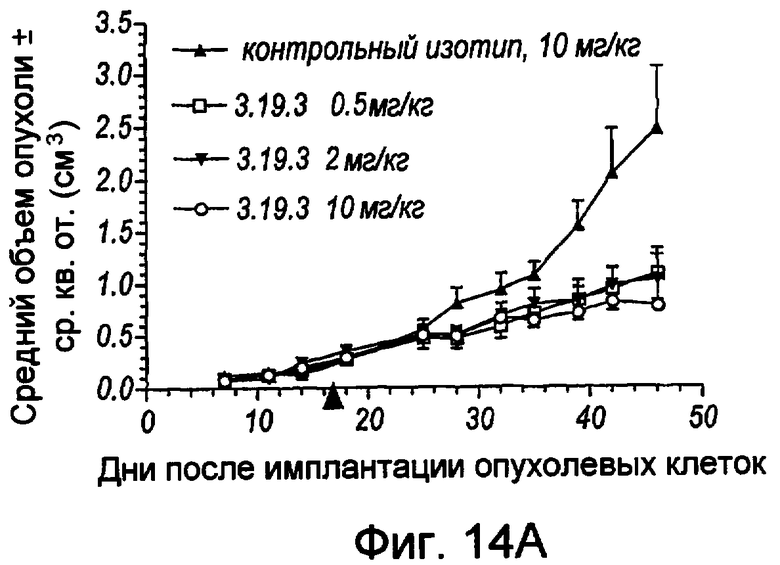
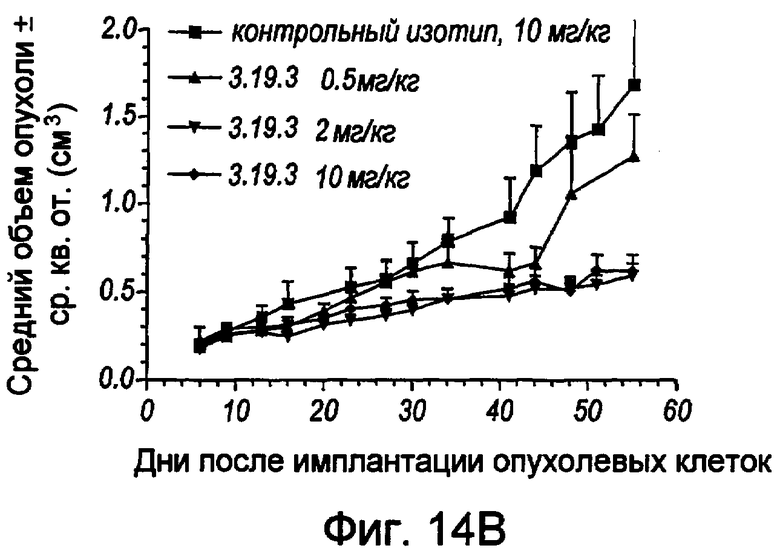
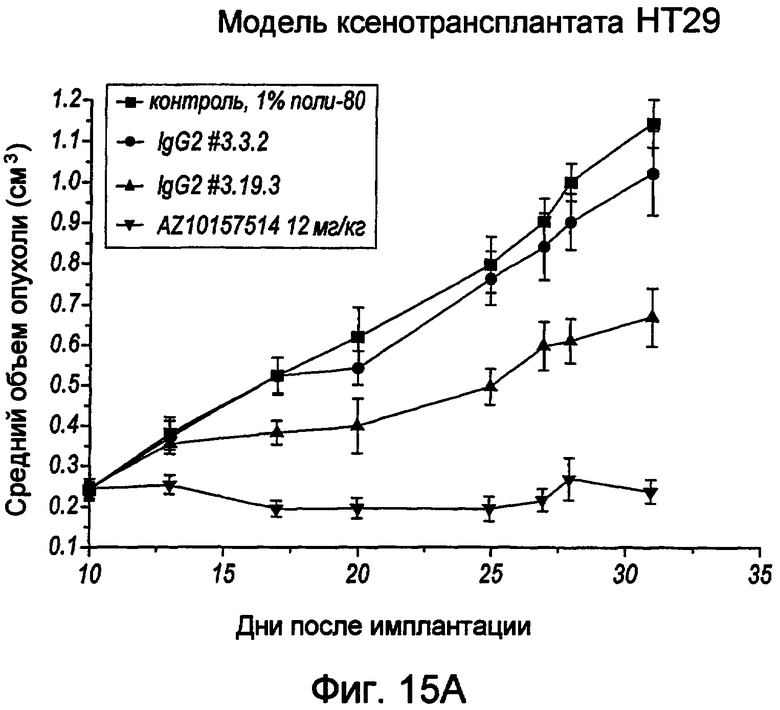
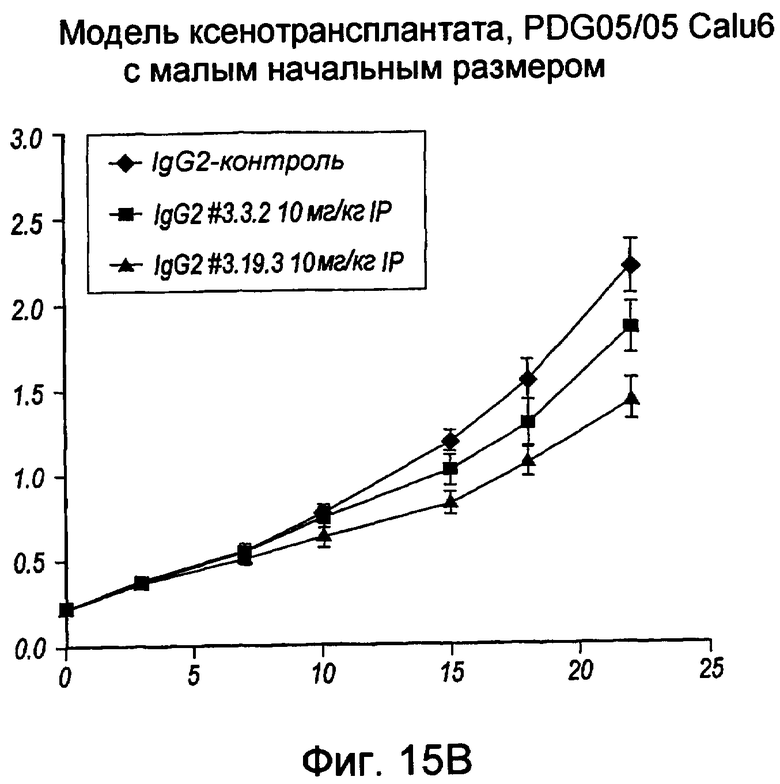
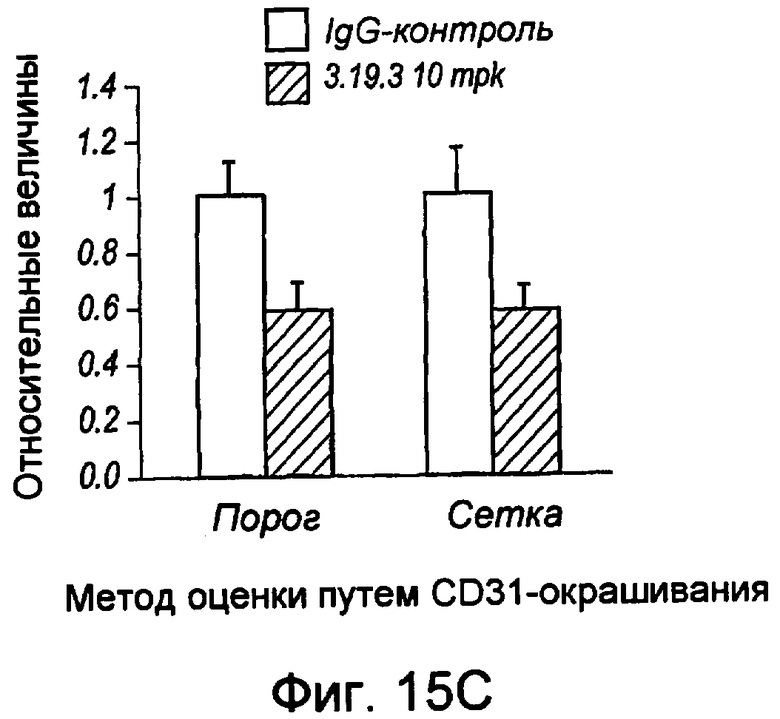
Настоящее изобретение относится к области биотехнологии и иммунологии. Предложено антитело против ангиопоэтина-2. Раскрыты варианты антитела, продуцируемые гибридомой АТСС РТА-7258, АТСС РТА-7259, АТСС РТА-7260. Раскрыты соответствующая кодирующая нуклеиновая кислота и экспрессионный вектор. Описана клетка-хозяина, продуцирующая антитело на основе указанного вектора. Предложены: способ лечения патологического ангиогенеза на основе антитела и использование антитела для приготовления лекарственного средства для лечения патологического ангиогенеза. Антитела по изобретению имеют Kd порядка 10-10-10-12 M, для антитела 3.19.3 (из АТСС РТА-7260) IC50=99 нМ. Указанные свойства антител могут найти применение в лечении различных опухолей человека. 8 н. и 25 з.п. ф-лы, 18 ил., 18 табл.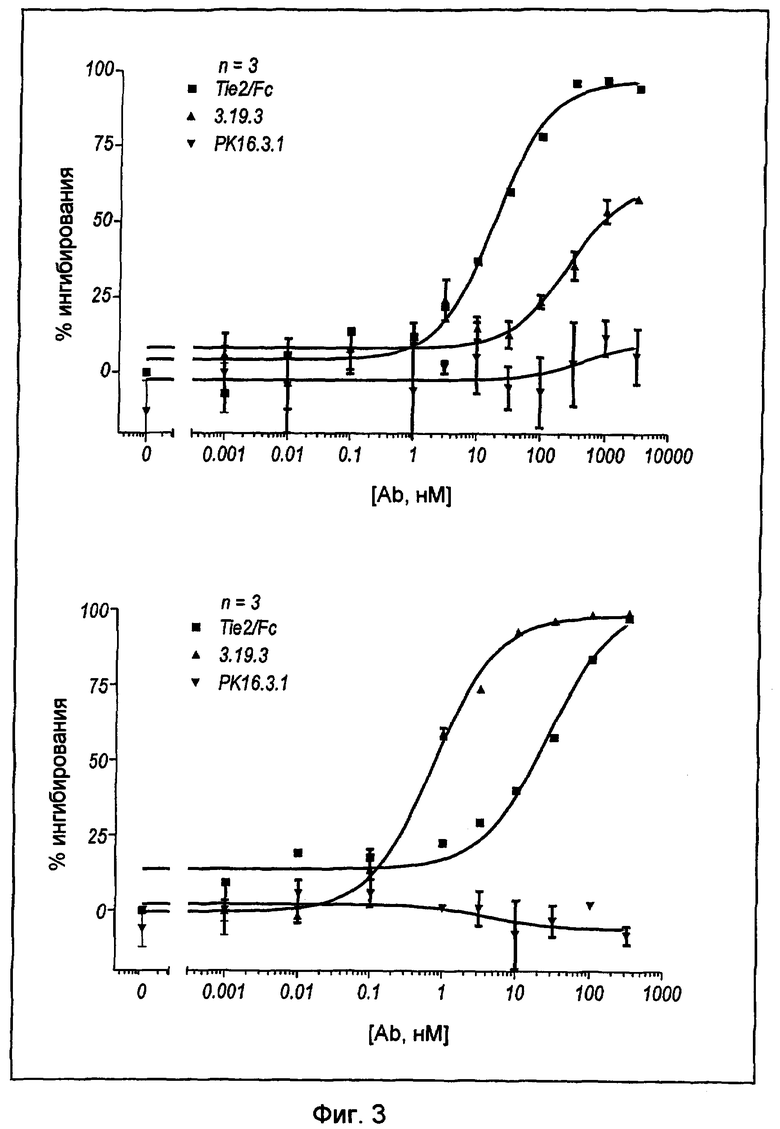
1. Моноклональное антитело, которое связывается с ангиопоэтином-2 (Ang-2), где указанное антитело содержит
вариабельную область легкой цепи, выбранную из группы, состоящей из:
а. последовательности легкой цепи, содержащей SEQ ID NO:81,
b. последовательности легкой цепи, содержащей SEQ ID NO:25,
и
с. последовательности легкой цепи, содержащей SEQ ID NO:471,
и
вариабельную область тяжелой цепи, выбранную из группы, состоящей из:
а. последовательности тяжелой цепи, содержащей SEQ ID NO:79,
b. последовательности тяжелой цепи, содержащей SEQ ID NO:23, и
с. последовательности тяжелой цепи, содержащей SEQ ID NO:469.
2. Моноклональное антитело по п.1, где указанное антитело содержит последовательность вариабельной области легкой цепи, содержащую SEQ ID NO:81.
3. Моноклональное антитело по п.1, где указанное антитело содержит последовательность вариабельной области легкой цепи, содержащую SEQ ID NO:25.
4. Моноклональное антитело по п.1, где указанное антитело содержит последовательность вариабельной области легкой цепи, содержащую SEQ ID NO:471.
5. Моноклональное антитело по п.1, где указанное антитело содержит последовательность тяжелой цепи, содержащую SEQ ID NO:79.
6. Моноклональное антитело по п.1, где указанное антитело содержит последовательность тяжелой цепи, содержащую SEQ ID NO:23.
7. Моноклональное антитело по п.1, где указанное антитело содержит последовательность тяжелой цепи, содержащую SEQ ID NO:469.
8. Моноклональное антитело по п.1, где указанное антитело содержит компонент, выбранный из группы, состоящей из:
а. последовательности вариабельной области легкой цепи, содержащей SEQ ID NO:81, и последовательности вариабельной области тяжелой цепи, содержащей SEQ ID NO:79;
b. последовательности вариабельной области легкой цепи, содержащей SEQ ID NO:25, и последовательности вариабельной области тяжелой цепи, содержащей SEQ ID NO:23; и
с. последовательности вариабельной области легкой цепи, содержащей SEQ ID NO:471, и последовательности вариабельной области тяжелой цепи, содержащей SEQ ID NO:469.
9. Моноклональное антитело по п.8, где указанное антитело содержит последовательность вариабельной области легкой цепи, содержащую SEQ ID NO:81, и последовательность вариабельной области тяжелой цепи, содержащую SEQ ID NO:79.
10. Моноклональное антитело по п.8, где указанное антитело содержит последовательность вариабельной области легкой цепи, содержащую SEQ ID NO:25, и последовательность вариабельной области тяжелой цепи, содержащую SEQ ID NO:23.
11. Моноклональное антитело по п.8, где указанное антитело содержит последовательность вариабельной области легкой цепи, содержащую SEQ ID NO:471, и последовательность вариабельной области тяжелой цепи, содержащую SEQ ID NO:469.
12. Антитело по п.8, где указанное антитело выбрано из группы, состоящей из:
a. mAb 3.19.3, где указанное антитело продуцируется гибридомой, депонированной под номером доступа в АТСС РТА-7260;
b. mAb 3.3.2, где указанное антитело продуцируется гибридомой, депонированной под номером доступа в АТСС РТА-7258;
и
с. mAb 5.88.3, где указанное антитело продуцируется гибридомой, депонированной под номером доступа в АТСС РТА-7259.
13. Антитело по п.12, где указанное антитело представляет собой антитело, продуцируемое гибридомой, депонированной под номером доступа в АТСС РТА-7260.
14. Антитело по п.12, где указанное антитело представляет собой антитело, продуцируемое гибридомой, депонированной под номером доступа в АТСС РТА-7258.
15. Антитело по п.12, где указанное антитело представляет собой антитело, продуцируемое гибридомой, депонированной под номером доступа в АТСС РТА-7259.
16. Моноклональное антитело, которое связывается с ангиопоэтином-2 (Ang-2), где указанное антитело содержит:
а. три участка CDR тяжелой цепи антитела 3.19.1, представленной в табл.11;
b. три участка CDR легкой цепи антитела 3.19.1, представленной в табл.12.
17. Антитело по любому из пп.1-16, присутствующее в комбинации с фармацевтически приемлемым носителем.
18. Молекула нуклеиновой кислоты, кодирующая антитело по любому из пп.1-16.
19. Экспрессионный вектор, содержащий молекулу нуклеиновой кислоты по п.18.
20. Клетка-хозяин для получения антитела, содержащая вектор по п.19.
21. Способ лечения злокачественной опухоли у животного, включающий введение указанному животному, нуждающемуся в этом, терапевтически эффективной дозы антитела по любому из пп.1-17.
22. Способ по п.21, где указанным животным является человек.
23. Способ по п.21, где указанным антителом является моноклональное антитело 3.19.3 (номер доступа в АТСС РТА-7260), или 3.3.2 (номер доступа в АТСС РТА-7258), или 5.88.3(номер доступа в АТСС РТА-7259).
24. Способ по п.21, где указанная злокачественная опухоль выбрана из группы, состоящей из меланомы, мелкоклеточного рака легких, немелкоклеточного рака легких, глиомы, гепатоцеллюлярной карциномы (печени), опухоли щитовидной железы, рака желудочно-кишечного тракта (желудка), рака предстательной железы, рака молочной железы, рака яичника, рака мочевого пузыря, рака легких, глиобластомы, рака эндометрия, рака почек, рака толстой кишки, рака поджелудочной железы и плоскоклеточной карциномы.
25. Способ лечения индуцированного ангиопоэтином-2 патологического ангиогенеза, включающий введение животному, нуждающемуся в этом, терапевтически эффективной дозы антитела по любому из пп.1-17.
26. Способ по п.25, где указанным животным является человек.
27. Способ по п.25, где указанным антителом является гуманизированное моноклональное антитело.
28. Способ по п.25, где указанное антитело связывается с ангиопоэтином-1.
29. Применение антитела по любому из пп.1-17 в целях приготовления лекарственного средства для лечения злокачественной опухоли.
30. Применение по п.29, где указанная злокачественная опухоль выбрана из группы, состоящей из: меланомы, мелкоклеточного рака легких, немелкоклеточного рака легких, глиомы, гепатоцеллюлярной карциномы (печени), опухоли щитовидной железы, рака желудочно-кишечного тракта (желудка), рака предстательной железы, рака молочной железы, рака яичника, рака мочевого пузыря, рака легких, глиобластомы, рака эндометрия, рака почек, рака толстой кишки, рака поджелудочной железы и плоскоклеточной карциномы.
31. Применение по п.29, где указанным антителом является моноклональное антитело.
32. Применение по п.31, где указанным антителом является гуманизированное моноклональное антитело.
33. Применение по п.32, где указанным полностью человеческим моноклональным антителом является полностью человеческое антитело 3.19.3 (номер доступа в АТСС РТА-7260), или 3.3.2 (номер доступа в АТСС РТА-7258), или 5.88.3 (номер доступа в АТСС РТА-7259).
Приоритет по пунктам:
19.12.2005 по пп.12-15, 23, 33;
21.12.2004 по пп.1-11, 16-22, 24-32;
25.08.2005 по пп.1-11, 16-22, 24-32.
| WO 03030833 А, 17.04.2003 | |||
| CAI et al., "Single chain Fv antibody against angiopoietin-2 inhibits VEGF-induced endothelial cell proliferation and migration in vitro", Biochem Biophys Res Commun | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| RU 98104128/14 A, 27.01.2000. | |||
Авторы
Даты
2010-07-20—Публикация
2005-12-19—Подача