Эта международная заявка заявляет приоритет находящихся на одновременном рассмотрении заявок США №418595, поданной 6 апреля 1995, №373579, поданной 17 января 1995, №353503, поданной 9 декабря 1994, №348492, поданной 2 декабря 1994, №330261, поданной 27 октября 1994, №319932, поданной 7 октября 1994, содержания каждой из которых включены сюда по ссылке. В описании имеются ссылки на различные публикации. Содержание этих публикаций целиком включено в рассматриваемую заявку по ссылке.
Введение
В общих чертах настоящее изобретение относится к области генной инженерии и, более конкретно, к генам рецепторов тирозинкиназ и их родственных лигандов, к их встраиванию в рекомбинантные ДНК векторы, и к получению кодируемых протеинов в реципиентных штаммах микроорганизмов и реципиентных эукариотных клетках. Более конкретно, настоящее изобретение относится к новым лигандам, известным как TIE-2 лиганды, которые связывают TIE-2 рецептор, а также к способам получения этих TIE-2 лигандов. В настоящем изобретении предложены также последовательности нуклеиновых кислот, кодирующие TIE-2 лиганды, и способы получения нуклеиновых кислот, кодирующих эти TIE-2 лиганды и их генные продукты. TIE-2 лиганды, так же как и кодирующие их нуклеиновые кислоты, могут быть полезны в диагностике и лечении некоторых заболеваний, затрагивающих эндотелиальные клетки и соответствующие TIE рецепторы, такие как неопластичные заболевания, включая опухолевый ангиогенез, лечение ран, тромбоэмболические заболевания, атеросклероз и воспалительные заболевания. В более общем плане биологически активные TIE-2 лиганды можно использовать для промотирования роста, выживания и/или дифференциации клеток, экспрессирующих TIE-2 рецептор. Биологически активный TIE-2 лиганд можно использовать для ин витро поддержания культуры клеток, экспрессирующих TIE-2 рецептор. Клетки и ткани, экспрессирующие TIE-2 рецептор, включают, например, эндотелиальные клетки сердца и сосудов, эпителий хрусталика и эпикард сердца. В другом варианте такой лиганд можно использовать для поддержки клеток, которые сконструированы для экспрессии TIE-2 рецептора. Далее, TIE-2 лиганды и соответствующие им рецепторы можно использовать в аналитических системах для идентификации агонистов или антагонистов TIE-2 рецептора.
Предпосылки изобретения
Поведение клеток, ответственных за развитие, сохранение и восстановление дифференцированных клеток и тканей регулируется в значительной степени за счет межклеточных сигналов, передаваемых за счет факторов роста и аналогичных лигандов и их рецепторов. Эти рецепторы расположены на поверхности соответствующих клеток, и они связывают пептиды или полипептиды, известные как факторы роста, а также другие гормоно-подобные лиганды. Результатом такого взаимодействия являются быстрые биохимические изменения в соответствующих клетках, а также быстрая и длительная перестройка экспрессии клеточных генов. Некоторые рецепторы, связанные с различными клеточными поверхностями, могут связывать специфические факторы роста.
Фосфорилирование тирозинов на протеинах за счет тирозинкиназ представляет одну из ключевых схем, за счет которых сигналы передаются через плазменную мембрану. Некоторые известные в настоящее время гены протеина тирозинкиназы кодируют трансмембранные рецепторы полипептидных факторов роста и гормонов, таких как эпидермальный фактор роста (EGF), инсулин, инсулино-подобный фактор роста (IGF-1), факторы роста, полученные из тромбоцитов (PDGF-A u -В) и факторы роста фибробластов (FGFs). (Heldin et al., Cell Regulation, 1: 555-566 (1990); Ullrich et al., Cell, 61: 243-54 (1990)).
В каждом случае эти факторы роста проявляют свое действие за счет связывания с внеклеточной частью соответствующих им рецепторов, что приводит к активации внутренней тирозинкиназы, которая присутствует на цитоплазмической части рецептора. Рецепторы факторов роста эндотелиальных клеток представляют особый интерес за счет возможного вовлечения факторов роста в ряд важных физиологических и патологических процессов, таких как васкулогенез, ангиогенез, атеросклероз, и воспалительные заболевания (Folkman et al., Science, 235: 442-447 (1987)). Кроме того, рецепторы некоторых гемопоэтических факторов роста являются тирозинкиназами; они включают c-fms, который представляет рецептор фактора 1, стимулирующего колонии, Sherr et al., Cell 41: 665-676 (1985), u c-kit, рецептор примитивного гемопоэтического фактора роста, о котором сообщает Huang et al., Cell, 63: 225-33 (1990).
Рецепторы тирозинкиназ подразделяют на эволюционные подсемейства на основе характеристических структур их эктодоменов (Ullrich. et al., Cell, 61: 243-54 (1990)). Такие подсемейства включают EGF рецепторо-подобную киназу (подкласс I) и подобную рецептору инсулина киназу (подкласс II), каждая из которых содержит повторенные гомологичные последовательности с высоким содержанием цистеина в своих внеклеточных доменах. Отдельный участок с высоким содержанием цистеина обнаружен также во внеклеточных доменах eph-подобных киназ. Hirai et al., Science 238: 1717-1720 (1987); Lindberg et al., Mol. Cell. Biol., 10: 6316-24 (1990); Lhotak et al., Mol. Cell. Biol. 11: 2496-2502 (1991). PDGF рецепторы, а также c-fms и c-kit рецепторы тирозинкиназ можно сгруппировать в подкласс III, тогда как FGF рецепторы образуют подкласс IV. Типичным для членов обоих этих подклассов являются внеклеточные складывающиеся фрагменты, стабилизированные внутрицепными дисульфидными связями. Такие так называемые иммуноглобулин (Ig)-подобные складки обнаружены в протеинах иммуноглобулинового суперсемейства, которое включает широкий круг других рецепторов клеточных поверхностей, имеющих либо связанные с клетками, либо растворимые лиганды. Williams et al., Ann. Rev. Immunol., 6: 381-405 (1988).
Рецепторы тирозинкиназ отличаются по своей специфичности и афинности. Обычно рецепторы тирозинкиназ являются гликопротеинами, которые состоят из (1) внеклеточного домена, способного связывать специфически фактор (факторы) роста; (2) трансмембранного домена, который обычно является альфа-спиральной частью протеина; (3) юкстамембранного домена, где рецептор может регулироваться, например, за счет фосфорилирования протеина; (4) домена тирозинкиназы, который является энзиматическим компонентом рецептора; и (5) карбокситерминального хвоста, который во многих рецепторах участвует в распознавании и связывании с субстратами для тирозинкиназы.
Сообщается, что такие процессы, как альтернативный экзонный сплайсинг и альтернативный выбор генного промотора или сайтов полиаденилирования способны привести к образованию нескольких различных полипептидов из одного и того же гена. Такие полипептиды могут содержать (или могут не содержать) различные домены, перечисленные ранее. Как следствие, некоторые внеклеточные домены могут быть экспрессированы как отдельные секретируемые протеины, и некоторые формы рецепторов могут не содержать домена тирозинкиназы, а содержать только внеклеточный домен, встроенный в плазменную мембрану за счет трансмембранного домена плюс короткого карбокситерминального хвоста.
Ген, кодирующий эндотелиальную клеточную трансмембранную тирозинкиназу, вначале идентифицированную за счет RT-PCR как неизвестный гомологичный тирозинкиназе кДНК фрагмент из клеток лейкемии человека, описан Partanen et al., Proc. Natl Acad. Sci. USA, 87: 8913-8917 (1990). Этот ген и кодируемый им протеин названы "tie", что является сокращением для "тирозинкиназы с доменами, гомологичными с Ig и EGF". Partanen et al., Mol. Cell Biol. 12: 1698-1707 (1992).
Сообщалось, что tie мРНК присутствует во всех тканях плода человека и мышиного эмбриона. После изучения tie посредник был локализован в клетках сердца и в сосудистых эндотелиальных клетках. tie мРНК были локализованы в эндотелии кровеносных сосудов и эндокарде мышиных эмбрионов на 9,5-18,5 день их существования. Была показана усиленная tie экспрессия во время неоваскуляризации, связанной с развитием фолликул яичников и гранулированием тканей в кожных ранах. Korhonen et al., Blood 80: 2548-2555 (1992). Таким образом, предполагается что tie играет роль в ангиогенезе, что важно для разработки способов лечения твердых опухолей и некоторых других заболеваний, зависящих от ангиогенеза, таких как диабетическая ретинопатия, псориаз, атеросклероз и артриты.
Два структурно родственных протеина TIE рецептора крыс, как сообщалось, кодируются различными генами с родственными профилями экспрессии. Один ген, названный tie-1, является крысиным гомологом tie человека. Maisonpierre et al., Oncogene 8: 1631-1637 (1993). Другой ген, tie-2, может быть крысиным гомологом мышиного tek гена, который, подобно tie, как сообщалось, должен экспрессироваться в мышах исключительно в эндотелиальных клетках и их предположительных предшественниках. Dumout et al., Oncogene 8: 1293-1301 (1993).
Как было обнаружено, оба гена широко экспрессированы в эндотелиальных клетках эмбриональных и постнатальных тканей. Значительные уровни tie-2 транскриптов присутствуют также в других популяциях эмбриональных клеток, включая эпителий хрусталика, эпикард сердца и участки мезенхимы. Maisonpierre et al., Oncogene 8: 1631-1637 (1993).
Преимущественная экспрессия TIE рецептора в сосудистом эндотелии предполагает, что TIE играет роль в развитии и сохранении сосудистой системы. Сюда включены роли в детерминации, дифференциации, пролиферации эндотелиальных клеток, в миграции клеток и копировании в элементы сосудов. Сообщалось, что анализ мышиных эмбрионов с дефицитом TIE-2 показал, что TIE-2 важны для ангиогенеза, особенно для образования сети сосудов в эндотелиальных клетках. Sato T.N. et al., Nature 376: 70-74 (1994). В зрелой сосудистой системе TIE могут функционировать как фактор выживания, сохранения эндотелиальных клеток и в реакциях на влияние патогенов.
Краткое содержание изобретения
В настоящем изобретении предложена композиция, содержащая TIE-2 лиганд, практически не содержащий других протеинов. В настоящем изобретении предложена также изолированная молекула нуклеиновой кислоты, кодирующая TIE-2 лиганд. Выделенная нуклеиновая кислота может быть ДНК, кДНК или РНК. В настоящем изобретении предложен также вектор, включающий выделенную молекулу нуклеиновой кислоты, кодирующую TIE-2 лиганд. Предложена также система хозяин-вектор для продуцирования в подходящих клетках хозяина полипептида, обладающего активностью TIE-2 лиганда. Клетки подходящих хозяев могут быть бактериальными, дрожжевыми, клетками насекомых или млекопитающих. В настоящем изобретении предложен также способ получения полипептида, обладающего биологической активностью TIE-2 лиганда, который включает выращивание клеток системы хозяин-вектор в условиях, обеспечивающих продуцирование полипептида и выделение полученного таким образом полипептида.
Настоящее изобретение, в котором описана изолированная молекула нуклеиновой кислоты, кодирующая TIE-2 лиганд, предлагает далее для развития лиганда фрагмент, или производное его, или другую молекулу, которая является агонистом или антагонистом рецептора, в качестве терапевтического агента для лечения пациентов, страдающих нарушениями, включающими клетки, ткани или органы, которые экспрессируют TIE рецептор. В настоящем изобретении предложено также антитело, которое специфически связывает такую терапевтическую молекулу. Это антитело может быть моноклональным или поликлональным. В настоящем изобретении предложен также способ использования такого моноклонального или поликлонального антитела для определения количества терапевтических молекул в образце, взятом у пациента с целью контроля за ходом лечения.
В настоящем изобретении предложено также антитело, которое специфически связывает TIE-2 лиганд. Это антитело может быть моноклональным или поликлональным. Таким образом, настоящее изобретение предлагает также терапевтические композиции, включающие антитело, которое специфически связывает ТIЕ-2 лиганд, в фармацевтически приемлемом носителе. В настоящем изобретении предложен также способ блокирования роста кровеносных сосудов у млекопитающих за счет введения эффективного количества терапевтической композиции, включающей антитело, которое специфически связывает TIE-2 лиганд, в фармацевтически приемлемом носителе.
В настоящем изобретении предложена далее терапевтическая композиция, включающая ТIЕ-2 лиганд в фармацевтически приемлемом носителе. В настоящем изобретении предложен также способ промотирования неоваскуляризации у пациента за счет введения ему эффективного количества терапевтической композиции, содержащей TIE-2 лиганд, в фармацевтически приемлемом носителе. В одном варианте способ можно использовать для промотирования заживления ран. В другом варианте способ можно использовать для лечения ишемии.
В другом варианте в настоящем изобретении предложен вариант, в котором TIE-2 лиганд может быть конъюгирован с цитотоксическим агентом, и на основании этого может быть приготовлена терапевтическая композиция. В настоящем изобретении предложено также рецепторное тело, которое специфически связывает TIE-2 лиганд. В настоящем изобретении предложена терапевтическая композиция, включающая рецепторное тело, которое специфически связывает TIE-2 лиганд, в фармацевтически приемлемом носителе. Предложен также способ блокирования роста кровеносных сосудов у млекопитающих за счет введения эффективного количества терапевтической композиции, включающей рецепторное тело, которое специфически связывает TIE-2 лиганд, в фармацевтически приемлемом носителе.
В настоящем изобретении предложен также антагонист TIE-2 рецептора, а также способ ингибирования биологической активности TIE-2 лиганда у млекопитающих, включающий введение млекопитающему эффективного количества TIE-2 антагониста. В соответствии с изобретением антагонистом может быть антитело или другая молекула, способная к специфическому связыванию либо TIE-2 лиганда, либо TIE-2 рецептора. Так, например, антагонистом может быть TIE-2 рецепторное тело.
Краткое описание чертежей
Фиг.1А и 1В: TIE-2 рецепторное тело (TIE-2 РВ) ингибирует развитие кровеносных сосудов в хориоаллантоевой мембране цыпленка (САМ). Отдельный кусочек поглощающей гелеобразной пены (Gelfoam), смоченный 6 мкг PBS, вводят немедленно под САМ однодневных эмбрионов цыпленка. После трех дней инкубирования четырехдневные эмбрионы и окружающие их САМ удаляют и исследуют. Фиг.1А: эмбрионы, обработанные ЕНК-1 RB /rЕНК-1 экто/h IgG1 Fc/ оказались жизнеспособными и обладали нормально развитыми кровеносными сосудами в окружающих их САМ. Фиг.1В: все эмбрионы, обработанные TIE-2 RB (r TIE-2 экто/h IgG1 Fc) погибли, уменьшившись в размере, и были почти полностью лишены окружающих кровеносных сосудов.
Фиг.2: Вектор pJFE14.
Фиг.3: Рестрикционная карта λgt10.
Фиг.4: Последовательности нуклеиновой кислоты и выделенной аминокислоты (однобуквенный код) человеческого TIE-2 лиганда из клона λgt10, кодирующие htie-2 лиганд 1.
Фиг.5: Последовательности нуклеиновой кислоты и выделенной аминокислоты (однобуквенный код) человеческого TIE-2 лиганда из T98G клона.
Фиг.6: Последовательности нуклеиновой кислоты и выделенной аминокислоты (однобуквенный код) человеческого TIE-2 лиганда из клона pBluescript KS, кодирующие человеческий TIE-2 лиганд 2.
Фиг.7: Результаты Вестерн-блоттинга, демонстрирующие активацию TIE-2 рецептора за счет TIE-2 лиганда 1 (полоса L1), но не за счет TIE-2 лиганда 2 (полоса L2), контроль (Моск.) активация также отсутствует.
Фиг.8: Результаты Вестерн-блоттинга, демонстрирующие, что предварительная обработка НАЕС клеток избытком TIE-2 лиганда 2 (полоса 2) препятствует последующей способности разбавленного TIE-2 лиганда 1 активировать TIE-2 рецептор (TIE-2-R) по сравнению с тем, что происходит при предварительной обработке НАЕС клеток MOCK средой (полоса 1).
Фиг.9: Гистограммное представление связывания с иммобилизованной поверхностью крысиного TIE2 IgG TIE2 лиганда в С2С12 ras, Rat2 ras, SHEP и T98G концентрированной (10х) кондиционированной среде. Специфическое связывание крысиных TIE2 (rТIЕ2) демонстрируется значительным снижением связывающей активности в присутствии 25 мкг/мл растворимых TIE2 RB по сравнению с меньшим снижением в присутствии растворимых trkB RB.
Фиг.10: Связывание рекомбинантного человеческого TIE-2 лиганда 1 (hTL1) и человеческого TIE-2 лиганда 2 (hTL2) в cos клеточных надосадочных жидкостях с иммобилизованной поверхностью человеческих TIE-2 RB. Специфическое связывание человеческих TIE-2 определяют, инкубируя образцы по 25 мгк/мл либо растворимого человеческого TIE2 RB, либо trkB RB; значительное снижение активности связывания наблюдается не только для образцов, инкубированных с TIE2 RB человека.
Фиг.11: Результаты Вестерн-блоттинга, демонстрирующие, что TIE-2 рецепторное тело (обозначенное TIE-2 RB, или как здесь, TIE2-Fc) блокирует активацию TIE-2 рецепторов за счет TIE-2 лиганда 1 (TL1) в HUVEC клетках, тогда как неродственное рецепторное тело (TRKB-Fc) не блокирует эту активацию.
Подробное описание изобретения
Как будет более подробно описано далее, заявители выделили за счет экспрессионного клонирования новый лиганд, который связывает TIE-2 рецептор. Настоящее изобретение включает TIE-2 лиганд, а также его аминокислотную последовательность и также функционально эквивалентные молекулы, в которых аминокислотные остатки замещены на остатки внутри последовательности, приводящие к молчащему изменению. Так, например, один или более из аминокислотных остатков в последовательности можно заменить другой аминокислотой (аминокислотами) аналогичной полярности, которая действует как функциональный эквивалент, и получить молчащую замену. Заместители аминокислот в последовательности можно выбрать из других членов того класса, к которому принадлежит эта аминокислота. Так, например, класс неполярных (гидрофобных) аминокислот включает аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин. Полярные нейтральные аминокислоты включают глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин. Позитивно заряженные (основные) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту. В объем настоящего изобретения включены также протеины, или их фрагменты, или производные, которые демонстрируют такие же или сходные биологические активности, и производные, которые дифференциально модифицированы во время или после трансляции, например, за счет гликозилирования, протеолитического расщепления, связывания с молекулой антитела или другим клеточным лигандом, и т.д.
Настоящее изобретение включает также нуклеотидную последовательность, которая кодирует протеин, описываемый здесь как TIE-2 лиганд 1, а также клетки, которые генетически сконструированы таким образом, чтобы продуцировать протеин, например, за счет трансфекции, трансдукции, инфицирования, электропорации или микроинъекции нуклеиновой кислоты, кодирующей TIE-2 лиганд 1, описываемый здесь, в подходящий вектор экспрессии.
Далее настоящее изобретение охватывает нуклеотидную последовательность, кодирующую протеин, описываемый здесь как TIE-2 лиганд 2, а также клетки, которые генетически сконструированы таким образом, чтобы продуцировать протеин, например, за счет трансфекции, трансдукции, инфицирования, электропорации или микроинъекции нуклеиновой кислоты, кодирующей TIE-2 лиганд 2, описываемый здесь, в подходящий вектор экспрессии.
Специалисту должно быть ясно, что настоящее изобретение охватывает ДНК и РНК последовательности, которые гибридизуются с выделенной последовательностью, кодирующей TIE-2 лиганд, в условиях умеренной жесткости, как определено, например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 2 ed., vol.1, pp. 101-104, Cold Spring Harbor Laboratory Press (1989). Так, молекула нуклеиновой кислоты, рассматриваемая в настоящем изобретении, включает молекулу, имеющую последовательность, выделенную из аминокислотной последовательности TIE-2 лиганда, полученную, как указано ранее, а также молекулу, имеющую последовательность нуклеиновых кислот, которая гибридизуется с такой последовательностью нуклеиновых кислот, а также последовательность нуклеиновых кислот, которая дегенеративна в отношении вышеуказанных последовательностей как результат генетического кода, но которая кодирует лиганд, который связывает TIE-2 рецептор.
Любой из способов, известных специалистам для встраивания ДНК фрагментов в вектор, может быть использован для конструирования вектор экспрессии, кодирующих TIE-2 лиганд за счет использования соответствующих контрольных сигналов транскрипции/трансляции и кодирующих протеин последовательностей. Эти способы могут включать ин витро рекомбинантные ДНК и синтетические методики, а также ин виво рекомбинации (генетические рекомбинации). Экспрессию последовательности нуклеиновых кислот, кодирующую TIE-2 лиганд или его пептидный фрагмент, можно регулировать за счет второй последовательности нуклеиновых кислот таким образом, что протеин или пептид экспрессируется в хозяине, трансформированном рекомбинантной ДНК молекулой. Так, например, экспрессию TIE-2 лиганда, здесь описываемого, можно контролировать любым промоторным/энхансерным элементом, известным специалистам. Промоторы, которые можно использовать для контроля за экспрессией лиганда, включают (но не ограничиваются этим) длинный терминальный повтор, как описано y Squinto et al. /Cell 65: 1-20 (1991)/; SV40 ранний промоторный участок (Bernoist and Chambon, Nature 290: 304-310), CMV промотор, M-MuLV 5’ терминальный повтор, промотор, содержащийся в 3’ длинном терминальном повторе вируса саркомы Payca (Yamamoto et al., Cell 22: 787-797 (1980)), промотор гена тимидинкиназы вируса герпеса (Wagner et al., Proc. Natl Acad. Sci. USA 78: 144-1445 (1981)), промотор аденовируса, регуляторные последовательности гена металлотионеина (Brinster et al., Nature 296: 39-42 (1982)); такие прокариотные векторы экспрессии, как промотор β-лактамазы (Villa-Kamaroff et al., Proc. Natl. Acad. Sci. USA 75: 3727-3731 (1978)) или tac промотор (DeBoer et al., Proc. Natl. Acad. Sci. USA 80: 21-25 (1983)), см. также "Useful proteins from recombinant bacteria" в Scientific American, 242: 74-94 (1980); промоторные элементы из дрожжей или других грибков, такие как Gal 4 промотор, ADH (алкогольдегидрогеназа) промотор, РGК (фосфоглицерин-кината) промотор, промотор щелочной фосфатазы и следующие участки транскрипционного контроля животных, которые демонстрируют тканеспецифичность, и были использованы в трансгенных животных: контрольный участок гена эластазы 1, который активен в ацинарных клетках поджелудочной железы (Swift et al., Cell. 38: 639-646 (1984); Ornitz et al., Cold Spring Harbor Symp. Quant. Biol. 50: 399-409 (1986); MacDonald, Hepatology 7: 425-515 (1987); контрольный участок инсулинового гена, который активен в бета-клетках поджелудочной железы (Hanahan, Nature 315: 115-122 (1985)), контрольный участок гена иммуноглобулина, который активен в лимфоидных клетках (Grosschedl et al., 1984, Cell 38: 647-658; Adames et al., 1985, Nature 318: 533-538; Alexander et al., 1987, Mol. Cell. Biol. 7: 1436-1444), контрольный участок вируса мышиной опухоли молочной железы, который активен в клетках яичников, груди, лимфоидных и тучных клетках (Leder et al., 1986, Cell 45: 485-495), контрольный участок гена альбумина, который активен в печени (Pinkert et al., 1987, Genes and Devel 1: 268-276), контрольный участок гена альфа-фетопротеина, который активен в печени (Krumlauf et al., 1985, Mol. Cell. Biol. 5: 1639-1648; Hammer et al., 1987, Science 235: 53-58); контрольный участок гена альфа 1-антитрипсина, который активен в печени (Kelsey et al., 1987, Genes and Devel. 1: 161-171), контрольный участок гена бета-глобина, который активен в миелоидных клетках (Mogram et al., 1985, Nature 315: 338-340; Kollias et al., 1986, Cell 46: 89-94); контрольный участок гена основного протеина миелина, который активен в олигодендроцитных клетках мозга (Readhead et al., 1987, Cell 48: 703-712); контрольный участок гена легкой цепи-2 миозина, который активен в скелетных мышцах (Shani, 1985, Nature 314: 283-286), и контрольный участок гена гормона высвобождения гонадотропина, который активен в гипоталамусе (Mason et al., 1986, Science 234: 1372-1378). Далее изобретение охватывает получение антисмысловых соединений, которые способны специфически гибридизоваться с последовательностью РНК, кодирующей TIE-2 лиганд для модулирования его экспрессии (Ecker, патент США №5166195, выданный 24 ноября 1992 г.).
Таким образом, в соответствии с настоящим изобретением векторы экспрессии, способные к репликации в бактериальных или эукариотных хозяевах, содержащие нуклеиновую кислоту, кодирующую TIE-2 лиганд, как он здесь раскрыт, используют для трансфекции хозяина и за счет этого прямой экспрессии такой нуклеиновой кислоты для получения TIE-2 лиганда, который можно затем выделить в биологически активной форме.
В том смысле, как здесь использован, биологически активная форма включает форму, способную связываться с ТIЕ-2 рецептором и вызывать такую биологическую реакцию, как диференцированное функционирование или влияние на фенотип клетки, экспрессирующей этот рецептор. Такие биологически активные формы должны, например, включать фосфорилирование домена тирозинкиназы рецептора TIE-2.
Векторы экспрессии, содержащие генную вставку, можно идентифицировать в результат четырех общих подходов: (а) ДНК-ДНК гибридизации, (в) по наличию или отсутствию "маркерных" генных функций, (с) по экспрессии встроенных последовательностей и (d) определению с помощью РСR. В первом подходе наличие чужеродной генной вставки в векторе экспрессии можно детектировать за счет ДНК-ДНК гибридизации, используя зонды, включающие последовательности, которые гомологичны гену, кодирующему встроенный TIE-2 лиганд. Во втором подходе систему рекомбинантный вектор/хозяин можно идентифицировать и отобрать на основании присутствия или отсутствия определенных "маркерных" генных функций (например, по активности тимидинкиназы, по устойчивости к антибиотикам, по фенотипу трансформации, по образованию тел окклюзии в бакуловирусах и т.д.), вызываемому за счет встраивания в вектор чужеродных генов. Так, например, если кодирующая TIE-2 лиганд нуклеиновая кислота встроена в последовательность маркерного гена вектора, рекомбинанты, содержащие эту вставку, можно идентифицировать по отсутствию функций маркерного гена. В третьем подходе рекомбинантные векторы экспрессии можно идентифицировать, анализируя продукт чужеродного гена, экспрессируемый рекомбинантом. Такой анализ может быть основан, например, на физических или функциональных свойствах генного TIE-2 продукта, например, за счет связывания лиганда с TIE-2 рецептором или его частью, которая может быть связана, например, с детектируемым антителом, или его частью, или за счет связывания с антителами, выработанными против протеина TIE-2 лиганда или его части.
Клетки настоящего изобретения могут кратковременно или предпочтительно конститутивно и постоянно экспрессировать ТIЕ-2 лиганды, как это здесь описано. В четвертом подходе можно получить ДНК нуклеотидные праймеры, соответствующие tie-2 специфической ДНК последовательности. Эти праймеры можно затем использовать в PCR tie-2 генных фрагментов (PCR Protocols: A Guide To Methods and Applications, Edited by Michael A. Innis et al., Academic Press (1990)).
Рекомбинантный лиганд можно выделить любым способом, который обеспечивает последующее образование стабильного биологически активного протеина. Так, например (но не с точки зрения ограничений), лиганд можно выделить из клеток либо как растворимые протеины, либо как тела включения, из которых лиганды можно экстрагировать количественно с помощью 8М гаунидинийхлорида и диализа. С целью дальнейшей очистки лиганда можно использовать обычную ионообменную хроматографию, хроматографию гидрофобных взаимодействий, хроматографию с обращенной фазой или гельфильтрацию.
В дополнительных вариантах изобретения рекомбинантный TIE-2 лиганд кодирующий ген можно использовать для инактивации или "нокаута" эндогенных генов за счет гомологической рекомбинации и тем самым создать клетки с дефицитом TIE-2 лиганда, ткани или животных. Так, например, (и не с целью ограничений), рекомбинантный TIE-2 лиганд кодирующий ген можно сконструировать так, чтобы он содержал встраиваемую мутацию, например nео ген, который должен инактивировать нативный TIE-2 лиганд кодирующий ген. Такая конструкция под контролем подходящего промотора может быть встроена в такие клетки, как стволовые клетки эмбриона, такими способами, как трансфекция, трансдукция или инъекции. Клетки, содержащие такую конструкцию, можно затем отобрать по устойчивости к G418. Клетки, в которых отсутствует интактный ген, кодирующий TIE-2 лиганд, можно затем идентифицировать, например, за счет Саузерн-блоттинга, PCR определения, Норзерн-блоттинга или анализа экспрессии. Клетки, в которых отсутствует интактный ген, кодирующий TIE-2 лиганд, можно затем слить с клетками эмбриона на ранней стадии для создания трансгенных животных с дефицитом такого лиганда. Таких животных можно использовать для определения специфических ин виво процессов, которые обычно зависят от этого лиганда.
В настоящем изобретении предложены также антитела к TIE-2 лигандам, здесь описаны, которые можно использовать для детектирования лигандов, например, в диагностических целях. Для получения моноклональных антител, направленных на TIE-2 лиганд, можно использовать любые методики, которые могут обеспечить получение молекул антител при непрерывном культивировании клеточных линий. Так, например, в объем изобретения входит методика с использованием гибридом, исходно разработанная Kohler and Milstein (1975, Nature, 256: 495-497), а также триомная методика, методика с использованием гибридом В-клеток человека (Kozbor et al., 1983, Immunology Today 4: 72), и методика EBV-гибридом для получения моноклональных антител человека (Cole et al., 1985, в "Monoclonal Antibodies and Cancer Therapy," Alan R.Liss, Inc. pp.77-96) и тому подобные.
Моноклональные антитела могут быть моноклональными антителами человека или химерными человеческими-мышиными (или других видов) моноклональными антителами. Моноклональные антитела человека можно получить любой из многочисленных методик, известных специалистам (например, Teng et al., 1983, Proc. Natl. Acad. Sci. USA 80: 7308-7312; Kozbor et al., 1983, Immunology Today 4: 72-79; Olsson et al., 1982, Meth. Enzymol. 92: 3-16). Химерные молекулы антител можно получить так, чтобы они содержали мышиный антиген-связывающий домен с постоянными человеческими участками (Morrison et al., 1984, Proc. Natl. Acad. Sci. USA, 81: 6851; Takeda et al., 1985, Nature 314: 452).
Различные известные специалистам процедуры можно использовать для получения поликлональных антител к эпитопам описываемым здесь TIE-2 лигандов. Для получения антител можно иммунизовать различных животных-хозяев за счет инъекций TIE-2 лиганда или его фрагмента или производного, таких как (но не ограничиваясь ими) кролики, мыши и крысы.
Для усиления иммунологической реакции можно использовать различные адъюванты, в зависимости от видов хозяев, которые включают (но не ограничиваются ими) адъюванты Фрейнда (полный и неполный), такие минеральные гели, как гидроксид алюминия, такие поверхностно-активные вещества, как лизолецитин, плуроновые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианины лимфы улитки, динитрофенол, и такие потенциально полезные человеческие адъюванты, как BCG (Bacille Calmette-Guerin) u Corynebacterium paryum.
Молекулярные клоны антител к выбранным эпитопам ТIЕ-2 лиганда можно получить известными способами. Рекомбинантная методика (см., например, Maniatis et al., 1982, Molecular Cloning, A Laboratory Manual, Cold Sprind Harbor Laboratory, Cold Sprind Harbor, New York) можно использовать для конструирования последовательностей нуклеиновых кислот, которые кодируют молекулы моноклональных антител, или их связывающие антиген участки.
В настоящем изобретении предложены молекулы антител, а также фрагменты таких молекул антител. Фрагменты антител, которые содержат идиотип молекулы, можно создать известными способами. Так, например, такие фрагменты включают, но не ограничиваются F(аb’)2 фрагмент, который можно получить за счет переваривания пепсина молекулы антитела; Fab’-фрагменты, которые можно получить, восстанавливая дисульфидные мостики F(ab’)2 фрагмента; и Fab-фрагменты, которые можно получить, обрабатывая молекулы антител папаином и восстанавливающим агентом. Молекулы антител можно выделить известными методиками, например за счет иммуноабсорбции или иммуноафинной хроматографии, такими хроматографическими методиками, как ВЭЖХ (высокоэффективная жидкостная хроматография), или их сочетаниями.
Настоящее изобретение включает также иммуноанализ для определения количества TIE-2 лиганда в биологических образцах за счет:
а) осуществления контактирования биологического образца с, по крайней мере, одним антителом, которое специфически связывает TIE-2 лиганд так, чтобы это антитело образовывало комплекс с любым TIE-2 лигандом, присутствующим в образце; и
б) определение количества комплекса и тем самым определение количества ТIЕ-2 лиганда в биологическом образце.
Далее настоящее изобретение охватывает анализ для определения количества TIE-2 рецепторов в биологических образцах за счет:
а) осуществления контактирования биологического образца с, по крайней мере, одним лигандом изобретения таким образом, чтобы этот лиганд образовывал комплекс с ТIЕ-2 рецептором, и
б) определение количества комплексов и тем самым определение количества TIE-2 рецепторов в биологическом образце.
В настоящем изобретении предложено также использование TIE-2 лиганда для поддержания выживания, и/или роста, и/или дифференциации клеток, экспрессирующих ТIЕ-2 рецептор. Таким образом, лиганд можно использовать в качестве дополнения для поддержания, например, культуры эндотелиальных клеток. Далее, открытие заявителями родственного лиганда для TIE-2 рецептора обеспечивает использование систем анализа, пригодных для идентификации агонистов или антагонистов TIE-2 рецептора. Такие аналитические системы могут пригодиться при идентификации молекул, способных промотировать ингибирование ангиогенеза. Так например, в одном варианте антагонисты TIE-2 рецептора можно идентифицировать как тестовые молекулы, которые способны вмешиваться во взаимодействие TIE-2 рецептора с биологически активным ТIЕ-2 лигандом. Такие антагонисты идентифицируют по их способности 1) блокировать связывание биологически активного TIE-2 лиганда с рецептором, при измерении, например, с использованием BlAcore биосенсорной технологии (BlAcore; Pharmacia Biosensor, Piscataway, NY), или 2) блокировать способность биологически активно TIE-2 лиганда вызывать биологическую реакцию. Такие биологические реакции включают (но ими не ограничиваются) фосфорилирование ТIЕ-2 рецептора или расположенных в прямом направлении компонентов схемы трансдукции TIE-2 сигнала, или выживание, рост или диференциацию содержащих TIE-2 клеток.
В одном варианте клетки, сконструированные, чтобы экспрессировать TIE-2 рецептор, могли бы зависеть от роста при добавлении TIE-2 лиганда. Такие клетки обеспечивают подходящие аналитические системы для идентификации дополнительных агонистов TIE-2 рецептора, или антагонистов, способных влиять на активность TIE-2 лиганда на таких клетках. В другом варианте аутокринные клетки, сконструированные так, что они способны к совместной экспрессии и TIE-2 лиганда и рецептора, могут представлять подходящие системы для анализа потенциальных агонистов или антагонистов.
Поэтому настоящее изобретение можно использовать для введения TIE-2 рецепторов в клетки, которые обычно не экспрессируют этот рецептор, тем самым позволяя этим клеткам демонстрировать сильные и легко различимые реакции на лиганд, который связывает этот рецептор. Тип выбранной реакции зависит от используемых клеток, а не от специфического рецептора, вводимого в эти клетки. Соответствующие клеточные линии можно выбрать таким образом, чтобы получить реакцию, представляющую ценность для анализов, так же как и обнаружить молекулы, которые могут действовать на рецепторы тирозинкиназы. Эти молекулы могут быть молекулами любого типа, включая (но не ограничиваясь ими) пептиды и непептидные молекулы, которые будут действовать в описываемых системах рецептор-специфическим образом.
Одной из наиболее подходящих для использования систем является система, которая включает введение TIE-2 рецептора в клеточную линию фибробластов (например, в NIH3T3 клетки) таким образом, что такой рецептор, который обычно не участвует в пролиферативных реакциях, может после введения в фибробласты тем не менее быть проанализирован за счет различных хорошо известных методик на количественные характеристики эффектов факторов роста фибробластов (например, включение тимидина или другие типы пролиферационных анализов; см. van Zoelen, 1990, "The Use of Biological Assays For Detection Of Polypeptide Growth Factors" in Progress Factor Research, Vol.2, pp.131-152; Zhan and M. Goldfarb, 1986, Mol. Cell. Biol., Vol.6, pp.3541-3544). Эти анализы отличаются тем дополнительным преимуществом, что любые препараты можно анализировать как на клеточную линию, имеющую введенный рецептор, так и как родительскую клеточную линию, в которой этот рецептор отсутствует; только специфические эффекты на клеточной линии с рецептором следует рассматривать как управляемые за счет введенного рецептора. Такие клетки можно сконструировать далее так, чтобы они экспрессировали TIE-2 лиганд, создавая таким образом аутокринную систему, пригодную для анализа молекул, которые действуют как антагонисты/агонисты такого взаимодействия.
Таким образом, в настоящем изобретении предложены клетки хозяева, содержащие нуклеиновую кислоту, кодирующую TIE-2 лиганд, и нуклеиновую кислоту, кодирующую TIE-2 рецептор.
Взаимодействие TIE-2 рецептор/TIЕ-2 лиганд также представляет полезную систему для идентификации небольших молекул агонистов или антагонистов TIE-2 рецептора. Так, например, фрагменты, мутанты или производные TIE-2 лиганда можно идентифицировать, которые связывают TIE-2 рецептор, но не индуцируют биологической активности. В другом варианте характеризация TIE-2 лиганда позволяет определять активную часть молекулы. Далее, идентификация лиганда позволяет определять кристаллическую структуру (с помощью рентгеновских лучей) комплекса рецептор/лиганд, тем самым позволяя определить сайт связывания на рецепторе. Знание сайта связывания позволяет предусмотреть рациональную конструкцию новых агонистов и антагонистов.
Специфическое связывание тестовой молекулы с TIE-2 рецептором можно определить различными способами. Так, например, реальное связывание тестовой молекулы с клетками, экспрессирующими tie-2, можно определить или измерить, определяя или измеряя (i) тестовые молекулы, связанные с поверхностью интактных клеток, (ii) тестовые молекулы, сшитые с TIE-2 протеином в клеточных лизатах, или (iii) тестовые молекулы, связанные с TIE-2 ин витро. Специфическое взаимодействие между тестовой молекулой и TIE-2 можно оценить, используя реагенты, которые демонстрируют уникальные свойства такого взаимодействия.
Как специфический, нелимитирующий пример способы настоящего изобретения можно использовать следующим образом. Рассмотрим случай, в котором необходимо определить содержание TIE-2 лиганда в образце. Различные разбавления образца (тестовых молекул) параллельно с негативным контролем (NC), не содержащим TIE-2 лигандной активности, и позитивным контролем (PC), содержащим известное количество TIE-2 лиганда, можно обработать клетками, которые экспрессируют tie-2 в присутствии детектируемого меченого TIE-2 лиганда (в этом примере радиоиодированного лиганда). Количество TIE-2 лиганда в тестовом образце можно оценить, определяя количество 125I-меченого ТIЕ-2 лиганда, которое связывается с контролями, и в каждом из разбавлений, а затем сравнить полученные для образцов значения с градуировочной кривой. Чем больше TIE-2 лиганда содержится в образце, тем меньше 125I-лиганда будет связано с ТIЕ-2.
Количество 125I-лиганда, связанного с TIE-2, можно определить, измеряя количество радиоактивности на клетку, или за счет связывания TIE-2 лиганда с протеинами клеточной поверхности, используя DSS, по способу Meakin and Shooter, 1991, Neuron 6: 153-163, и определяя количество меченого протеина в клеточных экстрактах, используя, например, электрофорез в полиакриламидном геле, что помогает выявить меченый протеин с размерами, соответствующими TIE-2 лиганд/TIЕ-2 рецептор. Специфические взаимодействия тестируемая молекула/ТIЕ-2 можно далее тестировать, добавляя в анализ различные разбавления немеченного контрольного лиганда, который не связывает TIE-2 рецептор, и поэтому не оказывает заметного влияния на конкуренцию между меченым TIE-2 лигандом и тестовой молекулой для TIE-2 связывания. В другом варианте молекулы, с которых известно, что они способны разрушить связывание TIE-2 лиганд/ТIЕ-2, например, такие как (но ими не ограничиваясь) анти-ТIЕ-2 антитело, или TIE-2 рецепторное тело, как они здесь описаны, как можно ожидать, будут участвовать в конкуренции между 125I-TIE-2 лигандом и тестовой молекулой на предмет связывания TIE-2 рецептора.
Детектируемо меченые TIE-2 лиганды включают (но не ограничиваются ими) TIE-2 лиганд, ковалентно связанный или нековалентно связанный с радиоактивным веществом, флуоресцирующим веществом, веществом, которое обладает энзиматической активностью, веществом, которое может служить в качестве субстрата для энзима (предпочтительны энзимы и субстраты, связанные с колориметрически детектируемыми реакциями), или с веществом, которое можно распознать с помощью молекул антител, то есть с детектируемо мечеными молекулами антител.
В другом варианте специфическое связывание тестовой молекулы с TIE-2 можно измерить, оценивая вторичные биологические эффекты связывания TIE-2 лиганд/TIE-2 рецептор, включая (но не ограничиваясь ими) рост клеток, и/или диференциацию, или немедленную раннюю генную экспрессию, или фосфорилирование TIE-2. Так, например, способность тестовой молекулы индуцировать диференциацию можно тестировать в клетках, в которых отсутствует tie-2 и в сравнительных клетках, которые экспрессируют tie-2; диференцирование в tie-2 экспрессирующих клетках, но не в сравнительных клетках, которые не содержат tie-2, будет служить показателем взаимодействия специфической тестовой молекулы с TIE-2. Аналогичные анализы можно осуществлять за счет детектирования индуцирования немедленно ранних генов (например, fos и jun) в tiе-2-минус и tie-2 -плюс клетках или за счет детектирования фосфорилирования TIE-2, используя стандартный анализ фосфорилирования, известный специалистам. Такие анализы могут быть полезны для идентификации агонистов или антагонистов, которые конкурентно связываются с TIE-2.
Аналогично, в настоящем изобретении предложен способ идентификации молекул, которые обладают биологической активностью TIE-2 лиганда, включающий (i) экспонирование клеток, которые экспрессируют tie-2, тестовым молекулам, и (ii) детектирование специфического связывания тестовой молекулы с TIE-2 рецептором, где специфическое связывание с TIE-2 позитивно коррелирует с ТIЕ-2 подобной активностью. Специфическое связывание можно определить, либо анализируя непосредственно связывание, либо вторичные биологические эффекты связывания, как это обсуждалось ранее. Такой способ может быть особенно полезным при идентификации новых членов семейства TIE лигандов или в фармацевтической промышленности при скринировании большого числа пептидов и непептидных молекул (например, пептидомиметиков) по TIE соответствующей биологической активности. В предпочтительном, специфическом, нелимитирующем варианте изобретения можно приготовить большую пластину культуральных ячеек, которые содержат в чередующихся рядах РС12 (или фибробласты) клетки, которые являются либо tie-2-минус, либо сконструированы так, чтобы быть tie-2-плюс. Затем можно добавить тестовые молекулы так, чтобы каждая колонка пластины или ее часть содержала бы тестовую молекулу. Затем каждую оценить на присутствие или отсутствие роста и/или диференциации. Таким образом можно скринирировать очень большое число тестовых молекул по их активности.
В дополнительных вариантах в настоящем изобретении предложены способы определения или измерения TIЕ-подобной активности, или идентификации молекул, как обладающих такой активностью, включающие: (i) экспонирование тестовой молекулы протеину TIE-2 рецептора ин витро в условиях, которые позволяют осуществлять связывание, и (ii) детектирование связывания тестовой молекулы с TIE-2 протеином, когда связывание тестовой молекулы с TIE-2 коррелирует с TIE-подобной активностью. В соответствии с такими способами TIE-2 может быть (а может и не быть) существенно очищенным, может быть связан с твердой подложкой (например, в аффинной колонке или как в ELISA анализе) или может быть включен в искусственную мембрану. Связывание тестовой молекулы с TIE-2 можно оценить любым известным специалистам способом. В предпочтительных вариантах связывание тестовой молекулы можно детектировать или измерять за счет оценки ее способности конкурировать с детектируемо мечеными известными TIE-2 лигандами для ТIЕ-2 рецепторного связывания.
Настоящее изобретение также обеспечивает способ детектирования способности тестовой молекулы функционировать в качестве антагониста TIE-подобной активности, включающий детектирование способности молекулы ингибировать эффект связывания TIE лиганда с TIE-2 на клетках, которые экспрессируют tie-2. Такой антагонист может (а может и нет) мешать связыванию TIE-2 лиганда с TIE-2 рецептором. Эффекты связывания TIE-2 лиганда с TIE-2 рецептором представляют предпочтительно биологические или биохимические эффекты, включая (но не ограничиваясь ими) выживание или пролиферацию клеток, трасформацию клеток, индуцирование немедленного раннего гена или пролиферацию TIE-2.
Далее настоящее изобретение предлагает как способ идентификации антител или других молекул, способных нейтрализовать лиганд или блокировать его связывание с рецептором, так же как и молекулы, идентифицированные этим способом. В качестве неограничивающего примера этот способ можно осуществить в анализе, который концептуально аналогичен ELISA анализу. Так, например, TIE рецепторное тело можно связать с твердым носителем, например с пластиковой многоячеечной пластиной. В качестве контроля можно затем ввести в ячейки известное количество TIE лиганда, который был Myc-маркирован, а затем любой меченый TIE лиганд, который связывает рецепторное тело, можно идентифицировать с помощью репортерного антитела, направленного против Myc-tag. Затем эту аналитическую систему можно использовать для скринирования тестовых образцов для молекул, которые способны: (i) связываться с меченым лигандом или (ii) связываться с рецепторным телом, и за счет этого блокировать связывание с рецепторным телом за счет меченого лиганда. Так, например, тестовый образец, содержащий предположительно представляющие интерес молекулы, вместе с известным количеством меченого лиганда, можно ввести в ячейку и определить количество меченого лиганда, который связывается с рецепторным телом. За счет сравнения количества связанного меченого лиганда в тестовом образце с количеством его в контрольном можно определить образцы, содержащие молекулы, которые способны блокировать связывание лиганд с рецептором. Представляющие интерес молекулы, определенные таким образом, можно выделить, используя хорошо известные специалистам способы.
После того как определен блокатор связывания лиганда, специалистам должно быть известно, что осуществить вторичный анализ для определения того, связывается ли блокатор с рецептором, или он связывается с лигандом, а также как осуществить анализ для определения того, может ли молекула блокатора нейтрализовать биологическую активность лиганда. Так, например, используя анализ связывания за счет BIAcore биосенсорной технологии (или его эквивалент), в котором либо TIE тело рецептора, либо TIE лиганд ковалентно связаны с твердой подложкой (например, карлоксиметилдекстраном или золотой поверхностью), специалист может определить, связывается ли молекула блокатора специфически с лигандом или с телом рецептора. Для определения того, может ли молекула блокатора нейтрализовать биологическую активность лиганда, специалист может осуществить анализ с помощью фосфорилирования (см. пример 5), или, в другом варианте, за счет такого функционального биоанализа, как анализ выживания, за счет первичных культур, например эндотелиальных клеток. В другом варианте молекулы блокатора, которые связываются с телом рецептора, могут быть агонистами, и специалисту должно быть ясно, как определить это за счет осуществления соответствующего анализа для идентификации дополнительных агонистов TIE-2 рецептора.
Так как TIE-2 рецептор был идентифицирован в связи с эндотелиальными клетками и, как здесь показано, блокирование лиганда, по-видимому, предотвращает васкуляризацию, заявители продемонстрировали, что TIE-2 лиганд может быть полезен для индуцирования васкуляризации при заболеваниях или болезненных состояниях, при которых эта васкуляризация показана. Такие заболевания или расстройства включают заживление ран, ишемию и диабеты. С другой стороны, антагонисты ТIЕ-2 рецептора, такие как рецепторные тела, как раскрыто в примерах 2 и 3, и ТIЕ-2 лиганд 2, как раскрыт в примере 9, могут быть полезны для предотвращения или ослабления васкуляризации, тем самым предотвращая или ослабляя, например, рост опухоли.
Так как клетки, содержащие TIE-2 рецептор, по-видимому, должны быть отрегулированы в сторону усиления васкуляризации, TIE-2 лигандные тела могут также быть полезны для предотвращения или ослабления, например, роста опухолей. TIE-2 лиганды могут быть полезны для доставки токсинов к содержащим рецепторы клеткам. В другом варианте, такие другие молекулы, как факторы роста, цитокины или питательные вещества, можно доставить к клеткам, содержащим TIE-2 рецептор, за счет TIE-2 лигандов. TIE-2 лиганды можно также использовать в качестве диагностического реагента для TIE-2 рецептора, для определения рецептора ин виво или ин витро. Там, где TIE-2 рецептор связан с болезненным состоянием, TIE-2 лигандные тела можно использовать в качестве диагностических реагентов для определения заболевания, например, при окрашивании тканей или при получении изображения всего тела.
В настоящем изобретении предложены также фармацевтические композиции, включающие TIE-2 лиганды или лигандные тела, здесь описываемые, их пептидные фрагменты или производные, в фармацевтически приемлемом носителе. Протеины TIE-2 лиганда, пептидные фрагменты или их производные можно вводить системно или локально. Можно использовать любые подходящие типы введения, известные специалистам, включая (но не ограничиваясь этим) внутривенное, внутрисухожильное, внутриартериальное, внутриназальное, пероральное, подкожное, внутрибрюшинное или за счет локальных инъекций или в виде хирургических имплантатов. Можно также приготовить композиции с замедленным высвобождением.
В настоящем изобретении предложены также выделенные и очищенные молекулы нуклеиновых кислот, содержащие последовательности нуклеиновых кислот, кодирующие TIE-2 лиганд человека, где последовательность нуклеиновых кислот выбирают из группы, состоящей из:
(а) последовательностей нуклеиновых кислот, содержащих участок, кодирующий TIE-2 лиганд человека, как изображен на фиг.4, фиг.5 или фиг.6,
(в) последовательностей нуклеиновых кислот, которые гибридизуются в условиях умеренной жесткости с последовательностью нуклеиновых кислот по (а), и которые кодируют TIE-2 лиганд, который связывает TIE-2 рецептор, и
(с) последовательностей нуклеиновых кислот, которые являются дегенеративными за счет генетического кода по отношению к последовательностям нуклеиновых кислот (а) или (в) и которые кодируют TIE-2 лиганд, который связывает TIE-2 рецептор.
В другом варианте в изобретении предложена выделенная молекула нуклеиновой кислоты, которая кодирует TIE-2 лиганд, где последовательность нуклеиновой кислоты является:
(а) последовательностью нуклеиновой кислоты, включающей участок, кодирующий TIE-2 лиганд человека, как представлено на фиг.4, фиг.5 или фиг.6,
(в) последовательностью нуклеиновой кислоты, которая гибридизуется в условиях умеренной жесткости с последовательностью нуклеиновой кислоты (а), и которая кодирует TIE-2 лиганд, который связывает ТIЕ-2 рецептор, или
(с) последовательностью нуклеиновой кислоты, которая, если бы не вырожденность генетического кода, гибридизовалась бы с последовательностью нуклеиновых кислот (а) или (в), и которая кодирует TIE-2 лиганд, который связывает ТIЕ-2 рецептор.
В настоящем изобретении предложены также выделенные и очищенные TIE-2 лиганды, кодируемые выделенной молекулой нуклеиновой кислоты настоящего изобретения. В настоящем изобретении предложен также вектор, который включает выделение молекулы нуклеиновой кислоты, включающей последовательность нуклеиновой кислоты, кодирующую лиганд TIE-2 человека. В одном из вариантов сконструирован вектор, обозначенный как pBluescript KS, кодирующий лиганд 2 ТIЕ-2 человека.
Настоящее изобретение представляет вектор экспрессии, включающий ДНК молекулу, кодирующую лиганд TIE-2 человека, где ДНК молекула оперативно связана с последовательностью, контролирующей экспрессию. В настоящем изобретении предложена также система хозяин-вектор для продуцирования полипептида, обладающего биологической активностью лиганда TIE-2 человека, которая включает вектор экспрессии настоящего изобретения в клетках подходящего хозяина. В одном из вариантов подходящими клетками хозяина могут быть бактериальные клетки, дрожжевые клетки, клетки насекомых или клетки млекопитающих. В настоящем изобретении предложен также способ получения полипептида, обладающего активностью биологически активного TIE-2 лиганда, который включает выращивание клеток системы хозяин-вектор настоящего изобретения, в условиях, обеспечивающих продуцирование полипептида, и выделение полученного таким образом полипептида.
В настоящем изобретении описывается выделенная молекула нуклеиновой кислоты, кодирующая TIE-2 лиганд, и предлагается создание лиганда, его фрагмента или производного, или другой молекулы, которая является агонистом или антагонистом рецептора, в качестве терапевтического агента для лечения пациентов, страдающих от заболеваний, включающих клетки, ткани или органы, которые экспрессируют TIE рецептор. В качестве нелимитирующего примера в настоящем изобретении предложено тело лиганда, которое специфически связывается с TIE-2 рецептором или TIE-2. В альтернативном варианте в настоящем изобретении предложено тело лиганда, которое включает TIE-2 лиганд, связанный с постоянным участком иммуноглобулина. В одном из вариантов тело лиганда включает TIE-2 лиганд 1 или TIE-2 лиганд 2 и Fс часть IgG1 человека. Тело лиганда можно использовать в способе лечения организмов человека или животных или в диагностических целях.
В настоящем изобретении предложено также антитело, которое специфически связывает такие терапевтические молекулы. Такое антитело может быть моноклональным или поликлональным. В настоящем изобретении предложен также способ использования таких моноклональных или поликлональных антител для определения количества терапевтических молекул в образце, отобранном у пациента с целью контроля за ходом лечения.
Далее в настоящем изобретении предложена терапевтическая композиция, включающая лиганд TIE-2 человека или тело лиганда, и конъюгированный с ним цитотоксический агент. В одном из вариантов цитотоксическим агентом может быть радиоизотоп или токсин.
В настоящем изобретении предложено также антитело, которое специфически связывает TIE-2 лиганд человека. Это антитело может быть моноклональным или поликлональным.
В настоящем изобретении предложен также способ выделения TIE-2 лиганда человека, включающий:
а) соединение, по крайней мере, одного TIE-2 связывающего субстрата с твердой матрицей,
в) инкубирование субстрата а) с клеточным лизатом для того, чтобы этот субстрат образовал комплекс с любым ТIЕ-2 лигандом в клеточном лизате,
c) промывку твердой матрицы и
d) элюирование TIE-2 лиганда человека из соединенного субстрата. В качестве субстрата может быть использовано любое вещество, которое специфически связывает TIE-2 лиганд человека. В одном из вариантов субстрат выбирают из группы, состоящей из анти-ТIЕ-2 лиганд-антитела, TIE-2 рецептора и TIE-2 рецепторного тела. В настоящем изобретении предложено также рецепторное тело, которое специфически связывает TIE-2 лиганд, а также терапевтическая композиция, включающая рецепторное тело в фармацевтически приемлемом носителе, и способ блокировки роста кровеносных сосудов у человека, включающий введение эффективного количества этой терапевтической композиции.
В настоящем изобретении предложена также терапевтическая композиция, включающая TIE-2 лиганд человека или тело лиганда в фармацевтически приемлемом носителе, а также способ промотирования неоваскуляризации у пациента, включающий введение пациенту эффективного количества терапевтической композиции.
Кроме того, в настоящем изобретении предложен способ идентификации клеток, которые экспрессируют TIE-2 рецептор, который включает контактирование клетки с детектируемо меченым TIE-2 лигандом или тело лиганда, в условиях обеспечивающих связывание детектируемо меченого лиганда с TIE-2 рецептором, и определение того, связан ли детектируемо меченый лиганд с TIE-2 рецептором, идентифицируя тем самым клетки как клетки, экспрессирующие TIE-2 рецептор. В настоящем изобретении предложена также терапевтическая композиция, включающая TIE-2 лиганд или тело лиганда, и конъюгированный с ним цитотоксический агент. Цитотоксическим агентом может быть радиоизотоп или токсин.
В настоящем изобретении предложен способ определения экспрессии TIE-2 лиганда за счет клеток, который включает получение мРНК из клеток, содержащих мРНК с мечеными молекулами нуклеиновой кислоты, кодирующими TIE-2 лиганд, в условиях гибридизации, определение наличия мРНК, гибридизованных с мечеными молекулами и тем самым определение экспрессии TIE-2 лиганда в клетках.
В настоящем изобретении предложен также способ определения TIE-2 лиганда в срезах тканей, который включает осуществление контакта этих срезов тканей с мечеными молекулами нуклеиновой кислоты, кодирующими TIE-2 лиганд, в условиях гибридизации, определение присутствия мРНК, гибридизованной с меченой молекулой, определяя тем самым экспрессию TIE-2 лиганда в срезах тканей.
ПРИМЕР 1. Идентификация клеточной линии АВАЕ как репортерных клеток для TIE-2 рецептора
Взрослые ВАЕ клетки зарегистрированы в Европейском депозитории клеточных культур под регистрационным номером ЕСАСС №92010601 (см. PNAS 75: 2621 (1978)). Норзерн (РНК) анализ выявил умеренные уровни tie-2 транскриптов в АВАЕ (взрослый бычий артериальный эндотелий =Adult Bovine Arterial Endothelial) клеточной линии, консистентных с ин ситу результатами гибридизации, что демонстрирует почти исключительную локализацию tie-2 РНК на сосудистых эндотелиальных клетках. Поэтому были исследованы АВАЕ клеточные лизаты на предмет присутствия TIE-2 протеина, а также с точки зрения степени, с которой этот TIE-2 протеин тирозин-фосфорилирован в нормальных условиях роста. АВАЕ клеточные лизаты собирают и иммуноосаждают с последующим Вестерн-блоттингом иммуноосажденных протеинов за счет ТIЕ-2 специфической и фосфотирозин-специфической антисыворотки. Пропуск или включение TIE-2 пептидов как специфически блокирующих молекул во время TIE-2 иммуноосаждения позволяет однозначно определять TIE-2 как умеренно детектируемый протеин примерно 150 кД, уровни фосфотирозина которого в стабильном состоянии уменьшаются до почти недектируемых уровней из-за предшествующего сывороточного голодания клеток.
Культивирование АВАЕ клеток и сбор клеточных лизатов осуществляют следующим образом. АВАЕ клетки с низким числом пассажей высевают в виде монослоя с плотностью 2×106 клеток/150 мм пластиковые чашки Петри (Falcon) и культивируют в Дюльбеко модифицированной среде Игла (DMEM), содержащей 10% телячью сыворотку (10% BCS), 2 mM L-глутамина (9) и 1% каждого из пенициллина и стрептомицина (P-S) в атмосфере 5% СO2. Перед сбором клеточного лизата клетки подвергают сывороточному голоданию в течение 24 часов в DMEM(Q)P-S, с последующей аспирацией среды и промывкой пластин ледяным буферированным фосфатом физиологическим раствором (РВ S), дополненным ортованадатом натрия, фторидом натрия и бензамидином натрия. Клетки подвергают лизису в небольшом объеме этого промывочного буфера, который был дополнен 1% NP40 детергента и ингибиторами протеазы, PMSF и апротинином. Нерастворимые осколки удаляют из клеточных лизатов за счет центрифугирования при 14000 g в течение 10 минут при 4°С, и надосадочные жидкости иммуноосаждают антисывороткой, специфической для TIE-2 рецептора, с добавлением (или без добавления) блокирующих пептидов к примерно 20 мкг/мл лизата. Иммуноосажденные протеины разделяют за счет PAGE (7,5% Laemmli гель), а затем осуществляют электроперенос на PVDF мембрану и инкубируют либо с различными TIE-2-, либо с фосфотирозин-специфической антисывороткой. ТIЕ-2-протеин визуализируют за счет инкубирования мембран с НКР-связанной вторичной антисывороткой с последующей обработкой ECL реагентом (Amersham).
ПРИМЕР 2. Клонирование и экспрессия TIE-2 рецепторных тел для основанных на афинности исследований взаимодействий TIE-2 лиганда
Создают такую экспрессионную конструкцию, которая может секретировать протеин, состоящий из полной внеклеточной части крысиного TIE-2 рецептора, силотого с постоянным участком гамма-2 иммуноглобулина человека (IgGl Fc). Этот протеин слияния называют TIE-2 "рецепторным телом" (RB) и обычно можно ожидать, что он существует как димер в растворе, за счет образования дисульфидных связей между отдельными IgGl Fc хвостами. Fc часть TIE-2 SB получают следующим образом. ДНК фрагмент, кодирующий Fc часть IgGl человека, который простирается от шарнирного участка до карбокси конца протеина, был амплифицирован из кДНК плаценты человека за счет PCR с олигонуклеотидами, соответствующими последовательности IgG1 человека, полученный ДНК фрагмент клонируют в плазмидный вектор. Соответствующие ДНК рестрикционные фрагменты из плазмиды, кодирующей полноразмерный TIE-2 рецептор, и из плазмиды IgG1 Fc человека, лигируют с каждой из сторон короткого PCR-полученного фрагмента, который был сконструирован так, чтобы сливать в рамке TIE-2 и человеческий IgG1 Fc протеин-кодирующие последовательности. Таким образом, полученный протеин слияния TIE-2 эктодомен-FС, точно замещает IgG1 Fc вместо участка, охватывающего TIE-2 трансмембранный и цитоплазмический домены. Альтернативный способ получения ВВ раскрыт y Goodwin et al., Cell 73: 447-456 (1993).
Миллиграммовые количества TIE-2 RB получают за счет клонирования TIE-2 ЕВ ДНК фрагмента в pVL1393 бакуловирусный вектор и последующего инфицирования Spodoptera frugiperda SF-21AE клеточной линии насекомых. В другом варианте можно использовать клеточную линию SF-9 (АТСС регистрационный N CRL-1711) или клеточную линию BTI-TN-5b1-4. ДНК кодирующую TIE-2 RB, клонируют как Eco RI-Notl фрагмент в бакуловирусную плазмиду переноса pVL 1393. Плазмидную ДНК, очищенную за счет центрифугирования с градиентом плотности цезий хлорида рекомбинируют с вирусной ДНК, смешивая 3 мкг плазмидной ДНК с 0,5 мкг Baculo-Gold ДНК (Pharminigen), с последующим введением в липосомы, используя 30 мкг липофектина (Lipofectin, GIBCO-BRL). Смеси ДНК-липосома добавляют к F-21AE клеткам (2×106 клеток/60 мм чашку) в среде TMN-FH модифицированная Grace среда для клеток насекомых (GIBCO-BRL) в течение 5 часов при 27°С, в течение 5 дней в TMN-FH среде, дополненной 5% фетальной телячей сывороткой. Среду тканевых культур собирают для бляшкового очищения рекомбинантных вирусов, что осуществляют описанным ранее способом (O’Reilly, D.R., L.K.Miller and V.A.Luckow, Baculovirus Expression Vectors - A Laboratory Manual. 1992, New York: W.H.Freeman) за исключением того, что агарозный поверхностный слой содержит 125 мкг/мл X-gal (5-бром-4-хлор-3-индолил-β-D -галактопиранозида, GIBCO-BRL). Через 5 дней инкубирования при 27°С нерекомбинантные бляшки оценивают по позитивной хромогенной реакции на Х-gal субстрате и отмечают их положения. Затем визуализируют рекомбинантные бляшки, добавляя второй поверхностный слой, содержащий 100 мкг/мл МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромид, Sigma). Предполагаемые рекомбинантные вирусные бляшки отбирают за счет аспирации бляшек и очищают за счет множественных циклов выделения бляшек для обеспечения гомогенности. Запас вирусов создают за счет серийного с низкой множественностью пассажа очищенного бляшками вируса. Получают запас низкого пассажа одного вирусного клона (vTIE-2 рецепторное тело).
SF-21AE клетки культивируют в среде, не содержащей сыворотки (SF-900 II, Gibco BRL), содержащий раствор IX антибиотик/антимикотик (Gibco BRL) и 25 мг/л гентамицина (Gibco BRL). В качестве поверхностно активного агента добавляют Pluronic F-68 до конечной концентрации 1 г/л. Культуры (4 л) выращивают в биореакторе (Artisan Cell Station System) в течение, по крайней мере, трех дней перед инфицированием. Клетки выращивают при 27°С, газируя до 50% растворенным кислородом, при скорости газового потока 80 мл/мин (аэрация с распылением по кольцу). Перемешивание осуществляют с помощью турбинки со скоростью 100 об/мин. Клетки собирают в средней логарифмической фазе роста (примерно 2×106 клеток на мл), концентрируют за счет центрифугирования и инфицируют 5 бляшкообразующими единицами vTIE-2 рецепторным телом на клетку. Клетки и инокулюм доводят до 400 мл за счет свежей среды, и вирус абсорбируют в течение 2 часов при 27°С в спиннере. Затем культуру снова суспендируют до конечного объема 8 л свежей, не содержащей сыворотки, среде, и клетки инкубируют в биореакторе, используя описанные ранее условия.
Культуральную среду клеток SF21AE, инфицированных TIE 2 рецепторным телом, собирают за счет центрифугирования (500 g, 10 минут) через 72 часа после инфицирования. Надосадочные жидкости доводят до рН 8 за счет NaOH. Добавляют ЕДТА до конечной концентрации 10 мМ и рН надосадочной жидкости снова доводят до 8. Надосадочную жидкость фильтруют (0,45 мкм, Millipore) и помещают на протеин А колонку (протеин А сефароза 4, быстрый поток или HiTrapp протеин А, обе от Pharmacia). Колонки промывают PBS, содержащим 0,5 М NaCl, до тех пор, пока поглощение при 280 нМ не падает до базовой линии. Колонку промывают PBS и элюируют 0,5 М уксусной кислотой. Фракции колонки немедленно нейтрализуют, элюируя в ампулы, содержащие 1 М трис рН 9. Пиковые фракции, содержащие TIE-2 PB, собирают и диализуют против PBS.
ПРИМЕР 3. Демонстрация того факта, что TIE-2 играет решающую роль в развитии сосудистой сети
Учитывая отсутствие известного лиганда для TIE-2 рецептора, разумно было бы предположить, что это может дать возможность выяснить функции TIE-2 за счет введения "избытка" растворимых TIE-2 рецепторных тел (TIE-2 RВ) в развивающуюся систему. Потенциальная способность TIE-2 RB связывать и тем самым нейтрализовать доступные ТIЕ-2 лиганды может привести к наблюдаемому нарушению нормального развития сосудов и к характеризации лиганда. Для исследования того, можно ли использовать TIE-2 RB для нарушения развития сосудов у ранних эмбрионов цыплят, небольшие кусочки биологически поглощающей пены смачивают TIE-2 RВ и немедленно помещают под хориоаллантоевую мембрану в положении непосредственно сбоку от примитивного эмбриона.
Ранний эмбрион цыпленка развивается сверху желтка из небольшого диска клеток, который покрыт хориоаллантоевой мембраной (САМ). Эндотелиальные клетки, которые должны выстилать сосудистую сеть в эмбрионе, образуются как из вне-, так и внутри-эмбрионных клеток. Экстраэмбрионально полученные эндотелиальные клетки, которые обеспечивают основной источник эндотелиальных клеток в эмбрионе, происходит из участков мезенхимы, которая расположена по бокам вокруг собственно эмбриона, непосредственно под САМ. По мере того как эти мезенхимные клетки зреют, они становятся источниками общего потомства как эндотелиальных, так и гемопоэтических клеточных линий, называемых гемангиобластами. В свою очередь, гемангиобласты служат источником смешанных популяций ангиобластов (потомства эндотелиальных клеток) и гемоцитобластов (полипотенциальный гемопоэтический предшественник). Образование рудиментов циркуляторной системы начинается, когда потомство эндотелиальных клеток разделяется с образованием пузырька толщиной в одну клетку, который окружает примитивную кровяную клетку. Пролиферация и миграция этих клеточных компонентов приводит к образованию сети заполненных кровью микрососудов под САМ, что в конечном счете охватывает эмбрион и соединяется с ограниченными, интраэмбрионально полученными сосудистыми элементами.
Недавно оплодотворенные куриные яйца, полученные от Spafas, Inc. (Boston, МА), инкубируют при 99,5°F (37,5°C), 55% RH. Примерно после 24 часов развития яичную скорлупу промывают 70% этанолом и с помощью зубоврачебного бора делают отверстие 1,5 см в тупом конце каждого яйца. Мембрану скорлупы удаляют для создания воздушного пространства непосредственно над эмбрионом. Вырезают небольшие прямоугольные кусочки стерильной Gelfoam (Upjohn) скальпелем и смачивают равными концентрациями либо TIE-2, либо ЕНК-1 рецепторных тел. ЕНК-1 рецепторное тело получают, как было указано ранее в примере 2, используя ЕНК-1 внеклеточный домен вместо TIE-2 внеклеточного домена (Maisonpierre et al., Oncogene 8: 3277-3288 (1993). Каждый кусочек пены геля абсорбирует примерно 6 мкг протеина в 30 мкл. Стерильный пинцет часового мастера используют для создания маленького отверстия в САМ в положении в нескольких мм сбоку от примитивного эмбриона. Большую часть кусочка RВ-смоченной Gelfoam помещают под САМ и яичную скорлупу закрывают кусочками липкой ленты. Другие яйца той же стадии развития обрабатывают параллельно RB неродственной, нейронно экспрессированной рецепторной тирозинкиназой, ЕНК-1 (Maisonpierre et al., Oncogene 8: 3277-3288 (1993). Развитию дают возможность протекать 4 дня, а затем эмбрион исследуют на предмет визуального исследования. Эмбрионы удаляют, осторожно разбивая скорлупу в чашки с подогретым RB, и осторожно вырезают эмбрион из окружающего САМ. Из 12 яиц, обработанных каждое RB, 6 TIE-2 RB и 5 ЕНК-1 RВ обработанных эмбрионов развились после стадии наблюдения в начале эксперимента. Разительная разница наблюдается между этими развитыми эмбрионами, что видно на фиг.1А и 1В. Те, что были обработаны ЕНК-1 RB, по-видимому, развивались относительно нормально. Четыре из пяти ЕНК-1 эмбрионов были жизнеспособны, о чем можно было судить по биениям сердца. Более того, экстраэмбриональная сосудистая сеть, которая визуально была очевидна из-за присутствия красных кровяных клеток, проникала и простиралась на несколько сантиметров вбок под САМ. Напротив, те, что были обработаны TIE-2 RB, были сильно ограничены, имели всего 2-5 мм в диаметре по сравнению с диаметром 10 мм для ЕНК-1 RB эмбрионов. Все эмбрионы, обработанные TIE-2 RB, погибли, и их САМ были лишены кровеносных сосудов. Способность TIE-2 RB блокировать развитие сосудов у цыплят демонстрирует, что TIE-2 лиганд необходим для развития сосудистой системы.
ПРИМЕР 4. Идентификация активности специфического связывания TIE-2 в кондиционированной среде из ras-онкоген-трансформированной клеточной линии С2С12 мышиных миобластов
Скринирование в 10 раз концентрированной клеточной кондиционированной среды (10 x ССМ) из различных клеточных линий на предмет присутствия растворимой Т1Е-2 специфической связывающей активности (ВIАсоrе; Рhаrmасiа Вiosensor, Рiscataway, NY) выявляет связывающую активность в не содержащей сыворотки среде от онкогенно-ras-трансформированных С2С12 клеток (С2С12-ras), RАТ 2-ras (что является ras трансформированной фибробластной клеточной линией), глиобластомы Е98G человека и нейробластомной клеточной линии, известной как SНЕР-1.
С2С12-ras 10Х ССМ, исходно полученные из стабильно-рансфектированной линии С2С12 миобластов, которые были онкогенно трансформированы за счет трансфекции Т-24 мутантами Н-ras стандартными методами с использованием кальцийфосфата. Неомицин-устойчивая экспрессионная плазмида на основе SV40 была физически связана с газ экспрессионной плазмидой для того, чтобы сделать возможной селекцию трансфектированных клонов. Полученные G418 устойчивые ras-С2С12 клетки обычным образом поддерживают в виде монослоя на пластиковых чашках в ДМЕМ/глутамин/пенициллин-стрептомицин среде, дополненной 10% фетальной телячей сывороткой (FСS). Не содержащие сыворотки С2С12-ras 10Х ССМ получают, высевая клетки при 60% конфлюентности на не содержащую сыворотки определенную среду на 12 часов. (Zhan and Goldfarb, Моl. Сеll. Вiоl. 6: 3541-3544 (1986)); Zhan, et аl. Оncogene 1: 369-376 (1987)). Среду сливают и заменяют на свежую DМЕМ/О/Р-S на 24 часа. Эту среду собирают, и клетки снова подкармливают свежей DМЕМ/О/Р-S, которую также собирают еще через 24 часа. Эти ССМ дополняют ингибиторами протеазы РМSF (1 mМ) и апротинином (10 мкг/мл) и концентрируют в 10 раз на стерильных мембранах эксклюзии по размерам (Amicon). TIE-2 связывающую активность можно нейтрализовать за счет инкубирования среды с избытком ТIЕ-2 RB, но не за счет инкубирования с ЕНК-1 RB, перед BIAcore анализом.
Связывающую активность 10x ССМ определяют, используя биосенсорную технологию (BIAcore; Pharmacia Biosensor, Piscataway, NJ), которая позволяет контролировать биомолекулярные взаимодействия в реальном времени за счет резонанса плазмона поверхности. Очищенные TIE-2 ВВ ковалентно связаны за счет первичных аминов с карбоксиметилдекстрановым слоем СМ5 сенсорного чипа исследовательской степени чистоты (Pharmacia Biosensor, Piscataway, NJ). Поверхность сенсорного чипа активируют, используя смесь N-гидроксисукцинимида (NHS) и N-этил-N’-(3-диметиламинопропил)карбодиимида (ЕДС), с последующей иммобилизацией TIE-2 RB (25 мкг/мл, рН 4,5) и дезактивацией непрореагировавших сайтов за счет 1,0 М этаноламина (рН 8,5). Поверхность негативного контроля ЕНК-1 рецепторного тела подготавливают аналогичным образом.
Промывочным буфером в этой системе является HBS (10 mM Hepes 3,4 мМ ЕДТА, 150 мМ NaCl, 0,005% Р20 ПАВ, рН 7,4). 10х ССМ образцы центрифугируют в течение 15 минут при 4°С и далее осветляют, используя стерильный, связывающий низкие протеины фильтр 0,45 мкМ Millipore, Bedford, MA). К каждому образцу ССМ добавляют декстран (2 мг/мл) и Р20 поверхностноактивный агент (0,005%). Аликвоты по 40 мкл инъектируют через иммобилизованную поверхность (либо TIE-2, либо ЕНК-1) при скорости потока 5 мкл/мин и в течение 8 минут регистрируют рецепторное связывание. Активность связывания (ед. резонанса, RU) определяют как разность между базовым значением, определяемым за 30 сек перед инъекцией образца, и величиной, полученной через 30 сек после инъекции. Регенерация поверхности осуществляется за счет одного 12-мкл импульса 3М MgCl2.
Приборный уровень шума составляет 20 RU; поэтому любую связывающую активность с сигналом выше 20 RU можно интерпретировать как реальное взаимодействие с рецептором. Для C2C12-ras кондиционированной среды связывающие активности оказываются в интервале 60-90 RU для TIE-2 RB иммобилизованной поверхности. Для тех же самых образцов, проанализированных на ЕНК-1 RB иммобилизованной поверхности, измеренные активности оказались менее 35 RU. Специфическое связывание с TIE-2 рецепторным телом оценивают, инкубируя образцы с избытком либо растворимого TIE-2, либо ЕНК-1 RВ перед анализом активности связывания. Добавление растворимого ЕНК-1 RB не оказывает влияния на TIE-2 связывающую активность для любого образца, тогда как в присутствии растворимого TIE-2 связывание с поверхностью оказывается в 2-30 раз меньше, нежели величина, измеренная в отсутствии TIE-2. Повторный анализ с использованием более чем в 50 раз концентрированным C2C12-ras ССМ приводит к четырехкратному усилению по сравнению с фоновым значением для сигнала специфического связывания TIE-2.
ПРИМЕР 5. C2C12-ras ССМ содержит активность, которая индуцирует тирозин-фосфорилирование ТIЕ-2 рецептора C2C12-ras 10х ССМ исследуют по способности индуцировать тирозинфосфорилирование TIE-2 в клетках АВАЕ.АВАЕ клетки после голодания по сыворотке кратковременно инкубируют с C2C12-ras CCM, подвергают лизису и иммуноосаждают, а затем проводят Вестерн-блоттинг описанным ранее способом. Стимулирование голодающих по сыворотке АВАЕ клеток, не содержащих сыворотки C2C12-ras 10х ССМ, осуществляют следующим образом. Среду АВАЕ клеток, подвергнутую голоданию, как описано ранее, удаляют и заменяют либо определенной средой, либо 10х CCM, которая была предварительно нагрета до 37°С. Через 10 минут среду удаляют, а клетки дважды промывают на льду избытком охлажденной PBS, дополненной ортованадат (NaF) бензамидином. Клеточный лизис и TIE-2 специфическое иммуноосаждение осуществляют описанным ранее способом.
АВАЕ клетки инкубируемые в течение 10 минут с указанной средой приводят к индуцированию TIE-2 тирозинфосфорилирования, тогда как инкубирование с C2C12-ras CCM стимулирует, по крайней мере, стократное усиление TIE-2 фосфорилирования. Эта активность почти полностью изчезает при предварительном инкубировании C2C12-ras 10х CCM в течение 90 минут при комнатной температуре с 13 мкг TIE-2 RB фиксированными на протеин 6-сефарозных шариках. Среда же при инкубировании с одной только протеин 6-сефарозой не утрачивает этой активности фосфорилирования.
ПРИМЕР 6. Экспрессионное клонирование TIE-2 лиганда COS-7 клетки культивируют в модифицированной Дюльбекко среде Игла (DMEM), содержащей 10% фетальной бычьей сыворотки (FBS), по 1% каждого пенициллина и стрептомицина (P/S) и 2 мМ глутамина в атмосфере 5% СО2. Клеточную линию мышиных миобластов С2С12 ras культивируют в минимальной необходимой среде Игла (ЕМЕМ) с 10% FBS, (P/S) и 2 мМ глутамина. Получают полной длины кДНК клоны мышиных TIE-2 лигандов за счет скринирования библиотеки С2С12 ras кДНК в pJFE14 векторе, экспрессированном в COS клетки. Этот вектор, как представлено на фиг.2, является модифицированной версией вектора pSRα (Takebe, et al. 1988, Mol. Cell. Biol. 8: 466-472). Эту библиотеку создают, используя два BSTX1 рестрикционных сайта в pJFE14 векторе.
COS-7 клетки кратковременно трансфицируют либо pJFE14 библиотекой, либо контрольным вектором за счет DEAE-декстран трансфекционной схемы. Короче говоря, COS-7 клетки высевают с плотностью 1,0×106 клеток на 100 мм пластины за 24 часа до трансфекции. Для трансфекции клетки культивируют в не содержащей сыворотки DMEM, содержащей 400 мкг/мл DEAE-декстрана, 1 мкМ хлороквина и 2 мМ глутамина и 1 мкг соответствующей ДНК, в течение 3-4 часов при 37°С в атмосфере 5% СО2. Среду для трансфекции отсасывают и заменяют буферированным фосфатом физиологическим раствором с 10% ДМСО в течение 2-3 минут. После такого ДМСО "шока" COS-7 клетки помещают в DMEM с 10% FBS, по 1% каждого пенициллина и стрептомицина и 2 мМ глутамина на 48 часов.
Так как TIE-2 лиганд секретируется, необходимо сделать клетки проницаемыми для определения связывания зонда рецепторного тела с лигандом. Через два дня после трансфекции клетки промывают PBS, a затем инкубируют с PBS, содержащим 1,8% формальдегида, в течение 15-30 минут при комнатной температуре. Затем клетки промывают XXX PBS и инкубируют в течение 15 минут с PBS, содержащим 0,1% Triton Х-100 и 10% телячей сыворотки для того, чтобы сделать клетки проницаемыми и блокировать сайты неспецифического связывания. Скринирование осуществляют за счет непосредственной локализации окрашивания, используя ТIЕ-2 рецепторное тело, которое состоит из внеклеточного домена TIE-2, слитого с постоянным участком IgG1. Это рецепторное тело получают как представлено ранее в примере 2. 100 мм чашки с трансфектированными, фиксированными и сделанными проницаемыми клетками COS зондируют за счет инкубирования их в течение 30 минут с TIE-2-RB. Затем клетки дважды промывают PBS и инкубируют в течение дополнительных 30 минут с PВS (10% сыворотка теленка) конъюгат анти IgG-человека щелочная фосфатаза. После трех PBS промывок клетки инкубируют в субстрате щелочной фосфатазы в течение 30-60 минут. Затем чашки исследуют под микроскопом на присутствие окрашенных клеток. Для каждой из окрашенных клеток небольшой участок клеток, включающий эту окрашенную клетку, вырезают из чашки, используя кончик пластиковой пипетки, затем выделяют плазмидную ДНК и используют для электропорации бактериальных клеток. Отдельные колонии бактерий, полученные в результате электропорации, отбирают, и полученную из этих колоний плазмидную ДНК используют для трансфекции COS-7 клеток, которые зондируют на предмет ТIЕ-2 лигандной экспресии, как доказательство связывания с ТIЕ-2 рецепторными телами. Это позволяет идентифицировать отдельные колонии, кодирующие TIE-2 лиганд. Подтверждение экспрессии TIE-2 лиганда получают за счет фосфорилирования TIE-2 рецептора, используя изложенный ранее в примере 5 способ. Плазмидный клон, кодирующий TIE-2 лиганд, депонирован в АТСС 7 октября 1994г. и обозначен как "pJFE14, кодирующий TIE-2 лиганд" под регистрационным номером АТСС №75910.
ПРИМЕР 7. Выделение и секвенирование полной длины кДНК клона, кодирующего TIE-2 лиганд человека
кДНК библиотеку легких плода человека в лямбда-gt 10 (см. фиг.3) получают из Clontech Laboratories, Inc. (Palo Alto, CA). Бляшки высевают с плотностью 1,25×106/20×20 см пластины и фильтры с отпечатками снимают в соответствии со стандартными процедурами (Sambrok et al., Molecular Cloning: A Laboratory Manual, 2nd Ed., page 8.46, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York).
Выделение клонов tie-2 к лиганда человека осуществляют следующим образом. 2,2 kb Xhol - фрагмент из депонированного клона tie-2 лиганда (АТСС №75910 - см. пример 6) метят за счет статистического примирования до специфической активности примерно 5×108 имп./мин/нг. Гибридизацию осуществляют при 65°С в гибридизационном растворе, содержащем 0,5 мг/мл ДНК спермы лосося. Фильтры промывают при 65°С в 2×SSC, 0,1% SDS и экспонируют на пленку Kodak XAR-5 в течение ночи при -70°С. Позитивные фаги очищают. Лизаты фагов с высокими титрами из чистых фагов используют для выделения ДНК на Qiagen колонке, используя стандартную методику (Qiagen, Inc., Chatsworth, CA, 1995 каталог, стр.36). Фаговую ДНК переваривают EcoRl для выделения клонированного кДНК фрагмента для последующего субклонирования. Лямбда фаговый вектор, содержащий ДНК tie-2 лиганда человека, депонируют в АТСС 26 октября 1994г. под названием λgt10 кодирующий htie-2 лиганд 1 (АТСС регистрационный №75928). Фаговую ДНК можно непосредственно подвергнуть ДНК секвенированию по способу с использованием дидеоксицепной терминации (Sanger et al., 1977, Proc. Natl. Acad. Sci. USA. 74: 5463-5467).
Субклонирование TIE-2 лиганда человека в вектор экспрессии млекопитающих
Клон λgt10, кодирующий htie-2 лиганд 1, содержит EcoRl-сайт, расположенный на 490 пар оснований в прямом направлении от старта кодирующей последовательности для tie-2 лиганда человека. Кодирующий участок можно вырезать, используя уникальные рестрикционные сайты в обратном и прямом направлении от инициатора и стоп кодона соответственно. Так, например, Spel-сайт, расположенный на 70 вр 5’ от инициаторного кодона, и Врu1102 (также известный как Вlрl) сайт, расположенный на 265 bр в направлении 3’ от стоп-кодона, можно использовать для вырезания полного кодирующего участка. Затем его можно субклонировать в pJFE14 клонирующий вектор, используя Xbal (совместимый со Spel выступом) и Pstl-сайты (Pstl- и Врu1102-сайты оба образуют тупые концы).
Секвенирование TIE-2 лиганда человека
Кодирующий участок из клона λgr10, кодирующий tie-2 лиганд 1, секвенируют, используя ABl 373A ДНК секвенатор и набор Taq Dyedeoxy Terminator Cycle Sequencing Kit (Applied Biosystems, Inc., Foster City, CA). Нуклеотидная и выделенная аминокислотная последовательности TIE-2 лиганда человека из клона λgt10, кодирующая tie-2 лиганд 1, представлены на фиг.4.
Кроме того, полноразмерные кДНК-клоны TIE-2 лиганда человека получают за счет скринирования библиотеки кДНК глиобластомы человека T98G в pJFE14 вектор. Клоны, кодирующие tie-2 лиганд человека, идентифицируют за счет ДНК гибридизации, используя 2,2 kb Xhol-фрагмент из депонированного клона tie-2 лиганда (АТСС №75910) в качестве зонда (см. пример 6). Кодирующий участок секвенируют, используя AB1 373A ДНК секвенатор и набор Taq Dyedeoxy Terminator Cycle Sequencing Kit (Applied Biosystems, Inc., Foster City, CA). Эта последовательность почти идентична последовательности клона λgt10, кодирующего tie-2 лиганд 1. Как представлено на фиг.4, клон λgt10, кодирующий tie-2 лиганд 1, содержит дополнительный глициновый остаток, который кодируется нуклеотидами 1114-1116. Кодирующая последовательность T98G клона не содержит этого глицинового остатка, но с другой стороны, идентична кодирующей последовательности клона λgt10, кодирующего tie-2 лиганда 1. На фиг.5 представлены нуклеотидная и выведенная аминокислотная последовательности и TIE-2 лиганда человека из T98G клона.
ПРИМЕР 8. Выделение и секвенирование второго полноразмерного кДНК-клона, кодирующего TIE-2 лиганд человека
Библиотеку кДНК легких плода человека в лямбда gt-10 (см.фиг.3) получают из Clontech Laboratories, Inc. (Palo Alto, CA). Бляшки высевают с плотностью 1,25×106/20×20 см пластины и получают реплики на фильтрах в соответствии со стандартной процедурой (Sambrook et al. Molecular Cloning: A Laboratory Manual, 2nd Ed., page 8.46, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York). Дубликаты фильтров скринируют в мягких условиях (2х SSC, 55°С) зондами, полученными для tie-2 L-1 последовательности человека. Один из дубликатных фильтров зондируют 5’ зондом, кодирующим аминокислоты 25-265 tie-2 L-1 человека, как представлено на фиг.4. Второй дубликатный фильтр зондируют 3’ зондом, который кодирует аминокислоты 282-498 tie-2 L-1 последовательности человека (см. фиг.4). Оба зонда гибридизуют при 55°С в гибридизационном растворе, содержащем 0,5 мг/мл ДНК спермы лосося. Фильтры промывают в 2x SSC при 55°С и в течение ночи экспонируют на рентгеновскую пленку. Кроме того, дубликаты фильтров гибридизуют в условиях нормальной жесткости (2x SSC, 65°С), с полной длины кодирующим зондом мышиного tie-2L (F3-15, Xhol-вставка). Отбирают три позитивных клона, которые удовлетворяют следующим критериям: i) гибридизация не наблюдается с полной длины (мышиным) зондом в условиях нормальной жесткости, и ii) гибридизация наблюдается в мягких условиях как с 5’-, так и с 3’-зондами. EcoRl переваривание фаговой ДНК, полученной из этих клонов, указывает на два независимых клона с размерами вставок примерно 2,2 кb и примерно 1,8 кb. Вставку 2,2 кb EcoRl субклонируют в EcoRl-сайты как pBluescript KS (Stratagene), так и в вектор экспрессии млекопитающего, пригодный для использования в СО клетках. Определяют две ориентации для вектора экспрессии млекопитающего. Вставку 2,2 кb в pBluescript KS депонировали в АТСС 9 декабря 1994 г. и обозначили как pBluescript KS, кодирующий TIE-2 лиганд 2 человека. Стартовый сайт кодирующей последовательности TIE-2 лиганда 2 содержит примерно 355 пар оснований в прямом направлении от pBluescript EcoRl сайта.
COS-7 клетки кратковременно трансфицируют либо вектором экспрессии, либо вектором клонирования по схеме ДЕАЕ-декстран-трансфекции. Короче, COS-7 клетки высевают при плотности 1,0×106 клеток на 100 мм пластину за 24 часа до трансфекции. Для трансфекции клетки культивируют в не содержащей сыворотки DMEM, содержащей 400 мкг/мл DEAE-декстрана, 1 мкМ хлороквина и 2 мМ глутамина, и 1 мкг соответствующей ДНК в течение 3-4 часов при 37°С в атмосфере 5% СО2. Трансфекционную среду отсасывают и заменяют буферированным фосфатом физиологическим раствором с 10% ДМСО в течение 2-3 минут. После такого ДМСО "шока" COS-7 клетки помещают в DMEM с 10% FBS, по 1% каждого пенициллина и стрептомицина, и 2 мМ глутамина в течение 48 часов.
Так как TIE-2 лиганд секретируется, необходимо сделать клетки проницаемыми, чтобы можно было определить связывание зонда рецепторного тела с лигандом. Трансфектированные COS-7 клетки высевают с плотностью 1,0×106 клеток на 100 мм пластину. Эти клетки смачивают PBS, а затем инкубируют с PBS, содержащим 1,8% формальдегида в течение 15-30 минут при комнатной температуре. Затем клетки промывают PBS и инкубируют в течение 15 минут в PBS, содержащего 0,1% Triton X-100 и 10% телячей сыворотки для придания клеткам проницаемости и блокирования сайтов неспецифического связывания. Скринирование осуществляют за счет непосредственной локализации окрашивания, используя ТIЕ-2 рецепторное тело, которое состоит из внеклеточного домена TIE-2, слитого с постоянным участком IgG1. Это рецепторное тело получают, как указано в примере 2. Трансфектированные COS клетки зондируют, инкубируя их в течение 30 минут с TIЕ-2 RB. Затем клетки дважды промывают PBS, фиксируют метанолом, а затем инкубируют в течение дополнительных 30 минут с PBS/10% сыворотки телячей конъюгат анти-IgG-человека щелочная фосфатаза. После трех промывок PBS клетки инкубируют в щелочном-фосфатазном субстрате в течение 30-60 минут. Затем чашки исследуют под микроскопом для определения наличия окрашенных клеток. Клетки, экспрессирующие одну ориентацию клона, но не другую ориентацию, как видно, связывают TIE-2 рецепторное тело.
Специалисту должно быть очевидно, что описанные методы можно использовать для дальнейшей идентификации других родственных членов семейства TIE лигандов.
Секвенирование второго TIE-2 лиганда человека
Кодирующий участок из клона pBluescript KS, кодирующего TIE-2 лиганд 2 человека, секвенируют, используя АВ1 373А ДНК секвенатор и набор Taq Dyedeoxy Terminator Cycle Sequencing Kit (Applid Biosystems, Inc., Foster City, CA). Нуклеотидная и выведенная аминокислотная последовательности TIE-2 лиганда человека из клона pBluesript KS, кодирующего TIE-2 лиганд 2 человека, представлены на фиг.6.
ПРИМЕР 9. ТIЕ-2 лиганд 2 является рецепторным антагонистом
Кондиционированную среду из СOS клеток, экспрессирующих либо TIE-2 лиганд 2 (TI2), либо TIE-2 лиганд 1 (TL1) сравнивают в отношении их способности активировать TIE-2 рецепторы, естественно присутствующие в эндотелиальной клеточной линии человека.
Липофектаминовый реагент (GIBCO-BRL, Inc.)и рекомендованные схемы используют для трансфекции COS-7 клеток либо одним pJFE14 экспрессионным вектором, pJFE14 вектором, содержащим кДНК ТIE-2 лиганда 1 человека или с рМТ21 экспрессионным вектором (Kaufman R.J., 1985, Proc. Natl. Acad. Sci. USA 82: 689-693), содержащим кДНК TIE-2 лиганда 2 человека. COS среду, содержащую секретированные лиганды, собирают спустя три дня и концентрируют в 20 раз за счет диафильтрации (DIAFLO ультрафильтрационные мембраны, Amicon, Inc.). Количество активного TIE-2 лиганда 1 и ТIЕ-2 лиганда 2, присутствующее в этих средах, определяют и выражают как количество (в резонансных единицах, R.U.) TIЕ-2 рецептора активности специфического связывания, определяемое в BlAcore анализе связывания.
Норзерн-блоттинг (РНК) анализ выявил значительные уровни TIE-2 транскриптов в НАЕС (эндотелиальные клетки аорты человека) первичных эндотелиальных клетках человека (Clonetics, Inc.), поэтому эти клетки были использованы для определения того, становится ли TIE-2 рецептор тирозин-фосфорилированным при экспонировании COS среде, содержащей TIE-2 лиганды. Клетки НАЕС поддерживают в полной питательной среде для выращивания эндотелиальных клеток (Clonetics, Inc.), которая содержит 5% фетальной телячей сыворотки, растворимый экстракт бычьего мозга, 10 нг/мл ЕGF человека, 1 мг/мл гидрокортизона, 50 мкг/мл гентамицина и 50 нг/мл амфотерицина-В.
Определение того, кто из Т L1 и TL 2 может активировать TIE-2 рецептор в НАЕС клетках, осуществляют следующим образом. Полуконфлюентные клетки НАЕС заставляют голодать по сыворотке в течение двух часов в Дюльбекко среде MEM с высоким содержанием глюкозы с добавленными L-глутамином и пенициллин-стрептомицином при 37°С с последующей заменой среды голодания на содержащую лиганд кондиционированную COS среду в течение 7 минут при 37°С в инкубаторе с 5% СО2. Затем клетки подвергают лизису, и TIE-2 рецепторный протеин выделяют за счет иммуноосаждения лизатов TIE-2 пептидной антисывороткой, с последующим Вестерн-блоттингом с антифосфотирозиновой антисывороткой, в точности по способу примера 1. Полученные результаты представлены на фиг.7. Уровни фосфотирозина на TIE-2 рецепторе (TIE-2-S) индуцируют за счет обработки НЕАС клеток TIE-2 лигандом 1 (полоса L1), а не TIE-2 лигандом 2 (полоса L2) кондиционированной COS среды. MOCK представляет кондиционированную среду из COS, трансфицированных JFE14 пустым вектором.
Доказательство того, что как ТL1, так и ТL2 специфически связывают TIE-2 рецептор, продемонстрировано за счет использования BlAcore для анализа TIE-2 рецепторных специфических активностей в трансфицированной СОS среде и за счет иммуноокрашивания ТL1- и ТL2-экспрессирующих СOS клеток TIE-2 рецепторными телами.
Так как ТL2 не активирует TIE-2 рецептор, заявители решили определить, может ли TIE-2 служить антагонистом TL1 активности. Осуществляют анализ НАЕС фосфорилирования, в котором клетки вначале инкубируют с "избытком" TL2 с последующим добавлением разбавленного TL1. Оказалось разумным, что до занятия TIE-2 рецептора за счет высоких уровней ТL2 может предотвратить последующую стимуляцию рецептора с последующим экспонированием для ТL1, присутствующего в ограниченных концентрациях.
Полуконфлюентные НАЕС клетки подвергают голоданию по сыворотке как указано ранее, а затем инкубируют в течение 3 минут при 37°С с 1-2 мл 20 х СОS /JFЕ14-ТL2 кондиционированной среды. Контрольные пластины обрабатывают только 20 х COS средой (MOCK). Пластины удаляют из инкубатора, а затем добавляют различные разбавления COS/JFE14-TL1 среды, с последующим дополнительным инкубированием пластин в течение 5-7 минут при 37°С. Клетки затем промывают, подвергают лизису и исследуют TIE-2 специфическое тирозинфосфорилирование в лизатах за счет иммуноосаждения рецепторов и Вестерн-блоттинга, как указано ранее. ТL1 разбавления осуществляют, используют 20 х COS/JFE14-TL1 среду, разбавленную до 2Х, 0,5Х, 0,1X или 0,02Х за счет добавления только 20Х COS/JFE14 среды. Анализ исходных 20Х ТL1 и 20Х ТL2 COS сред с использованием BlAcore биосенсорной технологии показывает, что они содержат аналогичные количества TIE-2 специфических связывающих активностей, т.е. 445 R.U. и 511 R.U. для ТL1 и TL2 соответственно. Результаты антифосфотирозинового Вестерн-блоттинга, представленные на фиг.8, показывают, что по сравнению с предварительной обработкой НАЕС клеток MOCK средой (полоса 1), предварительная обработка НАЕС клеток избытком TIE-2 лиганда 2 (полоса 2) противодействует соответствующей способности разбавленного TIE-2 лиганда 1 активировать TIE-2 рецептор (TIE-2-R).
Эти данные указывают на то, что в отличие от TL1 TL2 не способны стимулировать TIE-2 рецептора киназную активность в НАЕС клетках. Более того, предварительное инкубирование эндотелиальных клеток с высокими концентрациями TL2 с последующим добавлением TL1 блокирует способность TL1 стимулировать TIE-2 рецептор, доказывая, что TL2 является антагонистом TIE-2 рецептора.
ПРИМЕР 10. Идентификация TIE-2 специфической связывающей активности в кодиционированной среде и надосадочных жидкостях COS клеток
Связывающую активность 10х ССМ из клеточных линий С2С12 ras, Rat2 ras. SHEP и T98G или надосадочных жидкостей COS клеток после трансфекции либо TIE-2 лигандом 1 человека (hTL1), либо TIE-2 лигандом 2 человека (hTL2) определяют с помощью биосенсорной технологии (BlAcore; Pharmacia Biosensor, Piscatway, NJ), которая регистрирует биомолекулярные взаимодействия в реальном времени за счет поверхностно плазменного резонанса (SPR). Очищенные ТIЕ-2 RB человека или крысы ковалентно соединяют за счет первичных аминов со слоем карбоксиметилдекстрана СМ5 сенсорного чипа исследовательской степени чистоты (Pharmacia Biosensor, Piscataway, NJ).
Поверхность сенсорного чипа активируют, используя смесь N-гидроксисукцинимида (NHS) и N-этил-N’-(3-диметиламино-пропил)карбодиимида (ЕДС), с последующей иммобилизацией TIE-2 RB (25 мкг/мл, рН 4,5) и дезактивацией непрореагировавших частей 1,0 М этаноламином (рН 8,5).
Обычно 9000-10000 RU каждого из рецепторных тел соединяется с сенсорным чипом.
В качестве проточного буфера в системе используют НВS (10 мМ Hepes, 150 мМ NaC1, 0,005% Р2O поверхностно-активный агент, рН 7,4). Образцы центрифугируют в течение 15 минут при 4°С, а затем очищают, используя стерильный 0,45 мкм фильтр, связывающий мало белка (Millipore; Bedford, MA). К каждому образцу добавляют декстран (2 мг/мл) и поверхностно-активный агент Р20 (0,005%). Аликвоты по 40 мл инъецируют через иммобилизованную поверхность (либо ТIЕ2 человека, либо крысы) при скорости потока 5 мкл/мин, и регистрируют связывание рецепторов в течение 8 минут. Связывающую активность (резонансные единицы, RU) определяют как разницу между базовой линией, определяемой за 30 секунд до инъецирования образца, и измеренным результатом, полученным через 30 сек после инъекции. Регенерацию поверхности осуществляют за счет одного 15 мкл ввода 3М МgСl2.
ССМ образцы (С2С12 ras, Rat2 ras, SHEP, T98G) тестируют на иммобилизованной поверхности Т1Е2 RB крысы, тогда как рекомбинантные hTL 1 и hTL 2 тестируют на иммобилизованной поверхности Т1Е2 RB человека. В каждом случае специфическое связывание с TIE-2 рецепторным телом оценивают за счет инкубирования образцов 25 мкг/мл либо растворимого TIE-2 (крысы или человека) RB, либо trkB RB перед оценкой связывающей активности. Как представлено на фиг.9 и 10, добавление растворимого trkB RB вызывает небольшое снижение TIE-2 связывающей активности, тогда как добавление растворимого TIE-2 RB значительно снижает связывающую активность по сравнению с результатами в отсутствие ТIЕ-2 RB.
ПРИМЕР 11. TIE-2 специфически блокирует активацию TIE-2 рецептора за счет TIE-2 лиганда 1
Заявители хотели определить, может ли растворимый ТIЕ-2 RB служить в качестве конкурирующего ингибитора при блокировании активации TIE-2 рецептора за счет TIE-2 лиганда 1 (TL1). Для осуществления этого ТL1-содержащую СОS среду предварительно инкубируют либо с TIE-2, либо с ТгВ-RВ, а затем сравнивают их способности активировать TIE-2 рецепторы, естественно присутствующие в эндотелиальной клеточной линии человека.
Кондиционированную СОS среду получают из COS клеток, трансфицированных либо pJFE14 вектором экспрессии одним (MOCK), либо рJFЕ14 вектором, содержащим кДНК TIE-2 лиганда 1 человека (TL1), и собирают, как показано в примере 9, за исключением того, что среду фильтруют в стерильных условиях, но не концентрируют. Количество TL 1 определяют и выражают как количество (в резонансных единицах, R.U.) TIE-2 рецептор-специфической связывающей активности, определенной в BlAcore анализе связывания.
Норзерн-блоттинг (РНК) выявляет значительные уровни TIE-2 трансскриптов в HUVEC (эндотелиальные клетки пупочной вены человека), первичных эндотелиальных клетках человека (Clonetics, Inc). Поэтому эти клетки используют для определения того, можно ли TIE-2 рецептор тирозин-фосфорилировать при экспонировании в присутствии TIE-2- или ТгкВ-RB в COS среде, содержащей ТL1. HUVEC клетки поддерживают при 37°С, 5% СО2 в полной среде для выращивания эндотелиальных клеток (Clonetics, Inc.), которая содержит 5% фетальной телячей сыворотки растворимый экстракт бычьего мозга с 10 мкг/мл гепарина, 10 нг/мл EGF человека, 1 мкг/мл гидрокортизона, 50 мкг/мл гентамицина и 50 нг/мл амфотерицина-В. Определение того, может ли TL1 активировать TIE-2 рецептор в HUV ЕС клетках, осуществляют следующим образом. Конфлюентные чашки HUV ЕС клеток подвергают голоданию по сыворотке в течение двух-четырех часов в Дюльбекко MEM с низким содержанием глюкозы при 37°С, 5% СO2, с последующим десятиминутным инкубированием в среде голодания, которая содержит 0,1 мМ ортованадата натрия, потенциального ингибитора фосфотирозинфосфатазы. Тем временем кондиционированную COS среду, предварительно инкубированную в течение 30 минут при комнатной температуре либо с TIE-2, либо TrkB-RB, добавляют до 50 мкг/мл. Среду для голодания удаляют из HUVEC чашек и инкубируют с RB-содержащей COS средой в течение 7 минут при 37°С. HUV EC клетки затем подвергают лизису, и протеин TIE-2 рецептора выделяют за счет иммуноосаждения TIE-2 пептидной антисывороткой, с последующим Вестерн-блоттингом с антифосфотирозиновым антителом, как раскрыто в примере 1. Полученные результаты представлены на фиг.11. Уровни фосфотирозина на TIE-2 рецепторе индуцируют за счет обработки HUVEC клеток TIE-2 лигандом 1 (TL1) относительно тех, которые наблюдаются для контрольной среды (MOCK), и это индуцирование специфически блокируют за счет предварительного инкубирования с TIE2-RB (TIE2-Fc), но не за счет инкубирования с TrkB-RB (TrkB-Fc). Эти данные показывают, что растворимые TIE-2 RB могут служить селективным ингибитором для блокирования активации ТIЕ-2 рецептора за счет TIE-2 лиганда 1.
ПРИМЕР 12. Конструирование TIE-2 лигандных тел
Экспрессионную конструкцию создают таким образом, чтобы обеспечить получение секретируемого протеина, состоящего из полной кодирующей последовательности TIE-2 лиганда 1 человека (TL 1) или TIE-2 лиганда 2 (Т L2), слитых с константным участком гамма-1 иммуноглобулина человека (IgG1 Fc). Эти протеины слияния называют TIE-2 "лигандные тела" (TL1- или TL2-). Fc часть TL1-Fc и TL2-Fc получают следующим образом. ДНК фрагмент, кодирующий Fc часть IgG1 человека, которая простирается от шарнирного участка до карбокси конца протеина, амплифицируют из кДНК плаценты человека в результате PCR с олигонуклеотидами, соответствующими опубликованной последовательности IgGI человека, полученный ДНК фрагмент клонируют в плазмидный вектор. Соответствующие ДНК рестрикционные фрагменты из плазмиды, кодирующей полноразмерный TL 1 или TL2 и из Fc плазмиды IgG1 человека, лигируют с каждой стороны короткого, полученного в PCR фрагмента, который был сконструирован таким образом, чтобы сливать, в рамке TL1 или TL2 с протеин кодирующей последовательности IgG1 Fc человека.
Миллиграмовые количества TL2-Fc получают в результате клонирования ДНК фрагмента TL2-Fc в pVL 1393-бакуловирусный вектор и последующего культивирования инфицированной клеточной линии насекомого Spodoptera Frugiperda SF-21AE. В другом варианте можно использовать клеточную линию SF-9 (АТСС регистрационный №CRL-1711), или клеточную линию BP1-TN-5b1-4. ДНК, кодирующую TL2-Fc, клонируют как EcoR1-Not1-фрагмент в бакуловирусную плазмиду переноса pVL 1393. Плазмидную ДНК рекомбинируют в вирусную ДНК за счет смешивания 3 мг плазмидной ДНК с 0,5 мг Baculo-Gold ДНК (Pharminigen), с последующим введением в липосомы с помощью 30 мг липофектина (GIBCO-BRL). ДНК-липосомные смеси добавляют к SF-21AE клеткам (2х 106 клеток) 60 мм чашку (в TMN-FH среде). Модифицированная среда для клеток насекомых Fraces (GIBCO-BRL)) в течение 5 часов при 27°С, с последующим инкубированием при 27°С в течение 5 дней в TMN-FH среде, дополненной 5% фетальной телячей сывороткой. Культуральную среду тканей собирают для очистки бляшек рекомбинантных вирусов, что осуществляют, используя описанные ранее способы (O’Reilly, D.R., L.K.Miller and V.A.Luckow, Baculovirus Expression Vectors - A Laboratory Manual. 1992, New York: W.H.Freeman), за исключением того, что агарозный поверхностный слой содержит 125 мг/мл X-gal (5-бром-4-хлор-3-индолил-b-D-галактопиранозид, GIBCO-BRL). После 5 дней инкубирования при 27°С подсчитывают нерекомбинантные бляшки по позитивной хромогенной реакции с X-gal субстратом, и отмечают их положения. Затем рекомбинантные бляшки визуализируют, добавляя дополнительно второй поверхностный слой, содержащий 100 мг/мл МТТ (3-/4,5-диметилтиазол-2-ил/-2,5-дифенилтетразолийбромид, Сигма).
Бляшки предполагаемых рекомбинантных вирусов отбирают, отсасывая, и очищают в многократных циклах выделения бляшек для обеспечения гомогенности. Запас вирусов создают в результате серии пассажей с низкой множественностью очищенного бляшками вируса. Получают запас с малым числом пассажей одного вирусного клона (vTL2-Fc клон №7).
F-21AE клетки культивируют в не содержащей сыворотки среде (SF-900 II, Gibco BRL), содержащей 1х антибиотик/антимикотиновый раствор (Gibco BRL) и 25 мг/л гентамицина (Gibco BRL). В качестве поверхностно-активного агента добавляют Pluronic F-68 до конечной концентрации 1 г/л. Культуры (4 л) выращивают в биореакторе (Artisan Cell Station System) в течение, по крайней мере, трех дней до инфицирования. Клетки выращивают при 27°С, газируя до 50% растворенным кислородом при скорости газового потока 80 мл/мин (аэрация по распыляющему кольцу). Перемешивание осуществляют турбинкой со скоростью 100 об/мин. Клетки собирают в средне-логарифмической фазе роста (примерно 2×106 клеток на мл), концентрируют центрифугированием и инфицируют 5 бляшкообразующими единицами vTL2-Fc на клетку. Клетки и инокулюм доводят до 400 мл, добавляя свежую среду, и вирус адсорбируют в течение 3 часов при 27°С в спиннере. Затем культуру снова суспендируют в конечном объеме 8 л свежей не содержащей сыворотки среды, и клетки инкубируют в биореакторе, используя описанные ранее условия.
Культуральную среду из vTL2-Fc инфицированных SF21AE клеток собирают за счет центрифугирования (500 о, 10 минут) на 72 ч после инфицирования. Надосадочную жидкость клеток доводят до рН 8 за счет NaOH. Добавляют ЕДТА до конечной концентрации 10 мМ и рН надосадочной жидкости доводят до 8. Надосадочную жидкость фильтруют (0,45 мм, Millipore) и вводят в колонку с протеином А (протеин А, сефароза 4, скорость потока или HiTrap протеина А, обе от Pharmacia). Колонку промывают PBS, содержащим 0,5 М NaCl до тех пор, пока поглощение на 280 нм не падает до базовой линии. Колонку промывают PBS и элюируют 0,5 М уксусной кислотой. Фракции из колонки немедленно нейтрализуют, элюируя в ампулы, содержащие 1 М Tris, рН 9. Пиковые фракции, содержащие TL2-FC собирают и диализуют против PBS.
Депозиты
Нижеследующие были депонированы в Американской Коллекции Типовых Культур, 12301 Parklawn Drive, Rockville, Maryland 20852 в соответствии с Будапештским соглашением. Плазмидный клон, кодирующий TIE-2 лиганд, был депонирован с АТСС 7 октября 1994г, и обозначен как "pJFE14 кодирующий TIE-2 лиганд" под АТСС регистрационный №75910. Рекомбинантный бакуловирус Autographa californica, кодирующий TIE-2 рецепторное тело, был депонирован с АТСС 7 октября 1994 г. и обозначен как "vTIE-2 рецепторное тело" под АТСС регистрационный №VR2484. Лямбда фаговый вектор, содержащий ДНК tie-2 лиганда человека был депонирован с АТСС 26 октября 1994 г. и обозначен как λfgt10, кодирующий tie-2 лиганд 1 под АТСС регистрационным №75928. Плазмидный клон, кодирующий второй TIE-2 лиганд, был депонирован с АТСС 9 декабря 1994 г. и обозначен как "pBluescript KS, кодирующий TIE-2 лиганд 2 человека" под АТСС регистрационным номером 75963.
Настоящее изобретение не ограничивается объемом раскрытых здесь специфических вариантов. Естественно, различные модификации изобретения в дополнение к раскрытым здесь, будут очевидны специалистам из предшествующего описания и сопровождающих рисунков. Такие модификации должны быть включены в объем прилагаемых пунктов формулы.









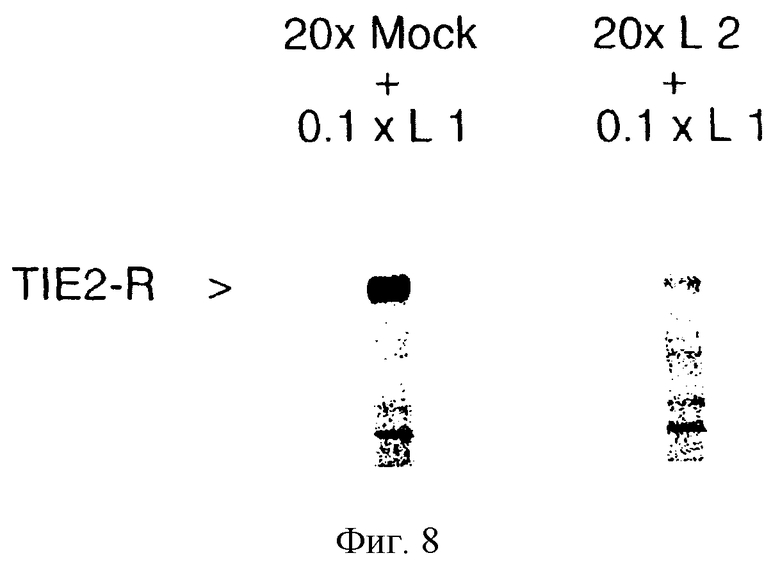
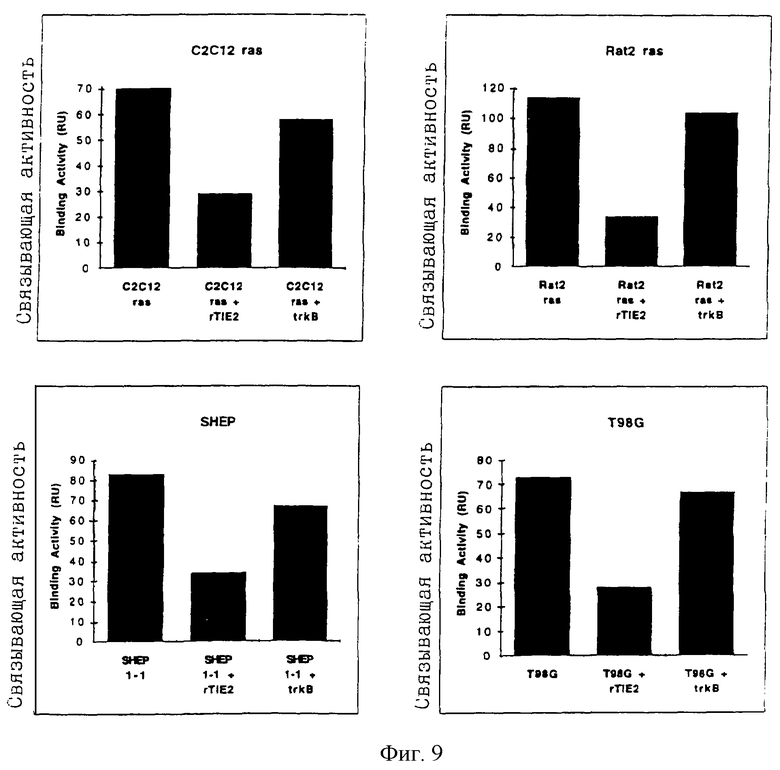


Изобретение относится к биотехнологии, в частности к генной инженерии, и может быть использовано для получения TIE-2 лиганда. TIE-2 лиганд получают путем культивирования клеток, трансформированных вектором, содержащим нуклеотидную последовательность, кодирующую TIE-2 лиганд. TIE-2 лиганд или лигандное тело, включающее дополнительно участок иммуноглобулина, в составе фармацевтической композиции используют для стимулирования неоваскуляризации у млекопитающего, а также для поддержания клетки, экспрессирующей TIE-2 рецептор. Антитело, специфически связывающееся с TIE-2 лигандом, получают путем иммунизации животного TIE-2 лигандом. Изобретение позволяет разрабатывать средства для диагностики и лечения заболеваний, затрагивающих эндотелиальные клетки. 12 н. и 7 з.п. ф-лы, 11 ил.

| Р.С.MAISONPIERRRE et al | |||
| Distinct rat genes with related profiles of expression define a TIE receptor tyrosine kinase family, ONCOGENE, 1993, v.8, по.6, p.1631-1637 | |||
| Экономайзер | 0 |
|
SU94A1 |
| T.N.SATO et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| PROCEEDINGS OF THE NATIONAL ACADEMY OF SCIENCES OF USA, 1993, v.90, p.9355-9358. | |||
Авторы
Даты
2004-07-20—Публикация
1995-10-06—Подача