Это частично продолжающаяся заявка U.S.Application, 08/209502, поданная 7 марта 1994 г., которая является частично продолжающейся заявкой U.S.Application 08/162 407, поданной 3 декабря 1993 г., которая является частично продолжающейся заявкой U.S.Application 08/111758, поданной 25 августа 1993 г. , которая является частично продолжающейся заявкой U. S.Application 08/106463, поданной 12 августа 1993 г., которая в свою очередь является частично продолжающейся заявкой U.S.Application 08/068394, поданной 24 мая 1993 г., рассмотрение которой прекращено.
Область изобретения
Данное изобретение относится к flt 3-лигандам млекопитающих, нуклеиновым кислотам, кодирующим такие лиганды, способам получения рекомбинатных flt 3-лигандов, фармацевтическим композициям, содержащим такие лиганды, и их применению в различных терапиях.
Предпосылки изобретения
Клетки крови, гемоциты, происходят из гемопоэтических стволовых клеток, дифференцирующихся в определенных направлениях дифференцировки, т. е. в эритроидном, мегакариоцитарном, гранулоцитарном, моноцитарном и лимфоцитарном направлениях дифференцировки. Цитокины, стимулирующие пролиферацию и созревание клеток-предшественников, называют колониестимулирующими факторами ("CSF"). Некоторые CSF продуцируются Т-лимфоцитами, в том числе интерлейкин-3 ("1L-3"), гранулоцитарно-моноцитарный CSF (CM-CSF), гранулоцитарный СSF (G-CSF) и моноцитарный CSF (М-CSF). Эти CSF воздействуют как на зрелые клетки, так и на стволовые клетки. До сих пор не были обнаружены факторы, способные действовать преимущественно на стволовые клетки.
Тирозинкиназные рецепторы ("ТКR") представляют собой рецепторы факторов роста, которые регулируют пролиферацию и дифференцировку многих клеток (Yarden, Y.8.Ulrich, A.Annu. Rev. Biochem 57, 443-478, 1988, и Cadena, D.L.& Gill, G. N. FASEB J. , 6, 2332-2337, 1992). Некоторые ТКР действуют внутри гемопоэтической (кроветворной) системы. Например, передача сигнала через колониестимулирующий фактор 1 ("CSF-1"), рецептор c-fms регулирует выживание, рост и дифференцировку моноцитов (Stanley et al., J. Cell Biochem, 21, 151-159, 1983). Фактор стила SF, также известный как фактор роста мастоцитов, фактор самоподдержания стволовых клеток или kit-лиганд, действующий через-kit, стимулирует пролиферацию клеток как в миелоидном, так и в лимфоидном компартментах.
flt 3 (Rosnet et аl., Оnсоgеnе, 6, 1641-1650, 1991) и flk-2 (Mathhews et al. , Cell, 65, 1143-1152, 1991) являются разновидностями ТКР, который относится к c-fms и с-kit рецепторам. Продукт гена flk-2 экспрессируется на гемопоэтических и недифференцированных клетках (клетках-предшественниках), тогда как продукт гена flt 3 имеет более общее тканевое распространение. Белки рецепторов flt 3 и flk-2 сходны по аминокислотной последовательности и отличаются по двум аминокислотным остаткам во внеклеточном домене и различаются в сегменте из 31 аминокислоты, расположенном вблизи С-концов (Lyman et al., Oncogene, 8, 815-822, 1993).
Было обнаружено, что flt 3-лиганд ("flt 3-L") регулирует рост и дифференцировку клеток-предшественников и стволовых клеток и, по-видимому, полезен в клинике в лечении нарушений кроветворения, в частности гипопластической (апластической) анемии и миелодиспластических синдромов. Кроме того, flt 3-L должен быть полезным в аллогенных, сингенных или аутогенных трансплантантах костного мозга у больных, подвергающихся цитовосстановительной терапии, а также в развитии клеток.
Flt 3-L будет также полезным в генной терапии и в системах мобилизации клеток-предшественников и стволовых клеток.
Рак лечат при помощи цитовосстановительной терапии, предусматривающей применение ионизирующей радиации или введение химических токсинов, убивающих быстро делящиеся клетки. Побочные действия обычно возникают вследствие цитотоксического действия на нормальные клетки и они могут ограничивать применение цитовосстановительных терапий. Частым побочным эффектом является миелосупрессия, или повреждение клеток костного мозга, увеличивающих количество лейкоцитов, эритроцитов и тромбоцитов. В результате миелосупрессии больные развивают цитопению или недостаток клеток крови, что увеличивает опасность инфекции и нарушения, связанные с кровотечением.
Цитопении увеличивают болезненность, смертность и ведут к заниженным дозам в лечении рака. Многие клинические исследователи манипулировали цитовосстановительной терапией, дозируя лекарственные средства и изменяя схемы применения лекарственных средств для увеличения дозирования для раковой терапии при одновременном ограничении повреждения костного мозга. Один из подходов использует трансплантанты костного мозга или клеток периферической крови, при которых костный мозг или циркулирующие гемопоэтические клетки-предшественники или стволовые клетки удаляют перед цитовосстановительной терапией и затем повторно вводят инфузией после терапии для восстановления гемопоэтической функции. U.S.Patent 5199942, включенный здесь в виде ссылки, описывает способ применения GM-CSF, 1L-3, SF, GM-CSF/1L-3-слитых белков, эритропоэтина ("ЕРО") и их комбинаций в аутогенных трансплантационных программах лечения.
Химиотерапия с высокими дозами терапевтически выгодна, поскольку она дает увеличенную частоту целевой ответной реакции у больных с метастатическим раком, в частности с раком грудной железы, по сравнению с терапией со стандартными дозами. Это может приводить к более продолжительной ремиссии с отсутствием признаков болезни для некоторых больных, даже с плохим прогнозом. Тем не менее химиотерапия высоких доз токсична и может приводить ко многим клиническим осложнениям, таким как инфекции, нарушения с кровотечением и другие эффекты, связанные с пролонгированными периодами миелосупрессии.
Миелодиспластические синдромы представляют собой нарушения стволовых клеток, характеризующиеся нарушенным созреванием клеток, прогрессивной панцитопенией и функциональными отклонениями от нормы зрелых клеток. Они также характеризуются вариабельными степенями цитопении, неэффективным эритропоэзом и миелопоэзом с клетками костного мозга, которые являются нормальными или увеличенными в числе и имеют необычную морфологию. Benet et al. (Вr.J. Haematol 1982; 51: 180-199) разделили эти нарушения на 5 подтипов: рефрактерная (стойкая) анемия, рефрактерная анемия с кольцеобразными сидеробластами, рефрактерная анемия с избытком бластных клеток, рефрактерная анемия с избытком бластных клеток в процессе перерождения и хронический миеломоноцитарный лейкоз. Хотя значительный процент этих больных развивает острый лейкоз, большинство из них умирают от инфекционных или геморрагических осложнений. Лечение этих синдромов ретиноидами, витамином и цитарабином не было успешным. Большинство больных, страдающих от этих синдромов, являются пожилыми и не являются возможными кандидатами для пересадки костного мозга или агрессивной противолейкозной химиотерапии.
Апластическая анемия представляет собой другую форму заболевания, характеризующегося нарушением костного мозга и тяжелой панцитопенией. В отличие от миелодиспластического синдрома при этом нарушении костный мозг не содержит клеток или содержит мало клеток. Существующие способы лечения предусматривают пересадку костного мозга из тканесовместимого донора или иммуносупрессивное лечение противотимоцитным глобулином (ATG). Так же, как и в случае миелодиспластического синдрома, большинство больных, страдающих от этого синдрома, являются пожилыми и для них неприемлемы пересадка костного мозга или агрессивная противолейкозная химиотерапия. У этих больных чрезвычайно высока смертность от инфекционных и геморрагических осложнений.
Анемия обычно бывает у больных с синдромом приобретенного иммунодефицита (СПИД). Эта анемия обычно является более тяжелой у больных, подвергающихся лечению зидовудином. Многие важные ретровирусные агенты, противоинфекционные и противоопухолевые средства подавляют эритропоэз. Было показано, что рекомбинантный ЕРО нормализует гематокритное число и уровни гемоглобина, однако, обычно для этого требуются очень высокие дозы. Фактор роста, стимулирующий пролиферацию при эритроидном направлении дифференцировки, мог бы быть использован один или в комбинации с ЕРО или другими факторами роста для лечения таких больных и снижения количества требуемых переливаний крови. Фактор роста, который мог бы также увеличивать количество Т-клеток, нашел бы конкретное применение в лечении больных СПИД.
Краткое изложение существа изобретения
Данное изобретение относится к биологически активному flt 3-лиганду (flt 3-L) в виде выделенного или гомогенного белка. Кроме того, изобретение относится к выделенным ДНК, кодирующим flt 3-L и к экспрессирующим векторам, содержащим кДНК, кодирующую flt 3-L. Внутри сферы этого изобретения находятся клетки-хозяева, которые были трансфицированы или трансформированы экспрессирующими векторами, содержащими кДНК, кодирующую flt 3-L, и способы получения flt 3-L путем культивирования таких клеток-хозяев при условиях, способствующих экспрессии flt 3-L.
Flt 3-L можно применять для приготовления фрмацевтических композиций для применения в способах аллогенной, сингенной и аутогенной трансплантации. Фармацевтические композиции могут содержать только flt 3-L или flt 3-L в комбинации с другими факторами роста, такими как интерлейкины, колониестимулирующие факторы, протеинтирозинкиназы и цитокины.
Это изобретение включает в себя способы применения композиций flt 3-L в генной терапии и в лечении больных, страдающих от миелодиспластического синдрома, апластической анемии, инфекции ВИЧ (СПИД) и раковых заболеваний, таких как рак молочной железы, лимфома, мелкоклеточный рак легкого, множественная миелома (болезнь Калера), нейробластома, острый лейкоз, тестикулярные опухоли и рак яичников.
Данное изобретение относится также к антителам, в частности моноклональным антителам, иммунореактивным с flt-3-L. Слитые белки, содержащие растворимую часть flt 3-L и константный домен иммуноглобулина, также включены в это изобретение.
Данное изобретение также направлено на применение flt 3-L в способах трансплантации клеток-предшественников периферической крови или стволовых клеток. В типичном случае клетки-предшественники периферической крови или стволовые клетки удаляют из больного перед миелосупрессивной цитовосстановительной тепарией и затем вновь вводят больному совместно с цитовосстановительной терапией или после нее для нейтрализации миелосупрессивных эффектов такой терапии. Данное изобретение обеспечивает применение эффективного количества flt 3-L по меньшей мере одним из следующих способов:
(i) flt 3-L вводят больному перед сбором клеток-предшественников или стволовых клеток для увеличения или мобилизации количества таких циркулярующих в кровотоке клеток;
(ii) после сбора клеток-предшественников или стволовых клеток больного, flt 3-L используют для увеличения в объеме таких клеток ex vivo и
(iii) flt 3-L вводят больному после трансплантации собранных клеток-предшественников или стволовых клеток для облегчения и приживления. Способ трансплантации этого изобретения может дополнительно предусматривать применение эффективного количества цитокина в последовательной или конкуретной комбинации с flt-3-L. Такие цитокины включают, но не ограничены ими, интерлейкины ("1L") 1L-1, 1L-2, 1L-3, 1L-4, 1L-5, 1L-6, 1L-7, 1L-8, 1L-9, 1L-10, 1L-11, 1L-12, 1L-13, 1L-14 или 1L-15, СSF, выбранный из группы, состоящей из G-CSF, GM-СSF, М-СSF или GM-CSF/1L-3-слитые белки, или другие факторы роста, такие как СSF-1, SF, ЕРО, ингибирующий лейкоз фактор ("1 1F") или фактор роста фибробластов ("FGF"). Flt 3-L также применим таким же образом для сингенной или аллогенной трансплантации.
Изобретение включает в себя далее среды для роста клеток-предшественников и стволовых клеток, содержащие среды для роста клеток, аутологичную сыворотку и flt 3-L один или в комбинации с цитокином из перечисленной выше группы.
Кроме того, изобретение предусматривает применение flt 3-L для увеличения в объеме клеток-предшественников или стволовых клеток, собранных из крови пупочной вены. Это растяжение клеток можно проводить с одним flt 3-L или в последовательной или конкурентной комбинации его с цитокином из описанной выше группы.
Кроме того, изобретение предусматрвиает применение flt 3-L в генной терапии. Flt 3-L делает возможными пролиферацию и культивирование ранних (недифференцированных) гемопоэтических клеток-предшественников или стволовых клеток, которые должны быть трансфицированы экзогенной ДНК для использования в генной терапии. Альтернативно кДНК, кодирующая flt 3-L, может быть трансфицирована в клетки, чтобы в конечном счете доставить продукт ее гена в клетке- или ткани-мишени.
Кроме того, изобретение предусматривает применение flt 3-L для стимуляции образования эритроидных клеток in vivo для лечения анемии. Такое применение предусматривает введение flt 3-L больному, нуждающемуся в таком стимулировании эритроидных клеток, в сочетании с цитовосстановительной терапией или после нее. Это лечение может предусматривать одновременное введение другого фактора роста, выбранного из цитокинов из перечисленной выше группы. Предпочтительными цитокинами для применения в этом лечении являются ЕРО, 1L-3, G-CSF и GM-CSF. Такое лечение, в частности, применимо для больных СПИД, в частности для больных СПИД, получающих лечение АZТ (азидодезокситимидином).
Поскольку flt 3-L стимулирует образование стволовых клеток, flt 3-L данного изобретения может влиять на другие не-гемопоэтические стволовые клетки, несущие рецепторы flt-3. Flt 3-L применим в способах оплодотворения in vitro и может быть применен in vivo в лечении бесплодия. В кишечнике flt 3-лиганд применим в лечении повреждения кишечника, вызываемого облучением или химиотерапией. Flt 3-L можно также применять для лечения больных, инфицированных вирусом иммунодефицита человека (H1V, ВИЧ). Такое лечение предусматривает введение flt 3-L для стимуляции in vivo образования, а также увеличения в объеме ex vivo Т-клеток и эритроидных клеток. Такое лечение может предотвратить недостаточность Т-клеток, в частности СD 4-положительных Т-клеток, и может повышать иммунный ответ больного против этого вируса, улучшая тем самым качество жизни больного. Flt 3-L можно применять для стимуляции стволовых клеток, что приводит к развитию волосяных фолликулов, усиливая рост волос.
Кроме того, flt 3-L может быть связан с твердофазным матриксом и использован для аффинной очистки или отделения клеток, экспрессирующих flt 3 на их поверхности. Изобретение предусматривает отделение клеток, имеющих flt 3-рецептор на их поверхности, от смеси клеток в растворе посредством контактирования этих клеток в смеси с поверхностью для контакта, имеющей на ней flt 3-связывающие молекулы, и отделения этой поверхности и раствора. После отделения эти клетки могут выращиваться ex vivo с применением flt 3-L и вводиться больному.
Подробное описание изобретения
Кодирующая мышиный flt 3-L кДНК была выделена и была описана в SEQ ID 1. Кодирующая человеческий flt 3-L кДНК была выделена и описана в SEQ ID 5. Это раскрытие кДНК, кодирующих мышиный и человеческий flt 3-L, делает возможным конструирование экспрессирующих векторов, содержащих кДНК, кодирующих flt 3-L; клеток-хозяев, трансфицированных или трансформированных этими экспрессирующими векторами; получение биологически активных мышиных и человеческих flt 3-L в виде гомогенных белков; антител, иммунореактивных с мышиным и человеческим flt 3-L.
Flt 3-L применим в усилении, стимуляции пролиферации или роста клеток, экспрессирующих flt 3-рецептор, в том числе клеток, не являющихся гомопоэтическими. Поскольку flt 3-рецептор обнаружен в мозгу, плаценте и тканях, происходящих из нервной системы, или тканях гемопоэтического происхождения и распределен в яичниках, яичниках, лимфатических узлах, селезенке, вилочковой железе и печени эмбриона, возможно лечение множества состояний, ассоциированных с повреждениями их тканей. Конкретные применения flt 3-L описаны ниже, хотя изобретение и не ограничивается только ими.
В применении здесь термин "flt 3-L" относится к роду полипетидов, которые связываются и образуют комплекс независимо с рецептором flt 3, обнаруженным на клетках-предшественниках (недифференцированных клетках) и стволовых клетках. Термин "flt 3-L" включает в себя белки, имеющие аминокислотную последовательность 1-231 SEQ ID 2: или аминокислотную последовательность 1-235 SEQ ID :6, а также те белки, которые имеют высокую степень сходства или высокую степень идентичности с аминокислотной последовательностью 1-231 SEQ ID :2 или с аминокислотной последовательностью 1-235 SЕQ ID :6 и являются биологически активными и связывают рецептор flt 3. Кроме того, этот термин относится к биологически активным генным продуктам ДНК SEQ ID :1 или SEQ ID : 5. Кроме того, термин "flt 3-L" относится к мембранно-связанным белкам (которые включают в себя внеклеточный район, мембранный район и внутриклеточный район) и растворимым или укороченным белкам, которые содержат исходно внеклеточную часть такого белка, сохраняют биологическую активность и способны секретироваться. Характерными примерами таких растворимых белков являются белки, содержащие последовательность аминокислот 28-163 SEQ ID :2 и последовательность аминокислот 28-160 SEQ ID :6.
Термин "биологически активный" по отношению к flt 3-L означает, что flt 3-L способен связываться с flt 3. Альтернативно термин "биологически активный" означает flt 3-L, который способен к трансдукции стимулирующего сигнала к клетке через мембранно-связанный flt 3.
"Выделенный" означает, что flt 3-L не связан с другими белками или полипептидами, например, в виде очищенного продукта культуры рекомбинантной клетки-хозяина или в виде очищенного экстракта.
В применении здесь "flt 3-L-разновидность" означает полипептид, по существу гомологичный нативному flt 3-L, но имеющий аминокислотную последовательность, отличающуюся от последовательности нативного flt 3-L (человека, мыши или других видов млекопитающих) вследствие одной или нескольких делеций, инсерций или замещений. Такая вариантная аминокислотная последовательность предпочтительно по меньшей мере на 80% идентична аминокислотной последовательности нативного flt 3-L, наиболее предпочтительно идентична по меньшей мере на 90%. Процент идентичности может быть, например, определен путем сравнения информации последовательности с применением компьютерной программы GАР, версия 6,0, описанной Devereux et al. (Nucl. Acids. Res. 12: 387, 1984) и доступна из University of Wisconsin Genetics Computer Group (UWGСG).
Программа GAP использует способ сравнительного анализа первичной структуры Nееdleman and Wunsch (J. Mol. Biol. 48:443, 1970), переработанный Smith and Waterman (Adv. Appl. Math. 2:482, 1981). Предпочтительными параметрами "по умолчанию" для программы GАР являются:
(1) унарная матрица сравнения (содержащая величину 1 для идентичностей и О для отрицания идентичности) для нуклеотидов и матрица сравнения веса Gribskov and Burgess, Nucl. Acids. Res. 14:6745, 1986, как описано Schartz and Dayhoff, eds., Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, pp.353-358, 1979;
(2) наказание 3,0 для каждого пропуска и дополнительное наказание 0,10 за каждый символ в каждом пропуске и
(3) отсутствие наказания за концевые пропуски. Разновидности могут содержать консервативно замещенные последовательности, т.е. данный аминокислотный остаток заменен остатком, имеющим сходные физико-химические свойства. Примерами консервативных замещений являются замена одного алифатического остатка на другой, например замены 1le, Val, Leu или Аlа друг на друга, или замены одного полярного остатка другим, например замены между LyS и Arg; Glu и Asp или Gln и Asn. Другие такие консервативные замещения, например замены целых районов, имеющих сходные характеристики гидрофобности, хорошо известны. Природно встречающиеся разновидности flt 3-L также включены в это изобретение. Примерами таких разновидностей являются белки, происходящие из событий перемещающегося сплайсинга мРНК или из протеолитического расщепления белка flt 3-L, при которых сохраняется связывающая способность fLt 3-L. Перемежающийся сплайсинг мРНК может давать укороченный, но биологически активный белок flt 3-L, такой как природно встречающаяся растворимая форма этого белка, например. Вариации, приписываемые протеолизу, включают, например, разилчия в N- или С-концах при экспрессии в разных типах клеток-хозяев, вызываемые протеолитическим удалением одной или нескольких концевых аминокислот из белка flt 3-L (в основном из 1-5 концевых аминокислот).
Термин "аутологичная или аутогенная трансплантация" описан в U.S.Patent 5199242, включенном здесь в виде ссылки. Вкратце, термин означает способ проведения трансплантации гемопоэтических аутогенных клеток-предшественников или стволовых клеток, предусматривающий:
(1) сбор гемопоэтических клеток-предшественников или стволовых клеток из больного перед цитовосстановительной терапией;
(2) увеличение в объеме (развитие) этих недифференцированных гемопоэтических клеток или стволовых клеток ex vivo с flt 3-L для обеспечения клеточного препарата, содержащего увеличенные количества гемопоэтических клеток-предшественников или стволовых клеток, и
(3) введение этого клеточного препарата больному вместе с цитовосстановительной терапией или после нее. Клетки-предшественники и стволовые клетки могут быть получены из собранной периферической крови или эксплантатов костного мозга. Иногда один или более цитокинов, выбранных из описанной выше группы, могут комбинироваться с flt 3-L для содействия пролиферации определенных типов гемопоэтических клеток или для воздействия на клеточную функцию полученной размноженной популяции гемопоэтических клеток. Из описанных выше предпочтительны SF, 1L-1, 1L-3, ЕРО, G-CSF, GM-CSF и GM-CSF/1L-3-слитые белки, а особенно предпочтительны G-CSF, GM-CSF и GM-CSF/1L-3-слитые белки. Термин "аллогенная трансплантация" означает способ, в котором клетки костного мозга или клетки-предшественники периферической крови или стволовые клетки удаляют из млекопитающего и вводят другому млекопитающему того же самого вида. Термин "сингенная трансплантация" означает трансплантацию костного мозга генетически идентичными млекопитающими.
Описанный выше способ трансплантации данного изобретения предусматривает предварительную процедуру in vivo, включающую введение flt 3-L одного или в последовательной или в совместной комбинации с пополняющим фактором роста больному для пополнения гемопоэтических клеток в периферической крови перед их сбором. Пригодные пополняющие количество гемопоэтических клеток факторы перечислены выше и предпочтительными из них являются flt 3-L, SF, 1L-1 и 1L-3.
Описанный выше способ данного изобретения иногда включает в себя процедуру, предусматривающую введение 3-1 одного или в последовательной или совместной комбинации с приживляющим фактором роста больному после трансплантации клеточного препарата для облегчения приживления и усиления пролиферации приживленных гемопоэтических клеток-предшественников или стволовых клеток из клеточного препарата. Пригодные способствующие приживлению факторы перечислены выше и предпочтительными из них являются GМ-СSF, G-CSF, 1L-3, 1L-1, EPO и слитые GM-CSF/1L-3.
Изобретение включает в себя далее среды для выращивания клеток-предшественников или стволовых клеток, содержащие среды для выращивания клеток, аутологичную сыворотку и flt 3-L один или в комбинации с цитокиновым фактором роста из перечисленных выше цитокинов. Предпочтительными факторами роста являются SF, GM-CSF, 1L-3, 1L-1, G-CSF, EPO и слитые белки GM-СSF/1L-3.
В частности, flt 3-L можно применять для стимуляции пролиферации гемопоэтических и не-гемопоэтических стволовых клеток. Такая стимуляция выгодна, когда происходит повреждение специфической ткани. Как таковой flt 3-L можно применять в лечении нейрологического повреждения и он может быть фактором роста для нервных клеток. Вероятно, flt 3-L можно было бы применять в способах оплодотворения in vitro и в лечении in vivo состояний бесплодия. Flt 3-L мог бы быть полезным в лечении кишечного повреждения, вызываемого облучением или химиотерапией. Поскольку рецептор flt 3 присутствует на стволовых клетках, ведущих к развитию волосяных фолликулов, flt 3-L, вероятно, можно было бы применять для усиления роста волос.
Поскольку показано, что flt 3-L стимулирует пролиферацию Т-клеток, а также эритроцитов (см. Примеры, infra), flt 3-L находит применение в лечении больных, инфицированных вирусом иммунодефицита человека (H1V, ВИЧ). Такое лечение должно включать введение flt 3-L для стимуляции образования in vivo, а также ex vivo размножения Т-клеток. Кроме того, flt 3-L может предотвращать недостаточность СD 4+T-клeтoк. Такое лечение может увеличивать или поддерживать иммунную ответную реакцию больного против этого вируса, улучшая тем самым или поддерживая качество жизни больного. Кроме того, такое лечение in vivo стимулировало бы клетки эритроидного направления дифференцировки, улучшая гематокритное число и уровни гемоглобина. Flt 3-L можно вводить в этом случае один или в последовательной или одновременной комбинации с цитокинами, выбранными из описанной группы.
Flt 3-L применим в генной терапии благодаря его специфичности для клеток-предшественников и стволовых клеток. Генная терапия предусматривает введение трансфицированных экзогенной ДНК клеток хозяину, которым дают прижиться в нем. См. , например, Boggs, International J. Cell Cloning, 8:80-96 (1990); Kohn et al. , Cancer Invest. , 7(2): 179-192; Lehn, Bоnе Marrow Тrarspl. 5: 287-293 (1990); Verma, Scientific American, pp.68-84 (1990). С применением способов генной терапии, известных в этой области, способ переноса гена млекопитающему предусматривает стадии:
(а) культивирования ранних гемопоэтических клеток в средах, содержащих один flt 3-L или в последовательной или одновременной комбинации с цитокином, выбранным из описанной выше группы;
(b) трансфекции культивируемых клеток стадии (а) экзогенным геном и
(с) введение трансфицированных клеток млекопитающему. В рамках этого способа находится новый способ трансфекции клеток-предшественников или стволовых клеток геном, предусматривающий описанные стадии (а) и (b). Кроме того, при помощи тех же или сходных способов кДНК, кодирующая flt 3-L, может быть трансфицирована в такие доставляющие клетки для доставки продукта гена flt 3-L к тканям-мишеням.
Пример 1 описывает конструирование нового слитого белка flt 3:Fс, применимого в скрининге на flt 3-L. Другие Fс районы антитела могут быть заменены на Fс район человеческого IgGl, описанный в Примере 1. Другими подходящими Рс районами являются те, которые могут связываться с высокой аффинностью с белком А или белком G и включают в себя Fс район человеческого IgGl или фрагменты Fс района и человеческого или мышиного IgGl, например фрагменты, содержащие по меньшей мере шарнирную область, так что будут образовываться межцепочечные дисульфидные связи. Слитый белок flt 3:Fc имеет преимущество, заключающееся в том, что его легко очистить. Кроме того, дисульфидные связи образуются между Fс районами двух отдельных цепей слитого белка, создавая димеры. Димерный рецептор flt 3:Fс был выбран для потенциального преимущества высокоаффинного связывания flt 3-L ввиду возможности того, что этот лиганд мог бы быть мультимерным.
Как описано supra, аспектом этого изобретения являются растворимые полипептиды flt 3-L. Растворимые полипептиды flt 3-1 содержат весь внеклеточный домен или его часть нативного flt 3-L, но не содержат трансмембранного района, который удерживал бы этот полипептид на клеточной мембране. Преимуществом растворимых полипептидов flt 3-L является то, что они содержат нативный (или гетерологичный) сигнальный пептид, который синтезируется первоначально для усиления секреции, но этот сигнальный пептид отщепляется при секреции flt 3-L из клетки. Растворимые полипептиды flt 3-L, включенные в это изобретение, сохраняют способность связывать рецептор flt 3. В самом деле растворимый flt 3-L может содержать также часть трансмембранного района или часть цитоплазметического домена или другие последовательности при условии, что растворимый белок flt 3-L может секретироваться.
Растворимый flt 3-L может быть идентифицирован (и его можно отличить от его мембранно-связанных копий) путем определения интактных клеток, экспрессирующих этот целевой белок, от культуральной среды, например, центрифугированием и анализом этой среды (супернатанта) на присутствие целевого белка. Присутствие flt 3-L в среде свидетельствует о том, что этот белок секретировался из клеток и, следовательно, представляет собой растворимую форму целевого белка.
Растворимые формы flt 3-L обладают многими преимуществами по сравнению с нативным связанным белком flt 3-L. Возможна очистка таких белков из рекомбинантных клеток-хозяев, т.к. растворимые белки секретируются из этих клеток. Кроме того, растворимые белки обычно более пригодны для внутривенного введения.
Примерами растворимых полипептидов flt 3-L являются полипептиды, содержащие значительную часть внеклеточного домена нативного белка flt 3-L. Такие растворимые белки flt 3-L млекопитающих содержат аминокислоты 28-188 SEQ ID :2 или аминокислоты 28-182 SEQ ID :6. Кроме того, в изобретение также включены укороченные растворимые белки flt 3-L, содержащие неполный внеклеточный домен. Такие укороченные ратворимые белки последовательностью аминокислот 28-163 SEQ ID : 2 и аминокислотами 28-160 SEQ ID :6. При первоначальной экспрессии внутри клетки-хозяина растворимый flt 3-L может дополнительно содержать один из гетерологичных сигнальных пептидов, описанных ниже, который функционален в клетках-хозяевах. Альтернативно белок может содержать нативный сигнальный пептид, так что flt 3-L млекопитающего содержит аминокислоты 1-188 SEQ ID :2 или аминокислоты 1-182 SEQ ID :6. В одном варианте изобретения растворимый flt 3-L экспрессировался в виде слитого белка, содержащего (от N- к С-концу) сигнальный пептид α-фактора дрожжей, FLAG® пептид, описанный ниже и в U.S.Patent 5011912, и растворимый flt 3-L, состоящий из аминокислот 28-188 SЕQ ID :2. Этот рекомбинатный слитый белок экспрессируется в дрожжевых клетках и секретируется на них. FLAG® пептид облегчает очистку этого белка и затем может быть отщеплен от растворимого flt 3-L при помощи энтерокиназы бычьей слизистой оболочки. Выделенные последовательности ДНК, кодирующие растворимые белки flt 3-L, включены в данное изобретение.
Укороченный flt 3-L, в том числе растворимые полипептиды, могут быть получены любым из многих стандартных способов. Целевая последовательность ДНК может быть химически синтезирована при помощи известных реr se способов. Фрагменты ДНК также могут быть получены расщеплением рестриктазами полноразмерной последовательности клонированной ДНК и выделены электрофорезом на агарозных гелях. Могут быть применены линкеры, содержащие сайт (сайты) расщепления рестриктаз, для инсерции целевого фрагмента ДНК в экспрессирующий вектор или фрагмент может быть расщеплен в сайтах расщепления, природно присутствующих в нем. Для амплификации последовательности ДНК, кодирующей целевой белковый фрагмент, может быть также применена хорошо известная процедура полимеразной цепной реакции. В качестве дальнейшей альтернативы известные способы мутагенеза могут быть также использованы для инсерции стоп-кодона в желаемой точке, например непосредственно справа (в направлении 5'-3') от кодона для последней аминокислоты внеклеточного домена.
В другом подходе может быть применена ферментативная обработка (например, экзонуклеазой Bal31) для делении концевых нуклеотидов из фрагмента ДНК для получения фрагмента, имеющего определенный целевой конец. Среди коммерчески доступных линкеров находятся линкеры, которые могут быть лигированы с тупыми концами, образуемыми при расщеплении Bal31, и которые содержат сайт (сайты) расщепления рестриктазами. Альтернативно олигонуклеотиды, реконструирующие N- или С-конец фрагмента ДНК до желаемой точки, могут быть синтезированы и лигированы с этим фрагментом ДНК. Синтезированный олигонуклеотид может содержать сайт расщепления рестриктазой слева (в направлении 3'-5') от желаемой кодирующей последовательности и положения инициирующего кодона (ATG) при N-конце кодирующей последовательности.
Как утверждалось выше, это изобретение обеспечивает выделенные или гомогенные полипептиды 3-1, как рекомбинантные, так и нерекомбинантные. Разновидности и производные нативных 3-1 белков, сохраняющие желаемую биологическую активность (например, способность связывать flt 3), могут быть получены при помощи мутаций нуклеотидных последовательностей, кодирующих нативные flt 3-L полипептиды. Изменения нативной аминокислотной последовательности могут быть достигнуты любым из ряда стандартных способов. Мутации могут быть введены при определенных локусах путем синтеза олигонуклеотидов, содержащих мутантную последовательность, фланкированную сайтами рестрикции, позволяющими лигирование с фрагментами нативной последовательности. После лигирования полученная реконструированная последовательность кодирует аналог, имеющий целевые инсерцию аминокислот, замену или делецию.
Альтернативно способы олигонуклеотид-направленного сайт-специфического мутагенеза могут быть использованы для обеспечения измененного гена, в котором заданные кодоны могут быть изменены посредством замены, делеции или инсерции. Примеры способов обеспечения таких изменений, изложенных выше, описаны Walder et al. (Gene 42:133, 1986); Bauer et al. (Gene 37:73, 1985); Craik (BioTechniques, January 1985, 12-19); Smith et al. (Genetic Engineering: Principles and Methods, Plenum Press 1981); Kunkel (Proc. Natl. Acad. Sci. USA 82:488, 1985); Kunkel et al. (Methods in Enzymol. 154:367, 1987) и U.S.Patent 4518584 и 4737462, включенных здесь в виде ссылок.
Flt 3-L может быть модифицирован для получения производных flt 3-L путем образования ковалентных или агрегатных конъюгатов с другими химическими частями молекул, такими как гликозильные группы, липиды, фосфатные, ацетильные группы и т.п. Ковалентные производные flt 3-L могут быть получены соединением этих химических частей молекул с функциональными группами на боковых аминокислотных цепях flt 3-L или при N-конце или С-конце полипептида flt-3-L или его внеклеточного домена. Другие производные flt 3-L в сфере действия этого изобретения включают ковалентные или агрегатные конъюгаты flt 3-L или его фрагментов с другими белками или полипептидами, например, при помощи синтеза в рекомбинантной культуре в виде N-концевых или С-концевых слитых белков. Например, такой конъюгат может содержать последовательность сигнального или лидерного полипептида (например, лидерную последовательность α-фактора Saccharomyces) при N-конце полипептида flt 3-L. Сигнальный или лидерный пептид ко-трансляционно или пост-трансляционно направляет транспорт конъюгата из места его синтеза к месту внутри или снаружи клеточной мембраны или клеточной стенки.
Слитые flt 3-L полипептиды могут содержать пептиды, добавленные для облегчения очистки и идентификации flt 3-L. Такие пептиды включают, например, поли-Нis или антигенные идентификационные пептиды, описанные в U.S.Раtеnt 5011912 и в Норр et al., Bio/Tесhnology 6:1204, 1988.
Кроме того, изобретение включает в себя flt 3-L полипептиды с ассоциированным природным распределением гликозилирования или без него. Flt 3-L, экспрессируемыe в дрожжевых системах экспрессии или в системах экспрессии млекопитающих (например, в СOS-7 клетках), могут быть подобными нативному полипептиду flt 3-L или значительно отличаться от него по мол. массе и распределению гликозилирования в зависимости от выбора системы экспрессии. Экспрессия flt 3-L полипептидов в бактериальных системах экспрессии, таких как Е.соli, обеспечивает негликозилированные молекулы.
В это изобретение включены эквивалентные конструкции ДНК, кодирующие различные добавления или замещения аминокислотных остатков или последовательностей или делеции концевых или внутренних остатков или последовательностей, не требующихся для биологической активности или связывания. Например, сайты N-гликозилирования во внеклеточном домене flt 3-L могут быть модифицированы для предотвращения гликозилирования, что делает возможной экспрессию восстановленного углеводного аналога в системах экспрессии млекопитающих и дрожжей. Сайты N-гликозилирования в полипептидах эукариот характеризуются аминокислотым триплетом Аsn-Х-Y, где X обозначает любую аминокислоту, кроме Рro, а Y обозначает Ser или Thr. Мышиный и человеческий flt 3-L-белки содержат (каждый) два таких триплета при положениях аминокислот 126-128 и 150-152 SEQ ID :6 соответственно. Подходящие замены, добавления или делеции в нуклеотидной последовательности, кодирующей эти триплеты, будут приводить к предотвращению присоединения углеводных остатков при Asn боковой цепи. Изменения в единственном нуклеотиде, выбранном таким образом, что Asn заменяется другой аминокислотой, например, достаточно для инактивации сайта N-гликозилирования. Известные способы для инактивации сайтов N-гликозилирования в белках включают способы, описанные в U.S.Patent 5071972 и ЕР276846, включенных здесь в виде ссылки.
В другом примере последовательности, кодирующие Сys остатки, которые несущественны для биологической активности, могут быть изменены таким образом, чтобы Cys остатки были делетированы или заменены другими аминокислотами, что препятствует образованию неправильных дисульфадных мостиков внутри молекул при ренатурации. Другие эквиваленты получают модификацией смежных двух основных аминокислотных остатков для усиления экспрессии в дрожжевых системах, в которых присутствует КЕХ2-протеазная активность. ЕР 212914 описывает применение сайт-специфического мутагенеза для инактивации сайтов действия КЕХ2-протеаз в белке. Эти сайты инактивируются делецией, добавлением или заменой остатков для изменения пар Аrg-Аrg, Аrg-Lys и Lys-Аrg для исключения присутствия этих смежных основных остатков. Пары Lys-Lys значительно меньше восприимчивы к расщеплению КЕХ2 и превращение пар Arg-Lys или Lys-Arg в пару Lys-Lys является консервативным и предпочтительным подходом для инактивации сайтов КЕХ2. Как мышиный, так и человеческий flt 3-L содержат два сайта действия КЕХ2-протеазы при аминокислотах 216-217 и 217-218 SEQ ID :2 и при аминокислотах 211-212 и 212-213 SЕQ ID :6 соответственно. Последовательности нуклеиновых кислот в сфере действия данного изобретения включают выделенные последовательности ДНК и РНК, гибридизующиеся с описанными здесь нуклеотидными последовательностями нативного flt 3-L при условиях умеренной или высокой строгости и кодирующие биологически активный flt 3-L. Условия умеренной строгости, описанные Sambrook et al. Molecular Cloning: A Laboratory Manual, 2ed. Vol. 1, pp. 1. 101-104, Cold Spring Harbor Laboratory Press, (1989), предусматривают применение предпромывного раствора 5х SSC, 0,5% SDS 1,0 мМ EDТА (рН 8,0) и гибридизационных условий приблизительно 55oС, 5х SSС, в течение ночи. Условия высокой строгости предусматривают более высокие температуры гибридизации и промывания. Квалифицированный специалист в этой области должен понимать, что температура и концентрация соли в промывном растворе могут быть корректированы, если необходимо, в соответствии с такими факторами, как длина зонда.
Вследствие известной вырожденности генетического кода, в котором более чем один кодон, может кодировать одну и ту же аминокислоту, последовательность ДНК может отличаться от представленной в SEQ ID :1 и SEQ ID :5 и все-таки кодировать белок flt 3-L, имеющий аминокислотную последовательность SEQ ID : 6 соответственно. Такие вариантные последовательности ДНК могут происходить из молчащих мутаций (например, встречающихся во время РСR амплификации) или могут быть продуктом неспецифического мутагенеза нативной последовательности.
Данное изобретение обеспечивает равноценные выделенные последовательности ДНК, кодирующие биологически активный flt 3-1, выбранные из:
(а) ДНК, полученной из кодирующего района нативного гена flt 3-L млекопитающего;
(b) кДНК, содержащей нуклеотидную последовательность, представленную в SЕQ ID :1 или SEQ ID :5;
(с) ДНК, способнoй гибридизоваться с ДНК (а) при умеренно строгих условиях и кодирующей биологически активный flt 3-L, и
(d) ДНК, вырожденнoй как результат генетического кода относительно ДНК, определенной в (а), (b) или (с), и кодирующей биологически активный flt 3-L. Белки flt 3-L, кодируемые такими эквивалентными последовательностями ДНК, включены в данное изобретение.
ДНК, являющиеся эквивалентами последовательности ДНК SЕQ ID :1 или SEQ ID :5, будут гибридизоваться при умеренно строгих условиях с нативной последовательностью ДНК, кодирующей полипептиды, содержащие аминокислотные последовательности 28-163 SEQ ID :2 или 28-160 SEQ ID :6. Примеры flt 3-L белков, кодируемых такой ДНК, включают (но не ограничиваются ими) фрагменты flt 3-L (растворимые или мембранно-связанные) и flt 3-L белки, содержащие инактивированные сайт(сайты) N-гликозилирования, инактивированные сайты действия КЕХ2-протеазы или консервативные аминокислотые замены, описанные выше. В изобретение включены также белки flt 3-L, кодируемые ДНК, полученной из других видов млекопитающих, которые будут гибридизоваться с ДНК SЕQ ID :1 или SEQ ID :5.
Разновидности, обладающие требуемой способностью связывать рецептор flt 3, могут быть идентифицированы любым пригодным для этого тестом. Биологическую активность flt 3-L можно, например, определить конкуренцией за связывание с лигандсвязывающим доменом рецептора flt 3 (т.е. тестами конкуретного связывания).
Один тип теста конкурентного связывания для полипептида flt 3-L использует радиоактивно меченый человеческий flt 3-L и интактные клетки, экспрессирующие рецепторы flt 3 клеточной поверхности. Вместо интактных клеток можно было бы применять растворимые рецепторы flt 3 (такие как слитый белок flt 3: Fc), связанные с твердой фазой через взаимодействие Протеина А, Протеина G или антител к flt 3- или Fc-частям этой молекулы с Fс районом слитого белка. Другой тип теста конкурентного связывания использует радиоактивно меченые растворимые рецепторы 3, такие как слитый белок flt 3:Fс, и инактные клетки, экспрессирующие flt 3-L. Альтернативно растворимый flt 3-L может быть связан с твердой фазой для положительного отбора экспрессирующих flt 3 клеток.
Тесты конкурентного связывания можно проводить согласно
общепринятой методологии. Например, можно использовать радиоактивно меченый flt 3-L для конкуренции с предполагаемым гомологом flt 3-L для оценки связывающей активности в отношении связанных с поверхностью рецепторов flt-3. Количественные результаты могут быть получены при помощи тестов конкурентного связывания с применением пластинки для авторадиографии или при помощи кривых Скетчарда, применяемых для получения количественных результатов.
Альтернативно 3-связывающие белки, такие как flt 3-L и антитела против flt 3, могут быть связаны с твердой фазой, такой как матрикс для колоночной хроматографии или подобный субстрат, пригодный для идентификации, отделения или очистки клеток, экспрессирующих рецептор flt 3 на их поверхности. Связывание flt 3-связывающих белков с контактирующей с твердой фазой поверхностью может быть выполнено любым способом, например конструированием слитого белка flt 3:Fc и связыванием его с твердой фазой через взаимодействие Протеина А или Протеина G. Многочисленные другие способы фиксации белков с твердой фазой хорошо известны в данной области и пригодны для применения в данном изобретении. Например, магнитные микросферы могут быть покрыты flt 3-связывающими белками и удерживаться в инкубационном сосуде при помощи магнитного поля. Суспензии клеточных смесей, содержащих гемопоэтические клетки-предшественники или стволовые клетки, приводят в контакт с твердой фазой, имеющей на ее поверхности flt 3-связывающие белки. Клетки, имеющие рецептор flt 3 на их поверхности, связываются с фиксированным flt 3-связывающим белком, а несвязавшиеся клетки вымываются. Этот способ аффинного связывания применим для очистки, скрининга или отделения таких экспрессирующих flt 3 клеток из раствора. Способ высвобождения положительно отобранных клеток из твердой фазы известны в данной области и предусматривают, например, применение ферментов. Такие ферменты предпочтительно являются нетоксичными и безвредными для клеток и предпочтительно направлены на отщепление связывающего партнера клеточной поверхности. В случае взаимодействий flt 3: flt 3-L фермент предпочтительно должен отщеплять рецептор flt 3, освобождая вследствие этого полученную клеточную суспензию от "чужеродного" flt 3-L материала. Очищенная клеточная популяция затем может быть размножена ех перед трансплантацией больному в количестве, достаточном для восстановления гемопоэтической и иммунной системы больного.
Альтернативно смеси клеток, в которых предполагают присутствие flt 3+ клеток, сначала можно инкубировать с биотинилированным flt 3-связывающим белком. Периоды инкубирования составляют обычно не менее часа для гарантии достаточного связывания с flt 3. Затем полученную смесь пропускают через колонку, упакованную покрытыми авидином гранулами, в результате чего высокая аффинность биотина в отношении авидина обеспечивает связывание клетки с гранулами. Применение покрытых авидином гранул известно в данной области. См. Bеrenson et al. J. Cell biochem., 10:239 (1986). Промывание несвязавшегося материала и высвобождение связанных клеток выполняют при помощи общепринятых способов.
В описанных выше способах подходящими flt 3-связывающими белками являются flt 3-L, антитела против flt 3 и другие белки, способные связываться с flt 3 с высокой аффинностью. Предпочтительным flt 3-связывающим белком является flt 3-L.
Как описано выше, flt 3-L этого изобретения можно применять для отделения клеток, экспрессирующих рецепторы flt 3. В альтернативном способе flt 3-L или его внеклеточный домен или его фрагмент могут быть конъюгированы с детектируемой частью молекулы, такой как 125I для обнаружения экспрессирующих flt 3 клеток. Радиоактивное мечение при помощи 125I можно проводить любой из нескольких стандартных методологий, которые дают функциональную молекулу 125I-flt 3-L, меченную до высокой удельной активности. Можно было бы использовать иодинированное или биотинилированное антитело против flt 3-района или Fс района этой молекулы. Можно использовать другую детектируемую часть молекулы, такую как фермент, способный катализировать колориметрическую или флуорометрическую реакцию, авидин или биотин. Клетки, тестируемые на экспрессию рецептора flt 3, можно привести в контакт с меченым flt 3-L. После инкубирования несвязавшийся flt 3-L удаляют и связывание измеряют при помощи детектируемой части.
Характеристики связывания flt 3-L (в том числе вариантов) можно также определить с применением конъюгированных рецепторов растворимого flt 3 (например, 125I-flt 3:Fc) в конкурентных тестах, подобных описанным выше. В этом случае, однако, применяют инактные клетки, экспрессирующие рецепторы flt 3, или рецепторы растворимого flt 3, связанные с твердым субстратом, для измерения степени, до которой проба, содержащая предполагаемую flt 3-L разновидность, конкурирует за связывание с растворимым flt 3, конъюгированным с flt 3-L.
Другие способы определения flt 3-L включают применение антител против flt 3-L, клеточных линий, размножающихся в ответ на flt 3-L, или рекомбинантных клеточных линий, экспрессирующих рецептор flt 3 и размножающихся в присутствии flt 3-L. Например, клеточная линия ВАF/ВОЗ не содержит рецептора flt 3 и является 1L-3-зависимой. (См. Hatakeyama et al., Cell 59:837-845 (1989)). Клетки BAF/BOЗ, трансфицированные экспрессирующим вектором, содержащим ген рецептора flt 3, размножаются в ответ либо на 1L-3, либо на flt 3-L. Примером подходящего экспрессирующего вектора для трансфекции flt 3 является плазмида pCAV/NOT, см. Mosley et al., Cell, 59:335-348 (1989).
Полипептиды flt 3-L могут существовать в виде олигомеров, таких как ковалентно соединенные или нековалентно соединенные димеры или тримеры. Олигомеры могут быть соединены дисульфидными связями, образуемыми между цистеиновыми остатками на различных полипептидах flt 3-L. В одном варианте изобретения димер flt 3-L образуют слиянием flt 3-L с Fc районом антитела (например, IgGl) таким образом, что это не мешает связыванию flt 3-L с flt 3-L-связывающим доменом. Полипептид Fc предпочтительно сливают с С-концом растворимого flt 3-L (содержащим только внеклеточный домен). Общее получение слитых белков, содержащих гетерологичные полипептиды, слитые с различными частями произведенных из антител полипептидов (в том числе с Fc доменом) было описано, например, Ashkenazi et al. (PNAS USA 88:10535, 1991) и Вyrn et al. (Naturе, 344:677, 1990), включенными здесь в виде ссылки. Генное слияние, кодирующее слитый белок flt 3-L:Fc, встраивают в подходящий экспрессирующий вектор. Слитые белки flt 3-L:Fc могут собираться подобно молекулам антител, после чего образуются межцепочечные дисульфидные связи между Fc полипептидами, образуя двухвалентный flt 3-L. Если слитые белки сделаны как из тяжелых, так и из легких цепей антитела, можно образовать олигомер flt 3-L с четырьмя flt 3-L внеклеточными районами. Альтернативно можно соединить два растворимых домена flt 3-L пептидным линкером.
Рекомбинантные экспрессирующие векторы, содержащие ДНК, кодирующую flt 3-L, могут быть приготовлены при помощи хорошо известных способов. Эти экспрессирующие векторы включают в себя последовательность ДНК flt 3-L, оперативно соединенную с подходящими транскрипционными или транскрипционными регуляторными нуклеотидными последовательностями, полученными, например, из гена млекопитающего, микроорганизма, вируса или насекомого. Примерами регуляторных последовательностей являются транскрипционные промоторы, операторы или энхансеры, сайт связывания рибосом мРНК и подходящие последовательности, регулирующие инициацию и терминацию транскрипции и трансляции. Нуклеотидные последовательности "оперативно соединены", если данная регуляторная последовательность функционально имеет отношение к последовательности ДНК flt 3-L. Так, промоторная нуклеотидная последовательность оперативно соединена с последовательностью ДНК flt 3-L, если эта промоторная нуклеотидная последовательность контролирует транскрипцию этой последовательности ДНК flt 3-L. Способность к репликации в желаемых клетках-хозяевах, обычно придаваемая началом репликации, и селектируемый ген, при помощи которого идентифицируют трансформанты, могут быть дополнительно встроены в экспрессирующий вектор.
Кроме того, последовательности, кодирующие подходящие сигнальные пептиды, которые в природе не связаны с flt 3-L, могут быть включены в экспрессирующие векторы. Например, последовательность ДНК для сигнального пептида (секреторного лидера) может быть слита в рамке считывания с последовательностью flt 3-L таким образом, что flt 3-L первоначально транслируется в виде слитого белка, содержащего сигнальный пептид. Сигнальный пептид, функциональный в предназначенных клетках-хозяевах, усиливает секрецию полипептида flt 3-L из клетки. Этот сигнальный пептид может отщепляться от полипептида flt 3-L после секреции flt 3-L из клетки.
Подходящими клетками-хозяевами для экспрессии полипептидов flt 3-L являются прокариоты, дрожжевые клетки или клетки высших эукариот. Пригодные клонирующие и экспрессирующие векторы для использования с бактериальными, грибковыми, дрожжевыми и млекопитающими клеточными хозяевами описаны, например, в Роuwels et al. Сloning Vectors: A Laboratory Manual, Elsevier New York (1985). Бесклеточные системы трансляции могли бы также применяться для продуцирования полипептидов flt 3-L с применением РНК, произведенных из конструкций ДНК, описанных здесь.
Прокариоты включают в себя грамм-отрицательные или грамм-положительные организмы, например, E.coli или Bacilli. Пригодные для трансформации прокариотные клетки-хозяева включают в себя, например E.coli, Bacillus subtilis, Salmonella typhimurium и многочисленные другие виды внутри родов Pseudomonas, Streptomyces и Staphylococcus в прокариотной клетке-хозяине, такой как E. coli, полипептид flt 3-L может содержать N-концевой остаток метионина для облегчения экспрессии рекомбинантного полипептида в клетке прокариотного хозяина. N-концевой Met может быть отщеплен от экспрессируемого рекомбинантного flt -3-L полипептида.
Экспрессирующие векторы для применения в прокаритных клетках-хозяевах содержат один или более фенотипических селектируемых маркерных генов. Фенотипическим селектируемым маркерным геном является, например, ген, кодирующий белок, который придает резистентность к антибиотику или который удовлетворяет требование автотрофии. Примерами применимых экcпрессирующих векторов для прокариотных клеток-хозяев являются векторы, произведенные из коммерчески доступных плазмид, таких как клонирующий вектор рВR322 (АТСС 37017), рВR322 содержит гены устойчивости к ампициллину и тетрациклину и, следовательно, обеспечивает простое средство для идентификации трансформированных клеток. Для конструирования экспрессирующего вектора с применением pBR322 подходящий промотор и последовательность ДНК flt 3-L встраивают в вектор PBR322. Другие коммерчески доступные векторы включают, например, рКК223-3 (Pharmacia Fine Chemicals, Uppsala, Sweden) и pGEM1 (Promega Biotec, Madison, W1, USA).
Промоторные последовательности, обычно применяемые для рекомбинантных эксперссирующих векторов прокариотных клеток-хозяев, включают β-лактамазную (пенициллиназную), лактозную промоторную систему (Сhang et al., Nature 275: 615, 1978, и Goeddel et al., Nature 281:544, 1979), систему промотора триптофана (trp) (Goeddel et al., Nucl. Acids. Res 8:4057, 1980, и ЕР-А-36776) и tас промотор (Maniatis, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory 412, 1982). Особенно ценная система экспрессии прокариотной клетки-хозяина применяет промотор фага λ PL и термолабильную репрессорную последовательность cl857ts. Плазмидные векторы, доступные из АТСС, содержащие производные PL промотора фага λ, включают плазмиду pHUB2 (резидент в штамме E. coli JМВ9 (АТСС 37092)) и pPL с28 (резидент в Е.соli RR1 (АТСС 53082)).
Полипептиды flt 3-L альтернативно могут экспрессироваться в дрожжевых клетках-хoзяевах, предпочтительно из рода Saccharomyces (например, S. serevisae). Можно применять также другие роды дрожжей, такие как Pichia, K. lactis или Kluyveromyces. Дрожжевые векторы будут часто содержать последовательность начала (ориджина) репликации из дрожжевой плазмиды 2μ, автономно реплицирующуюся последовательность (ARS), промоторный район, последовательности полиаденилирования, последовательности терминации транскрипции и селектируемый маркерный ген. Пригодные промоторные последовательности для дрожжевых векторов включают, среди прочих, промоторы для металлотионеина, 3-фосфоглицераткиназы (Hitzeman et al., J.Biol. Chem. 255:2073, 1980) или других гликолитических ферментов (Hess et al., J.Adv. Enzyme Reg 7:149, 1968, и Hollard et al., Biochem, 17:4900, 1978), таких как энолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюко-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкозоизомераза и глюкокиназа. Другие пригодные векторы и промоторы для применения в дрожжевой экспрессии описаны далее в Hitzeman, EP-A-73657 или в Fleer et al., Gene, 10:285:195 (1991), и Van der Berg et al., Bio/Technology, 8:135-139 (1990). Другой альтернативой является репрессируемый глюкозой промотор АDН2, описанный Russel et al., (J.Biol. Chem. 258:2674, 1982) и Beier et al. (Nature 300:724, 1982). Челночные векторы, реплицируемые как в дрожжах, так и в E.coli, могут быть сконструированы путем встраивания последовательностей ДНК из рВR322 для отбора и репликации в E.coli (гена резистентности к ампициллину и начала репликации) в описанные выше дрожжевые векторы.
Дрожжевая лидерная последовательность α-фактора может быть использована для направления секреции полипептида flt 3-L. Лидерную последовательность α-фактора часто встраивают между промоторной последовательностью и последовательностью структурного гена. См., например, Kurjan et al., Cell 30:933, 1982; Bitter et al., Proc. Natl. Acad. Sci. USA 81:5330, 1984; U.S.Patent 4546082 и ЕР 324274. Другие лидерные последовательности, пригодные для облегчения секреции рекомбинантных полипептидов из дрожжевых хозяев, известны специалистам в данной области. Лидерная последовательность может быть модифицирована вблизи ее 3'-конца таким образом, чтобы она содержала один или более сайтов рестрикции. Это будет облегчать слияние лидерной последовательности со структурным геном.
Протоколы трансформации дрожжей известны специалистам в этой обалсти. Один из таких протоколов описан Hinnen et al., Proc. Natl. Acad. Sci. USA 75:1929, 1978. Протокол Hinnen et al. отбирает Тrр+ трансформанты в селективной среде, состоящей из 0,67% дрожжевого азотистого основания, 0,5% аминокислот казеина, 2% глюкозы, 10 мкг/мл аденина и 20 мкг/мл урацила.
Дрожжевые клетки-хозяева, трансформированные векторами, содержащими промоторную последовательность АDН2, могут выращиваться для индуцирования экспрессии в "богатой" среде. Примером богатой среды является среда, состоящая из 1% дрожжевого экстракта, 2% пептона и 1% глюкозы, дополненными 80 мкг/мл аденина и 60 мкг/мл урацила. Дерепрессия промотора АДН2 происходит, когда глюкоза истощается из среды.
Системы культур клеток-хозяев млекопитающих или насекомых также могли бы использоваться для экспрессии рекомбинантных полипептидов flt 3-L. Обзор бакуловирусных систем для получения гетерологичных белков в клетках насекомых дан Luckow u Summers, Bio/Technology 6:47 (1988). Могут также применяться установленные клеточные линии, происходящие из млекопитающих. Примерами подходящих линий клеток-хозяев млекопитающих являются линии COS-7 клеток почек обезьян (АТСС СRL 1651) (Gluzman et al., Cell 23:175, 1981), L клетки, С127 клетки, 3Т3 клетки (АТСС CCL 163), клетки яичника китайского хомячка (СНО), He1a клетки и ВНК (АТСС СRL 10) клеточные линии и клеточная линия СV -1/ЕВ N А-1, полученная из линии клеток почек Африканской зеленой мартышки CV 1 (АТСС ССL 70), описанной McMahan et al. (EMBO J. 10:2821, 1991).
Транскрипционные и трансляционные регуляторные последовательности для экспрессирующих векторов клеток-хозяев млекопитающих могут быть вырезаны из вирусных геномов. Обычно применяемые промоторные последовательности и эхансерные последовательности произведены из вируса полиомы, аденовируса 2, вируса обезъян 40 (SV 40) и человеческого цитомегаловируса. Последовательности ДНК, произведенные из вирусного генома SV 40, например ориджин SV-40, ранний и поздний промотор, энхансер, сайты сплайсинга и полиаденилирования, могут быть использованы для обеспечения других генетических элементов для экспрессии последовательности структурного гена в клетке-хозяине млекопитающего. Вирусные ранний и поздний промоторы особенно применимы, поскольку их легко получить из вирусного генома в виде фрагмента, который содержит также вирусную точку инициации репликации (ориджин) (Fiers et al., Nature 273: 113, 1978). Можно применять большие или меньшие фрагменты SV 40, при условии, что включена последовательность приблизительно из 250 п.н., простирающаяся от сайта Hind 111 по напавлению к сайту Bgl 1, локализованнуму в сайте начала репликации вируса SV 40.
Примеры экспрессирующих векторов для применения в клетках-хозяевах млекопитающих могут быть сконструированы, как описано Okayama u Berg (Mol. Cell Biol. 3:280, 1983). Ценная система для стабильной экспрессии высокого уровня кДНК млекопитающих в С127 мышиных эпителиальных клетках молочной железы может быть сконструирована по существу, как описано Соsman еt al. (Mol. Immunol. 23: 935, 1986). Ценный высокоэкспрессирующий вектор, PMLSV N1/N4, описанный Cosman et al. , Nature 312:768, 1984, был депонирован как АТСС 39890. Дополнительные ценные экспрессирующие векторы млекопитающих описаны в ЕР-А-0367566 и в U.S.Patent Application Serial 07/701415, поданной 16 мая 1991 года, включенных здесь в виде ссылок. Эти векторы могут быть произведены из ретровирусов. Вместо нативной сигнальной последовательности может быть добавлена гетерологичная сигнальная последовательность, например сигнальная последовательность для 1L-7, описанная в U.S.Рatent 4965195; сигнальная последовательность для рецептора 1L-2, описанная в Сosman еt al., Nature 312: 768 (1984); сигнальный пептид 1L-4, описанный в ЕР 367566; сигнальный пептид рецептора 1L-1 типа 1, описанный в 4968607, и сигнальный пептид рецептора 1L-1 типа 11, описанный в ЕР 460846.
Flt 3-L в виде выделенного или гомогенного белка согласно изобретению может быть получен при помощи рекомбинантных систем экспрессии, описанных выше, или очищен из природно встречающихся клеток. Flt 3-L может быть очищен по существу до гомогенности, о чем свидетельствует одна полоса белка после анализа электрофорезом в полиакриламидном геле с ДСН (SDS) (SDS-РАСЕ).
Один способ получения flt 3-L предусматривает культивирование клетки-хозяина, трансформированной экспрессирующим вектором, содержащим последовательность ДНК, кодирующую flt 3-L, при условиях, достаточных для усиления экспрессии flt 3-L. Затем flt 3-L извлекают из культуральной среды или клеточных экстрактов, в зависимости от примененной системы экспрессии. Как это известно квалифицированным специалистам, процедуры очистки рекомбинантного белка будут вариировать в соответствии с такими факторами, как тип примененных клеток-хозяев, или в зависимости от того, секретируется или нет рекомбинантный белок в культуральную среду.
Например, если применяют системы экспрессии, которые секретируют рекомбинантный белок, культуральную среду сначала можно концентрировать с применением коммерчески доступного фильтра для концентрирования белка, например ультрафильтрационной единицы Amicon или Millipore Pellicon. После стадии концентрирования концентрат может быть нанесен на очищающий матрикс, такой как гель-фильтрационная среда. Альтернативно можно применять анионообменную смолу, например матрикс или субстрат, имеющий боковые диэтиламиноэтильные (DЕАЕ) группы. Такими матриксами могут быть акриламид, агароза, декстран, целлюлоза или другие типы, обычно применяемые в очистке белков. Пригодные катионообменники включают различные нерастворимые матриксы, содержащие сульфопропильные или карбоксиметильные группы. Предпочтительны сульфопропильные группы. Наконец, могут быть применены одна или более стадий жидкостной хроматографии высокого разрешения с обращенной фазой (RP-HPL С, ЖХВР), применяющие гидрофобные среды RP-HPL С (например, силикагель с боковыми метильными или иными алифатическими группами), для дальнейшей очистки flt 3-L. Некоторые или все из предшествующих стадий очистки, в различных комбинациях, хорошо известны и могут применяться для обеспечения практически гомогенного рекомбинантного белка.
Можно использовать аффинную колонку, содержащую лигандсвязывающий домен рецепторов flt 3, для аффинной очистки экспрессируемых поилпептидов flt 3-L. Полипептиды flt 3-L могут быть удалены из аффинной колонки при помощи общепринятых способов, например в высокосолевом буфере для элюции, и затем диализованы в низкосолевой буфер применения или путем изменения рН или других компонентов в зависимости от примененного аффинного матрикса. Альтернативно аффинная колонка может содержать антитело, связывающее flt 3-L. Пример 6 описывает процедуру для применения flt 3-L данного изобретения для генерирования моноклональных антител против flt 3-L.
Рекомбинантный белок, продуцируемый в бактериальной культуре, обычно выделяют первоначальным разрушением клеток-хозяев, центрифугированием, экстракцией из осадков клеток в случае нерастворимого полипептида или из жидкости супернатанта, в случае растворимого полипептида, с последующим одним или более концентрированиями, высаливанием, ионообменом, аффинной очисткой или стадиями гель-фильтрационной хроматографии. Наконец, для конечных стадий очистки можно применять RP-HPLС. Микробные клетки можно разрушать любым стандартным способом, в том числе при помощи циклов замораживания-оттаивания, разрушением ультразвуком, механическим разрушением или при помощи лизирующих клетки агентов.
Трансформированные дрожжевые клетки-хозяева применяют предпочтительно для экспрессии flt 3-L в виде секретируемого полипептида для упрощения очистки. Секретируемый рекомбинантный полипептид, полученный при ферментации дрожжевых клеток-хозяев, может быть очищен согласно способам, описанным Urdal et al. (J. Chromatog 296:171, 1984). Urdal et al. описывают две последовательные стадии RP-HPLС для очистки рекомбинантного человеческого 1L-2 на препаративной колонке НРLС.
Согласно этому изобретению могут быть приготовлены смысловые или антисмысловые олигонуклеотиды, содержащие одноцепочечную последовательность нуклеиновой кислоты (РНК или ДНК), способную связыватьcя с целевой последовательностью мРНК flt 3-L (с образованием дуплекса) или с последовательностью flt 3-L в двухцепочечной спирали ДНК (с образованием тройной спирали). Антисмысловые или смысловые олигонуклеотиды, согласно изобретению, содержат фрагмент кодирующего района кДНК flt 3-L. Такой фрагмент обычно содержит не менее 14 нуклеотидов, предпочтительно от приблизительно 14 до приблизительно 30 нуклеотидов. Способность создавать антисмысловой или смысловой олигонуклеотид на основе последовательности кДНК для данного белка описана, например, Stein и Cohen, Cancer Res. 48:2659, 1988, и Van der Krol et al., BioTechniques 6:958, 1988.
Связывание антисмыслового или смыслового олигонуклеотидов с целевыми последовательностями нуклеиновых кислот приводит к образованию комплексов, блокирующих трансляцию (РНК) или транскрипцию (ДНК) одним из нескольких способов, включающих в себя повышенную деградацию дуплексов, преждевременную терминацию транскрипции или трансляции, или другими способами. Таким образом, антисмысловые олигонуклеотиды могут быть использованы для блокирования экспрессии flt 3-L белков. Кроме того, антисмысловые и смысловые олигонуклеотиды включают олигонуклеотиды, имеющие модифицированные сахарфосфодиэфирные структуры (или другие сахарные связи, такие, котоpые описаны в WО 91/06629), причем такие сахарные связи устойчивы к эндогенным нуклеазам. Такие олигонуклеотиды с устойчивыми сахарными связями стабильны in vivo (т.е. способны противостоять разрушению ферментами), но сохраняют специфичность последовательности, позволяющую связываться с целевыми нуклеотидными последовательностями. Другие примеры смысловых и антисмысловых олигонуклеотидов включают такие олигонуклеотиды, которые ковалентно соединены с органическими частями молекул, как описано в WO 90/10448, и другими составляющими, которые увеличивают аффинность такого олигонуклеотида в отношении целевой последовательности нуклеиновой кислоты, таким как поли-(L-лизин). Кроме того, интеркалирующие агенты, такие как эллиптицин, и алкилирующие агенты и комплексы металлов могут быть присоединены к смысловым или антисмысловым олигонуклеотидам для модификации специфичности связывания антисмыслового или смыслового олигонуклеотида в отношении целевой нуклеотидной последовательности.
Антисмысловые или смысловые олигонуклеотиды могут быть введены в клетку, содержащую целевую последовательность нуклеиновой кислоты, любым способов переноса генов, в том числе, например, СаРO4-опосредованной трансфекцией ДНК, электропорацией или путем применения векторов переноса генов, таких как вирус Эпштейна-Барра. Антисмысловые или смысловые олигонуклеотиды предпочтительно вводят в клетку, содержащую целевую последовательность нуклеиновой кислоты, встраиванием антисмыслового или смыслового олигонуклеотида в подходящий ретровирусный вектор с последующим контактированием этой клетки с ретровирусным вектором, содержащим встроенную последовательность, in vivo или ex vivo. Подходящие ретровирусные векторы включают (но не ограничены ими) мышиный ретровирус M-MuLV N2 (ретровирус, произведенный из M-MuLV) или двухкопийные векторы, обозначенные DCT5A, DCT5B и DСТ5С (см. РСТ Application W 90/02656).
Смысловые или антисмысловые олигонуклеотиды могут быть также введены в клетку, содержащую целевую нуклеотидную последовательность, путем образования конъюгата с лигандсвязывающей молекулой, как описано в WO 91/04753. Подходящие лигандсвязывающие молекулы включают (но не ограничены ими) рецепторы клеточной поверхности, факторы роста, другие цитокины или другие лиганды, связывающиеся с рецепторами клеточной поверхности. Предпочтительно конъюгирование лигандсвязывающей молекулы по существу не мешает способности этой молекулы связываться с соответствующей ей молекулой или рецептором или не блокирует вхождение смыслового или антисмыслового олигонуклеотида или его конъюгированной версии в клетку.
Альтернативно смысловой или антисмысловой олигонуклеотид может быть введен в клетку, содержащую целевую последовательность нуклеиновой кислоты, путем образования олигонуклеотид-липидного комплекса, как описано в WO 90/10448. Этот комплекс смыслового или антисмыслового олигонуклеотида с липидом предпочтительно диссоциируется внутри клетки эндогенной липазой.
Flt 3-L полипептиды изобретения могут быть приготовлены в соответствии с известными технологическими способами, применяемыми для получения фармацевтически применимых композиций. Flt 3-L может быть объединен в смеси либо в виде единственного активного материала, либо с другими известными активными материалами с фармацевтически приемлемыми разбавителями (например, с Трис-HCl, ацетатом, фосфатом), консервантами (например, Тимерозалом, бензиловым спиртом, парабенами), эмульгаторами, растворителями, адъювантами и/или носителями. Подходящие носители и их готвоые формы описаны в Remington's Pharmaceutical Sciences, 16th ed. 1980, Маcк Publishing Co. Кроме того, такие композиции могут содержать flt 3-L в комплексе с полиэтиленгликолем (РЕС), ионами металла или flt 3-L может быть включен в полимерные соединения, такие как полиуксусная кислота, полигликолевая кислота, гидрогели и т. д. , или в липосомы, микроэмульсии, мицеллы, однослойные или многослойные везикулы, гемолизированные эритроциты ("тени" эритроцитов) или сферобласты. Такие композиции будут влиять на физическое состояние, растворимость, стабильность, скорость выделения in vivo и на скорость клиренса in vivo flt 3-L. Flt 3-L может быть также конъюгирован с антителами против тканеспецифических рецепторов, лигандов или антигенов или соединен с лигандами тканеспецифических рецепторов. В случаях, когда рецептор flt 3 обнаружен на неопластических клетках, flt 3-L может быть конъюгирован с токсином для применения его для доставки этого токсина к специфическому сайту или он может быть использован для сенсибилизации таких неопластических клеток к вводимым затем противоопухолевым агентам.
Flt 3-L можно вводить топически, парентерально или ингаляцией. Термин "парентерально" включает в себя подкожные инъекции, внутривенную, внутримышечную, внутриполостную инъекцию или инфузионные способы. Эти композиции обычно содержат эффективное количество flt 3-L, одного или в бинации с эффективным количеством любого другого активного материала. Дозы и желаемые концентрации лекарственного средства, содержащиеся в композиции, могут вариировать с зависимости от многих факторов, в том числе от предназначаемого применения, массы тела больного и его возраста и от пути введения. Предварительные дозы могут быть определены в тестах на животных, а определение дозировок для введения человеку выполняют в соответствии с принятыми в данной области способами. С учетом описанного выше типичные дозы flt 3-L могут быть в пределах от приблизительно 10 мкг/кв.м до приблизительно 1000 мкг/кв.м. Предпочтительный диапазон доз имеет порядок приблизительно 100 - 300 мкг/кв. м.
В дополнение к вышеописанному следующие примеры иллюстрируют конкретные варианты, но не ограничивают сферу действия этого изобретения.
ПРИМЕР 1
Получение слитого белка flt 3-рецептор:Fс
Этот пример описывает клонирование мышиной кДНК 3 и конструирование экспрессирующего вектора, кодирующего слитый белок мышиного flt 3-рецептора с Fс, для применения в детектировании клонов кДНК, кодирующих flt 3-L. Полимеразную цепную реакцию (PCR), клонирующую кДНК flt 3 из мышиной Т-клетки, проводили с применением олигонуклеотидных праймеров и способов, описанных Lyman et al., Oncogene 8:815-822 (1993), включенных здесь в виде ссылки. Последовательность кДНК и кодируемая ею аминокислотная последовательность мышиного рецептора flt 3 представлены Rosnet et al., Oncogene 6:1641-1650 (1991) (включ. здесь ссылкой). Мышиный белок 3 имеет внеклеточный домен из 542 аминокислот, трансмембранный домен из 21 аминокислоты и цитоплазматический домен из 437 аминокислот.
Перед слиянием кДНК мышиного flt 3 с N-концом кДНК, кодирующей Fс часть молекулы человеческого IgGl, амплифицированный фрагмент кДНК мышиного flt 3 был встроен в Asp 718-Not 1 сайт pCAV/NOT, описанный в РСТ Application 90/05183. ДНК, кодирующая одноцепочечный полипептид, WO содержащий Fc район человеческого IgGl антитела, была клонирована в сайт Spel вектора pBLUESCRIPT SK®, коммерчески доступного из Stratagene Clonning Systems, La Jolla, California. Этот плазмидный вектор может реплицироваться в E.coli и содержит полилинкерный сегмент, содержащий 21 уникальный сайт рестрикции. Уникальный сайт Вgl 11 вводили вблизи 5-конца встроенной кодирующей Fс последовательности, так что сайт Bgl 11 включает кодоны для аминокислот три и четыре Fc полипептида.
Кодируемый Fc полипептид простирается от N-концевой шарнирной области до нативного С-конца, т.е. является по существу полноразмерным Fc районом антитела. Фрагменты Fc районов, например, укороченные при С-конце, также можно использовать. Эти фрагменты предпочтительно содержат множественные состатки цистеина (по меньшей мере остатки цистеина в шарнирном районе), что делает возможным образование межцепочечных дисульфидных связей между частями Fc полипептидов двух отдельных слитых белков 3:Fc с образованием обсуждаемых выше димеров.
Сайт расщепления Аsр 718 рестриктазой вводили слева от кодирующего flt 3 района. Выделили фрагмент Asp 718-Not 1 кДНК мышиного flt 3 (содержащий весь внеклеточный район, трансмембранный район и небольшую часть цитоплазматического домена). Описанную выше частичную кДНК Asp 718-Not 1 flt-3 клонировали в вектор pBLUESCRIPT SK®, содержащий кДНК Fc, таким образом, что кДНК flt 3 расположена слева (в направлении 3'-5') от кДНК Fс. Одноцепочечную ДНК, произведенную из полученного слитого генного продукта, подвергали мутагенезу по способу, описанному Кunkel (Proc. Natl. Acad. Sci. USA 82:488, 1985) и Kunkel et al. (Methods in Enzymol. 154:367, 1987), для точного слияния всего внеклеточного домена flt 3 с Fс последовательностью. Мутированную ДНК секвенировали для подтверждения, что надлежащие нуклеотиды были удалены (т. е. трансмембранный район и частичный цитоплазматический домен ДНК были детектированы) и что flt 3 и Fc последовательности были в одной и той же рамке считывания. Затем слитую кДНК вырезали и встраивали в экспрессирующий вектор млекопитающих, обозначенный sfHAV-ЕО 409, который был разрезан Sal1-Not1 и Sal1 и Asp 718 концы затупляли. Вектор sfHAV-ЕО (также известный как р DС406) описан МсМаhan et al. (ЕМВО J., 10; 10:2821-2832 (1991)).
Слитые белки flt 3:Fc предпочтительно синтезировали в культуре рекомбинантных клеток млекопитающего. Содержащий продукт слияния flt 3:Fс экспрессирующий вектор трансфицировали в CV-1 клетки (АТСС CCL 70) и СОS-7 клетки (АТСС СRL 1651), полученные из почек обезьян. Уровень экспрессии flt 3:Fс был относительно низко как в CV-1, так и в СОS-7 клетках. Поэтому была сделана попытка экспрессии в клетках 293 (трансформированных первичных человеческих эмбриональных почечных клетках, АТСС СRL 1573).
Клетки 293, трансфицированные вектором sfHAV-EO/flt 3:Fc, культивировали в роллерных флаконах для нестационарной экспрессии слитого белка, который секретируется в культуральную среду через сигнальный пептид flt 3. Слитый белок очищали на Сефарозных колонках с Протеином А, элюировали и использовали для скрининга клеток на способность связывать flt 3:Fc, как описано в Примерах 2 и 3.
ПРИМЕР 2
Скрининг клеток на связывание flt 3:Fc
Приблизительно 100 различных эмбриональных клеток и клеточных линий, подразделяющихся на следующие основные категории: эмбриональные мышиные клетки мозга зародыша, линии клеток печени мышиного зародыша, линии клеток мозга крысиного эмбриона, линии клеток (фибробластоидных) рака легкого человека, человеческие и мышиные линии лимфоидных и миелоидных клеток, тестировали на связывание flt 3:Fc. Клеточные линии инкубировали с flt 3:Fс, затем с биотинилированным антителом против человеческого Fс, затем с комплексом стрептавидин-фикоэритрин (Becton Dickinson). Биотинилированные антитела покупали из Jackson Immunoresearch Laboratories. Стрептавидин связывается с молекулой биотина, соединенной с антителом против человеческого Fc, которое в свою очередь связывается с Fс частью слитого белка flt 3:Fc. Фикоэритрин, представляющий собой флуоресцентный фикобилирубин, служит в качестве детектируемой метки. Уровень сигнала флуоресценции измеряли для каждого клеточного типа с применением проточного цитометра FАС ScanR (Becton Dickinson). Были идентифицированы клеточные типы, которые считали положительными в отношении связывания flt 3:Fc.
ПРИМЕР 3
Выделение и клонирование кДНК flt 3-L из библиотеки кДНК мышиных Т-клеток
Библиотека кДНК мышиных Т-клеток клеточной линии Р7В-0,3А4 была выбрана в качестве возможного источника кДНК flt 3-L. Р7В-0,3А4 является клоном мышиных Т-клеток, который является Thy l,2+, CD4-, СD8-, TCRab±, СD44+. Эта линия первоначально клонирована при плотности клеток 0,33 клеток на лунку в присутствии rHu1L-7 и иммобилизованных анти-СD3 МАb и ее выращивали в непрерывной культуре в течение более 1 года с пассажем один раз в неделю в среде, содержащей 15 нг/мл rHu1L-7. Родительскую клеточную линию получали из клеток лимфатического узла SJL/J мышей, иммунизированных 50 нмолями РLР139-151-пептида и 100 мкг Mycobacterium tuberculosis H37Ra в неполном адъюванте Фрейнда. PLP является протеолипидным белковым компонентом миелиновой оболочки центральной нервной системы. Этот пептид, состоящий из аминокислот 139-151, как было ранее показано, является энцефалогенным пептидом в экспериментальном аутоиммунном энцефаломиелите (ЕАЕ), мышиной модели для рассеянного склероза в SJL/J мышах (Touhy V.К., Z. Lu, R.A. Sobel, R.A.Laursen and M. B.Lees; 1989. Identification for SJL mice J.Immunol 142:1523). После исходной культуры в присутствии антигена родительская клеточная линия, обозначенная PLP7, находилась в непрерывной культуре с rHu1L-7 (и без антигена) в течение более 6 месяцев перед клонированием.
Р7В-0,3А4 размножается только в ответ на очень высокие концентрации пептида PL Р139-151 в присутствии облученных сингенных клеток селезенки и не является энцефалогенной и аллореактивной. Этот клон размножается в ответ на иммобилизованные анти-СD3 Mab, 1L-2 и 1L-7, но не 1L-4.
Связывание flt 3:Fc наблюдали на мышиных Т-клетках и человеческих Т-клетках и были выбраны мышиные Т-клетки (линия 0,3А4) благодаря легкости их выращивания. Библиотеку кДНК мышиной 0,3А4 клеточной линии в sfHAV-EО готовили, как описано в МсМаhan et al. (ЕМВО J., 10: 10; 2821-2832, 1991). SfHAV-EO является экспрессирующим вектором млекопитающих, который также реплицируется в Е.coli sfHAV-НО, содержит начала репликации, произведенные из SV 40, вируса Эпштейна-Барра и рВР322, и является производным НАV-ЕО, описанным Dower et al. , J. Immunol. 142:4314 (1989). SfHAV-ЕО отличается от HAV-ЕО делецией интрона, присутствующего в трехчастной лидерной последовательности аденовируса 2 в HAV-ЕО. Вкратце, кДНК мышиных Т-клеток клонировали в Sal1 сайт sfHAV-ЕО адаптерным способом, подобным описанному Наymerle et al. (Nucl. Acids. Rеs. ) 14:8615, 1986), с применением следующей олигонуклеотидной адаптерной пары:
5' TCGACTGGAACGAGACGACCTCGT 3' SEQ ID :3
3' GACCTTGCTCTGCTGGACCA 5' SEQ ID :4
Двухцепочечную кДНК с тупыми концами и произвольными праймерами получали из 0,3А4 поли(А)+РНК, в основном, как описано Gubler и Hoffman, Gene, 25: 263-269 (1983), с применением набора ДНК Pharmacia. Указанные выше адаптеры добавляли к этой кДНК, как описано Haymerle et al. Низкомолекулярный материал удаляли пропусканием через Sерhacrye S-1000 при 65oC и кДНК лигировали в sfHAV-EO 410, расщепленную предварительно Sal 1, и лигировали с той же самой парой олигонуклеотидов. Этот вектор обозначали как sfНАV-ЕO410. ДНК вводили электропорацией (Dower et al., Nucleic Acids. Res., 16:6127-6145, 1988) в E. coli DН1OВ и после 1 часа роста при 37oС трансформированные клетки замораживали в виде аликвот по 1 мл в среде SОС (Hanahan et al., J.Mol.Biol. 166: 557-580, 1983), содержащей 20% глицерин. Одну аликвоту титровали для определения числа устойчивых к ампициллину колоний. Полученная 0,3А4 библиотека имела 1,84 миллиона клонов.
Клетки штамма E. coli DН1OВ, трансфицированные библиотекой кДНК в sfHAV-EO410, высевали для обеспечения приблизительно 1600 колоний на чашку. Колонии выскребали из каждой чашки, объединяли и из каждого пула получали плазмидную ДНК. Эти объединенные ДНК, представляющие приблизительно 1600 колоний, применяли затем для трансфекции субконфлюентного (сливающегося) слоя CV- 1/ЕВNА-1 клеток с применением ДЭАЭ-декстрана с последующей обработкой хлорохином, подобно способу, описанному Luthman et al., Nucl. Acids. Res. 11: 1295 (1983), и McCutchan et al., J.Natl. Cancer. Inst. 41:351 (1986). Клеточная линия CV-1/EBNA-1 (ATCC CP1 10478) конститутивно экспрессирует EBV ядерный антиген-1, запускаемый самым ранним энхансером/промотором CMV. CV 1-EBNA-1 получали из линии клеток CV-1 почек Африканских зеленых мартышек (ATCC CCL 70), как описано МсМаhan et al. (EMBO J., 10:2821, 1991).
Для трансфекции CV-1/ЕВNА-1 клеток библиотекой кДНК эти клетки выдерживали в полной среде (модифицированной Дульбекко среде Игла (DMEM), содержащей 10% (об./об.) фетальную (плодную) телячью сыворотку (FCS), 50 Е/мл пенициллина, 50 Е/мл стрептомицина, 2 мМ 1-глутамин), и высевали при плотности 2х105 клеток/лунку на однокамерные предметные стекла (Lab-Тек). Стекла предобрабатывали 1 мл человеческого фибронектина (10 мкг/мл в PBS) в течение 30 минут и затем промывали 1 раз PBS. Среду удаляли из прикрепленного клеточного слоя и заменяли 1,5 мл полной среды, содержащей 66,6 мкМ сульфата хлорохина. 2/10 мл раствора ДНК (2 мкг ДНК, 0,5 мг/мл ДЭАЭ-декстрана в полной среде, содержащей хлорохин) добавляли затем к этим клеткам и инкубировали в течение 5 часов. После инкубации среду удаляли и клетки обрабатывали шоком путем добавления полной среды, содержащей 10% DMSО в течение 2,5-20 минут и затем заменяли этот раствор свежей полной средой. Клетки культивировали в течение 2-3 дней для экспрессии встроенных последовательностей.
Трансфицированные монослои СV-1/EBNA-1 клеток анализировали на экспрессию flt 3-L при помощи радиoавтографии на предметных стеклах, описанной Gearing et al. (ЕМВО J., 8:3667, 1989). Трансфицированные С-1/ЕВПА-1 клетки (прикрепленные к имеющим камеру предметным стеклам) промывали 1 раз средой для связывания с обезжиренным сухим молоком (BM-NFDM) (PPM1 среда 1640, содержащая 25 мг/мл бычьего сывороточного альбумина (BSA), 2 мг/мл азида натрия, 20 мМ HEPES, рН 7,2, и 50 мг/мл обезжиренного сухого молока). Затем клетки инкубировали с flt 3:Fс в BM-NFDМ (1 мкг/мл) в течение 1 часа при комнатной температуре. После инкубации монослои клеток в предметных стеклах с камерами промывали 3 раза при помощи BM-NFDM для удаления несвязавшегося слитого белка flt 3:Fc и затем инкубировали с 40 нг/мл 125I-мышиными антителами против Fс человека (описанными ниже) (разведение 1:50) в течение 1 часа при комнатной температуре. Клетки промывали 3 раза ВМ-NFDM, затем 2 раза солевым раствором с фосфатным буфером (РВS) для удаления несвязавшихся 125I-мышиных антител против Fс человека. Клетки фиксировали инкубированием в течение 30 минут при комнатной температуре в 2,5% глутаровом альдегиде в PBS, рН 7,3, промывали дважды в РВS и сушили на воздухе. Предметные стекла с камерами, содержащими клетки, выдерживали на Phophorimager (Molecular Dynamics) в течение ночи, затем погружали в фотографическую эмульсию Kodak GTNB-2 (6x разведение в воде) и выдерживали в темноте в течение 3-5 дней при 4oС в светонепроницаемом боксе. Предметные стекла затем проявляли приблизительно в течение 4 минут в проявителе Kodak D19 (40 г/500 мл воды), промывали водой и фиксировали в фиксаже Agfa 433С. Эти предметные стекла по отдельности исследовали в микроскопе при увеличении 25-40х и положительные клетки, экспрессирующие flt 3-L, идентифицировали по присутствию радиоавтографических гранул серебра против светлого фона.
Мышиные антитела против Fс человека получали из Jackson Laboratories. Эти антитела обнаруживали минимальное связывание с Fс, связанными с Fс γ-рецептором. Антитела метили при помощи способа с Хлорамином Т. Вкратце, готовили колонку Сефадекса G-25 согласно изготовителю. Колонку предобрабатывали 10 объемами колонки РВS, содержащего 1% бычий сывороточный альбумин, для снижения неспецифической адсорбции антител с колонкой и смолой, затем несвязавшийся бычий сывороточный альбумин из колонки 5 объемами РВS без бычьего сывороточного альбумина. В микрофужную пробирку добавляли 10 мкг антител (растворенных в 10 мкл PBS) к 50 мкл 50 мМ натрий-фосфатного буфера (рН 7,2), добавляли 2,0 кКи Nа125I без носителя и раствор хорошо перемешивали. 15 мкл свежеприготовленного раствора хлорамина Т (2 мг/мл в 0,1 М натрийфосфатном буфере, рН 7,2) добавляли и смесь инкубировали в течение 30 минут при комнатной температуре. Затем эту смесь сразу же наносили на колонку Сефадекса G-25. После этого радиоактивно меченые антитела элюировали из колонки, собирая фракции элюата по 100-150 мкл. Бычий сывороточный альбумин добавляли к элюированным фракциям,
содержащим радиоактивно меченые антитела, до конечной концентрации 1%. Радиоиодинирование дало удельные активности в пределах 5-10х1015 имп/нмоль белка.
При помощи подхода с применением радиоавтографии предметных стекол приблизительно 1840000 кДНК подвергли скринингу в пулах из приблизительно 1600 кДНК, пока анализ одного пула трансфектантов не обнаружил множество клеток, явно положительных в отношении связывания flt 3:Fc. Этот пул затем делили на 500 пулов и снова скринировали при помощи радиоавтографии на предметных стеклах и идентифицировали положительный пул. Этот пул делили на 100 пулов и снова скринировали. Отдельные колонии из этого пула скринировали, пока не был идентифицирован клон (клон 6С), который направлял синтез поверхностного белка с детектируемой связывающей flt 3:Fс активностью. Этот клон выделяли и секвенировали его кДНК-инсерцию 0,88 т.п.н.
Нуклеотидная и кодируемая аминокислотная последовательность кодирующего района кДНК мышиного flt 3-L клона 6С представлены в SEQ ID 1 и 2. Инсерция кДНК имеет длину 0,88 т.п.н. Открытая рамка считывания внутри этой последовательности могла бы кодировать белок из 231 аминокислоты. Таким образом, ДНК и кодируемые аминокислотные последовательности для открытой рамки считывания из 231 аминокислоты представлены в SEQ ID :1 и :2. Белок SEQ ID 2 является белком трансмембранного типа с N-концевым сигнальным пептидом (аминокислоты 1-27), внеклеточным доменом (аминокислоты 28-188), трансмембранным доменом (аминокислоты 189-211) и цитоплазматическим доменом (аминокислоты 212-231). Предсказанная мол. масса нативного белка после отщепления сигнальной последовательности равна 23164 дальтон. Зрелый белок имеет оцененную р1 9,372. Имеются 56 п.н. 5'-некодирующей последовательности и 126 п.н. 3'-некодирующей последовательности, которые фланкируют кодирующий район, в том числе добавленные адаптеры кДНК. Описанная выше процедура клонирования дала также клон 5Н мышиного flt 3-лиганда, который идентичен клону 6С, начиная при нуклеотиде 49 и по нуклеотид 545 (соответствующий аминокислоте 163) SEQ ID :1. Клон 5Н полностью отличается от этой точки дальше и представляет собой другую полученную при участии сплайсинга конструкцию.
Вектор sfHAV-EO410, содержащий кДНК flt 3-L в клетках E.coli DН1OВ, был депонирован с АТСС, Rockville, MD USA, 20 апреля 1993 г. и получил accession number АТСС 69286. Депонирование было выполнено по условиям Budapest Treaty.
ПРИМЕР 4
Клонирование кДНК, кодирующей человеческий flt 3-L
кДНК, кодирующую человеческий flt 3-L, клонировали из библиотеки кДНК человеческого клона 22 т-клеток λgt 10 с произвольными праймерами, как описано Sims et al., PNAS, 86:8946-8950 (1989). Библиотеку скринировали Ple 1 фрагментом 413 п.н., соответствующим внеклеточному домену мышиного flt 3-L (нуклеотиды 103-516 SEQ ID :1). Фрагмент произвольного примировали, гибридизовали в течение ночи с фильтрами библиотеки при 55oС, в олиго-предгибридизационном буфере. Затем фрагмент промывали при 55oС при 2xSSC/0,1% SDS в течение 1 часа, затем 1x SSC/0,1% SDS в течение 1 часа и затем 0,5xSSС/1% SDS в течение 1 часа. ДНК из положительных фаговых бляшек экстрагировали и инсерции амплифицировали при помощи РСR с применением олигонуклеотидов, специфических для фаговых отростков. Затем эту ДНК секвенировали и последовательность клона 9 показана в SЕQ ID :5. Дополнительную кДНК человеческого flt 3-L выделяли из той же самой библиотеки кДНК λgt 10 с произвольными праймерами, как описано выше, путем скрининга этой библиотеки фрагментом внеклеточного домена мышиного клона 5 кДНК, содержащего последовательность кДНК, в основном соответствующую нуклеотидам 128-541 SEQ ID :1.
Секвенирование клона 9 кДНК из 988 п.н. обнаружило открытую рамку считывания из 705 п.н., окруженную 29 п.н. 5'-некодирующей последовательности и 250 п.н. 3'-некодирующей последовательности. 3'-некодирующий район не содержит поли-А-хвост. Не было в рамке считывания стоп-кодонов слева от инициирующего метионина. Открытая рамка считывания кодирует трансмембранный белок типа 1 из 235 аминокислот, как показано аминокислотами 1-235 SEQ ID :6. Этот белок имеет N-концевой сигнальный пептид из 26 или 27 аминокислот. Существует несколько большая вероятность, что N-концевой сигнальный пептид имеет длину 26 аминокислот, чем 27 аминокислот. За сигнальным пептидом следует внеклеточный домен из 156 или 155 аминокислот (для сигнальных пептидов из 26 и 27 аминокислот соответственно); далее следуют трансмембранный домен из 23 аминокислот и цитоплазматический домен из 30 аминокислот. Человеческий flt 3-L имеет всего 72% идентичных аминокислот и 78% сходных аминокислот по сравнению с мышиным flt 3-L. Вектор pBLU-ESCRIPT SK(-), содержащий кДНК человеческого flt 3-L клона 9, был депонирован с АТСС, Rоckville, Maryland, USA, 6 августа 1993 г. и получил accession АТСС 69382. Депонирование было выполнено по условиям Budapest Treaty.
ПРИМЕР 5
Экспрессия flt 3-L в дрожжах
Для экспрессии растворимого flt 3-L в дрожжах использовали синтетические олигонуклеотидные праймеры для амплификации при помощи РСR (Mullis and Faloona, Meth. Enzymol. 155: 335-350, 1987) всего внеклеточного кодирующего домена flt 3-L между концом сигнального пептида и началом трансмембранного сегмента. 5'-праймер (5'-AATTGGTACCTTTGGATAAAAGAGACTACAAGGACGACGATGACAAGACACCTGACTGTTACTTCAGCCA-3') SEQ ID : 7 кодировал часть лидера α-фактора и антигенный октапептид, последовательность FL АG, слитую в рамке с предсказанным зрелым N-концом flt 3-L. 3'-олигонуклеотид (5'-ATATGGATCCCTACTGCCTGGGCCGAGCCTCTGGGAG-3') SEQ ID : 8 создал кодон терминации после Gln-189, как раз при предполагаемом трансмембранном районе. Этот генерированный полимерзаной цепной реакцией фрагмент ДНК лигировали в дрожжевой экспрессирующий вектор (для экспрессии в К. lactis), который направляет секрецию рекомбинантного продукта в среду дрожжей (Fleer et al., 107:285-195 (1991) и Van den Bеrg еt al., Bio/Technology, 8:135-139 (1990)). Слитый белок FLAG: flt 3-L очищали из дрожжевого бульона аффинной хроматографией, как описано ранее (Норр et al., BioTechnology 6:1204-1210, 1988).
ПРИМЕР 6
Моноклональные антитела к flt 3-L
Этот пример иллюстрирует способ получения моноклональных антител к flt 3-L. Flt 3-L экспрессируется в клетках-хозяевах млекопитающих, таких как COS-7 или CV-1/EBNA-1 клетки и его очищают при помощи аффинной хроматографии с flt 3:Fс. Очищенный flt 3-L, его фрагмент, такой как внеклеточный домен, синтетические пептиды или клетки, экспрессирующие flt 3-L, могут быть использованы для получения моноклональных антител против flt 3-L при помощи общепринятых способов, например способов, описанных в U.S.Раtent 4411993. Вкратце, мышей иммунизировали flt 3-L в качестве иммуногена, эмульгированным в полном адъюванте Фрейнда, и инъецировали в количествах от 10 до 100 мкг подкожно или внутрибрюшинно. Спустя 10-12 дней иммунизированных животных повторно иммунизировали дополнительным количеством flt 3-L, эмульгированным в неполном адъюванте Фрейнда. Мышей периодически иммунизировали повторно после этого по схеме иммунизации 1 раз в неделю или 1 раз в две недели. Пробы сыворотки периодически брали ретроглазничным кровопусканием или отрезанием кончика хвоста для анализа на антитела против flt 3-L при помощи дот-блот-анализа, EL1SA (твердофазного иммуноферментного анализа) или ингибирования связывания flt 3.
После обнаружения достаточного титра антител положительным животным давали одну последнюю внутривенную инъекцию flt 3-L в солевом растворе. Спустя 3-4 дня животных убивали, вырезали клетки селезенки и их сливали с клетками мышиной миеломы, например NS 1 или предпочтительно P3x63Ag8.653 (ATCC CRL 1580). Слияние дает гибридомные клетки, которые высевают на множество микротитрационных планшетов в HAT (гипоксантин, аминоптерин и тимидин) селективной среде для ингибирования пролиферации неслитых клеток, миеломных гибридов и гибридов клеток селезенки.
Гибридомные клетки скринировали при помощи ELISА на реактивность против очищенного flt 3-L с применением адаптированных способов, описанных в Engval et al. Immunochem 8: 871, 1971, и в U.S.Раtent 4703004. Предпочтительным способом скрининга является способ захвата антител, описанный в Beckmann et al. (J. Immunol. 144: 4212, 1990). Положительные гибридомные клетки можно ввести внутрибрюшинной инъекцией в сингенных BALB/c мышей для образования асцитов, содержащих высокие концентрации моноклональных антител против flt 3-L. Альтернативно гибридомные клетки можно выращивать in vitro в колбах или роллерных флаконах различными способами. Моноклональные антитела, образованные в мышиных асцитах, можно очистить осаждением сульфатом аммония, а затем гель-фильтрационной хроматографией. Альтернативно можно также использовать аффинную хроматографию, основанную на связывании антител с Протеином А или Протеином G, а также аффинную хроматографию на основе связывания с flt 3-L.
ПРИМЕР 7
Применение flt 3-L отдельно и в комбинации с 1L-7 или 1L-3
Этот пример демонстрирует стимуляцию и пролиферацию АА4.1+ эмбриональных печеночных клеток под влиянием композиций, содержащиx flt 3-L и 1L-7, а также стимуляцию и пролиферацию с-kit-положительных (с-kit+) клеток под влиянием композиций, содержащих flt 3-L и 1L-3.
АА4.1-положительные (AA4.1+) экспрессирующие клетки выделяли из печеней 14-дневных эмбрионов C57BL/6 мышей пэннингом клеток в пластиковых чашках Петри (Optilux 100 мм) (Falcon 1001, Oxrard CA). Чашки были покрыты в течение ночи при 4oС в PBS плюс 0,1% фетальная бычья сыворотка (FBS), содержащая 10 мкг/мл АА4.1 антител (МсКеаrn et al., J.Immunol. 132:232-339, 1984) и затем промыты интенсивно PBS плюс 1% FBS перед применением. Суспензию отдельных печеночных клеток добавляли при концентрации 107 клеток на чашку в PBS с 1% FBS и давали клеткам прикрепиться к чашкам в течение 2 часов при 4oС. Затем чашки интенсивно промывали и прикрепившиеся клетки собирали соскабливанием для анализа или дальнейшего использования в описанных ниже тестах на гемопоэз. FACS анализ с применением АА4.1 антител показал более 95% АА4.1+ клеточной популяции.
С-kit+ плюрипотентные стволовые клетки очищали из костного мозга взрослых мышей (de Vries et al., J. Exp. Med., 176:1503-1509, 1992, и Visser and de Vries, Methods in Cell Biol., Submitted). Клетки низкой плотности (≤1,078 г/см3), положительные в отношении лектина агглютинина зародышей пшеницы и отрицательные в отношении антигенов, узнаваемых В220 и 15-1. 4.1 (Visser et al. , Meth. In Cell Biol., 33:451-468, 1990) моноклональными антителами, можно было разделить на субпопуляции клеток, экспрессирующих и не экспрессирующих с-kit, при помощи биотинилированного фактора Стила. Было показано, что с-kit+ фракция содержит плюрипотентные гемопоэтические стволовые клетки (de Vries et al., Science 255:989-991; Visser and de Vries, Methods in Cell Biol., 1993, Submitted, и Ware et al., 1993, Submitted).
AA4.1+ эмбриональные печеночные клетки культивировали в рекомбинантном 1L-7 (U. S. Patent 4965195) при 100 нг/мл и рекомбинантном flt 3-L при 250 нг/мл. Flt 3-L применяли в трех различных формах в этих экспериментах:
(1) в виде присутствующего на фиксированных трансфицированных flt 3-L CV1/EBNA клетках;
(2) в виде концентрированных культуральных супернатантов из тех же трансфицированных flt 3-1L CV1/EBNA клеток и
(3) в виде препарата очищенного и выделенного полипептида из дрожжевого супернатанта, описанного в Примере 5.
Тесты на гемопоэз
Пролиферацию c-kit+ стволовых клеток, эмбриональных печеночных АА4.1+ клеток анализировали в тестах включения [3Н]-тимидина, описанных в общем de Vries et al., J. Exp. Med., 173: 1205-1211, 1991. Очищенные с-kit+ стволовые клетки культивировали при 37oС в полностью увлажненной атмосфере 6,5% СО2 и 7% О2 в воздухе в течение 96 часов. Мышиный рекомбинантный 1L-3 применяли при конечной концентрации 100 нг/мл. Затем эти клетки импульсно метили с применением 2 мкКи на лунку [3H]-тимидином (81 Ки/ммоль; Amersham Corp., Arlington Heights, 1L) и инкубировали еще в течение 24 часов. АА4.1+ клетки (приблизительно 20000 клеток на лунку) инкубировали в 1L-7, flt 3-L и flt 3-L+1L-7 в течение 48 часов и затем импульсно метили [3Н]-тимидином в течение 6 часов. Результаты flt 3-L и 1L-7 показаны в Таблице I и результаты flt 3-L и 1L-3 показаны в Таблице II.
Комбинация flt 3-L и 1L-7 дала ответную реакцию, которая была приблизительно в 4 раза выше, чем при одном flt 3-L, и приблизительно в 40 раз выше, чем при одном 1L-7.
Культуральный супернатант от CV1/EBNA клеток, трансфицированных кДНК flt 3-L, стимулировал с-kit+ стволовые клетки приблизительно в 18 раз больше, чем культуральный супернатант CV1/EBNA клеток, трансфицированных одним экспрессирующим вектором. Добавление 1L-3 к flt 3-L, содержащему супеннатанту, дало синергическое действие, при котором наблюдали приблизительно вдвое более высокую пролиферацию, чем можно было бы ожидать, если бы действия были аддитивными.
ПРИМЕР 8
Конструирование слитого белка flt 3-L:Fс
Этот пример описывает способ конструирования слитого белка, содержащего внеклеточный район flt 3-L и Fc-домен человеческого иммуноглобулина. Эти способы в основном те же самые, которые описаны в Примере 1 для конструирования слитого белка flt 3:Fс.
Перед слиянием кДНК flt 3-L с N-концом кДНК, кодирующей Fс-часть молекулы человеческого IgGl, фрагмент кДНК 3-1 встраивали в сайт Аsр 718-Not1 вектора pCAV /NOT, описанного в РСТ Aррlication WO 90/05183. ДНК, кодирующую одноцепочечный полипептид, содержащий Fc район человеческого IgGl антитела, клонировали в Spe1 сайт вектора pBLUESCRIPT SKR, который коммерчески доступен из Stratagene Cloning Systems, La Jolla California. Этот плазмидный вектор может реплицироваться в E.coli и содержит полилинкерный сегмент, содержащий 21 уникальный сайт рестрикции. Затем уникальный Bgl 11 сайт встраивали вблизи 5'-конца встроенной кодирующей Fc последовательности таким образом, что сайт Вgl 11 включает в себя кодоны для аминокислот 3 и 4 Fc полипептида.
Кодируемый Fс полипептид простирается от N-терминальной шарнирной области от нативного С-конца, т.е. представляет по существу полноразмерный Fc район антитела. Можно также использовать фрагменты Fc районов, например, укороченные при С-конце. Эти фрагменты предпочтительно содержат множество остатков цистеина (по меньшей мере в шарнирном районе), что делает возможным образование межцепочечных дисульфидных связей между частями Fc полипептидов двух отдельных слитых белков с образованием димеров.
Asp 718-Stu1 частичная кДНК flt 3-L в pCAV/NOT может быть клонирована в Asp 718-Spe1 сайт вектора pBLUESCRIPT SKR, содержащего кДНК Fс, таким образом, что кДНК flt 3-L расположена в направлении 3'-5' от кДНК Fc. Последовательность одноцепочечной ДНК, полученной из образованного слитого гена, может быть подвергнута направленному на определенную матрицу мутагенезу, описанному Kunkel (prос. Natl. Acad Sci, USA 82:488, 1985) и Kunkel et al. (Methods in Enzymol. 154:367, 1987), для точного слияния всего внеклеточного домена flt 3-L с Fс последовательностью. Полученную ДНК можно затем секвенировать для подтверждения того, что удалены надлежащие нуклеотиды (т.е. делетированы трансмембранный район и частичный цитоплазматический район) и что последовательности flt 3-L и Fc находятся в одной рамке считывания. Затем слитую кДНК вырезают и встраивают общепринятыми способами в экспрессирующий вектор млекопитающих pCAV/NOT, который расщеплен Asp 718-Not 1.
Слитые белки flt 3-L:Fс предпочтительно синтезируют в культуре рекомбинантных клеток млекопитающего. Затем содержащий слитый продукт flt 3-L:Fc экспрессирующий вектор трансфицируют в CV-1 клетки (АТСС CCL 70) или COS-7 клетки (АТСС CRL 1651). Возможна также экспрессия в клетках 293 (трансформированных эмбриональных почечных клетках человека, АТСС CRL 1573).
293 клетки, трансфицированные вектором рСАV/NOT/ flt 3-L:Fc культивируют в роллерных флаконах для кратковременной экспрессии слитого белка, который секретируется в культуральную среду через сигнальный пептид flt 3-L. Слитый белок можно очистить на колонках с Протеин А-сефарозой.
ПРИМЕР 9
Получение трансгенный мышей, сверхпродуцирующих flt 3-L
Этот пример описывает процедуру, применяемую для получения трансгенных мышей, сверхпродуцирующих flt 3-L. Сверхпродуцирующих flt 3-L трансгенных мышей исследовали для определения биологических эффектов избыточной экспрессии. Пронуклеусы мыши (В16/J) микроинъецировали дезоксирибонуклеиновой кислотой (ДНК) flt 3-L согласно способу, описанному Cordon et al., Science 214: 1244-1246 (1981). В общих чертах, оплодотворенные мышиные яйцеклетки, имеющие видимые Пронуклеусы, сначала помещали на камеру для инъекции и удерживали на месте небольшой пипеткой. Затем использовали инъекционную пипетку для инъекции гена, кодирующего flt 3-L (клона 6С), в пронуклеусы яйцеклетки. Затем инъецированные яйцеклетки или (i) переносили в яйцевод 0,5 дня р.с. ложнобеременной самки; (ii) культивировали in vitro до стадии двух клеток (в течение ночи) и переносили в яйцевод 0,5 дня р.с. псевдобеременной самки или (iii) культивировали in vitro до стадии бластоцисты и переносили в матку 2,5 дня р.с. псевдобеременной самки. Предпочтительно можно применять два первых варианта, т. к. они позволяют избежать культивирования, и предпочтительно следует применять приблизительно 20-30 микроинъецированных яйцеклеток для переноса в самок во избежание малого приплода.
ПРИМЕР 10
Flt 3-L стимулирует пролиферацию эритроидных клеток в селезенке
Этот пример описывает действие flt 3-L на образование эритроидных клеток в селезенке трансгенных мышей. Трансгенных мышей получали в соответствии с процедурами Примера 9. Мышей убивали и из каждой инактной селезенки готовили суспензию отдельных клеток. Суспендированные клетки откручивали и затем ресуспендировали в 10 мл среды, содержащей PBS и 1% фетальную бычью сыворотку. Подсчет клеток проводили с применением гемоцитометра. Каждый клеточный образец считали с красителем Trypan Blue для получения общего числа жизнеспособных клеток на 1 мл среды в соответствии со следующей формулой: (RBC+WBC)/мл, где RBС обозначает число эритроцитов, а WBC обозначает число лейкоцитов. Затем каждый образец считали с красителем Turk для получения общего числа лейкоцитов на 1 мл среды. Общее число эритроцитов на 1 мл рассчитывали для каждого образца вычитанием общего числа лейкоцитов на 1 мл из общего числа жизнеспособных клеток на 1 мл. Эти результаты показаны в следующей далее Таблице III.
Как видно из данных Таблицы III числа лейкоцитов на 1 мл были приблизительно такими же, что и в контрольных мышах. Однако числа эритроцитов из селезенок двух трансгенных мышей были приблизительно в 2-3 раза выше, чем наблюдаемые в контрольных мышах. Flt 3-L стимулирует увеличение в клетках эритроидного направления дифференцировки, возможно, через стимуляцию эритроидных клеток-предшественников, через стимуляцию клеток, продуцирующих эритропоэтин, или путем блокирования механизма, ингибирующего эритропоэз.
ПРИМЕР 11
Flt 3-L стимулирует пролиферацию Т-клеток и ранних В-клеток
Костный мозг из 9-недельных трансгенных мышей, полученных согласно Примеру 9, подвергали скринингу на присутствие различных маркеров фенотипов Т- и В-клеток с применением антител, иммунорегирующих с такими маркерами. Исследовали следующие маркеры: маркер В220, специфичный к линии дифференцировки В-клеток; маркер поверхностного Ig М (sIgM) специфичный для зрелых В-клеток; маркер S7 (СD43), являющийся маркером ранних В-клеток; маркер антиген-1 стволовых клеток (SСА-1), являющийся маркером активированных Т-клеток и В-клеток; СD4, являющийся маркером хелперных Т-клеток и некоторых стволовых клеток, и маркер Мас-1, специфичный для макрофагов. Костный мозг скринировали с применением хорошо известных антител против таких маркеров. Следующая далее Таблица 1У показывает данные, полученные из скрининга костного мозга. Двух трансгенных мышей из одного и того же приплода анализировали по сравнению с нормальной мышью из того же приплода (контроль) и с неродственной нормальной мышью (контроль).
Представленные выше данные показывают, что сверхпродуцирование flt 3-L в мышах приводит к увеличению в числе В-клеток, как видно из увеличения В220+ клеток и SCA-1+ клеток. Анализ В220+ клеток при помощи FАСS (клеточного сортера с возбуждением флуоресценции) показал увеличение в числе проВ-клеток (HSA-, S7+). Увеличение в СD4+ клетках показало приблизительно 2-кратное повышение в числе Т-клеток и стволовых клеток. Уменьшение в клетках, имеющих SIgM маркер, свидетельствует о том, что flt 3-L не стимулирует пролиферацию зрелых В-клеток. Эти данные свидетельствуют о том, что flt 3-L увеличивает число клеток с фенотипом стволовых клеток, Т-клеток или ранних В-клеток и не стимулирует пролиферацию зрелых В-клеток или макрофагов.
ПРИМЕР 12
Анализ тимуса (вилочковой железы из сверхпродуцирующих flt 3-L мышей
Этот пример описывает анализ тимуса из трансгенных мышей, полученных согласно продедуре Примера 9. Убивали 6 взрослых мышей приблизительно 3-месячного возраста. Из каждой мыши удаляли тимус и готовили суспензию отдельных клеток.
FАСS анализ показал, что не происходило общего изменения в числе клеток и что мыши не обнаружили изменения в соотношениях созревающих тимоцитов при применении маркеров: СD 4 VS. СD8; СD3VS. αβTCR (рецептор Т-клеток) и СD3 γδTCR (рецептор Т-клеток). Однако изменение в соотношениях определенных типов клеток внутри СD4- и СD8- компартмента (т.е. самых ранних клеток в отношении развития; каждые из указанных представляют приблизительно 2-3% от всех клеток тимуса) происходило. В частности, СD4- и СD8- клетки в тимусе развиваются в трех стадиях. Стадия 1 представляет собой клетки, имеющие Pgp-1++, HSA+ и 1L-2-рецептор-отрицательные ("1L-2R-") маркеры. После стадии 1 клетки тимуса развиваются до стадии 2, состоящей из клеток, имеющих Pgp-1+, HSA++ и 1L-2R++ маркеры, и затем до стадии 3, характеризующейся клетками, имеющими Pgp-1+/-, НSА++ и 1L-2R- маркеры. Клетки тимуса в стадии 2 уменьшались в числе приблизительно на 50%, в то время как популяция клеток в стадии 3 пропорционально увеличивалась. Эти данные предполагают, что flt 3-L действует на переход клеток тимуса от стадии 2 к стадии 3 их развития, что свидетельствует о том, что flt 3-L активен на ранних Т-клетках.
ПРИМЕР 13
Применение flt 3-L в трансплантации периферических стволовых клеток
Этот пример описывает способ применения flt 3-L в аутологической (аутогенной) трансплантации периферических стволовых клеток (РSС) или клеток-предшественников периферической крови (РВРС). Обычно трансплантацию РВРС и PSC проводят на больных, костный мозг которых непригоден для взятия вследствие, например, патологии или злокачественного поражения.
Перед сбором клеток может быть желательным мобилизовать или увеличить количества циркулирующих РВРС и PSC. Мобилизация может улучшить сбор РВРС и PCS и она достигается внутривенным введением flt 3-L больным перед сбором таких клеток. Другие факторы роста, такие как CSF-1, GM-MSF, SF, G-CSF, EPO, 1L-1, 1L-2, 1L-3, 1L-4, 1L-5, 1L-6, 1L-7, 1L-8, 1L-9, 1L-10, 1L-11, 1L-12, 1L-13, 1L-14, 1L-15, GM-CSF/1L-3-слитые белки, L1F, FGF и их комбинации, могут быть также введены в последовательной или одновременной комбинации с flt 3-L. Мобилизованные или немобилизованные РВРС и РSС собирают при помощи процедур афераза, известных в этой области. См., например, Bishop et al., Blood, vol. 83, 2, pp.610-616 (1994). Вкратце, РВРС и РSС собирают при помощи стандартных устройств, например, при помощи устройства для афереза Haemonetics Model V50 (Haemonetics, Braintree, MA). Четырехчасовое взятие клеток проводят обычно не более чем 5 раз в неделю, до тех пор пока не будет собрано приблизительно 6,5х108 одноядерных клеток (МNС) на 1 кг массы больного. Аликвоты собранных РВРС и РSС анализируют на содержание гранулоцитарно-макрофагальных колониеобразующих единиц (СFu-GM) путем разведения приблизительно 1: 6 сбалансированным солевым раствором Хенка без кальция или магния (HBSS) и наслаивания на среду для отделения лимфоцитов (Organon Teknika Durham, North Carolina). После центрифугирования МNС в интерфазе собирают, промывают и ресуспендируют в HBSS. Аликвоты по 1 мл, содержащие приблизительно 300000 МNС, модифицированную среду McCoy 5A, 0,3 % агар, 200 Е/мл рекомбинантного человеческого GM-CSF, 200 Е/мл рекомбинантного человеческого 1L-3 и 200 Е/мл рекомбинатного человеческого G-CSF, культивировали при 37oС в 5% СО2 в полностью увлажненном воздухе в течение 14 дней. Иногда к этим культурам можно добавить flt 3-L или слитые молекулы GM-CSF/11-3 (Р1ХУ 321). Эти культуры окрашивали красителем Райта и колонии CF u -GM оценивали при помощи препаровальной лупы (Ward et al., Exp. Hematol, 16:358 (1988). Альтернативно CFu-GM колонии можно оценивать при помощи способа СD 34/CD 33 проточной цитометрии (Siena et al., Blood, vol. 77, 2, pp.400-409, 1991) или любого иного способа, известного в данной области.
CFu-GМ содержащие культуры замораживали в морозильном аппарате с контролируемой скоростью замораживания (например, Cryo. Med, Mt. Clemens, M1), затем хранили в фазе паров жидкого азота. В качестве криопротектора можно применять 10% диметилсульфоксид. После завершения всех сборов из больного CFu-GM содержащие культуры оттаивали и объединяли. Оттаянные собранные клетки либо повторно вливали внутривенно больному или размножали ех vivo перед повторной инфузией. Ех vivo увеличение объединенных клеток можно выполнять с применением flt 3-L в качестве фактора роста либо одного, либо в одновременной комбинации с другими цитокинами, указанными выше. Способы такого увеличения в объеме ex vivo хорошо известны в данной области. Клетки, увеличенные или неувеличенные, повторно вливают больному внутривенно. Для облегчения приживления трансплантированных клеток flt 3-L вводили одновременно с повторной инфузией или после нее. Flt 3-L при этом вводили один или последовательно или в совместной комбинации с другими цитокинами, выбранными из приведенного выше перечня.
ПРИМЕР 14
Очистка гемопоэтических клеток-предшественников или стволовых клеток при помощи flt 3-L
Этот Пример описывает способ очистки клеток-предшественников и стволовых клеток из суспензии, содержащей смесь клеток. Клетки из костного мозга и периферической крови собирают при помощи общепринятых процедур. Эти клетки суспендируют в стандартных средах и затем центрифугируют для удаления эритроцитов и нейтрофилов. Клетки, расположенные при интерфазе между двумя фазами (также известной как лейкоцитарная пленка), извлекают и ресуспендируют. Эти клетки преимущественно одноядерные и представляют основную часть ранних гемопоэтических клеток-предшественников и стволовых клеток. Затем полученную клеточную суспензию инкубируют с биотинилированным flt 3-L в течение времени, достаточного для взаимодействия flt 3-L : flt 3-L. Обычно достаточны периоды инкубации не менее 1 часа. После инкубирования клеточную суспензию пропускают под действием силы тяжести через колонку, упакованную покрытыми авидином гранулами. Такие колонки хорошо известны в данной области, см. Berenson et al., J. Cell Biochem., 10:239 (1986). Колонку промывали раствором PBS для удаления несвязавшегося материала. Целевые клетки высвобождали из гранул и освобождали от flt 3-L при помощи общепринятых способов.










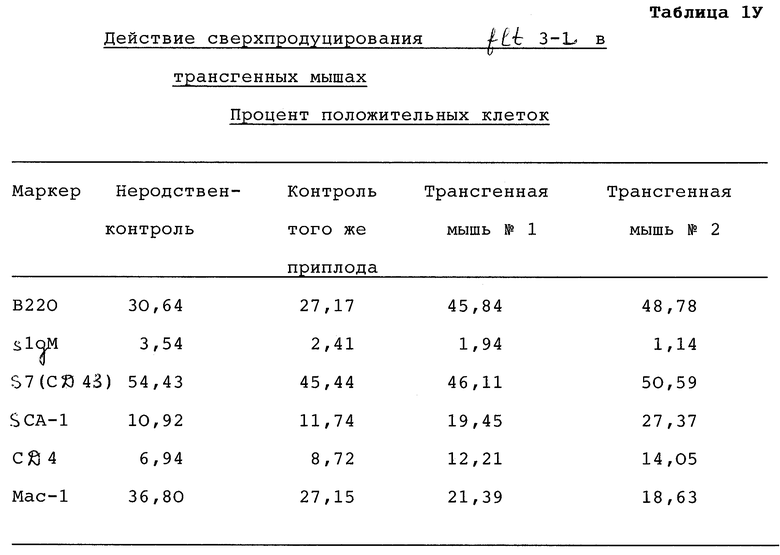
Изобретение относится к биотехнологии и может быть использовано для получения flt3 лиганда. Полинуклеотид, кодирующий полипептид лиганда flt3, клонируют в экспрессирующий вектор, функциональный в клетках млекопитающих. Полипептид лиганда flt3 получают путем культивирования линии клеток СНО, трансфицированных вектором. Фармацевтическая композиция, способная стимулировать пролиферацию и дифференцировку клеток-предшественников и стволовых клеток, содержит полипептид flt3 в эффективном количестве. Изобретение позволяет разрабатывать средства для лечения больных анемией, СПИД и раковыми заболеваниями. 16 с. и 2 з.п. ф-лы, 4 табл.
аминокислоты 1-235 последовательности SEQ ID NO:6, или
аминокислоты 28-235 последовательности SEQ ID NO:6, или
аминокислоты 1-182 последовательности SEQ ID NO:6, или
аминокислоты 1-160 последовательности SEQ ID NO:6, или
аминокислоты 28-182 последовательности SEQ ID NO:6, или
аминокислоты 28-160 последовательности SEQ ID NO:6.
(а) полинуклеотида, содержащего SEQ ID NO:5;
(b) полинуклеотидной последовательности SEQ ID NO:5, которая кодирует растворимый полипептид лиганда flt3, содержащий аминокислоты 28-182 или аминокислоты 28-160 последовательности SEQ ID NO:6, причем растворимый полипептид лиганда flt3 является биологически активным; и
(с) полинуклеотидной последовательности, которая вследствие вырожденности генетического кода кодирует flt3-лиганд, имеющий аминокислотную последовательность полипептидов, кодируемых полинуклеотидными последовательностями подпунктов (а) или (b).
| US 5185438 A, 09.02.1993 | |||
| O.ROSNET et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Горизонтальное водяное колесо | 1924 |
|
SU1641A1 |
| J.G.Flanagan et al | |||
| The kit Ligand: A cell surface molecule altered in steel mutant fibrolasts, Cell, 1990, v.63, p.185-194 | |||
| US 5199942 A, 06.04.1993 | |||
| US 5192553 A, 09.03.1993 | |||
| Шланговое соединение | 0 |
|
SU88A1 |
| ГЕРМЕТИЗИРУЮЩАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2064955C1 |
Авторы
Даты
2004-01-10—Публикация
1994-05-12—Подача