Область изобретения
Данное изобретение вообще относится к области рецепторов, принадлежащих суперсемейству рецепторов TNF/NGF, и контролю их биологических функций. Суперсемейство рецепторов TNF/NGF включает такие рецепторы как р55 и р75 фактора некроза опухоли (TNF-R) и рецептор лиганда FAS (названный также FAS/APOI или FAS-R, далее будет называться FAS-R) и другие. Конкретно данное изобретение касается нового белка, обозначенного здесь MORT-I (названный также HF-I), который соединяется с внутриклеточным доменом (IC) FAS-R (этот внутриклеточный домен получил обозначение FAS-IC). Этот новый белок способен модулировать функцию FAS-R. Кроме того, MORT-I способен к самоассоциации и может активировать собственную цитотоксичность клетки. Данное изобретение касается также получения и использования MORT-I.
Следует отметить, что названия HF-I (первоначальное обозначение) и MORT-I (обозначение, используемое в настоящее время) оба используются повсюду и обозначают один и тот же белок.
Предпосылки изобретения и исходные данные
Фактор некроза опухоли (TNF-α и Лимфотоксин (TNF-β) (далее TNF-α и TNF-β оба будут обозначаться TNF) являются многофункциональными цитокинами, провоцирующими воспалительные процессы, синтезируемыми главным образом моноядерными фагоцитами, и оказывающими разнообразные эффекты на клетки (Wallach, D. (1986) in: Interferon 7 (Ion Grosser, ed.), pp.83-122, Academic Press, London; and Beutler and Cerami (1987)). TNF-α и TNF-β проявляют свои эффекты путем связывания с рецепторами клеточной поверхности. Некоторые эти эффекты полезны для организма: например, они могут убивать опухолевые клетки или клетки, инфицированные вирусом, и усиливать противобактериальную активность гранулоцитов. Таким способом TNF участвует в защитных реакциях организма против опухолей и инфекционных агентов и в залечивании ран. Так, TNF можно использовать как противоопухолевое средство. В этом случае он связывается с рецепторами на поверхности опухолевых клеток и таким образом инициирует процессы, ведущие к гибели опухолевой клетки. TNF можно также использовать в качестве противоинфекционного средства.
Однако как TNF-α, так и TNF-β оказывают также вредные эффекты. Имеются данные, что чрезмерная продукция TNF-α может играть основную патогенную роль в ряде заболеваний. Так, сейчас известно, что действие TNF-α прежде всего на сосудистую систему является основной причиной симптомов септического шока (Tracey et al., 1986). При некоторых заболеваниях TNF может вызвать чрезмерную потерю веса (кахексию), подавляя активность адипоцитов и вызывая анорексию, и поэтому он был назван кахетином. Он был также описан как посредник повреждения тканей при ревматических заболеваниях (Beutler and Cerami, 1987) и как основной посредник наблюдаемого нарушения реакций трансплантант - против хозяина (Piquet et al., 1987). Кроме того, известно, что TNF участвует в процессе воспаления и во многих других заболеваниях.
Инициация и/или модуляция вышеуказанных биологических эффектов TNF осуществляется двумя различными, независимо экспрессируемыми, рецепторами р55 и р75 TNF-R, которые специфически связывают как TNF-α, так и TNF-β. Эти два рецептора имеют структурно различающиеся внутриклеточные домены, что указывает на различие идущих от них сигналов (см. Hohmann et al.; 1989; Engelmann et al., 1990; Brockhaus et al., 1990; Leotscher et al., 1990; Schall et al., 1990; Nophar et al., 1990; Smith et al., 1990; and Heller et ai., 1990). Однако еще необходимо выяснить клеточные механизмы, например различные белки и возможные другие факторы, которые участвуют в передаче внутриклеточных сигналов от р55 и р75 TNF-R (в PCT/US95/05854 и приводимом ниже в данной работе материале описаны новые белки, способные связываться с р75IС и p55IC). Именно внутриклеточные сигналы, которые обычно имеют место после связывания лиганда, то есть TNF (α или β), с рецептором, ответственны за начало каскада реакций, которые в конечном счете приводят к наблюдаемой реакции клетки на TNF.
Что касается цитотоксического действия TNF, то у большинства изученных в настоящее время клеток это действие запускается главным образом рецептором р55 TNF-R. Антитела против внеклеточного домена (домена, связывающего лиганд) р55 TNF-R сами по себе могут запускать цитотоксическое действие (см. ЕР 412486), что коррелирует с эффективностью связывания рецептора антителами. Полагают, что это является первым этапом генерации процессов выработки внутриклеточных сигналов. Исследование мутаций (Brakebusch et al., 1992; Tartaglia et al., 1993) показало, что биологическая функция р55 TNF-R зависит от целостности его внутриклеточного домена, и в соответствии с этим предположили, что инициация внутриклеточного сигнала, ведущего к цитотоксическому эффекту TNF, осуществляется как следствие соединения двух или более внутриклеточных доменов р55 TNF-R. Кроме того, TNF (α и β) обнаруживается как гомотример и, как предположили, индуцирует внутриклеточный сигнал через р55 TNF-R благодаря его способности связываться и образовывать поперечные связи между молекулами рецептора, т.е. осуществлять аггрегацию рецептора. В PCT/US95/05854, а также в данной работе ниже описывается, как p55IC и p55DD могут самоассоциироваться и индуцировать независящие от лиганда такие эффекты на клетку, какие оказывает TNF.
Другим членом суперсемейства рецепторов TNF/NGF является рецептор FAS (FAS-R), который назван также антиген FAS, белок поверхности клетки, эксперссируемый в различных тканях и обнаруживающий гомологию с рядом рецепторов поверхности клетки, включая TNF-R и NGF-R. FAS-R опосредует гибель клетки путем апоптоза (Itoh et al., 1991) и, по-видимому, служит в качестве фактора негативной селекции аутореактивных Т-клеток, т.е. в процессе созревания Т-клеток FAS-R опосредует апоптоз Т-клеток, распознающих собственные антигены. Обнаружено также, что мутации в гене FAS-R (lpr) вызывают лимфопролиферативное расстройство у мышей, которое соответствует аутоиммунному заболеванию человека - системной красной волчанке (Watanabe-Fukunaga et al., 1992). Лигандом FAS-R, по-видимому, является молекула поверхности клетки, которую наряду с другими клетками несут Т-клетки киллеры (или цитотоксические Т-лимфоциты - CTL). Поэтому, когда такие CTL приходят в контакт с клетками, несущими FAS-R, они способны индуцировать апоптоз клеток, несущих FAS-R. Далее, были получены моноклональные антитела против FAS-R и эти моноклональные антитела обладали способностью индуцировать апоптоз клеток, несущих FAS-R, включая мышиные клетки, трансформированные кДНК, кодирующей FAS-R человека (Itoh et al., 1991).
Было обнаружено также, что различные другие нормальные клетки наряду с Т-лимфоцитами экспрессируют FAS-R на поверхности и могут быть убиты путем запуска этого рецептора. Предпологают, что неконтролируемая индукция такого процесса гибели клеток вносит вклад в повреждение ткани при определенных заболеваниях, например деструкции клеток печени при острых гепатитах. Поэтому поиск путей ограничения цитотоксической активности FAS-R может иметь терапевтическое значение.
Напротив, так как было обнаружено, что определенные малигнизированные клетки и клетки, инфицированные вирусом HIV, несут на поверхности FAS-R, антитела против FAS-R или лиганд FAS-R могут быть использованы для запуска опосредованных рецептором FAS-R цитотоксических эффектов у этих клеток и таким образом служить в качестве средства борьбы с такими малигнизированными клетками или клетками, инфицированными вирусом HIV (см. Itoh et al., 1991). Поэтому поиск других путей увеличения цитотоксической активности FAS-R также может иметь терапевтическое значение.
Долгое время считали необходимым найти путь модуляции реакции клетки на TNF (α или β) и лиганд FAS, например, в таких паталогических случаях, которые упомянуты выше, где имеет место повышенная экспрессия TNF и лиганда FAS, желательно подавить цитотоксические эффекты, индуцируемые TNF или лигандом FAS-R. В других случаях, например при залечивании ран, желательно увеличить эффект TNF, или в случае FAS-R желательно увеличить эффекты, опосредуемые FAS-R, в опухолевых клетках или клетках, инфицированных вирусом HIV.
Авторами данного изобретения был использован ряд подходов (см., например, Европейские Заявки ЕР 186833, ЕР 308378, ЕР 398327 и ЕР 412486) для регуляции вредных эффектов TNF путем подавления связывания TNF с его рецепторами антителами против TNF или с использованием растворимых рецепторов TNF (по существу в основном растворимых внутриклеточных доменов рецепторов), конкурирующих с рецепторами TNF-R на поверхности клетки за связывания TNF. Далее, учитывая, что связывание TNF с рецепторами необходимо для индукции эффектов TNF на клетку, авторы данного изобретения применили подход для модуляции эффектов TNF, основанный на модуляции активности TNF-Rs. Кратко ЕР 568925 (IL 101769) касается метода модуляции переноса сигнала и/или расщепления внутри TNF-Rs, в результате чего пептиды или другие молекулы могут взаимодействовать с самим рецептором или с эффекторными белками, участвующими во взаимодействии с рецептором, модулируя таким образом нормальное функционирование TNF-R. В ЕР 568925 описаны конструкции и свойства различных мутантов р55 TNF-R, имеющих мутации в экстраклеточном, трансмембранном и внутриклеточном доменах р55 TNF-R. Таким способом в указанных выше доменах были идентифицированы области, которые являются существенными для функционирования рецептора, т.е. для связывания лиганда (TNF) и последующей передачи сигнала и внутриклеточного переноса сигнала, что в конечном итоге приводит к наблюдаемому эффекту TNF на клетку. Далее, описан также ряд подходов для выделения и идентификации белков, пептидов или других факторов, которые способны связываться с различными областями вышеуказанных доменов TNF-R. Эти белки, пептиды и другие факторы могут участвовать в регуляции или модуляции активности TNF-R. В ЕР 568925 был изложен также ряд подходов для выделения и клонирования последовательностей ДНК, кодирующих такие белки и пептиды; конструирования векторов экспрессии для синтеза этих белков и пептидов; получения антител или их фрагментов, которые взаимодействуют с TNF-R или с вышеуказанными белками и пептидами, связывающими различные области TNF-R. Однако в ЕР 568925 не указаны фактически существующие белки и пептиды, которые связываются с внутриклеточными доменами TNF-R (например, р55 TNF-R), не описан подход с использованием системы дрожжевых дигибридов для выделения и идентификации таких белков и пептидов, связывающихся с внутриклеточными доменами TNF-R. Ранее также не были обнаружены белки или пептиды, способные связывать внутриклеточные домены FAS-R.
Таким образом, когда хотят подавить эффект TNF или лиганда FAS-R, желательно уменьшить количество TNF-R или FAS-P на поверхности клетки или их активность, в то время как при попытках увеличить эффект TNF или лиганда FAS-P желательно увеличить количество TNF-R или FAS-R или их активность. С этой целью была определена и проанализирована нуклеотидная последовательность промоторов р55 TNF-R и р75 TNF-R и был обнаружен ряд ключевых последовательностей, характерных для различных факторов регуляции транскрипции, в том числе и таких, которые могут контролировать экспрессию TNF-R на уровне промотора, т.е. подавления считывания с промотора для уменьшения количества рецепторов и усиления считывания с промоторов для увеличения количества рецепторов (см. IL 104355 и IL 109633). Соответствующие исследования, относящиеся к контролю FAS-R на уровне промотора гена FAS-R, пока еще не опубликованы.
Далее, следует упомянуть следующее. Известно, что рецепторы фактора некроза опухоли (TNF) и структурно родственные рецепторы FAS-R запускают в клетках при стимуляции их лигандами, синтезируемыми лейкоцитами, деструктивные активности, которые ведут к гибели этих клеток, но механизмы этого запуска еще мало понятны. Исследования мутаций показывают, что в выработке сигналов цитотоксичности рецепторами FAS-R и р55 TNF (p55-R) участвуют различные области их внутриклеточных доменов (Brakebusch et al., 1992; Tartaglia et al., 1993; Itoh and Nagata, 1993). Эти области ("домены гибели") имеют сходные последовательности. "Домены гибели" как FAS-R, так и p55-R имеют тенденцию к самоассоциации. Их самоассоциация, по-видимому, стимулирует аггрегацию рецепторов, которая необходима для инициации сигналов (см. PCT/US95/05854, а также Song et al., 1994; Wallach et al., 1994; Boldin et al., 1995), и высокий уровень экспрессии рецепторов может приводить к запуску сигналов, не зависящему от лиганда (PCT/US95/05854 и Boldin et al., 1995).
Таким образом, до появления PCT/US95/05854 и данного изобретения не были известны белки, которые могут регулировать действие лигандов, принадлежащих к суперсемейству TNF/NGF, такое действие, какое оказывает TNF или лиганд FAS-R на клетку, опосредуя процессы выработки внутриклеточных сигналов. Эти процессы, по-видимому, управляются в значительной степени внутриклеточными доменами (ICs) рецепторов из суперсемейства рецепторов TNF/NGF, например TNF-Rs, т.е. внутриклеточных доменов р55 и р75 TNF-R (р551С и р751С соответственно), а также FAS-IC.
В соответствии с этим целью данного изобретения является получение белков, именно MORT-I, его аналогов, фрагментов и производных, которые способны связываться с внутриклеточным доменом FAS-R. Предполагают, что эти белки участвуют в процессах передачи внутриклеточных сигналов, инициируемых связыванием лиганда FAS с его рецептором. Белок MORT-I, его аналоги, фрагменты и производные данного изобретения отличаются от белков, связывающих FAS-IC, описанных в упомянутых ранее заявках.
Другой целью изобретения является получение антагонистов (например, антител) против этих молекул, связывающих FAS-IC, т.е. против белка MORT-I, его аналогов, фрагментов и производных. Эти антагонисты могут быть использованы с целью подавления процессов передачи сигналов, когда такие белки, связывающие FAS-IC, являются позитивными сигнальными эффекторами (т.е. индуцируют сигналы), или с целью усиления процесса передачи сигналов, когда такие белки, связывающие FAS-IC, являются негативными эффекторами (т.е. подавляют сигналы).
Еще одна цель изобретения состоит в использовании белка MORT-I, его аналогов, фрагментов и производных для выделения и характеристики других белков или факторов, которые могут, например, участвовать в конечных звеньях процесса передачи сигналов, и/или для выделения и идентификации других рецепторов, участвующих в начальных звеньях процесса передачи сигналов. Эти белки, факторы и рецепторы (например, другие FAS-R или родственные рецепторы) могли бы связываться с белком MORT-I, его аналогами, фрагментами и производными и таким образом принимать участие в их функционировании.
Кроме того, целью данного изобретения является использование вышеуказанного белка MORT-I, его аналогов, фрагментов и производных в качестве антигенов при получении поликлональных и/или моноклональных антител против них. Эти антитела в свою очередь могут быть использованы, например, для очистки нового белка MORT-I из других источников, например из клеточных экстрактов или линий трансформированных клеток.
Далее, эти антитела могут быть использованы для целей диагностики, например для идентификации расстройств, связанных с аномальным функционированием клеточных эффектов, опосредуемых рецептором FAS-R.
Другая цель изобретения состоит в получении фармацевтических составов, включающих белок MORT-I, его аналоги, фрагменты и производные, а также фармацевтических составов, включающих указанные выше антитела или другие антагонисты.
Краткое изложение изобретения
Согласно данному изобретению мы обнаружили новый белок, который способен связываться с внутриклеточным доменом FAS-R. Этот белок, связывающий FAS-IC, может действовать как посредник или модулятор действия лиганда FAS-R на клетки, опосредуя или модулируя процесс передачи сигналов, который обычно происходит после связывания лиганда FAS-R с клеточной оболочкой.
Этот новый белок обозначен как HFI или MORT-I (′Mediator of Receptor Toxicity′) и кроме его способности специфически связываться с FAS-IC имеет другие свойства (см. Пример 1), например, он имеет область, гомологичную областям "домена гибели" (DD) рецепторов p55-TNF-R и FAS-R (p55-DD и FAS-DD) и поэтому способен к самоассоциации. MORT-I способен также активировать в клетке собственную цитотоксичность, активность, которая возможно связана с его способностью к самоассоциации. Сейчас обнаружено также, что совместная экспрессия той области в MORT-I (HFI), которая содержит последовательность, гомологичную "домену гибели" (MORT-DD, присутствующую в С-концевой части MORT-I). Эта область сильно препятствует гибели клетки, индуцируемой FAS, как это и следовало ожидать на основании ее способности связываться с "доменом гибели" FAS-IC. Далее, в таких же условиях эксперимента было обнаружено, что совместная экспрессия того участка MORT-I, которая не содержит область MORT-IDD (N-концевая часть MORT-I, аминокислоты с 1 по 117, "головная часть MORT-I"), не приводит к подавлению гибели клетки, индуцируемой FAS, и ни в какой степени не увеличивает цитотоксичность клетки, индуцируемую FAS.
В соответствии с этим в данном изобретении дается последовательность ДНК, кодирующая белок, который обозначен здесь как MORT-I, его аналоги или фрагменты, каждый из которых способен связываться и взаимодействовать с внутриклеточным доменом лиганда рецептора FAS (FAS-IC).
В частности, в данном изобретении дается последовательность ДНК из группы, включающей:
(a) последовательность кДНК из области, кодирующей белок MORT-I;
(b) последовательность ДНК, способную гибридизоваться с кДНК пункта (а) в умеренных условиях. Эта последовательность кодирует биологически активный белок, связывающий внутриклеточный домен FAS-R; и
(c) последовательность ДНК, которая получается из ДНК (а) и (b) в результате вырожденности генетического кода. Эта последовательность кодирует биологически активный белок, связывающий внутриклеточный домен FAS-R.
Характерным примером вышеуказанной последовательности является последовательность ДНК, кодирующая белок MORT-I, которая содержит последовательность, изображенную на Фиг.4.
В данном изобретении дается также белок MORT-I, его аналоги, фрагменты или производные, кодируемые вышеуказанными последовательностями этого изобретения, причем указанные белки, его аналоги, фрагменты и производные способны связываться или взаимодействовать с внутриклеточным доменом FAS-R.
Характерным примером вышеуказанного белка этого изобретения является белок MORT-I, имеющий полученную из последовательности нуклеотидов аминокислотную последовательность, изображенную на Фиг.4.
В данном изобретении даны также векторы, кодирующие белок MORT-I, его аналоги, фрагменты или производные этого изобретения, которые содержат вышеуказанные последовательности ДНК этого изобретения, причем эти векторы способны экспрессироваться в соответствующих эукариотических или прокариотических клетках-хозяина; трансформированные эукариотические или прокариотические клетки-хозяина, содержащие такие веторы; и метод получения белка MORT-I, его аналогов; соответствующие условия для экспрессии указанных белков, его аналогов, фрагментов или производных; проведение посттранскрипционной модификации вышеуказанного белка, необходимой для получения указанных белков, и выделение вышеуказанных экспрессированных белков, его аналогов, фрагментов или производных из культуральной среды от вышеуказанных трансформированных клеток или из клеточных экстрактов вышеуказанных трансформированных клеток.
В другом разделе данного изобретения даются также антитела, или активные производные, или фрагменты этих антител против белка MORT-I, его аналогов, фрагментов и производных данного изобретения.
В еще одном разделе изобретения даются различные примеры использования вышеуказанных последовательностей ДНК или кодируемых ими белков согласно данному изобретению. Среди них имеются следующие примеры:
(i) метод модуляции действия лиганда FAS-R на клетки, несущие FAS-R, включающий обработку вышеуказанных клеток белком MORT-I, его аналогами, фрагментами или производными, или их комбинациями согласно данному изобретению, каждый из которых способен связываться с внутриклеточным доменом и модулировать активность FAS-R. В этом методе обработка клеток включает введение в указанную клетку белка MORT-I, его аналогов, фрагментов или производных, или их комбинаций в форме, удобной для внутриклеточного введения, или введение в вышеуказанную клетку последовательностей ДНК, кодирующих вышеуказанные белки, аналоги, фрагменты или производные, или их комбинации в составе соответствующего вектора экспрессии, несущего вышеуказанные последовательности, при этом вышеуказанный вектор способен эффективно встраиваться в последовательности ДНК вышеуказанной клетки таким образом, что указанная последовательность экспрессируется в указанной клетке;
(ii) метод модуляции действия лиганда FAS-R на клетки, включающий обработку указанных клеток белком MORT-I, его аналогами, фрагментами или производными, каждый из которых способен связываться с внутриклеточным доменом и модифицировать активность FAS-R. Вышеуказанная обработка клеток включает введение в указанную клетку указанного белка MORT-I, его аналогов, фрагментов или производных в виде, приемлемом для их введения внутрь клетки, или введение в указанную клетку последовательности ДНК, кодирующей указанный белок MORT-I, его аналоги, фрагменты или производные в составе соответствующего вектора, несущего указанные последовательности, при этом указанный вектор способен эффективно встраивать указанную последовательность в указанную клетку таким образом, что указанная последовательность экспрессируется в указанной клетке;
(iii) метод, такой как в (ii), где указанная обработка указанных клеток состоит в трансфекции указанных клеток рекомбинантным вектором вируса животных, включающий следующие этапы:
(a) конструирование рекомбинантного вектора вируса животных, несущего последовательность, кодирующую белок оболочки вируса (лиганд), который способен связываться со специфическим рецептором на поверхности клетки, несущей FAS-R, и вторую последовательность, кодирующую белок из числа белков MORT-I, его аналогов, фрагментов и производных этого изобретения, которые при экспрессии в указанной клетке способны модулировать активность указанного FAS-R; и
(b) инфицирование указанной клетки указанным вектором (а);
(iv) метод модификации действия лиганда FAS-R на клетки, несущие FAS-R, включающий обработку указанных клеток антителами, или их активными производными, или фрагментами согласно этому изобретению, причем указанная обработка клеток проводится соответствующим составом, содержащим указанные антитела, их активные фрагменты или производные. Когда белок MORT-I или его часть находится на поверхности клетки, указанный состав готовится в форме для применения вне клетки, а когда указанный белок является внутриклеточным, указанный состав готовится в форме для введения внутрь клетки;
(v) метод модуляции эффекта лиганда на клетки, несущие FAS-R, включающий обработку указанных клеток олигонуклеотидной последовательностью, кодирующей антисмысловую последовательность по крайней мере части последовательности MORT-I этого изобретения, причем указанная олигонуклеотидная последовательность способна блокировать MORT-I;
(vi) метод, такой как в (v), где обработка клеток состоит в трансфекции указанных клеток рекомбинантным вектором вируса животных, включающий следующие этапы:
(a) конструирование рекомбинантного вектора вируса животных, несущего последовательность, кодирующую белок оболочки вируса (лиганд), который способен связываться со специфическим рецептором на поверхности клетки, несущей FAS-R, и вторую последовательность, которая является олигонуклеотидной последовательностью, кодирующей антисмысловую последовательность по крайней мере части последовательности MORT-I согласно данному изобретению, при этом указанная олигонуклеотидная последовательность способна блокировать экспрессию белка MORT-I при введении указанного вируса в указанную клетку; и
(b) инфицирование указанной клетки указанным вектором (а);
(vii) метод обработки опухолевых клеток или клеток, инфицированных вирусом HIV или других желаемых клеток, включающий:
(а) конструирование рекомбинантного вектора вируса животных, несущего последовательность, кодирующую белок оболочки вируса, который способен связываться с рецептором на поверхности опухолевой клетки, или с рецептором на поверхности клетки, инфицированной вирусом HIV, или с рецептором, который несут другие желаемые клетки, и вторую последовательность, кодирующую один из белков MORT-I, его аналоги, фрагменты и производные этого изобретения, которые при экспрессии в указанной опухолевой клетке, клетке, инфицированной вирусом HIV, или какой-то другой клетке способны убивать указанную клетку; и
(b) инфицирование указанной опухолевой клетки; клетки, инфицированной вирусом HIV; или какой-то другой клетки указанным вектором (а);
(viii) метод модификации действия лиганда FAS-R на клетки, включающий применение процедуры с использованием рибозима, в котором вектор, кодирующий последовательность рибозима, способного взаимодействовать с последовательностью клеточной мРНК, кодирующей белок MORT-I этого изобретения, вводится в указанную клетку в такой форме, которая обеспечивает экспрессию указанной последовательности рибозима в указанной клетке. В этом методе при экспрессии указанной последовательности рибозима она взаимодействует с указанной последовательностью клеточной мРНК и расщепляет указанную последовательность мРНК, приводя к подавлению экспрессии белка MORT-I в указанных клетках;
(ix) метод из числа перечисленных выше, где указанный белок MORT-I или последовательность, кодирующая указанный белок MORT-I, включает по крайней мере ту часть белка MORT-I, которая специфически связывается с FAS-IC, или по крайней мере ту часть последовательности, которая кодирует участок белка MORT-I, специфически связывающийся с FAS-IC;
(х) метод выделения и идентификации белка, способного связываться с внутриклеточным доменом FAS-R, включающий применение процедуры нестрогой Саузерн-гибридизации с последующим клонированием с помощью PCR, в котором последовательность или ее части согласно этому изобретению используются в качестве зондов, связывающихся с участками кДНК или участками ДНК из библиотеки генов, имеющими по крайней мере частичную гомологию с этими зондами. Указанные связанные последовательности затем амплифицировали и клонировали с помощью процедуры PCR. В результате получили клоны, кодирующие белок, имеющие по крайней мере частичную гомологию с указанными последовательностями согласно этому изобретению.
В данном изобретении дается также фармацевтический состав для модуляции действия лиганда FAS на клетку, включающий в качестве активного ингредиента одну из следующих добавок:
(i) белок MORT-I этого изобретения, его биологически активные фрагменты, аналоги, производные или их смеси; (ii) рекомбинантный вектор вируса животных, кодирующий белок, способный связывать рецептор на поверхности клетки, и кодирующий белок MORT-I или его биологически активные фрагменты или аналоги согласно этому изобретению; и (iii) олигонуклеотидную последовательность, кодирующую антисмысловую последовательность последовательности MORT-I этого изобретения, где указанная олигонуклеотидная последовательность может быть второй последовательностью указанного выше (ii) рекомбинантного вектора вируса животных.
Следует подчеркнуть, что MORT-I имеет особую область, которая связывается с FAS-IC, и другую обособленную область, которая участвует в самоассоциации MORT-I, и, в соответствии с этим, отдельные области или части MORT-I могут быть независимо использованы для идентификации других белков, рецепторов и т.п., которые способны связываться с MORT-I или с FAS-R и могут участвовать в процессах передачи внутриклеточных сигналов, обусловленных MORT-I или FAS-R. Далее, MORT-I может иметь другие типы активности, связанные либо с вышеуказанными, либо с другими областями MORT-I, либо с их комбинациями, например ферментативную активность, относящуюся к эффектам MORT-I на собственную цитотоксичность клетки. Таким образом, MORT-I может быть использован также для специфической идентификации других белков, пептидов и т.п., которые могут участвовать в проявлении такого рода дополнительных активностей у MORT-I.
В последующем детальном описании данного изобретения даются также другие его аспекты и приложения.
Следует отметить, что используемые здесь термины "Модуляция действия лиганда FAS на клетку" и "Модуляция действия MORT-I на клетку" обозначают обработку как ин витро, так и ин виво.
Краткое описание чертежей
Фиг.1 А и В воспроизводят авторадиограмму гелей SDS-PAGE (10% акриламида), показывающую взаимодействие между HFI (MORT-I) и FAS-IC ин витро. На Фиг. 1А показана контрольная авторадиограмма иммунопреципитата белков (из экстрактов клеток HeLa, трансфецированных слитым белком FLAG-NFI (FLAG-MORT-I) или кДНК люциферазы (контроль), причем иммунопреципитация выполнена с помощью антител против FLAG; и
на Фиг.1В показана авторадиограмма характерного геля, отражающая взаимодействие между HFI и FAS-IC ин витро с помощью авторадиографического анализа связывания метаболически меченного по /35S/-метионину HFI, синтезированного в трансфецированных клетках HeLa, в виде белка, слитого с октапептидом FLAG (FLAG-MORT-I), с GST, слитым белком GST-FAS-IC человека и мыши (GST-huFAS-IC, GST-mFAS-IC) и слитыми белками GST-FAS-IC, в котором FAS-IC содержит мутацию замены Ile на Аlа в положении 225 (GST-mFAS-IC 1225A). Белки из клеток HeLa, меченые по /35S/, включающие меченый слитый белок FLAG-MORT-I, сначала экстрагировали и затем им давали провзаимодействовать с различными белками GST и GST-FAS-IC (прикрепленными к бусам из глютатиона) и затем разделяли с помощью SDS-PAGE. Во всех контрольных экспериментах экстракты из клеток HeLa, трансфецированные люциферазой, взаимодействовали с GST и слитыми белками GST-FAS-IC и проводили SDS-PAGE. Фиг. 1А и 1В описаны также в Примере 1.
Фиг.2А, В и С воспроизводят авторадиограммы гелей SDS-PAGE (10% акриламида), в которых разделяли различные иммунопреципитаты из трасфецированных клеток HeLa. В них показано взаимодействие ин виво HF-I с FAS-IC. Клетки HeLa были трансфецированы конструкциями ДНК, кодирующими: только слитый белок HFI-FLAG (FLAG-MORT-I), слитый белок HFI-FLAG и FAS-R человека (FLAG-MORTI+FAS/APOI) или только FAS-R человека (FAS/APOI) (Фиг.2А); или слитый белок HFI-FLAG и p55-R человека (FLAG-MORTI+p55-R) (Фиг.2В); или слитый белок HFI-FLAG и химерный слитый белок из FAS-R и р55 человека, в котором экстраклеточный домен FAS-R был заменен на соответствующую область из p55-R (FLAG-MORTI+химера p55-FAS), или только химерный слитый белок FAS-R-p55-R (Фиг.2С). Во всех случаях трансфецированные клетки метаболически метили по /35S/-цистеину (20 мкКю/мл) и /35S/-метионину (40 мкКю/мл) и белок экстрагировали. Белковые экстракты из различных трансфецированных клеток затем иммунопреципитировали различными антителами: анти-FLAG, анти-FAS, анти-р75-R и анти-р55-R (FLAG, αFAS, αp75-R и αp55-R на Фиг.2А-С) и разделяли SDS-PAGE. На Фиг.2А слева видны белковые полосы, соответствующие FAS-R (Fas/APOI) и HFI-FLAG (FLAG-MORTI); между Фиг.2А и В показаны относительные положения стандартных маркетов молекулярного веса (кD); и на Фиг.2С справа видны полосы белков, соответствующие p55R и химере p55-FAS. Фиг.2А-С описаны также в Примере 1.
Фиг.3 воспроизводит Нозерн-блоттинг, в котором поли А+PНК (0,3 мкг) из трансфецированных клеток HeLa выявляли с помощью зондов кДНК HF-I, как описано в Примере 1.
Фиг.4 дает схематическое изображение предварительной нуклеотидной последовательности и полученной из нее аминокислотной последовательности HF-I, как описано в Примере 1, в котором "домен гибели" подчеркнут как возможный сайт начала трансляции, т.е. подчеркнут остаток метионина в положении 49 (М, подчеркнутое жирной линией). Звездочкой помечен стоп-кодон трансляции (нуклеотиды 769-771). В начале и середине каждой строки даны два числа, обозначающие относительные положения нуклеотидов и аминокислот в этой последовательности, отсчитываемые от начала последовательности (5′-конец), где первое число обозначает положение нуклеотида, а второе - аминокислоты.
Фиг.5 представляет результаты экспериментов по определению С-конца MORT-I, где на Фиг.5 воспроизводится радиоавтограф геля после SDS-PAGE (10% акриламид), с помощью которого разделяли различные слитые белковые продукты MORTI-FLAG, экспрессируемые в клетках HeLa и метаболически меченые по 35S-цистеину и 35S-метионину с последующей иммунопреципитацией или с помощью моноклональных антител анти-FLAG (М2) (дорожки 2, 4 и 6) или, в контроле, с помощью антител-р75 TNF-R (#9) (дорожки 1, 3 и 5), как описано в Примере 1.
Фиг.6 (А и В) графически изображает не зависящий от лиганда запуск цитотоксических эффектов в клетках, трансфецированных MORT-I, где жизнеспособность клетки определяли либо в тесте поглощения нейтрально-красного (Фиг.6A), либо в случае специфического определения жизнеспособности клеток, экспрессирующих трансфецирующую ДНК - путем измерения количества секретируемой в среду щелочной фосфатазы плаценты (Фиг. 6В). Клетки HeLa трансфецировали векторами, кодирующими HFI (MORTI), FAS-IC человека, р55-IС человека или люциферазу (контроль). Экспрессия этих векторов контролируется тетрациклином. Во всех случаях эти клетки трансфецировали также препаратом кДНК, кодирующим секретируемую щелочную фосфатазу, которая позволяет выявлять действие временной экспрессии этих белков на жизнеспособность клеток. На Фиг.6А и 6В светлые столбики представляют трансфецированные клетки, растущие в присутствии тетрациклина (1 мкг/мл, для блока экспрессии), а закрашенные столбики представляют трансфецированные клетки, растущие в отсутствие тетрациклина. Фиг.6А и В описаны в Примере 1.
Фиг.7 дает графическое изображение влияния различных участков белка MORT-I на цитотоксические эффекты клетки, опосредуемые рецептором FAS-R, как описано в Примере 1.
Детальное описание изобретения
Один из аспектов данного изобретения касается нового белка MORT-I (HFI), который способен связываться с внутриклеточным доменом рецептора FAS-R, принадлежащего суперсемейству TNF/NGF, и поэтому рассматривается как посредник или модулятор рецептора FAS-R, который функционирует, например, в процессе передачи сигналов, инициируемых при связывании лиганда FAS с FAS-R. Аминокислотные последовательности и последовательности ДНК для MORT-I согласно этому изобретению являются новыми последовательностями; они не содержатся в банке данных для ДНК или аминокислотных последовательностей в "GENEBANK" или "PROTEIN BANK".
Таким образом, в данном изобретении описывается последовательность ДНК, кодирующая белок MORT-I, и белок MORT-I, кодируемый этой последовательностью ДНК.
Кроме того, в данном изобретении описываются последовательности ДНК, кодирующие биологически активные аналоги, фрагменты и производные белка MORT-I, и аналоги, фрагменты и производные, кодируемые этими последовательностями ДНК. Получение таких аналогов, фрагментов и производных осуществляется с помощью стандартной процедуры (см., например, Sambrook et al., 1989), которая позволяет получить делении, вставки или замены одного или более кодонов в последовательности ДНК, кодирующей белок MORT-I, что приводит к получению аналогов, имеющих по сравнению с природным белком по крайней мере одну измененную аминокислоту. Приемлемыми являются также аналоги, которые сохраняют по крайней мере способность связываться с внутриклеточным доменом FAS-R, или аналоги, которые могут опосредовать или любое другое связывание, или ферментативную активность, например аналоги, которые связывают FAS-IC, но не дают сигналов, т.е. не связываются с рецептором, белком или другим фактором следующего звена реакции, или не катализируют реакцию, зависящую от сигнала. Таким способом можно получить аналог, который имеет так называемый доминантно-негативный эффект, а именно аналог, который имеет дефект или по связыванию с FAS-IC или в последующей передаче сигнала после связывания. Такие аналоги могут быть использованы, например, для подавления действия лиганда FAS путем конкуренции с природными белками, связывающими FAS-IC. Таким же способом можно получить так называемые доминантно-положительные аналоги, которые могут служить для усиления эффекта лиганда FAS. Они могут иметь такие же или лучшие характеристики связывания FAS-IC и такие же или лучшие характеристики передачи сигналов, чем у природных белков, связывающих FAS-IC. Способом, аналогичным описанному для получения аналогов MORT-I, можно получить биологически активные фрагменты МОRТ-I. Приемлемыми являются такие фрагменты MORT-I, которые сохраняют способность связывать FAS-IC, или такие, которые опосредуют или связывание или ферментативную активность, как отмечено выше. В соответствии с этим могут быть получены фрагменты MORT-I, которые имеют доминантно-негативный или доминантно-позитивный эффект, как это было отмечено в отношении аналогов. Следует отметить, что эти фрагменты представляют собой специальный класс аналогов этого изобретения, а именно они определяются как участки MORT-I, взятые из полной последовательности MORT-I, причем каждый такой участок или фрагмент имеет вышеуказанные желательные активности. Таким же образом могут быть получены производные с помощью стандартных модификаций боковых групп в одном или более аминокислотных остатков белка MORT-I, его аналогов или фрагментов или путем конъюгации белка MORT-I, его аналогов или фрагментов с другой молекулой, например с антителом, ферментом, рецептором и т.д., как это известно специалистам.
Новый белок MORT-I, его аналоги, фрагменты и производные имеют ряд возможных применений.
(i) Они могут быть использованы для имитации или усиления функции лиганда FAS-R в ситуациях, где желательно усилить действие лиганда FAS-R, например при применении противоопухолевых, противовоспалительных или противовирусных (анти-HIV) антител, когда желательно получить цитотоксичность, индуцируемую лигандом FAS-R. В этом случае белок MORT-I, его аналоги, фрагменты или производные, которые увеличивают эффект лиганда FAS-R, т.е. цитотоксический эффект, могут быть введены в клетку с помощью стандартных процедур, известных как perse. Например, так как белок MORT-I является внутриклеточным и должен быть введен только в клетки, когда хотят получить эффект лиганда FAS-R, необходима система для специфического введения этого белка в эти клетки. Один из способов сделать это состоит в построении рекомбинантного вируса животных, например, полученного из коровьей оспы, с ДНК, в которую введены два следующих гена: ген, кодирующий лиганд, который связывается с белками клеточной поверхности, экспрессируемыми клетками, например белком gp120 вируса AID (HIV), который специфически связывается с некоторыми клетками (CD 4 лимфоцитами и родственными лейкемиями), или какой-нибудь другой лиганд, который специфически связывается с клетками, несущими FAS-R, так, чтобы рекомбинантный вирусный вектор обладал способностью связываться с клетками, несущими FAS-R; и ген, кодирующий белок MORT-I. Таким образом, при экспресси белка оболочки вируса, связывающегося с поверхностью клетки, опухолевая клетка или другая клетка, несущая FAS-R, превратится в мишень для этого вируса, в результате этого белок MORT-1 будет вводиться в эти клетки с помощью вируса и при его экспрессии в этих клетках, он будет приводить к усилению действия лиганда FAS-R, ведущему к гибели опухолевой клетки или другой клетки, несущей FAS-R, которую хотят убить. Такой рекомбинантный вирус животного конструируется с помощью стандартной процедуры (см., например, Sambrook et al., 1989). Другая возможность состоит во введении последовательности белка MORT-1 в форме олигонуклеотидов, которые могут абсорбироваться клеткой и экспрессероваться в ней. Еще одна возможность состоит в модификации метода, описанного Лином и др. в Journal of Biological Chemistry, Vol.270, No.24, pp.14255-14258, 1995.
(ii) Они могут быть использованы для подавления действия лиганда FAS-R, например, в случае повреждения ткани при септическом шоке, реакции отторжения трансплантант - против хозяина, или при острых гепатитах, когда желательно заблокировать внутриклеточный сигнал, индуцируемый при связывании лиганда FAS-R с FAS-R. В этом случае можно, например, с помощью стандартной процедуры ввести в клетки олигонуклеотиды, имеющие антисмысловую кодирующую последовательность белка MORT-1. Она будет эффективно блокировать трансляцию мРНК, кодирующую белок MORT-1 и, таким образом, блокировать его экспрессию и приводить к подавлению действия лиганда FAS-R. Такие олигонуклеотиды могут быть введены в клетки с помощью вышеприведенного подхода с использованием рекомбинантного вируса, в котором вторая последовательность, входящая в этот вирус, является олигонуклеотидной последовательностью.
Другая возможность состоит в использовании антител против белка MORT-1, которые подавляют его активность в процессе передачи внутриклеточных сигналов.
Еще один, недавно разработанный способ подавления действия лиганда FAS основан на использовании рибозима. Рибозимы являются каталитически активными молекулами РНК, которые специфически расщепляют РНК. Можно создать рибозимы, расщепляющие конкретную РНК, например мРНК, кодирующую белок MORT-1 данного изобретения. Такие рибозимы должны иметь последовательности, специфические для мРНК MORT-1, и обладать способностью взаимодействовать с ней по комплементарному механизму с последующим расщеплением этой мРНК. Это приводит к снижению (или полной утрате) экспресси белка MORT-1, причем уровень снижения экспрессии зависит от уровня экспрессии рибозима в клетках-мишенях. Для введения рибозимов в нужные клетки (например, несущие FAS-R) можно использовать любой подходящий вектор, например плазмиду, векторы вирусов животных (ретро-вирусы), которые обычно используют для этой цели (см. выше (i), где вирус имеет в качестве второй последовательности кДНК, кодирующую рибозим с выбранной последовательностью). (Обзоры, методы и т.п., касающиеся рибозимов, смотри в Chen et al., 1992; Zhao and Pick, 1993; Shore et al., 1993; Joseph and Burke, 1993; Shimayama et al., 1993; Cantor et al., 1993; Barinaga, 1993; Crisell et al., 1993 and Koizumi et al., 1993).
(iii) Они могут быть использованы для выделения, идентификации и клонирования других белков, которые способны связываться с ними, например других белков, участвующих в цепи процессов передачи внутриклеточных сигналов, индуцируемых внутриклеточным доменом TNF-R или FAS-R. Например, белок МОRТ-1, а именно кодирующая его последовательность ДНК, может быть использована в системе дрожжевых дигибридов (см. ниже. Пример 1), в которой последовательность для белка MORT-1 будет использоваться как "наживка" для выделения, клонирования и идентификации в кДНК или ДНК библиотеки генов других последовательностей ("жертв"), кодирующих белки, которые могут связываться с MORT-1. Таким же способом можно определить, может ли белок MORT-1 данного изобретения связываться с другими клеточными белками, например другими рецепторами из суперсемейств рецепторов TNF/NGF.
(iv) Белок MORT-1, его аналоги, фрагменты или производные могут быть использованы также для выделения, идентификации и клонирования других белков такого же класса, т.е. таких, которые связываются с внутриклеточным доменом FAS-R или с функционально родственными рецепторами и участвуют в процессе передачи внутриклеточных сигналов. Для этой цели может быть использована упомянутая выше система дрожжевых дигибридов или недавно разработанная система, основанная на использовании нестрогой Саузерн-гибридизации с последующим клонированием с помощью PCR (Wilks et al., 1989). В публикации Уилкса и др. описана идентификация и клонирование предполагаемых протеин-тирозинкиназ с помощью нестрогой Саузерн-гибридизации с последующим клонированием с помощью PCR, основанном на известной последовательности основной части киназы, характерной для киназы. Согласно данному изобретению этот подход может быть применен при использовании последовательности, кодирующей белок MORT-1, для выделения и клонирования родственных белков, связывающих внутриклеточные домены FAS-R.
(v) Еще один подход с использованием белка MORT-1, его аналогов, фрагментов или производных состоит в применении их в методах аффинной хроматографии для выделения и идентификации других белков или факторов, с которыми они способны связываться, например других рецепторов, родственных рецептору FAS-R, или других белков или факторов, участвующих в процессе передачи внутриклеточных сигналов. При таком применении белка MORT-1, его аналогов, фрагментов или производных данного изобретения каждый из них индивидуально можно присоединять к матрицам для аффинной хроматографии. Затем с этими иммобилизованными белками инкубируют экстракты, или выделенные белки, или факторы, предположительно участвующие в передаче внутриклеточных сигналов. После завершения процедуры аффинной хроматографии эти другие белки и факторы, которые связались с белком MORT-1, его аналогами, фрагментами или производными данного изобретения, можно элюировать, выделить и охарактеризовать.
(vi) Как отмечено выше, белок MORT-1, его аналоги, фрагменты или производные этого изобретения можно также использовать в качестве иммуногенов (антигенов) для получения антител против них. Эти антитела также могут быть использованы для целей очистки белка MORT-1 или из клеточных экстрактов, или из линий трансформированных клеток, синтезирующих белок MORT-1, его аналоги или фрагменты. Далее, эти антитела можно использовать для целей диагностики при идентификации расстройств, связанных с ненормальным функционированием системы лиганда FAS, например с клеточными эффектами, индуцируемыми сверхактивным или низкоактивным лигандом FAS-R. Таким образом, при расстройствах, связанных с ненормальным функционированием системы передачи внутриклеточных сигналов, в которых участвует белок MORT-1, такие антитела будут служить в качестве важного средства диагностики.
(vii) MORT-1 можно также использовать в качестве косвенного модулятора ряда других белков благодаря его способности связываться с другими внутриклеточными белками (так называемые белки связывания МОRТ-1), которые в свою очередь прямо связывают другие внутриклеточные белки или внутриклеточный домен трансмембранного белка. Примером такого белка или такого внутриклеточного домена является хорошо известный рецептор TNF р55, внутриклеточные сигналы от которого модулируются рядом других белков, непосредственно связывающихся с его внутриклеточным доменом (см. заявку IL 109632). Фактически мы выделили такой белок, связывающий МОRТ-1 (см. ниже и Пример 2), который связывается с внутриклеточным доменом рецептора TNF р55.
С целью модулирования этих других внутриклеточных белков или внутриклеточных доменов трансмембранных белков белок MORT-1 можно вводить в клетку с помощью ряда способов, упомянутых выше (ii).
Следует отметить также, что выделение, идентификация и характеристика белка МОRТ-1 этого изобретения может быть выполнена с помощью различных хорошо известных процедур скрининга. Например, одна из этих процедур скрининга, процедура дрожжевых дигибридов, изложенная здесь (Пример 1), была использована для идентификации белка MORT-1 этого изобретения. Точно так же, как указано выше и далее, могут быть использованы другие процедуры, например аффинная хроматография, процедуры гибридизации ДНК и другие известные процедуры, для выделения, идентификации и характеристики белка МОRТ-1 этого изобретения или для выделения, идентификации и характеристики других белков, факторов, рецепторов и т.п., которые способны связываться с белком МОRТ-1 этого изобретения.
Далее, следует также подчеркнуть, чток свойствам белка МОRТ-1 относится его способность связываться с FAS-IC, а также способность к самоассоциации. МОRТ-1 способен также активировать собственную цитотоксичность клетки, активность, связанную с его способностью к самоассоциации. По-видимому (см. Пример 1), участок в МОRТ-1, который связывается с FAS-IC, отличается от участка МОRТ-1, который принимает участие в самоассоциации. МОRТ-1 может иметь также другие типы активности, связанные с функцией разных вышеуказанных участков молекулы МОRТ-1, или каких-то других участков молекулы, или их различных комбинаций. Эти другие типы активности могут быть ферментативными или относиться к связыванию других белков (например, белков, связывающих МОRТ-1, или других рецепторов, факторов и т.п.). Таким образом, МОRТ-1 может быть использован в вышеуказанных методах модуляции действия лиганда FAS-R или клеточных эффектов, опосредуемых МОRТ-1, или он может быть использован для модуляции других клеточных процессов передачи сигналов, связанных с другими рецепторами, факторами и т.п.
Более конкретным в данном аспекте изобретения является то, что сама молекула ДНК, кодирующая МОRТ-1, или ее мутантная форма (Т.е. ДНК, кодирующая аналоги или активные фрагменты МОRТ-1) могут быть использованы в генной терапии (т.е. способами, изложенными выше в (i) и (ii) для модуляции активности FAS-R (или модуляции либо опосредования действия лиганда FAS на клетки). Кроме того, поскольку MORT-1 оказывает также цитотоксическое действие на клетки, эти молекулы ДНК или их мутантные варианты, кодирующие MORT-1, могут быть использованы в генной терапии для модуляции действия MORT-1 на клетки (в том числе с применением способов, описанных выше в (i) и (ii)). В этих приложениях для генной терапии MORT-1, его аналоги и производные могут быть использованы тремя способами:
(a) целый белок МОRТ-1, его аналоги, производные или активные фрагменты, которые способны связываться как с FAS-IC, так и с MORT-1 (т.е. содержат две области MORT-1, одна из которых участвует в связывании с FAS-IC, а другая участвует в самоассоциации МОRТ-1), могут быть использованы для модуляции эффектов, связанных с FAS-R и MORT-1;
(b) часть белка MORT-1, аналоги, производные и активные фрагменты этой части MORT-1, которые связываются с FAS-IC, могут быть использованы для индукции "доминантного негативного" эффекта на FAS-IC, т.е. для подавления клеточных эффектов, опосредуемых FAS-R, или могут быть использованы для индукции "наращивания функции" действия на FAS-IC, т.е. увеличения клеточных эффектов, опосредуемых FAS-R; и
(c) часть молекулы MORT-1, аналоги, производные и активные участки этой части, которые специфически связываются с MORT-1, могут быть использованы для индукции "доминантных негативных" эффектов на MORT-1, т.е. либо подавления, либо увеличения клеточных эффектов, связанных с MORT-1.
Как изложено выше в (vi), белок MORT-1 может быть использован для получения антител к MORT-1. Эти антитела или их фрагменты могут быть использованы, как это детально описано ниже, при этом понятно, что эти применения антител или их фрагментов касаются специально MORT-1.
Что касается упомянутых здесь антител, то термин "антитела" всюду обозначает поликлональные антитела; моноклональные антитела (mAb); химерные антитела; идиотипы антител (анти-Id) против антител, которые могут быть помечены в растворимой или связанной форме; а также их фрагменты, полученные с помощью известных методов, например, таких как ферментативное расщепление, синтез пептидов или рекомбинантная технология и других.
Поликлональные антитела являются гетерогенной популяцией молекул антител из сыворотки животных, иммунизированных антигеном. Моноклональные антитела содержат по существу гомогенную популяцию антител к данным антигенам, в которой все антитела содержат связывающие участки по существу к одному и тому же эпитопу. MAb можно получить с помощью методов, известных специалистам в этой области. Смотри, например, Kohler and Milstein, Nature, 256: 495-497 (1975); US Patent No. 4376110; Ausubel et al., eds., Harlow and Lane ANTIBODIES: A LABORATORY MANUAL, Cold Spring Harbor Laboratory (1988); and Colligan et al., eds.. Current Protocols in Immunology, Greene publishing Assoc. and Wiley Interscience N.Y. (1992, 1993), здесь содержится практически полный перечень ссылок по данному вопросу. Такие антитела могут относиться к любому классу иммуноглобулинов, включая IgG, IgM, IgE, IgA, GILD, и любому из их подклассов. Гибридомы, синтезирующие mAb данного изобретения, можно культивировать in vitro, in situ или in vivo. В настоящее время предпочтительны методы продукции mAd in vivo или in situ ввиду высокого титра антител, синтезируемых с помощью этих методов.
Молекулы химерных антител состоят из разных участков, происходящих из различных видов животных, например имеют вариабильную область из мышиных mAb и константную область иммуноглобулина человека. Химерные антитела используют главным образом для уменьшения иммуногенности при их применении и для увеличения выхода при их получении, например, когда выход мышиных mAb из гибридом выше, но и выше их иммуногенность на человеке, тогда используют химерные mAb человек/мышь. Химерные антитела и методы их получения известны специалистам (Cabilly et al., Proc. Natl. Acad. Sci. USA 81:3273-3277 (1984); Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984); Boulianne et al., Nature 312:643-646 (1984); Cabilly et al., European Patent Application 125023 (опубликован 14 ноября 1984); Neuberger et al., Nature 314: 268-270 (1985); Taniguchi et al., European Patent Application 171496 (опубликован 19 февраля 1985); Morrison et al., European Patent Application 173494 (опубликован 5 марта 1986); Neuberger et al., PCT Application WO 8601533 (опубликован 13 марта 1986); Kudo et al., European Patent Application 184187 (опубликован 11 июня 1986); Sahagan et al., J. Immunol. 137:1066-1074 (1986); Robinson et al., International Patent Application No. WO 8702671 (опубликован 7 мая 1987); Liu et al., Proc. Natl. Acad. Sci. USA 84:3439-3443 (1987); Sun et al., Proc. Natl. Acad. Sci USA 84:214-218 (1987); Better et al., Science 240:1041-1043 (1988); and Harlow and Lane, ANTIBODIES: A LABORATORY MANUAL, дано выше). В этом перечне содержатся практически все ссылки по данному вопросу.
Антитела против идиотипов (анти-Id) являются антителами, которые распознают уникальные детерминанты, обычно находящиеся в антигенсвязывающем участке антитела. Антитела против Id можно получить путем иммунизации животных того же вида и генотипа (например, линии мышей), как и животное, служащее источником mAb, моноклональными антителами mAb, против которых приготавливают анти-Id. Иммунизированные животные будут распознавать и реагировать на идиотипические детерминанты антител, взятых для иммунизации, и синтезировать антитела к этим идиотипическим детерминантам (анти-Id антитела). Смотри, например, US Patent No. 4699880, в который входят практически все ссылки по данному вопросу.
Антитела анти-Id можно использовать также в качестве "иммуногена" для индукции иммунного ответа у других животных, синтезирующих так называемые анти-анти-Id антитела. Анти-анти-Id антитела могут распознавать эпитопы, идентичные эпитопам исходных mAb, которые индуцировали анти-Id. Таким образом, используя антитела к идиотипическим детерминантам mAb, можно идентифицировать другие клоны, экспрессирующие антитела с идентичной специфичностью.
В соответствии с этим mAb, полученные против белка MORT-1, его аналогов, фрагментов или производных данного изобретения, можно использовать для индукции анти-Id антител в соответствующих животных, например мышах BALB/c. Клетки из селезенки таких иммунизированных животных используются для получения гибридом, секретирующих анти-Id mAb. Далее, анти-Ib mAb можно привязать к носителю, например, гемоцианину из фиссуреллы (KLH) и использовать для иммунизации других мышей BALB/c. Сыворотка из этих животных будет содержать анти-анти-Id антитела, которые имеют связывающие свойства исходных mAb против эпитоп вышеуказанного белка MORT-1, его аналогов, фрагментов или производных.
Таким образом, анти-Id mAb имеют собственные идиотипические эпитопы, или "идиотопы", структурно сходные с выявленными эпитопами, например, как у GRB белка-α.
Термин "антитело" обозначает как интактные молекулы, так и их фрагменты, например, Fab и F(ab′)2, которые способны связывать антиген. Fab и F(ab′)2 фрагменты, не имеющие Fc фрагмента интактного антитела, по понятным причинам быстрее выходят из циркуляции и могут иметь меньшую тканевую специфичность, чем интактные антитела (Wahl et al., J. Nucl. Med. 24:316-325 (1983)).
Необходимо понимать, что Fab и F(ab′)2 фрагменты и другие фрагменты антител, пригодные для данного изобретения, могут быть использованы для обнаружения и количественного определения белка MORT-1 с помощью методов, предложенных здесь для интактных молекул антител. Такие фрагменты обычно получают путем протеолитического расщепления, используя ферменты, такие как папаин (для получения Fab фрагментов) или пепсин (для получения F(ab′)2 фрагментов).
Говорят, что антитело "способно связывать" молекулу, если оно способно специфически реагировать с этой молекулой путем ее связывания антителом. Термин "эпитоп" обозначает участок любой молекулы, который может распознаваться этим антителом и связываться им. Эпитопы или "антигенные детерминанты" обычно состоят из химически активных группировок на поверхности молекулы, например аминокислот или боковых цепей сахаров, и имеют специфическую трехмерную структуру, а также специфический заряд.
"Антиген" является молекулой или частью молекулы, которую способно связывать антитело, и, кроме того, способной индуцировать у животного синтез антител, способных связываться с эпитопом этого антигена. Антиген может иметь один или более эпитоп. Указанная выше специфическая реакция означает, что антиген будет реагировать высоко селективным образом с соответствующим антителом, но не реагирует с множеством других антител, которые можно индуцировать другими антигенами.
Антитела, включая и фрагменты антител, нужные для данного изобретения, могут быть использованы для количественного и качественного определения MORT-1 в образце, или для обнаружения клеток, которые экспрессируют MORT-1 данного изобретения. Это можно сделать с помощью методов иммунофлюоресцентного анализа с использованием антител, меченых флюоресцирующими красителями (см. ниже) при помощи световой микроскопии, проточной цитометрии или флюорометрии.
Антитела (или их фрагменты), пригодные для данного изобретения, могут быть использованы для гистологического исследования с помощью иммунофлюоресцентной или иммуноэлектронной микроскопии, например для обнаружения in situ MORT-1 данного изобретения. Обнаружение in situ может быть выполнено путем получения гистологического образца от пациента и обработки этого образца мечеными антителами данного изобретения. Биологический образец или прямо обрабатывается меченым антителом (или фрагментом) против данного антигена, или сначала соответствующим немеченым антителом, а затем вторым меченым антителом против первого антитела. При использовании такой процедуры удается определить не только присутствие MORT-1, но также и его распределение в исследуемой ткани. Используя данное изобретение, любой специалист поймет, что любые самые разные гистологические методы (например, процедуры окрашивания) можно модифицировать применительно к обнаружению in situ.
Такие тесты МОRТ-1 данного изобретения, как правило, включают инкубацию биологического образца, например биологической жидкости, экстракта из ткани, свежевыделенных клеток, таких как лимфоциты или лейкоциты, или клеток, инкубируемых в культуре в присутствии нужного количества меченых антител, способных идентифицировать белок MORT-1, и обнаружение этих антител каким-либо из ряда хорошо известных методов.
Биологический образец можно нанести на твердую подложку или носитель, например нитроцеллюлозу или другую твердую подложку или носитель, которые обладают способностью иммобилизировать клетки, частицы клеток или растворимые белки. Эту подложку или носитель затем можно промыть соответствующим буфером, после чего обработать мечеными антителами согласно данному изобретению, как указано выше. Жесткую подложку или носитель можно затем промыть второй раз буфером для удаления несвязавшихся антител. Количество связанной метки на указанной подложке или носителе затем можно обнаружить соответствующими способами.
"Твердофазная подложка", "твердофазный носитель", "жесткая подложка", "жесткий носитель", "подложка" или "носитель" служат для обозначения подложки или носителя, способных связывать антиген или антитела. Хорошо известными подложками или носителями являются стекло, полистерол, полипропилен, полиэтилен, декстран, нейлон амилазы, природная или модифицированная целлюлоза, полиакриламиды, габро и магнетиты. Для целей данного изобретения природные носители могут быть растворимыми в некоторой степени или нерастворимыми. Материал подложки может иметь любую возможную структурную форму, но такую, чтобы его молекулы обладали способностью связываться с антигеном или антителом. Так, форма подложки или носителя может быть сферической в виде шариков, цилиндрической с внутренней поверхностью выверенной трубочки или с внешней поверхностью палочки, или их поверхность может быть плоской, как у листка выверенной полоски, и т.п. Предпочитают подложки или носители в виде шариков из полистерола. Специалистам в данной области, возможно, известны другие удобные носители для связывания антител или антигенов, или они могут выбрать их путем рутинной экспериментальной проверки.
Связывающую активность данной партии антител этого изобретения, как отмечено выше, можно определить с помощью хорошо известных методов. Специалист может определить оперативные и оптимальные условия для такого рода испытаний, применяя рутинные экспериментальные проверки.
В эти испытания могут быть введены другие этапы, такие как промывка, помешивание, встряхивание, фильтрование и т.п., как принято или как необходимо в каждом отдельном случае.
Один из способов, с помощью которого может быть помечено антитело согласно данному изобретению, состоит в присоединении к нему фермента и использования иммуноферментного анализа (EIA). Этот фермент затем при взаимодействии с соответствующим субстратом будет реагировать с этим субстратом, и образовавшийся химический продукт реакции может быть обнаружен, например, с помощью спектрофотометрии, флюорометрии или визуально. Ферменты, которые используются для мечения антител, включают, например, малатдегидрогеназу, нуклеазу из стафилококка, дельта-5-стероидизомеразу, дрожжевую алкогольдегидрогеназу, альфаглицерофосфатдегидрогеназу, триозофосфатизомеразу, пероксидазу хрена, щелочную фосфатазу, аспарагеназу, глюкозоксидазу, бета-галактозидазу, рибонуклеазу, уреазу, каталазу, глюкозо-6-фосфатдегидрогеназу, глюкоамилазу, ацетилфолинэстеразу и др. ферменты.
Обнаружение антитела может быть выполнено с помощью хромометрических методов, основанных на выявлении хромогенного субстрата фермента. Обнаружение можно также выполнить путем визуального сравнения величины ферментативной реакции субстрата со стандартным образцом, приготовленным сходным способом.
Выявление антитела можно также выполнить с помощью других различных методов иммунологического анализа. Например, с помощью меченых радиоактивной меткой антител или фрагментов антител удается обнаружить R-PTPase с помощью радиоиммунологического анализа (PIA). Хорошее описание PIA можно найти в кн. Laboratory Techniques and Biochemistry in Molecular Biology, by Work, T.S. et al., North Holland Publishing Company, NY (1978), специально обратившись к главе "An Introduction to Radioimmune Assay and Related Techniques" by Chard, Т., где имеются соответствующие ссылки. Радиоактивный изотоп можно регистрировать с помощью γ-счетчиков, сцинцилляционных счетчиков или с помощью радиоавтографии.
Антитела данного изобретения можно также пометить флюоресцирующим соединением. Меченые флюоресцентной меткой антитела при облучении светом соответствующей длины волны можно обнаруживать по их флюоресценции. Наиболее часто используемыми соединениями для флюоресцентной метки являются флюоресцеин, изотиоцианат, родамин, фикоэретрин, фикоцианин, аллофикоцианин, о-фтальдегид и флюоресцамин.
Антитела можно также пометить флюоресцирующими металлами, например, 152E или другими из серии лантанидов. Эти металлы можно присоединить к антителу с помощью хелирующих металл групп, например диэтилентриаминпентауксусной кислоты (ЕТРА).
Антитело можно пометить также, присоединяя к нему хемилюминесцирующее соединение. Присутствие антитела, промаркированного хемилюминесцирующим веществом, можно определить по наличию флюоресценции, которая возникает при химической реакции. Примерами особенно удобных в качестве метки хемилюминесцирующих соединений являются люминол, изолюминол, хлоргидрат акридил, имидазол, тероматический сложный эфир акридиниевой кислоты, диэтиловый эфир щавелевой кислоты.
Антитело данного изобретения можно пометить также соединением, способным к биолюминесценции. Биолюминесценция является разновидностью хемилюминесценции, обнаруживаемой в биологических системах, при которой белок-катализатор усиливает реакцию хемилюминесценции. Присутствие биолюминесцентного белка определяют по наличию люминесценции. Важными биолюминесцентными соединениями в качестве метки являются люциферин, люцифераза и акварин.
Молекулы антител данного изобретения могут быть приспособлены для использования в иммунометрическом тесте, известном также как "двухсайтовый", или "сендвич"-тест. В типичном иммунометрическом тесте определенное количество немеченых антител (или фрагментов антител) связывают с жесткой подложкой или носителем, и затем добавляется определенное количество меченых антител, что позволяет обнаружить и/или оеределить количество тройного комплекса, образованного антителом в твердой фазе, антигеном и меченым антителом.
Типичный и предпочтительный иммунометрический тест включает "ранний" тест, в котором антитело, связанное с твердой фазой, сначала взаимодействует с испытываемым образцом, что позволяет экстрагировать антиген из образца путем образования бинарного комплекса антитело-антиген в твердой фазе. После необходимого периода инкубации твердую подложку или носитель промывают для удаления материала жидкого образца, в том числе и непрореагировавшего антигена, если таковой имеется, и погружают в раствор, содержащий неизвестное количество меченых антител (которые функционируют как "сигнальные молекулы"). После второго периода инкубации, в котором меченые антитела образуют комплекс с антигеном, связанным с твердой подложкой или носителем немечеными антителами, твердую подложку или носитель промывают второй раз для удаления непрореагировавших меченых антител.
В другом типе "сендвич"-теста, который также может быть пригодным для антигенов данного изобретения, используются так называемые "единовременный" и "обратный" тесты. Единовременный тест включает один этап инкубации, так как и антитела, связанные с твердой подложкой или носителем, и меченые антитела одновременно добавляются к испытываемому образцу. После завершения периода инкубации твердая подложка или носитель отмываются для удаления остатка жидкого образца и непрореагировавших меченых антител. Наличие меченых антител, связанных с твердой подложкой или носителем, затем определяют, так же как это делается в "раннем" сендвич-тесте.
В обратном тесте используется поэтапное добавление сначала раствора меченых антител к жидкому образцу, затем, после необходимого периода инкубации, добавляются немеченые антитела, связанные с твердой подложкой или носителем. После второго периода инкубации твердую фазу промывают соответствующим способом для удаления остатков испытываемого образца и непрореагировавших меченых антител. Определение меченых антител, связавшихся с твердой подложкой или носителем, затем осуществляют, как в "раннем" и "единовременном" тестах.
MORT-1 этого изобретения можно получить с помощью стандартной процедуры рекомбинантной технологии (см., например, Sambrook, et al., 1989), в которой соответствующие эукариотические или прокариотические клетки-хозяина трансформируются подходящими эукариотическими или прокариотическими векторами, содержащими последовательности, кодирующие эти белки. В соответствии с этим данное изобретение касается также таких векторов экспрессии и трансформированных клеток-хозяина для синтеза белков этого изобретения. Как упомянуто выше, в число этих белков входят также их биологически активные аналоги, фрагменты и производные, и в соответствии с этим в число векторов, кодирующих их, входят векторы, кодирующие аналоги и фрагменты этих белков, а в число трансформированных клеток-хозяина входят клетки, синтезирующие такие аналоги и фрагменты. Производными этих белков являются производные, полученные путем стандартной модификации белков, их аналогов или их фрагментов, синтезируемых трансформированными клетками-хозяина.
Данное изобретение касается также фармацевтических составов, в которые входит рекомбинантные векторы вирусов животных, кодирующие белок MORT-1. Эти векторы кодируют также белок оболочки вируса, способный специфически связываться с белками поверхности клетки-мишени (например, опухолевой клетки) так, чтобы осуществилось введение последовательности для MORT-1 в клетку. Другие аспекты этого изобретения даны в следующих примерах.
Теперь это изобретение будет описано более детально в следующих примерах, не ограничивающих рамки изобретения, и соответствующих фигурах.
ПРИМЕР 1: КЛОНИРОВАНИЕ И ВЫДЕЛЕНИЕ БЕЛКА MORT-1, КОТОРЫЙ СВЯЗЫВАЕТСЯ С ВНУТРИКЛЕТОЧНЫМ ДОМЕНОМ FAS-R
(i) Скрининг в дигибридной системе и тест экспрессии β-галактозидазы в дигибридной системе
Для выделения белков, взаимодействующих с внутриклеточным доменом FAS-R, использована дрожжевая дигибридная система (Fields and Song, 1989; смотри также совместные заявки IL 109632, 112002 и 112692). В кратком изложении эта дигибридная система представляет собой генетический анализ в дрожжевых клетках, позволяющий обнаружить специфические взаимодействия типа белок-белок in vivo по восстановлению функции эукариотического активатора транскрипции, такого как GAL4, который имеет два разных домена - домен связывания ДНК и домен активации. При экспрессии этих доменов и их воссоединении образовавшийся восстановленный белок GAL4 способен связываться с 5-районом активирующей последовательности, что в свою очередь активирует промотор, который контролирует экспрессию сигнального гена, например, lac Z или HIS3. Экспрессию этих генов легко наблюдать в культивируемых клетках. В этой системе гены двух белков, взаимодействие которых исследуется, клонируются в двух разных векторах экспрессии. В одном векторе экспрессии последовательность для одного из этих белков клонируется вместе с последовательностью для домена связывания ДНК белка GAL4, что приводит к образованию гибридного белка, содержащего домен связывания ДНК GAL4. В другом векторе последовательность для другого белка клонируется вместе с доменом активации GAL4. Этими двумя векторами совместно трансформируют клетки-хозяина дрожжевого штамма, имеющего сигнальный ген lас Z или HIS3, находящийся под контролем 5′-района участков связывания GAL4. Сигнальный ген будет экспрессироваться только в тех трансформированных клетках-хозяина (котрансформантах), в которых оба гибридных белка экспрессируются и способны взаимодействовать друг с другом. Когда сигнальным геном является lас Z, клетки-хозяина, в которых он экспрессируется, будут окрашиваться в голубой цвет при добавлении в культуру Х-gаl. Следовательно, наличие колоний голубого цвета указывает на то, что два исследуемых клонированных белка способны взаимодействовать друг с другом.
Используя эту систему дигибридов, внутриклеточный домен FAS-IC клонировали отдельно в векторе pGBT9 (несущем последовательность связывания ДНК GAL4, получен в CLONTECH, USA, смотри ниже), чтобы получить слитый белок с доменом связывания ДНК GAL4. Для клонирования FAS-R в pGBT9 использовали клон, кодирующий полноразмерную последовательность кДНК для FAS-R (смотри совместную заявку IL 111125), из которого с помощью стандартной процедуры с использованием различных рестриктаз был вырезан участок, кодирующий внутриклеточный домен IС. Затем этот клон выделили и вставили в вектор pGBT9, разрезанный соответствующими рестриктазами в области множественных сайтов клонирования (MCS). Следует отметить, что FAS-IC занимает участок в интактном FAS-R от 175 до 319 остатка, причем именно этот участок FAS-IC был вставлен в вектор pGBT9 (смотри также IL 111125).
Вышеуказанный гибридный (химерный) вектор вместе с кДНК из библиотеки генов клеток человека HeLa, клонированный в векторе pGADGH, несущем домен активации GAL4, были использованы для совместной трансфекции дрожжей штамма HF7 (все вышеуказанные векторы - pGBT9 и pGADGH, несущие библиотеку кДНК клеток HeLa, а также штамм дрожжей были взяты из Clontech Laboratories, Inc., USA, в качестве составной части системы MATCHMAKER Two-Hybrid System, #PT1265-1).
У совместно трансфецированных дрожжей провели селекцию на способность расти в среде, не содержащей гистидии (среда His-), при этом растущие клоны указывали на наличие позитивных трансформантов. Отселектированные дрожжевые клоны затем испытывали на способность экспрессировать ген lac Z, т.е. на активность LAC Z в них. Это делали, добавляя в культуральную среду X-gal, которая под действием β-галактозидазы - фермента, кодируемого геном lac Z, распадается с образованием продукта голубого цвета.
Таким образом, голубые колонии указывают на активность в них гена lас Z. Для активности гена lac Z необходимо, чтобы активатор транскрипции GAL4 находился в активной форме в трансформированных клонах, а именно чтобы связывающих ДНК домен, кодируемый вышеуказанным гибридным вектором, должным образом соединялся с доменом активации GAL4, кодируемым другим гибридным вектором. Такое соединение возможно только в том случае, если два белка, слитые соответственно с разными доменами GAL4, обладали способностью устойчиво взаимодействовать (связываться) друг с другом. Таким образом, выделенные His+ и голубые (LAC Z+) колонии являются колониями, которые совместно трансформированы вектором, кодирующим FAS-IC, и вектором, кодирующим белковый продукт из клеток человека HeLa, способный устойчиво связываться с FAS-IC.
ДНК плазмиды из вышеуказанных His+, LAC Z+ колоний дрожжей была выделена и путем электропорации введена в E.coli штамм НВ101 с помощью стандартной процедуры, и затем были отобраны трансформанты Leu+ и резистентные к ампицилину, причем эти трансформанты несут гибридный вектор pGADGH, который имеет кодирующие последовательности для АmрR и Leu2. Следовательно, такие трансформанты являются клонами, несущими последовательности, кодирующие новые идентифицированные белки, способные связываться с FAS-IC. ДНК плазмиды затем была выделена из этих трансформированных клеток E.coli и еще раз протестирована следующим образом:
(а) путем ретрансформации ей совместно с исходной гибридной плазмидой, кодирующей FAS-R (гибрид pGTB9, несущей FAS-IS), дрожжей штамма HF7, как было описано выше. В контроле для совместной трансформации были использованы векторы, несущие последовательности, кодирующие ненужный белок, например, рАСТ-ламин, или только рСтВТ9 совместно с плазмидой, кодирующей белок, связывающий FAS-IC (т.е. MORT-1). Совместно трансформированные дрожжевые клетки затем были испытаны на способность расти в среде His- или в этой среде с добавками различных количеств 3-аминотриазола; и
(в) путем ретрансформации дрожжевых клеток-хозяина штамма SFY526 ДНК плазмидой и исходной гибридной плазмидой с FAS-IC и контрольными плазмидами, описанными в (а), с последующим определением активности LAC Z+ (эффективности образования β-gal, т.е. образования голубых колоний).
Результатами вышеуказанных тестов выявлено, что характер роста колоний в среде His- был идентичен характеру активности LAC Z, так как испытанные окрашенные колонии, т.е. колонии His+, имели также и фенотип LAC Z+. Далее, активность LAC Z в жидкой среде (предпочтительные условия культивирования) тестировали после трансфекции гибридными плазмидами с доменом связывания ДНК GAL4 и доменом активации в дрожжевых клетках SFY256, которые характеризуются лучшей индуцибельностью LAC Z активатором транскрипции GAL4, чем дрожжевые клетки-хозяина HF-7.
С помощью вышеуказанной процедуры был идентифицирован, выделен и охарактеризован белок, называвшийся HF-1 и названный теперь MORT-1, "Mediator of Receptor-induced Toxicity".
Следует также упомянуть, что в ряде вышеприведенных тестов экспрессии β-галактозидазы в дигибридной системе экспрессию β-галактозидазы тестировали с помощью теста на фильтрах. При скрининге было обнаружено, что 5 из 3×106 молекул кДНК содержат вставку MORT-1. Выделенные таким образом клонированные вставки кДНК MORT-1 были секвенированы с помощью стандартных процедур определения последовательностей ДНК.
Аминокислотную последовательность MORT-1 получили из последовательности нуклеотидов в ДНК. Аминокислотные остатки в белках пронумеровывали, как это делается в банке данных Swiss-Prot.
Мутанты с деляциями получали с помощью PCR, а точковые мутанты - с помощью мутагенеза, направляемого олигонуклеотидами (Current Protocols in Molec. Biol., 1994).
(ii) Индуцированная экспрессия, метаболическое мечение и иммунопреципитация белков.
MORT-1, присоединенный N-концом к октопептиду FLAG (FLAG-HF-1; Eastman Kodak, New Haven, Ct., USA), химеру FAS-IC, FAS-R, p55-R, включающую экстраклеточный домен p55R (аминокислоты с 1 по 168), слитый с трансмембранным и внутриклеточным доменом FAS-R (аминокислоты с 153 по 319), и кДНК люциферозы, служащую для контроля, экспрессировали в клетках HeLa. Экспрессию выполняли, используя вектор экспрессии, контролируемый тетрациклином, в клоне клеток HeLa (HtTA-1), в котором экспрессируется контролируемый тетрациклином трансактиватор (Gossen and Bujard, 1992; как описано в PCT/US95/05854; смотри также Boldin et al., 1995). Метаболическое мечение [35S]-метионином и [35S]-цистеином (DUPONT, Wilmington, De., USA and Amersham, Buckinghamshire, England) проводили через 18 ч после трансфекции в течение 4 ч при 37°С в среде Игла, модифицированной Дульбекко, не содержащей метионин и цистеин, но дополненный 2%-ной диализованной эмбриональной телячьей сывороткой. Затем клетки лизировали в буфере RIPA (10 мм Tris-HCl, pH 7,5, 150 мМ NCl, 1% NP-40, 1% дезоксихолаха, 0,1% SDS и 1 мМ EDTA), и лизат предварительно просветляли путем инкубации с балластной кроличьей антисывороткой (3 мкл/мл) и шариками Сефарозы с G белком (Pharmacia, Uppsala, Sweden; 60 мкл/мл). Иммунопреципитацию выполняли путем инкубации в течение 1 ч при 4°С 0,3 мл лизата с мышиными моноклональными антителами (5 мкл/на пробу) против октопептида FLAG (M2; Eastman Kodak), pp 55-P (#18 и #20; (Engelmann et al., 1990)), или FAS-R (ZB4; Kamiya Southand Oaks, Ca., USA), или с соответствующими изотипическими мышиными антителами в качестве контроля, с последующей инкубацией в течение 1 ч с шариками Сефарозы, нагруженными G белком.
(iii) Связывание in vitro
Приготавливали глютатион S-трансферазу, слитую с Fas-IC дикого типа или мутанным Fas-IC, и адсорбировали ее на шариках с глютатионом (как описано в IL 109632, 111125, 112002, 112692; смотри также Boldin et al., 1995; Current protocols in molecular biology, 1994; Frangioni and Neel, 1993). Связывание метаболически меченого слитого белка FLAG-HF-1 с CST-Fas-IC оценивали путем инкубации шариков в течение 2 ч при 4°С с экстрактами клеток HeLa, метаболически мечеными по [35S]-метионину (60 мк Кю/мл), которые экспрессируют FLAG-HF-1. Экстракты готовили в буфере, содержащем 50 мМ Tris-HCl, рН 7,5, 150 мМ NaCl, 0,1% NP-40, 1 мМ дитиотриэтола, 1 мМ EDTA, 1 мМ фенилметилсульфонилфторида, 20 мкг/мл апротонина, 20 мкг/мл лейпептина, 10 мМ фторида натрия и 0,1 мМ ванадата натрия (1 мл на 5×105 клеток).
(iv) Анализ цитотоксичности, запускаемой индуцированной экспрессией HF-1.
кДНК HF1, Fas-IC, p55-IC и люциферазы вставляли в контролируемый тетрациклином вектор экспрессии и им трансфецировали клетки НtТА-1 (линия клеток HeLa) (Grossen and Bujard, 1992) совместно с кДНК секретируемой щелочной фосфатазы плаценты, поставленной под контроль промотора SV40 (вектор pSBC-2 ((Dirks et al., 1993)). Гибель клеток оценивали через 40 ч после трансфекции в тесте по поглощению клетками нейтрального красного (Wallach, 1984) или для специфической оценки гибели тех клеток, которые экспрессируют трансфецированную кДНК, путем определения количества щелочной фосфатазы из плаценты, секретируемой в ростовую среду на 5-й ч инкубации.
В другой серии экспериментов с целью анализа области белка MORT-1 (HF-1), участвующей в связывании с FAS-IC, в клетках HeLa, которые содержат контролируемый тетрациклином трансактиватор (HtTA-1), индуцировали временную экспрессию следующих белков, используя контролируемый тетрациклином вектор экспрессии (pUHD 10-3): только FAS-R человека; FAS-R, а также N-концевую часть МОRТ-1 (аминокислоты с 1 по 117, "головная часть MORT-1"); FAS-R человека, а также С-концевую часть MORT-1, которая содержит гомологичную область его "домена гибели" (аминокислоты с 130 по 245, "MORT-100", смотри также IL 112742); FLAG-55.11 (аминокислоты 309-900 белка 55.11, слитого его N-концом с октопептидом FLAG, причем 55.11 является белком специфического связывания р55-IС, смотри также IL 109632). Через 12 ч после трансфекции клетки собрали трипсинизированием и вновь посеяли при концентрации 30000 клеток/ячейку. После инкубации в течение 24 ч клетки обрабатывали 6 ч моноклональными антителами против экстраклеточного домена FAS-R (моноклональные антитела СН-11, Oncor) при различных концентрациях (0,001-10 мкг/мл моноклональных антител) в присутствии 10 г/мл цикогексимида. После этого определяли жизнеспособность клеток в тесте по поглощению нейтрального красного и результаты подсчитывали в % живых клеток по отношению к числу клеток, инкубируемых с одним циклогексимидом (в отсутствие моноклональных антител СН-11 против FAS-R).
(v) Нозерн-анализ и определение последовательностей.
Поли А+ РНК выделяли из клеток HeLa (набор Oligotex-dT мРНК, QIAGEN, Hilden, Germany). Нозерн-анализ с использованием в качестве пробы кДНК HF-1 выполняли с помощью обычного метода (как описано в PCT/US95/05854; смотри также Boldin et al., 1995). Нуклеотидную последовательность для MORT-1 (HF-1) определяли в обоих направлениях с помощью метода терминации дидезокси цепи.
В вышеприведенных экспериментах получены следующие результаты, показанные в Таблице 1 и Фиг.1-7. Анализ последовательности кДНК MORT-1, клонированной с помощью дигибридной процедуры, показал, что она кодирует новый белок (смотри ниже).
Применение дигибридного теста для оценки специфичности связывания этого белка (MORT-1, "Mediator of Receptor-induced Toxicity") c Fas-IC и для определения специальной области в Fas-IC, с которой он связывается, привело к следующим результатам (Таблица 1):
(a) этот белок связывается как с человечьим, так и с мышиным Fas-IC, но не связывается с рядом других испытанных белков, включая три рецептора из семейства рецепторов TNF/NGF (рецепторы TNF р55 и р75 и CD40);
(b) показано, что мутация замены в положении 255 (Ile) в "домене гибели" FAS-R, блокирующая передачу сигналов как in vitro, так и in vivo (мутация 1prcg (Watanabe-Fukunaga et al., 1992; Itoh and Nagata, 1993)), предотвращает также связывание MORT-1 с FAS-IC;
(c) сайт связывания MORT-1 в FAS-R находится в "домене гибели" этого рецептора, и
(d) MORT-1 связывается с самим собой. В самоассоциации и в связывании HF-1 с FAS-R участвуют разные области белка. Фрагмент MORT-1, соответствующий остаткам с 1 по 117, связывается с полноразмерной молекулой MORT-1, но не связывается ни с таким же фрагментом, ни с FAS-IC. И наоборот, фрагмент, соответствующий остаткам с 130 по 245, связывается с FAS-R, но не связывается с MORT-1. Кроме того, из результатов, приведенных в Таблице 1, видно, что область "домена гибели" FAS-R критична для самоассоциации FAS-IC, так же как и область "домена гибели" p55-R для самоассоциации р55-1С. Делеции на обеих сторонах от этого "домена гибели" не влияют на их способность к самоассоциации, однако делеции внутри этих "доменов гибели" влияют на самоассоциацию.
В случае MORT-1 связывание MORT-1 с FAS-IC также зависит от целого (полноразмерного) "домена гибели" FAS-R, связывание с FAS-R не зависит от областей за пределами "домена гибели" FAS-R.
В Таблице 1 приведены результаты взаимодействия пар белков, один из которых кодируется конструкцией рСВТ9, содержащей также код для домена ДНК-связывания белка GAL4, а другой кодируется конструкцией pGAD-CH, содержащей также код домена активации GAL4. Взаимодействие этих белков происходило в дрожжевых клетках SF 526, совместно трансфецированных указанными конструкциями, и анализировалось с помощью теста экспрессии β-галактозидазы на фильтре. В число конструкций ДНК-связывающего домена входят четыре конструкции Fas-IC человека; четыре конструкции Fas-IC мыши, включающие две полноразмерные конструкции, имеющие мутации замены Ile на Leu или Ile на Аlа в положении 225 (I225N и I225A соответственно); и три конструкции HF-1 (МОRТ-1). Все эти конструкции изображены на левой стороне Таблицы 1. В число конструкций домена активации входят три конструкции HF-1, причем конструкции частей HF-1 такие же, как и конструкции ДНК-связывающего домена; конструкция полноразмерного Fas-IC человека, причем конструкция части Fas-IC такая же, как и вышеуказанная конструкция ДНК-связывающего домена. Внутриклеточные домены рецептора р55 TNF человека (остатки 206-426 p55-IC), CD40 человека (остатки 216-227) и рецептора р75 TNF человека (остатки 287-461), а также ламин, циклин Д и "пустой" Gal4 вектор (pGBT9) служили в качестве негативных контролей в виде конструкций ДНК-связывающего домена. SNF-1 и SNF4 служили в качестве позитивных контролей в виде конструкций ДНК-связывающего домена (SNF1) и домена активации (SNF4). "Пустые" GAL4 векторы (pGADCH) также служили в качестве негативных контролей в виде конструкций домена активации (детальнее о p55-IC и р75-IС смотри в PCT/US95/05854). Символы "++" и "+" обозначают развитие сильной окраски в течение 30 и 90 мин теста соответственно; и "-" обозначает отсутствие окрашивания в течение 24 ч. Комбинации, для которых эти символы отсутствуют, не тестировались.
Экспрессия молекул HF1 (MORT-1), слитых с N-концом октопептида FLAG (FLAG-HF-1), приводила к образованию в клетках HeLa белков четырех различных размеров: около 27, 28, 32 и 34 kD. На Фиг.1 (А и В) приведены результаты, демонстрирующие взаимодействие HF1 с Fas-IC in vitro. Как указано выше в описании Фиг.1А и В, на Фиг.1 воспроизведен контрольный радиоавтограф иммунопреципитата белков из экстрактов клеток HeLa, трансфецированных слитым белком FLAG-HF1 (FLAG-MORT1) или кДНК люциферазы в качестве контроля. На Фиг.1В воспроизведен радиоавтограф, показывающий взаимодействие in vitro между HF1 и Fas-IC, где HF1 находится в виде меченого по [35S]-метионину слитого белка HF1-FLAG, полученного из экстракта трансфекцированных клеток HeLa, a Fas-IC - в виде слитых белков человека и мыши GST-FAS-IC, один из которых имеет мутацию замены в положении 225 в Fas-IC. Все эти слитые белки GST-FAS-IC получены в клетках E.coli. Слитые с GST белки перед взаимодействием с экстрактами, содержащими слитый белок HF1-FLAG, прикрепляли к шарикам из глютатиона. После этого взаимодействия проводили SDS-PAGE. Таким образом, взаимодействие in vitro оценивали с помощью радиоавтографий после SDS-PAGE по связыванию метаболически меченого белка HF1, синтезируемого в клетках HeLa в составе слитого белка HF1 с октопептидом FLAG(FLAG-HF1), с GST, слитым с человечьим или мышиным Fas-IC (GST-huFas-IC, GST-mFas-IC); или с GST, слитым с Fas-IC, содержащим мутацию замены Ile на Аlа в положении 225. Как видно из Фиг.1В, все четыре белка FLAG-HF1 обнаруживают способность связываться с Fas-IC при инкубации с слитым белком GST-Fas-IC. Как и в тесте в системе дрожжевых дигибридов, HF1 не связывается с слитым белком GST-Fas-IC, содержащим сайт с мутацией замены lprcg (I225A).
Белки, кодируемые кДНК FLAG-HF1, также обнаруживают способность связываться с внутриклеточным доменом FAS-R, а также с химерным внутриклеточным доменом FAS-R, в котором внутриклеточный домен заменен на соответствующий домен p55-R (р55-FAS) в условиях совместной экспрессии этих рецепторов в клетках HeLa. На Фиг.2 (А, В, С) приведены результаты, демонстрирующие взаимодействие HF1 с FAS-IC в трансфецированных клетках HeLa, т.е. in vivo. Как указывалось выше, при описании Фиг.2 А, В, С, на этих фигурах воспроизводятся радиоавтографы преципитатов из различных трансфецированных клеток HeLa, которые демонстрируют взаимодействие in vivo и специфическое взаимодействие между HF1 и FAS-IC в клетках, совместно трансфецированных конструкциями, кодирующими эти белки. Таким образом, слитый белок FLAG-HF1 экспрессировался и метаболически метился по [35-S]-цистеину (20 мк Кю/мл) и по [35S]-метионину (40 мк Кю/мл), в клетках HeLa отдельно или вместе с химерой FAS-R человека, FAS-R, в которой эстраклеточный домен FAS-R заменен соответствующей областью из p55-R человека (p55-FAS), иил вместе с p55-R в качестве негативного контроля. Перекрестная иммунопреципитация HF1 с совместно экспрессируемым рецептором выполнялась с использованием указанных антител (Фиг.2А-С). Как видно из Фиг.2А-С, FLAG-HF1 способен связываться с внутриклеточным доменом FAS-R, а также с химерным внутриклеточным доменом FAS-R-p55-R, имеющим экстраклеточный домен p55-R и внутриклеточный домен FAS-R в условиях совместной экспрессии этих рецепторов в клетках HeLa (смотри средние дорожки Фиг.2А и три дорожки слева на Фиг.2С соответственно). Далее, иммунопреципитация FLAG-HF1 из экстрактов трансфецированных клеток приводит также к преципитации совместно экспрессированного FAS-R (Фиг.2А) или совместно экспрессированной химеры p55-FAS (Фиг.2С). И наоборот, иммунопреципитация этих рецепторов приводит к совместной преципитации FLAG-HFl (Фиг.2А и 2С).
Анализ с помощью Нозерн-гибридизации с использованием в качестве зонда кДНК HF1 выявляет один гибридизующийся транскрипт в клетках HeLa. На Фиг.3 приведен Нозерн-блоттинг, в котором поли A+PHK (0,3 мкг) из трансфецированных клеток гибридизовали с кДНК HF1. Размер этого транскрипта (около 1,8 кВ) близок к размеру кДНК HF1 (около 1702 нуклеотидов).
При анализе последовательности было обнаружено, что эта кДНК содержит открытую рамку считывания приблизительно для 250 аминокислот. На Фиг.4 приведена предварительная нуклеотидная последовательность и полученная из нее аминокислотная последовательность HF1, в которой основная часть "домена гибели" подчеркнута так же, как и возможный стартовый остаток Met (положение 49, жирно подчеркнутая М), и отмечен стоп-кодон трансляции (звездочка под кодоном в положении 769-771). Главная часть "домена гибели" обнаруживает гомологию с известными главными частями "доменов гибели" p55-R и FAS-R (р55 DD и FAS-DD). Для точного определения С-концевой части HF-1 и получения точных данных о N-концевой части HF1 (стартового остатка Met) были выполнены следующие эксперименты.
С помощью описанных выше методов был сконструирован ряд конструкций, кодирующих молекулы HF1, слитые их N-концами с октопептидом FLAG (FLAG-HF1). При экспрессии этих конструкций в клетках HeLa экспрессируемые белки метаболически пометили, используя 35S-цистеин и 35S-метионин (смотри выше о том же на Фиг.5В). Молекулы HF1-FLAG кодировались следующими кДНК, содержащими различные участки с кодом разных участков Н 1:
i) кДНК октопептида FLAG, присоединенная к 5′-концу кДНК HF1, из которой вырезаны нуклеотиды с 1 по 145 (смотри Фиг.4);
ii) кДНК октопептида FLAG, присоединенная к 5′-концу полноразмерной кДНК HF1 (см. конструкцию FLAG-HF1, приведенную выше на Фиг.1В);
iii) кДНК октопептида FLAG, присоединенную к 5′-концу кДНК HF1, из которой вырезаны нуклеотиды с 1 по 145, а также нуклеотиды с 832 по 1701 (см. Фиг.2), а кодон GCC в положении 142-144 изменен на ТСС для того, чтобы предотвратить старт трансляции в этом сайте.
После экспрессии вышеуказанных слитых продуктов HF1-FLAG провели их иммунопреципитацию, как указано выше, используя или моноклональные антитела анти-FLAG (М2) или, в контроле, антитела анти-р75ТМF-R (Н9), и затем - разделение в SDS-PAGE (1% акриламида) и радиоавтографию. Результаты приведены на Фиг.5, где воспроизведен радиоавтограф разделенных вышеуказанных слитых белков, образцы которых наносили на дорожки геля, как указано ниже.
Дорожки 1 и 2: слитый белок HF1-FLAG, кодируемый кДНК октопептида FLAG, присоединенной к 5′-концу кДНК HF1, из которой вырезаны нуклеотиды 1-145.
Дорожки 3 и 4: слитый белок HF1-FLAG, кодируемый кДНК октопептида FLAG, присоединенной к 5′-концу кДНК полноразмерного HF1.
Дорожки 5 и 5: слитый белок HF1-FLAG, кодируемый кДНК, присоединенной к 5′-концу кДНК HF1, из которой вырезаны нуклеотиды 1-145, а также 832-1701, a GCC в положении 142-144 заменен на ТСС для того, чтобы предотвратить старт трансляции в этом сайте.
Иммунопреципитацию образцов на дорожках 2, 4 и 6 проводили моноклональными антителами анти-FLAG, а образцов на дорожках 1, 3 и 5 - антителами aнти-p75TNF-R.
Из радиоавтографа на Фиг.5 видно следующее. Идентичность размеров продуктов на дорожках 2 и 4 подтверждает, что нуклеотиды 769-771 являются сайтами терминации трансляции для HF1, т.е. этот кодон представляет собой стоп-сигнал, как это показано звездочкой на Фиг.4. Далее, наличие широкой полосы, в которой на самом деле содержатся два продукта трансляции (видные на геле, но из-за сильного мечения сливающиеся в одну большую полосу на радиоавтографе) на дорожке 6, показывает, что наличие двух дополнительных продуктов (более высокий молекулярный вес в широких полосах) в дорожках 2 и 4 отражает тот факт, что инициация трансляции происходит как на N-конце слитой молекулы, так и с остатка метионина в положении 49 в последовательности HF-1 (см. жирно подчеркнутое М в положении 49 аминокислотной последовательности на Фиг.4). Таким образом, вышеприведенные результаты подтверждают правильность приведенной аминокислотной последовательности С-конца HF1 и служат доказательством того, что N-конец HF-1 может находиться в положении 49 последовательности, изображенной на Фиг.4.
Действительно, в дополнительных экспериментах по экспрессии HF-1 без присоединенного к его 5′-концу октопептида FLAG было показано, что Met49 служит как эффективный сайт инициации трансляции.
Следует напомнить, что при поиске в банке данных "Gene Bank" и "Protein Bank" не обнаружены последовательности, соответствующие последовательностям HF-1, изображенным на Фиг.4. Таким образом, HF1 представляет собой новый белок специфического связывания FAS-IC.
Высокий уровень экспрессии р55-IС приводит к запуску цитотоксического эффекта (см. IL 109632, 111125 и Boldin et al., 1995). Экспрессия Fas-IC в клетках HeLa также приводит к такому эффекту, хотя и меньшему по величине, который может быть обнаружен только с помощью чувствительного теста. На Фиг.6А и В приведены диаграммы для не зависящего от лиганда запуска цитотоксических эффектов в клетках, трансфецированных HF1, а также р55-IС и FAS-IC человека. Действие временной экспрессии HF1, Fas-IC человека, р55-IС человека, или люциферазы - в контроле, на жизнеспособность клеток HeLa анализировали, используя вектор экспрессии, контролируемый тетрациклином. Жизнеспособность клеток определяли через 40 мин после введения кДНК в присутствии (неокрашенные столбики Фиг.6А и В) или в отсутствии (закрашенные столбики Фиг.6А и В) тетрациклина (1 мкг/мл, для блока экспрессии) совместно с кДНК, кодирующей секретируемую щелочную фосфатазу плаценты. Жизнеспособность клеток определяли либо в тесте по поглощению красителя нейтрального красного (Фиг.6А), либо при специфическом определении жизнеспособности клеток, которые экспрессируют трансфецирующую ДНК, путем измерения количества щелочной фосфатазы плаценты, секретируемой в ростовую среду (Фиг.6В).
Из Фиг.6А и В видно, что при экспрессии HF1 в клетках HeLa гибнет значительно больше клеток, чем при экспрессии FAS-IC. Цитотоксические эффекты p55-IC, FAS-IC и HF1, по-видимому, связаны с областями "домена гибели", имеющимися у всех этих белков, "домены гибели" которых имеют предрасположенность к самоассоциации и, возможно, поэтому провоцируют цитотоксические эффекты. Упомянутые выше свойства HF1 (MORT-1); а именно специфическая ассоциация HF1 с особой областью в FAS-R, которая участвует в индукции гибели клетки, и тот факт, что даже небольшое изменение структуры в этой области (мутация lprcg), предотвращающее передачу сигналов, блокирует также связывание HF1, показывают, что этот белок играет роль в передаче сигналов и запуске гибели клеток. Этот вывод подтверждается обнаруженной способностью HF1 запускать эффект собственной цитотоксичности клетки. Так, HF1 (MORT-1) может функционировать (i) как модулятор самоассоциации FAS-R благодаря его способности связываться с FAS-R так же, как и при самоассоциации, или (ii) служить как место стыковки других белков, которые участвуют в передаче сигналов, зависящих от FAS, т.е. HF1 может быть белком "стыковки" и поэтому связывать наряду с FAS-R другие рецепторы, или (iii) является составной частью другой системы передачи сигналов, которая взаимодействует с сигнальной системой FAS-R.
Для дальнейшего анализа областей MORT-1 (HF1), принимающих участие в связывании FAS-R и модуляции клеточных эффектов (цитотоксичности), опосредуемых FAS-R, были выполнены вышеупомянутые эксперименты с использованием векторов, кодирующих белки MORT-1 ("головная часть MORT-1", аминокислоты 10117 и "MORT-1 dd", аминокислоты 130-245) (отдельно), с вектором, кодирующим FAS-R, для совместной трансфекции клеток HeLa. В этих экспериментах проводили временную экспрессию различных белков и комбинаций белков в клетках HeLa, которые содержат контролируемый тетрациклином трансактиватор (HtTA-1), вставляя последовательности, кодирующие эти белки, в контролируемый тетрациклином вектор экспрессии pUHD 10-3. В контрольных трансфекциях использованы векторы, кодирующие только FAS-R, и векторы, кодирующие слитый белок FLAG-55.11 (белок 55.11, представляющий собой часть белка из аминокислот с 309 по 900, специфически связывающую р55-IС, был слит (его N-концом) с октапептидом FLAG).
Трансфецированные клетки после соответствующих периодов инкубации (см. выше (iv)) обрабатывали различными концентрациями моноклональных антител анти-FAS-R (СН-11), которые специфически связываются с экстраклеточным доменом FAS-R, экспрессируемым клетками. Такое связывание антител анти-FAS-R индуцирует агрегацию FAS-R на поверхности клетки (во многом такую же, как при связывании лиганда FAS-R) и индуцирует цепь внутриклеточных сигналов, опосредуемых FAS-IC, что в конечном счете ведет к гибели клетки (цитотоксичность клетки, опосредуемая FAS-R). Использовали концентрации моноклональных антител анти-FAS-R (СН-11) 0,01-10 мкг/мл, обычно такие концентрации 0,005; 0,05; 0,5 и 5 мкг/мл. Клетки обрабатывали антителами анти-FAS-R в присутствии 10 мкг/мл циклогексимида.
Результаты вышеприведенного анализа приведены в виде графиков на Фиг.7, в которых % жизнеспособных трансфецированных клеток показан как функция концентрации моноклональных антител анти-FAS-R (СН-11), использованных для обработки клеток, для каждой из четырех групп трансфецированных клеток. Эти группы трансфецированных клеток обозначены разными символами: (i) незакрашенные квадраты обозначают клетки, трансфеци-рованные только контрольным вектором, кодирующим слитый белок FLAG-55.11 ("55.11", негативный контроль), не связывающий FAS-IC; (ii) закрашенные квадраты обозначают клетки совместно трансфецированные векторами, кодирующими FAS-IC, и векторами, кодирующими С-концевую часть MORT-1, аминокислоты 130-245, которая содержит область, гомологичную "домену гибели" (dd) MORT-1 ("fas+mort Idd"); (iii) закрашенные треугольники обозначают клетки, трансфецированные только вектором, кодирующим FAS-R ("fas", положительный контроль); и (iv) незакрашенные кружки обозначают клетки, совместно трансфецированные векторами, кодирующими FAS-R, и векторами, кодирующими N-концевую часть MORT-1, аминокислоты 1-117, "голова MORT-1" ("fas-morthe").
Из результатов, представленных на Фиг.7, видно, что экспрессия FAS-R в трансфецированных клетках придает клетке повышенную чувствительность к цитотоксическому действию антител анти-FAS-R (сравни "fas" с "55.11"). Далее, совместная экспрессия области MORT-1, которая содержит район, гомологичный "домену гибели" и FAS-R ("fas+mort Idd"), сильно препятствует гибели клетки, индуцируемой FАS (т.е. опосредуемой FAS-R), как это и следовало ожидать, исходя из способности района "домена гибели" DD МОRТ-1 связываться с "доменом гибели" FAS (FAS-DD). Кроме того, совместная экспрессия N-концевой части MORT-1 и FAS-R ("fas+morthe") или вовсе не влияет на гибель клетки, опосредуемую FAS-R, или лишь несколько увеличивает цитотоксичность (т.е. несколько увеличивает гибель клеток).
Таким образом, приведенные выше результаты ясно показывают, что белок MORT-1 имеет две различные области, участвующие в связывании FAS-IC и опосредовании доменом FAS-IC цитотоксической активности клетки.
Следовательно, эти результаты дают основания для использования разных участков (т.е. активных фрагментов или аналогов) белка MORT-1 в различных фармацевтических приложениях. Например, те аналоги или фрагменты или производные белка MORT-1, которые в основном содержат только С-концевую часть MORT-1, включающую его "домен гибели", могут быть использованы для подавления опосредуемых FAS-R цитотоксических эффектов в клетках или тканях, содержащих FAS-R, и защиты, таким способом, этих клеток или тканей от вредных эффектов лиганда FAS-R, например, в таких случаях как острые гепатиты. Наоборот, те аналоги или фрагменты или производные белка MORT-1, которые содержат в основном только N-концевую часть MORT-1, могут быть использованы для увеличения опосредуемых FAS-R цитотоксических эффектов в клетках или тканях, содержащих FAS-R, и для усиления таким способом разрушения этих клеток или тканей в тех случаях, когда это желательно, например опухолевых клеток или аутореактивных Т- и В-клеток. Вышеуказанные применения различных районов MORT-1 могут быть осуществлены, как это было указано выше, путем использования различных рекомбинантных вирусов (например, из коровьей оспы) для встраивания различных последовательностей, кодирующих участки MORT-1, в определенные клетки или ткани, нуждающиеся в лечении.
Кроме того, можно также получить и использовать другие различные молекулы, например антитела, пептиды и органические молекулы, последовательности и молекулярные структуры которых соответствуют вышеуказанным участкам MORT-1, для достижения таких же желательных эффектов, какие опосредуются этими участками МОRТ-1.
ССЫЛКИ
Barinaga, M. (1993) Science 262:1512-4.
Berger, J., Hauber, J., Hauber, R., Geiger, R. and Cullen, B.R. (1988) Gene 66, 1-10.
Beutler, В. and Cerami, C. (1987) NEJM, 316:379-385.
Boldin, M.P. et al. (1995) J. Biol. Chem. 270, 337-341.
Brakebusch, С. et al. (1992) EMBO J., 11:943-950.
Brockhaus, M. et al. (1990) Proc. Natl. Acad. Sci. USA, 81:3127-3131.
Cantor, G.H. et al. (1993) Proc. Natl. Acad. Sci. USA 90:10932-6.
Chen, C.J. et al. (1992) Ann N.Y. Acad. Sci. 660:271-3.
Crisell, P. et al., (1993) Nucleic Acids Res. (England) 21 (22):5251-5.
Current protocols in molecular biology (Ausubel, F.M., Brent, R., Kingston, R.E., Moore, D.D., Seidman, J.G., Smith, J.A., Struhl, K., Albright, L.M., Coen, D.M. & Varki, A., eds.), (1994) pp. 8.1.1-8.1.6 and 16.7-16.7.8, Greene Publishing Associates, Inc. and Wiley & Sons, Inc., New York.
Dirks, W., Wirth, M. and Hauser, H. (1993) Gene 128, 247-249.
Engelmann, H. et al. (1990) J. Biol. Chem., 265:1531-1536.
Fields, S. and Song, О. (1989) Nature, 340:245-246.
Frangioni, J.V. and Neel, B.G. (1993) Anal. Biochem. 210, 179-187.
Gossen, M. and Boujard, H. (1992) Proc. Natl. Acad. Sci. USA, 89:5547-5551.
Heller, R.A. et al. (1990) Proc. Natl. Acad. Sci. USA, 87:6151-6155.
Hohmann, H.-P. et al. (1989) J. Biol. Chem., 264:14927-14934.
Itoh, N. et al. (1991) Cell 66:233.
Itoh, N. and Nagata, S. (1993) J. Biol. Chem. 268, 10932-7.
Joseph, S. and Burke, J.M. (1993) J. Biol. Chem. 268:24515-8.
Koizumi, M. et al. (1993) Biol. Pharm. Bull (Japan) 16 (9): 879-83.
Loetscher, H. et al. (1990) Cell, 61:351-359.
Nophar, Y. et al. (1990) EMBO J., 9:3269-3278.
Piquet, P.F. et al. (1987) J. Exp. Med., 166:1280-89.
Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold spring Harbor, NY.
Schall, T.J. et al. (1990) Cell, 61:361-370.
Shimayama, T. et al. (1993) Nucleic Acids Symp. Ser. 29:177-8.
Shore, S.K. et al. (1993) Oncogene 8:3183-8.
Smith, C.A. et al. (1990) Science, 248:1019-1023.
Song, H.Y. et al. (1994) J. Biol. Chem. 269, 22492-22495.
Tartaglia, L. A. et al. (1993) Cell, 74:845-853.
Tracey, J.T. et al. (1987) Nature, 330:662-664.
Wallach, D. (1984) J. Immunol. 132, 2464-9.
Wallach, D. (1986) in: Interferon 7 (Ion Gresser, ed.), pp. 83-122, Academic Press, London.
Wallach, D. et al. (1994) Cytokine 6, 556.
Watanabe-Fukunaga, R. et al. (1992) Nature, 356, 314-317.
Wilks, A.F. et al. (1989) Proc. Natl. Acad. Sci. USA, 86:1603-1607.
Zhao, J.J. and Pick, L. (1993) Nature (England) 365:448-51.
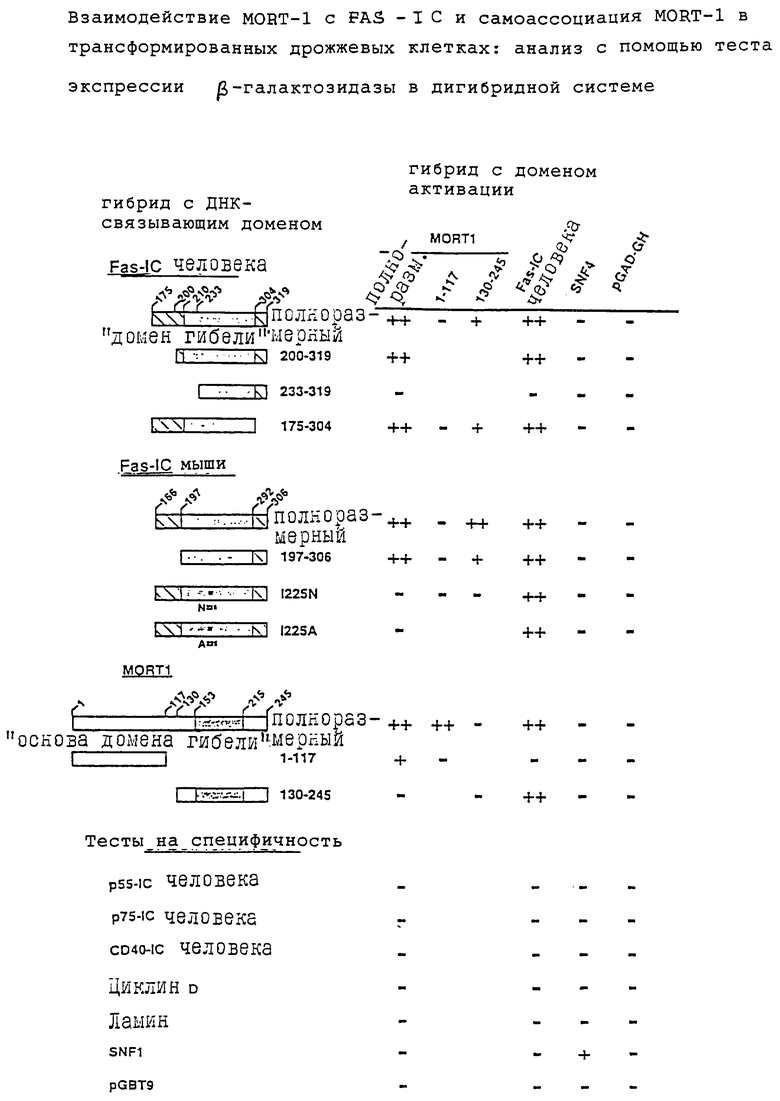







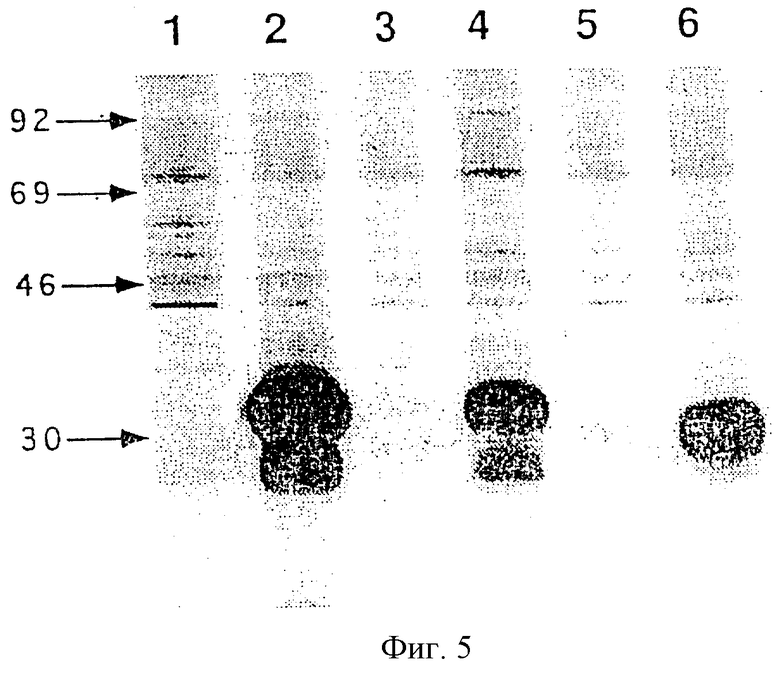
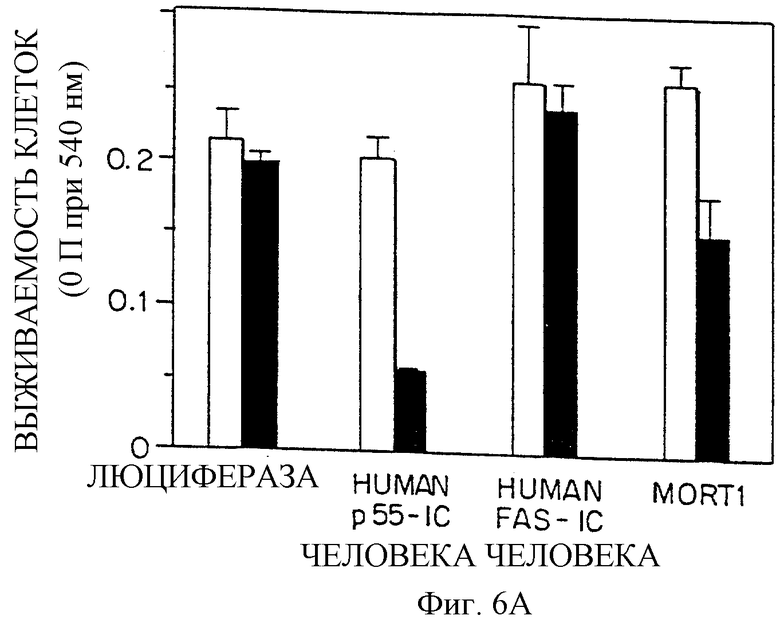
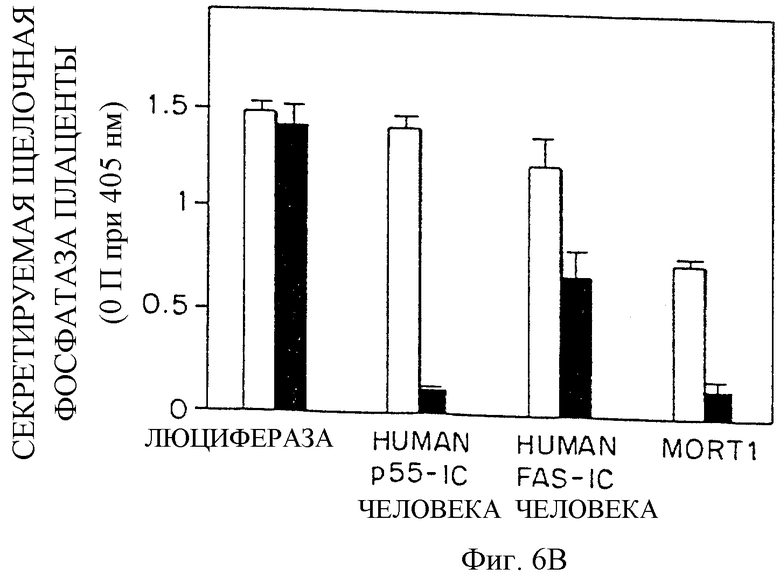
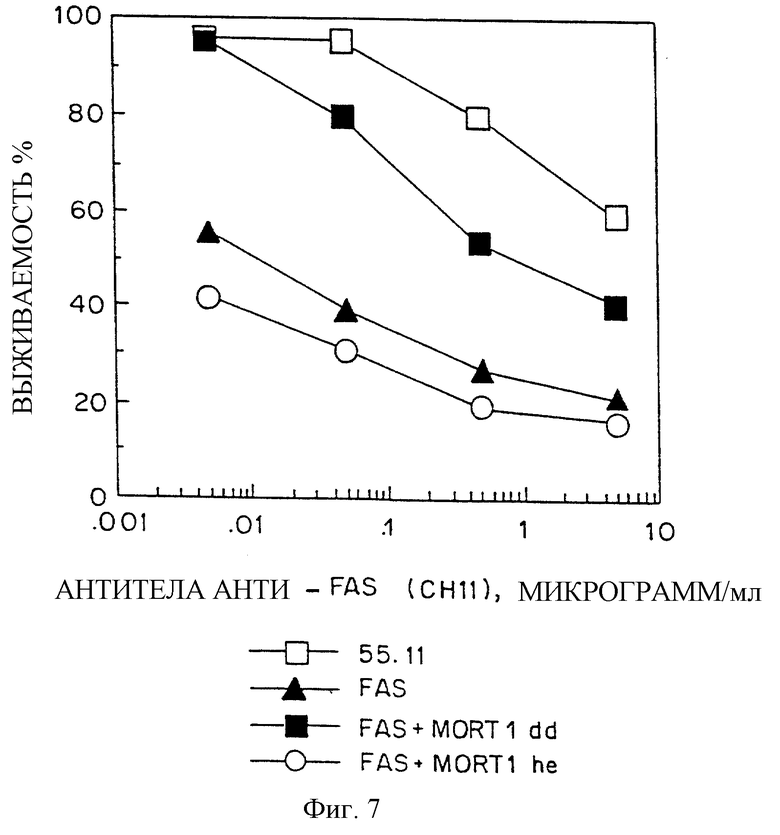
Изобретение относится к биотехнологии, в частности к генной инженерии, и может быть использовано для получения белка, способного модулировать функцию Fas-рецептора. Полипептид, способный связываться с внутриклеточным доменом Fas-R, получают путем культивирования клеток, трансформированных вектором, содержащим последовательность ДНК, кодирующую указанный полипептид. Модуляцию действия лиганда Fas-R осуществляют с помощью полипептида или мРНК, кодирующей полипептид. Фармацевтическая композиция для модуляции действия лиганда Fas-R на клетки содержит указанный полипептид или вирусный вектор, его кодирующий. Изобретение позволяет разрабатывать терапевтические средства для модуляции цитотоксической активности Fas-R. 9 н. и 3 з.п. ф-лы, 8 ил., 1 табл.
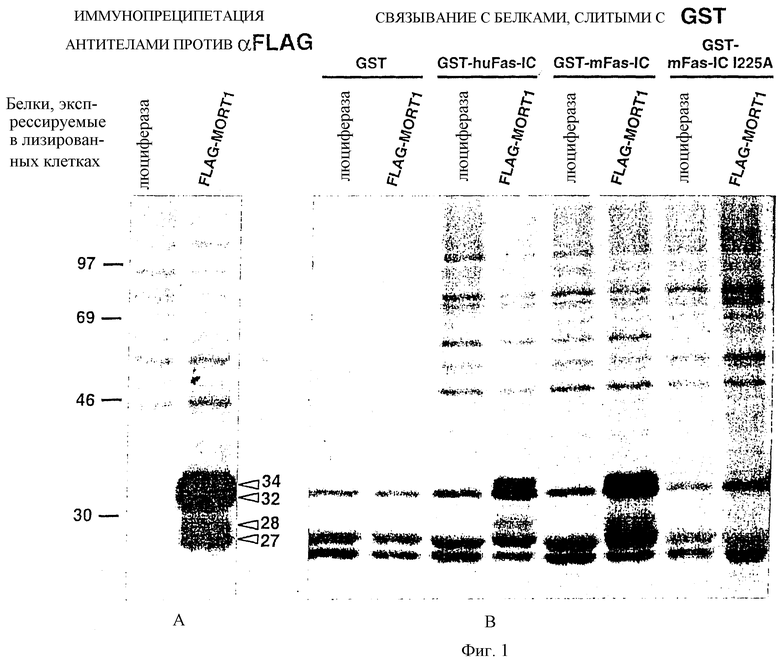
(1) нуклеотидную последовательность SEQ ID No: 1 белка MORT-1;
(2) нуклеотидную последовательность, которая кодирует аналог указанного белка MORT-1, где указанный аналог отличается от белка MORT-1 по единственному аминокислотному остатку и связывается с FAS-IC;
(3) нуклеотидную последовательность, состоящую из нуклеотидной последовательности, которая кодирует фрагмент указанного белка MORT-1, где указанный фрагмент белка связывается с FAS-IC; или
любой из полученных на основе вырожденности генетического кода вариантов нуклеотидной последовательности, указанной в (1), (2) или (3).
| NAGATA et al | |||
| Fas and Fas Ligand: A death factor and its receptor | |||
| Advances in immunology | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| BAKER et al | |||
| Transducers of life and death: TNF receptor superfamily and associated proteins | |||
| document | |||
| Oncogene, 1996, v.12, p.1-9 | |||
| BOLDIN et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Journal of Biological Chemistry | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| Приспособление для уменьшения дымовой тяги паровоза | 1920 |
|
SU270A1 |
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| CHINNAIYAN et al | |||
| FADD, a novel death domain-containing protein, interacts with the death domain of Fas and initiates apoptosis | |||
| Cell, 1995, v.81, p.505-512 | |||
| ITOH N | |||
| et al.: A Novel Protein Domain Required for Apoptosis | |||
| Journal of Biological Chemistry | |||
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
Авторы
Даты
2004-12-10—Публикация
1995-12-14—Подача