ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к таксанам, особенно паклитакселу и доцетакселу, ковалентно связанному с гиалуроновой кислотой или производным гиалуроновой кислоты, способу их получения и их использованию в области онкологии, при лечении аутоиммунных заболеваний и рестеноза.
УРОВЕНЬ ТЕХНИКИ
Таксаны и, особенно, паклитаксел и доцетаксел, в настоящее время продаваемые на рынке под торговым названием таксол и таксотер, являются противораковыми агентами (Huizing M.T. et al., Cancer Inv., 1995, 13: 381-405), которые проявляют свое антипролиферативное действие посредством действия на организацию микротрубочек в клеточной цитоскелетной системе. Действительно, посредством ингибирования деполяризации указанных микротрубочек они предотвращают их нормальную динамическую реорганизацию, которая имеет место во время митотического деления клеток (Manfredi J.J. et al., J. Cell Biol., 1982, 94: 688-696).
Основными терапевтическими показаниями для паклитаксела являются:
- терапия для запущенного рака грудной железы;
- терапия для саркомы Капоши;
- терапия для саркомы легких (не микроцитомы);
- карцинома яичников, устойчивая к лечения стандартной химиотерапией.
Кроме того, указанную химиотерапию используют также для лечения карциномы мочевого пузыря, простаты и эндометрия.
Зная, что паклитаксел является нерастворимым в воде, его смешивают со смесью кремофор® EL (касторовое масло) - этиловый спирт в отношении 1:1 в фармацевтических композициях, используемых в настоящее время в раковой химиотерапии (Pfeifer R.W. et al., Am. J. Hosp.Pharm., 1993, 50:2520-2521). Этот препарат обычно используют для непрерывной внутривенной инфузии (в течение от 3 до 24 часов) при дозе 135-175 мг/м2.
Присутствие кремофора EL в указанном выше препарате является основной причиной побочных реакций, которые обычно имеют место во время введения паклитаксела и изменяются от простых поражений крапивницы до одышки и бронхоспазм и даже анафилактического шока (Weiss R.B. et al., J. Clin. Oncol., 1990, 8: 1263-1268).
По этой причине любой пациент, который собирается получить лечение фармацевтической композицией паклитаксел-кремофор EL, должен сначала следовать протоколу премедикации с введением дексаметазона, возможно ассоциированного с антигистамином.
Несмотря на эти предосторожности, до 40% пациентов, которые получают внутривенную инфузию паклитаксела, все же испытывают более или менее серьезные побочные реакции. Поэтому можно сказать, что клиническое применение препарата таксола в настоящее время и способы, используемые для его введения, имеют ограниченную эффективность. Это является причиной того, почему исследование теперь направлено для синтеза новых фармацевтических препаратов и/или для получения новых химических препаратов вышеуказанного противоракового лекарственного средства, которые являются водорастворимыми.
Например, исследователи пытались капсулировать паклитаксел в липосомах, нанокапсулах и микросферах, составленных полимерными стенками, образованными биоразрушаемыми сополимерами, такими как полимолочная кислота, бионеразрушаемыми сополимерами, такими как сополимер этилена и винилацетата.
Кроме того, были получены микросферы, которые загружают паклитакселом и которые образованы биоразрушаемым полимером, таким как полифосфоэфир, для создания системы для пролонгированного высвобождения лекарственного средства у места терапии при лечении карциномы легких (Nuijen В. et al., Investigation New Drugs, 2001, 19: 143-153).
Были предприняты также попытки получения мицелл указанного противоракового лекарственного средства осаждением паклитаксела в органическом растворителе системой фосфатидилхолин/соли желчных кислот (Nuijen В. et al., Investigation New Drugs, 2001, 19:143-153).
Однако при получении этих новых систем для капсулирования паклитаксела могут возникнуть трудности в отношении стабильности, получения и способности воспроизводства.
Кроме того, были сделаны различные попытки растворения лекарственного средства циклодекстрином, но новые препараты не дали желательных результатов (Nuijen В. et al., Investigation New Drugs, 2001, 19: 143-153).
Химическое исследование по новым препаратам паклитаксела, которые делают лекарственное средство более водорастворимым при сохранении его эффективности в качестве противоракового агента, привело к синтезу новых аналогов, модифицированных в положениях С2' м С7 (заявка на патент США №2001/0018531), а также к получению новых пролекарств.
Пролекарства являются терапевтически инертными производными лекарственных средств, которые активируются при введении в организм.
Здесь активный ингредиент высвобождается после самопроизвольных процессов гидролиза и/или ферментативного гидролиза.
С этой точки зрения и по указанным выше причинам были предприняты попытки синтеза новых пролекарств, которые привели, например, к получению лекарственных средств, таких как ацетилпаклитаксел (Mellado W. et al., Biochem. Biophys. Res. Commun., 1984, 124(2): 329-336) или синтеза новых сложных эфиров указанного лекарственного средства с янтарной, глутаровой и сульфоновой кислотами на атоме углерода в положении С2'. Однако доказано, что эти эфиры являются нестабильными в водной окружающей среде.
Кроме того, были синтезированы некоторые производные с группой фосфонооксифенилпропионатного эфира в положении С2' или С7, такие как паклитаксел-2'-карбонат, и ряд новых эфиров паклитаксела с аминокислотами и их производные с глутарильной группой в положении С2'.
Показано, что глутарилпаклитаксел-аспарагин и глутарилпаклитаксел-глутамин являются двумя наиболее высокорастворимыми продуктами, полученными типом описанного выше синтеза, но они являются менее эффективными, чем паклитаксел per se (Nuijen В. et al., Investigation New Drugs, 2001, 19: 143-153).
Известно также, что паклитаксел этерифицировали поли-L-глутаминовой кислотой с образованием нового водорастворимого производного указанного химиотерапевтического лекарственного средства со значительно более высоким полупериодом существования, чем неконъюгированный паклитаксел (Li С. et al., Cancer Research, 1998, 58(11): 2404-2409).
Паклитаксел был также превращен в производное с ПЭГ (полиэтиленгликоль) этерификацией лекарственного средства химиотерапии в положении С2'; однако показано, что новая молекула является очень хорошо растворимой, но не очень стабильной.
Наконец, недавно была разработана новая система доставки лекарственного средства конъюгацией паклитаксела с альбумином сыворотки крови человека (HSA). Доказано, что конъюгат паклитаксел-HSA является очень хорошо растворимым в воде и способен «нести» до 30 молекул химиотерапевтического лекарственного средства. Однако эксперименты, проведенные in vitro, показали, что он является менее эффективным против рака, чем паклитаксел per se (Nuijen В. et al., Investigation New Drugs, 2001, 19: 143-153).
В последнее время исследователи синтезировали новую систему доставки для паклитаксела, этерифицированные предварительно модифицированной гиалуроновой кислотой (далее здесь обозначаемой "НА"), которая является НА, подвергнутой взаимодействию с молекулами гидразида, связанного с карбоксильной группой НА амидной связью (Luo Y. et al., Biomacromolecules 2000, 1 (2): 208-218; патент США №5874417). Эта новая система доставки для паклитаксела позволяет лекарственному средству дойти непосредственно до поверхности мембраны являющейся мишенью раковой клетки, характеризующейся сверхэкспрессией рецептора для НА, CD44. Следовательно, доказано, что паклитаксел, связанный с НА, функционализированной гидразидом, способен связываться специфическим образом с CD44 раковой клетки и, таким образом, способен (благодаря процессу эндоцитолиза) входить в цитоплазму клетки, где он может быть ферментативным образом высвобожден и активирован, запуская свой механизм ингибирования деполяризации тубулина и, следовательно, деления клеток. Этот механизм селективного переноса лекарственного средства называют «клеточным прицеливанием».
Кроме того, известно, что НА может быть использована в качестве наполнителя для противораковых лекарственных средств в фармацевтических композициях, где НА ассоциирована (а не ковалентно связана) с химиотерапевтическими лекарственными средствами, такими как паклитаксел, для повышения их терапевтической эффективности благодаря феномену «прицеливания», описанному выше (Международная патентная заявка №WO 00/41730), и получения возможности снизить дозы, обычно указываемые в обычных химиотерапевтических протоколах (Международная патентная заявка №WO 99/02151).
И наконец, известно, что НА с низкой молекулярной массой и/или ее липидные производные используют для получения липосом, используемых для доставки лекарственных средств, включающих антираковые лекарственные средства, таких как паклитаксел (Международная патентная заявка №WO 01,39815). С точки зрения указанного выше все еще остается потребность в новых производных таксанов, которые являются стабильными и растворимыми в воде и терапевтически эффективными, по меньшей мере, такими, какими являются немодифицированные таксаны.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Автором заявки теперь обнаружено, что, ковалентно связанные с НА или производными НА таксаны, необязательно при помощи соединяющего соединения, получают стабильные и водорастворимые продукты, пригодные для получения фармацевтических композиций для лечения опухолей, аутоиммунных нарушений и рестеноза. Таким образом предметом изобретения является таксан, ковалентно привязанный к гиалуроновой кислоте или ее производному, причем указанная ковалентная связь выбрана из группы, состоящей из:
i) прямой эфирной связи, сформированной между карбоксильными группами гиалуроновой кислоты или ее производного и гидроксильными группами таксана,
ii) связи, сформированной между карбоксильными группами гиалуроновой кислоты или ее производного и гидроксильной функцией таксана посредством разделителя, причем указанный разделитель формирует эфирную связь с гиалуроновой кислотой или ее производным, и
iii) связи, сформированной между гидроксильной функцией гиалуроновой кислоты или ее производного и гидроксильной функцией таксана посредством разделителя, причем указанный разделитель формирует эфирную связь с гиалуроновой кислотой или ее производным.
Настоящее изобретение далее относится к способам получения таксанов, ковалентно связанных с НА или производными НА.
Следующим предметом изобретения являются фармацевтические композиции, содержащие в качестве активного вещества, по меньшей мере, таксан, ковалентно связанный с НА или производными НА, и их использование при лечении опухолей, аутоиммунных заболеваний и рестеноза.
Данные таксаны, ковалентно связанные с НА или производными НА, имеют много преимуществ, которые могут быть суммированы следующим образом:
1) они являются моментально растворимыми в кровотоке;
2) их не нужно смешивать с кремофором EI для получения препаратов, что позволяет преодолевать вышеуказанные проблемы, относящиеся к повышенной чувствительности и анафилаксии;
3) благодаря ферментативной активности ферментов, таких как эстеразы, обычно присутствующие в плазме, таксаны сразу высвобождаются применяемой в качестве их наполнителя НА или производным НА из настоящих композиций в кровь, где они могут свободно проявлять свою противораковую активность;
4) они дают возможность получать новое лекарственное средство, которое в случае некоторых типов рака может обладать неожиданной химиотерапевтической активностью, которая значительно выше, чем активность, которую получают, при введении неконъюгированного таксана, когда рассматривают одинаковые дозы лекарственного средства.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
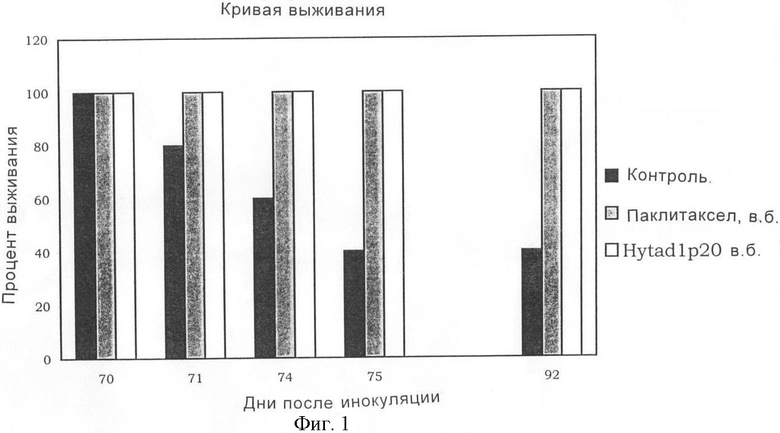
На фигуре 1 показан процент выживаемости после имплантирования опухолевых клеток, как описано в примере 1, для контролей (черная гистограмма) и для мышей, которые получали паклитаксел (серая гистограмма) и паклитаксел, ковалентно связанный со сложным эфиром НА при 16% этерификации (белая гистограмма), полученным, как в примере 7.
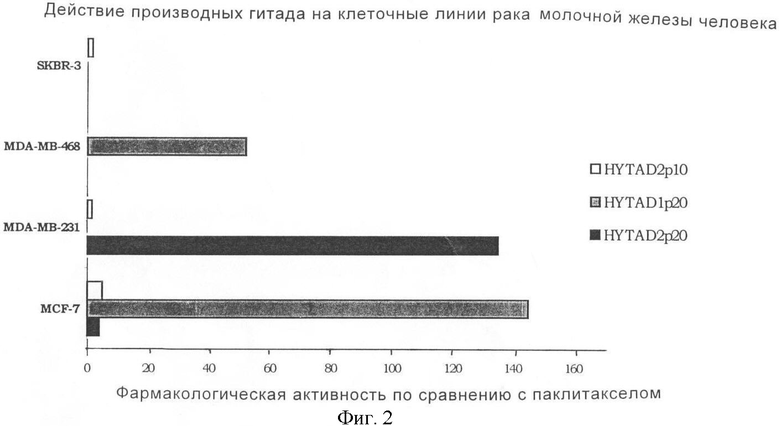
На фигуре 2 показана фармакологическая способность, выраженная как IC50 и являющаяся результатом экспериментов в примере 2, паклитаксела, ковалентно связанного с эфирными производными НА, имеющими 16% этерификацию (серая гистограмма), 22% этерификацию (черная гистограмма) и 6,8% этерификацию (белая гистограмма) для четырех клеточных линий рака молочной железы по сравнению со ссылочным продуктом паклитакселом.
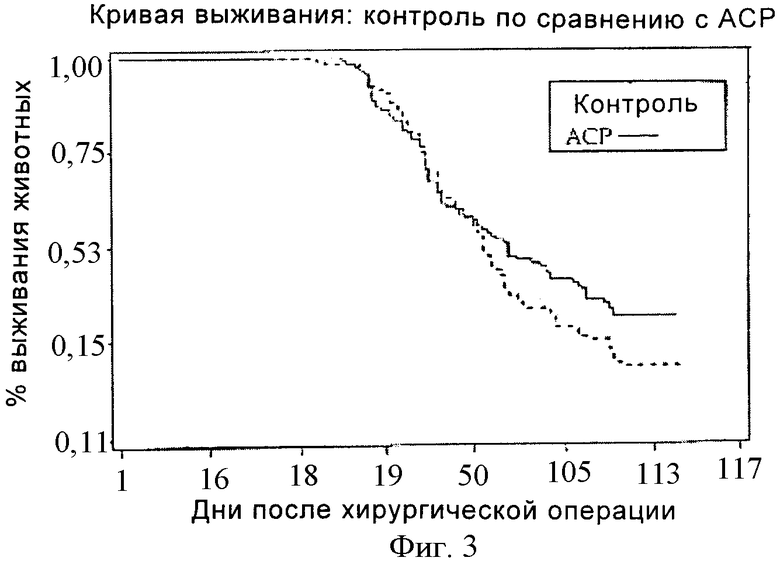
На фигуре 3 показан процент выживаемости после имплантации опухолевых клеток, как описано в примере 3, у контрольных мышей (пунктирная линия) и у мышей, которые получали гель АСР (непрерывная линия).
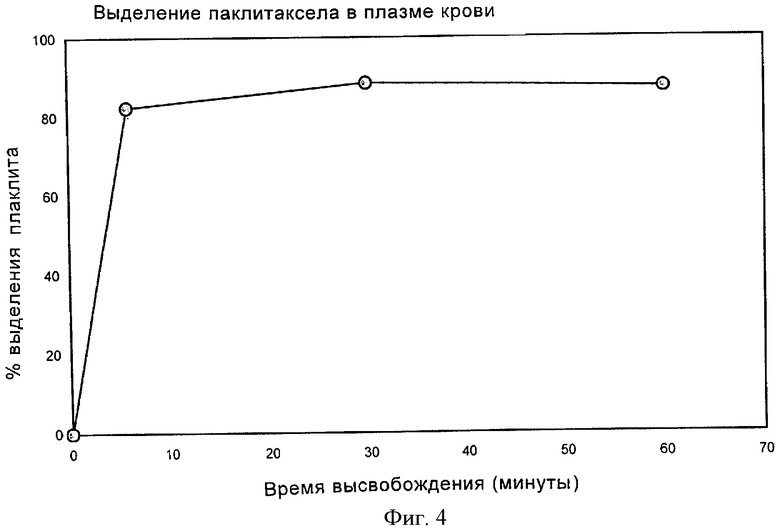
На фигуре 4 показан процент паклитаксела, ковалентно связанного со сложным эфиром НА, как описано в примере 7, высвобождаемого в плазму крови человека, как описано в испытании примера 13, в зависимости от времени.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
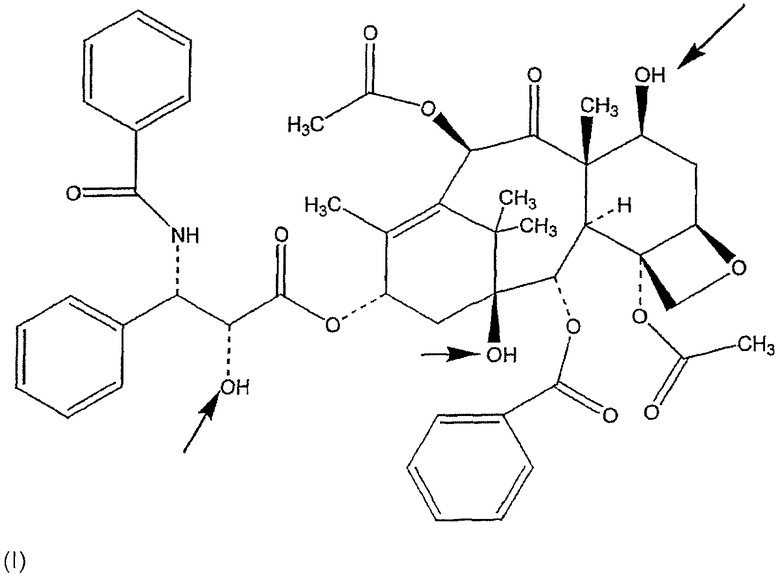
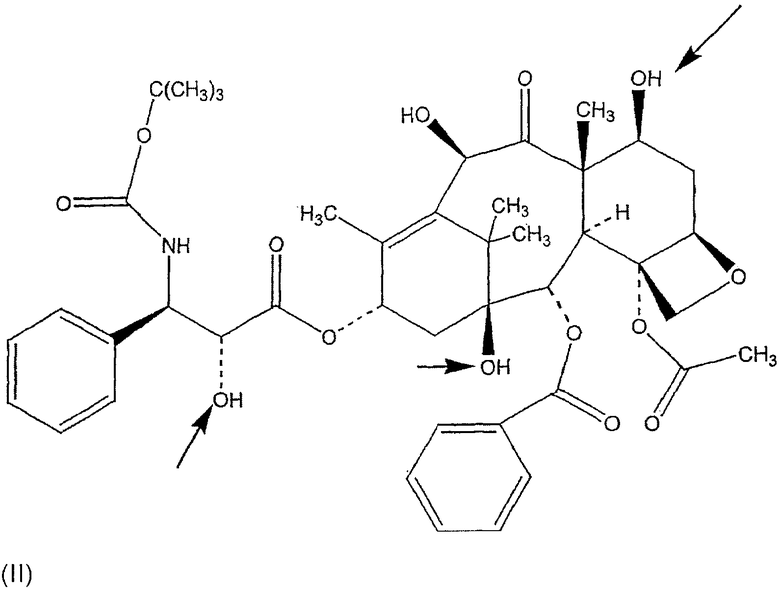
В настоящем изобретении описаны соединения, относящиеся к семейству таксана, предпочтительно, паклитакселу и доцетакселу, ниже представленных формулами (I) и (II) соответственно, ковалентно связанных с НА или производными НА, предпочтительно, при помощи соединяющей группы, как границы между таксановым компонентом и НА или производным НА, ковалентно связанным с обеими молекулами.
НА представляет собой гетерополисахарид, состоящий из чередующихся остатков D-глюкуроновой кислоты и N-ацетил-D-глюкозамина и имеющий следующие повторяющиеся звенья:
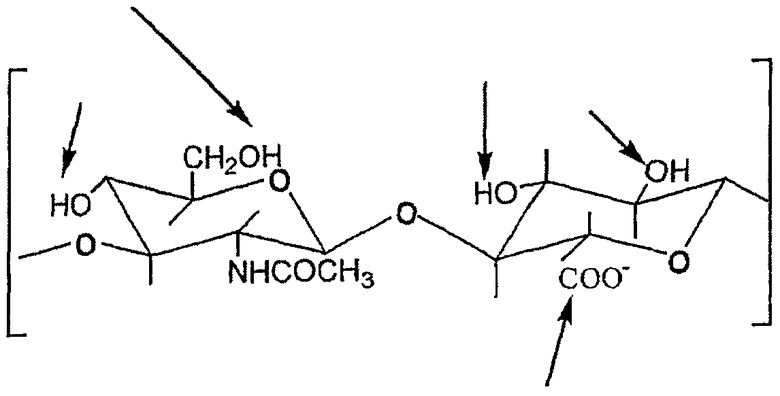
НА представляет собой полимер с линейной цепью и молекулярной массой, которая может варьировать между 50000 и 13×106 Да в зависимости от его источника и способа, используемого для получения его. Она присутствует в природе в перицеллюлярных гелях, в основном веществе соединительной ткани позвоночных организмов (в которых она является одним из основных компонентов), в синовиальной жидкости суставов, в эндолифме и в пуповине. НА играет важную роль в биологическом организме в качестве механического носителя для клеток многих тканей, таких как кожа, сухожилия, мышцы и хрящи. Она является основным компонентом внеклеточной матрицы, но она имеет другие функции, такие как гидратация тканей, смазывание, и миграция, и дифференциация клеток.
НА, используемая в настоящем изобретении, может быть экстрагирована из любого источника, например из кондилом, или она может быть получена ферментативным путем, или технологическим способом и она может иметь молекулярную массу между 400 и 3×106 Да, особенно между 400 и 1×106 Да, и предпочтительно, между 400 и 230000 Да.
Производные НА по настоящему изобретению, предпочтительно, выбраны из группы, состоящей из следующих производных НА:
- НА в форме соли с органическими и/или неорганическими основаниями;
- Hyaff: эфиры НА со спиртами алифатического, аралифатического, циклоалифатического, ароматического, циклического и гетероциклического рядов со степенью этерификации, которая может варьировать в соответствии с типом и длиной цепи используемого спирта и в любом случае никогда не превышает 50% этерификацию и, что предпочтительно, составляет 0,1-20%, так как конечный полимер, который получают, должен всегда быть водорастворимым, тогда как оставшаяся неэтерифицированная НА может быть превращена в соли с органическими и/или неорганическими основаниями, причем такие соединения описаны в патенте США №4851521, включенном здесь в качестве ссылки;
- HyaddTM: амиды НА, образованные с аминами алифатического, аралифатического, циклоалифатического, ароматического, циклического и гетероциклического рядов с процентом амидирования между 0,1 и 10%, так как конечный полимер всегда должен быть водорастворимым, тогда как оставшаяся НА, которая не является амидированной, может быть превращена в соли с органическими и/или неорганическими основаниями, причем такие соединения описаны в заявке на Европейский патенте №1095064, включенной здесь в качестве ссылки;
- O-сульфатированные производные НА со степенью сульфатирования 4, описанные в патенте США №6027741, включенном здесь в качестве ссылки;
- АСР: внутренние эфиры НА с процентом этерификации не более чем 15%, так как полимер всегда должен быть водорастворимым, предпочтительно, между 0,05 и 10% этерификации, тогда как оставшаяся неэтерифицированная НА может быть превращена в соли с органическими и/или неорганическими основаниями, причем такие соединения описаны в Европейском патент №0341745 В1, включенном здесь в качестве ссылки;
- продукты деацетилирования НА: их получают деацетилированием звена N-ацетилглюкозамина с процентом деацетилирования, предпочтительно, между 0,1 и 30%, тогда как все карбоксильные группы НА могут быть превращены в соли с органическими и/или неорганическими основаниями, как иллюстрировано в следующей структуре (А):
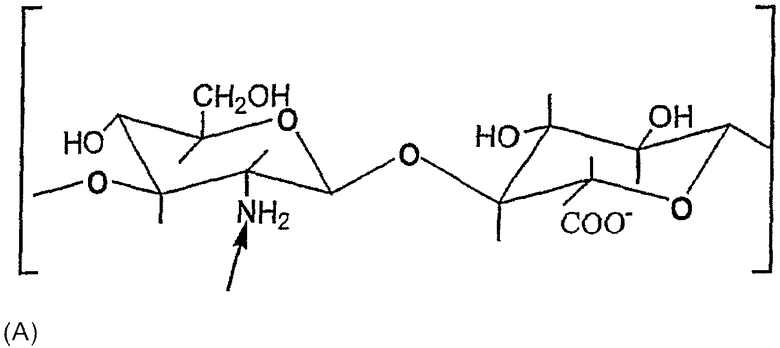
причем деацетилаты НА, описанные в Международной патентной заявке №WO 02/18450, авторы включают здесь в качестве ссылки;
- НуоххTM: перкарбоксилированные производные НА, полученные окислением первичного гидроксила звена N-ацетилглюкозамина со степенью перкарбоксилирования между 1 и 100%, предпочтительно, между 25 и 75%. Все карбоксильные группы НА могут быть превращены в соли с органическими и/или неорганическими основаниями, как иллюстрируется в следующей структуре (В):
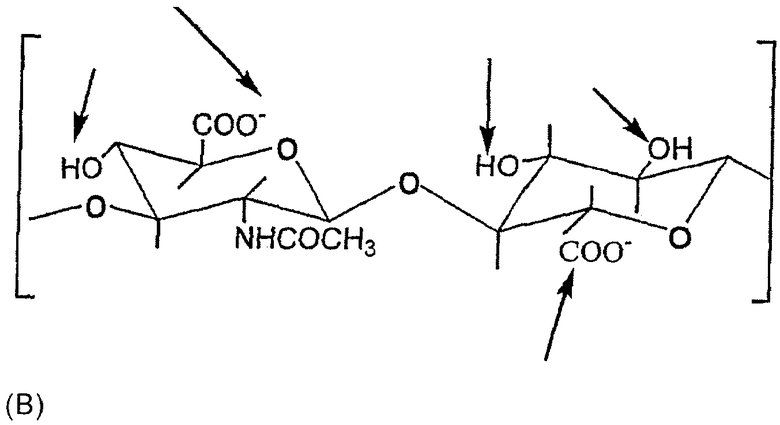
Перкарбоксилированные производные НА описаны в заявке на патент США №US 2003181689.
Кроме того, настоящие соединения, в которых таксан, в частности, паклитаксел, ковалентно связан со сложным эфиром НА, могут быть получены из молекул химически немодифицированной НА и только после синтеза с химиотерапевтическим лекарственным средством модифицированием НА этерификацией ее со всеми перечисленными выше спиртами для получения продуктов Hyaff® или образованием внутренних эфиров, как в случае АСР® (см. пример 8).
Предварительно перечисленные производные НА, которые являются особенно важными в способе синтеза пролекарства НА-таксан, и, в частности, пролекарства НА-паклитаксел, являются деацетированными и сульфатированными производными, поскольку при таких же процентах паклитаксела, связанного с предварительно немодифицированной гиалуроновой кислоты, они делают конечный продукт более растворимым в кровотоке.
Известно, что при помощи рецептора СD44-мембраны НА опосредует многие различные процессы, относящиеся к клеточной физиологии и биологии, такие как пролиферация, дифференциация и локомация раковых клеток и других клеток.
В научной литературе недавно была показана эффективность НА против рака, когда НА инъецируют как таковую непосредственно в растущую раковую опухоль. Доказано, что она способна вызывать полную регрессию 30% опухолей (Herrera-Gayol A. et al., Experimental and Molecular Pathology, 2002, 72: 179-185).
Известно также, что НА может быть ассоциирована с любым химиотерапевтическим лекарственным средством для получения многих различных фармацевтических композиций, так как она способна действовать в качестве второго противоопухолевого реагента, который синергически усиливает противораковое действие лекарственного средства, ассоциированного с ней (Международная патентная заявка №WO 01/47561; в альтернативном варианте НА заявлена в качестве противоракового лекарственного средства, которое вводят как таковое в различных клинических протоколах для уменьшения/регрессии роста раковой опухоли (Международная патентная заявка №WO 97/40841).
Таксан настоящей заявки, ковалентно связанный с НА или производными НА, как указано выше, отличается от всех препаратов таксанов, в частности, ковалентная связь паклитаксела с НА или производными НА, необязательно при помощи соединяющей группы, делает паклитаксел растворимым в воде без снижения его фармакологической активности.
Действительно, эксперимент in vivo, описанный в примере 1, явно демонстрирует одинаковую противораковую эффективность данного конъюгированного паклитаксела и неконъюгированного паклитаксела, когда их вводят при одинаковых дозах.
Кроме того, НА-паклитаксел может проявлять неожиданные фармакологические свойства, которые отличаются от фармакологических свойств неконъюгированного паклитаксела, особенно в случае некоторых типов опухоли.
Действительно, в примере 2 явно показано, что настоящее эфирное производное НА, связанной с паклитакселом, обладает новой противоопухолевой фармакологической активностью: на модели цитотоксичности in vitro, описанной ниже, НА-паклитаксел настоящего изобретения неожиданного проявляет противораковую активность, которая является значительно превосходящей активность, проявляемую взятым отдельно неконъюгированным паклитакселом.
Новые противоопухолевые свойства означает, что данные таксаны, особенно, паклитаксел, конъюгированный с НА или производными НА, могут быть использованы для получения фармацевтических композиций, применимых в качестве химиотерапевтического лекарственного средства не только для лечения всех форм опухоли, для лечения которых вводят таксол®, но также для других форм опухоли, которые обычно не лечат таксолом®, таких как рак желудка и печени, рак толстой кишки, меланомы и лейкоза. Кроме того, его можно использовать при системных аутоиммунных нарушениях, таких как ревматоидный артрит, системная красная волчанка, аутоиммунный гломерулонефрит и, наконец, тиреоидит Хашимото.
Использование настоящих продуктов в новой фармакологической терапии для вышеуказанных патологий возможно, поскольку новое соединение НА-паклитаксел снижает системную токсичность таксола®, таким образом повышая терапевтическую эффективность самого лекарственного средства, так как он:
- является водорастворимым;
- не ассоциируется с кремофором® EL и, следовательно, не проявляет токсичные действия, которые проявляет кремофор;
- является одинаково эффективным при дозах, определенно более низких, чем дозы, обычно используемые в клинических протоколах, или равных этим дозам.
Известно также использование паклитаксела в качестве лекарственного средства, которое используют для ингибирования процесса рестеноза, который обычно следует после пластической операции на сосудах (предпочтительно, артериальных сосудах), коронарного шунтирования и трансплантаций органов.
Настоящие таксаны, в частности, паклитаксел, ковалентно связанные с НА или производными НА, можно также использовать для профилактики рестеноза или они могут быть использованы для образования внутреннего покрытия для стентов и устройств, имплантируемых после вышеуказанных сосудистых операций, так как было доказано, что они возможно связываются химическим образом с поверхностью указанных стендов или легко адсорбируется на ней.
В любом случае время пребывания данных продуктов на поверхности стента и, следовательно, их постепенное высвобождение в кровоток больше, чем у неконъюгированного паклитаксела, вследствие того, что химические-физические характеристики НА способствуют прогрессирующему, медленному, но непрерывному высвобождению таксола® с поверхности устройства.
Фармацевтические композиции, включающие в себя настоящие таксаны, ковалентно связанные с НА или производными НА, могут быть введены системным способом (внутривенными или артериальными, внутримышечными, внутрибрюшинными, подкожными или пероральными путями), они могут быть использованы для местного применения (чрескожной абсорбцией) или они могут быть введены непосредственно в место раковой опухоли при помощи инъекции.
НА или ее производное, ковалентно связанное с паклитакселом, может также действовать в качестве противоракового лекарственного средства per se.
В нижеследующем примере 1 автор заявки показывает, как лечение экспериментально индуцированного роста опухоли у «голых» мышей сшитым производным НА, АСР®, обнаруживает значительный регресс опухоли по сравнению с необработанными контролями.
Автор заявки поэтому описывает в первый раз новую роль НА и ее производных, которые входят в состав настоящих продуктов таксан-НА или таксан-производное НА, в качестве противоопухолевых агентов и их сравнительные использования в области онкологии. Кроме того, настоящие таксаны, ковалентно связанные с НА или производными НА, могут быть ассоциированы с различными биологически и фармакологически активными молекулами, такими, как например, стероиды, гормоны, белки, трофические факторы, витамины, нестероидные противовоспалительные лекарственные средства, химиотерапевтические лекарственные средства, антагонисты кальция, антибиотики, антивирусные агенты, интерлейкины и цитокины, такие как интерферон. Таким образом, можно получить много различных ассоциаций вышеуказанных лекарственных средств и относительно различные фармацевтические композиции, содержащие таксаны изобретения.
Настоящее изобретение относится также к способу получения настоящих таксанов, особенно, паклитаксела, ковалентно связанного с НА или производными НА; данные продукты могут быть получены следующими способами:
1) непрямым синтезом, который включает в себя введение соединяющей группы (спейсера, spacer) между таксаном и НА или производным НА, или
2) прямым синтезом между таксаном и НА или производным НА.
Функциональными группами НА или производных НА, которые могут реагировать с таксаном непосредственно или не непосредственно при помощи соединяющей группы (spacer), являются следующие группы:
1) гидроксильные группы;
2) карбоксильные группы.
Соединяющее соединение может быть, например, выбрано из группы, состоящей из алифатической или аралифатической цепи, неразветвленной или разветвленной, замещенной одной или несколькими группами, выбранными из гидроксильных, карбоксильных или карбонильных групп, эпоксидов, ацилхлоридов, меркаптанов, нитрилов, галогенов, ангидридов, изоцианатов и изотиоцианатов и аминогрупп.
Среди возможных соединяющих соединений предпочтительными являются бромпроизводные карбоновых кислот, имеющих от 2 до 18 атомов углерода, и особенно кислот, имеющих от 3 до 10 атомов углерода, более предпочтительными являются 3-бромпропионовая кислота и 4-броммасляная кислота.
Реакция синтеза между функциональными гидроксильными группами НА (или ее производных) и таксановым компонентом, таким как паклитаксел, может быть проведена способом непрямого или прямого синтеза.
Непрямой синтез может привести к образованию следующих типов ковалентной связи между соединяющей группой и НА или производными НА:
сложноэфирной группы:
- включающей в себя карбоксильную функциональную группу подходящим образом выбранной соединяющего соединения, которую активируют активирующим агентом, таким как, например, карбодиимид (схема 1, ниже);
- включающей в себя гидроксильные группы НА или производного НА, которые бромируют или замещают тозильной группой с последующим нуклеофильным замещением карбоксилом подходящим образом выбранного соединяющего соединения (схема 2, приведенная ниже); или включающей в себя ангидридную функцию подходящим образом выбранного соединяющего соединения (схема 3, приведенная ниже);
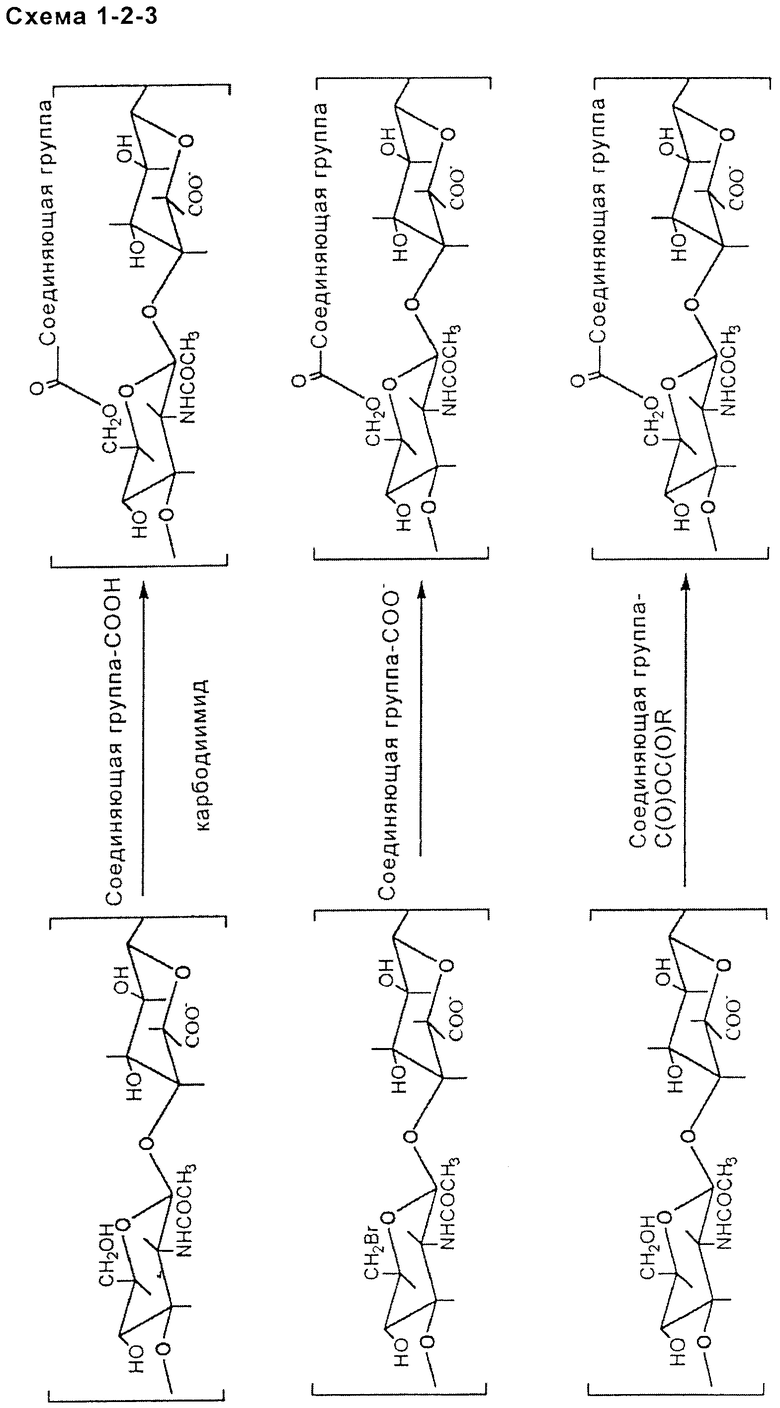 уретановой или тиоуретановой связи:
уретановой или тиоуретановой связи:
- включающей в себя аминогруппу подходящим образом выбранной соединяющей группы (схема 4, приведенная ниже), или
- включающей в себя изоцианатную или изотиоцианатную функциональую группу подходящим образом выбранной соединяющей группы (схема 5, приведенная ниже).
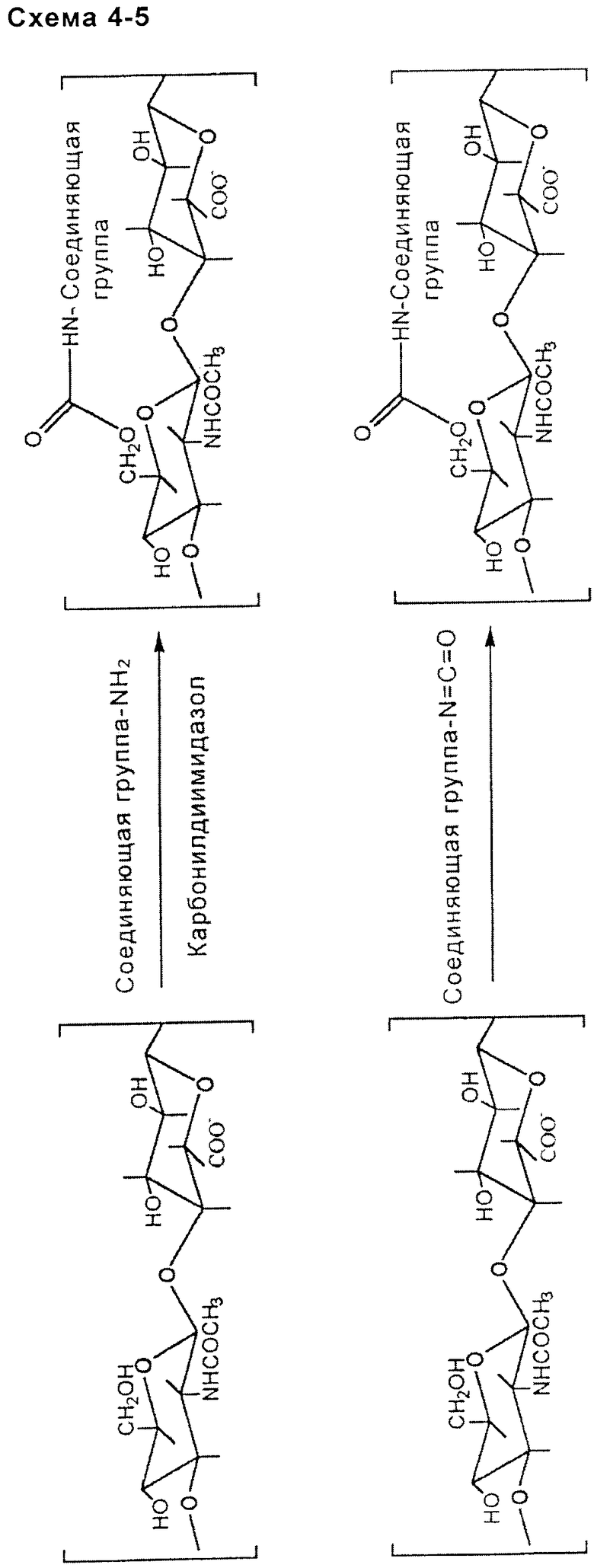 простой эфирной связи:
простой эфирной связи:
- включающей в себя функциональную эпоксигруппу (подходящим образом выбранной) соединяющей группы (схема 6, приведенная ниже);
- включающей гидроксигруппы НА или производного НА, которые бромируют или замещают тозильной группой с последующим нуклеофильным замещением гидроксильной группой подходящим образом выбранной соединяющей группы (схема 7, приведенная ниже).
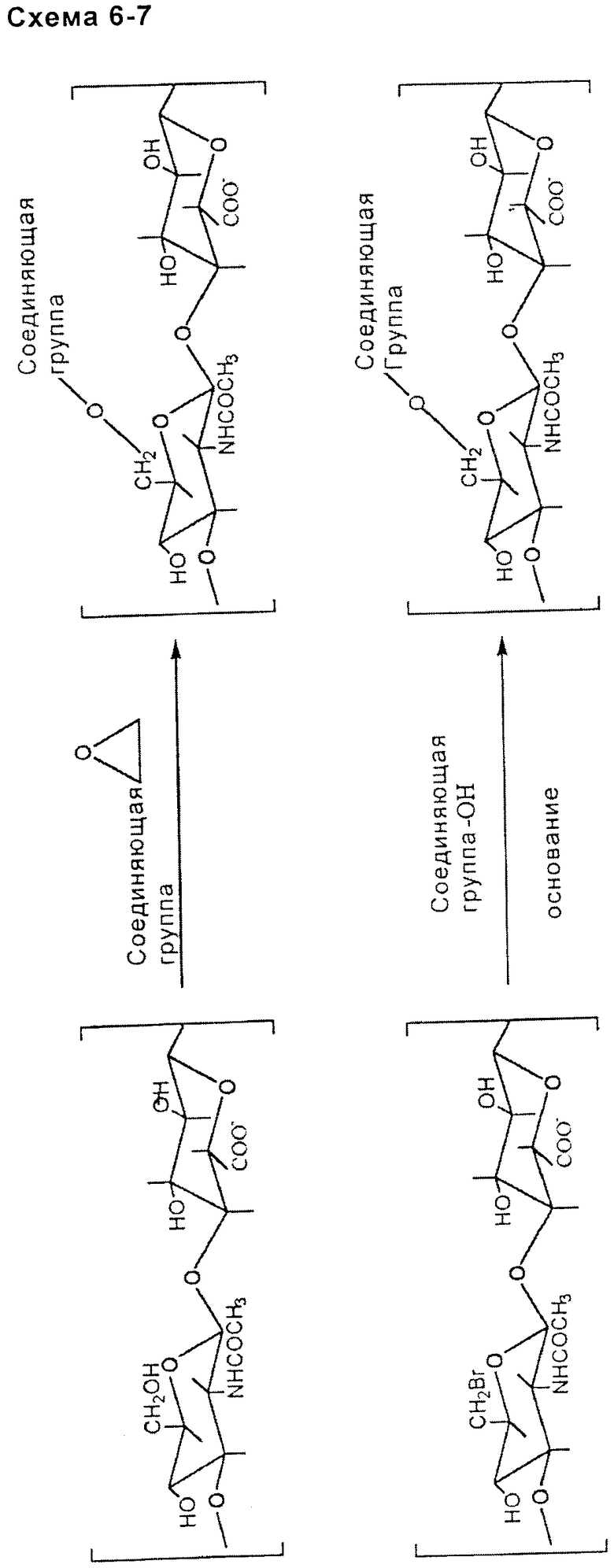
ацетальной или кетальной связи:
- включающей в себя альдегидную и/или кетонную группу подходящим образом выбранной соединяющей группы (схема 8, приведенная ниже);
- включающей гидроксильную группу подходящим образом выбранной соединяющей группы и требующей присутствия простого карбонильного соединения, такого как формальдегид (схема 9, приведенная ниже).

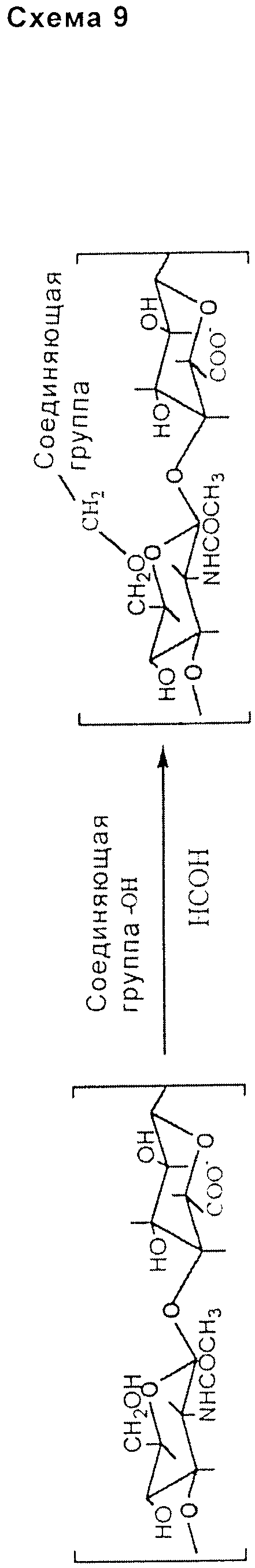
Вышеописанные способы могут быть осуществлены с использованием агентов, активирующих гидроксильную группу НА или производных НА, например, выбранных из группы, состоящей из карбонилдиимидазола и ди-(N-сукцинимидил)карбоната.
Прямая реакция синтеза между гидроксильными группами НА или производных НА и таксаном, таким как паклитаксел, может привести к образованию следующего типа ковалентной связи:
ацетальной связи:
- включающей гидроксильную группу таксана и гидроксильные группы НА или производных НА, которые ковалентно связывают присоединение простого карбонильного соединения, такого как формальдегид (схема 10).
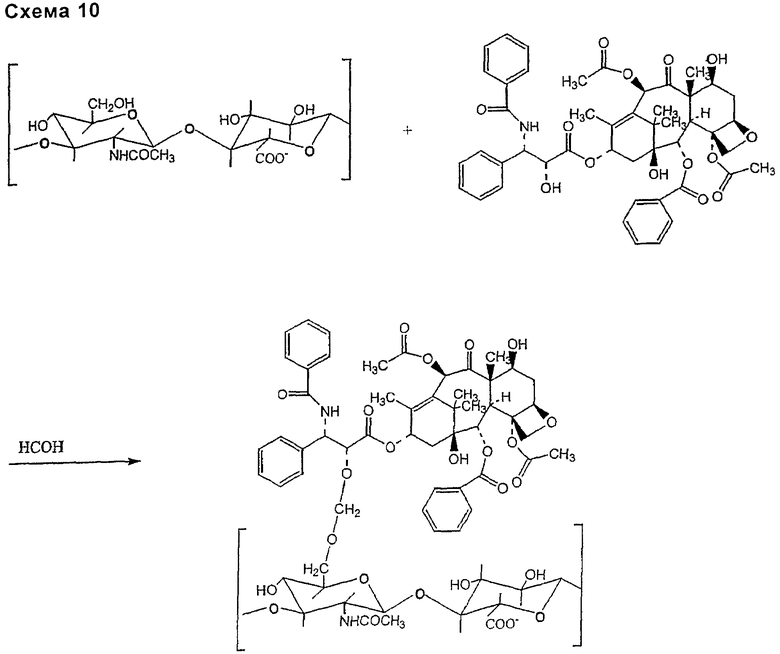
Реакцию между карбоксильными группами НА или производных НА и таксаном, таким как паклитаксел, можно проводить способом прямого или непрямого синтеза. Непрямой синтез может привести к образованию следующих типов ковалентной связи между соединяющим соединением и НА или производными НА:
сложноэфирная связь:
- карбоксильную группу подходящим образом выбранного соединяющего соединения, такого как 4-броммасляная кислота, активируют активирующим агентом, таким как карбодиимид, и таким образом делают ее подходящей для синтеза с гидроксильной группой таксана (предпочтительно, группой на атоме углерода у С2'), такого как паклитаксел. Затем прямым контактированием в безводном растворителе с четвертичной аммониевой солью, в частности с тетрабутиламмониевой (ТВА) солью НА или производного НА, получают нуклеофильное замещение карбоксила НА или производного НА на бромсоединяющего соединения. Таким способом получают сложноэфирную связь между НА или производным НА и соединяющей группой в свою очередь связанной с паклитакселом. В альтернативном случае нуклеофильное замещение карбоксильной группы НА или производного НА бромсоединяющего соединения можно проводить перед образованием связи между самим соединяющим соединением и таксаном (схема 11, приведенная ниже).
- посредством использования активирующих агентов карбоксильной группы НА или производного НА, таких как карбодиимид, можно образовать сложноэфирную связь между указанной группой и функциональной гидроксильной группой (подходящим образом выбранного) соединяющего соединения, предварительно или впоследствии связанного с паклитакселом (схема 12, приведенная ниже).
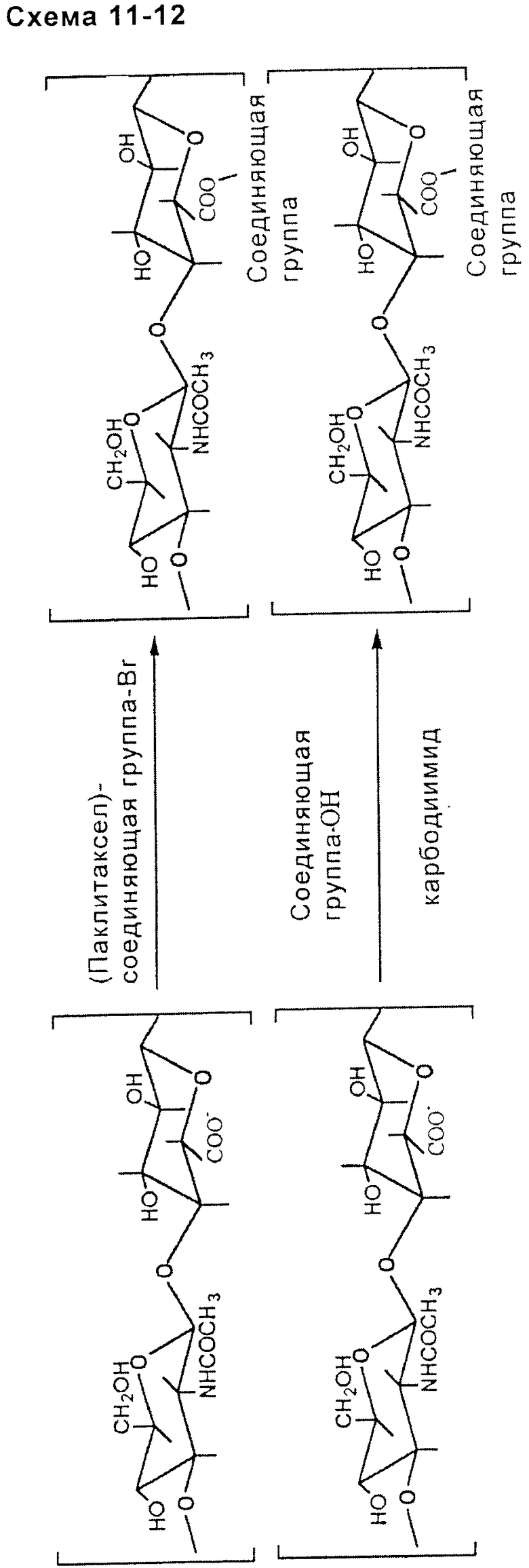
амидная связь:
- активация карбоксильных групп НА или производных НА активирующим агентом, способным связываться с аминогруппой подходящим образом выбранного соединяющего соединения, за исключением гидразидов, предварительно или впоследствии связанного с таксаном, таким как паклитаксел (схема 13, приведенная ниже).
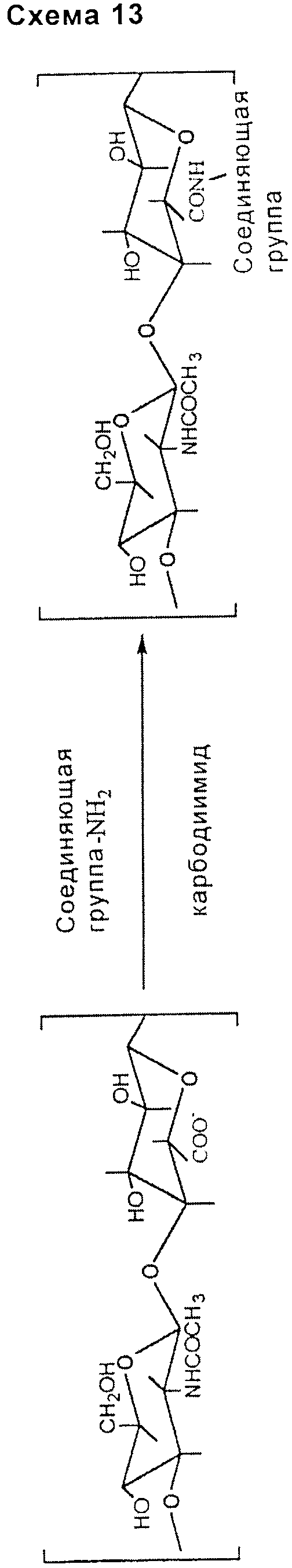 Прямой синтез может привести к образованию следующих типов ковалентной связи:
Прямой синтез может привести к образованию следующих типов ковалентной связи:
сложноэфирная связь:
- активация карбоксильных групп НА или производного НА активирующим агентом, придающим возможность связыванию ее с гидроксильной группой таксана (схема 14, приведенная ниже).
- активация гидроксильной группы таксанового компонента активирующим агентом, придающим возможность связывания ее с функциональной карбоксильной группой НА или производного НА (схема 14, приведенная ниже);
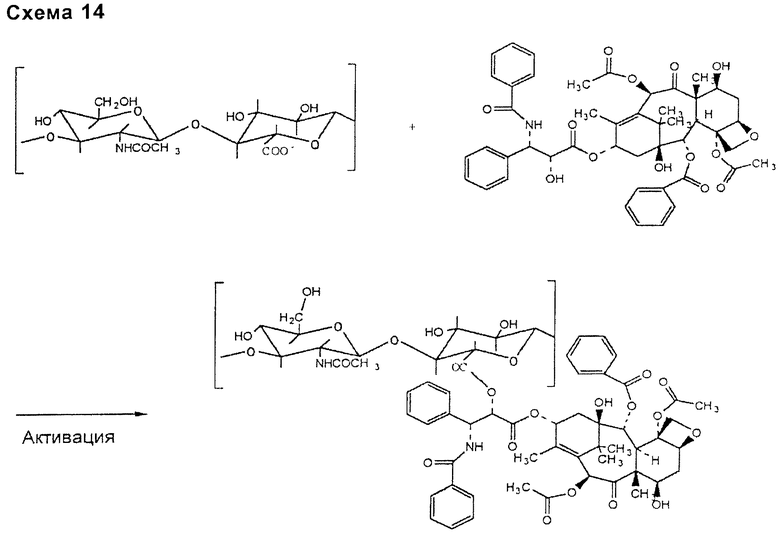
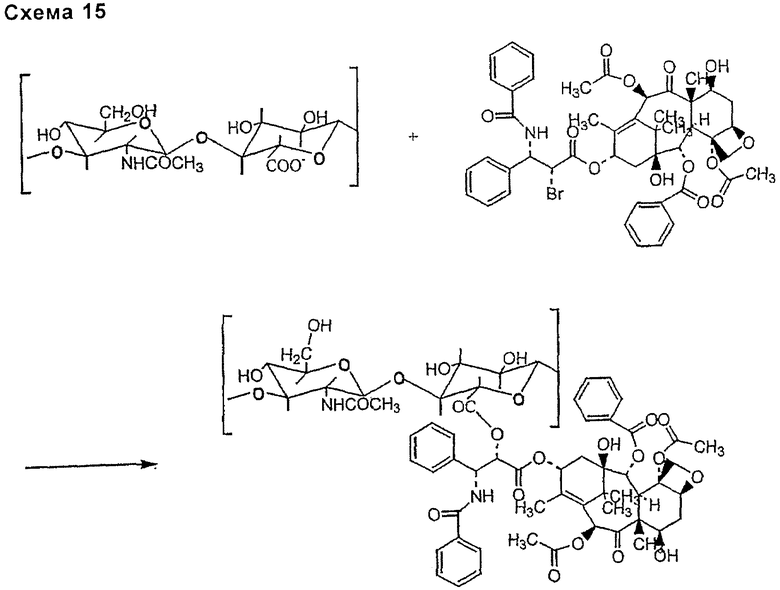
- следующий тип связи требует бромидного или тозилатного производного таксана. Указанную связь получают реакцией нуклеофильного замещения бромидной или тозильной группы карбоксильной группой НА или производного НА (схема 15, приведенная ниже).
Реакцию синтеза между аминогруппами деацетилированной НА и таксановым компонентом, таким как паклитаксел, можно проводить способом непрямого или прямого синтеза.
Непрямой синтез может привести к образованию следующих типов ковалентной связи между соединяющим соединением и НА:
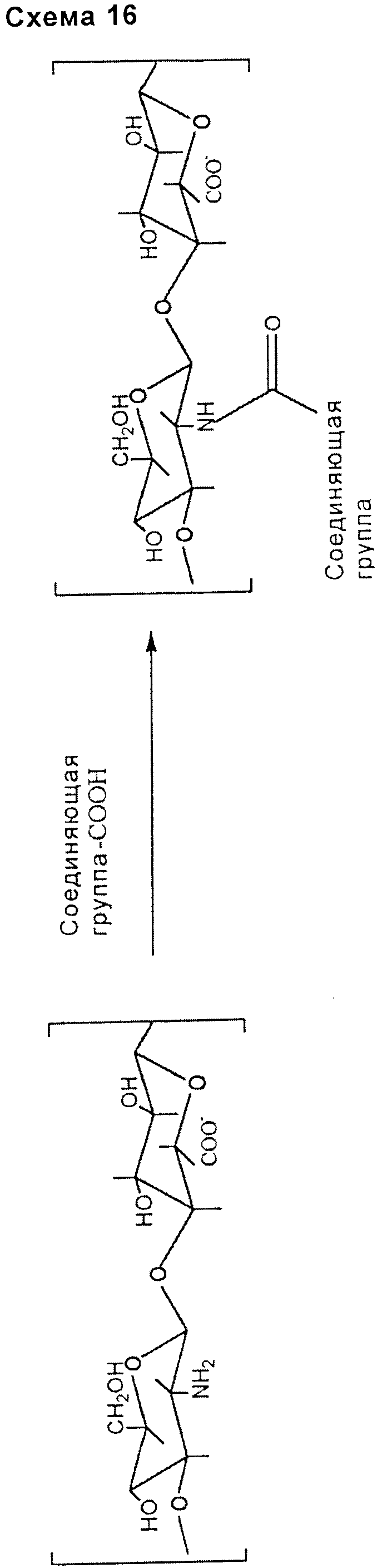
амидной связи:
- включающей в себя карбоксильную группу подходящим образом выбранного связывающего соединения (схема 16);
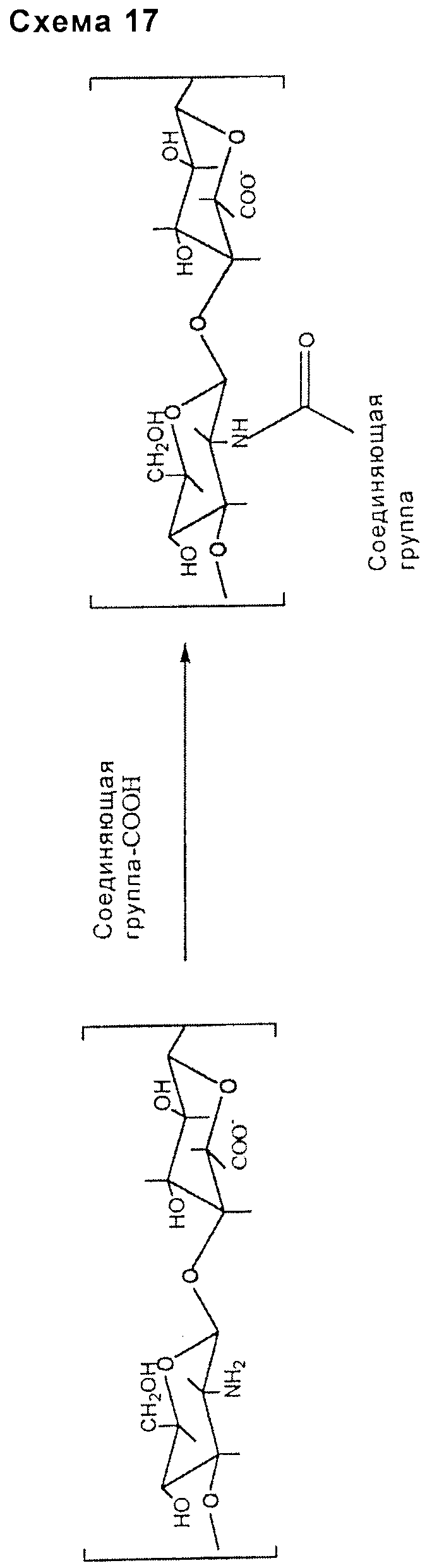
уретановой или тиоуретановой связи:
- включающей в себя гидроксильную или тиольную группу подходящим образом выбранного соединяющего соединения (схема 17).
Прямой синтез может привести к образованию следующего типа ковалентной связи:
уретановой связи:
- включающей в себя гидроксильную группу таксана и функциональную аминогруппу деацетилированной НА (схема 18).
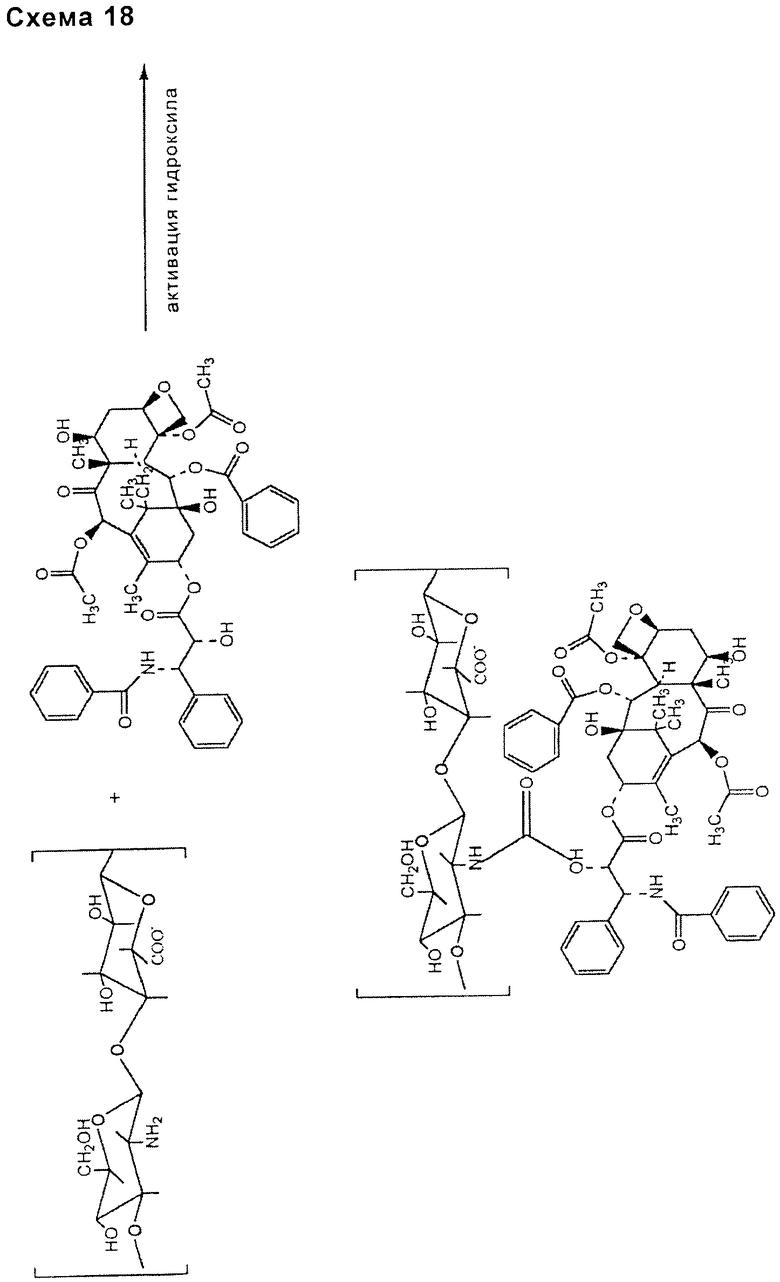
По такому же способу связью, включающей в себя соединяющее соединение и таксан, такой как паклитаксел, может быть связь типа сложного эфира (схема 19), уретана или тиоуретана (схема 20), ацеталя или кеталя (схема 21), для ее образования может требоваться присутствие активирующего агента, особенно для сложноэфирных и уретановых связей.
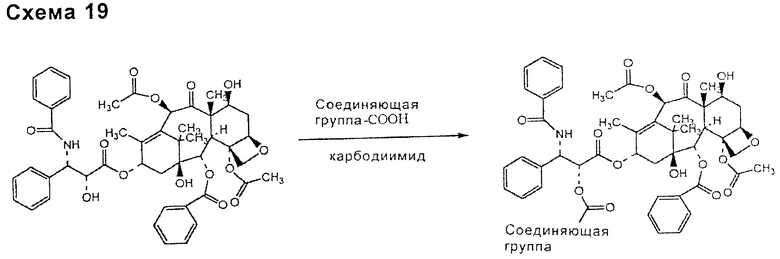
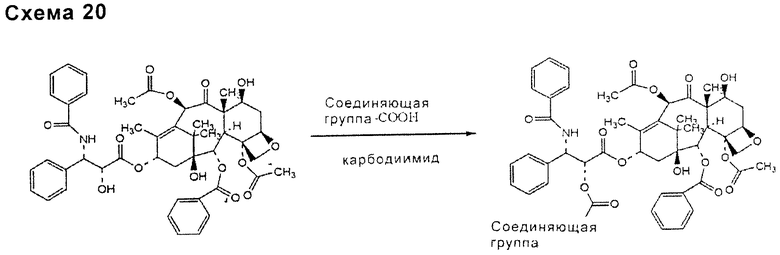
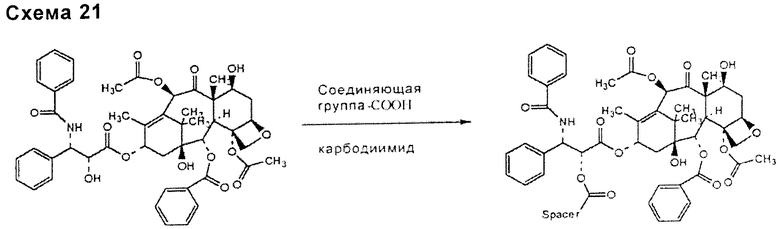
Соединяющее соединение может быть связано с таксаном, таким как паклитаксел, до или после связывания с функциональными группами НА или производных НА, в зависимости от типа функциональных групп подходящим образом выбранного соединяющего соединения.
Процент прямого или непрямого связывания таксана, такого как паклитаксел, с НА или производным НА может варьировать между 0,1% и 100%, предпочтительно, между 0,1% и 35%.
Следующие примеры приведены для предоставления неограничивающих иллюстраций настоящего изобретения.
Пример 1
Влияние новых эфирных производных НА с паклитакселом на «голых» мышей после имплантации опухолевых клеток
Для данного эксперимента авторы инокулировали клетками аденокарциномы яичника человека, OVCAR-3, иммунодепрессивных голых мышей, принадлежащих к виду Athymic CD-1. Каждую мышь инокулировали внутрибрюшинным путем 5×106 раковых клеток.
Экспериментальная схема:
Испытуемые лекарственные средства:
- таксол, обрабатывали 5 животных;
- HYTAD1p20: эфирное производное НА, ковалентно связанное с паклитакселом, с 16% этерификации карбоксила (мас./мас.). Молекулярная масса НА, используемой для синтеза данного нового лекарственного средства, была 200000 Да (см. пример 7 для деталей его получения). Для этого лекарственного средства также использовали пять животных.
Обработанные животные: 10 животных сначала инокулировали клетками OVCAR-3.
Пять животных использовали для эксперимента с Таксолом® и другие пять использовали для экспериментов с HYTAD1p20:
- все десять животных затем получали внутрибрюшинной инъекцией 3 дозы фармакологического средства (на 6-й, 13-й и 20-й дни после инокуляции раковых клеток), равные 20 мг/кг массы тела Таксола® или 125 мг/кг массы тела HYTAD (соответствует 20 мг/мышь паклитаксела).
Контрольные животные: 5 животных сначала инокулировали индуцирующей раковое заболевание суспензией клеток OVCAR-3, после чего они не получали какого-либо лечения.
Определение кривой выживания
Кривую выживания вычисляли из данных лечебного вмешательства на 92-й день после инокуляции раковых клеток в брюшную полость.
Результаты: полученные результаты иллюстрируются на фигуре 1.
Трое контрольных животных имели развившуюся аденокарциному яичников и погибли между 70-м и 75-м днем после инокуляции раковых клеток. На 92-й день после лечебного вмешательства, последний день эксперимента, ни одно из животных, которые получали фармакологическую обработку паклитакселом или HYTAD, не погибло.
Пример 2
Эксперимент in vitro
Целью эксперимента in vitro в основном было определение профиля активности новых эфирных производных НА, связанной с паклитакселом, и оценка/сравнение противоопухолевой активности производных HYTAD с паклитакселом, чтобы таким образом определить их фармакологический потенциал по сравнению с противоопухолевым лекарственным средством.
Экспериментальная схема:
Испытуемые продукты:
- Таксол: ссылочный продукт
- HYTAD1p20 - HYTAD2p20 - HYTAD2p10: эфирные производные НА, ковалентно связанные с паклитакселом с 16% этерификацией карбоксила (мас./мас.) (в случае HYTAD1p20 молекулярная масса НА, используемой в синтезе этого нового лекарственного средства, составляет 200000 Да) (см. пример 7 для деталей его получения) или 22% (в случае HYTAD2p20 молекулярная масса используемой НА составляет 39000 Да), или 6,8% (в случае HYTAD2p20, молекулярная масса используемой НА составляет 39000 Да).
Клеточные линии
Клеточные линии человеческого происхождения
Использовали четыре клеточные линии рака молочной железы человека. Все четыре из испытуемых штаммов клеток обычно восприимчивы к паклитакселу и явно экспрессируют рецептор CD44 с такой же амплификацией.
- MCF-7
- MDA-MB-231
- MDA-MB-468
- SKBR-3
Экспериментальный протокол:
1) Испытуемую клеточную линию засевают при концентрации 3000 клеток на лунку на 96-луночном планшете с плоским дном;
2) спустя 24 часа в клетки добавляют испытуемые растворы, подходящим образом разведенные в культуральной среде;
3) еще через 72 часа клетки испытывают колориметрией с использованием бромида 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2Н-тетразолия (МТТ) оценкой их жизнеспособности, данное испытание обнаруживает также различную восприимчивость клеток к испытуемому лекарственному средству. Это возможно, потому что митохондриальная дегидрогеназа способна восстановить тетразолиевые соли (желтые) в кристаллы синего формазана. Большую или меньшую интенсивность цвета оценивают спектрофотометрией (Dezinot F. et al., J. Immunol. Methods, 1986, 22 (89): 271-277).
Результаты
Ниже авторы приводят в таблице и в графической форме на фигуре 2 результаты, полученные в терминах IC50 (концентрация лекарственного средства, необходимая для ингибирования роста клеток на 50% в отношении испытуемого продукта и различных использованных клеточных линий).
На фигуре 2 ось абсцисс представляет собой фармакологическую активность, выраженную как IC50 и вычисленную как отношение между молярными концентрациями по сравнению со ссылочным продуктом (паклитакселом), которую обычно принимают такой, чтобы она имела величину ноль. Следовательно, заштрихованные колонки указывают фармакологическую активность, которая выше, чем у ссылочного продукта.
IС50 (выраженная как нМ или мкМ паклитаксела или его HYTAD-производных в культуральной среде)
Заключение
Как указывается в литературе, все используемые клеточные линии являются восприимчивыми к таксолу, лекарственному средству, в основном используемому для лечения метастатической карциномы молочной железы и яичников. Что касается клеточных линий рака молочной железы, показано, что различные HYTAD являются значительно более сильными средствами, чем паклитаксел, с фактором +150 относительно HYTAD1p20 на линии клеточных клеток MCF-7.
Пример 3
Влияние геля АСР на голых мышей после имплантации опухолевых клеток
Для данного эксперимента авторы использовали клетки НТ29 карциномы толстой кишки человека в организме иммунодепрессированных голых мышей, относящихся к виду Athymic Nude-nu (nu-nu). Каждое животное анестезировали и 0,3 мл суспензии клеток НТ29 инъецировали в его брюшную полость при концентрации 166000 клеток/мл. Таким образом, каждая мышь получала 50000 раковых клеток.
Экспериментальная схема:
Обработанные животные: 113 животных сначала инокулировали НТ29 и сразу после этого они получали одну дозу обработки, равную 0,2 мл геля АСР 40 мг/мл.
Контрольные животные: 117 животных инокулировали суспензий раковых клеток НТ29, но они не получали лечения.
Кривая выживания: кривую выживания вычисляли со дня инокуляции до дня гибели. Гибель либо устанавливали, либо вызывали умерщвлением животных, масса которых снижалась более чем на 20% их исходной массы, и в случае гемоперикарда, указывающего на диффузные метастазы. Процент выживания в двух группах определяли ежедневно и выражали в виде графика для получения кривой, показанной на фигуре 3.
Эксперимент продолжался 120 дней, после окончания которого всех выживших животных умерщвляли и исследовали некроскопическим способом для контроля присутствия опухолей в брюшной полости.
Результаты: 32 животных из 230 не проявляли развития никакой заметной неоплазии. 22 из этих животных принадлежали к группе мышей, обработанных гелем АСР®, 10 - к контрольной группе.
Гель АСР®: 19,5% обработанных животных не обнаружили неоплазию;
контроль: 8,5% контрольных животных не обнаружили неоплазию.
Пример 4
Получение НА с молекулярной массой между 5000 и 10000 дальтонов (для возможного синтеза НА-паклитаксел с НА с низкой молекулярной массой)
2,40 г натриевой соли НА с молекулярной массой 990000 Да растворяют в 240 мл раствора 0,15 М NaCl. Раствор затем дополняют 7,9 мл 14% раствора NaOCl. При постоянной температуре +4°C раствор обрабатывают ультразвуком в течение 120 минут при частоте 20 Гц и при 150 Вт. После завершения реакции рН регулируют до 6,5 0,1 н. HCl и раствор затем обрабатывают для осаждения в 1000 мл смеси 2:1 метанол:ацетон. Продукт собирали фильтрованием и сушили в вакууме в течение 48 часов при 45°С. Таким образом получают 1,65 г натриевой соли. Анализ высокоэффективной жидкостной хроматографией (ВЭЖХ) показывает, что полученная фракция НА имеет среднюю молекулярную массу (ММ) 5850, среднечисленную молекулярную массу (MN) 3640 и индекс полидисперсности 1,61.
Пример 5
Получение эфирного производного НА, связанной с паклитакселом, с этерификацией карбоксила приблизительно 4 мас./мас.%
51 мг паклитаксела растворяют в CH2Cl2 и раствор дополняют 104 мг 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC) и 20 мг 4-броммасляной кислоты. Затем раствор распределяют в воде. После удаления остатков карбодиимида и бромида растворитель реакции сушат безводным сульфатом натрия и удаляют роторным испарителем. Полученный таким образом продукт в количестве 21 мг растворяют в N-метилпирролидоне (NMP) и добавляют к 20 мг/мл раствора НА, превращенного в тетрабутиламмониевую (ТВА) соль в NMP (200 мг в 10 мл NMP). После проведения реакции в течение семи дней при температуре окружающей среды раствор разбавляют 5 мл воды и 1 мл насыщенного раствора NaCl. Полученный таким образом раствор перемешивают в течение 1 часа, чтобы можно было заменить натрий на ион ТВА. Затем медленно по каплям один раз добавляют этанол и полученный таким образом волокнистый продукт растворяют в воде, диализуют и, наконец, сушат вымораживанием.
Пример 6
Получение эфирного производного НА, связанной с паклитакселом, с этерификацией у карбоксила приблизительно 10 мас./мас.%
Как в примере 5, 308,7 мг паклитаксела, растворенного в 15 мл дихлорметана, дополняют 117,2 мг 4-броммасляной кислоты и 614,1 мг EDC. Затем к раствору добавляют воду для удаления всего бромида и карбодиимида. Полученный таким образом органический раствор дополняют сульфатом натрия для обезвоживания его, тогда как растворитель удаляют роторным испарителем. В конце концов получают 363 мг промежуточного продукта.
175 мг полученного таким образом промежуточного продукта добавляют к 1 г НА-ТВА, растворенного в безводном NMP. Раствор перемешивают при температуре окружающей среды в течение 7 дней, после чего добавляют 20 мл воды и 4 мл насыщенного раствора NaCl. Смесь перемешивают в течение 1 часа, чтобы провести обмен натрия на ион ТВА. Затем медленно по каплям один раз добавляют этанол и полученный таким образом волокнистый продукт растворяют в воде, диализуют и, наконец, сушат вымораживанием.
Пример 7
Получение эфирного производного НА с паклитакселом с этерификацией у карбоксила приблизительно 16 мас./мас.%
164 мг промежуточного продукта, полученного по процедуре, описанной в предыдущих примерах 5 и 6, добавляют к раствору 680 мг НА-ТВА, растворенного в 25 мл безводного NMP. Спустя 7 дней реакции при температуре окружающей среды раствор дополняют 20 мл воды и 4 мл насыщенного раствора NaCl. Через 1 час медленно по каплям один раз добавляют этанол. Образованный продукт собирают фильтрованием и растворяют в воде, диализуют и когда проводимость раствора диализа снижается ниже 10 мкСм, его замораживают. Замороженный раствор затем сушат замораживанием.
Пример 8
Получение эфирного производного НА с паклитакселом с этерификацией у карбоксила приблизительно 10 мас./мас.%
102,6 мг паклитаксела растворяют в 5 мл дихлорметана и раствор дополняют 20,4 мг янтарного ангидрида. Спустя три часа растворитель удаляют выпариванием с использованием роторного испарителя. Полученный таким образом продукт растворяют в 5 мл диметилсульфоксида (ДМСО) с низким содержанием воды и добавляют 27,3 мг дициклогексилкарбодиимида. Спустя 5 минут раствор дополняют раствором НА-ТВА, полученного растворением 327 мг полимера в 15 мл ДМСО с низким содержанием воды. Раствор перемешивают при температуре окружающей среды в течение 24 часов. Затем к раствору добавляют несколько мл воды и 3 мл насыщенного раствора NaCl. Спустя 1 час осадок осаждают добавлением этанола. Волокнистый продукт, собранный фильтрованием, растворяют в воде, диализуют и, наконец, сушат вымораживанием.
Пример 9
Получение эфирного производного НА с паклитакселом с этерификацией у карбоксила приблизительно 4 мас./мас.%
510,1 мг паклитаксела, растворенного в 6 мл дихлорметана, дополняют 95,4 мг 3-бромпропионовой кислоты и 525,0 мг EDC. Затем к раствору добавляют воду для удаления бромида и карбодиимида распределением, тогда как применяют 10 объемов воды для удаления этих реагентов. Органический раствор дополняют сульфатом натрия для обезвоживания его и растворитель удаляют роторным испарителем.
Таким образом полученный промежуточный продукт в количестве 155,5 мг добавляют к 1,46 г НА-ТВА, растворенного в безводном NMP, и таким образом полученный раствор перемешивают при температуре окружающей среды в течение 7 дней. Затем добавляют 20 мл воды и 4 мл насыщенного раствора NaCl. Раствор перемешивают в течение 1 часа, чтобы осуществить обмен натрия на ион ТВА. Затем медленно по каплям один раз добавляют этанол и полученный таким образом волокнистый продукт растворяют в воде, диализуют и, наконец, сушат вымораживанием.
Пример 10
Получение эфирного производного гиалуроновой кислоты с этерификацией у карбоксила приблизительно 30 мас./мас.%
500 мг паклитаксела растворяют в СН2Сl2 и раствор дополняют 397,6 мг 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC) и 300,9 мг 4-броммасляной кислоты. Затем раствор распределяют в воде. После удаления остатков карбодиимида и бромида реакционный раствор сушат безводным сульфатом натрия и растворитель удаляют роторным испарителем. Полученный таким образом продукт растворяют в NMP и добавляют к раствору, содержащему ~20 мг/мл гиалуроновой кислоты, превращенную в соль с ТВА в NMP (1,95 г в 100 мл NMP). После 7 дней реакции при температуре окружающей среды раствор разбавляют 20 мл воды и 4,5 мл насыщенного раствора NaCl. Раствор перемешивают в течение 1 часа, чтобы провести обмен натрия на ион ТВА. Затем медленно по каплям один раз добавляют этанол и полученный таким образом волокнистый продукт растворяют в воде, диализуют и, наконец, сушат вымораживанием.
Пример 11
Получение частично аутосшитого эфира (приблизительно 10% замещение) НА с 8% мас./мас. паклитаксела
3,10 г НА, превращенного в соль с ТВА, растворяют в 150 мл ДМСО с низким содержанием воды, при температуре окружающей среды. Раствор затем дополняют 541,0 мг промежуточного паклитаксела, полученного по способу, описанному в примерах 5, 6 и 7. После выдерживания его для протекания реакции в течение 7 дней при температуре окружающей среды в реакционный раствор добавляют 126,5 г триэтиламина и всю смесь перемешивают в течение 30 минут.
Раствор 319,5 г йодида 2-хлор-1-метилпиридина в 30 мл ДМСО медленно добавляют по каплям на протяжении 45 минутного интервала и смесь выдерживают при 30°С в течение 15 часов.
Добавляют раствор, образованный 50 мл воды и 1,7 г хлорида натрия, и образовавшуюся смесь медленно выливают в 400 мл ацетона при непрерывном перемешивании. Образуется осадок, который отделяют фильтрованием и промывают три раза 50 мл смеси 5:1 ацетона и воды и три раза ацетоном (50 мл). Таким образом, полученный конечный продукт сушат в вакууме при 38°C.
Пример 12
Испытания на растворимость эфира НА-паклитаксел, полученного по примеру 5, в 5% растворе глюкозы
14,6 мг продукта НА-паклитаксел, полученного этерификацией по примеру 7 (исходя из НА с молекулярной массой 200 кДа) со степенью замещения у карбоксила 16,3 мас./мас.%, растворяли в 1 мл водного 5% раствора глюкозы. Раствор, перемешанный магнитным перемешивающим бруском, может быть профильтрован через 20 мкм стерильный фильтр, установленный на шприце. Концентрация паклитаксела в растворе составляет 2,38 мг/мл.
Авторы пытались также найти максимальную концентрацию продукта на мл 5% водного раствора глюкозы. При концентрации 32,8 мг продукта НА-паклитаксел на мл раствора глюкозы получают вязкий раствор с концентрацией паклитаксела 5,35 мг/мл.
Пример 13
Тесты на выделение паклитаксела из плазмы человека
Получают раствор, который состоит из 101,3 мг продукта НА-паклитаксел в 10 мл воды. НА-паклитаксел получают, как описано в примере 7. Тесты на выделение проводят помещением 40 мг вышеописанного раствора в контакте с 2 мл плазмы человека при 37°С.
Для определения паклитаксела, который высвобождается в плазму отделением себя от НА, устанавливали три времени контактирования: 6, 30 и 60 минут. В конце каждого интервала контактирования паклитаксел экстрагировали из раствора плазма-НА-паклитаксел 3 промываниями, каждый раз 1,5 мл трет-бутилметилового эфира (ТВМЕ), продукт трех экстракций собирали вместе, упаривали досуха природным испарением при 65°С и снова суспендировали в 400 мкл абсолютного этанола для определения содержания рассматриваемого лекарственного средства ВЭЖХ (высокоэффективной жидкостной хроматографией). Полученные результаты показаны на фигуре 4: спустя 6 минут более чем 80% паклитаксела становилось отделенным от НА и такой процент не повышался при более позднем времени наблюдения.
Пример 14
Приготовление эфирного производного гиалуроновой кислоты (НА) с паклитакселом с прямой эстерификацией у карбоксила примерно 10% w/w (мас./мас.%)
0,5211 г паклитаксела было растворено в сосуде с круглым дном в 15 мл дихлорметана и дополнено 0.1185 г П-толуол хлорида (p-Toluenesulfonil Chloride) и 0.0751 г диметиламинопиридина (ДМАП/DMAP). Реакция активации гидроксила происходила при комнатной температуре при перемешивании в течение ночи. В дальнейшем, реакция была доведена до получения продукта («выбивки» продукта (worked up)) путем добавления воды и экстрагирования посредством DCM; органическая фаза затем была дополнена сульфатом магния для дегидратации и после фильтрации была высушена и сконцентрирована на ротационном испарителе Rotavapor.
320 мг промежуточного продукта, полученного таким образом, были добавлены к 1.987 г НАТВА, растворенного в безводном NMP. Раствор перемешивался при температуре окружающей среды в течение 7 дней, после чего 20 мл воды и 8 мл насыщенного раствора NaCl было добавлено. Раствор, полученный таким образом, перемешивался в течение 1 часа для того, чтобы позволить обмен натрия с ионами ТВА. Затем медленно добавляли этанол, капля за каплей, и полученный таким образом волокнистый продукт растворялся в воде, диализировался и, наконец, подвергался сухой заморозке.
Пример 15
Приготовление эфирного производного гиалуроновой кислоты с паклитакселом с прямой эстерификацией у карбоксила примерно 15% w/w (мас./мас.%)
0,4122 г паклитаксела было растворено в сосуде с круглым дном в 15 мг дихлорметана и дополнено 0.0952 г П-толуол хлорида(р-Toluenesulfonil Chloride) и 0.0601 г диметиламинопиридина (ДМАП). Реакции активации гидроксила позволили происходить при комнатной температуре при перемешивании в течение ночи. В дальнейшем реакция была доведена до получения продукта (доведена до «выбивки» продукта) (worked up) путем добавления воды и экстрагирования посредством DMC; органическая фаза затем была дополнена сульфатом магния для дегидратации и после фильтрации была высушена и сконцентрирована на Rotavapor (ротационный испаритель).
300 мг промежуточного продукта, полученного таким образом, были добавлены к 1.2451 г НАТВА, растворенного в безводном NMP. Раствор перемешивался при температуре окружающей среды в течение 7 дней, после чего 20 мл воды и 5 мл насыщенного раствора NaCl было добавлено. Раствор, полученный таким образом, перемешивался в течение 1 часа для того, чтобы позволить обмен натрия с ионами ТВА. Затем медленно добавляли этанол, капля за каплей, и полученный таким образом волокнистый продукт растворялся в воде, диализировался и, наконец, подвергался сухой заморозке.
Пример 16
Конверсия ин витро данных примера 2 как функции эквивалентов таксола
Корректное значение IC50 для таксола по MDA/MB/231 клеток
Корректная данные для IC50 для таксола по MDA/MB/231 клеток и указанная в таблице по примеру 2 не составляет 0.35 нМ, но составляет 0.35 мкМ, что очевидно при внимательном прочтении фиг.2, где соотношения IC50 таксола к компонентам по изобретению указываются в форме графика. И, по сути, корректной единицей измерения для IC50 не может быть нМ, но является мкМ.
По сути 0.35 мкM соответствуют 350 нМ, поэтому вышеназванное соотношение составит 350/2.58=135, что соответствует значению, указанному в фиг.2.
Анализ результатов по примеру 2
В указанном примере 2 тестируется следующая смесь по изобретению: HYTAD1p20 эфир-производное от НА (гиалуроновой кислоты), ковалентно связанной с палитакселом со степенью эстерификации, расчитанной как w/w 16% (мас./мас.%), причем средняя молекулярная масса гиалуроновой кислоты составляет 200,000 Da, HYTAD1p20 эфир-производное от гиалуроновой кислоты, ковалентно связанной с палитакселом со степенью эстерификации, расчитанной как w/w 22%(мас./мас.%), причем средняя молекулярная масса гиалуроновой кислоты, составляет 39000 Da, HYTAD1p20 эфир-производное от гиалуроновой кислоты, ковалентно связанной с палитакселом со степенью эстерификации, расчитанной как w/w 6,8%(мас./мас.%), причем средняя молекулярная масса гиалуроновой кислоты составляет 39000 Da. Определение степени молярной дериватизации гиалуроновой кислоты(НА) палитакселом, причем вышеназванные производные НА с палитакселом имеют вышеуказанную степень эстерификации, выражающуюся, как массовое процентное содержание:
1) Расчет количества повторяющихся единиц НА, где карбоксильные группы дериватизованы таксолом - спейсером (taxol-spacer % R.U. НА-Тах):
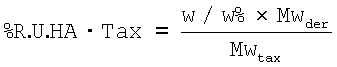
где
w/w % - степень массовой дериватизации
MwDer - молекулярная масса единицы, связывающей таксол-спейсер (Mw R.U.+MWspacer+Mwtaxol)
MWtax - молекулярная масса паклитаксела (853.92 г/моль)
2) Расчет количества повторяющихся недериватизованных единиц НА, где карбоксильные группы представляют собой соль натрия (% R.U. НА Na):
%R.U. НА Na=100-(%R.U. HA-Tax)
3) Расчет количества молей повторяющихся единиц НА дериватизованных паклитакселом (mol HA-tax):
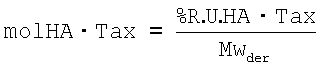
4) Расчет количества молей недериватизованных повторяющихся единиц ГА (mol НА Na):
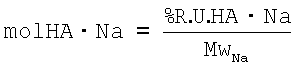
где
MwNa - молекулярная масса недериватизованных повторяющихся единиц НА, где карбоксильные группы представляют собой соль натрия (401.38)
5) расчет молярного процентного соотношения таксола, привязанного к гиалуроновой кислоте (НА):
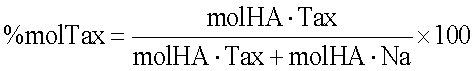
Таким образом, вышеназванная смесь
HYTAD1p20:
- w/w%=16%
- Mwder=(НА Na-Na)+CH2CH2CH2CO+Tax=1301.41
- Mwtax=853.92
% R.U. HA-Tax=16*1301.41/853.92=24.38
% R.U. HA Na=100-24.38=75.62
mol HA-Tax=24.38/1301.41=0.018
mol HA-Na=75.62/401.38=0.188
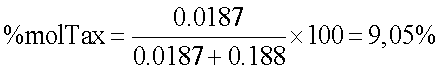
Второе производное HYTAD2p20:
- w/w%=22%
- Mwder=(НА Na-Na)+CH2CH2CH2CO+Tax=1301.41
- Mwtax=853.92
% R.U. HA-Tax=22*1301.41/853.92=33.52
% R.U. НА Na=100-33.52=66.48
mol HA-Tax=33.52/1301.41=0.0257
mol HA-Na=66.48/401.38=0.165
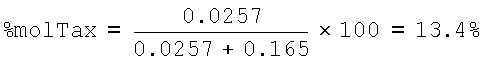
3-й HYTAD2p10:
- w/w%=6.8%
- Mwder=(НА Na-Na)+CH2CH2CH2CO+Tax=1301.41
- Mwtax=853.92
% R.U. HA-Tax=6.8*1301.41/853.92=10.36
% R. U. НА Na=100-10.36=89.64
mol HA-Tax=10.36/1301.41=0.0079
mol HA-Na=89.64/401.38=0.223
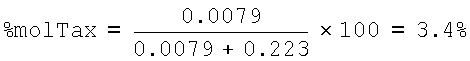
Теперь мы переконвертируем значения, указанные в таблице по примеру 2 (исправленные в плане значений IС50 к паклитакселу, что подчеркнуто в п.(1)), с тем, чтобы определить IС50, выраженный в количествах эквивалентов таксола (IC50taxol equivalents (эквивалент таксола)), содержащихся в трех протестированных выше смесях от IС50 выраженного как нМ протестированного продукта (IС50nM tested conpounds) путем приложения следующей математической формулы
IC50taxol equivalents (эквиваленты таксола)=IC50nМ tested products(тестированные продукты)×% степень замены моль таксола/моль ГА.
У нас имеется следующая таблица:
Далее следует, что смеси по изобретению соответственно более эффективны, чем таксол по:
- MCF/7 клеток соответственно: 3.5/0,11=в 31.8 раз (times)
3.5/0.0022=1590 раз 3.5/0.023=152.1 раз,
- MDA/MB/231 соответственно 350нM / 0.34нМ=в 1100 раз (times), 350nМ/8.16=43раз
SKBR/3: 0.23/ 0.0047=48.9 раз
Пример 17
Приготовление эфирного производного НА (гиалуроновой кислоты) с палитакселом путем прямой эстерификации (эфиризации) карбоксильной кислоты с применением активизирующего агента, отличного от тозилата или бромида
0,6035 г ди(N-сукцинимидил) карбоната было растворено в 20 мл ацетонитрила в сосуде с круглым дном под потоком азота. После полного растворения, 0.5010 г паклитаксела, предварительно растворенного в 20 мл ацетонитрила, и 140 мл пиридина было добавлено. Реакции позволили проистекать при перемешивании при комнатной температуре под потоком азота. После 24 часов растворитель был удален под вакуумом в Rotavapor и необработанный продукт помещался в дихлорметан. Белый осадок был отфильтрован, а органическая фаза была пять раз промыта водой слабой кислотности (рН около 4). После экстрагирования органическая фаза была дополнена сульфатом натрия для удаления воды, отфильтрована и высушена в ротационном испарителе.
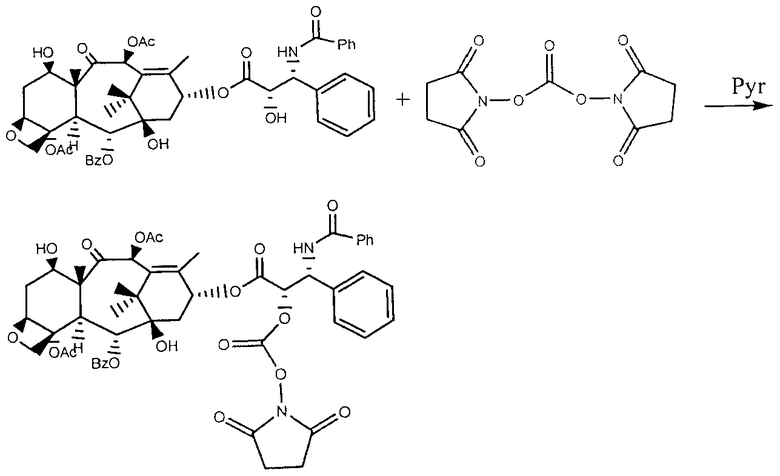
Вторым шагом 0.534 мг активированного паклитаксела, полученного таким образом, было растворено в 50 мл NMP и добавлено к 2.1787 г НАТВА, предварительно растворенного в безводном NMP. Смесь перемешивалась при 35°С в течение 24 часов, после чего 12 мл насыщенного раствора NaBr было добавлено, и перемешивание продолжалось еще один час, с тем, чтобы допустить замену ионов ТВА натрием. Затем конъюгат был выведен в осадок путем добавления этанола капля за каплей, и очищен промывкой смесью этанол/вода 90:10, до полного удаления солей и несвязанного паклитаксела.
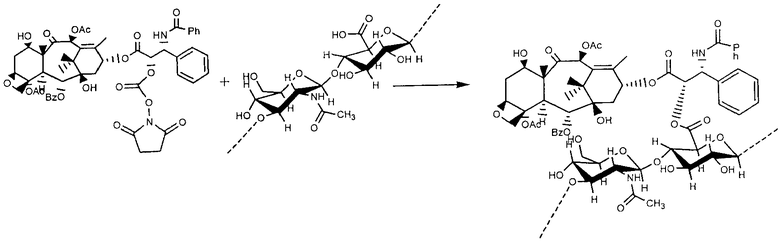
Пример 18
Приготовление эфирного производного НА (гиалуроновой кислоты) с палитакселом путем непрямой эфиризации в гидроксильных группах, предварительно активированных тозилатом
В раствор палитаксела в сухом пиридине (0.4 г/мл) было добавлено 10 эквивалентов янтарного ангидрида с тем, чтобы получить 2'-O-сукцинил-паклитаксел производного (спейсер-паклитаксел). Смесь реакции содержалась при комнатной температуре в течение 3 часов при барботировании азотом. Затем растворитель был выпарен под вакуумом, а твердый остаток был очищен от свободного янтарного ангидрида путем суспендирования в слабокислотной дистиллированой воде, при перемешивании в течение 30 минут и пятикратном центрифугировании. Затем окончательный очищенный продукт был высушен.
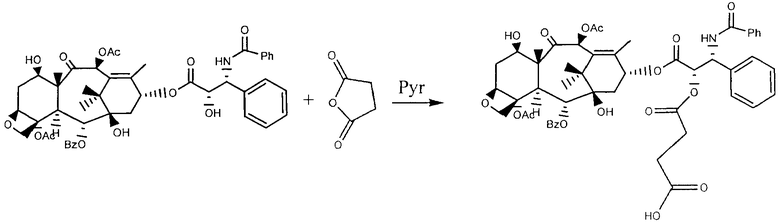
Тем временем 2.1241 г ГА ТВА было растворено в 500 мл DMSO и дополнено 0.0961 г р-толуолсульфонил хлорида и 0.0641 г диметиламинопиридина (ДМАП) с тем, чтобы активировать гидроксильные группы гиалуроновой кислоты. Реакции активации гидроксила позволили происходить при комнатной температуре с перемешиванием в течение ночи, затем раствор был разбавлен 300 мл DMSO.
Затем 1.8535 г 2'-O-сукцинил-паклитаксел производного, растворенного в 6 мл пиридина, было добавлено по капле в активированную гиалуроновую кислоту и реакция эфиризации осуществлялась при 35°С в течение 48 часов, после чего 12 мл насыщенного раствора NaBr было добавлено. Таким образом полученная смесь перемешивалась еще один час, с тем, чтобы допустить замену ионов ТВА натрием. Затем конъюгат был выведен в осадок путем добавления этанола и очищен промывкой смесью этанол/вода 90:10 до полного удаления солей и несвязанного 2'-O-сукцинил-паклитаксела.
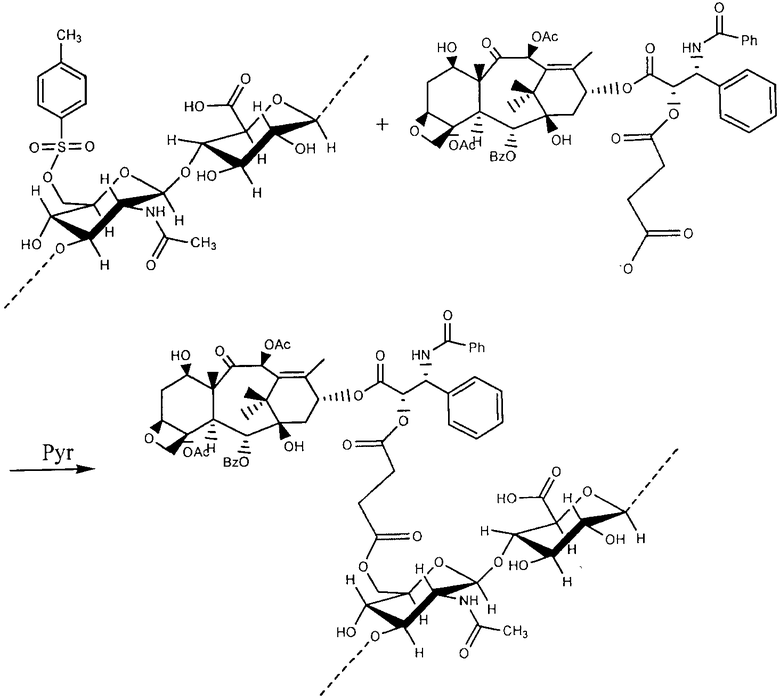
Пример 19
Приготовление эфирного производного гиалуроновой кислоты с палитакселом путем непрямой эстерификации (эфиризации) в гидроксильных группах посредством разделителя, содержащего функциональную группу ангидрида
0.6157 г Di(N-succinimidyl) карбоната было растворено в 20 мл ацетонитрила в сосуде с круглым дном под потоком азота. После полного растворения, 0.5105 г паклитаксела, предварительно растворенного в 60 мл ацетонитрила, и 140 мл пиридина было добавлено. Реакции позволили проистекать при перемешивании при комнатной температуре под потоком азота. После 24 часов растворитель был удален под вакуумом в Rotavapor и необработанный продукт помещался в дихлорметан. Белый осадок был отфильтрован, а органическая фаза была пять раз промыта водой слабой кислотности (рН около 4). После экстрагирования органическая фаза была дополнена сульфатом натрия для удаления воды, отфильтрована и высушена в ротационном испарителе.
Вторым шагом 2.1125 г ГА ТВА было растворено в 500 мл безводного DMF, дополненного 0.0532 г L-aspartic ангидрид-гидрохлорида. Реакции позволили протекать в течение 24 часов при комнатной температуре для достижения эстерификации гидроксильных групп гиалуроновой кислоты.
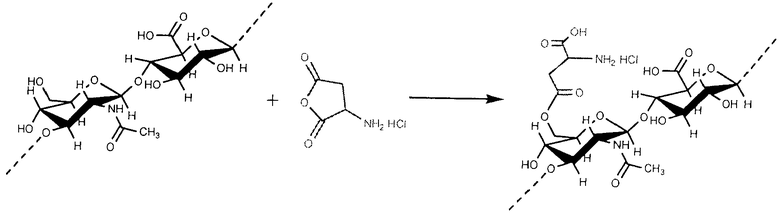
Затем 0.4120 г активированного паклитаксела, заранее приготовленного, было растворено в 50 мл безводного DMF и было медленно добавлено в производное гиалуроновой кислоты. Реакция в течение 24 часов осуществлялась при комнатной температуре в присутствии триэтиламина. В конце 12 мл насыщенного раствора NaBr было добавлено. Полученная таким образом смесь перемешивалась в течение часа с тем, чтобы допустить замену ионов ТВА натрием. Затем конъюгат был выведен в осадок путем добавления этанола, и очищен промывкой смесью этанол/вода 90:10, до полного удаления солей и несвязанного паклитаксела.
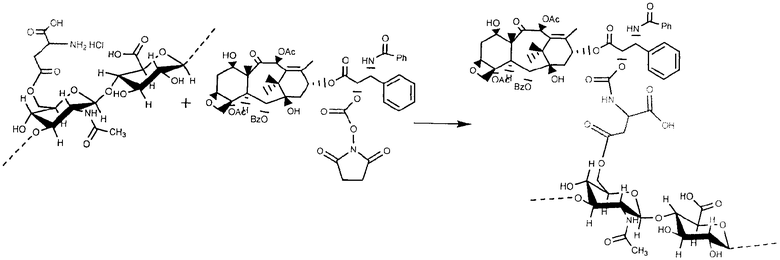
Пример 20
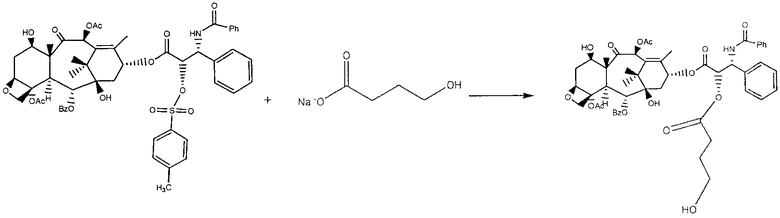
Приготовление эфирного производного гиалуроновой кислоты с палитакселом путем непрямой эстерификации в в карбоксильной кислоте посредством разделителя, содержащего гидроксильную группу ГА+CDI att cooh
Сперва производное паклитаксел-разделителя было синтезировано следующим образом.
К раствору 1.0254 г паклитаксела в 50 мл дихлорметана было добавлено 0.2521 г р-толуолсульфонил хлорида и 0.1583 г диметиламинопиридина. Реакция активации гидроксила проходила в течение ночи при комнатной температуре; затем он был очищен несколькими промывками водой и экстрагированием органической фазы, после чего сконцентрирован в «Rotavapor» для последующей реакции с разделителем. Таким образом он был растворен в 100 мл безводного DMF и дополнен 0.1854 г 4-гидроксибутирата натрия. Реакции эфиризации позволили протекать при 35°С в течение 4 четырех часов, затем продукт был выведен в осадок в воде, несколько раз промыт и высушен под вакуумом.
После дегидратации сульфатом натрия раствор был отфильтрован и высушен под вакуумом.
Во вторую очередь 1.2589 гиалуроновой кислоты ТВА было растворено в 200 мл безводного DMSO и с целью активации гидроксильных групп гиалуроновой кислоты было добавлено 0.1156 п 1,1'-карбонилдиимидазола (CDI); реакция осуществлялась в течение 1 часа при 42°С, а затем раствор был разбавлен 600 мл DMSO. В конце был добавлен предварительно подготовленный р-толуолсульфонил-паклитаксел в избытке, чтобы позволить гидроксильному разделителю вступить в реакцию формирования эфира.
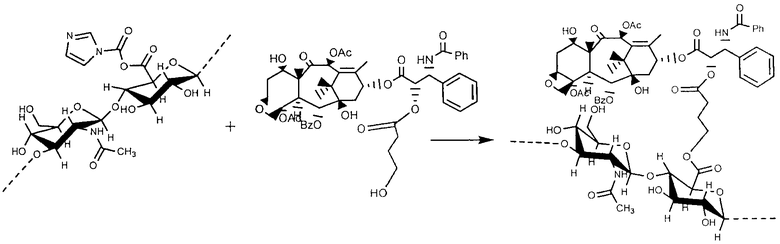
Реакции позволили происходить при 42°С в течение ночи при перемешивании, после чего 12 мл насыщенного раствора NaBr было добавлено, и перемешивание продолжалось еще один час, с тем, чтобы допустить замену ионов ТВА натрием. Затем конъюгат был выведен в осадок путем добавления этанола капля за каплей и очищен промывкой смесью этанол/вода 90:10 до полного удаления солей и несвязанного паклитаксела.
Из описанного, таким образом, изобретения ясно, что эти способы могут быть модифицированы различными путями. Такие модификации не должны рассматриваться как отклонение от сущности и цели изобретения, и любые такие модификации, которые могут казаться очевидными эксперту в данной области, оказываются в пределах объема нижеследующей формулы изобретения.
Изобретение относится к таксану, особенно к паклитакселу и доцетакселу, ковалентно связанному с гиалуроновой кислотой или производным гиалуроновой кислоты, используемому в качестве активного вещества в фармацевтических композициях, которые применяют в области онкологии, при лечении опухолей, аутоиммунных заболеваний и рестеноза, а также в качестве покрытия для стентов и медицинских устройств. Ковалентная связь образуется между гидроксильными группами таксана и карбоксильными группами или гидроксильными группами гиалуроновой кислоты или производными гиалуроновой кислоты, или аминогруппами деацетилированной гиалуроновой кислоты. Связывание может происходить при помощи соединяющего соединения (спейсерного соединения), связывающего таксан с гиалуроновой кислотой или производными гиалуроновой кислоты, при условии, что соединяющее соединение отличается от гидразида. Заявленный таксан обладает повышенной терапевтической эффективностью при лечении онкологических заболеваний, аутоиммунных заболеваний и рестеноза, является водорастворимым без снижения его фармакологической активности, а также не проявляет токсичные действия, что приводит к преодолению повышенной чувствительности и анафилаксии. 14 н. и 32 з.п. ф-лы, 4 ил., 2 табл.
1. Таксан, ковалентно связанный с гиалуроновой кислотой или производным гиалуроновой кислоты, где ковалентная связь выбирается из группы, состоящей из:
(1) прямой сложноэфирной связи между карбоксильными группами гиалуроновой кислоты или ее производного и гидроксильными группами таксана,
(2) связи, образованной между карбоксильными группами гиалуроновой кислоты или ее производного и гидроксильными группами таксана при помощи соединяющего соединения (спейсерного соединения), где это соединяющее соединение образует сложноэфирную связь с гиалуроновой кислотой или производным гиалуроновой кислоты,
(3) связи, образованной между гидроксильными группами гиалуроновой кислоты или ее производного и гидроксильными группами таксана посредством соединяющего соединения, где это соединяющее соединение образует сложноэфирную связь с гиалуроновой кислотой или производным гиалуроновой кислоты.
2. Таксан по п.1, где таксан выбран из паклитаксела и доцетаксела.
3. Таксан по п.1, где указанным таксаном является паклитаксел.
4. Таксан по п.1, где гиалуроновая кислота имеет молекулярную массу между 400 и 3·106 Да.
5. Таксан по п.4, где гиалуроновая кислота имеет молекулярную массу между 400 и 1·106 Да.
6. Таксан по п.4, где гиалуроновая кислота имеет молекулярную массу между 400 и 230000 Да.
7. Таксан по п.1, где гиалуроновая кислота превращена в соль с органическими и/или неорганическими основаниями.
8. Таксан по п.1, где производное гиалуроновой кислоты выбрано из группы, состоящей из сложных эфиров гиалуроновой кислоты со спиртами алифатического, аралифатического, циклоалифатического, ароматического, циклического и гетероциклического рядов, причем указанные эфиры имеют степень этерификации, равную 50% или меньшую, чем 50%.
9. Таксан по п.1, где производное гиалуроновой кислоты выбрано из группы, состоящей из амидов гиалуроновой кислоты с аминами алифатического, аралифатического, циклоалифатического, ароматического, циклического и гетероциклического рядов, причем указанные амиды имеют степень амидирования между 0,1 и 10%.
10. Таксан по п.1, где производное гиалуроновой кислоты выбрано из группы, состоящей из O-сульфатированных производных гиалуроновой кислоты со степенью сульфатирования до 4.
11. Таксан по п.1, где производное гиалуроновой кислоты выбрано из группы, состоящей из внутренних эфиров гиалуроновой кислоты, имеющей степень этерификации, равную или меньшую, чем 15%.
12. Таксан по п.1, где производное гиалуроновой кислоты выбрано из группы, состоящей из деацетилатов гиалуроновой кислоты, образованных деацетилированием звена N-ацетилглюкозамина и имеющих степень деацетилирования между 0,1 и 30%.
13. Таксан по п.1, где производное гиалуроновой кислоты выбрано из группы, состоящей из перкарбоксилированных производных гиалуроновой кислоты, полученных окислением первичного гидроксила звена N-ацетилглюкозамина и имеющих степень перкарбоксилирования между 1 и 100%.
14. Таксан по п.1, где соединяющее соединение, связывающее таксан с гиалуроновой кислотой или производным гиалуроновой кислоты, выбрано из группы, состоящей из алифатических или аралифатических цепей, неразветвленных или разветвленных, замещенных одной или несколькими группами, выбранными из гидроксильных, карбоксильных, ацилхлоридных, галогенных, ангидридных.
15. Таксан по п.14, где соединяющее соединение выбрано из группы, состоящей из карбоновых кислот, имеющих от 2 до 18 атомов углерода в алифатической или аралифатической цепи, замещенной бромом.
16. Таксан по п.14, где соединяющее соединение выбрано из группы, состоящей из карбоновых кислот, имеющих от 3 до 10 атомов углерода в алифатической или аралифатической цепи, замещенной бромом.
17. Таксан по п.16, где соединяющее соединение выбрано из 3-бромпропионовой кислоты и 4-броммасляной кислоты.
18. Таксан по п.8, где гиалуроновая кислота этерифицирована после образования ковалентной связи с таксаном.
19. Таксан по п.11, где гиалуроновая кислота этерифицирована после образования ковалентной связи с таксаном.
20. Таксан по п.1, где ковалентная связь является сложноэфирной связью между таксаном и соединяющим соединением.
21. Таксан по п.1, где процент связывания между гиалуроновой кислотой и таксаном находится между 0,1 и 100%.
22. Таксан по п.21, где процент связывания между гиалуроновой кислотой и таксаном находится между 0,1 и 35%.
23. Таксан по п.1, где гиалуроновая кислота или производное гиалуроновой кислоты повышает противораковое действие таксана.
24. Таксан по п.11, где внутренний эфир гиалуроновой кислоты повышает противораковое действие таксана.
25. Таксан по п.1, где гиалуроновая кислота повышает противораковое действие таксана.
26. Фармацевтическая композиция для применения в онкологии для лечения опухолей, аутоиммунных заболеваний и рестеноза, содержащая в качестве активного вещества, по меньшей мере, таксан, ковалентно связанный с гиалуроновой кислотой или производным гиалуроновой кислоты, как указано в пп.1-25 в комбинации с фармацевтически приемлемыми наполнителями или разбавителями.
27. Фармацевтическая композиция по п.26 для введения пероральным, внутривенным, артериальным, внутримышечным, подкожным, внутрибрюшинным или чрескожным путем или прямой инъекцией в место опухоли.
28. Фармацевтическая композиция по п.27 для введения пероральным путем.
29. Фармацевтическая композиция по п.27, где гиалуроновая кислота или производное гиалуроновой кислоты способно высвобождать таксан в месте введения.
30. Фармацевтическая композиция по любому из пп.27-29, дополнительно содержащая одно или несколько биологически или фармакологически активных веществ.
31. Фармацевтическая композиция по п.30, где указанное биологически или фармакологически активные вещества выбраны из группы, состоящей из стероидов, гормонов, трофических факторов, белков, витаминов, нестероидных противовоспалительных лекарственных средств, химиотерапевтических лекарственных средств, блокаторов кальция, антибиотиков, противовирусных средств, интерлейкинов и цитокинов.
32. Фармацевтическая композиция по п.30, где указанным биологически или фармакологически активным веществом является интерферон.
33. Использование таксана, ковалентно связанного с гиалуроновой кислотой или производным гиалуроновой кислоты по пп.1-25 для получения фармацевтических композиций, применимых для лечения опухолей.
34. Использование по п.33, где лечение опухолей, включает в себя химиотерапию для рака молочной железы, рака яичников и/или эндометрии, меланомы, рака легких, рака печени, простаты и/или мочевого пузыря, рака желудка и/или кишечника, лейкоза и саркомы Капоши.
35. Использование таксана, ковалентно связанного с гиалуроновой кислотой или производным гиалуроновой кислоты по пп.1-25 для получения фармацевтических композиций, применимых для лечения аутоиммунных патологий.
36. Использование по п.35, где указанные аутоиммунные патологии выбраны из группы, состоящей из ревматоидного артрита, тироидита Хашимото, системной красной волчанки и аутоиммунного гломерулонефрита.
37. Использование таксана, ковалентно связанного с гиалуроновой кислотой или производным гиалуроновой кислоты по пп.1-25 для получения фармацевтических композиций, применимых для лечения рестеноза.
38. Использование таксана, ковалентно связанного с гиалуроновой кислотой или производным гиалуроновой кислоты по пп.1-25 для покрытия стентов и медицинских устройств.
39. Стенты и медицинские устройства, покрытые таксаном, ковалентно связанным с гиалуроновой кислотой или производным гиалуроновой кислоты по пп.1-25.
40. Способ получения таксана, ковалентно связанного с гиалуроновой кислотой или производным гиалуроновой кислоты класса (1) по п.1, включающий в себя следующие стадии:
A) активацию гидроксильной группы таксана или, соответственно, карбоксильной группы гиалуроновой кислоты или производного гиалуроновой кислоты при помощи активирующего агента;
B) добавление гиалуроновой кислоты или производного гиалуроновой кислоты или, соответственно, таксана, растворенного в подходящем растворителе;
(С) необязательную очистку полученного таким образом продукта.
41. Способ получения таксана, ковалентно связанного с гиалуроновой кислотой или производным гиалуроновой кислоты класса (1) по п.1, включающий в себя следующие стадии:
А') получение бромида или тозилата таксана;
В') выполнение нуклеофильного замещения бромида или тозилата таксана, полученного на стадии А'), карбоксильной группой гиалуроновой кислоты или производного гиалуроновой кислоты;
С') необязательную очистку полученного продукта.
42. Способ получения таксана, ковалентно связанного с гиалуроновой кислотой или производным гиалуроновой кислоты класса (3) по п.1, включающий в себя следующие стадии:
L) активацию карбоксильной группы соединяющего соединения, возможно предварительно связанного с таксаном;
М) добавление гиалуроновой кислотой или производного гиалуроновой кислоты;
N) необязательную очистку полученного таким образом продукта и реакцию с таксаном, если он не был предварительно связан с соединяющим соединением.
43. Способ получения таксана, ковалентно связанного с гиалуроновой кислотой или производным гиалуроновой кислоты класса (3) по п.1, где соединяющее соединение имеет, по меньшей мере, карбоксильную группу и связано с гидроксильной группой гиалуроновой кислоты или производного гиалуроновой кислоты сложноэфирной связью, включающий в себя следующие стадии:
L') замещение гидроксильной группы гиалуроновой кислоты или производного гиалуроновой кислоты группой тозила или бромида;
М') добавление соединяющего соединения, возможно предварительно связанного с таксаном;
N') необязательную очистку полученного таким образом продукта и проведение реакции с таксаном, если он предварительно не был связан с соединяющим соединением.
44. Способ получения таксана, ковалентно связанного с гиалуроновой кислотой или производным гиалуроновой кислоты класса (3) по п.1 посредством соединяющего соединения, имеющего, по меньшей мере, одну ангидридную группу и связывающего гидроксильную группы гиалуроновой кислоты или производного гиалуроновой кислоты сложноэфирной связью, включающий в себя следующие стадии:
L") добавление соединяющего соединения к раствору, содержащему гиалуроновую кислоту или производное гиалуроновой кислоты;
М") необязательную очистку полученного таким образом продукта;
N") проведение реакции продукта, полученного на стадиях L") или М") с таксаном.
45. Способ получения таксана, ковалентно связанного с гиалуроновой кислотой или производным гиалуроновой кислоты класса (3) по п.1 посредством соединяющего соединения, имеющего, по меньшей мере, гидроксильную группу и соединяющего карбоксильную группу гиалуроновой кислоты или производного гиалуроновой кислоты при помощи сложноэфирной связи, включающий в себя следующие стадии:
a) добавление активирующего агента к раствору, содержащему гиалуроновую кислоту или производное гиалуроновой кислоты;
b) добавление соединяющего соединения, возможно предварительно связанного с таксаном, в раствор, полученный на стадии а);
c) необязательную очистку полученного таким образом продукта и проведение реакции с таксаном, если он предварительно не был связан с соединяющим соединением.
46. Способ получения таксана, ковалентно связанного с гиалуроновой кислотой или производным гиалуроновой кислоты класса (2) по п.1 посредством соединяющего соединения, имеющего, по меньшей мере, галоген, такой как бром, и связывающего карбоксильную группу гиалуроновой кислоты или производного гиалуроновой кислоты при помощи сложноэфирной связи, включающий в себя следующие стадии:
а') добавление соединяющего соединения, возможно предварительно связанного с таксаном, в раствор гиалуроновой кислоты или производного гиалуроновой кислоты;
b') необязательную очистку полученного таким образом продукта, и проведение реакции с таксаном, если он предпочтительно не был связан с соединяющим соединением.
| WO 9733552 A1, 18.09.1997 | |||
| US 5648506 A, 15.07.1997 | |||
| US 4851521 A, 25.07.1989 | |||
| WO 9902151 A1, 21.01.1999 | |||
| LUO Y ET AL: "SYNTHESIS AND SELECTIVE CYTOTOXICITY OF A HYALURONIC ACID-ANTITUMORBIOCONJUGATE", BIOCONJUGATE CHEMISTRY, AMERICAN CHEMICAL SOCIETY, WASHINGTON, US, VOL.10, N 01.5, 20.09.1999 | |||
| Судовой движитель | 1923 |
|
SU755A1 |
| КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ БИОЛОГИЧЕСКИЙ АГЕНТ | 1996 |
|
RU2166934C2 |
Авторы
Даты
2010-03-20—Публикация
2003-10-10—Подача