Изобретение относится к гидроксидам Со2+,которые можно использовать при синтезе промышленных катализаторов (процессы полного и селективного окисления, гидрирования СО, NOx и др.) и высокотехнологичных материалов для других областей применения (литий-кобальт-оксидные катодные материалы для ионных аккумуляторов).
Механизм твердофазных превращений при синтезе и физико-химические свойства (в том числе каталитические) указанных целевых продуктов существенно зависят от особенностей структуры и дисперсности Со(ОН)2.
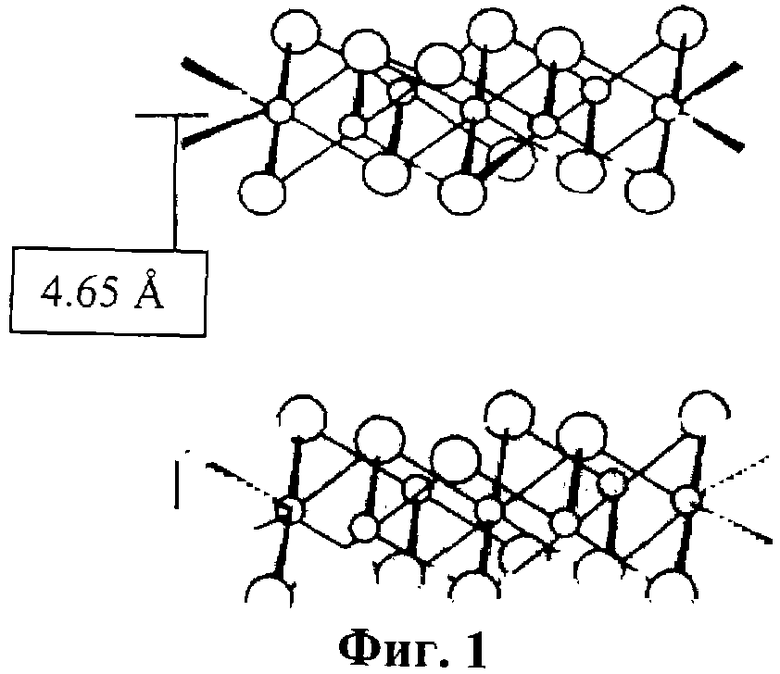
Известен гидроксид Со2+, обозначенный в патентах и научной литературе как β -Со(ОН)2. Модификация β -Со(ОН)2 является относительно стабильной. Этот гидроксид состоит из гексагональных пластинчатых кристаллов с размерами до тысячи нм и имеет удельную поверхность 0.1-10 м2/г [JP 11292549, 26 Oct. 1999], характеризуется бруситоподобной структурой Mg(OH)2 и содержит ионы Со2+ только в октаэдрической кислородной координации [Pertlik Fr. The distortion of the hexagonal close packing of oxygen atoms in Со(ОН)2 compared to isotypic brucite-type structures // Monatshefte fur Chemie, 1999, V.130, №9, Р.1083-1088.]. Структурная модель и параметры кристаллической решетки гидроксида β -Со(ОН)2 бруситоподобной структуры с параметрами решетки а=3.17 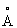 и с=4.65
и с=4.65 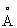 из [Kamath P.V., Therese G.H.A., Gopalakrishnan J. On the existence of hydrotalcitelike phases in the absence of trivalent cations.//.J. Solid State Chem., 1997, V.128, №1, Р.38-41.] приведены на фиг.1. К недостаткам β -Со(ОН)2 относятся низкая реакционная способность самого гидроксида (температура начала дегидратации около 300° С), сложный фазовый состав и низкая реакционная способность промежуточных продуктов термообработки β -гидроксида (СоО(ОН), СоО, Со3O4 и т.д.).
из [Kamath P.V., Therese G.H.A., Gopalakrishnan J. On the existence of hydrotalcitelike phases in the absence of trivalent cations.//.J. Solid State Chem., 1997, V.128, №1, Р.38-41.] приведены на фиг.1. К недостаткам β -Со(ОН)2 относятся низкая реакционная способность самого гидроксида (температура начала дегидратации около 300° С), сложный фазовый состав и низкая реакционная способность промежуточных продуктов термообработки β -гидроксида (СоО(ОН), СоО, Со3O4 и т.д.).
Известен гидроксид Со2+, обозначенный в патентах и научной литературе как α -Со(ОН)2. Из нескольких предложенных для α -Со(ОН)2 моделей [Kamath P.V., Therese G.H.A., Gopalakrishnan J. On the existence of hydrotalcite-like phases in the absence of trivalent cations. // J.Solid State Chem., 1997, V.128, №1, Р.38-41] более экспериментально обоснованной считается модель, основанная на гидротальцитподобной структуре (Mg6Al2(OH)16CO3·4H2O), не содержащей, однако, в гидроксидном слое катионов М3+. Необходимый для гидротальцитподобной модели α -Co(OH)2 нескомпенсированный положительный заряд гидроксидного слоя обеспечивается частичным протонированием гидроксильных групп в октаэдре [Со2+(ОH)6]4- по уравнению М(OH)2+хН→ [М(OH)2-х(H2O)х]x+ [Kamath P.V., Therese G.H.A, Gopalakrishnan J. On the existence of hydrotalcite-like phases in the absence of trivalent cations. // J.Solid State Chem., 1997, V.128, №1, Р.38-41]. Положительный заряд гидроксидного слоя компенсируется анионами используемых солей Со2+, которые внедряются на стадии синтеза в межслоевое пространство α -Со(ОН)2. В этой модели предполагается искаженная октаэдрическая координация ионов Со2+. Искажение октаэдра [Со2+(OH)6]4- обусловлено частичным замещением в первой координационной сфере ОН-групп другими лигандами, например молекулами Н2O. Структурная модель и интервалы значений параметров а=3.05-3.12 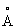 и с=7.5-8.0
и с=7.5-8.0 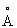 кристаллической решетки α -Со(ОН)2 гидротальцитподобной структуры из [Kamath P.V., Therese G.H.A., Gopalakrishnan J. On the existence of hydrotalcite-like phases in the absence of trivalent cations. // J.Solid State Chem., 1997, V.128, №1, Р.38-41; Rajamathi M., Kamath P.V., Seshadri R. Chemical synthesis of α -cobalt hydroxide // Mater. Res. Bull., 2000, V.35, №2, Р.271-278] представлены на фиг.2. К недостаткам α -Со(ОН)2 относятся непостоянство химического состава и высокая чувствительность его к условиям синтеза и старения гидроксида, что затрудняет получение из α -Со(ОН)2 целевых продуктов с воспроизводимыми характеристиками.
кристаллической решетки α -Со(ОН)2 гидротальцитподобной структуры из [Kamath P.V., Therese G.H.A., Gopalakrishnan J. On the existence of hydrotalcite-like phases in the absence of trivalent cations. // J.Solid State Chem., 1997, V.128, №1, Р.38-41; Rajamathi M., Kamath P.V., Seshadri R. Chemical synthesis of α -cobalt hydroxide // Mater. Res. Bull., 2000, V.35, №2, Р.271-278] представлены на фиг.2. К недостаткам α -Со(ОН)2 относятся непостоянство химического состава и высокая чувствительность его к условиям синтеза и старения гидроксида, что затрудняет получение из α -Со(ОН)2 целевых продуктов с воспроизводимыми характеристиками.
В патентах и научной литературе не известны гидроксиды Со(ОН)2 с тетраэдрической кислородной координацией ионов Со+.
В основу заявляемого изобретения положена задача синтеза гидроксида Со(ОН)2 с необычной для таких систем тетраэдрической кислородной координацией ионов Со2+. Эту модификацию мы обозначаем как γ -Со(ОН)2. Задача синтеза γ -Со(ОН)2 решается путем гидролиза и поликонденсации аква-ионов Со2+ с формированием фрагментов такого гидроксида из “сшитых” между собой по ребрам гидроксильных тетраэдров. Структурный фрагмент гидроксида γ -Со(ОН)2 представлен на схеме:
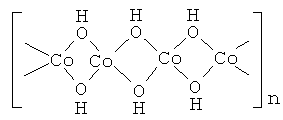
где: n - число ионов Со2+ в структурном фрагменте γ -Со(ОН)2.
Наиболее близким по способу приготовления является "Кобальт-гидроксидный пигмент и способ его получения" (Пат. JP 61163123, C 01 G 51/04, 23.07.1986). В противопоставленном способе к водному раствору КОН с концентрацией 0.82 моль/л приливают водный раствор Со(NО3)2 с концентрацией 0.41 моль/л и выдерживают суспензию при 60° С в течение 3 ч при барботаже через нее N2. При этом формируются гексагональные пластинчатые кристаллы гидроксида кобальта с диаметром ~0.1 мкм и толщиной 200 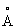 . Кристаллы покрывают пленкой SiO2 для повышения устойчивости полученного гидроксида кобальта к окислению. Значение рН, при котором ведут осаждение гидроксида кобальта, и структура получаемого гидроксида не приведены. Однако форма и размеры кристаллов полученного гидроксида позволяют заключить, что гидроксид кобальта имеет гексагональную структуру β -Со(ОН)2 и содержит ионы Со2+ только в октаэдрической кислородной координации.
. Кристаллы покрывают пленкой SiO2 для повышения устойчивости полученного гидроксида кобальта к окислению. Значение рН, при котором ведут осаждение гидроксида кобальта, и структура получаемого гидроксида не приведены. Однако форма и размеры кристаллов полученного гидроксида позволяют заключить, что гидроксид кобальта имеет гексагональную структуру β -Со(ОН)2 и содержит ионы Со2+ только в октаэдрической кислородной координации.
Согласно изобретению, предлагаемый гидроксид кобальта Co(OH)2 характеризуется тем, что он содержит ионы Со2+ в тетраэдрической кислородной координации и состоит из нанодисперсных частиц с преимущественными размерами 1.5-3.0 нм.
Образцы гидроксидов γ -Со(ОН)2 синтезируют приливанием с заданной объемной скоростью водных растворов гидроксидов первой группы Периодической системы или NH4OH к водным растворам солей Со2+ при барботаже через суспензию N2 так, чтобы исключить окисление в маточных растворах Со2+ до Со3+ при получении осадков.
Более конкретно гидроксид кобальта Со(ОН)2 с тетраэдрической кислородной координацией ионов Со2+ получают приливанием водных растворов щелочей с концентрациями 1.0-2.5 моль/л и со скоростями не ниже 0.2 л/ч при комнатной температуре до конечного значения рН 6.0-12.0, выдержке суспензии Со(ОН)2 при перемешивании в течение 15 мин с барботажем через нее азота.
Химический и фазовый состав синтезированных образцов определяют методами количественного химического и рентгенофазового анализа (РФА). Рентгеновские съемки проводят на дифрактометре D-8 (Bruker) в СuКα -излучении с использованием графитового монохроматора на отраженном пучке.
Кислородное координационное окружение и степень окисления ионов Со2+ в синтезированных гидроксидах кобальта определяют путем анализа электронных спектров диффузного отражения (ЭСДО) в ближней ультрафиолетовой и видимой областях. Спектры снимают на спектрофотометре UV-2501 PC фирмы “Shimadzu” с приставкой диффузного отражения ISR-240 А. Спектры регистрируют относительно стандарта отражения - BaSO4 в диапазоне 900-190 nm (11000-54000 см-1). Данные ЭСДО представляют в виде функции Кубелки-Мунка, F(R).
Размеры частиц гидроксида γ -Со(ОН)2 оценивают по данным малоуглового рентгеновского рассеяния (МУР). Съемки проводят в камере КРМ-1 (диапазон углов 2 θ от 7’ до 5° , излучение СuКα ), после чего из углового распределения интенсивности МУР J(9) рассчитывают функцию распределения частиц по диаметрам Dn(r) в предположении об их сферической форме. Используют связь этих функций  (где f(r,θ ) - форм-фактор) [GrimerA., Fournet G. // Small-angle scattering of X-rays. N-Y.: J.Wiley, Sons Inc. 1955.9]. Отметим, что использованная нами методика позволяла изучать распределение частиц по размерам в интервале 0.6-30.0 нм.
(где f(r,θ ) - форм-фактор) [GrimerA., Fournet G. // Small-angle scattering of X-rays. N-Y.: J.Wiley, Sons Inc. 1955.9]. Отметим, что использованная нами методика позволяла изучать распределение частиц по размерам в интервале 0.6-30.0 нм.
Для исследования методами ЭСДО, РФА и МУР образцы сразу после их синтеза отделяют от маточника на центрифуге при 6000 об/мин с последующим выполнением указанных измерений на пастах Со(ОН)2.
На рентгенограммах образцов, содержащих новую модификацию гидроксида кобальта γ -Со(ОН)2, имеются три характерные уширенные линии с положением их максимумов d=5.31; 2.77 и 2.31  , которые не соответствуют положению линий как на рентгенограммах α - и β -Со(ОН)2, так и основных солей Со2+. Размеры областей когерентного рассеяния (о.к.р.) рентгеновских лучей на частицах γ -Со(ОН)2, рассчитанные известным способом из полуширины линий на рентгенограммах, в различных кристаллографических направлениях составляют 2.0-3.0 нм. Это свидетельствует о нанодисперсном состоянии заявляемого гидроксида γ -Со(ОН)2. По современным представлениям к нанодисперсным системам относят твердые вещества с размерами частиц 1.0-100.0 нм.
, которые не соответствуют положению линий как на рентгенограммах α - и β -Со(ОН)2, так и основных солей Со2+. Размеры областей когерентного рассеяния (о.к.р.) рентгеновских лучей на частицах γ -Со(ОН)2, рассчитанные известным способом из полуширины линий на рентгенограммах, в различных кристаллографических направлениях составляют 2.0-3.0 нм. Это свидетельствует о нанодисперсном состоянии заявляемого гидроксида γ -Со(ОН)2. По современным представлениям к нанодисперсным системам относят твердые вещества с размерами частиц 1.0-100.0 нм.
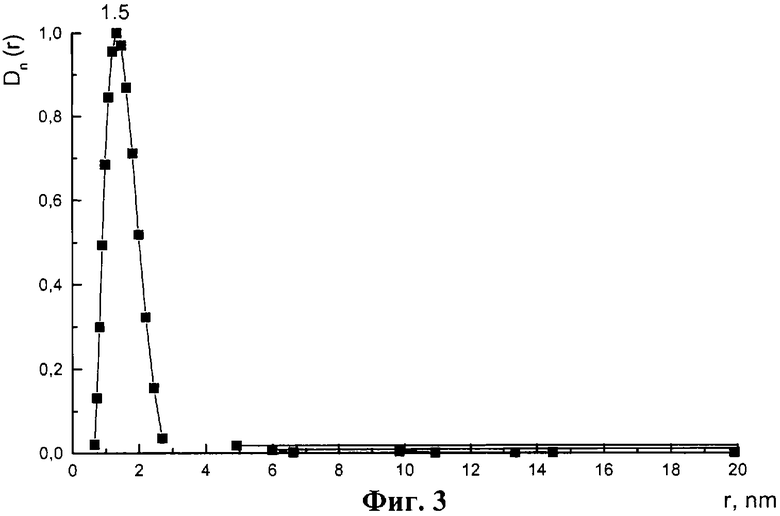
Данные по о.к.р. для γ -Со(ОН)2 хорошо согласуются с результатами измерения распределения частиц γ -Со(ОН)2 по размерам, полученных методом МУР. Из фиг.3 видно, что γ -Со(ОН)2 имеет узкое распределение частиц по размерам (0.5-2.5 нм) с преимущественным размером около 1.5 нм.
Принципы отнесения полос поглощения ЭСДО к тем или иньм состояниям окисления кобальта и в зависимости от координационного окружения хорошо разработаны. Известно [Lever А.В.Р. // Inorganic Electronic Spectroscopy. 2nd Ed. Amsterdam-Oxford-NewYork-Tokyo: Elsevier. 1987], что для ионов Со2+ (d7-элeктpoннaя конфигурация, 4F - основной терм свободного иона, 4P - ближайший вышележащий терм возбужденного состояния иона) по d-d-переходам четко разделяются их октаэдрическая и тетраэдрическая координации. Для ионов Со
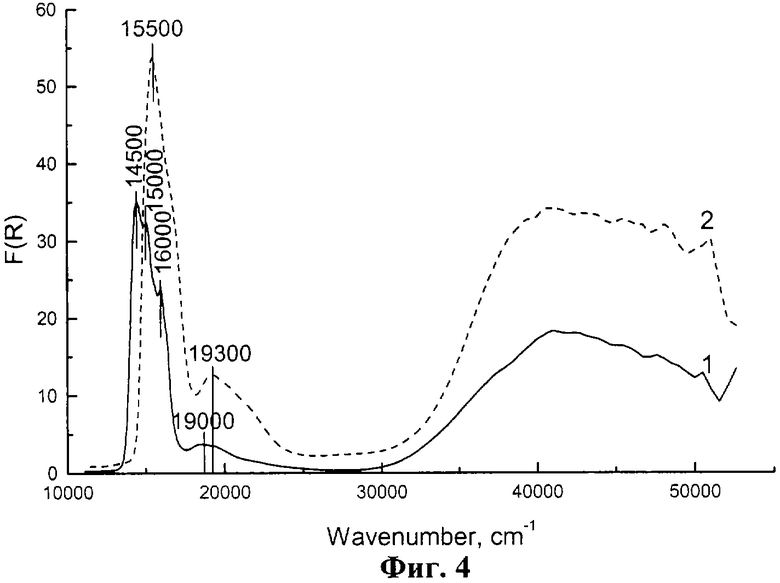
На фиг.4, кр.1 представлен ЭСДО гидроксида γ -Со(ОН)2, полученного по примеру 1. Из спектра видно, что доминирующей является идеальная тетраэдрическая кислородная координация ионов Со2+, о чем свидетельствуют интенсивные п.п.14500, 15000 и 16000 см-1, обусловленные полностью разрешенной мультиплетной природой перехода 4A2(F)→ 4T1(P), характерного для ионов Со
Установленная нами температура начала дегидратации γ -Со(ОН)2 (около 140° С) свидетельствует о высокой реакционной способности γ -Со(ОН)2 в твердофазных превращениях.
Сущность изобретения иллюстрируется следующими примерами:
Пример 1. В реактор, содержащий 0.1 л водного раствора CoCl2 с концентрацией 2.5 моль/л, дозирующим насосом со скоростью 3 л/час подают 0.0325 л водного раствора LiOH с концентрацией 5 моль/л. Смешение растворов соли Со2+ и LiOH осуществляют при интенсивном перемешивании суспензии и барботаже через нее азота. После завершения смешения растворов для усреднения состава суспензию Со(ОН)2 перемешивают еще в течение 15 мин. Конечное значение рН суспензии составляет 6.5. Пасту отделяют от маточного раствора на центрифуге при 6000 об/мин. Паста содержит 7.6 г гидроксида γ -Со(ОН)2 с ионами Со2+ в тетраэдрической кислородной координации (см. фиг.4, кр.1, мультиплет п.п.14500, 15000 и 16000 см-1 от Со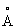 .
.
Пример 2. В реактор, содержащий 0.1 л водного раствора CoCl2 с концентрацией 1 моль/л, дозирующим насосом со скоростью 3 л/час подают 0.1 л водного раствора NaOH с концентрацией 2 моль/л. Смешение растворов соли Со2+ и NaOH осуществляют при интенсивном перемешивании суспензии и барботаже через нее азота. После завершения смешения растворов для усреднения состава суспензию Со(ОН)2 перемешивают еще в течение 15 мин. Конечное значение рН суспензии составляет 10.5. Пасту отделяют от маточного раствора на центрифуге при 6000 об/мин. Паста содержит 9.3 г гидроксида γ -Со(ОН)2 с ионами Со2+ в тетраэдрической кислородной координации (см. фиг.4, на которой показаны спектры ЭСДО: 1- образца γ -Со(ОН)2, полученного по примеру 1; 2- образца, полученного γ -Со(ОН)2 по примеру 2; кр.2, п.п.15500 см-1 от Со
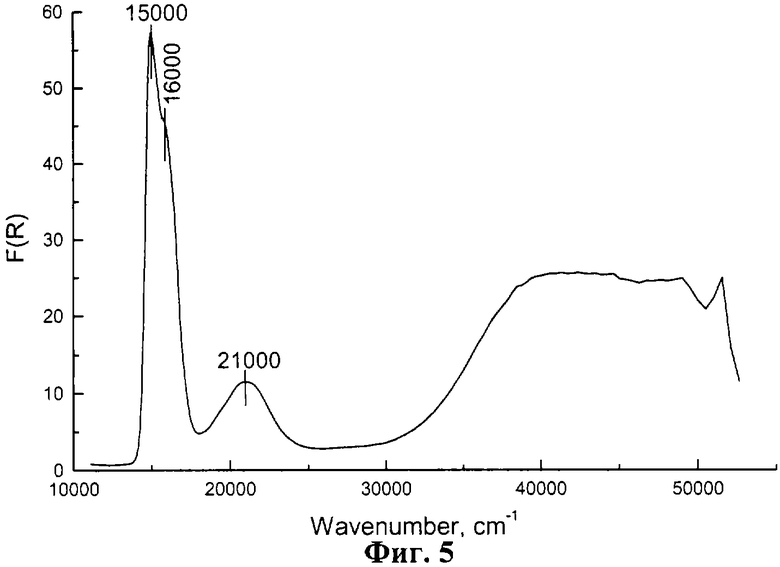
Пример 3. То же, что и по примеру 2. Отличие состояло в том, что после смешения растворов соли Со2+ и щелочи, добавлением раствора соляной кислоты понижают рН суспензии от 10.5 до 8.0 и проводят старение суспензии в течение 5 суток. Паста содержит 9.3 г гидроксида γ -Со(ОН)2 с ионами Со2+ в тетраэдрической кислородной координации (см. фиг.5, п.п.15000 см-1 от Со
Пример 4. В реактор, содержащий 0.1 л водного раствора Со(NО3)2 с концентрацией 1 моль/л, дозирующим насосом со скоростью 0.2 л/ч подают 0.075 л водного раствора NaOH с концентрацией 2 моль/л. Смешение растворов соли Со2+ и NaOH осуществляют при интенсивном перемешивании суспензии и барботаже через нее азота. После завершения смешения растворов для усреднения состава суспензию Со(ОН)2 перемешивают еще в течение 15 мин. Конечное значение рН суспензии составляет 7.0. Пасту отделяют от маточного раствора на центрифуге при 6000 об/мин. Паста содержит 7.0 г гидроксида γ -Со(ОН)2 с ионами Со2+ в тетраэдрической кислородной координации (наличие в ЭСДО п.п.15500 см-1 от Со
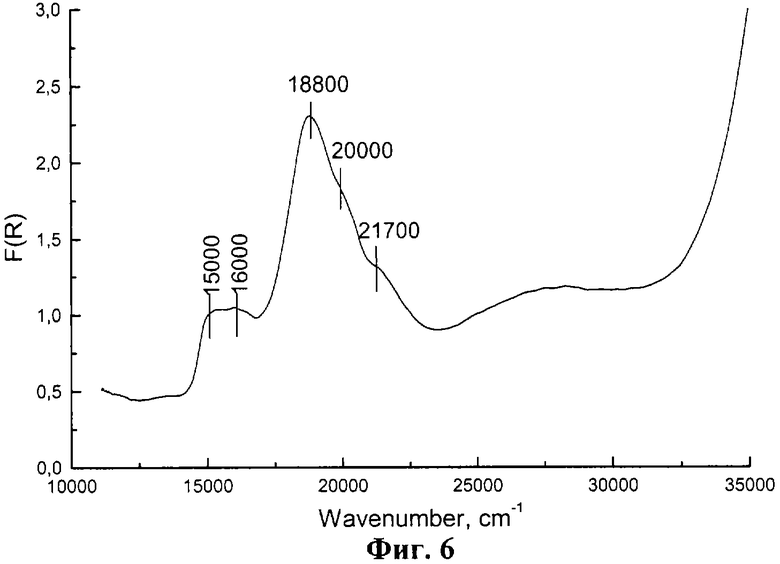
Пример 5. В реактор, содержащий 0.1 л водного раствора NaOH с концентрацией 2 моль/л, дозирующим насосом со скоростью 3 л/час подают 0.1 л водного раствора CoCl2 с концентрацией 1 моль/л. Смешение растворов NaOH с раствором соли Со2+ осуществляют при интенсивном перемешивании суспензии и барботаже через нее азота. После завершения смешения растворов для усреднения состава суспензию Со(ОН)2 перемешивают еще 15 мин. Конечное значение рН составляет 6.5. Пасту отделяют от маточного раствора на центрифуге при 6000 об/мин. Паста содержит 8.9 г гидроксида α -Со(ОН)2 и 0.4 г γ -Со(ОН)2 (см. фиг.6, мультиплет п.п.18800, 20000, 21700 см-1 от искаженного Со
Полученный гидроксид кобальта Со(ОН)2 содержит ионы Со2+ в тетраэдрической кислородной координации и состоит из нанодисперсных частиц с преимущественными размерами 1.5-3.0 нм. Гидроксид кобальта Со(ОН)2 обладает высокой дисперсностью, низкими температурами дегидратации и перехода в оксидное состояние, имеет низкую температуру восстановления до металлического кобальта с сохранением высокой дисперсности. Новое качество полученного гидроксида кобальта Со(ОН) позволяет упростить технологию и снизить энергетические затраты при получении кобальтсодержащих материалов для различных областей применения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛИТИЙ-КОБАЛЬТ-ОКСИДНЫЙ МАТЕРИАЛ И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2011 |
|
RU2473466C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОДИСПЕРСНЫХ ОКСИДНЫХ МАТЕРИАЛОВ В ВИДЕ СФЕРИЧЕСКИХ АГРЕГАТОВ | 2016 |
|
RU2610762C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОБАЛЬТИТА ЛИТИЯ | 2013 |
|
RU2554652C2 |
| КАТАЛИЗАТОР, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ ФТОРИРОВАНИЯ ГАЛОГЕНИРОВАННЫХ УГЛЕВОДОРОДОВ | 2010 |
|
RU2431524C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОРАЗМЕРНОГО ПОРОШКА ЖЕЛЕЗОИТТРИЕВОГО ГРАНАТА | 2012 |
|
RU2509625C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ХЕМОРЕЗИСТОРА НА ОСНОВЕ НАНОСТРУКТУР ОКСИДА НИКЕЛЯ ЭЛЕКТРОХИМИЧЕСКИМ МЕТОДОМ | 2018 |
|
RU2682575C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИСПЕРСНЫХ МЕЗОПОРИСТЫХ ПОРОШКОВ НА ОСНОВЕ ОКСИДА АЛЮМИНИЯ ДЛЯ НОСИТЕЛЕЙ КАТАЛИЗАТОРОВ | 2018 |
|
RU2665038C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ КАТАЛИЗАТОРА ДЛЯ ГИДРООЧИСТКИ НЕФТЯНЫХ ФРАКЦИЙ | 1992 |
|
RU2008972C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ХЕМОРЕЗИСТОРА НА ОСНОВЕ НАНОСТРУКТУР ОКСИДА КОБАЛЬТА ЭЛЕКТРОХИМИЧЕСКИМ МЕТОДОМ | 2018 |
|
RU2677093C1 |
| ВЕЩЕСТВО ДЛЯ ПАССИВНОГО ЛАЗЕРНОГО ЗАТВОРА | 1997 |
|
RU2114495C1 |
Изобретение относится к гидроксидам кобальта, которые можно использовать при синтезе промышленных катализаторов и высокотехнологических материалов. Гидроксид кобальта Со(ОН)2 содержит ионы Со2+ в тетраэдрической кислородной координации и состоит из нанодисперсных частиц с преимущественными размерами 1,5-3,0 нм. Техническим результатом является синтез гидроксида кобальта с необычной для таких систем тетраэдрической кислородной координацией ионов Со2+. 6 ил.
Гидроксид кобальта Со(ОН)2, отличающийся тем, что он содержит ионы Со2+ в тетраэдрической кислородной координации и состоит из нанодисперсных частиц с преимущественными размерами 1,5-3,0 нм.
| JP 61163123 А, 23.07.1986 | |||
| ПЯТНИЦКИЙ И.В | |||
| Аналитическая химия кобальта | |||
| - М.: Наука, 1965, с.12 | |||
| US 5057299 А, 15.10.1991 | |||
| JP 11292549 А, 26.10.1999 | |||
| МОЩНЫЙ ФРИКЦИОННЫЙ ПОГЛОЩАЮЩИЙ АППАРАТ С УДЛИНЕННОЙ ВЕЛИЧИНОЙ ХОДА | 2005 |
|
RU2377152C2 |
Авторы
Даты
2004-12-27—Публикация
2003-10-09—Подача