ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к области синтеза бензодиоксолов, в частности в парфюмерной промышленности и в области инсектицидов.
УРОВЕНЬ ТЕХНИКИ
Различные биологически активные природные вещества, такие как флавоны и алкалоиды, содержат группу метилендиокси-1,2-бензола (также известного как бензо[1,3]-диоксол). Например, производные бензо[1,3]диоксола применяются при лечении заболеваний печени (Chem.Abstracts, 1990, 452534).
Однако наиболее широко применяются вышеупомянутые производные в области парфюмерии, ароматизирующих веществ и инсектицидов. Соединения, обладающие инсектицидным действием, содержащие бензо[1,3]диоксольную группу, описаны в различных публикациях (например, Bull.Soc.Chim.France, 1964, 1892-1895).
5-(2-пропенил)бензо[1,3]диоксол (сафрол) входит в состав многих эфирных масел, включая масло сассафраса, в котором он составляет около 75% (Oswald et al., Biochim.Biophys.Acta 230, 237 (1971)).
5-(1-пропенил)бензо[1,3]диоксол (изосафрол) применяется как эссенция в парфюмерии и как дезодорант для мыла; в свою очередь изосафрол используют в синтезе другой эссенции - пиперонала (гелиотропин, или бензо[1,3]диоксол-5-карбоксиальдегид), применяемого в промышленности для производства духов и ароматизирующих веществ.
5-Гидроксиметилбензо[1,3]диоксол (пиперониловый спирт) и его производные также представляют значительный интерес для областей промышленности, указанных выше. Настоящее изобретение удовлетворяет потребность в нахождении эффективных методов синтеза пиперонилового спирта и его производных.
Из предшествующего уровня техники известен ряд процессов для этой цели. Наиболее широко применяемый метод заключается в реакции между альдегидом формулы
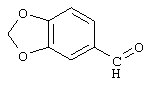
и реактивом Гриньяра (алкилмагнийбромиды) с образованием производных бензодиоксола, замещенных в положении 5 α-гидроксиалкильной группой (например, US-A-3946040). Те же соединения можно получить, исходя из 5-кетозамещенных производных бензо[1,3]диоксола (DE-A-2210374).
Вышеперечисленные способы синтеза, хотя и полезные с точки зрения анализа, представляют значительные ограничения в отношении промышленного применения. В действительности, эти реакции требуют наличия соединений, уже содержащих бензодиоксоловый цикл - такие соединения трудно доступны и являются очень дорогостоящими. Кроме того, реакции Гриньяра проводятся с применением очень нестабильных и небезопасных реактивов и безводных растворителей (к примеру, магния, этилового эфира, тетрагидрофурана), что влечет применение дорогостоящих мер безопасности на заводах.
Селективное ацилирование в качестве способа введения заместителей в бензодиоксоловый цикл до сих пор было трудным для промышленного применения из-за низкого выхода и трудностей очистки ацилированного продукта. В публикации WO A-9639133 указано, что ацилированный бензодиоксол было трудно очистить и требовалась повторная обработка обесцвечиванием. Другие авторы добивались селективного ацилирования бензодиоксолов посредством дорогостоящих решений, таких как пропускание продукта через слой цеолитовых катализаторов (J.Chem.Soc.Chem.Commun., 1994, 717).
Ввиду указанных ограничений существует потребность в эффективном способе получения 5-гидроксиалкилбензодиоксолов. В частности требуется такой способ, который может применяться в промышленности в широких масштабах и который можно проводить с помощью легко осуществимых реакций, мало влияющих на окружающую среду. Наконец, существует потребность в таком способе синтеза, в котором в качестве реагентов применяются легкодоступные и недорогие соединения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
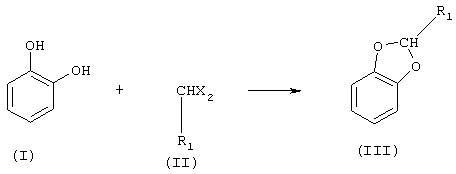
Настоящее изобретение относится к трехстадийному способу синтеза 5-(α-гидроксиалкил)бензо[1,3]диоксолов. Способ включает: (i) реакцию между пирокатехином (1,2-дигидроксибензолом) и дигало- или диалкоксиалканом с образованием производного бензо[1,3]диоксола; (ii) селективное каталитическое ацилирование производного бензо[1,3]диоксола в положение 5 с образованием 5-алканоилбензо[1,3]диоксола и последующим (iii) восстановлением до 5-(α-гидроксиалкил)бензо[1,3]диоксола. Также описаны новые бензодиоксолы, получаемые указанным выше способом. Способ согласно изобретению прост для промышленного осуществления и мало влияет на окружающую среду. Он позволяет получать с высоким выходом производные, представляющие значительный интерес, особенно для парфюмерной промышленности и в области инсектицидов.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Объектом настоящего изобретения является новый способ синтеза 5-(α-гидроксиалкил)бензо[1,3]диоксолов. Этот способ включает следующие стадии:
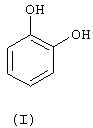
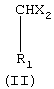
а) реакцию между 1,2-дигидроксибензолом (пирокатехином) (I) в биполярном апротонном растворителе при температуре между 70°С и 190°С и соединением формулы (II), в которой r1 означает либо Н, либо линейный или разветвленный C1-С3-алкил, а Х означает либо хлор, фтор, бром или иод, либо линейную или разветвленную C1-С5-алкоксигруппу, с образованием продукта формулы (III), в которой R1 имеет указанные значения
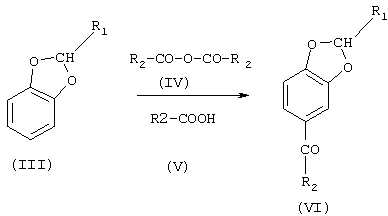
б) реакцию между соединением (III) и алифатическим ангидридом формулы (IV) или алифатической кислотой формулы (V), в которых R2 означает линейный или разветвленный C1-С19-алкил, в присутствии катализатора ацилирования с образованием соединения формулы (VI), в которой R1 и R2 имеют указанные выше значения
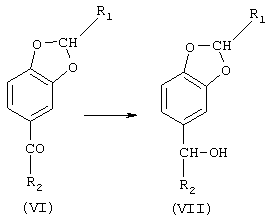
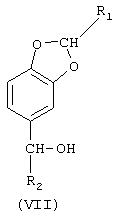
в) восстановления соединения (VI) с образованием 5-(α-гидроксиалкил)бензо[1,3]диоксола формулы (VII).
Реакция а) проводится в биполярных апротонных растворителях. Предпочтительными растворителями этого типа являются N,N-диметилформамид, N,N-диметилацетамид и диметилсульфоксид. Температура реакции соответствует температуре кипения реакционной смеси с обратным холодильником и обычно находится между 70 и 190°С. В том случае, когда в качестве растворителя применяется N,N-диметилформамид, температура обычно находится между 110 и 150°С, более предпочтительно между 110 и 130°С.
Реакция а) может проводиться в присутствии соли иода. В этом случае соль предпочтительно выбирают из числа LiI, NaI, KI и CaI2.
Выбор реагента формулы (II), применяемого в реакции а), зависит от природы синтезируемого конечного продукта (VII). Если целью является получение бензо[1,3]диоксолов, не замещенных в положении 2, то выбирают реагенты формулы (II), в которых r1=Н. Примеры таких реагентов - метиленхлорид и диметоксиметан. Если целью является получение бензо[1,3]диоксолов, замещенных алкилом в положении 2, то выбирают реагенты формулы (II), в которых R1 означает тот же алкильный радикал, который должен быть введен в кольцо бензодиоксола. Предпочтительными радикалами R1 являются метил, этил, н-пропил и изопропил.
Как показано выше, реагент формулы (II) содержит две группы Х = галоген или же две Х=C1-С5-алкоксигруппы, линейные или разветвленные.
Если применяются производные формулы (II), в которых Х = галоген, то реакция а) проводится в присутствии неорганического основания, предпочтительно выбранного из NaOH, КОН, Na2CO3 и К2СО3. Твердые неорганические основания (например, карбонаты) предпочтительно добавляют в реакционную смесь в мелко размолотом виде.
Когда применяются производные формулы (II), в которых Х=C1-С5-алкоксигруппа, линейная или разветвленная, то реакция А проводится в присутствии катализатора трансэстерификации, предпочтительно выбранного из CH3ONa, C2H5ONa, (С4Н9)2SnО И Ti(OC4H9)4.
Возможны различные способы смешивания указанных реагентов.
В предпочтительном воплощении реакция а) проводится следующим образом. Соединение (II) смешивают с биполярным апротонным растворителем и с неорганическим основанием (или катализатором трансэстерификации). Затем в эту смесь, нагретую до температуры кипения с обратным холодильником, добавляют пирокатехин. Предпочтительно его добавляют по каплям в жидкую смесь, образующуюся при смешивании пирокатехина, соединения (II) и биполярного апротонного растворителя.
Полученную смесь нагревают при температуре кипения с обратным холодильником в течение 1-3 часов, после чего реакцию останавливают. Конечный продукт (III) отделяют от растворителя и от непрореагировавшего соединения (II) путем фракционной перегонки или перегонки с паром.
Реагенты предпочтительно используют в следующем молярном соотношении - пирокатехин : неорганическое основание : соединение (II)=1:1:2, причем указанное соотношение соединения (II) предпочтительно относится и к начальной смеси, и к той, что содержит пирокатехин, подаваемый по каплям.
Описанная выше реакция ведет к образованию продуктов формулы (III) с выходом более 90%, обычно около 95%.
Реакция ацилирования б) приводит к образованию 5-алканоилбензо[1,3]диоксолов формулы (VI). Эта реакция требует выбора соответствующей кислоты или ангидрида, служащих в качестве ацилирующих агентов, и для ее катализа предпочтительно используют соединения из ряда ZnO, ZnCl2;, FeCl2, FеСl3, FeSO4, Fе2(SO4)3, FeO, Fe2O3, Н3РO4, НСlO4 и полифосфорной кислоты. Особенно предпочтительным катализатором для этой реакции является хлорная кислота (НСlO4). Необязательно реакция протекает в присутствии инертных растворителей, примерами которых являются циклогексан, метилциклогексан, декалин, дихлороэтан и тетрахлорэтан.
Когда в качестве ацилирующего агента применяется кислота (V), молярное соотношение бензодиоксол/кислота (V) колеблется от 5:1 до 0,5:1, предпочтительно 1:1. Когда в качестве ацилирующего агента применяется ангидрид (IV), молярное соотношение бензодиоксол/ангидрид (IV) колеблется от 3:1 до 1:1, предпочтительно 2:1.
Температура реакции поддерживается между 0°С и точкой кипения самого низкокипящего компонента реакционной смеси.
Возможны различные способы смешивания указанных реагентов. В предпочтительном воплощении бензо[1,3]диоксол (III) смешивают с катализатором ацилирования, а затем к этой смеси медленно прибавляют кислоту или ангидрид, выбранный для этой реакции. Реакция завершается за период времени от 1 до 7 часов. Из реакционной смеси выделяют 5-алканоилбензо[1,3]диоксол (VI) путем экстракции органическим растворителем, предпочтительно метиленхлоридом, с последующей фракционной перегонкой органической фазы.
В предпочтительном воплощении реакционная смесь, получаемая в конце стадии б), подвергается циркуляции. Этот процесс проводится путем добавления в истощенную смесь новой порции катализатора ацилирования, а также ацилирующего агента формулы (IV) или (V); можно (хотя и необязательно) добавить и новую порцию бензо[1,3]диоксола формулы (III). При добавлении предпочтительно сохранять молярное соотношение между бензодиоксолом и ацилирующим агентом в пределах тех значений, что указаны выше.
Обогащенную таким образом смесь оставляют для реакции при тех же условиях (время и температура), что и в первом цикле. Эту операцию циркуляции можно проводить один или несколько раз.
На стадии в) 5-алканоилбензо[1,3]диоксол (VI) восстанавливается до 5-(α-гидроксиалкил)бензо[1,3]диоксола (VII). На этой стадии, в общем, можно использовать любые восстановительные реакции. Например, можно использовать водород в присутствии таких катализаторов, как палладий, платина или рутений. Катализатор может быть нанесен на носитель из инертного материала: примерами таких систем являются Pd на углероде, Pt на углероде, Ru на углероде, Pd на окиси алюминия и Pd на сульфате бария. Из других восстанавливающих реагентов можно упомянуть РtO2, PtO, Ni-Raney, NaBH4 и LiAlH4.
Условия реакции (время, температура, давление) и соотношения реагентов - те, что обычно применяются в данной области для реакций этого типа. Например, когда применяется газообразный водород с катализатором, то рабочая температура предпочтительно находится между 20°С и 100°С, а давление от 1 до 60 бар, возможно, в присутствии подходящего растворителя типа метанола, этанола, пропанола, изопропанола или бутанола.
Описанный в настоящем изобретении способ представляет собой первый пример синтеза 5-(α-гидроксиалкил)бензо[1,3]диоксолов исходя из негетероциклического реагента, легкодоступного и недорогого (пирокатехина). Высокий выход на трех стадиях описанной выше реакции дает возможность получать большие количества конечного продукта.
Более того, реакция стадии а) дает возможность получать 2-алкилзамещенные бензо[1,3]диоксолы, не прибегая к отдельной стадии алкилирования в положение 2.
2-алкилзамещенные продукты, получаемые описанным выше способом, являются новыми и поэтому составляют еще один аспект настоящего изобретения. Эти соединения имеют структурную формулу (VIII)
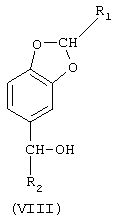
в которой R1 означает линейный или разветвленный C1-С3-алкил, a R2 означает линейный или разветвленный C1-С19-алкил.
Предпочтительную группу соединений формулы VIII составляют те, в которых R1 представляет собой метил, этил, н-пропил или изопропил.
Производные формулы (VII), независимо от того, являются они замещенными в положении 2 на кольце бензо[1,3]диоксола или нет, наряду с тем, что они представляют интерес сами по себе как эссенции и ароматизирующие вещества, могут также применяться как реагенты при получении подобных производных и представляют особый интерес для парфюмерной промышленности или производства инсектицидов.
Предпочтительным примером таких соединений являются 5-алкилбензо[1,3]диоксолы, особенно 5-пропилбензо[1,3]диоксол (дигидросафрол). Тем самым настоящее изобретение также включает получение этих продуктов путем дальнейшего восстановления производных формулы (VII), предварительно полученных на стадии в). Можно также получить 5-алкилбензо[1,3]диоксолы непосредственно реакцией восстановления, исходя из соединений формулы (VI). При этом производные формулы (VII) образуются как промежуточные соединения, без их выделения, в этом случае в качестве катализаторов восстановления предпочтительно используют металлы на инертном носителе, такие как Pd/C, Pt/C и Pd/BaSO4.
5-(1-пропенил)бензо[1,3]диоксол (изосафрол) является другим примером производного, которое можно получить способом, составляющим предмет настоящего изобретения. В этом случае 5-гидроксиалкилбензо[1,3]диоксол формулы (VII), полученный на стадии в), подвергают реакции дегидратации. Такие реакции дегидратации, известные из литературы, можно проводить в присутствии подходящего растворителя, такого как бензол, толуол, ксилол, мезитилен, дихлороэтан или тетрахлороэтан, в присутствии органической или неорганической кислоты, такой как, например, азотной, серной, соляной, хлорной, уксусной, трифторуксусной, бензолсульфоновой или n-толуолсульфоновой кислоты, при температуре кипения растворителя, удаляя образующуюся при реакции воду с помощью азеотропной отгонки.
В свою очередь, 5-(1-пропенил)бензо[1,3]диоксол можно превратить в пиперональ или же, с помощью реакции восстановления, в 5-пропилбензо[1,3]диоксол (дигидросафрол).
Далее настоящее изобретение иллюстрируется следующими неограничивающими его примерами.
ПРИМЕРЫ
1. Получение бензо[1,3]диоксола
В смесь из 104 г (0,75 моль) мелко размолотого карбоната калия в 440 мл N,N-диметилформамида добавляли 45 мл (0,7 моль) метиленхлорида и эту смесь нагревали до температуры кипения с обратным холодильником (128-130°С). Затем по каплям добавляли раствор, содержащий 75 г (0,68 моль) пирокатехина в 110 мл N,N-диметилформамида и 45 мл (0,7 моль) метиленхлорида.
После добавления смесь нагревали при температуре кипения с обратньм холодильником в течение 2 часов, охлаждали, а затем фильтровали.
Полученный раствор перегоняли при атмосферном давлении и собирали 42 мл дихлорометана (40-41°С). После этого порциями по 50 мл добавляли 400 мл воды и отгоняли при 98-100°С азеотропную смесь бензо[1,3]диоксола и воды и затем при 152-153°С отгоняли N,N-диметилформамид.
Из смеси бензо[1,3]диоксола и воды отделяли продукт, и в водную фазу добавляли насыщенный раствор хлористого натрия, после чего экстрагировали 2 раза 60 мл дихлорметана.
Продукт объединяли с органическим раствором и упаривали при 25°С/ 20 мбар, получая 78 г бензо[1,3]диоксола.
2. Получение 5-пропаноилбензо[1,3]диоксола
В смесь из 73,2 г (0,6 моль) бензо[1,3]диоксола и 1 мл 70% хлорной кислоты, охлажденную до 0-5°С, медленно добавляли 38,1 мл (0,3 моль) пропионового ангидрида, поддерживая во время добавления температуру 0-5°С.
По завершении добавления смесь оставляли при перемешивании на 3 часа, позволяя нагреться до комнатной температуры. Эту смесь разбавляли 50 мл дихлорометана и 50 мл воды, перемешивали в течение получаса, а затем отделяли органическую фазу. Органическую фазу промывали 30 мл 2 М водного раствора гидроокиси натрия и водой, а затем высушивали в присутствии сульфата натрия.
Органическую фазу перегоняли при атмосферном давлении, собирая дихлорометан при 40-41°С, отгоняли непрореагировавший бензо[1,3]диоксол (44 г) при 55°С/1,3 мбар и затем продукт (34,5 г) при 125-130°С/1,3 мбар.
В реакционную смесь, содержащую 44 г непрореагировавшего бензо[1,3]диоксола, добавляли 29,2 г (0,24 моль) бензо[1,3]диоксола и 1 мл 70% хлорной кислоты. В эту смесь, охлажденную до 0-5°С, добавляли 38,1 мл (0,3 моль) пропионового ангидрида. По методике, описанной в предыдущих абзацах, получали 44 г непрореагировавшего бензо[1,3]диоксола и 34,5 г требуемого продукта.
3. Получение 5-(α-гидроксипропил)бензо[1,3]диоксола
В многогорловую колбу на 250 мл в атмосфере азота вносили 30 г 5-пропаноил-бензо[1,3]диоксола (0,268 моль), растворенного в 100 мл метанола. При 25°С по каплям в течение 20 минут добавляли 7 г NaBH4 (0,185 моль), растворенного в 50 мл метанола, после чего реакционную смесь доводили до температуры кипения с обратным холодильником. Через 2 часа смесь охлаждали, удаляли метанол при пониженном давлении, разбавляли 100 мл 2 М НСl и экстрагировали дважды CH2Cl2. Объединенные органические фазы промывали 100 мл Н2O и концентрировали при пониженном давлении, получая 30,07 г тяжелого светлого масла, анализ которого методами газовой хроматографии, масс-спектроскопии, ЯМР (1Н, 13С, DEPT) подтвердил присутствие требуемого продукта.
В качестве альтернативы 5-(α-гидроксипропил)бензо[1,3]диоксол получали следующим способом. В автоклав на 1 литр вносили 30 г 5-пропаноилбензо[1,3]диоксола (0,168 моль), растворенного в 150 мл изопропанола, и 1 г 5% Ru/C. Автоклав закрывали, продували азотом и заполняли Н2 при давлении 1 бар при перемешивании. Смесь продолжали перемешивать при постоянном давлении Н2 в 1 бар в течение 1 часа, после чего продували N2 и фильтровали. После отгонки растворителя при пониженном давлении получили 30 г тяжелого масла, анализ которого методами газовой хроматографии, масс-спектроскопии, ЯМР (1Н, 13С, DEPT) подтвердил присутствие требуемого продукта.
4. Получение 5-пропилбензо[1,3]диоксола (ди гидросафрола)
34,5 г 5-пропаноилбензо[1,3]диоксола (0,19 моль) растворяли в 100 мл изопропанола и добавляли 2 г 50%-й взвеси 5% Pd/C. Эту смесь вносили в автоклав и гидрогенизировали при давлении 4 бар и температуре 40°С. Смесь фильтровали и упаривали при 40°С/20 мбар, получая масло, которое отгоняли при 108-109°С/18 мбар, анализ которого методами газовой хроматографии, масс-спектроскопии, ЯМР (1Н, 13С, DEPT) подтвердил присутствие требуемого продукта.
5. Получение 5-[(Е) 1-пропенил]-1,3-бензодиоксола
В многогорловую колбу на 100 мл вносили 5 г 5-(α-гидроксиэтил)бензо[1,3]-диоксола (27 ммоль), растворенного в 50 мл толуола, и кристалл n-толуолсульфоновой кислоты. Реакционную смесь нагревали до температуры кипения с обратным холодильником и воду, образовавшуюся в этой реакции, собирали с помощью азеотропной отгонки. Через 2 часа в охлажденную смесь добавляли 10 мл 2 М NaOH и оставляли при перемешивании на 10 минут. После разделения двух фаз органическую фазу концентрировали при пониженном давлении, получая желтое масло, которое очищали перегонкой (90°С, 1 mmHg).
Получили 4,1 г светлого желтоватого масла, анализ которого методами газовой хроматографии, масс-спектроскопии, ЯМР (1Н, 13С, DEPT) подтвердил присутствие требуемого продукта.
Пример 6
Следуя методике, приведенной в примере 1, смесь 52 г (0,375 моль) мелкоразмолотого карбоната калия, 230 мл N,N-диметилформамида, 11,4 г (0,076 моль) NaI и 22,5 мл (0,35 моль) метиленхлорида при 128-130°С подвергают взаимодействию с раствором 37,5 г (0,34 моль) пирокатехина в 55 мл N,N-диметилформамида и 22,5 мл метиленхлорида. Следуя методике, описанной в примере 1, получают 40,2 г бензо[1,3]диоксола, имеющего температуру кипения 172-173°С.
Пример 7
Следуя методике, приведенной в примере 1, смесь 10,4 г (0,075 моль) мелкоразмолотого карбоната калия, 30 мл N,N-диметилформамида, 0,9 г (0,006 моль) NaI и 9,4 г (0,08 моль) 1,1-дихлорпропана (т.е. соединения формулы II, где R1 представляет собой этил) при 130°С подвергают взаимодействию с раствором 7,5 г (0,068 моль) пирокатехина в 11 мл N,N-диметилформамида.
В конце реакции смесь нагревают при температуре кипения с обратным холодильником в течение 2 часов. Затем реакционную смесь охлаждают, образовавшуюся соль отфильтровывают и полученный раствор подвергают перегонке, получая соединение формулы III, где R1 представляет собой этил, имеющее температуру кипения 218-221°С. Это соединение используют в качестве промежуточного соединения для синтеза соединения VII, где R1 и R2 представляют собой этил, используя методики примеров 2 и 3. Полученное соединение обладает инсектицидным действием.
Пример 8
Следуя методике, аналогичной приведенной для получения 5-(α-гидроксипропил)бензо[1,3]диоксола, получают соединение, охарактеризованное формулой VIII, где R1 и R2 означают этил. Полученный продукт представляет собой густое белое масло, которое медленно кристаллизуется из н-гексана и имеет температуру плавления, равную 112-114°С. Структура полученного соединения также подтверждается данными ЯМР (H1).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ДИГИДРО-2,3-БЕНЗОДИАЗЕПИНА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1995 |
|
RU2151149C1 |
| СПОСОБ СТЕРЕОСЕЛЕКТИВНОГО ПОЛУЧЕНИЯ ЭНАНТИОМЕРА ГЕТЕРОБИЦИКЛИЧЕСКОГО СПИРТА, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1997 |
|
RU2185379C2 |
| МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2012 |
|
RU2640420C2 |
| БЕНЗО-N-ГИДРОКСИАМИДНЫЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2737433C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛОНОВ, СПОСОБ ПОЛУЧЕНИЯ И БИОЛОГИЧЕСКИЕ ПРИМЕНЕНИЯ | 2008 |
|
RU2491283C2 |
| НОВЫЕ АНТАГОНИСТЫ NK И NK | 2006 |
|
RU2419609C2 |
| ПРОИЗВОДНЫЕ 6,7-ДИГИДРО-3Н-ОКСАЗОЛО[3,4-α]ПИРАЗИН-5,8-ДИОНА | 2011 |
|
RU2581831C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2-ЗАМЕЩЕННОГО БЕНЗО[B]ТИОФЕНА (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-ФЕНИЛ-3-АРОИЛБЕНЗО[B]ТИОФЕНА (ВАРИАНТЫ), И ПРОИЗВОДНЫЕ БЕНЗО[B]ТИОФЕНА | 1996 |
|
RU2147582C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОПТИЧЕСКИ АКТИВНЫХ АЛЬФА-АМИНОАЦЕТАЛЕЙ | 2009 |
|
RU2507194C2 |
| ПОЛУЧЕНИЕ 3-[(1R,2R)-3-(ДИМЕТИЛАМИНО)-1-ЭТИЛ-2-МЕТИЛПРОПИЛ]-ФЕНОЛА | 2007 |
|
RU2463290C2 |
Изобретение касается трехстадийного способа синтеза 5-(α-гидроксиалкил)бензо[1,3]диоксолов. Способ включает: (i) взаимодействие пирокатехина (1,2-дигидроксибензола) с дигало- или диалкоксиалканом с образованием производного бензо[1,3]диоксола; (ii) избирательное каталитическое ацилирование бензо[1,3]диоксола в положении 5 с образованием 5-алканоилбензо[1,3]диоксола и последующее (iii) восстановление до 5-(α-гидроксиалкил)бензо[1,3]диоксола. Также описаны новые бензодиоксолы, получаемые указанным выше способом. Способ изобретения прост для промышленного осуществления и мало влияет на окружающую среду. Он позволяет получать с высоким выходом производные бензо[1,3]диоксола, представляющие значительный интерес, особенно для парфюмерной промышленности и в области инсектицидов. 4 н. и 10 з.п. ф-лы.
где R1 означает Н или линейный или разветвленный C1-С3-алкил;
R2 означает линейный или разветвленный C1-С19-алкил,
включающий следующие стадии:
а) взаимодействие 1,2-дигидроксибензола (пирокатехина) формулы I
с соединением формулы II
где Х означает хлор, фтор, бром, иод, линейную или разветвленную C1-С5-алкоксигруппу;
R1 имеет вышеуказанные значения,
в биполярном апротонном растворителе, при температуре между 70 и 190°С,
б) взаимодействие полученного соединения формулы III
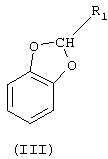
где R1 имеет вышеуказанные значения,
с алифатическим ангидридом формулы IV
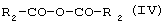
или алифатической кислотой формулы V
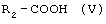
где R2 имеет вышеуказанное значение,
в присутствии катализатора ацилирования, с получением соединения формулы VI
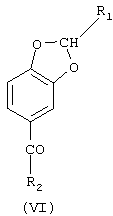
где R1 и R2 имеют вышеуказанные значения,
в) восстановление полученного соединения формулы VI с получением соединения формулы VII, где R1 и R2 имеют вышеуказанные значения.
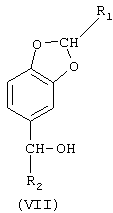
где R1 означает Н или линейный или разветвленный C1-С3-алкил;
R2 означает линейный или разветвленный C1-С19-алкил,
по любому из пп.1-8 с последующим его восстановлением до 5-алкилбензо[1,3]диоксола.
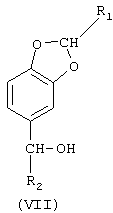
где R1 означает Н или линейный или разветвленный C1-С3-алкил;
R2 означает линейный или разветвленный C1-С19-алкил,
по любому из пп.1-8 с последующей его дегидратацией до 5-(1-алкенил)бензо[1,3]диоксола.
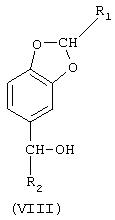
где R1 означает линейный или разветвленный C1-С3-алкил;
R2 означает линейный или разветвленный C1-С19-алкил.
| 2-/2-Цианоэтил/-4,5-бензо-1,3-диоксолан, обладающий акарицидной активностью против иксодовых клещей рода Шаломма | 1989 |
|
SU1703648A1 |
| ПРОИЗВОДНЫЕ 1,4-ДИГИДРОПИРИДИНА ИЛИ ИХ ГИДРОХЛОРИДЫ, ОБЛАДАЮЩИЕ АНТАГОНИСТИЧЕСКИМИ СВОЙСТВАМИ ПО ОТНОШЕНИЮ К ИОНАМ КАЛЬЦИЯ | 1992 |
|
RU2036922C1 |
| Тепловой аккумулятор | 1987 |
|
SU1502914A1 |
| ИСКРИСТО-ФОРСОВЫЙ СОСТАВ | 2000 |
|
RU2170223C1 |
| US 3946040 А, 23.03.1976. | |||
Авторы
Даты
2004-12-27—Публикация
1999-10-14—Подача