Изобретение относится к новому процессу синтеза некоторых производных дигидро-2,3-бензодиазепина и особенно применимо к процессу получения этих соединений с высокой энантимерной чистотой и выходами. Оно также относится к промежуточным соединениям, полезным в данном процессе.
В патенте США N 4835152 раскрывается, что соединение 1-(4- аминофенил)-4-метил-7,8-метилендиокси-3,4-дигидро-5H-2,3- бензодиазепин обладает свойством оказывать действие на центральную нервную систему.
Европейская патентная заявка, опубликованная под N EP-A1-0492485 раскрывает производные 2,3-бензодиазепина и другие дигидро-2,3-бензодиазепиновые производные, оказывающие действие на центральную нервную систему, в особенности проявляющие активность расслаблять мышцы и противоконвульсивную активность. Соединения, описанные в EP-A1-0492485, представлены общей формулой: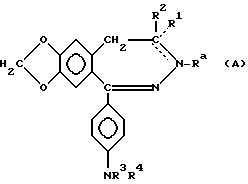
в которой Ra представляет (C1-C6)алифатическую ацильную группу, необязательно замещенную метокси, циано, карбоксильной, амино, (C1-C4)алкиламино, ди(C1-C4)алкил) амино, пирролидино, фталимидо или фенильной группой или одним или более атомами галогена; или
Ra представляет бензоильную, циклопропанкарбонильную, (C1-C5)алкилкарбамоильную или фенилкарбамоильную группу; или
Ra отсутствует, когда между атомами N(3) и C(4) существует двойная связь;
R1 обозначает водород; или
R1 отсутствует, когда между N(3) и C(4) атомами существует двойная связь;
R2 представляет (C1-C3)алкильную группу; или
R1 и R2 вместе обозначают метиленовую группу, и между N(3) и C(4) атомами отсутствует двойная связь;
R3 представляет водород или (C1-C4) алифатическую ацильную группу;
R4 представляет водород; (C1-C6)алифатическую ацильную группу, необязательно замещенную метокси, циано, карбоксильной, амино, (C1-C4) алкиламино, ди((C1-C4)алкил) амино, пирролидино, фталимидо или фенильной группой, или одним или более атомами галогена; а также бензоильную, пальмитоильную, циклопропанкарбонильную, (C1-C5)-алкилкарбамоильную или фенилкарбамоильную группу; или пунктирные линии представляют валентные связи, которые необязательно присутствуют, при условии, что между N(3) и C(4) атомами двойная связь отсутствует, когда и R3 и R4 обозначает водород.
В публикации международной патентной заявки N WO 9211262 также раскрываются некоторые производные дигидро- 2,3-бензодиазепина, оказывающие действие на центральную нервную систему, в особенности антидепрессивное и/или антипаркинсоновое действие. Эти соединения могут быть представлены общей формулой (A), приведенной выше, в которой
R1 представляет водород, R2 представляет метил, Ra представляет водород или (C1-C4)алкильную группу, необязательно замещенную карбоксильной или (C2- C5)алкоксикарбонильной группой, R3 представляет водород и R4 представляет алифатическую (C1-C6) ацильную, бензоильную или фенилацетильную группу.
В настоящее время известно, что соединения, раскрытые в патенте США N 4853152, EP-A1-0492485 и WO 92/11262, являются сильными антагонистами рецепторов класса АМРА (альфа-амино-3-гидрокси-5- метилизоксазол-4-пропионовая кислота) центральной нервной системы млекопитающих. Они потенциально имеют широкое применение в качестве нейрозащитных агентов, особенно в качестве антиконвульсивных агентов. Они, таким образом, могут быть полезными при лечении эпилепсии, церебральной ишемии, травм головного и спинного мозга, эпилептических припадков, болезни Паркинсона и амиотрофического латерального склероза.
Дигидро-2,3-бензодиазепины, описанные в патенте США N 4835152, EP-A1-0492485 и WO 92/11262, имеют центр асимметрии в положении 4. В настоящее время известно, что (R) энантиомеры, например (R)-7-ацетил-5-(4-аминофенил)-8,9-дигидро-8-метил-7H- 1,3-диоксоло[4,5-h][2,3]-бензодиазепин, известный также как (R)-1-(4-аминофенил)- 3-ацетил-4-метил- 7,8-метилендиокси-3,4-дигидро- 5H-2,3-бензодиазепин, являются более сильными, чем (S) энантиомеры.
В патенте США N 4835152, EP-A1-0492485 и WO 92/11262 описываются синтетические способы получения дигидро-2,3- бензодиазепинов. По этим способам дигидро-2,3-бензодиазепиновое кольцо образуется с помощью селективного восстановления соответствующего 2,3-бензодиазепинового соединения с использованием неорганического или смешанного органическо- неорганического и/или комплекса гидрида металла, такого как боргидрид натрия с последующим, если необходимо, отделением оптически активных форм.
В настоящее время найден весьма оригинальный привлекательный способ стереоселективного синтеза для получения (R) энантиомеров дигидро-2,3-бензодиазепинов, описанных в патенте США N 4835152, EP-A1-0492485, WO 92/11262, и некоторых других дигидро-2,3-бензодиазепинов.
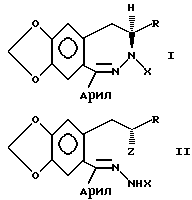
Настоящее изобретение представляет способ получения соединения, имеющего общую формулу: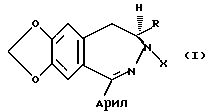
в которой R представляет водород или (C1-C10)алкил;
X представляет водород, (C1-C10)алкил, ацил, арил или карбоксил,
или их замещенные производные.
Во время данного процесса образуются новые и неочевидные промежуточные соединения, которые далее обеспечивают эффективный синтез целевых соединений. Некоторые из раскрытых новых промежуточных соединений включают полукетальные и гидразоновые соединения.
где Z представляет уходящий атом или группу, такую, как мезилат (метилсульфонат). Следует иметь в виду, что R и фрагменты сохраняют одни и те же значения на протяжении данного описания.
Соответственно, целью данного изобретения является предоставление нового стереоселективного процесса образования производных дигидро-2,3-бензодиазепинов.
Еще одной целью является предоставление процесса получения производных дигидро-2,3-бензодиазепина, который является эффективным и экономичным в связи с тем, что достигаются высокие выходы и энантиомерная чистота с помощью меньшего числа стадий и с меньшими затратами, чем это было известно ранее.
Еще одна цель заключается в предоставлении новых промежуточных соединений, образуемых в течение синтеза дигидро-2,3-бензодиазепинов.
Другие цели станут очевидными после прочтения следующего ниже описания.
Согласно одному аспекту настоящее изобретение предоставляет процесс получения соединения, имеющего общую формулу:
в которой R представляет водород или (C1-C10)алкил; и
X представляет водород, (C1-C10)алкил, ацил, арил, карбоксил;
или их замещенные производные,
или защитную группу, или их фармацевтически приемлемых солей, при этом данный процесс включает циклизацию соединения, имеющего общую формулу: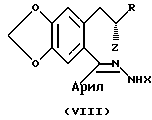
в которой Z представляет уходящий атом или группу, с получением соединения, имеющего общую формулу (I); после чего, если необходимо, превращение соединения формулы (I) в другое соединение формулы (I) и/или образование фармацевтически приемлемой соли.
Было найдено, что соединения формулы (I) могут получаться с высоким выходом и с высокой энантиомерной чистотой с помощью процесса согласно изобретению.
Как он используется здесь, термин "(C1-C10)алкил" представляет прямую или разветвленную алкильную цепь, имеющую от одного до десяти атомов углерода. Типичные (C1-C10)алкильные группы с прямой или разветвленной цепью включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, н-гексил, 2-метилпентил, н- октил, децил и аналогичные. Термин "(C1-C10)алкил" охватывает своим значением и "(C1-C4)алкил" и "(C1-C6)алкил".
Термин "арил" обозначает ароматический фрагмент, такой как фенил, тиенил, фурил, пиридил, имидазолил, и полиядерные ароматические фрагменты, такие как нафтил, фталазинил, хинолил, флуоренил, антрацил и фенантренил. Термин "замещенный арил" представляет арильную группу, замещенную одним или большим числом фрагментов, выбранных из группы, состоящей из галогена, гидрокси, циано, нитро, (C1-C6)алкила, (C1-C4)алкокси, карбокси, ацетила, формила, карбоксиметила, гидроксиметила, амино, аминометила или трифторметила. Примеры замещенных арильных групп включают 4- метилфенил, 2-метилфенил, 4-метоксифенил, 4-(изопропил) фенил, 4-циклопентилфенил, 4-(трет-бутил) фенил, 4-ацетилфенил, 4-трифторметилфенил, 4-хлорфенил, 2-бромфенил, 3-иодфенил, 6-бромнафтил, 3,4-(метилендиокси) фенил, инданил, 1,2,3,4- тетрагидронафтил и 1,2,4,4-тетраметил-1,2,3,4- тетрагидронафтил.
Термин "ацил" означает водород, (C1-C6)алкильную группу или гетероатом (например, азот, как в амидогруппе), присоединенные к карбонильной группе. Типичные ацильные группы включают формил, ацетил, пропионил, бутанил, валерил, гексанил карбамоил, N-метилкарбамоил и уреил.
"Арил", используемый в формулах в данном описании, представляет незамещенную или замещенную арильную группу. Примерами значений для арила являются п-нитрофенил, п-аминофенил и п-(замещенный амино) фенил, такой как п-((C1-C6)алканоиламино) фенил, например п-ацетиламинофенил. Примеры подходящих защитных групп могут быть найдены в Mcomie, Protective Groups in Organic Chemistry, Plenum Press, Н.-Й., 1973, и Green и Wutz, Protecting Groups in Organic Synthesis 2-е изд., Джон Вили энд Санз, Н.-Й., 1991.
R предпочтительно представляет (C1-C3)алкильную группу, например метил.
Примерами значений для X являются водород, формил, ацетил, пропионил и метилкарбамоил.
X предпочтительно представляет (C1-C6)алифатическую ацильную группу, необязательно замещенную метокси, циано, карбоксильной, амино, (C1-C4)алкиламино, ди((C1-C4)алкил)амино пирролидино, фталимидо или фенильной группой, или одним или более галогенами; или R представляет бензоильную, циклопропанкарбонильную, (C1-C5)алкилкарбамоильную или фенилкарбамоильную группу.
Уходящим или удаляемым атомом или группой, представленными символом Z, могут быть, например, атом галогена или органосульфонилоксигруппа, или она может образовываться на месте (ин ситу) из соответствующего соединения формулы VIII, в которой Z представляет гидрокси.
Конкретными значениями Z, когда он представляет атом галогена, является хлор или бром.
Органосульфонилоксигруппой, представленной Z, может быть, например, (C1-C4)алкансульфонилоксигруппа, трифторметансульфонилоксигруппа или фенилсульфонилоксигруппа, в которой фенильная группа является незамещенной или замещенной одним или двумя заместителями, выбранными независимо из (C1- C4)алкила, (C1-C4)алкокси, галогена, нитро и галоид (C1-C4)алкила. Конкретными значениями Z являются метансульфонилокси, п-толуолсульфонилокси и п-нитрофенилсульфонилокси.
Было найдено, что гораздо лучший выход получается с помощью циклизации соединения формулы VIII, в которой Z представляет органосульфонилоксигруппу, а не соединения формулы VIII, в которой Z представляет атом галогена.
Когда Z представляет атом галогена или органосульфонилоксигруппу, циклизация предпочтительно проводится в присутствии основания, выбранного из гидроокисей щелочного металла, например гидроокиси натрия или калия; карбонатов щелочного металла, например карбонатов натрия или калия; гидридов щелочных металлов, например гидрида натрия или калия; алкоголятов щелочных металлов, например трет-бутилата лития, натрия или калия. Процесс удобным образом проводится при температуре в интервале от -30 до 100oC, предпочтительно от 0 до 50oC. Подходящие растворители включают алканолы, такие как метанол или этанол, и простые эфиры, такие как тетрагидрофуран.
Соединение формулы VIII, в которой Z представляет уходящий атом или группу, может генерироваться на месте по реакции, например, соединения формулы VIII, в которой Z представляет гидроксильную группу, с триарилфосфином в присутствии азидодикарбоксилатного эфира. Предпочтительно триарилфосфином является трифенилфосфин, а азидодикарбоксилатным эфиром - диэтилазодикарбоксилат. Процесс удобно проводится при температуре в интервале от -30 до 100oC, предпочтительно от -10 до 50oC. Подходящие растворители включают простые эфиры, такие как тетрагидрофуран. Следует понимать, что в данном случае уходящей группой, представленной символом Z, является триарилфосфонилоксигруппа, такая как трифенилфосфонилокси.
Способ согласно изобретению представляет особый интерес для получения соединений формулы (I), в которой арил представляет п-аминофенил. Такие соединения предпочтительно получаются с помощью циклизации соединения общей формулы VIII, в которой арил представляет п-нитрофенил, п-аминофенил или п-(защищенный амино) фенил, после чего, если необходимо, осуществляют:
(a) восстановление п-нитрофенилового эфира, получая п-аминофениловый эфир, или
(b) снятие защиты или деблокирование п-(защищенный амино)-фенильной группы с получением п-аминофенильной группы.
В соответствии с предпочтительным аспектом настоящее изобретение предоставляет способ получения соединения, имеющего общую формулу (I), в которой R представляет метил и X представляет водород, формил, ацетил, пропионил или N-метилкарбамоил или защитную группу, а арил представляет п-нитрофенил, п-аминофенил или п-(защищенный амино) фенил, после чего, если необходимо, осуществляют:
(a) восстановление п-нитрофенильной группы с получением п-аминофенильной группы;
(b) снятие защиты с п-(защищенный амино) фенильной группы с получением п-аминофенильной группы;
(c) удаление защитной группы, представленной символом X, для получения соединения формулы (I), в которой X представляет водород; и/или
(d) ацилирование соединения формулы (I), в которой X представляет водород, для получения соединения формулы (I), в которой X представляет формил, ацетил, пропионил или N-метилкарбамоил; и, если необходимо, образование фармацевтически приемлемой соли.
Нитрогруппа в п-нитрофенильной группе может восстанавливаться с помощью методов, известных в технике, например, как описано в EP-A1-0492485. Так, она может восстанавливаться с помощью реакции с гидразином или гидразингидратом в присутствии катализатора - никеля Ренея. Альтернативно, она может восстанавливаться по реакции с водородом, муравьиной кислотой, формиатом аммония, триалкиламмонийформиатом, таким как триэтиламмонийформиат, или формиатом щелочного металла, таким как формиат натрия или калия, в присутствии катализатора на основе металла группы VIII, такого как палладий на активированном угле. Подходящие растворители включают спирты, такие как метанол, этанол или изопропанол, и простые эфиры, такие как тетрагидрофуран или ацетон. Восстановление может удобно проводиться при температуре в интервале от -10 до 120oC.
Защитная группа в п-(защищенной амино)фенильной группе может удаляться обычным образом. Например, (C1-C6)алканоильная группа может удаляться с помощью гидролиза в присутствии минеральной кислоты, например соляной кислоты.
Ацилирование соединения формулы (I), в которой X представляет водород, для получения соединения формулы (I), в которой X представляет ацильную группу, такую как формил, ацетил, пропионил или N-метилкарбамоил, может проводиться, как описано в EP-A1-492485.
Соединения формулы VIII, в которой Z представляет гидроксильную группу или уходящий атом или группу, считаются новыми и предоставляются в качестве дополнительного аспекта изобретения.
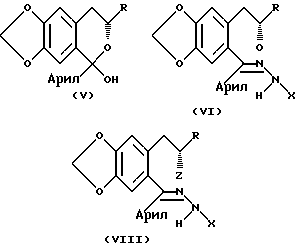
Соединения общей формулы VIII могут получаться с помощью многостадийного процесса, исходящего из производного метилендиоксифенилацетона.
Согласно еще одному аспекту, следовательно, настоящее изобретение предоставляет процесс получения соединения, имеющего общую формулу: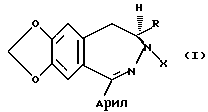
в которой R представляет водород или (C1-C10)алкил; и
X представляет водород, (C1-C10)алкил, ацил, арил, карбоксил, или его замещенное производное; данный процесс включает стадии:
a) предоставления некоторого количества соединения, имеющего формулу:
b) асимметричного восстановления соединения формулы II, давая соединение формулы: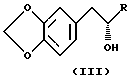
c) взаимодействие соединения формулы III с арилальдегидным соединением формулы Арил•CHO, с получением изохроманового соединения, имеющего формулу:
d) реакции соединения формулы IV с окисляющим агентом для получения соединения формулы:
e) взаимодействие соединения формулы V с гидразидным производным формулы H2NNHX для получения соединения формулы: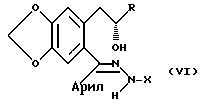
и f) взаимодействия соединения формулы VI с (i) сульфонилгалогенидным реагентом и основанием для образования промежуточного сульфоната, с последующей реакцией полученного в результате сульфоната с сильным основанием; или
(ii) путем непосредственной циклизации по Мицунобу для получения соединения формулы I.
Новый процесс данного изобретения предоставляет синтез с помощью меньшего числа стадий, с получением более высоких выходов и стереоселективности, и не дает никаких тяжелых металлов, и приводит к очень незначительным или вообще не дает почти никаких непроизводительных затрат. Процесс предусматривает на ранней стадии энантиоселективное восстановление, во время которого стереохимия устанавливается в сторону предпочтительного изомера (в данном случае (R) или (-) энантиомера конечного продукта).
Предпочтительный процесс включает раннее хиральное восстановление кетона в спирт. В многостадийном процессе добавляются заместители для закрытия бензо-сконденсированного пиранового кольца перед тем, как вводится гидразиновый реагент для открытия кольца и добавления необходимых азотных компонентов. Наконец, вторичное кольцо закрывается при добавлении сильного основания и соединение восстанавливается, образуя желаемое соединение.
Наиболее предпочтительно стадия хирального восстановления является начальной стадией в синтезе соединений формулы (I) из кетонов. Хиральное восстановление может проводиться при использовании специфических химических веществ или предпочтительно с помощью использования биологических агентов, описанных ниже. Установление стереохимии на ранней стадии в процессе является благоприятным и позволяет более поздним стадиям осуществляться с относительно энантиомерно чистым материалом. Это увеличивает как производительность, так и энантиомерную чистоту.
Первая стадия процесса включает хиральное восстановление исходного материала (предпочтительно 3,4-метилендиоксифенил-ацетонового производного) с получением фактически энантиомерно чистого спиртового производного 1,2-метилендиоксибензола. Предпочтительно образуемым энантиомером является (S) или (+) стереоизомер спирта. Наиболее предпочтительным исходным соединением является 3,4-метилендиоксифенил-ацетон.
Альтернативно, начальная стадия может включать сочетание галоидного производного 1,2-метилендиоксибензола с энантиомерно обогащенным эпоксидом. Это также приводит в результате к получению высоко обогащенного в энантиомерном отношении спиртового производного 1,2-метилендиоксибензола.
Материалом, используемым для проведения начальной стадии хирального восстановления, может быть или химический, или, предпочтительно, биологический материал. В случае биологических агентов предпочтительными агентами являются восстанавливающие ферменты, наиболее предпочтительными являются дрожжи из группы Zygosaccharamyces. Другие биологические агенты, которые могут использоваться, включают: Pichia fermentas, Endomycopsis fibuligera, Nematospora coryli, Saccharоmyces sp., Candida famata, Saccharоmyces pastorianus, Saccharоmyces cerevisiae, Saccharomyces uvarum, Candida utitis, Saccharomyces globosus, Kluyveromyces dobzhansk, Kluyveromyces lactis, Candida albicans, пекарские дрожжи, Zygosaccharоmyces rouxii, Lactobacillus acidophilus, Aureobasidium pullulans, Mortierella isabellina, Rhizopus orysae, Kloeskeva javanica, Hinseniaspora valbyensis, Octosporomyces octospori, Candida quilliermondi, Candida parapsilosis, Candida tropicalis, Torulopsis taboadae, Torulopsis ethanolitolerans, Torulopsis ptarmigani, Torulopsis (sonorensis, Trigonopsis variabilis, Torulopsis enokii, Torulopsis methanothermo быстро растворимые дрожжи SAF, инакт. дрожжи ashland, Candida boidinii, Candida blankii и дрожжи Red star.
Желательным промежуточным продуктом, образующимся на начальной стадии, является спиртовое замещенное производное 1,2-метилендиоксибензола, причем наиболее предпочтительное производное состоит из (S)-альфа-метил-1,3-бензодиоксол-5-этанола.
Желательное промежуточное соединение, образовавшееся на начальной стадии, затем подвергается реакции Пиктет-Спенглера, которая дает конвергентное слияние углеродных составных компонентов бензодиазепина. Предпочтительным реагентом является п-нитробензальдегид, хотя могут использоваться и другие известные специалистам в данной области реагенты, такие как ацетали. Предпочтительными промежуточными соединениями являются дигидробензопираны, причем наиболее предпочтительным соединением является 7,8-дигидро-7-метил-5-(4-нитрофенил)-5H-1,3-диоксоло- бензо[b]пиран.
Дигидробензопирановое производное затем окисляется в C-5 положении, давая полукетальное производное общей формулы: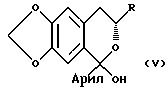
Предпочтительные окисляющие агенты включают перманганат калия, DDQ (2,3-дихлор-5,6-циано-1,4-бензохинон) или другие, причем наиболее предпочтительным агентом является гидроокись натрия, диметилсульфоксид и сочетание с воздухом.
C-5 полукеталь затем подвергается реакции с гидразидным производным формулы H2NNHX в присутствии кислоты для образования гидразонового промежуточного соединения. На данной стадии раскрывается бензопирановое кольцо, так что гидразоновый компонент становится связанным с C-5 углеродом. Наиболее предпочтительным гидразидом является уксусный гидразид и он предпочтительно подвергается реакции в дефлегмирующем ароматическом или протонном растворителе, предпочтительным гидразоном является соединение общей формулы: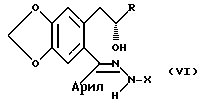
где R представляет CH3, X представляет ацетил и арил представляет п-нитрофенил.
Гидразоновое производное превращается в желательное бензодиазепиновое кольцо через внутримолекулярное алкилирование. Это достигается с помощью одного из нескольких возможных методов. Первый метод включает добавление смеси сульфонилгалогенидного реагента формулы YSO2Xa, в которой Xa представляет атом галогена, такой как хлор, и в которой Y представляет органическую группу, такую как (C1-C4)алкил, трифторметил или фенил, в которых фенильная группа является незамещенной или замещенной одним или двумя заместителями, выбранными независимо из (C1-C4)алкила, (C1-C4)алкокси, галогена, нитро и галоид (C1-C4)алкила (например, метансульфонилхлорида) и основания, такого как третичный амин (например, триэтиламин), с образованием сульфонатного промежуточного соединения формулы
Сульфонат затем превращается в 8,9-дигидро-7H-2,3-бензо- диазепиновое производное с помощью добавления сильного основания, наиболее предпочтительно - гидроокиси щелочного металла, такой как каустическая сода, алкоголята щелочного металла, такого как трет- бутилат натрия или калия, карбоната щелочного металла, такого как карбонат калия, или гидрида щелочного металла, такого как гидрид натрия. Необязательно реакция может проводиться в присутствии катализатора переноса фаз, такого как тетрабутиламмонийбромид.
Альтернативно, соединение формулы VI может превращаться в соединение формулы VIII, в которой Z представляет атом галогена, например соединение формулы VI может подвергаться реакции с имидазолом, трифенилфосфином и бромом, давая соединение формулы VIII, в которой Z представляет атом брома. Полученное соединение формулы VIII может затем циклизоваться после той же процедуры, что используется в случае соединения формулы VIII, в которой Z представляет органосульфонилоксигруппу.
Совершенно удивительно было найдено, что циклизация соединения формулы VIII, в которой Z представляет органосульфонилоксигруппу, может проводиться с высоким выходом, с явно незначительным, если оно и есть, элиминированием. Однако, в случае соединения формулы VIII, в которой Z представляет атом галогена, выход является значительно более низким, вследствие конкурентного элиминирования. Соответственно, предпочитается использование соединения формулы VIII, в которой Z представляет органосульфонилоксигруппу (соответствующую соединению формулы VII).
Еще один метод включает циклизацию по Мицунобу, которая представляет одностадийный процесс, дающий п-нитрофенил-бензодиазепиновое промежуточное соединение.
Когда желательным является соединение формулы I, в котором арил представляет п-аминофенил, и получено соединение формулы IV, в которой арил представляет п-нитрофенил, нитрогруппа может восстанавливаться на любой стадии процесса. Предпочтительно, она восстанавливается после стадии процесса e) или f).
Нитрогруппа может восстанавливаться с помощью добавления газообразного водорода или источника водорода в присутствии катализатора. Предпочтительным источником водорода является формиат калия или другая формиатная соль (такая как формиат аммония), при этом предпочтительным катализатором является сочетание металла палладия и активированного древесного угля. Стадия восстановления хорошо известна специалистам в данной области техники.
Предпочтительные процессы могут быть суммированы с помощью следующих ниже схем, с получением наиболее предпочтительного продукта.
Схема I.

На схеме I начальная стадия процесса включает добавление биологических агентов, наиболее предпочтительно Zygosaccharоmyces rouxii, для восстановления кетона в желаемый спирт. Для предотвращения гибели организма или для абсорбирования спирта, как только он образуется, к реакционной смеси может добавляться подходящее количество адсорбирующей смолы, такой как AD-7, XAD-7, HP2MG α (поперечно-сшитые полиметакрилаты фирмы Ром энд Хаас), HP20 (полистирольная) или SP207 (бромированный полистирол фирмы Мицунобу).
Могут также использоваться другие сходные смолы.
Схема II.

На схеме (II) начальная стадия процесса включает взаимодействие арилгалогенидного производного, такого как 4-бром- 1,2-(метилендиокси)бензол, с углеводородным производным щелочного металла (предпочтительным является втор-бутиллитий) и энантиомерно чистым эпоксидом. Предпочтительным является (S)-(-)- пропиленоксид. Альтернативно, арилгалогенид может сначала превращаться в реагент Гриньяра по реакции с магнием, а затем вводиться в реакцию с энантиомерно чистым эпоксидом в присутствии иодида меди (I) в качестве катализатора. На обеих схемах (I) и (II) целью является как можно раньше установить стереохимию C-8 атома бензодиазепинового кольца. Было замечено, что обе эти схемы достигают данной цели, и образуются энантиомерно обогащенные (ee) спирты с 98% чистотой.
Следующие примеры являются показательными примерами осуществления процесса данного изобретения.
Пример 1. Синтез (S)-альфа-метил-1,3-бензодиоксол-5-этанола
1 Эквивалент 3,4-метилендиоксифенил-ацетона, 0,45 эквив. динатрийфосфата, 0,03 эквив. фосфорной кислоты, 12,5 объемов смолы AD-7 и 5,8 объемов воды смешивались вместе и перемешивались в течение 15-60 мин при 20-25oC. Добавлялось 2,27 эквив. глюкозы и Z.rouxii АТСС 14462 добавлялся в количестве 1,5 г влажной клеточной пасты на грамм кетона (это составляет 0,375 г/г на сухой основе). Данная смесь разбавлялась водой до 25 объемов, а затем осторожно перемешивалась при 33-35oC в течение 8-16 ч. Смесь фильтровалась на сите из нержавеющей стали размером 100 меш (примерно 150 мкм) и смола, которая оставалась на сите, промывалась 25 объемами волы, разделенными на 4 отдельные порции. Продукт, который адсорбировался смолой, затем десорбировался со смолы 25 объемами ацетона. Раствор ацетон-продукт затем подвергался паровой отгонке досуха под вакуумом, давая целевое промежуточное соединение в виде желтого масла средней вязкости. Выход на месте (ин ситу) был 97-100%, в то время как выход выделенного продукта составлял 85-90%. Активность составляла 80-95%, а EE - 100%.
Пример 2. Синтез (5RS, 7S)-7,8-дигидро-7-метил-6-(4- нитрофенил)-5H-1,3-диоксоло-[4,5-G][2]бензопирана
Указанное выше промежуточное соединение растворялось в 4,64 объемах толуола, фильтровалось через гифло и промывалось 1,55 объемами толуола. Добавлялось 1,05 эквив. п-нитро-бензальдегида и 1,05 эквив. концентрированной соляной кислоты, и смесь нагревалась до 55-65oC и перемешивалась в течение 1 ч. Затем производился обмен растворителей, при 250 мм рт.ст. толуол заменялся 12,4 объемами смеси 93% изопропанола/7% воды. Объем во время данной замены растворителя менялся от 11-14 объемов и конечный объем составлял примерно 11 объемов. Смесь охлаждалась до 0-10oC и перемешивалась в течение 2 ч. Продукт в виде иглообразных кристаллов отфильтровывался и промывался 2 раза 1,85 объема изопропанола и сушился под вакуумом при 50-60oC. Выход ин ситу целевого соединения был 95%, в то время как выход выделенного продукта составлял 87-93%. Активность составляла более 99%, а EE - 100%.
Пример 3. Альтернативный синтез (S)-альфа-метил-1,3- бензодиоксол-5-этанола
3,47 г 4-Бром-1,2-(метилендиокси)бензола растворялось в 100 мл тетрагидрофурана при -78oC, затем добавлялось 13,9 мл 1,3 М втор-бутиллития в циклогексане для потребления арилгалогенида менее чем через 30 мин. С помощью шприца добавлялось 1,00 г (S)-(-)-окиси пропилена в 2 мл ТГФ, и раствор перемешивался в течение 45 мин. Раствор затем подогревался до 23oC в течение 16 ч. Реакционная смесь выливалась в 3 М раствор хлорида аммония и продукт выделялся с помощью экстракции этилацетатом. Объединенные экстракты сушились над сульфатом магния, фильтровались через флорисил и концентрировались с помощью роторного испарения. Остаточное масло очищалось с помощью хроматографии на силикагеле и элюировалось смесью 50:50 гексана и диэтилового эфира, давая 1,40 г (45%) указанного в заголовке промежуточного соединения.
Pchem: (α)365 +117,2o (с 1,0 CHCl3);
ТСХ Rf = 0,26 (50:50 гексан:эфир);
ИК (CHCl3): 3598, 3012, 2973, 2887, 1490, 1249, 1041 см-1;
13C ЯМР (CDCl3): д. 147.75, 146.19, 132.26, 122.27, 109.68, 108.30;
масс. спектр, m/z, (FD, M+) 180;
Анализ для C10H12O3: Вычислено: C 66.65, H 6.71,
Найдено: C 66.42, H 6.66.
Пример 4. Альтернативный синтез (5RS,7S)-7,8-дигидро-7-метил-5- (4-нитрофенил)- 5H-1,3-диоксоло-[4,5-G][2]бензопирана
244 г п-Нитробензальдегида добавлялось к раствору 300 г промежуточного соединения, образовавшегося на стадии биокатализируемого восстановления примера 1, в 4,45 л толуола. На протяжении 15-20 мин по каплям добавлялось 166,5 мл концентрированной соляной кислоты и получающаяся в результате смесь нагревалась до 60oC в течение 2,5 ч. Смесь охлаждалась до комнатной температуры и концентрировалась с помощью роторного испарения. Добавлялось 3 л этанола и смесь концентрировалась до твердого вещества. Добавлялась еще 3 л порция этанола и смесь перемешивалась в течение 1 ч. Суспензия охлаждалась на протяжении ночи, и кристаллический продукт отделялся с помощью вакуумной фильтрации. Осадок на фильтре промывался этанолом, а затем сушился в вакуумной печи при 40-60oC, давая 450 г (86%) не совсем белого твердого вещества, которое по данным определения представляло изомерную смесь названного выше в заголовке оптически активного промежуточного соединения.
Pchem: (α)365 +55 (с. 0.4, CHCl3).
Пример 5. Синтез (5RS, 7S)-7,8-дигидро-7-метил-5-(4-нитрофенил)- 5H-1,3-диоксоло-[4,5-G][2]бензопиран-5-ола
350 г Изомерного промежуточного соединения из примера 4 добавлялось к раствору 731 мл диметилсульфоксида и 2923 мл диметилформамида. Смесь охлаждалась до 8-12oC и через смесь пропускался сжатый воздух. Добавлялось 117,5 мл 50% водной гидроокиси натрия в виде одной порции, и получающаяся в результате смесь перемешивалась в течение 4,5 ч. Реакционная смесь добавлялась с помощью трубочки на протяжении 30-60 мин к 8,25 л перемешиваемого раствора 1 н. соляной кислоты при 10-15oC. Получающийся осадок отфильтровывался и промывался 3 л воды, затем подвергался воздушной сушке до постоянного веса (384 г). Влажный осадок на фильтре переносился на стадию примера 6 без дальнейшей сушки.
Pchem: данные регистрировались по 3:1 изомерной смеси;
ТСХ Rf = 0.19 (75:25 гексан:этилацетат);
ИК (CHCl3): 3605, 3590, 3015, 3000, 2960, 1608, 1522, 1484, 1352, 1240, 1240, 1042 см-1;
1H ЯМР (CDCl3, 300 МГц): (главный изомер) 8.16 (д, 2H, 7=6.9 Гц), 7.73 (д, 2H, 7=6.9 Гц), 6.55 (с, 1H), 6.38 (с, 1H), 5.86 (с, 1H), 5.83 (с, 1H), 4.38 (м, 1H), 2.70 (м, 2H), 1.39 (д, 3H, J= 6.3 Гц), d (второстепенный изомер) 8.27 (д, 2H, J =8.9 Гц), 7.90 (д, 2H, J=8.6 Гц), 6.87 (с, 1H), 6.73 (с, 1H), 6.03 (с, 1H), 6.02 (с, 1H), 3.95 (м, 1H), 2.7 (смазанный, м, 2H), 1.24 (д, 3H, J=6.1 Гц);
масс. спектр, m/z (FD, M+) 329;
Анализ для C17H15NO6: Вычислено: C 62.01, H 4.59, N 4.25.
Найдено: C 62.22, H 4.79, N 4.29.
Пример 6. Синтез (S)-уксусная кислота-[[6-(2-гидроксипропил)-1,3- бензодиоксол-5-ил](4-нитрофенил)метилен]гидразида
К 350 г влажного осадка с фильтра из примера 5 в 2300 мл этанола добавлялось 94,5 г уксусного гидразида и 1 мл концентрированной соляной кислоты. Получающийся раствор нагревался до температуры дефлегмации в течение 2,5 ч. Смесь охлаждалась до комнатной температуры и концентрировалась до желтой пены с помощью роторного испарения. Концентрат растворялся в 4,9 л этилацетата и промывался 1,5 л насыщенного бикарбоната натрия, а затем 1,5 л солевого раствора. Органическая фаза сушилась над сульфатом натрия, фильтровалась и концентрировалась, давая 373 г желтой пены (91%). Материал идентифицировался в виде 1:1 неразделимой смеси изомеров указанного в заголовке соединения (97% чистая по данным ВЭЖХ).
Pchem: данные регистрировались по 1:1 изомерной смеси;
T.пл. 167,8-169,7oC;
ТСХ Rf = 0,55 (этилацетат);
ИК (CHCl3): 3590, 3485, 3310, 1694, 1673, 1520, 1485, 1346 см-1;
1H ЯМР (CDCl3, 300 МГц): 8.64, 8.50 (с, 1H, NH), 8.18 (д, 2H, Ar-H), 7.74, 7.71 (д, 2H, J=8 Гц, Ar-H), 6.99, 6.95 (с, 1H, Ar-H), 6.52, 6.50 (с, 1H, Ar-H), 6.06, 6.05 (д, 2H, J=5 Гц, O2CH2), 2.44 (с, 1H, CH3), 3.87 (м, 1H, CH), 2.4-2.2 (м, 2H, CH2), 1.12, 1.10 (д, 3H, CH3);
13C ЯМР (CDCl3, 75 МГц): d 209.94 (C), 173.38, 173.43 (C), 149.38, 149.62 (C), 148.31, 148.58 (C), 147.90, 148.18 (C), 147.54 (C), 142.5, 143.04 (C), 132.64 (C), 127.53, 127.61 (CH), 123.75, 123,77 (CH), 122.86, 123.27 (C), 112.13 (CH), 110.55 (CH), 108.03, 108.10 (CH), 101.83 (CH2), 67.51, 68.08 (CH), 42.37, 42.97 (CH2), 23.48, 23.83 (CH3), 20.47, 20.55 (CH3);
(α)589 +103.8o (с 1, CHCl3);
масс. спектр, m/z (FD, M+), 385;
Анализ для C19H19N3O6: Вычислено: C 59.22, H 4.97, N 10.90.
Найдено: C 58.99, H 5.04, N 10.68.
Пример 7. Синтез (S)-уксусной кислоты[[6-2-[(метилсульфонил) окси]пропил]-1,3-бензодиоксол-5-ил](4-нитрофенил)метилен]гидразида
340 г Промежуточного соединения из примера 6 растворялось в 2380 мл метиленхлорида. Раствор охлаждался до 0 - 10oC и добавлялось 187 мл триэтиламина. Затем добавлялось 78,2 мл метансульфонилхлорида, и получающаяся в результате смесь перемешивалась в течение 15-30 мин. Добавлялось 510 мл воды. Отделенная органическая фаза промывалась 460 мл 1 н. раствора соляной кислоты, а затем 500 мл солевого раствора. Метиленхлоридный раствор подогревался до 35-45oC и на протяжении 90 мин добавлялось 4760 мл гексана. Смесь медленно охлаждалась до комнатной температуры, а затем дополнительно охлаждалась до 0 - 5oC. Продукт отделялся с помощью вакуумного фильтрования и сушился в вакуумной печи при 40-50oC, давая 356,2 г (87%) изомерной смеси названного в заголовке соединения в виде желтого твердого вещества.
Pchem: данные регистрировались по 3:1 изомерной смеси;
T.пл. 150,5-152,5oC;
ТСХ Rf = 0.80 и 0.73 (этилацетат);
ИК (CHCl3): 1696, 1520, 1486, 1346, 1175, 1041, 923 см-1;
1H ЯМР (CDCl3, 300 МГц) δ: 8.44 (с, 1H, NH), 8.20 (д, 2H, J=8.8 Гц, Ar-H), 7.73 (д, 2H, J =8.6 Гц), 6.94 (д, 1H, J=2.7 Гц, Ar-H), 6.57 (д, 1H, J = 2.6 Гц, Ar-H), 6.08 (д, 2H, J=5.4 Гц), 4.77 (м, 1H, CH), 2.90 (с, 3H, CH3 основной или главный), 2.83 (с, 3H, CH3 второстепенный), 2.66-2.57 (м, 2H, CH2), 1.30 (д, CH3 второстепенный), 1.26 (д, 3H, CH3 главный);
масс. спектр, m/z (FD, M+) 385;
Анализ для C20H21N3O8S:
Вычислено: C 51.83, H 4.57, N 9.07, S 6.92.
Найдено: C 52.05, H 4.53, N 8.84, S 6.96.
Пример 8. Синтез (R)-7-ацетил-8,9-дигидро-8-метил-5-(4- нитрофенил)-7H-1,3-диоксоло-[4,5-h][2,3]бензодиазепина
325 г Промежуточного соединения примера 7 растворялось в 3174 мл метанола. К перемешиваемому раствору добавлялось 38,1 мл 50% раствора каустической соды. К смеси добавлялось 6348 мл воды и содержимое перемешивалось в течение 3 ч, после чего получающийся в результате осадок отделялся с помощью вакуумного фильтрования. Вещество сушилось в вакуумной печи при 45-55oC, давая 255 г (97%) названного в заголовке соединения, которое было 97,6% чистоты по данным процента площади ВЭЖХ. 221 г высушенного материала дополнительно очищалось с помощью ресуспендирования в 1105 мл этанола, который нагревался до температуры дефлегмации. Получающаяся в результате смесь охлаждалась до комнатной температуры и осадок отделялся с помощью вакуумного фильтрования. Изолят сушился в вакуумной печи при 45-55oC, давая 199 г (90%) указанного в заголовке соединения, которое имело 100% чистоту по данным анализа ВЭЖХ.
Пример 9. Синтез (R)-7-ацетил-5-(4-аминофенил)-8,9-дигидро-8- метил-7H-1,3-диоксоло-[4,5-h][2,3]бензодиазепина
К 5 г промежуточного соединения из примера 8 в 50 мл этанола добавлялось 0,5 г 10% Pd/C, увлажненного водой. Перемешиваемая взбалтыванием суспензия обрабатывалась раствором 4 г формиата калия в 4 мл воды. Получающаяся в результате смесь перемешивалась в течение 2,5 ч, а затем фильтровалась через Гифло. Фильтрат концентрировался до 10-20 мл с помощью перегонки и к теплому (78oC) раствору медленно добавлялось 22 мл воды. Получающаяся в результате смесь нагревалась до 90oC и затем медленно охлаждалась до комнатной температуры. Продукт отделялся с помощью вакуумного фильтрования и промывался 10-20 мл воды. Отделенное твердое вещество сушилось в вакууме до 50oC, давая 4,17 г (93%) названного в заголовке конечного соединения, которое было на 100% чистым по данным анализа на содержание активного вещества ВЭЖХ.
(α)365 = -303.7 (c=1, метанол).
Пример 10. Синтез (5RS,7)-7,8-дигидро-7-метил-5-(4-нитрофенил- 5H-1,3-диоксоло[4,5-G][2]бензопиран-5-ола
15 г Промежуточного соединения из примера 4 (получаемого по методу восстановления кетона с помощью Z. rouxii) растворялось в растворе 75 мл диметилсульфоксида и 75 мл диметилформамида. Раствор охлаждался до 7-9oC, а затем аэрировался 40% кислородом в азоте. Добавлялось 7,62 г 50% гидроокиси натрия в воде и получающаяся в результате смесь перемешивалась в течение 3-4 ч. Реакция заканчивалась и при поддержании температуры, равной 12oC, добавлялось 120 мл толуола, а затем смесь 45 мл воды и 10 мл соляной кислоты. Фазы разделялись и органический слой промывался 75 мл 10% водного раствора тиосульфата натрия. Органический слой, содержащий названное в заголовке промежуточное соединение, переносился на следующую стадию.
Пример 11. Синтез (S)-уксусная кислота-[[6-(2-гидроксипропил)- 1,3-бензодиоксол-5-ил](4-нитрофенил)метилен гидразида
К толуольному раствору промежуточного соединения из примера 10 добавлялось 4,26 г уксусного гидразида и (0,01 объема) соляная кислота. Получающаяся в результате смесь нагревалась до кипения в течение 3,5 ч с удалением воды с помощью ловушки Дина-Старка. Реакционная смесь концентрировалась с помощью вакуумной перегонки до 1 объема. Концентрат разбавлялся 105 мл метиленхлорида и промывался по 50-55 мл каждым из насыщенного раствора бикарбоната натрия и солевого раствора. Органический раствор сушился над сульфатом магния (0,25 вес. %) и фильтровался через слой гифло. Фильтр прополаскивался 1 объемом метиленхлорида. Объединенная органическая фаза, содержащая названное в заголовке промежуточное соединение, переносилась на следующую стадию.
Пример 12. Синтез (S)-уксусная кислота[[6-[2-[(метилсульфонил) окси]пропил]-1,3-бензодиоксол-5-ил](4-нитрофенил)метилен]гидразида
Метиленхлоридный раствор, содержащий промежуточное соединение примера 11, охлаждался до 0 - (-5)oC и добавлялось 10 мл триэтиламина.
Медленно добавлялось 4,1 мл метансульфонилхлорида для поддержания температуры реакции, равной 0oC. К получающемуся раствору добавлялось 1,5 объема воды. Органическая фаза отделялась и промывалась 2,5 объемами 1 н. раствора соляной кислоты. Органическая фаза отделялась и концентрировалась до половины первоначального объема с помощью перегонки при атмосферном давлении. Продукт осаждался добавлением по каплям гептана (2:1 объема гептана к органическому концентрату) к раствору при 45oC. Перемешиваемая смесь охлаждалась до 20 -25oC в течение 1 ч, затем охлаждалась до 0 - (-5)oC в течение 1-2 ч. Осадок отделялся с помощью вакуумной фильтрации и промывался 3 объемами смеси 4: 1 гептан: метиленхлорид; затем сушился в вакуумной печи при 45-55oC. Получалось 17,43 г указанного в заголовке промежуточного соединения (78%) в виде оптически активной смеси изомеров гидразона, которая имела 97,7% чистоту по данным анализа содержания активного вещества с помощью ВЭЖХ.
Пример 13. Синтез (R)-7-ацетил-8,9-дигидро-8-метил-5-(4- нитрофенил)-7H-1,3-диоксоло-[4,5-H][2,3]бензодиазепина
17,5 г Промежуточного соединения из примера 12 суспендировалось в 175 мл этилового спирта. К перемешиваемой смеси добавлялось 1,7 г порошкообразной гидроокиси натрия. Получающаяся смесь перемешивалась в течение 1 ч. К смеси добавлялось 88 мл воды, и содержимое перемешивалось в течение 1 ч, после чего получающийся в результате осадок отделялся с помощью вакуумного фильтрования и промывался 175 мл воды. Вещество сушилось в вакуумной печи при 70oC, давая 12,2 г (86%) названного в заголовке соединения, которое имело 99,9% чистоту по данным анализа активности с помощью ВЭЖХ.
Пример 14. Синтез (R)-7-ацетил-5-(4-аминофенил)-8,9-дигидро-8- метил-7H-1,3-диоксоло-[4,5-h][2,3]бензодиазепина
При использовании продукта примера 13 целевое соединение получалось с помощью той же самой процедуры эксперимента, что описана в примере 9.
Пример 15. (R)-7-ацетил-8,9-дигидро-8-метил-5-(4-нитрофенил)- 7H-1,3-диоксоло-[4,5-h][2,3]бензодиазепин
1,05 г (S)-Уксусная кислота [[6-[2-[гидрокси пропил]- 1,3-бензодиоксол-5-ил] (4-нитрофенил)метилен] гидразида и 0,78 г трифенилфосфина в 70 мл тетрагидрофурана охлаждались до 0oC. По каплям на протяжении 15 мин добавлялось 0,57 г диэтилазодикарбоксилата в 5 мл тетрагидрофурана. Получающаяся смесь перемешивалась в течение 2 ч, затем подогревалась до комнатной температуры в течение 2 ч. Смесь переносилась в делительную воронку и раствор промывался 1 н. HCl, водой и солевым раствором. Органическая фаза сушилась над сульфатом магния, фильтровалась и концентрировалась с помощью роторного испарения. Остаток элюировался на силикагельной колонке (1:1 этилацетат: гексан). Фракции, содержащие желаемое соединение, концентрировались до желтого масла, которое затвердевало при стоянии. Желтое кристаллическое вещество суспендировалось в 30 мл метиленхлорида и гексана (3:7) при 0oC. Осадок удалялся с помощью фильтрования и фильтрат концентрировался до желтой пены. Остаток суспендировался в 10 мл этанола, который подогревался до дефлегмации, затем медленно охлаждался до комнатной температуры. Осадок собирался с помощью фильтрования и сушился в вакуумной печи при 60oC, давая 0,51 г (50%) указанного в заголовке продукта (100% ee), который был по данным ВЭЖХ анализа активности на 98,3% чистым.
Примеры 16-18
0,5 мл суспензии замороженных дрожжей, содержащей микроорганизм, указанный в таблице 1, добавлялось к 50 мл солодово-дрожжевой среды в 250 мл колбе. После 48-часового встряхивания 1,0 мл культуры добавлялся к дополнительным 50 мл среды и смесь встряхивалась в течение еще 48 ч. Добавляется 3,4-метилендиоксифенилацетон до тех пор, пока конечная концентрация не будет 10 г/л наряду с 1 мл 10% глюкозы. Культуры инкубируются и встряхиваются в течение 24 ч, затем анализируются с помощью ВЭЖХ на присутствие хирального спиртового промежуточного продукта примера 1.
Пример 19. Синтез (S)уксусная кислота[[6-[2-(метилсульфонил) окси]пропил-1,3-бензодиоксол-5-ил](4-аминофенил)-метилен]гидразина
К суспензии промежуточного соединения из примера 7 (5,00 г) в 100 мл изопропилового спирта добавлялся 10% Pd/C (1 г), а затем формиат калия (3,7 г), растворенный в 8 мл воды. Спустя 1,5 ч, добавлялась еще одна порция формиата калия (3,7 г) с последующим добавлением 10% Pd/C (1 г). Исходное вещество потреблялось через 30 мин. Смесь фильтровалась через слой диатомовой земли и концентрировалась, остаток растворялся в метиленхлориде и промывался водой и солевым раствором. Органический раствор сушился над сульфатом натрия, фильтровался и концентрировался. Целевое соединение (4,52 г) отделялось в виде светло-желтого твердого вещества с выходом 97% в виде 1:1,3 изомерной смеси.
Данные, зарегистрированные по 1:1,3 изомерной смеси.
ТСХ Rf = 0.83 (ацетонитрил);
ИК (CHCl3): 3010, 1670, 1628, 1332, 1174, 1041, 922 см-1;
1H ЯМР (CDCl3, 300 МГц) d 8.18 (д, 1H, J =9.2 Гц), 7.39 (д, 2H, J=11.4 Гц), 7.38 (д, 2H, J =10 Гц), 6.91 (с, 1H), 6.89 (с, 1H), 6.62 (д, 2H, J=8.5 Гц), 6.61 (д, 2H, J=8.1 Гц), 6.57 (с, 1H), 6.56 (с, 1H), 6.06 (м, 4H), 4.71 (секст. , 2H, J = 7 Гц), 3.9 (шир.с, 4H), 2.86 (с, 3H), 2.78 (с, 3H), 2.74-2.49 (м, 4H), 1.29 (д, 3H, J=10.8 Гц), 1.25 (д, 3H, J =10.8 Гц);
масс. спектр, m/z (FD, M+) 433;
УФмакс (этанол) 326 нм (ε 20767), 231 (17587), 205 (42765).
Пример 20. Синтез (R)-7-ацетил-5-(4-аминофенил)-8,9-дигидро-8- метил-7H-1,3-диоксоло-[4,5-h][2,3]бензодиазепина
К раствору промежуточного соединения из примера 19 (0,51 г) в 6 мл ТГФ добавлялась одна порция трет-бутилата лития (0,17 г). Раствор перемешивался при температуре окружающей среды в течение 2 ч, затем подогревался до 40-50oC в течение 4 ч. Реакционная смесь гасилась добавлением 10 мл 3 М хлорида аммония. Получающаяся в результате смесь разбавлялась 15 мл эфира и промывалась 15 мл воды и 15 мл солевого раствора. Органический раствор сушился над сульфатом натрия, фильтровался и концентрировался. Остаток растворялся в 5-10 мл теплого метиленхлорида и продукт осаждался при добавлении 10-20 мл эфира. Продукт отделялся с помощью фильтрования, повторно растворялся в этиловом спирте и концентрировался. Целевое соединение (0,23 г) отделялось с выходом 58% и 100% ee (по данным ВЭЖХ хирального анализа).
Пример 21. Метилсемикарбазид
В 200 мл этанола, охлажденного до 2,5oC, в атмосфере азота растворялось 17 мл (350,4 ммоля) моногидрата гидразина. К данному холодному перемешивающемуся раствору добавлялся по каплям на протяжении 2 ч раствор 10,3 мл (174,6 ммоля) метилизоцианата в 150 мл толуола при поддержании внутренней температуры менее 6oC. Прозрачный бесцветный раствор перемешивался в течение 30 мин при 5-10oC, затем выпаривался и сушился под вакуумом, давая 15,19 г белого твердого вещества. Твердые вещества перемешивались в 40 мл толуола и нагревались до кипения, давая мутный раствор. После медленного охлаждения до комнатной температуры и перемешивания в течение 2 ч суспензия фильтровалась через грубого помола стекло. Твердые вещества промывались гексаном и сушились под вакуумом при 50oC, давая 13,39 г (86,4%) целевого соединения в виде белого кристаллического твердого вещества.
T.пл. 116oC;
МС (FD+) = 89;
ИК: 3362, 3303, 1630, 1561 см-1;
1H ЯМР (DMCO) δ: 2.57 (д, 3, J=4 Гц), 4.06 (шир.с, 2), 6.27 (шир.с, 1), 6.94 (шир.с, 1);
13C ЯМР (DMCO) δ: 160.87, 25.89.
Пример 22. Синтез (S)-2-[[6-(2-гидроксипропил)-1,3-бензодиоксол- 5-ил] (4-нитрофенил)-метилен]-N-метилгидразинкарбоксамида
В колбе в атмосфере азота растворялось 5,17 г (15,70 ммоля) промежуточного продукта примера 5 в 30 мл этанола. К данному перемешиваемому раствору добавлялось 1,75 г (19,7 ммоля) метилсемикарбазида. Смесь нагревалась до температуры дефлегмации для растворения твердых веществ, а затем добавлялось 5 капель концентрированной HCl. После 1 ч нагревания с обратным холодильником желтое твердое вещество выпадало в осадок из раствора. Спустя 1 ч анализ ВЭЖХ показал завершение реакции, 38,2% и 55,4% двух изомеров продукта и полное отсутствие какого-либо остатка исходного материала. Желтая суспензия медленно охлаждалась до температуры окружающей среды и перемешивалась в течение 1 ч, а затем перемешивалась в течение 30 мин на бане из ледяной воды. Смесь фильтровали через грубое стекло. Твердые вещества промывались этанолом и сушились под вакуумом при 50oC, давая 5,08 г (81,2%) целевого соединения в виде желтого твердого вещества.
T.пл. 238oC.
Анализ ВЭЖХ показал два изомера, 46,2%+53,1%. МС (FD+) = 400;
ИК: 1692, 1345 см-1;
1H ЯМР (DMCO) δ: 0.90 (т, 3, J=6 Гц), 2.22 (м, 2), 2.72 (д, 3, J=5 Гц), 3.63 (м, 1), 4.42 (д, 1/2, J=6 Гц), 4.58 (д, 1/2, J=6 Гц), 6.10 (с, 2), 6.69 (д, 1, J=8 Гц), 7.05 (д, 1, J=10 Гц), 7.32 (шир. т, 1, J=4 Гц), 7.85 (д, 1, J=9 Гц), 8.18 (д, 2, J=9 Гц), 8.62 (д, 1, J=8 Гц);
13C ЯМР (DMCO) δ: 24.27, 24.51, 27.18, 43.30, 43.73, 67.09, 67.47, 102.45, 108.95, 109.19, 111.50, 111.54, 112.41, 112.45, 124.40, 124.48, 124.69, 128.35, 133.47, 133.69, 144.55, 144.61, 144.68, 144.79, 147.71, 147.76, 148.06, 149.39, 149.54, 156.11, 156.23;
Анализ для C19H20N4O6: Вычислено: C 57.00, H 5.03, N 13.99.
Найдено: C 57.72, H 5.01, N 13.99.
Пример 23. Синтез (S)-N-метил-2-[[6-[2-[(метилсульфонил)окси] пропил]-1,3-бензодиоксол-5-ил](4-нитрофенил)-метилен]гидразинкарбоксамида
В колбе в атмосфере азота в 120 мл ТГФ суспендировалось 2,00 г (5,00 ммолей) промежуточного соединения примера 22. Смесь нагревалась слегка для растворения твердых веществ, затем медленно охлаждалась до температуры окружающей среды без осаждения. К желтому раствору добавлялось 1,1 мл (7,89 ммоля) триэтиламина. Раствор затем охлаждался на бане из смеси ледяной воды и NaCl и добавлялось 500 мкл (6,34 ммоля) метансульфонилхлорида. Спустя 30 мин ВЭЖХ показал завершение реакции, 99,0% мезилата. Реакционная смесь гасилась 50 мл волы и переносилась в делительную воронку с 100 мл этилацетата. Органический слой промывался 1 н. HCl (50 мл) и солевым раствором (50 мл), затем сушился над сульфатом натрия. Растворитель выпаривался, давая 2,56 г сырого целевого соединения в виде смеси желтого твердого вещества/пены. Сырое или неочищенное целевое соединение растворялось в 12 мл метиленхлорида и раствор нагревался до кипения с обратным холодильником. К раствору добавлялось 6 мл гексанов по каплям, что вызывало осаждение желтых твердых веществ. Смесь медленно охлаждалась до температуры окружающей среды при перемешивании. После нахождения в течение 1 ч при температуре окружающей среды, смесь фильтровалась через грубый стеклянный фильтр и твердые вещества промывались гексанами. После сушки при 50oC и 30'' Hq, собиралось целевое соединение в виде 2,19 г (91,6%) желтых кристаллов, т.пл. 164oC.
МС (FD) = 478;
ИК: 1696, 1346 см-1;
1H ЯМР (DMCO) δ: 1.12 и 1.19 (д, 3, J=6 Гц), 2.52 (м, 2), 2.73 (д, 3, J= 3 Гц), 2.98 и 3.03 (с, 3), 4.76 и 4.84 (кв., 1, J=6, 12 Гц), 6.13 (с, 2), 6.74 и 6.78 (с, 1), 7.16 и 7.20 (с, 1), 7.33 (шир. т, 1, J=5 Гц), 7.86 (д, 2, J=9 Гц), 8.18 и 8.22 (д, 2, J=9 Гц), 8.76 (с, 1);
13C ЯМР (DMCO) δ: 21.35, 21.47, 27.09, 38.55, 79.50, 79.91, 102.56, 109.34, 109.46, 111.34, 111.37, 111.72, 111.74, 124.37, 124.42, 124.86. 128.26, 128.36, 130.01, 130.14, 143.74, 143.81, 144.22, 144.32, 147.93, 147.98, 148.19, 148.25, 149.65, 155.97;
Анализ для C20H22N4O8S: Вычислено: C 50.21, H 4.63, N 11.71.
Найдено: C 50.46, H 4.71, N 11.65.
Пример 24. Синтез (R)-7-N-метилкарбамоил-8,9-дигидро-8-метил- 5-(4-нитрофенил)-7H-1,3-диоксоло[4,5-h][2,3]бензодиазепина
В колбе в атмосфере азота в 40 мл ТГФ суспендировалось 1,50 г промежуточного соединения из примера 23. После перемешивания желтая смесь охлаждалась на бане из смеси ацетона и льда и добавлялось 276 мг (3,45 ммоля) трет-бутилата лития. После перемешивания в течение 1 ч анализ ВЭЖХ мутной оранжево-красной смеси показал 96,5% желаемого соединения и лишь 3,1% оставшегося исходного материала. Спустя 90 мин реакционная смесь гасилась 5 мл насыщенного водного хлористого аммония и смесь переносилась в делительную воронку с 5 мл воды и 60 мл метиленхлорида. Желтый органический слой промывался 20 мл 1 н. HCl, насыщенным водным бикарбонатом натрия и солевым раствором, затем сушился над сульфатом натрия. Растворитель удаляли путем выпаривания, давая 1,29 г сырого целевого соединения в виде смеси из желтого твердого вещества и пены.
МС (FD+) = 382.2;
Анализ для C19H18N4O5: Вычислено: C 59.68, H 4.74, N 14.65.
Найдено: C 60.00, H 5.13, N 13.75.
Пример 25. Синтез (R)-5-(4-аминофенил)-8,9-дигидро-8-метил- 7-N-метилкарбамоил-7H-1,3-диоксоло[4,5-h][2,3]-бензодиазепина
В колбе в атмосфере азота в 9 мл этанола растворялось 902 мг (2,36 ммоля) промежуточного соединения из примера 24. К данному раствору добавлялось 90 мг 10% Pd/C с последующим добавлением раствора 690 мг (8,20 ммолей) формиата калия в 0,7 мл воды. Формиатный раствор добавлялся с помощью пипетки на протяжении примерно 30 секунд, и инициировалась изотермия, которая достигала 53oC через 2-3 мин. Спустя 15 мин ВЭЖХ анализ аликвоты реакционной смеси показал только желаемый продукт. Черная реакционная смесь фильтровалась через смоченный этанолом фильтр из целита на микроволокнистой бумаге, и фильтр промывался этанолом. Фильтрат выпаривался, давая 953 мг сырого целевого соединения в виде светло-желтых твердых веществ. После попытки перекристаллизации из водного этанола материал распределялся между водой и этилацетатом. Органический слой промывался солевым раствором и сушился над сульфатом натрия. Растворитель выпаривался и этанол отгонялся с паром из продукта несколько раз, давая 647 мг (97%) целевого соединения в виде от светло-рыжеватокоричневого до желтого твердого вещества, т.пл. = 142,4oC. По данным анализа хиральной ВЭЖХ определено 99,5% ee.
Пример 26. Синтез (S)-уксусная кислота[[6-(2-бромпропил)- 1,3-бензодиоксол-5-ил]-(4-нитрофенил)метилен]гидразида
1,0 г (2,59 ммоля) промежуточного соединения примера 6, 0,265 г (3,89 ммоля) имидазола и 0,849 г (3,24 ммоля) трифенилфосфина объединялись в 10 мл метиленхлорида при температуре окружающей среды, давая золотисто-желтый раствор, который охлаждался до 0oC на бане из ледяной воды. После охлаждения до 0oC добавлялось 0,414 г (2,59 ммоля) брома. Получающийся в результате раствор перемешивался в течение 90 мин при 0oC, в течение которых наблюдалось, что он становился слегка мутным. Реакционная смесь затем гасилась добавлением 6 мл 1 н. HCl. Смесь переносилась в делительную воронку, где она промывалась дважды 20 мл 1 н. HCl, а затем промывалась 10 мл насыщенного солевого раствора. Органический раствор сушился над сульфатом натрия и выпаривался до красно-коричневого камедеобразного твердого вещества. Хроматография на силикагеле с использованием 2:1 смеси этилацетата и гексанов давала 0,71 г (78%) целевого соединения. В качестве загрязняющей примеси от реакции элиминирования брома присутствовало около 5% стирола. Наблюдалась смесь гидразоновых изомеров с двойной связью и амидных ротомеров, что осложняло 1H ЯМР спектр.
1H ЯМР (CDCl3): 1.39 и 1.44, и 1.58 и 1.65 (д, 3, J=6 Гц), 2.48 (с, 3), 2.50-2.85 (м, 2), 3.85-4.15 (м, 1), 6.09 (с, 1), 6.11 (с, 1), 6.55 (с, 1), 6.94 (с, 1), 7.73 и 7.80 (д, 2, J= 9 Гц), 8.19 и 8.20 (д, 2, J=9 Гц), 8.37 и 8.45 (с, 1);
MC (FD+) M+ = 450, наблюдаемый для C19H18N3O5Br.
Пример 27. Синтез 7-ацетил-8,9-дигидро-8-метил-5-(4-нитрофенил)- 7H-1,3-диоксоло[4,5-H][2,3]бензодиазепина
0,100 г (0,22 ммоля) промежуточного соединения из примера 26 растворялось в 2 мл сухого ТГФ и охлаждалось до 0oC на бане из ледяной воды в атмосфере азота. Затем добавлялось 0,018 г (0,22 ммоля) трет-бутилата лития. Смесь перемешивалась при 0oC в течение 2 ч, в течение которых за ходом реакции следили с помощью ВЭЖХ. Поскольку ВЭЖХ обнаруживал, что образовалось приблизительно 10% продукта и все еще оставалось значительное количество исходного материала, колба закрывалась стеклянной крышкой и помещалась в морозильник при -35oC на 3 дня. После дополнительного нахождения в течение 8 ч при комнатной температуре ВЭЖХ показал наличие 16% желаемого продукта. Реакционная смесь гасилась 1 мл 50% насыщенного водного раствора хлористого аммония и переносилась в делительную воронку с 10 мл метиленхлорида. Смесь промывалась дважды 10 мл 1 н. HCl, а затем 10 мл насыщенного солевого раствора. Органический раствор сушился над сульфатом натрия и выпаривался до желто-коричневого смолообразного твердого вещества. Выход 0,05 г. Желаемый продукт образовывался с выходом около 15%, о чем судили по сравнению 1H ЯМР спектра и следов ВЭЖХ с данными аутентичного продукта. Основной продукт получался в результате элиминирования в соответствующее стирольное производное.
Пример 28. Альтернативный синтез (S)-альфа-метил-1,3- бензодиоксол-5-этанола
К суспензии магниевой стружки (17 г) в 50 мл тетрагидрофурана добавлялся по каплям раствор 5-бром-1,3-бензодиоксола (93,6 г). После полного добавления смесь разбавлялась 250 мл тетрагидрофурана и получающаяся смесь перемешивалась на протяжении ночи. 13 мл раствора (0,78 М) переносилось в круглодонную колбу, содержащую йодистую медь (I) (0,12 г). Получающаяся в результате смесь охлаждалась до -50oC и медленно добавлялся раствор (S)-(-)-окиси пропилена в 3 мл тетрагидрофурана, а затем смесь перемешивалась 10 мин. Смесь разбавлялась эфиром. Отделенная органическая фаза промывалась водой и солевым раствором. Водные смывки экстрагировались эфиром (2х) и объединенные органические растворы сушились над сульфатом магния, фильтровались и концентрировались. Остаток очищался с помощью хроматографии на силикагеле (50% эфира в пентане), давая 1,66 г желаемого продукта (91%). Анализ хиральной ВЭЖХ показал, что оптическая чистота материала была 98,3%.
Пример 29. Синтез (R)-7-ацетил-8,9-дигидро-8-метил-5-(4- нитрофенил)-7H-1,3-диоксоло[4,5-H][2,3]бензодиазепина
К суспензии промежуточного соединения из примера 7 (1,53 г) в 60 мл толуола добавлялись 10 мл 1 н. гидроокиси натрия и тетрабутиламмонийбромида (0,053 г). Получающаяся смесь перемешивалась энергично в течение 72 ч. Смесь промывалась солевым раствором и органическая фаза сушилась над сульфатом магния, фильтровалась и концентрировалась с помощью роторного испарения. Остаток растворялся в этаноле и концентрировался досуха, давая 1,05 г целевого соединения (86%). Анализ ВЭЖХ показал, что образовалось менее 0,5% соответствующего продукта элиминирования.

Описывается стереоселективный способ получения замещенных дигидро-2,3-бензодиазепина формулы I, где R - Н, C1-10алкил; Х - Н, C1-10алкил, ацил, арил, карбоксил, или его замещенное производное, или защитная группа, или фармацевтически приемлемой соли циклизацией соединения формулы II. Соединения формулы I полезны в качестве антагонистов АМРА-рецептора. 4 с. и 16 з.п. ф-лы, 1 табл.

в которой R - водород или (C1-C10)алкил;
Х - водород, (C1-C10)алкил, ацил, арил, карбоксил, или его замещенное производное, или защитная группа,
или фармацевтически приемлемой соли его, отличающийся тем, что циклизуют соединение общей формулы VIII
в которой Z - уходящий атом или группа,
с получением соединения общей формулы I, после чего, если необходимо, превращают соединение формулы I в другое соединение формулы I и/или образуют фармацевтически приемлемую соль.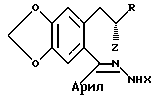
в которой R - водород или (C1-C10)алкил;
Х - водород, (C1-C10)алкил, ацил, арил, карбоксил или его замещенное производное, или защитная группа;
Z - гидроксильная группа, или уходящий атом, или группа;
или его соль.
в которой R - водород или (C1-C10)алкил;
Х - водород, (C1-C10) алкил, ацил, арил или карбоксил, или его замещенное производное,
отличающийся тем, что соединение формулы II
асимметрически восстанавливают с получением соединения формулы III
которое подвергают взаимодействию с арилальдегидным соединением формулы Арил • CHO с получением изохроманового соединения формулы IV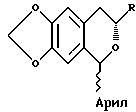
соединение формулы IV подвергают реакции с окисляющим агентом с получением соединения формулы V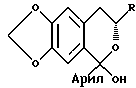
соединение формулы V подвергают взаимодействию с гидразидным производным формулы H2NNHX с получением соединения формулы VI
соединение формулы VI подвергают (i) взаимодействию с сульфонилгалогенидным реагентом и основанием с получением промежуточного сульфоната с последующей реакцией полученного сульфоната с сильным основанием или (ii) прямой циклизации по Мицунобу с получением соединения формулы I.
в которой R - водород или (C1-C10)алкил.
| Способ получения 4-фенил- или 4(2-тиенил)-6,7-метилендиокси-2(ин)хиназолинонов или -2(ин) хиназолинтионов | 1972 |
|
SU454740A3 |
| Способ получения двойного окисла титана и кремния | 1973 |
|
SU492485A1 |
Авторы
Даты
2000-06-20—Публикация
1995-08-30—Подача